Изобретение относится к медицине, в частности к способам визуализации воспалений с применением радиоактивных изотопов галлия, и может быть использовано для радионуклидной диагностики воспалений различной природы и локализации.
Своевременная диагностика и визуализация воспалений остается одной из наиболее актуальных проблем современной медицины и требует разработки новых подходов, поскольку даже такие современные методы исследования, как компьютерная томография (КТ), магнитно-резонансная томография (МРТ) и ультрасонография, не позволяют выявить воспалительный процесс до возникновения анатомических изменений в ткани, т.е. на ранней стадии развития процесса. Решением этой проблемы может служить использование радионуклидных методов диагностики, которые во многих случаях позволяют сделать оценку патофизиологических изменений и отразить функциональный статус в поврежденных органах и тканях методом эмиссионной томографии. За два прошедших десятилетия было синтезировано немалое количество соединений для идентификации инфекционно-воспалительных очагов. Весьма перспективными являются соединения с изотопами галлия. Из всех известных радиоактивных изотопов галлия три - 66Ga, 67Ga и 68Ga, - благодаря своим ядерно-физическим свойствам, нашли применение в ядерной медицине. Одним из первых, получивших наибольшее распространение радиоактивных нуклидов, включенных в состав радиофармацевтических препаратов, является гамма-излучающий 67Ga. Наиболее широко известен 67Ga-цитрат. Изучению его метаболизма и поведения в живом организме посвящено множество публикаций. Однофотонная эмиссионная компьютерная томография (ОФЭКТ) с использованием 67Ga-цитрата достаточно широко используется в настоящее время.
Позитронно-эмиссионная томография (ПЭТ), обладающая рядом преимуществ перед ОФЭКТ, является атравматичной медицинской диагностической процедурой, позволяющей визуализировать с высоким разрешением различные физиологические процессы, отражая их функциональный статус.
Нехватка циклотронов в медицинских учреждениях и их дорогостоящая эксплуатация стимулировали ученых к разработке ПЭТ-маркеров на основе более доступных генераторных радионуклидов, одним из которых является изотоп 68Ga [1], получаемый из генератора 68Ge/68Ga. Большой период полураспада материнского 68Ge (Т½=270,9 сут) обеспечивает продолжительный срок эксплуатации генератора, а малый период полураспада 68Ga (Т½=67,7 мин) позволяет использовать радиофармпрепараты (РФП) необходимой активности, не создавая при этом значительной дозовой нагрузки на пациента и медицинский персонал. ПЭТ-визуализация является более четкой и информативной по сравнению с ОФЭКТ [2], поэтому, проявляя практически одинаковое биологическое поведение, РФП с 68Ga являются более перспективными по сравнению с РФП с 67Ga, цитратный комплекс которого уже несколько десятков лет используется в ядерной медицине.
Хотя механизм накопления Ga-цитрата в воспаленных тканях до конца не изучен, известно, что после внутривенного введения Ga-цитрата, происходит реакция перелигандирования, и он связывается с трансферрином плазмы крови, подобно железу [3, 4]. Трансферрин же, в свою очередь, доставляет галлий в места воспаления через высокопроницаемые стенки сосудов и трансферриновые рецепторы [5]. Затем галлий высвобождается в клетках из-за связывания с лактоферрином из погибающих лейкоцитов и бактериальными сидерофорами при инфекционно-воспалительных процессах [6, 7].
На сродство галлия к железосвязывающим белкам (трансферрину, лактоферрину, ферритину) указал Хоффер [8] еще в 1980 году, опираясь на утверждения более ранних экспериментаторов, которые предлагали обратить внимание на химическое сродство 67Ga к трансферрину [9, 10, 11, 12].
Вместе с тем, достаточное связывание галлия с трансферрином приводит к медленному клиренсу крови от радионуклида и, соответственно, более длительному периоду накопления в патологическом очаге. Следствием такого поведения является низкое отношение концентрации радионуклида в очаге воспаления к концентрации в циркулирующей крови в первые часы после введения, что приводит к неблагоприятным последствиям: необходимость откладывания процедуры сканирования пациента или лабораторного животного (на 48-72 часа) из-за нецелесообразности получения «нечитаемых» и неинформативных сцинтиграмм в первые часы после введения; в свою очередь, длительный период ожидания сканирования лишает возможности оценки биораспределения и выведения препарата в невизуализируемых в первые часы органах (кишечник, легкие, сердце, почки); длительный период циркуляции в крови большого количества 67Ga-трансферрина приводит к получению пациентом высоких лучевых нагрузок, тем самым снижая показатель «эффективность/безопасность» препарата.
Поэтому важной задачей является повышение уровня накопления меченых соединений в пораженном органе или ткани по отношению к здоровой ткани и крови. Одним из путей решения этой задачи предполагается введение дополнительных химических агентов, которые будут конкурировать с радиоактивным галлием в присоединении к трансферрину крови, делая его доступным для активного накопления в патологическом очаге и выведения из организма по другим механизмам.
Для усовершенствования процесса визуализации воспалительных очагов путем сокращения биологического периода полувыведения галлия известен способ с использованием скандия (III) в качестве селективного агента конкурентного связывания [13]. Скандий, заблокировав определенные фрагменты белков крови, предотвращает на них излишнее накопление галлия. В исследованиях на животных при одновременном введении цитратов 67Ga и стабильного скандия было получено чрезвычайно высокое накопление в опухоли и крови, а также в тканях. Однако введение цитрата скандия человеку привело к тяжелой гемолитической анемии [14].
Также известен способ уменьшения накопления 67Ga в крови путем применения хелатирующего агента дефероксамина [15]. В результате комплекс галлия с дефероксамином выводится через почки быстрее, чем свободный галлий. Но, согласно цитируемой публикации, этот агент должен быть введен через 24 часа после инъекции радиоактивного галлия для того, чтобы свести к минимуму потерю накопления активности в опухоли, что не решает проблему получения излишних лучевых нагрузок, а также ускорения процесса визуализации во времени с учетом периода полураспада при применении 68Ga.
Известны способы, описанные Кригелем [16] и Брюнером [17], с добавлением солей стабильного Ga к препарату 68Ga-цитрата, когда может быть достигнута удовлетворительная визуализация уже через небольшой временной интервал после введения. Однако необходимое количество стабильного галлия для удовлетворительной визуализации зачастую является относительно большим с точки зрения нефротоксичности.
Известно, что попытка использовать декстран железа для улучшения визуализации воспалений к успеху не привела [15].
Наиболее близким по технической сущности и достигаемому результату является способ по патенту США №4448763 [18], согласно которому изменение биораспределения галлия за счет введения комплексов нерадиоактивного индия позволило существенно улучшить качество визуализации опухолей. Автор патента отмечал, что для человека максимально допустимая доза вводимой соли стабильного галлия почти в 17 раз меньше допустимого количества вводимого индия и составляет соответственно 3 мг/кг (Ga) против 50 мг/кг (In). Согласно цитируемому патенту, в качестве блокады могут использоваться водорастворимые соли стабильного индия как органические (цитрат, лактат, тартрат, фитат, фталат), так и неорганические (хлорид, нитрат, сульфат, бромид), а также комплекс с трансферрином. Радиофармпрепараты могут быть приготовлены путем растворения соединений галлия и индия в любом приемлемом растворителе, таком, как вода, физиологический раствор и т.п. Физиологический раствор является предпочтительным в качестве растворителя. Предпочтительно введение соединений галлия и индия одновременно, однако, соединения индия могут вводиться за 2 часа до или после галлия. При введении дополнительных агентов, конкурентно реагирующих с трансферрином, в соответствии с этим изобретением, реализуются следующие преимущества: уменьшается накопление активности в крови и мягких тканях, что позволяет получить четкое изображение патологических очагов; снижается время, необходимое для визуализации; доза облучения пациента уменьшается, так как увеличивается скорость, с которой радиоактивный галлий выводится из организма; появляется возможность применения более удобного короткоживущего позитрон-излучателя 68Ga и ПЭТ-диагностики, что позволяет просматривать патологические очаги в трех измерениях, тем самым увеличивая информативность визуализации для постановки диагноза.
Относительно недостатков рассматриваемого изобретения надо отметить, что, хотя используемые в эксперименте дозы индия согласно справочным данным [19] находятся в безопасном диапазоне, не стоит забывать, что индий - тяжелый металл и что эксперименты проводились на лабораторных животных, а при экстраполяции вводимых доз на человека получаются довольно высокие концентрации.
Целью изобретения является разработка нового высокоэффективного и простого способа визуализации воспалений различной природы и локализации, отличающегося высоким накоплением изотопов галлия, пригодных для радионуклидной диагностики, в очаге воспаления, позволяющим получать изображения с увеличенной информативностью уже в ранние сроки после введения изотопов.
Учитывая, что по данным Харриса и Пекораро [3] наиболее близким к трехвалентному галлию по константе связывания с транспортными белками является трехвалентное железо, кроме того, схожими являются значения радиусов, электроотрицательности и потенциала ионизации этих ионов, было сделано предположение о возможности использования соединений трехвалентного железа для блокирования трансферрина крови. Кроме сходства между Ga3+ и железа Fe3+ есть и выгодная разница в их поведении in vivo: невозможность восстановления иона галлия до двухвалентного состояния, в отличие от железа 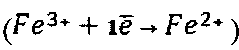 , что препятствует встраиванию ионов галлия в структуру гема, благодаря чему они не мешают нормальным физиологическим процессам оксигенации гемоглобина, миоглобина и цитохромов. При попадании в кровь ионы железа Fe3+ максимально насыщают металлсвязывающую способность трансферрина, после чего вероятность его связывания с изотопами галлия в разы падает. Данный феномен положительно сказывается на выведении радиофармпрепарата мочевыделительной системой, повышении информативности сцинтиграмм уже в ранние сроки после введения для 67Ga-цитрата и, как следствие, благоприятствует применению позитронного короткоживущего изотопа 68Ga, чьи достоинства уже были описаны выше.
, что препятствует встраиванию ионов галлия в структуру гема, благодаря чему они не мешают нормальным физиологическим процессам оксигенации гемоглобина, миоглобина и цитохромов. При попадании в кровь ионы железа Fe3+ максимально насыщают металлсвязывающую способность трансферрина, после чего вероятность его связывания с изотопами галлия в разы падает. Данный феномен положительно сказывается на выведении радиофармпрепарата мочевыделительной системой, повышении информативности сцинтиграмм уже в ранние сроки после введения для 67Ga-цитрата и, как следствие, благоприятствует применению позитронного короткоживущего изотопа 68Ga, чьи достоинства уже были описаны выше.
В результате проведенных исследований был разработан способ визуализации воспалений с использованием дополнительного внутривенного введения физиологически приемлемых соединений железа(III).
Суть изобретения заключается в том, что конкурентное связывание ионов трехвалентного железа с трансферрином крови (блокирование металлсвязывающей способности трансферрина) обеспечивает снижение концентрации изотопов галлия в крови и увеличение их накопления в очагах воспаления, что позволяет уже в ранние сроки после введения изотопов получать изображения с увеличенной информативностью, кроме того, достигается более интенсивное выведение изотопов из организма.
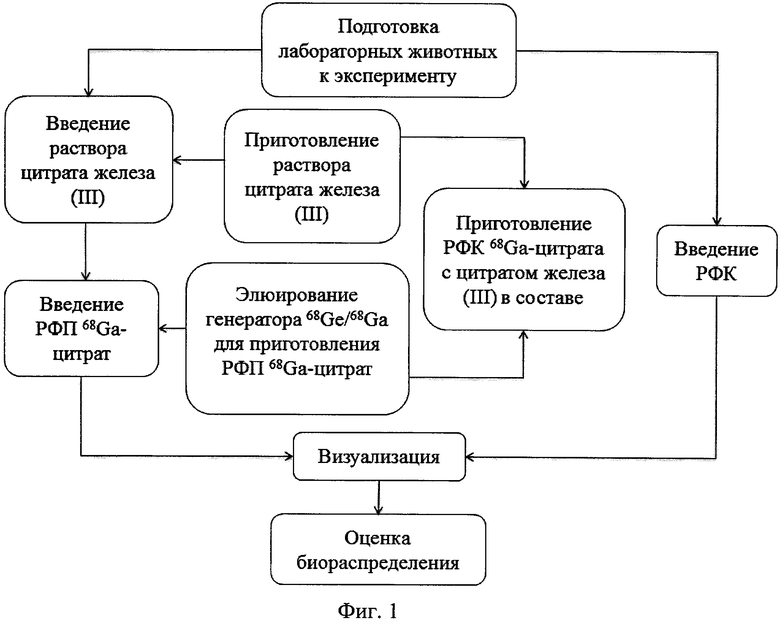
Последовательно предлагается два варианта реализации способа (блок-схема, составленная на примере 68Ga-цитрата и цитрата железа(III), представлена на фиг. 1): согласно первому варианту, для улучшенной визуализации воспаления за 10-15 минут до введения радиофармпрепата, содержащего 68Ga, внутривенно вводили раствор цитрата железа(III), обеспечивающий блокирование металлсвязывающей способности трансферрина; согласно второму варианту, для улучшенной визуализации воспаления внутривенно вводили радиофармацевтическую композицию (РФК), включающую 68Ga для визуализации воспаления и трехвалентное железо, обеспечивающее блокирование трансферрина.
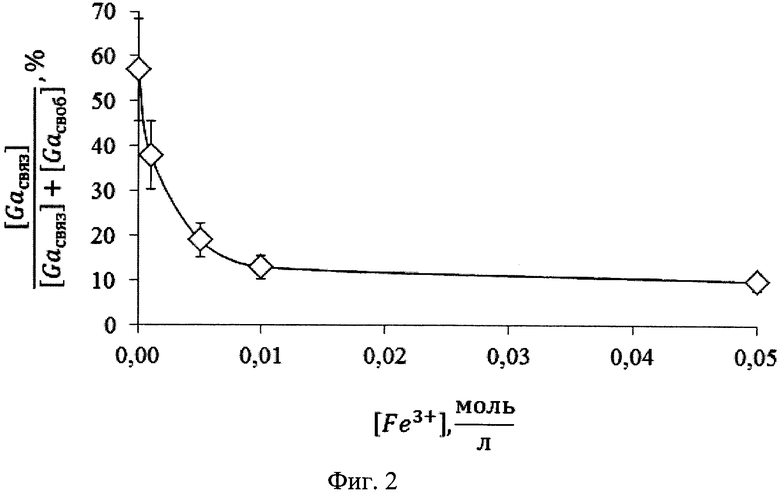
Для достижения поставленной цели была проведена серия экспериментов по изучению эффективности связывания трансферрина с галлием в присутствии трехвалентного железа в различных концентрациях in vitro. Долю связывания 68Ga с трансферрином от общей активности связанного и свободного галлия определяли методом тонкослойной хроматографии в различных системах. По результатам, представленным на графике (фиг. 2), видно, что 10-2 М концентрация трехвалентного железа является оптимальной для значительного снижения процента связывания галлия с трансферрином в рамках исследования. При добавлении рекомендуемой концентрации раствора цитрата железа происходит, видимо, максимальное насыщение металлсвязывающей способности трансферрина, и нет необходимости для увеличения концентрации вводимой соли трехвалентного железа.
Венофер - коммерческий противоанемический препарат трехвалентного железа, восполняющий его дефицит в организме. Активным веществом является сахарозный комплекс гидроксида железа(III) с содержанием в пересчете на железо(III) 20 мг/мл препарата. Препарат предназначен для внутривенного введения, что позволяет предположить его использование в качестве потенциального хелатора для частичного блокирования металлсвязывающей способности трансферрина. Расчет вводимых доз был проведен с учетом коэффициентов пересчета человек/экспериментальное животное в соответствии с «Руководством по проведению доклинических исследований лекарственных средств» под редакцией А.Н. Миронова [20].
Для приготовления радиофармацевтического препарата во флакон, содержащий необходимое количество натрия цитрата в лиофилизированной форме, с помощью шприца вносили 2 мл предварительно очищенного в соответствии с патентом РФ №2522892 [21] элюата генератора 68Ge/68Ga, встряхивали до полного растворения содержимого флакона и инкубировали при комнатной (20°C) температуре в течение 15 минут.
Лекарственная форма готового препарата представляла собой раствор для внутривенного введения следующего состава на 1 мл:
приготовления)
Для приготовления радиофармацевтической композиции во флакон, содержащий необходимое количество лиофилизированной смеси цитрата натрия и железа(III), с помощью шприца вносили 2 мл предварительно очищенного в соответствии с патентом РФ №2522892 [21] элюата генератора 68Ge/68Ga, встряхивали до полного растворения содержимого флакона и инкубировали при комнатной (20°C) температуре в течение 15 минут.
Лекарственная форма готовой радиофармацевтической композиции представляла собой раствор для внутривенного введения следующего состава на 1 мл:
приготовления)
РХЧ не менее 95%
Для предварительной оценки возможности получения информативных изображений было проведено исследование накопления препарата с 68Ga в очаге воспаления и крови. Эксперимент был выполнен на ПО нелинейных крысах-самках массой 181,9±16,0 г с моделью асептического воспаления мягких тканей, вызванного внутримышечной инокуляцией раствора стерильного скипидара.
Животных разбивали на 4 группы с одинаковой моделью воспаления для сравнения фармакокинетики препарата 68Ga-цитрат:
1 - без введения дополнительных хелатирующих агентов;
2 - с предварительным введением раствора цитрата железа(III);
3 - с совместным введением цитрата железа(III);
4 - с предварительным введением Венофера.
Готовый раствор цитрата железа(III) вводили внутривенно крысам в объеме инъекции 0,30±0,05 мл за 10-15 минут до введения радиофармпрепарата 68Ga-цитрата. В пересчете каждая крыса получала 0,168±0,030 мг железа(III) (0,84±0,14 мг/кг живого веса или (15,0±2,5)·10-6 моль/кг живого веса). При экстраполяции приведенных концентраций на человека по «Руководству по проведению доклинических исследований лекарственных средств» под редакцией А.Н. Миронова [20]:
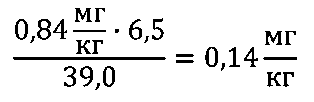
Где 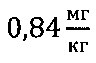 - концентрация вводимого раствора блокады в пересчете массы железа на единицу массы крысы, 6,5 и 39,0 - коэффициенты «подобия» для крысы и человека массой 0,2 кг и 70 кг, соответственно.
- концентрация вводимого раствора блокады в пересчете массы железа на единицу массы крысы, 6,5 и 39,0 - коэффициенты «подобия» для крысы и человека массой 0,2 кг и 70 кг, соответственно.
Человек массой 70 кг в такой инъекции получит около  трехвалентного железа, что на порядок меньше допустимого суточного количества вводимого внутривенно железа для профилактики (50-100 мг).
трехвалентного железа, что на порядок меньше допустимого суточного количества вводимого внутривенно железа для профилактики (50-100 мг).
Для получения результатов, которые можно сравнивать с предварительным введением раствора цитрата железа(III), исходный раствор Венофера (6 мг железа(III) в инъекции объемом 0,3 мл для крысы) разбавляли в 15-20 раз.
Через 10-15 минут после введения раствора цитрата железа(III) (группа 2) или Венофера (группа 4) крысам внутривенно вводили заранее приготовленный РФП 68Ga-цитрата в объеме 0,20±0,05 мл. Затем животных умерщвляли через 30, 60 и 120 минут после введения 68Ga-цитрата для отбора проб органов и тканей с последующим определением содержания в них препарата (% от введенной активности) методом прямой радиометрии на автоматическом гамма-счетчике Wizard 2480 (PerkinElmer, USA).
Для группы 1 готовый радиофармпрепарат вводили сразу в вышеописанном объеме. Для группы 3 вводили радиофармкомпозицию с трехвалентным железом.
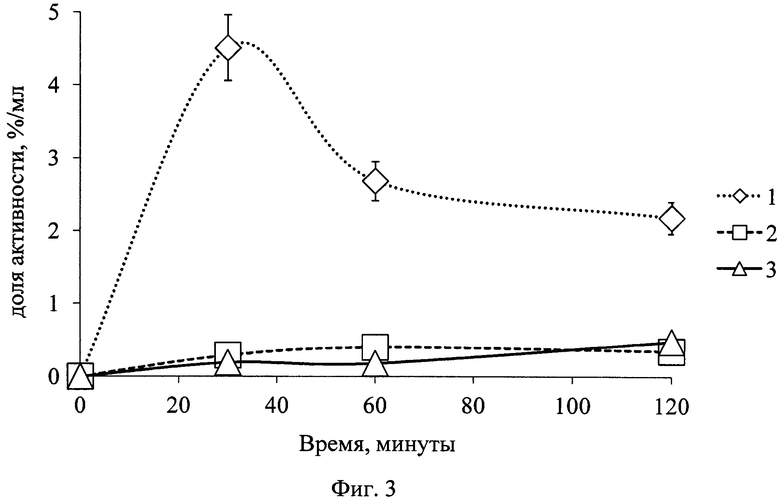
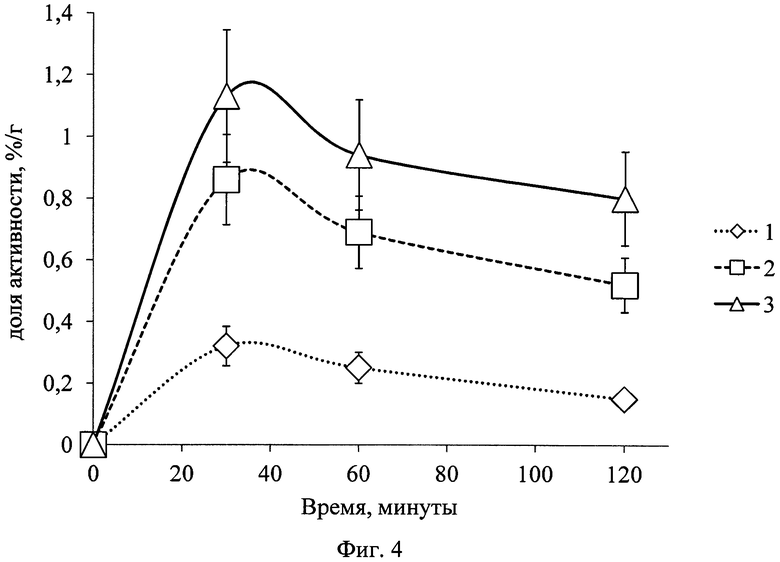
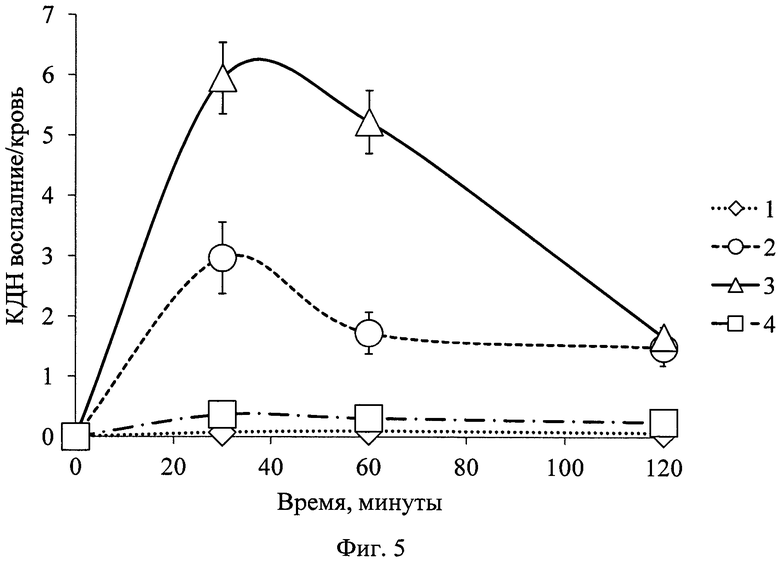
Анализ полученных данных показал следующую фармакокинетику 68Ga-цитрата: без предварительного введения цитрата железа(III): препарат в больших количествах оставался в крови в течение длительного времени (фиг. 3) и незначительно накапливался в патологическом очаге (фиг. 4). Отношение результатов такого накопления является неудовлетворительным, поскольку КДН воспаление/кровь намного меньше единицы (фиг. 5), что не позволяет визуализировать очаг воспаления методом ПЭТ.
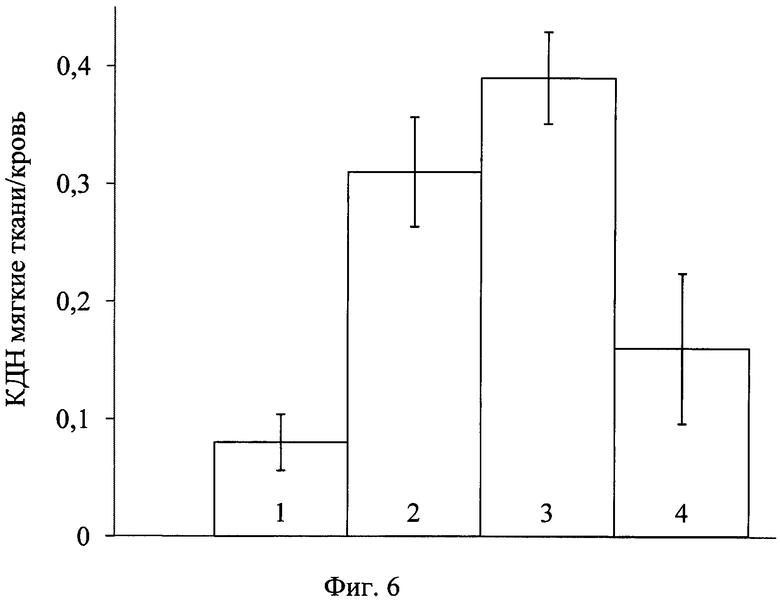
Практически аналогичную картину наблюдали с предварительным введением Венофера (фиг. 5), несмотря на частичное блокирование трансферрина. Фармакокинетика 68Ga-цитрата с его предварительным введением отличалась более активным, но недостаточным накоплением в патологическом очаге по отношению к накоплению в крови. Недостаточное связывание железа(III), входящего в состав Венофера, с трансферрином также отмечал Geisser [22]. Хотя отношение КДН мягкие ткани/кровь с предварительным введением Венофера больше, чем без него (фиг. 6), но значительно меньше такового с введением цитрата железа(III), что не позволит визуализировать разницу на изображениях между накоплением в патологии и здоровой ткани.
По результатам, представленным на графике (фиг. 3), видно, что при предварительном введении в организм раствора цитрата железа(III) концентрация 68Ga-цитрата в крови уже в первые часы снижалась на 87,5±5,3%, а при совместном введении (трехвалентное железо в составе РФК) - на 89,0±9,6% по отношению к выведению без железа(III).
По результатам, представленным на графике (фиг. 4), видно, что при предварительном введении в организм цитрата железа(III) концентрация 68Ga-цитрата в очаге воспаления уже в первые часы увеличивалась в 3,0±0,4 раза, а при совместном введении (трехвалентное железо в составе РФК) - в 4,2±1,0 раз по отношению к введению 68Ga-цитрата без цитрата железа(III).
Проведенные исследования показывают, что нет статистически достоверной разницы между предварительным введением раствора цитрата железа(III) или введением радиофармпрепарата 68Ga-цитрата с трехвалентным железом в его составе - разница в накоплении-выведении РФП между двумя способами находится в пределах погрешности проводимых исследований (фиг. 3, 4). Величины отношения накопления в очаге воспаления к накоплению в крови (фиг. 5), при предварительном введении раствора цитрата железа(III), позволили получить четкое и контрастное изображение патологического очага при ПЭТ-исследовании, по сравнению с опытами без введения соединения трехвалентного железа или с введением Венофера.
В качестве физиологически приемлемых соединений железа(III), помимо цитрата, при реализации заявленного способа могут быть применены: тартрат, лактат, манат, аскорбат и некоторые подобные. Эти соединения трехвалентного железа характеризуются устойчивостью, достаточной для предотвращения гидролиза при физиологических значениях среды, но не препятствующей реакциям перелигандирования железа на транспортные белки плазмы крови.
Что касается углеводсодержащих препаратов трехвалентного железа, то необходимо отметить, что помимо Венофера, известно еще несколько коммерчески доступных противоанемических лекарственных средств для внутривенного введения, содержащих Fe(III): Ферковен, Феррлецит, Феррум лек, Космофер, Феринжект и некоторые другие. Действующими веществами в них являются различные сахарозные комплексы с железом, однако, аффинность трехвалентного железа к углеводам выше, чем к гликопротеинам (транспортным белкам крови), поэтому при введении таких веществ не происходит или почти не происходит реакции перелигандирования. Данный феномен благоприятно сказывается при применении препаратов по прямому назначению, так как обеспечивается сохранность сахарозных комплексов железа in vivo в течение длительного времени, тем самым улучшается доставка железа для формирования гемопротеинов (гемоглобина, миоглобина, цитохромов и др.), однако, этот же феномен определяет бесперспективность углеводсодержащих препаратов для снижения металлсвязывающей способности транспортных белков и применения в предложенном способе визуализации.
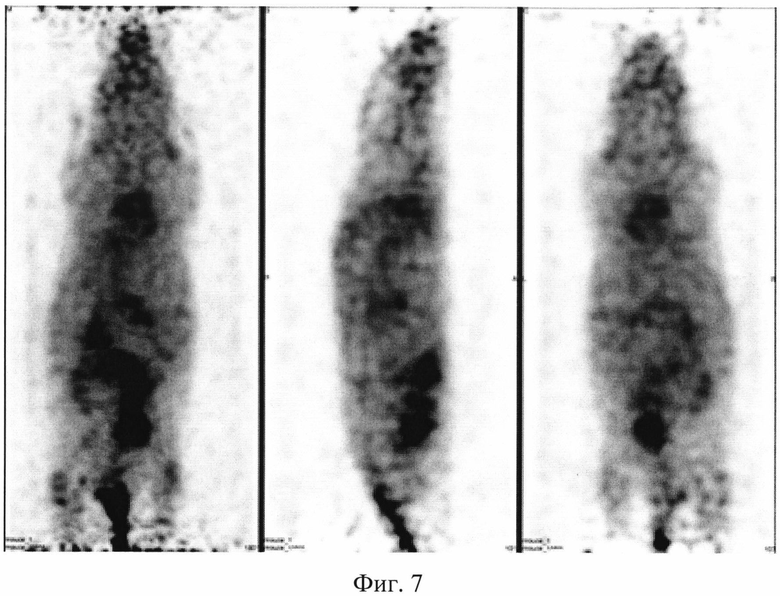
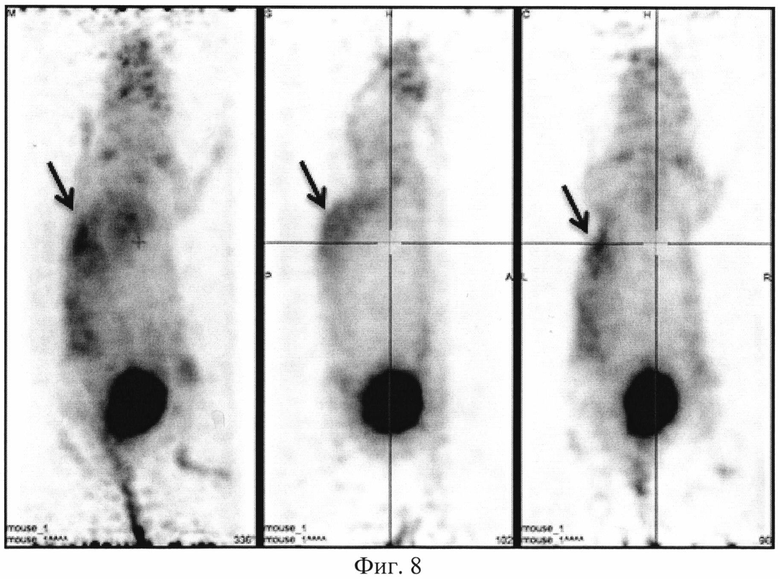
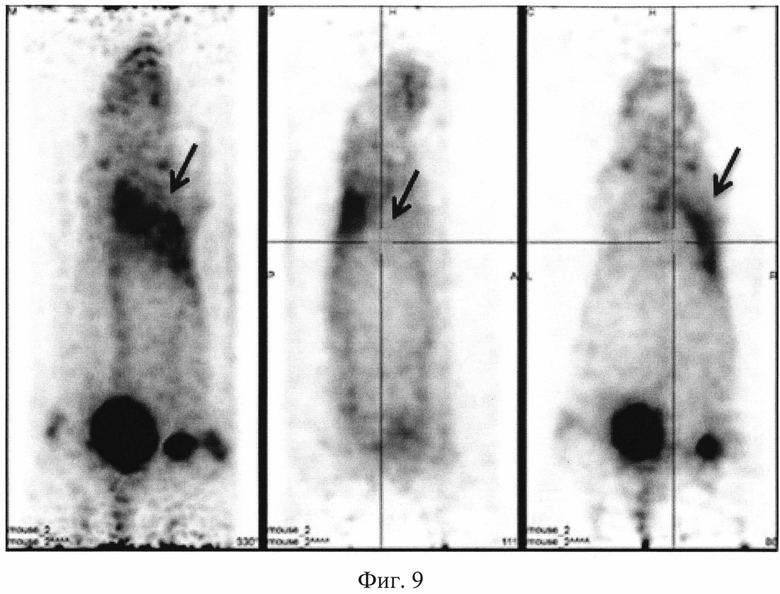
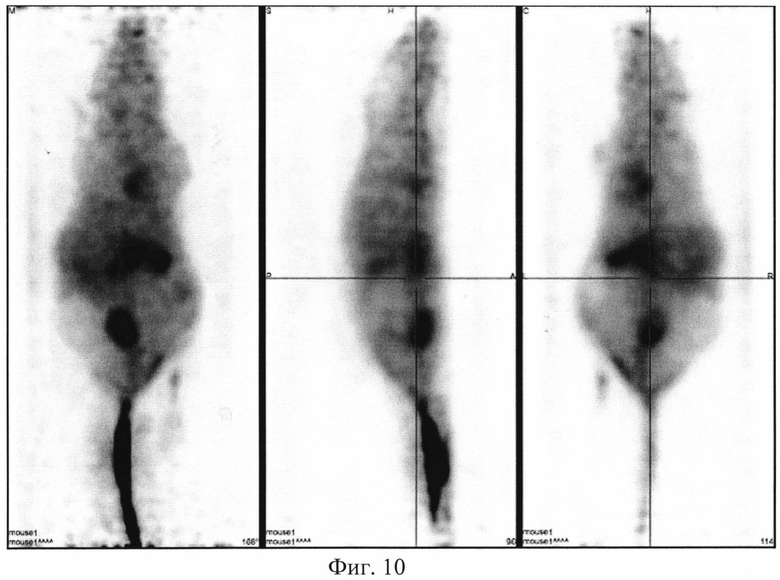
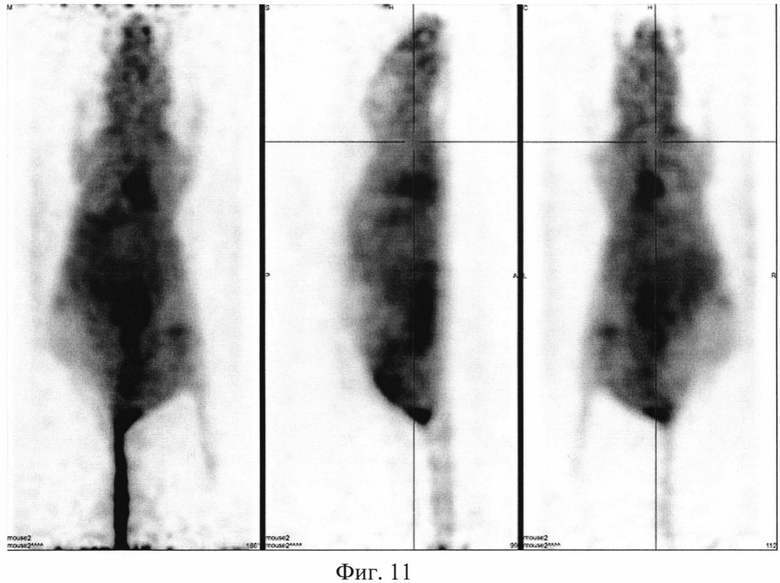
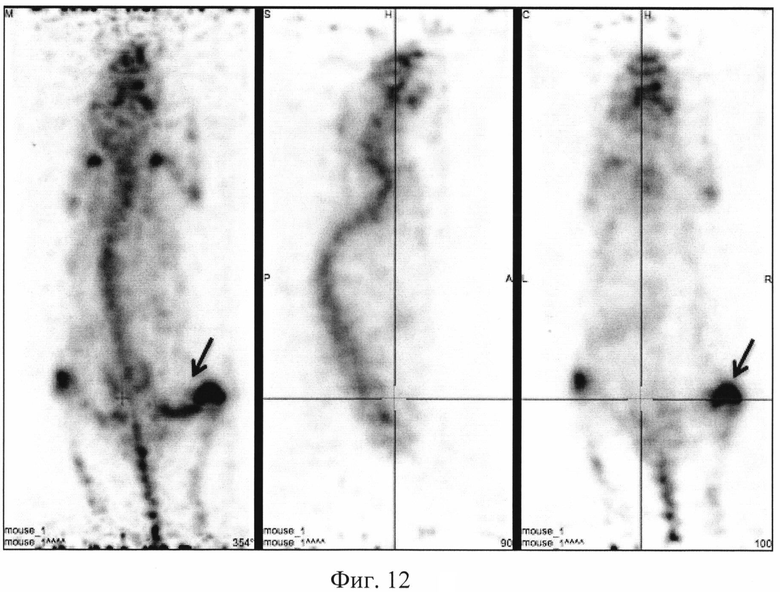
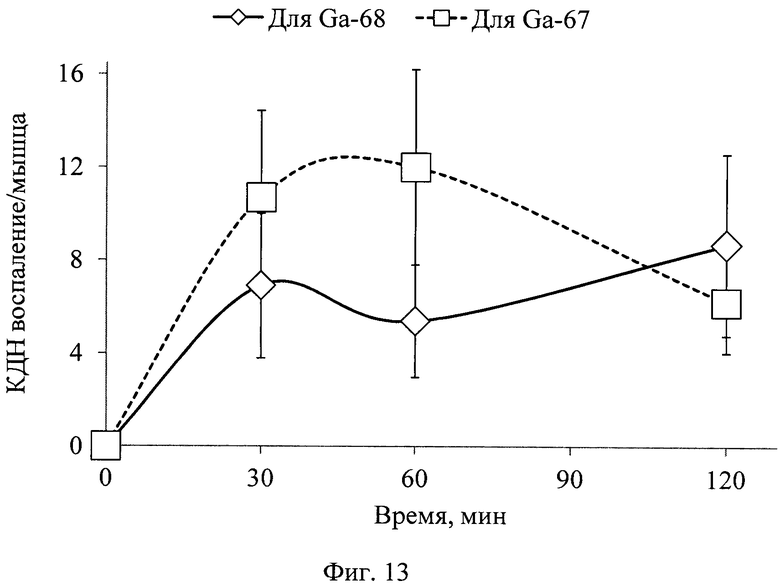
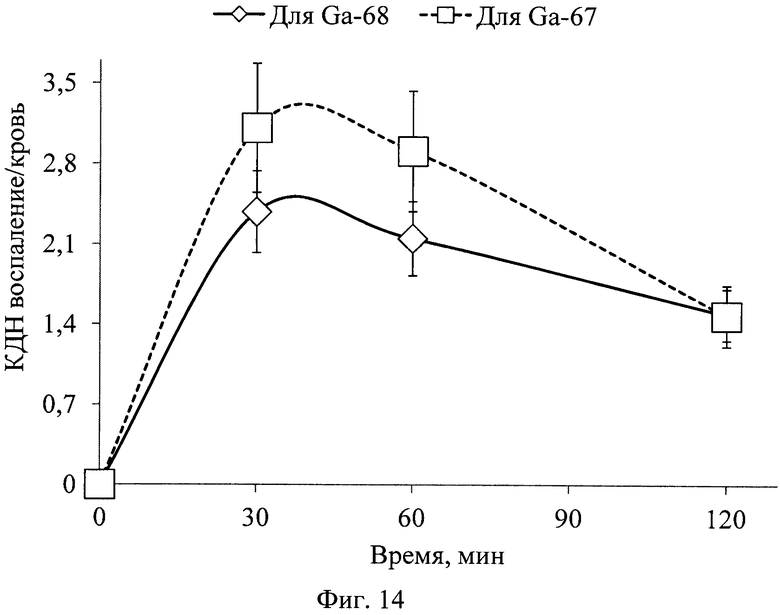
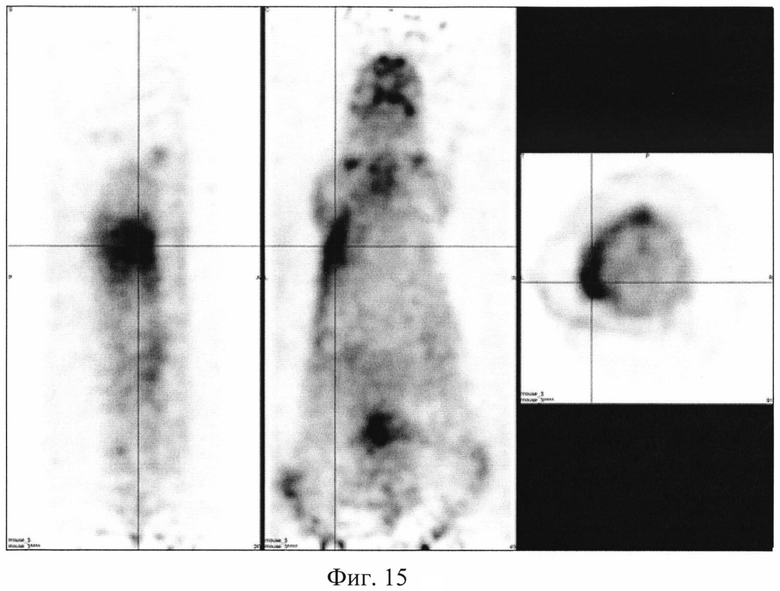
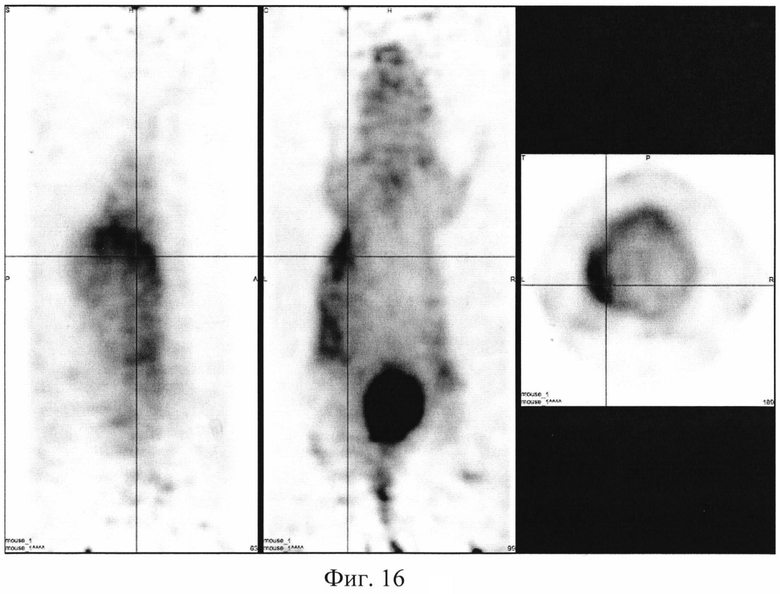
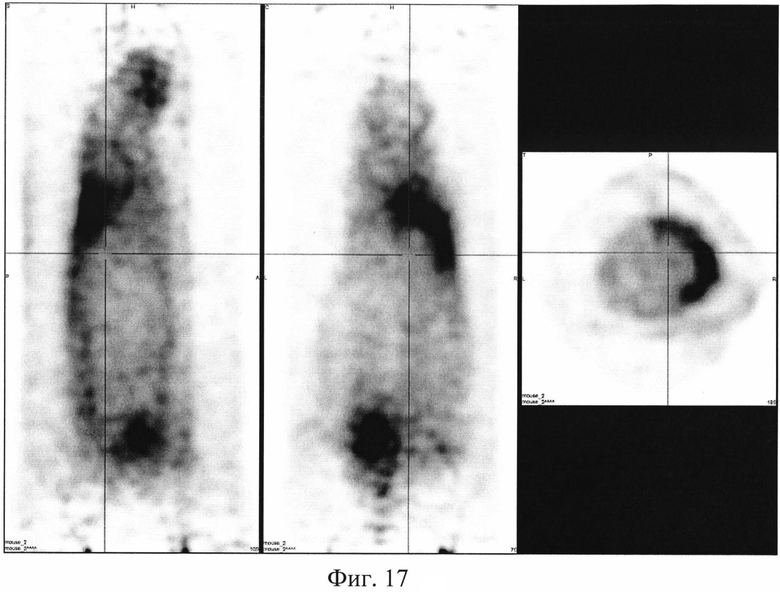
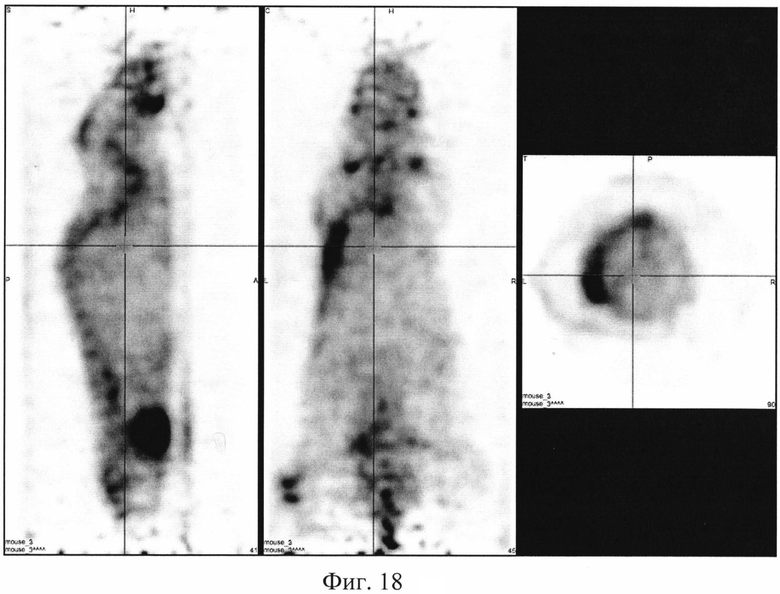
На фиг. 1 изображена блок-схема осуществления способа визуализации воспалений с использованием 68Ga-цитрата и цитрата железа(III); на фиг. 2 изображен график зависимости доли связывания 68Ga трансферрином от концентрации вводимого раствора цитрата железа(III); на фиг. 3 изображен график изменения во времени активности 68Ga-цитрата в крови для различных условий эксперимента: 1 - без введения раствора цитрата железа(III), 2-е предварительным введением раствора цитрата железа(III), 3-е трехвалентным железом в составе препарата; на фиг. 4 - график изменения во времени активности 68Ga-цитрата в очаге воспаления для различных условий эксперимента: 1 - без введения раствора цитрата железа(III), 2-е предварительным введением раствора цитрата железа(III), 3-е трехвалентным железом в составе препарата; на фиг. 5 - график изменения во времени коэффициентов дифференциального накопления (КДН) очаг воспаления/кровь для различных условий эксперимента: 1 - без введения раствора цитрата железа(III), 2-е предварительным введением раствора цитрата железа(III), 3-е трехвалентным железом в составе препарата, 4-е предварительным введением препарата Венофер; на фиг. 6 изображена гистограмма КДН мягкие ткани/кровь через 60 минут после введения 68Ga-цитрата для различных условий эксперимента: 1 - без введения раствора цитрата железа(III), 2-е предварительным введением раствора цитрата железа(III), 3-е трехвалентным железом в составе препарата, 4-е предварительным введением препарата Венофер; на фиг. 7 представлено ПЭТ-изображение мыши с моделью воспаления легкого, полученное через 60 минут после введения 68Ga-цитрата без введения раствора цитрата железа(III); на фиг. 8 - ПЭТ-изображение мыши с моделью воспаления легкого, полученное через 60 минут после введения 68Ga-цитрата с предварительным введением раствора цитрата железа(III); на фиг. 9 - ПЭТ-изображение мыши с моделью воспаления легкого, полученное через 60 минут, после введения РФК; на фиг. 10 - ПЭТ-изображение мыши с моделью воспаления легкого, полученное через 60 минут после введения 68Ga-цитрата с предварительным введением Венофера; на фиг. 11 - ПЭТ-изображение мыши с моделью остеомиелита, полученное через 60 минут после введения 68Ga-цитрата без введения раствора цитрата железа(III); на фиг. 12 - ПЭТ-изображение мыши с моделью остеомиелита (с опорожненным мочевым пузырем), полученное после введения РФК; на фиг. 13 изображен график изменения во времени КДН воспаление/мышца для двух изотопов 67Ga и 68Ga; на фиг. 14 - график изменения во времени КДН воспаление/кровь для двух изотопов 67Ga и 68Ga; на фиг. 15 представлено ПЭТ-изображение мыши с моделью септического воспаления легких, полученное через 60 минут после введения 68Ga-цитрата с предварительным введением тартрата железа(III); на фиг. 16 - ПЭТ-изображение мыши с моделью септического воспаления легких, полученное через 60 минут после введения 68Ga-цитрата с предварительным введением лактата железа(III); на фиг. 17 - ПЭТ-изображение мыши с моделью септического воспаления легких, полученное через 60 минут после введения 68Ga-цитрата с предварительным введением маната железа(III); на фиг. 18 -ПЭТ-изображение мыши с моделью септического воспаления легких, полученное через 60 минут после введения 68Ga-цитрата с предварительным введением аскорбата железа(III).
Приведенные ниже примеры иллюстрируют применение заявленного способа, но не исчерпывают область притязаний заявителя.
Пример 1.
Визуализация воспаления легкого у мышей. Эксперимент выполняют на 12 мышах-самках BALB / с массой 19,3±3,2 г с моделью септического воспаления легкого, вызванного внутрилегочной инокуляцией культуры клеток Escherichia coli. Животных разбивают на 4 группы для сравнения фармакокинетики препарата 68Ga-цитрат при различных условиях эксперимента:
1 - без введения дополнительных агентов;
2 - с предварительным введением раствора цитрата железа(III);
3 - с совместным введением цитрата железа(III) - введение РФК;
4 - с предварительным введением коммерческого препарата Венофер.
Мышам из первой группы внутривенно вводят приготовленный РФП 68Ga-цитрата в объеме 0,10±0,02 мл с активностью 20 МБк/мл. Мышам из второй группы внутривенно вводят готовый раствор цитрата железа(III) в объеме инъекции 0,10±0,02 мл за 10-15 минут до введения радиофармпрепата 68Ga-цитрата в объеме 0,10±0,02 мл. Мышам из третьей группы внутривенно вводят РФК в объеме 0,10±0,02 мл. Мышам из четвертой группы внутривенно вводят разбавленный раствор Венофера в объеме инъекции 0,10±0,02 мл, затем через 10 минут этим мышам внутривенно вводят РФП 68Ga-цитрат в объеме 0,10±0,02 мл. Визуализацию воспаления у мышей проводят на позитронно-эмиссионном томографе PET/X-RAY Genisys 4 (SofieBioscience, USA) для лабораторных животных через 60 минут после инъекции препарата или композиции с получением файла формата *.dicom и его последующей количественной обработки в программе VivoQuant 1.24 для получения читаемых изображений с фильтром invert (black and white). После введения РФП мышам из группы 1 получаются неинформативные изображения с высоким «шумом» и практически равномерным биораспределением. Пример изображения приведен на фиг. 7. Введенный 68Ga-цитрат почти равномерно распределялся по всему кровотоку тушки мыши с отдельными локусами в сердце, печени и кишечнике, что никак не связано с моделями воспаления легкого (фиг. 7). Также можно отметить небольшое накопление изотопа в мочевом пузыре, связанное с выведением препарата (фиг. 7). Иная картина наблюдается при введении 68Ga-цитрата мышам из группы 2 с предварительным введением раствора цитрата железа(III). Пример изображения приведен на фиг. 8. Предварительное введение раствора цитрата железа(III) позволяет существенно более точно визуализировать смоделированное воспаление в легком (фиг. 8). Введение РФК позволяет максимально точно визуализировать смоделированное воспаление правого легкого (пример изображения приведен на фиг. 9), без различных артефактов в сердце, печени и кишечнике, которые присутствуют на фиг. 7. Получение неинформативных изображений наблюдается при предварительном введении Венофера мышам из четвертой группы. Пример изображения приведен на фиг. 10. Такое биораспределение объясняется, вероятно, почти полным связыванием введенного радиофармпрепарата с белками крови, что не дает нужному количеству изотопа поступить в очаг воспаления. Сравнение изображений всех четырех групп позволяют сделать вывод, что 68Ga-цитрат, введенный после цитрата железа(III) или с трехвалентным железом в составе РФК, более интенсивно регистрируется в мочевом пузыре, что свидетельствует о его значительном выведении уже в первые часы. Изображения второй и третьей групп мышей отличаются высокой информативностью и четкими границами между здоровыми и воспаленными тканями, что подтверждает получение желаемого результата.
Пример 2.
Визуализация остеомиелита у мышей. Эксперимент выполняют на 6 мышах-самках BALB / с массой 20,8±2,3 г с моделью септического остеомиелита, вызванного нарушением целостности бедренной кости с последующей инокуляцией культуры клеток Staphylococcus aureus. Животных разбивают на 2 группы для сравнения фармакокинетики препарата 68Ga-цитрат:
1 - без введения дополнительных агентов;
2 - с совместным введением цитрата железа(III) - введение РФК.
Мышам из первой группы внутривенно вводят приготовленный РФП 68Ga-цитрата в объеме 0,10±0,02 мл. Мышам из второй группы вводят РФК в объеме 0,10±0,02 мл. Визуализацию воспаления у мышей проводят на позитронно-эмиссионном томографе PET/X-RAY Genisys 4 (Sofie Bioscience, USA) для лабораторных животных через 60 минут после инъекции РФП или РФК с получением файла формата *.dicom и его последующей количественной обработки в программе VivoQuant 1.24 для получения читаемых изображений с фильтром invert (black and white). После введения РФП мышам из группы 1 получаются неинформативные изображения с высоким «шумом» и практически равномерным биораспределением. Пример изображения приведен на фиг. 11. Введенный 68Ga-цитрат почти равномерно распределяется по всему кровотоку тушки мыши с отдельными локусами в сердце, печени и кишечнике, что никак не связано с моделью остеомиелита (фиг. 11). Также можно отметить небольшое накопление изотопов в мочевом пузыре, связанное с выведением препарата (фиг. 11). Введение РФК позволяет очень точно визуализировать смоделированный остеомиелит (пример изображения приведен на фиг. 12), без различных артефактов в сердце, печени и кишечнике, которые присутствуют на фиг. 11. Во второй группе отмечается более интенсивное выведение 68Ga мочевыделительной системой по сравнению с первой группой. Изображения второй группы мышей отличаются высокой информативностью и четкими границами между здоровыми и воспаленными тканями, что подтверждает получение желаемого результата.
Пример 3.
Сравнение накопления цитратов 67Ga и 68Ga в организме крыс. Эксперимент выполняют на 18 нелинейных крысах-самках массой 181,9±16,0 г с моделью септического воспаления легкого, вызванного внутрилегочной инокуляцией культуры клеток Escherichia coli. Животных разбивают на две группы для сравнения фармакокинетики препаратов:
1 - 67Ga-цитрата с предварительным введением раствора цитрата железа(III);
2 - 68Ga-цитрата с предварительным введением раствора цитрата железа(III).
Крысам из первой группы внутривенно вводят готовый раствор 10-2 М цитрата железа(III) в объеме инъекции 0,20±0,03 мл за 10-15 минут до введения радиофармпрепарата 67Ga-цитрата в объеме 0,20±0,03 мл с активностью 20 МБк/мл. Крысам из второй группы внутривенно вводят готовый раствор в 10-2 М цитрата железа(III) в объеме инъекции 0,20±0,03 мл за 10-15 минут до введения радиофармпрепарата 68Ga-цитрата в объеме 0,20±0,03 мл с активностью 20 МБк/мл. Крыс умерщвляют методом частичной декапитации через 30, 60 и 120 минут после введения 68Ga- или 68Ga-цитрат для отбора проб крови и интересующих тканей (мышечной, очага воспаления) с последующим определением содержания в них препарата (%/мл или %/г) методом прямой радиометрии на автоматическом гамма-счетчике Wizard 2480 (PerkinElmer, USA). Полученные данные, представленные в таблице, используют для расчета КДН воспаление/кровь, КДН воспаление/мышца, с дальнейшим построением и сравнением зависимостей КДН от времени для двух препаратов.
Динамика распределения препаратов 68Ga- и 67Ga-цитрата в организме крыс с моделью воспаления мягких тканей с предварительным введением раствора цитрата железа(III)
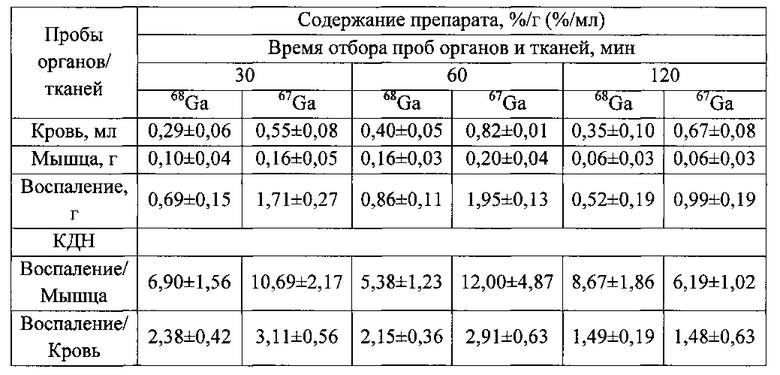
Анализ представленных в таблице данных показывает, что нет статистически достоверной разницы между изменением КДН воспаление/мышца и КДН воспаление/кровь для 67Ga- и 68Ga-цитрата во времени (фиг. 13, фиг. 14, соответственно). КДН для отношений воспаление/мышца, воспаление/кровь подтверждают одинаковую селективность препаратов с 67Ga и 68Ga к очагу воспаления. Представленные данные подтверждают идентичность фармакокинетики обоих препаратов (разница находится в пределах погрешности и индивидуальных значений биораспределения). Выявленный уровень накопления изотопа 67Ga позволяет сделать вывод о возможности ранней визуализации воспаления методом ОФЭКТ.
Пример 4.
Визуализация воспаления легкого у мышей. Эксперимент выполняют на 6 мышах-самках BALB / c массой 19,7±4,1 г с моделью септического воспаления легкого, вызванного внутрилегочной инокуляцией культуры клеток Escherichia coli. Мышам внутривенно вводят готовый 10-2 М раствор тартрата железа(III) в объеме инъекции 0,10±0,02 мл за 10-15 минут до введения радиофармпрепарата 68Ga-цитрата в объеме 0,10±0,02 мл. Визуализацию воспаления у мышей проводят на позитронно-эмиссионном томографе PET/X-RAY Genisys 4 (SofieBioscience, USA) для лабораторных животных через 60 минут после инъекции 68Ga-цитрата с получением файла формата *.dicom и его последующей количественной обработки в программе VivoQuant 1.24 для получения читаемых изображений с фильтром invert (black and white). Пример изображения приведен на фиг. 15. Таким образом, предварительное введение раствора тартрата железа(III) позволяет визуализировать смоделированное воспаление в легком и сделать вывод, что тартрат трехвалентного железа характеризуется устойчивостью, достаточной для предотвращения гидролиза при физиологических значениях среды, но не препятствующей реакциям перелигандирования железа с транспортными белками плазмы крови, и может быть применен для ранней визуализации воспалений цитратами изотопов галлия.
Пример 5.
Визуализация воспаления легкого у мышей. Эксперимент выполняют на 6 мышах-самках BALB / c массой 19,2±3,1 г с моделью септического воспаления легкого, вызванного внутрилегочной инокуляцией культуры клеток Escherichia coli. Мышам внутривенно вводят готовый 10-2 М раствор лактата железа(III) в объеме инъекции 0,10±0,02 мл за 10-15 минут до введения радиофармпрепарата 68Ga-цитрата в объеме 0,10±0,02 мл. Визуализацию воспаления у мышей проводят на позитронно-эмиссионном томографе PET/X-RAY Genisys 4 (SofieBioscience, USA) для лабораторных животных через 60 минут после инъекции 68Ga-цитрата с получением файла формата *.dicom и его последующей количественной обработки в программе VivoQuant 1.24 для получения читаемых изображений с фильтром invert (black and white). Пример изображения приведен на фиг. 16. Таким образом, предварительное введение раствора лактата железа(III) позволяет визуализировать смоделированное воспаление в легком и сделать вывод, что лактат трехвалентного железа характеризуется устойчивостью, достаточной для предотвращения гидролиза при физиологических значениях среды, но не препятствующей реакциям перелигандирования железа с транспортными белками плазмы крови, и может быть применен для ранней визуализации воспалений цитратами изотопов галлия.
Пример 6.
Визуализация воспаления легкого у мышей. Эксперимент выполняют на 6 мышах-самках BALB / c массой 18,9±20,8 г с моделью септического воспаления легкого, вызванного внутрилегочной инокуляцией культуры клеток Escherichia coli. Мышам внутривенно вводят готовый 10-2 М раствор маната железа(III) в объеме инъекции 0,10±0,02 мл за 10-15 минут до введения радиофармпрепарата 68Ga-цитрата в объеме 0,10±0,02 мл. Визуализацию воспаления у мышей проводят на позитронно-эмиссионном томографе PET/X-RAY Genisys 4 (SofieBioscience, USA) для лабораторных животных через 60 минут после инъекции 68Ga-цитрата с получением файла формата *.dicom и его последующей количественной обработки в программе VivoQuant 1.24 для получения читаемых изображений с фильтром invert (black and white). Пример изображения приведен на фиг. 17. Таким образом, предварительное введение раствора малата железа(III) позволяет визуализировать смоделированное воспаление в легком и сделать вывод, что малат трехвалентного железа характеризуется устойчивостью, достаточной для предотвращения гидролиза при физиологических значениях среды, но не препятствующей реакциям перелигандирования железа с транспортными белками плазмы крови, и может быть применен для ранней визуализации воспалений цитратами изотопов галлия.
Пример 7.
Визуализация воспаления легкого у мышей. Эксперимент выполняют на 6 мышах-самках BALB/c массой 19,5±3,3 г с моделью септического воспаления легкого, вызванного внутрилегочной инокуляцией культуры клеток Escherichia coli. Мышам внутривенно вводят готовый 10-2 М раствор аскорбата железа(III) в объеме инъекции 0,10±0,02 мл за 10-15 минут до введения радиофармпрепарата 68Ga-цитрата в объеме 0,10±0,02 мл. Визуализацию воспаления у мышей проводят на позитронно-эмиссионном томографе PET/X-RAY Genisys 4 (SofieBioscience, USA) для лабораторных животных через 60 минут после инъекции 68Ga-цитрата с получением файла формата *.dicom и его последующей количественной обработки в программе VivoQuant 1.24 для получения читаемых изображений с фильтром invert (black and white). Пример изображения приведен на фиг. 18. Таким образом, предварительное введение раствора аскорбата железа(III) позволяет визуализировать смоделированное воспаление в легком и сделать вывод, что аскорбат трехвалентного железа характеризуется устойчивостью, достаточной для предотвращения гидролиза при физиологических значениях среды, но не препятствующей реакциям перелигандирования железа с транспортными белками плазмы крови, и может быть применен для ранней визуализации воспалений цитратами изотопов галлия.
Таким образом, цель изобретения достигнута - высокоэффективный простой и дешевый способ визуализации воспалений разработан.
Источники информации
1. Audi G., Bersillon О., Blachot J.A. et al. The Nubase evaluation of nuclear and decay properties // Nucl. Phys. A., 2003, V. 729, No 1, p. 3-128;
2. Lavender J.P., Lowe J., Barker J. Gallium 67 citrate scanning in neoplastic and inflammatory lesions // Br. J. Radiol. - №44, - 1971. - pp. 361-366.
3. Harris W.R., Pecoraro V.L. Thermodynamic binding constants for gallium transferrin // Biochemistry. - №22, - 1983. - pp. 292-299.
4. Martinez J.L., Delgado-Iribarren A., Baquero F. Mechanisms of iron acquisition and bacterial virulence // FEMS Microbiol. Rev. - №75, - 1990. - pp. 45-56.
5. Larson S.M., Rasey J.S., Allen D.R., Nelson N.J. A transferrin-mediated uptake of gallium-67 by EMT-6 sarcoma. I. Studies in tissue culture // J. Nucl. Med. - 1979 - Vol. 20. - P. 837-842.
6. Ando A., Nitta K., Ando I. et al. Mechanism of gallium 67 accumulation in inflammatory tissue // Eur. J. Nucl. Med. - №17, - 1990. - pp. 21-27.
7. Gelrud L.G., Arsenau J.C., Milder M.S. The kinetics of 67Ga incorporation into inflammatory lesions: experimental and clinical studies // J Lab Clin Med. - 1974. - N 83. - P. 489-495.
8. Hoffer R. Gallium: mechanisms // J. Nucl. Med. - 1980. - Vol. 21. - P. 282-285.
9. Gunasekera S.W., King L.J., Lavender P.J. The behavior of tracer gallium-67 towards serum proteins // Clin. Chim. Acta. - 1972. - Vol. 39. - P. 401-406.
10. Hara T. On the binding of gallium to transferrin // Int. J. Nucl. Med. Biol. - 1974. - N1. - P. 152-154.
11. Larson S.M., Allen D.R., Rasey J.S., Grunbaum Z. Kinetics of binding of carrier-free Ga-67 to human transferrin // J. Nucl. Med. - 1978. - Vol. 19. - P. 1245-1249.
12. Vallabhajosula S.R., Harwig J.F., Siemsen J.K., Wolf W. Radio gallium localization in tumors: blood binding and transport and the role of transferrin.// J. Nucl. Med. - 1980. - Vol. 21. P. 650-656.
13. Hayes R.L., Edwards C.L. The effect of stable scandium on red blood cells and on the retention and excretion of 67Ga in humans // South. Med. J. - 1973. - Vol. 66. - P. 1339-1340.
14. Hayes R.L., Byrd B.L., Rafter J.J., Carlton J.E. The Effect of Scandium on the Tissue Distribution of Ga-67 in Normal and Tumor-Bearing Rodents // J. Nucl. Med. - 1980. - Vol. 21. - P. 361-365.
15. Oster Z.H., Som P., Sacker D.F., Atkins H.L. The effects of deferoxamine mesylate on gallium-67 distribution in normal and abscess-bearing animals: concise communication // J. Nucl. Med. - 1980. - Vol. 21. - P. 421-425.
16. Kriegel H. Biokinetics and metabolism of radio gallium. // Nuclear Medicine. - 1984. - N23. - P. 53-57.
17. Bruner H. D., Hayes R.L. and Perkinson J.D. A study of gallium-72-X. Preliminary data on gallium-67. // Radiology. - №61, - 1953. - pp. 602-603.
18. Пат. США №4448763 (15.05.1984).
19. Adamson R.H., Canellos G.P., Sieber S.M. Studies on the antitumor activity of gallium nitrate and other Group III a metal salts // Cancer Chem other Rep Part 1.59: 599-610 1975;
20. Руководство по проведению доклинических исследований лекарственных средств. Часть первая // под ред. А.Н. Миронова, М.: Гриф и К., 2012. - 944 с. 21. Патент РФ №2522892 (20.07.2014).
22. Geisser P., Burckhardt S. The pharmacokinetics and Pharmacodynamics of iron preparations // Pharmaceutics. - №3, - 2013. - pp. 12-33.
| название | год | авторы | номер документа |
|---|---|---|---|
| Применение радиофармацевтической композиции с использованием меченых аутологичных лейкоцитов для визуализации местных лучевых поражений методом однофотонной эмиссионной томографии | 2018 |
|
RU2708088C2 |
| ЛИОФИЛИЗАТ ДЛЯ ПРИГОТОВЛЕНИЯ РАДИОФАРМАЦЕВТИЧЕСКОГО ПРЕПАРАТА | 2017 |
|
RU2702238C2 |
| ОКТАПЕПТИД ДЛЯ ПОЛУЧЕНИЯ РАДИОФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ, РАДИОФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО НА ЕГО ОСНОВЕ И СПОСОБ ДИАГНОСТИКИ ОПУХОЛЕЙ, ЭКСПРЕССИРУЮЩИХ СОМАТОСТАТИНОВЫЕ РЕЦЕПТОРЫ | 2011 |
|
RU2457215C1 |
| Способ радионуклидной диагностики злокачественных лимфом | 2018 |
|
RU2706602C1 |
| ОСТЕОТРОПНЫЙ РАДИОФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ ДЛЯ ПЭТ-ВИЗУАЛИЗАЦИИ | 2014 |
|
RU2614235C2 |
| КОНЪЮГИРОВАННЫЕ БИСФОСФОНАТЫ ДЛЯ ДИАГНОСТИКИ И ТЕРАПИИ ЗАБОЛЕВАНИЙ КОСТЕЙ | 2015 |
|
RU2742660C2 |
| ПАРААМИНОГИППУРОВАЯ КИСЛОТА (ПАГ) КАК ВЕЩЕСТВО ДЛЯ ЗАЩИТЫ ПОЧЕК | 2020 |
|
RU2804349C2 |
| АНТАГОНИСТЫ GRPR ДЛЯ ОБНАРУЖЕНИЯ, ДИАГНОСТИКИ И ЛЕЧЕНИЯ GRPR-ПОЗИТИВНОГО ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ | 2013 |
|
RU2821944C2 |
| РАДИОФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ (ТЕРАПИИ) КОСТНЫХ ПОРАЖЕНИЙ СКЕЛЕТА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2407746C2 |
| АНТАГОНИСТЫ GRPR ДЛЯ ОБНАРУЖЕНИЯ, ДИАГНОСТИКИ И ЛЕЧЕНИЯ GRPR-ПОЗИТИВНОГО ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ | 2013 |
|
RU2693465C2 |
Изобретение относится к медицине и фармацевтической промышленности и представляет собой способ визуализации воспалений, включающий внутривенное введение изотопа галлия, пригодного для радионуклидной диагностики и выбранного из 68Ga и 67Ga в форме цитратного комплекса, и вещества, блокирующего металлсвязывающую способность трансферрина крови, представляющего собой физиологически приемлемое соединение трехвалентного железа, выбранного из цитрата железа, тартрата железа, лактата железа, малата железа и аскорбата железа, и последующую визуализацию очагов воспаления методами позитронно-эмиссионной томографии и однофотонной эмиссионной компьютерной томографии. Изобретение обеспечивает получение изображений с увеличенной информативностью о воспалении в ранние сроки после введения изотопов галлия. 2 н. и 4 з.п. ф-лы, 7 пр., 1 табл., 18 фиг.
1. Способ визуализации воспалений, включающий внутривенное введение изотопа галлия, пригодного для радионуклидной диагностики и выбранного из 68Ga и 67Ga в форме цитратного комплекса, и вещества, блокирующего металлсвязывающую способность трансферрина крови, представляющего собой физиологически приемлемое соединение трехвалентного железа, выбранного из цитрата железа, тартрата железа, лактата железа, малата железа и аскорбата железа, и последующую визуализацию очагов воспаления методами позитронно-эмиссионной томографии и однофотонной эмиссионной компьютерной томографии.
2. Способ по п. 1, где за 10-15 мин до введения изотопов галлия, пригодных для радионуклидной диагностики, в форме цитратных комплексов, внутривенно вводится в качестве блокирующего вещества физиологически приемлемое соединение железа(III) в дозе 0,14 мг/кг в пересчете на железо.
3. Способ по п. 2, где изотопом галлия, пригодным для радионуклидной диагностики, является 68Ga в количестве 37-740 МБк/мл.
4. Способ по п. 1, где одновременно внутривенно вводится изотоп галлия, пригодный для радионуклидной диагностики, и физиологически приемлемое соединение железа(III) в дозе 0,14 мг/кг в пересчете на железо.
5. Способ по п. 4, где изотопом галлия, пригодным для радионуклидной диагностики, является 68Ga в количестве 37-740 МБк/мл.
6. Радиофармацевтическая композиция для визуализации воспалений методом позитронно-эмиссионной томографии, содержащая 68Ga и физиологически приемлемое соединение трехвалентного железа, выбранное из цитрата железа, тартрата железа, лактата железа, малата железа и аскорбата железа.
| US 4448763 A, 15.05.1984 | |||
| WO 1993023743 А1, 25.11.1993 | |||
| Ларенков А.А | |||
| Способ получения смеси хлоргидратов опийных алкалоидов (пантопона) из опийных вытяжек с любым содержанием морфия | 1921 |
|
SU68A1 |
| СПОСОБ ВИЗУАЛИЗАЦИИ | 2008 |
|
RU2505316C2 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
Авторы
Даты
2015-12-20—Публикация
2014-11-05—Подача