Предполагаемое изобретение относится к прикладной гидробиологии и альгологии и предназначено для длительного хранения микроводорослей в научных и учебных учреждениях, а также может быть использовано в биотехнологической промышленности для хранения штаммов музейных культур.
Надёжное сохранение культур микроводорослей и создание банков штаммов является одной из важных задач современной биологии. Практическое значение изобретения связано с возрастающей потребностью науки и биотехнологии постоянно иметь в своём распоряжении жизнеспособные и стабильные культуры, а также с проблемой сохранения биоразнообразия флоры Украины.
В альгологической практике используется широкий спектр методов, позволяющих сохранять микроводоросли в жизнеспособном состоянии. Это содержание микроводорослей на жидких средах длительного хранения [Marsalek В., Rojickova, 1988], агаре, альгинате [Chen Y.С, 2003], при помощи лиофилизации и криосохранения с использованием защитных сред и криопротекторов [Айздайчер Н.Α., Силкин В.Α., 1983]. Однако при использовании этих методов происходит изменение морфологических и функциональных свойств, а также измельчание клеток сохраняемых культур. Кроме того, поддержание культур в жизнеспособном состоянии является трудоёмким процессом и требует дорогостоящего оборудования.
Для сохранения микроорганизмов в течение длительного времени применяют высушивание (обезвоживание) - перевод клеток в состояние ангидробиоза. Ангидробиоз - глубокое и длительное торможение метаболизма, обратимое при благоприятных условиях и достаточно распространённое явление в природе. Применяемые способы длительного сохранения культур путём высушивания должны отвечать двум основным требованиям: во-первых, процесс обезвоживания не должен оказывать вредного воздействия на клетки; во-вторых, обезвоженные клетки должны длительное время сохранять свои биохимические свойства [Колесов С.Г., 1952, 1959]. Клетки различных видов микроорганизмов могут быть высушены на воздухе при комнатной или слегка повышенной температуре в стерильной почве, в кварцевом песке, на гранулированной пемзе, на тальке, на активированном угле, на зернах злаков, на дисках агара, на бумаге, на шерстяных нитках и многих других «носителях» и храниться в течение многих лет в жизнеспособном состоянии [Бекер М.Е. Обезвоживание микробной биомассы и экстрацеллюлярных метаболитов. - Рига: Зинатне, 1967. - С. 74 - 77; Бекер М.Е., Кудрявцев В.И. Лиофилизация бактерий // Методы хранения коллекций культур. - М: Наука, 1967. - С. 119 - 135.; Potts M. Desiccation tolerance of prokaryotes // Microbiol Rev. - 1994. - Vol. 58, №4. - P. 755-805]. Недостатком этих методов является то, что, они разработаны для бактерий и дрожжей. Описаний исследований по ангидробиозу микроводорослей в литературе встречается крайне мало. Единичные сведения об исследовании ангидробиоза у микроводорослей представлены (см. Нестеренко Т.В. Реактивация микроводорослей из состояния сухого анабиоза. // Вопросы управления биосинтезом низших растений. - Новосибирск: Наука, 1982. - 139 с), где рассматривается процесс реактивации клеток. Недостаток метода состоит в том, что при увлажнении клеток хлоридом натрия, с учётом концентрации растворов, которая зависит от степени обезвоживания микроводорослей, происходит потеря клеточного содержимого.
В основу изобретения «Способ длительного хранения микроводорослей» поставлена задача путём выбора условий де- и регидратации, обеспечить оптимальное сохранение жизнеспособности клеток микроводорослей длительное время.
Поставленная задача достигается тем, что в предлагаемом способе, состоящем из перевода микроводорослей в состояние ангидробиоза, сохранения микроводорослей в обезвоженном состоянии, выведении из ангидробиоза, дегидратацию микроводорослей проводят на стадии стационарного роста при температуре 30-60°С до остаточной влажности клеток 8-14%. Реактивацию сухих одноклеточных водорослей проводят при освещенности 2 кЛк путем увлажнения питательной средой, разбавленной дистиллированной водой в соотношении 1:1, температура которой составляет 30°С, а через 2 ч к реактивируемым культурам добавляют культуральные среды той же концентрации и температуры. Обезвоженные культуры содержат в герметичной упаковке, без доступа света и при температуре окружающей среды 15-20°С.
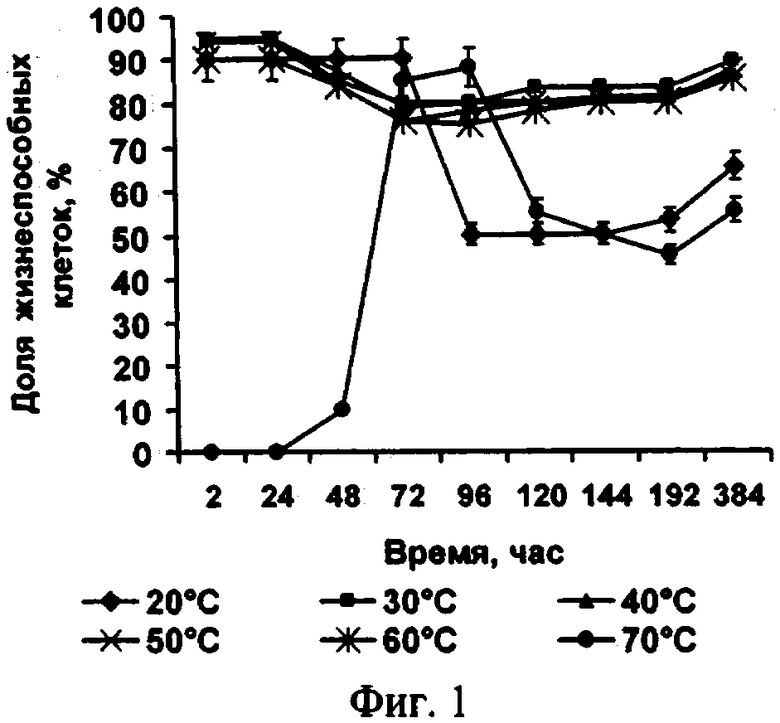
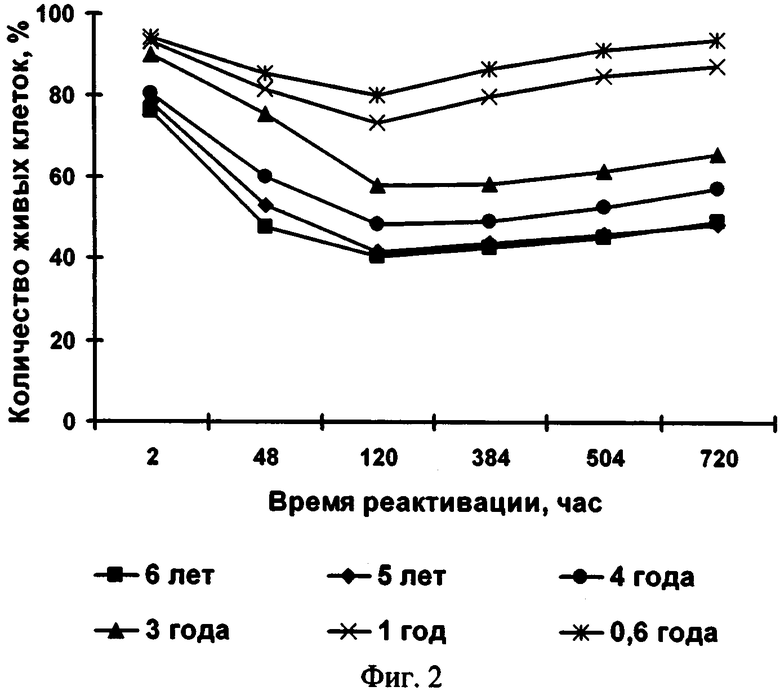
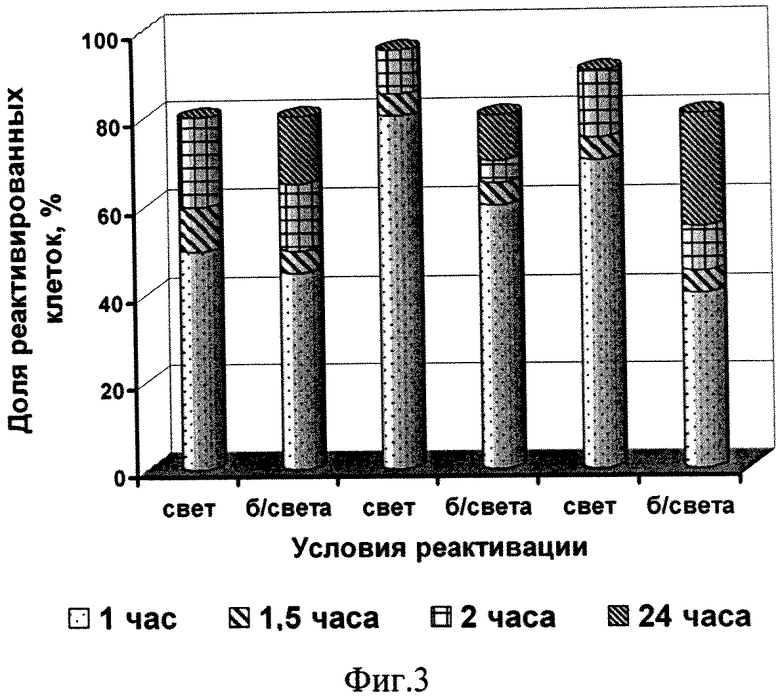
Способ поясняется иллюстрациями. На фиг.1 - Влияние температуры обезвоживания на жизнеспособность клеток микроводоросли; фиг. 2 - Влияние сроков хранения на жизнеспособность микроводоросли в состоянии ангидробиоза; фиг. 3 - Влияние условий реактивации на жизнеспособность реактивируемой культуры (1 -хлорид натрия, 2 - разбавленная среда Заррук (1: 1), 3 - среда Заррук)
В способе обезвоживают клетки микроводорослей, достигшие необходимых качественных характеристик в процессе культивирования. Известно [Далакян Т.А., Волкова Е.Р., Недосекин А.Г., 1984], что, каждая из фаз роста микроводорослей характеризуется ярко выраженной направленностью потока углерода в один из основных блоков метаболизма клеток. В логарифмической фазе синтезируется белок, в фазе замедления скорости роста - углеводы, в стационарной фазе, особенно в конце фазы, накапливаются липиды. Для максимального сохранения жизнеспособности клетки необходимо обезвоживать на стационарной стадии роста, т.к. накопленные углеводы и липиды самые эффективные источники сохранения энергии и играют жизненно важную роль в устойчивости к разным физиологическим стрессам. В предлагаемом способе культивирование микроводорослей проводят в накопительном режиме, при этом клетки находятся в стационарной фазе роста.
Экспериментальные исследования влияния условий обезвоживания клеток на их жизнеспособность, выполненные автором, позволили сделать выбор оптимальной температуры обезвоживания (см. фиг.1) и табл. 1.
Автором экспериментально определен оптимальный диапазон остаточной влажности (8-14%). Изменение остаточной влажности всего на 2% оказывалось критическим для сохранения жизнеспособности клеток в высушенном состоянии.
Разбавление среды водой и её нагревание препятствуют развитию осмотического шока у реактивируемых клеток. Стабилизирующее действие на мембраны при осмотическом шоке оказывают ионы кальция, которые присутствуют в питательных растворах. Определение оптимального режима регидратации осуществили в эксперименте на примере водоросли Spirulina platensis, выращенной на среде Заррук. Использовали три раствора: 1) хлорид натрия 0,25 М, 2) среда Заррук, разбавленная дистиллированной водой в соотношении 1:1, 3) полная среда Заррук (не разбавленная). Результаты представлены в табл. 2
Таблица 1

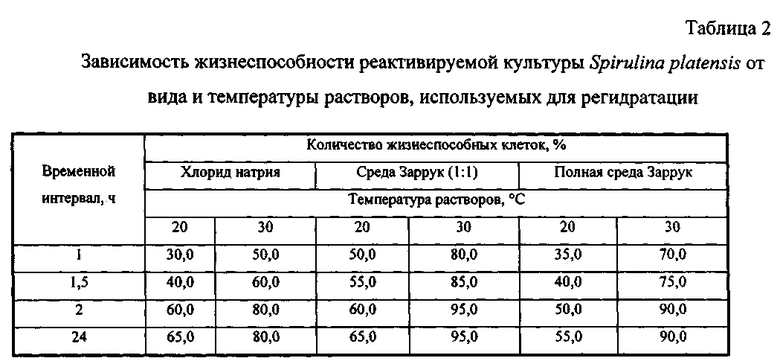
Наибольший процент жизнеспособных клеток отмечен при увлажнении средой Заррук (1:1), при t=30°C
Результаты исследования влияния условий реактивации на жизнеспособность реактивируемой культуры (см. фиг.3) подтверждают необходимость ее выдерживания в течение 2 ч при освещенности 2 кЛк.
Способ реализуется следующим образом. Культивируемые микроводоросли обезвоживают на стационарной стадии роста в температурном диапазоне 30-60°С до остаточной влажности клеток 8-14%. Дегидрированные культуры помещают в герметичный полиэтиленовый пакет, а затем в пластиковую емкость. Хранят в специальном помещении (боксе) без доступа света и температуре окружающей среды 15-20°С. Для реактивации обезвоженные клетки микроводорослей увлажняют питательной средой для культивирования, разбавленной дистиллированной водой в соотношении 1:1 и подогретой до 30°С.
Пример.
Про- и эукариотические микроводоросли, культивируемые на различных средах (Spirulina platensis - среда Заррук; Synechococcus sp, Phaeodactylum tricornutum, Porphyridium omentum - среда Тренкеншу), обезвоживали на стационарной стадии роста в термостате при температуре 30-60°С до остаточной влажности клеток Spirulina platensis - 9-11%, Synechococcus sp. - 8-11%, Phaeodactylum tricornutum - 12-14%, Porphyridium cruentum - 10-11%. Упаковывали дегидратированные клетки в герметичные полиэтиленовые пакеты, а затем в пластиковые емкости. Хранили в специальном помещении без доступа света и при температуре окружающей среды 15-20°С. По мере необходимости из хранилища изымали образцы микроводорослей. Их навески помещали в чашки Петри и увлажняли средой культивирования (Spirulina platensis - среда Заррук; Synechococcus sp, Phaeodactylum tricornutum, Porphyridium cruentum - среда Тренкеншу), разбавленной дистиллированной водой в соотношении 1:1 и подогретой до 30°С. Чашки Петри с увлажнёнными клетками микроводорослей выставляли на люминостат с освещённостью 2 кЛк. Через 2 часа прибавляли культуральную среду той же концентрации и температуры.
Прокариотические микроводоросли более устойчивы к обезвоживанию по сравнению с эукариотическими. Исходные размеры клеток Synechococcus sp. восстанавливались через 30 мин после начала реактивации, a Spirulina platensis - через 24 часа. У эукариотической микроводоросли Porphyridium cruentum исходные размеры восстанавливались через 10 дней, a Phaeodactylum tricornutum - в течение 1 месяца. Процесс деления после реактивации начинается: у Synechococcus sp. - через 24 часа, у Spirulina platensis - через 2 недели, у Phaeodactylum tricornutum и Porphyridium cruentum - через 1 месяц. Хранение микроводорослей в состоянии ангидробиоза от 0,6 года до 6 лет не приводило к угнетению жизнеспособности клеток (см. фиг.2).
Основное преимущество заявляемого способа длительного хранения микроводорослей заключается в простоте и надежности, а также в том, что предлагаемый метод оптимально приближён к естественным условиям, экономически выгоден и даёт возможность рекомендовать его для использования в биотехнологических, научных и учебных целях.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БИОМАССЫ СПИРУЛИНЫ С ВЫСОКИМ СОДЕРЖАНИЕМ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ | 2022 |
|
RU2790921C1 |
| ШТАММ ARTHROSPIRA PLATENSIS (NORDST.) GEITL. 1/02-T/03-5 - ПРОДУЦЕНТ БЕЛКОВОЙ БИОМАССЫ | 2006 |
|
RU2322489C1 |
| Способ получения биомассы диатомовой водоросли Cylindrotheca closterium, обогащенной железом, используемой в качестве сырья для получения биологически активных добавок к пище | 2017 |
|
RU2644682C1 |
| Штамм одноклеточной микроводоросли Eustigmatos magnus - продуцент эйкозапентаеновой кислоты | 2017 |
|
RU2661116C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЯГКОГО СЫЧУЖНОГО СЫРА БЕЗ СОЗРЕВАНИЯ | 2024 |
|
RU2837187C1 |
| СПОСОБ КРИОСОХРАНЕНИЯ МОРСКИХ МИКРОВОДОРОСЛЕЙ | 2012 |
|
RU2496318C1 |
| Способ выращивания микроводоросли Porphyridium purpureum | 2016 |
|
RU2675318C2 |
| СПОСОБ ПОЛУЧЕНИЯ СЫРЬЯ ИЗ ARTHROSPIRA PLATENSIS, ОБОГАЩЕННОЙ МИКРОЭЛЕМЕНТАМИ В ОРГАНИЧЕСКОЙ ФОРМЕ | 2024 |
|
RU2837132C1 |
| Способ получения монокультуры водорослей (его варианты) | 1982 |
|
SU1084296A1 |
| СПОСОБ КРИОКОНСЕРВАЦИИ КЛЕТОК ЦИАНОБАКТЕРИЙ | 2017 |
|
RU2650786C1 |
Способ длительного хранения микроводорослей относится к прикладной гидробиологии и альгологии. Предназначен для длительного хранения микроводорослей в научных и учебных учреждениях, а также может быть использован в биотехнологической промышленности для хранения штаммов музейных культур.
В способе, состоящем из перевода микроводорослей в состояние ангидробиоза, сохранения микроводорослей в обезвоженном состоянии, выведении из ангидробиоза, дегидратацию микроводорослей проводят на стадии стационарного роста при температуре 30-60°С до остаточной влажности клеток 8-14%. Реактивацию сухих одноклеточных водорослей проводят при освещенности 2 кЛк путем увлажнения питательной средой, разбавленной дистиллированной водой в соотношении 1:1, температура которой составляет 30°С, а через 2 ч к реактивируемым культурам добавляют культуральные среды той же концентрации и температуры. Обезвоженные культуры содержат в герметичной упаковке, без доступа света и при температуре окружающей среды 15-20°С.
Основное преимущество заявляемого способа длительного хранения микроводорослей заключается в простоте и надежности, а также в том, что предлагаемый метод оптимально приближён к естественным условиям, экономически выгоден и даёт возможность рекомендовать его для использования в биотехнологических, научных и учебных целях.
1. Способ длительного хранения микроводорослей, состоящий из культивирования клеток с использованием сред культивирования, перевода клеток в анабиотическое состояние путем дегидратации и реактивации, включающей увлажнение клеток, отличающийся тем, что дегидратацию микроводорослей проводят на стадии стационарного роста при температуре от 30-60°С до остаточной влажности клеток 8-14%, а реактивацию сухих одноклеточных водорослей проводят при освещенности 2 кЛк путем увлажнения питательной средой, разбавленной в соотношении 1:1 дистиллированной водой, температура которой 30°С.
2. Способ по п. 1, отличающийся тем, что обезвоженные культуры содержат в герметичной упаковке, без доступа света и при температуре окружающей среды 15-20°С.
Авторы
Даты
2015-02-10—Публикация
2014-09-26—Подача