Изобретение относится к микроводорослевой биотехнологии и представляет собой новый ранее не описанный, стабильный по морфологическим признакам штамм сине-зеленой водоросли/цианобактерии Arthrospira platensis (Nordst.) Geitl. 1/02-T/03-5 (коллекция научно-исследовательской лаборатории возобновляемых источников энергии (НИЛ ВИЭ) географического факультета МГУ), который может быть использован для получения биомассы, имеющей пищевое, кормовое, медицинское, фармацевтическое назначение.
Ценность биомассы различных штаммов A.platensis в указанных целях определяется высоким содержанием легкоусвояемого белка, включающего все незаменимые аминокислоты, углеводов, липидов, полиненасыщенных жирных кислот (особенно большим количеством ценных линолевой и γ-линоленовой кислот), широким спектром витаминов группы B, наличием β-каротина, фикоцианина, хлорофилла 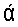 и т.д. Представителен список публикаций, касающихся масштабов использования спирулины (коммерческое название биомассы A.platensis) по различному назначению [1].
и т.д. Представителен список публикаций, касающихся масштабов использования спирулины (коммерческое название биомассы A.platensis) по различному назначению [1].
Отличительной особенностью штаммов, используемых для получения биомассы спирулины в промышленном масштабе, в том числе и штамма A.platensis 1/02 (коллекция НИЛ ВИЭ), является их высокий полиморфизм, проявляющийся как в стационарных условиях культивирования, так и являющийся следствием измененных физико-химических условий выращивания [2, 3, 4]. Изменению подвергается в основном геометрия спирали вплоть до появления прямых трихомов, которые могут составлять от 10 до 100% биомассы [5, 6]. Появление в культиваторах прямых вариантов трихомов создает определенные трудности в технологическом процессе получения биомассы, связанные с установлением альгологической чистоты культуры [7], ухудшением фильтруемости культуральной жидкости [5]. Поддержание культур в коллекции требует частых пересевов, при этом происходит полная замена спиральных форм на прямые.
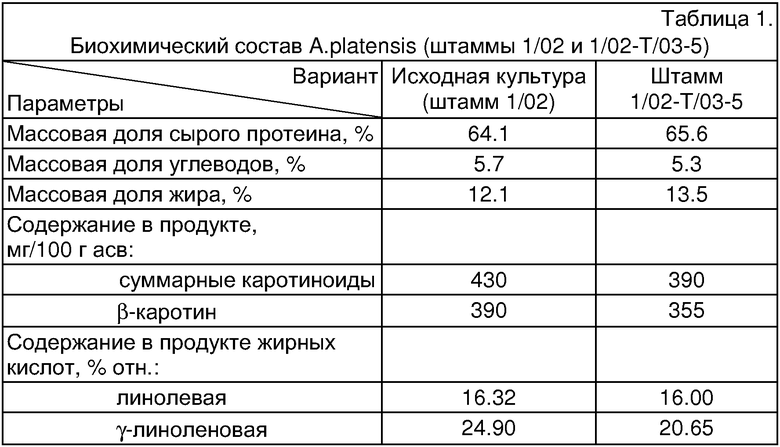
Предметом изобретения является A.platensis штамм 1/02-Т/03-5 спиральной формы, отличной от таковой исходного штамма A.platensis 1/02, в процессе длительного культивирования и длительного хранения которого не отмечены прямые трихомы, а также любые другие морфологические варианты. При этом сохранены все полезные свойства биомассы, присущие A.platensis шт.1/02 (таблица 1).
Происхождение штамма.
Из производственной установки НИЛ ВИЭ, где выращивалась спирулина A.platensis (Nordst.) Geitl. штамм IPPAS В-287 (коллекция ИФР РАН) с большим содержанием прямых трихомов (до 90%) были выделены на твердой агаровой среде Заррука [8] две клоновые культуры: штамм 1/02 спиральной формы и штамм 1/02-П/03 прямой формы. Проведенный генетический анализ выделенных культур и коллекционного штамма A.platensis (Nordst.) Geitl. штамм IPPAS В-287 показал, что все три культуры принадлежат к одному виду (таблица 2).
Геномные характеристики штаммов A.platensis (Nordst.) Geitl.
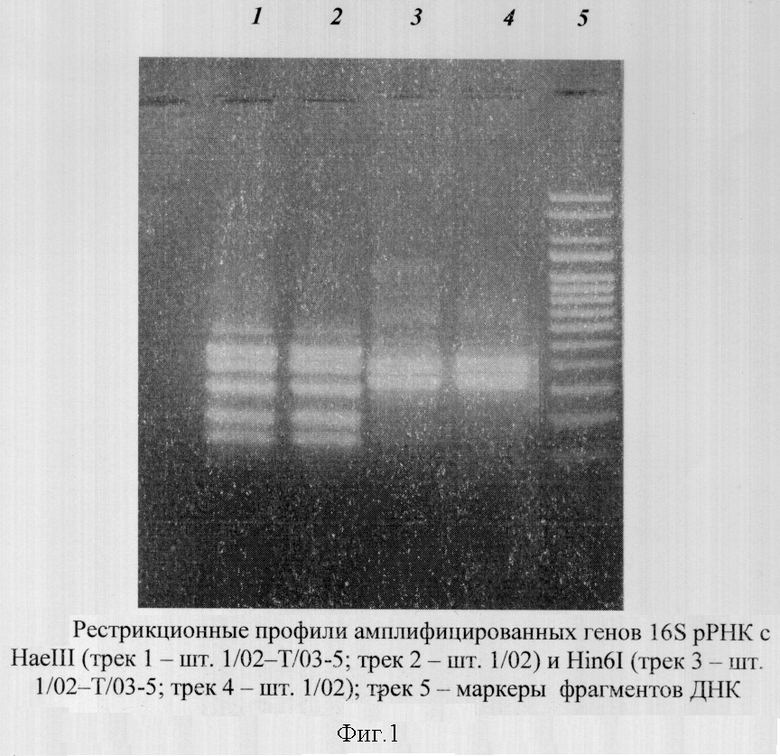
В процессе изучения естественной изменчивости клоновой культуры A.platensis шт.1/02 по морфологическому признаку был получен штамм A.platensis 1/02-Т/03 - 5, отличающийся геометрией спирали от исходного штамма и стабильный при длительном культивировании и хранении в коллекции по морфологии трихома (три года наблюдений). Генетический анализ обоих штаммов по результатам ARDRA с двумя рестриктазами показал их идентичность (фиг.1).
Морфологические признаки штамма.
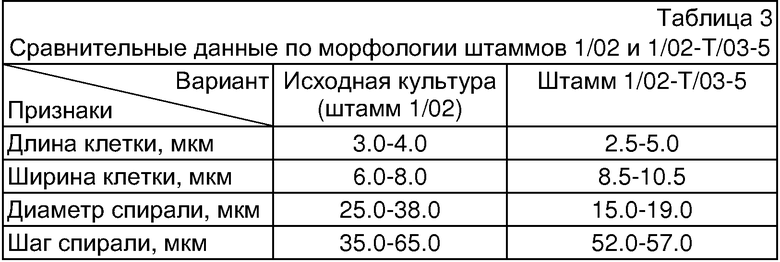
При выращивании штамма 1/02-Т/03-5 в колбах на жидкой среде Заррука при температуре 24-30°С, освещенности 2.0 клк и периодическом встряхивании культура представлена слабо спирализованными трихомами темно-зеленого цвета, гранулированными, без перетяжек или со слабо выраженными перетяжками у поперечных перегородок. Ширина клетки (трихома) - 8.5-10.5 мкм; длина клетки - 2.5-4.0 мкм; внутренний диаметр спирали - 7.0-8.5 мкм; внешний - 15.0-19.0 мкм; расстояние между витками спирали (высота спирали) - 36.0-57.0 мкм. Длина трихома до 500 мкм, число оборотов спирали - 2.0-20.0, преимущественно 5-8 витков.
На агаровой среде Заррука (1.2% агар-агара) культура представлена как отдельными трихомами, так и в виде пучков. Сравнительные данные по морфологии трихомов исходного штамма 1/02 и штамма 1/02-Т/03-5 даны в таблице 3 и на фиг.2.
При хранении в жидкой среде Заррука в баре-холодильнике при температуре 12-14°С и освещении лампой дневного света 0.5 клк культура в течение 5 месяцев без пересева представлена трихомами темно-зеленого цвета, гранулированными с числом оборотов от 2 до 20.
Характерным признаком штамма 1/02-Т/03-5 является то, что геометрия спирали трихома не меняется при многочисленных пересевах при длительном культивировании в жидкой питательной среде и длительном хранении на жидких питательных средах в течение 3-х лет (время наблюдения).
Размножение.
Вегетативное, делением клеток и последующей фрагментацией трихомов путем разрыва или в области некридиальных клеток. В оптимальных условиях относительная скорость роста равна 0.20 ч-1, что соответствует минимальному времени удвоения 5.0 час.
Физиологические свойства штамма.
Штамм артроспиры 1/02-Т/03-5 является автотрофом, источником углерода служат карбонаты и гидрокарбонаты натрия и калия, усваивает азот в нитратной (натрий азотнокислый и калий азотнокислый) и аммиачной (мочевина, аммиачная селитра) формах. Мезофил: оптимальная температура выращивания 26-32°С. Оптимум рН составляет 8.5-10,5. Подщелачивание выше 11.0 тормозит рост и накопление биомассы.
Для культивирования используется среда Заррука [8] и ее модификации. Состав среды, обеспечивающий продуктивность штамма 1/02-Т/03-5 на уровне 0.9-1.5 г/л сухой биомассы, включает (в г/л):
- NaHCO3 - 8.0-32.0,
- KNO3 - 1.0-6.0,
- K2НРО·3Н2O - 0.5-2.0,
- K2SO4 - 0.5-2.0,
- MgSO4·7H2O - 0.1-0.4,
- NaCl - 0.5-2.0,
- CaCl2 - 0.02-0.04
- FeSO4·7H2O - 0.01-0.04,
- трилон Б - 0.04-0.16,
- микроэлементы (растворы А и Б по 1 мл /л среды).
Раствор А (г/л):
- Н3ВО3 - 2.86,
- MnCI2·4H2O - 1.81,
- ZnSO4·7H2O - 0.22,
- CuSO4·5H2O - 0.08,
- МоО3 - 0.015.
Раствор Б (г/л):
- K2Cr2(SO4)4·24Н2O - 0.096,
- NH4VO3 - 0.023,
- NiSO4·7Н2O - 0.048,
- Na2WO4·2H2O - 0.018,
- Ti2(SO4)3 - 0.04,
- Со(NO3)2·6Н2O - 0.044.
Изобретение может быть проиллюстрировано следующими примерами.
Пример 1.
Клоновая культура A.platensis штамм 1/02 (исходный штамм) выращивалась в течение 5 месяцев в десяти пробирках размером (20×2) см с объемом среды Заррука 15 мл при освещении 2.0 клк, температуре 26-28°С и периодическом встряхивании с пересевом на свежую питательную среду каждые две недели. При микроскопическом исследовании состояния культуры в камере Горяева после 2-недельного культивирования наблюдались прямые морфологические варианты в количестве 0.1-0.3% после 3-го пассажа; 1.0-3.0% после 4-го пассажа; до 6.0% после 5-го пассажа; 12.0-20.0% после 6-го пассажа; 18.0-37.0% после 7-го пассажа; свыше 50.0% после 10-го пассажа (5-месячного культивирования). Микроскопический анализ проводился на микроскопе «Axioplan 2 Imaging" с камерой высокого разрешения «AxioCam MBm» и модульной системой обработки и анализа изображений «AxioVision 3.1.». Плотность культуры в конце 2-недельного культивирования при каждом пассаже была 0.9-1.6 г/л сухой биомассы.
Пример 2.
2-недельная клоновая культура A. platensis шт.1/02, выращенная в десяти пробирках размером (20×2) см с объемом среды Заррука 15 мл при освещении 2.0 клк, температуре 26-28°С, была заложена на хранение в холодильник-бар со стеклянной дверцей при температуре 12-14°С и освещении лампой дневного света 0.5 клк. Плотность культуры составляла 1.2-1.5 г/л сухой биомассы. После трех месяцев хранения обнаружены прямые варианты в количестве 1.5-2.0%, выявленные при пересеве на свежую питательную среду Заррука (10 об.% посевного материала) и подращивании в пробирках при периодическом встряхивании при Т 26-28°С и освещенности 2.0 клк в течение 2-х недель. После 5 месяцев хранения культуры прямые варианты обнаружены в исходной культуре при микроскопировании, а при пересеве на свежую питательную среду Заррука (10 об.% посевного материала) прямые варианты обнаруживались в количестве до 20% после двухнедельного подращивания.
Пример 3.
Клоновая культуры A.platensis штамм 1/02-Т/03-5 выращивалась в течение 5 месяцев в десяти пробирках размером (20×2) см с объемом среды Заррука 15 мл при освещении 2.0 клк, температуре 26-28°С и периодическом встряхивании с пересевом на свежую питательную среду каждые две недели. Плотность культуры в конце 2-недельного выращивания при каждом пассаже была 0.9-1.3 г/л сухой биомассы. При микроскопическом исследовании не обнаружены прямые и иные морфологические варианты ни в одном из пассажей. Геометрия (характер) спирали сохранялась на протяжении всего опыта.
Пример 4.
2-недельная клоновая культура A.platensis шт.1/02-Т/03-5, выращенная в десяти пробирках размером (20×2) см с объемом среды Заррука 15 мл при освещении 2.0 клк, температуре 26-28°С, была заложена на хранение в холодильник-бар со стеклянной дверцей при температуре 12-14°С и освещении лампой дневного света 0.5 клк. Плотность культуры составляла 0.9-1.3 г/л сухой биомассы. В течение 5 месяцев хранения ежемесячно культура анализировалась микроскопически непосредственно, а также после посева на свежую питательную среду Заррука и подращивания в условиях, аналогичных описанным в примере 2. В течение всего срока хранения культуры в ней не были обнаружены прямые и иные морфологические варианты. Культура была стабильна по морфологическому признаку.
Пример 5.
2-недельная клоновая культура A.platensis шт. 1/02-Т/03-5, выращенная в десяти пробирках размером (20×2) см с объемом среды Заррука 15 мл при освещении 2.0 клк, температуре 26-28°С, была заложена на хранение в холодильник-бар со стеклянной дверцей при температуре 12-14°С и освещении лампой дневного света 0.5 клк. Плотность культуры составляла 0.9-1.3 г/л сухой биомассы. В течение 3-х лет хранения каждые пять месяцев культура анализировалась микроскопически и пересевалась. В течение всего срока хранения культуры в ней не были обнаружены прямые и иные морфологические варианты. Культура была стабильна по морфологическому признаку.
Источники информации
1. R.Henrikson. Earth Food Spirulina.Kenwood, California, 1994. 180 p.
2. Levin R.A. Uncoiled variants of Spirulina platensis (Cyanophyceae: Oscillatoriaceae), Arch. HydrobioL, Suppl.60. Algol. Stud., 1980. 26, P.48-52.
3. Vrio Ciferri. Spirulina, the Edible Microorganism. Microbiological Reviews. Dec., 1983. Vol.47, No.4. P.551-578.
4. N.Jeeji Bai. Competitive exclusion or morphological transformation? A case study with Spirulina fusiformis, Arch. Hydrobiol, Suppl.71, Algol. Stud, 1985. 38/39, P.191-199.
5. Jourdan J-P. Grow your own spirulina. http://perso.orange.fr/petites-nouvelles/manuel/grow.htm
6. A.c. СССР №1347204. A01H 13/00, A23K 1/00, С12N 1/12 // С12N 1/12, С12R 1:89. 1985.
7.Сиренко Л.А, Шевченко Т.Ф. Альгологическое загрязнение промышленных культур Spirulina Turp. и трудности их идентификации. Альгология, 1996. Т.6, №1. С.91-96.
8. Пиневич В.В, Верзилин Н.Н., Михайлов А.А. Изучение Spirulina platensis - нового объекта для высокоинтенсивного культивирования. Физиология растений. 1970. Т.17, Вып.5. С.1007.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ Arthrospira platensis (Nordst.) Geitl. rsemsu T/05-117 - ПРОДУЦЕНТ ЛИПИДОСОДЕРЖАЩЕЙ БИОМАССЫ | 2012 |
|
RU2539766C2 |
| ШТАММ СИНЕ-ЗЕЛЕНЫХ ВОДОРОСЛЕЙ SPIRULINA PLATENSIS (NORDST) GEITL КАК ИСТОЧНИК БЕЛКА И БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ | 1992 |
|
RU2096463C1 |
| СПОСОБ ПОЛУЧЕНИЯ СЫРЬЯ ИЗ ARTHROSPIRA PLATENSIS, ОБОГАЩЕННОЙ МИКРОЭЛЕМЕНТАМИ В ОРГАНИЧЕСКОЙ ФОРМЕ | 2024 |
|
RU2837132C1 |
| Биологически активная добавка к пище | 2017 |
|
RU2654282C1 |
| ПРЕПАРАТ ПОЛИВАЛЕНТНОГО БАКТЕРИОФАГА ПРОТИВ СИНЕГНОЙНОЙ ПАЛОЧКИ, ШТАММЫ БАКТЕРИОФАГА BACTERIOPHAGUM PSEUDOMONAS AERUGINOSA СПБГМА ИМ. И.И. МЕЧНИКОВА №05, №03, №06 И №07, ИСПОЛЬЗУЕМЫЕ ПРИ ПРИГОТОВЛЕНИИ ПОЛИВАЛЕНТНОГО ПРЕПАРАТА ПРОТИВ СИНЕГНОЙНОЙ ПАЛОЧКИ | 2001 |
|
RU2186574C1 |
| ШТАММ КЛОНАЛЬНОЙ ПЕРЕВИВАЕМОЙ ЛИНИИ КЛЕТОК ПОЧКИ САЙГИ Saiga tatarica ПС/с4, ИСПОЛЬЗУЕМЫЙ ДЛЯ ВИРУСОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ | 2007 |
|
RU2339693C1 |
| ВНК-21/13-13-ПЕРЕВИВАЕМАЯ МОНОСЛОЙНО-СУСПЕНЗИОННАЯ СУБЛИНИЯ КЛЕТОК ПОЧКИ НОВОРОЖДЕННОГО СИРИЙСКОГО ХОМЯЧКА, ПРЕДНАЗНАЧЕННАЯ ДЛЯ РЕПРОДУКЦИИ ВИРУСА ЯЩУРА И ВИРУСА БЕШЕНСТВА | 2014 |
|
RU2553552C1 |
| ВНК-21/13-02-перевиваемая монослойно-суспензионная сублиния клеток почки новорожденного сирийского хомячка, предназначенная для репродукции вируса ящура и вируса бешенства | 2005 |
|
RU2614074C1 |
| ШТАММ БАКТЕРИЙ Achromobacter sp.-ДЕСТРУКТОР ОРГАНОФОСФОНАТОВ И СПОСОБ ЕГО ПРИМЕНЕНИЯ ДЛЯ БИОРЕМЕДИАЦИИ ПОЧВ | 2009 |
|
RU2401298C1 |
| СУХАЯ ФОРМА ПОСЕВНОГО БАКТЕРИАЛЬНОГО МАТЕРИАЛА РЕКОМБИНАНТНОГО ШТАММА БАКТЕРИЙ Escherichia coli JM 103/pTBI - ПРОДУЦЕНТА БЕЛКА TBI С ИХ ИСПОЛЬЗОВАНИЕМ | 2010 |
|
RU2460782C2 |

Штамм Arthrospira platensis (Nordst.) Geitl. 1/02-T/03-5 выделен из клоновой культуры Arthrospira platensis 1/02. Штамм хранится в коллекции НИЛ ВИЭ географического факультета МГУ. Штамм характеризуется повышенным выходом белковой биомассы. Массовая доля белка составляет 65,6%. 3 ил., 3 табл.
Штамм Arthrospira platensis (Nordst.) Geitl. 1/02-T/03-5 (коллекция НИЛ ВИЭ географического факультета МГУ) - продуцент белковой биомассы.
| ПИНЕВИЧ В.В | |||
| и др | |||
| Изучение Spimlina platensis - нового объекта для высокоинтенсивного культивирования | |||
| - Физиология растений, 1970, т.17, вып.5, с.1037-1045 | |||
| ORIO CIFERRL Spimlina, the Edible Microorganism | |||
| Microbiological reviews, Dec | |||
| Гребенчатая передача | 1916 |
|
SU1983A1 |
| Способ получения биомассы спирулины | 1988 |
|
SU1620477A1 |
| СПОСОБ ПОЛУЧЕНИЯ ОБОГАЩЕННОЙ СЕЛЕНОМ БИОМАССЫ СПИРУЛИНЫ (SPIRULINA PLATENSIS) | 2000 |
|
RU2199582C2 |
Авторы
Даты
2008-04-20—Публикация
2006-06-27—Подача