Изобретение относится к нанотехнологии и может быть использовано для исследования образцов, например биоматериалов и изделий медицинского назначения, методами сканирующей зондовой микроскопии. В частности это может быть исследование внутренних пор зондом сканирующего зондового микроскопа (СЗМ).
Известен способ исследования трехмерных структур, включающий срез трехмерной структуры ножом криотома и исследование двухмерной структуры зондом с острием сканирующего зондового микроскопа [1]. Этот способ выбран в качестве прототипа предложенного решения.
Недостаток этого способа заключается в ограниченной информативности измерения образцов, связанной с исследованием только его поверхности, что снижает его функциональные возможности.
Технический результат изобретения заключается в расширении функциональных возможностей известного способа исследования трехмерных структур.
Указанный технический результат достигается тем, что в способе исследования трехмерных структур, включающем осуществление среза трехмерной структуры ножом и исследование срезанной поверхности образца трехмерной структуры зондом с чувствительным элементом сканирующего зондового микроскопа, после среза трехмерной структуры исследуют ее внутренние зоны.
Существует вариант, в котором внутренние зоны трехмерной структуры исследуют линейным чувствительным элементом зонда сканирующего зондового микроскопа и(или) боковые стенки внутренних зон трехмерной структуры исследуют расширяющимся чувствительным элементом с боковыми выступами.
Существует также вариант, в котором после исследования внутренних зон трехмерной структуры осуществляют дополнительный срез трехмерной структуры ножом в соответствии с результатами этого исследования, после чего проводят дополнительное исследование поверхности трехмерной структуры и ее внутренних зон чувствительным элементом зонда сканирующего зондового микроскопа
Существует также вариант, в котором после исследования внутренних зон трехмерной структуры осуществляют следующий срез под углом к предыдущему срезу.
Существует также вариант, в котором выполнение следующего среза под углом к предыдущему срезу осуществляют после поворота трехмерной структуры и(или) выполнение следующего среза под углом к предыдущему срезу осуществляют после поворота ножа.
Существует также вариант, в котором исследование внутренних зон трехмерной структуры осуществляют после введения в них через капилляр жидкости с наночастицами, в качестве которых используют наночастицы золота с биологически активными веществами, например цитостатиками.
Существует также вариант, в котором после среза трехмерной структуры на нее осуществляют стороннее воздействие, в качестве которого используют ультрафиолетовое излучение и(или) рентгеновское излучение, и (или) лазерное излучение, и(или) плазму, и(или) температурное воздействие.
Существует также вариант, в котором в качестве трехмерных структур используют волокнистые структуры.
Существует также вариант, в котором исследование проводят в криокамере при температуре ниже 0°C.
На фиг.1 изображено устройство для реализации предложенного способа.
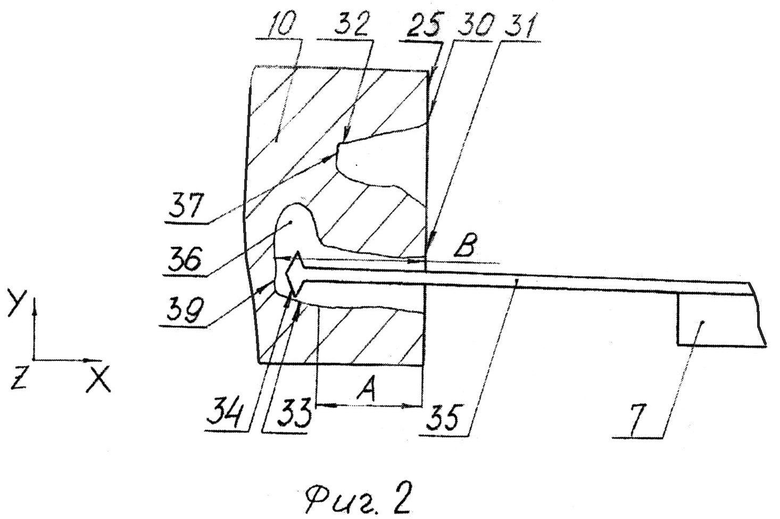
На фиг.2 представлен вариант исследования внутренних зон чувствительным элементом с боковыми выступами.
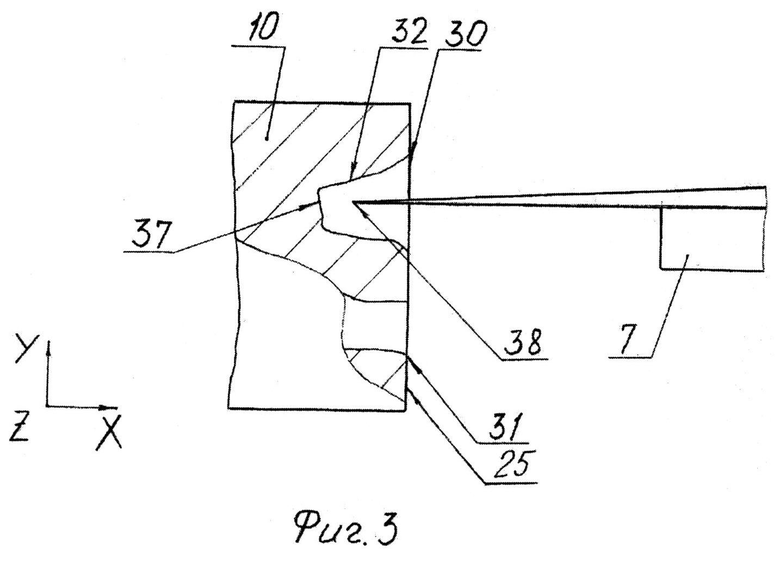
На фиг.3 представлен вариант исследования внутренних зон линейным чувствительным элементом.
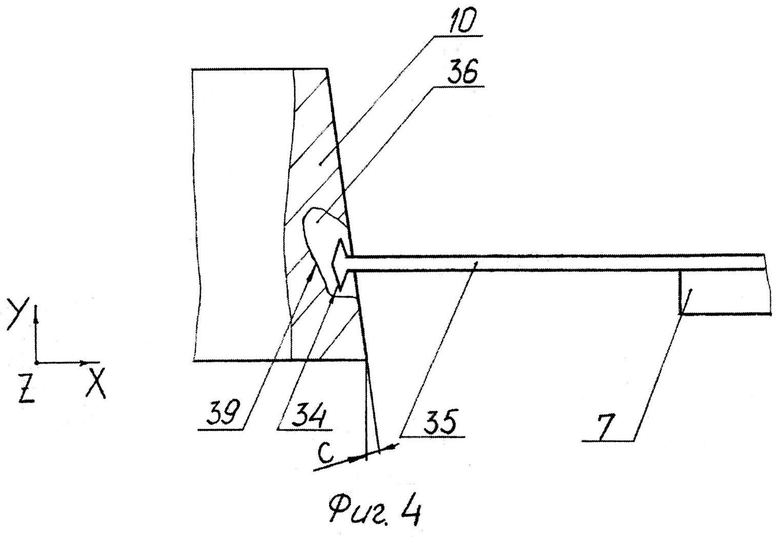
На фиг.4 представлен вариант исследования боковых ответвлений внутренних зон.
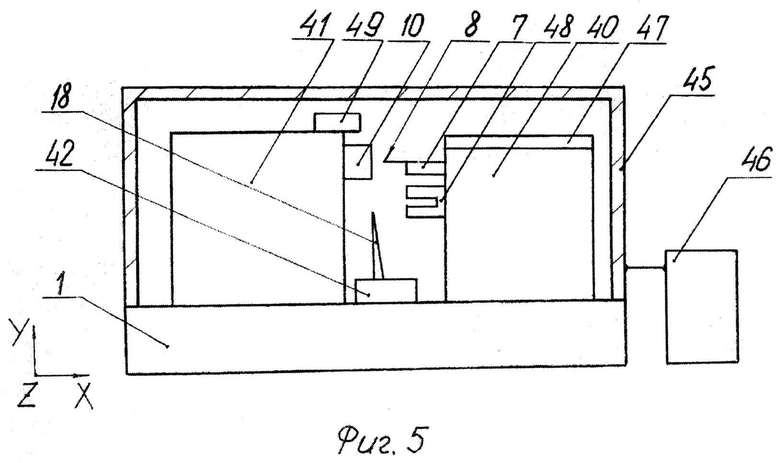
На фиг.5 изображен вариант криотома.
На фиг.6-7 представлены результаты исследований трехмерной структуры образца клеточного матрикса предложенным способом.
Устройство для реализации предложенного способа содержит платформу 1, на которой на первых направляющих 2 установлена первая подвижная каретка 3 (координата X) с пьезосканером 4, содержащим фланец 5, в котором закреплен первый держатель 6 зонда 7, имеющего чувствительный элемент 8. Первая подвижная каретка 3 может быть сопряжена с первым приводом 9. Чувствительный элемент 8 может быть установлен с возможностью взаимодействия с образцом 10, закрепленным во втором держателе 11, размещенным на механизме поворота 12, установленном на второй подвижной каретке 13 (координаты Y или Y, Z). При этом вторая подвижная каретка 13 может быть установлена на вторых направляющих 14, расположенных на платформе 1. Вторая подвижная каретка 13 может быть сопряжена со вторым приводом 15. На платформе 1 на третьих направляющих 16 установлена третья подвижная каретка 17 с ножом 18, сопряженная с третьим приводом 19. Элементы 2, 3, 4, 5, 6, 7, 8, 9 представляют собой сканирующий зондовый микроскоп (см. подробно в [2, 3], который может быть подключен к первому блоку управления 22. Это подключение показано условно. Второй блок управления 23 может быть соединен с механизмом поворота 12, вторым приводом 15 и третьим приводом 19. Элементы с 10 по 23 за исключением блока 22 входят в состав микротома. Блоки 22 и 23 могут быть объединены в один блок (не показано).
В качестве зонда 7 может использоваться кварцевый резонатор с чувствительным элементом (см. подробно в [4]). В качестве чувствительного элемента 8 могут использоваться удлиненные элементы с боковыми выступами, описанные в [5, 6], а также нитевидные кристаллы, технология получения которых описаны в [7, 8]. В качестве первых 2 и вторых 14 направляющих можно использовать линейные направляющие, описанные в [2], либо две линейные направляющие, установленные одна на другой. Вторые направляющие 14 и второй привод 15 показаны условно и могут быть выполнены аналогично описанным в [1]. Тем не менее следует заметить, что в серийно выпускаемых микротомах и криотомах часто элементы 14, 15 и 16 представляют собой шарнирную конструкцию. Механизм поворота 12 может иметь шарнирное исполнение (см., например [9], либо быть выполненным на сферической опоре, как на фиг.1 и закрепляться вручную, например, с использованием накидного элемента (не показан).
Третья подвижная каретка 17 может осуществлять перемещения по координатам X, Y, а также вращение вокруг оси 24. Это может быть двухкоординатный стол на основе двух линейных направляющих с поворотным механизмом. Двухкоординатное перемещение может быть механизированным, а вращение осуществляться вручную и закрепляться накидным элементом (не показаны). Координатные столы, осуществляющие все описанные перемещения, подробно описаны в [10, 11, 12]. Микротом и криотом, обеспечивающие срез образца 10 и формирование гладкой поверхности 25, описаны также в [13, 14].
В качестве образца 10 может использоваться образец пористой трехмерной структуры с характерным размером пор от 1 нм до нескольких сотен мкм, выполненной на основе биоматериалов или полимеров.
На варианте по фиг.2 внутренние зоны 30 и 31 исследуют расширяющимся чувствительным элементом 35 с боковыми выступами 34. Количество боковых выступов 34 может достигать пяти. При этом можно в первую очередь исследовать боковые поверхности 32, 33 и ответвление 36, но не дно 39.
На варианте по фиг.3 внутренние зоны 30 и 31 исследуют линейным чувствительным элементом 38. При этом можно в первую очередь исследовать поверхность (дно) 37.
На варианте по фиг.4 исследуют ответвление 36 линейным чувствительным элементом 38 (не показано) или расширяющимся чувствительным элементом 35 с боковыми выступами 34.
В варианте криотома (фиг.5) платформа 1 с первыми средствами перемещения 40 зонда 7, вторыми средствами перемещения 41 образца 10 и третьими средствами перемещения 42 ножа 18 расположена внутри камеры 45, соединенной с источником хладагента 46.
Существует вариант, в котором устройство сопряжено с источником 47 лазерного, ультрафиолетового или рентгеновского излучения, или источником нейтронов (см., например, [15, 16, 17, 18]).
Существует вариант, в котором камера 45 является герметичной с возможностью откачки воздуха по крайней мере до уровня 1 мбар и сопряжена с электродами 48, обеспечивающими возникновения в ней плазмы [19]. В данном варианте возможно также использование источника 47 лазерного, ультрафиолетового или рентгеновского излучения, или источника нейтронов.
Существует вариант, в котором устройство сопряжено с нагревателем 49 (см., например, [20]).
Реализация способа осуществляется следующим образом. Закрепляют зонд 7 (фиг.1) в первом держателе 6. Закрепляют образец 10 во втором держателе 11. Используя подвижку образца 10 относительно ножа 18, осуществляют срез образца 10 и формирование гладкой поверхности 25 образца 10. Используя первый привод 9, подводят чувствительный элемент 8 к поверхности 25 образца 10. Используя пьезосканер 4, осуществляют сканирование поверхности 25 и измерение ее характеристик. Подробно работу СЗМ см. в [2, 3, 13, 14]. Обычно расширяющимся чувствительным элементом 35 (фиг.2) сначала исследуют боковые поверхности 32 и 33 внутренних зон 30 и 31. При этом элементом 35 можно исследовать также дно 37 и 39. Более точное исследования дна 37 и 39 можно проводить линейным чувствительным элементом 38 (фиг.3). В том случае, если элементом 35 не удается исследовать все дно 39, можно делать следующее. Производят отвод чувствительного элемента 35 от поверхности 25. В том случае, если необходимо проводить срез на определенную величину А (фиг.2) в соответствии с измеренной глубиной В, нож 18 перемещают на величину А по координате X и выполняют срез. После этого образец 10 (фиг.4) разворачивают против часовой стрелки на угол C и исследуют ответвление 36 и в частности дно 39 выступом 34 элемента 35.
В одном из вариантов исследование внутренних зон 30 и 31 (фиг.2) трехмерной структуры осуществляют после введения в них через капилляр жидкости с наночастицами. Для этого может использоваться микропипетка (не показана). В качестве наночастиц можно использовать наночастицы с размерами 2-100 нм. В качестве наночастиц можно также использовать наночастицы золота с биологически активными веществами. В качестве биологически активных веществ могут использоваться связывающиеся с рецепторами на поверхности клеток-мишеней молекулы, например интерлейкин-2 или инсулин, которые могут быть закреплены на наночастицах золота. В частном случае в качестве биологически активных веществ используют цитостатики, например доксорубицин, которые могут быть закреплены на наночастицах золота [21]. Через этот же капилляр может вводиться химически активная жидкость.
Существует вариант (фиг.5), при котором после осуществления среза образца 10 ножом 18 поверхность 25 подвергается воздействию пучка ультрафиолетового, рентгеновского или лазерного излучения заданной интенсивности и длительности, для чего используется, соответственно, источник лазерного, ультрафиолетового или рентгеновского излучения, или источник нейтронов 47. Минимальные размеры зоны воздействия лазерного, ультрафиолетового или рентгеновского излучения, или нейтронов на поверхность 25 определяются возможностями фокусировки пучков соответствующих источников. Для рентгеновских источников эти возможности описаны в [22].
В результате воздействия ультрафиолетового или лазерного излучения на трехмерные структуры может происходить изменение морфологии биологических структур на поверхности 25, например изменение белковой структуры белка коллагена [16], механических свойств и структурной организации коллагеновых фибрилл [23] в результате кросс-линкинга белковых молекул.
В результате воздействия лазерного излучения на трехмерные структуры так же может происходить изменение морфологии белковых микроструктур [15] на поверхности 25 в результате кросс-линкинга белковых молекул, а так же полимеризация структур на поверхности 25 [24, 25].
В результате воздействия рентгеновского излучения на трехмерные структуры так же может происходить изменение наноструктуры [26] поверхности 25.
Существует вариант, при котором после осуществления среза образца 10 ножом 18 на поверхность 25 оказывают дополнительное воздействие с использованием плазмы. Это воздействие осуществляется следующим образом. После осуществления среза из герметичной камеры 45 откачивают воздух до заданного значения давления в диапазоне от 1 до 10 мбар. Затем на электроды 48 подают напряжение в диапазоне до 3 кВ. С помощью образующейся в камере 45 плазмы осуществляют плазменное травление поверхности 25 с выявлением чужеродных включений. Технология плазменного травления описана подробно в [27].
Существует вариант, при котором после осуществления среза образца 10 ножом 18 на поверхность 25 оказывают дополнительное температурное воздействие с использованием нагревателя 49. Это воздействие осуществляется следующим образом. После осуществления среза производят нагрев поверхности 25 образца 10 до заданной температуры в диапазоне от 20°C до 300°C. Нагрев может осуществляться образом, описанным в [28]. В результате нагрева на поверхности 25 может происходить, например, дегидратация, полимеризация материала поверхности или денатурация белковых структур, в зависимости от материала образца 10.
В качестве трехмерных структур помимо описанных вариантов можно использовать волокнистые структуры, например, описанные в [29]. В одном из вариантов исследование проводят в криокамере при температуре ниже 0°C. Такие варианты описаны в [30].
В качестве примера реализации способа представлено исследование трехмерной структуры микро- и нанопористого клеточного матрикса на основе фиброина (регенерированного шелка), предназначенного для использования в регенеративной медицине. Подобные матриксы описаны в [31]. Исследуемый матрикс закреплялся с помощью эпоксидной смолы в держателе образца микротома, после чего выполнялся срез трехмерной структуры матрикса ножом микротома и формирование поверхности 25. Затем выполнялось измерение участка поверхности 25 матрикса размером 50×50 мкм с помощью чувствительного элемента зондового микроскопа и локализация и определение размеров внутренних зон 30 микропор матрикса на исследуемом участке (фиг.6). В качестве чувствительного элемента сканирующего зондового микроскопа использовался зонд, чувствительный элемент которого выполнен в виде линейной вольфрамовой иглы, закрепленной на кварцевом резонаторе. Подобные зонды описаны в [32]. После этого чувствительный элемент вводился в выбранную внутреннюю зону микропоры 30 и выполнялось исследование ее структуры. В результате исследования были получены изображения поверхности дна внутренней зоны 37, определены морфология, средний диаметр и среднее количество наноразмерных пор (2,4 мкм-2) на единицу площади на данной поверхности. Пример полученного изображения поверхности дна внутренней зоны 37 показан на фиг.7.
Данные параметры трехмерной структуры матрикса имеют ключевое значения для предсказания его биологических свойств.
В случае если глубина исследуемой микропоры превышала предельный диапазон измерения используемого сканирующего зондового микроскопа по оси X (10 мкм), выполнялся дополнительный срез трехмерной структуры матрикса ножом микротома, толщина которого соответствовала данной величине. Затем проводилось дополнительное исследование поверхности и внутренних зон трехмерной структуры чувствительным элементом сканирующего зондового микроскопа.
То, что после среза трехмерной структуры исследуют ее внутренние зоны, расширяет функциональные возможности способа.
То, что внутренние зоны трехмерной структуры исследуют линейным чувствительным элементом зонда сканирующего зондового микроскопа и (или) боковые стенки внутренних зон трехмерной структуры исследуют расширяющимся чувствительным элементом с боковыми выступами, расширяет функциональные возможности способа за счет возможности получения максимальной информации о структуре внутренних зон.
То, что после исследования внутренних зон трехмерной структуры осуществляют дополнительный срез трехмерной структуры ножом в соответствии с результатами этого исследования, после чего проводят дополнительное исследование поверхности трехмерной структуры и ее внутренних зон чувствительным элементом зонда сканирующего зондового микроскопа, позволяет учитывать результаты предыдущих исследований и получать новые более информативные результаты.
То, что после исследования внутренних зон трехмерной структуры осуществляют следующий срез под углом к предыдущему срезу. Аналогичным образом можно получать новые, более информативные результаты.
То, что исследование внутренних зон трехмерной структуры осуществляют после введения в них через капилляр жидкости с наночастицами, в качестве которых используют наночастицы золота с биологически активными веществами, например цитостатиками, повышает информативность способа и соответственно его функциональные возможности.
То, что после среза трехмерной структуры на нее осуществляют стороннее воздействие, в качестве которого используют ультрафиолетовое излучение и(или) рентгеновское излучение, и(или) лазерное излучение, и(или) плазму, и(или) температурное воздействие, также повышает информативность способа и соответственно его функциональные возможности.
То, что в качестве трехмерных структур используют волокнистые структуры, расширяет функциональные возможности способа.
То, что исследование проводят в криокамере при температуре ниже 0°C, позволяет изучать более широкий круг материалов, на которых срез может быть осуществлен только в замороженном состоянии.
Литература
1. Патент RU 2389032, 2010.
2. Патент RU 2152103, 2000.
3. Миронов В.Л. Основы сканирующей зондовой микроскопии. - М.: Техносфера, 2009. - 144 с.
4. Патент RU 2208763, 2003.
5. Патент US 5345816, 1994.
6. Патент US 5382795, 1995.
7. Патент RU 2220429, 2003.
8. Публикация Microsc. Microanal. Microstruct., 3 (1992), с.313-331.
9. Патент US 4950909, 1990.
10. Патент RU 2377620, 2009.
11. Патент RU 2242054, 2004.
12. Патент RU 2306621, 2001.
13. Патент RU 2427846, 2011.
14. Патент RU 2389032, 2010.
15. S Turunen, E Käpylä, К Terzaki, J Viitanen, С Fotakis, M Kellomäki and M Farsari, Pico- and femtosecond laser-induced crosslinking of protein microstructures: evaluation of processability and bioactivity, Biofabrication, 3, 045002 (2011).
16. A.J. Majewski, M. Sanzari, H.-L. Cui, P. Torzilli, Effects of ultraviolet radiation on the type-I collagen protein triple helical structure: A method for measuring structural changes through optical activity, Phys. Rev. E 65, 031920 (2002).
17. Gerhart Lowenthal, Peter Airey, Practical Applications of Radioactivity and Nuclear Radiations, Cambridge University Press, 2001.
18. Тюфяков Н.Д., Штань А.С. Основы нейтронной радиографии. 1975. - 256 с.
19. Патент RU 2206882, 2003.
20. Патент RU 2244948, 2005.
21. Singh, A., Hede, S. and Sastry, M., Spider Silk as an Active Scaffold in the Assembly of Gold Nanoparticles and Application of the Gold-Silk Bioconjugate in Vapor Sensing. Small, 2007, 3, p.466-473.
22. Егоров Е.В., Егоров В.К. Практическая реализация повышения светосилы плоских рентгеновских волноводов-резонаторов // Поверхность. 2009. №1, с.1-9.
23. Weadock, К.S., Miller, E.J., Bellincampi, L.D., Zawadsky, J.P. and Dunn, M.G. (1995), Physical crosslinking of collagen fibers: Comparison of ultraviolet irradiation and dehydrothermal treatment. J. Biomed. Mater. Res., 29: 1373-1379.
24. С. Decker, Laser-Induced Polymerization, Materials for Microlithography. Chapter 9, p.207-223, ACS Symposium Series, Vol.266 (1984).
25. М.Т. Raimondi, S.M. Eaton, M.M. Nava, M. Lagana, G. Cerullo, R. Osellame, Two-photon laser polymerization: from fundamentals to biomedical application in tissue engineering and regenerative medicine, J Appl Biomater Function Mater 2012; 10(1): 56-66.
26. M. Ishino, A. Faenov, M. Tanaka, N. Hasegawa, M. Nishikino, S. Tamotsu, T. Pikuz, N. Inogamov, V. Zhakhovsky, I. Skobelev, V. Fortov, V. Khohlov, V. Shepelev, T. Ohba, T. Kaihori, Y. Ochi, T. Imazono, T. Kawachi, Interaction of soft x-ray laser pulse radiation with aluminum surface: Nano-meter size surface modification, AIP Conf. Proc. 1465, p.236-240;
27. Моряков О.С. Элионная обработка. - M.: Элионная разработка. 1990. - 128 с.
28. Блинов И.Г., Кожитов Л.В. Оборудование полупроводникового микроскопа. - M.: Машиностроение. 1986. - 264 с.
29. V.G. Bogush, О.S. Sokolova, L.I. Davydova, D.V. Klinov, К.V. Sidoruk, N.G. Esipova, T.V. Neretina, I.A. Orchanskyi, V. Yu Makeev, V.G. Tumanyan, K.V. Shaitan, V.G. Debabov, M.P. Kirpichnikov, A Novel Model System for Design of Biomaterials Based on Recombinant Analogs of Spider Silk Proteins, Journal of Neuroimmune Pharmacology, March 2009, Volume 4, Issue 1, p.17-27.
30. A.E. Efimov, H. Gnaegi, R. Schaller, W. Grogger, F. Hofer and N.B. Matsko, Analysis of native structure of soft materials by cryo scanning probe tomography, Soft Matter, 2012, 8, p.9756-9760.
31. Агапов И.И., Мойсенович M.M., Васильева Т.В., Пустовалова О.Л., Коньков А.С., Архипова А.Ю., Соколова О.С., Богуш В.Г, Севастьянов В.И., Дебабов В.Г., Кирпичников М.П., Биодеградируемые матриксы из регенерированного шелка Bombix Mori, Доклады Академии наук, 2010, Т.433, №5, с.699-702.
32. N.В. Matsko, J. Wagner, A. Efimov, I. Haynl, S. Mitsche, W. Czapek, B. Matsko, W. Grogger, F. Hofer, Self-Sensing and - Actuating Probes for Tapping Mode AFM Measurements of Soft Polymers at a Wide Range of Temperatures, Journal of Modem Physics, 2011, 2, p.72-78.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИССЛЕДОВАНИЯ ТРЕХМЕРНЫХ СТРУКТУР ПОСРЕДСТВОМ СКАНИРУЮЩЕЙ ОПТИЧЕСКОЙ ЗОНДОВОЙ НАНОТОМОГРАФИИ | 2017 |
|
RU2680726C1 |
| СПОСОБ ФОРМИРОВАНИЯ НАНОРАЗМЕРНЫХ СТРУКТУР | 2013 |
|
RU2529458C1 |
| СКАНИРУЮЩЕЕ УСТРОЙСТВО ЛОКАЛЬНОГО ВОЗДЕЙСТВИЯ | 2016 |
|
RU2617542C1 |
| Сканирующий зондовый микроскоп, совмещенный с устройством модификации поверхности образца | 2017 |
|
RU2653190C1 |
| СКАНИРУЮЩИЙ ЗОНДОВЫЙ МИКРОСКОП, СОВМЕЩЕННЫЙ С УСТРОЙСТВОМ СРЕЗАНИЯ ТОНКИХ СЛОЕВ ОБЪЕКТА | 2004 |
|
RU2287129C2 |
| Зонд для сканирующей зондовой микроскопии и способ его изготовления (варианты) | 2017 |
|
RU2660418C1 |
| СПОСОБ ИЗМЕРЕНИЯ ПОВЕРХНОСТИ ОБЪЕКТА В РЕЖИМЕ СКАНИРУЮЩЕГО ЗОНДОВОГО МИКРОСКОПА | 2015 |
|
RU2597959C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКОГО ОБРАЗЦА ДЛЯ ИССЛЕДОВАНИЯ МЕТОДОМ СКАНИРУЮЩЕЙ ЗОНДОВОЙ НАНОТОМОГРАФИИ | 2020 |
|
RU2769836C2 |
| СКАНИРУЮЩИЙ ЗОНДОВЫЙ МИКРОСКОП, СОВМЕЩЕННЫЙ С УСТРОЙСТВОМ МОДИФИКАЦИИ ПОВЕРХНОСТИ ОБЪЕКТА | 2012 |
|
RU2572522C2 |
| АНАЛИЗАТОР МНОГОФУНКЦИОНАЛЬНЫЙ | 2013 |
|
RU2561234C2 |


Изобретение относится к области нанотехнологий и может быть использовано для исследования образцов, например биоматериалов и изделий медицинского назначения, методами сканирующей зондовой микроскопии, включая исследование внутренних пор зондом сканирующего зондового микроскопа (СЗМ). Для исследования трехмерных структур выполняют срез образца трехмерной структуры ножом и исследование срезанной поверхности зондом с чувствительным элементом СЗМ, после чего исследуют внутренние зоны трехмерной структуры. Затем, в соответствии с результатами этого исследования, осуществляют дополнительный срез трехмерной структуры и проводят дополнительное исследование поверхности трехмерной структуры и ее внутренних зон чувствительным элементом зонда СЗМ. Технический результат - повышение информативности исследования трехмерных структур. 5 з.п. ф-лы, 7 ил.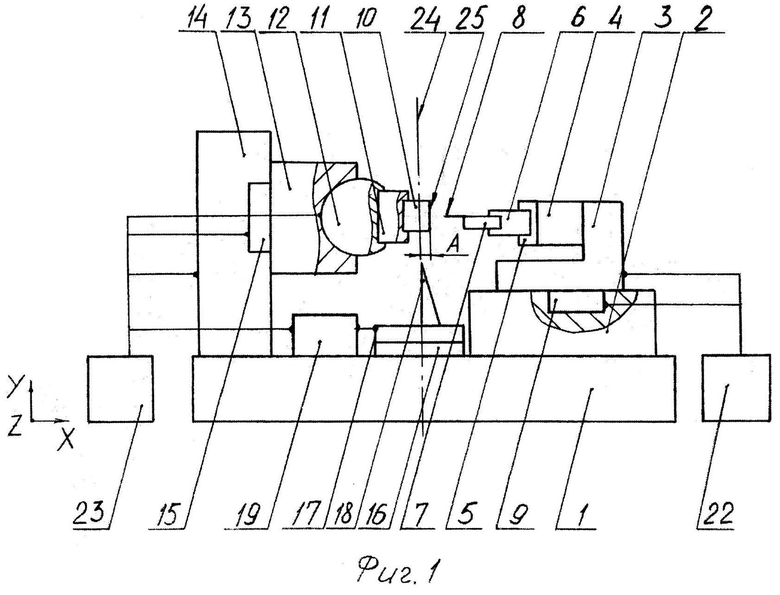
1. Способ исследования трехмерных структур, включающий осуществление среза трехмерной структуры ножом и исследование срезанной поверхности образца трехмерной структуры зондом с чувствительным элементом сканирующего зондового микроскопа, отличающийся тем, что после среза трехмерной структуры исследуют ее внутренние зоны, после исследования внутренних зон трехмерной структуры осуществляют дополнительный срез трехмерной структуры ножом в соответствии с результатами этого исследования, после чего проводят дополнительное исследование поверхности трехмерной структуры и ее внутренних зон чувствительным элементом зонда сканирующего зондового микроскопа.
2. Способ по п. 1, отличающийся тем, что после исследования внутренних зон трехмерной структуры осуществляют следующий срез под углом к предыдущему срезу.
3. Способ по п. 1, отличающийся тем, что исследование внутренних зон трехмерной структуры осуществляют после введения в них через капилляр жидкости с наночастицами.
4. Способ по п. 3, отличающийся тем, что в качестве наночастиц используют наночастицы золота.
5. Способ по п. 3, отличающийся тем, что в качестве наночастиц используют наночастицы золота с биологически активными веществами.
6. Способ по п. 5, отличающийся тем, что в качестве биологически активных веществ используют цитостатики.
| СКАНИРУЮЩИЙ ЗОНДОВЫЙ МИКРОСКОП, СОВМЕЩЕННЫЙ С УСТРОЙСТВОМ МОДИФИКАЦИИ ПОВЕРХНОСТИ ОБЪЕКТА | 2008 |
|
RU2389032C2 |
| US 2011093990 A1, 21.04.2011 | |||
| СКАНИРУЮЩИЙ ЗОНДОВЫЙ МИКРОСКОП, СОВМЕЩЕННЫЙ С УСТРОЙСТВОМ МЕХАНИЧЕСКОЙ МОДИФИКАЦИИ ПОВЕРХНОСТИ ОБЪЕКТА | 2003 |
|
RU2233490C1 |
| СКАНИРУЮЩИЙ ЗОНДОВЫЙ МИКРОСКОП С НАНОТОМОМ | 2010 |
|
RU2427846C1 |
Авторы
Даты
2015-03-27—Публикация
2014-02-07—Подача