Изобретение относится к области медицины, в частности к лечению заболеваний сосудов нижних конечностей, и может быть использовано для лечения облитерирующего атеросклероза, тромбангиита (болезни Бюргера) и диабетической ангиопатии.
Известен способ лечения облитерирующего атеросклероза, тромбангиита (болезни Бюргера) и диабетической ангиопатии путем выполнения реконструктивных хирургических вмешательств на артериях нижних конечностей - выполнение протезирования, шунтирования или эндартерэктомии при окклюзиях и критических стенозах магистральных артерий (Заболевания аорты и ее ветвей. / Покровский А.В. - М.: Медицина, 1979).
Недостатком данного способа лечения является невозможность его применения у больных с многососудистым поражением артерий нижних конечностей с развитием протяженных окклюзий артерий голеней, когда из-за отсутствия «путей оттока» выполнение реконструктивных вмешательств невозможно или неэффективно. Реконструктивные вмешательства также невозможны или сопряжены с крайне высоким риском у больных с выраженной сочетанной патологией, с явлениями выраженной сердечной недостаточности.
Известен способ лечения облитерирующего атеросклероза, тромбангиита (болезни Бюргера) и диабетической ангиопатии путем выполнения чрескожной транслюминальной баллонной ангиопластики и (при необходимости) стентирования стено-окклюзионного поражения артерий нижних конечностей (Клиническая ангиология: Руководство. / Под ред. А.В.Покровского. В двух томах. - Т.1. - М.: ОАО «Издательство «Медицина», 2004).
Недостатком данного способа лечения является невозможность его применения у больных с многососудистым поражением артерий нижних конечностей с развитием протяженных окклюзий артерий. Выполнение ангиопластики и стентирования периферических артерий невозможно при наличии у пациента выраженной сочетанной патологии с явлениями почечной недостаточности (высокий уровень креатинина - более 130 мкмоль/л), с явлениями выраженной сердечной недостаточности. Также ограничивает применение этого способа его высокая стоимость.
Известен способ консервативного лечения облитерирующего атеросклероза, тромбангиита (болезни Бюргера) и диабетической ангиопатии, включающий назначение антиагрегантов, сосудорасширяющих, противовоспалительных и обезболивающих средств. препаратов, содержащих простагландины (Диагностика и лечение пациентов с критической ишемией нижних конечностей. Российский консенсус. - М., 2002. - 40 с.).
Недостатком данного способа лечения является его низкая эффективность при ишемии нижних конечностей III-IV степени. Как отмечают авторы, обычная медикаментозная терапия необходима, но малоэффективна.
Известен способ восстановления кровообращения в ишемизированной конечности, направленный на инициацию ангиогенеза посредством клеточной терапии, генно-клеточной терапии и пептидной терапии. (Берсенев А.В. Аутогенная трансплантация клеток при ишемии нижних конечностей в клинике. // Клеточная трансплантология и тканевая инженерия. - М., 2005. №1. - С. 40-43).
Клеточная терапия имеет ряд преимуществ перед генно- и пептидной терапией. Во-первых, своей физиологичностью, так как клетка обладает уникальным сбалансированным уровнем генной экспрессии и оптимальным для очага ишемии уровнем секреции факторов роста. Во-вторых, отсутствием при аутологичной трансплантации риска иммунных реакций, которые возможны при введении генных конструкций и рекомбининтных факторов роста (Берсенев А.В. Аутогенная трансплантация клеток при ишемии нижних конечностей в клинике. // Клеточная трансплантология и тканевая инженерия. - М., 2005. №1).
Однако клеточная терапия терминальной ишемии мононуклеарной фракцией аутологичного костного мозга как наиболее часто используемого клеточного материала также не лишена недостатков. Наравне с положительными результатами описаны отрицательные (усиление болей при внутримышечном введении в зону ишемии), а также отсутствие динамики (Higashi Y. et al / Autologous bone-marrow mononuclear cell implantation improves endothelium depondent vasodilatation in patient with limb ischemia. / Circ. 2004; 109:1215-8).
На взгляд авторов эффект клеточной терапии напрямую зависит от метода доставки клеточного материала в зону ишемии. Нами была проведена экспериментальная работа и клиническое исследование с целью проведения сравнительной оценки эффективности разных способов доставки мононуклеарных клеток в зону ишемии. В результате проведенного исследования доказано, что оптимальным способом доставки является комбинированный, объединяющий внутримышечную и внутриартериальную доставку клеток (Патент на изобретение. №2369399).
Однако изолированная клеточная терапия критической ишемии, к сожалению, не всегда приносит ожидаемый эффект и позволяет сохранить конечность.
Цель изобретения - повышение эффективности лечения заболевания.
Цель достигается путем внутри- и периартериального введения взвеси мононуклеарных аутологичных клеток костного мозга через микрокатетер непосредственно в зону поражения (ишемии) сразу после выполнения ангиопластики стено-оккюзионного поражения периферических артерий.
В табл.1 представлена характеристика аутологичной фракции костного мозга.
В табл 2 представлена клиническая характеристика больных.
В табл. 3. представлена характеристика больных по степени ишемии и характеру поражения артериального русла.
В табл.4. представлены изменение показателей регионарной перфузии (на уровне средней и нижней трети голени) по данным УЗДГ.
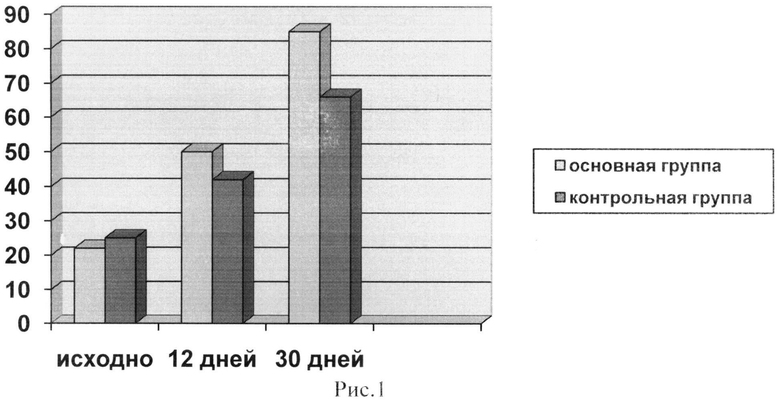
На рис.1 представлена динамика увеличения дистанции ходьбы через месяц с начала лечения.
Способ реализуется следующим образом. Первым этапом в чистой операционной в асептических условиях под местной или сочетанной анестезией у больного выполняли аспирацию костного мозга из задневерхних остей подвздошных костей. Забор костного мозга осуществлялся шприцами по 10 мл с 1 мл раствора гепарина в стерильный гемакон. Общее количество взвеси аутологичного костного мозга составило в среднем 126±8 мл. В лаборатории в течение 3 часов из полученного пункгата выделялась мононуклеарная фракция аутологичного костного мозга. Подсчет количества мононуклеаров в полученном продукте и иммунофенотипирование осуществлялось в день взятия материала на проточном цитометре "Cytomics FC500" фирмы "Beckman Coulter" США с использованием различных комбинаций прямых моноклональных антител и изотипических контролей "Beckman Coulter": IgG1FITC/IgG1 PF/CD45PC-5, CD34 FITC/CD38PE/CD45PC-5. Выход мононуклеров составлял 90-96%, жизнеспособность клеток в тесте с трипановым синим была не ниже 95% (табл.1).
Параллельно выделению мононуклеарной фракции костного мозга пациенту в условия рентгеноперационной (Philips Allura FD20) производилась катетеризация левой плечевой артерии, селективная ангиография артерий нижних конечностей (Омнипак 240 100 мл), реканалиация и ангиопластика стенозов (окклюзии) артерий голени на пораженной нижней конечности. В конце выполнения оперативного вмешательства после выполнения контрольной ангиографии внутриартериальный микрокатетер подводился непосредственно в зону ишемии и производилось внутриартериальное введение взвеси аутологичных мононуклеарных клеток костного мозга в объеме 10-15 мл. При невозможности выполнения реканализации и ангиопластики стенозов (окклюзии) артерий голени на пораженной нижней конечности внутриартериальный микрокатетер подводился в дистальный отдел проходимой артерии или ее концевые ветви, производилась микроперфорация стенки артерии и периартериальное введение взвеси аутологичных мононуклеарных клеток костного мозга в объеме 10-15 мл.
Подобный метод лечения и доставки клеточного материала, как мы считаем, выгодно отличается от чисто внутримышечного или внутриартериального введения в общую бедренную артерию. Во-первых, при выполнении ангиопластики устраняется стенозирование или окклюзия магистральных артерий, за счет чего повышается перфузионное давление в периферических артериях ишемизированной конечности, даже при невозможности восстановления их полной проходимости. Повышается перфузионное давление и транспорт кислорода в концевых артериях в зоне ишемии. Во-вторых, при выполнении микроперфорации доступной концевой ветви магистральной артерии формируется устье для артериогенеза. В-третьих, обеспечивается доставка моноцитов, как вероятных индукторов артериогенеза, непосредственно в очаг ишемии. В-четвертых, минимизируется риск гибели трансплантированных клеток в очаге ишемии. В-пятых, за счет включения перицитов дублируется продукция фактора роста эндотелиоцитов, обеспечивающая необходимый пролиферативный потенциал эндотелиоцитов и их костномозговых предшественников. В конечном итоге обеспечиваются оптимальные условия для артерио-, ангио- и васкулогенеза в ишемизированной конечности с последующим регрессом ишемии.
С целью подтверждения этого положения была выполнена данная работа. Материал и методы исследования.
В исследование было включено 26 больных, страдающих облитерирующим атеросклерозом сосудов нижних конечностей с ишемией II-б-IV стадии (табл.2).
Перед началом исследования все больные подписывали информированное согласие.
Критерии, не позволяющие включить больного в исследование:
- тяжелые сердечные, легочные, неврологические или метаболические заболевания, которые могут препятствовать проведению мобилизации, забору и имплантации стволовых клеток;
- онкологические заболевания в анамнезе в течение последних 5 лет, кроме опухолей кожи I, локализованной стадии (исключая меланому);
- уровень креатинина и/или билирубина, печеночных ферментов сыворотки, превышающий нормальный более чем в 2,5 раза;
- тяжелые инфекционные осложнения;
- общесоматический статус 4 степени ВОЗ;
- психологические, социально-экономические или географические обстоятельства, которые не могут гарантировать должное соблюдение требований протокола по лечению и дальнейшему наблюдению;
- позитивная серологическая реакция на ВИЧ-инфекцию.
В качестве контрольной группы были проанализированы результаты лечения пациентов со схожим топическим поражением артерий нижних конечностей и степенью ишемии нижних конечностей, получавших такое же лечение, что и пациенты экспериментальной группы, за исключением имплантации мононуклеарных клеток костного мозга.
Характеристика больных по степени ишемии и характеру поражения артериального русла конечностей представлена в таблице №3.
Все пациенты получали комплексную многокомпонентную терапию с использованием:
- антиагрегантов: тромбо-АСС 100 мг + тиклид или клопидогрель в дозе 75 мг ежедневно;
- антикоагулянтов: гепарин в дозе от 6 до 20 тыс.ед. в сутки под контролем АЧТВ и ВСК, с переходом в течение 4 дней на непрямые антикоагулянты (фенилин, варфарин) под контролем ПТИ (в пределах 60-75%) и MHO (в пределах 1,8-2,2);
- реополиглюкина в дозе 400 мл в сутки в течение первых 6-8 суток;
- пентоксифиллина в дозе 800 мг в сутки ежедневно;
- вазапростана (аллопростана) в дозе 40 мкг в сутки (внутривенные инфузии начинали выполнять, как правило, на 2-3 сутки от момента поступления больного в клинику и далее в течение 10 дней);
- симвостатина 20 мг в сутки ежедневно (при уровне холестерина более 5,5 ммоль/л).
Также 24 пациентам (12 в основной группе и 12 в контрольной) проводился курс гипербарической оксигенации и 22 пациентам (11 в основной группе и 11 в контрольной) курс физиотерапии с использованием магнита переменного поля.
Пациенты с трофическими поражениями нижних конечностей (язвы, гангрена) также получали антибактериальную терапию (цефалоспорины 3,4 поколения в комбинации с метронидазолом) и местное лечение язв в зависимости от стадии течения раневого процесса.
Получение аутологичных мононуклеаров костного мозга
В чистой операционной в асептических условиях под местной или сочетанной анестезией у больного выполняли аспирацию костного мозга из задневерхних остей подвздошных костей. Забор костного мозга осуществлялся шприцами по 10 мл с 1 мл раствора гепарина в стерильный гемакон. Общее количество взвеси аутологичного костного мозга составило в среднем 126±8 мл. В лаборатории в течение 3 часов из полученного пунктата выделялась мононуклеарная фракция аутологичного костного мозга. Подсчет количества мононуклеаров в полученном продукте и иммунофенотипирование осуществлялось в день взятия материала
Методы введения стволовых клеток
Введение мононуклеаров осуществлялось следующими способами: Параллельно выделению мононуклеарной фракции костного мозга пациенту в условия рентгеноперационной (Philips) производилась катетеризация левой плечевой артерии, селективная ангиография артерий нижних конечностей (Омнипак 240 100 мл), реканализация и ангиопластика стенозов (окклюзии) артерий голени на пораженной нижней конечности. В конце выполнения оперативного вмешательства после выполнения контрольной ангиографии внутриартериальный микрокатетер подводился непосредственно в зону ишемии и производилось внутриартериальное введение взвеси аутологичных мононуклеарных клеток костного мозга в объеме 10-15 мл. При невозможности выполнения реканализации и ангиопластики стенозов (окклюзии) артерий голени на пораженной нижней конечности внутриартериальный микрокатетер подводился в дистальный отдел проходимой артерии или ее концевые ветви, производилась микроперфорация стенки артерии и периартериальное введение взвеси аутологичных мононуклеарных клеток костного мозга в объеме 10-15 мл.
Оценка эффективности проводимой терапии складывалась из:
- оценки интенсивности болевого синдрома, уменьшении дозировок и отказа от применения анальгетиков;
- изменения дистанции без болевой ходьбы (тредмил-тест);
- динамики течения раневого процесса при наличии язвенного дефекта или некроза;
- динамики показателей периферического кровотока по данным ультразвуковой допплерографии;
- частоты выполнения ампутаций нижних конечностей во время проведения курса интенсивной терапии и в ближайшие 3 месяца;
- оценки общей летальности среди пациентов, включенных в исследование в период наблюдения.
Оценка болевого синдрома производилась по десятибалльной визуально-аналоговой шкале с самостоятельной оценкой больным интенсивности боли в баллах от 0 (отсутствие боли) до 10 (непереносимая боль). Также принималось во внимание наличие ночных болей и вынужденное положение больного во время сна со спущенной с кровати вниз пораженной конечностью. Объективным критерием являлась частота применения наркотических (промедол) и ненаркотических (трамал, кетонал) анальгетиков.
Оценка дистанции без болевой ходьбы производилась с помощью беговой дорожки по стандартной методике (тредмил-тест). Время появления боли принималось за минимальную дистанцию ходьбы, время остановки от боли - за максимальную дистанцию ходьбы. Тредмил-тест выполнялся при поступлении, через 7 и 14 дней от начала лечения и через 30 суток после выписки из стационара. В 31% случаев в контрольной группе (у 8 больных) и в 27% в основной (у 7 больных) первичная оценка дистанции ходьбы не проводилась из-за выраженного болевого синдрома.
Наличие и размеры язвенного дефекта оценивались визуально и путем определения площади язвенной поверхности через каждые трое суток.
Ультразвуковая допплерография применялась для оценки магистрального и периферического кровотока и регистрации его количественных показателей. УЗДГ выполнялась при поступлении больного в клинику, через 7 и 14 дней от начала лечения и через 30 дней после выписки. Исследование выполнялось на аппарате Acuson Sequoia и Siemens Sonolain в дуплексном и триплексном режимах визуализации с использованием программ для регистрации периферического и магистрального кровотока. Определяли систолическую линейную скорость (Vmax), среднюю скорость кровотока (Vs), индекс резистентности (PR), пульсовой индекс (PI), рассчитывали лодыжечно-плечевой индекс (ЛПИ).
При оценке интенсивности болевого синдрома было выявлено его снижение в обеих группах к 3-4 дню с момента начала интенсивной многокомпонентной терапии. Однако при IV степени ишемии в обеих группах первоначально интенсивность болевого синдрома возрастала в ответ на проводимую терапию, что может быть обусловлено возвратом чувствительности в зоне пограничной ишемии. В дальнейшем у 65,3% пациентов основной группы и 61,5% в контрольной группе отмечено снижение уровня боли с 7-8 баллов до уровня 4-5 баллов. У 46,1% пациентов основной группы и 38,5% пациентов контрольной группы болевой синдром купировался, нормализовался ночной сон и были отменены анальгетики.
Проведение тредмил-теста показало прирост дистанции безболевой ходьбы уже к двенадцатому дню проведения терапии у 73% больных основной группы и 61,5% больных контрольной группы. У этих больных и в дальнейшем наблюдалось увеличение дистанции ходьбы, достигающее максимума к месяцу с начала лечения. Динамика этого показателя отражена в диаграмме на рисунке 1. В диаграмму не включены пациенты, у которых проводимое лечение не имело эффекта и сохранялся болевой синдром, исключающий проведение нагрузочного теста.
Как видно из диаграммы, в основной группе прирост дистанции безболевой ходьбы превысил контрольную группу на 19% (р<0,05). Такое же соотношение сохранялось и в дальнейшем.
Оценка изменения регионарной перфузии по данным ультразвуковой допплерографии.
В связи с тем, что у большого количества пациентов был дистальный характер поражения артериального русла (14 в основной группе и 13 в контрольной), выполнение УЗДГ по стандартной методике часто было неинформативно. При отсутствии кровотока в ЗББА и ПББА в нижней трети голени, с помощью цветного и энергетического допплера выявляли крупные коллатеральные ветви с артериальным кровотоком и ограничивались определением ЛПИ и PI. Также обязательно оценивалось изменение показателей кровотока по проходимым крупным артериальным стволам. В целом увеличение регионарного кровотока было выявлено в обеих группах, однако в основной группе это было выражено более значительно (таблица 4). К концу третьей недели лечения отмечалось увеличение количества функционирующих мелких артерий диаметром 1,5-2 мм на уровне средней и нижней трети голени. Также при сканировании в режиме энергетического допплера было выявлено увеличение количества функционирующих артерио-венозных шунтов и увеличение плотности кровотока в тканях.
Динамика течения раневого процесса.
Из 26 больных, вошедших в исследование, у 13 (50%), была IV ст. ишемии конечности с развитием трофических язв, некрозов, начинающейся гангрены конечности. У 9 пациентов в результате проведенного лечения удалось добиться положительной динамики в течение раневого процесса. При поступлении некрэктомия не выполнялась, при необходимости выполнялось вскрытие и дренирование флегмон, абсцессов. Ежедневно выполнялись перевязки с растворами антисептиков (хлоргекседин, димексид), водорастворимыми мазями (левосин, левомеколь). При получении хорошего эффекта от проводимой терапии в течение 8-10 дней от момента поступления (значительное уменьшение болевого синдрома, увеличение дистанции ходьбы, увеличения пульсового индекса, максимальной и средней скорости кровотока) выполнялась механическая санация ран (язв) с использованием ультразвуковой кавитации, при необходимости выполнялась некрэктомия. Было отмечено, что при обширных раневых поверхностях (более 12 см2) и пальцевых некрозах, переходящих на тыл стопы, существенного улучшения не было достигнуто ни в основной, ни в контрольной группах. При язвенном дефекте до 10 см2 в основной группе в 61,5% случаев наступало очищение язвы и проявлялся рост грануляций, тогда как в контрольной группе это наблюдалось лишь у 30,8% пациентов.
Заключение
Таким образом, основываясь на результатах проводимого исследования, можно заключить, что использование комбинации эндоваскулярного метода лечения (баллонная ангиопластика при стено-окклюзирующем поражении артерий голени, стопы) и введения взвеси аутологичных мононуклеарных клеток непосредственно в зону ишемии через внутриаргериальиый микрокатетер приводит к усилению эффективности каждого метода лечения и улучшению результатов лечения заболевания в целом.
Основу предлагаемой лечебной тактики составляет комбинация эндоваскулярного метода лечения (баллонная ангиопластика при стено-окклюзирующем поражении артерий голени, стопы) и введение взвеси аутологичных мононуклеарных клеток непосредственно в зону ишемии через внутриартериальный микрокатетер. Доставка клеток-кандидатов для ангиогенеза непосредственно в зону ишемизированных тканей ускоряет процесс неоангиогенеза.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ лечения ишемической болезни нижних конечностей | 2015 |
|
RU2633487C2 |
| Способ лечения ишемической ангиопатии сосудов нижних конечностей | 2017 |
|
RU2649498C1 |
| БИОТРАНСПЛАНТАТ И СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ ИШЕМИИ НИЖНИХ КОНЕЧНОСТЕЙ | 2005 |
|
RU2286159C1 |
| Комбинированный способ лечения пациентов с критической ишемией нижних конечностей | 2023 |
|
RU2796189C1 |
| Способ комбинированной хирургической стимуляции неоангиогенеза хронической ишемии нижних конечностей | 2018 |
|
RU2703395C1 |
| СПОСОБ ЛЕЧЕНИЯ НЕОПЕРАБЕЛЬНЫХ КАРДИОЛОГИЧЕСКИХ БОЛЬНЫХ | 2004 |
|
RU2250772C1 |
| СПОСОБ ЛЕЧЕНИЯ ИШЕМИИ НИЖНИХ КОНЕЧНОСТЕЙ | 2008 |
|
RU2376995C1 |
| СПОСОБ ЛЕЧЕНИЯ СУБКРИТИЧЕСКОЙ ИШЕМИИ КОНЕЧНОСТИ НА ФОНЕ ХРОНИЧЕСКИХ ОБЛИТЕРИРУЮЩИХ ЗАБОЛЕВАНИЙ АРТЕРИЙ НИЖНИХ КОНЕЧНОСТЕЙ | 2014 |
|
RU2570285C1 |
| Способ комбинированного лечения пациентов с критической ишемией нижних конечностей | 2024 |
|
RU2833152C1 |
| СПОСОБ ЛЕЧЕНИЯ ПАЦИЕНТОВ С КРИТИЧЕСКОЙ ИШЕМИЕЙ НИЖНИХ КОНЕЧНОСТЕЙ | 2023 |
|
RU2808920C1 |
Изобретение относится к медицине, а именно к лечению ишемии нижних конечностей. Для этого осуществляют введение взвеси мононуклеарных аутологичных клеток костного мозга через микрокатетер непосредственно в зону ишемии сразу после выполнения ангиопластики стено-окклюзионного поражения периферических артерий. Такой способ доставки клеточного материала обеспечивает эффективное лечение ишемии нижних конечностей за счет выраженного усиления регионарного кровотока. 1 ил., 4 табл.
Способ лечения ишемии нижних конечностей путем внутриартериального введения взвеси мононуклеарных аутологичных клеток костного мозга, отличающийся тем, что аутологичные клетки костного мозга вводят через микрокатетер непосредственно в зону ишемии сразу после выполнения ангиопластики стено-окклюзионного поражения периферических артерий.
| БИОТРАНСПЛАНТАТ И СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ ИШЕМИИ НИЖНИХ КОНЕЧНОСТЕЙ | 2005 |
|
RU2286159C1 |
| СПОСОБ ЛЕЧЕНИЯ ТЕРМИНАЛЬНОЙ ИШЕМИИ КОНЕЧНОСТЕЙ | 2008 |
|
RU2369399C1 |
| US2011238107 29.09.2011 | |||
| МАСЛЯНЮК О.В | |||
| и др | |||
| " Поиск оптимального варианта клеточной терапии критической ишемии конечностей в эксперименте" | |||
| Клеточная трансплантология и тканевая инженерия, 2011, т.6, N3, с.41-45 | |||
| ДОРОШЕНКО О | |||
| "Лечение ишемии нижних конечностей методом трансплантации | |||
Авторы
Даты
2015-04-10—Публикация
2012-12-26—Подача