ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка является непредварительной заявкой, поданной в соответствии с 37 CFR 1.53(b)(1), по которой испрашивается приоритет в соответствии с 35 USC 119(e) предварительной заявки под номером 61/253758, поданной 21 октября 2009 года, содержание которой включено в настоящий документ в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение в основном относится к лечению заболевания человека. Более конкретно, изобретение относится к влажной возрастной дегенерации желтого пятна (AMD).
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
AMD является основной причиной тяжелой, необратимой потери зрения у пожилых людей. Bressler (2004) JAMA 291:1900-01. Она характеризуется широким спектром клинических и патологических показателей, включая светло-желтые пятна, известные как друзы, разрушение пигментного эпителия сетчатки (RPE), хороидальную неоваскуляризация (CNV) и дисковидную дегенерацию желтого пятна. Заболевание классифицируют на две формы: неэкссудативную (сухую) и экссудативную (влажную или неоваскулярную). Недавно разработано несколько видов терапии для лечения влажной AMD - фотодинамическая терапия с использованием вертепорфина (визудин®); связывающего VEGF аптамера, пегаптаниба (макуген®) и фрагмента антитела против VEGF, ранибизумаба (луцентис®).
В популяции встречаются генетические полиморфизмы, когда разные аллели конкретных генов приводят к различным фенотипам, включая развитие или прогрессирование заболевания и ответ на терапевтические лекарственные средства. Идентифицировано множество полиморфизмов, ассоциированных с развитием или прогрессированием AMD (например, Despriet et al. (2007) Arch. Ophthalmol. 125:1270-71; Seddon et al. (2007) JAMA 297:1793-99, 2585; Boon et al. (2008) Am. J. Human Genet. 82:516-23). Предыдущие работы показали, что конкретные полиморфизмы в положении аминокислоты 402 гена фактора комплемента H (CFH) ассоциированы с ответом на PDT с использованием вертепорфина или терапию AMD бевацизумабом вне предусмотренных показаний (Brantley et al. (2008) Eye published online 22 February, pp. 1-6; Brantley et al. (2007) Ophthalmology 114:2168-73). Идентификацию дополнительных полиморфизмов, ассоциированных с развитием заболевания и/или являющихся прогностическими для эффективности или безопасности конкретных видов терапии, можно использовать для того, чтобы подобрать подходящий тип терапии для тех пациентов, которые получат от него наибольший эффект.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение частично основано на идентификации генетических полиморфизмов, являющихся прогностическими для риска AMD или повышенной вероятности того, что пациенты с AMD получат эффект от лечения высокоаффинными антителами против VEGF.
В одном из аспектов изобретение относится к способу прогнозирования существования у пациента с влажной AMD повышенной вероятности эффекта от лечения высокоаффинными антителами против VEGF, предусматривающему скрининг образца, полученного у указанного пациента, на аллель геномного полиморфизма гена матриксной металлопротеиназы 25 (MMP25), соответствующего rs1064875, при котором у пациента повышена вероятность эффекта от указанного лечения, если соответствующий генотип содержит AA или AG. В некоторых вариантах осуществления генотип содержит AA. В некоторых вариантах осуществления генотип содержит AG.
В другом аспекте изобретение относится к способу прогнозирования у пациента с влажной AMD повышенной вероятности эффекта от лечения антителом против VEGF, предусматривающему скрининг образца, полученного у указанного пациента на аллель геномного полиморфизма гена представителя семейства рецепторов домена дискоидина 2 (DDR2), соответствующего rs10917583, при котором у пациента повышена вероятность эффекта от указанного лечения, если соответствующий генотип содержит AA или AC. В некоторых вариантах осуществления генотип содержит AA. В некоторых вариантах осуществления генотип содержит AC.
В другом аспекте изобретение относится к способу прогнозирования у пациента с влажной AMD повышенной вероятности эффекта от лечения антителом против VEGF, предусматривающему скрининг образца, полученного у указанного пациента, на аллель геномного полиморфизма ATF-подобного основного фактора транскрипции с "лейциновой застежкой" (BATF), соответствующего rs175714, при котором у пациента повышена вероятность эффекта от указанного лечения, если соответствующий генотип содержит AA или AG. В некоторых вариантах осуществления генотип содержит AA. В некоторых вариантах осуществления генотип содержит AG.
В некоторых вариантах осуществления антитело против VEGF связывает тот же эпитоп, что и моноклональное антитело против VEGF A4.6.1, продуцируемое гибридомой ATCC® HB 10709. В некоторых вариантах осуществления антитело против VEGF содержит вариабельный домен тяжелой цепи, содержащий следующие аминокислотные последовательности определяющих комплементарность областей (CDR) тяжелой цепи: CDRH1 (GYDFTHYGMN; SEQ ID NO:1), CDRH2 (WINTYTGEPTYAADFKR; SEQ ID NO:2) и CDRH3 (YPYYYGTSHWYFDV; SEQ ID NO:3) и вариабельный домен легкой цепи, содержащий следующие аминокислотные последовательности CDR легкой цепи: CDRL1 (SASQDISNYLN; SEQ ID NO:4), CDRL2 (FTSSLHS; SEQ ID NO:5) и CDRL3 (QQYSTVPWT; SEQ ID NO:6). В некоторых вариантах осуществления антитело против VEGF содержит вариабельный домен тяжелой цепи и вариабельный домен легкой цепи Y0317. В некоторых вариантах осуществления антитело против VEGF представляет собой ранибизумаб.
В другом аспекте изобретение относится к набору для прогнозирования у пациента с влажной AMD повышенной вероятности эффекта от лечения ранибизумабом, содержащему первый олигонуклеотид и дополнительные олигонуклеотиды, специфичные для аллелей полиморфизма A/G MMP25, соответствующего rs1064875. В некоторых вариантах осуществления первый олигонуклеотид и указанный второй олигонуклеотид можно использовать для амплификации части гена MMP25, содержащей аллель полиморфизма A/G MMP25, соответствующего rs1064875.
В другом аспекте изобретение относится к набору для прогнозирования у пациента с влажной AMD повышенной вероятности эффекта от лечения ранибизумабом, содержащему первый олигонуклеотид и дополнительные олигонуклеотиды, специфичные для аллелей полиморфизма A/C DDR2, соответствующего rs10917583. В некоторых вариантах осуществления первый олигонуклеотид и указанный второй олигонуклеотид можно использовать для амплификации части гена DDR2, содержащей полиморфизм A/C аллелей DDR2, соответствующий rs10917583.
В другом аспекте изобретение относится к набору для прогнозирования того, обладает ли пациент с влажной AMD повышенной вероятностью эффекта от лечения ранибизумабом, содержащему первый олигонуклеотид и дополнительные олигонуклеотиды, специфичные для аллелей полиморфизма A/G BATF, соответствующего rs175714. В некоторых вариантах осуществления первый олигонуклеотид и указанный второй олигонуклеотид можно использовать для амплификации части гена BATF, содержащей полиморфизм A/G аллелей BATF, соответствующий rs175714.
В другом аспекте изобретение относится к способам определения того, подвержен ли пациент повышенному риску развития влажной AMD, предусматривающим скрининг образца, полученного у пациента на один или нескольких аллельных вариантов, представленных в таблице 4 или таблице 5, где присутствие одного или нескольких аллельных вариантов, представленных в таблице 4 или таблице 5, указывает на то, что пациент подвержен повышенному риску развития влажной AMD.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
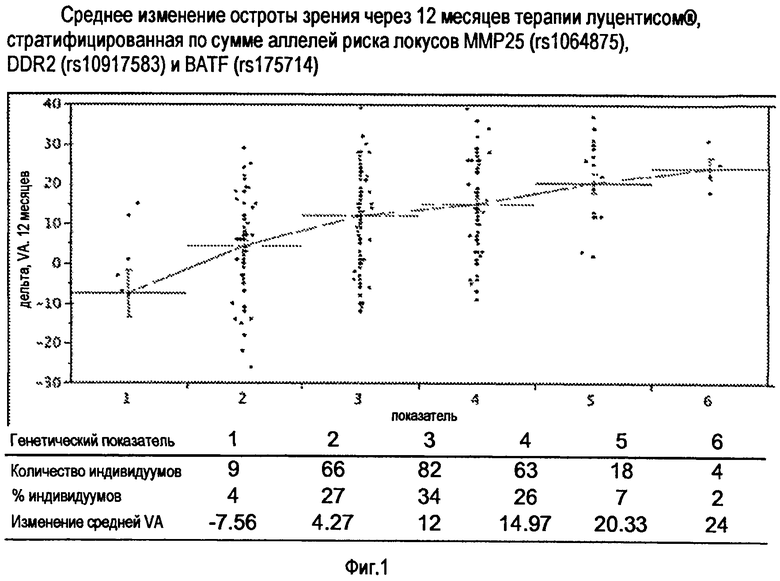
На ФИГ.1 продемонстрировано среднее изменение остроты зрения через 12 месяцев терапии луцентисом, стратифицированное по сумме аллелей риска генов MMP25, DDR2 и BATF.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Если не указано иначе, в практическом осуществлении настоящего изобретения используют общепринятые способы молекулярной биологии (включая рекомбинантные технологии), микробиологии, клеточной биологии, биохимии и иммунологии, которые известны специалистам в данной области. Такие способы полностью описаны в литературе, такой как "Molecular Cloning: A Laboratory Manual", second edition (Sambrook et al., 1989); "Oligonucleotide Synthesis" (M. J. Gait, ed., 1984); "Animal Cell Culture" (R. I. Freshney, ed., 1987); "Methods in Enzymology" (Academic Press, Inc.); "Current Protocols in Molecular Biology" (F. M. Ausubel et al., eds., 1987, и периодические обновления); "PCR: The Polymerase Chain Reaction", (Mullis et al., eds., 1994).
Если не определено иначе, технические и научные термины, используемые в настоящем документе, имеют те же самые значения, как обычно понимают специалисты в области, к которой принадлежит настоящее изобретение. Singleton et al., Dictionary of Microbiology and Molecular Biology 2nd ed., J. Wiley & Sons (New York, N.Y. 1994), и March, Advanced Organic Chemistry Reactions, Mechanisms and Structure 4th ed., John Wiley & Sons (New York, N.Y. 1992) предоставляют специалистам в данной области общее руководство по многим терминам, используемым в настоящей заявке.
Все ссылки, цитируемые в настоящем документе, включая патентные заявки и публикации, в полном объеме включены в качестве ссылки.
ОПРЕДЕЛЕНИЯ
Как используют в настоящем документе, формы единственного числа, если из контекста явно не следует иначе, включают формы множественного числа. Например, клетка также означает "клетки".
Термин "содержащий" предназначен для обозначения того, что композиции и способы содержат указанные элементы, но не исключают других.
Термины "VEGF" и "VEGF-A" взаимозаменяемо используют в отношении фактора роста эндотелия сосудов, состоящего из 165-аминокислот, и/или в отношении родственных факторов роста эндотелия сосудов, состоящих из 121, 189 и 206 аминокислот, как описано в Leung et al. Science, 246:1306 (1989) и Houck et al. Mol. Endocrin., 5:1806 (1991), вместе с существующими в природе аллельными формами и их преобразованными формами.
"Антитело против VEGF" представляет собой антитело, с достаточной аффинностью и специфичностью связывающее VEGF. Предпочтительно антитело против VEGF по изобретению можно использовать в качестве терапевтического средства для направленной доставки препарата к органу-мишени и воздействующего на заболевания или состояния, связанные с активностью VEGF. Как правило, антитело против VEGF не связывает другие гомологи VEGF, такие как VEGF-B или VEGF-C, или другие факторы роста, такие как P1GF, PDGF или bFGF. Предпочтительное антитело против VEGF представляет собой моноклональное антитело, связывающее тот же эпитоп, что и моноклональное антитело против VEGF A4.6.1, продуцируемое гибридомой ATCC® HB 10709, и представляет собой высокоаффинное антитело против VEGF. Аффинность "высокоаффинного антитела против VEGF" по меньшей мере в 10 раз лучше аффинности к VEGF моноклонального антитела против VEGF A4.6.1. Предпочтительно антитело против VEGF является рекомбинантным гуманизированным фрагментом моноклонального антитела против VEGF, полученным в по WO 98/45331, включающим антитело, содержащее CDR и/или вариабельные области Y0317. Более предпочтительно, антитело против VEGF представляет собой фрагмент антитела, известный как ранибизумаб (луцентис®).
Термин "антитело" используют в самом широком смысле, и он включает моноклональные антитела (включая полноразмерные или интактные моноклональные антитела), поликлональные антитела, поливалентные антитела, полиспецифические антитела (например, биспецифические антитела) и фрагменты антител при условии, что они проявляют желаемую биологическую активность.
"Лечение" относится как к терапевтическому лечению, так и профилактическим или предупредительным мерам. Нуждающиеся в лечении включают тех, у кого уже существуют нарушения, а также тех, у кого это нарушение необходимо предотвратить или задержать.
Термин "полиморфизм" относится к положению в последовательности гена, которое изменяется в популяции. Полиморфизм состоит из различных "аллелей". Положение такого полиморфизма можно идентифицировать по его положению в гене и по различным аминокислотам или основаниям, которые в нем находятся. Например, Y402H CFH означает, что в положении аминокислоты 402 гена CFH существует вариация между тирозином (Y) и гистидином (H). Эта замена аминокислоты является результатом двух возможных вариантов оснований, C и T, которые являются различными аллелями. Вследствие того, что генотип состоит из двух отдельных аллелей, у любого индивидуума можно наблюдать любой из нескольких возможных вариантов (например, для этого примера, CC, CT или TT). Индивидуальным полиморфизмам также приписываются идентификационные номера ("характеристический SNP", "refSNP" или "rs#"), известные специалистам данной области и используемые, например, в базе данных Single Nucleotide Polymorphism Database (dbSNP) вариаций нуклеотидной последовательности, доступной на веб-сайте NCBI.
Термин "генотип" относится к конкретным аллелям определенного гена в образце клеток или ткани. В приведенном выше примере возможными генотипами при полиморфизме Y402H CFH являются CC, CT или TT.
Термин "образец" включает образец клеток или ткани, полученный у пациента. Например, образец может включать образец кожи, образец клеток щеки или клеток крови.
Определение конкретного генотипа в образце можно проводить любым из ряда способов, хорошо известных специалисту в данной области. Например, определение полиморфизма можно проводить клонированием аллеля и его секвенированием, хорошо известными в данной области способами. Кроме того, последовательности генов можно амплифицировать с геномной ДНК, например, используя ПЦР, и секвенировать продукт. Ниже описано несколько неограничивающих способов анализа ДНК пациента на мутации в данном генетическом локусе.
Можно использовать технологию микропанелей ДНК, например, устройства чипов ДНК и микропанелей высокой плотности для высокопроизводительного скрининга и микропанелей низкой плотности. Способы изготовления микропанелей известны в данной области и включают различные струйные и микроструйные технологии и способы нанесения или точечного нанесения, фотолитографические способы синтеза олигонуклеотидов in situ или "на чипе" и способы электронного указания зондов ДНК. Способы гибридизации на ДНК-микропанелях успешно применяли в областях анализа экспрессии генов и генотипирования точечных мутаций, однонуклеотидных полиморфизмов (SNP) и коротких тандемных повторов (STR). Дополнительные способы включают микропанели для РНК-интерференции и комбинации микропанелей и других способов, таких как лазерная захватывающая микродиссекция (LCM), сравнительная геномная гибридизация (CGH) и иммунопреципитация хроматина (ChiP). См., например, He et al. (2007) Adv. Exp. Med. Biol. 593:117-133 и Heller (2002) Annu. Rev. Biomed. Eng. 4:129-153. Другие способы включают ПЦР, xMAP, анализ с захватывающим олигонуклеотидом, масс-спектрометрию и пиросеквенирование (Wang et al. (2007) Microarray Technology and Cancer Gene Profiling Vol 593 of book series Advances in Experimental Medicine and Biology, pub. Springer New York).
Другим способом детекции является специфическая гибридизация аллеля с использованием зондов, перекрывающих полиморфный участок и содержащих приблизительно 5, или альтернативно 10, или альтернативно 20, или альтернативно 25, или альтернативно 30 нуклеотидов вокруг полиморфной области. Например, к твердофазной подложке, например, "чипу", прикрепляют несколько зондов, способных специфически гибридизоваться с аллельным вариантом. Олигонуклеотиды можно связывать с твердой подложкой множеством способов, включая литографию. Анализ с детекцией мутаций с использованием этих чипов, содержащих олигонуклеотиды, также именуемых "панели с зондами ДНК" описан, например, в Cronin et al. (1996) Human Mutation 7:244.
При других способах детекции перед идентификацией аллельного варианта сначала необходимо амплифицировать по меньшей мере часть генов. Амплификацию можно проводить, например, посредством ПЦР и/или LCR или других способов, хорошо известных в данной области.
В некоторых случаях наличие специфического аллеля в ДНК пациента можно показать посредством анализа с рестрикционными ферментами. Например, конкретный нуклеотидный полиморфизм может приводить к нуклеотидной последовательности, содержащей участок рестрикции, который отсутствует в нуклеотидной последовательности другого аллельного варианта.
В дополнительном варианте осуществления для детекции несоответствия оснований в гетеродуплексах РНК/РНК, ДНК/ДНК или РНК/ДНК можно использовать защиту от расщепляющих средств (таких как нуклеаза, гидроксиламин или тетроксид осмия и пиперидин) (см., например, Myers et al. (1985) Science 230:1242). В общем случае способ "расщепления несоответствий" начинают, получая гетеродуплексы, образованные гибридизацией контрольной нуклеиновой кислоты, которая необязательно помечена, например, РНК или ДНК, содержащей нуклеотидную последовательность аллельного варианта гена, с образцом нуклеиновой кислоты, например РНК или ДНК, полученными из образца ткани. Двухцепочечные дуплексы обрабатывают средством, расщепляющим одноцепочечные области дуплекса, такие как дуплексы, образованные на основе несовпадения пар нуклеотидов между контрольной цепью и цепью из образца. Например, для ферментативного расщепления несовпадающих областей дуплексы РНК/ДНК можно обрабатывать РНКазами, а гибриды ДНК/ДНК можно обрабатывать нуклеазой S1. Альтернативно для расщепления несовпадающих областей дуплексы ДНК/ДНК или РНК/ДНК можно обрабатывать гидроксиламином или тетроксидом осмия и пиперидином. Затем после расщепления несовпадающих областей полученный материал разделяют по размеру в денатурирующем полиакриламидном геле для определения того, имеют ли контрольные нуклеиновые кислоты и образцы нуклеиновой кислоты идентичную нуклеотидную последовательность или такую, в которой нуклеотиды являются различными. См., например, патент США № 6455249; Cotton et al. (1988) Proc. Natl. Acad. Sci. USA 85:4397; Saleeba et al. (1992) Meth. Enzymol. 217:286-295.
Также для идентификации конкретного аллельного варианта можно использовать изменение электрофоретической подвижности. Например, для детекции различий в электрофоретической подвижности между нуклеиновыми кислотами мутантного и дикого типа можно использовать одноцепочечный конформационный полиморфизм (SSCP) (Orita et al. (1989) Proc Natl. Acad. Sci USA 86:2766; Cotton (1993) Mutat. Res. 285:125-144 и Hayashi (1992) Genet. Anal. Tech. Appl. 9:73-79). Одноцепочечные фрагменты ДНК нуклеиновых кислот из образца и контрольные нуклеиновые кислоты денатурировали и подвергали ренатурации. Вторичная структура одноцепочечных нуклеиновых кислот варьирует в соответствии с последовательностью, возникающее в результате изменение электрофоретической подвижности обеспечивает детекцию замены даже одного основания. Фрагменты ДНК можно метить или детектировать мечеными зондами. Чувствительность анализа можно усилить посредством использования РНК (вместо ДНК), где вторичная структура более чувствительна к изменению последовательности. В другом предпочтительном варианте осуществления в способе по настоящему изобретению используют гетеродуплексный анализ с разделением сдвоенных двухцепочечных гетеродуплексных молекул на основе изменений электрофоретической подвижности (Keen et al. (1991) Trends Genet. 7:5).
Идентификацию аллельного варианта также можно проводить посредством анализа подвижности нуклеиновой кислоты, содержащей полиморфную область, в полиакриламидных гелях, содержащих градиент денатурирующего средства, что анализируют с использованием денатурирующего гель-электрофореза (DGGE) (Myers et al. (1985) Nature 313:495). Когда в качестве способа анализа применяют DGGE, ДНК для защиты от полной денатурации модифицируют, например, внося посредством ПЦР GC-участки приблизительно из 40 п.н. высоко плавящейся богатой GC ДНК. В дополнительном варианте осуществления вместо градиента денатурирующего агента для идентификации различий в подвижности контрольной ДНК и ДНК образца применяют температурный градиент (Rosenbaum and Reissner (1987) Biophys. Chem. 265:1275).
Примеры способов детекции различий 2 нуклеиновых кислот по меньшей мере по одному нуклеотиду в качестве неограничивающих примеров включают селективную гибридизацию олигонуклеотидов, селективную амплификацию или селективную достройку праймеров. Например, можно получать олигонуклеотидные зонды, в которых известный полиморфный нуклеотид находится в центральном положении (аллель-специфические зонды), а затем гибридизовать с ДНК-мишенью в условиях, обеспечивающих гибридизацию только в случае полного соответствия (Saiki et al. (1986) Nature 324:163); Saiki et al. (1989) Proc. Natl. Acad. Sci. USA 86:6230). Такие способы аллель-специфической гибридизации олигонуклеотидов можно использовать для детекции изменений нуклеотидов в полиморфной области гена. Например, олигонуклеотиды, с нуклеотидной последовательностью конкретного аллельного варианта, прикрепляют к гибридизационной мембране, а затем эту мембрану гибридизуют с меченым образцом нуклеиновой кислоты. Затем при анализе сигнала после гибридизации выявляют вид нуклеотидов образца нуклеиновой кислоты.
Альтернативно, по настоящему изобретению можно использовать способ аллель-специфической амплификации, основанный на селективной амплификации ПЦР. Олигонуклеотиды, используемые в качестве праймеров для специфической амплификации, могут нести представляющие интерес аллельные варианты в середине молекулы (таким образом, амплификация зависит от различной гибридизации) (Gibbs et al. (1989) Nucl. Acids Res. 17:2437-2448) или в крайнем положении 3' конца первого праймера, где при соответствующих условиях несоответствие может предотвращать или снижать достройку полимеразой (Prossner (1993) Tibtech 11:238 и Newton et al. (1989) Nucl. Acids Res. 17:2503). Этот способ также называется "PROBE" от PRobe Oligo Base Extension (достройка олигонуклеотидного зонда). Кроме того, может быть желательным введение в область мутации нового участка рестрикции для осуществления детекции, на основе расщепления (Gasparini et al. (1992) Mol. Cell. Probes 6:1).
В другом варианте осуществления идентификацию аллельного варианта проводят с использованием анализа лигирования олигонуклеотидов (OLA), как описано, например, в патенте США № 4998617 и в Laridegren, U. et al. Science 241:1077-1080 (1988). В протоколе OLA используют два олигонуклеотида, которые сконструированы так, чтобы они могли гибридизоваться с примыкающими последовательностями одиночной цепи мишени. Один из олигонуклеотидов связан с маркером разделения, например биотинилирован, а другой является детектируемо меченым. Если в молекуле-мишени присутствует точная комплементарная последовательность, олигонуклеотиды гибридизуются таким образом, что их концы стыкуются и образуют субстрат для лигирования. Затем лигирование обеспечивает выделение меченого олигонуклеотида с помощью авидина или другого лиганда биотина. В Nickerson, D. A. et al. описан способ детекции нуклеиновой кислоты, в котором комбинированы свойства ПЦР и OLA (Nickerson, D. A. et al. (1990) Proc. Natl. Acad. Sci. USA 87:8923-8927). В этом способе ПЦР используют для осуществления экспоненциальной амплификации ДНК-мишени, которую затем детектируют посредством OLA.
Изобретение относится к способам детекции однонуклеотидных полиморфизмов (SNP) в MMP25, DDR2 и BATF. Так как однонуклеотидные полиморфизмы фланкированы областями с инвариантной последовательностью, их анализ не требует большего, чем определение вида одиночного вариантного нуклеотида, и определять полную последовательность гена у каждого пациента необязательно. Разработано несколько способов обеспечения анализа SNP.
Однонуклеотидный полиморфизм можно детектировать, используя специализированный устойчивый к экзонуклеазам нуклеотид, как описано, например, в патенте США № 4656127. В соответствии с этим способом праймеру, комплементарному аллельной последовательности непосредственно после 3' конца полиморфного участка, позволяют гибридизоваться с молекулой-мишенью, полученной у конкретного животного или человека. Если полиморфный участок на молекуле-мишени содержит нуклеотид, комплементарный конкретному присутствующему устойчивому к экзонуклеазам производному нуклеотида, тогда это производное включается на конце гибридизованного праймера. Такое включение придает праймеру устойчивость к экзонуклеазам и, таким образом, обеспечивает ее детекцию. Так как вид устойчивого к экзонуклеазам производного из образца известен, обнаружение того, что праймер приобрел устойчивость к экзонуклеазам, выявляет то, что нуклеотид, присутствующий в полиморфном участке молекулы-мишени, комплементарен производному нуклеотида, используемому в реакции. Преимуществом этого способа является то, что он не требует определения больших количеств излишних данных о последовательностях.
Для определения вида нуклеотида в полиморфном участке также можно использовать способ не основе раствора (WO 91/02087). Как описано выше, используется праймер, который является комплементарным к аллельным последовательностям непосредственно после 3' конца полиморфного участка. Этим способом определяют вид нуклеотида в этом участке с использованием меченых дидезоксинуклеотидных производных, которые в случае их комплементарности нуклеотиду в полиморфном участке включаются в конец праймера.
В WO 92/15712 описан альтернативный способ. В этом способе используют смеси меченых терминаторов и праймер, комплементарный последовательности после 3' конца полиморфного участка. Таким образом, встраиваемый меченый терминатор определяется нуклеотидом, находящимся в полиморфном участке оцениваемой молекулы-мишени, и комплементарен ему. Этот способ, как правило, представляет собой гетерофазный анализ, в котором праймер или молекула-мишень иммобилизованы на твердой фазе.
Описано множество других направляемых праймером способов включения нуклеотидов для анализа полиморфных участков ДНК (Komher, J. S. et al. (1989) Nucl. Acids. Res. 17:7779-7784; Sokolov, B. P. (1990) Nucl. Acids Res. 18:3671; Syvanen, A.-C., et al. (1990) Genomics 8:684-692; Kuppuswamy, M. N. et al. (1991) Proc. Natl. Acad. Sci. USA 88:1143- 1147; Prezant, T. R. et al. (1992) Hum. Mutat. 1: 159-164; Ugozzoli, L. et al. (1992) GATA 9:107-112; Nyren, P. et al. (1993) Anal. Biochem. 208:171-175). Все эти способы основаны на включении меченых дезоксинуклеотидов с выявлением различий между основаниями в полиморфном участке.
Кроме того, следует понимать, что любой из описанных выше способов детекции изменений в гене или генном продукте или в полиморфных вариантах можно использовать для мониторинга курса лечения или терапии.
Способы, описываемые в настоящем документе, можно осуществлять, например, с использованием предварительно упакованных диагностических наборов, таких как описанные ниже, содержащих, по меньшей мере, одну нуклеиновую кислоту зонда или праймера, которую подходящим образом можно применять, например, для определения того, существует ли у индивидуума повышенная вероятность развития AMD или существует ли у пациента с влажной AMD повышенная вероятность эффекта от лечения антителом против VEGF.
Образец нуклеиновой кислоты для использования в описываемых выше диагностических и прогностических способах можно получать из любого типа клеток или тканей индивида. Например, можно известными способами получать жидкость организма пациента (например, кровь). Альтернативно, исследования нуклеиновой кислоты можно проводить на основе сухих образцов (например, волос или кожи).
Изобретение, описываемое в настоящем документе, относится к способам и композициям для определения и идентификации аллеля, присутствующего в нескольких аллелях, включая аллели MMP25, DDR2 и BATF в rs1064875, rs10917583 и rs175714 соответственно. Зонды можно использовать для прямого определения генотипа образца или их можно использовать одновременно с амплификацией или после нее. Термин "зонды" включает встречающиеся в природе или рекомбинантные одно- или двухцепочечные нуклеиновые кислоты или химически синтезированные нуклеиновые кислоты. Их можно метить посредством ник-трансляции, реакции достройки Кленова, ПЦР или другими известными в данной области способами. Зонды по настоящему изобретению, их получение и/или мечение описаны в Sambrook et al. (1989), выше. Зонд может представлять собой полинуклеотид любой длины, подходящей для селективной гибридизации с нуклеиновой кислотой, содержащей полиморфную область по изобретению. Длина используемого зонда частично зависит от характера анализа и используемых условий гибридизации.
Меченые зонды также можно использовать в сочетании с амплификацией полиморфизма. (Holland et al. (1991) Proc. Natl. Acad. Sci. USA 88:7276-7280). В патенте США № 5210015 описаны подходы для проведения измерений продуктов амплификации при ПЦР в реальном времени, основанные на флуоресценции. При таких подходах применяют интеркалирующие красители (такие как бромистый этидий) для индикации количества присутствующей двухцепочечной ДНК, или в них используют зонды, содержащие пары флуоресцентная молекула-гаситель (также обозначаемый как способ "TaqMan®"), где зонд во время амплификации расщепляется с высвобождением флуоресцентной молекулы, концентрация которой пропорциональна количеству присутствующей двухцепочечной ДНК. При амплификации вследствие нуклеазной активности полимеразы зонд при гибридизации с последовательностью-мишенью расщепляется, что служит причиной отделения флуоресцентной молекулы от молекулы гасителя, таким образом, вызывая возникновение флуоресценции с репортерной молекулы. В способе TaqMan® используют зонд, содержащий пару репортерная молекула-молекула-гаситель, которая специфически отжигается с областью полинуклеотида-мишени, содержащего полиморфизм.
Зонды можно прикреплять к поверхностям для использования в качестве "генных чипов". Такие генные чипы можно использовать для детекции генетических вариаций рядом способов, известных специалистам в данной области. В одном из способов олигонуклеотиды располагают на генном чипе для определения последовательности ДНК посредством секвенирования с применением такого подхода к гибридизации, как описан в патентах США №№ 6025136 и 6018041. Зонды по изобретению также можно использовать для флуоресцентной детекции генетической последовательности. Такие способы описаны, например, в патентах США №№ 5968740 и 5858659. Зонд также может присоединять к поверхности электрода для электрохимической детекции последовательностей нуклеиновой кислоты, такой как описана в патенте США № 5952172 и в Kelley, S. O. et al. (1999) Nucl. Acids Res. 27:4830-4837.
Кроме того, выделенные нуклеиновые кислоты, используемые в качестве зондов или праймеров, для их большей стабильности можно модифицировать. Иллюстративные молекулы нуклеиновой кислоты, подвергаемые модифицированию, включают фосфорамидатные, фосфотиоатные и метилфосфонатные аналоги ДНК (см. также патенты США №№ 5176996; 5264564 и 5256775).
Как указано в настоящем документе, изобретение также относится к способам диагностики для определения типа аллельных вариантов полиморфных областей, присутствующих в MMP25, DDR2 или BATF. В некоторых вариантах осуществления в способах используют зонды или праймеры, содержащие нуклеотидные последовательности, комплементарные к полиморфным областям MMP25, DDR2 или BATF. Таким образом, изобретение относится к наборам для осуществления этих способов.
В некоторых вариантах осуществления изобретение относится к набору для определения того, существует ли у пациента с влажной AMD повышенная вероятность эффекта от лечения антителом против VEGF, включая высокоаффинное антитело против VEGF. Такие наборы содержат одну или несколько композиций, описываемых в настоящем документе, и инструкции по применению. Только в качестве примера, изобретение также относится к наборам для определения того, существует ли у пациента с влажной AMD повышенная вероятность эффекта от лечения ранибизумабом, содержащим первый олигонуклеотид и дополнительные олигонуклеотиды, специфичные для полиморфизма AG в SNP rs1064875 MMP25. Олигонуклеотиды, "специфичные для" генетического локуса, связываются с полиморфной областью или связываются с областью, примыкающей к полиморфной области локуса. Для олигонуклеотидов, которые предназначены для применения в качестве праймеров для амплификации, праймеры примыкают к данной области, если они достаточно близко расположены для использования при получении полинуклеотида, содержащего полиморфную область. В одном из вариантов осуществления олигонуклеотиды являются примыкающими, если они связываются в пределах приблизительно 1-2 т.п.н., например менее чем 1 т.п.н. от полиморфизма. Специфические олигонуклеотиды способны гибридизоваться с последовательностью, а в подходящих условиях не связываются с последовательностью, отличающейся единственным нуклеотидом.
Набор может содержать по меньшей мере один зонд или праймер, который способен специфически гибридизоваться с полиморфной областью MMP25, DDR2 или BATF, и инструкции по применению. Наборы, как правило, содержат по меньшей мере одну из описанных выше нуклеиновых кислот. Наборы для амплификации по меньшей мере части MMP25, DDR2 или BATF, как правило, содержат два праймера, по меньшей мере один из которых способен гибридизоваться с последовательностью аллельного варианта. Такие наборы подходят для детекции генотипа посредством, например, детекции флуоресценции, посредством электрохимической детекции или посредством другой детекции.
Содержащиеся в наборе олигонуклеотиды, используемые в качестве зондов или праймеров, можно детектируемо метить. Метки можно детектировать непосредственно, например, при флуоресцентных метках или опосредованно. Опосредованная детекция может включать любой способ детекции, известный специалистам в данной области, включая взаимодействия биотин-авидин, связывание антител и т.п. Флуоресцентно меченые олигонуклеотиды также могут содержать молекулу-гаситель. Олигонуклеотиды можно связывать с поверхностью. В некоторых вариантах осуществления поверхность представляет собой диоксид кремния или стекло. В некоторых вариантах осуществления поверхность представляет собой металлический электрод.
Другие наборы по изобретению содержат по меньшей мере один реактив, необходимый для проведения анализа. Например, набор может содержать фермент. Альтернативно набор может содержать буфер или любой другой необходимый реактив.
Наборы могут содержать все или некоторые из положительных контролей, отрицательных контролей, реагентов, праймеров, маркеров для секвенирования, зондов и антител, описываемых в настоящем документе для определения генотипа индивида в полиморфной области MMP25, DDR2 или BATF.
Приведенные ниже примеры предназначены только для иллюстрации практического осуществления настоящего изобретения и не приведены с целью ограничения.
ПРИМЕР
Пример 1. Генетические полиморфизмы и их ассоциация с частотой AMD и исходами лечения
Образцы и генотипирование
Получали образцы периферической крови у 250 деидентифицированных пациентов, включенных в базовые клинические исследования луцентиса® (MARINA, ANCHOR и FOCUS), которые принимали участие в генетическом подисследовании DAWN расширенного исследования HORIZON, и выделяли геномную ДНК. У всех образцов, используемых в анализе, определена самоидентифицированная раса, записанная как "белый", и у всех существует подтвержденный диагноз неоваскулярная AMD. Образцы включали 104 мужчины и 146 женщин, а средний возраст в начале исследования составлял 75,7 лет. У всех индивидуумов, участвовавших в исследовании, получали подписанное информированное согласие, и протоколы исследования утверждали экспертным советом организации.
Кроме описанных выше образцов, как часть исследования DAWN, получали 102 образца, в результате чего общее число образцов составило 352 образца. Эти 352 образца генотипировали с применением Illumina® 550K Human HapMap Bead Array. Авторы использовали строгие критерии контроля качества (QC) для обеспечения включения в конечный анализ высококачественных данных. При этом авторы a) исключали индивидуумов, с потерей > 5% данных и b) исключили индивидуумов, на основе неявного родства и дублирования образцах на основе IBS статуса (PI_Hat > 0,15, в этом наборе данных ни одного образца не детектировано). Авторы включали только SNP с a) отсутствием <5% данных, b) значением p HWE >1×10-6 и c) MAF >0,01%. Все тесты с QC проводили с применением PLINK (Purcell et al. (2007) Am. J. Hum. Genet. 81, 559-75).
Полногеномное исследование ассоциации ответа на терапию луцентисом®
Образцы DAWN разделяли на 2 группы на основе статуса лечения во время испытаний MARINA, ANCHOR и FOCUS. Группа, получавшая лечение луцентисом®, включала индивидуумов, получавших дозы 0,3 мг, 0,5 мг или 0,5 мг+PDT (N=242). Группа SHAM/PDT состояла из индивидуумов, получавших инъекцию, не содержащую препарата, (SHAM) или только фотодинамическую терапию (PDT) (N=110). Авторы проводили полногеномное исследование ассоциации для выявления генетических вариантов, значимо ассоциированных с изменением остроты зрения (VA, измеренная в буквах) после 12 месяцев лечения луцентисом® (таблица 1). Из верхней части списка локусов, ассоциированных со средним изменением VA, авторы идентифицировали 3 локуса, содержащие гены, способные играть роль в заживлении ран (таблица 2) и получали "генетический показатель" посредством суммирования числа аллелей риска, которые несет каждый из индивидуумов в локусах MMP25 (rs1064875), DDR2 (rs10917583) и BATF (rs175714) (фиг.1).
Упорядоченный список вариантов, наиболее ассоциированных с изменением остроты зрения после 12 месяцев терапии луцентисом® (P<2×10-5)
Среднее изменение остроты зрения на 12 месяц лечения луцентисом®, стратифицированное по генотипу локусов MMP25, DDR2 и BATF
Полногеномное исследование ассоциации для клинических фенотипов на начало исследования
Во всех 352 образцах DAWN авторы полногеномное исследование ассоциации нескольких фенотипов на начало исследования, включая: остроту зрения в начале исследования (таблица 3), наличие CNV во втором глазу, не подвергавшемся лечению (таблица 4), и классификацию CNV (классификация как преимущественно классическая в отличие от классификации как минимально классической и скрытой, таблица 5).
Упорядоченный список вариантов, ассоциированных с изменением остроты зрения в начале исследования
у 352 индивидуумов (P<2×10-5)
Упорядоченный список вариантов, ассоциированных с присутствием CNV в другом глазу в начале исследования у 352 индивидуумов (P<2×10-5)
Упорядоченный список вариантов, ассоциированных с классификацией CNV в начале исследования у 352 индивидуумов (P<2×10-5)


Предложенная группа изобретений относится к области медицины. Предложен способ прогнозирования у пациента с влажной возрастной дегенерацией желтого пятна (AMD) повышенной вероятности эффекта от лечения высокоаффинным антителом против VEGF, в частности ранибизумабом. Предложен набор, содержащий первый олигонуклеотид и дополнительные олигонуклеотиды, специфичные для аллелей полиморфизма гена матриксной металлопротеазы 25 (ММР25), соответствующего rs1064875. Если соответствующий генотип содержит АА или AG, у пациента прогнозируют повышенную вероятность эффекта от указанного лечения. Предложенная группа изобретений обеспечивает эффективные средства и методы для прогнозирования у пациента с влажной AMD повышенной вероятности получения эффекта от лечения высокоаффинным антителом против VEGF. 2 н. и 7 з.п. ф-лы, 1 ил., 5 табл., 1 пр.
1. Способ прогнозирования у пациента с влажной AMD повышенной вероятности эффекта от лечения высокоаффинным антителом против VEGF, предусматривающий скрининг образца, полученного у указанного пациента, на аллель геномного полиморфизма гена матриксной металлопротеазы 25 (ММР25), соответствующего rs1064875, где у пациента повышена вероятность эффекта от указанного лечения, если соответствующий генотип содержит АА или AG.
2. Способ по п.1, где указанное антитело против VEGF связывает тот же эпитоп, что и моноклональное антитело против VEGF A4.6.1, продуцируемое гибридомой АТСС® НВ 10709.
3. Способ по п.2, где указанное антитело против VEGF содержит вариабельный домен тяжелой цепи, содержащий следующие аминокислотные последовательности определяющих комплементарность областей (CDR) тяжелой цепи: CDRH1 (GYDFTHYGMN; SEQ ID NO:1), CDRH2 (WINTYTGEPTYAADFKR; SEQ ID NO:2) и CDRH3 (YPYYYGTSHWYFDV; SEQ ID NO:3), и вариабельный домен легкой цепи, содержащий следующие аминокислотные последовательности CDR легкой цепи: CDRL1 (SASQDISNYLN; SEQ ID NO:4), CDRL2 (FTSSLHS; SEQ ID NO:5) и CDRL3 (QQYSTVPWT; SEQ ID NO:6).
4. Способ по п.3, где указанное антитело против VEGF содержит вариабельный домен тяжелой цепи и вариабельный домен легкой цепи Y0317.
5. Способ по п.1, где указанное антитело против VEGF представляет собой ранибизумаб.
6. Способ по п.1, где соответствующий генотип содержит АА.
7. Способ по п.1, где соответствующий генотип содержит AG.
8. Набор для прогнозирования у пациента с влажной AMD повышенной вероятности эффекта от лечения ранибизумабом, содержащий первый олигонуклеотид и дополнительные олигонуклеотиды, специфичные для аллелей полиморфизма A/G MMP25, соответствующего rs1064875.
9. Набор по п.8, где указанный первый олигонуклеотид и указанный второй олигонуклеотид можно использовать для амплификации части гена MMP25, содержащего аллели полиморфизма A/G MMP25, соответствующего rs1064875.
| EA 200600344 A1, 25.08.2006 | |||
| LEE A.Y | |||
| et al | |||
| РУЧКА С РЕЗЕРВУАРОМ ДЛЯ ЧЕРНИЛ | 1922 |
|
SU402A1 |
| Br J Ophthalmol | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
Авторы
Даты
2015-04-10—Публикация
2010-10-20—Подача