Изобретение относится к химическим технологиям и может быть использовано для получения одновременно с двойным сульфатом раствора хлористого водорода, пригодного для использования или в качестве разбавленного раствора соляной кислоты или в качестве выщелачивающего раствора или в качестве источника для производства газообразного хлористого водорода для получения соляной кислоты.
Двойных сульфатов существует несколько десятков. В источниках (Справочник по растворимости, Т.1, Изд. Академии наук СССР, Москва-Ленинград, 1961 [1], Химический энциклопедический словарь под ред. И.Л. Кнунянца, М. Советская энциклопедии, 1983 [2]), приведены сведения о растворимости в % при 0°C некоторых двойных сульфатов. Многие из этих двойных сульфатов нашли широкое применение в промышленности, производятся в больших количества и, следовательно, нуждаются в максимально экономичной технологии производства. Так, например, двойной сульфат хрома-калия (хромокаливые квасцы) применяют для дубления кож, в производстве кинопленки, в фотографии, как протраву при крашении, для пропитывания тканей. Двойной сульфат алюминия-калия (алюмокаливые квасцы) применяют в косметологии, в дезодорантах, в целюлозно-бумажной промышленности, для очистки сточных вод, как разрыхлитель при выпечке хлебо-булочных изделий и в качестве регулятора кислотности и стабилизатора. Двойной сульфат никеля-аммония применяют для химического никелирования. Двойной сульфат железа-аммония (соль Мора) применяют для пропитки древесины для защиты ее от гниения. Двойной сульфат кобальта-аммония используют для кобальтирования, для окрашивания стекла и керамики. Двойной сульфат магния-аммония применяют как комплексное удобрение.
Известен способ производства двойных сульфатов (Ключников Н.Г.
Руководство по неорганическому синтезу. - М.: Химия, 1965, С.332) [3] путем совместной кристаллизации двух реактивов, сульфатов, образующих двойной сульфат. Способ является универсальным и позволяет получить любой двойной сульфат.
Недостатком способа является то, что двойной сульфат производится только из сульфатов, содержащих катионы, входящие в состав двойного сульфата. Это сильно ограничивает сырьевую базу для производства двойного сульфата, поскольку в промышленности, как правило, один из катионов может быть широко представлен в виде дешевого хлорида.
Известен, например, способ производства двойного сульфата никеля-аммония (RU 2310610, публ. 20.11.2007) [4]. В способе в качестве источника одного из катионов, входящих в двойной сульфат - катиона никеля, используется не сульфат никеля, а хлорид никеля, содержащийся в отработанном растворе химического никелирования. Осаждение ведут добавлением в отработанный раствор химического никелирования избытка сульфата аммония и серной кислоты, которые служат источником сульфат иона связывающего ион никеля в двойной сульфат.
Необходимо заметить, что добавление одновременно сульфата аммония и серной кислоты равносильно внесению некоторого количества кислой соли - гидросульфата аммония, которая мгновенно образуется при взаимодействии сульфата аммония и серной кислоты. Собственно говоря, уже потом после своего образования гидросульфат аммония и взаимодействует с хлоридом никеля, образуя двойной сульфат никеля-аммония по реакции кристаллизации (сама реакция кристаллизации имеет малую скорость по сравнению с мгновенной скоростью образования гидросульфата, поскольку вначале должно быть достигнуто пересыщение для двойного сульфата, потом образование зародышей, и только потом начнется рост кристаллов) и раствор хлористого водорода. Но сульфат аммония вносится с избытком, поэтому оставшийся сульфат аммония взаимодействует с образовавшимся раствором хлористого водорода, снова образуя гидросульфат аммония. Поскольку катиона никеля уже нет, он связан в двойной сульфат никеля-аммония, то этот избыток (относительно осаждаемого катиона никеля) гидросульфата аммония остается в растворе, то есть после осаждения двойного сульфата никеля-аммония остается раствор гидросульфата аммония. А растворы гидросульфатов не нашли применения в промышленности и должны быть утилизированы.
Таким образом, недостатком способа [4] является образование при производстве двойного сульфата никеля-аммония растворов кислых сульфатов, которые невозможно использовать в промышленности и которые и должны быть утилизированы. Сказанное справедливо и в отношении способов (RU 2337878, публ. 10.11.2008 [5], RU 2314260, публ. 20.08.2007[6], RU 2307793, публ. 10.10.2007 [7]).
Задачей настоящего изобретения является одновременное получение не только двойного сульфата с использованием в качестве источника одного из катионов - хлорида этого катиона, но и раствора хлористого водорода, который можно использовать в промышленности.
Для решения поставленной задачи способ включает изготовление раствора из хлорида, содержащего один из катионов двойного сульфата, и гидросульфата, содержащего второй из катионов двойного сульфата, осаждение из раствора двойного сульфата, при этом осаждение ведут до удаления из раствора сульфат иона с одновременным получением раствора хлористого водорода.
В качестве хлорида, содержащего второй из катионов двойного сульфата, используют или хлорид магния или хлорид алюминия или хлорид тяжелого металла предпочтительно: или хлорид никеля или хлорид хрома или хлорид кобальта, или хлорид марганца или хлорид меди или хлорид железа или хлорид кадмия или хлорид цинка
Если в качестве гидросульфата, содержащего первый из катионов двойного сульфата, используют гидросульфат не одновалентного катиона, например гидросульфат магния, то в качестве хлорида, содержащего второй из катионов двойного сульфата, предпочтительно используют хлорид одновалентного катиона.
В качестве гидросульфата, содержащего первый из катионов двойного сульфата, предпочтительно используют гидросульфат одновалентного катиона, то есть или гидросульфат натрия или гидросульфат калия или гидросульфат аммония или гидросульфат рубидия или гидросульфат цезия.
Осаждение двойного сульфата, имеющего низкую растворимость, до удаления из раствора сульфат иона, осуществляют предпочтительно охлаждением до минимальной растворимости двойного сульфата. Осаждение двойного сульфата, имеющего среднюю или высокую растворимость, до удаления из раствора сульфат иона, осуществляют предпочтительно одновременно и охлаждением, и высаливаем избытком хлорида, содержащего один из катионов, входящих в состав двойного сульфата, но не сульфата этого катиона.
Согласно заявленному способу после осаждения двойного сульфата, до удаления из раствора сульфат иона, получают раствор хлористого водорода. Для двойного сульфата, имеющего низкую растворимость, раствор хлористого водорода имеет предпочтительно по концентрации примесей в растворе качество разбавленной технической соляной кислоты. Для двойного сульфата, имеющего среднюю растворимость, раствор хлористого водорода имеет предпочтительно качество раствора хлористого водорода достаточное как для выщелачивания концентратов руд, предпочтительно имеющих в своем составе химический элемент аналогичный катиону хлоридом которого производится высаливание двойного сульфата, так и для получения газообразного хлористого водорода. Для двойного сульфата, имеющего высокую растворимость, раствор хлористого водорода имеет предпочтительно качество раствора хлористого водорода достаточное для получения газообразного хлористого водорода.
Сущность заявленного способа заключается в следующем. Изготавливают раствор хлорида, содержащего один из катионов двойного сульфата, и гидросульфата, содержащего второй из катионов двойного сульфата. Проводят реакцию кристаллизации, до удаления из раствора сульфат иона, и после окончания реакции кристаллизации между этими веществами и образования кристаллогидрата двойного сульфата, получают раствор хлористого водорода. В результате получают пульпу, состоящую из раствора хлористого водорода и малорастворимого осадка из двойного сульфата, который отделяют.
До образования кристаллогидрата двойного сульфата в растворе находились ионы, образующиеся при растворении гидросульфата содержащего второй из катионов двойного сульфата: Me2й+, HSO4 -, H+ и SO4 и ионы, образующиеся при растворении хлорида, содержащего первый из катионов двойного сульфата, Me1й+, Cl-, при этом диссоциация гидросульфата шла по первой ступени на Me2й+ и HSO4 - и по второй степени на H+ и SO4 -, количество ионов H+ было мало и определялось константой диссоциации (HSO4 -)Ka=1,2*10-2, pH раствора было равным примерно 0,5 и соответствовало силе средней кислоты, что характерно для поведения кислых солей сульфатов. После удаления из раствора ионов Me2й+ и SO4 - путем связывания ионов в двойной сульфат в растворе начинается дополнительная диссоциация HSO4 - на SO4 - и H+, и число ионов H+ растет, pH раствора становится равным примерно -0,5-0,1, что соответствует раствору сильной кислоты. Поскольку по способу двойной сульфат осаждается из раствора до удаления из раствора сульфат ионов SO4 -, то это уже раствор хлористого водорода, сильной кислоты.
Для образования двойного сульфата необходимо наличие двух катионов образующих с сульфат ионом двойной сульфат. Если первый из катионов, например, одновалентный катион аммония, поступает с гидросульфатом аммония, то второй катион, например, катион магния, должен поступать с хлоридом магния, для образования двойного сульфата магния-аммония и раствора хлористого водорода. И наоборот, если первый из катионов, например, одновалентный катион аммония, поступает с хлоридом аммония, то второй катион, например, катион магния, должен поступать с гидросульфатом магния, для образования того же самого двойного сульфата магния-аммония и раствора хлористого водорода. Осаждение двойного сульфата низкой растворимости охлаждением до его минимальной растворимости предпочтительно, т.к. чем меньше его растворимость, тем меньше останется в растворе сульфат иона, образующего гидросульфат, содержащий второй из катионов двойного сульфата, и соответственно меньше останется в растворе хлорида, содержащего первый из катионов двойного сульфата, тем более чистый и концентрированный раствор хлористого водорода будет получен, что важно для использования раствора разбавленной соляной кислоты. За минимальную растворимость двойных сульфатов принимают их минимальную растворимость в весовых процентах в воде без образования в воде льда. Растворимость двойных сульфатов считается низкой, если она равна или ниже растворимости KAl(SO4)2↓*12 H2O. Осаждение двойного сульфата средней и высокой растворимости предпочтительно одновременным охлаждением до минимальной растворимости двойного сульфата и высаливаем избытком хлорида, содержащего один из катионов, входящих в состав двойного сульфата, имеющегося в выщелачиваемой руде, т.к. чем меньше растворимость двойного сульфата, тем более концентрированный раствор хлористого водорода будет получен, что важно для его использования в качестве раствора для выщелачивания. Растворимость двойных сульфатов считается средней, если она выше растворимости KAl(SO4)2↓*12 H2O, но ниже растворимости (NH4)2Fe(SO4)2↓*6 H2O и высокой, если эта растворимость равна или выше растворимости (NH4)2Fe(SO4)2↓*6 H2O. При качестве раствора хлористого водорода, достаточном для выщелачивания концентратов руд, присутствие в выщелачивающем растворе катиона, имеющегося, в том числе и в руде, не окажет отрицательного влияния на результаты выщелачивания. Если этот раствор использовать для его десорбции, то для ускорения процесса в него нужно добавлять хлориды, поэтому хлориды, добавленные в раствор в процессе осаждения двойного сульфата, не скажутся отрицательно на десорбции.
Таким образом, заявленный способ производства двойного сульфата,
включает получение раствора хлористого водорода, использование которого будет производиться известным способом или в качестве разбавленного раствора технической соляной кислоты или в качестве раствора для выщелачивания руды или в качестве сырья для получения газообразного хлористого водорода.
Новый технический результат, достигаемый заявляемым способом, заключается в расширении возможностей производства двойных сульфатов путем одновременно получения двойного сульфата, а также разбавленного раствора технической соляной кислоты или раствора для выщелачивания руды или сырья для получения газообразного хлористого водорода.
Согласно теории планирования эксперимента для экспериментальной проверки способа нет необходимости проводить несколько сотен опытов с получением всех возможных двойных сульфатов и одновременно с этим получать и проверять качество раствор хлористого водорода. Достаточно провести опыты с получением каждой разновидности двойных сульфатов по определенным критериям. В качестве критериев использованы: растворимость - низкая, средняя, высокая, высокая (даже очень высокая); использование одновалентного катиона - конкретно взяты из всех катионы аммония, калия, натрия; использование двухвалентного катиона - конкретно взяты из всех катионы никеля, кобальта, магния; использование трехвалентного катиона - конкретно взяты катион алюминия; использование в гидросульфатах разных по валентности металлов - одновалентного катиона - конкретно взяты катионы аммония, калия, натрия и двухвалентного катиона - конкретно взяты катион магния; получение разных по качеству растворов хлористого водорода - разбавленного раствора соляной кислоты, раствора хлористого водорода пригодного для выщелачивания концентратов руд, раствора для получения газообразного хлористого водорода.
Для экспериментальной проверки заявляемого способа составили таблицу сведений о растворимости в процентах при 0°C некоторых двойных сульфатов: (один катион из вертикального ряда, другой катион из горизонтального ряда).
Проверку осуществляли по нижеприведенному плану:
Для примера 1: низкая растворимость двойного сульфата, работоспособность пары: одновалентный катион с двухвалентным катионом, использование одновалентного катиона аммония, использование одного из двухвалентных катионов, использование одновалентного катиона в гидросульфате, получение разбавленного раствора соляной кислоты.
Для примера 2: низкая растворимость двойного сульфата, использование уже другого одновалентного катиона - катиона калия, проверяется работоспособность пары: одновалентный катион с трехвалентным катионом. Проверяется трехвалентный катион алюминия.
Для примера 3: средняя растворимость двойного сульфата, использование одновалентного катиона аммония, использование уже другого из двухвалентных катионов
Для примера 4: высокая растворимость двойного сульфата, использование двухвалентного катиона в виде гидросульфата в качестве первого из катионов, использование соответствующего одновалентного катиона, второго из катионов в виде хлорида, инвариантность получения двойного сульфата относительно обмена катионов в гидросульфате и хлориде, высаливание двойного сульфата одним из катионов входящих в двойной сульфат, проверка возможности использования раствора хлористого водорода, полученного высаливанием для выщелачивания руды, проверка возможности получения газообразного хлористого водорода из раствора полученного высаливанием.
Для примера 5: очень высокая растворимость двойного сульфата, проверяется работоспособность пары: одновалентный катион с одновалентным катионом, использование одновалентного катиона натрия.
Пример 1.
Проверяется двойной сульфат, имеющий низкую растворимость, - сульфат никеля-аммония, растворимость при 0°C составляет 0,99%. Проверяется работоспособность пары: одновалентный катион с двухвалентным катионом. Проверяется катион аммония. Проверяется одновалентный катион в составе гидросульфата. Проверяется двухвалентный катион никеля. Проверяется получение раствора разбавленной соляной кислоты
В качестве хлорида, содержащего первый из катионов двойного сульфата, использовали хлорид никеля NiCl2, в качестве гидросульфата содержащего второй из катионов двойного сульфата, использовали гидросульфат аммония NH4HSO4

В термостойкий стакан налили 100 грамм горячей воды и растворили в ней 22,99 грамм гидросульфата аммония марки ЧДА, это 0,200 молей реактива, pH раствора равен 0,52, это соответствует раствору кислой соли. В термостойкий стакан налили 50 грамм горячей воды и растворили в ней 23,50 грамм хлорида никеля 6 водного марки Ч, это 0,100 молей реактива. Полученные растворы смешали в термостойком стакане. Стакан поставили в кювету, заполненную спиртовым раствором и кусочками льда, и начали охлаждать, перемешивая раствор и измеряя температуру и pH раствора. По мере охлаждения раствора pH раствора уменьшается: при 11,4°C pH=0,14, при 9,4°C pH=0,10. При 8,8°C pH=0,07 и заметно помутнение раствора, при 4,6°C pH=-0,05 уже образовался осадок, сразу оседающий на дно после прекращения перемешивания, при 1,5°C pH=-0,14, при 0,6°C, pH=-0,15 дальнейшее охлаждение теряет смысл. Скорость осаждения осадка после окончания перемешивания очень велика, раствор становится полностью прозрачным за время менее половины минуты.
Таким образом, в стакане образовался осадок, как результат реакции гидросульфата аммония с хлоридом никеля с образованием двойного сульфата аммония-никеля 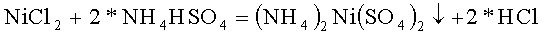
По полученным результатам делаем расчеты для полученного раствора хлористого водорода: pH=-0,15 дает концентрацию H+ ионов, а значит и соляной кислоты 10-(-0,15)=1,41 моль/л, значит в нашем декантате 128 мл*1,4125 моль/л=0,181 моль соляной кислоты из 0,200 молей, которые можно было получить теоретически, что означает успешное проведение реакции со значимыми (больше 90%) для промышленности процентами выхода раствора хлористого водорода.
Следует заметить, что реальный процент выхода хлористого водорода еще выше, так как часть раствора хлористого водорода осталось во влажном осадке (в промышленности его можно выделить на центрифуге) и потом ушло с промывными водами. Рассчитать количество этой неучтенного хлористого водорода напрямую по pH раствора невозможно, поскольку при растворении осадка в раствор попадает двойной сульфат аммония-никеля, взаимодействующий с хлористым водородом.
Необходимо отметить, что реакция образования двойного сульфата аммония-никеля прошла без мешающих побочных реакций (соосаждения кислых солей) и получен очень чистый двойной сульфат никеля-аммония. Проводим следующую оценку по характеристикам осадка: растворенный осадок имеет pH=2,76, что дает концентрацию H+ ионов 10-(2,76)=0,0017 моль/л, значит в растворенном осадке всего H+ 150 мл*0,0017 моль/л=0,0026 молей примесей. Это, скорее всего не примеси, а результат недостаточной промывки осадка.
Полученный раствор хлористого водорода можно использовать любым известным способом. Например, промышленным способом выделить из полученного раствора хлористый водород (Левинский М.И, Мазанко А.Ф., Новиков И.Н. Хлористый водород и соляная кислота. - М: Химия, 1985) [8].
Делаем контрольную проверку, подтверждающую возможность получения газообразного хлористого водорода. Берем полученный раствор весом 133 грамма, начинаем его кипятить: лакмусовая бумажка в паре синеет, в парах находится хлористый водород. Упариваем раствор до объема 2-3 мл, добавляем воды до веса 133 грамма и измеряем pH раствора равный 1,06. Проводим следующую оценку по характеристикам раствора: концентрация H+ ионов 10-(1,06)=0,087 моль/л, значит в растворенном осадке всего H+ 133 мл*0,087 моль/л=0,0116 молей, которые остались в растворе 133 мл. Значит, из раствора содержащего 0,180 молей хлористого водорода действительно выделили 0,1684 молей газообразного хлористого водорода.
Проводим анализ на сульфат ион оставшихся 133 мл раствора, осаждая сульфат ион нитратом бария и получая при этом 1,22 грамма сульфата бария. Это дает 0,50 грамма сульфат иона в 133 мл раствора или 0,38% примеси сульфат иона в растворе хлористого водорода. По ТУ 6-01-1194-79 на техническую соляную кислоту количество сульфатов в пересчете на сульфат ион не должно превышать 0,8%. Примеси иона железа анализом не обнаружены. Следовательно, учитывая, что нами не получена концентрация хлористого водорода, требующаяся по ТУ, но выдержаны требования по примесям, мы получили разбавленную соляную кислоту.
Пример 2.
Проверяется двойной сульфат, имеющий низкую растворимость, - сульфат алюминия-калия, растворимость при 0°C составляет 2,91%. Проверяется работоспособность пары: одновалентный катион с трехвалентным катионом. Проверяется одновалентный катион калия. Проверяется трехвалентный катион алюминия.
В качестве хлорида, содержащего первый из катионов двойного сульфата, использовали хлорид алюминия AlCl3, в качестве гидросульфата содержащего второй из катионов двойного сульфата, использовали гидросульфат калия KHSO4
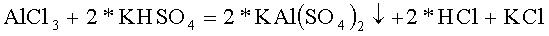
В термостойкий стакан налили 75 грамм горячей воды и растворили в ней 27,19 грамм гидросульфата калия марки ЧДА, это 0,200 молей реактива, pH раствора равен 0,51, это соответствует раствору кислой соли. В термостойкий стакан налили 75 грамм горячей воды и растворили в ней 24,1 грамм хлорида алюминия 6 водного марки Ч, это 0,100 молей реактива. Полученные растворы смешали в термостойком стакане. Стакан поставили в кювету, заполненную спиртовым раствором и кусочками льда, и начали охлаждать, перемешивая раствор и измеряя температуру и pH раствора. По мере охлаждения раствора pH раствора уменьшается: при 31,0°C pH=0,15, При 22,0°C pH=0,06 и заметно образование осадка, при 1,8°C pH=-0,05, при 0,6°C pH=-0,09, при 0,0°C, pH=-0,09 дальнейшее охлаждение теряет смысл. Скорость осаждения осадка после окончания перемешивания очень велика, раствор становится полностью прозрачным за время менее минуты.
Таким образом, в стакане образовался осадок, как результат реакции гидросульфата калия с хлоридом алюминия с образованием двойного сульфата калия-алюминия 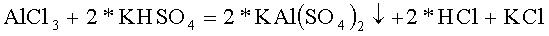
По полученным результатам делаем расчеты для полученного раствора хлористого водорода: pH=-0,09 дает концентрацию H+ ионов, а значит и соляной кислоты 10-(-0,09)=1,230 моль/л, значит в нашем декантате 142 мл*1,230 моль/л=0,175 моль соляной кислоты из 0,200 молей, которые можно было получить теоретически, что означает успешное проведение реакции со значимыми (почти 90%) для промышленности процентами выхода раствора хлористого водорода.
Пример 3.
Проверяется двойной сульфат, имеющий среднюю растворимость, - сульфат кобальта-аммония, растворимость при 0°C составляет 5,7%. Проверяется работоспособность пары: одновалентный катион с двухвалентным катионом. Проверяется катион аммония. Проверяется двухвалентный катион кобальта.
В качестве хлорида, содержащего первый из катионов двойного сульфата, использовали хлорид кобальта CoCl2, в качестве гидросульфата содержащего второй из катионов двойного сульфата, использовали гидросульфат аммония NH4HSO4
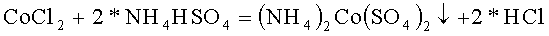
В термостойкий стакан налили 50 грамм горячей воды и растворили в ней 22,99 грамм гидросульфата аммония марки ЧДА, это 0,200 молей реактива, pH раствора равен 0,52, это соответствует раствору кислой соли. В термостойкий стакан налили 53 грамм горячей воды и растворили в ней 23,50 грамм хлорида кобальта 6 водного марки Ч, это 0,100 молей реактива. Полученные растворы смешали в термостойком стакане. Стакан поставили в кювету, заполненную спиртовым раствором и кусочками льда, и начали охлаждать, перемешивая раствор и измеряя температуру и pH раствора. По мере охлаждения раствора pH раствора уменьшается: при 3,5°C pH=0,09, при 0,9°C pH=-0,07. При 0,0°C pH=-0,10 дальнейшее охлаждение теряет смысл. Скорость осаждения осадка после окончания перемешивания очень велика, раствор становится полностью прозрачным за время менее половины минуты.
Таким образом, в стакане образовался осадок, как результат реакции гидросульфата аммония с хлоридом кобальта с образованием двойного сульфата аммония-кобальта 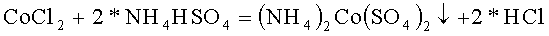
Раствор с осадка слили, измерили pH декантата равный -0,10, что соответствует pH раствора уже не кислой соли, а раствора хлористого водорода. Объем декантата составил 102 мл, а вес 111 г.
По полученным результатам делаем расчеты для полученного раствора хлористого водорода: pH=-0,10 дает концентрацию H+ ионов, а значит и соляной кислоты 10-(-0,10)=1,259 моль/л, значит в нашем декантате 102 мл*1,259 моль/л=0,128 моль соляной кислоты из 0,200 молей, которые можно было получить теоретически, что означает успешное проведение реакции со значимыми (больше 64%, плюс раствор оставшийся в осадке) для промышленности процентами выхода раствора хлористого водорода.
Полученный раствор хлористого водорода можно использовать для выделения хлористого водорода промышленным способом [8].
Пример 4.
Проверяется двойной сульфат, имеющий высокую растворимость, -сульфат магния-аммония, растворимость при 0°C составляет 10,58%. Проверяется работоспособность пары: одновалентный катион с двухвалентным катионом, когда двухвалентный катион в составе гидросульфата. Проверяется одновалентный катион аммония в хлориде. Проверяется двухвалентный катион магния. Проверяется инвариантность получения двойного сульфата относительно обмена катионов в гидросульфате и хлориде. Проверяется высаливание двойного сульфата катионом, входящим в состав руды, катион ион магния. Проверяется пригодность для выщелачивания полученного высаливанием раствора хлористого водорода на примере магнийсодержащего концентрата - серпентинита Баженовского месторождения г. Асбест. Проверяется возможность получения из раствора, полученного высаливанием, газообразного хлористого водорода.
В качестве хлорида, содержащего первый из катионов двойного сульфата, использовали хлорид аммония NH4Cl, в качестве гидросульфата содержащего второй из катионов двойного сульфата, использовали гидросульфат магния Mg(HSO4)2
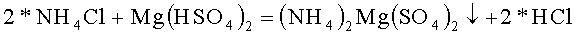
В термостойкий стакан налили 50 грамм горячей воды и растворили в ней 21,80 грамм гидросульфата магния марки ЧДА, это 0,100 молей реактива, pH раствора равен 0,51, это соответствует раствору кислой соли. В термостойкий стакан налили 60 грамм горячей воды и растворили в ней 10,70 грамм хлорида аммония марки Ч, это 0,200 молей. Стакан поставили в кювету, заполненную спиртовым раствором и кусочками льда, и начали охлаждать, перемешивая раствор и измеряя температуру и pH раствора. По мере охлаждения раствора pH раствора уменьшается: при 14,0°C pH=0,40, при 6,0°C pH=0,18, при 0,0°C pH=0,12, дальнейшее охлаждение теряет смысл, ни осадка, ни помутнения раствора указывающего на начало процесса кристаллизации нет. Двойной сульфат, имеющий высокую растворимость, охлаждением до 0°C осадить не удалось. Стакан с раствором перенесли в морозильную камеру с температурой -18°C и стали охлаждать при периодическом перемешивании. Во время перемешивания происходило растворение кристалликов льда на стенках и поверхности жидкости. Через три часа в стакане образовался прозрачный раствор и на дне осадок соли.
Таким образом, в стакане образовался осадок, как результат реакции гидросульфата магния с хлоридом аммония с образованием двойного сульфата магния - аммония 
По полученным результатам делаем расчеты для полученного раствора хлористого водорода: pH=-0,18 дает концентрацию ионов, а значит и соляной кислоты 10-(-0,18)=1,514 моль/л, значит в нашем декантате 108 мл*1,514 моль/л=0,163 моль соляной кислоты из 0,200 молей, которые можно было получить теоретически, что означает успешное проведение реакции со значимыми (81,3%) для промышленности процентами выхода раствора хлористого водорода.
Для проверки инвариантности получения двойного сульфата относительно обмена катионов в гидросульфате и хлориде в качестве хлорида, содержащего первый из катионов двойного сульфата, используем хлорид магния MgCl2, в качестве гидросульфата содержащего второй из катионов двойного сульфата, использовали гидросульфат магния NH4HSO4
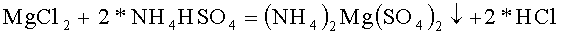
В термостойкий стакан налили 54 грамм горячей воды и растворили в ней 22,98 грамм гидросульфата аммония марки ЧДА, это 0,200 молей реактива, pH раствора равен 0,50, это соответствует раствору кислой соли. В термостойкий стакан налили 50 грамм горячей воды и растворили в ней 31,06 грамм хлорида магния 6 водного марки Ч, это 0,153 молей. Стакан поставили в кювету, заполненную спиртовым раствором и кусочками льда, и начали охлаждать, перемешивая раствор и измеряя температуру и pH раствора. По мере охлаждения раствора pH раствора уменьшается: при 0,8°C pH=0,23, при 0,3°C, pH=-0,25 дальнейшее охлаждение теряет смысл. Скорость осаждения осадка после окончания перемешивания очень велика, раствор становится полностью прозрачным за время менее минуты.
Таким образом, в стакане образовался осадок, как результат реакции гидросульфата аммония с хлоридом магния с образованием двойного сульфата аммония-магния 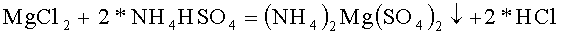
По полученным результатам делаем расчеты полученного хлористого водорода: pH=-0,25 дает концентрацию H+ ионов, а значит и хлористого водорода 10-(-0,25)=1,79 моль/л, значит в нашем декантате 112 мл*1,79 моль/л=0,199 моль хлористого водорода из 0,200 молей, которые можно было получить теоретически, что означает успешное проведение реакции почти со 100% процентами выхода хлористого водорода.
Очевидно, что чрезвычайно успешному проведению реакции способствовало наличие избытка хлорида магния относительно стехиометрического количества необходимого для проведения реакции образования двойного сульфата количестве 0,1 моль. Именно избыток хлорида магния определил высаливающий эффект иона магния по отношению к двойному сульфату аммония-магния и усилил осаждение двойного сульфата, растворимость двойного сульфата магния-аммония в растворе хлорида магния при низких температурах оказалась ничтожна. Для успешного осаждения двойного сульфата магния-аммония можно было внести также хлорид аммония, который определил бы высаливающий эффект иона аммония по отношению к двойному сульфату аммония-магния. Но сточки зрения использования полученного раствора хлористого водорода для выщелачивания магний содержащего сырья это было бы хуже. Ион магния все равно попадает в раствор при выщелачивании магний содержащего сырья и его наличие в исходном выщелачивающем растворе не загрязняет конечный продукт, а ион аммония вносил бы загрязнения.
Следует отметить, что при проведении реакции образования двойного сульфата имеющего высокую растворимость вносить избыток реактивов для получения высаливающего эффекта нужно только в виде хлорида. В случае внесения высаливающего реактива в виде сульфата в растворе будет уменьшаться количество хлористого водорода за счет взаимодействия хлористого водорода и сульфат иона с получением гидросульфата.
Для проведения выщелачивания магний содержащего сырья отбираем в термостойкий стакан из полученного раствора хлористого водорода 100 мл, концентрации 6,52% по хлористому водороду. Добавляем в стакан песок мелкий фракции 0,063-0,16 из отсевов дробления Баженовского месторождения комбината ОАО «Ураласбест» состава: MgO-36,40%, Al2O3 - 1,76%, Fe2O3 - 10,30%, SiO2 - 44,70%, NiO - 0,50%, Cr2O3 - 1,90%, MnO - 0,27%, H2O-3,00%, CaO - 0,52%, Na2O - 0,67% в количестве 8,9 грамм, это соответствует стехиометрическому соотношению для выщелачивания во взятом растворе хлористого водорода. Ставим стакан на магнитную мешалку с подогревом, накрываем стеклом и начинаем выщелачивание при температуре 100°C и перемешивании. Замеряем через 10 минут pH раствора равный 0,06, это соответствует проведению выщелачивания на 51,4%, через 20 минут pH раствора равный 0,18, это соответствует проведению выщелачивания на 63,0%, через 60 минут pH раствора равный 0,57, это соответствует проведению выщелачивания на 84,7%, через 150 минут pH раствора равный 1,52, это соответствует проведению выщелачивания на 98,3%. Следовательно, учитывая высокий процент выщелачивания полученным раствором хлористого водорода, доказана возможность применения полученного раствора в качестве раствора для выщелачивания руды.
По результатам примера 4 можно констатировать, что при осаждении двойного сульфата имеющего высокую растворимость одного охлаждения может быть не достаточно для получения результата в виде высокого процентного выхода раствора хлористого водорода. Но совместное использование охлаждения и высаливания одним из катионов, входящих в состав двойного сульфата, дает отличный результат даже для двойных сульфатов имеющих высокую растворимость.
Пример 5:
Проверяется двойной сульфат, имеющий очень высокую растворимость, - сульфат натрия-аммония. Проверяется работоспособность пары: одновалентный катион с одновалентным катионом. Проверяется одновалентный катион натрия
В качестве хлорида, содержащего первый из катионов двойного сульфата, использовали хлорид натрия NaCl, в качестве гидросульфата содержащего второй из катионов двойного сульфата, использовали гидросульфат аммония NH4HSO4
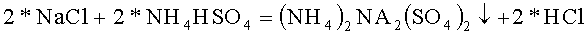
В термостойкий стакан налили 20 грамм горячей воды и растворили в ней 23,00 грамм гидросульфата аммония марки ЧДА, это 0,200 молей реактива, pH раствора равен 0,50, это соответствует раствору кислой соли. В термостойкий стакан налили 30 грамм горячей воды и растворили в ней 11,60 грамм хлорида натрия марки поваренная пищевая выварочная соль, это 0,200 молей реактива. Полученные растворы смешали в термостойком стакане. Стакан поставили в кювету, заполненную спиртовым раствором и кусочками льда, и начали охлаждать, перемешивая раствор и измеряя температуру и pH раствора. Охладив раствор до 0°C, видим, что осадка нет. Ставим стакан в морозильную камеру с температурой -18°C, на 1 сутки. Получаем в стакане сверху прозрачный раствор, а на дне осадок соли с незначительными вкраплениями кристаллов льда.
Таким образом, в стакане образовался осадок, как результат реакции гидросульфата аммония с хлоридом натрия с образованием двойного сульфата аммония-натрия 
Раствор с осадка слили, измерили pH декантата равный -0,68, что соответствует pH раствора уже не кислой соли, а раствора хлористого водорода. Объем декантата составил 41 мл, а вес 50,5 грамма. Вес влажного осадка составил 30,9 грамма.
По полученным результатам делаем расчеты для полученного раствора хлористого водорода: pH=-0,68 дает концентрацию H+ ионов, а значит и соляной кислоты 10-(-0,68)=4,786 моль/л, значит в нашем декантате 41 мл*4,786 моль/л=0,196 моль соляной кислоты из 0,200 молей, которые можно было получить теоретически, что означает успешное проведение реакции со значимыми (почти 98%) для промышленности процентами выхода раствора хлористого водорода. Следовательно, нами получен большой процент выхода раствора хлористого водорода, то есть операция проведена успешно.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СЕРНОКИСЛОТНОЙ ПЕРЕРАБОТКИ СЫРЬЯ | 2013 |
|
RU2571755C2 |
| СПОСОБ ПЕРЕРАБОТКИ ГИПСА | 2013 |
|
RU2554139C2 |
| СПОСОБ ПРОИЗВОДСТВА АММИАКА И СЕРНОЙ КИСЛОТЫ ИЗ СУЛЬФАТА АММОНИЯ | 2013 |
|
RU2560445C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОКСИДА МАГНИЯ | 2012 |
|
RU2535690C2 |
| СПОСОБ ПЕРЕРАБОТКИ ПРИРОДНОГО ФОСФАТА ДЛЯ ИЗВЛЕЧЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ | 2014 |
|
RU2560802C1 |
| СПОСОБ ПОЛУЧЕНИЯ СВИНЦА | 2014 |
|
RU2555261C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЧИСТОЙ ВОЛЬФРАМОВОЙ КИСЛОТЫ | 2014 |
|
RU2571244C1 |
| СПОСОБ ПРОИЗВОДСТВА ГИДРОСУЛЬФАТА АММОНИЯ | 2012 |
|
RU2519945C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИДКОГО СТЕКЛА | 2016 |
|
RU2620659C1 |
| СПОСОБ ПРОИЗВОДСТВА МЕТАЛЛИЧЕСКИХ ПРОДУКТОВ | 2008 |
|
RU2478566C2 |
Изобретение может быть использовано химической промышленности. Способ получения двойного сульфата и раствора хлористого водорода включает приготовление раствора из хлорида, содержащего один из катионов двойного сульфата, и гидросульфата, содержащего второй из катионов двойного сульфата, и осаждение из раствора двойного сульфата. Осаждение ведут до удаления из раствора сульфат-иона с одновременным получением раствора хлористого водорода. В качестве гидросульфата, содержащего первый из катионов двойного сульфата, используют гидросульфат натрия, или гидросульфат калия, или гидросульфат аммония, или гидросульфат рубидия, или гидросульфат цезия. В качестве хлорида, содержащего второй из катионов двойного сульфата, используют хлорид магния, или хлорид алюминия, или хлорид никеля, или хлорид хрома, или хлорид кобальта, или хлорид марганца, или хлорид меди, или хлорид железа, или хлорид кадмия, или хлорид цинка. Изобретение позволяет одновременно получать двойные сульфаты и разбавленный раствор технической соляной кислоты или раствор для выщелачивания руд или производства газообразного хлористого водорода. 7 з.п. ф-лы, 1 табл., 5 пр.
1. Способ получения двойного сульфата и раствора хлористого водорода, включающий изготовление раствора из хлорида, содержащего один из катионов двойного сульфата, и гидросульфата, содержащего второй из катионов двойного сульфата, осаждение из раствора двойного сульфата, отличающийся тем, что осаждение ведут до удаления из раствора сульфат-иона с одновременным получением раствора хлористого водорода.
2. Способ по п.1, отличающийся тем, что в качестве гидросульфата, содержащего первый из катионов двойного сульфата, предпочтительно используют гидросульфат одновалентного катиона, в качестве которого используют гидросульфат натрия, или гидросульфат калия, или гидросульфат аммония, или гидросульфат рубидия, или гидросульфат цезия, а в качестве хлорида, содержащего второй из катионов двойного сульфата, предпочтительно используют хлорид магния, или хлорид алюминия, или хлорид тяжелого металла, предпочтительно хлорид никеля, или хлорид хрома, или хлорид кобальта, или хлорид марганца, или хлорид меди, или хлорид железа, или хлорид кадмия, или хлорид цинка.
3. Способ по п.1, отличающийся тем, что осаждение из раствора двойного сульфата, имеющего низкую растворимость, осуществляют предпочтительно охлаждением до минимальной растворимости двойного сульфата.
4. Способ по п.1, отличающийся тем, что осаждение из раствора двойного сульфата, имеющего низкую растворимость, предпочтительно ведут до получения раствора хлористого водорода, который по количеству примесей соответствует разбавленной технической соляной кислоте.
5. Способ по п.1, отличающийся тем, что осаждение из раствора двойного сульфата, имеющего среднюю растворимость, предпочтительно ведут до получения раствора хлористого водорода, пригодного для выщелачивания концентратов руд и для получения газообразного хлористого водорода.
6. Способ по п.1, отличающийся тем, что осаждение из раствора двойного сульфата, имеющего среднюю или высокую растворимость, ведут предпочтительно охлаждением с одновременным высаливаем избытком хлорида, содержащего один из катионов, входящих в состав двойного сульфата.
7. Способ по п.1, отличающийся тем, что осаждение из раствора двойного сульфата, имеющего среднюю или высокую растворимость, ведут предпочтительно охлаждением с одновременным высаливаем избытком хлорида, содержащего один из катионов двойного сульфата, имеющегося также в руде, для выщелачивания которой производят раствор хлористого водорода.
8. Способ по п.1, отличающийся тем, что осаждение из раствора двойного сульфата, имеющего высокую растворимость, ведут предпочтительно до получения раствора хлористого водорода, пригодного для получения газообразного хлористого водорода.
| CN 101717280 A, 02.06.2010; | |||
| СПОСОБ ПОЛУЧЕНИЯ ГЕКСАГИДРАТА СУЛЬФАТА НИКЕЛЯ-АММОНИЯ | 2005 |
|
RU2310610C2 |
| Способ получения двойной соли сульфата калия-кальция | 1973 |
|
SU558855A1 |
| Кассетка к прибору для проявления фотографических пластинок на свету | 1925 |
|
SU2758A1 |
| CN 102009954 A, 13.04.2011 | |||
Авторы
Даты
2015-04-20—Публикация
2013-08-23—Подача