Уровень техники.
Раковые заболевания - одна из основных причин преждевременной смертности и крупных социальных затрат. В настоящее время основными методами лечения рака остается хирургический и химиотерапевтический. По данным Всемирной организации здравоохранения 40% смертей от онкологических заболеваний можно предотвратить использованием современных видов химиотерапии. Различные виды противоопухолевой терапии с включением различных режимов химиотерапии получают более 70% всех больных злокачественными новообразованиями.
В то же время эффективность современного противоопухолевого лечения, особенно для пациентов с III-IV стадиями заболевания, невысока. Кроме того, даже к эффективным химиопрепаратам через несколько курсов лечения возникает лекарственная резистентность. Существует потребность в разработке новых высокоэффективных противоопухолевых препаратов оригинального действия, обладающих низкой токсичностью. В настоящее время идут активные исследования в области создания новых высокоэффективных противоопухолевых агентов, особенно т.н. «таргетных» препаратов - препаратов, блокирующих определенные белки-мишени в опухолевых клетках. Среди перспективных мишеней для противоопухолевого воздействия называются:
- рецепторы факторов роста;
- стимуляторы роста новых микрососудов внутри опухоли;
- белки, участвующие в процессе апоптоза;
- белки лекарственной резистентности;
- и другие.
Создание таких препаратов может снизить смертность от онкологических заболеваний и, что наиболее важное, уменьшить инвалидность больных злокачественными новообразованиями.
Кроме того, лекарственная резистентность опухоли к традиционным химиопрепаратам может возникать при ингибировании запуска программированной гибели клетки - апоптоза. Разработка противоопухолевых препаратов, которые позволили бы восстановить чувствительность опухолевых клеток к индукции апоптоза, или поиск других мишеней для запуска клеточной гибели являются чрезвычайно актуальными подходами.
Таким образом, получение новых оригинальных классов противоопухолевых агентов является крайне важной и актуальной задачей. В настоящее время в клинической онкологии используются несколько десятков противоопухолевых фармакологических препаратов, эффективность большинства из которых недостаточна, а спектр онкологических заболеваний, излечиваемых с помощью химиотерапии, в значительной мере ограничен.
Известен лекарственный препарат «Доксорубицин», противоопухолевый антибиотик антрациклинового ряда. Доксорубицин обладает высокой противоопухолевой и противолейкозной активностью, обладает способностью интеркалировать ДНК клеток. Обладает иммуносупрессивной активностью. Применяют доксорубицин при раке молочной железы, саркомах мягких тканей, остеогенной саркоме, опухоли Юинга, раке легкого, лимфосаркоме, раке яичников, плоскоклеточных раках различной локализации, раке мочевого пузыря, опухоли Вильямса, раке щитовидной железы, острых лейкозах, лимфогранулематозе. Вводят только внутривенно. Недостатками данного средства является угнетающее влияние на кроветворение, а также очень высокая токсичность LD 50 13-15 мг/кг и кардиотоксическое действие (Машковский М.Д. Лекарственные средства. Москва. - 2001 г.).
Известен лекарственный препарат «Фторурацил», который является одним из широко используемых в клинической онкологии противоопухолевых препаратов и применяется для лечения рака яичников, рака молочной железы, рака печени (гапатомы), меланомы и др. (Safit J.N., Bonavida В. // Cancer Res. - 1992. - Vol. 52. - P. 6630). Как и все цитостатики, 5-фторурацил очень токсичен - при его применении возникают тошнота, рвота, угнетение костномозгового кроветворения, токсическое поражение почек и др. (Машковский М.Д. Лекарственные средства. Москва. - 2001 г., стр. 425).
Наиболее близкими по структуре являются вещества, описанные в заявке на патент РФ 2010138202/15(054523) от 16.09.2010 г., которые являются полными структурными аналогами предлагаемых нами соединений, в этой заявке также предложено применение производных триндолилметанов формулы I в качестве противоопухолевых препаратов, но не приведены конкретные составы фармацевтических композиций. Новизна заключается в том, что нами впервые предложен состав композиции, позволяющий преодолеть плохую растворимость этих веществ в воде и физрастворе, что ранее не позволяло применять их в виде инъекционных форм для терапии опухолей.
Описание изобретения
Данное изобретение относится к фармацевтической композиции, представляющей собой раствор активного ингредиента - производного трииндолилметана-фармацевтически приемлемой соли трис(1-пентил-1Н-индол-3-ил)метилия формулы (I), в частности хлорид трис(1-пентил-1Н-индол-3-ил)метилия в неионногенном поверхностно-активном вспомогательном веществе - фармацевтически приемлемом полисорбате (твине), в частности в полисорбате-80 (твин-80), из которой можно легко приготовить фармацевтический препарат путем разбавления водными растворами.
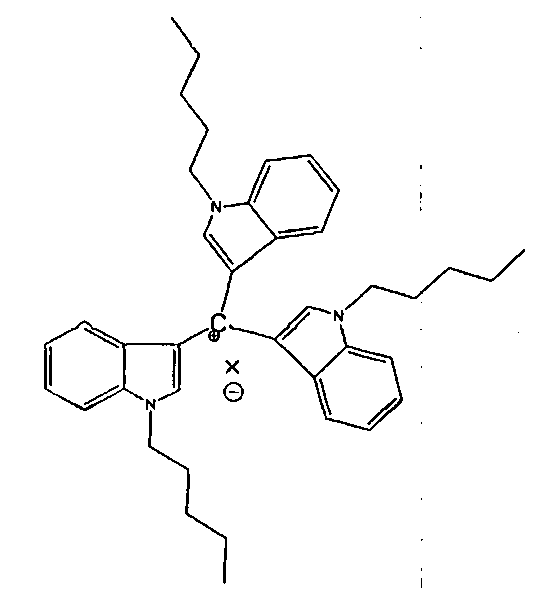
формула I
где X- представляет собой анион любой фармацевтически приемлемой органической или неорганической кислоты.
Полисорбат (Твин), предназначенный для применения в данном изобретении, представляет собой, например, полисорбат-80 или другой фармацевтически приемлемый полисорбат, который добавляют в количестве не менее 50% массовых, обычно 50-99% массовых, в частности 5-10% массовых, предпочтительно 15-20 частей массы, на часть массы указанного выше активного ингредиента.
Термин «Фармацевтически приемлемый» означает материал, который используют при получении фармацевтической композиции и который обычно является безопасным в биологическом или ином отношении, нетоксичным и приемлемым как в ветеринарии, так и в фармацевтике.
Термин «Фармацевтически приемлемые соли» означает соли, которые являются фармацевтически приемлемыми и которые обладают необходимой фармакологической акивностью исходного соединения. Такие соли включают соли неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., или соли органических кислот, таких как муравьиная, уксусная, пропионовая, бензойная, бензолсульфоновая, толуолсульфоновая, этансульфоновая, метансульфоновая, камфорсульфоновая, янтарная, фумаровая, малеиновая, молочная, яблочная, миндальная, винная, лимонная, глюконовая, глюкуроновая, гликолевая, салициловая, триметилуксусная и т.п. Подразумевается, что все фармацевически приемлемые соли включают сольваты или кристаллические формы указанной соли.
Термин «сольваты» означает сольватированные формы, содержащие стехиометрическое или нестехиометрическое количество растворителя.
Препаративная форма фармацевтической композиции данного изобретения представляет собой жидкость, которая, в частности, является инъекционным раствором, глазными каплями, каплями в нос, каплями в ухо, жидкостью для внутривенного вливания, жидкостью для перорального введения, жидкостью для ингаляции, жидкостью для лосьона или т.п., с предпочтением инъекционного раствора (например, для внутривенных, подкожных, внутримышечных и т.д. инъекций), глазных капель и жидкости для внутривенного вливания, с особенным предпочтением раствора для инъекций (например, для внутривенных, подкожных, внутримышечных и т.д. инъекций) и жидкости для внутривенных вливаний. Эти препаративные формы подходящим образом подбирают в соответствии с заболеваниями, подлежащими лечению, их симптомами, полом и возрастом пациента, областью введения и т.п., и препарат приготавливают способом, известным квалифицированному специалисту в данной области, в частности путем разбавления фармацевтической композиции до терапевтической концентрации. водными растворами, приемлемыми для инъкций - в частности водой для инъекций, физиологическим раствором, реополиглюкином и др.
Фармацевтическая композиция данного изобретения может поставляться в продажу в виде готового жидкого препарата или в виде набора, включающего порошок или лиофилизированный продукт, содержащий активный ингредиент и т.д., и жидкость для растворения.
Фармацевтическая композиция данного изобретения может содержать помимо указанных выше ингредиентов, например, растворители, изотонирующие компоненты, компоненты, регулирующие значение pH, буферные средства, антиоксиданты, загустители, поверхностно-активные вещества, консерванты, увлажнитель, отдушки, красители и т.п., когда это приемлемо. Эти добавки могут добавляться при введении композиции данного изобретения в фармацевтический препарат или могут добавляться в жидкость для растворения, поставляемую в указанном выше наборе для получения препарата, которую используют для растворения при применении.
Фармацевтическая композиция данного изобретения может использоваться в форме жидкого препарата для терапии злокачественных опухолей
Пример способа получения фармацевтической композиции
К 100 г Твина-80 при комнатной температуре и перемешивании на магнитной мешалке добавляют 5 г хлорида трис(1-пентил-1Н-индол-3-ил)метилия и перемешивают до полного растворения.
Тестирование биологической активности
Примеры биологической активности приведены в таблицах 1 и 2 с целью предоставить возможность специалисту в данной области более подробно ознакомиться с предлагаемым изобретением и использовать его на практике. Примеры приведены с целью иллюстрации и не ограничивают объем изобретения. Тестируемые вещества получены методами, описанными в статье (Sergey N. Lavrenov, Yuriy N. Luzikov, Evgeniy E. Bykov, Marina I. Reznikova, Evgenia V. Stepanova, Valeria A. Glazunova, Yulia L. Volodina, Victor V. Tatarsky Jr., Alexander A. Shtil, and Maria N. Preobrazhenskaya. Synthesis and Cytotoxic Potency of Novel Tris(1-alkylindol-3-yl)methylium Salts: Role of N-alkyl Substituents. Bioorg. Med. Chem. 2010, v.18, №18; 6905-6913).
Ингибирование роста опухолевых клеток является индикатором противоопухолевой активности, широко используемым для описания противоопухолевых свойств новых лекарств.
Активность соединений тестировали на панели клеточных линий опухолей человека различного гистогенеза (Табл.1). Максимальное ингибирование опухолевого роста наблюдалось для клеточной линии метастатической меланомы кожи Mel Kor. Показано, что клеточная гибель клеток линии Jurkat под действием соединений происходит путем апоптоза (Табл.2). Оценка апоптоза проводилась иммунофлуоресцентным методом путем окрашивания клеток Jurkat красителем Annexin V-FITC через 48 часов инкубации клеток с соединениями при оценке на проточном цитофлуориметре. Одним из механизмов действия веществ на опухолевые клетки может быть блокирование уровня активации белка NfKB.
Пример 1. Цитотоксическое действие in vitro соединений на клеточные линии опухолей человека.
Противоопухолевая активность соединений была оценена на шести клеточных линиях опухолей человека с использованием МТТ теста. В работе были использованы следующие клеточные линии опухолей человека: НСТ116 (рак прямой кишки); К562 (клетки эритролейкемии); Jurkat (Т-клеточный лимфобластный лейкоз), mel Kor (диссеминированная меланома кожи), SKOV-3 (рак яичников), MCF-7 (рак молочной железы) и SK-BR-3 (рак молочной железы). Соединения были тестированы в диапазоне концентраций от 1 мкМ.
Клетки (105-106 клеток/мл) вносили в лунки плоскодонного 96-луночного планшета в среде RPMI-1640, содержащей 10% эмбриональной сыворотки, 2 мМ глутамина. Через 24 часа в лунки вносили водный раствор фармацевтической композиции в различных концентрациях. В качестве контроля клеткам вносили водный раствор Твин-80 без добавления активного ингредиента. Инкубацию с препаратом проводили 48 часов, затем добавляли МТТ в конечной концентрации 0,5 мг/мл. Клетки инкубировали 4 часа, затем среду отбирали и клетки растворяли в ДМСО. Оптическую плотность (OD) оценивали на анализаторе BioTek ELx808 при 520 нм, используя ДМСО как нулевой контроль. Эксперименты повторялись не менее 3 раз.
Цитотоксический эффект фармацевтической композиции в различной концентрации выражали в процентах клеточной жизнеспособности относительно необработанного контроля (% контроля), которые определяли как [(OD обработанных клеток)/(ОЭ необработанных клеток)]×100. Определен параметр цитотоксического действия препарата - IC50 (ингибирующая доза, при которой блокируется жизнеспособность 50% клеток).
Таблица 1 представляет значения IC50 (выраженные в микромолях активного вещества) активности композиции.
Из представленных данных в табл.1 видно, что композиция обладает значимой и достоверной противоопухолевой активностью в отношении различных клеточных линий опухолей человека в диапазоне концентраций от 1 мкМ до 0,01 мкМ. Вещества, относящиеся к изобретению, обладают высокой активностью по отношению к опухолевым клетками меланомы кожи линии Mel Kor.
Пример 2. Апоптотическая активность соединений in vitro.
Тестирование проводили на клеточной линии Т-клеточного лейкоза Jurkat. Клетки культивировались в среде RPMI 1640, содержащей 10% эмбриональной сыворотки крупного рогатого скота, 2 mM глутамина, антибиотики (100 IU/mL пенициллина и 100 mg/ml стрептомицина).
Оценку апоптоза проводили по окрашиванию на Аннексии V с помощью тест-набора FITC Annexin V Apoptosis Detection kit (BD Pharmingen).
Клетки Jurkat высаживали (1,25×105 клеток/мл) и инкубировали с препаратами в течение 48 часов. Клетки отмывали в холодном PBS и добавляли к клеткам 100 мкл Аннексии V-связывающий буфер. Добавляли 5 мкл Аннексина V и 5 мкл пропидий йодида и инкубировали 15 минут при комнатной температуре в темноте. Флуоресцентную активность клеток определяли с помощью проточного цитофлуориметра Becton Dickenson FacsCallibur при 525 нм (зеленый канал, FL1, Аннексии V) и 675 нм (красный канал, FL2, пропидий йодид). Анализировалось не менее 10 тысяч клеток. Эксперименты повторялись не менее 3 раз.
Апоптотическую активность веществ выражали в процентах апоптотических клеток относительно общего количества клеток в пробе, которые определяли как [(количество клеток, окрашенных Аннексином V)/(общее количество клеток)]×100.
Композиция индуцирует апоптотическую гибель клеток линии Jurkat в зависимости от дозы вводимого препарата (Табл.2).
Пример 3. Ингибирование активности белка NfKB под действием композиции in vitro.
Белок NFκB регулирует экспрессию различных генов (в том числе и некоторых протоонкогенов), вовлеченных в ингибирование апоптоза, повышение выживаемости клеток и их пролиферативной активности, стимуляцию ангиогенеза и метастазирования основных процессов, участвующих в развитии и прогрессии опухолей. Активированный NfKB транслоцируется в ядро и запускает транскрипцию различных генов, в том числе и антиапоптотических. Белок NfKB является перспективной мишенью для действия современных противоопухолевых препаратов направленного механизма действия.
Проведено изучение влияния веществ согласно изобретению в нецитотоксической концентрации на уровень активированной субъединицы NfKB р65. Оценку ингибирования активности белка NfKB проводили с помощью флуоресцентного иммуноцитохимического метода при инкубации с первичными антителами против активированной субъединицы р65 NfKB.
Клетки Jurkat высаживали (1,25×105 клеток/мл) и инкубировали с препаратами в нецитотоксических дозах в течение 48 часов. Клетки промывали 2 раза в холодном фосфатно-солевом буфере (ФСБ) и осаживали на стекла с помощью цитоцентрифуги. Клетки фиксировались в спирте в течение 5 минут, а затем в ацетоне - 3 минуты. Клетки пермеабилизировались в растворе ФСБ, содержащий 1% Тритон Х-100 в течение 5 минут. Затем стекла инкубировались в течение 10 минут в ФСБ, содержащей 5% BSA для забивки неспецифического связывания. Первичные антитела против активной субъединицы NfKB р65 (МАВ3026, Chemicon) наносились на 1 час. В качестве вторичных антител использовали антитела, конъюгированные с красителем Alexa Fluor 594 (А11005, Invitrogen). Препараты докрашивали Hoechst-33258 (2 мкг/мл). Препараты анализировались с помощью флуоресцентного микроскопа Nikon 80i при увеличении 400х.
Композиция согласно изобретению снижает уровень экспрессии активированной субъединицы р65 в клетках Jurkat, а также блокируют ее транслокацию в ядро.
Изучение активности веществ ин виво
Была изучена противоопухолевая активность на животных с перевиваемыми опухолями.
Результаты приведены в таблицах 3 и 4.
При ежедневном пятикратном применении в дозах 0,5 и 1,0 мг/кг препарат проявляет выраженную противоопухолевую активность в отношении меланомы В 16 мышей, которая сохраняется до 18 суток после перевивки опухоли. Композицию растворяли в изотоническом растворе хлорида натрия и в 0,025% концентрации вводили мышам при помощи пластикового шприца ежедневно в течение 5 дней внутрибрюшинно в разовых дозах 0,5; 1,0 и 1,5 мг/кг с 1 по 5 сутки, начиная через 24 часа после перевивки опухоли.
Ежедневно наблюдали за состоянием и поведением животных, один раз в неделю измеряли условный объем опухолей (как произведение 3-х диаметров опухоли). ТРО % рассчитывали по общепринятой формуле: 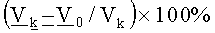
Из представленных материалов видно, что препарат, примененный в дозе 0,5 мг/кг ежедневно в течение 5 дней, проявляет выраженную достоверную противоопухолевую активность, которая сохраняется в течение 15 суток после перевивки опухоли.
Аденокарциному молочной железы мышей АК 755 (9 генерация) перевивали по стандартной методике подкожно по 1 млн клеток.
Фармацевтическую композицию растворяли в изотоническом растворе хлорида натрия и в 0,025% концентрации вводили мышам при помощи пластикового шприца ежедневно в течение 5 дней внутрибрюшинно в разовых дозах 0,5; 1,0 и 1,5 мг/кг с 1 по 5 сутки, начиная через 24 часа после перевивки опухоли. Ежедневно наблюдали за состоянием и поведением животных, один раз в неделю измеряли условный объем опухолей (как произведение 3-х диаметров опухоли). ТРО% рассчитывали по общепринятой формуле 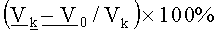
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ ТРИИНДОЛИЛМЕТАНА В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ СРЕДСТВ | 2010 |
|
RU2454232C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ 6-[(4-МЕТИЛ-I-1-ПИПЕРАЗИНИЛ)МЕТИЛ]-ИНДОЛО[1',7':1,2,3]ПИРРОЛО[3',4':6,7]АЗЕПИНО[4,5-b]ИНДОЛ-1,3(2Н,10 Н)-ДИОНА В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВОГО СРЕДСТВА | 2013 |
|
RU2523387C1 |
| N,N'-(АЛКАНДИИЛ)БИС[ЛАБДА-7(9),13,14-ТРИЕН-4-КАРБОКСАМИДЫ], ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2654201C1 |
| КОМБИНИРОВАННОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ | 2002 |
|
RU2291710C2 |
| СРЕДСТВО ДЛЯ СЕЛЕКТИВНОЙ АПОПТОТИЧЕСКОЙ ЭЛИМИНАЦИИ ОПУХОЛЕВЫХ КЛЕТОК | 2014 |
|
RU2567670C2 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 2014 |
|
RU2569729C1 |
| Производные 2-аминохроменов проявляющие противоопухолевую активность. Фармацевтические композиции | 2018 |
|
RU2704262C1 |
| ОНКОГЕННОЕ RAS-СПЕЦИФИЧНОЕ ЦИТОТОКСИЧЕСКОЕ СОЕДИНЕНИЕ И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2006 |
|
RU2448703C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА, ИНДУЦИРУЮЩИЕ ФЕРРОПТОЗ В МЕТАСТАТИЧЕСКИХ КЛЕТКАХ МЕЛАНОМЫ И РАКА ТОЛСТОЙ КИШКИ | 2019 |
|
RU2722308C1 |
| БИОЛОГИЧЕСКИЕ МАТЕРИАЛЫ И ИХ ПРИМЕНЕНИЕ | 2006 |
|
RU2432363C9 |
Изобретение относится к фармацевтической промышленности и включает в себя фармацевтическую композицию, представляющую собой раствор производного трииндолилметана - фармацевтически приемлемой соли трис(1-пентил-1Н-индол-3-ил)метилия, в частности хлорид трис(1-пентил-1Н-индол-3-ил)метилия, в фармацевтически приемлемом полисорбате (твине), в частности в полисорбате-80 (твин-80). Композиция применяется для терапии злокачественных опухолей человека или животных. 4 табл., 3 пр.
Фармацевтическая композиция для терапии злокачественных опухолей, содержащая, как минимум, один активный компонент- фармацевтически приемлемую соль трис(1-пентил-1Н-индол-3-ил)метилия формулы (I), в частности хлорид трис(1-пентил-1Н-индол-3-ил)метилия и, как минимум, одно вспомогательное вещество - полисорбат (твин), в частности полисорбат-80 (твин-80).
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ ТРИИНДОЛИЛМЕТАНА В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ СРЕДСТВ | 2010 |
|
RU2454232C2 |
| RU 2008116170, 27.10.2009 | |||
| Robin S | |||
| Dothager et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Chem | |||
| Soc, 2005, 127, 8686-8696 | |||
Авторы
Даты
2015-04-27—Публикация
2012-11-16—Подача