Изобретение относится к медицине, а именно к лекарственным средствам, обладающим противоопухолевым действием, и может найти применение при лечении злокачественных опухолей.
Известны лекарственные средства для лечения злокачественных опухолей из ряда нитрозоалкилмочевины (НАМ), которые широко применяются в современной онкологии [Полозкова С.А., Орел Н.Ф., Маркович А.А., Кузьминов А.Е., Горбунова В.А. / Злокачественные опухоли. №1 - 2013 (5) С. 47-55].
Так, при лечении опухолей центральной нервной системы (ЦНС) широко применяются препараты, относящиеся к алкилирующим агентам, - это НАМ, а также ее производные: ломустин, кармустин, нидран, мюстафоран [Дементьева Н.П., Корман Д.Б. / Вопросы онкологии. 2001. Т. 47. №6. С. 3-11], [Горбунова В.А., Орел Н.Ф. / Эффективная фармакотерапия. 2010. №2. С. 30-33].
Направленность действия препаратов данной группы объясняется не только способностью присоединяться ко многим веществам путем реакции алкилирования, но прежде всего способностью НАМ и ее производных проникать через гематоэнцефалический барьер [Перетолчина Н.М., Герасимова Г.К., Белоусова А.К. и др. / В кн. "Экспериментальная онкология на рубеже веков" // Ред. М.И. Давыдов, А.Ю. Барышников. - М.: Издательская группа РОНЦ им. Н.Н. Блохина РАМН. 2003. С. 147-160].
Отличительной чертой производных НАМ от других алкилирующих агентов является отсутствие перекрестной устойчивости по отношению к другим препаратам этой же группы, а также липофильность и миелосупрессивное действие. Препараты НАМ широко используются в клинической практике. Они обладают высокой терапевтической активностью, широким спектром противоопухолевого действия и применяются в комбинированной терапии опухолей (диссеминированной меланомы, мелкоклеточной карциномы легких, опухолей мозга и лимфом) [Горбунова В.А., Орел Н.Ф., Егоров Г.Н. Этюды химиотерапии. Юбилейный сборник, посвященный 40-летию отделения химиотерапии РОНЦ им. Н.Н. Блохина РАМН / Под редакцией проф. В.А. Горбуновой. - Москва. - 2000. - С. 22-47].
Известно производное НАМ: лизомустин в виде «Лизомустина лиофилизата для приготовления раствора для инфузий 100 мг» [Краснов В.П., Авдюкова Н.В., Клочкова Т.И. и др. / Аналитика и контроль. 2001. Т.5. №2. С. 168-170], [Перетолчина Н.М., Клочкова Т.И., Михайлова Л.М. и др. / Практическое пособие для онкологов и врачей. 2000. С. 22].
Недостатки лизомустина:
1. Выраженная токсичность.
2. Высокая доза вводимого препарата.
3. Низкий спектр терапевтического действия.
Известно средство - Nδ-нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитин - производное НАМ (Патент РФ №2503657), обладающее противоопухолевым действием.
Данное средство принято в качестве прототипа.
Недостатки прототипа:
1. Плохая растворимость.
2. Невозможность автоматического дозирования.
3. Нестабильность растворов.
Задачей настоящего изобретения является создание нового отечественного противоопухолевого средства из класса НАМ, удобного в употреблении, обладающего хорошей растворимостью, стабильного при хранении и обладающего высоким цитостатическим эффектом.
Технический результат:
1. Хорошая растворимость.
2. Стабильность при хранении.
3) Расширение спектра отечественных противоопухолевых препаратов из класса НАМ.
Поставленная задача достигается тем, что создано новое противоопухолевое средство, содержащее:
Nδ-Нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитин; поливинилпирролидон низкомолекулярный Mm=7000-11000 (ПВП) и кислоту хлористоводородную при следующем соотношении компонентов (мг):
Пример 1
Пример 2
Пример 3
Способ получения заявляемого средства
Nδ-Нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитин растворяли в 0,1 М кислоте хлористоводородной, добавляли ПВП (6%), проводили стерилизующую фильтрацию, разливали по 5,0 мл во флаконы вместимостью 20 мл, подвергали сублимации: кассеты с флаконами помещали в камеру сублимационной установки на предварительно охлажденные полки для замораживания и последующей лиофилизации. Температура полки при загрузке не превышала (-40) - (-45)°С.
При достижении температуры (-40) - (-45)°С продукт выдерживали в течение 3 часов.
Повышение температуры полок до -20°С проводили после включения и выравнивания вакуума со скоростью 2°С в час и далее до +20°С со скоростью 5°С в час. Температура препарата при досушивании не превышала +20°С. Продолжительность досушивания составила 3 часа.
Общее время сушки препарата составило 27,5-28 часов.
По окончании процесса сушки вакуум в сублимационной камере гасили чистым профильтрованным стерильным воздухом, пропущенным через патрон с безводным силикагелем и стерильным воздушным фильтром с размером пор 0,22 мкм.
Сравнение цитотоксического действия заявляемого средства и прототипа
Исследование in vitro проводили на клеточных линиях диссеминированной меланомы человека Mel Kor и Mel Z, аденокарциномы молочной железы MCF-7; карциномы легкого А549; карциномы толстой кишки НСТ-116; нейробластомы человека SH-SY5Y; Т-клеточного лимфобластного лейкоза Jurkat.
Клеточные линии культивировали в среде RPMI-1640, содержащей 10% телячьей эмбриональной сыворотки, 10мМ HEPES (Sigma, США), 2 мМ L-глутамина (Sigma, США), 40 нг/мл гентамицина (ICN, США), 0,1% 1000х раствора аминокислот и 0,1% 1000х раствора витаминов (ПанЭко, Россия), при t°=37°С в атмосфере 5% СO2. Клетки поддерживали в логарифмической фазе роста постоянным пересевом культуры через 3-4 дня. Для открепления адгезионных клеточных культур от пластика использовали раствор Версена. Клетки отмывали жидкостью чистой бессывороточной среды RPMI-1640 и пересаживали в 96-луночные плоскодонные планшеты по 4 тыс. клеток в 180 мкл полной среды RPMI-1640 на лунку. Суспензионную клеточную культуру Jurkat снимали без использования раствора Версена и сажали в плоскодонные планшеты в количестве 25 тыс. клеток на лунку в 180 мкл полной среды RPMI-1640.
Через сутки в лунки с клетками добавляли по 20 мкл заявляемого средства и прототипа в различных концентрациях. Планшеты с клетками помещали в инкубатор при t°=37°С 5% СО2. В качестве контроля использовали лунки с клетками, в которые добавляли 20 мкл среды.
Через 24, 48 или 72 ч в каждую лунку вносили по 20 мкл раствора МТТ[3-(4,5-диметилтиазолин-2)-2,5 дифенилтетразолий бромид] (маточный раствор 5 мг/мл) и инкубировали 4 ч при t°=37 °С в 5% СО2-инкубаторе.
После образования формазана планшеты с клетками центрифугировали, надосадочную жидкость удаляли. Осадок растворяли, добавляя в лунки по 200 мкл диметисульфоксида. Планшеты помещали на 5-7 минут в термостат при t°=37°С, затем - в шейкер. Интенсивность окрашивания среды измеряли на фотометрическом анализаторе иммуноферментных реакций «АИФР-01 Униплан» (ЗАО «Пикон») при λ=530 нм. Величина поглощения была прямо пропорциональна числу живых клеток.
Выживаемость клеток рассчитывалась по формуле:

Все эксперименты повторяли не менее трех раз.
Цитотоксическую активность оценивали по ИК50-концентрации, при которой происходит подавление роста 50% клеток.
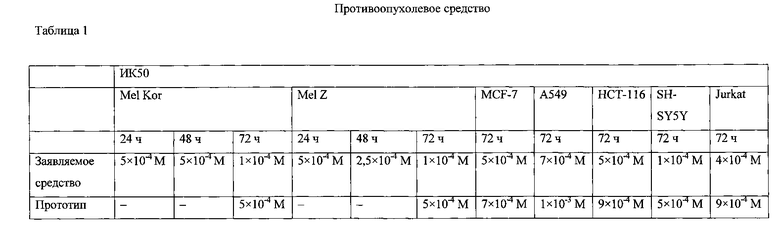
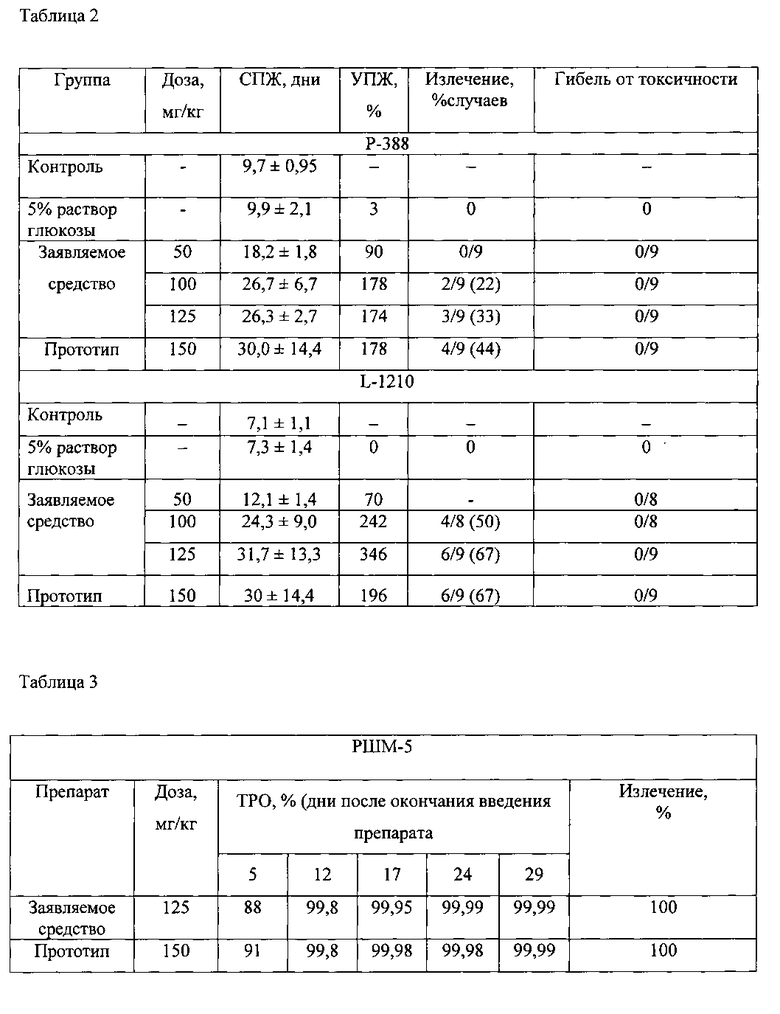
Изобретение иллюстрируется таблицами 1-3, где приводятся результаты сравнения цитотоксического и противоопухолевого действия заявляемого средства и прототипа на используемые в исследовании клеточные линии и модели опухолей животных.
На линии клеток Mel Коr максимальный цитотоксический эффект наблюдался для заявляемого средства и прототипа при 72 ч инкубации с самой высокой дозой 1×10-3 М при 10% выживших клеток. ИК50 для прототипа при инкубации в течение 24 ч и 48 ч в исследуемых концентрациях не найдена, при инкубации в течение 72 ч она составила 5х10-4 М. При инкубации в течение 72 ч она составила 1х10-4 М (табл.1).
На клеточной линии Mel Z максимальный цитотоксический эффект наблюдался для заявляемого средства и прототипа при 72 ч инкубации с самой высокой исследованной дозой 5×10-3 М и составил 10% выживших клеток. ИК50 - для прототипа при инкубации в течение 24 ч и 48 ч в исследуемых концентрациях не найдена, при инкубации в течение 72 ч она составила 5×10-4 М. ИК50 для заявляемого средства при инкубации 24 ч составила 5×10-4 М, при инкубации 48 ч - 2,5×10-4 М, при инкубации в течение 72 ч- 1×10-4 M (табл. 1).
При 72 ч инкубации ИК50 для заявленного средства на клеточной линии MCF-7 составила 5×10-4 М, на клеточной линии А549 - 7×10-4 М, на клеточной линии НСТ-116 - 5×10-4 М, на клеточной линии SH-SY5Y - 1×10-4 М и на клеточной линии Jurkat - 4×10-4 М. Тогда как для прототипа на всех клеточных линиях ИК50 была более высокой: на MCF-7 - 7×10-4 М, на А549 - 7×10-3 М, на НСТ-116 и Jurkat - 9×10-4 М и на SH-SY5Y - 5×10-4 М (табл. 1).
Показано, что заявляемое средство в виде лиофилизата для приготовления раствора для инъекций по сравнению с прототипом оказывает более выраженное цитотоксическое действие на клетки диссеминированной меланомы человека, аденокарциномы молочной железы человека, карциномы легкого человека, карциномы толстой кишки человека, нейробластомы человека и Т-клеточного лимфобластного лейкоза человека.
Сравнение противоопухолевого действия заявляемого средства и прототипа in vivo
Исследование противоопухолевой активности заявляемого средства и прототипа проводили при внутривенном введении стандартным животным: самкам мышей гибридов BDF1 (С57l/6j×DBA/2) массой 18-20 грамма, полученным из питомника ФГБНУ «РОНЦ им. Н.Н.Блохина» в соответствии с этическими аспектами проведения исследований на биомоделях и на лабораторных животных. Все мыши были здоровы, имели ветеринарный сертификат качества о состоянии здоровья. мышей содержали в специальных просторных клетках по 5 особей при температуре воздуха 20-23°С и относительной влажности 60-65% в условиях естественного освещения и принудительной вентиляции на подстилке из древесных стружек, стерилизованных в сухожаровом шкафу. Для кормления животных использовали стандартный промышленный и сертифицированный брикетированный корм для грызунов с установленным сроком годности. Кормление проводили в одно и то же время.
Для оценки противоопухолевой активности в соответствии с «Руководством по проведению доклинических исследований лекарственных средств» использовали лимфолейкозы Р-388 и L-1210 мышей и рак шейки матки РШМ-5. Лечение лейкозов начинали через 24 часа, а рака шейки матки через 48 часов после перевивки.
Группы формировались с учетом получения статистически достоверных результатов: контрольная группа состояла из 12 мышей, опытные группы - из 8 или 9 животных.
Критериями оценки противоопухолевого эффекта служили: торможение роста опухоли (ТРО,%), увеличение продолжительности жизни (УПЖ,%) опытных мышей по сравнению с контрольными и излечение.
После однократного внутривенного введения заявляемого средства на модели лимфолейкоза мышей Р-388 в диапазоне доз от 50 мг/кг до 125 мг показана зависимость терапевтического эффекта от дозы. При введении заявляемого средства в дозе 50 мг/кг у мышей с лимфолейкозом Р-388 УПЖ составляло 90%, в дозе 100 мг/кг - 178% и излечение в 22% случаев, в дозе 125 мг/кг - 174% и излечение в 33% случаев. Прототип был эффективен в более высокой дозе - 150 мг/кг, УПЖ составило 178% и излечение 44% случаев (табл.2).
После однократного внутривенного введения заявляемого средства в диапазоне доз от 50 мг/кг до 125 мг/кг на модели лимфолейкоза L-1210 также выявлено, что терапевтический эффект увеличивался при возрастании дозы, в дозе 100 мг/кг УПЖ составило 244%, а излечение 50% случаев, в дозе 125 мг/кг УПЖ составило 346% и излечение в 67% случаев. Тогда как применение прототипа в более высокой дозе 150 мг/кг вызывало УПЖ 196% и излечение в 67% случаев (табл. 2).
Показано, что заявляемое средство в виде лиофилизата для приготовления раствора для инъекций по сравнению с прототипом оказывает более выраженное противоопухолевое действие на перевиваемые опухоли животных - лимфолейкоз Р-388 и L-1210 и рак шейки матки РШМ-5.
| название | год | авторы | номер документа |
|---|---|---|---|
| N-НИТРОЗО-N-[(2-ХЛОРЭТИЛ)КАРБАМОИЛ]-L-ОРНИТИН | 2012 |
|
RU2503657C1 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 2014 |
|
RU2572691C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-НИТРОЗО-N-[(2-ХЛОРЭТИЛ)КАРБАМОИЛ]-L-ОРНИТИНА | 2015 |
|
RU2601753C1 |
| Средство для терапии опухолей | 2019 |
|
RU2726801C1 |
| Производное класса N-гликозидов индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дионов - N-{ 12-(β-D-ксилопиранозил)-5,7-диоксо-индоло[2,3-а]пирроло[3,4-с] карбазол-6-ил} пиридин-2-карбоксамид, обладающее цитотоксической и противоопухолевой активностью | 2017 |
|
RU2667906C1 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 2014 |
|
RU2575572C1 |
| ПРЕПАРАТ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ И СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ РАКА С ЕГО ИСПОЛЬЗОВАНИЕМ | 2012 |
|
RU2521327C1 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 2007 |
|
RU2335284C1 |
| Комбинированная наноконструкция для терапии рака легкого | 2024 |
|
RU2841547C1 |
| N-ГЛИКОЗИДЫ ИНДОЛО[2,3-a]ПИРРОЛО[3,4-c]КАРБАЗОЛОВ, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2548045C1 |
Изобретение относится к фармацевтике, в частности к противоопухолевому средству, содержащему Nδ-нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитин, поливинилпирролидон низкомолекулярный Mm=7000-11000 и кислоту хлористоводородную. Осуществление изобретения позволяет получить противоопухолевое средство из класса НАМ, удобное в употреблении, обладающее хорошей растворимостью, стабильностью при хранении и обладающее высоким цитостатическим эффектом. 3 табл., 3 пр.
Противоопухолевое средство, содержащее Nδ-нитрозо-Nδ-[(2-хлорэтил)карбамоил]-L-орнитин, отличающееся тем, что оно содержит поливинилпирролидон низкомолекулярный Мm=7000-11000 (ПВП) и кислоту хлористоводородную при следующих соотношениях компонентов (мг):
| N-НИТРОЗО-N-[(2-ХЛОРЭТИЛ)КАРБАМОИЛ]-L-ОРНИТИН | 2012 |
|
RU2503657C1 |
| Аминокислоты в регио- и стереонаправленном синтезе физиологически активных соединений / Левит Г.Л | |||
| // автореферат, Екатеринбург " 2009 | |||
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 1999 |
|
RU2144821C1 |
Авторы
Даты
2015-11-27—Публикация
2014-07-10—Подача