Область техники, к которой относится изобретение
По настоящей заявке испрашивается приоритет японской патентной заявки No. 2008-208766, зарегистрированной 13 августа 2008 г.
Настоящее изобретение относится к модифицированному биотинсвязывающему белку.
Известный уровень техники
Авидин представляет собой белок, происходящий из белка яйца, а стрептавидин является белком, происходящим из Streptomyces avidinii. Авидин и стрептавидин, каждый обладает очень высоким сродством (KD=от 10-16 до 10-14) к биотину (D-[(+)-цис-гексагидро-2-оксо-1H-тиено-(3,4)-имидазол-4-валерату]), и это сродство является одним из наиболее сильных взаимодействий между двумя биологическими молекулами. Их молекулярные массы составляют приблизительно 60 кДа. В настоящее время взаимодействие авидин/стрептавидин-биотин широко применяется в областях биохимии, молекулярной биологии и медицины (Green, (1975), Adv. Protein Chem., 29: 85-133; Green, (1990), Methods Enzymol., 184: 51-67). Авидин и стрептавидин, каждый образует тетрамер, и одна субъединица тетрамера связывается с одной молекулой биотина.
Проблемой в использовании авидина является его неспецифическое связывание. Авидин может не специфически связываться не только с клетками, но также с ДНК, белками и биологическим материалом, таким как мембраны. Например, при определении вещества с использованием связывания авидин-биотин авидин не специфически связывается с веществами, отличными от целевого вещества, предназначенного для определения, что увеличивает фон. Причины высокого неспецифического связывания авидина включают его высокую изоэлектрическую точку и цепи сахаров, содержащиеся в количестве приблизительно 10% от молекулярной массы. Авидин представляет собой сильно основной белок, обладающий высокой изоэлектрической точкой 10 или более, и в целом заряжен положительно. Соответственно, считается, что авидин легко связывается с биологическими веществами, которые во многих случаях заряжены отрицательно.
Кроме того, считается, что цепи сахаров на поверхности авидина легко связываются с биологическими веществами (Marttila et al., (2000) FEBS Lett, 467, 31-36). Для того чтобы снизить неспецифическое связывание авидина, исследовались, например, химически модифицированный нейтравидин, у которого цепи сахаров авидина удалены с помощью гликозидазы (Bayer, et al., (1995) Appl Biochem Biotechnol, 53(1), 1-9), и биосинтез авидина без приобретения модификации цепями сахаров в результате замещения аспарагинового остатка в положении 17 (мишени гликозилирования в авидине) на остаток изолейцина (Marttila, et al., (2000) FEBS Lett, 467, 31-36). Кроме того, существует исследование по снижению изоэлектрической точки авидина путем превращения остатка лизина или остатка аргинина в авидине в нейтральную аминокислоту или кислую аминокислоту с помощью генной инженерии (Marttila, et al., (1998) FEBS Lett, 441, 313-317).
Хотя эти модификации могут снизить неспецифическое связывание, например, ДНК и клеток к авидину, снижение неспецифического связывания с сыворотками человека, которые необходимо использовать в системах клинического тестирования, существенно не исследовалось. Кроме того, биосинтез мутантных авидинов требует экспрессионных систем насекомых. Соответственно, модификация последовательности авидина требует длительного времени культивирования и высока по стоимости, следовательно, до сих пор не вошла в использование на практике.
В соответствии с представленным исследованием относительно сродства между биотином и связывающим биотин белком, таким как авидин или стрептавидин, связывание с флуоресцентным биотином усиливается при существенной модификации структуры стрептавидина (Aslan, et al., (2005) Proc Natl Acad Sci U.S.A., 102, 8507-8512). К сожалению, биотинсвязывающая способность этого белка существенно снижается.
Изобретатели настоящего изобретения очистили белок, проявляющий антибактериальную активность против Magnaporthe grisea, из съедобного гриба Pleurotus cornucopiae. Как обнаружено, белок обладал биотинсвязывающей активностью и был назван тамавидином (тамавидин 1). В патенте WO 02/072817 раскрыта как аминокислотная последовательность белка тамавидина 1, так и нуклеотидная последовательность гена, кодирующего белок (SEQ ID NO: 1 и 2 в патенте WO 02/072817). Был также идентифицирован гомолог тамавидина 1 (тамавидин 2) из Pleurotus cornucopiae, и, как показано, он обладал сильной биотинсвязывающей активностью. Как обнаружено, белок обладал биотинсвязывающей активностью и был назван тамавидином (тамавидин 1). В патенте WO 02/072817 раскрыта как аминокислотная последовательность белка тамавидина 2, так и нуклеотидная последовательность гена, кодирующего белок (SEQ ID NO: 3 и 4 в патенте WO02/072817), и был успешно получен их рекомбинантный белок. Тамавидины 1 и 2 могут быть экспрессированы в Escherichia coli. В частности, тамавидин 2, который может быть легко получен путем очистки с использованием иминобиотиновой колонки и обладает более высокой устойчивостью к нагреванию по сравнению с стрептавидином, является прекрасным биотинсвязывающим белком. Однако, хотя неспецифическое связывание тамавидина 2 с нуклеиновыми кислотами и/или белками ниже, чем у существующего авидина, оно сравнимо со стрептавидином.
Перечень ссылок
Патентный документ
Патентный документ 1: WO02/072817 A1
Патентный документ 2: WO2008/081938 A1
Непатентный документ
Непатентный документ 1: Marttila, et al., (2000) FEBS Lett, 467, 31-36
Непатентный документ 2: Bayer, et al., (1995) Appl Biochem Biotechnol, 53(1), 1-9
Непатентный документ 3: Marttila, et al., (1998) FEBS Lett, 441, 313-317
Непатентный документ 4: Alon, et al., (1990) Biochem Biophys Res Commun, 170, 1236-1241
Непатентный документ 5: Aslan, et al., (2005) Proc Natl Acad Sci U.S.A., 102, 8507-8512
Непатентный документ 6: Weber, et al., (1989) Science, 243: 85-88
Непатентный документ 7: Livnah, et al., (1993) Proc. Natl. Acad. Sci. U.S.A., 90, 5076-5080
Непатентный документ 8: Qureshi, et al., (2001) J. Biol. Chem., 276(49), pp. 46422-46428
Краткое изложение сущности изобретения
Техническая задача
Целью настоящего изобретения является предоставление модифицированного биотинсвязывающего белка, который проявляет улучшенные характеристики, такие как пониженное неспецифическое связывание и/или дополнительно увеличенное сродство связывания биотина при сохранении специфических характеристик тамавидина, т.е. высокой биотинсвязывающей способности.
Решение технической задачи
В настоящем изобретении успешно улучшены характеристики тамавидина 2 (в настоящем описании далее может обозначаться как TM2) путем модификации аминокислотной последовательности (SEQ ID NO: 2) природного тамавидина 2.
Предпочтительные варианты осуществления настоящего изобретения
Настоящее изобретение предпочтительно включает следующие варианты осуществления:
Способ 1
Модифицированный биотинсвязывающий белок, включающий аминокислотную последовательность, представленную SEQ ID NO: 2, аминокислотную последовательность, обладающую от одной до нескольких мутаций аминокислот в последовательности, представленной SEQ ID NO: 2, или аминокислотную последовательность, идентичную последовательности, представленной SEQ ID NO: 2, на 80% или более, и обладающий биотинсвязывающей активностью, где
один или более остатков выбранные из
1) остатка аргинина в положении 104 SEQ ID NO: 2;
2) остатка лизина в положении 141 SEQ ID NO: 2;
3) остатка лизина в положении 26 SEQ ID NO: 2; и
4) остатка лизина в положении 73 SEQ ID NO: 2
заменены остатком кислой аминокислоты или остатком нейтральной аминокислоты;
Способ 2
Модифицированный биотинсвязывающий белок по способу 1, где аминокислотный остаток, выбранный из от 1) до 4) заменен аминокислотным остатком, обладающим индексом гидрофобности 2 или менее;
Способ 3
Модифицированный биотинсвязывающий белок по способу 1, где 1) остаток аргинина в положении 104 SEQ ID NO: 2 и/или 2) остаток лизина в положении 141 SEQ ID NO: 2 заменены кислым аминокислотным остатком или нейтральным аминокислотным остатком;
Способ 4
Модифицированный биотинсвязывающий белок по способу 3, где 1) остаток аргинина в положении 104 SEQ ID NO: 2 и/или 2) остаток лизина в положении 141 SEQ ID NO: 2 заменены кислым аминокислотным остатком;
Способ 5
Модифицированный биотинсвязывающий белок по способу 3 или 4, где 1) остаток аргинина в положении 104 SEQ ID NO: 2 и/или 2) остаток лизина в положении 141 SEQ ID NO: 2 заменены остатком глутаминовой кислоты;
Способ 6
Модифицированный биотинсвязывающий белок по любому из способов с 1 по 5, где остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина;
Способ 7
Модифицированный биотинсвязывающий белок по любому из способов с 1 по 6, который выбран из группы, состоящей из:
модифицированного биотинсвязывающего белка (R104E-K141E), в котором остаток аргинина в положении 104 SEQ ID NO: 2 заменен остатком глутаминовой кислоты, и остаток лизина в положении 141 заменен остатком глутаминовой кислоты;
модифицированного биотинсвязывающего белка (D40N-R104E), в котором остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина, и остаток аргинина в положении 104 заменен остатком глутаминовой кислоты;
модифицированного биотинсвязывающего белка (D40N-K141E), в котором остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина, и остаток лизина в положении 141 заменен остатком глутаминовой кислоты; и
модифицированного биотинсвязывающего белка (D40N-R104E-K141E), в котором остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина, остаток аргинина в положении 104 заменен остатком глутаминовой кислоты и остаток лизина в положении 141 заменен остатком глутаминовой кислоты;
Способ 8
Модифицированный биотинсвязывающий белок по любому из способов с 1 по 7, который удовлетворяет, по меньшей мере, одному требованию, выбранному из следующих требований от a) до l):
a) аспарагиновый остаток в положении 14 SEQ ID NO: 2 не модифицирован или заменен глутамином или аспарагиновой кислотой;
b) остаток серина в положении 18 SEQ ID NO: 2 не модифицирован или заменен треонином или тирозином;
c) остаток тирозина в положении 34 SEQ ID NO: 2 не модифицирован или заменен серином, треонином или фенилаланином;
d) остаток серина в положении 36 SEQ ID NO: 2 не модифицирован или заменен треонином или тирозином;
e) остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 не модифицирован или заменен аспарагином;
f) остаток триптофана в положении 69 SEQ ID NO: 2 не модифицирован;
g) остаток серина в положении 76 SEQ ID NO: 2 не модифицирован или заменен треонином или тирозином;
h) остаток треонина в положении 78 SEQ ID NO: 2 не модифицирован или заменен серином или тирозином;
i) остаток триптофана в положении 80 SEQ ID NO: 2 не модифицирован;
j) остаток триптофана в положении 96 SEQ ID NO: 2 не модифицирован;
k) остаток триптофана в положении 108 SEQ ID NO: 2 не модифицирован; и
l) остаток аспарагиновой кислоты в положении 116 SEQ ID NO: 2 не модифицирован или заменен глутаминовой кислотой или аспарагином;
Способ 9
Модифицированный биотинсвязывающий белок по способу 1, включающий аминокислотную последовательность, идентичную на 90% или более последовательности, представленной SEQ ID NO: 2;
Способ 10
Модифицированный биотинсвязывающий белок по любому из способов с 1 по 9, который удовлетворяет, по меньшей мере, одному свойству, выбранному из следующих свойств от i) до iv):
i) обладающий изоэлектрической точкой, более низкой, чем точка белка, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 2;
ii) проявляющий более низкое неспецифическое связывание с нуклеиновыми кислотами и/или белками по сравнению с белком, состоящим из аминокислотной последовательности, представленной SEQ ID NO: 2;
iii) проявляющий более низкую фибронектинсвязывающую активность по сравнению с белком, состоящим из аминокислотной последовательности, представленной SEQ ID NO: 2; и
iv) проявляющий более высокую биотинсвязывающую активность по сравнению с белком, состоящим из аминокислотной последовательности, представленной SEQ ID NO: 2;
Способ 11
Модифицированный биотинсвязывающий белок, включающий аминокислотную последовательность, представленную SEQ ID NO: 2, аминокислотную последовательность, обладающую мутациями от одной до нескольких аминокислот в последовательности, представленной SEQ ID NO: 2, или аминокислотную последовательность, идентичную на 80% или более последовательности, представленной SEQ ID NO: 2, и обладающий биотинсвязывающей активностью, где остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина;
Способ 12
Модифицированный биотинсвязывающий белок по способу 11, где биотинсвязывающая активность является более высокой, чем у белка, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 2;
Способ 13
Нуклеиновая кислота, кодирующая белок по любому из способов от 1 до 12;
Способ 14
Вектор, содержащий нуклеиновую кислоту по способу 13; и
Способ 15
Носитель, с которым иммобилизован белок по любому из способов с 1 по 12.
Предпочтительные варианты осуществления для выполнения настоящего изобретения будут описаны ниже.
Тамавидин
Тамавидины представляют собой новые биотинсвязывающие белки, которые обнаружены в съедобном грибе Pleurotus cornucopiae (патент WO 02/072817). В этом документе показано:
- что тамавидин 1 и тамавидин 2 характеризуются 65,5% гомологией аминокислот и прочно связываются с биотином;
- что тамавидин 2 в высокой степени экспрессируется в растворимых фракциях в Escherichia coli; и
- что, когда тамавидин 2 экспрессирован в Escherichia coli, 4,5-часовая культура дает очищенный рекомбинантный белок высокой степени чистоты в количестве от приблизительно 1 мг на 50 мл культуры; это очень высокая величина, даже более высокая, чем величины для авидина и стрептавидина, которые известны как биотинсвязывающие белки.
Применяемый в настоящем описании термин «тамавидин 2» обозначает тамавидин 2 или его варианты. В настоящем изобретении предлагается модифицированный TM2 путем модификации конкретного аминокислотного остатка TM2 или его вариантов, который демонстрирует неспецифическое связывание с нуклеиновыми кислотами и/или белками. В настоящем описании «тамавидин 2» и «TM2» относятся к TM2 дикого типа или к его вариантам, если конкретно не указано иначе. Однако эти термины могут быть использованы как родовое название, включающее модифицированный TM2 настоящего изобретения, TM2 дикого типа, вариантного типа и TM2 модифицированного типа, в зависимости от контекста. Кроме того, так как TM2 проявляет биотинсвязывающую активность, он может быть обозначен в настоящем описании как «биотинсвязывающий белок».
Конкретно, TM2 (дикого типа) обычно может представлять собой белок, включающий аминокислотную последовательность SEQ ID NO: 2 или белок, кодируемый нуклеиновой кислотой, включающей нуклеотидную последовательность SEQ ID NO: 1. Альтернативно, TM2 может представлять собой вариант белка, включающий аминокислотную последовательность SEQ ID NO: 2 или варианты белок, кодируемые нуклеиновой кислотой, включающей нуклеотидную последовательность SEQ ID NO: 1, где варианты обладают биотинсвязывающей активностью, эквивалентной активности тамавидина 2. Варианты TM2 могут представлять собой белок, включающий аминокислотную последовательность с делецией, заменой, вставкой и/или добавлением одной или более аминокислот в аминокислотной последовательности SEQ ID NO: 2, в которой биотинсвязывающая активность эквивалентна активности TM2. Замена может представлять собой консервативную замену, что означает замещение определенного аминокислотного остатка другим остатком, имеющим сходные физические и химические характеристики. Не ограничивающие примеры консервативной замены включают замену одного аминокислотного остатка, содержащего алифатическую группу (например, Ile, Val, Leu или Ala), другим и замену одного полярного остатка другим, как замены между Lys и Arg, или Glu и Asp, или Gln и Asn.
Варианты или мутанты в результате делеций, замен, вставок и/или добавления аминокислот могут быть получены из ДНК, кодирующей природный белок, путем применения хорошо известного способа, например, сайт-специфического мутагенеза (смотри, например, статью в Nucleic Acid Research, Vol. 10, No. 20, p. 6487-6500, 1982, включенную в настоящее описание в качестве ссылки в полном объеме). Применяемое в настоящем описании выражение «одна или более аминокислот» обозначает возможное количество аминокислот, которые могут быть удалены, заменены, вставлены или добавлены с помощью сайт-специфического мутагенеза. Необходимо также отметить, что применяемое в настоящем описании выражение «одна или более аминокислот» может иногда обозначать одну или несколько аминокислот.
Сайт-специфический мутагенез может быть осуществлен следующим образом с использованием синтетических олигонуклеотидных праймеров, которые комплементарны одноцепочечной ДНК фага, подвергаемой мутации, за исключением конкретной ошибки спаривания, которая соответствует желаемой мутации. Более конкретно, указанные выше синтетические олигонуклеотиды используются в качестве праймеров для синтеза цепи, комплементарной фагу, и клетка-хозяин трансформируется полученной двуспиральной ДНК. Культура трансформированной клетки высевается в агар, и из одиночных содержащих фаг клеток образуются бляшки. Затем, теоретически 50% новых колоний содержат фаги, обладающие мутацией в одной цепи, а оставшиеся 50% имеют исходную последовательность. Полученные бляшки гибридизуют с синтетическим зондом, меченным обработкой киназой, при температуре, которая позволяет гибридизоваться с теми колониями, которые характеризуются полным совпадением ДНК, обладающей указанной выше желаемой мутацией, но не позволяет гибридизоваться с теми колониями, которые имеют исходную цепь. Затем бляшки, которые гибридизуются с зондом, собирают и культивируют для получения ДНК.
Отмечается, что методы введения делеции, замены, вставки и/или добавления одной или более аминокислот в аминокислотную последовательность биологически активного пептида при сохранении его активности включают не только указанный выше сайт-специфический мутагенез, но также метод, который включает обработку гена мутагеном, а также метод, который включает селективное расщепление гена, затем удаление, замену, вставку или добавление выбранного нуклеотида и наконец, сшивку расщепленных фрагментов. Более конкретно, используемый в настоящем изобретении TM2 представляет собой белок, который состоит из аминокислотной последовательности с делецией, заменой, вставкой или добавлением от одной до десяти аминокислот в аминокислотную последовательность SEQ ID NO: 2, и который обладает биотинсвязывающей активностью.
Вариант или мутант TM2 может также представлять собой белок, который включает аминокислотную последовательность, идентичную, по меньшей мере, на 80%, предпочтительно идентичную, по меньшей мере, на 85%, идентичную, по меньшей мере, на 90%, идентичную, по меньшей мере, на 95%, идентичную, по меньшей мере, на 96%, идентичную, по меньшей мере, на 97%, идентичную, по меньшей мере, на 98%. или идентичную, по меньшей мере, на 99%, и более предпочтительно идентичную, по меньшей мере, на 99,3% аминокислотной последовательности SEQ ID NO: 2, и который обладает сходной с TM2 биотинсвязывающей активностью.
Процент идентичности между двумя аминокислотными последовательностями может быть определен с помощью визуального обследования и математического расчета. Альтернативно, процент идентичности двух белковых последовательностей может быть определен с помощью сравнения информации о последовательностях с использованием компьютерной программы GAP, которая основывается на алгоритме Needleman, S.B. and Wunsch, C.D. (J. Mol. Biol., 48: 443-453, 1970), и которая имеется в распоряжении University of Wisconsin Genetics Computer Group (UWGCG). Предпочтительные параметры по умолчанию для программы GAP включают: (1) матрицу подсчета очков blosum 62, как описано Henikoff, S. and Henikoff, J.G. (Proc. Natl. Acad. Sci. USA 89: 10915-10919, 1992); (2) 12 очков за пробел; (3) 4 очка за длину пробела; и (4) отсутствие штрафа за концевые пробелы.
Для сравнения последовательностей могут быть также использованы другие программы, применяемые специалистами в данной области техники. Процент идентичности может быть определен путем сравнения с информацией о последовательностях с использованием программы BLAST, описной, например, в Altschul et al. (Nucl. Acids. Res., 25, p. 3389-3402, 1997). Эта программа может быть доступна по интернету на вебсайте национального центра биотехнологической информации (NCBI) или из банка данных по ДНК Японии (DDBJ). Различные условия (параметры) для поиска идентичности с помощью программы BLAST подробно даны на этих вебсайтах, и часть установок может варьироваться подходящим образом, хотя поиск обычно осуществляют с использованием величин по умолчанию. Альтернативно, процент идентичности между двумя аминокислотными последовательностями может быть определен с помощью программы, такой как компьютерная программа обработки генетической информации GENETYX Ver. 7 (Genetyx) или алгоритма FASTA. В этом альтернативном случае поиск может быть осуществлен с использованием величин по умолчанию.
Процент идентичности между последовательностями двух нуклеиновых кислот может быть определен с помощью визуального обследования и математического расчета, или боле предпочтительно путем сравнения информации о последовательностях с использованием компьютерной программы. Обычной предпочтительной компьютерной программой является пакет Wisconsin, версия 10.0 программы GAP от Genetics Computer Group (GCG; Madison, State of Wisconsin) (Devereux et al., Nucl. Acids Res. 12: 387, 1984). При использовании этой программы GAP можно осуществить сравнение не только последовательностей двух нуклеиновых кислот, но также двух аминокислотных последовательностей и сравнение последовательности нуклеиновой кислоты и аминокислотной последовательности. В настоящем описании предпочтительные параметры по умолчанию для программы GAP включают: (1) использование программы GCG одинарной матрицы сравнения (содержащей величину 1 для идентичных и 0 для неидентичных) для нуклеотидов, и взвешенную матрицу сравнения аминокислот по Gribskov and Burgess, Nucl. Acids Res. 14: 6745, 1986, как описано Schwartz and Dayhoff, eds., Atlas of Polypeptide Sequence and Structure, National Biomedical Research Foundation, pp. 353-358, 1979, или другие применяемые матрицы сравнения; (2) штраф 30 за каждый аминокислотный пробел и дополнительный штраф 1 за каждый символ в каждом пробеле или штраф 50 за каждый пробел в нуклеотидной последовательности и дополнительный штраф 3 за каждый символ в каждом пробеле; (3) отсутствие штрафа за концевые пробелы; и (4) отсутствие максимального штрафа за длинные пробелы. Другие программы сравнения последовательностей, которые используются специалистами в данной области техники и которые могут быть использованы в настоящем изобретении, включают программу BLAST, версия 2.2.7, которая может быть загружена в вебсайта US National Library of Medicine (http://www.ncbi.nlm.nih.gov/blast/bl2seq/bls.html), или алгоритм UW-BLAST 2.0. Установки стандартных параметров по умолчанию для UW-BLAST 2.0 описаны на следующем вебсайте: http://blast.wustl.edu. Кроме того, в алгоритме BLAST используется матрица подсчета очков для аминокислот BLOSUM 62 и параметры отбора, которые могут применяться следующим образом: (A) включение фильтра для маскированных сегментов запрашиваемой последовательности, обладающей низкой композиционной сложностью (при определении с помощью программы SEG от Wootton and Federhen (Computers and Chemistry, 1993); смотри также Wootton and Federhen, “Analysis of compositionally biased regions in sequence databases” в Methods Enzymol., 266: 544-71, 1996) или для маскированных сегментов, включающих внутренние повторы короткой периодичности (при определении с помощью программы XNU от Claverie and States (Computers and Chemistry, 1993)); и (B) ожидаемые вероятности совпадения, которое ожидается найти только случайно в соответствии со статистической моделью порогов или E-множеств (Karlin and Altschul, 1990), статистически значимых различий для сообщения о совпадении с последовательностями базы данных (если статистически достоверное различие, обусловленное определенным совпадением выше, чем порог E-множества, о совпадении не сообщается); численная величина предпочтительного порога E-множества составляет либо 0,5, либо в возрастающем порядке предпочтения 0,25, 0,1, 0,05, 0,01, 0,001, 0,0001, 1e-5, 1e-10, 1e-15, 1e-20, 1e-25, 1e-30, 1e-40, 1e-50, 1e-75 или 1e-100.
Вариант или мутант TM2 может также представлять собой белок, который кодируется нуклеиновой кислотой, включающей нуклеотидную последовательность, которая гибридизуется с цепью, комплементарной нуклеотидной последовательности SEQ ID NO: 2 в жестких условиях, и который обладает такой же биотинсвязывающей активностью, что и TM2.
Применяемое в настоящем описании выражение «в жестких условиях» обозначает гибридизацию в условиях умеренной или высокой жесткости. Конкретно, условия умеренной жесткости могут быть легко определены специалистами в данной области техники на основе, например, длины ДНК. Основные условия сформулированы в книге Sambrook et al. Molecular Cloning: A Laboratory Manual, 3rd ed. Chapter 6, Cold Spring Harbor Laboratory Press, 2001, и включают использование: раствора для предварительной промывки 5×SSC, 0,5% SDS и 1,0 мМ ЭДТА (pH 8,0); условия гибридизации - приблизительно 50% формамид, 2×SSC-6×SSC, предпочтительно 5-6×SSC и 0,5% SDS, при приблизительно 42°C (или другие сходные условия гибридизации, такие как раствор Старка в приблизительно 50% формамиде при приблизительно 42°C); и условия промывки при приблизительно 50-68°C, 0,1-6×SSC и 0,1% SDS. Предпочтительно условия умеренной жесткости включают условия гибридизации (и условия промывки) приблизительно 50°C, 6×SSC и 0,5% SDS. Условия высокой жесткости также могут быть легко определены специалистом в данной области техники на основе, например, длины ДНК.
Обычно такие условия включают гибридизацию при более высоких температурах и/или при более низких концентрациях солей, чем при условиях умеренной жесткости (например, гибридизацию в присутствии приблизительно 0,5% SDS при приблизительно 65°C с от 6×SSC до 0,2×SSC, предпочтительно 6×SSC, более предпочтительно 2×SSC, даже более предпочтительно 0,2×SSC, или 0,1×SSC), и/или промывку, и они могут быть определены как условия гибридизации описанного выше типа и включают промывку при приблизительно 65-68°C в 0,2-0,1×SSC и 0,1% SDS. В буферном растворе для использования при гибридизации и промывки SSC (1×SSC состоит из 0,15М NaCl и 15 мМ цитрата натрия) может быть заменен на SSPE (1×SSPE состоит из 0,15М NaCl, 10 мМ NaH2PO4 и 1,25 мМ ЭДТА; pH 7,4), и промывка осуществляется в течение приблизительно от 15 минут до одного часа после завершения гибридизации.
Если это желательно, может быть использован коммерческий набор для гибридизации, в котором в качестве зонда не используется радиоактивное вещество. Конкретным примером является гибридизация, в которой применяется система ECL прямого промечивания и определения (продукт Amersham). Жесткая гибридизация может быть осуществлена при 42°С в течение 4 часов после добавления к буферу для гибридизации набора блокирующего агента и NaCl в количествах, соответствующих 5% (масс./об.) и 0,5М; промывка может быть осуществлена дважды в 0,4% SDS и 0,5×SSC в течение 20 минут каждая при 55°С, затем однократно в 2×SSC в течение 5 минут при комнатной температуре.
Биотинсвязывающая активность вариантов или мутантов TM2 может быть измерена с помощью любого из известных методов. Например, она может быть определена с помощью метода, основанного на флуоресцентном биотине, как описано в статье Kada et al. (Biochim. Biophys. Acta., 1427: 33-43 (1999)). Этот метод представляет собой тест-систему, в которой используется такая природа флуоресцентного биотина, что если он связывается с биотинсвязывающим сайтом в биотинсвязывающем белке, то интенсивность его флуоресценции затухает. Альтернативно, биотинсвязывающая активность вариантов или мутантных белков может быть также оценена с использованием сенсора, способного измерить связывание белка с биотином, такого как биосенсор, работающий по принципу поверхностного плазмонного резонанса.
В модифицированном тамавидине по настоящему изобретению аминокислотные остатки, которые желательно не подвергать модификации, будут описаны ниже.
Модифицированный тамавидин, в котором неспецифическое связывание понижено по настоящему изобретению
Модифицированный TM2 настоящего изобретения включает аминокислотную последовательность, представленную SEQ ID NO: 2, аминокислотную последовательность, обладающую от одной до нескольких аминокислотных мутаций в последовательности, представленной SEQ ID NO: 2, или аминокислотную последовательность, идентичную последовательности, представленной SEQ ID NO: 2, на 80% или более, и обладающий биотинсвязывающей активностью, и отличается тем, что модифицированный TM2 представляет собой белок (TM2 дикого типа и вариантный тип TM2), в котором один или более остатков, выбранные из группы, состоящей из:
1) остатка аргинина в положении 104 SEQ ID NO: 2;
2) остатка лизина в положении 141 SEQ ID NO: 2;
3) остатка лизина в положении 26 SEQ ID NO: 2; и
4) остатка лизина в положении 73 SEQ ID NO: 2
заменены остатком кислой аминокислоты или остатком нейтральной аминокислоты.
Изоэлектрическая точка (pI) TM2 дикого типа, рассчитанная на основе его первичной структуры, составляет приблизительно 7,4, тогда как действительно измеренная величина составляет приблизительно от 8,2 до 8,6. Таким образом, TM2 дикого типа представляет собой белок с pI от нейтральной до слабокислой. Степень неспецифического связывания TM2 намного меньше, чем у авидина, и приблизительно равна таковой у стрептавидина, который является нейтральным белком.
Изобретатели настоящего изобретения провели исследования по дальнейшему снижению неспецифического связывания TM2. Они включают эксперименты с использованием TM2, в котором остаток основной аминокислоты модифицирован в остаток кислой или нейтральной аминокислоты, они были проведены на основе предположения о том, что даже в белке с pI от нейтральной до слабокислой, таком как TM2, неспецифическое связывание может быть дополнительно снижено путем снижения его pI.
Известно, что сродство связывания стрептавидина или авидина с биотином снижается в некоторых случаях в результате замены одной или нескольких аминокислот. Соответственно, в экспериментах выполнена модификация аминокислотных остатков, в то же время проведенная проверка, описанная ниже, показала, что не только снижается изоэлектрическая точка, но также не ослабляются прекрасные характеристики, т.е. высокая биотинсвязывающая способность TM2.
В результате интенсивных исследований изобретатели настоящего изобретения нашли, что модифицированный белок TM2, обладающий мутациями одного или более остатков, выбранных из группы, состоящей из:
1) остатка аргинина (R104) в положении 104 SEQ ID NO: 2;
2) остатка лизина (K141) в положении 141 SEQ ID NO: 2;
3) остатка лизина (K26) в положении 26 SEQ ID NO: 2; и
4) остатка лизина (K73) в положении 73 SEQ ID NO: 2,
удовлетворяет указанным выше требованиям как TM2 модифицированного типа настоящего изобретения, обладающий низкой pI. Таким образом, изобретение было выполнено.
Аминокислота после мутации представляет собой остаток кислой аминокислоты (аспарагиновой кислоты или глутаминовой кислоты) или остаток нейтральной аминокислоты (аспарагина, серина, глутамина, треонина, глицина, тирозина, триптофана, цистеина, метионина, пролина, фенилаланина, аланина, валина, лейцина или изолейцина).
Кроме того, так как неполярная аминокислота может вести к неспецифическому связыванию, обусловленному гидрофобному взаимодействию, остаток кислой или нейтральной аминокислоты предпочтительно обладает индексом гидрофобности 2 или менее. Индекс гидрофобности определяет степень гидрофобности каждого аминокислотного остатка, что описано, например, в статье Kyte and Doolittle, J. Mol. Biol., 157, 105-132 (1982), и хорошо известно специалистам в данной области техники. «Остатки кислых аминокислот или остатки нейтральных аминокислот, обладающие индексом гидрофобности 2 или менее» представляют собой аспарагиновую кислоту и глутаминовую кислоту, которые являются остатками кислых аминокислот, или аспарагин, серин, глутамин, треонин, глицин, тирозин, триптофан, метионин, пролин и аланин, которые являются остатками нейтральных аминокислот.
Более предпочтительно 1) остаток аргинина в положении 104 SEQ ID NO: 2 и/или 2) остаток лизина в положении 141 SEQ ID NO: 2 заменены кислым аминокислотным остатком или нейтральным аминокислотным остатком. Более предпочтительно 1) остаток аргинина в положении 104 SEQ ID NO: 2 и/или 2) остаток лизина в положении 141 SEQ ID NO: 2 заменены кислым аминокислотным остатком.
K26 предпочтительно заменен A (аланином), K73 предпочтительно заменен Q (глутамином), R104 предпочтительно заменен E (глутаминовой кислотой) или D (аспарагиновой кислотой), и K141 предпочтительно заменен E (глутаминовой кислотой) или D (аспарагиновой кислотой); и R104 более предпочтительно заменен E, и K141 более предпочтительно заменен E.
Модифицированный TM2 настоящего изобретения, обладающий низкой pI, имеет изоэлектрическую точку, которая существенно ниже, чем у TM2 дикого типа. Конкретно, в пунктах 1-8) примера 1 выявлено, что изоэлектрическая точка каждого модифицированного TM2, обладающего мутацией, снижена на 1 или более по сравнению с изоэлектрической точкой TM2 дикого типа.
Результаты показывают, что модифицированный белок TM2 настоящего изобретения характеризуется более низким неспецифическим связыванием с нуклеиновыми кислотами и/или белками по сравнению со связыванием белка TM2 дикого типа или мутантного типа. Конкретно, в пунктах 1-11) примера 1 выявлено снижение неспецифического связывания с ДНК. Более того, в пунктах 1-9) примера 1 выявлено снижение неспецифической адсорбции сывороточного белка. Неспецифическое связывание и адсорбция оба снижаются до приблизительно 60% от связывания TM2 дикого типа в результате мутации K26, K73 или K141. В R104-K141 (оба R104 и K141 мутированы) неспецифическое связывание и адсорбция оба снижаются до уровня, близкого к 20% от связывания TM2. Напротив, хотя сообщалось о снижении неспецифического связывания с ДНК или клетками авидина с мутантными основными аминокислотами (Marttila, et al., (2000) FEBS, 467, pp. 31-36), о таком большом снижении неспецифического связывания с сывороточным белком не сообщалось.
Исследование связывания модифицированного TM2 настоящего изобретения, обладающего низкой pI, с фибронектином выявило существенное снижение связывания фибронектина. Фибронектин представляет собой молекулу клеточной адгезии, присутствующую во внеклеточном матриксе, и вызывает фоновый шум особенно при определении белка в плазме или сыворотке. Таким образом, более низкое связывание с фибронектином является предпочтительным. Как показано в пунктах 1-10) примера 1, уровень связывания фибронектина снижен у всех мутантов по сравнению с TM2. В частности, уровни связывания фибронектина с K141 и R104-K141 оба существенно снижаются до от 10 до 20% от уровня связывания TM2 дикого типа. Не было известно никакой взаимосвязи между величиной pI и фибронектинсвязывающей способностью, и действительно не наблюдалось никакой четкой корреляции между величиной pI и степенью снижения связывания фибронектина. В этом отношении снижение уровней связывания фибронектина с мутантами K141 и R104-K141 является непредсказуемо очень большим.
В одном предпочтительном модифицированном TM2 настоящего изобретения, у которого снижено связывание с фибронектином, лизин в положении 141 в аминокислотной последовательности TM2 модифицирован в кислую аминокислоту или нейтральную аминокислоту, более предпочтительно модифицирован в кислую аминокислоту или нейтральную аминокислоту, обладающую индексом гидрофобности 2 или менее, более предпочтительно модифицирован в E (глутаминовую кислоту) или D (аспарагиновую кислоту) и наиболее предпочтительно в E.
Альтернативно, в другом модифицированном TM2, у которого снижено связывание с фибронектином, R104 и K141, каждый модифицирован в кислую аминокислоту или нейтральную аминокислоту, более предпочтительно каждый модифицирован в кислую аминокислоту или нейтральную аминокислоту, обладающую индексом гидрофобности 2 или менее, более предпочтительно модифицирован в E (глутаминовую кислоту) или D (аспарагиновую кислоту) и наиболее предпочтительно в E.
Модифицированный тамавидин, обладающий улучшенной биотинсвязывающей способностью
TM2 очень прочно связывается с биотином с константой скорости ассоциации (ka) 9,19×105 (М-1 сек-1), константой скорости диссоциации (kd) 6,83×10-6 (сек-1) и константой диссоциации (KD) 7,43×10-12 (М). ka, kd и KD стрептавидина, другого биотинсвязывающего белка, измеренные сходным образом, составляли, соответственно 2,28×106 (М-1 сек-1), 2,52×10-6 (сек-1) и 1,11×10-12 (М). Это значит, что прочность связывания TM2 с биотином того же порядка, что и прочность связывания стрептавидина, но слегка ниже, чем у стрептавидина (патент WO 2008/081938 A1). Для того чтобы биотинсвязывающий белок связывался с биотином более быстро или в большем количестве, желательна более высокая биотинсвязывающая способность.
Изобретатели настоящего изобретения успешно получили высокоаффинный модифицированный TM2, обладающий дополнительно улучшенной биотинсвязывающей способностью, путем модификации аминокислотных остатков TM2 дикого типа, обладающего высокой исходной биотинсвязывающей способностью. В высокоаффинном TM2 настоящего изобретения, по меньшей мере, остаток аспарагиновой кислоты в положении 40 (D40) в аминокислотной последовательности SEQ ID NO: 2, представляющей TM2, модифицирован. Аминокислотой после модификации предпочтительно является N (аспарагин).
Модификация D40 может быть осуществлена в сочетании с модификацией R104, K141, K26 и/или K73 для снижения описанного выше неспецифического связывания (способ 6), или может быть осуществлена в одиночку (способ 11). Как показано в примерах 2 и 3, модифицированный TM2, в котором модифицирован D40, обладает биотинсвязывающей активностью, существенно более высокой, чем активность TM2 дикого типа.
Модифицированный тамавидин, обладающий сниженным неспецифическим связыванием и улучшенной биотинсвязывающей способностью
Модифицированный тамавидин, полученный с помощью сочетанных мутаций аминокислот описанного выше «модифицированного тамавидина со сниженным неспецифическим связыванием» и «модифицированного тамавидина с повышенной биотинсвязывающей способностью», характеризовался сниженным неспецифическим связыванием и повышенной таким образом биотинсвязывающей способностью. Полученный таким образом модифицированный тамавидин содержит мутацию, по меньшей мере, одного аминокислотного остатка из K26, K73, R104 и K141 в аминокислотной последовательности TM2, и дополнительно содержит мутацию аминокислотного остатка D40, замененного мутацией на N (способ 6).
Аминокислота после мутации K26, K73, R104 и/или K141 представляет собой кислую или нейтральную аминокислоту, предпочтительно кислую или нейтральную аминокислоту, обладающую индексом гидрофобности 2 или менее (Kyte and Doolittle, J. Mol. Biol., 157, 105-132 (1982)). Более предпочтительно K26 мутирован в A (аланин), K73 мутирован в Q (глутамин), R104 мутирован в E (глутаминовую кислоту) или D (аспарагиновую кислоту) и K141 мутирован в E (глутаминовую кислоту) или D (аспарагиновую кислоту); и более предпочтительно R104 мутирован в E, и K141 мутирован в E.
В модифицированном тамавидине, в котором модифицированы как R104, так и D40, наблюдалось повышение сродства и снижение неспецифического связывания с белком (в пунктах 3-7) и 3-9) примера 3).
Модифицированный тамавидин, в котором модифицированы все R104, K141 и D40, характеризовался снижением изоэлектрической точки, повышением сродства, снижением неспецифического связывания с белками, снижением фибронектинсвязывающей способности и снижением неспецифического связывания с нуклеиновыми кислотами (в пунктах 3-6), 3-7) 3-9), 3-10) и 3-11) примера 3). Более того, неожиданно оказалось, что заметно улучшилась устойчивость структуры белка к нагреванию (в пунктах 3-8) примера 3).
Соответственно, предпочтительно модифицировать оба аминокислотных остатка D40 и R104 и более предпочтительно модифицировать все остатки D40, R104 и K141.
Как описано выше, модифицированный TM2 настоящего изобретения предпочтительно, но, не ограничиваясь этим, выбран из группы, состоящей из:
модифицированного биотинсвязывающего белка (D40N-R104E), в котором остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина, и остаток аргинина в положении 104 заменен остатком глутаминовой кислоты;
модифицированного биотинсвязывающего белка (D40N-K141E), в котором остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина, и остаток лизина в положении 141 заменен остатком глутаминовой кислоты; и
модифицированного биотинсвязывающего белка (D40N-R104E-K141E), в котором остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина, остаток аргинина в положении 104 заменен остатком глутаминовой кислоты и остаток лизина в положении 141 заменен остатком глутаминовой кислоты.
В предпочтительном варианте осуществления модифицированный белок TM2 настоящего изобретения включает, например, любую из аминокислотных последовательностей SEQ ID NO: 8, 10, 16, 20, 22, 24 и 25.
Более предпочтительными являются D40N-R104E, D40N-K141E и D40N-R104E-K141Eи наиболее предпочтительным является D40N-R104E-K141E.
Модифицированный белок TM2 настоящего изобретения удовлетворяет, по меньшей мере, одному свойству, выбранному из следующих свойств от i) до iv):
i) обладает изоэлектрической точкой, более низкой, чем точка белка, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 2;
ii) проявляет более низкое неспецифическое связывание с нуклеиновыми кислотами и/или белками по сравнению с белком, состоящим из аминокислотной последовательности, представленной SEQ ID NO: 2;
iii) проявляет более низкую фибронектинсвязывающую активность по сравнению с белком, состоящим из аминокислотной последовательности, представленной SEQ ID NO: 2; и
iv) проявляет более высокую биотинсвязывающую активность по сравнению с белком, состоящим из аминокислотной последовательности, представленной SEQ ID NO: 2.
В отношении свойства i), так как изоэлектрическая точка TM2 дикого типа составляет приблизительно от 8,5 до 8,8, изоэлектрическая точка модифицированного TM2 настоящего изобретения составляет предпочтительно 8,0 или менее и более предпочтительно 7,7 или менее.
В отношении свойства iii), тогда как фибронектинсвязывающее свойство TM2 дикого типа определено как составляющее от 1,3 до 1,4, фибронектинсвязывающая активность модифицированного TM2 настоящего изобретения предпочтительно составляет 1,0 или менее, 0,25 или менее или 0,15 или менее.
Аминокислотный остаток, который желательно не модифицировать в модифицированном TM2 настоящего изобретения
Модификация аминокислотных остатков в модифицированном TM2 настоящего изобретения не должна влиять на биотинсвязывающую активность. В этой связи биотинсвязывающий карман стрептавидина, одного биотинсвязывающего белка, уже в некоторой степени выявлен. Гомология аминокислот между стрептавидином и TM2 составляет только приблизительно 50%. Изобретатели настоящего изобретения сравнили аминокислотные последовательности TM2 и стрептавидина, для того чтобы получить информацию о биотинсвязывающем кармане TM2. В результате было обнаружено, что среди аминокислот, образующих биотинсвязывающий карман стрептавидина, остатки, прямо взаимодействующие с биотином, т.е. N23, S27, Y43, S45, N49, W79, S88, T90, W92, W108, W120 и D128 (Weber, et al., (1989) Science 243: 85-88, Livnah, et al., (1993) Proc. Natl. Acad. Sci. U.S.A. 90: 5076-5080), соответствуют N14, S18, Y34, S36, D40, W69, S76, T78, W80, W96, W108 и D116 TM2, соответственно, и что биотинсвязывающий карман в высокой степени консервативен.
Отличием было только то, что N (аспарагин) в положении 49 стрептавидина в TM2 представляет собой D (аспарагиновую кислоту) в положении 40, и биотинсвязывающая способность TM2 D40N, в котором аспарагиновая кислота модифицирована в аспарагин, как в стрептавидине, повышалась, как описано выше. Эти результаты предполагают, что биотинсвязывающие карманы TM2 и стрептавидина обладают очень похожими структурами и что эти аминокислотные остатки существенно вовлечены в связывание с биотином.
В частности, так как четыре остатка триптофана (W69, W80, W96 и W108), как считается, являются очень важными частями структуры биотинсвязывающего кармана, предпочтительно, чтобы они не были модифицированы. В то же время, другие аминокислоты, которые есть в TM2, как считается, вовлечены в связывание с биотином, предпочтительным также является, чтобы аминокислотные остатки (N14, S18, Y34, S36, S76, T78 и D116), как предполагается, прямо взаимодействующие с биотином, не были модифицированы. Альтернативно, в том случае, когда эти остатки модифицированы, предпочтительно, чтобы аминокислоты были модифицированы в аминокислоты, обладающие сходными свойствами и структурами, так, чтобы сохранялась биотинсвязывающая способность. Например, аспарагин (N14) желательно модифицировать в глутамин (Q) или аспарагиновую кислоту (D) и предпочтительно в аспарагиновую кислоту; аспарагиновую кислоту (D40) желательно модифицировать в аспарагин (N); серин (S18, S36 и S76) модифицировать в треонин (T) или тирозин (Y) и предпочтительно в треонин; тирозин (Y34) желательно модифицировать в серин (S), треонин (T) или фенилаланин (F) и предпочтительно в фенилаланин; треонин (T78) желательно модифицировать в серин (S) или тирозин (Y) и предпочтительно в серин; и аспарагиновую кислоту (D116) желательно модифицировать в глутаминовую кислоту (E) или аспарагин (N) и предпочтительно в аспарагин.
Способ модификации аминокислоты
Модифицированный TM2 настоящего изобретения может быть получен путем модификации аминокислоты или аминокислот TM2 с помощью известного метода, который вызывает мутацию в аминокислотной последовательности без какого-либо ограничения. Предпочтительно модификация достигается путем получения нуклеотидной последовательности нуклеиновой кислоты, кодирующей модифицированный белок настоящего изобретения.
Например, для того чтобы модифицировать аминокислоту в конкретном положении аминокислотной последовательности, может быть применен метод, использующий ПЦР (Higuchi, et al., (1988), Ho, et al., (1989)). Это означает, что проводят ПЦР с использованием праймера, содержащего ошибочно спаренный кодон для мутации-мишени, с получением ДНК, кодирующей целевой мутант, и позволяют ДНК экспрессировать целевой мутант.
Варианты или мутанты, возникшие в результате делеций, замен, вставок и/или добавок, могут быть получены из природной ДНК, кодирующей белок, путем применения хорошо известного метода, например, сайт-специфического мутагенеза (смотри, например, журнал Nucleic Acid Research, Vol. 10, No. 20, p. 6487-6500, 1982, включенный в настоящее описание в качестве ссылки в полном объеме). Сайт-специфический мутагенез может быть осуществлен следующим образом с использованием синтетических олигонуклеотидных праймеров, которые комплементарны одноцепочечной ДНК фага, подвергаемой мутации, за исключением конкретной ошибки спаривания, которая соответствует желаемой мутации. Более конкретно, указанные выше синтетические олигонуклеотиды используются в качестве праймеров для синтеза цепи, комплементарной фагу, и клетку-хозяина трансформируют полученной двуспиральной ДНК. Культуру трансформированных клеток высевают на агар, и из одиночных клеток, содержащих фаг, образуются бляшки. Затем теоретически 50% новых колоний содержат фаги, обладающие мутацией в одной цепи, и оставшиеся 50% имеют исходную последовательность. Полученные бляшки гибридизуют с синтетическим зондом, меченным обработкой киназой, при температуре, которая позволяет гибридизоваться с теми колониями, которые проявляют полное спаривание с ДНК, обладающей указанной выше желаемой мутацией, но не позволяет гибридизоваться с теми колониями, которые имеют исходную цепь. Затем бляшки, которые гибридизуются с зондом, собирают и культивируют для получения ДНК.
Нуклеиновая кислота, кодирующая модифицированный белок тамавидин 2 (TM2)
В настоящем изобретении предлагается нуклеиновая кислота, кодирующая модифицированный TM2 настоящего изобретения. Нуклеиновая кислота включает, например, нуклеотидную последовательность, полученную с помощью модификации нуклеотидной последовательности (SEQ ID NO: 1) TM2 в нуклеотидную последовательность, кодирующую модифицированный белок TM2, обладающий модифицированной аминокислотой или модифицированными аминокислотами. Нуклеотидная последовательность, подвергаемая модификации, не ограничивается до тех пор, пока нуклеотидная последовательность после модификации кодирует модифицированную аминокислоту или модифицированные аминокислоты. Их примеры включают нуклеиновую кислоту, обладающую нуклеотидной последовательностью, модифицируемой для обеспечения модификации настоящего изобретения в нуклеиновую кислоту, состоящую из нуклеотидной последовательности SEQ ID NO: 1, или нуклеиновую кислоту, которая гибридизуется с комплементарной цепью нуклеиновой кислоты, состоящей из нуклеотидной последовательности SEQ ID NO: 1, в жестких условиях, и кодирует белок, обладающий биотинсвязывающей активностью (обозначаемую в настоящем описании далее как «ген TM2»).
Нуклеиновая кислота настоящего изобретения предпочтительно кодирует аминокислотную последовательность: SEQ ID NO: 8, 10, 16, 20, 22, 24 или 25, и более предпочтительно кодирует аминокислотную последовательность SEQ ID NO: 22 или 24. Нуклеиновая кислота настоящего изобретения предпочтительно состоит из последовательности нуклеиновой кислоты: SEQ ID NO: 7, 9, 15, 19, 21 или 23, и более предпочтительно состоит из последовательности нуклеиновой кислоты SEQ ID NO: 21 или 23.
Вектор, содержащий нуклеиновую кислоту настоящего изобретения
В настоящем изобретении предлагается вектор, содержащий нуклеиновую кислоту, кодирующую модифицированный белок TM2. Вектор представляет собой экспрессионный вектор для экспрессии модифицированного белка TM2.
Нуклеиновая кислота, кодирующая модифицированный белок TM2 настоящего изобретения, является нуклеиновой кислотой, описанной в разделе «Нуклеиновая кислота, кодирующая модифицированный белок тамавидин 2», и особенно не ограничивается.
Вектор может обладать сайтом узнавания ферментами рестрикции или последовательностью, используемой в системе Gateway (Invitrogen), такой как aatB1, aatB2 или aatB3, на одном конце или на обоих концах нуклеиновой кислоты, кодирующей модифицированный белок TM2. Более того, промотор и терминатор, которые работают в желаемых клетках-хозяевах, могут быть локализованы, соответственно, выше и ниже нуклеиновой кислоты, кодирующей модифицированный белок TM2.
Тип сайта узнавания ферментами рестрикции особенно не ограничивается, но экспрессионный вектор предпочтительно обладает только одним типом сайта узнавания. Количество сайтов узнавания особенно не ограничивается, но составляет один или более и предпочтительно 10 или более.
Более того, последовательность нуклеиновой кислоты, кодирующая линкерную аминокислотную последовательность (которая особенно не ограничивается и может представлять собой обычно используемую специалистами в данной области техники, например, последовательность, содержащую большое количество глицинов и серинов), состоящую, по меньшей мере, из одной аминокислоты, предпочтительно, по меньшей мере, из пяти аминокислот, более предпочтительно, по меньшей мере, из десяти аминокислот, более предпочтительно, по меньшей мере, из 25 аминокислот и самое большее из 50 аминокислот, может быть расположена между сайтом узнавания ферментом рестрикции и нуклеиновой кислотой модифицированного TM2, или между последовательностью aatB и нуклеиновой кислотой модифицированного TM2. Кроме того, например, могут быть расположены последовательности, кодирующие сайты узнавания энтерокиназой или протеазой, такой как фактор Xa, хотя это особенно не ограничивается.
Например, в том случае, если ген, кодирующий антитело, такое как scFv или Fab, вставлен в настоящий экспрессионный вектор в восстанавливающих условиях, не пригодных для экспрессии гибридного белка, такого как внутрицитоплазматический белок, последовательность нуклеиновой кислоты, кодирующая лидирующий пептид, такой как сигнальный пептид или сигнал секреции, может быть расположена между промотором и единицей, включающей последовательность для вставки нуклеиновой кислоты, кодирующей модифицированный тамавидин.
Вектор настоящего изобретения предпочтительно представляет собой экспрессионный вектор. В дополнение к такой экспрессионной единице экспрессионный вектор может включать единицу для разрешения репликации в желаемых клетках-хозяевах, например, ориджин репликации или маркерный ген устойчивости к лекарствам для селекции желаемых клеток-хозяев. Клетка-хозяин особенно не ограничивается, но предпочтительно представляет собой Escherichia coli. Кроме того, может быть включена подходящая система контроля экспрессии, такая как система репрессии лактозы в Escherichia coli.
Носитель для иммобилизации модифицированного тамавидина
В настоящем изобретении предлагается носитель для иммобилизации модифицированного белка TM2 настоящего изобретения.
Материал, составляющий носитель, может быть любым известным материалом, и примеры его включают, но не ограничиваются этим, целлюлозу, тефлон, нитроцеллюлозу, агарозу, декстран, хитозан, полистирол, полиакриламид, полиэфир, поликарбонат, полиамид, полипропилен, нейлон, полидивинилидендифторид, латекс, кремнезем, стекло, стекловолокно, золото, платину, серебро, медь, железо, нержавеющую сталь, феррит, кремниевую пластину, полиэтилен, полиэтиленимин, полимер молочной кислоты, смолы, полисахариды, белки (например, альбумин), углерод и их сочетания. Предпочтительный носитель обладает определенным уровнем прочности и стабильным составом и характеризуется низким неспецифическим связыванием.
Твердый носитель может иметь любую форму, включая, но, не ограничиваясь этим, шарики, магнитные шарики, тонкие пленки, микротрубочки, фильтры, планшеты, микропланшеты, углеродные нанотрубки и сенсорные микроматрицы. Плоские твердые носители, такие как тонкие пленки и планшеты, могут быть предоставлены с лунками, каналами, донными решетками фильтра или тому подобным, как это известно в данной области техники.
В варианте осуществления настоящего изобретения шарики могут иметь диаметр сферы в диапазоне от приблизительно 25 нм до приблизительно 1 мм. В предпочтительном варианте осуществления шарики могут иметь диаметр в диапазоне от приблизительно 50 нм до приблизительно 10 мкм. Размер шариков может быть выбран в зависимости от предназначаемой цели. Так как некоторые бактериальные споры имеют размер порядка приблизительно 1 мкм, предпочтительные шарики для захвата таких спор имеют диаметр больший, чем 1 мкм.
Иммобилизация белка на носителе особенно не ограничивается и может быть осуществлена с помощью известного метода связывания белка с носителем. Конкретно, подходящий метод может быть выбран специалистами в данной области техники в зависимости от типа носителя и тому подобного.
Преимущества изобретения
По настоящему изобретению предлагается модифицированный тамавидин, который проявляет улучшенные свойства, такие как снижение неспецифического связывания и/или дополнительно улучшение связывания биотина при сохранении характеристик тамавидина, т.е. высокой биотинсвязывающей способности. Использование модифицированного тамавидина для определения, например, в иммунотесте или методе гибридизации нуклеиновой кислоты, для измерения анализируемого соединения с использованием связывания авидин-биотин, может снизить фон, повысить чувствительность и поддержать свойство связывания с биотином в жестких условиях (например, при высокой температуре в присутствии денатурирующего агента и фермента).
Краткое описание фигур
[Фиг.1] На фиг.1 представлено неспецифическое связывание модифицированных белков TM2 настоящего изобретения с низкой pI с сывороточными белками, иммобилизованными на магнитных шариках (**p<0,01 по отношению к TM2).
[Фиг.2] На фиг.2 представлено неспецифическое связывание модифицированных белков TM2 настоящего изобретения с низкой pI с фибронектином (*p<0,01 по отношению к TM2).
[Фиг.3] На фиг.3 представлено неспецифическое связывание модифицированных белков TM2 настоящего изобретения с низкой pI с ДНК.
[Фиг.4] На фиг.4 представлена неспецифическая адсорбция сывороточного белка на магнитных шариках с иммобилизованным белком TM2 настоящего изобретения, характеризующимся низким неспецифическим связыванием/высокой аффинностью, (*p<0,1 по отношению к TM2).
[Фиг.5] На фиг.5 представлено неспецифическое связывание белков TM2 настоящего изобретения, характеризующихся низким неспецифическим связыванием/высокой аффинностью, с фибронектином (*p<0,01 по отношению к TM2).
[Фиг.6] На фиг.6 представлено неспецифическое связывание белков TM2 настоящего изобретения, характеризующихся низким неспецифическим связыванием/высокой аффинностью, с ДНК, где в верхней, средней и нижней колонках представлены результаты для TM2 дикого типа, TM2 R104EK141E и TM2 D40NR104EK141E, соответственно.
Примеры
Настоящее изобретение будет описано конкретно со ссылкой на последующие примеры, но примеры не предназначены для ограничения технического объема настоящего изобретения. Специалисты в данной области техники могут с легкостью добавлять модификации/изменения в настоящее изобретение на основе представленного в настоящем документе описания. И такие модификации/изменения включены в технический объем настоящего изобретения.
Пример 1: Создание и анализ TM2 с низкой pI
1-1) Создание TM2 с низкой pI
Для того чтобы снизить изоэлектрическую точку TM2, остаток основной аминокислоты в TM2 был заменен нейтральной аминокислотой или кислой аминокислотой для создания следующих семи мутантов.
(1) Мутант TM2, в котором лизин в положении 26 заменен аланином (в настоящем описании далее обозначается как "TM2 K26A"; его нуклеотидная последовательность представлена в SEQ ID NO: 3 и аминокислотная последовательность в SEQ ID NO: 4);
(2) Мутант TM2, в котором лизин в положении 73 заменен глутамином (в настоящем описании далее обозначается как "TM2 K73Q"; его нуклеотидная последовательность представлена в SEQ ID NO: 5 и аминокислотная последовательность в SEQ ID NO: 6);
(3) Мутант TM2, в котором аргинин в положении 104 заменен глутаминовой кислотой (в настоящем описании далее обозначается как "TM2 R104E; его нуклеотидная последовательность представлена в SEQ ID NO: 7 и аминокислотная последовательность в SEQ ID NO: 8);
(4) Мутант TM2, в котором лизин в положении 141 заменен глутаминовой кислотой (в настоящем описании далее обозначается как "TM2 K141E; его нуклеотидная последовательность представлена в SEQ ID NO: 9 и аминокислотная последовательность в SEQ ID NO: 10);
(5) Мутант TM2, в котором лизин в положении 33 заменен треонином, и лизин в положении 37 заменен аланином (в настоящем описании далее обозначается как "TM2 K33TK37A"; его нуклеотидная последовательность представлена в SEQ ID NO: 11 и аминокислотная последовательность в SEQ ID NO: 12);
(6) Мутант TM2, в котором лизин в положении 33 заменен треонином, лизин в положении 37 заменен аланином, и аргинин в положении 104 заменен глутаминовой кислотой (в настоящем описании далее обозначается как "TM2 K33TK37AR104E"; его нуклеотидная последовательность представлена в SEQ ID NO: 13 и аминокислотная последовательность в SEQ ID NO: 14); и
(7) Мутант TM2, в котором аргинин в положении 104 заменен глутаминовой кислотой, и лизин в положении 141 заменен глутаминовой кислотой (в настоящем описании далее обозначается как "TM2 R104EK141E"; его нуклеотидная последовательность представлена в SEQ ID NO: 15 и аминокислотная последовательность в SEQ ID NO: 16).
(8) Мутант TM2, в котором лизин в положении 19 заменен треонином (в настоящем описании далее обозначается как "TM2 K19T", его нуклеотидная последовательность представлена в SEQ ID NO: 17 и аминокислотная последовательность в SEQ ID NO: 18).
E в R104E и T и A в K33TK37A определены с помощью сравнения аминокислотных последовательностей TM2 и стрептавидина со ссылкой на соответствующие положения в последовательности стрептавидина. E в K141E определена со ссылкой на аминокислоту в соответствующем положении в последовательности тамавидина 1.
Сначала для того, чтобы создать TM2 с низкой pI, были созданы праймеры для введения каждой мутации: праймер Tm2NtermPci, состоящий из 5'-сайта гена TM2 и последовательности PciI, кодирующей сайт расщепления ферментами рестрикции (ACATGT), расположенной выше 5'-сайта, создан праймер Tm2CtermBam, состоящий из 3'-сайта гена TM2 и последовательности BamHI, кодирующей сайт расщепления ферментами рестрикции (GGATCC), расположенной ниже 3'-сайта, и серии смысловых праймеров, содержащих ошибочно спаренные кодоны для каждого мутанта, и их антисмысловые праймеры представляли собой следующее (SEQ ID NO: от 26 до 37):
Таблица 1: праймеры для создания TM2 с низкой pI
ACA ATG AAC TCA ACT CCA AGA TGG AAT TGA CTG CAA ACG CAG ACG
GTA CTC TCA CTG GAA AGT
Сверху SEQ ID NO: с 26 по 37
Сайты узнавания ферментами рестрикции подчеркнуты, и сайты мутаций показаны пунктирными линиями.
1-2) ПЦР
Для того чтобы создать ген TM2 с низкой pI, выполняли двухстадийную ПЦР. На первой стадии ПЦР при использовании плазмиды с вектором pTrc99A, содержащем в качестве матрицы ген TM2, 5'-сайт амплифицировали с использованием праймера Tm2NtermPci и антисмыслового праймера Tm2 K26A R, Tm2 K73Q R, Tm2 K33TK37A R, Tm2 R104E R или Tm2 K19T R, содержащих ошибочно спаренный кодон каждого мутанта, и 3'-сайт амплифицировали с использованием праймера Tm2CtermBam и смыслового праймера Tm2 K26A F, Tm2 K73Q F, Tm2 K33TK37A F, Tm2 R104E F или Tm2 K19T F, содержащих ошибочно спаренный кодон каждого мутанта.
В случае TM2 K141E мутация была введена в единственную реакцию ПЦР с использованием праймеров Tm2NtermPci и Tm2 K141E Bam.
ПЦР проводили при условиях реакции: 50 мкл реакционного раствора, содержащего матрицу ДНК (500 нг), буфер 10×Pyrobest (Takara, 5 мкл), 2,5 мМ dNTP (4 мкл), праймеры (25 пмоль, каждый), и 5 Ед/мкл ДНК-полимеразы Pyrobest (Takara, 0,5 мкл) и начинали с 3 мин при 96°С с последующими десятью циклами по 1 мин при 96°С, 1 мин при 55°С и 2 мин при 72°С и заканчивали с 6 мин при 72°С в системе с программируемым контролем температуры PC-700 (ASTEK). В результате продукты ПЦР, которые составляли приблизительно 120 п.н. TM2 K33TK37A и приблизительно 330 п.н. TM2 K R104E, получали в 5'-сайте и приблизительно 310 п.н. TM2 K33TK37A, приблизительно 100 п.н. TM2 K R104E и приблизительно 60 п.н. TM2 K19T получали в 3'-сайте. В случае TM2 K141E получали продукт ПЦР 430 п.н.
Эти продукты ПЦР подвергали электрофорезу на агарозе с использованием агарозы с низкой точкой плавления (SeaPlaqueGTG) в буфере TAE. Каждый фрагмент ДНК вырезали вместе с гелем и туда добавляли такое же, что и гель количество 200 мМ NaCl с последующей обработкой при 70°С в течение 10 мин для плавления геля. Этот образец подвергали экстракции фенолом, экстракции фенолом/хлороформом и экстракции хлороформом, каждой по одному разу, и фрагменты ДНК 5'-сайта и 3'-сайта собирали с помощью осаждения этанолом. Используя эти фрагменты в качестве матрицы, проводили вторую стадию ПЦР для создания генов, кроме TM2 K141E, с использованием праймеров Tm2NtermPci и Tm2CtermBam. Условия реакции были теми же, что и на первой стадии ПЦР. В результате получен каждый продукт ПЦР 430 п.н.
1-3) Клонирование
Фрагменты гена TM2 с низкой pI, полученные с помощью ПЦР, клонировали в вектор pCR4 Blunt TOPO (Invitrogen). Реакцию лигирования проводили в соответствии с инструкцией, прилагаемой к набору вектора. ДНК вводили в Escherichia coli TB1 с помощью электропорации, и ДНК плазмиды экстрагировали в соответствии с обычным методом (Sambrook, et al., 1989, Molecular Cloning, A laboratory manual, 2nd edition). Нуклеотидные последовательности продуктов ПЦР клонов, в которых была подтверждена вставка, определяли с обоих концов с использованием праймера M13 (Takara) с помощью флуоресцентного секвенатора ABI PRISM (Model 310 Genetic Analyzer, Perkin Elmer) для подтверждения модификации нуклеотида-мишени.
Плазмиду, в которой ген (его нуклеотидная последовательность была подтверждена) введен в CR4 Blupnt TOPO, дважды гидролизовали PciI и BamHI, и фрагмент ДНК собирали с помощью очистки в геле в соответствии с описанным выше методом. Фрагмент лигировали в экспрессионный вектор pTrc99A для Escherichia coli, который гидролизовали NcoI и BamHI заранее с использованием набора для лигирования (Takara). Продукт лигирования трансформировали в Escherichia coli TB1, и экстракцию ДНК плазмиды и анализ с помощью ферментов рестрикции проводили в соответствии с обычным методом для подтверждения присутствия вставленного гена для получения векторов, экспрессирующих белок TM2 с низкой pI, TM2 K26A/pTrc99A, TM2 K73Q/pTrc99A, TM2 K33TK37A, TM2 R104E/pTrc99A, TM2 K141E/pTrc99A и TM2 K19T/pTrc99A. Кроме того, ген, кодирующий TM2 R104EK141E, был создан путем введения мутации с помощью ПЦР с использованием вектора TM2 R104E/pTrc99A в качестве матрицы и с использованием праймеров Tm2NtermPci и Tm2 K141E Bam. Ген, кодирующий TM2 K33TK37AR104E, был создан путем введения мутации с помощью ПЦР с использованием вектора TM2 K33TK37A/pTrc99A в качестве матрицы и с использованием праймеров Tm2NtermPci и Tm2 K141E Bam и был клонирован с помощью того же метода, что и описанный выше.
1-4) Экспрессия TM2 с низкой pI в Escherichia coli
Escherichia coli TB1, трансформированную TM2/pTrc99A с низкой pI, инокулировали в культуральную среду LB (6 мл), содержащую антибиотик ампициллин (конечная концентрация: 100 мкг/мл), и культивировали со встряхиванием при 37°C до достижения поглощения 0,5 при 600 нм, ОП600, затем добавляли 1 мМ IPTG и далее культивировали со встряхиванием при 37°C в течение ночи. Escherichia coli собирали из 1 мл культурального раствора путем центрифугирования и суспендировали в 20 мМ фосфатном буфере (pH 7, 400 мкл) с последующим разрушением бактериальных клеток с помощью обработки ультразвуком. Раствор после разрушения центрифугировали (15000 об/мин) для получения растворимой фракции в виде супернатанта.
Растворимую фракцию подвергали анализу с помощью иммуноблотинга: растворимую фракцию и такой же объем буфера для образцов 2×SDS (250 мМ трис-HCl, pH 6,8, 20% 2-меркаптоэтанол, 20% SDS, 20% глицерин) смешивали и нагревали при 95°C в течение 10 минут с последующим разделением на SDS-PAGE для анализа иммуноблотингом с использованием антитела кролика против TM2 (PCT/JP2006/326260) в качестве первого антитела и антикроличьего антитела IgG, меченного щелочной фосфатазой (BIO-RAD), в качестве второго антитела. Результаты анализа иммуноблотингом показали, что выявлялась полоса около 15,5 кДа у каждой Escherichia coli, трансформированной TM2/pTrc99A с низкой pI, но полоса не выявлялась у Escherichia coli, трансформированных вектором pTrc99A, не содержащим ген TM2 с низкой pI. Размеры этих полос согласовывались с молекулярной массой, 15,5 кДа, мономера, предсказанной по аминокислотной последовательности TM2.
Образование тетрамера мутантов TM2 в неденатурированном состоянии было подтверждено в соответствии с методом Bayer, et al., (1996, Electrophoresis, 17(8), 1319-24). Это значит, что смешивали SDS буфер для образцов, не содержащий восстанавливающего агента, такого как DTT или меркаптоэтанол, и растворимую фракцию мутанта TM2, с последующим анализом с помощью SDS-PAGE без температурной обработки. В результате полосу, имеющую тот же размер, что и полоса TM2 дикого типа, определяли у каждого мутанта, у которого продемонстрировано образование тетрамера. Уровень экспрессии растворимого белка TM2 с низкой pI составлял 20 мг на 1 л культурального раствора, для каждого TM2 K26A, TM2 K73Q, TM2 R104E, TM2 K141E и TM2 R104EK141E. Это эквивалентно уровню экспрессии TM2 дикого типа.
Напротив, в отличие от этих мутантов, уровни экспрессии у TM2K33TK37A, TM2 K33TK37AR104E и TM2 K19T, у каждого были настолько низкими как 2 мг.
1-5) Измерение активности флуоресцентного биотина
Биотинсвязывающая способность TM2 с низкой pI, экспрессированного в Escherichia coli, была подтверждена в соответствии с методом из Biochim. Biophys. Acta, 1427, 44-48 (1999): готовили растворы (каждый по 150 мкл) буфера для анализа (50 мМ NaH2PO4, 100 мМ NaCl, 1 мМ ЭДТА (pH 7,5)), содержащего градуально растущие количества раствора экстракта, проэкстрагированного из 25 мл культурального раствора каждого TM2 с низкой pI с помощью 1,5 мл 20 мМ фосфатного буфера (рН 7). Каждый из этих растворов и 10 пмоль/мкл раствора флуоресцентного биотина (биотин-4-флуоресцеин: Molecular Probe, 50 мкл (500 пмоль)) смешивали и вводили в реакцию при комнатной температуре в течение 10 минут с последующим измерением интенсивности флуоресценции при Ex=460 нм и Em=525 нм с использованием Infinite M200 (TECAN).
Результаты показали, что интенсивность флуоресценции снижалась пропорционально росту количества экстракта TM2 с низкой pI. В результате этого продемонстрировано, что полноразмерный мутант TM2, в котором основная аминокислота в TM2 заменена нейтральной или кислой аминокислотой, связан с биотиноподобным соединением.
1-6) Очистка TM2 с низкой pI
TM2 с низкой pI очищали в соответствии с методом Hofmann, et al., (1980) с использованием колонки, заполненной 2-иминобиотин-сефарозой (Sigma). Каждый культуральный раствор Escherichia coli (25 мл) с индуцированной экспрессией TM2 с низкой pI смешивали с 50 мМ CAPS (рН 11, 1,5 мл), содержащем 50 мМ NaCl для суспендирования клеток, с последующим разрушением ультразвуком. Супернатант наносили на колонку, заполненную 2-иминобиотин-агарозой (500 мкл). Колонку полностью промывали 50 мМ CAPS (рН 11), содержащем 500 мМ NaCl с последующей элюцией 50 мМ NH4OAC (pH 4). Количество каждого очищенного белка TM2 с низкой pI было приблизительно на том же уровне, что и количество, экспрессированное в Escherichia coli, с продемонстрированной чистотой 95% или более.
1-7) Измерение биотинсвязывающей способности
Тест связывания биотина TM2 с низкой pI проводили с использованием Biacore (зарегистрированная торговая марка) 3000 (Biacore, биосенсор, использующий принцип поверхностного плазмонного резонанса). Биотинилированный альбумин сыворотки быка (БСА) иммобилизовали на сенсорных матрицах CM5 (Biacore) с помощью аминной сшивки с EZ-Link (зарегистрированная торговая марка) NHS-LC-Biotin (22,4 Å) или с EZ-Link (зарегистрированная торговая марка) NHS-LCLC-Biotin (30,5 Å) (оба представляют собой продукты PIERCE). HBS-EP (Biacore) использовали в качестве проточного буфера, и каждый TM2 с низкой pI (40 мкл) вводили при 25°C и скорости тока 20 мкл/мин в течение 2 минут.
Из полученных сенсорограмм рассчитывали константу скорости ассоциации (ka), константу скорости диссоциации (kd) и константу диссоциации (KD) с использованием компьютерных программ анализа, BIAevaluation, версия 4.1. В таблице 2 представлены результаты. Величины, представленные в таблице в скобках, указывают, что они ниже предела определения Biacore 3000 (ka<5×10-6). Каждый TM2 с низкой pI обнаруживает специфическое связывание с биотином и таким образом демонстрирует, что мутация существенно не повлияла на биотинсвязывающую способность.
Таблица 2: Анализ взаимодействия между TM2 с низкой pI и биотином
1-8) Электрофорез с изоэлектрическим фокусированием
Изоэлектрическую точку каждого TM2 с низкой pI измеряли с помощью электрофореза с изоэлектрическим фокусированием с использованием XCell SureLock Mini-Cell (Invitrogen). В соответствии с инструкцией каждый TM2 с низкой pI (500 нг) и буфер для образцов IEF (pH от 3 до 10 (2×), Invitrogen) смешивали и добавляли к полиакриламидному гелю (pH от 3 до 10, IEF Gel, Invitrogen) при рН в диапазоне от 3 до 10 с последующим электрофорезом при регулируемом напряжении в 100 В в течение 1 часа, 200 В в течение 1 часа и 500 В в течение 45 минут в этом порядке.
После электрофореза гель встряхивали в буфере для блотинга (0,7% уксусной кислоты) в течение 10 минут и затем переносили на мембрану PVDF при 10 В в течение 1 часа с использованием XCell ll Blot Module (Invitrogen). Мембрану PVDF вводили в реакцию с кроличьим антителом против TM2 (патент PCT/JP2006/326260), служащим в качестве первого антитела и с антикроличьим антителом IgG, меченным щелочной фосфатазой (BIO-RAD), служащим в качестве второго антитела, с последующим определением полос набором II <VECTOR Black> (VECTRO) с субстратом щелочной фосфатазы.
Результаты выявили, что изоэлектрическая точка каждого мутанта TM2 была ниже, чем изоэлектрическая точка TM2 дикого типа на 1 или более. В таблице 3 представлены величины pI, фактически измеренные с помощью электрофореза с изоэлектрическим фокусированием и величины pI, рассчитанные с помощью Genetyx.
Таблица 3: изоэлектрические точки TM2 с низкой pI
1-9) Неспецифическое связывание с сывороткой человека
В этом варианте осуществления неспецифическое связывание с сывороткой человека исследовали как неспецифическую адсорбцию TM2 с низкой pI на магнитных шариках с иммобилизованными сывороточными белками. Конкретно, для того чтобы исследовать неспецифическое связывание TM2 с низкой pI, измеряли количество TM2 с низкой pI, адсорбированное на магнитных шариках, к которым были ковалентно присоединены белки сыворотки. TM2 K26A, TM2 K73Q, TM2 R104E, TM2 K141E и TM2 R104EK141E, которые экспрессировались в высокой степени в Escherichia coli, использовали в качестве TM2 с низкой pI, подвергаемых исследованию.
Белок сыворотки человека и магнитные шарики связывали друг с другом следующим образом. Магнитные шарики, обладающие поверхностями, покрытыми карбоксильными группами (Dynabeads M-270 Carboxylic Acid, Dynal, 210 мкл), отмывали 0,01н гидроксидом натрия (210 мкл) в течение 10 минут и затем ультрачистой водой (210 мкл) в течение 10 минут три раза. К отмытым магнитным шарикам добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC, PIERCE), растворенный в охлажденной ультрачистой воде, в конечной концентрации 0,2М, и смесь встряхивали при комнатной температуре в течение 30 минут. Затем магнитные шарики отмывали охлажденной ультрачистой водой (210 мкл) и затем 50 мМ буфером MES (рН 5,0, 210 мкл).
К магнитным шарикам добавляли 1 мг/мл белка сыворотки человека (CHEMICON, 210 мкл), диализованного против 50 мМ буфера MES (рН 5,0). Смесь встряхивали при комнатной температуре в течение 30 минут для ковалентного связывания белка сыворотки человека с магнитными шариками. Магнитные шарики собирали магнитом для удаления супернатанта. Непрореагировавшие активные группы на шариках удаляли 50 мМ трис буфером (рН 7,0, 210 мкл), и затем магнитные шарики блокировали PBS буфером (420 мкл), содержащим 0,5% БСА и 0,1% твин 20. Магнитные шарики суспендировали в PBS буфере (210 мкл) для получения магнитных шариков с иммобилизованным белком сыворотки человека.
Магнитные шарики (7 мкл) и 0,56 мкг/мл каждого TM2 с низкой pI смешивали для взаимодействия при комнатной температуре в течение 1 часа. Магнитные шарики собирали магнетиком и супернатант удаляли. После отмывания 20 мМ калий-фосфатным буфером (500 мкл), содержащим 500 мМ хлорида натрия, магнитные шарики смешивали с 20 мкл буфера для образцов 2×SDS (250 мМ трис-HCl, pH 6,8, 20% 2-меркапоэтанол, 20% SDS, 20% глицерин) с последующим нагреванием при 95°С в течение 20 минут для диссоциации TM2 с низкой pI от магнитных шариков.
Этот образец подвергали SDS-PAGE и затем анализу иммуноблотингом для определения количества TM2 с низкой pI. Кроличье антитело против тамавидина 2 и козье антитело против IgG кролика, меченное щелочной фосфатазой, использовали в качестве первого и второго антитела, соответственно. Полосы определяли набором II <VECTOR Black> (VECTRO) с субстратом щелочной фосфатазы и количественно определяли с помощью Las-3000 (FUJIFILM). Результаты представлены на фиг.1.
Как показано на фиг.1, адсорбция TM2 с низкой pI к сывороточному белку человека была снижена по сравнению с TM2 дикого типа на 10% у TM2 R104E, на 30% у TM2 K26A, на 40% у K73Q и K141E и на 70% у TM2 R104EK141E. Таким образом, неспецифическое связывание K26A, K73Q, K141E и K104EK141E было существенно ниже по сравнению с неспецифическим связыванием TM2.
1-10) Неспецифическое связывание с фибронектином
Связывание с фибронектином каждого TM2 с низкой pI сравнивали с использованием микропланшета, на котором был иммобилизован фибронектин. Концентрацию фибронектина доводили до 50 мкг/мл с помощью фиксирующего раствора исключительно для планшета New ELISA, и раствор фибронектина (50 мкл) добавляли к каждому планшету New ELISA (Sumitomo Bakelite) с последующим встряхиванием при 37°С в течение 4 часов для иммобилизации. Затем планшет промывали три раза PBS, содержащим 0,1% тритон X-100 (300 мкл), и затем высушивали естественным образом.
Мутанты TM2, K26A, K73Q, R104E, K141E и R104EK141E (50 мкл каждый), каждый добавляли к соответствующей лунке планшета и оставляли при комнатной температуре на 1 час. Планшет промывали 3 раза 300 мкл/лунка PBST (PBS буфером, содержащим 0,1% твин 20). Затем биотинилированную HRP, разведенную в 5000 раз PBST, содержащим 0,5% БСА, добавляли по 50 мкл/лунка и давали прореагировать с мутантом при комнатной температуре в течение 1 часа. После промывания PBST 300 мкл/лунка, три раза, к каждой лунке добавляли 50 мкл/лунка раствора 1-стадийного Ultra TMB-ELISA для развития окраски. После прекращения развития окраски под действием 2М серной кислоты, 50 мкл/лунка, измеряли поглощение при 450 нм с помощью микропланшетного ридера Infinite 200. Результаты показали, что связывание фибронектина было существенно ниже у мутантов TM2 с низкой pI по сравнению с TM2.
Результаты представлены на фиг.2. Как показано на фиг.2, эффект снижения связывания с фибронектином было высоким у R104EK141E, K141E, R104E, K26A и K73Q, в этом порядке.
1-11) Неспецифическое связывание с ДНК
Анализировали неспецифическое связывание TM2 с низкой pI с ДНК.
ДНК спермы лосося, разведенную ступенчато от 10 мкг до 1 мкг 2×SSC буфером, денатурировали щелочью и адсорбировали на Hybond N+мембране (Amersham Biosceinces) с использованием Bio-Dot SF (BIO-RAD). После блокирования мембраны раствором Денхардта × 5 (0,1% БСА, 0,1% фиколл, 0,1% поливинилпирролидон) мембрану погружали в раствор 25 мкг/мл TM2 с низкой pI или TM2 дикого типа при комнатной температуре на 90 минут. Затем мембрану промывали буфером TTBS (буфером TBS, содержащим 0,05% твин 20) при комнатной температуре в течение 5 минут, три раза. Мембрану блокировали буфером TBS, содержащим 3% снятого молока и 0,1% твина 20, в течение 1 часа. Мембрану вводили в реакцию с биотинилированной пероксидазой хрена (Vector), разведенной в 5000 раз буфером TBS, содержащим 3% снятого молока и 0,1% твина 20, при комнатной температуре в течение 1 часа. Мембрану опять промывали буфером TBS, содержащим 0,1% твина 20, и затем встряхивали в растворе, который представлял собой смесь реагента 1 и реагента 2 от ECL (Amasham) в одинаковых объемах, с последующим определением по реакции флуоресценции с помощью Las-3000 (FUJIFILM).
Результаты представлены на фиг.3. Как показано на фиг.3, только TM2 слабо связывался с 10 мкг ДНК, но связывание каждого мутанта TM2 с низкой pI было ниже предела определения. Это показывает, что неспецифическое связывание TM2 с низкой pI с ДНК существенно снижено.
На основе результатов примера 1 свойства модифицированных TM2 с низкой pI настоящего изобретения суммированы в таблице 4.
Таблица 4: итоговые свойства модифицированных TM2 с низкой pI
Пример 2 Создание и анализ TM2 с высоким сродством
2-1) Создание TM2 с высоким сродством
Для подтверждения повышения сродства к биотину в TM2 была введена мутация аминокислоты.
Общеизвестны несколько стрептавидинов, например, стрептавидин v2 (номер депонирования: Q53533, Bayer, et al., (1995) Biochim Biophys Acta 1263: 60-66) и стрептавидин v1 (номер депонирования: Q53532) из Streptomyces violaceus, и стрептавидин Streptomyces avidinii (номер депонирования: P22629, Argarana, et al., (1986) Nucleic Acids Res 14: 1871-1882) из Streptomyces avidinii. Как описано в патенте WO02/072817, гомологии аминокислотных последовательностей этих стрептавидинов с белком TM2 каждая составляет 50%, 48% и 48%, т.е. приблизительно 50%.
Изобретатели настоящего изобретения предположили, что структура, сходная со структурой стрептавидина, необходима для поддержания или повышения биотинсвязывающей способности белка TM2. Соответственно, аминокислотные последовательности стрептавидина и ТМ2 сравнивали в отношении остатков триптофана, которые, как считается, составляет очень важные части для связывания между стрептавидином и биотином, и в отношении остатков, которые становятся вовлеченными в образование водородных связей (Qureshi, et al., (2001), J. Biol. Chem. 276(49), pp. 46422-46428).
В результате изобретатели обнаружили, что среди остатков, которые становятся вовлеченными в образование водородных связей с биотином, аспарагин в положении 49 последовательности стрептавидина отличался от соответствующей аминокислоты (аспарагиновая кислота в положении 40) в последовательности TM2. Изобретатели исследовали, может или нет модификация D40 в TM2 в аспарагин, т.е. в аминокислоту стрептавидинового типа увеличить сродство.
Сначала, для того чтобы создать TM2 с высоким сродством, были созданы праймеры для введения указанной выше мутации: праймер Tm2NtermPci, состоящий из 5'-сайта гена TM2, и последовательности, кодирующей сайт расщепления ферментом рестрикции PciI (ACATGT), расположенной выше 5'-сайта, и праймер Tm2CtermBam, состоящий из 3'-сайта гена TM2, и последовательности, кодирующей сайт расщепления ферментом рестрикции BamHI (GGATCC), расположенной ниже 3'-сайта, которые были теми же самыми, что и праймеры, описанные выше. Серии смысловых праймеров, содержащих ошибочно спаренные кодоны для каждого мутанта, и их антисмысловые праймеры представляли собой следующее (SEQ ID NO: 38 и 39):
Таблица 5: праймеры для создания TM2 с высоким сродством
SEQ ID NO: 38 и 39
Сайты узнавания ферментами рестрикции подчеркнуты, и сайты мутаций показаны пунктирными линиями.
2-2) ПЦР и клонирование
Как описано выше, был сконструирован мутант TM2, в котором аспарагиновая кислота в положении 40 была заменена аспарагином (в настоящем описании далее обозначаемый как “TM D40N”; его нуклеотидная последовательность SEQ ID NO: 19 и аминокислотная последовательность SEQ ID NO: 20).
Для конструирования гена, кодирующего этот мутант TM2, повторяли ПЦР в две стадии. При ПЦР первой стадии плазмидный вектор pTrc99A, содержащий ген TM2, использовали в качестве матрицы, причем 5'-конец амплифицировали с помощью праймера tm2NtermPci и антисмыслового праймера TM2 SA D40N R, содержащего ошибочно спаренный кодон мутанта, тогда как 3'-конец амплифицировали с помощью смыслового праймера TM2 SAD40N F, содержащего ошибочно спаренный кодон, и праймера TM2CtermBam.
ПЦР проводили при следующих условиях реакции: 50 мкл реакционного раствора, содержащего матричную ДНК (500 нг), 10×Pyrobest буфер (Takara, 5 мкл), 2,5 мМ dNTP (4 мкл), праймеры (25 пмоль каждого) и 5 Е/мкл ДНК-полимеразы Pyrobest (Takara, 0,5 мкл), реакцию начинали с 3 мин при 96°С с последующими 10 циклами из 1 мин при 96°С, 1 мин при 55°С и 2 мин при 72°С и заканчивали 6 мин при 72°С в системе с программируемым температурным контролем PC-700 (ASTEK). В результате на 5'-конце были получены продукты ПЦР ожидаемого размера. Эти продукты ПЦР подвергали электрофорезу в агарозе с использованием агарозы с низкой точкой плавления (SeaPlaqueGTG) в буфере TAE для очистки фрагментов ДНК, как описано выше.
С помощью этих фрагментов в качестве матриц проводили вторую стадию ПЦР с использованием праймеров Tm2NtermPci и Tm2CtermBam. Условия реакции были теми же, что и на первой стадии ПЦР. Полученный высокоаффинный фрагмент гена TM2 из 430 п.н. клонировали в вектор pCR4 Blunt TOPO (Invitrogen) с помощью процесса, описанного выше. В результате был получен экспрессирующий белок TM2 D40N вектор TM2 D40N/pTrc99A.
2-3) Экспрессия высокоаффинного TM2 в Escherichia coli
Escherichia coli TB1, трансформированную вектором pTrc99A, содержащим мутант TM2, полученный в 2-2), инокулировали в культуральную среду LB (6 мл), содержащую антибиотик ампициллин (конечная концентрация: 100 мкг/мл), и культивировали при встряхивании при 37°С до достижения поглощения при 600 нм, ОП600, равного 0,5.
После этого к культуральному раствору добавляли 1 мМ IPTG с последующим встряхиванием культуры при 37°С в течение ночи. Escherichia coli собирали из 1 мл культурального раствора центрифугированием и суспендировали в 20 мМ фосфатном буфере (pH 7, 400 мкл) с последующим разрушением бактериальных клеток обработкой ультразвуком. Раствор разрушения центрифугировали (15000 об/мин) для сбора растворимой фракции в виде супернатанта. Растворимую фракцию подвергали анализу иммуноблотингом: растворимую фракцию и равный объем 2×SDS буфера для образца смешивали и нагревали при 95°С в течение 10 минут с последующим разделением с помощью SDS-ПАГЭ для анализа иммуноблотингом с использованием антитела кролика против TM2 (PCT/JP2006/326260) в качестве первичного антитела и меченого щелочной фосфатазой антитела против IgG кролика (BIO-RAD) в качестве вторичного антитела.
В результате была выявлена полоса около 15,5 кДа в Escherichia coli, трансформированной вектором pTrc99A, содержащим TM2 D40N, но не была выявлена в Escherichia coli, трансформированной вектором pTrc99A, не содержащим мутант TM2. Размер полосы находился в соответствии с молекулярной массой 15,5 кДа мономера, предсказанной на основании аминокислотной последовательности TM2. Затем согласно методу Bayer et al. (1996, Electrophoresis, 17(8), 1319-24) было подтверждено образование тетрамера высокоаффинного TM2 (с высоким сродством) в неденатурированном состоянии, как и в случае TM2 с низкой pI. Результаты показали полосу того же размера, что и полосы TM2 дикого типа в высокоаффинном TM2, который демонстрировал образование тетрамера. Уровень экспрессии растворимого белка TM2 составлял 20 мг на 1 л культурального раствора.
2-4) Очистка высокоаффинного TM2.( TM2 с высоким сродством)
Высокоаффинный TM2 очищали по методу Hofmann, et al. (1980), как описано выше. В результате количество очищенного мутантного белка TM2 было по существу на том же уровне, что и количество экспрессированного в Escherichia coli белка, с чистотой 95% или более.
2-5) Измерение активности с помощью флуоресцентного биотина
Биотинсвязывающая способность очищенного мутанта TM2 была подтверждена с помощью метода, опубликованного в Biochim. Biophys. Acta, 1427, 44-48 (1999). Результаты показали, что интенсивность флуоресценции снижается пропорционально повышению количества раствора мутанта TM2. Это подтверждает, что мутация D40N не подавляет существенно связывание TM2 с биотин-подобным соединением.
2-6) Электрофорез с изоэлектрическим фокусированием
Изоэлектрическую точку высокоаффинного TM2 измеряли с помощью электрофореза с изоэлектрическим фокусированием с использованием XCell SureLock Mini-Cell (Invitrogen). В таблице 6 показаны результаты анализа высокоаффинного TM2 (200 нг), полученные в соответствии с инструкцией. Электрическая точка TM2 D40N, содержащего замену основной аминокислоты, была выше электрической точки TM2 дикого типа также при электрофорезе с изоэлектрическим фокусированием.
2-7) Измерение биотинсвязывающей способности
Межмолекулярное взаимодействие анализировали с помощью теста связывания иминобиотина и теста связывания биотина высокоаффинным TM2 с использованием Biacore 3000 (Biacore).
2-7-1) Тест связывания иминобиотина
TM2 и высокоаффинный TM2, которые использовали в качестве лигандов для присоединения к сенсорным чипам, очищали с помощью 2-иминобиотин-агарозы в соответствии с традиционным способом и диализовали против 20 мМ KPi (pH 7) в течение ночи. Эти образцы разбавляли 10 мМ ацетатным буфером (pH 5, Biacore) до приблизительно 50 мкг/мл.
Иммобилизацию проводили при 25°С и скорости потока 10 мкл/мин с использованием HBS-EP (Biacore) в качестве рабочего буфера. TM2 и TM2 мутант (приблизительно от 4000 до 8000 RU) иммобилизовали на сенсорных чипах CM5 (Biacore) путем присоединения амина. Время активации было установлено равным 10 минутам.
Специфическое взаимодействие измеряли с использованием иминобиотин-БСА в качестве анализируемого вещества (вещества, протекающего через проточный канал) при 25°С и скорости потока 20 мкл/мин и с использованием буфера CAPS (50 мМ CAPS, 150 мМ NaCl, 0,005% твин 20, pH 11) в качестве рабочего буфера. Иминобиотин-БСА получали следующим образом: Высокоочищенный БСА (Sigma, 2 мг) и NHS-иминобиотин (Pierce, 1 мг) растворяли в 50 мМ борате натрия (pH 8,0, 1 мл) с последующей инкубацией при 4°С в течение 2 часов. Раствор помещали в диализную трубку (MWCO 6-8,000) и диализовали против 50 мМ карбоната натрия (pH6,7) при 4°С в течение ночи. Полученный конъюгат иминобиотин-БСА (мол. масса: 67 кДа, 30 мкМ) использовали в качестве анализируемого вещества для биосенсора Biacore (зарегистрированная торговая марка). Время введения иминобиотин-БСА составляло 2 минуты, а время диссоциации равнялось 10 минутам. Измерение проводили путем ступенчатого повышения концентрации, начиная с низкой концентрации, без стадий восстановления. Сначала вводили (2 минуты) 40 мкл БСА, разбавленного рабочим буфером до 9,375 нМ, 18,75 нМ, 37,5 нМ, 75 нМ, 150 нМ, 300 нМ и 600 нМ, начиная с меньшей концентрации, в проточную ячейку, на которой был иммобилизован целевой белок, для измерения диссоциации. Затем в той же проточной ячейке сходным образом измеряли иминобиотин-БСА, полученный с помощью процесса, описанного выше.
Каждую константу для образцов, проявляющих взаимодействие, рассчитывали с помощью аналитической программы BIAevaluation ver. 4.1. Сенсограмму, полученную для БСА в качестве репера в той же концентрации, что и иминобиотин-БСА, вычитали из сенсограммы, полученной для каждой концентрации иминобиотин-БСА, и полученную сенсограмму подвергали анализу кинетики взаимодействия с использованием модели связывания 1:1 (Ленгмюр) для расчета константы скорости связывания (ka) и константы скорости диссоциации (kd). Константу диссоциации (KD) определяли по kd/ka. В случае, когда стадия восстановления не используется, Rmax (максимальное количество связываемого анализируемого вещества) снижается при каждом измерении. Соответственно, при анализе Rmax рассчитывали путем подгонки для каждой концентрации и использовали лишь результаты при концентрациях (преимущественно от 18,75 до 75 нМ), приближенные к модели связывания 1:1 (Ленгмюр).
В результате константа скорости связывания (ka) TM2 D40N с иминобиотином была увеличена на 40%, а константа скорости диссоциации (kd) была снижена на 45% по сравнению с TM2, что привело к снижению KD приблизительно на 60%. То есть, сродство TM2 D40N к иминобиотину было в 2,5 раз выше, чем сродство TM2 (таблица 7).
2-7-2) Тест связывания биотина
Высокоочищенный БСА (Sigma, 2 мг) и NHS-LC-биотин (Pierce, 1 мг) растворяли в 50 мМ борате натрия (pH 8,0, 1 мл) и инкубировали при 4°С в течение 2 часов. Раствор помещали в диализную трубку (MWCO 6-8000) и диализовали против 50 мМ карбоната натрия (pH 6,7) при 4°С в течение ночи. Полученный конъюгат биотин-LC-БСА (мол. масса: 67 кДа, 30 мкМ) использовали в качестве лиганда для биосенсора Biacore (зарегистрированная торговая марка). Помимо этого, TM2 и высокоаффинный TM2 D40N очищали с помощью 2-иминобиотин-агарозы, как описано выше и диализовали против 20 мМ KPi (pH 7)в течение ночи для получения анализируемых веществ.
Биотин-LC-БСА и БСА, служащий в качестве отрицательного контроля, иммобилизовали на сенсорных чипах CM5 методом присоединения амина. Уровень иммобилизации доводили до приблизительно 200 RU. Чипы, на которых был иммобилизован БСА, помещали в проточные ячейки 1 и 3, а чипы, на которых был иммобилизован биотин-LC-БСА, помещали в проточные ячейки 2 и 4. Проточные ячейки 1 и 2 загружали TM2, а проточные ячейки 3 и 4 загружали высокоаффинным TM2 (D40N) при скорости потока 20 мкл/мин в течение 2 минут с использованием рабочего буфера [10 мМ HEPES, pH 7,4, 150 мМ NaCl, 3 мМ ЭДТА, 0,005% сурфактант 20 (Biacore)].
После этого отслеживали диссоциацию образцов в течение 60 минут, но связанный TM2 и высокоаффинный TM2 (D40N) не диссоциировали. Соответственно, проводили семиступенчатое измерение (3,125, 6,25, 12,5, 25, 50, 100 и 200 нМ), начиная с наименьшей концентрации, без стадий восстановления. Данные для БСА в качестве репера вычитали из данных для биотин-LC-БСА. Измерение проводили при 25°С. Полученные сенсорограммы подвергали анализу кинетики взаимодействия с помощью аналитической программы BIAevaluation ver. 4.1 для модели связывания 1:1 для расчета константы скорости связывания (ka) и константы скорости диссоциации (kd). Константу диссоциации (KD) определяли по kd/ka. В случае, когда стадия восстановления не используется, Rmax (максимальное количество связываемого анализируемого вещества) снижается при каждом измерении. Соответственно, при анализе Rmax рассчитывали путем подгонки для каждой концентрации и использовали лишь результаты при концентрациях анализируемого вещества, приближенных к модели связывания 1:1.
В результате константа скорости связывания (ka) TM2 D40N с иминобиотином была увеличена, а константа скорости диссоциации (kd) была снижена на 45% по сравнению с TM2 (таблица 7).
Эти результаты показывают, что биотинсвязывающая способность (сродство) TM2 D40N была увеличена.
На основании результатов примера 2 свойства высокоаффинного TM2 настоящего изобретения суммированы в таблице 8.
Пример 3: Конструирование и анализ высокоаффинного TM2 с низким неспецифическим связыванием
3-1) Конструирование высокоаффинного TM2 с низким неспецифическим связыванием (HALU TM2: высокое сродство и низкая неспецифичность)
В TM2 была введена мутация для снижения неспецифического связывания, а также повышения сродства к биотину.
На основании результатов примера 1 в качестве мутации для снижения неспецифического связывания были введены мутации R104E и K141E в качестве аминокислотной мутации для снижения неспецифического связывания. На основании результатов измерения биотинсвязывающей способности в примере 2 в качестве мутации для повышения сродства к биотину была введена мутация D40N. То есть, были сконструированы мутант TM2, содержащий мутации D40N и R104E (далее в настоящем описании обозначаемый как "TM2 D40NR104E"; его нуклеотидная последовательность представлена в SEQ ID NO:21, а аминокислотная последовательность в SEQ ID NO:22) и мутант TM2, содержащий мутации D40N и R104EK141E (далее в настоящем описании обозначаемый как "TM2 D40NR104EK141E"; его нуклеотидная последовательность представлена в SEQ ID NO:23, а аминокислотная последовательность в SEQ ID NO:24).
3-2) ПЦР и клонирование
Для конструирования HALU TM2 были использованы те же праймеры, что и праймеры, использованные для введения каждой мутации. Условия ПЦР и методы клонирования были такими же, что и описанные выше.
Ген, кодирующий TM2 D40NR104E, был сконструирован путем получения вектора TM2 D40NR104E/pTrc99A для экспрессии белка TM2 D40NR104E путем введения мутации посредством реакции ПЦР в две стадии с использованием вектора TM2 D40N/pTrc99A в качестве матрицы и использованием пары праймеров Tm2NtermPci и Tm2 R104E R и пары праймеров Tm2 R104E F и Tm2CtermBam. Ген, кодирующий TM2 D40NR104EK141E был сконструирован путем получения вектора TM2 D40NR104EK141E/pTrc99A для экспрессии белка TM2 D40NR104EK141E путем введения мутации посредством реакции ПЦР в одну стадию с использованием вектора TM2 D40NR104E/pTrc99A в качестве матрицы и пары праймеров Tm2NtermPci и Tm2 K141E Bam.
3-3) Экспрессия HALU TM2 в Escherichia coli
Escherichia coli TB1, трансформированную вектором pTrc99A, содержащим любой из мутантов TM2, инокулировали в культуральную среду LB (6 мл), содержащую антибиотик ампициллин (конечная концентрация: 100 мкг/мл), и культивировали при встряхивании при 37°С или 25°С до достижения поглощения при 600 нм, ОП600, равного 0,5. Добавляли 1 мМ IPTG, и культуру дополнительно встряхивали при 37°С или 25°С в течение ночи. Escherichia coli собирали из 1 мл культурального раствора центрифугированием и суспендировали в 20 мМ фосфатном буфере (pH 7, 400 мкл) с последующим разрушением бактериальных клеток обработкой ультразвуком. Раствор разрушения центрифугировали (15000 об/мин) для сбора растворимой фракции в виде супернатанта. Эту растворимую фракцию и равный объем 2×SDS буфера для образца смешивали и нагревали при 95°С в течение 10 минут. Белки разделяли с помощью SDS-ПАГЭ и выявляли окрашиванием CBB.
В результате была выявлена полоса около 15,5 кДа в каждой Escherichia coli, трансформированной вектором pTrc99A, содержащим мутантный TM2, но не была выявлена в Escherichia coli, трансформированной вектором pTrc99A, не содержащим мутант TM2. Размеры этих полос находились в соответствии с молекулярной массой 15,5 кДа мономера, предсказанной на основании аминокислотной последовательности TM2. Затем согласно методу Bayer et al. (1996, Electrophoresis, 17(8), 1319-24) было подтверждено образование тетрамера HALU TM2 в неденатурированном состоянии, как и в случае TM2 с низкой pI и высокоаффинного TM2. Результаты показали полосу того же размера, что и полосы TM2 дикого типа в HALU TM2, который демонстрировал образование тетрамера. Уровень экспрессии растворимых мутантных белков TM2 составлял 24 мг на 1 л культурального раствора в культуре TM2 D40NR104E при 37°C, 10 мг в культуре TM2 D40NR104EK141E при 37°C и 32 мг в культуре TM2 D40NR104E при 25°C. Что касается TM2 D40NR104EK141E, замена клеток-хозяев на BL21 (DE3) повышала уровень экспрессии растворимой фракции в культуре при 25°С до 43 мг.
3-4) Очистка HALU TM2
HALU TM2 очищали по методу Hofmann et al. (1980), как описано выше. В результате количество очищенного белка каждого мутанта TM2 было по существу на том же уровне, что и количество экспрессированного в Escherichia coli белка, с чистотой 90% или более.
3-5) Измерение активности с помощью флуоресцентного биотина
Биотинсвязывающая способность каждого очищенного мутанта TM2 была подтверждена с помощью метода, опубликованного в Biochim. Biophys. Acta, 1427, 44-48 (1999). Результаты показали, что интенсивность флуоресценции снижается пропорционально повышению количества раствора мутанта HALU TM2. Это подтверждает, что мутант HALU TM2 связывается с биотин-подобным соединением.
3-6) Электрофорез с изоэлектрическим фокусированием
Изоэлектрическую точку HALU TM2 измеряли с помощью электрофореза с изоэлектрическим фокусированием с использованием XCell SureLock Mini-Cell (Invitrogen). В соответствии с инструкцией полосы каждого HALU TM2 (4 мкг) выявляли с помощью окрашивания CBB. Результаты показаны в таблице 9. Наблюдаемая изоэлектрическая точка TM2 D40N равнялась 9,7 и была снижена до 8,9 после введения мутации R104E и снижалась до от 7,3 до 7,5 после дополнительного введения мутации K141E.
2-7) Измерение биотинсвязывающей способности
Тест связывания биотина высокоаффинным TM2 проводили с использованием Biacore 3000 (Biacore).
Использованный в качестве лиганда биотин-БСА получали, как описано в параграфе 2-7-2). TM2 и HALU TM2, использованные в качестве анализируемых веществ, получали очисткой с помощью 2-иминобиотин-агарозы в соответствии с обычным методом и диализовали против 20 мМ KPi (pH 7) в течение ночи. Каждое из анализируемых веществ доводили до приблизительно 50 мкг/мл в 10 мМ ацетатном буфере (pH 5, Biacore).
Иммобилизацию лиганда и измерение, и анализ специфического взаимодействия с анализируемыми веществами проводили, как описано в параграфе 2-7-2). В результате константа скорости связывания (ka) с биотином была увеличена у обоих мутантов HALU TM2 по сравнению с TM2. Константа скорости диссоциации (kd) у TM2 D40NR104EK141E была снижена, что демонстрирует дополнительное повышение биотинсвязывающей способности (см. табл. 10).
3-8) Термостабильность структуры белка HALU TM2
Каждый из растворов 0,2 мкг/мкл мутанта TM2 (10 мкл (2 мкг)) нагревали при комнатной температуре, 50, 60, 70, 80, 90 или 99°С в течение 20 минут. Затем раствор центрифугировали при 15000 об/мин в течение 10 минут, и растворимый белок супернатанта суспендировали в равном объеме 2×SDS буфера для образца (250 мМ трис-HCl, pH 6,8, 20% 2-меркаптоэтанол, 20% SDS, 20% глицерин). Суспензию нагревали при 95°С в течение 10 минут с последующим SDS-ПАГЭ. Белковые полосы выявляли окрашиванием CBB. Стандартную кривую получали с использованием количественного маркера (LMW ELECTROPHORESIS CALIBRATION KIT; Pharmacia Biotech) с использованием Las-3000 (FUJIFILM) для количественного определения белковых полос.
В результате температура, при которой терялось 50% белка D40NR104E, составила 78°С. Напротив, 78% белка D40NR104EK141E сохранялось, даже если белок нагревали при 99°С. Температура, при которой терялось 50% белка, составляла 87,5°C для TM2 и 70°С для стрептавидина.
3-9) Неспецифическое связывание HALU TM2 с сывороткой человека.
В этом примере исследовали неспецифическую адсорбцию белка сыворотки на магнитных шариках с иммобилизованным HALU TM2.
TM2 D40NR104E и TM2 D40NR104EK141E ковалентно присоединяли к магнитным шарикам (Dynabeads M-270 Carboxylic Acid, Dynal) методом, описанным в параграфе 1-9) примера 1, и измеряли количество белка сыворотки человека, адсорбированного на шариках. Количество каждого HALU TM2, иммобилизованного на магнитных шариках, доводили до 10 мкг/100 мкл шариков. Сыворотку человека (CHEMICON) разбавляли в 800 раз буфером PBS, и к разбавленной сыворотке человека добавляли магнитные шарики (50 мкл), на которых было иммобилизовано определенное количество белка HALU TM2, с последующим смешиванием переворачиванием вверх дном пробирки, содержащей шарики, при комнатной температуре в течение 15 минут. Магнитные шарики промывали буфером PBS, содержащим 0,1% твин 20 (PBST, 500 мкл) четыре раза и подвергали взаимодействию антиген-антитело при комнатной температуре в течение 15 минут с меченным HRP антителом мыши против IgG человека (100 мкл), разбавленным в 5000 раз PBST, содержащим 0,5% БСА. Затем шарики промывали PBST (500 мкл) пять раз с последующим проявлением окрашиванием с помощью 1-Step Ultra TMB-ELISA (100 мкл). После остановки проявления окрашиванием 2 М серной кислотой (100 мкл) магнитные шарики собирали с помощью магнита. Измеряли поглощение супернатанта при 450 нм с помощью микропланшетного ридера Infinite 200.
Результаты показаны на фиг.4. Как видно на фиг.4, неспецифическое связывание было низким и для TM2 D40NR104E, и для TM2 D40NR104EK141E по сравнению с магнитными шариками с иммобилизованным TM2 дикого типа.
3-10) Неспецифическое связывание с фибронектином
Неспецифическое связывание HALU TM2 с фибронектином исследовали так же, как в параграфе 1-10) примера 1.
Результаты показали, что связывание TM2 D40NR104EK141E с фибронектином было также очень низким и, таким образом, значительно более низким по сравнению с TM2 (фигура 5). Ингибирующее действие D40NR104EK141E на связывание с фибронектином было сопоставимо с эффектом TM2 R104EK141E, проявляющим наибольшее действие среди мутантов TM2 с низкой pI.
Эти результаты показали, что мутация D40N не оказывает влияния на связывание R104EK141E с фибронектином.
3-11) Неспецифическое связывание с ДНК
Неспецифическое связывание HALU TM2 с ДНК анализировали с помощью метода из параграфа 1-11) примера 1. Результаты показали, что связывание TM2 D40NR104EK141 с 10 мкг ДНК, было ниже порога чувствительности, как и в случае TM2 R104EK141E, тогда как TM2 дикого типа слабо связывался (фиг.6). Это показывает, что мутация D40N не оказывает влияния на связывание с ДНК.
На основании результатов примера 3 в таблице 11 представлены итоговые свойства высокоаффинного TM2 с низким неспецифическим связыванием настоящего изобретения.
(KD)
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДИФИЦИРОВАННЫЙ ТАМАВИДИН | 2011 |
|
RU2591524C2 |
| МОДИФИЦИРОВАННЫЙ БИОТИН-СВЯЗЫВАЮЩИЙ БЕЛОК, СЛИТЫЕ БЕЛКИ НА ЕГО ОСНОВЕ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2632651C2 |
| МУТАНТЫ ИНДУЦИРУЕМОЙ АКТИВАЦИЕЙ ЦИТИДИНДЕАМИНАЗЫ (AID) И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2537264C2 |
| АНТИТЕЛА К БИОТИНУ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2630296C2 |
| МУТАНТЫ ГЕМАГГЛЮТИНИНА ВИРУСА ГРИППА | 2019 |
|
RU2800938C2 |
| ИММУНОГЕННЫЙ ПЕПТИД ПРОТИВ СТРЕПТОКОККОВ ГРУППЫ А | 2018 |
|
RU2775621C2 |
| МУТАНТ AAV, ОБЛАДАЮЩИЙ СПОСОБНОСТЬЮ НАЦЕЛИВАТЬСЯ НА ГОЛОВНОЙ МОЗГ | 2020 |
|
RU2809389C2 |
| ВАРИАНТЫ ДИЗИНТЕГРИНА И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2015 |
|
RU2685869C1 |
| Мутантные иммуноглобулин-связывающие полипептиды | 2015 |
|
RU2701695C2 |
| БИБЛИОТЕКА ЗАВИСИМЫХ ОТ КОНЦЕНТРАЦИИ ИОНОВ СВЯЗЫВАЮЩИХ МОЛЕКУЛ | 2012 |
|
RU2812861C1 |
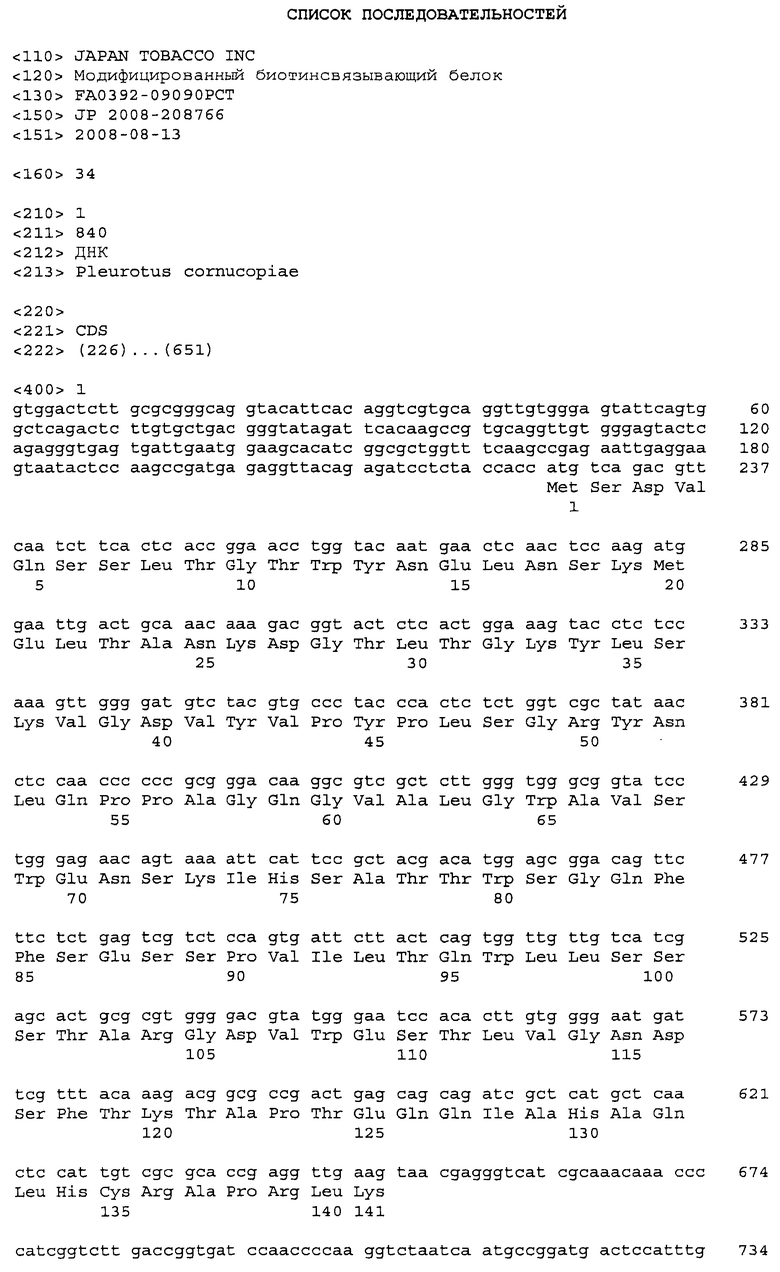
















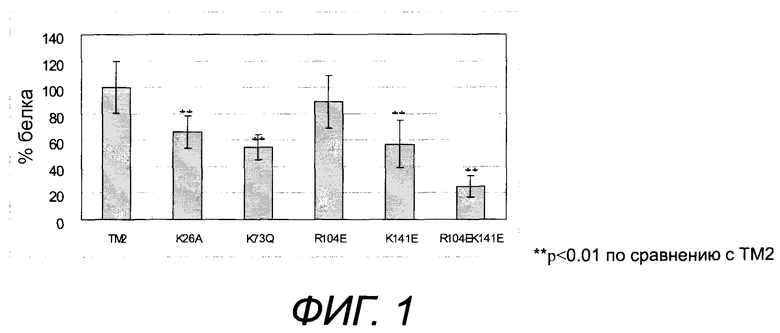
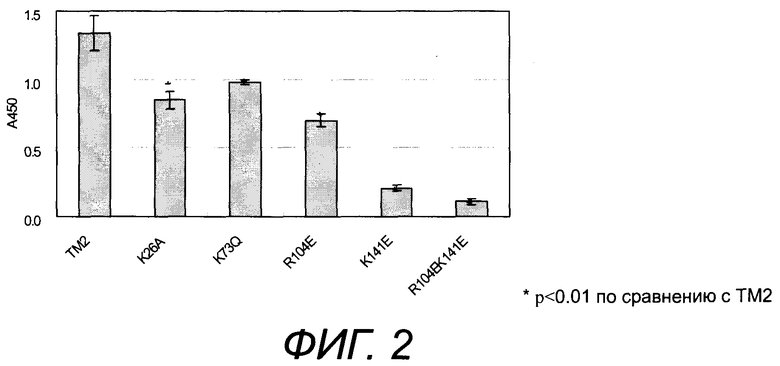
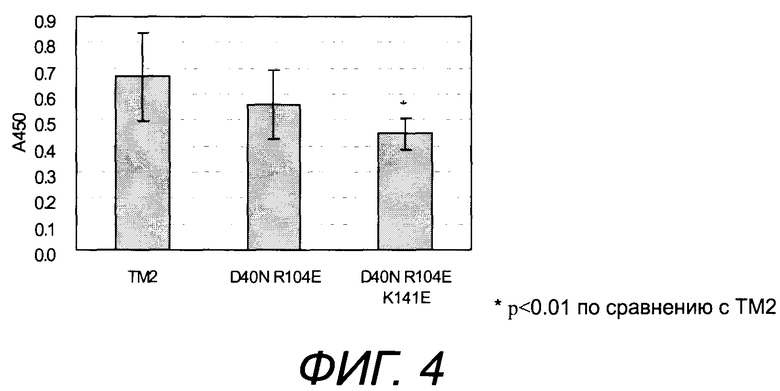
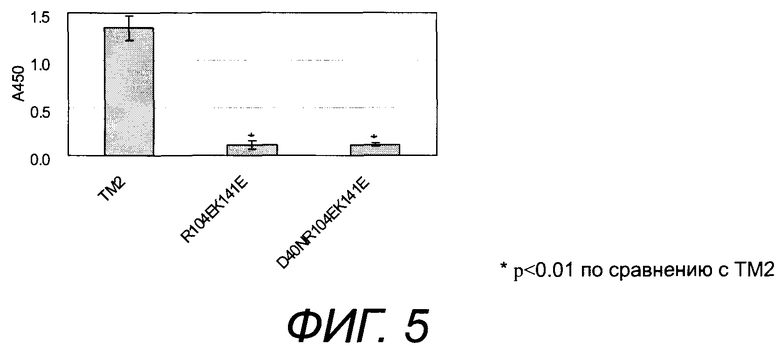

Представленные изобретения касаются модифицированного белка, нуклеиновой кислоты, кодирующей такой белок, вектора, содержащего нуклеиновую кислоту, и носителя для связывания биотина, на котором иммобилизован такой белок. Охарактеризованный модифицированный биотинсвязывающий белок получен введением мутации от одного до нескольких аминокислотных остатков в последовательность, представленную в SEQ ID NO:2, или аминокислотную последовательность, идентичную на 98% или более указанной последовательности, и наличием биотинсвязывающей активности, где по меньшей мере один остаток, выбранный из группы, состоящей из остатков от 1) до 4), представленных ниже, заменен остатком кислой аминокислоты или остатком нейтральной аминокислоты: 1) остатка аргинина в положении 104 SEQ ID NO: 2; 2) остатка лизина в положении 141 SEQ ID NO: 2; 3) остатка лизина в положении 26 SEQ ID NO: 2 и 4) остатка лизина в положении 73 SEQ ID NO: 2. Предложенные изобретения позволяют получить биотинсвязывающий белок и могут быть применимы для связывания биотина. 5 н. и 9 з.п. ф-лы, 6 ил., 11 табл., 3 пр.
1. Модифицированный биотинсвязывающий белок, включающий аминокислотную последовательность, представленную SEQ ID NO: 2, или аминокислотную последовательность, идентичную последовательности, представленной SEQ ID NO: 2, на 98% или более, и обладающий биотинсвязывающей активностью, где
один или более остатков, выбранных из группы, состоящей из:
1) остатка аргинина в положении 104 SEQ ID NO: 2;
2) остатка лизина в положении 141 SEQ ID NO: 2;
3) остатка лизина в положении 26 SEQ ID NO: 2 и
4) остатка лизина в положении 73 SEQ ID NO: 2
заменены остатком кислой аминокислоты или остатком нейтральной аминокислоты.
2. Модифицированный биотинсвязывающий белок по п.1, где аминокислотный остаток, выбранный из от 1) до 4), заменен аминокислотным остатком, обладающим индексом гидрофобности 2 или менее.
3. Модифицированный биотинсвязывающий белок по п.1, где 1) остаток аргинина в положении 104 SEQ ID NO: 2 и/или 2) остаток лизина в положении 141 SEQ ID NO: 2 заменены кислым аминокислотным остатком или нейтральным аминокислотным остатком.
4. Модифицированный биотинсвязывающий белок по п.3, где 1) остаток аргинина в положении 104 SEQ ID NO: 2 и/или 2) остаток лизина в положении 141 SEQ ID NO: 2 заменены кислым аминокислотным остатком.
5. Модифицированный биотинсвязывающий белок по п.3 или 4, где 1) остаток аргинина в положении 104 SEQ ID NO: 2 и/или 2) остаток лизина в положении 141 SEQ ID NO: 2 заменены остатком глутаминовой кислоты.
6. Модифицированный биотинсвязывающий белок по любому из пп.1-4, где остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина.
7. Модифицированный биотинсвязывающий белок по любому из пп.1-4, который выбран из группы, состоящей из:
модифицированного биотинсвязывающего белка (R104E-K141Е), в котором остаток аргинина в положении 104 SEQ ID NO: 2 заменен остатком глутаминовой кислоты, и остаток лизина в положении 141 заменен остатком глутаминовой кислоты;
модифицированного биотинсвязывающего белка (D40N-R104E), в котором остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина, и остаток аргинина в положении 104 заменен остатком глутаминовой кислоты;
модифицированного биотинсвязывающего белка (D40N-K141E), в котором остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина, и остаток лизина в положении 141 заменен остатком глутаминовой кислоты; и
модифицированного биотинсвязывающего белка (D40N-R104E-К141Е), в котором остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина, остаток аргинина в положении 104 заменен остатком глутаминовой кислоты и остаток лизина в положении 141 заменен остатком глутаминовой кислоты.
8. Модифицированный биотинсвязывающий белок по любому из пп.1-4, который удовлетворяет, по меньшей мере, одному требованию, выбранному из следующих требований от а) до l):
a) аспарагиновый остаток в положении 14 SEQ ID NO: 2 не модифицирован или заменен глутамином или аспарагиновой кислотой;
b) остаток серина в положении 18 SEQ ID NO: 2 не модифицирован или заменен треонином или тирозином;
c) остаток тирозина в положении 34 SEQ ID NO: 2 не модифицирован или заменен серином, треонином или фенилаланином;
d) остаток серина в положении 36 SEQ ID NO: 2 не модифицирован или заменен треонином или тирозином;
e) остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 не модифицирован или заменен аспарагином;
f) остаток триптофана в положении 69 SEQ ID NO: 2 не модифицирован;
g) остаток серина в положении 76 SEQ ID NO: 2 не модифицирован или заменен треонином или тирозином;
h) остаток треонина в положении 78 SEQ ID NO: 2 не модифицирован или заменен серином или тирозином;
i) остаток триптофана в положении 80 SEQ ID NO: 2 не модифицирован;
j) остаток триптофана в положении 96 SEQ ID NO: 2 не модифицирован;
k) остаток триптофана в положении 108 SEQ ID NO: 2 не модифицирован; и
l) остаток аспарагиновой кислоты в положении 116 SEQ ID NO: 2 не модифицирован или заменен глутаминовой кислотой или аспарагином.
9. Модифицированный биотинсвязывающий белок по любому из пп.1-4, который удовлетворяет, по меньшей мере, одному свойству, выбранному из следующих свойств от i) до iv):
i) обладающий изоэлектрической точкой, более низкой, чем изоэлектрическая точка белка, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 2;
ii) проявляющий более низкое неспецифическое связывание с нуклеиновыми кислотами и/или белками по сравнению с белком, состоящим из аминокислотной последовательности, представленной SEQ ID NO: 2;
iii) проявляющий более низкую фибронектинсвязывающую активность по сравнению с белком, состоящим из аминокислотной последовательности, представленной SEQ ID NO: 2; и
iv) проявляющий более высокую биотинсвязывающую активность по сравнению с белком, состоящим из аминокислотной последовательности, представленной SEQ ID NO: 2.
10. Модифицированный биотинсвязывающий белок, включающий аминокислотную последовательность, представленную SEQ ID NO: 2, или аминокислотную последовательность, идентичную на 98% или более последовательности, представленной SEQ ID NO: 2, и обладающий биотинсвязывающей активностью, где
остаток аспарагиновой кислоты в положении 40 SEQ ID NO: 2 заменен остатком аспарагина.
11. Модифицированный биотинсвязывающий белок по п.10, где биотинсвязывающая активность является более высокой, чем у белка, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 2.
12. Нуклеиновая кислота, кодирующая белок по любому из пп.1-11.
13. Вектор, содержащий нуклеиновую кислоту по п.12, для экспрессии белка по любому из пп.1-11.
14. Носитель для связывания биотина, на котором иммобилизован белок по любому из пп.1-11.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| WO 2008081938 A1, 10.07.2008 | |||
| JP 0007289264 A, 07.11.1995 | |||
| Sau-Ching Wu et al., Engineering Soluble Monomeric Streptavidin with Reversible Biotin Binding Capability, THE JOURNAL OF BIOLOGICAL CHEMISTRY, Issue of June 17 2005, Vol.280, No:24, p.p.23225"23231 | |||
| Пропеллерный парашют | 1929 |
|
SU17017A1 |
Авторы
Даты
2015-05-20—Публикация
2009-08-13—Подача