Область техники, к которой относится изобретение
Настоящее изобретение относится к иммуногенному пептиду для предупреждения и лечения заболеваний и состояний, связанных со стрептококком группы А.
Предпосылки создания изобретения
Синтетические и рекомбинантные пептиды разрабатывают в качестве вакцин для предупреждения и защиты от многочисленных инфекционных, а также неинфекционных заболеваний. Их польза заключается в их способности имитировать нативные эпитопы на чужеродных белках или белках-хозяевах и специфически активировать или модулировать защитные или вредные иммунные ответы. Значительный прогресс был достигнут в отношении многих неинфекционных заболеваний, включая рак, аллергии, рассеянный склероз и хронические заболевания, такие как гипертония, диабет и болезнь Альцгеймера (1). Однако самые большие ожидания связаны с вакцинами, предназначенными для предупреждения инфекционных заболеваний. Суть в том, что их малый размер существенно облегчает разработку многокомпонентных вакцин, включающих эпитопы из множества целевых антигенов (2), вакцин, которые могут предупреждать инфекции, вызванные организмами, существующими в множественных аллельных формах (3), и вакцин, которые могут быть нацелены на скрытые или криптические эпитопы, приводя к выработке иммунных ответов, которые не индуцируются организмом естественным путем, но которые являются смертельными для организма после индукции вакциной (4).
Эпитопы, распознаваемые В- и Т-клетками, являются малыми и благодаря своему размеру могут быть легко и недорого синтезированы. Однако из-за того, что имеют малый размер, репертуар В- или Т-клеток, которые они стимулируют, очень ограничен, и именно по этой причине еще не было разработано и лицензировано никаких вакцин на основе пептидов для применения у человека.
Вакцины против Streptococcus pyogenes (стрептококки группы А по классификации Lancefield; GAS) давно пытаются создать из-за изнуряющих форм заболеваний, вызванных бактерией, в частности, ревматической лихорадки и ревматической болезни сердца. В настоящее время ревматическая лихорадка является редким заболеванием в большинстве развитых стран, но она остается основной причиной приобретенных пороков сердца у детей, подростков и молодых людей в развивающихся странах. Кроме того, инвазивное заболевание GAS является частой причиной сепсиса у детей и взрослых, и имеет высокий уровень летальности. Дальнейшим присоединением к бремени болезни GAS является постстрептококковый гломерулонефрит, который, по-видимому, способствует высокой частоте развития конечной стадии почечной недостаточности во многих GAS эндемичных регионах. Фарингит и импетиго, вызванные GAS, являются причиной наибольшего абсолютного числа GAS-инфекций ежегодно. Фарингит, вызванный GAS, поражает приблизительно 8-15% детей школьного возраста в год, а импетиго, вызванная GAS, является очень распространенной инфекцией среди детей с заболеваемостью 10-50%. Связанные с GAS тяжелые заболевания являются проблемой не только в развивающихся странах, а даже в развитых странах появились особенно вирулентные штаммы GAS, которые являются устойчивыми к стандартной терапии антибиотиками и вызывают изнуряющие заболевания, такие как тяжелый некротический фасциит.
Вакцины на основе пептидов против стрептококка группы А были сфокусированы на пептидах, полученных из белка М, таких как пептиды р145, J8 и J14. В настоящее время ведущим кандидатом на вакцину является пептид J8, который содержит минимальный эпитоп из двенадцати аминокислот в пределах р145, введенный в аминокислотную последовательность дрожжевого спирального пептида (GCN4) (12). Аминокислотная последовательность GCN4 способствует поддержанию спиральности пептида, чтобы оптимизировать презентацию минимального эпитопа иммунной системе. Этому кандидату на вакцину требуется также три дозы, чтобы вызвать защиту от кожных заболеваний (19).
Краткое описание изобретения
Неожиданно авторы настоящего изобретения обнаружили, что иммуногенность пептида р145 может быть существенно повышена путем таргетной модификации аминокислотной последовательности р145. Иммунизация однократной дозой модифицированного пептида р145, а не множественные иммунизации, может защитить от стрептококковой инфекции группы А, даже гипервирулентных штаммов, таких как мутантный штамм CovR/S. Неожиданно было обнаружено, что модифицированный пептид, фрагмент или вариант р145 вызывает иммунный ответ слизистой оболочки при введении млекопитающему. Иммунный ответ слизистой оболочки характеризуется продукцией IgG, при этом продукция IgA практически отсутствует или находится на относительно пониженном уровне по сравнению с уровнем продуцируемого IgG.
Изобретение в целом относится к пептиду р145, содержащему одну или несколько модификаций аминокислотной последовательности, которые существенно улучшают или усиливают иммуногенность, в частности, для индукции иммунных ответов слизистой оболочки. В предпочтительной форме пептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 1.
В одном аспекте изобретения обеспечен способ вызывания иммунного ответа на стрептококковые бактерии группы А у млекопитающего, при этом указанный способ включает стадию введения: выделенного белка, содержащего модифицированную аминокислотную последовательность пептида р145, содержащую аминокислотную замену остатков 13 и 17 последовательности SEQ ID NO: 3; антитела или фрагмента антитела, которое связывается или продуцируется против выделенного белка или его фрагмента или варианта; или выделенной нуклеиновой кислоты, кодирующей выделенный белок или его фрагмент или вариант; млекопитающему, чтобы таким образом вызвать иммунный ответ.
В другом аспекте изобретения обеспечен способ индукции иммунитета против стрептококковой бактериальной инфекции группы А у млекопитающего, при этом указанный способ включает стадию введения: выделенного белка, содержащего модифицированную аминокислотную последовательность пептида р145, содержащую аминокислотную замену остатков 13 и 17 последовательности SEQ ID NO: 3; антитела или фрагмента антитела, которое связывается или продуцируется против выделенного белка или его фрагмента или варианта; или выделенной нуклеиновой кислоты, кодирующей выделенный белок или его фрагмент или вариант; млекопитающему, чтобы таким образом индуцировать иммунитет против стрептококковой бактериальной инфекции группы А у млекопитающего.
Еще один аспект изобретения обеспечивает способ лечения или предупреждения возникновения бактериальной стрептококковой инфекции группы А у млекопитающего, при этом указанный способ включает стадию введения: выделенного белка, содержащего модифицированную аминокислотную последовательность пептида р145, содержащую аминокислотную замену остатков 13 и 17 последовательности SEQ ID NO: 3; антитела или фрагмента антитела, которое связывается или продуцируется против выделенного белка или его фрагмента или варианта; или выделенной нуклеиновой кислоты, кодирующей выделенный белок или его фрагмент или вариант; млекопитающему, чтобы таким образом предупредить или лечить бактериальную стрептококковую инфекцию группы А у млекопитающего.
Модифицированный пептид р145, его фрагмент или вариант подходящим образом содержит аминокислоту аспарагин (N) в остатке 13 и аминокислоту аргинин (R) в остатке 17.
В одном варианте осуществления модифицированный пептид р145, его фрагмент или вариант содержит аминокислотную последовательность, представленную в SEQ ID NO: 1.
В одном варианте осуществления фрагмент модифицированного пептида р145 содержит аминокислотную последовательность, представленную в SEQ ID NO: 2.
Предпочтительно модифицированный пептид, фрагмент или вариант р145, вызывает иммунный ответ слизистой оболочки при введении млекопитающему.
Соответственно, иммунный ответ слизистой оболочки характеризуется продукцией IgG. Как правило, продуцирование IgA, по существу, отсутствует или находится на относительно сниженном уровне по сравнению с уровнем продуцируемого IgG.
Предпочтительно, модифицированный пептид, фрагмент или вариант р145 вызывает иммунный ответ слизистой оболочки при внутримышечном введении млекопитающему.
Предпочтительно млекопитающее из вышеупомянутых аспектов представляет собой человека.
В конкретном варианте осуществления вышеупомянутых аспектов модифицированный пептид, фрагмент или вариант р145 можно вводить в комбинации с иммуногенным фрагментом белка SpyCEP. Предпочтительно фрагмент SpyCEP представляет собой или содержит пептид S2 (SEQ ID NO: 23) или вариант, такой как пептид K4S2 (SEQ ID NO: 24).
Таким образом, связанный аспект изобретения обеспечивает композицию, содержащую: выделенный белок, содержащий модифицированную аминокислотную последовательность пептида р145, содержащую аминокислотную замену остатков 13 и 17 последовательности SEQ ID NO: 3, его фрагмента или варианта, антитело или фрагмент антитела, которое связывается или продуцируется против выделенного белка или его фрагмента или варианта, или выделенную нуклеиновую кислоту, кодирующую выделенный белок или его фрагмент или вариант; и иммуногенный фрагмент белка SpyCEP или его вариант, антитело или фрагмент антитела, которое связывается или продуцируется против иммуногенного фрагмента SpyCEP или его варианта; или выделенную нуклеиновую кислоту, которая кодирует иммуногенный фрагмент SpyCEP или его вариант.
Соответственно, модифицированная аминокислотная последовательность пептида р145 содержит аминокислоту аспарагин (N) в остатке 13 и аминокислоту аргинин (R) в остатке 17, предпочтительно содержащую аминокислотную последовательность, представленную в SEQ ID NO: 1. Предпочтительно фрагмент модифицированного пептида р145 содержит аминокислотную последовательность, представленную в SEQ ID NO: 2.
В предпочтительном варианте осуществления фрагмент SpyCEP представляет собой или содержит пептид S2, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 23, или его вариант. Вариант может представлять собой пептид K4S2, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 24.
Используемые в настоящем документе неопределенные артикли «а» и «ап» используются здесь для обозначения или охвата единственного или множественного числа элементов или признаков и не должны рассматриваться как означающие или определяющие «один» или «единичный» элемент или признак.
Если контекст не требует иного, термины «содержат», «содержит» и «содержащий» или подобные термины означают неисключительное включение, при котором указанный перечень элементов или признаков не включает в себя те элементы или признаки, которые заявлены или перечислены исключительно, а может включать в себя другие элементы или признаки, которые не перечислены или.
Под выражением «состоящая по существу из» в контексте аминокислотной последовательности понимается указанная аминокислотная последовательность вместе с дополнительной одной, двумя или тремя аминокислотами на N- или С-конце.
Краткое описание чертежей
Фигура 1: Разработка пептидных библиотек: (А) Распознавание различных вариантных пептидов р145 антисывороткой к р145. (А) Пептидную библиотеку, состоящую из 86 вариантов р145, подвергали скринингу с использованием антисыворотки к р145. Антисыворотку к р145 получали у мышей B10.D2, и способность антисыворотки к р145 связываться с каждым пептидом определяли с помощью ELISA. Минимальная последовательность эпитопа из р145 показана в верхней части графика, и в скобках ниже показаны номера пептидных последовательностей, подвергнутых мутации в каждой аминокислоте. Вертикальные линии отделяют пептиды на основе мутации в одном и том же положении. Пептид 87 является неспецифическим контрольным пептидом (pNS). (В) Идентификация иммунодоминантных пептидов в библиотеке вариантов р145. Ингибиторные анализы ELISA (Peptide-inhibition ELISA) проводили для идентификации иммунодоминантных пептидов в пуле вариантов р145. Отобранные пептиды при концентрации 0,25 мкг/мл инкубировали с антисывороткой к р145. Затем сыворотку использовали в ELISA против иммобилизованного р145. Антиген (р145)-специфическую сыворотку собирали у гипериммунизированных мышей B10.D2. Данные для каждого столбца представляют собой средние значения ± SEM. (С) Создание пептидной библиотеки 2 (L2) с двумя изменениями: Отобранные 7 пептидов использовали для создания новой пептидной библиотеки с двумя аминокислотными заменами в положениях, которые, как было идентифицировано, усиливают иммуногенность родительского р145. Показаны полученные пептиды, демонстрирующие мутации в различных положениях в пределах минимального эпитопа р145.
Фигура 2: Иммунные ответы на дважды мутированные пептиды: (А) Иммуногенность отобранных пептидов у аутбредных мышей Quackenbush, показывающих титры в анализе ELISA на иммунизирующий пептид: Группы мышей подкожно иммунизировали пептидным антигеном, составленным с адъювантом, на дни 0, 21 и 28. Мыши в группах с антиген-специфическими титрами ниже 1000 получали дополнительную бустерную иммунизацию на 35-й день (обозначен как "). У мышей забирали кровь на 20, 27, 34 и 41-й день. Контрольные мыши получали исходный р145 или PBS. Антиген-специфические титры IgG в сыворотке определяли с использованием ELISA, и показаны средние значения ± SEM для пептидов 1-5 (1 i), 6-12 (ii) и 13-18 (iii). (В): Связывание антипептидного IgG с иммобилизованным р145: Способность аффинно-очищенного пептид-специфического сывороточного IgG связываться с возрастающими концентрациями пептида р145 определяли с помощью ELISA. Пептид р145, иммобилизованный на планшетах для ELISA, инкубировали со специфическим к различным пептидам очищенным сывороточным IgG от аутбредных мышей Quackenbush. Связывание антител при концентрации 5 мкг/мл показано для (i) пептидов 1-5 и (ii) пептидов 6-10, (iii) пептидов 11-13 и (iv) пептидов 15-18. Показано среднее поглощение (450 нм) ± SEM. ANOVA с множественными сравнительными тестами Холма-Сидака использовали для расчета значимости по сравнению с р145.
Фигура 3: Эффективность связывания пептид-специфических антител с поверхностью GAS. Для определения способности пептид-специфического сывороточного IgG связываться с цельными бактериями проводили анализ методом проточной цитометрии с использованием двух штаммов GAS (А) 2031 (emm1) и (В) 88/30 (етт97). После инкубации с антипептидными антителами FITC-конъюгированный антимышиный IgG использовали для определения связывания антител с GAS. Результаты представлены в виде среднего значения ± SEM средней интенсивности флуоресценции (MFI) для 3 повторностей в каждой группе. Горизонтальная линия на фигуре обозначает относительное связывание специфического к различным пептидам IgG с р145 в сравнении с р145 IgG. ANOVA с методом апостериорного анализа (post-hoc) Тьюки использовали для определения значимости по сравнению с р145. (С) Представлены репрезентативные гистограммы, демонстрирующие связывание р*17-специфического IgG с GAS 2031, 88/30 и JRS145 (М-негативный штамм GAS)
Фигура 4: Иммуногенность и защитная эффективность p145-DT и его варианта p*17-DT в отношении защиты от поверхностной инфекции кожи различными штаммами GAS: Группы мышей BALB/c (n=10 мышей в каждой группе) иммунизировали подкожно 30 мкг составов p145-DT или p*17-DT или PBS-Alum на день 0. Образцы сыворотки собирали на день 20 после иммунизации для оценки р145-специфического ответа IgG. Показаны данные, полученные от некоторых репрезентативных мышей (n=5) (А). На 21 день мышей заражали через кожу инфекцией GAS 2031 (В и С) или GAS 88/30 (D и Е). На 3 и 6 день после инфицирования 5 мышей на группу умерщвляли и собирали образцы для определения бактериальной нагрузки GAS в коже (В и D) и крови (С и Е). Результаты показаны как среднее значение ± SEM для 5 мышей в каждой группе в каждый момент времени. ANOVA с использованием апостериорного (post hoc) метода Тьюки использовали для определения значимости между всеми обработанными и контрольными группами в каждый момент времени. *р<0,05, ***р<0,001.
Фигура 5: Структуры пептидов р145 и р*17: Наложение репрезентативных структур р145 (сиреневый) и р*17 (зеленый), полученных в результате симуляций 50 ns MD с выравниванием на основе СА остатков 3-13 (С-концевые аминокислоты показаны красным, N-концевые аминокислоты показаны синим (A). Lys-13 нарушает спиральный характер в р145. Вероятность принятия пептидами спиральной конформации показана в (В), выявляя, что р145 с меньшей вероятностью будет формировать спиральную конформацию по сравнению с р*17. Среднеквадратичные флуктуации (RMSF) для р145 и р*17 в сравнении показаны на (С). р145 показывает значительно более высокие флуктуации по сравнению с р*17. Наибольшее различие в гибкости можно наблюдать для Lys-13 в р145 по сравнению с Asn-13 в р*17.
Фигура 6: Идентификация иммунодоминантных пептидов в библиотеке вариантов р145. Ингибиторные анализы ELISA проводили для идентификации иммунодоминантных пептидов в пуле вариантов р145. Отобранные пептиды при концентрации 2,5 мкг/мл инкубировали с антисывороткой к р145. Затем сыворотку использовали в ELISA против иммобилизованного р145. Антиген (р145)-специфическую сыворотку собирали у гипериммунизированных мышей B10.D2. Данные для каждого столбца представляют среднее значение ± SEM.
Фигура 7: Перекрестная реактивность пептидной антисыворотки с белками человека. ELISA использовали для определения перекрестной реактивности дважды мутированной пептидной (L2) антисыворотки с человеческими белками (а) тропомиозином, (b) миозином и (с) кератином. Показано среднее поглощение (450 нм) ± SEM.
Фигура 8: Защитная эффективность p145-DT у мышей BALB/c после 1, 2 или 3 иммунизаций: Группы мышей BALB/c (10 мышей на группу) получали 1, 2 или 3 подкожных инъекции p145-DT или PBS с адъювантом на дни 0, 21 и 28. Оценивали эффективность вакцины после заражения кожи 88/30 GAS. Показана бактериальная нагрузка в коже (А) и крови (В) для дней 3 и 6 после инфицирования, соответственно, для групп мышей. Защитная эффективность p*17-DT после однократной иммунизации: (С) Когорты мышей BALB/c (10 мышей на группу) получали однократную иммунизацию p*17-DT, убитые нагреванием GAS (2031) или PBS с адъювантом на дни 0. Антигенспецифические титры IgG определяли на 20 день после иммунизации. Титры для мышей, иммунизированных убитыми нагреванием GAS 1, тестировали против рекомбинантного белка M1, иммобилизованного на планшете для ELISA. Тест Манна-Уитни использовали для определения значимости между двумя вакцинированными группами, где **р<0,01. (D) На 21-й день после иммунизации мышей заражали мутантом CovR/S 5448АР GAS посредством кожного пути инфицирования. Образцы кожи оценивали на бактериальную нагрузку на 3 и 6 день после инфицирования. Показано процентное снижение количества бактерий в группе, иммунизированной p*17-DT или убитыми нагреванием GAS, по сравнению с контрольной когортой, получавшей PBS. ANOVA с использованием апостериорного (post hoc) метода Тьюки использовали для определения значимости между всеми вакцинированными и контрольными группами в каждый момент времени. **р<0,01, ***р<0,001.
Фигура 9: Схема внутримышечной иммунизации. Мышей иммунизировали три (3) раза p*17-DT+K4S2-DT/Alum и интраназально заражали 5448АР (штамм CovR/S МТ).
Фигура 10: Иммуногенность после внутримышечной (i.m.) иммунизации вакцинами на основе р*17. Мышей BALB/c (n=15 на группу; самки в возрасте 4-6 недель) иммунизировали i.m. p*17-DT/Alum, p*17-DT+K4S2-DT/Alum и PBS/Alum на дни 0, 21 и 42. Через неделю после последней бустерной иммунизации собирали образцы сыворотки и слюны и измеряли ответы р*17-специфического IgG (А и С) и IgA (В и D) антитела с помощью ELISA, и представляли в виде среднего значения ± SEM. Титры показаны в сравнении с контрольной группой, которая получала только PBS/Alum.
Фигура 11: Защита от интраназальной инфекции. Через две недели после последней бустерной вакцинации мышей заражали интраназально мутантом covR/S GAS (5448АР). На дни 1-3 собирали назальные выделения (NS). Бактериальную нагрузку в назальных выделениях определяли путем придавливания ноздрей каждой мыши к чашкам с кровяным колумбийским агаром (СВА), содержащим 5% дефибринированной лошадиной крови, и попавшие с дыханием частицы сеяли штрихом. На дни 1-3 NS собирали и представляли в виде логарифмически преобразованного среднего значения + SEM для каждого отдельного дня (А) и в виде кумулятивных КОЕ для всех трех дней вместе (В), о обозначает мышей, отобранных на 2-й день после потери 15% массы тела или более.
Фигура 12: Процентное снижение бактериальной нагрузки в назальных выделениях. Процентное снижение рассчитывали по сравнению с общим средним значением для PBS/Alum в качестве контроля для каждого отдельного дня (А) и в виде кумулятивного снижения для всех трех дней вместе (В), о обозначает мышей, отобранных на 2-й день после потери 15% массы тела или более.
Фигура 13: Защита от интраназальной инфекции. В дополнение к NS на дни 1-3 собирали мазки из зева (TS). Для взятия мазков из зева палочки-тампоны помещали в стерильный PBS для смачивания, затем мышей фиксировали и брали мазки из зева. Палочку-тампон затем суспендировали в PBS, серийно разводили и точечно высевали в двух повторностях на чашки с СВА, содержащие 5% дефибринированной лошадиной крови. На дни 1-3 собирали NS и представляли в виде логарифмически преобразованного среднего значения КОЕ/мл ± SEM для каждого отдельного дня (А) и в виде кумулятивных КОЕ для всех трех дней вместе (В), о обозначает мышей, отобранных на 2-й день после потери массы тела 15% или более.
Фигура 14: Процентное снижение бактериальной нагрузки в мазках из зева. Процентное снижение рассчитывали по сравнению с общим средним значением для PBS/Alum в качестве контроля для каждого отдельного дня (А) и в виде кумулятивного снижения для всех трех дней вместе (В), о обозначает мышей, отобранных на 2-й день после потери массы тела 15% или более.
Фигура 15: Защита после интраназального инфицирования. На 3-й день после инфицирования всех выживших мышей умерщвляли и собирали образцы NALT, легких, селезенки и крови для определения бактериальной нагрузки GAS, данные представлены в виде логарифмически преобразованного среднего значения КОЕ/мл ± SEM (А) и в виде процентного снижения по сравнению с PBS/Alum в качестве контроля (В), о обозначает мышей, отобранных на 2-й день после потери массы тела на 15%) или более.
Фигура 16: Сравнения структур пептидов J8, р145 и р*17. MD моделирование, сравнивающее структуры пептидов р*17 и J8 в отношении (А) процента спиральности и (В) RMS-флуктуации.
Краткое описание последовательностей


SEQ ID NO: 25-111 В таблице 3 представлена пептидная библиотека в убывающем числовом порядке от пептида 1 до пептида 87, соответственно.
SEQ ID NO: 112: SGSGLRRDLDASREAKKQVEKALE
Подробное описание изобретения
Настоящее изобретение по меньшей мере частично основано на открытии того, что определенные аминокислоты пептида р145 могут быть модифицированы для существенного улучшения иммуногенности против стрептококков группы А. Однократная иммунизация модифицированным пептидом р145 вместо множественных иммунизаций может защитить от стрептококковой инфекции группы А, вызванной даже гипервирулентными штаммами, такими как мутантный штамм CovR/S. Более конкретно, модифицированный пептид р145 может индуцировать иммунитет слизистой оболочки, характеризующийся продукцией IgG, а не IgA. Иммунитет слизистой оболочки может быть вызван после внутримышечного введения пептида.
Широкий аспект изобретения направлен на применение выделенного пептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 1, называемого в настоящем документе как «пептид р*17», для индукции или вызывания иммунитета к бактериальной стрептококковой инфекции группы А. Предпочтительно выделенный пептид индуцирует иммунитет слизистой оболочки к бактериальной стрептококковой инфекции группы А.
В некоторых вариантах осуществления пептид р*17 можно вводить в комбинации с фрагментом белка SpyCEP. Фрагмент SpyCEP может представлять собой пептид «S2», в частности, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 23, или вариант, содержащий аминокислотную последовательность, такую как приведенная в SEQ ID NO: 24, как будет описано более подробно далее в настоящем документе.
Используемые в настоящем документе термины «стрептококк группы А», «стрептококки группы А», «стрептококковая группа А», «стреп. группы А» и аббревиатура «GAS» относятся к стрептококковым бактериям серогруппы А по классификации Lancefield, которые являются грамположительными β-гемолитическими бактериями видов Streptococcus pyogenes. Важным фактором вирулентности GAS является белок М, который обладает сильной антифагоцитарной активностью и связывается с сывороточным уровнем фактора Н, разрушая С3-конвертазу и предотвращая опсонизацию фрагментом комплемента C3b. Они также включают вирулентные «мутанты», такие как мутанты CovR/S или CovRS, в частности, описанные в Graham et al., 2002, PNAS USA 99 13855, хотя ими не ограничиваются.
Заболевания и состояния, вызванные стрептококками группы А, включают целлюлит, рожистое воспаление, импетиго, скарлатину, инфекции горла, такие как острый фарингит («ангина»), бактериемия, синдром токсического шока, некротический фасциит, острая ревматическая лихорадка и острый гломерулонефрит, хотя ими не ограничиваются.
Для целей данного изобретения под термином «выделенный» понимается материал, который был удален из своего естественного состояния или иным образом был подвергнут манипуляциям человеком. Выделенный материал может по существу или в основном не содержать компоненты, которые обычно сопровождают его в его естественном состоянии, или может быть подвергнут манипуляциям таким образом, чтобы находиться в искусственном состоянии вместе с компонентами, которые обычно сопровождают его в его естественном состоянии. Выделенный материал может находиться в нативной, химической синтетической или рекомбинантной форме.
Под термином «белок» понимается полимер аминокислоты. Аминокислоты могут представлять собой природные или неприродные аминокислоты, D- или L-аминокислоты, хорошо известные в данной области.
Термин «белок» включает и охватывает «пептид», который обычно используется для описания белка, имеющего не более пятидесяти (50) аминокислот, и «полипептид», который обычно используется для описания белка, имеющего более пятидесяти (50) аминокислот.
Авторы изобретения показали, что модификация аминокислотной последовательности пептида р145 «дикого типа» или «немодифицированного» пептида p145 существенно улучшает или усиливает иммуногенность пептида. Как правило, модификация включает замену одной или нескольких аминокислот пептида р145.
Это позволяет избежать необходимости добавления гетерологичной аминокислотной последовательности GCN4 к пептиду р145 для поддержания желаемой альфа-спиральной структуры пептида. Тем не менее, без привязки к теории, молекулярно-динамическое моделирование показывает, что в отличие от р145 дикого типа или немодифицированного р145, раскрытый в настоящем документе модифицированный пептид р145 не имеет «изгиба» в своей структуре, который может быть по меньшей мере частично ответственным за его улучшенную иммуногенность.
Соответственно, пептид р145 «дикого типа» или немодифицированный пептид р145 содержит аминокислотную последовательность LRRDLDASREAKKQVEKALE (SEQ ID NO: 3). Минимальная последовательность эпитопа Р145 представляет собой SREAKKQVEKAL (SEQ ID NO: 4).
Предпочтительно модифицированный пептид р145 содержит остаток N, соответствующий остатку 13 последовательности SEQ ID NO: 3, и аминокислоту R в остатке 17 последовательности SEQ ID NO: 3.
Предпочтительно минимальный эпитоп модифицированного р145 содержит остаток N, соответствующий остатку 6 последовательности SEQ ID NO: 1, и аминокислоту R в остатке 10 последовательности SEQ ID NO: 1.
В одном варианте осуществления пептид р*17 содержит аминокислотную последовательность LRRDLDASREAKNQVERALE (SEQ ID NO: 1).
В одном варианте осуществления модифицированный минимальный эпитоп р*17 содержит аминокислотную последовательность SREAKNQVERAL (SEQ ID NO: 2).
Изобретение также обеспечивает фрагмент модифицированного пептида р145, раскрытого в настоящем документе.
«Фрагмент» представляет собой сегмент, домен, часть или участок белка или пептида (такой как SEQ ID NO: 1, SEQ ID NO: 2, SpyCEP, SEQ ID NO: 23 или SEQ ID NO: 24), который составляет менее 100% аминокислотной последовательности белка. Должно быть понятно, что фрагмент может представлять собой единичный фрагмент или может представлять собой повторяющийся фрагмент, взятый в отдельности или с другими фрагментами.
Как правило, фрагменты могут содержать, состоять в основном или состоять из 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18 или 19 смежных аминокислот (таких как SEQ ID NO: 1, SEQ ID NO: 2, SpyCEP, SEQ ID NO: 23 или SEQ ID NO: 24). В одном варианте осуществления фрагмент содержит остаток N, соответствующий остатку 13 последовательности SEQ ID NO: 1, и аминокислоту R в остатке 17 последовательности SEQ ID NO: 1. Неограничивающий пример фрагмента содержит аминокислотную последовательность SREAKNQVERAL (SEQ ID NO: 2).
Соответственно, фрагмент представляет собой иммуногенный фрагмент.В контексте настоящего изобретения термин «иммуногенный», используемый в настоящем документе, указывает на способность или потенциал генерировать или вызывать иммунный ответ, такой как на стрептококк группы А или его молекулярные компоненты, такие как белок М или эпитоп белка М, соответствующий р145, при введении иммуногенного фрагмента млекопитающему. Предпочтительно иммунный ответ, вызванный иммуногенным фрагментом, представляет собой иммунный ответ слизистой оболочки.
Под выражением «вызывать иммунный ответ» подразумевается генерирование или стимулирование продукции или активности одного или нескольких элементов иммунной системы, включая клеточную иммунную систему, антитела и/или врожденную иммунную систему. Соответственно, один или несколько элементов иммунной системы включают В-лимфоциты, антитела и нейтрофилы. Предпочтительно иммунный ответ представляет собой иммунный ответ слизистой оболочки. Как правило, иммунные ответы слизистой оболочки характеризуются продукцией IgA с минимальной продукцией других изотипов антител, таких как IgG. Неожиданно было обнаружено, что иммунный ответ слизистой оболочки, вызванный пептидом р*17, раскрытым в настоящем документе, характеризуется продукцией IgG. Продукция IgA является относительно сниженной по сравнению с продукцией IgG или практически отсутствует.
Используемый в настоящем документе «вариант» белка имеет такую же поддающуюся определению нуклеотидную или аминокислотную последовательность, что и эталонная аминокислотная последовательность. Эталонная аминокислотная последовательность может представлять собой, например, аминокислотную последовательность, представленную в SEQ ID NO: 1 или SEQ ID NO: 2, или SEQ ID NO: 23. «Вариантный» белок может иметь одну или множество аминокислот эталонной аминокислотной последовательности, которые удалены или замещены различными аминокислотами. В данной области техники хорошо известно, что некоторые аминокислоты могут быть замещены или удалены без изменения активности иммуногенного фрагмента и/или белка (консервативные замены). Предпочтительно варианты белка обладают по меньшей мере 70% или 75%, предпочтительно по меньшей мере 80% или 85%, или более предпочтительно по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с эталонной аминокислотной последовательностью.
В конкретных вариантах осуществления вариант может содержать: остаток N, соответствующий остатку 13 последовательности SEQ ID NO: 1, и аминокислоту R, соответствующую остатку 17 последовательности SEQ ID NO: 1; или остаток N, соответствующий остатку 6 последовательности SEQ ID NO: 2, и аминокислоту R, соответствующую остатку 10 последовательности SEQ ID NO: 2. Соответственно, один или несколько других остатков последовательности SEQ ID NO: 1 или SEQ ID NO: 2 могут быть консервативно модифицированы (например, путем замены или делеции аминокислоты) таким образом, что вариант по существу сохраняет иммуногенность SEQ ID NO: 1 или SEQ ID NO: 2. В этой связи делается ссылка на таблицу 2 и примеры, которые описывают модификации аминокислот, отличных от остатков 13 и 17 последовательности SEQ ID NO: 1, и их эффекты на иммуногенность.
В одном конкретном варианте осуществления вариантный белок или пептид может содержать один или множество остатков лизина на своем N- и/или С-конце. Множество остатков лизина (например, полилизин) могут представлять собой линейную последовательность остатков лизина или могут представлять собой последовательности остатков лизина с разветвленной цепью. Эти дополнительные остатки лизина могут способствовать увеличению растворимости пептидов. Неограничивающий пример такого варианта обозначается как «K4S2» (SEQ ID NO: 24).
Терминами, обычно используемыми в настоящем документе для описания взаимосвязей последовательностей между соответствующими белками и нуклеиновыми кислотами, являются «окно сравнения», «идентичность последовательностей», «процент идентичности последовательностей» и «существенную идентичность». Поскольку каждая из соответствующих нуклеиновых кислот/белков может содержать (1) только одну или несколько частей полноразмерной последовательности нуклеиновой кислоты/белка, которые являются сходными у нуклеиновых кислот/белков, и (2) одну или несколько частей, которые отличаются у нуклеиновых кислот/белков, то сравнение последовательностей обычно осуществляют путем сопоставления последовательностей по «окну сравнения» для идентификации и сравнения локальных областей гомологии последовательностей. «Окно сравнения» относится к концептуальному сегменту, как правило, из 6, 9 или 12 смежных остатков, в котором осуществляют сравнение с эталонной последовательностью. Для оптимального выравнивания соответствующих последовательностей, окно сравнения может включать добавления или делеции (т.е. пробелы), составляющие приблизительно 20% или менее по сравнению с эталонной последовательностью. Оптимальное выравнивание последовательностей для их сопоставления в окне сравнения может быть осуществлено посредством компьютеризированной реализации алгоритмов (Geneworks фирмы Intelligenetics; GAP, BESTFIT, FASTA и TFASTA в пакете компьютерных программ Wisconsin Genetics Software Package Release 7.0, Genetics Computer Group, 575 Science Drive Madison, WI, USA, включенных в настоящий документ посредством ссылки) или путем оценки и наилучшего выравнивания (т.е. получения наивысшего процента гомологии в окне сравнения), достигаемого с применением различных выбранных методов. Может быть также упомянуто семейство программ BLAST, например, описанных в работе Altschul et al., 1997, Nucl. Acids Res. 25 3389, включенной в настоящий документ посредством ссылки. Подробное обсуждение анализа последовательности можно найти в Разделе 19.3 руководства CURRENT PROTOCOLS IN MOLECULAR BIOLOGY Eds. Ausubel et al. (John Wiley & Sons Inc NY, 1995-1999).
Термин «идентичность последовательностей» используется в настоящем документе в самом широком смысле для включения числа точных соответствий нуклеотидов или аминокислот исходя из соответствующего выравнивания с использованием стандартного алгоритма с учетом степени идентичности последовательностей в окне сравнения. Таким образом, «процент идентичности последовательности» вычисляют путем сравнения двух оптимально выровненных последовательностей в окне сравнения; определения числа положений, в которых основания нуклеиновой кислоты (например, А, Т, С, G, I) являются идентичными в обеих последовательностях, в результате чего получают число соответствующих положений; деления этого числа соответствующих положений на общее число положений в окне сравнения (т.е. на размер окна); и умножения полученного результата на 100 с получением процента идентичности последовательностей. Например, «идентичность последовательностей» можно определить как «процент соответствий», вычисленный с помощью компьютерной программы DNASIS (версия 2.5 для Windows; поставляемая в пакете программ Hitachi Software engineering Co., Ltd., South San Francisco, California, USA).
Изобретение также обеспечивает производное модифицированного пептида р145, раскрытого в настоящем документе. Соответственно, модифицированный пептид р145 содержит аминокислотную последовательность, представленную в SEQ ID NO: 1 или SEQ ID NO: 2.
Используемый в настоящем документе термин «производные» представляет собой молекулы, такие как белки, их фрагменты или варианты, которые были изменены, например, путем конъюгации или образования комплексов с другими химическими фрагментами, путем посттрансляционной модификации (например, фосфорилирования, ацетилирования и т.п.), модификации гликозилирования (например, добавление, удаление или изменение гликозилирования), липидирования и/или включения дополнительных аминокислотных последовательностей, как понимается в данной области. В одном конкретном варианте осуществления дополнительная аминокислотная последовательность может содержать один или множество остатков лизина на ее N- и/или С-конце. Множество остатков лизина (например, полилизин) может представлять собой линейную последовательность остатков лизина или может представлять собой последовательности остатков лизина с разветвленной цепью. Эти дополнительные остатки лизина могут способствовать повышению растворимости пептидов. Другое конкретное производное получают путем конъюгации пептида с дифтерийным токсином (DT). Этому может способствовать добавление С-концевого остатка цистеина
Дополнительные аминокислотные последовательности могут включать аминокислотные последовательности партнера по слияния, которые создают белок слияния. Например, аминокислотные последовательности партнера по слиянию могут способствовать обнаружению и/или очистке выделенного белка слияния. Неограничивающие примеры включают металлсвязывающие (например, полигистидин) партнеры по слиянию, мальтоза-связывающий белок (МВР), белок А, глутатион-S-трансферазу (GST), последовательности флуоресцентного белка (например, GFP), эпитопные метки, такие как myc, FLAG, и гемагглютининовая метка.
Другие дополнительные аминокислотные последовательности могут принадлежать белкам-носителям, таким как дифтерийный анатоксин (DT) или его фрагмент, или фрагмент белка CRM, такого как описанный в международной публикации WO 2017/070735.
Другие производные, предусмотренные изобретением, включают, но без ограничения, модификацию боковых цепей, включение неприродных аминокислот и/или их производных во время пептидного или белкового синтеза, и использование кросс-линкеров, и другие способы, которые накладывают конформационные ограничения на иммуногенные белки, фрагменты и варианты по изобретению.
В этом отношении квалифицированный специалист обращается к Главе 15 CURRENT PROTOCOLS IN PROTEIN SCIENCE, Eds. Coligan et al. (John Wiley & Sons NY 1995-2008) за более обширной методологией, касающейся химической модификации белков.
Выделенные иммуногенные белки, фрагменты и/или производные по настоящему изобретению могут быть получены любыми способами, известными в данной области, включая, но без ограничения, химический синтез, технологию рекомбинантной ДНК и протеолитическое расщепление, для получения пептидных фрагментов.
Химический синтез включает твердофазный синтез и синтез в жидкой фазе. Такие способы хорошо известны в данной области, при этом ссылка делается на примеры методов химического синтеза, представленных в Главе 9 SYNTHETIC VACCINES Ed. Nicholson (Blackwell Scientific Publications) и Главе 15 CURRENT PROTOCOLS IN PROTEIN SCIENCE Eds. Coligan et al., (John Wiley & Sons, Inc. NY USA 1995-2008). В этой связи, ссылка также делается на международную публикацию WO 99/02550 и международную публикацию WO 97/45444.
Рекомбинантные белки могут быть легко получены специалистом в данной области с использованием стандартных протоколов, таких как, например, описанные в Sambrook et al., MOLECULAR CLONING. A Laboratory Manual (Cold Spring Harbor Press, 1989), в частности, в Разделах 16 и 17; CURRENT PROTOCOLS IN MOLECULAR BIOLOGY Eds. Ausubel et al., (John Wiley & Sons, Inc. NY USA 1995-2008), в частности, в Главах 10 и 16; и CURRENT PROTOCOLS IN PROTEIN SCIENCE Eds. Coligan et al., (John Wiley & Sons, Inc. NY USA 1995-2008), в частности в Главах 1, 5 и 6. Как правило, получение рекомбинантного белка включает экспрессию нуклеиновой кислоты, кодирующей белок, в подходящей клетке-хозяине.
Другой аспект изобретения обеспечивает антитело или фрагмент антитела, которое связывается с выделенным иммуногенным пептидом или продуцируется против выделенного иммуногенного пептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 1, или его фрагмента, варианта или производного.
Соответственно, антитело или фрагмент антитела специфически связывается с выделенным иммуногенным пептидом, содержащим аминокислотную последовательность, представленную в SEQ ID NO: 1, или фрагментом, содержащим аминокислотную последовательность, представленную в SEQ ID NO: 2. В некоторых вариантах осуществления антитело или фрагмент антитела связывается с пептидом р145 или минимальной последовательностью эпитопа, такой как последовательность, представленная в SEQ ID NO: 3 или SEQ ID NO: 4, со значительно более высокой аффинностью, чем антитело, продуцируемое против пептида р145. В этом контексте под «существенно более высокой аффинностью» подразумевается аффинность, которая по меньшей мере в 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз выше при определенной концентрации пептида р145.
Антитела и фрагменты антител могут быть поликлональными или моноклональными, нативными или рекомбинантными. Фрагменты антител включают фрагменты Fc, Fab или F(ab)2 и/или могут содержать одноцепочечные Fv-фрагменты антител (scFv). Такие scFv могут быть получены, например, в соответствии со способами, описанными соответственно в патенте США 5091513, европейском патенте 239400 или статье Winter & Mil stein, 1991, Nature 349:293. Антитела также могут включать поливалентные рекомбинантные фрагменты антител, такие как диатела, триатела и/или тетратела, содержащие множество scFv, а также активированные димеризацией демитела (например, WO/2007/062466). В качестве примера, такие антитела могут быть получены в соответствии со способами, описанными в Holliger et al., 1993 Proc Natl Acad Sci USA 90 6444; или в Kipriyanov, 2009 Methods Mol Biol 562 177. Хорошо известные протоколы, которые можно использовать для получения, очистки и применения антител, можно найти, например, в Главе 2 Coligan et al., CURRENT PROTOCOLS IN IMMUNOLOGY (John Wiley & Sons NY, 1991-1994) и Harlow, E. & Lane, D. Antibodies: A Laboratory Manual., Cold Spring Harbour, Cold Spring Harbour Laboratory, 1988.
Способы получения поликлональных антител хорошо известны специалистам в данной области. Иллюстративные протоколы, которые могут быть использованы, описаны, например, в Coligan et al., CURRENT PROTOCOLS IN IMMUNOLOGY выше, и в Harlow & Lane, 1988, выше. В конкретном варианте осуществления поликлональные антитела против SpyCEP могут быть получены или очищены из человеческой сыворотки от индивидуумов, подвергшихся воздействию или инфицированных стрептококком группы А. Альтернативно, поликлональные антитела могут быть продуцированы против очищенного или рекомбинантного SpyCEP, или его иммуногенного фрагмента у продуцирующих видов, таких как лошади, и затем последовательно очищены перед введением.
Моноклональные антитела могут быть получены с использованием стандартного способа, например, первоначально описанного в статье Kohler & Milstein, 1975, Nature 256, 495, или с помощью его более поздних модификаций, как, например, описано в Coligan et al., CURRENT PROTOCOLS IN IMMUNOLOGY выше, путем иммортализации селезенки или других продуцирующих антитело клеток, полученных от продуцирующих видов, которые были инокулированы одним или несколькими выделенными белками, фрагментами, вариантами или производными по изобретению. В определенных вариантах осуществления моноклональное антитело или его фрагмент может быть представлен в рекомбинантной форме. Это может быть особенно выгодно для «гуманизации» моноклонального антитела или фрагмента, если моноклональное антитело первоначально продуцируется клетками селезенки млекопитающего, не являющегося человеком.
В некоторых вариантах осуществления антитело или фрагмент антитела можно вводить млекопитающему для обеспечения «пассивного» иммунитета к стрептококковой инфекции группы А.
Некоторые дополнительные аспекты и варианты осуществления изобретения относятся к введению одной или нескольких нуклеиновых кислот, кодирующих выделенный иммуногенный пептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:1, или его фрагмент, вариант или производное для:
(i) вызывания иммунного ответа на стрептококковые бактерии группы А у млекопитающего;
(ii) иммунизации млекопитающего против стрептококковых бактерий группы А; и/или
(iii) лечения или предупреждения стрептококковой бактериальной инфекции группы А у млекопитающего.
Используемый в настоящем документе термин «нуклеиновая кислота» обозначает одно- или двухцепочечную ДНК и РНК. ДНК включает геномную ДНК и кДНК. РНК включает мРНК, РНК, РНК-интерференцию (RNAi), малую интерферирующую РНК (siRNA), кРНК и аутокаталитическую РНК. Нуклеиновые кислоты могут также представлять собой гибриды ДНК-РНК. Нуклеиновая кислота содержит нуклеотидную последовательность, которая обычно включает нуклеотиды, содержащие основание A, G, С, Т или U. Однако нуклеотидные последовательности могут включать другие основания, такие как модифицированные пурины (например, инозин, метилинозин и метиладенозин) и модифицированные пиримидины (например, тиоуридин и метилцитозин).
В предпочтительной форме выделенная нуклеиновая кислота, кодирующая иммуногенный пептид, его фрагмент, вариант или производное, находится в форме генетической конструкции, подходящей для введения млекопитающему, такому как человек. Предпочтительно генетическая конструкция является подходящей для ДНК-вакцинации млекопитающего, такого как человек.
Соответственно, генетическая конструкция находится в форме генетических компонентов - плазмиды, бактериофага, космиды, дрожжей или бактериальной искусственной хромосомы, которые хорошо известны в данной области, или содержит их. Генетические конструкции могут быть также подходящими для поддержания и размножения выделенной нуклеиновой кислоты в бактериях или других клетках-хозяевах, для манипуляции с помощью технологии рекомбинантных ДНК.
Для целей экспрессии белка генетическая конструкция представляет собой экспрессионную конструкцию. Соответственно, экспрессионная конструкция содержит одну или несколько нуклеиновых кислот, функционально связанных с одной или несколькими дополнительными последовательностями в экспрессионном векторе. «Экспрессионный вектор» может представлять собой либо самореплицирующийся внехромосомный вектор, такой как плазмида, либо вектор, который интегрируется в геном хозяина.
Под выражением «функционально связанная или соединенная» подразумевается, что указанная дополнительная нуклеотидная последовательность(и) расположена/расположены относительно нуклеиновой кислоты по изобретению предпочтительно для инициации, регуляции или иного контроля транскрипции.
Регуляторные нуклеотидные последовательности, в целом, будут подходящими для клетки-хозяина или ткани, где требуется экспрессия. В данной области известны различные типы подходящих экспрессионных векторов и подходящих регуляторных последовательностей для разнообразных клеток-хозяев.
Как правило, указанная одна или несколько регуляторных нуклеотидных последовательностей могут включать, но без ограничения, промоторные последовательности, лидерные или сигнальные последовательности, сайты связывания рибосом, последовательности начала и окончания транскрипции, последовательности начала и окончания трансляции, и последовательности энхансера или активатора. Конститутивные или индуцибельные промоторы, известные в данной области, рассматриваются в изобретении. Экспрессионная конструкция может также включать дополнительную нуклеотидную последовательность, кодирующую партнера по слиянию (обычно обеспеченную экспрессионным вектором), таким образом, что рекомбинантный белок по изобретению экспрессируется в виде белка слияния, как описано выше в настоящем документе.
Соответственно, ДНК-вакцинация осуществляется посредством одной или нескольких экспрессионных конструкций плазмидной ДНК. Плазмиды обычно содержат вирусный промотор (такой как промоторы SV40, RSV или CMV). Интрон А может быть включен для улучшения стабильности мРНК и тем самым увеличения экспрессии белка. Плазмиды могут, кроме того, включать сайт множественного клонирования, сильный сигнал полиаденилирования/терминации транскрипции, такой как последовательности полиаденилирования бычьего гормона роста или бета-глобулина кролика. Плазмида может, кроме того, содержать цис-действующие транскрипционные элементы вируса обезьяны Мэйзена-Пфейзера (MPV-CTE) с повышенной экспрессией белка оболочки rev ВИЧ или без нее. Дополнительные модификации, которые могут улучшать экспрессию, включают вставку последовательностей энхансера, синтетических интронов, трехкомпонентных лидерных последовательностей аденовируса (TPL) и/или модификации последовательностей полиаденилирования и/или терминации транскрипции. Неограничивающим примером плазмиды ДНК-вакцины является pVAC, которая коммерчески доступна от фирмы Invivogen.
Полезным источником, описывающим ДНК-вакцинологию, является «DNA Vaccines, Methods and Protocols)), второе издение (Volume 127 of Methods in Molecular Medicine series, Humana Press, 2006).
Как описано выше в настоящем документе, изобретение обеспечивает композиции, вакцины и/или способы иммунизации, предупреждения или лечения заболевания, нарушения или состояния, связанного со стрептококком группы А, у млекопитающего. Соответственно, композиции, вакцины и/или способы иммунизации, предупреждения или лечения заболевания, нарушения или состояния, связанного со стрептококком группы А, вызывают иммунный ответ слизистой оболочки при введении млекопитающему. Предпочтительно иммунный ответ слизистой оболочки характеризуется продукцией IgG по сравнению с более низким уровнем или отсутствием IgA.
Используемые в настоящем документе термины «иммунизировать», «вакцинировать» и «вакцина» относятся к способам и/или композициям, которые вызывают защитный иммунный ответ против стрептококков группы А, посредством чего последующее инфицирование стрептококком группы А по меньшей мере частично предупреждается или сводится к минимуму.
Используемый в настоящем документе термин «лечение», «лечить» или «терапия» относится к терапевтическому воздействию, при котором по меньшей мере частично устраняется, ликвидируется или уменьшается симптом или патологический признак заболевания, нарушения или состояния, связанного со стрептококком группы А, после начала его развития. Лечение может не быть абсолютно успешным для субъекта. Благоприятный эффект может быть определен с использованием любых способов или стандартов, известных специалисту в данной области.
Используемый в настоящем документе термин «предупреждение», «предупреждать» или «профилактика» относится к порядку действий, инициированных до инфицирования или подвергания воздействию стрептококка группы А, и/или до появления симптома или патологического признака заболевания, нарушения или состояния, связанного со стрептококком группы А, чтобы таким образом предупредить возникновение инфекции и/или уменьшить симптом или патологический признак. Следует понимать, что такое предупреждение может не быть абсолютно успешным для субъекта. «Профилактическое» лечение представляет собой лечение, проводимое у субъекта, который не проявляет признаков заболевания, нарушения или состояния, связанного со стрептококком группы А, или проявляет только ранние признаки, с целью уменьшения риска развития симптома или патологического признака заболевания, нарушения или состояния, связанного со стрептококком группы А.
В контексте настоящего изобретения под «заболеванием, нарушением или состоянием, связанным со стрептококком группы А» подразумевается любая клиническая патология, возникающая в результате инфекции, вызванной стрептококком группы А, и включает целлюлит, рожистое воспаление, импетиго, скарлатину, инфекции горла, такие как острый фарингит («ангина»), бактериемия, синдром токсического шока, некротический фасциит, острая ревматическая лихорадка и острый гломерулонефрит, хотя ими не ограничивается.
В определенных аспектах и вариантах осуществления пептид, фрагмент, вариант или производное р*17, выделенные нуклеиновые кислоты, генетические конструкции, антитела и/или фрагменты антител, раскрытые в настоящем документе, можно вводить млекопитающему отдельно или в комбинации в форме композиции.
В предпочтительной форме композиция содержит приемлемый носитель, разбавитель или вспомогательное вещество.
Под «приемлемым носителем, разбавителем или вспомогательным веществом» подразумевается твердый или жидкий наполнитель, разбавитель или инкапсулирующее вещество, которое можно безопасно использовать при системном введении. В зависимости от конкретного пути введения могут быть использованы разнообразные носители, разбавители и вспомогательные вещества, хорошо известные в данной области. Они могут быть выбраны из группы, включающей сахара, крахмалы, целлюлозу и ее производные, солод, желатин, тальк, сульфат кальция, растительные масла, синтетические масла, полиолы, альгиновую кислоту, фосфатные буферные растворы, эмульгаторы, изотонический солевой раствор и соли, такие как соли минеральных кислот, включая гидрохлориды, бромиды и сульфаты, органических кислот, такие как ацетаты, пропионаты и малонаты, воду и апирогенную воду.
Полезной ссылкой, описывающей приемлемые носители, разбавители и вспомогательные вещества, является Remington's Pharmaceutical Sciences (Mack Publishing Co. N.J. USA, 1991), которая включена в настоящий документ посредством ссылки.
Предпочтительно, чтобы вызвать иммунный ответ, определенные иммунологические агенты можно использовать в комбинации с пептидом, фрагментом, вариантом или производным р*17.
Термин «иммунологический агент» включает в себя носители, агенты для доставки, иммуностимуляторы и/или адъюванты, которые хорошо известны в данной области. Как будет понятно из уровня техники, иммуностимуляторы и адъюванты относятся к одному или нескольким веществам или включают одно или несколько веществ, которые усиливают иммуногенность и/или эффективность композиции. Неограничивающие примеры подходящих иммуностимуляторов и адъювантов включают сквалан и сквален (или другие масла растительного или животного происхождения); блок-сополимеры; детергенты, такие как Tween®-80; Quil® А, минеральные масла, такие как Drakeol или Marcol, растительные масла, такие как арахисовое масло; адъюванты, происходящие из коринебактерий, таких как Corynebacterium parvum; адъюванты, происходящие из пропионовокислых бактерий, таких как Propionibacterium acne; Mycobacterium bovis (бацилла Кальметта-Герена или BCG); антигены Bordetella pertussis; столбнячный анатоксин; дифтерийный анатоксин; поверхностно-активные вещества, такие как гексадециламин, октадециламин, октадециловые эфиры аминокислот, лизолецитин, диметилдиоктадециламмония бромид, N,N-дикоктадецил-N',N'-бис(2-гидроксиэтил-пропандиамин), метоксигексадецилглицерол и полиолы плюроник; полиамины, такие как пиран, декстрансульфат, поли-IC карбопол; пептиды, такие как мурамилдипептид и его производные, диметилглицин, туфтсин; масляные эмульсии; и минеральные гели, такие как фосфат алюминия, гидроксид алюминия или Alum; интерлейкины, такие как интерлейкин 2 и интерлейкин 12; монокины, такие как интерлейкин 1; фактор некроза опухоли; интерфероны, такие как гамма-интерферон; иммуностимулирующая ДНК, такая как CpG-ДНК, комбинации, такие как сапонин-гидроксид алюминия или Quil А-гидроксид алюминия; липосомы (например, см. международную публикацию WO 2017/07073 5); адъювант ISCOM® и ISCOMATRIX®; экстракт клеточной стенки микобактерий; синтетические гликопептиды, такие как мурамилдипептиды или другие производные; Avridine; производные липида А; декстрансульфат; взятый в отдельности DEAE-декстран или вместе с фосфатом алюминия; карбоксиполиметилен, такой как Carbopol' ЕМА; эмульсии акрилового сополимера, такие как Neocryl А640 (например, патент США 5047238); эмульгаторы вода-в-масле, такие как Montanide ISA 720; полиовирус, белки коровьей оспы или вируса оспы животных; или их смеси.
Иммунологические агенты могут включать носители, такие как тиреоглобулин и дифтерийный анатоксин (DT); альбумины, такие как человеческий сывороточный альбумин; токсины, токсоиды или любой мутантный перекрестно-реактивный материал (CRM) токсина из столбняка, дифтерии, коклюша, Pseudomonas, E.coli, Staphylococcus и Streptococcus; полиаминокислоты, такие как поли(лизин: глутаминовая кислота); грипп; Ротавирус VP6, парвовирус VP1 и VP2; основной белок вируса гепатита В; рекомбинантную вакцину против вируса гепатита В и т.п. Альтернативно можно использовать фрагмент или эпитоп белка-носителя или другого иммуногенного белка. Например, можно использовать Т-клеточный эпитоп бактериального токсина, анатоксина или CRM. В связи с этим ссылка может быть сделана на патент США 5785973, который включен в настоящий документ посредством ссылки. Другие иммунологические агенты могут включать иммуногенные пептиды из стрептококковых белков группы А, отличных от белка М, например, пептид SpyCEP, как описано в международной публикации WO 2015/157820.
Любая подходящая методика рассматривается для получения вакцинных композиций. В качестве примера, методики включают, например, методики, описанные в работе New Generation Vaccines (1997, Levine et al., Marcel Dekker, Inc. New York, Basel, Hong Kong), которая включена в настоящий документ посредством ссылки.
В некоторых вариантах осуществления композиции и вакцины можно вводить млекопитающим в форме аттенуированных или инактивированных бактерий, которые могут быть генетически модифицированы для экспрессии пептида, фрагмента, варианта или производного р*17 и/или агента, который способствует восстановлению или усилению активности нейтрофилов. Неограничивающие примеры аттенуированных бактерий включают виды Salmonella, например Salmonella enterica серовар Typhimurium или Salmonella typhi. Альтернативно, другие кишечные патогены, такие как виды Shigella или E.coli, могут быть использованы в аттенуированной форме. Аттенуированные штаммы Salmonella сконструированы путем инактивации генов в пути биосинтеза ароматических аминокислот (Alderton et al., Avian Diseases 35 435), путем введения мутаций в два гена в пути биосинтеза ароматических аминокислот (как описано в патенте США 5770214) или в другие гены, такие как htrA (например, как описано в патенте США 5980907), или в гены, кодирующие белки наружных мембран, такие как ompR (в частности, описанных в патенте США 5851519).
Может быть использован любой безопасный путь введения, включая, но без ограничения, пероральное, ректальное, парентеральное, подъязычное, буккальное, внутривенное, внутрисуставное, внутримышечное, внутрикожное, подкожное, ингаляционное, внутриглазное, внутрибрюшинное, интрацеребровентрикулярное, местное, мукозальное и трансдермальное введение.
В одном конкретном варианте осуществления введение является внутримышечным, например, путем одной или нескольких внутримышечных инъекций. Как правило, интраназальное введение считается оптимальным для индукции иммунитета слизистой оболочки. Удивительно, что внутримышечное введение пептида р*17 вызывает иммунный ответ слизистой оболочки на стрептококковые бактерии группы А.
Лекарственные формы включают таблетки, дисперсии, суспензии, инъекции, растворы, сиропы, троше, капсулы, назальные спреи, суппозитории, аэрозоли, трансдермальные пластыри и т.п. Эти лекарственные формы могут также включать устройства для инъекции или имплантации с контролируемым высвобождением, разработанные специально для этой цели, или другие формы имплантатов, модифицированных для дополнительного действия таким образом. Контролируемое высвобождение может быть достигнуто с помощью покрытия гидрофобными полимерами, включая акриловые смолы, воски, высшие алифатические спирты, полимолочную и полигликолевую кислоты, и некоторые производные целлюлозы, такие как гидроксипропилметилцеллюлоза. Кроме того, контролируемое высвобождение может быть достигнуто путем использования других полимерных матриц, липосом и/или микросфер.
Композиции могут находиться в виде дискретных единиц, таких как капсулы, саше, функциональные продукты питания/корма или таблетки, каждая из которых содержит предварительно определенное количество одного или нескольких терапевтических агентов по изобретению, в виде порошка или гранул, или в виде раствора или суспензии в водной жидкости, в неводной жидкости, в виде эмульсии масло-в-воде или жидкой эмульсии вода-в-масле. Такие композиции могут быть получены с помощью любого из известных в области фармацевтики способов, но все способы включают стадию смешивания одного или нескольких агентов, как описано выше, с носителем, который состоит из одного или нескольких необходимых ингредиентов. В основном композиции получают путем равномерного и тщательного смешивания агентов по изобретению с жидкими носителями или тонкоизмельченными твердыми носителями, или с обоими, и затем, при необходимости, формования продукта в целевую композицию.
Вышеуказанные композиции можно вводить способом, совместимым с лекарственной формой, и в таком количестве, которое является эффективным. Доза, вводимая пациенту в контексте настоящего изобретения, должна быть достаточной, чтобы вызвать благоприятный ответ у пациента на протяжении соответствующего периода времени. Количество вводимого агента (агентов) может зависеть от субъекта, подвергаемого лечению, в том числе от возраста, пола, массы тела и общего состояния здоровья, факторов, которые будут зависеть от мнения лечащего врача.
В конкретном варианте осуществления вышеупомянутых способов и композиций модифицированный пептид, фрагмент или вариант р145 можно вводить в комбинации с иммуногенным фрагментом белка SpyCEP. Следует понимать, что фрагмент белка SpyCEP может действовать в качестве агента, который способствует восстановлению или повышает активность нейтрофилов путем прямого или опосредованного по меньшей мере частичного усиления или восстановления продукции, миграции и/или хемотаксиса нейтрофилов, и/или одной или нескольких иммунологических активностей нейтрофилов. Как правило, фрагмент SpyCEP вызывает ингибирующий иммунный ответ на серинпротеазу SpyCEP, которая протеолитически расщепляет интерлейкин 8. SpyCEP представляет собой мультидоменную серинпротеазу с молекулярной массой 170 кДа, которая экспрессируется на поверхности человеческого патогена Streptococcus pyogenes, который играет важную роль в инфекции, катализируя расщепление и инактивацию нейтрофильного хемоаттрактанта интерлейкина-8. Неограничивающие примеры аминокислотных последовательностей SpyCEP можно найти под номерами доступа YP597949.1 (S pyogenes MGAS10270) и YP596076.1 (S pyogenes MGAS9429). Предпочтительно фрагмент SpyCEP представляет собой или содержит пептид S2 (SEQ ID NO: 23) или вариант, такой как пептид K4S2 (SEQ ID NO: 24).
В некоторых вариантах осуществления модифицированный пептид, фрагмент или вариант р145, и пептид, фрагмент или вариант S2 могут быть представлены в виде единичного химерного пептида. В этом варианте осуществления модифицированный пептид р145 может представлять собой N-концевой или С-концевой пептид S2.
В настоящем документе обычно используемые термины «пациент», «индивидуум» и «субъект» используются в контексте любого млекопитающего, получающего лечение или композицию, раскрытую в настоящем документе. Соответственно, способы и композиции, раскрытые в настоящем документе, могут иметь медицинское и/или ветеринарное применение. В предпочтительной форме млекопитающее является человеком.
Для более полного понимания и осуществления на практике изобретения делается ссылка на следующие неограничивающие примеры.
ПРИМЕРЫ
Вступление
Разработку вакцины значительно бы облегчила способность малых пептидных эпитопов усиливать иммуногенность. Подходы, применяемые до сих пор для улучшения иммуногенности для продуцирования антител, были сконцентрированы на новейших технологиях фолдинга, которые приводят к тому, что эпитоп более близко напоминает нативную структуру (например, (5)), или на стратегиях включения дополнительных молекул с пептидом, который будет активировать антигенпрезентирующие клетки (например, (6, 7)) или Т-хелперные клетки (8, 9).
Также, рассматриваются подходы к изменению последовательности пептида для улучшения его иммуногенности. Гетероклитические пептиды были протестированы на усиление иммуногенности в отношении Т-клеток (10). Однако почти все вакцины зависят от продукции защитных антител, и в данном случае модифицированные пептиды не получили должного внимания, но было показано, что модификации аминокислот вне минимального эпитопа из 4 аминокислот способны улучшать распознавание пептида моноклональным антителом, что свидетельствует о том, что этот подход может быть полезным для разработки вакцин (11). Модификации последовательностей сложных эпитопов и модификации в пределах минимальных эпитопов для улучшения иммуногенности не были тестированы в качестве способа повышения эффективности.
Консервативный пептидный эпитоп из белка М Streptococcus pyogenes обеспечивает идеальную цель и возможность для разработки стратегии для рационального дизайна и тестирования усиленного сложного пептидного иммуногена для индукции защитных антител. Белок М имеет консервативную карбоксильную концевую область, и был описан пептид из 20 аминокислот, «р145», имеющий альфа-спиральную структуру, который может индуцировать антитела, защищающие от широкого ряда штаммов (обзор см. в (12)). Минимальный В-клеточный эпитоп из 12 аминокислот существует в пределах р145. Однако для поддержания спирального сворачивания минимального эпитопа требуются все 20 аминокислот.Этот эпитоп является криптическим для организма.
Подвергание воздействию S. pyogenes обычно не приводит к продукции антител к р145 (13), (14); однако антитела, индуцированные к минимальному эпитопу путем вакцинации, могут убить организм. Иммунитет требует многократных циклов вакцинаций, и защита коррелирует с величиной иммунного ответа (15).
В настоящем исследовании итеративные циклы целевых аминокислотных замен в пределах минимального В-клеточного эпитопа выполняли для создания вариантов р145. В результате иммуногенность и способность антисыворотки к пептидам связывать р145 и стрептококки значительно увеличились, а эффективность вакцины усилилась таким образом, что для индукции иммунитета требовалась только однократная иммунизация. Наблюдался повышенный в 10000 раз уровень защиты от инвазивного стрептококкового заболевания по сравнению с контрольными мышами, вакцинированными родительским пептидом.
Материалы и способы
Пептиды
Пептиды получали от Mimotopes Pty Ltd (Victoria, Australia). Библиотеку пептидов (87 пептидов, включая р145) приобретали в виде Cleaved PepSet с биотином, соединенным с N5-концом, и линкер из четырех аминокислот (SGSG) был добавлен между пептидом и биотином. Пептиды биотинилировали через N-конец, чтобы минимизировать вмешательство в связывание лиганда. Пептиды р*1-р*18 получали в виде специальных пептидов с минимальной чистотой >90%. Дополнительный остаток цистеина добавляли на N-конце к каждому пептиду для обеспечения возможности связывания с колонками Gel Spin (см. ниже). Используемый для нанесения покрытия в ELISA р145 был синтезирован в QIVIR Berghofer Medical Research Institute, DNA and Peptide Unit или China peptides. Пептид p*17 с С-концевым остатком цистеина был синтезирован в China peptides и конъюгирован с DT, как описано в другом месте (16).
Антисыворотка
Антисыворотки, используемые для скрининга пептидов, получали от J8-иммунизированных мышей B10.BR, J8-DT-иммунизированных мышей BALB/c или р145-иммунизированных мышей BALB/c, мышей Quackenbush и B10.D2.
Бактерии
Штаммы GAS, 2031 (emm1) представляют собой изолят из Prague Reference Center и 8830 (emm97) представляет собой клинический изолят из Северной территории Австралии (17). Оба штамма получали из Menzies School of Health Research (MSHR); мыши были адаптированы для исследований in vivo и устойчивы к стрептомицину (200 мкг/мл). JRS145 является негативным мутантом М-белка.
Твердофазный иммуноферментный анализ (ELISA)
ELISA с биотинилированными пептидами проводили в соответствии с рекомендациями изготовителя (Mimotopes, Australia). Вкратце, аликвоты по 100 мкл стрептавидина (Sigma-Aldrich, Australia) при конечной концентрации 5 мкг/мл в воде вносили в 96-луночные планшеты для микротитрования, активированные Oltrack (Concentrack, Netherlands), и инкубировали при 37°С в течение ночи. Лунки блокировали в течение 1 часа при комнатной температуре с помощью 200 мкл PBS, рН 7,2, содержащего 0,05% Tween 20 и 1% казеината натрия, и затем промывали PBS/Tween 20. Пептиды разбавляли в PBS/Tween 20 с помощью 0,1% азида натрия до рабочей концентрации 20 мкг/мл, и 100 мкл каждого вносили в лунки и инкубировали в течение 1 часа при комнатной температуре. После тщательных промывок вносили мышиную антисыворотку к р145 или J8. Планшеты инкубировали в течение 1 часа при комнатной температуре, промывали и добавляли HRP-конъюгированный козий антимышиный IgG (Bio-Rad, Australia) (1/3000) в течение еще 20 минут при комнатной температуре. После дополнительных промывок добавляли субстрат OPD (Sigma-Aldrich) и измеряли при OD450. Титр определяли как наибольшее разведение, которое дает значение оптической плотности (OD), более чем на три стандартных отклонения (SD) превышающее среднее значение OD контрольных лунок, содержащих нормальную мышиную сыворотку в том же разведении (19)
Для анализов ингибирования планшеты для микротитрования покрывали 100 мкл очищенного р145 при конечной концентрации 5 мкг/мл в 75 мМ карбонате натрия, рН 9,6, при 4°С в течение ночи. Планшеты промывали промывочным буфером (PBS с 0,05% Tween 20, рН 7,2) и блокировали в течение 90 мин при 37°С в промывочном буфере, содержащем 5% обезжиренное молоко (блокирующий буфер). Сыворотки против р145 инкубировали с различными концентрациями (0,25 мкг/мл - 2,5 мкг/мл) выбранных пептидов из библиотеки пептидов в течение 30 минут при комнатной температуре. Затем тестируемую антисыворотку вносили в блокированные планшеты и инкубировали в течение 90 мин при 37°С. Планшеты промывали четыре раза и добавляли HRP-конъюгированный козий анти-мышиный IgG (Biorad, Australia) (1/3000) и инкубировали в течение дополнительных 90 минут при 37°С. После дополнительной промывки планшеты проявляли, как указано выше, и измеряли при OD450.
В анализе перекрестной реактивности с белками сердца человека 5 мкг/мл тропомиозина, миозина или кератина (Sigma-Aldrich, Australia) иммобилизовывали на микротитровальных планшетах. После блокирования и промывки, как указано выше, планшеты инкубировали в течение 90 мин при 37°С с триплетами анти-пептидной (р*1-р*18) сыворотки (1/100), соответственно. После этого добавляли вторичное антитело и субстрат, как указано выше.
Иммунизация мышей
Все протоколы были одобрены Комитетом по этике животных Медицинского исследовательского институту QIMR Berghofer в соответствии с руководящими принципами Австралийского национального совета по здравоохранению и медицинским исследованиям (NHMRC). На день 0 мышей Quackenbush (Animal Resources Centre, Australia) (n=3 на группу) инокулировали подкожно (s.c.) в основании хвоста 30 мкг различных пептидов, эмульгированных 1:1 с полным адъювантом Фрейнда (CFA) в общем объеме 50 мкл. Контрольные мыши получали стерильно фильтрованный PBS в CFA. Через три недели после первичной иммунизации мыши получали 2 повторные бустерные иммунизации иммуногена (30 мкг каждая в стерильно фильтрованном PBS), проводимые с недельными интервалами (дни 21 и 28). Группы мышей с титрами антител менее 1000 получали третью бустер-инъекцию, эмульгированную 1:1 с неполным адъювантом Фрейнда. GAS 2031 (убитый нагреванием) готовили, как описано ранее (18). Для исследований заражения кожи мышей BALB/c (n=10 на группу) иммунизировали s.c. один раз в основание хвоста 30 мкг p145-DT или p*17-DT, или препаратом убитого нагреванием 2031 GAS, составленным в квасцах. Для исследования диапазона доз р145, после первичной иммунизации p145-DT/Alum на день 0, определенным когортам вводили 1 или 2 бустерные дозы на дни 21 и 28. Контрольные мыши получали только адъювант. Кровь собирали у каждой мыши за 1 день до бустерных инъекций и через одну неделю после последней иммунизации. Кровь оставляли сворачиваться при 4°С в течение по меньшей мере 4 часов и сыворотку собирали после центрифугирования при 1000 g в течение 10 минут. Сыворотки хранили при -20°С.
Афинная очистка сыворотки
Для очистки пептид-специфической сыворотки использовали набор Microlink peptide coupling kit (Pierce, USA) в соответствии с инструкциями производителя. Вкратце, каждый пептид разбавляли до 0,6 мг/мл в связывающем буфере и иммобилизировали на спин-колонке Ultralink Iodoacetyl Gel Spin Column (Pierce, USA). Колонки тщательно промывали связывающим буфером и блокировали L-цистеином HCl (10 мг/мл). После этого колонки промывали промывочным буфером, а затем PBS. Для аффинной очистки 300 мкл различных сывороток Quackenbush вносили в соответствующие колонки и инкубировали с переворачиванием при 4°С в течение ночи. Колонки промывали три раза PBS и антитела элюировали 100 мкл буфера для элюирования. После этого колонки промывали и снова блокировали, как описано выше, и добавляли дополнительное количество сыворотки. Концентрации элюированного иммуноглобулина (Ig) оценивали с помощью Nanodrop (Thermo Scientific, USA). Очищенные препараты IgG при концентрации 5 мкг/мл с последующими двукратными серийными разведениями оценивали на их связывание с различной концентрацией р145.
Проточная цитометрия
Связывание пептидных антител с S. pyogenes анализировали проточной цитометрией. Бактерии выращивали в бульоне Тодда-Хьюитта (ТНВ) с 1% неопептона в течение ночи и дважды промывали в PBS. После этого бактерии (3×107 колониеобразующих единиц; КОЕ) предварительно инкубировали с 100 мкл Fc-блокатора в течение 15 минут при комнатной температуре с последующим добавлением пептидных антител при концентрации 10 мг/мл. После инкубации в течение 30 минут при комнатной температуре бактерии дважды промывали в PBS с последующей инкубацией с FITC-конъюгированным анти-мышиным IgG (разведенным 1/50 в PBS с помощью 2% BSA), общий объем 100 мкл добавляли еще в течение 30 минут при комнатной температуре. Бактерии промывали и инкубировали в 300 мкл 1% формальдегида (в PBS) и в течение 15 минут при комнатной температуре, а затем переносили на лед до считывания на проточном цитометре FACS Calibur Flow Cytometer 1 (Becton Dickinson, USA).
FITC-конъюгированный анти-мышиный IgG добавляли отдельно в качестве отрицательного контроля для каждого анализируемого штамма и, кроме того, в качестве контроля использовали неспецифический мышиный IgG.
Методика заражения кожи GAS
S. pyogenes 2031 (emm1), 88/30 (emm97) и 5448АР (emm1) культивировали в течение ночи в ТНВ с 1% неопептоном (THBN), дважды промывали в THBN и ресуспендировали в 25% от исходного объема. Дозу инокулята (КОЕ/мл) определяли по оптической плотности при 600 нм и посеву 10-кратных разведений бактериальных суспензий на 2% агар ТНВ с кровью лошади. После инкубации в течение ночи при 37°С определяли количество колоний. Через две недели после последней иммунизации иммунизированных и контрольных мышей заражали выбранным штаммом GAS путем инфицирования через кожу, как описано ранее (19).
Моделирование методом молекулярной динамики (MD)
Моделирование методом молекулярной динамики (MD) пептидов р*17 и Р145 выполняли для изучения возможной молекулярной основы их иммуногенности. Их последовательности с присоединенным С-концевым цистеином отправляли на сервер PEP-FOLD (20) для построения начальных структурных моделей. Эти модели использовали в качестве отправных точек для MD моделирования, которое выполняли в GROMACS 5 (21). Все остатки были параметризованы с помощью силового поля Amber ff14SB (22). Каждый пептид помещали в додекаэдрический бокс с минимальным расстоянием 1,2 нм между растворенным веществом и краем бокса с последующей сольватацией с помощью молекул воды TIP3P (23). Затем добавляли ионы соли до концентрации 0,15 М для уравновешивания ионного заряда в системе. Минимизацию энергии проводили последовательно с помощью интегратора наискорейшего спуска и алгоритма сопряженного градиента для достижения максимальной силы менее 500 кДж/ моль-1 нм-1 на любом атоме. Схему отсечения Верле (24) использовали для оценки ближних несвязанных взаимодействий, причем как Ван-дер-Ваальсовые, так и электростатические взаимодействия были усечены при 0,8 нм. Дальнодействующие электростатические взаимодействия обрабатывали методом частиц Эвальда (РМЕ) (25, 26). Температуру поддерживали на уровне 298 К с использованием термостата с изменением скорости (27) с константой связи 0,1 пс, в то время как давление поддерживали на уровне 1,0 атм с использованием баростата Брендсена (28) с константой связи 1 пс.
Моделирование проводилось с шагом по времени 2 фс, и все связи, включающие атомы водорода, были ограничены параллельным решателем линейных ограничений (P-LINCS) (29). Каждую систему уравновешивали в ансамбле с постоянным объемом (NVT) в течение 100 пс и в ансамбле с постоянным давлением (NPT) в течение 100 пс. Ограничение гармонического положения с постоянной силы 1000 кДж моль-1 нм-2 было применено ко всем тяжелым атомам молекул, не являющихся растворителями. После уравновешивания производственное моделирование MD проводилось в течение 100 не для каждой системы без каких-либо ограничений. Три повторных прогона MD выполняли для каждой системы путем варьирования случайного начального числа для начальной скорости генерации. Анализ траекторий MD были выполнены на пакете программ GROMACS 5 в последние 40 не каждого прогона по 100 не, чтобы обеспечить равновесие.
Статистический анализ.
Среднее значение и стандартную ошибку рассчитывали по стандартным формулам. Тесты Манна-Уитни использовали для сравнения титров антител между двумя группами. Если не указано иное, значения Р корректировали с использованием метода Бонферрони для множественных сравнений. ANOVA с использованием апостериорного метода анализа Тьюки использовали для определения значимости между всеми обработанными и контрольными когортами в каждый момент времени.
Результаты
Целью являлась разработка превосходящего пептидного иммуногена против GAS по сравнению с р145 с использованием раундов итеративного отбора мутантных последовательностей в пределах минимального эпитопа из 12 аминокислот в пределах р145 (таблица 1). Вначале была разработана библиотека мутантных пептидов (L1) для ответа на вопрос, может ли быть увеличена антигенность р145 с помощью единичных мутаций. Мы стремились идентифицировать мутации, которые будут усиливать антигенность, но без создания последовательностей, которые будут напоминать известные человеческие белки.
В L1 одну аминокислоту изменяли за один раз, и аминокислотные замены отбирали исходя из их физико-химических свойств, подходящих для сохранения пептида в свернутом в альфа-спираль виде (5,11 30). Полученная библиотека состояла из 86 вариантов р145 плюс исходный р145 (таблица 3). Кроме того, неспецифический пептид (pNS [# 87]) был включен в качестве контроля. Связывание антисыворотки к р145 с каждым пептидом анализировали с использованием ELISA. В этих исследованиях для гарантии связывания одинакового количества каждого пептида с планшетом использовали биотинилированные пептиды, которые были прикреплены к планшетам посредством стрептавидина. Пептидный линкер из четырех аминокислот помещали между мутантным пептидом и биотином для гарантии достаточного пространства для распознавания антитела. Антисыворотку получали от р145-иммунизированных мышей B10.D2, BALB/c и аутбредных мышей Quackenbush. Для каждого из трех различных мышиных штаммов связывание антисыворотки с вариантными пептидами варьировало от минимального до слегка повышенного по сравнению с ее связыванием с р145 (фигура 1А). Большинство замен привело к снижению связывания. Более того, аналогичные результаты были получены для антисывороток к J8 или J8-DT, взятых у мышей B10.BR или BALB/c, соответственно (данные не показаны).
Неспецифический пептид распознавался наименее хорошо из всех пептидов. Было идентифицировано 17 пептидов, с которыми р145-специфическая антисыворотка показала сходное или лучшее связывание, чем с р145, и возник вопрос, могут ли эти пептиды в растворе ингибировать связывание р145-специфической антисыворотки с родительским пептидом р145. Эти пептиды при тестировании в ингибиторном ELISA при двух различных концентрациях (0,25 мкг/мл и 2,5 мкг/мл) продемонстрировали дозозависимый ответ (фигура 1В и фигура 6). При обеих концентрациях пептиды ингибировали связывание антител против р145 в растворе до сравнимой степени с р145, вероятно из-за того, что они сохраняли сворачивание, сходное с р145, однако ни один из них не был явно лучше (фигура 1В и фигура 6).
Для того, чтобы избежать индукцию человеческих специфических антител, авторы проанализировали, привели ли аминокислотные замены к последовательностям, которые были тесно связаны с человеческими белками, с использованием программ биоинформатики (BLASTP и Clustal Omega). Три пептида (2, 9 и 41) были исключены из дальнейшего рассмотрения из-за сходства (идентичность последовательностей >50%) с человеческими белками, включая рутлетин (Ciliary rootlet coiled-coil protein), динактин 1, ассоциированный с В-клеточным рецептором белок 29, фактор сшивания микротрубочек и актина 1, и миозин (тяжелый полипептид 7 В, сердечная мышца, бета, изоформа CRA_c). Таким образом, в результате первичного скрининга получили семь пептидов (5, 6, 11, 13, 40, 66 и 72), которые включали мутации в четырех положениях: S1E, S1V, R2N, R2D, K6N, K10R и К10М в пределах минимального эпитопа р145 (фигура 1С).
Учитывая, что единичные мутации в этих пептидах привели к немного увеличенному распознаванию р145-антисывороткой, авторы затем разработали вторую библиотеку, L2, которая содержала 18 пептидов, включающих каждую возможную комбинацию двух мутаций из семи аминокислотных мутаций, идентифицированных выше. Это привело к получению пептидов, обозначенных р*1-18 (таблица 2).
Авторы исследовали иммуногенность этих дважды мутированных пептидов у аутбредных (Quackenbush) мышей. Иммуногенность пептидов варьировала, но все, кроме р*14 и р*16, генерировали антитела к иммунизирующему пептиду, при этом большинство дало титры от 1×105 до 106 после трех иммунизаций (фигура 2А). Все пептиды, за исключением р*14, р*15 и р*16, были значительно более иммуногенными, чем р145. Наиболее иммуногенным пептидом был р*17. Антитела ко всем пептидам, за исключением р*14 и р*16, затем подвергали аффинной очистке с использованием иммунизирующего пептида, и авторы установили относительное связывание каждого из антител с титруемыми концентрациями пептида р145, иммобилизованного на пластике. Каждый планшет инкубировали с очищенными антителами при концентрации 5 мкг/мл.
Антитела, индуцированные семью пептидами (р*2, р*4, р*6, р*10, р*13, р*17 и р*18), показали более высокую аффинность, значительно сильнее связываясь с иммобилизованным р145 по сравнению с р145-индуцированными антителами (фигура 2В). Было замечено, что пять из этих семи пептидов (р*4, р*10, р*13, р*17 и р*18) несут мутацию К10. Затем использовали проточную цитометрию для исследования связывания аффинно-очищенных антител, каждого в одной и той же концентрации, с поверхностью стрептококков, экспрессирующих различные белки emm - 2031 (emm1) и 88/30 (emm97), каждый из которых содержит одну и ту же последовательность р145.
Антитела к р*2, р*4, р* 17 и р*18 связываются с обоими штаммами GAS в гораздо большей степени по сравнению с р145-индуцированными антителами (фигура 3А-В), при этом анти-р*17 IgG продемонстрировал наиболее высокое связывание. Для большинства пептидных антисывороток наблюдалась корреляция между связыванием с р145 и связыванием с бактериальной поверхностью, причем антисыворотка к р*17 показала наиболее сильное связывание как с р145, так и со стрептококками (фигуры 2В и 3). Эту антисыворотку также тестировали против emm-негативного штамма (JRS145). Никакого связывания не наблюдалось против этого штамма (фигура 3С), подтверждая, что антитела распознавали эпитоп в пределах М-белка.
Из наиболее эффективных пептидов (р*2, р*4, р* 17 и р*18), пептиды *2 и *4 больше не рассматривались, поскольку антитела к обоим этим пептидам распознавали альфа-спиральные структуры человеческих белков (фигура 7). Таким образом, два пептида, р*17 и р*18, оставили для дальнейшего рассмотрения, и внимание было сосредоточено на р*17 из-за его превосходной иммуногенности.
Показав, что р*17 является более иммуногенным, чем р145, что антитела к р*17 продемонстрировали более высокую аффинность к р145, чем антитела, индуцированные самим р145, и что они связывают различные штаммы стрептококков сильнее, чем антитела, индуцированные р145, возник вопрос, будет ли р*17 являться лучшей вакциной к р145. Конъюгированный с дифтерийным анатоксином р145 (р145-DT) может защитить от стрептококкового заражения кожи, но требуются три дозы вакцины (дополнительные фигуры 3А и В). Таким образом, р*17 конъюгировали с дифтерийным анатоксином и сравнивали в прямом сравнительном исследовании с p145-DT, но используя только однократную дозу вакцины. Конъюгированные пептиды использовали для обеспечения сходной степени помощи Т-клеток для ответов против пептидов, что позволило напрямую провести сравнение иммуногенностей пептидов в отношении В-клеток.
Мышей BALB/c иммунизировали подкожно p*17-DT, p145-DT или PBS, каждый из которых был составлен в квасцах. Несмотря на то, что иммуногены были конъюгированы с DT, отмечалось, что р145-специфические титры антител, индуцированных p*17-DT, значительно превышали титры антител, индуцированных p145-DT, при измерении через три недели после вакцинации (фигура 4А). Затем мышей заражали кожным путем штаммами 2031 (emm1) или 88/30 (emm97) GAS для определения эффективности вакцины. И вновь защита не была обеспечена путем вакцинации однократной дозой p145-DT против 2031 или 88/30 GAS (фигура 4В и D). Однако вакцинация p*17-DT привела к 100-1000-кратному снижению бактериальной нагрузки на кожу через шесть дней после заражения по сравнению с мышами, вакцинированными p145-DT (фигура 4В и D). Более того, вакцинация p*17-DT привела к стерильной защите от бактериемии, обусловленной 2031 GAS у мышей (>10000-кратное снижение бактериальной нагрузки в крови по сравнению с мышами, вакцинированными p145-DT) (фигура 4С). Кроме того, у группы, вакцинированной p*17-DT, полностью исчезла системная инфекция, обусловленная 88/30, на 6 день после инфицирования, тогда как группы, иммунизированные р145 и PBS, все еще имели значительно более высокую бактериемию (фигура 4Е).
Защитная способность p*17-DT была дополнительно продемонстрирована в еще одном исследовании, в котором использовали мутантный штамм CovR/S. Однократная вакцинация p*17-DT индуцировала высокие пептид-специфические титры (фигура 8С) и привела к >90%-ному снижению бактериальной нагрузки в коже по сравнению с контрольной группой, получавшей PBS (фигура 8D). Более того, уровень защиты был значительно лучше по сравнению с уровнем, обеспеченным убитыми нагреванием GAS (фигура 8D).
Таким образом, р*17, неприродное производное р145, может индуцировать антитела с превосходящими свойствами, реакционноспособные против р145 в отношении титров и аффинности, чем сам р145, и является значительно более сильным иммуногеном к р145 в отношении индукции антител, которые распознают стрептококки и защищают от них. Для ответа на вопрос, существуют ли значительные структурные различия между р145 и р*17, которые могут объяснить это расхождение, использовали молекулярно-динамическое (MD) моделирование для анализа пептидов. Моделирование показало, что спираль в р145 разрывается между положением 12 и 14, вероятно из-за разрушительного эффекта положительно заряженных Ks в положениях 12 и 13 (фигура 5А), р*17 имеет незаряженный аспарагин (N) в положении 13, облегчающий сворачивание спирали. Данные также демонстрируют, что пептид р145 с меньшей вероятностью принимает спиральную структуру, чем р* 17 (процент спиральности <50 против <80; фигура 5 В), а также показал более высокую гибкость (среднеквадратичная (RMS) флуктуация; фигура 5С).
В последующих экспериментах согласно схеме, показанной на фигуре 9, исследовали внутримышечную иммунизацию р*17, взятым в отдельности или вместе с пептидом S2. Мышей иммунизировали три (3) раза p*17-DT+K4S2-DT/Alum и интраназально заражали 5448АР (штамм CovR/S МТ). Фигура 10 демонстрирует иммуногенность после внутримышечной (i.m.) иммунизации вакцинами на основе р*17. Мышей BALB/c (n=15 на группу; самки в возрасте 4-6 недель) иммунизировали внутримышечно (i.m.) p*17-DT/Alum, p*17-DT+K4S2-DT/Alum и PBS/Alum на дни 0, 21 и 42. Через неделю после последней иммунизации собирали образцы сыворотки и слюны, и измеряли ответы р*17-специфического IgG (А и С) и IgA (В и D) антитела с помощью ELISA и представляли в виде среднего значения ± SEM. Титры представлены в сравнении с контрольной группой, получавшей только PBS/Alum.
На фигуре 11 показана защита после интраназального инфицирования. Через две недели после последней бустерной вакцинации мышей инфицировали интраназально мутантом covR/S GAS (5448АР). На дни 1-3 собирали назальные выделения (nasal shedding, NS). Бактериальную нагрузку в назальных выделениях определяли путем придавливания ноздрей каждой мыши к чашкам с кровяным колумбийским агаром (СВА) с 5% дефибринированной лошадиной крови, и попавшие с дыханием частицы сеяли штрихом. На дни 1-3 NS собирали и представляли в виде логарифмически преобразованного среднего значения + SEM для каждого отдельного дня (А) и в виде кумулятивных КОЕ для всех трех дней вместе (В). Процентное снижение бактериальной нагрузки в назальных выделениях показано на фигуре 12.
На фигуре 13 показана защита после интраназальной инфекции. Дополнительно к NS на дни 1-3 собирали мазки из зева (throat swabs, TS). Для взятия мазков из зева палочки-тампоны помещали в стерильный PBS для смачивания, затем мышей фиксировали и брали мазок из зева. Палочку-тампон затем суспендировали в PBS, серийно разводили и точечно высевали в двух повторностях на чашки с СВА, содержащие 5% дефибринированной лошадиной крови. На дни 1-3 собирали NS и представляли в виде логарифмически преобразованного среднего значения КОЕ/мл ± SEM для каждого отдельного дня (А) и в виде кумулятивных КОЕ для всех трех дней вместе (В). На фигуре 14 показано снижение бактериальной нагрузки в мазках из зева.
На фигуре 15 показана защита после интраназальной инфекции. На день 3 после инфицирования всех выживших мышей умерщвляли и собирали образцы NALT (назально-ассоциированная лимфоидная ткань), легких, селезенки и крови для определения бактериальной нагрузки GAS, данные представлены в виде логарифмически преобразованного среднего значения КОЕ/мл ± SEM (А) и в виде процентного снижения по сравнению с контрольной группой, получавшей PBS/Alum (В).
Кроме того, наблюдалось, что 3-кратные внутримышечные иммунизации р*17-DT/Alum защищали от интраназального заражения GAS. Наблюдалось 70-90%-ное снижение бактериальной нагрузки в назальных выделениях и мазках из зева, соответственно. Кроме того, системная бактериальная нагрузка снизилась более чем на 70%. И это несмотря на тот факт, что эти мыши не индуцировали сывороточный или слюнный IgA. Интересно, что наблюдалась индукция слюнного IgG после внутримышечной иммунизации. Полуколичественный анализ (ELISA) проводили для определения ответов антител, которые определялись как конечные точки титрования. В экспериментах, в которых использовали внутримышечную вакцинацию p*17-DT (с K4S2 или без него), ответы IgA слизистой оболочки были неопределяемыми, тогда как ответы IgG слизистой оболочки были по меньшей мере в 10 раз более высокими.
Выполняли структурные сравнения пептидов J8, р145 и р*17, которые предполагают различия между пептидами J8 и р*17, что дополнительно подтверждает усиленную иммуногенность р*17. Пептид J8 является 28-мерным, тогда как р*17 представляет собой 20-мерный пептид. Два пептида имеют одинаковые 10 аминокислот, которые происходят из нативного пептида р145 (фигура 16), стрептококковые аминокислоты показаны жирным шрифтом. Исследования методом MD-моделирования, сравнивающие J8 и р*17, показали, что оба пептида сворачиваются в спираль, однако J8 является более гибким по сравнению с р*17. Мы полагаем, что общая третичная структура р*17 делает его более стабильным, способствуя лучшему взаимодействию с молекулами хозяина. Более того, аминокислотный состав р*17 (более сходный с последовательностью стрептококка, чем J8), вероятно, индуцирует антитела, распознающие нативную структуру организма лучше, чем J8.
Обсуждение
Разработке пептидных вакцин будут чрезвычайно способствовать технологии, которые повышают иммуногенность пептидов. В очень немногих исследованиях были использованы селективные аминокислотные замены для модификации иммуногенности, и в случае тестирования они были сфокусированы на модификациях эпитопа для усиления стимуляции CD8+ Т-клеток, где результаты были неоднозначными. В настоящем документе описана стратегия значительного усиления иммуногенности сложного 12-аминокислотного спирального синтетического пептида из S. pyogenes. Ряд дважды модифицированных пептидов продемонстрировал значительно усиленную иммуногенность, проявляющуюся индукцией антител к иммунизирующему пептиду и к родительскому пептиду, при этом некоторые антисыворотки также показали усиленное связывание с поверхностью стрептококков. Пептид с антисывороткой, которая наиболее сильно связывается как с родительским пептидом, так и с организмом (анти-р*17), тестировали в качестве вакцины для предупреждения стрептококковой инфекции, где наблюдали, что однократная иммунизация привела к значительно усиленной защите от кожных и инвазивных заболеваний (более чем 100-кратное снижение биологической нагрузки кожных стрептококков и >10000-кратное снижение бактериальной нагрузки в крови).
Был разработан р*17 на основе начальных наблюдений антигенности пептидной библиотеки из 86 пептидов с одной аминокислотной заменой в каждом пептиде. Четыре аминокислоты из 12 аминокислот минимального спирального эпитопа были важными для конструирования пептидов, которые распознавались по меньшей мере так же, как и родительская последовательность. Даже несмотря на то, что эти единично мутированные пептиды показали минимально улучшенное распознавание по сравнению с родительским пептидом, р145, антисывороткой к р145, новые пептиды с двумя мутациями намного превосходили р145 в качестве иммуногенов. Но что еще более удивительно, антитела, генерируемые этими дважды мутированными пептидами, распознавали р145 со значительно более высокой аффинностью, чем антитела, индуцированные самим р145. Кроме того, некоторые пептидные антисыворотки распознавали поверхность стрептококков более быстро, чем антитела, индуцированные путем вакцинации р145.
Более того, защитная эффективность одного такого пептида, р*17, показывает, что этот пептид является превосходным кандидатом на вакцину. Однократная иммунизация р*17 индуцировала высокие уровни собственных и р145-специфических антител, которые защищали от множественных штаммов GAS. Кроме того, пептид также защищал от гипервирулентного штамма GAS, который отвечает за инвазивные инфекции на глобальном уровне. В настоящее время минимальный эпитоп в пределах р145, проявляемый в пределах дрожжевого спирального пептида и называемый как J8, является ведущим кандидатом на вакцину против стрептококков (12). Также, требуется три дозы этого кандидата на вакцину, чтобы индуцировать защиту от кожного заболевания (19).
MD-моделирование выявило, что р*17 с большей вероятностью сворачивается в виде спирали, чем р145, и обладает большей стабильностью. Повышенная стабильность, по-видимому, сделала его более иммуногенным, чем р145, и с большей вероятностью индуцирует антитела, которые распознают нативную структуру организма, где эпитоп удерживается в виде спирали. Конформационное связывание антител р*17 с другими эпитопами вдоль белка М, которые отличаются от последовательности р145, также может отчасти объяснять повышенную эффективность р*17. Тем не менее, любопытно, что анти-р*17 антитела распознают р145 лучше, чем антитела, продуцированные к самому р145. Возможно, что анти-р*17 антитела могут сворачивать р145 в спираль.
Мы обнаружили, что из семи вариантных пептидов, которые индуцировали анти-р145 антитела с более высоким титром и с более высокой аффинностью, четыре (р*10, р*13, р*17 и р*18) содержали мутации в положениях и/или минимального эпитопа таким образом, что оба положения не были заняты заряженными аминокислотами. Эти положения в минимальном эпитопе соответствуют положениям f и с в мотиве heptad, которые сходятся на гидрофильной стороне спирального пептида; это, по-видимому, делает эти структуры более стабильными. MD-моделирование не выполняли для других пептидов, чтобы подтвердить это, так как внимание было сосредоточено на наиболее иммуногенном пептиде, который не проявлял гомологию последовательностей с человеческими белками (р*17).
Также, мы предполагаем, что защита на поверхности слизистой оболочки обусловлена индукцией слюнного IgG. Было показано, что IgG на поверхности слизистой оболочки предупреждает колонизацию путем агглютинации и тем самым обеспечивает удаление бактерий (Roche et. al., Mucosal Immunol, 2015). Кроме того, p*17-DT в случае комбинирования с K4S2-DT также способен индуцировать слюнный IgG, и комбинированная вакцина способна защищать против гипервирулентного мутанта CovR/S GAS 5448АР значительно лучше, чем взятый в отдельности p*17-DT.
Исследования методом MD-моделирования, в которых сравнивали J8 и р*17, показали, что оба пептида сворачиваются в виде спирали, однако J8 является более гибким по сравнению с р*17. Мы полагаем, что общая третичная структура р*17 делает его более стабильным, способствуя лучшему взаимодействию с молекулами хозяина. Более того, аминокислотный состав р*17 (более сходный с последовательностью стрептококка, чем J8), вероятнее всего, индуцирует антитела, распознающие нативную структуру организма лучше, чем J8.
В заключение мы определяли стратегию для дизайна пептидов, обладающих значительно усиленной иммуногенностью, посредством механизма, который может быть связан не с модификациями взаимодействующих остатков эпитопа с рецептором иммуноглобулина, а с неспецифическими ионными силами между эпитопом и В-клеточным рецептором Ig. Общая описываемая стратегия может улучшить иммуногенность многих сложных пептидных эпитопов.
Во всем данном описании целью являлось описание предпочтительных вариантов осуществления изобретения без ограничения изобретения каким-либо одним вариантом осуществления или определенной совокупностью признаков. Различные изменения и модификации могут быть сделаны в вариантах осуществления, описанных и проиллюстрированных в настоящем документе, без отступления от широкой сущности и объема изобретения.
Все компьютерные программы, алгоритмы, патентная и научная литература, упомянутые в настоящем документе, включены в настоящий документ посредством ссылки во всей своей полноте.



Подчеркнуты аминокислоты, замещенные в исходной последовательности р145.




| название | год | авторы | номер документа |
|---|---|---|---|
| МНОГОКОМПОНЕНТНАЯ ИММУНОГЕННАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДУПРЕЖДЕНИЯ ЗАБОЛЕВАНИЯ, ВЫЗВАННОГО β-ГЕМОЛИТИЧЕСКИМИ СТРЕПТОКОККАМИ (БГС) | 2009 |
|
RU2478396C2 |
| СЛИТЫЙ БЕЛОК, СПОСОБНЫЙ ИНДУЦИРОВАТЬ ЗАЩИТНЫЙ ИММУНИТЕТ ПРОТИВ СТРЕПТОКОККА ГРУППЫ В, И ВАКЦИНА, СОДЕРЖАЩАЯ ТАКОЙ БЕЛОК | 2008 |
|
RU2487890C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ГРИБКОВЫХ И БАКТЕРИАЛЬНЫХ ПАТОГЕНОВ | 2014 |
|
RU2717306C2 |
| СИНТЕТИЧЕСКИЙ ПЕПТИД, СИНТЕТИЧЕСКИЙ ЛИПОПЕПТИД, ИММУНОГЕННЫЙ КОНЪЮГАТ (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ ОЛИГОМЕРА, ЗАЩИЩЕННЫЙ ТВЕРДЫМ МОНОМЕТИЛОВЫМ ЭФИРОМ ПОЛИЭТИЛЕНГЛИКОЛЯ ПОЛИСАХАРИД | 1993 |
|
RU2141527C1 |
| ПРОСТАТОАССОЦИИРОВАННЫЕ АНТИГЕНЫ И ИММУНОТЕРАПЕВТИЧЕСКИЕ СХЕМЫ НА ОСНОВЕ ВАКЦИН | 2013 |
|
RU2737765C2 |
| ВАКЦИНА ПРОТИВ PCSK9 | 2010 |
|
RU2538162C2 |
| ПРОФИЛАКТИЧЕСКАЯ ПРОТИВОРАКОВАЯ ВАКЦИНА | 2004 |
|
RU2556128C2 |
| ВЕЩЕСТВА И СПОСОБЫ ДЛЯ ПРИМЕНЕНИЯ ПРИ ПРЕДУПРЕЖДЕНИИ И/ИЛИ ЛЕЧЕНИИ БОЛЕЗНИ ГЕНТИНГТОНА | 2015 |
|
RU2742493C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ И СПОСОБЫ | 2008 |
|
RU2468034C2 |
| АНТИГЕННЫЕ TAU-ПЕПТИДЫ И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2518291C2 |

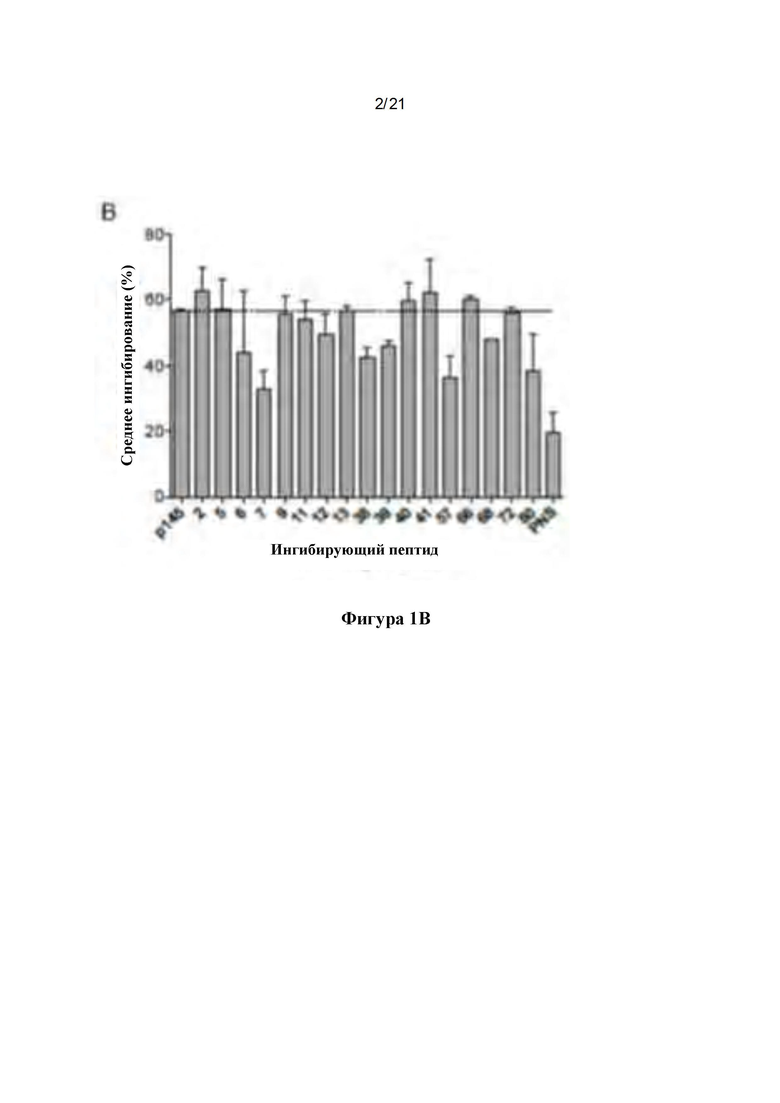

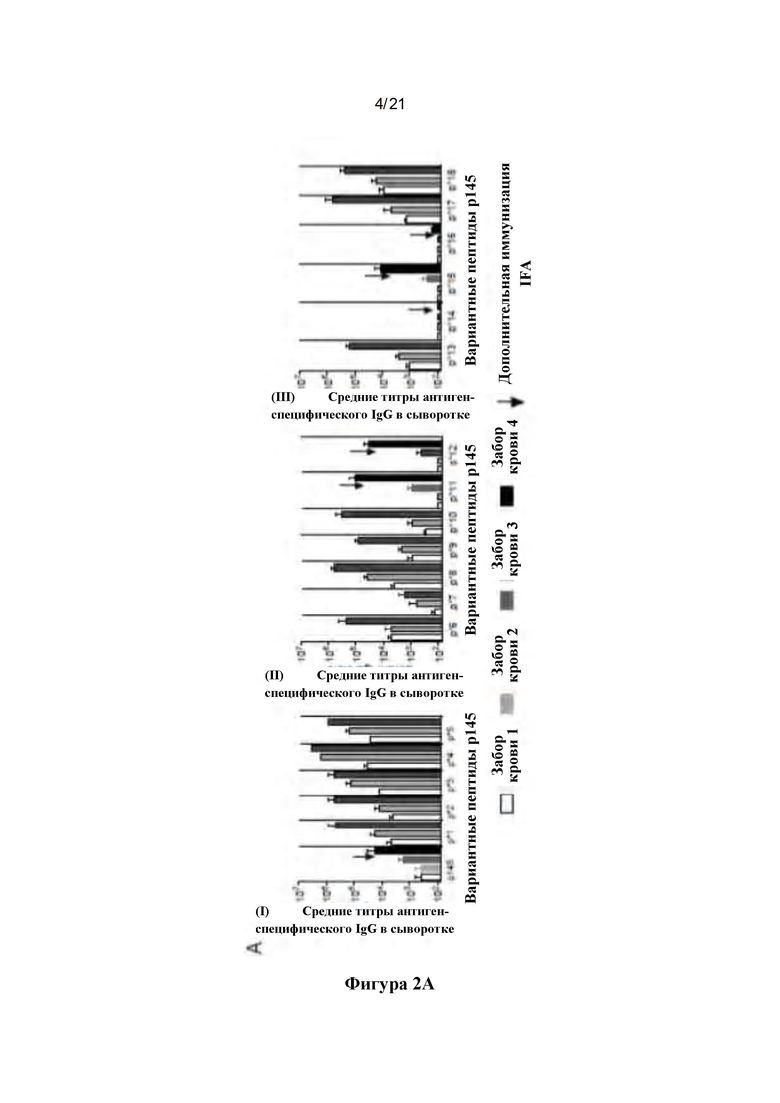

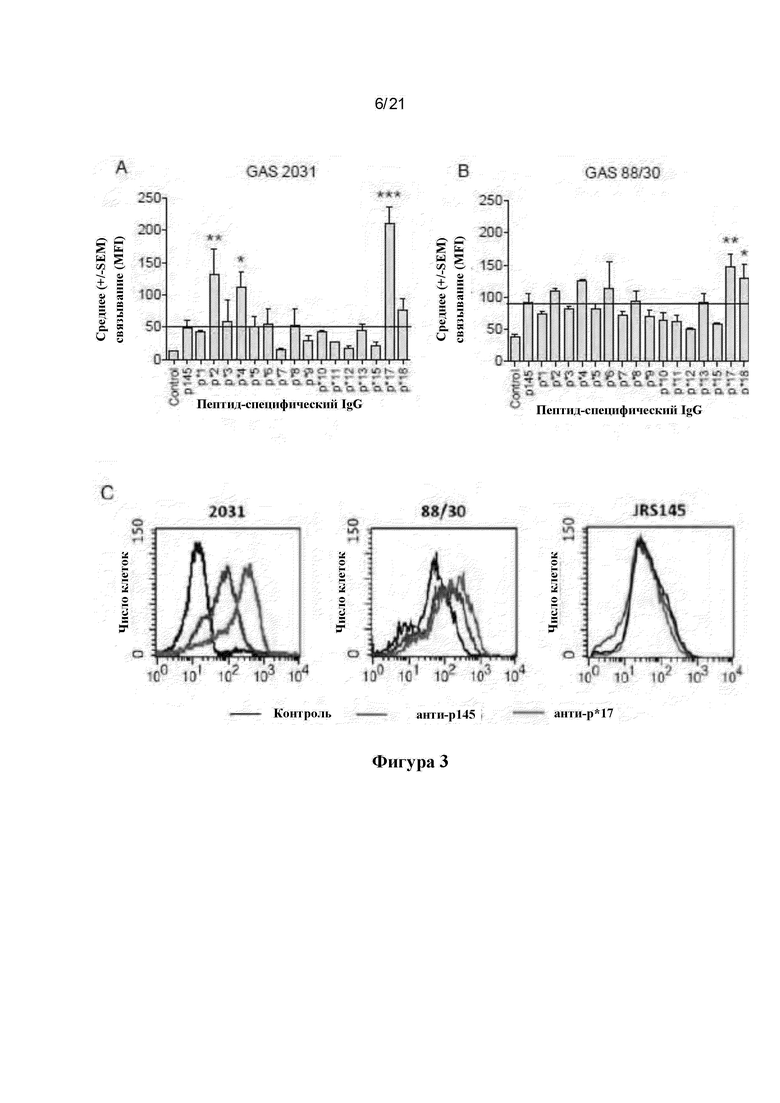
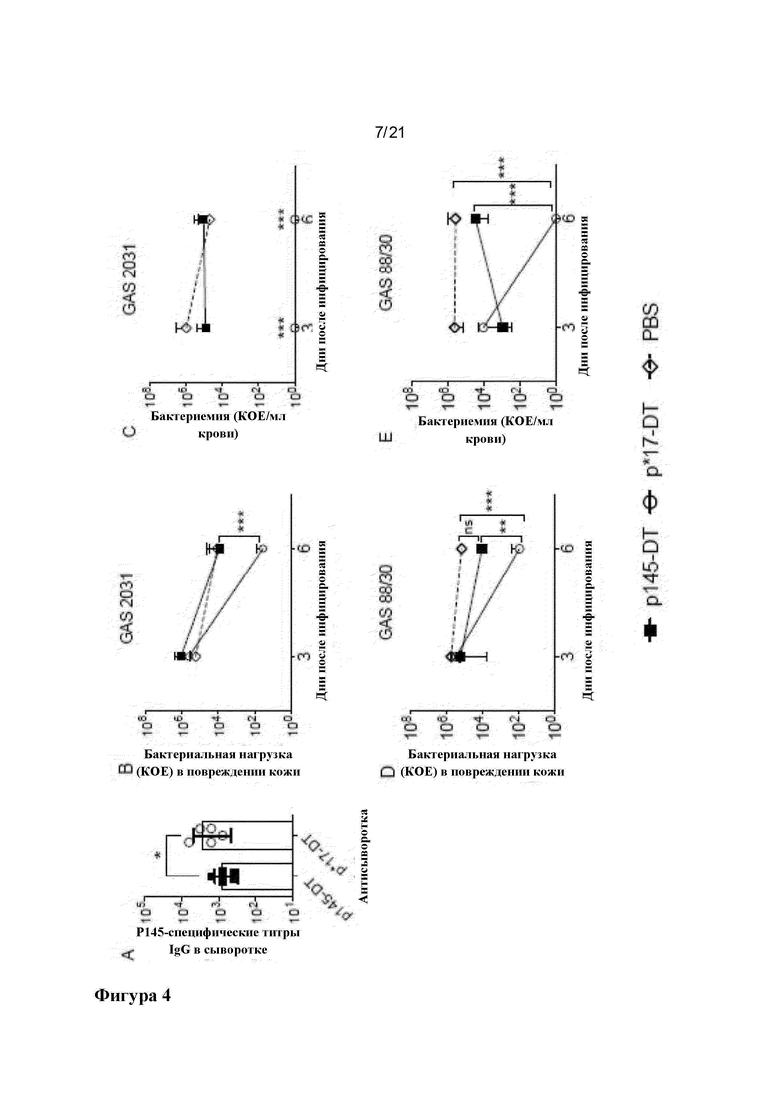
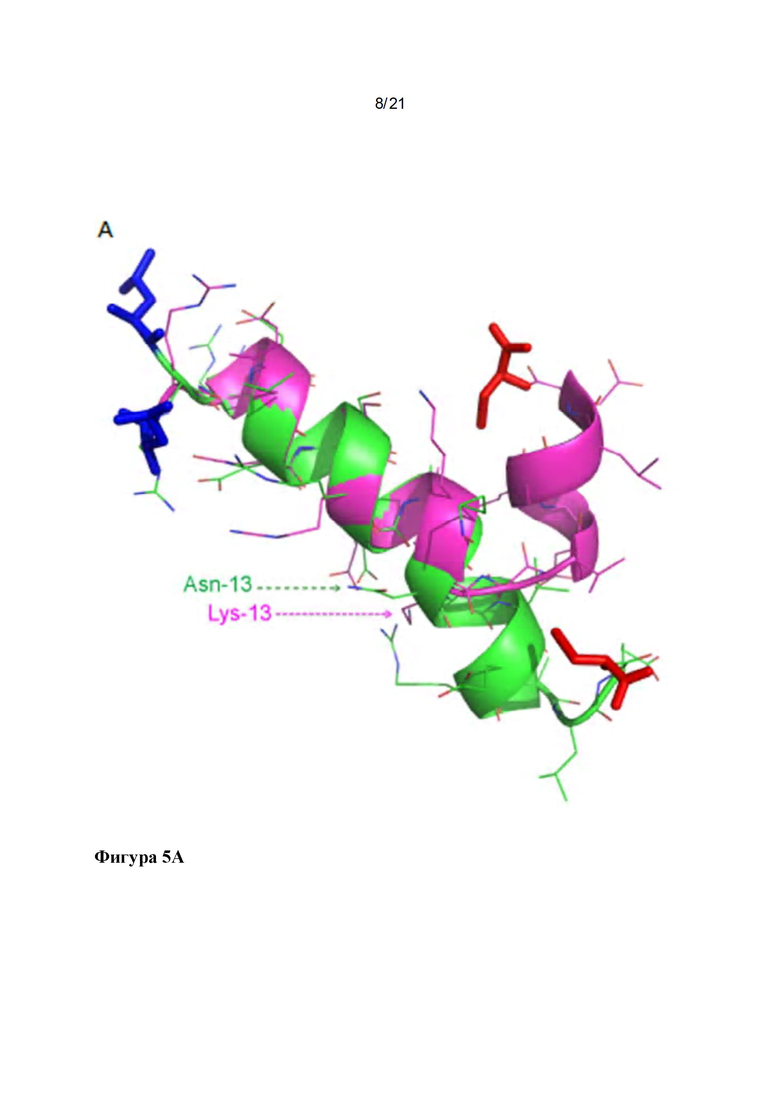
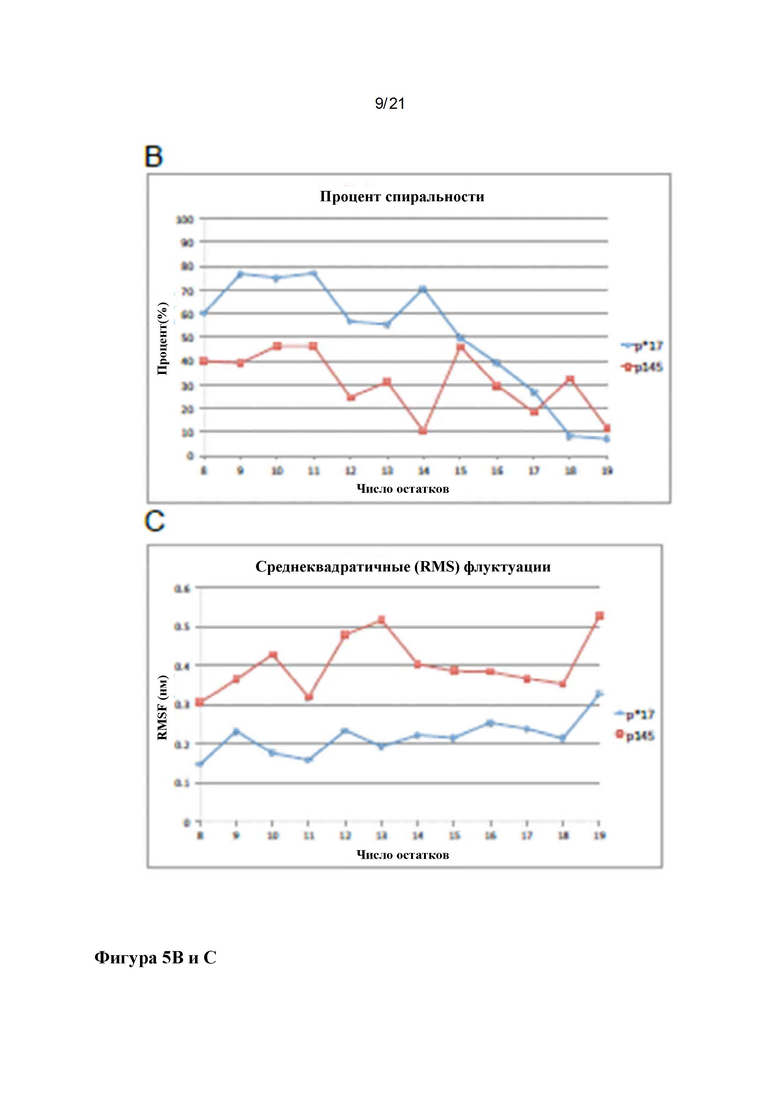
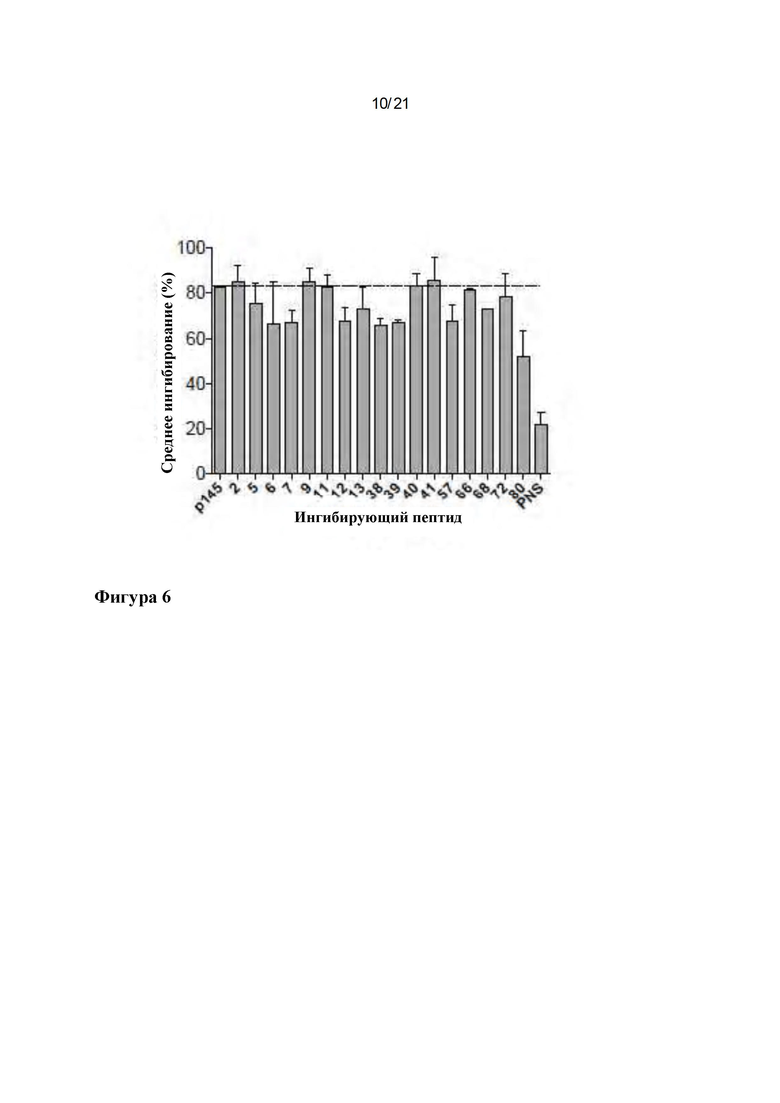

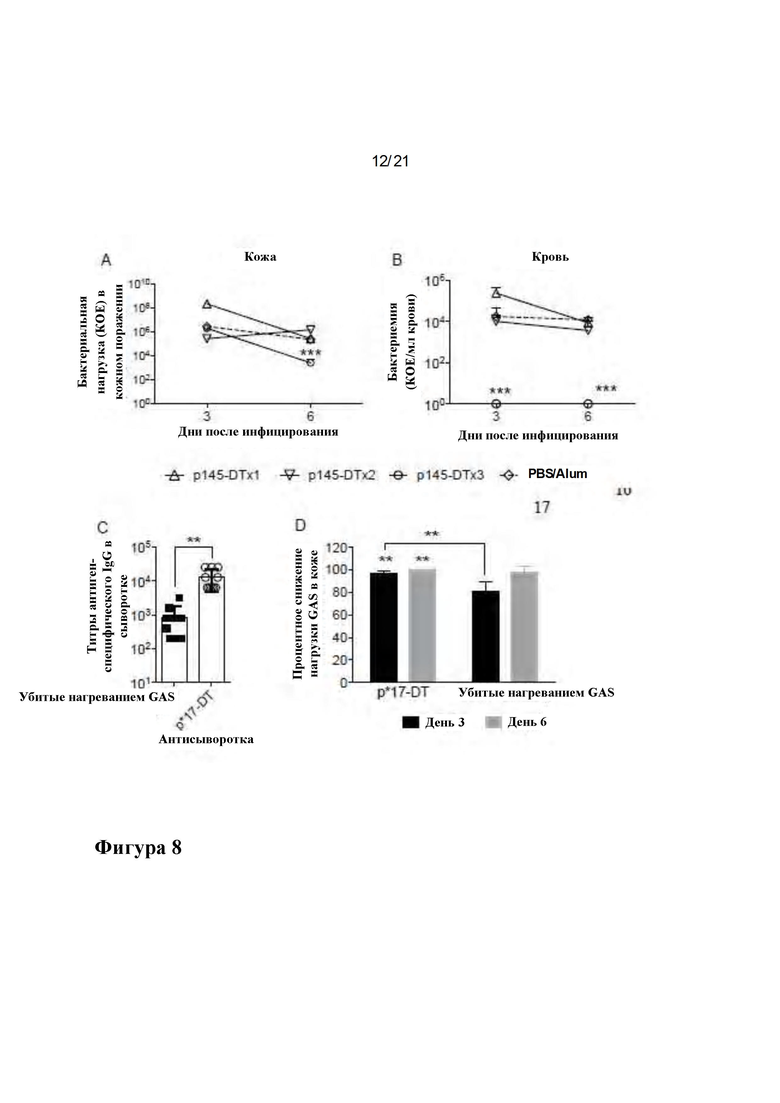


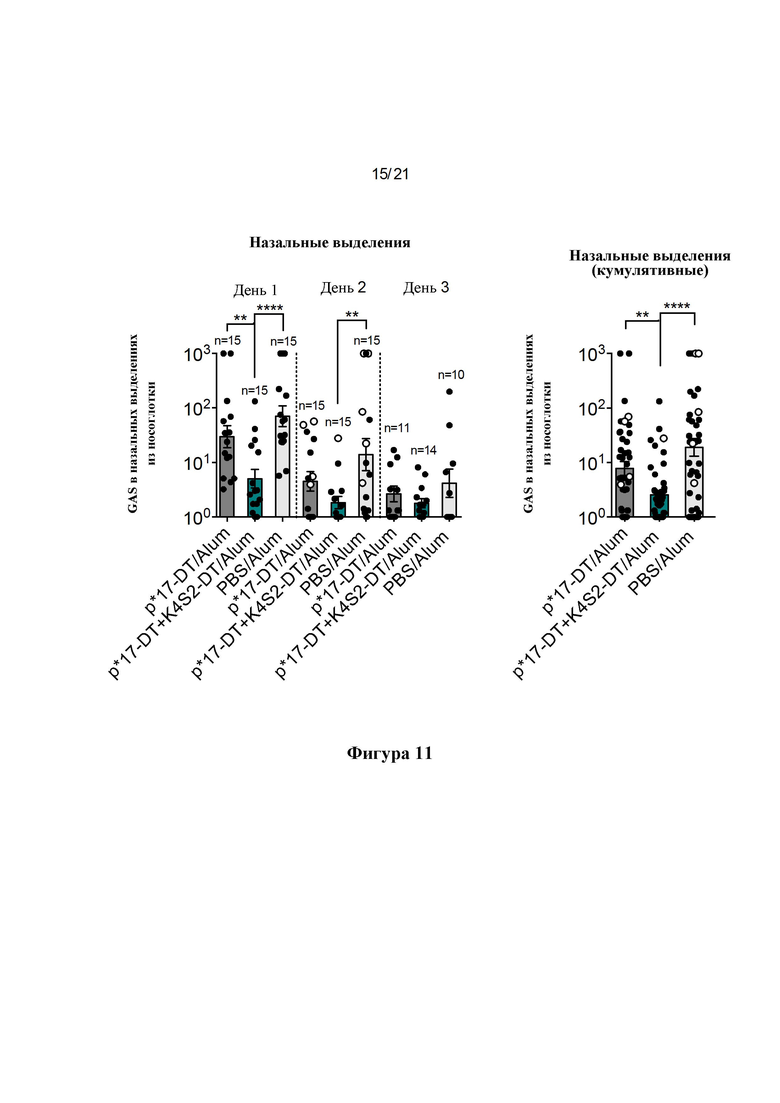
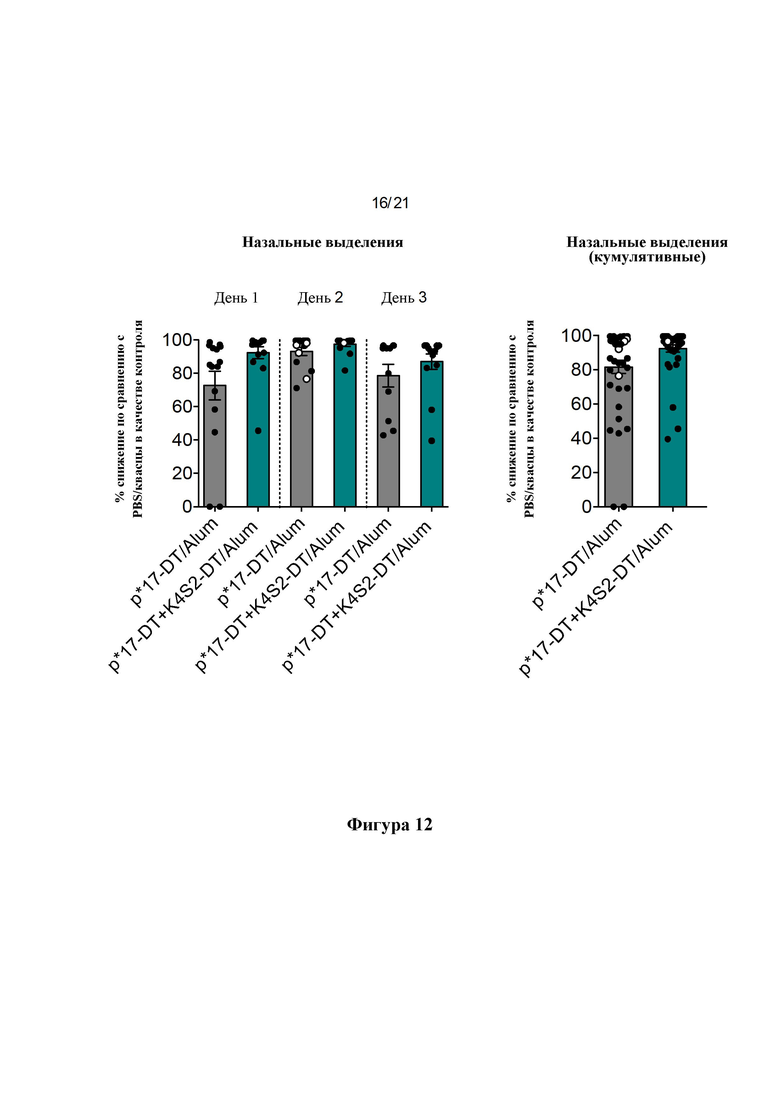
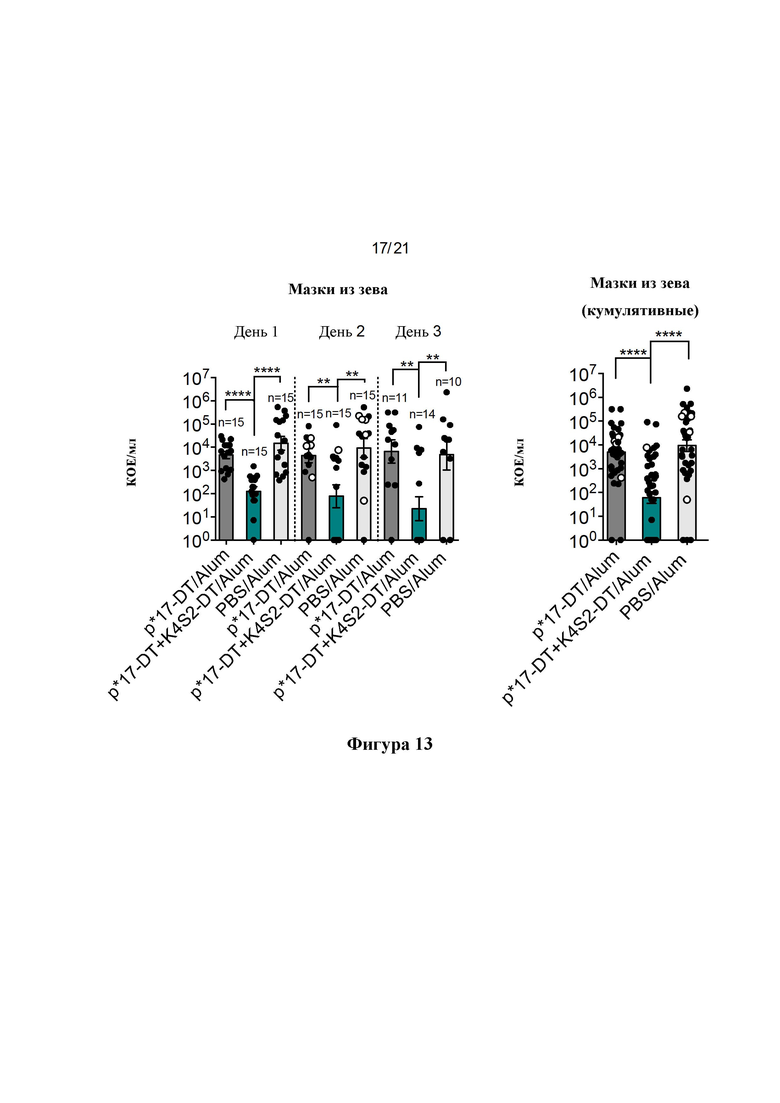
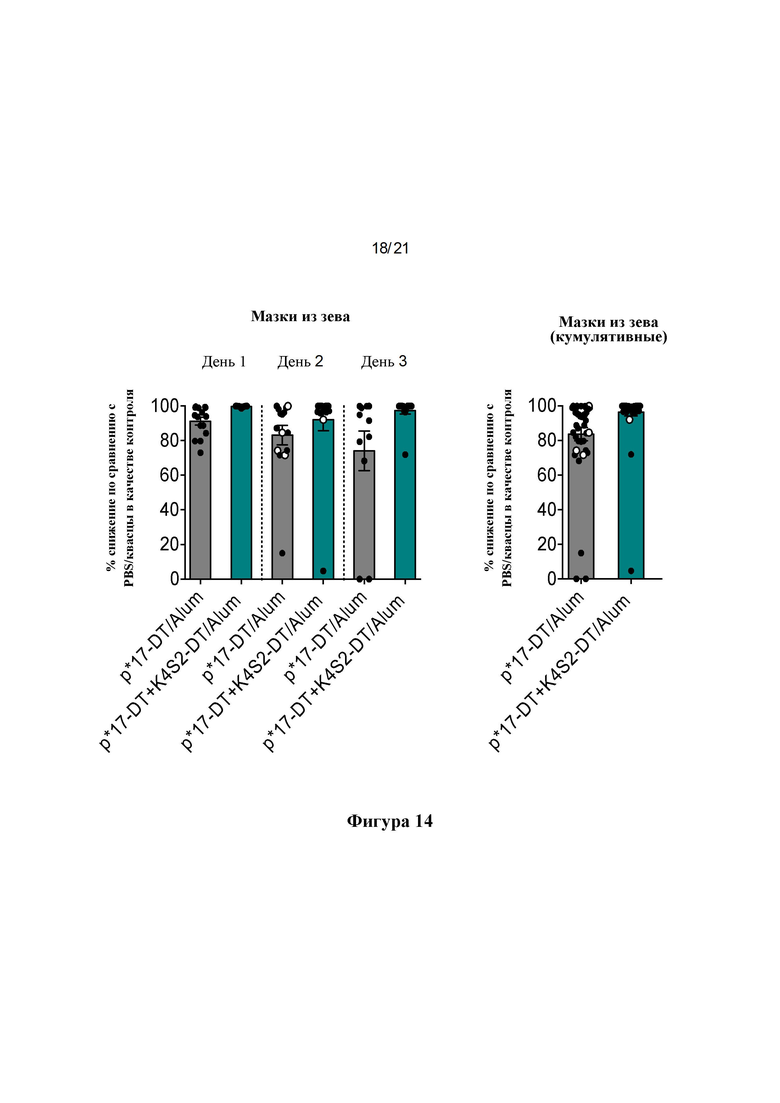

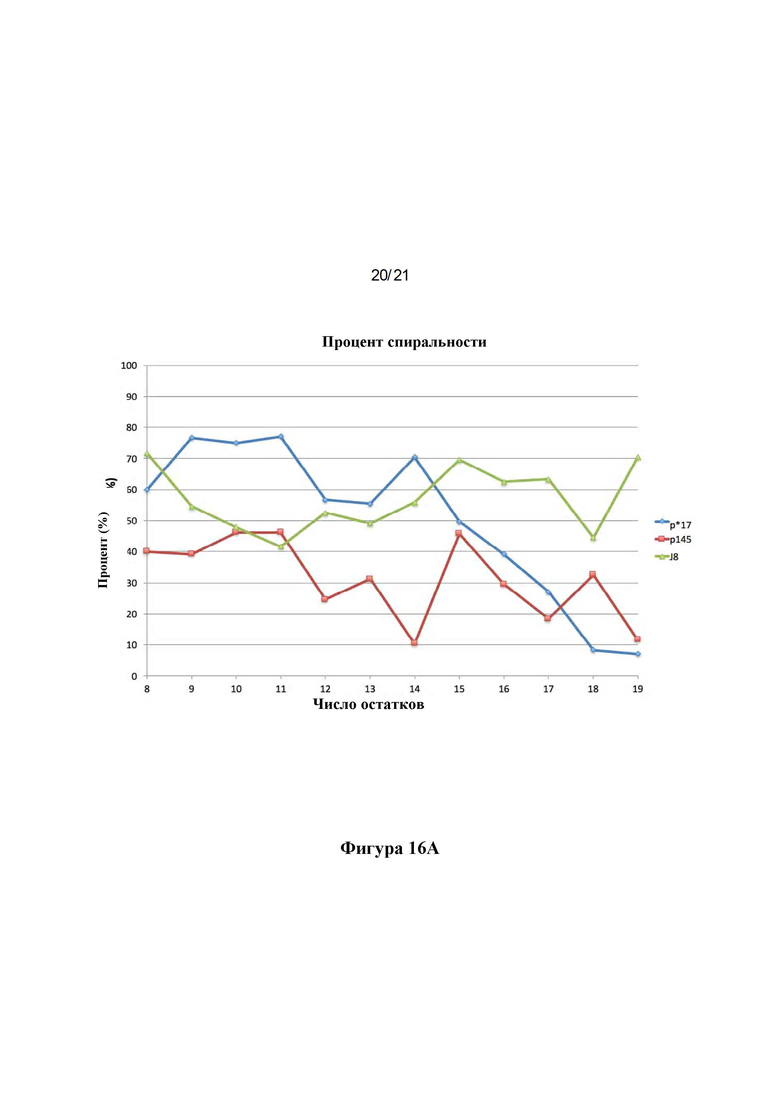
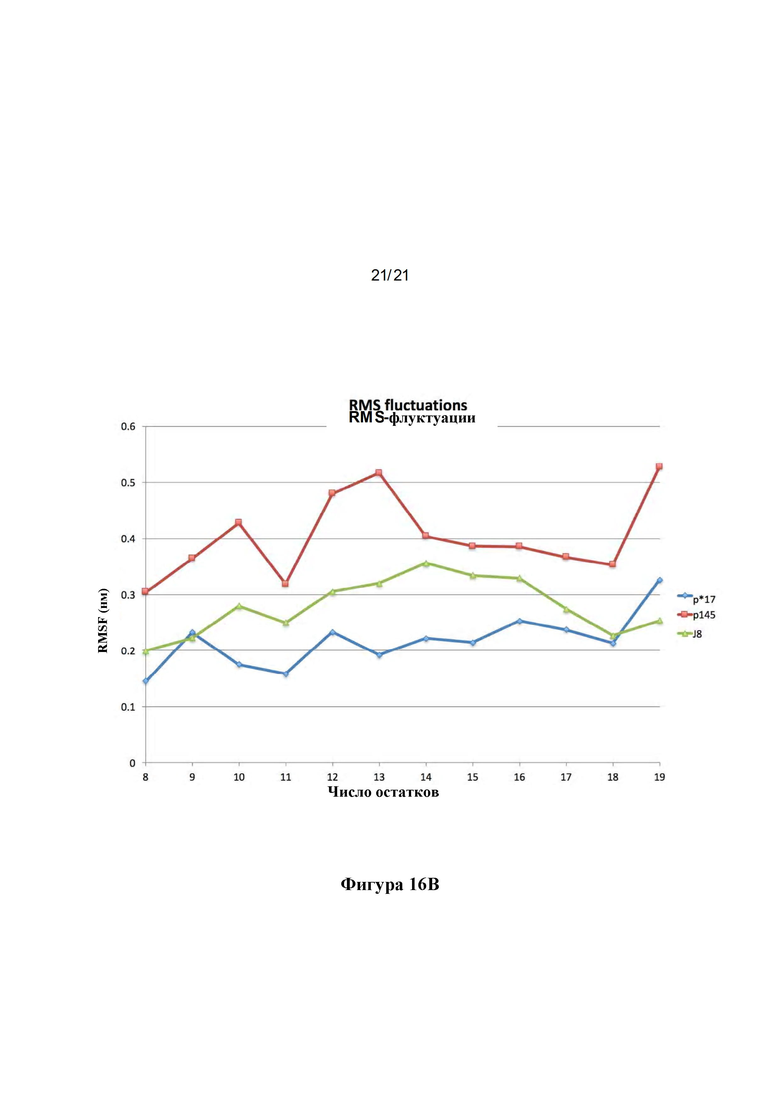
Изобретение относится к биотехнологии, а именно к применению выделенного белка, представляющего модифицированный пептид р145 с определенной аминокислотной последовательностью, антитела к этому белку или выделенной нуклеиновой кислоты, кодирующей данный белок, в изготовлении лекарственного средства для: вызывания иммунного ответа слизистой оболочки на стрептококковые бактерии группы А у млекопитающего; индукции иммунитета слизистой оболочки против стрептококковой бактериальной инфекции группы A у млекопитающего; или лечения или предупреждения стрептококковой бактериальной инфекции группы A у млекопитающего, при этом выделенный белок или его фрагмент или вариант способен вызывать ответ слизистой оболочки и/или индуцировать иммунитет слизистой оболочки к стрептококковой бактериальной инфекции группы А у млекопитающего. Представлена композиция, содержащая выделенный белок, антитело или фрагмент антитела, которое связывается или продуцируется против данного белка; или выделенную нуклеиновую кислоту, кодирующую выделенный белок; и иммуногенный фрагмент белка SpyCEP, антитело или фрагмент антитела, которое связывается или продуцируется против иммуногенного фрагмента SpyCEP, или выделенную нуклеиновую кислоту, которая кодирует иммуногенный фрагмент SpyCEP, причем указанная композиция предназначена для: вызывания иммунного ответа слизистой оболочки на стрептококковые бактерии группы А у млекопитающего; индукции иммунитета слизистой оболочки против стрептококковой бактериальной инфекции группы A у млекопитающего; или лечения или предупреждения стрептококковой бактериальной инфекции группы A у млекопитающего, при этом выделенный белок или его фрагмент или вариант способен вызывать ответ слизистой оболочки и/или индуцировать иммунитет слизистой оболочки к стрептококковой бактериальной инфекции группы А у млекопитающего. Иммунизация однократной дозой модифицированного пептида р145, а не множественные иммунизации, может защитить от стрептококковой инфекции группы А, даже гипервирулентных штаммов, таких как мутантный штамм CovR/S. Модифицированный пептид, фрагмент или вариант р145 вызывает иммунный ответ слизистой оболочки при введении млекопитающему, при этом продукция IgA практически отсутствует или находится на относительно пониженном уровне по сравнению с уровнем продуцируемого IgG. 2 н. и 14 з.п. ф-лы, 3 табл., 22 ил., 1 пр.
1. Применение:
(i) выделенного белка, содержащего:
(a) последовательность SEQ ID NO: 1 (p*17) или SEQ ID NO: 21 (p*18);
(b) последовательность SEQ ID NO: 1 или SEQ ID NO: 21, конъюгированную с белком-носителем, его фрагментом или эпитопом;
(ii) антитела или фрагмента антитела, которое связывается или продуцируется против последовательности, представленной в SEQ ID NO: 1 или в SEQ ID NO: 21; или
(iii) выделенной нуклеиновой кислоты, кодирующей белок (a) или (b),
в изготовлении лекарственного средства для:
вызывания иммунного ответа слизистой оболочки на стрептококковые бактерии группы А у млекопитающего;
индукции иммунитета слизистой оболочки против стрептококковой бактериальной инфекции группы A у млекопитающего; или
лечения или предупреждения стрептококковой бактериальной инфекции группы A у млекопитающего, при этом выделенный белок или его фрагмент, или вариант способен вызывать ответ слизистой оболочки и/или индуцировать иммунитет слизистой оболочки к стрептококковой бактериальной инфекции группы А у млекопитающего.
2. Применение по п. 1, в котором указанное лекарственное средство составляют для введения млекопитающему внутримышечно и/или подкожно.
3. Применение по п. 1 или 2, в котором однократная иммунизация млекопитающего указанным лекарственным средством защищает млекопитающее от заболевания кожи, вызванного стрептококками группы А.
4. Применение по пп. 1, 2 или 3, в котором белок-носитель, его фрагмент или эпитоп включает тиреоглобулин, альбумин, токсин, анатоксин или любой мутантный перекрестно-реактивный материал (CRM), предпочтительно токсин из столбняка, дифтерии, коклюша, Pseudomonas, E.coli, Staphylococcus и Streptococcus, или его фрагмент, или эпитоп, или указанный белок-носитель включает аминокислотную последовательность, не обнаруженную у стрептококка группы А.
5. Применение по п. 4, в котором белок-носитель представляет собой токсин из дифтерии, белок CRM или его иммуногенный фрагмент.
6. Применение по любому из пп. 1-5, в котором лекарственное средство дополнительно содержит иммуногенный фрагмент белка SpyCEP или в котором иммуногенный фрагмент белка SpyCEP предназначен для введения млекопитающему совместно.
7. Применение по п. 6, в котором иммуногенный фрагмент белка SpyCEP включает:
(i) пептид SpyCEP, представленный в SEQ ID NO: 23;
(ii) вариант пептида SpyCEP, состоящий из аминокислотной последовательности, по меньшей мере на 90% идентичной SEQ ID NO: 23;
(iii) пептид SpyCEP по (i) или вариант пептида SpyCEP по (ii), дополнительно состоящий из одного или множества остатков лизина на своем N- и/или C-конце;
(iv) пептид K4S2, представленный в SEQ ID NO: 24; или
(v) любой из (i) - (iv), конъюгированный с белком-носителем, его фрагментом или эпитопом.
8. Применение по п. 7, в котором иммуногенный фрагмент представляет собой пептид K4S2 (SEQ ID NO: 24).
9. Применение по любому из пп. 1-8, в котором указанная последовательность представляет собой SEQ ID NO: 1 (p*17).
10. Применение по любому из пп. 1-8, в котором указанная последовательность представляет собой SEQ ID NO: 21 (p*18).
11. Композиция, содержащая:
(i) выделенный белок, содержащий:
(a) последовательность, представленную в SEQ ID NO: 1 (p*17) или SEQ ID NO: 21 (p*18);
(b) последовательность, представленную в SEQ ID NO: 1 или в SEQ ID NO: 21, конъюгированную с белком-носителем, его фрагментом или эпитопом;
(ii) антитело или фрагмент антитела, которое связывается или продуцируется против последовательности, представленной в SEQ ID NO: 1 или в SEQ ID NO: 21; или
(iii) выделенную нуклеиновую кислоту, кодирующую выделенный белок по (a) или (b); и
иммуногенный фрагмент белка SpyCEP, антитело или фрагмент антитела, которое связывается или продуцируется против иммуногенного фрагмента SpyCEP, или
выделенную нуклеиновую кислоту, которая кодирует иммуногенный фрагмент SpyCEP, причем указанная композиция предназначена для:
(a) вызывания иммунного ответа слизистой оболочки на стрептококковые бактерии группы А у млекопитающего;
(b) индукции иммунитета слизистой оболочки против стрептококковой бактериальной инфекции группы A у млекопитающего; или
(c) лечения или предупреждения стрептококковой бактериальной инфекции группы A у млекопитающего, при этом выделенный белок или его фрагмент или вариант способен вызывать ответ слизистой оболочки и/или индуцировать иммунитет слизистой оболочки к стрептококковой бактериальной инфекции группы А у млекопитающего.
12. Композиция по п. 11, составленная для введения внутримышечно и/или подкожно.
13. Композиция по п. 11 или 12, составленная для достижения защиты от заболевания кожи, вызванного стрептококками группы А путем однократной иммунизации млекопитающего.
14. Композиция по любому из пп. 11-13, причем иммуногенный фрагмент белка SpyCEP содержит:
(i) пептид SpyCEP, представленный в SEQ ID NO: 23;
(ii) вариант пептида SpyCEP, состоящий из аминокислотной последовательности, на 90% идентичной SEQ ID NO: 23;
(iiii) пептид SpyCEP по (i) или вариант пептида SpyCEP по (ii), дополнительно состоящий из одного или множества остатков лизина на своем N- и/или C-конце;
(iv) пептид K4S2, представленный в SEQ ID NO: 24; или
(v) любой из (i) - (iv), конъюгированный с белком-носителем, его фрагментом или эпитопом.
15. Композиция по любому из пп. 11-14, в которой указанная последовательность представляет собой SEQ ID NO:1 (p*17).
16. Композиция по любому из пп. 11-14, в которой указанная последовательность представляет собой SEQ ID NO: 21 (p*18).
| Колосоуборка | 1923 |
|
SU2009A1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| АРТЕМУК Е.Г | |||
| и др | |||
| Аминокислоты и белки, Брест 2010, с.20, найдено в Интернет 21.12.2021, адрес сайта: https://www.brsu.by/sites/default/files/e_editions/aab.pdf. | |||
Авторы
Даты
2022-07-05—Публикация
2018-08-22—Подача