ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается в соответствии с 35 U.S.C. § 119(e) приоритет предварительных заявок США серийный номер 61/236466, поданной 24 августа 2009 г., и 61/301149, поданной 3 февраля 2010 г., которые приводятся в настоящем документе в качестве ссылки в полном объеме для всех целей.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к диагностике и лечению рака и, в частности, определению мутаций или сверхэкспрессии RTK, которые являются диагностически и/или прогностически значимыми, и выбору лечения рака в зависимости от определения.
УРОВЕНЬ ТЕХНИКИ
Рецепторные тирозинкиназы (RTK) и их лиганды являются важными регуляторами пролиферации опухолевых клеток, ангиогенеза и метастазирования. Например, к семейству RTK ErbB относятся EGFR (HER1 и ErbB1), HER2 (neu или ErbB2), HER3 (ErbB3) и HER4 (ErbB4), и они обладают явными лиганд-связывающей и сигнальной активностями. К лигандам, которые связываются с рецепторами ErbB, относятся эпидермальный фактор роста (EGF), трансформирующий фактор роста а (TGFa), гепарин-связывающий EGF-подобный лиганд (HB-EGF), амфирегулин (AR), бетацеллюлин (BTC), эпирегулин (EPR), эпиген (EPG), херегулин (HRG) и нейрегулин (NRG). Эти лиганды связываются непосредственно с EGFR, HER3 или HER4 и запускают большое число последующих сигнальных каскадов, к которым относятся пути RAS-ERK и PI3K-Akt. EGF и другие факторы роста и цитокины, такие как тромбоцитарный фактор роста (PDGF), передают сигнал через Ras. Мутации Ras прочно блокируют Ras в его активном, связанном с GTP состоянии (Wislez, M., et al., Cancer Drug Discovery and Development: EGFR Signaling Networks in Cancer Therapy, Eds: J.D. Haley and W.J.Gullick, Humana Press, pp.89-95, 2008).
Другой RTK является МЕТ, активация которой с помощью ее лиганда - фактора роста гепатоцитов (HGF) - индуцирует каталитическую активность киназы МЕТ, что запускает трансфосфорилирование тирозинов Tyr 1234 и Tyr 1235. Эти два тирозина запускают большое число сигнальных трансдукторов, таким образом, инициируя целый спектр биологических активностей, вызванных МЕТ. HGF индуцирует длительную активацию RAS и, таким образом, пролонгированную активность МАРК.
Одним из генов ras является K-ras, который подвергается мутации в большом числе видов рака. Мутация гена K-ras в кодонах 12 и 13 вносит вклад в онкогенез, приводя к функциональной модификации белка р21-ras, продукта гена K-ras, результатом чего является перенос избыточных сигналов роста в ядро клетки, стимулируя рост и деление клетки. Поэтому идентификация мутаций гена K-ras была широко использована в качестве удобного средства в диагностике рака, например, рака поджелудочной железы, колоректального и немелкоклеточного рака легких, и исследованиями было показано, что она могла бы быть ассоциирована с несколькими фенотипами опухолей (Samowitz W. S., et al., Cancer Epidemiol. Biomarkers Prev. 9: 1193-1197, 2000; Andreyev H. J., et al., Br. J. Cancer 85: 692-696, 2001; и Brink M., et al., Carcinogenesis 24: 703-710, 2003).
Ras имеет существенное значение в онкогенной трансформации и генезе. Онкогенные Н-, К- и N-Ras возникают из-за точечных мутаций, ограниченных небольшим количеством сайтов (аминокислоты 12, 13, 59 и 61). В отличие от нормальных Ras онкогенные белки ras лишены присущей им GTPазной активности и поэтому остаются постоянно активированными (Trahey, M., и McCormick, F. (1987) Science 238: 542-5; Tabin, C.J. et al. (1982) Nature. 300: 143-9; Taparowsky, E. et al. (1982) Nature. 300: 762-5). Вклад онкогенного ras при раке человека оценивают в 30% (Almoguera, C. et al. (1988) Cell. 53:549-54).
Мутации часто ограничиваются лишь одним из генов ras, и частота является ткане- и опухолеспецифичной. Самым распространенным мутированным онкогеном при раке человека является K-ras, особенно часто встречается мутация в кодоне 12. В то время как онкогенная активация Н-, К- и N-Ras, возникающая из-за однонуклеотидных замен, была обнаружена в 30% случаев рака человека (Bos, J.L. (1989) Cancer Res 49, 4682-9), мутация K-ras по кодону 12 обнаруживается в более чем 90% случаев рака поджелудочной железы человека (Almoguera, C. et al. (1988) Cell 53, 549-54; Smit, V.T. et al. (1988) Nucleic Acids Res 16, 7773-82; Bos, J.L. (1989) Cancer Res 49, 4682-9). Протоковая аденокарцинома поджелудочной железы, самый распространенный рак поджелудочной железы, печально известна по причине ее быстрого возникновения и резистентности к лечению. Высокая частота мутаций K-ras при опухолях поджелудочной железы человека указывает на то, что постоянная активация Ras имеет решающее значение в процессе онкогенеза поджелудочной железы. Аденокарцинома экзокринной части поджелудочной железы представляет четвертую причину связанной с раком смертности в странах Запада. Лечение имело ограниченный успех, и пятилетняя выживаемость остается меньше чем 5% со средней выживаемостью 4 месяца для пациентов с неоперабельными опухолями (Jemal, A. et al. (2002) CA Cancer J Clin 52, 23-47; Burris, H.A., 3rd et al. (1997) J Clin Oncol 15, 2403-13). Данная точечная мутация может быть рано идентифицирована в течение заболевания при прогрессировании нормального кубического эпителия протоков поджелудочной железы в плоский гиперпластический очаг, и как полагают, является причиной заболевания в патогенезе рака поджелудочной железы (Hruban, R.H. et al (2000) Clin Cancer Res 6, 2969-72; Tada, M. et al. (1996) Gastroenterology 110, 227-31). Регуляция сигналинга онкогенного K-ras при раке поджелудочной железы человека, тем не менее, остается главным образом неизвестной.
Мутации К-ras находят в 50% случаев рака толстого кишечника и легких (Bos, J.L. et al. (1987) Nature. 327: 293-7; Rodenhuis, S. et al. (1988) Cancer Res. 48: 5738-41). В случаях рака мочевыводящих путей и мочевого пузыря мутации в основном находятся в гене Н-ras (Fujita, J. et al. (1984) Nature. 309: 464-6; Visvanathan, K.V. et al. (1988) Oncogene Res. 3: 77-86). Мутации гена N-ras встречаются в 30% случаев лейкоза и рака печени. Приблизительно в 25% случаев повреждений кожи у человека вовлечены мутации Ha-Ras (25% для плоскоклеточной карциномы и 28% для меланом) (Bos, J.L. (1989) Cancer Res. 49: 4683-9; Migley, R.S, and Kerr, D.J. (2002) Crit Rev Oncol Hematol. 44: 109-20). 50-60% случаев карцином щитовидной железы уникальны, имея мутации во всех трех генах (Adjei, A.A. (2001) J Natl Cancer Inst. 93: 1062-74).
Постоянная активация Ras может быть достигнута посредством онкогенных мутаций или через гиперактивированные рецепторы факторов роста, такие как EGFR. Повышенная экспрессия и/или амплификация членов семейства EGFR, особенно EGFR и HER2, могут быть задействованы в большом числе форм злокачественных опухолей человека (как показано в статье Prenzel, N. et al. (2001) Endocr Relat Cancer. 8: 11-31). При некоторых из этих видов рака (к которым относятся рак поджелудочной железы, толстого кишечника, мочевого пузыря, легких) сверхэкспрессия EGFR/HER2 усугубляется наличием онкогенных мутаций Ras. Аномальная активация этих рецепторов в опухолях может быть объяснена сверхэкспрессией, амплификацией гена, мутациями, приводящими к постоянной активации, или аутокринными петлями факторов роста (Voldborg, B.R. et al. (1997) Ann Oncol. 8: 1197-206). В отношении рецепторов факторов роста, особенно рецепторов EGFR, амплификация или/и сверхэкспрессия этих рецепторов часто обнаруживается при раке молочных желез, яичников, желудка, пищевода, поджелудочной железы, легких, толстого кишечника и нейробластоме.
Сигнальный путь RAS-MAPK контролирует рост, дифференциацию и жизнеспособность клетки. Этот сигнальный путь долгое время считался перспективным путем для противораковой терапии вследствие его центральной роли в регуляции роста и жизнеспособности клеток широкого спектра опухолей человека, и мутации в компонентах этого сигнального пути лежат в основе инициации опухоли в клетках млекопитающих (Sebolt-Leopold et al (2004) Nat Rev Cancer 4, pp 937-47).
Сигнальный путь RAS-MAPK активируется большим числом внеклеточных сигналов (гормонами и факторами роста), которые активируют RAS путем замены GDP на GTP. Ras затем привлекает RAF к плазматической мембране, где происходит его активация. Как отмечалось выше, в основе инициации опухоли в клетках млекопитающих лежат мутации в компонентах сигнального пути, приводящие к постоянной активации. Например, рецепторы факторов роста, такие как рецептор эпидермального фактора роста (EGFR), при многих типах рака подвергаются амплификациям и мутациям, составляя до 25% случаев немелкоклеточного рака легких и 60% случаев глиобластом. Также часто мутирует Braf, особенно при меланомах (приблизительно в 70% случаев) и карциномах толстого кишечника (приблизительно в 15% случаев). Более того, самым часто мутированным онкогеном, присутствующим приблизительно в 30% всех типов рака человека, является ras. Частота и тип мутированных генов ras (Н-ras, К-ras или N-ras) широко варьируют в зависимости от типа опухоли. К-ras, тем не менее, является наиболее часто мутированным геном, причем наибольшее число случаев детектировалось при раке поджелудочной железы (приблизительно 90%) и колоректальном раке (приблизительно 45%). Это делает его, а также другие компоненты сигнального пути подходящей мишенью противораковой терапии. Действительно, прошли клинические испытания низкомолекулярные ингибиторы, созданные для нацеливания большого числа стадий этого пути. Более того, недавно был одобрен для лечения почечно-клеточной карциномы ингибитор RAF-киназы, приводящий к ингибированию передачи сигнала RAS, сорафениб (Nexavar.RTM., Bayer HealthCare Pharmaceuticals). На основании этих данных сохраняется повышенный интерес к нацеливанию пути RAS-МАРК для разработки улучшенных способов лечения рака.
Описанные в статье Downward, J. (2002) Nature Reviews Cancer, volume 3, pages 11-22, белки RAS являются членами большого суперсемейства низкомолекулярных GTP-связывающих белков, которые могут быть подразделены на несколько семейств согласно степени консерватизма последовательностей. Различные семейства важны для различных клеточных процессов. Например, семейство RAS контролирует рост клетки, и семейство RHO контролирует актиновый цитоскелет. Обычно семейство RAS описывают как состоящее из трех членов Н-, N- и К-RAS, причем К-RAS продуцирует большой (4В) и малый (4А) сплайсированный вариант (Ellis, C.A. and Clark, G. (2000) Cellular Signalling, 12: 425-434). Обнаружено, что члены семейства RAS активируются мутацией в опухолях человека и обладают сильным трансформирующим потенциалом.
Члены RAS являются очень близкородственными, имея гомологию аминокислотных последовательностей 85%. Несмотря на то, что белки RAS функционируют в очень схожих путях, недавно стали известны некоторые указания на тонкие различия между ними. Белки Н-ras, К-ras и N-ras широко экспрессируются, причем К-ras экспрессируется почти во всех типах клеток. Исследования с нокаутом показали, что для нормального развития мыши не требуются Н-ras и N-ras ни самостоятельно, ни в сочетании, тогда как К-ras существенен (Downward, J (2002) на странице 12).
Более того, как описано в статье Downward, J (2002), нарушенная передача сигнала через пути RAS происходит в результате нескольких различных классов мутационного повреждения в опухолевых клетках. Самые наглядные из этих мутаций находятся в самих генах ras. Приблизительно 20% опухолей человека имеют в ras активирующие точечные мутации, чаще в К-ras (около 85% всех), затем N-ras (около 15%), затем Н-ras (менее 1%). Все эти мутации компромитируют GTPазную активность RAS, предотвращая стимулированный GAP-белками гидролиз GTP на RAS и таким образом вызывая аккумуляцию RAS в GTP-связанной, активной форме. Активация почти всех RAS в опухолях объясняется мутациями в кодонах 12, 13 и 61 (страница 15 статьи Downward, J (2002)).
Было бы эффективно, если бы лечение рака можно было подбирать для конкретного рака. В частности настоящее изобретение относится к способам определения, не окажутся ли некоторые утвержденные и доступные способы лечения все-таки неэффективными для конкретного типа рака.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к прогностическим способам идентификации опухолей, которые не чувствительны к лечению ингибитором В-Raf, путем определения мутаций в гене или белке К-ras. К способам относится определение наличия или отсутствия в образце мутированного гена или белка К-ras, таким образом, идентифицируя опухоль, которая не отвечает на лечение ингибитором В-Raf. Для осуществления способов также описаны наборы.
В другом аспекте настоящее изобретение относится к прогностическим способам идентификации опухолей, которые не чувствительны к лечению ингибитором В-Raf, путем определения аберрантных уровней экспрессии RTK. К способам относится определение уровней экспрессии некоторых RTK в образце, причем сверхэкспрессия RTK коррелирует с отсутствием ответа на лечение ингибитором В-Raf. К примерам RTK, которые коррелируют с ответом на лечение В-Raf, относятся, но ими не ограничиваются, EGFR и cMet. К способам также относится определение уровней индукции некоторых лигандов RTK в образце, причем аномально высокие уровни индукции лигандов коррелируют с отсутствием ответа на лечение ингибитором В-Raf. К примерам лигандов, которые коррелируют с ответом на лечение В-Raf, относятся, но ими не ограничиваются, EGF и HGF. К способам также относится определение в образце уровней Ras-GTP, причем аномально высокие уровни Ras-GTP коррелируют с отсутствием ответа на лечение ингибитором В-Raf. Для осуществления способов также описаны наборы.
В другом аспекте настоящее изобретение относится к способам лечения опухоли, которая не отвечает на лечение ингибитором В-Raf. К способам относится введение ингибитора В-Raf в сочетании с ингибитором EGFR.
ОПИСАНИЕ ФИГУР
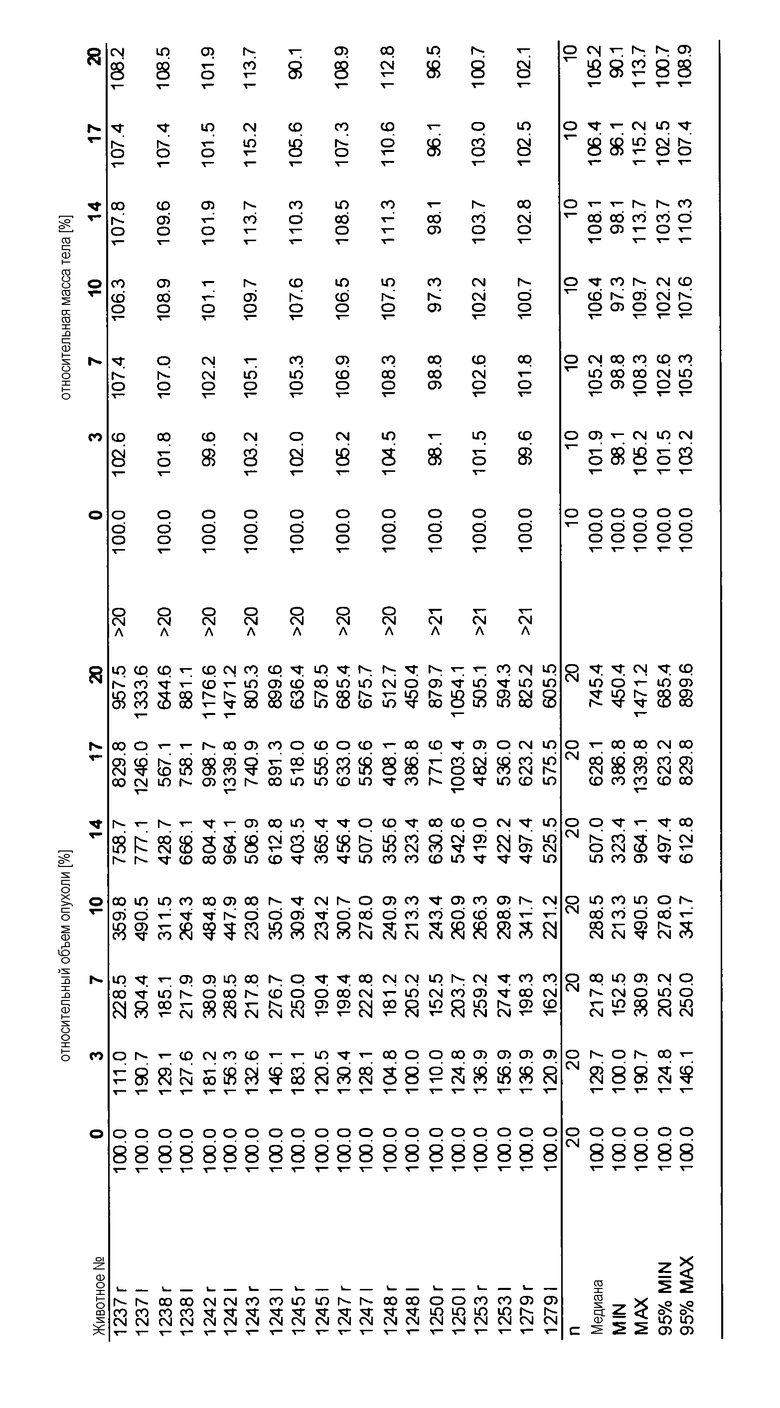
На фигуре 1 представлены данные биохимического ферментативного анализа. Данные указывают на то, что при физиологическом уровне [ATP] лишь у GDC-0879 сохраняется эффективность как против В-RafV600E, так и Raf WT изоформ.
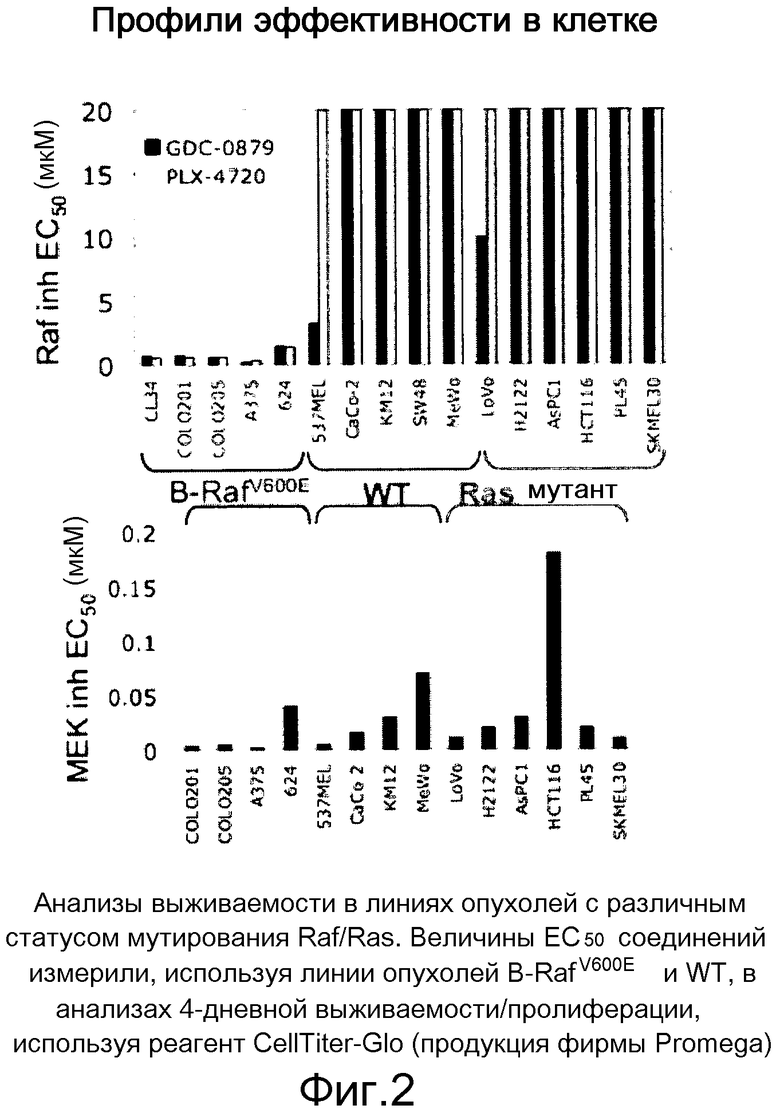
На фигуре 2 представлены анализы жизнеспособности на линиях опухолей с различным статусом мутирования Raf/Ras.
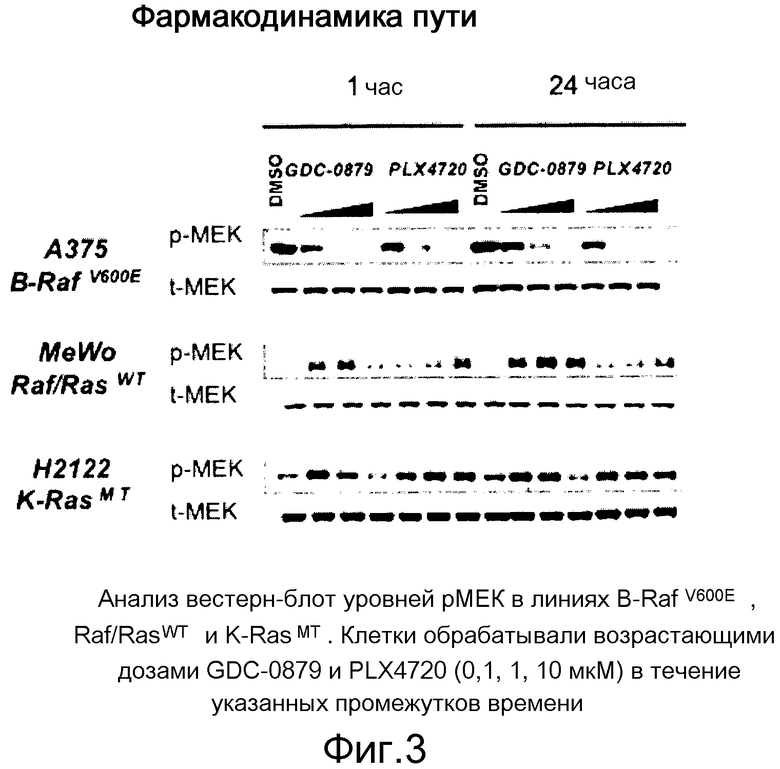
На фигуре 3 показана длительная индукция рМЕК посредством ингибиторов Raf лишь на линиях, отличных от В-RafV600E. Уровни рМЕК достигают определенного уровня относительно IC50 ингибиторов против Raf WT.
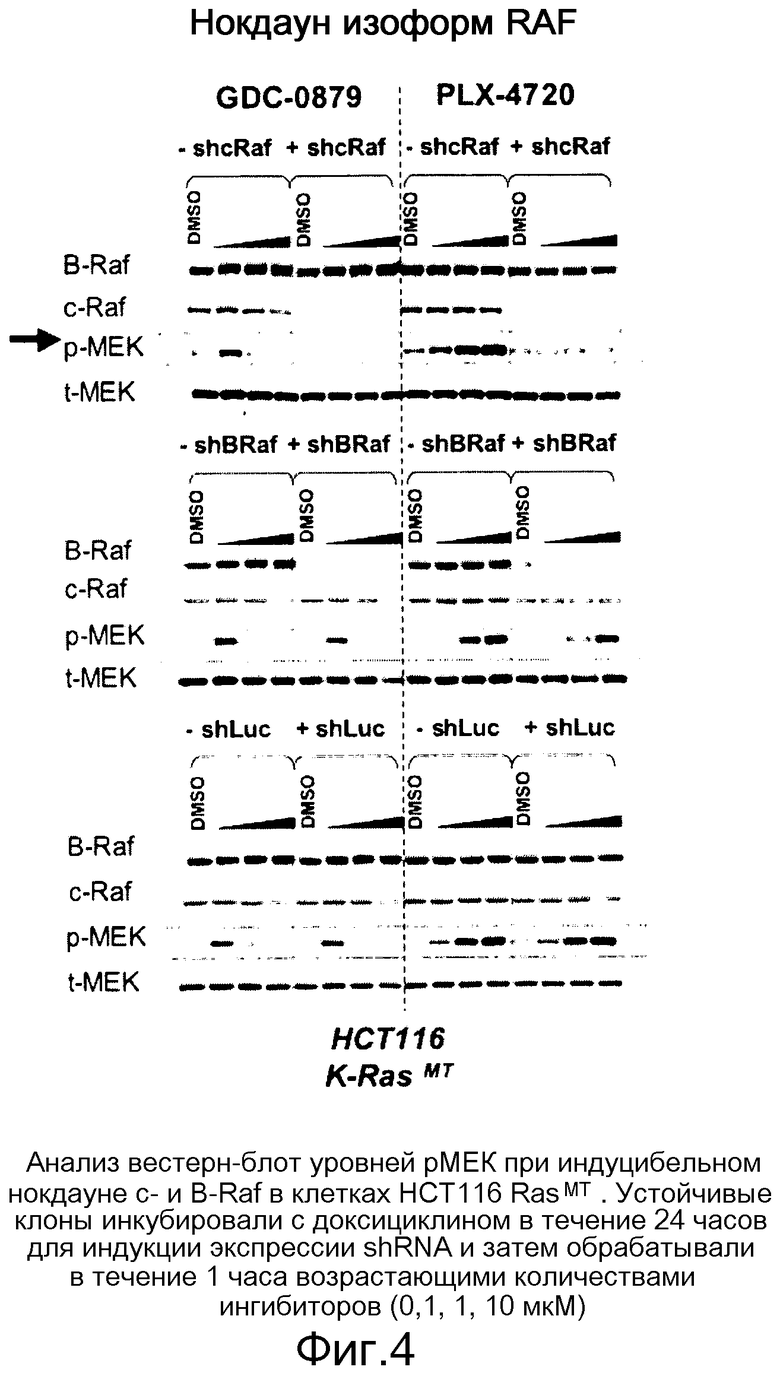
На фигуре 4 показано, что с-Raf представляет собой изоформу Raf, главным образом ответственную за индукцию рМЕК ингибиторами Raf на линиях, отличных от В-RafV600E.
На фигуре 5 представлена специфическая активность с-Raf, индуцированная обоими ингибиторами лишь на линиях, отличных от В-RafV600E. Не оказалось снижения уровней прорастания в условиях индукции Raf.
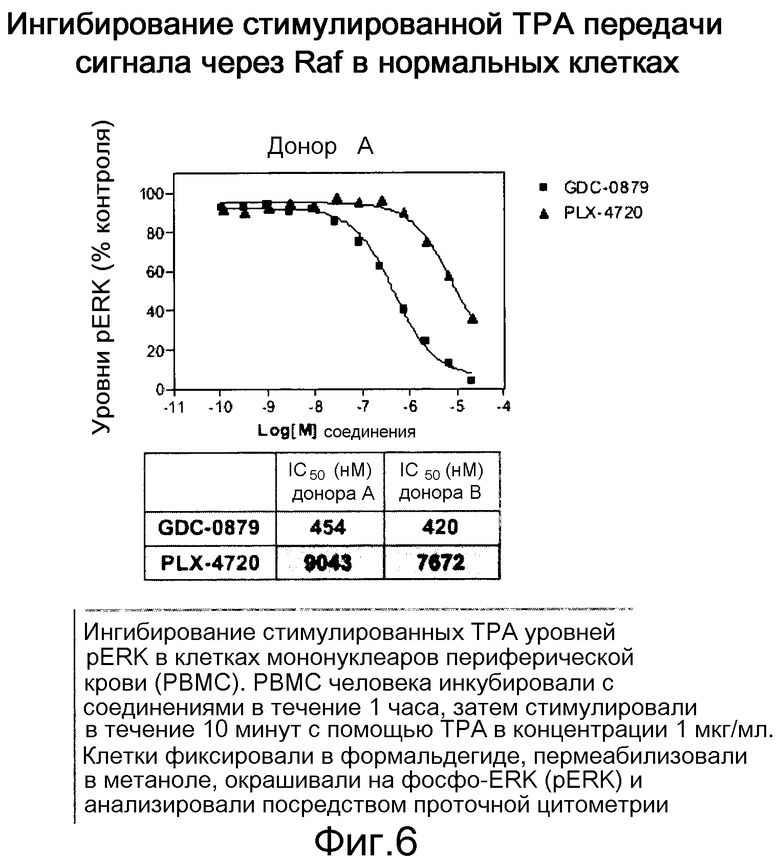
На фигуре 6 показано отсутствие индукции уровней pERK. Относительная эффективность ингибиторов коррелирует с их биохимическими IC50.
На фигуре 7 показано колоколообразное влияние на уровни рМЕК в исходных условиях. Ингибирующее влияние GDC-0879 преобладает после стимуляции сывороткой.
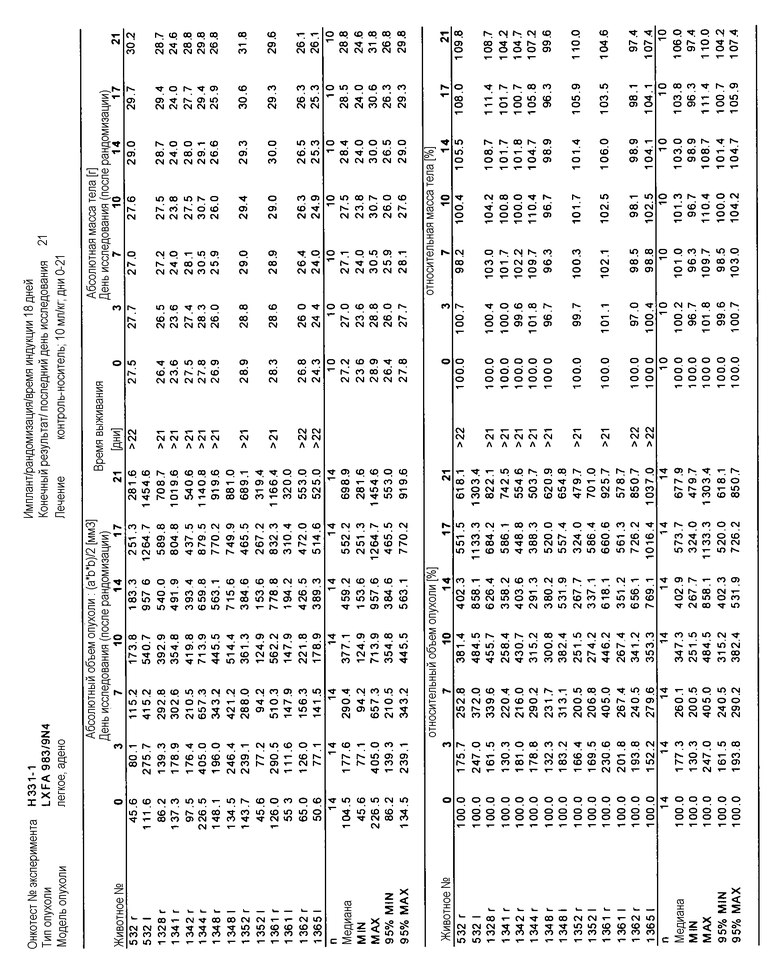
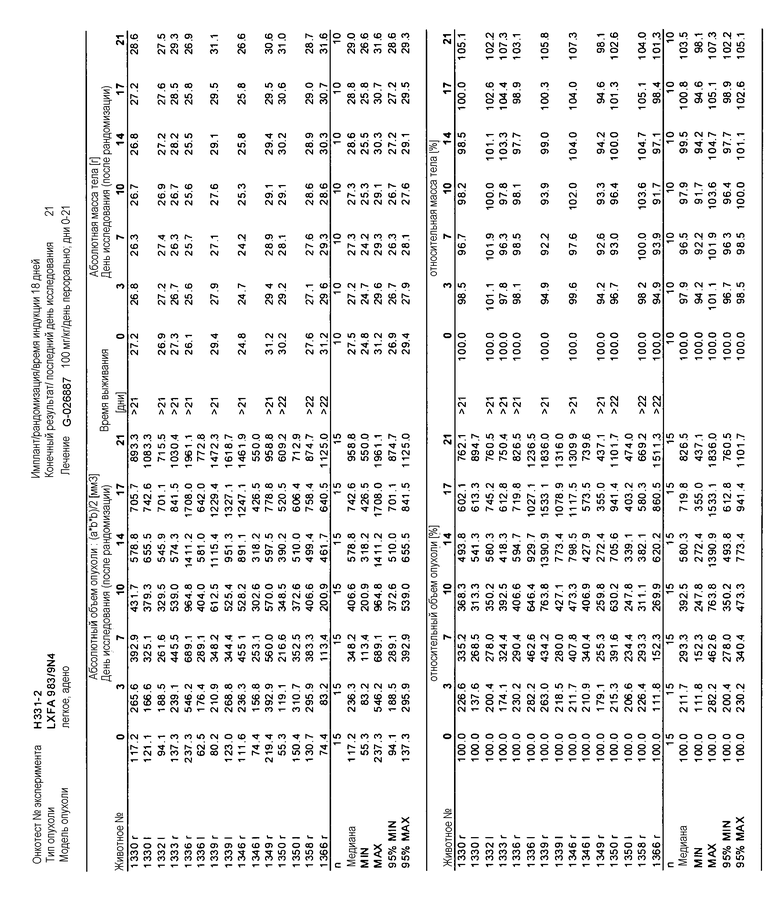
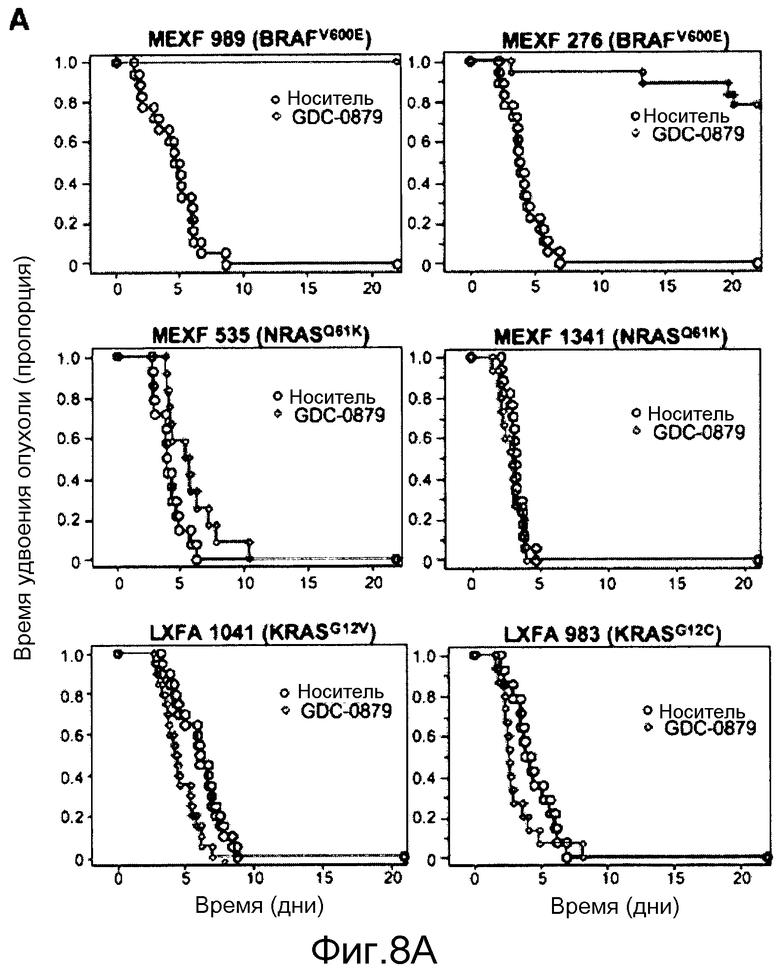
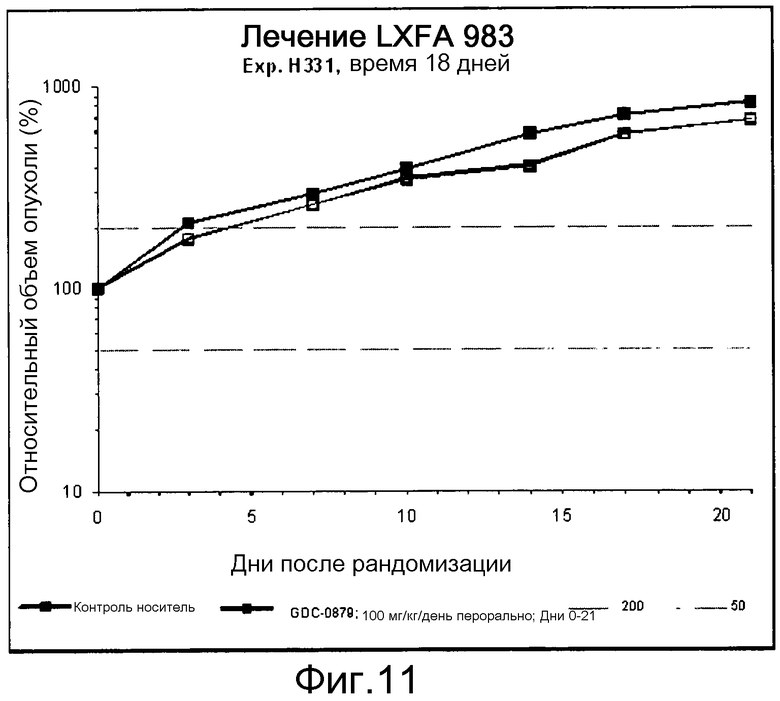
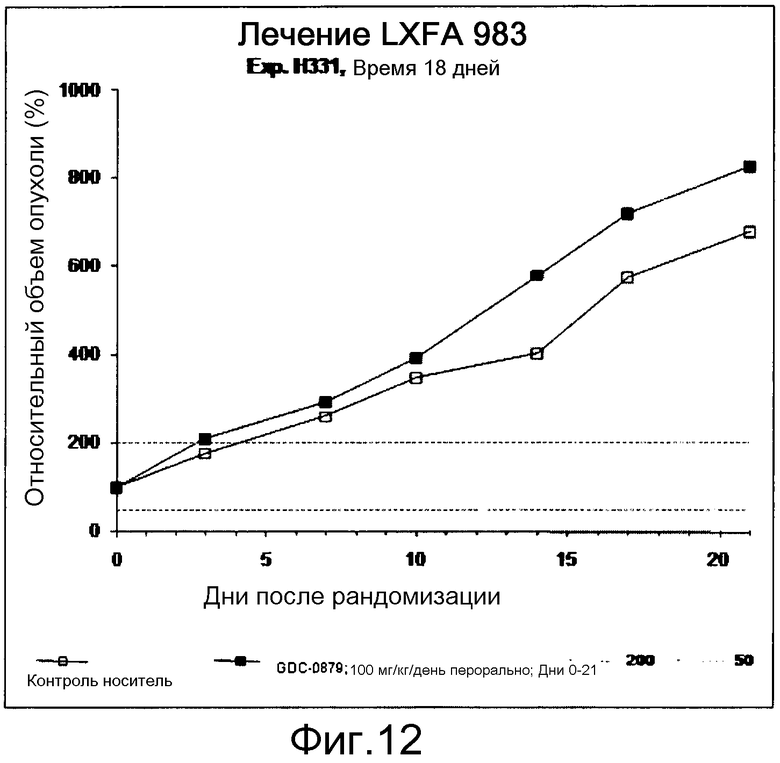
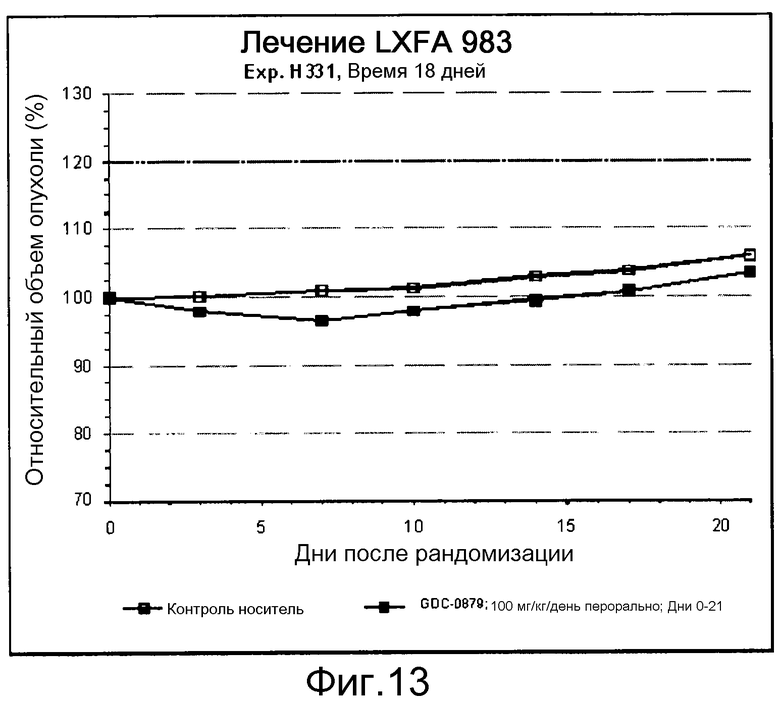
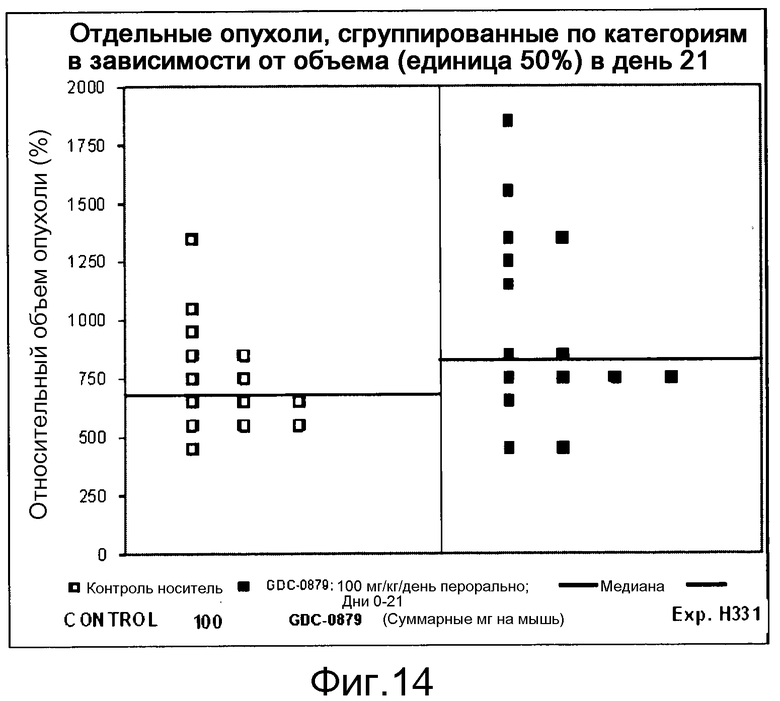
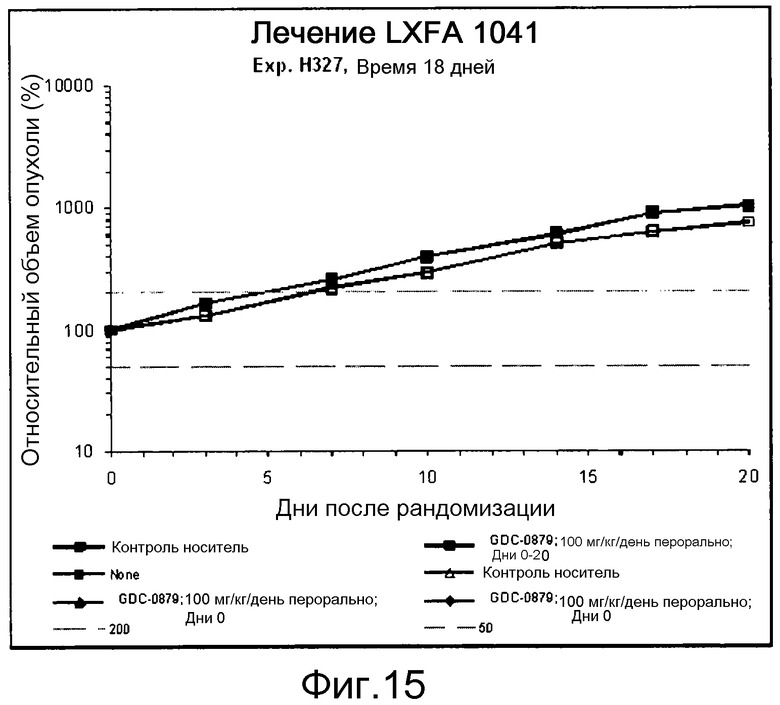
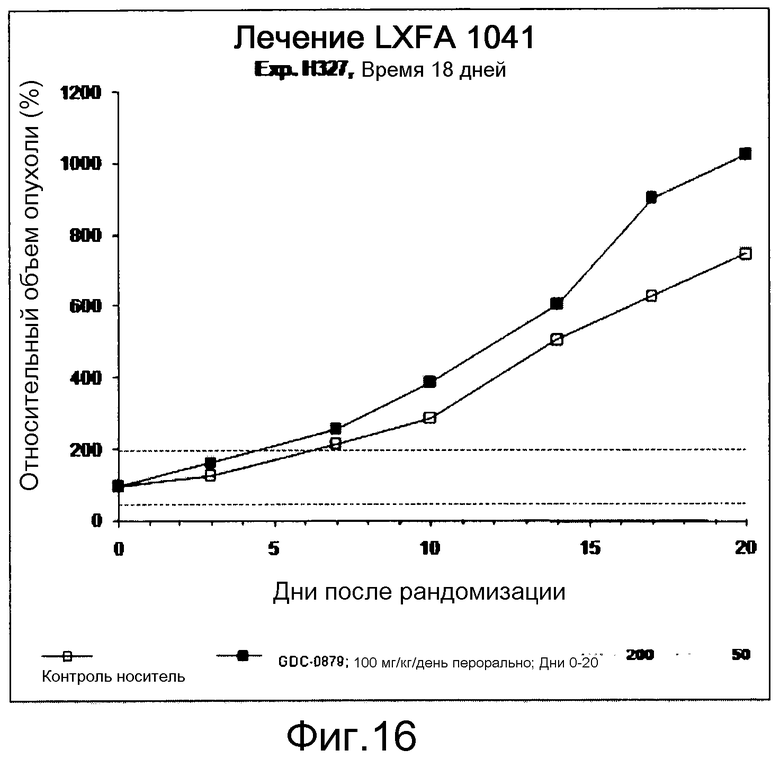
На фигуре 8А показано, что продолжительность и величину ингибирования пути BRAF определяет ингибитор В-Raf, эффективность GDC-0879 на основных моделях ксенотрансплантатов опухоли человека. График Каплана-Мейера, показывающий время удвоения опухоли для моделей полученных от пациентов опухолей: меланомы и немелкоклеточного рака легких, обработанных ежедневно с помощью GDC-0879 в количестве 100 мг/кг или носителем. Генотипы BRAF, N-ras и K-ras указаны. Статистически значимое (P<0,05) замедление опухолевой прогрессии отмечалось для опухолей MEXF 989, MEXF 276 и MEXF 355. Введение GDC-0879 существенно усилило рост некоторых K-ras-мутантных немелкоклеточных опухолей легких, таких как LXFA 1041 и LXFA 983.
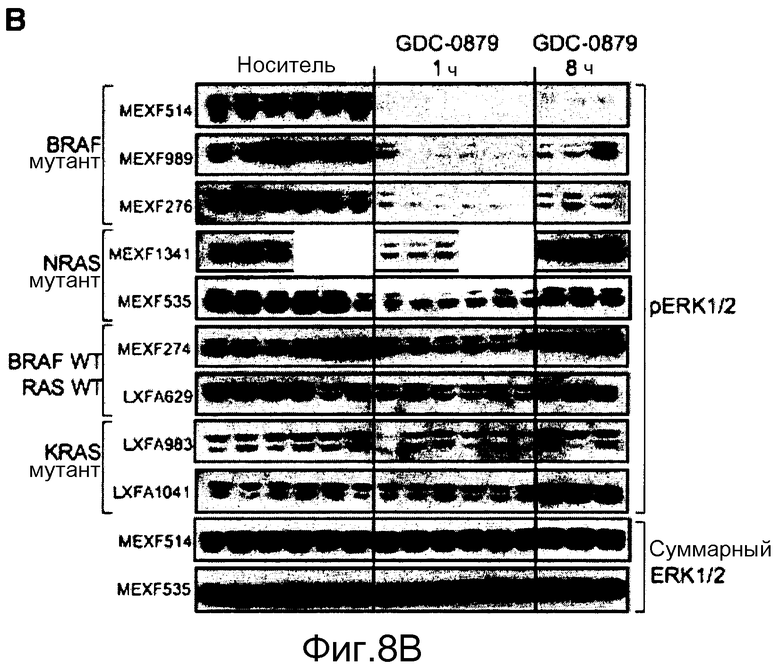
На фигуре 8В показано, что обработка с помощью GDC-0879 снижает фосфорилирование ERK1/2 в основных ксенотрансплантированных опухолях человека BRAFV600E. Во время курсовых фармакодинамических исследований мышей обрабатывали с помощью GDC-0879 в количестве 100 мг/кг и забивали через 1 или 8 ч после последней дозы (21-24 дни). Представлены иммуноблоты фосфорилированной и суммарной ERK1/2. Сильное ингибирование фосфо-ERK1/2, продолжавшееся через 8 ч, в значительной степени коррелировало со статусом BRAFV600E и противоопухолевой эффективностью GDC-0879. В качестве контроля нагрузки во всех образцах оценивали экспрессию суммарной ERK1/2.
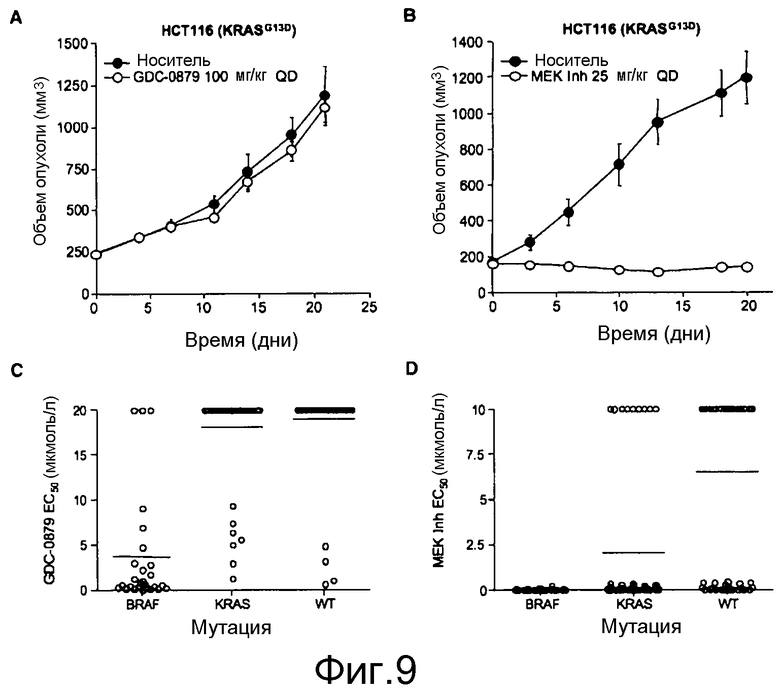
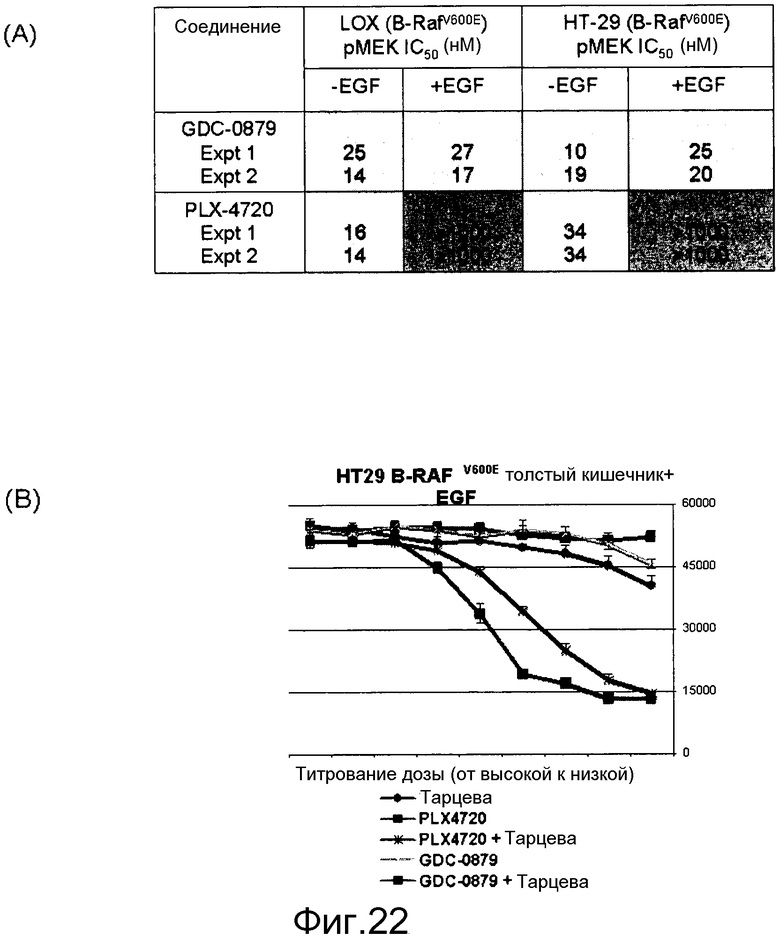
На фигурах 9А, В, С и D показано, что у линий K-ras-мутантных опухолевых клеток наблюдается различная чувствительность к ингибитору RAF GDC-0879 и ингибитору МЕК in vivo и in vitro. На фигурах А и В, ингибирование МЕК, но не RAF, предотвратило рост in vivo K-RAS-мутантных опухолей НСТ116. При достижении опухолями размера ~200 мм3 мышей отбирали случайным образом и начинали обработку либо ингибитором GDC-0879 в количестве 100 мг/кг (А), либо ингибитором МЕК в количестве 25 мг/кг (МЕК Inh; B) по ежедневной схеме. Точки, среднее; черточки, SE. C, величины ЕС50 GDC-0879 130 линий клеток представлены в виде функции статуса мутирования BRAF и К-RAS. GDC-0879-опосредованное ингибирование роста клеток в значительной степени коррелировало с мутацией BRAF. D, точечные диаграммы величин ЕС50 ингибитора МЕК сгруппированы согласно генотипу. Ингибирование МЕК также влияло на значительную фракцию линий клеток, экспрессирующих BRAF дикого типа. Данные представляют среднее четырехкратных измерений.
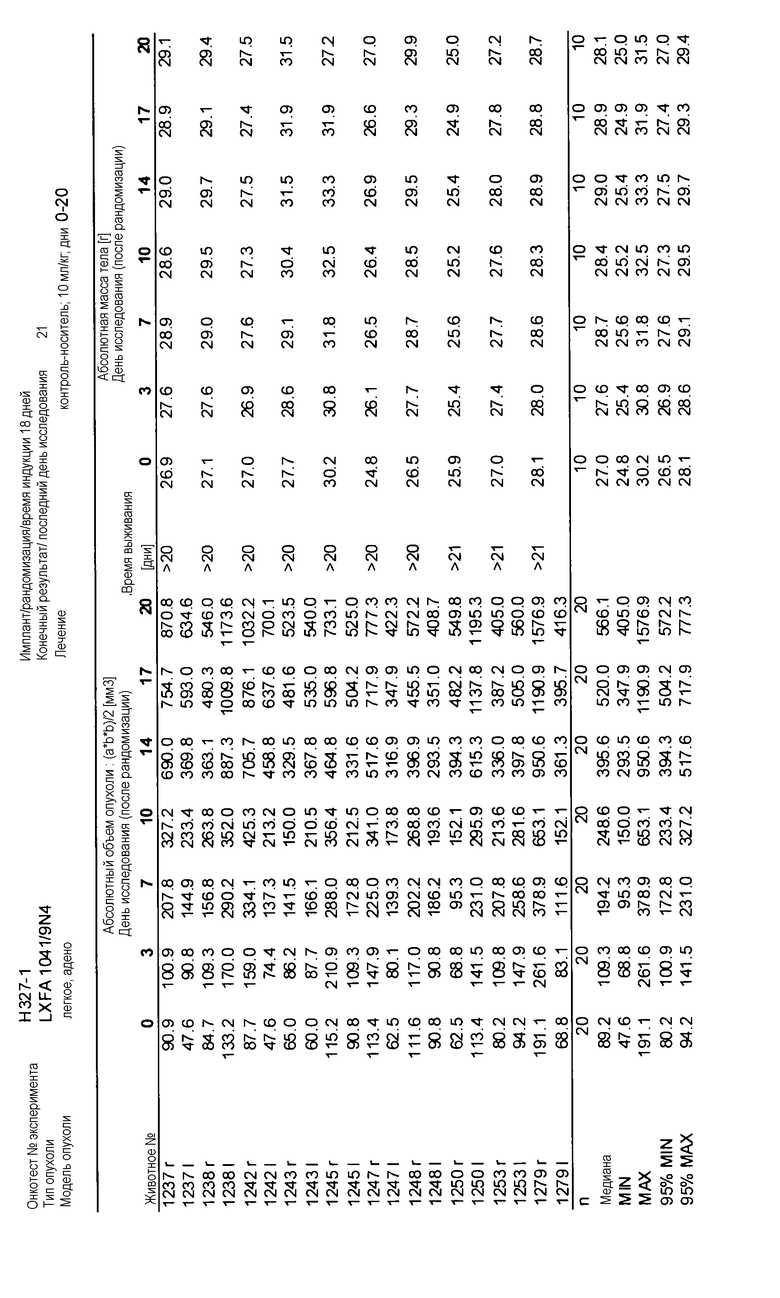
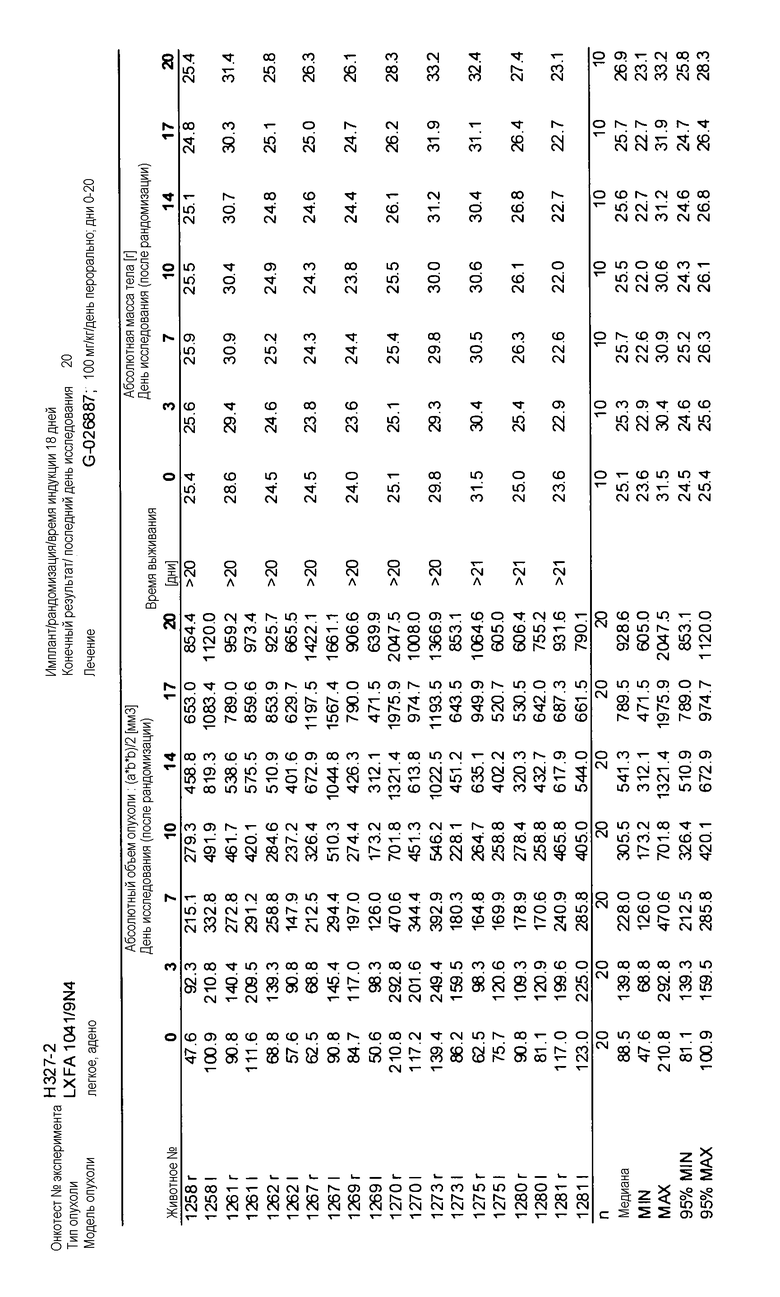
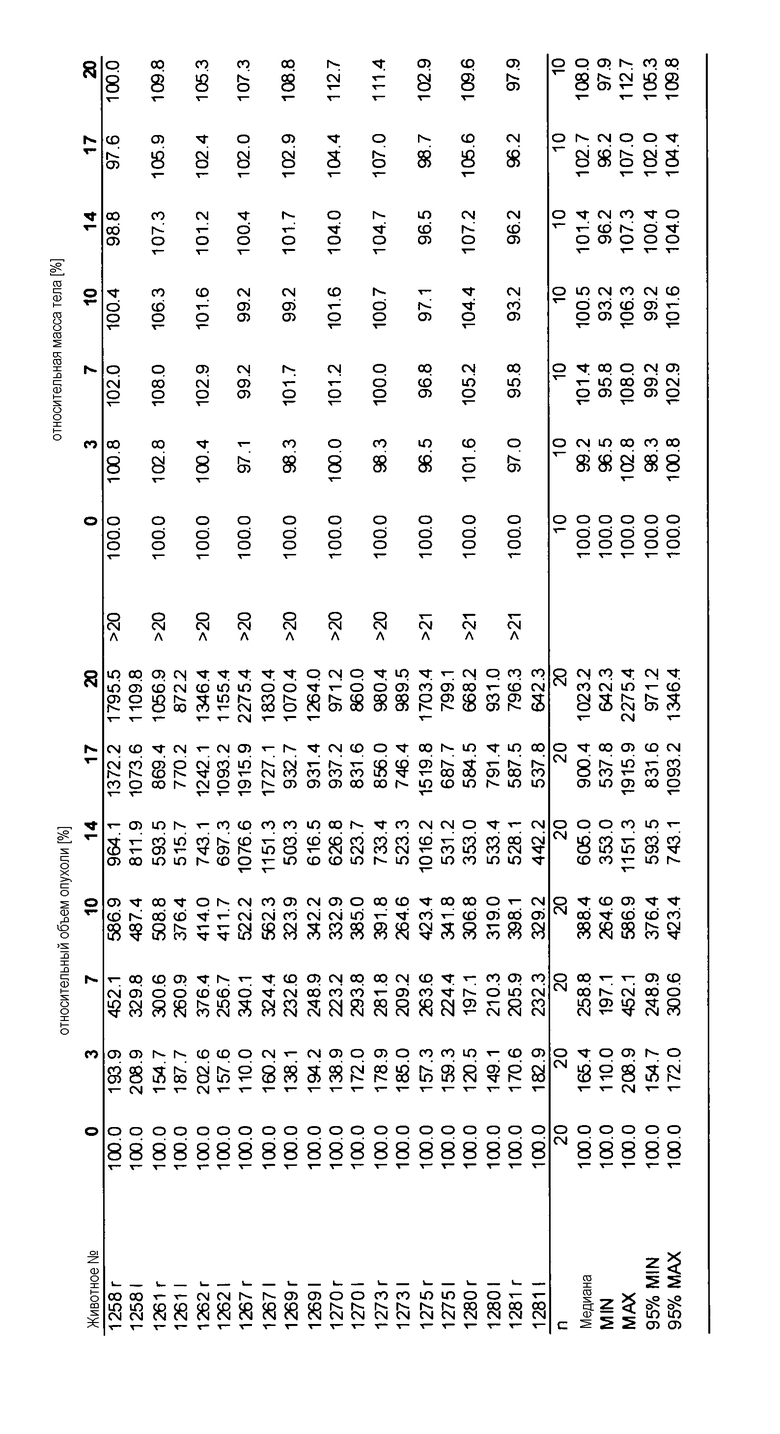
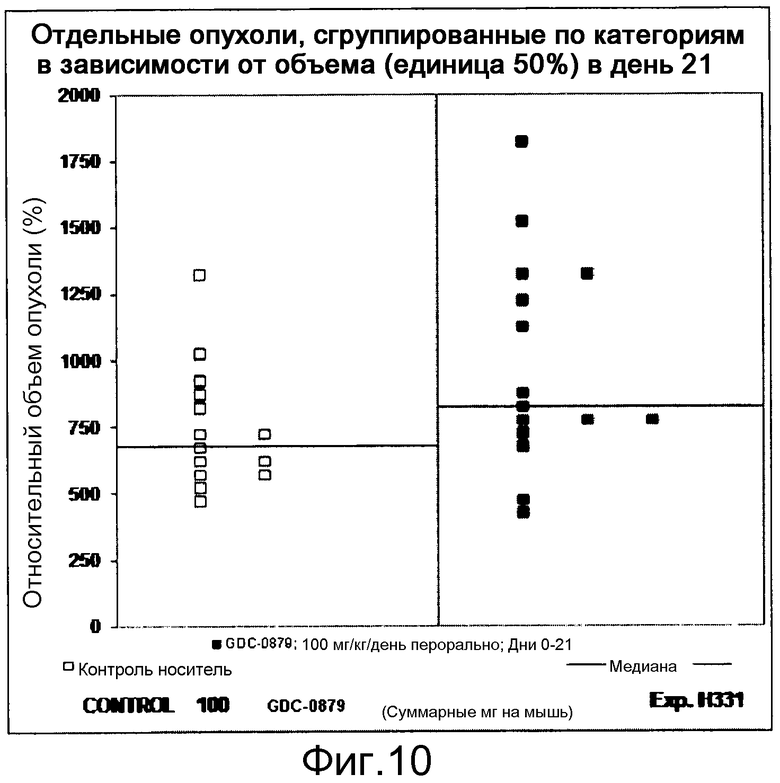
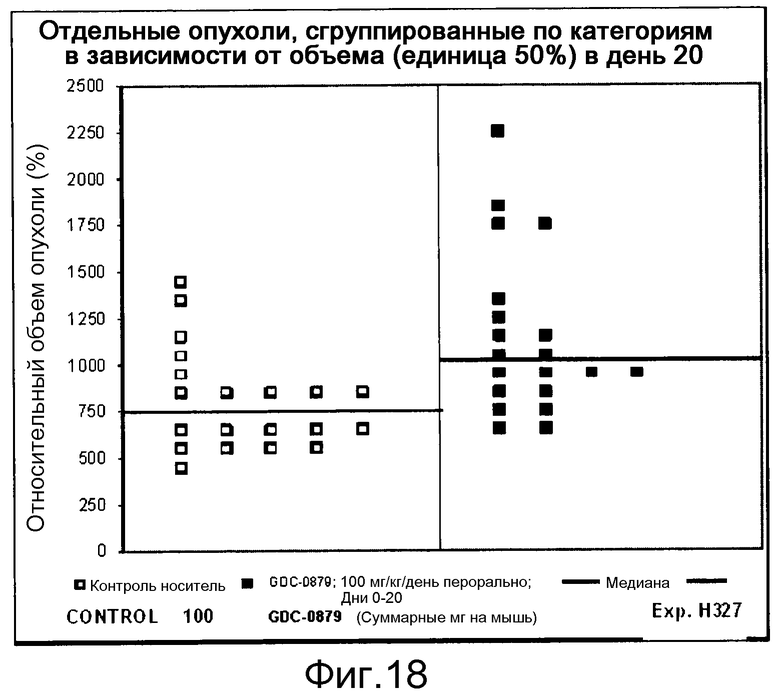
На фигурах 10-18 показан рост в ксенотрансплантатах опухолей легких после введения дозы GDC-0879.
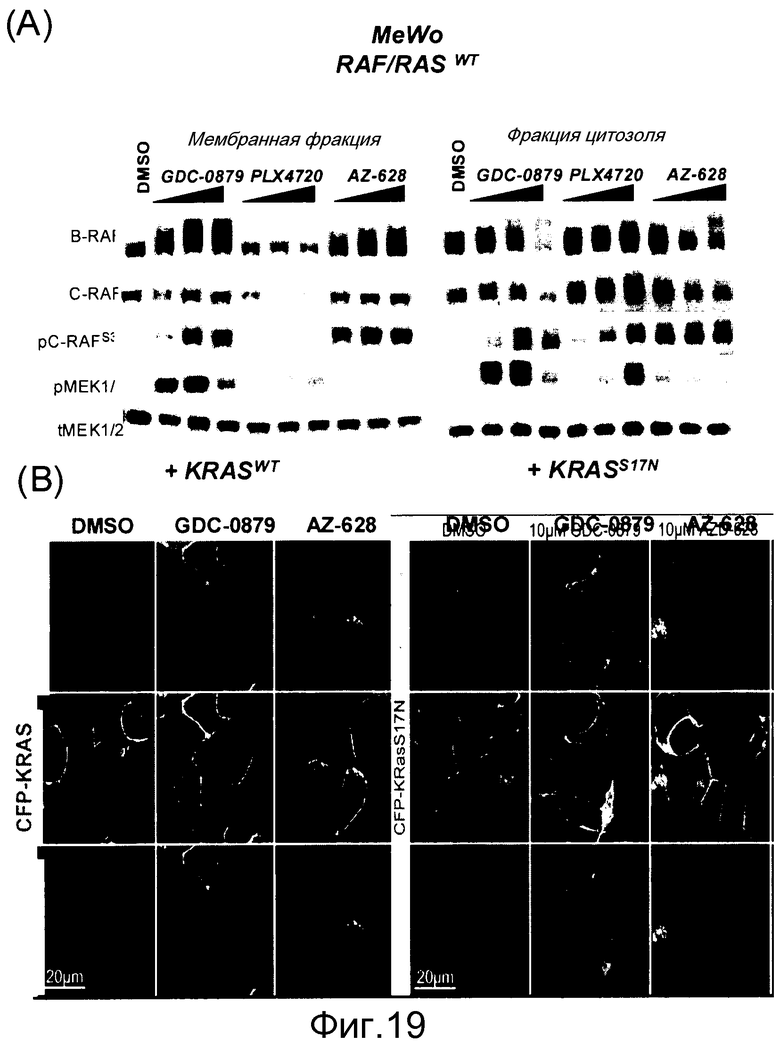
На фигурах 19А и В представлены ингибиторы Raf, индуцирующие RAS-зависимую транслокацию RAF дикого типа в плазматическую мембрану в клетках, отличных от B-RAFV600E. (A) Клетки MeWo (RAS/RAFWT) обрабатывали с помощью GDC-0879 (2-{4-[(1E)-1-(гидроксиимино)-2,3-дигидро-1H-инден-5-ил]-3-(пиридин-4-ил)-1H-пиразол-1-ил}этан-1-ол), PLX4720 (N-[3-[(5-хлор-1Н-пирроло[2,3-b]пиридин-3-ил)карбонил]-2,4-дифторфенил]-1-пропансульфонамид) или AZ-628 (3-(2-цианопропан-2-ил)-N-(4-метил-3-(3-метил-4-оксо-3,4-дигидрохиназолин-6-иламино)фенил)бензамид) (все в концентрации 0,1, 1, 10 мМ) в течение 1 часа и фракционировали на мембранную (Р100) и цитозольную (S100) фракции. Аликвоты мембранной и цитозольной фракций подвергали иммуноблоттингу с указанными антителами. (В) Клетки НЕК293Т временно трансфицировали с помощью Venus-C-RAF (зеленый), CFP-K-RAS (красный) и mCherry-H2B (голубой). Меченный с помощью Venus C-RAF локализуется рядом с CFP-KRAS на плазматической мембране в клетках, обработанных в течение 4 часов с помощью GDC-0879 или AZ-628, взятых в концентрации 10 мМ, с последующим изображением жизнеспособных клеток, используя конфокальную флуоресцентную микроскопию. Транслокация на мембране блокируется при трансфекции доминантного негативного меченного CFP KRASS17N вместо KRASWT (правая панель).
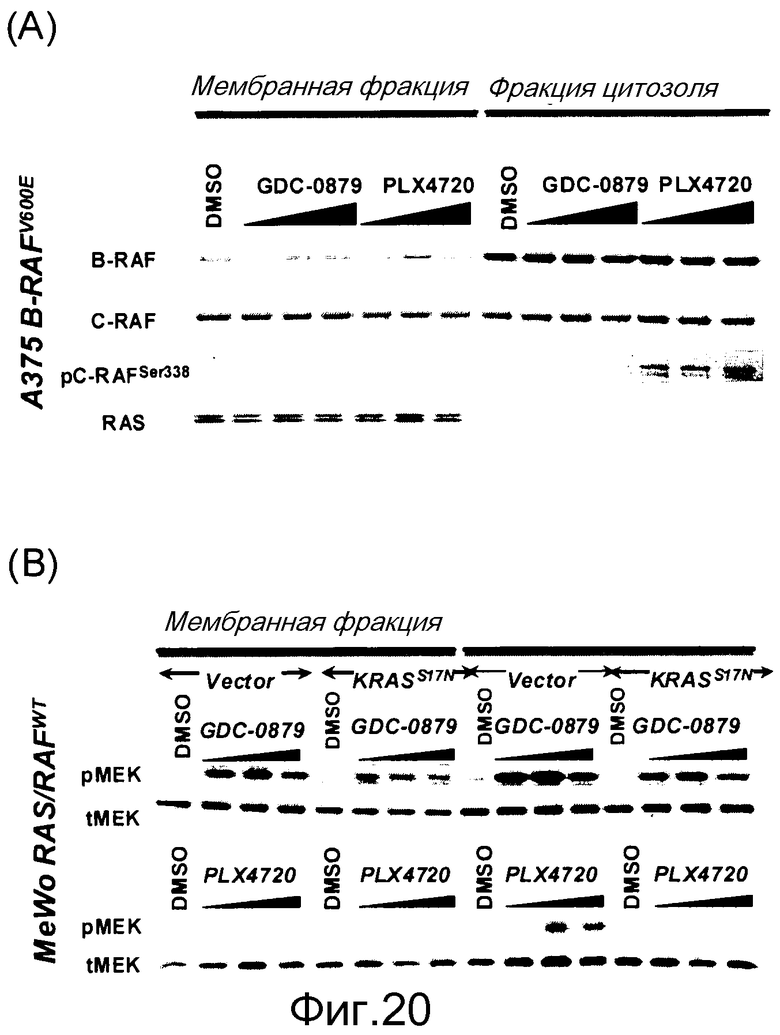
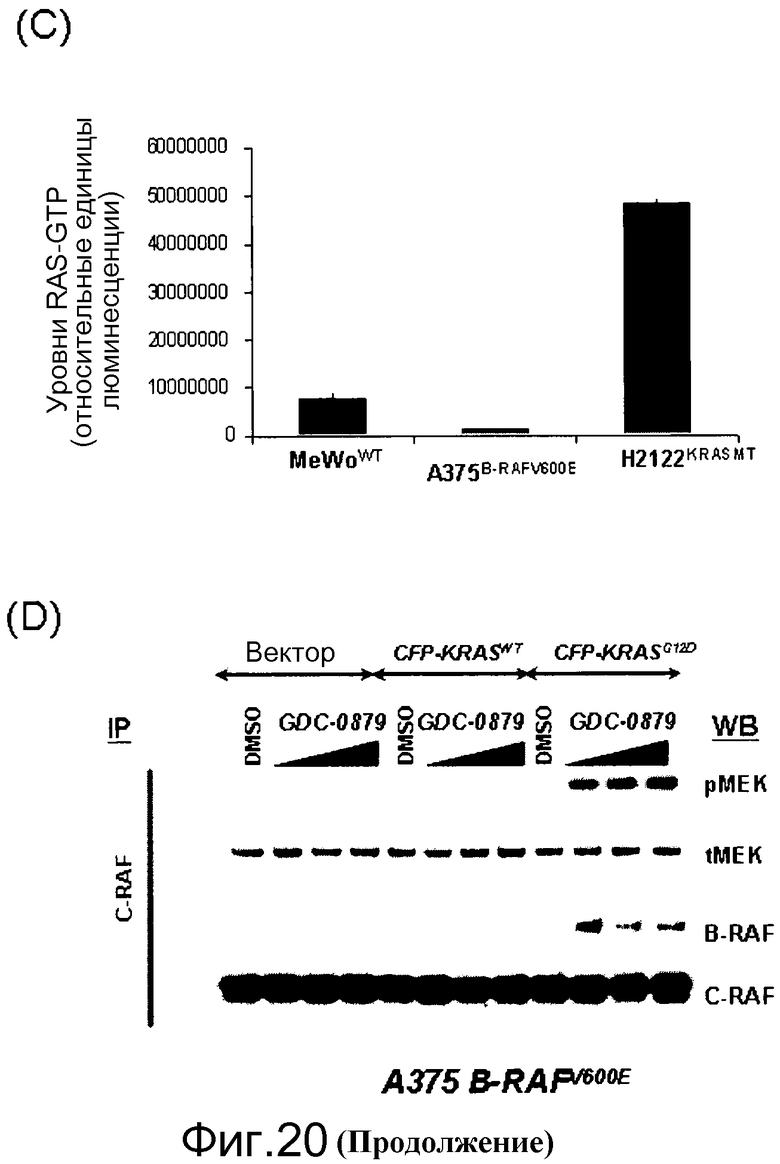
На фигурах 20А, В, С и D показана важность роли, которую активный Ras играет в активации C-RAF и индукции фосфо-МЕК посредством ингибиторов RAF. (А) Клетки А375 (B-RAFV600E) обрабатывали с помощью GDC-0879 или PLX4720 в течение 1 часа и лизировали в гипотоничном буфере для фракционирования мембраны. Обе фракции, мембранную (Р100) и цитозольную (S100), подвергали иммуноблоттингу с указанными антителами. (В) Клетки MeWo временно трансфицировали с помощью KRASWT или KRASS17N, обрабатывали с помощью GDC-0879 или PLX4720 (в концентрациях 0,1, 1, 10 мМ) в течение 1 часа и фракционировали на мембранную (Р100) и цитозольную (S100) фракции. Аликвоты мембранной и цитозольной фракций подвергали иммуноблоттингу с антителами против фосфо- и против суммарной МЕК. (С) Из лизатов клеток MeWo (RAS/RAFWT), A375 (B-RAFV600E) и H2122 (KRASMT) измеряли уровни RAS-GTP с помощью протокола ELISA Ras-GTP, используя иммобилизованный C-RAF-RBD в качестве приманки для захвата RAS-GTP. Относительные единицы люминесценции представляют детекцию RAS антителом против RAS, связанным с RBD. По RAS-GTP H2122>>Mewo>A375. (D) Трансфекция мутантного KRASG12D (но не KRASWT) в клетки А375 (B-RAFV600E) дает возможность клеткам индуцировать гетеродимеры B-RAF:С-RAF и активировать киназу С-RAF при наличии ингибитора RAF GDC-0879 (дозированного по 0,1, 1, 10 мМ). С-RAF иммонопреципитировали из контрольных и обработанных ингибитором клеток и анализировали в отношении активности белка и гетеродимеризации B-RAF. Показанные с помощью WB суммарные уровни С-RAF в иммунопреципитате указывают загрузку каждой полосы.
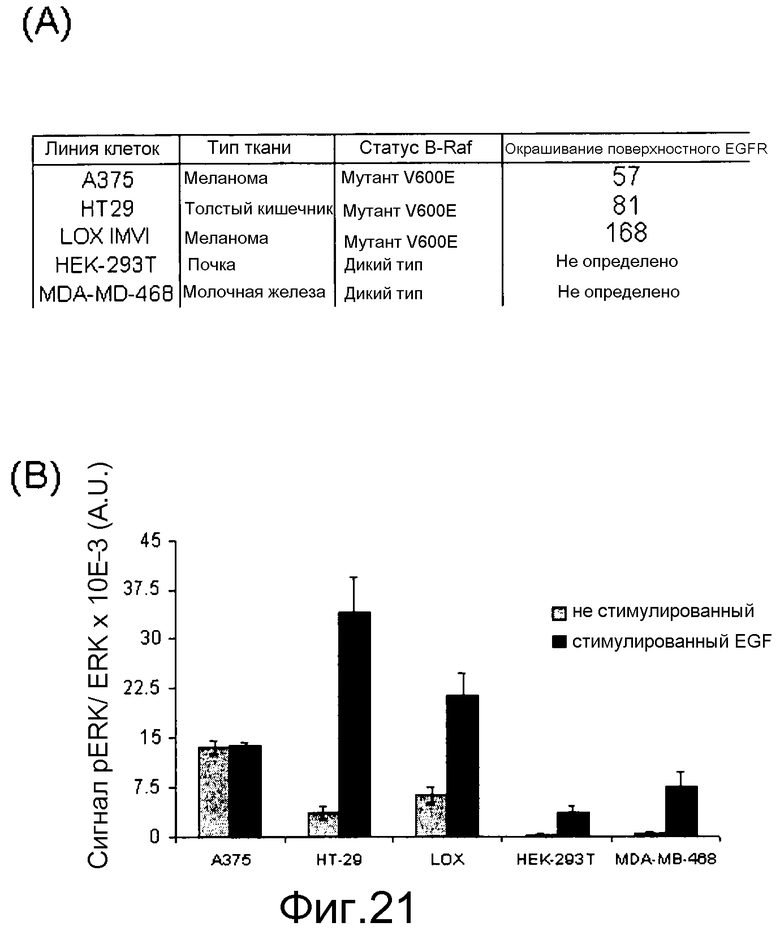
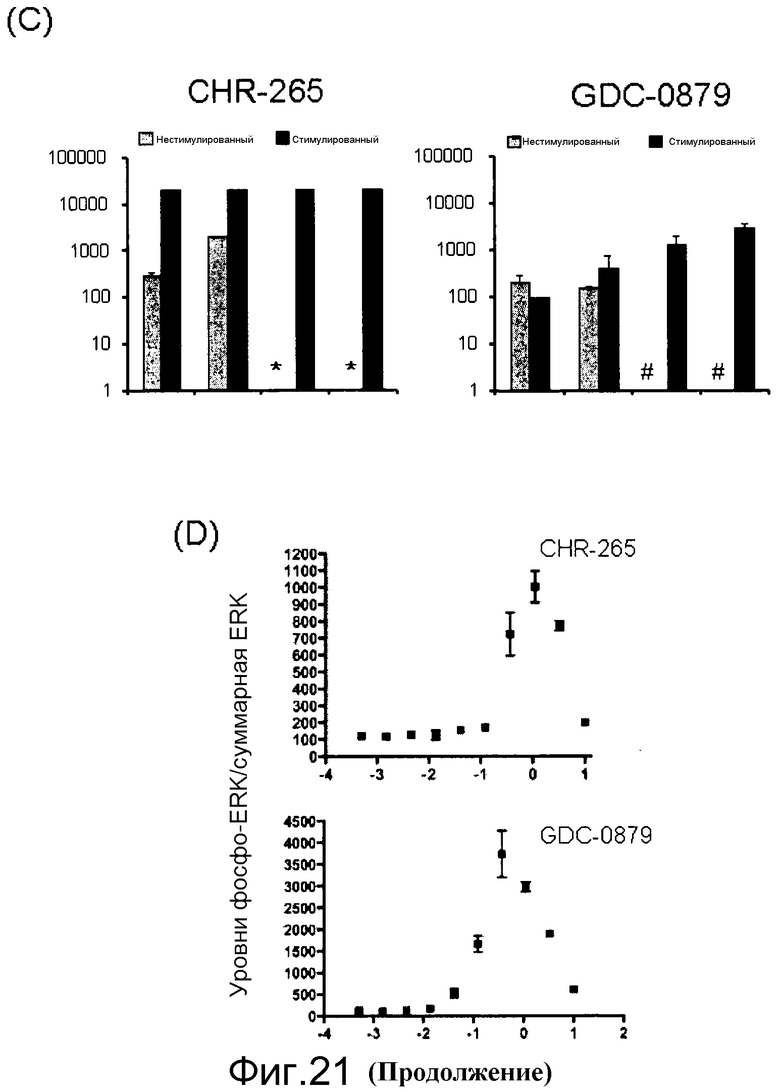
На фигурах 21А, В, С и D представлены измерения исходного и стимулированного EGF нокдауна pERK с помощью ингибиторов Raf в линиях клеток B-RAFV600E и В-Raf WT. (A) Таблица генотипа и уровней EGFR среди протестированных линий. (В) Измерение исходных и стимулированных уровней pERK: клетки обрабатывали с помощью соединения, взятого в концентрации 0,0004-10 мМ, в бессывороточных средах в течение 1 часа. Для стимуляции за 5 мин до лизиса клеток добавляли EGF в количестве 20 нг/мл. Лизаты переносили в плашку MSD, на которой измеряли уровни фосфо- и суммарной ERK. (C) Данные по IC50 pERK наносили на графики для двух ингибиторов Raf (CHR-265, 1-метил-5-[[2-[5-(трифторметил)-1H-имидазол-2-ил]-4-пиридинил]окси]-N-[4-(трифторметил)фенил]-1H-бензимидазол-2-амина, и GDC-0879) в исходных и стимулированных с помощью EGF условиях. (D) Графики доза-ответ индукции pERK при 1-часовой обработке указанных линий B-Raf WT с помощью ингибиторов Raf.
На фигурах 22А и В показана стимуляция с помощью EGF уровней фосфо-МЕК и клеточной пролиферации линий мутантных клеток B-RAF V600E, резистентных к ингибитору RAF. (А) Клетки обрабатывали соединением в концентрации 0,0004-10 мМ в бессывороточных средах в течение 1 часа. Для стимуляции за 5 мин до лизиса клеток добавляли EGF в количестве 20 нг/мл. Лизаты переносили в плашку MSD, на которой измеряли уровни фосфо- и суммарной MEK. Данные по IC50 фосфо-МЕК наносили на график для двух указанных ингибиторов Raf в исходных и стимулированных EGF условиях. GDC-0879 более эффективен в нокдауне уровней фосфо-МЕК, поскольку он обладает меньшей доведенной величиной IC50 в отношении изоформ C-RAF и B-RAF дикого типа, чем PLX4720. (B) Обработка EGF выявляет клетки B-RAFV600E, резистентные к ингибиторам RAF, но комбинация с тарцева (или ингибитором МЕК, например, PD-0325901) преодолевает эту устойчивость. В клетки вводили указанные ингибиторы либо самостоятельно, либо в комбинации при наличии в среде EGF в концентрации 20 нг/мл.
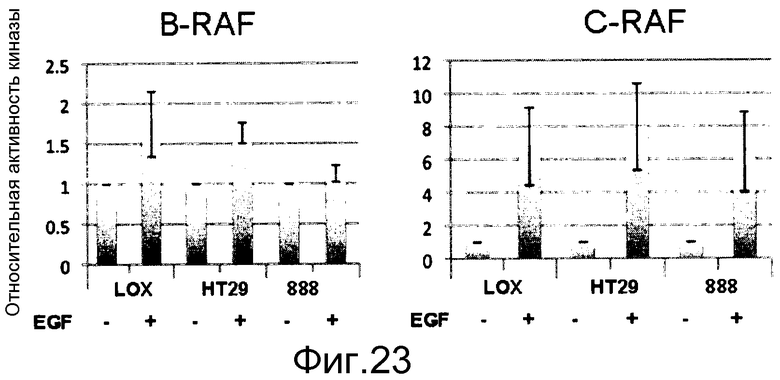
На фигуре 23 показана стимуляция EGF, индуцирующая активность B-RAF и С-RAF в мутантных линиях B-RAFV600E (LOX, 888 представляют собой меланому, тогда как НТ29 представляет собой рак толстого кишечника). Все линии клеток экспрессируют уровни поверхностных EGFR. 888 гомозиготен по аллелю B-RAFV600E, все другие линии гетерозиготны, поэтому также несут аллель B-RAF дикого типа. Гетерозиготные клеточные линии индуцируют активность как B-RAF, так и С-RAF, тогда как гомозиготная линия индуцирует активность лишь С-RAF. Эта активность RAF дикого типа не может быть ингибирована с помощью селективных ингибиторов RAF B-RAF V600E, поэтому в этих линиях уровни фосфо-МЕК, индуцированные с помощью EGF, резистентны к ингибированию RAF, тогда как эндогенные уровни фосфо-МЕК, вызванные B-RAF V600E, чувствительны к селективным ингибиторам RAF B-RAF V600E.
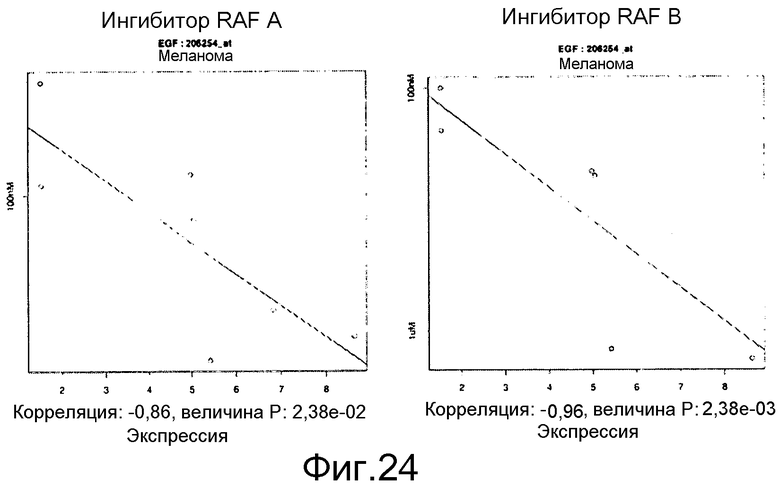
На фигуре 24 показана тенденция к отрицательной корреляции между высокими уровнями мРНК EGF (ось х) и величиной IC50 ингибитора RAF (мкМ, по оси у). Данные по клеточной эффективности показаны для линий клеток меланомы B-RAF V600E и представляют ингибиторы RAF, которые биохимически селективны в отношении изоформы B-RAF V600E с меньшими соответствующими биохимическими и клеточными эффектами в отношении изоформ RAF дикого типа.
На фигуре 25 показаны уровни RAS-GTP в большом числе типов опухолей. Уровни RAS-GTP являются низкими в опухолях К-RASWT и высокими в опухолях, несущих мутантный К-RAS, например, опухолях Н2122. Уровни Ras-GTP определяли с помощью анализа RBD-Elisa.
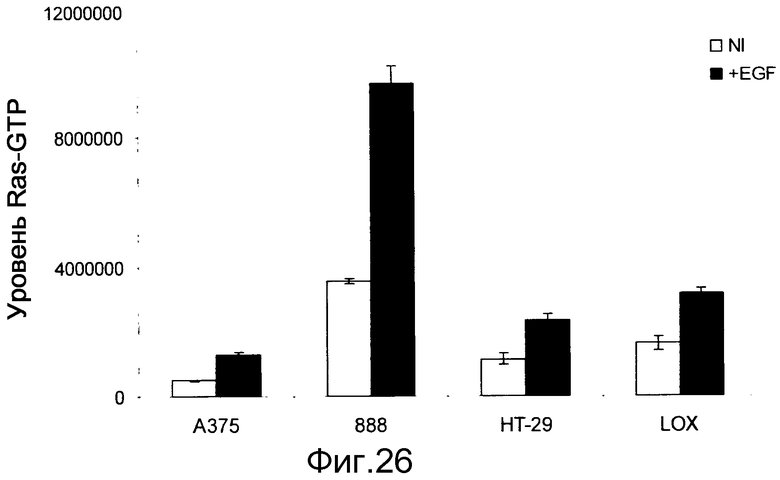
На фигуре 26 показаны уровни Ras-GTP в клетках B-Raf V600E при наличии (+EGF) и в отсутствие (NI) индукции EGF. Стимуляция EGF в клетках BRAF V600E повышает уровни Ras-GTP.
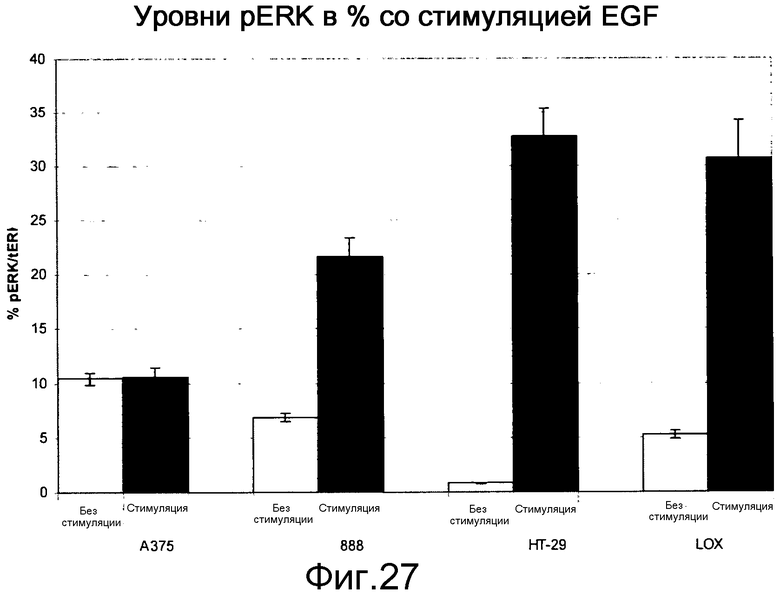
На фигуре 27 показаны уровни pERK в клетках B-Raf V600E при наличии (stim) и в отсутствие (unstim) индукции EGF. Стимуляция EGF в клетках BRAF V600E повышает уровни Ras-GTP, приводя к повышению уровней pERK в линиях клеток B-RAF V600E посредством активации С-Raf (см. активацию С-Raf, показанную на фигуре 23). Все 4 линии клеток являются мутантами В-Raf V600E, но среди них А375 имеет самые низкие уровни Ras-GTP (самые низкие уровни активного Ras) и у нее не наблюдается устойчивой индукции уровней рМЕК и pERK в ответ на EGF. Известно, что клетки А375 чувствительны к ингибиторам Raf.
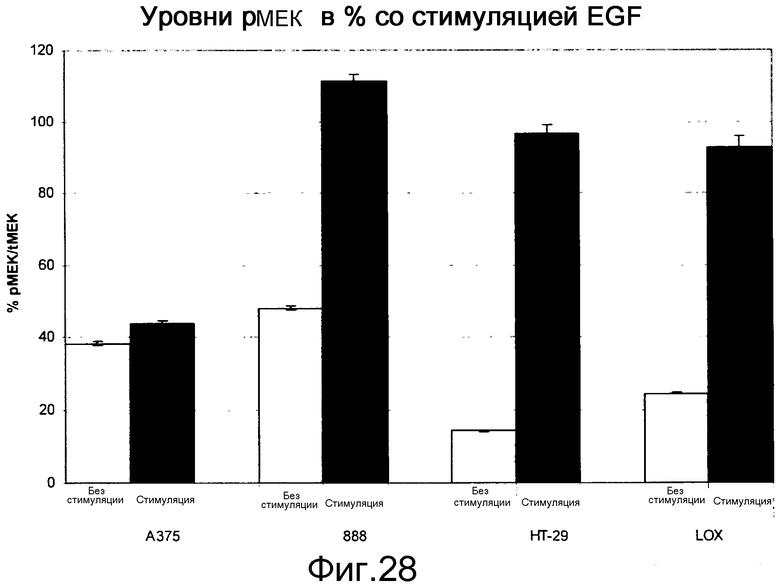
На фигуре 28 показаны уровни рМЕК в клетках B-Raf V600E при наличии (stim) и в отсутствие (unstim) индукции EGF. Стимуляция EGF в клетках BRAF V600E повышает уровни Ras-GTP, приводя к повышению уровней pMEK в линиях клеток B-RAF V600E посредством активации С-Raf (см. активацию С-Raf, показанную на фигуре 23).
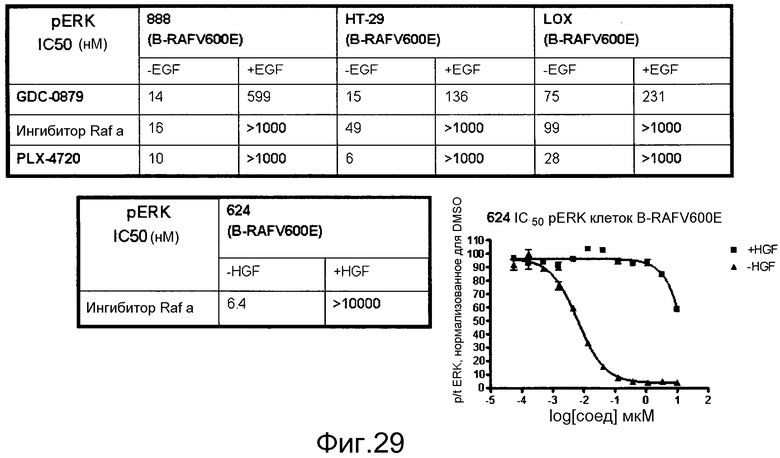
На фигуре 29 суммируются эффекты некоторых ингибиторов RAF (GDC-0879, PLX-4720 и “Raf inh a”, который представляет собой 2,6-дифтор-N-(3-метокси-1Н-пиразоло[3,4-b]пиридин-5-ил)-3-(пропилсульфонамидо)бензамид) по блокированию клеточной индукции pERK в ответ на стимуляцию с помощью EGF. Клетки BRAF V600E, экспрессирующие EGFR, помещали в бессывороточную среду и затем либо оставляли без стимуляции (-EGF), либо стимулировали с помощью EGF (+EGF) при наличии указанных ингибиторов RAF в различных дозах. Строили графики ингибирования pERK и графически представляли величины IC50. GDC-0879, как показано на фигуре 1, может эффективнее блокировать передачу сигнала через RAF дикого типа, в то время как остальные два ингибитора являются селективными в отношении BRAF V600E.
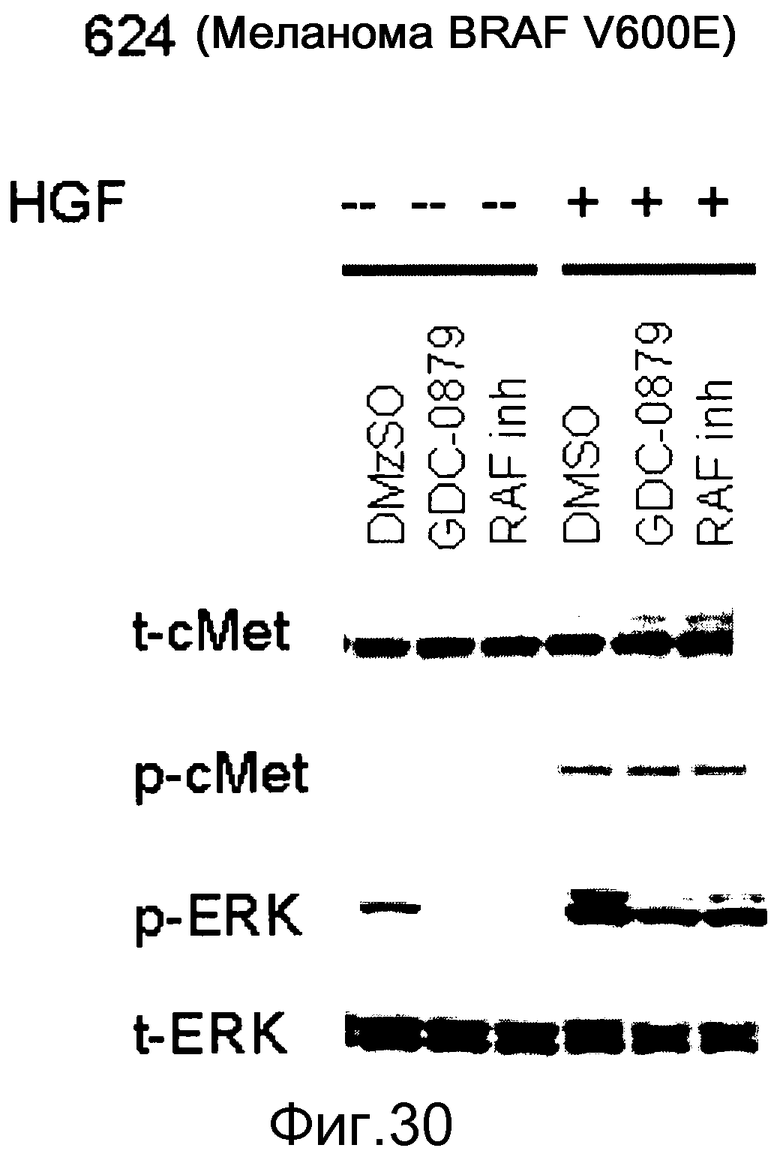
На фигуре 30 показано, как стимуляция HGF (+HGF) приводит к индукции pERK в клетках, сверхэкспрессирующих с-МЕТ. Эта индукция не блокируется ингибиторами RAF. Тем не менее, исходные уровни pERK, которые вызываются BRAF V600E, эффективно блокируются ингибиторами RAF. Это демонстрирует, что передача сигнала через с-МЕТ также происходит при участии изоформ RAF дикого типа.
Таким образом, аберрантная экспрессия рецепторных тирозинкиназ (RTK), к которым относится EGFR, или аберрантная индукция соответствующими лигандами может выявить клетки, устойчивые к ингибиторам RAF.
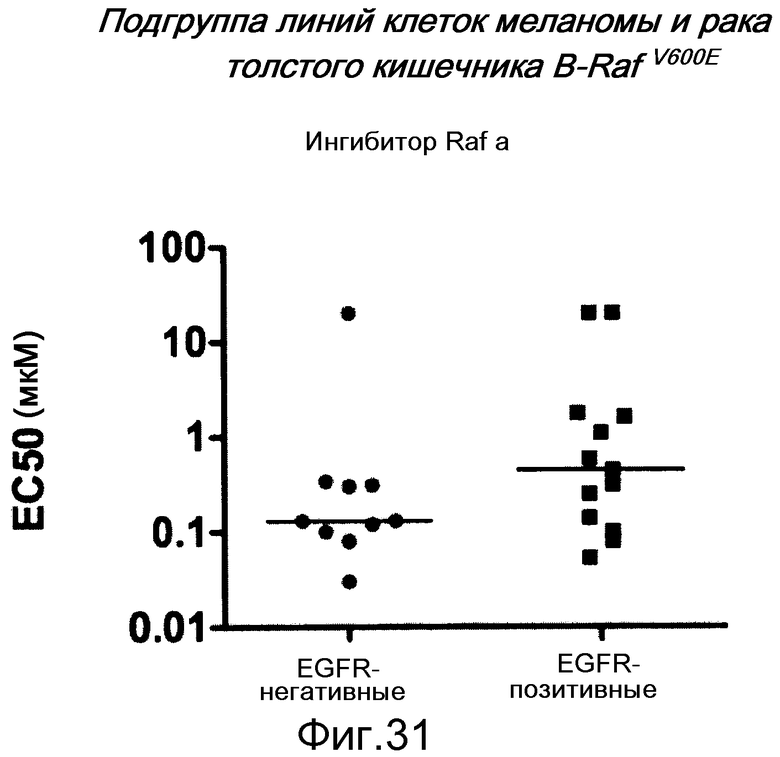
На фигуре 31 показано, как среди клеток B-RAFV600E экспрессия EGFR ассоциируется с устойчивостью к ингибиторам RAF. Этот график представляет величины ЕС50, отражающие клеточную жизнеспособность, (мкМ) линий мутантных клеток B-RAF V600E меланомы и толстого кишечника, которые обрабатывали ингибитором RAF за 4 дня до определения жизнеспособности. Уровни EGFR определяли вестерн-блотом и классифицировали как отрицательные в случае отсутствия полосы при проведении вестерн-блота лизатов клеток с антителом против EGFR. Между EGFR-позитивными линиями клеток существует диапазон экспрессии от низкого к среднему и высокому. Единственной EGFR-негативной линией клеток, которая устойчива (>20 мкМ ЕС50), является линия клеток PTEN null.
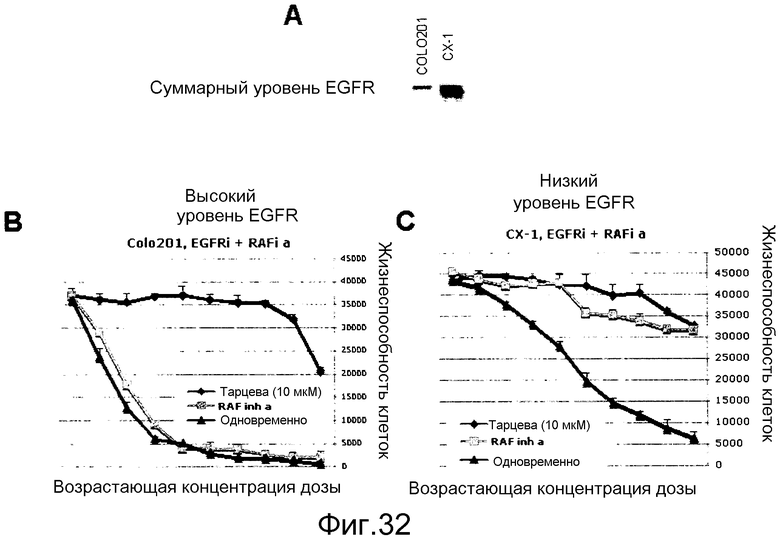
На фигурах 32А-С показаны комбинированные исследования ингибитора RAF и ингибитора EGFR (тарцева) в линиях опухолей толстого кишечника с различными уровнями экспрессии EGFR.
На фигуре 32А вестерн-блотом лизатов двух линий рака толстого кишечника BRAF V600E показаны их различные уровни суммарного EGFR: COLO201 имеет низкие уровни EGFR, тогда как СХ-1 имеет относительно высокие уровни EGFR.
На фигуре 32В показано влияние комбинированной обработки клеток COLO201 либо ингибитором RAF самостоятельно, тарцева самостоятельно, либо комбинацией ингибитора RAF и тарцева.
На фигуре 32С показано влияние комбинированной обработки клеток CX-1 либо ингибитором RAF самостоятельно, тарцева самостоятельно, либо комбинацией ингибитора RAF и тарцева. Ни ингибитор RAF самостоятельно, ни тарцева самостоятельно не супрессируют пролиферацию настолько эффективно, как комбинация. У обоих ингибиторов при совместном введении в клетки СХ-1 наблюдается удовлетворительный синергизм.
Таким образом, среди клеток BRAFV600E, экспрессирующих EGFR, высокие уровни EGFR прогнозируют сильный синергизм между ингибиторами RAF и ингибиторами EGFR. В частности, при раке толстого кишечника, когда среди опухолей BRAFV600E преобладает высокая экспрессия EGFR, у комбинации этих ингибиторов RAF и тарцева наблюдается синергизм в отношении ингибирования пролиферации опухолевых клеток.
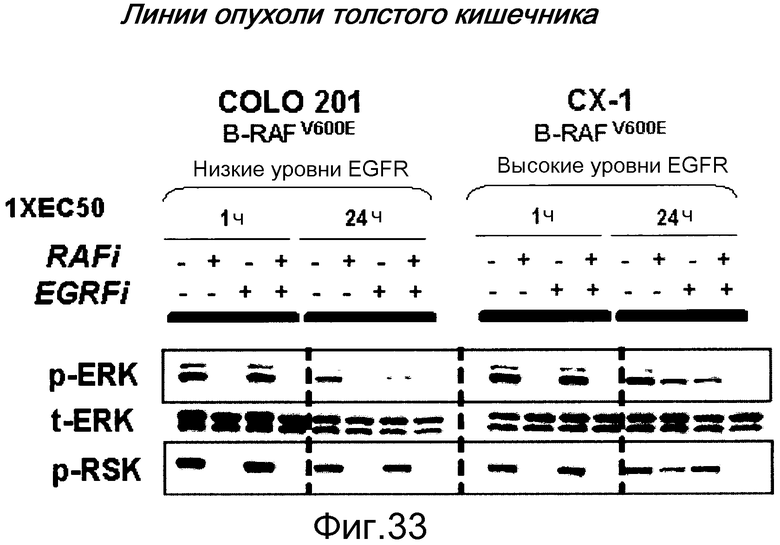
На фигуре 33 показана механистическая основа синергизма между ингибиторами RAF и тарцева в клетках опухолей BRAFV600E, экспрессирующих высокие уровни EGFR. Вестерн-блот осуществляли, взяв клетки, обработанные либо в течение 1 часа, либо 24 часов или без ингибиторов (ряды 1, 5, 9, 13), или ингибитором RAF самостоятельно (ряды 2, 6, 10, 14), тарцева самостоятельно (ряды 3, 7, 11, 15) или комбинацией ингибитора RAF и тарцева (ряды 4, 8, 12, 16) в концентрации, равной величине их клеточной ЕС50. Временная точка 24 часа показывает, что фосфорилирование ERK в мутантных клетках B-RAFV600E с высокой экспрессией EGFR (СХ-1) снизило чувствительность к ингибированию ингибиторами RAF, и для максимальной эффективности требуется комбинация ингибитора RAF и ингибитора EGFR. Часть сигнала активации ERK поступает от RAF дикого типа, который активируется после EGFR и не может быть блокирован селективным ингибитором BRAF V600E.
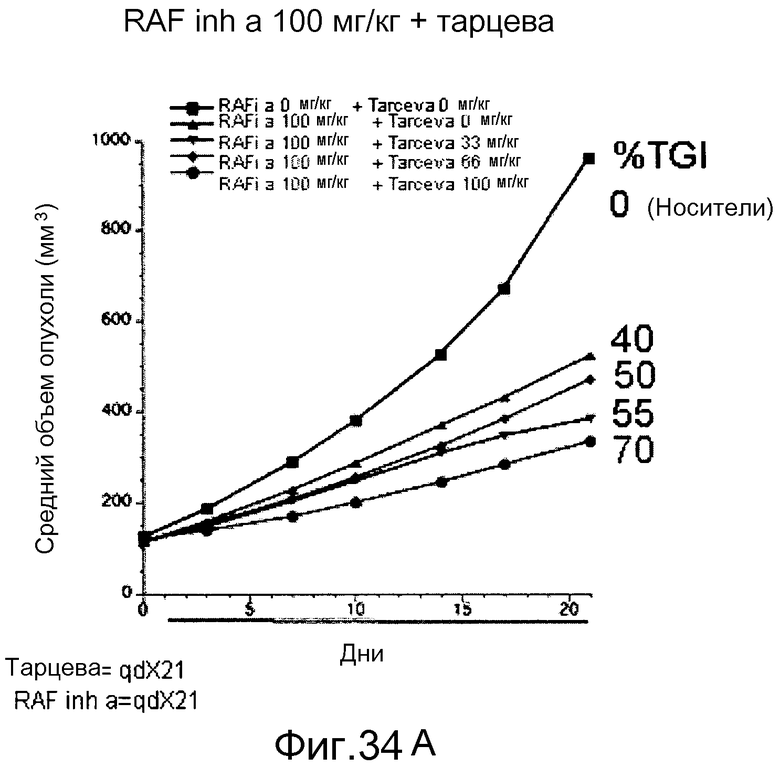
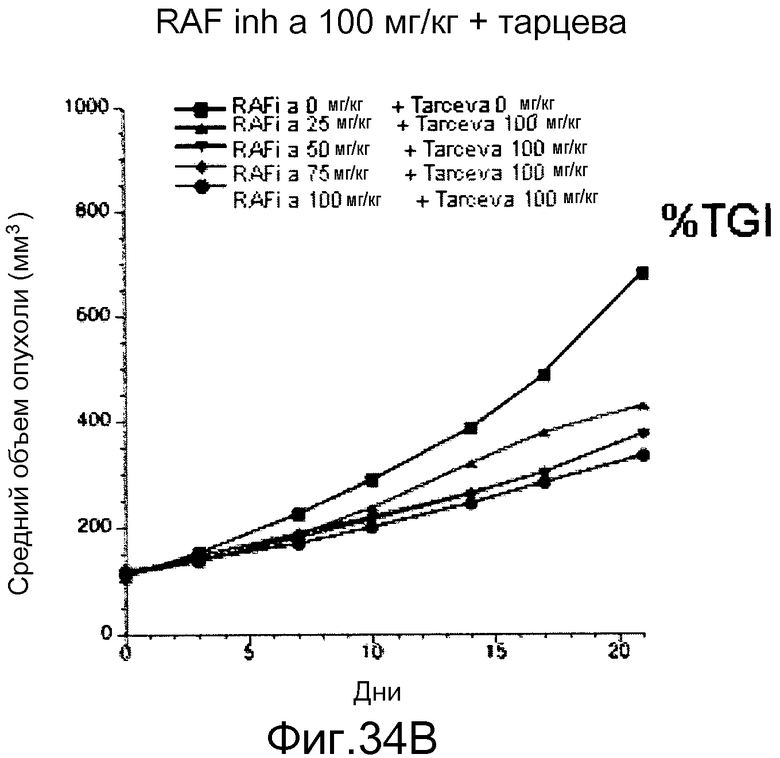
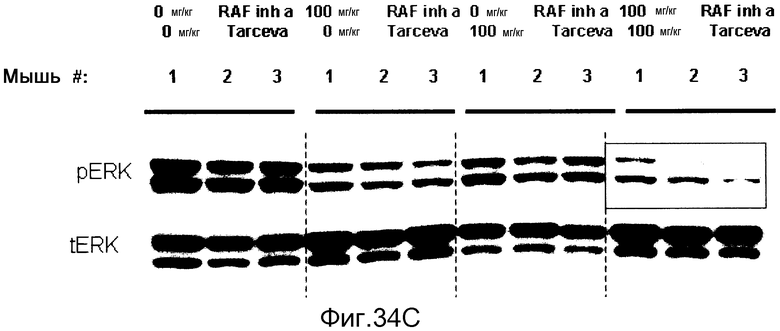
На фигурах 34А-С показаны результаты взаимодействия и эффективность ингибитора RAF а и эрлотиниба (тарцева), вводимых в комбинации мышам NCR nude (Taconic), несущим подкожные ксенотрансплантаты колоректальной карциномы человека НТ-29 BRAF V600E. На фигуре 34А RAF inh a получали в количестве 100 мг/кг с возрастающими дозами тарцева. На фигуре 34В все животные получали тарцева с возрастающими концентрациями RAF inh a. Повышенную эффективность наблюдали при введении обоих соединений в комбинации. На фигуре 34С лизаты опухолей, обработанных указанными дозами ингибиторов на фигурах 34А и В, анализировали с помощью вестерн-блота в отношении уровней фосфо-ERK (pERK). Ингибитор RAF а и тарцева у мышей при совместном введении действовали синергистично в отношении снижения в опухолях уровней фосфо-ERK.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном из вариантов осуществления объект изобретения, описанный в настоящем документе, относится к способу идентификации пациента, не отвечающего на лечение ингибитором B-Raf, включающему определение величины экспрессии или индукции RTK и/или их лигандов. К способам относится определение в образце уровней экспрессии или индукции некоторых RTK и/или их лигандов, причем сверхэкспрессия RTK и/или их лигандов коррелирует с отсутствием ответа на лечение ингибитором B-Raf. В одном из вариантов осуществления образец экспрессирует мутант B-Raf V600E. К примерам RTK, которые коррелируют с ответом на лечение B-Raf, относятся, но ими не ограничиваются, EGFR и cMet. К способам также относится определение в образце уровней экспрессии некоторых лигандов RTK, причем аномально высокие уровни экспрессии лигандов коррелируют с отсутствием ответа на лечение ингибитором B-Raf. К примерам лигандов, которые коррелируют с ответом на лечение B-Raf, относятся, но ими не ограничиваются, EGF и HGF.
В одном из вариантов осуществления объект изобретения, описанный в настоящем документе, относится к способу идентификации пациента, не отвечающего на лечение ингибитором B-Raf, включающему определение в образце количества Ras-GTP, причем повышенные количества указывают на то, что пациент не ответит на лечение указанным ингибитором B-Raf. В одном из примеров повышенные количества выше, чем количества, обнаруживаемые в нормальных не стимулированных образцах. Способы измерения уровней Ras-GTP в образце известны, например, используются анализы ELISA (например, анализы ELISA Ras-GTPазы, продукция фирмы Upstate, Inc.). В одном из примеров способ дополнительно включает введение указанному не отвечающему пациенту эффективного количества ингибитора МЕК или ERK. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR в сочетании с ингибитором B-Raf.
В одном из вариантов осуществления объект изобретения, описанный в настоящем документе, относится к способу идентификации пациента, не отвечающего на лечение ингибитором B-Raf, включающему определение в образце уровня экспрессии EGF или EGFR, причем сверхэкспрессируемые уровни либо EGF, либо EGFR указывают на то, что пациент не ответит на лечение указанным ингибитором B-Raf. В одном из примеров определяют количество мРНК EGF. Способы измерения уровней экспрессии EGF и EGFR в образце известны, например, используют иммуноанализы ELISA (например, иммуноанализы QUANTIKINE®, продукция фирмы R&D Systems, Inc.). В одном из примеров способ дополнительно включает введение указанному не отвечающему пациенту эффективного количества ингибитора МЕК или ERK. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR в сочетании с ингибитором B-Raf.
В одном из вариантов осуществления объект изобретения, описанный в настоящем документе, относится к способу идентификации пациента, не отвечающего на лечение ингибитором B-Raf, включающему определение в образце уровня экспрессии HGF или сМЕТ, причем сверхэкспрессируемые уровни либо HGF, либо сМЕТ указывают на то, что пациент не ответит на лечение указанным ингибитором B-Raf. В одном из примеров пациент экспрессирует B-Raf V600E. В одном из примеров определяют количество мРНК HGF. Способы измерения уровней экспрессии HGF и сМЕТ в образце известны, например, используются анализы количественной ПЦР RT-RealTime. В другом примере используют иммуноанализы ELISA (например, наборы для проведения ELISA cMET PhosphoDetect®, продукция фирмы EMD Chemicals, Inc или набор для проведения ELISA cMET Human, продукция фирмы Invitrogen, Inc.). В одном из примеров способ дополнительно включает введение указанному не отвечающему пациенту эффективного количества ингибитора сМЕТ или HGF. В другом примере способ дополнительно включает введение эффективного количества ингибитора сМЕТ или HGF в комбинации с ингибитором B-Raf.
В одном из вариантов осуществления объект изобретения, описанный в настоящем документе, относится к способу идентификации пациента, не отвечающего на лечение ингибитором B-Raf, включающему определение наличия или отсутствия мутации K-ras, причем наличие мутации K-ras указывает на то, что пациент не ответит на лечение указанным ингибитором B-Raf. В одном из примеров способ дополнительно включает введение указанному не отвечающему пациенту эффективного количества ингибитора МЕК или ERK. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR в комбинации с ингибитором B-Raf.
В некоторых вариантах осуществления объект изобретения, описанный в настоящем документе, относится к способу определения, ответит ли опухоль на лечение ингибитором B-Raf, включающему определение в образце указанной опухоли наличия мутантного белка или гена K-ras, причем наличие мутантного белка или гена K-ras указывает на то, что опухоль не ответит на лечение ингибитором B-Raf. В одном из примеров способ дополнительно включает введение в указанную не отвечающую опухоль эффективного количества ингибитора МЕК или ERK. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR в комбинации с ингибитором B-Raf.
В некоторых вариантах осуществления предлагается способ прогноза, ответит ли пациент на лечение ингибитором B-Raf. В некоторых вариантах осуществления способ включает определение наличия или отсутствия в опухоли пациента мутации K-ras, где мутация K-ras находится в кодоне 12 или кодоне 13. В некоторых вариантах осуществления при наличии мутации K-ras прогнозируют, что пациент не ответит на лечение ингибитором B-Raf.
В некоторых вариантах осуществления предлагается способ прогноза, ответит ли опухоль на лечение ингибитором B-Raf. В некоторых вариантах осуществления способ включает определение наличия или отсутствия в образце указанной опухоли мутации K-ras, где мутация K-ras находится в кодоне 12 или кодоне 13. В некоторых вариантах осуществления наличие мутации K-ras указывает на то, что опухоль не ответит на лечение ингибитором B-Raf.
В некоторых вариантах осуществления предлагается способ классификации индивидуума человека в протоколе лечения. Способ включает определение наличия в образце индивидуума мутантного гена K-ras или его белка, причем наличие мутантного гена или белка K-ras указывает на то, что индивидуум не ответит на лечение ингибитором B-Raf, и исключение у индивидуума лечения ингибитором B-Raf. К этому способу может относиться отнесение индивидуума к определенной подгруппе, например, в клиническом испытании. В другом варианте осуществления способ дополнительно включает введение указанному индивидууму, имеющему указанный мутантный ген или белок K-ras, эффективного количества ингибитора МЕК или ERK. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR в комбинации с ингибитором B-Raf.
В одном из вариантов осуществления предлагается способ классификации опухоли молочных желез, легких, толстого кишечника, яичников, щитовидной железы, меланомы или опухоли поджелудочной железы. Способ включает стадии: получения или доставки образца опухоли; определения в образце экспрессии или активности (i) гена, кодирующего мутанта B-Raf V600E, и (ii) гена, кодирующего мутанта k-Ras. Способ может дополнительно включать классификацию опухоли как относящейся к подклассу опухолей на основе результатов стадии определения; и подбора лечения, исходя из стадии классификации, где указанное лечение отличается от лечения специфическим ингибитором B-Raf V600E при сверхэкспрессии в указанном образце опухоли указанного мутанта эффективного количества ингибитора передачи сигнала через EGFR. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR в комбинации с ингибитором B-Raf.-RAS. В одном из примеров лечение включает введение в указанную не отвечающую опухоль эффективного количества ингибитора МЕК или ERK. В другом примере способ дополнительно включает введение
В другом варианте осуществления предлагается способ лечения колоректального рака или рака легких. Способ включает определение, вызывается ли рак K-ras или B-Raf, причем при лечении такого рака, который определяют, как вызванный K-ras, лечение не включает ингибитора B-Raf. В одном из примеров лечение включает введение в указанный вызванный K-ras рак эффективного количества ингибитора МЕК или ERK. Также предлагается набор, содержащий специфический материал для определения, вызывается ли рак K-ras или B-Raf, и инструкции для идентификации пациента или опухоли, которые не отвечают на лечение ингибитором B-Raf.
В некоторых вариантах осуществления определение наличия или отсутствия у индивидуума одной или нескольких мутаций K-ras включает определение в образце индивидуума наличия или количества экспрессии мутантного полипептида K-ras. В некоторых вариантах осуществления определение наличия или отсутствия у индивидуума одной или нескольких мутаций K-ras включает определение в образце индивидуума наличия или количества транскрипции или трансляции мутантного полипептида K-ras.
В некоторых вариантах осуществления определение наличия или отсутствия у индивидуума одной или нескольких мутаций K-ras включает определение наличия или количества экспрессии полипептида, содержащего по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из следующих SEQ ID NO, перечисленных в US2009/0075267: SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10, SEQ ID NO:12, SEQ ID NO:14 и SEQ ID NO:16. В некоторых вариантах осуществления определение наличия или отсутствия у индивидуума одной или нескольких мутаций K-ras включает определение в образце индивидуума наличия или количества транскрипции или трансляции полинуклеотида, кодирующего по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из следующих SEQ ID NO, перечисленных в US2009/0075267: SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10, SEQ ID NO:12, SEQ ID NO:14 и SEQ ID NO:16.
В некоторых вариантах осуществления предлагается определение наличия или отсутствия полинуклеотида, кодирующего мутантный полипептид K-ras. В некоторых вариантах осуществления способ определения наличия или отсутствия в образце полинуклеотида, кодирующего мутантный полипептид K-ras, включает (а) экспозицию образца с зондом, который гибридизуется с полинуклеотидом, кодирующим регион мутантного полипептида K-ras, где регион содержит по меньшей мере одну мутацию K-ras, выбранную из G12S, G12V, G12D, G12A, G12C, G13A и G13D, и (b) определение наличия или отсутствия в образце полинуклеотида, кодирующего мутантный полипептид K-ras. В некоторых вариантах осуществления способ определения наличия или отсутствия в образце мутантного полипептида K-ras включает (а) экспозицию образца с зондом, который гибридизуется с полинуклеотидом, кодирующим регион мутантного полипептида K-ras, где регион содержит по меньшей мере одну мутацию K-ras, выбранную из G12S, G12V, G12D, G12A, G12C, G13A и G13D, и (b) определение наличия или отсутствия в образце мутантного полипептида K-ras.
В некоторых вариантах осуществления предлагается определение наличия или отсутствия полинуклеотида, кодирующего мутантный полипептид B-Raf. В некоторых вариантах осуществления способ определения наличия или отсутствия в образце полинуклеотида, кодирующего мутантный полипептид B-Raf, включает (а) экспозицию образца с зондом, который гибридизуется с полинуклеотидом, кодирующим регион мутантного полипептида B-Raf, где регион содержит мутацию V600E, и (b) определение наличия или отсутствия в образце полинуклеотида, кодирующего мутантный полипептид B-Raf. В некоторых вариантах осуществления способ определения наличия или отсутствия в образце мутантного полипептида B-Raf включает (а) экспозицию образца с зондом, который гибридизуется с полинуклеотидом, кодирующим регион мутантного полипептида B-Raf, где регион содержит мутацию V600E, и (b) определение наличия или отсутствия в образце мутантного полипептида B-Raf.
В некоторых вариантах осуществления предлагается набор для определения у индивидуума полинуклеотида, кодирующего мутантный полипептид K-ras. В некоторых таких вариантах осуществления набор содержит зонд, который гибридизуется с полинуклеотидом, кодирующим регион мутантного полипептида K-ras, где регион содержит по меньшей мере одну мутацию K-ras, выбранную из G12S, G12V, G12D, G12A, G12C, G13A и G13D. В некоторых вариантах осуществления набор дополнительно содержит два или несколько праймеров для апмлификации. В некоторых вариантах осуществления набор дополнительно содержит компонент для детекции. В некоторых вариантах осуществления набор дополнительно содержит компонент для обработки нуклеиновых кислот. Набор необязательно может содержать материал для определения мутации B-Raf. Эти материалы известны в данной области. Комбинацию набора, способного детектировать мутантные гены или белки K-ras и B-Raf, можно использовать в частности при лечении рака толстого кишечника и легких. В набор включены инструкции для идентификации пациента или опухоли, которые не отвечают на ингибирование B-Raf, когда рак вызывается K-ras. Вызванный RAS рак известен в данной области. Вызванный Ras рак представляет собой любой рак или опухоль, в которой искаженная активность белка Ras приводит к продукции трансформированной клетки или формированию рака или опухоли.
В некоторых вариантах осуществления для таких образцов, опухолей, видов рака, индивидуумов или пациентов, определенных как не отвечающие на ингибитор B-Raf, способы дополнительно включают введение указанным не отвечающим образцам, опухолям, типам рака, индивидуумам или пациентам эффективного количества ингибитора МЕК.
В некоторых вариантах осуществления для таких образцов, опухолей, видов рака, индивидуумов или пациентов, определенных как не отвечающие на ингибитор B-Raf, способы дополнительно включают введение указанным не отвечающим образцам, опухолям, типам рака, индивидуумам или пациентам эффективного количества ингибитора ERK. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR. В другом примере способ дополнительно включает введение эффективного количества ингибитора передачи сигнала через EGFR в сочетании с ингибитором B-Raf.
Передачу сигнала через EGFR можно ингибировать большим числом способов, к которым относятся ингибирование киназной активности EGFR, связывание с внеклеточным доменом EGFR для ингибирования активации или путем ингибирования активности и передачи сигнала с лиганда EGF.
В данной области известны ингибиторы передачи сигнала через EGFR, и к ним относятся, например, эрлотиниб (ТАРЦЕВА®), гефитиниб (ИРЕССА®), лапатиниб, пелитиниб, цетуксимаб, панитумумаб, залутумумаб, нимотузумаб и матузумаб и лекарственные средства, описанные в патенте США № 5747498.
В данной области известны ингибиторы B-Raf, и к ним относятся, например, сорафениб, PLX4720, PLX-3603, GSK2118436, GDC-0879, N-(3-(5-(4-хлорфенил)-1H-пирроло[2,3-b]пиридин-3-карбонил)-2,4-дифторфенил)пропан-1-сульфонамид и лекарственные средства, описанные в WO2007/002325, WO2007/002433, WO2009111278, WO2009111279, WO2009111277, WO2009111280 и патенте США № 7491829.
В данной области известны ингибиторы сМЕТ, и к ним относятся, но ими не ограничиваются, AMG208, ARQ197, ARQ209, PHA665752 (3Z)-5-[(2,6-дихлорбензил)сульфонил]-3-[(3,5-диметил-4-{[(2R)-2-(пирролидин-1-илметил)пирролидин-1-ил]карбонил}-1H-пиррол-2-ил)метилен]-1,3-дигидро-2Н-индол-2-он, N-(4-(3-((3S,4R)-1-этил-3-фторпиперидин-4-иламино)-1H-пиразоло[3,4-b]пиридин-4-илокси)-3-фторфенил)-2-(4-фторфенил)-3-оксо-2,3-дигидропиридазин-4-карбоксамид и SU11274 и лекарственные средства, описанные в патенте США № 7723330.
В данной области известны ингибиторы МЕК, и к ним относятся, но ими не ограничиваются, ARRY-162, AZD8330, AZD6244, U0126, GDC-0973, PD184161 и PD98059 и описанные в WO2003047582, WO2003047583, WO2003047585, WO2003053960, WO2007071951, WO2003077855, WO2003077914, WO2005023251, WO200501300, WO2005051302, WO2007022529, WO2006061712, WO2005028426, WO2006018188, WO20070197617, WO2008101840, WO2009021887, WO2009153554, WO20090275606, WO2009129938, WO2009093008, WO2009018233, WO2009013462, WO2008125820, WO2008124085, WO2007044515, WO2008021389, WO2008076415 и WO2008124085.
В данной области известны ингибиторы ERK, и к ним относятся, но ими не ограничиваются, FR180204 и 3-(2-аминоэтил)-5-((4-этоксифенил)метилен)-2,4-тиазолидиндион и лекарственные средства, описанные в WO2006071644, WO2007070398, WO2007097937, WO2008153858, WO2008153858, WO2009105500 и WO2010000978.
Для способа, описанного в настоящем документе, подходит любой известный способ детекции мутантного гена или белка K-ras. Конкретные мутации, определенные в экзоне 1, представляют собой: G12C; G12A; G12D; G12R; G12S; G12V; G13C; G13D. Способы определения наличия мутаций K-ras также аналогичны способам, использованным для идентификации мутаций K-ras и EGFR, например, олигонуклеотиды K-ras для проведения ПЦР, перечисленные как SEQ ID NO:55, 56, 57 и 58, описанные в опубликованной патентной заявке США № US2009/0202989A1, приведенной в настоящем документе в качестве ссылки в полном объеме. Как пример, другие способы детекции мутантного гена или белка K-ras и праймеры, олигонуклеотиды и SEQ ID NO описаны в опубликованных патентных заявках США № US2009/0202989A1, US2009/0075267А1, US20090143320, US20040063120 и US2007/0003936. Техники и процедуры обычно осуществляют согласно принятым способам, хорошо известным в данной области и описанным в большом числе общих и более конкретных ссылок, которые процитированы и обсуждаются на протяжении настоящего описания. См., например, руководство Sambrook et al. Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)), которое приводится в настоящем документе в качестве ссылки.
В данной области известны некоторые способы детекции мутации в полинуклеотиде. К некоторым типичным способам относятся, но ими не ограничиваются, секвенирование, реакции удлинения праймеров, электрофорез, анализы picogreen, анализы лигирования олигонуклеотидов, гибридизационные анализы, анализы TaqMan, анализы SNPlex и анализы, описанные, например, в патентах США №№ 5470705, 5514543, 5580732, 5624800, 5807682, 6759202, 6756204, 6734296, 6395486 и патентной публикации США № US 2003-0190646 A1.
В некоторых вариантах осуществления детекция мутации в полинуклеотиде включает сначала амплификацию полинуклеотида, который может содержать мутацию. В данной области известны некоторые способы амплификации полинуклеотида. Такие продукты амплификации могут быть использованы для детекции мутации в полинуклеотиде любым из способов, описанных в настоящем документе или известных в данной области.
Некоторые способы детекции мутации в полинуклеотиде известны в данной области. К некоторым таким типичным способам относятся, но ими не ограничиваются, детекция, используя агент для специфического связывания с мутантным полипептидом. К другим способам детекции мутантного полипептида относятся, но ими не ограничиваются, электрофорез и секвенирование пептида.
Некоторые типичные способы детекции мутации в полинуклеотиде и/или полипептиде описаны, например, в статьях Schimanski et al. (1999) Cancer Res., 59: 5169-5175; Nagasaka et al. (2004) J. Clin. Oncol., 22: 4584-4596; публикации РСТ № WO 2007/001868 A1; патентной публикации США № 2005/0272083 А1; и статье Lievre et al. (2006) Cancer Res. 66: 3992-3994.
В некоторых вариантах осуществления предлагаются микрочипы, содержащие один или несколько полинуклеотидов, кодирующих один или несколько мутантных полипептидов K-ras. В некоторых вариантах осуществления предлагаются микрочипы, содержащие один или несколько полинуклеотидов, комплементарных одному или нескольким полинуклеотидам, кодирующим один или несколько мутантных полипептидов K-ras. В некоторых вариантах осуществления предлагаются микрочипы, содержащие один или несколько полинуклеотидов, кодирующих один или несколько мутантных полипептидов B-Raf. В некоторых вариантах осуществления предлагаются микрочипы, содержащие один или несколько полинуклеотидов, комплементарных одному или нескольким полинуклеотидам, кодирующим один или несколько мутантных полипептидов B-Raf.
В некоторых вариантах осуществления, используя технологию микрочипов, в двух или более образцах клеток или тканей определяют наличие или отсутствие одного или нескольких мутантных полинуклеотидов K-ras. В некоторых вариантах осуществления, используя технологию микрочипов, в двух или более образцах клеток или тканей определяют количество одного или нескольких мутантных полинуклеотидов K-ras.
В некоторых вариантах осуществления, используя технологию микрочипов, в двух или более образцах клеток или тканей оценивают наличие или отсутствие одного или нескольких мутантных полинуклеотидов B-Raf. В некоторых вариантах осуществления, используя технологию микрочипов, в двух или более образцах клеток или тканей определяют количество одного или нескольких мутантных полинуклеотидов B-Raf.
В некоторых вариантах осуществления, используя технологию микрочипов, в двух или более образцах клеток или тканей определяют наличие или отсутствие одного или нескольких мутантных полипептидов K-ras. В некоторых таких вариантах осуществления сначала из образца клетки или ткани экстрагируют мРНК и после этого преобразуют в кДНК, которую гибридизуют с микрочипом. В некоторых таких вариантах осуществления наличие или отсутствие кДНК, которая специфически связывается с микрочипом, указывает на наличие или отсутствие мутантного полипептида K-ras. В некоторых таких вариантах осуществления уровень экспрессии одного или нескольких мутантных полипептидов K-ras оценивают, рассчитывая количество кДНК, которое специфически связывается с микрочипом.
В некоторых вариантах осуществления, используя технологию микрочипов, в двух или более образцах клеток или тканей определяют наличие или отсутствие одного или нескольких мутантных полипептидов B-Raf. В некоторых таких вариантах осуществления сначала из образца клетки или ткани экстрагируют мРНК и после этого преобразуют в кДНК, которую гибридизуют с микрочипом. В некоторых таких вариантах осуществления наличие или отсутствие кДНК, которая специфически связывается с микрочипом, указывает на наличие или отсутствие мутантного полипептида B-Raf. В некоторых таких вариантах осуществления уровень экспрессии одного или нескольких мутантных полипептидов B-Raf оценивают, рассчитывая количество кДНК, которое специфически связывается с микрочипом.
В некоторых вариантах осуществления предлагаются микрочипы, содержащие один или несколько агентов, специфически связывающихся с одним или несколькими мутантными полипептидами K-ras. В некоторых таких вариантах осуществления определяют наличие или отсутствие в клетке или ткани одного или нескольких мутантных полипептидов K-ras. В некоторых таких вариантах осуществления оценивают количество в клетке или ткани одного или нескольких мутантных полинуклеотидов K-ras.
В некоторых вариантах осуществления предлагаются микрочипы, содержащие один или несколько агентов, специфически связывающихся с одним или несколькими мутантными полипептидами B-Raf. В некоторых таких вариантах осуществления оценивают наличие или отсутствие в клетке или ткани одного или нескольких мутантных полипептидов B-Raf. В некоторых таких вариантах осуществления оценивают количество в клетке или ткани одного или нескольких мутантных полинуклеотидов B-Raf.
Все ссылки, процитированные в настоящем документе, к которым относятся патенты, патентные заявки, публикации, руководства и подобное, и ссылки, процитированные в них, в тех случаях, когда они ранее не представлены, настоящим приводятся в данный документ в качестве ссылки в полном объеме. В случае, если один или несколько из документов, приведенных в качестве ссылки, определяют термин в противоречии с определением этого термина по настоящей заявке, данная заявка является контрольной. Заглавия разделов, использованные в настоящем документе, предназначены лишь для организационных целей и не должны быть истолкованы как ограничивающие описанный объект изобретения.
Определения
Если не указано другого, научные и технические термины, использованные в связи с настоящим изобретением, будут иметь значения, которые обычно понимаются специалистами в данной области. Кроме того, если контекстом не требуется другого, термины в единственном числе будут включать множественное, и термины во множественном числе будут включать единственное.
Термин «ингибитор B-Raf» относится к любому соединению или агенту, который ингибирует, снижает активность киназы B-Raf. Такой ингибитор также может ингибировать другие киназы, к которым относятся другие киназы raf. «Специфический ингибитор киназы B-Raf» относится к ингибитору, который обладает избирательностью по отношению к мутанту B-Raf, такому, который имеет мутацию в валиновом остатке по аминокислотной позиции 600, например, мутацию V600E, по сравнению с B-Raf дикого типа. Такой ингибитор по меньшей мере в два раза, чаще по меньшей мере в три или более раз эффективнее ингибитора B-Raf дикого типа. Эффективность также может быть сопоставлена в величинах IC50 для клеточных анализов, в которых измеряется ингибирование роста.
Термин «протокол лечения» относится к схеме лечения или курсу введения одного или нескольких агентов для лечения расстройства или заболевания. К этому относятся клинические испытания.
Терминология “X#Y” в контексте мутации в полипептидной последовательности принята в данной области, где “#” указывает расположение мутации с учетом порядкового номера аминокислоты полипептида, «Х» указывает аминокислоту, обнаруженную в этой позиции в аминокислотной последовательности дикого типа, и «Y» указывает мутантную аминокислоту в этой позиции. Например, выражение «G12S» со ссылкой на полипептид K-ras указывает на то, что аминокислотой под номером 12 последовательности K-ras дикого типа является глицин и что в мутантной последовательности K-ras глицин замещается на серин.
Термины «мутантный полипептид K-ras» и «мутантный белок K-ras» используются взаимозаменяемо и относятся к полипептиду K-ras, содержащему по меньшей мере одну мутацию K-ras, выбранную из G12S, G12V, G12D, G12A, G12C, G13A и G13D. К некоторым типичным мутантным полипептидам K-ras относятся, но ими не ограничиваются, аллельные варианты, сплайсированные варианты, производные варианты, варианты с заменами, варианты с делециями и/или варианты со вставками, слитые полипептиды, ортологи и межвидовые гомологи. В некоторых вариантах осуществления мутантный полипептид K-ras включает дополнительные остатки на С- или N-конце, такие как, но ими не ограничиваясь, остатки лидерной последовательности, нацеливающие остатки, аминоконцевые остатки метионина, лизиновые остатки, меченые остатки и/или остатки слитого белка.
Термины «мутантный полипептид B-Raf» и «мутантный белок B-Raf» используются взаимозаменяемо и относятся к полипептиду B-Raf, содержащему мутацию V600E. К некоторым типичным мутантным полипептидам B-Raf относятся, но ими не ограничиваются, аллельные варианты, сплайсированные варианты, производные варианты, варианты с заменами, варианты с делециями и/или варианты со вставками, слитые полипептиды, ортологи и межвидовые гомологи. В некоторых вариантах осуществления мутантный полипептид B-Raf включает дополнительные остатки на С- или N-конце, такие как, но ими не ограничиваясь, остатки лидерной последовательности, нацеливающие остатки, аминоконцевые остатки метионина, лизиновые остатки, меченые остатки и/или остатки слитого белка.
Термины «мутантный полинуклеотид K-ras», «мутантный олигонуклеотид K-ras» и «мутантная нуклеиновая кислота K-ras» используются взаимозаменяемо и относятся к полинуклеотиду, кодирующему полипептид K-ras, содержащий по меньшей мере одну мутацию K-ras, выбранную из G12S, G12V, G12D, G12A, G12C, G13A и G13D.
Термины «мутантный полинуклеотид B-Raf», «мутантный олигонуклеотид B-Raf» и «мутантная нуклеиновая кислота B-Raf» используются взаимозаменяемо и относятся к полинуклеотиду, кодирующему полипептид B-Raf, содержащий мутацию V600E.
Термин «агент» используется в настоящем документе для обозначения химического соединения, смеси химических соединений, биологической макромолекулы или экстракта, полученного из биологических материалов.
Термин «фармацевтический агент или лекарственное средство», используемый в настоящем документе, относится к химическому соединению или композиции, способной при введении пациенту должным образом индуцировать желаемый терапевтический эффект. Другие химические термины в настоящем документе используются согласно принятому в данной области применению, например, предложенному словарем химических терминов McGraw-Hill (Parker, S., Ed., McGraw-Hill, San Francisco (1985)), приведенным в настоящем документе в качестве ссылки.
К термину пациент относятся индивидуумы люди и животные.
Термины «млекопитающее» и «животное» для целей лечения относятся к любому животному, классифицированному как млекопитающее, к которому относятся домашние и сельскохозяйственные животные и животные зоопарков, спортивные животные или животные-любимцы, такие как собаки, лошади, кошки, коровы и т.д. Предпочтительно млекопитающее представляет собой человека.
Термин «болезненное состояние» относится к физиологическому состоянию клетки или всего млекопитающего, при котором произошли задержка, прекращение или расстройство функций клетки или организма, систем или органов.
Термин «лечение» относится и к терапевтическому лечению и к профилактическим или упреждающим мерам, когда у объекта предупреждают или замедляют (уменьшают) нежелательное физиологическое изменение или расстройство, такое как развитие или распространение рака. Для целей настоящего изобретения к благоприятным или желательным клиническим результатам относятся, но ими не ограничиваются, облегчение симптомов, уменьшение распространенности заболевания, стабилизация (т.е. без ухудшения) состояния, задержка или замедление прогрессирования заболевания, смягчение или временное облегчение болезненного состояния и ремиссия (частичная или полная), детектируемые или недектируемые. «Лечение» также может означать продление жизни по сравнению с ожидаемым сроком жизни без получения лечения. К тем, кто нуждается в лечении, относятся индивидуумы, уже имеющие состояние или расстройство, а также склонные приобрести состояние или расстройство или те, у кого состояние или расстройство должно быть предупреждено.
Под термином «отвечающий», используемым в настоящем документе, понимают, что у пациента или опухоли после введения агента наблюдается полный ответ или частичный ответ согласно критериям RECIST (критериям оценки ответа при солидных опухолях). Под термином «не отвечающий», используемым в настоящем документе, понимают, что у пациента или опухоли после введения агента наблюдается стабильное заболевание или прогрессирующее заболевание согласно RECIST. Критерии RECIST описаны, например, в руководстве Therasse et al., February 2000, “New Guidelines to Evaluate the Response to Treatment in Solid Tumors,” J. Natl. Cancer Inst. 92(3): 205-216, которое приводится в настоящем документе в качестве ссылки в полном объеме.
«Расстройством» является любое состояние, на которое оказали бы положительное влияние один или несколько способов лечения. К нему относятся хронические и острые расстройства или заболевание, к которому относятся такие патологические состояния, которые провоцируют у млекопитающего рассматриваемое расстройство. К неограничиваемым примерам расстройств, подвергаемых лечению в настоящем документе, относятся доброкачественные и злокачественные опухоли, лейкозы и злокачественные новообразования лимфоидной ткани. «Опухоль» содержит одну или несколько раковых клеток. К примерам рака относятся, но ими не ограничиваются, карцинома, лимфома, бластома, саркома и лейкоз или злокачественные новообразования лимфоидной ткани. К более конкретным примерам таких типов рака относятся плоскоклеточный рак (например, рак сквамозного эпителия), рак легких, к которому относятся мелкоклеточный рак легких, немелкоклеточный рак легких (“NSCLC”), аденокарцинома легкого и сквамозная карцинома легкого, рак брюшины, гепатоцеллюлярный рак, рак желудка, к которому относится гастроинтестинальный рак, рак поджелудочной железы, глиобластома, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатома, рак молочных желез, рак толстого кишечника, рак прямой кишки, колоректальный рак, карцинома эндометрия или матки, карцинома слюнных желез, рак почки, рак простаты, рак вульвы, рак щитовидной железы, карцинома печени, анальная карцинома, пенильная карцинома, а также рак головы и шеи. В частности, настоящий способ подходит для лечения рака молочных желез, колоректального рака, рака яичников, поджелудочной железы или легких. Конкретнее, рак представляет собой рак толстого кишечника, легких или яичников. Рак может представлять собой рак, вызванный Ras.
К заболеванию или состоянию, связанному с мутантным K-ras, относятся одно или несколько из следующих заболеваний: заболевание или состояние, обусловленное мутантным геном или белком K-ras; заболевание или состояние, развитию которого способствовал мутантный ген или белок K-ras; и заболевание или состояние, которое ассоциируется с наличием мутантного гена или белка K-ras. В некоторых вариантах осуществления заболевание или состояние, связанное с мутантным K-ras, представляет собой рак.
К «заболеванию или состоянию, связанному с мутантным полипептидом K-ras», относятся одно или несколько из следующего списка: заболевание или состояние, обусловленное мутантным полипептидом K-ras; заболевание или состояние, развитию которого способствовал мутантный полипептид K-ras; заболевание или состояние, которое вызывает мутантный полипептид K-ras; и заболевание или состояние, которое ассоциируется с наличием мутантного полипептида K-ras. В некоторых вариантах осуществления заболевание или состояние, связанное с мутантным полипептидом K-ras, может существовать в отсутствие мутантного полипептида K-ras. В некоторых вариантах осуществления заболевание или состояние, связанное с мутантным полипептидом K-ras, может усугубляться наличием мутантного полипептида K-ras. В некоторых вариантах осуществления заболевание или состояние, связанное с мутантным полипептидом K-ras, представляет собой рак.
Последующие примеры, включающие проведенные эксперименты и полученные результаты, предлагаются лишь с целью иллюстрации и не должны быть истолкованы как ограничивающие формулу изобретения.
ПРИМЕРЫ
Пример 1
Делеция и фармакологическое ингибирование B-RAF усиливает онкогенез, вызванный K-ras
Семейство GTPаз Ras контролирует большое число последующих сигнальных каскадов под влиянием сигналов, регулирующих клеточные процессы, к которым относятся пролиферация и выживаемость. Хотя Ras представляет собой одну из преобладающих мишеней для мутаций типа gain-of-function в опухолях человека, непонятно, как функционирует эффекторный путь Ras при онкогенезе, вызванном мутантным K-ras. Поскольку к важной функции K-ras относится активация B-Raf по каноническому сигнальному пути МАРК, авторы предложили исследование по определению роли B-Raf в стимуляции и поддержании опухоли, вызванной мутантным K-ras. В некоторых опухолях с мутантным K-ras ингибирование B-Raf не только не привело к какому-нибудь благоприятному влиянию на опухоль, оно даже усилило рост опухоли. См. фиг. 8А, на которой показано время удвоения опухоли.
В легкие мышей, созданных методами генной инженерии, имеющих условный аллель K-ras G12D (K-ras LSL-G12D) и либо 0, 1, либо обе копии гена B-raf, фланкированного сайтами LoxP (B-raf CKO), доставляли аденовирус, экспрессирующий рекомбиназу Cre. Эта процедура приводит к экспрессии мутантного K-rasG12D при наличии или в отсутствие в легком мыши одного или обоих удаленных аллелей B-raf. Неожиданно оказалось, что делеция B-raf существенно повышает количество опухолей в легких и тяжесть заболевания и снижает общую выживаемость. При использовании высокоспецифичного низкомолекулярного ингибитора, который нацеливает B-Raf, на линии немелкоклеточной карциномы легких мышей, несущей мутацию K-rasG12D, авторы обнаружили повышение клеточной пролиферации и образование колоний на мягком агаре. Дальнейшее изучение выявило, что обработка клеток, экспрессирующих K-rasG12D, с помощью ингибитора B-Raf усилила фосфорилирование МЕК и Erk. Таким образом, эти данные указывают на то, делеция B-Raf не только не ингибирует инициацию опухоли, вызванной K-ras, и прогрессирование заболевания, но ее наличие может иметь ключевое значение в установлении отрицательной обратной связи для постоянной активности мутантного K-ras.
Пример 2
Понимание передачи сигнала через RAF в мутанте B-RAFV600E по сравнению с опухолями дикого типа
Для понимания значения пути Raf с различными мутациями в генах Ras и Raf авторы охарактеризовали два селективных низкомолекулярных ингибитора Raf с четкими профилями эффективности против B-Raf и c-Raf дикого типа (WT) в отношении мутанта (MT) B-RafV600E. Несмотря на их биохимические различия, они обладали идентичными клеточными профилями, действуя против опухолей B-RAFV600E, но не WT или МТ Ras. Оба ингибитора индуцировали активацию пути Raf/MEK/ERK в линиях, отличных от BRAFV600E, в основном через изоформу с-Raf. Напротив, согласно своим предсказанным биохимическим эффектам они ингибировали активность Raf/MEK/ERK, стимулированную форболовым эфиром и фактором роста. Таким образом, клеточная специфичность селективных ингибиторов Raf в отношении линий B-RAFV600E не является простым отражением их селективности в отношении изоформы B-RAFV600E, но скорее отражает сложную регуляцию активности Raf в различных условиях в клетке.
Биохимическая избирательность в отношении B-RafV600E - не единственный стимул для профилей эффективности в клетке ингибиторов Raf. Ингибиторы индуцируют уровни рМЕК избирательно в отличных от мутанта V600E линиях через с-Raf. Ингибиторы индуцируют специфическую активность с-Raf и уровни рМЕК быстро и дозозависимым образом согласно своей эффективности. При обычных условиях колоколообразная кривая для GDC-0879 указывает на двойное стимулирующее против ингибиторного влияния на с-Raf. Статус путей В- и с-Raf в различных ситуациях определяет фармакодинамику ингибирования Raf. Результаты характеристики показаны на фиг. 1-7.
Пример 3
Рост в ксенотрансплантатах опухолей легких после введения дозы ингибитора B-RAF
Данные представлены ниже и на фиг. 10-14 для эксперимента Н331 и фиг. 15-18 для эксперимента Н327.







| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНАЦИИ ИНГИБИТОРА PI3K И ИНГИБИТОРА МЕК | 2010 |
|
RU2563193C2 |
| МУТАЦИИ BRAF, ОБЕСПЕЧИВАЮЩИЕ РЕЗИСТЕНТНОСТЬ К ИНГИБИТОРАМ BRAF | 2011 |
|
RU2571930C2 |
| КОМПОЗИЦИИ НА ОСНОВЕ ИНГИБИТОРА SHP2 И СПОСОБЫ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2805355C2 |
| ТЕРАПЕВТИЧЕСКИЕ КОМБИНАЦИИ, СОДЕРЖАЩИЕ ИНГИБИТОР RAF И ИНГИБИТОР ERK | 2017 |
|
RU2774612C2 |
| НОВЫЕ МАЛЫЕ МОЛЕКУЛЫ ДЛЯ ЦЕЛЕНАПРАВЛЕННОГО РАСЩЕПЛЕНИЯ НЕ ПОДДАЮЩЕГОСЯ ЦЕЛЕНАПРАВЛЕННОМУ ВОЗДЕЙСТВИЮ KRAS В ТЕРАПИИ РАКА | 2021 |
|
RU2839932C1 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ | 2018 |
|
RU2815400C2 |
| АГЕНТ, ИНДУЦИРУЮЩИЙ КЛЕТОЧНУЮ ГИБЕЛЬ, ДЛЯ КЛЕТОК, ИМЕЮЩИХ МУТАЦИИ ГЕНА BRAF, АГЕНТ, ПОДАВЛЯЮЩИЙ РОСТ ТАКИХ КЛЕТОК, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ТЕРАПИИ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ ДЕФЕКТОМ РОСТА ТАКИХ КЛЕТОК | 2016 |
|
RU2760835C2 |
| Фармацевтические комбинации | 2017 |
|
RU2759669C2 |
| ТЕРАПЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ СНИЖЕНИЯ УСТОЙЧИВОСТИ К ИНГИБИТОРАМ ТИРОЗИНКИНАЗЫ | 2016 |
|
RU2735493C2 |
| Полипептиды для лечения онкологических заболеваний | 2017 |
|
RU2728870C2 |



Изобретение относится к области медицины. Предложен способ, включающий определение наличия или отсутствия мутации K-rasG12D. Наличие мутации K-rasG12D указывает на то, что пациент не ответит на лечение ингибитором В-Raf. Изобретение обеспечивает эффективный способ идентификации пациента, не отвечающего на лечение ингибитором B-Raf. 5 з.п. ф-лы, 34 ил., 12 табл., 3 пр.
1. Способ идентификации пациента, не отвечающего на лечение ингибитором B-Raf, включающий определение наличия или отсутствия мутации K-rasG12D, причем наличие мутации K-rasG12D указывает на то, что пациент не ответит на лечение указанным ингибитором В-Raf.
2. Способ по п.1, где указанный ингибитор B-Raf представляет собой специфический ингибитор B-Raf-киназы.
3. Способ по п.2, где указанным ингибитором B-Raf-киназы является GDC-0879.
4. Способ по п.1, где наличие мутации K-ras определяют путем амплификации нуклеиновой кислоты K-ras из указанной опухоли или ее фрагмента, предположительно содержащего мутацию, и секвенирования указанной амплифицированной нуклеиновой кислоты.
5. Способ по п.1, где наличие мутации K-ras определяют путем амплификации нуклеиновой кислоты K-ras из указанной опухоли или ее фрагмента, предположительно содержащего мутацию, и сравнения электрофоретической подвижности амплифицированной нуклеиновой кислоты с электрофоретической подвижностью соответствующей нуклеиновой кислоты или фрагмента K-ras дикого типа.
6. Способ по п.1, где определение наличия или отсутствия мутации K-ras в опухоли содержит определение в образце опухоли мутантного полипептида K-ras.
| Колосоуборка | 1923 |
|
SU2009A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| ТЮРЯЕВА И.И | |||
| Опухолевые антигены | |||
| Цитология | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
Авторы
Даты
2015-06-10—Публикация
2010-08-24—Подача