ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области составов терапевтических антител. Более конкретно, настоящее изобретение относится к области фармацевтических составов, содержащих антитело человека, специфически связывающееся с рецептором интерлейкина 6 человека.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Одновременно с настоящим описанием подан текстовой файл со списком последовательностей соответствующий стандарту WIPO ST.25 (1998). Содержание текстового файла включено в настоящий документ в качестве ссылки. Содержащий список последовательностей текстовой файл, называемый "IL6RAbFormulationSeqList", создан 7 января 2010 года и содержит 37387 байт.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Терапевтические макромолекулы (например, антитела) необходимо формулировать таким способом, который не только делает молекулы подходящими для введения пациенту, но также поддерживает их стабильность при хранении. Например, если раствор сформулирован не надлежащим образом, терапевтические антитела в жидком растворе подвержены разрушению, агрегации и/или нежелательным химическим модификациям. Стабильность антитела в жидком составе зависит не только от характера эксципиентов, используемых в составе, но также от количества и отношения эксципиентов друг относительно друга. Кроме того, помимо стабильности, при получении жидкого состава антитела в расчет необходимо принимать другие факторы. Примеры таких дополнительных факторов включают вязкость раствора и концентрацию антитела, которую можно обеспечить при данном составе. Таким образом, при формулировании терапевтического антитела, для получения состава, который остается стабильным, содержит достаточную концентрацию антитела и обладает подходящей вязкостью, а также другими свойствами, обеспечивающими удобное введение состава пациентам, необходимо прилагать большие усилия.
Антитела к рецептору интерлейкина 6 человека (hIL-6R) представляют собой один из примеров терапевтически значимой макромолекулы, которой необходим подходящий состав. Антитела к hIL-6R клинически пригодны для лечения и/или предотвращения таких заболеваний, как ревматоидный артрит, анкилозирующий спондилит и другие состояния. Иллюстративные антитела к IL-6R в числе других описаны в US 7582298; 6410691; 5817790; 5795695 и 6670373. Особенно важным антителом к hIL-6R с большим терапевтическим потенциалом является антитело, обозначенное в US 7582298 как VQ8F11-21 (также обозначаемое в настоящем документе как "mAb1").
Хотя антитела к hIL-6R известны, в данной области остается необходимость в новых фармацевтических составах, содержащих антитела к hIL-6R, которые в достаточной степени стабильны, а также подходят для введения пациентам.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение удовлетворяет указанную выше необходимость, предоставляя фармацевтические составы, содержащие антитело человека, специфически связывающееся с рецептором интерлейкина 6 человека (hIL-6R). Составы по изобретению в дополнение к антителу к hIL-6R могут содержать эксципиенты. Например, в определенных вариантах осуществления состав может содержать (i) антитело человека, специфически связывающееся с hIL-6R; (ii) по меньшей мере одну аминокислоту; и (iii) по меньшей мере один углевод. Аминокислота может представлять собой, например, гистидин и/или аргинин. Углевод может представлять собой сахар, такой как, например, сахароза, глюкоза, маннит, лактоза или трегалоза.
По определенным вариантам осуществления настоящего изобретения состав дополнительно содержит неионное поверхностно-активное вещество. Неионное поверхностно-активное вещество может представлять собой, например, полисорбат 20, полисорбат 80, полиоксиэтиленсорбитанмоноолеат, полиэтиленгликоль и т.д.
Антитело, содержащееся в фармацевтических составах по настоящему изобретению, может представлять собой любое антитело, специфически связывающееся с hIL-6R. Иллюстративные антитела, которые могут содержаться в составах по изобретению, представляют собой антитела, содержащие вариабельную область тяжелой цепи (HCVR) и вариабельную область легкой цепи (LCVR), где HCVR содержит определяющую комплементарность область тяжелой цепи (HCDR) 1 с аминокислотной последовательностью SEQ ID NO:20, HCDR2 с аминокислотной последовательностью SEQ ID NO:22 и HCDR3 с аминокислотной последовательностью SEQ ID NO:24; и где LCVR содержит определяющую комплементарность область легкой цепи (LCDR) 1 с аминокислотной последовательностью SEQ ID NO:28, LCDR2 с аминокислотной последовательностью SEQ ID NO:30 и LCDR3 с аминокислотной последовательностью SEQ ID NO:32. В определенных вариантах осуществления антитела, содержащиеся в составах по настоящему изобретению, представляют собой антитела, содержащие HCVR с аминокислотной последовательностью SEQ ID NO:18 и LCVR с аминокислотной последовательностью SEQ ID NO:26.
Составы антител по настоящему изобретению могут содержаться в любом подходящем контейнере, пригодном для хранения фармацевтических составов. Примеры таких подходящих контейнеров включают, например, стеклянные или пластиковые флаконы, шприцы и картриджи. Контейнер может быть прозрачным или светонепроницаемым (например, желтого цвета).
По определенным аспектам настоящего изобретения фармацевтические составы остаются относительно стабильными после хранения в течение нескольких суток, месяцев или лет при определенной температуре. Например, в определенных иллюстративных вариантах осуществления настоящего изобретения сохраняется высокое процентное содержание антитела (например, 90%, 95%, 96% или более) в его нативной форме после хранения по меньшей мере в течение 3, 6, 9 или более месяцев. Процентное содержание нативной формы антитела можно измерять, например, посредством ЭВЭЖХ или любым другим известным в данной области способом. Температура хранения, при которой поддерживается стабильность антитела, может составлять, например, -80°C, -40°C, -20°C, 0°C, 5°C, 25°C, 45°C или более.
Другие варианты осуществления настоящего изобретения станут очевидными при рассмотрении следующего далее подробного описания.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фиг.1 представлено процентное содержание нативного mAb1, остающееся после различных периодов времени хранения при -20°C (закрашенные треугольники), -30°C (закрашенные квадраты) и -80°C (закрашенные ромбы) по измерениям посредством ЭВЭЖХ.
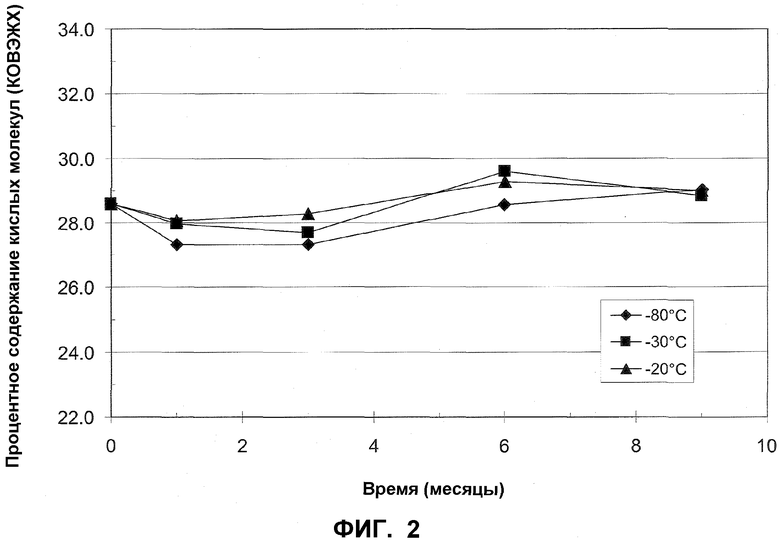
На фиг.2 представлено процентное содержание кислых молекул mAb1, после различных периодов времени хранения при -20°C (закрашенные треугольники), -30°C (закрашенные квадраты) и -80°C (закрашенные ромбы) по измерениям посредством КОВЭЖХ.
На фиг.3 представлено процентное содержание нативного mAb1, остающееся в различных составах с минимальным количеством эксципиентов после различных периодов времени хранения при -30°C по измерениям посредством ЭВЭЖХ. Закрашенные ромбы представляют состав 1 (80 мг/мл mAb1, 0,13% полисорбат 20, 6% сахароза, 10 мМ гистидин); закрашенные квадраты представляют состав 2 (80 мг/мл mAb1, 0,13% полисорбат 20, 10 мМ гистидин); закрашенные треугольники представляют состав 3 (80 мг/мл mAb, 1% сахароза, 10 мМ гистидин); незакрашенные квадраты представляют состав 4 (80 мг/мл mAb1, 2% сахароза, 10 мМ гистидин); звездочки представляют состав 5 (80 мг/мл mAb1, 4% сахароза, 10 мМ гистидин); закрашенные окружности представляют состав 6 (80 мг/мл mAb1, 6% сахароза, 10 мМ гистидин); кресты представляют состав 7 (80 мг/мл антитело, 10 мМ гистидин); и незакрашенные окружности представляют состав 8 (65 мг/мл антитело, 10 мМ гистидин). Все составы приведены в таблице 6 (см. пример 2, ниже).
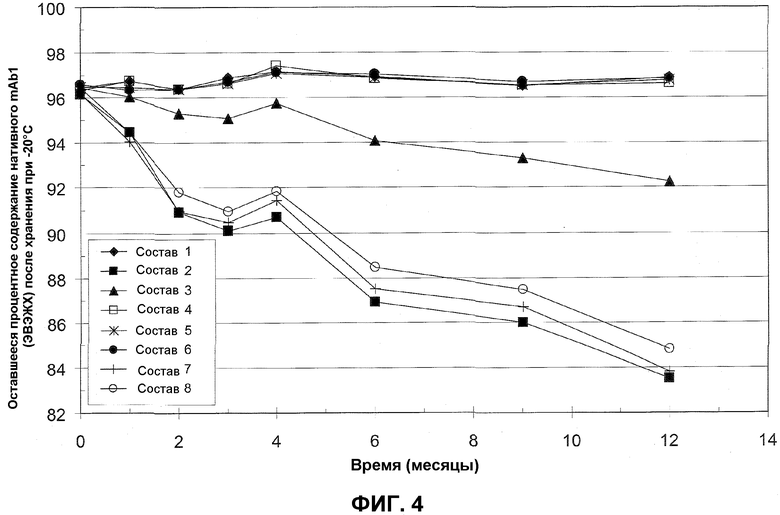
На фиг.4 представлено процентное содержание нативного mAb1, остающееся в различных составах с минимальным количеством эксципиентов после различных периодов времени хранения при -20°C по измерениям посредством ЭВЭЖХ. Закрашенные ромбы представляют состав 1 (80 мг/мл mAb1, 0,13% полисорбат 20, 6% сахароза, 10 мМ гистидин); закрашенные квадраты представляют состав 2 (80 мг/мл mAb1, 0,13% полисорбат 20, 10 мМ гистидин); закрашенные треугольники представляют состав 3 (80 мг/мл mAb, 1% сахароза, 10 мМ гистидин); незакрашенные квадраты представляют состав 4 (80 мг/мл mAb1, 2% сахароза, 10 мМ гистидин); звездочки представляют состав 5 (80 мг/мл mAb1, 4% сахароза, 10 мМ гистидин); закрашенные окружности представляют состав 6 (80 мг/мл mAb1, 6% сахароза, 10 мМ гистидин); кресты представляют состав 7 (80 мг/мл антитело, 10 мМ гистидин); и незакрашенные окружности представляют состав 8 (65 мг/мл антитело, 10 мМ гистидин). Все составы приведены в таблице 6 (см. пример 2, ниже).
ПОДРОБНОЕ ОПИСАНИЕ
Перед тем, как будет описано настоящее изобретение, следует понимать, что изобретение не ограничено конкретными описанными способами и экспериментальными условиями, так как эти способы и условия могут варьировать. Также следует понимать, что используемая в настоящем документе терминология предназначена только для цели описания конкретных вариантов осуществления, и не предназначена для ограничения, так как объем настоящего изобретения ограничен только приложенной формулой изобретения.
Если не определено иначе, все используемые в настоящем документе технические и научные термины имеют то же значение, как обычно понимает специалист в области, к которой принадлежит настоящее изобретение. Как применяют в настоящем документе, термин "приблизительно", когда его используют по отношению к конкретному указанному числовому значению, означает, что значение может варьировать от указанного значения не более чем на 1%. Например, как применяют в настоящем документе, выражение "приблизительно 100" включает 99 и 101 и все значения между ними (например, 99,1, 99,2, 99,3, 99,4 и т.д.).
Хотя в практическом осуществлении или тестировании настоящего изобретения можно использовать любые способы и материалы, сходные со способами и материалами, описываемыми в настоящем документе, или эквивалентные им, в настоящем документе описаны предпочтительные способы и материалы. Все указанные в настоящем документе публикации включены в настоящий документ в качестве ссылки для описания в полном объеме.
ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ
Как применяют в настоящем документе, выражение "фармацевтический состав" означает комбинацию по меньшей мере одного активного ингредиента (например, низкомолекулярного соединения, макромолекулы, соединения и т.д., способных проявлять биологическое действие у человека или у не являющегося человеком животного) и по меньшей мере одного неактивного ингредиента, который, при комбинации с активным ингредиентом и/или одним или несколькими дополнительными неактивными ингредиентами, подходит для терапевтического введения человеку или не являющемуся человеком животному. Как применяют в настоящем документе, если конкретно не указано иначе, термин "состав" означает "фармацевтический состав". Настоящее изобретение относится к фармацевтическим составам, содержащим по меньшей мере один терапевтический полипептид. По определенным вариантам осуществления настоящего изобретения терапевтический полипептид представляет собой антитело, специфически связывающееся с рецептором интерлейкина 6 человека (hIL-6R), или его антигенсвязывающий фрагмент. Более конкретно, настоящее изобретение относится к фармацевтическим составам, содержащим: (i) антитело человека, специфически связывающееся с hIL-6R; (ii) гистидин; и (iii) углевод. В составы по настоящему изобретению можно включать дополнительные компоненты, такие как, например, по меньшей мере одно неионное поверхностно-активное вещество и по меньшей мере одна дополнительная аминокислота. Конкретные иллюстративные компоненты и составы, включаемые в настоящее изобретение, подробно описаны ниже.
В определенных вариантах осуществления фармацевтические составы по настоящему изобретению могут представлять собой текучие составы. Как применяют в настоящем документе, выражение "текучий состав" означает смесь по меньшей мере двух компонентов, которая при температуре приблизительно от 5°C до приблизительно 45°C находится преимущественно в текучем состоянии. Текучие составы в числе других включают жидкие составы. Текучие составы могут обладать низкой, умеренной и высокой вязкостью в зависимости от составляющих их частиц.
АНТИТЕЛА, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩИЕСЯ С hIL-6R
Фармацевтические составы по настоящему изобретению могут содержать антитело человека или его антигенсвязывающий фрагмент, специфически связывающиеся с hIL-6R. Как применяют в настоящем документе, термин "hIL-6R" означает рецептор цитокина человека, специфически связывающийся с интерлейкином 6 (IL-6).
В определенных вариантах осуществления антитело, содержащееся в фармацевтических составах по настоящему изобретению, специфически связывается с внеклеточным доменом hIL-6R. Внеклеточный домен hIL-6R представлен аминокислотной последовательностью SEQ ID NO:74.
Как применяют в настоящем документе термин "антитело" в основном относится к молекулам иммуноглобулинов, содержащим четыре полипептидные цепи, две тяжелые (H) цепи и две легкие (L) цепи, связанные дисульфидными связями, а также к их мультимерам (например, IgM); однако определение термина "антитело также включены молекулы иммуноглобулинов, состоящие только из тяжелых цепей (т.е., с отсутствием легких цепей). Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращаемую в настоящем документе как HCVR или VH) и константную область тяжелой цепи. Константная область тяжелой цепи содержит три домена, CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращаемую в настоящем документе как LCVR или VL) и константную область легкой цепи. Константная область легкой цепи содержит один домен (CL1). Области VH и VL можно дополнительно подразделять на области гипервариабельности, называемые определяющими комплементарность областями (CDR), чередующиеся с областями, которые являются более консервативными, называемыми каркасными областями (FR). Каждая VH и VL состоят из трех CDR и четырех FR, расположенных от N-конца до C-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Как применяют в настоящем документе, если конкретно не указано иначе, термин "антитело", следует понимать как охватывающий молекулы целых антител, а также их антигенсвязывающие фрагменты. Как применяют в настоящем документе термины "антигенсвязывающая часть" или "антигенсвязывающий фрагмент" антитела (или просто "часть антитела" или "фрагмент антитела"), относятся к одному или нескольким фрагментам антитела, сохраняющим способность к специфическому связыванию с hIL-6R.
Как применяют в настоящем документе, "выделенное антитело", предназначено для обозначения антитела, которое по существу не содержит других антител с отличной антигенной специфичностью (например, выделенное антитело, которое специфически связывается с hIL-6R по существу не содержит антител, специфически связывающихся с антигенами, отличными от hIL-6R).
Термин "специфически связывается" или т.п., означает, что антитело или его антигенсвязывающий фрагмент формируют с антигеном комплекс, который относительно стабилен в физиологических условиях. Специфическое связывание можно характеризовать константой диссоциации по меньшей мере приблизительно 1×10-6 M или более. Способы определения специфического связывания двух молекул хорошо известны в данной области и включают, например, равновесный диализ, поверхностный плазмонный резонанс и т.п. Однако выделенное антитело, специфически связывающееся с hIL-6R, может обладать перекрестной реактивностью с другими антигенами, такими как молекулы IL-6R других видов. В контексте настоящего изобретения полиспецифические (например, биспецифические) антитела, связывающиеся с hIL-6R, а также с одним или несколькими дополнительными антигенами считают "специфически связывающимися" с hIL-6R. Кроме того, выделенное антитело по существу может не содержать других клеточного материала и/или химических веществ.
Иллюстративные антитела к hIL-6R, которые можно включать в фармацевтические составы по настоящему изобретению, указаны в US 7582298, описание которого полностью включено в качестве ссылки.
По определенным вариантам осуществления настоящего изобретения антитело к hIL-6R или его антигенсвязывающий фрагмент содержат определяющую комплементарность область тяжелой цепи (HCDR) 1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:4, 20, 36 и 52; HCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:6, 22, 38 и 54; и HCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:2, 18, 34 и 50. В определенных вариантах осуществления антитело к hIL-6R или его антигенсвязывающий фрагмент содержат домены HCDR1-HCDR2-HCDR3, соответственно, выбранные из группы, состоящей из: (i) SEQ ID NO:4-6-8; (ii) SEQ ID NO:20-22-24; (iii) SEQ ID NO:36-38-40; и (iv) SEQ ID NO:52-54-56.
По определенным вариантам осуществления настоящего изобретения антитело к hIL-6R или его антигенсвязывающий фрагмент содержат определяющую комплементарность область легкой цепи (LCDR) 1 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:12, 28, 44 и 60; LCDR2 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:14, 30, 46 и 62; и LCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:16, 32, 48 и 64. В определенных вариантах осуществления антитело к hIL-6R или его антигенсвязывающий фрагмент содержат домены LCDR1-LCDR2-LCDR3, соответственно, выбранные из группы, состоящей из: (i) SEQ ID NO:12-14-16; (ii) SEQ ID NO:28-30-32; (iii) SEQ ID NO:44-46-48; и (iv) SEQ ID NO:60-62-64.
В определенных вариантах осуществления антитело к hIL-6R или его антигенсвязывающий фрагмент содержат домены HCDR1-HCDR2-HCDR3/LCDR1-LCDR2-LCDR3, соответственно, выбранные из группы, состоящей из: (i) SEQ ID NO:4-6-8/SEQ ID NO:12-14-16; (ii) SEQ ID NO:20-22-24/SEQ ID NO:28-30-32; (iii) SEQ ID NO:36-38-40/SEQ ID NO:44-46-48; и (iv) SEQ ID NO:52-54-56/SEQ ID NO:60-62-64.
В определенных вариантах осуществления антитело к hIL-6R или его антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи (HCVR) с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:2, 18, 34 и 50. В определенных вариантах осуществления антитело к hIL-6R или его антигенсвязывающий фрагмент содержат вариабельную область легкой цепи (LCVR) с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:10, 26, 42 и 58. В определенных вариантах осуществления антитело к hIL-6R или его антигенсвязывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO:2/10; 18/26; 34/42 и 50/58.
Неограничивающее иллюстративное антитело, используемое в примерах в настоящем документе, обозначают как "mAb1". Это антитело в US 7582298 также обозначено как VQ8F11-21. mAb1 (VQ8F11-21) содержит пару аминокислотных последовательностей HCVR/LCVR с SEQ ID NO:18/26 и домены HCDR1-HCDR2-HCDR3/LCDR1-LCDR2-LCDR3, представленные SEQ ID NO:20-22-24/SEQ ID NO:28-30-32.
Количество антитела или его антигенсвязывающего фрагмента, содержащееся в фармацевтических составах по настоящему изобретению может варьировать в зависимости конкретных желаемых свойств составов, а также конкретных условий и целей использования, для которых предназначены составы. В определенных вариантах осуществления фармацевтические составы могут содержать приблизительно от 1 мг/мл до приблизительно 500 мг/мл антитела; приблизительно от 5 мг/мл до приблизительно 400 мг/мл антитела; приблизительно от 5 мг/мл до приблизительно 200 мг/мл антитела; приблизительно от 25 мг/мл до приблизительно 180 мг/мл антитела; приблизительно от 25 мг/мл до приблизительно 150 мг/мл антитела; или приблизительно от 50 мг/мл до приблизительно 180 мг/мл антитела. Например, составы по настоящему изобретению могут содержать приблизительно 1 мг/мл; приблизительно 2 мг/мл; приблизительно 5 мг/мл; приблизительно 10 мг/мл; приблизительно 15 мг/мл; приблизительно 20 мг/мл; приблизительно 25 мг/мл; приблизительно 30 мг/мл; приблизительно 35 мг/мл; приблизительно 40 мг/мл; приблизительно 45 мг/мл; приблизительно 50 мг/мл; приблизительно 55 мг/мл; приблизительно 60 мг/мл; приблизительно 65 мг/мл; приблизительно 70 мг/мл; приблизительно 75 мг/мл; приблизительно 80 мг/мл; приблизительно 85 мг/мл; приблизительно 86 мг/мл; приблизительно 87 мг/мл; приблизительно 88 мг/мл; приблизительно 89 мг/мл; приблизительно 90 мг/мл; приблизительно 95 мг/мл; приблизительно 100 мг/мл; приблизительно 105 мг/мл; приблизительно 110 мг/мл; приблизительно 115 мг/мл; приблизительно 120 мг/мл; приблизительно 125 мг/мл; приблизительно 130 мг/мл; приблизительно 131 мг/мл; приблизительно 132 мг/мл; приблизительно 133 мг/мл; приблизительно 134 мг/мл; приблизительно 135 мг/мл; приблизительно 140 мг/мл; приблизительно 145 мг/мл; приблизительно 150 мг/мл; приблизительно 155 мг/мл; приблизительно 160 мг/мл; приблизительно 165 мг/мл; приблизительно 170 мг/мл; приблизительно 175 мг/мл; приблизительно 180 мг/мл; приблизительно 185 мг/мл; приблизительно 190 мг/мл; приблизительно 195 мг/мл; или приблизительно 200 мг/мл антитела или его антигенсвязывающего фрагмента, специфически связывающихся с hIL-6R.
ЭКСЦИПИЕНТЫ и pH
Фармацевтические составы по настоящему изобретению содержат один или несколько эксципиентов. Как применяют в настоящем документе, термин "эксципиент" означает любое нетерапевтическое средство, добавляемое в состав для обеспечения желаемой консистенции, вязкости или стабилизирующего действия.
В определенных вариантах осуществления фармацевтический состав по изобретению содержит по меньшей мере одну аминокислоту. Иллюстративные аминокислоты, пригодные для использования в составах по настоящему изобретению, в числе других включают аргинин и/или гистидин.
Количество аминокислоты, содержащееся в фармацевтических составах по настоящему изобретению может варьировать в зависимости от конкретных желаемых свойств составов, а также конкретных условий и целей использования, для которых предназначены составы. В определенных вариантах осуществления составы могут содержать приблизительно от 1 мМ до приблизительно 200 мМ аминокислоты; приблизительно от 2 мМ до приблизительно 100 мМ аминокислоты; приблизительно от 5 мМ до приблизительно 50 мМ аминокислоты; или приблизительно от 10 мМ до приблизительно 25 мМ аминокислоты. Например, фармацевтические составы по настоящему изобретению могут содержать приблизительно 1 мМ; приблизительно 1,5 мМ; приблизительно 2 мМ; приблизительно 2,5 мМ; приблизительно 3 мМ; приблизительно 3,5 мМ; приблизительно 4 мМ; приблизительно 4,5 мМ; приблизительно 5 мМ; приблизительно 5,5 мМ; приблизительно 6 мМ; приблизительно 6,5 мМ; приблизительно 7 мМ; приблизительно 7,5 мМ; приблизительно 8 мМ; приблизительно 8,5 мМ; приблизительно 9 мМ; приблизительно 9,5 мМ; приблизительно 10 мМ; приблизительно 10,5 мМ; приблизительно 11 мМ; приблизительно 11,5 мМ; приблизительно 12 мМ; приблизительно 12,5 мМ; приблизительно 13 мМ; приблизительно 13,5 мМ; приблизительно 14 мМ; приблизительно 14,5 мМ; приблизительно 15 мМ; приблизительно 15,5 мМ; 16 мМ; приблизительно 16,5 мМ; приблизительно 17 мМ; приблизительно 17,5 мМ; приблизительно 18 мМ; приблизительно 18,5 мМ; приблизительно 19 мМ; приблизительно 19,5 мМ; приблизительно 20 мМ; приблизительно 20,5 мМ; приблизительно 21 мМ; приблизительно 21,5 мМ; приблизительно 22 мМ; приблизительно 22,5 мМ; приблизительно 23 мМ; приблизительно 23,5 мМ; приблизительно 24 мМ; приблизительно 24,5 мМ; приблизительно 25 мМ; приблизительно 25,5 мМ; приблизительно 26 мМ; приблизительно 26,5 мМ; приблизительно 27 мМ; приблизительно 27,5 мМ; приблизительно 28 мМ; приблизительно 28,5 мМ; приблизительно 29 мМ; приблизительно 29,5 мМ; приблизительно 30 мМ; приблизительно 35 мМ; приблизительно 40 мМ; приблизительно 45 мМ; или приблизительно 50 мМ аминокислоты (например, гистидина и/или аргинина).
Фармацевтические составы по настоящему изобретению также могут содержать один или несколько углеводов, например, один или несколько сахаров. Сахар может представлять собой восстанавливающий сахар или невосстанавливающий сахар. "Восстанавливающие сахара" включают, например, сахара с кетоновой или альдегидной группой и содержат и реактивную полуацетальную группу, позволяющую действовать сахару в качестве восстановителя. Конкретные примеры восстанавливающих сахаров включают фруктозу, глюкозу, глицеральдегид, лактозу, арабинозу, маннозу, ксилозу, рибозу, рамнозу, галактозу и мальтозу. Невосстанавливающие сахара могут содержать аномерный атом углерода, которой представляет собой ацеталь и по существу не реагирует с аминокислотами или полипептидами с инициацией реакции Майяра. Конкретные примеры невосстанавливающих сахаров включают сахарозу, трегалозу, сорбозу, сукралозу, мелицитозу и рафинозу. Сахарные кислоты включают, например, сахаристые кислоты, глюконат и другие полигидроксисахара и их соли.
Количество сахара, содержащееся в фармацевтических составах по настоящему изобретению, варьирует в зависимости от конкретных условий и целей использования, для которых предназначены составы. В определенных вариантах осуществления составы могут содержать приблизительно от 0,1% до приблизительно 20% сахара; приблизительно от 0,5% до приблизительно 20% сахара; приблизительно от 1% до приблизительно 20% сахара; приблизительно от 2% до приблизительно 15% сахара; приблизительно от 3% до приблизительно 10% сахара; приблизительно от 4% до приблизительно 10% сахара или приблизительно от 5% до приблизительно 10% сахар. Например, фармацевтические составы по настоящему изобретению могут содержать приблизительно 0,5%; приблизительно 1,0%; приблизительно 1,5%; приблизительно 2,0%; приблизительно 2,5%; приблизительно 3,0%; приблизительно 3,5%; приблизительно 4,0%; приблизительно 4,5%; приблизительно 5,0%; приблизительно 5,5%; приблизительно 6,0%; 6,5%; приблизительно 7,0%; приблизительно 7,5%; приблизительно 8,0%; приблизительно 8,5%; приблизительно 9,0%; приблизительно 9,5%; приблизительно 10,0%; приблизительно 10,5%; приблизительно 11,0%; приблизительно 11,5%; приблизительно 12,0%; приблизительно 12,5%; приблизительно 13,0%; приблизительно 13,5%; приблизительно 14,0%; приблизительно 14,5%; приблизительно 15,0%; приблизительно 15,5%; приблизительно 16,0%; 16,5%; приблизительно 17,0%; приблизительно 17,5%; приблизительно 18,0%; приблизительно 18,5%; приблизительно 19,0%; приблизительно 19,5%; или приблизительно 20,0% сахара (например, сахарозы).
Фармацевтические составы по настоящему изобретению также могут содержать одно или несколько поверхностно-активное вещество. Как применяют в настоящем документе, термин "поверхностно-активное вещество" означает вещество, снижающее поверхностное натяжение жидкости, в которой оно растворено и/или снижающее межфазное натяжение между маслом и водой. Поверхностно-активные вещества могут быть ионными или неионными. Иллюстративные неионные поверхностно-активные вещества, которые можно включать в составы по настоящему изобретению, включают, например, алкилполи(этиленоксид), алкилполиглюкозиды (например, октилглюкозид и децилмальтозид), жирные спирты, такие как цетиловый спирт и олеиловый спирт, кокамид-MEA, кокамид-DEA и кокамид-TEA. Конкретные неионные поверхностно-активные вещества, которые можно включать в составы по настоящему изобретению, включают, например, полисорбаты, такие как полисорбат 20, полисорбат 28, полисорбат 40, полисорбат 60, полисорбат 65, полисорбат 80, полисорбат 81 и полисорбат 85; полоксамеры, такие как полоксамер 188, полоксамер 407; полиэтиленполипропиленгликоль или полиэтиленгликоль (PEG). Полисорбат 20 также известен как TWEEN 20, сорбитанмонолаурат и полиоксиэтиленсорбитанмонолаурат.
Количество поверхностно-активного вещества, содержащееся в фармацевтических составах по настоящему изобретению, может варьировать в зависимости от конкретных желаемых свойств состава, а также конкретных условий и целей использования, для которых предназначены составы. В определенных вариантах осуществления составы могут содержать приблизительно от 0,05% до приблизительно 5% поверхностно-активного вещества или приблизительно от 0,1% до приблизительно 0,2% поверхностно-активного вещества. Например, составы по настоящему изобретению могут содержать приблизительно 0,05%; приблизительно 0,06%; приблизительно 0,07%; приблизительно 0,08%; приблизительно 0,09%; приблизительно 0,10%; приблизительно 0,11%; приблизительно 0,12%; приблизительно 0,13%; приблизительно 0,14%; приблизительно 0,15%; приблизительно 0,16%; приблизительно 0,17%; приблизительно 0,18%; приблизительно 0,19%; приблизительно 0,20%; приблизительно 0,21%; приблизительно 0,22%; приблизительно 0,23%; приблизительно 0,24%; приблизительно 0,25%; приблизительно 0,26%; приблизительно 0,27%; приблизительно 0,28%; приблизительно 0,29%; или приблизительно 0,30% поверхностно-активного вещества (например, полисорбата 20).
pH фармацевтических составов по настоящему изобретению может составлять приблизительно от 5,0 до приблизительно 8,0. Например, pH составов по настоящему изобретению может составлять приблизительно 5,0; приблизительно 5,2; приблизительно 5,4; приблизительно 5,6; приблизительно 5,8; приблизительно 6,0; приблизительно 6,2; приблизительно 6,4; приблизительно 6,6; приблизительно 6,8; приблизительно 7,0; приблизительно 7,2; приблизительно 7,4; приблизительно 7,6; приблизительно 7,8; или приблизительно 8,0.
ИЛЛЮСТРАТИВНЫЕ СОСТАВЫ
По одному из аспектов настоящего изобретения фармацевтический состав содержит: (i) антитело человека, специфически связывающееся с hIL-6R (например, mAb1); (ii) аминокислоту (например, гистидин); и (iii) сахар (например, сахарозу). Конкретные неограничивающие иллюстративные варианты осуществления, охватываемые этим аспектом изобретения, приведены в таблице 1.
По другому аспекту настоящего изобретения фармацевтический состав содержит: (i) антитело человека, специфически связывающееся с hIL-6R (например, mAb1); (ii) аминокислоту (например, гистидин); (iii) сахар (например, сахарозу); и (iv) поверхностно-активное вещество (например, полисорбат 20). Конкретные неограничивающие иллюстративные варианты осуществления, охватываемые этим аспектом изобретения, приведены в таблицах 2A и 2B.
По другому аспекту настоящего изобретения фармацевтический состав содержит: (i) антитело человека, специфически связывающееся с hIL-6R (например, mAb1); (ii) первую аминокислоту (например, гистидин); (iii) сахар (например, сахарозу); (iv) поверхностно-активное вещество (например, полисорбат 20); и (v) вторую аминокислоту (например, аргинин). Конкретные неограничивающие иллюстративные варианты осуществления, охватываемые этим аспектом изобретения, приведены в таблицах 3A, 3B, 3C, 3D, 3E и 3F.
Дополнительные неограничивающие примеры фармацевтических составов, охватываемых настоящим изобретением, приведены в других разделах настоящего документа, включающих демонстрационные примеры, предоставленные ниже.
СТАБИЛЬНОСТЬ И ВЯЗКОСТЬ ФАРМАЦЕВТИЧЕСКИХ СОСТАВОВ
Как правило, фармацевтические составы по настоящему изобретению демонстрируют высокие уровни стабильности. Как применяют в настоящем документе термин "стабильный" по отношению к фармацевтическим составам означает, что антитела в фармацевтических составах сохраняют приемлемую степень структуры, и/или функции, и/или биологической активности после хранения в течение определенного периода времени. Состав может быть стабильным даже несмотря на то, что антитело, содержащееся в нем, не сохраняет 100% своей структуры, и/или функции, и/или биологической активности после хранения в течение определенного периода времени. В определенных условиях как "стабильное" можно рассматривать сохранение приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или приблизительно 99% структуры, и/или функции, и/или биологической активности антитела после хранения в течение определенного периода времени.
Стабильность, в числе другого, можно измерять, определяя процентное содержание нативного антитела, остающегося в составе после хранения в течение определенного периода времени при данной температуре. Процентное содержание нативного антитела, в числе другого, можно определять посредством эксклюзионной хроматографии (например, эксклюзионной высокоэффективной жидкостной хроматографии [ЭВЭЖХ]). "Приемлемая степень стабильности", как эту фразу применяют в настоящем документе, означает, что в составе после хранения в течение определенного периода времени при данной температуре можно детектировать по меньшей мере 90% нативной формы антитела. В определенных вариантах осуществления в составе после хранения в течение определенного периода времени при данной температуре можно детектировать по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% нативной формы антитела. Определенный период времени после которого измеряют стабильность может составлять по меньшей мере 1 месяц, по меньшей мере 2 месяца, по меньшей мере 3 месяца, по меньшей мере 4 месяца, по меньшей мере 5 месяцев, по меньшей мере 6 месяцев, по меньшей мере 7 месяцев, по меньшей мере 8 месяцев, по меньшей мере 9 месяцев, по меньшей мере 10 месяцев, по меньшей мере 11 месяцев, по меньшей мере 12 месяцев, по меньшей мере 18 месяцев, по меньшей мере 24 месяца или более. Температура, при которой можно хранить фармацевтический состав при оценке стабильности, может представлять собой любую температуру приблизительно от -80°C до приблизительно 45°C, например, хранение приблизительно при -30°C, приблизительно при -20°C, приблизительно при 0°C, приблизительно при 5°C, приблизительно при 25°C или приблизительно при 45°C. Например, фармацевтический состав можно считать стабильным, если после 3 месяцев хранения при 5°C посредством ЭВЭЖХ детектируют больше, чем приблизительно 90%, 95%, 96% или 97% нативного антитела. Также фармацевтический состав можно считать стабильным, если после 6 месяцев хранения при 5°C посредством ЭВЭЖХ детектируют больше, чем приблизительно 90%, 95%, 96% или 97% нативного антитела. Также фармацевтический состав можно считать стабильным, если после 9 месяцев хранения при 5°C посредством ЭВЭЖХ детектируют больше, чем приблизительно 90%, 95%, 96% или 97% нативного антитела. Также фармацевтический состав можно считать стабильным, если после 3 месяцев хранения при 25°C посредством ЭВЭЖХ детектируют больше, чем приблизительно 90%, 95%, 96% или 97% нативного антитела. Также фармацевтический состав можно считать стабильным, если после 6 месяцев хранения при 25°C посредством ЭВЭЖХ детектируют больше, чем приблизительно 90%, 95%, 96% или 97% нативного антитела. Также фармацевтический состав можно считать стабильным, если после 9 месяцев хранения при 25°C посредством ЭВЭЖХ детектируют больше, чем приблизительно 90%, 95%, 96% или 97% нативного антитела.
Для оценки стабильности составов по настоящему изобретению можно использовать другие, такие как, например, дифференциальная сканирующая калориметрия (DSC) для определения термостабильности, контролируемое перемешивание для определения механической стабильности и оптическая плотность приблизительно при 350 нм или приблизительно при 405 нм для определения мутности раствора. Например, состав по настоящему изобретению можно считать стабильным, если после 6 или более месяцев хранения при температуре приблизительно от 5°C до приблизительно 25°C изменение OD405 состава составляет менее чем приблизительно 0,05 (например, 0,04, 0,03, 0,02, 0,01 или менее) от OD405 состава в момент t=0.
Стабильность также можно оценивать посредством измерения биологической активности и/или аффинности связывания антитела с его мишенью. Например, состав по настоящему изобретению можно считать стабильным, если после хранения, например, при 5°C, 25°C, 45°C и т.д. в течение определенного периода времени (например, от 1 до 12 месяцев) антитело к IL-6R, содержащееся в составе связывается с IL-6R с аффинностью, которая составляет по меньшей мере 50%, 60%, 70%, 80%, 90%, 95% или более от аффинности связывания антитела до указанного хранения. Дополнительные способы оценки стабильности антитела в составе продемонстрированы в примерах, предоставленных ниже.
В жидкой форме фармацевтические составы по настоящему изобретению в определенных вариантах осуществления могут демонстрировать уровни вязкости от низких до умеренных. Как применяют в настоящем документе "вязкость" может представлять собой "кинематическую вязкость" или "абсолютную вязкость". "Кинематическая вязкость" представляет собой меру резистивный поток жидкости под влиянием гравитации. Когда две жидкости равного объема помещают в идентичные капиллярные вискозиметры и позволяют течь под действием гравитации, более вязкой жидкости для протекания через капилляр необходимо большее время, чем менее вязкой жидкости. Например, если одной жидкости для полного протекания необходимо 200 секунд, а второй жидкости необходимо 400 секунд, вторая жидкость является в два раза более вязкой, чем первая по шкале кинематической вязкости. "Абсолютная вязкость", иногда называемая динамической или простой вязкостью, представляет собой произведение кинематической вязкости и плотности жидкости (абсолютная вязкость = кинематическая вязкость × плотность). Размерность кинематической вязкости представляет собой L2/T, где L представляет собой длину, а T представляет собой время. Как правило, кинематическую вязкость выражают в сантистоксах (сСт). Единицей СИ кинематической вязкости является мм2/сек, что составляет 1 сСт. Абсолютную вязкость выражают в единицах сантипуаз (сП). Единицей СИ абсолютной вязкости является миллипаскаль·сек (мПа·сек), где 1 сП = 1 мПа·сек.
Как применяют в настоящем документе, низкий уровень вязкости по отношению к текучему составу по настоящему изобретению, демонстрирует абсолютную вязкость менее чем приблизительно 20 сПуаз (сП). Например, можно считать, что текучий состав по изобретению обладает "низкой вязкостью", если при измерении стандартными способами измерения вязкости состав демонстрирует абсолютную вязкость приблизительно 19 сП, приблизительно 18 сП, приблизительно 17 сП, приблизительно 16 сП, приблизительно 15 сП, приблизительно 14 сП, приблизительно 13 сП, приблизительно 12 сП, приблизительно 11 сП, приблизительно 10 сП, приблизительно 9 сП, приблизительно 8 сП, приблизительно 7 сП, приблизительно 6 сП, приблизительно 5 сП, приблизительно 4 сП или менее. Как применяют в настоящем документе, умеренный уровень вязкости по отношению к текучему состав по настоящему изобретению, демонстрирует абсолютную вязкость приблизительно от 30 сП до приблизительно 20 сП. Например, можно считать, что текучий состав по изобретению обладает "умеренной вязкостью", если при измерении стандартными способами измерения вязкости состав демонстрирует абсолютную вязкость приблизительно 30 сП, приблизительно 29 сП, приблизительно 28 сП, приблизительно 27 сП, приблизительно 26 сП, приблизительно 25 сП, приблизительно 24 сП, приблизительно 23 сП, приблизительно 22 сП, приблизительно 21 сП или приблизительно 20 сП.
Как проиллюстрировано в примере 6 ниже, авторы настоящего изобретения сделали неожиданное открытие, что текучие составы с вязкостью от низкой до умеренной, содержащие высокие концентрации антитела к hIL-6R (например, по меньшей мере до 175 мг/мл) можно получать, формулируя антитело с гистидином в концентрации от 25 мМ до 100 мМ и аргинином в концентрации от 25 мМ до 50 мМ. Кроме того, дополнительно выявлено, что вязкость состава можно сжинать даже в большей степени, доводя содержание сахарозы менее чем до 10%.
КОНТЕЙНЕРЫ ДЛЯ ФАРМАЦЕВТИЧЕСКИХ СОСТАВОВ И СПОСОБЫ ВВЕДЕНИЯ
Фармацевтические составы по настоящему изобретению можно содержать в любом контейнере, подходящем для хранения лекарственных средств и других терапевтических композиций. Например, фармацевтические составы можно содержать в закрытом и стерилизованном пластиковом или стеклянном контейнере определенного объема, таком как флакон, ампула, шприц, картридж или бутылка. Для содержания составов по настоящему изобретению можно использовать различные типы флаконов, включая, например, прозрачные и светонепроницаемые (например, желтые) стеклянные или пластиковые флаконы. Подобным образом для содержания и/или введения фармацевтических составов по настоящему изобретению можно использовать любой тип шприца.
Фармацевтические составы по настоящему изобретению можно содержать в шприцах с "нормальным содержанием вольфрама" или в шприцах с "низким содержанием вольфрама". Как понятно специалистам в данной области, способ получения стеклянных шприцов, как правило, включает использование горячего вольфрамового стержня, который действует, протыкая стекло, создавая, таким образом, отверстие из которого жидкости можно выпускать и изгонять из шприца. Этот способ приводит к отложению незначительных количеств вольфрама на внутренней поверхности шприца. Для снижения количества вольфрама в шприце можно использовать последующую отмывку и другие этапы обработки. Как применяют в настоящем документе, термин "нормальное содержание вольфрама" означает, что шприц содержит более 500 миллиардных долей (млрд.д.) вольфрама. Термин "низкое содержание вольфрама" означает, что шприц содержит менее 500 млрд.д. вольфрама. Например, шприц с низким содержанием вольфрама по настоящему изобретению может содержать менее чем приблизительно 490, 480, 470, 460, 450, 440, 430, 420, 410, 390, 350, 300, 250, 200, 150, 100, 90, 80, 70, 60, 50, 40, 30, 20, 10 или менее млрд.д. вольфрама.
Для предотвращения загрязнения медицинского содержимого шприца или флакона и/или сохранения его стабильности на резиновые плунжеры, используемые в шприцах, и резиновые пробки, используемые для закрывания отверстий флаконов, можно наносить покрытия. Таким образом, фармацевтические составы по настоящему изобретению по определенным вариантам осуществления можно содержать в шприце, содержащем плунжер с нанесенным покрытием, или во флаконе, который герметически закрывают резиновой пробкой с нанесенным покрытием. Например, плунжер или пробку можно покрывать слоем фторуглерода. Примеры пробок и/или плунжеров с нанесенным покрытием, пригодных для использования во флаконах и шприцах, содержащих фармацевтические составы по настоящему изобретению, указаны, например, в патентах США №№ 4997423; 5908686; 6286699; 6645635 и 7226554, содержание которых полностью включено в настоящий документ в качестве ссылки. Конкретные иллюстративные резиновые пробки и плунжеры с нанесенным покрытием, которые можно использовать в контексте настоящего изобретения, коммерчески доступны под торговой маркой "FluroTec®", доступной в West Pharmaceutical Services, Inc. (Lionville, PA).
По определенным вариантам осуществления настоящего изобретения фармацевтические составы можно содержать в шприце с низким содержанием вольфрама, содержащем покрытый фторуглеродом плунжер. Как описано в разделе примеров ниже, выявлено, что комбинация шприца с низким содержанием вольфрама и покрытого фторуглеродом плунжера обеспечивает неожиданные характеристики стабильности в отношении фармацевтических составов по настоящему изобретению.
Фармацевтические составы можно вводить пациенту парентеральными маршрутами, такими как инъекция (например, подкожная, внутривенная, внутримышечная, интраперитонеальная и т.д.) или чрескожное, слизистое, назальное, легочное и/или пероральное введение. Для подкожной доставки фармацевтических составов по настоящему изобретению можно использовать множество шприц-ручек и/или автоинъекторных средств доставки с повторным использованием. Некоторые примеры в качестве неограничивающих примеров включают автопен (AUTOPEN™) (Owen Mumford, Inc., Woodstock, UK), шприц-ручку дисетроник (DISETRONIC™) (Disetronic Medical Systems, Bergdorf, Switzerland), хумалог (HUMALOG) MIX 75/25™ pen, шприц-ручку хумалог (HUMALOG™), шприц-ручку хумалин (HUMALIN) 70/30™ (Eli Lilly and Co., Indianapolis, IN), новопен (NOVOPEN™) I, II и III (Novo Nordisk, Copenhagen, Denmark), новопен джунинор (NOVOPEN JUNIOR™) (Novo Nordisk, Copenhagen, Denmark), шприц-ручку BD™ (Becton Dickinson, Franklin Lakes, NJ), оптипен (OPTIPEN™), оптипен про (OPTIPEN PRO™), оптипен старлет (OPTIPEN STARLET™) и оптиклик (OPTICLIK™) (Sanofi-Aventis, Frankfurt, Germany). Некоторые примеры распределительных шприц-ручек и/или автоинъекторных средств доставки, находящие применение при подкожной доставке фармацевтической композиции по настоящему изобретению, в качестве неограничивающих примеров включают шприц-ручку солостар (SOLOSTAR™) (Sanofi-Aventis), флекспен (FLEXPEN™) (Novo Nordisk) и квикпен (KWIKPEN™) (Eli Lilly), автоинектор сурклик (SURECLICK™) (Amgen, Thousand Oaks, CA), пенлет (PENLET™) (Haselmeier, Stuttgart, Germany), эпипен (EPIPEN) (Dey, L.P.) и шприц-ручку хумира (HUMIRA™) (Abbott Labs, Abbott Park, IL).
Также по настоящему документу для доставки фармацевтических составов по настоящему изобретению предусмотрено использование микроинфузора. Как применяют в настоящем документе, термин "микроинфузор" означает средство подкожной доставки, разработанное для медленного введения больших объемов (например, приблизительно до 2,5 мл или более) терапевтического состава в течение длительного периода времени (например, приблизительно 10, 15, 20, 25, 30 или более минут). См., например, U.S. 6629949; US 6659982 и Meehan et al., J. Controlled Release 46:107-116 (1996). Микроинфузоры особенно пригодны для доставки больших доз терапевтических белков, содержащихся в высокой концентрации (например, приблизительно 100, 125, 150, 175, 200 или более мг/мл) и/или в вязких растворах.
ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ ФАРМАЦЕВТИЧЕСКИХ СОСТАВОВ
Фармацевтические составы по настоящему изобретению в числе прочего пригодны для лечения, предотвращение и/или улучшения состояния любого заболевания или нарушения, ассоциированного с активностью IL-6, включая заболевания или нарушения, опосредуемые активацией рецептора IL-6. В качестве неограничивающих примеров, заболевания и нарушения, которые можно лечить и/или предотвращать введением фармацевтических составов по настоящему изобретению, включают, например, ревматоидный артрит, анкилозирующий спондилит, болезнь Крона, язвенный колит, панкреатит, юношеский идиопатический артрит, васкулит, болезнь Кавасаки, системную красную волчанку, псориаз, псориатический артрит, синдром Шегрена, болезнь Стилла, болезнь Кастлемана, рассеянный склероз, заболевания, ассоциированные с аномальным свертыванием крови или фибринолизом (например, тромбоз), злокачественную опухоль (например, рак молочной железы, лейкоз, рак яичников, меланому, рак предстательной железы, рак поджелудочной железы, лимфому, рак легких, почечноклеточную карциному, колоректальный рак, множественную миелому и т.д.), кахексию, хроническое отторжение трансплантированных органов и клеток, кардиопатию, вирусную инфекцию (например, инфекцию ВИЧ, инфекцию ВЭБ и т.д.), плазмацитоз, гипериммуноглобулинемию, анемию, нефрит, мезотелиому и потерю слуха и другие нарушения внутреннего уха.
Таким образом, настоящее изобретение относится к способам лечения, предотвращения и/или улучшения состояния любого заболевания или нарушения, ассоциированных с активностью IL-6 или активацией IL-6R (включая любое из указанных выше заболеваний, нарушений и состояний). Способы лечения по настоящему изобретению включают введение индивидууму любого состава, содержащего антитело к hIL-6R, как описано в настоящем документе. Индивидуум, которому вводят фармацевтический состав, может представлять собой, например, любого из человека или не являющегося человеком животного, нуждающихся в таком лечении, предотвращении и/или улучшении состояния, или которые иным образом получат пользу от ингибирования или снижения активности IL-6 и/или активности, опосредованной IL-6R. Например, индивидуум может представлять собой индивидуума, у которого диагностировано или у которого выявлен риск поражения любым из указанных выше заболеваний или нарушений. Настоящее изобретение дополнительно включает использование любого из фармацевтических составов, описываемых в настоящем документе, в производстве лекарственного средства для лечения, предотвращение и/или улучшения состояния любого заболевания или нарушения, ассоциированных с активностью IL-6 или активацией IL-6R (включая любое из указанных выше иллюстративных заболеваний, нарушений и состояний).
ПРИМЕРЫ
Приведенные ниже примеры используют для того, чтобы предоставить специалистам в данной области полное раскрытие и описание того, как получать и использовать способы и композиции по изобретению, и они не предназначены для ограничения области того, что авторы изобретения рассматривают как их изобретение. Были предприняты усилия для обеспечения точности в отношении используемых чисел (например, количеств, температуры и т.д.), однако следует учитывать некоторые экспериментальные ошибки и отклонения. Если не указано иначе, части представляют собой массовые части, молекулярная масса представляет собой среднюю молекулярную массу, температура приведена в градусах Цельсия, а давление представляет собой атмосферное или близкое к атмосферному.
Пример 1. Стабильность полностью человеческого антитела к рецептору интерлейкина 6 (IL-6R) человека ("mAb1") после хранения при низких температурах
В этом примере, получали различные составы, содержащие антитело к IL-6R человека без эксципиентов. Иллюстративное антитело, используемое в этом и во всех последующих примерах, приведенных ниже, представляет собой антитело, содержащее вариабельную область тяжелой цепи (HCVR) с аминокислотной последовательностью SEQ ID NO:18, и вариабельную область легкой цепи (LCVR) с аминокислотной последовательностью SEQ ID NO:26. Это антитело в настоящем документе обозначено как "mAb1".
В качестве предварительного эксперимента, стабильность mAb1 в жидком растворе определяли после различных периодов времени хранения в замороженном состоянии при -20°C, -30°C и -80°C. Концентрация mAb1, используемая в этом примере, составляла 128 мг/мл. В различные моменты времени определяли стабильность mAb1 посредством эксклюзионной высокоэффективной жидкостной хроматографии (ЭВЭЖХ) и посредством катионообменной высокоэффективной жидкостной хроматографии (КОВЭЖХ). Стабильность оценивали на основе процентного содержания нативного mAb1, остающегося в образце (посредством ЭВЭЖХ; таблица 4) и по процентному содержанию кислых молекул, наблюдаемых в образце (посредством КОВЭЖХ; таблица 5) (Увеличение процентного содержания кислых молекул соответствует дезаминированию антитела, и, таким образом, его рассматривают как нежелательное явление в отношении фармацевтических составов по настоящему изобретению).
Результаты в таблицах 3 и 4 изображены на фиг.1 и 2, соответственно. Эти результаты демонстрируют, что mAb1 при концентрации 128 мг/мл при хранении при -80°C может оставаться стабильным в течение по меньшей мере 9 месяцев.
Пример 2. Стабильность составов mAb1, содержащих минимальное количество эксципиентов
Получали восемь различных составов, содержащих mAb1 и минимальное количество эксципиентов, как приведено в таблице 6. Составы тестировали на стабильность посредством ЭВЭЖХ после различных периодов времени при -30°C и -20°C. Результаты, выражаемые в процентном содержании остающегося нативного mAb1, приведены в таблицах 7 (хранение при -30°C) и 8 (-20°C).
Результаты в таблицах 7 и 8 изображены на фиг.3 и 4, соответственно. Как показано в этом примере, стабильность mAb1 после нескольких месяцев хранения при -20°C и -30°C в значительной степени сохранялась в составах 1, 4, 5 и 6. Эти результаты демонстрируют, что стабильность mAb1 при -20°C и -30°C можно увеличивать добавлением по меньшей мере 2% сахарозы.
Пример 3. Стабилизированный состав mAb1
Получали стабилизированный состав, содержащий различные концентрации mAb1, для применения в примерах 4 и 5 ниже. Этот состав, обозначенный "состав A", приведен в таблице 9.
Пример 4. Стабильность состава A после хранения при 5°C
Состав A (см. пример 3), содержащий 25, 50 или 100 мг/мл mAb1 тестировали на стабильность после нескольких месяцев хранения при 5°C в прозрачных флаконах. Стабильность оценивали по следующим параметрам: (a) внешний вид; (b) мутность (OD405 нм); (c) pH; (d) получаемое процентное содержание общего mAb1 (по измерениям посредством ВЭЖХ-ОФ); (d) получаемое процентное содержание нативного mAb1 (по измерениям посредством ЭВЭЖХ); (e) получаемое процентное содержание основного пика mAb1 (по измерениям посредством КОВЭЖХ) и (f) получаемое процентное содержание кислых молекул mAb1 (по измерениям посредством КОВЭЖХ). Результаты анализа стабильности для состава A, содержащего 25, 50 и 100 мг/мл mAb1, обобщены в таблицах 10, 11 и 12, соответственно.
Результаты этого примера демонстрируют, что состав A, содержащий 25, 50 или 100 мг/мл mAb1, оставался стабильным в течение по меньшей мере 9 месяцев хранения при 5°C в прозрачных флаконах, приблизительно с 97% или более нативного mAb1, остающегося во всех образцах после 9 месяцев хранения в этих условиях. Для составов с 50 и 100 мг/мл, 96,9% и 96,5% нативного mAb1, соответственно, детектировали после периода хранения при 5°C до 24 месяцев. Кроме того, процентное содержание кислых молекулы оставались на уровне 29% или менее во все анализируемые моменты времени, таким образом, подтверждая стабильность составов.
Подобные исследования стабильности также проводили с использованием состава A, содержащего 75 мг/мл mAb1, после хранения при 2-8°C. Ни для какой тестируемой концентрации после хранения в течение 24 месяцев при 2-8°C, как определяли посредством ЭВЭЖХ и КОВЭЖХ значимого разрушения не наблюдали (данные не показаны).
Пример 5. Стабильность состава A, производимого в прозрачных флаконах и во флаконах из желтого стекла
Проводили дополнительные эксперименты для сравнения стабильности состава A (см. пример 3), содержащего 25 и 100 мг/мл mAb1, производимого во флаконах из желтого стекла, с тем же составом, производимым в прозрачных флаконах. В этом примере использовали два типа флаконов из желтого стекла: 5 мл и 20 мл флаконы из желтого стекла. Стабильность оценивали после хранение при 5°C, 25°C или 45°C на основе тех же параметров, какие использовали в примере 4. Результаты для составов с 25 мг/мл и 100 мг/мл обобщены в таблицах 13-21.
Как показано в этом примере, состав A, содержащий 25 мг/мл или 100 мг/мл mAb1, при хранении в прозрачных флаконах или флаконах из желтого стекла демонстрировал эквивалентные профили стабильности. Кроме того, как показано в примере 4 для хранения в прозрачных флаконах, в составе A при хранении в прозрачных флаконах или флаконах из желтого стекла при 5°C в течение периода до 12 месяцев сохранялась относительно высокая стабильность mAb1.
Пример 6. Влияние концентраций аргинина, гистидина и сахарозы на вязкость и стабильность составов, содержащих 150 мг/мл mAb1
Получали несколько составов, содержащих 150 мг/мл, 175 мг/мл и 200 мг/мл mAb1 и различные количества гистидина, аргинина и сахарозы. Для каждого состава измеряли вязкость и осмоляльность. Кроме того, оценивали стабильность составов со 150 мг/мл после 4 недель хранения при 45°C в отношении остающегося процентного содержания нативного mAb1 (посредством ЭВЭЖХ) и остающегося процентного содержания главного пика (посредством КОВЭЖХ). Результаты обобщены в таблице 22.
Результаты, представленные в таблице 16, демонстрируют, что увеличение концентрации гистидин до 25 мМ или 100 мМ и добавление в состав аргинина (25 мМ или 50 мМ) значительно снижают вязкость состава по сравнению с составами, содержащими только 10 мМ гистидин и не содержащими аргинин. Кроме того, снижение концентрации сахарозы с 10% до 5% с добавляемыми гистидином и аргинином снижала вязкость состава даже в большей степени.
Основываясь, по меньшей мере частично, на указанном выше, получали указанные ниже в таблице 23 составы (обозначаемые "состав B" и "состав C").
Пример 7. Стабильность состава B, содержащего 150 мг/мл mAb1, при производстве во флаконе и шприцах
Состав B (см. таблицу 23), содержащий 150 мг/мл mAb1, получали в 2 мл стеклянном флаконе и в двух различных шприцах: с обычным и низким содержанием вольфрама. Препараты хранили при 5, 25 и 45°C в течение различных периодов времени. Стабильность mAb1 после хранения измеряли посредством ЭВЭЖХ и КОВЭЖХ. Результаты представлены в таблице 24. (Увеличение процентного содержания кислых молекул соответствует дезаминированию антитела, и, таким образом, его рассматривают как нежелательное явление в отношении фармацевтических составов по настоящему изобретению).
Как показано в этой таблице, состав B, содержащий 150 мг/мл mAb1, хранимый в стеклянном флаконе или шприце при 5°C, оставался относительно стабильным в течение по меньшей мере 3 месяцев.
Пример 8: Стабильность составов mAb1 в предварительно заполненных шприцах
Проводили ряд экспериментов для оценки стабильности различных составов mAb1 в предварительно заполненных шприцах. Для этих экспериментов использовали различные шприцы Люэра и с несъемной иглой с обычным содержанием вольфрама и с низким содержанием вольфрама в комбинации с различными типами плунжеров (покрытых и непокрытых) и концевых колпачков. Составы тестировали на стабильность после хранения в предварительно заполненных шприцах при 45°C, 25°C и 5°C в течение различных периодов времени (в диапазоне от 14 суток до 12 месяцев, в зависимости от тестируемых условий).
В этом примере на стабильность в предварительно заполненных шприцах тестировали шесть различных составов mAb1: (1) состав A (см. таблицу 9), содержащий 100 мг/мл mAb1; (2) состав A (см. таблицу 9), содержащий 25 мг/мл mAb1; (3) состав B (см. таблицу 23), содержащий 150 мг/мл mAb1; (4) состав B (см. таблицу 23), содержащий 25 мг/мл mAb1; (5) состав C (см. таблицу 23), содержащий 175 мг/мл mAb1; и (6) состав C (см. таблицу 23), содержащий 25 мг/мл mAb1.
Стабильность оценивали по следующим параметрам: (a) визуальный анализ; (b) мутность (OD405 нм); (c) получаемое процентное содержание посредством ВЭЖХ-ОФ; (d) процентное содержание нативного mAb1 посредством ЭВЭЖХ; (e) процентное содержание основного пика mAb1 посредством КОВЭЖХ; и (f) процентное содержание кислых молекул посредством КОВЭЖХ.
Результаты характерной экспериментальной оценки стабильности состава A, содержащего 100 мг/мл mAb1, в двух различных шприцах (шприц № 1 и шприц № 2) приведены в таблицах 25 и 26 ниже.
Ниже, в таблицах 27 и 28, приведены результаты другой характерной экспериментальной оценки стабильность состава C, содержащего 175 мг/мл mAb1, в двух различных шприцах (шприц № 1 и шприц № 3).
Результаты этого ряда экспериментов демонстрируют, что различные составы в предварительно заполненных шприцах остаются относительно стабильными, особенно при хранении при температурах от 25°C и ниже, в течение одного месяца или более. Кроме того, выявлено, что различные составы по изобретению обладают улучшенной стабильностью при хранении в шприцах с низким содержанием вольфрама, содержащих покрытые фторуглеродом плунжеры.
Настоящее изобретение не ограничено в объеме конкретными вариантами осуществления, описываемыми в настоящем документе. Фактически, специалистам в данной области на основе указанного выше описания и сопровождающих фигур очевидны различные модификации изобретения в дополнение к описываемому в настоящем документе. Подразумевается, что такие модификации входят в объем приложенной формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СТАБИЛИЗИРОВАННЫЕ ПРЕПАРАТЫ, СОДЕРЖАЩИЕ АНТИТЕЛА ПРОТИВ NGF | 2011 |
|
RU2700174C2 |
| СТАБИЛИЗИРОВАННЫЕ ПРЕПАРАТЫ, СОДЕРЖАЩИЕ АНТИТЕЛА ПРОТИВ NGF | 2019 |
|
RU2728575C1 |
| СОСТАВ АНТИТЕЛА | 2015 |
|
RU2743681C2 |
| Препараты однодоменных антигенсвязывающих молекул | 2013 |
|
RU2683861C2 |
| СОСТАВЫ НА ОСНОВЕ АНТИТЕЛ | 2015 |
|
RU2704611C2 |
| СОСТАВЫ СО СНИЖЕННЫМ ОКИСЛЕНИЕМ | 2014 |
|
RU2707092C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО СИНУСИТА С ПОЛИПАМИ НОСА ПУТЕМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2015 |
|
RU2734490C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ АСТМЫ ПОСРЕДСТВОМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2015 |
|
RU2713406C2 |
| СОСТАВЫ СО СНИЖЕННЫМ ОКИСЛЕНИЕМ | 2014 |
|
RU2707550C2 |
| СОСТАВЫ, СОДЕРЖАЩИЕ АНТИТЕЛА | 2009 |
|
RU2563179C2 |


























Группа изобретений относится к области фармацевтики и касается фармацевтических стабильных составов, содержащих антитело человека, специфически связывающееся с рецептором интерлейкина 6 человека (hIL-6R), где указанное антитело человека, содержится в концентрации от 5 до 200 мг/мл и включает вариабельную область тяжелой цепи с аминокислотной последовательностью SEQ ID NO:18 и вариабельную область легкой цепи с аминокислотной последовательностью SEQ ID NO:26, гистидин, аргинин, сахарозу, полисорбат. Группа изобретений обеспечивает значительную степень стабильности антитела после хранения в течение нескольких месяцев. 3 н. и 19 з.п. ф-лы, 8 пр., 28 табл., 4 ил.
1. Фармацевтический стабильный состав, содержащий:
(i) антитело человека, специфически связывающееся с рецептором интерлейкина 6 человека (hIL-6R), где указанное антитело человека, содержится в концентрации от 5 до 200 мг/мл и включает вариабельную область тяжелой цепи (HCVR) с аминокислотной последовательностью SEQ ID NО:18 и вариабельную область легкой цепи (LCVR) с аминокислотной последовательностью SEQ ID NO:26;
(ii) гистидин в концентрации от 25 мМ до 100 мМ;
(iii) аргинин в концентрации от 25 мМ до 50 мМ;
(iv) сахароза в количестве от 2% до 10% масс./об. и
(v) полисорбат в количестве от 0,1% до 0,2% масс./об.
2. Фармацевтический состав по п. 1, где гистидин содержится в концентрации приблизительно 25 мМ.
3. Фармацевтический состав по п. 1, где аргинин содержится в концентрации 50 мМ.
4. Фармацевтический состав по п. 1, в котором сахароза присутствует в количестве 5% масс./об.
5. Фармацевтический состав по п. 1, где полисорбат содержится в количестве 0,2% масс./об.
6. Фармацевтический состав по п. 1, где pH состава равен 6.
7. Фармацевтический состав по п. 1, содержащий: от 25 до 200 мг/мл указанного антитела человека, специфически связывающегося с hIL-6R.
8. Фармацевтический состав по п. 7, содержащий от 50 до 180 мг/мл указанного антитела человека, специфически связывающегося с hIL-6R.
9. Фармацевтический состав по п. 8, содержащий 150 мг/мл указанного антитела человека, специфически связывающегося с hIL-6R.
10. Фармацевтический состав по п. 8, содержащий 175 мг/мл указанного антитела человека, специфически связывающегося с hIL-6R.
11. Фармацевтический состав по п. 10, где получают по меньшей мере 90% нативной формы указанного антитела после девяти месяцев хранения при 5°C, как определяют посредством эксклюзионной высокоэффективной жидкостной хроматографии (ЭВЭЖХ).
12. Фармацевтический состав п. 11, где получают по меньшей мере 95% нативной формы указанного антитела после девяти месяцев хранения при 5°C, как определяют посредством эксклюзионной высокоэффективной жидкостной хроматографии (ЭВЭЖХ).
13. Фармацевтический состав п. 12, где получают по меньшей мере 96% нативной формы указанного антитела после девяти месяцев хранения при 5°C, как определяют посредством эксклюзионной высокоэффективной жидкостной хроматографии (ЭВЭЖХ).
14. Фармацевтический состав по п. 1, где состав содержится в стеклянном флаконе.
15. Фармацевтический состав по п. 1, где состав содержится в шприце.
16. Фармацевтический состав по п. 1, где состав содержится в микроинфузоре.
17. Фармацевтический состав по п. 15, где указанный шприц содержит покрытый фторуглеродом плунжер.
18. Фармацевтический состав по п. 15, где указанный шприц представляет собой шприц с низким содержанием вольфрама.
19. Фармацевтический стабильный состав, содержащий: (i) от 5 до 200 мг/мл антитела человека, специфически связывающегося с рецептором интерлейкина 6 человека (hIL-6R); где указанное антитело включает вариабельную область тяжелой цепи (HCVR) с аминокислотной последовательностью SEQ ID NO: 18 и вариабельную область легкой цепи (LCVR) с аминокислотной последовательностью SEQ ID NO: 26;
(ii) гистидин в концентрации 25 мМ;
(iii) сахарозу в количестве от 5% масс./об.;
(iv) полисорбат 20 в количестве 0,2% масс./об.;
(v) аргинин в количестве 50 мМ.
20. Фармацевтический стабильный состав, содержащий: (i) 175 мг/мл антитела человека, специфически связывающегося с рецептором интерлейкина 6 человека (hIL-6R), где указанное антитело содержит пару аминокислотных последовательностей вариабельных областей тяжелой цепи и легкой цепи (HCVR/LCVR) SEQ ID NO: 18/26; (ii) 25 мМ гистидина; (iii) 5% сахарозы; (iv) 0,2% полисорбата 20 и (v) 50 мМ аргинина.
21. Фармацевтический состав по п. 20, где состав содержится в предварительно заполненном шприце со съемной иглой.
22. Фармацевтический состав по п. 20 или 21, где по меньшей мере 96% нативной формы указанного антитела восстанавливается после двух месяцев хранения при 5°C, как определяют посредством эксклюзионной высокоэффективной жидкостной хроматографии (ЭВЭЖХ).
| US2007280945 A1, 06.12.2007 |
Авторы
Даты
2015-06-27—Публикация
2011-01-07—Подача