ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет предварительной заявки США № 61/780845, зарегистрированной 13 марта 2013 года, и предварительной заявки США № 61/909813, зарегистрированной 27 ноября 2013 года, каждая из которых, таким образом, включена в качестве ссылки полностью.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0002] Настоящее изобретение относится к жидким составам, содержащим белок и дополнительно содержащим соединение, которое предотвращает окисление указанного белка, способы получения и применения жидких составов, а также способы скрининга соединений, которые предотвращают окисление белка в белковых композициях.
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
[0003] Окислительная деградация аминокислотных остатков является широко наблюдаемым явлением в белковых фармацевтических препаратах. Ряд аминокислотных остатков подвержены окислению, конкретно метионин (Met), цистеин (Cys), гистидин (His), триптофан (Trp) и тирозин (Tyr) (Li et al., Biotechnology and Bioengineering 48:490-500 (1995)). Окисление, как правило, наблюдают, когда белок подвергается воздействию пероксида водорода, света, ионов металлов или их комбинации во время разнообразных этапов обработки (Li et al., Biotechnology and Bioengineering 48:490-500 (1995)). Конкретно, белки, подверженные воздействию света (Wei, et al., Analytical Chemistry 79(7):2797-2805 (2007)), AAPH или реагентам Фентона (Ji et al., J Pharm Sci 98(12):4485-500 (2009)) продемонстрировали повышенные уровни окисления на остатках триптофана, тогда как подверженные воздействию пероксида водорода они, как правило, демонстрировали только окисление метионина (Ji et al., J Pharm Sci 98(12):4485-500 (2009)). Воздействие света может привести к окислению белка посредством образования активных форм кислорода (ROS), включая атомарный кислород, пероксид водорода и супероксид (Li et al., Biotechnology and Bioengineering 48:490-500 (1995); Wei, et al., Analytical Chemistry 79(7):2797-2805 (2007); Ji et al., J Pharm Sci 98(12):4485-500 (2009); Frokjaer et al., Nat Rev Drug Discov 4(4):298-306 (2005)), тогда как окисление белка, как правило, происходит посредством гидроксильных радикалов в опосредованной реакции Фентона (Prousek et al., Pure and Applied Chemistry 79(12):2325-2338 (2007)) и посредством алкоксильных пероксидов в AAPH опосредованной реакции (Werber et al., J Pharm Sci 100(8):3307-15 (2011)). Окисление триптофана приводит к большому количеству продуктов окисления, включая гидрокситриптофан, кинуренин и N-формилкинуренин, и имеет потенциал влиять на безопасность и эффективность (Li et al., Biotechnology and Bioengineering 48:490-500 (1995); Ji et al., J Pharm Sci 98(12):4485-500 (2009); Frokjaer et al., Nat Rev Drug Discov 4(4):298-306 (2005)). Сообщалось об окислении конкретного остатка триптофана в тяжелой цепи, определяющей комплементарную область (CDR) моноклонального антитела, которое коррелирует с потерей биологической функции (Wei, et al., Analytical Chemistry 79(7):2797-2805 (2007)). Недавно сообщалось об окислении Trp, опосредованном ионом металла, скоординированным с гистидином, для Fab молекулы (Lam et al., Pharm Res 28(10):2543-55 (2011)). Автоокисление полисорбата 20 в составе Fab, ведущее к образованию различных пероксидов, также было процитировано в том же докладе. Образование, вызванное автоокислением этих пероксидов, также может привести к окислению метионина в белке во время длительного хранения лекарственного продукта, ввиду того что остатки Met в белках, как предполагают, действуют в качестве внутренних антиоксидантов (Levine et al., Proceedings of the National Academy of Sciences of the United States of America 93(26):15036-15040 (1996)) и легко окисляются пероксидами. Окисление аминокислотных остатков имеет потенциал влиять на биологическую активность белка. Это может быть особенно верным для моноклональных антител (mAb). Окисление метионина в Met254 и в Met430 в IgG1 mAb потенциально влияет на время полувыведения из сыворотки у трансгенных мышей (Wang et al., Molecular Immunology 48(6-7):860-866 (2011)) и также влияет на связывание IgG1 человека с FcRn и Fc-гамма рецепторами (Bertolotti-Ciarlet et al., Molecular Immunology 46(8-9)1878-82 (2009)).
[0004] Стабильность белков, особенно в жидком состоянии, нуждается в оценке во время производства и хранения лекарственного продукта. Разработка фармацевтических составов иногда включает добавление антиоксидантов, чтобы предотвратить окисление активного ингредиента. Добавление L-метионина к составам вызывает уменьшение окисления остатка метионина в белках и пептидах (Ji et al., J Pharm Sci 98(12):4485-500 (2009); Lam et al., Journal of Pharmaceutical Sciences 86(11):1250-1255 (1997)). Подобным образом, добавление L-триптофана продемонстрировало уменьшение окисления остатков триптофана (Ji et al., J Pharm Sci 98(12):4485-500 (2009); Lam et al., Pharm Res 28(10):2543-55 (2011)). L-Trp, однако, обладает сильной абсорбцией в УФ области (260-290 нм), делая его главной мишенью во время фотоокисления (Creed, D., Photochemistry and Photobiology 39(4):537-562 (1984)). Было сделано предположение, что Trp как эндогенный фотосенсибилизатор, усиливающий зависящее от кислорода фотоокисление тирозина (Babu et al., Indian J Biochem Biophys 29(3):296-8 (1992)) и других аминокислот (Bent et al., Journal of the American Chemical Society 97(10):2612-2619 (1975)). Было продемонстрировано, что L-Trp может образовывать пероксид водорода под воздействием света и что L-Trp под УФ лучами производит пероксид водорода через супероксид анион (McCormick et al., Science 191(4226):468-9 (1976); Wentworth et al., Science 293(5536):1806-11 (2001); McCormick et al., Journal of the American Chemical Society 100:312-313 (1978)). Дополнительно, триптофан, как известно, образует атомарный кислород под воздействием света (Davies, M.J., Biochem Biophys Res Commun 305(3):761-70 (2003)). Сходным образом с окислением белка, вызванным автоокислением полисорбата 20, возможно, что окисление белка может произойти при образовании ROS посредством других эксципиентов в белковом составе (например, L-Trp) при нормальном режиме работы.
[0005] Очевидно, что последние исследования о том, что добавление стандартных эксципиентов, таких как L-Trp и полисорбаты, к белковым композициям, которые предназначены стабилизировать белок, может вызвать неожиданные и нежелательные последствия, такие как окисление белка, вызванное ROS. Поэтому остается необходимость в идентификации альтернативных эксципиентов для применения в белковых композициях и разработке таких композиций.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0006] Приводимые в данном документе составы, содержащие белок и соединение, которое предотвращает окисление белка в составе, способы создания составов и способы скрининга соединений, которые предотвращают окисление белка в белковой композиции.
[0007] В одном из аспектов, приводимый в данном документе состав, содержащий белок и соединение, которое предотвращает окисление белка в жидком составе, где соединение выбрано из группы, состоящей из 5-гидрокси-триптофана, 5-гидрокси индола, 7-гидрокси индола и серотонина.
[0008] В некоторых вариантах осуществления, жидкий состав является фармацевтическим составом, пригодным для введения индивидууму. В некоторых вариантах осуществления, состав является водным.
[0009] В некоторых вариантах осуществления, соединение, которое предотвращает окисление белка, в составе составляет от приблизительно 0,3 мМ до приблизительно 10 мМ, или до высшей концентрации, при которой соединение является растворимым в составе. В некоторых вариантах осуществления, соединение, которое предотвращает окисление белка, в составе составляет от приблизительно 0,3 мМ до приблизительно 9 мМ, от приблизительно 0,3 мМ до приблизительно 8 мМ, от приблизительно 0,3 мМ до приблизительно 7 мМ, от приблизительно 0,3 мМ до приблизительно 6 мМ, от приблизительно 0,3 мМ до приблизительно 5 мМ, от приблизительно 0,3 мМ до приблизительно 4 мМ, от приблизительно 0,3 мМ до приблизительно 3 мМ, от приблизительно 0,3 мМ до приблизительно 2 мМ, от приблизительно 0,5 мМ до приблизительно 2 мМ, от приблизительно 0,6 мМ до приблизительно 1,5 мМ, или от приблизительно 0,8 мМ до приблизительно 1,25 мМ. В некоторых вариантах осуществления, в составе составляет от приблизительно 0,3 мМ до приблизительно 5 мМ. В некоторых вариантах осуществления, соединение, которое предотвращает окисление белка, в составе составляет от приблизительно 0,3 мМ до приблизительно 1 мМ. В некоторых вариантах осуществления, соединение, которое предотвращает окисление белка, в составе составляет приблизительно 1 мМ. В некоторых вариантах осуществления, соединение предотвращает окисление триптофана и/или метионина в белке. В некоторых вариантах осуществления, соединение предотвращает окисление белка посредством активных форм кислорода. В некоторых вариантах осуществления, активные формы кислорода выбраны из группы, состоящей из атомарного кислорода, супероксида (O2-), пероксида водорода, гидроксильного радикала и алкил пероксида.
[0010] В некоторых вариантах осуществления белок является подверженным окислению. В некоторых вариантах осуществления, триптофан в белке является подверженной окислению. В некоторых вариантах осуществления, белок является антителом (например, поликлональным антителом, моноклональным антителом, гуманизированным антителом, антителом человека, химерным антителом или фрагментом антитела). В некоторых вариантах осуществления, концентрация белка в составе составляет от приблизительно 1 мг/мл до приблизительно 250 мг/мл.
[0011] В некоторых вариантах осуществления состав дополнительно содержит один или несколько эксципиентов, выбранных из группы, состоящей из стабилизатора, буфера, поверхностно-активного вещества и средства придания тоничности. В некоторых вариантах осуществления, состав имеет pH от приблизительно 4,5 до приблизительно 7,0.
[0012] В другом аспекте приводимый в данном документе способ создания жидкого состава, содержащий добавление количества соединения, которое предотвращает окисление белка, к жидкому составу, где соединение выбрано из группы, состоящей из 5-гидрокси-триптофана, 5-гидрокси индола, 7-гидрокси индола и серотонина. В другом аспекте представленный в данном документе способ предотвращения окисления белка в жидком составе, содержащий добавление количества соединения, которое предотвращает окисление белка, к жидкому составу, где соединение выбрано из группы, состоящей из 5-гидрокси-триптофана, 5-гидрокси индола, 7-гидрокси индола и серотонина.
[0013] В некоторых вариантах осуществления способов, описываемых в настоящем документе, состав является фармацевтическим составом, пригодным для введения индивидууму. В некоторых вариантах осуществления, состав является водным.
[0014] В некоторых вариантах осуществления способов, описываемых в настоящем документе, соединение в составе составляет от приблизительно 0,3 мМ до приблизительно 10 мМ, или до высшей концентрации, при которой соединение является растворимым в составе. В некоторых вариантах осуществления, соединение в составе находится в концентрации от приблизительно 0,3 мМ до приблизительно 9 мМ, от приблизительно 0,3 мМ до приблизительно 8 мМ, от приблизительно 0,3 мМ до приблизительно 7 мМ, от приблизительно 0,3 мМ до приблизительно 6 мМ, от приблизительно 0,3 мМ до приблизительно 5 мМ, от приблизительно 0,3 мМ до приблизительно 4 мМ, от приблизительно 0,3 мМ до приблизительно 3 мМ, от приблизительно 0,3 мМ до приблизительно 2 мМ, от приблизительно 0,5 мМ до приблизительно 2 мМ, от приблизительно 0,6 мМ до приблизительно 1,5 мМ, или от приблизительно 0,8 мМ до приблизительно 1,25 мМ. В некоторых вариантах осуществления, соединение в составе составляет от приблизительно 0,3 мМ до приблизительно 1 мМ. В некоторых вариантах осуществления, соединение в составе составляет от приблизительно 0,3 мМ до приблизительно 5 мМ. В некоторых вариантах осуществления, соединение в составе составляет от приблизительно 1 мМ. В некоторых вариантах осуществления, соединение предотвращает окисление триптофана и/или метионина в белке. В некоторых вариантах осуществления, соединение предотвращает окисление белка посредством активных форм кислорода. В некоторых вариантах осуществления, активные формы кислорода выбраны из группы, состоящей из атомарного кислорода, супероксида (O2-), пероксида водорода, гидроксильного радикала и алкил пероксида.
[0015] В некоторых вариантах осуществления белок является подверженным окислению. В некоторых вариантах осуществления, триптофан в белке является подверженным окислению. В некоторых вариантах осуществления, белок является антителом (например, поликлональным антителом, моноклональным антителом, гуманизированным антителом, антителом человека, химерным антителом или фрагментом антитела). В некоторых вариантах осуществления, концентрация белка в составе составляет от приблизительно 1 мг/мл до приблизительно 250 мг/мл.
[0016] В некоторых вариантах осуществления один или несколько эксципиентов, выбранных из группы, состоящей из стабилизатора, буфера, поверхностно-активного вещества и средства придания тоничности. В некоторых вариантах осуществления, состав имеет pH от приблизительно 4,5 до приблизительно 7,0.
[0017] В другом аспекте приводимый в данном документе способ скрининга соединения, которое предотвращает окисление белка в белковой композиции, содержащий выбор соединения, которое обладает более низким окислительным потенциалом и меньшей фоточувствительностью по сравнению с L-триптофаном, и тестирование эффекта выбранного соединения на предотвращение окисления белка.
[0018] В некоторых вариантах осуществления, фоточувствительность измеряют на основе определенного количества H2O2, произведенного посредством соединения при воздействии света. В некоторых вариантах осуществления, выбирают соединение, которое производит менее чем приблизительно 20% определенного количества H2O2, образованного L-триптофаном. В некоторых вариантах осуществления, окислительный потенциал измеряют посредством циклической вольтамметрии. В некоторых вариантах осуществления, выбранное соединение тестируют на предмет эффекта на предотвращение окисления белка посредством активных форм кислорода, образованных посредством 2,2'-азобис(2-амидинопропан) дигидрохлорида (AAPH), света и/или реагента Фентона.
[0019] Следует понимать, что одно, несколько или все качества различных вариантов осуществления, описываемые в настоящем документе, можно комбинировать, чтобы образовать другие варианты осуществления по настоящему изобретению. Эти и другие аспекты изобретения станут очевидными специалисту в данной области. Эти и другие варианты осуществления по изобретению дополнительно описаны посредством подробного описания, которое следует далее.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
[0020] На фигуре 1 представлена серия графиков, демонстрирующих окисление A) Fab в mAb1, и B) Fc в mAb1 после восьми часов воздействия света при 250 Вт/м2. mAb1 присутствовал в концентрации 5 мг/мл в 20 мМ гистидин ацетате, 250 мМ трегалозе, 0,02% полисорбате 20. Все флаконы помещали в лайтбокс за исключением mAb1 Ref Mat. Флаконы CTRL были завернуты в фольгу до помещения в лайтбокс. Три отдельные экспериментальные флаконы были усреднены для каждого образца, за исключением «10 мМ Met, 1 мМ Trp» (*), который был средним двух экспериментальных флаконов, и mAb1 Ref Mat был одним экспериментальным флаконом с тремя независимыми инъекциями на ВЭЖХ. Величины ошибок представляют одно стандартное отклонение.
[0021] На фигуре 2 представлен график, демонстрирующий дозозависимое образование H2O2 L-Trp. Ромбы обозначают L-Trp в отдельности; треугольники обозначают L-Trp + SOD; круги и квадраты обозначают L-Trp + NaN3 ± SOD. Все исследования проводили в 20 мМ L-His HCl, pH 5,5.
[0022] На фигуре 3 представлена серия графиков, демонстрирующих A) получение пероксида водорода (H2O2) в 50 мг/мл составах mAb1, содержащих 3,2 мМ L-Trp при воздействии естественного освещения в течение 1, 3 и 7 дней и B) процент (%)окисления Fab в составах mAb1, содержащих 3,2 мМ L-Trp после 10 дней воздействия естественного освещения.
[0023] На фигуре 4 представлена серия графиков, демонстрирующие образование пероксида водорода производными триптофана и производными индола при световом стрессе в течение 4 часов при 250 Вт/м2. A) Скрининг производных триптофана (1 мМ) для образования пероксида водорода (мкМ) в 20 мМ составе HisAc pH5,5. B) Скрининг производных индола (1 мМ) для образования пероксида водорода (мкМ) в 20 мМ составе HisAc pH5,5.
[0024] На фигуре 5 представлен график, демонстрирующий эффект NaN3 на получение H2O2 различными производными Trp при воздействии света. Данные представлены в виде соотношения с учетом пероксида, образованного L-Trp.
[0025] На фигуре 6 представлен график, демонстрирующий корреляцию между окислительным потенциалом и индуцированным светом образованием пероксида. Заключенная в прямоугольник область демонстрирует вероятные антиоксидантные соединения.
[0026] На фигуре 7 представлена серия графиков, демонстрирующих окисление A) Fab в mAb1, и B) Fc в mAb1 после инкубации AAPH. Все образцы инкубировали с AAPH кроме mAb1 Ref Mat и No AAPH. Все образцы инкубировали при 40°C кроме mAb1 Ref Mat. Представленные данные являются средними из трех экспериментальных образцов ± 1SD, кроме mAb1 Ref Mat, который является средним из шести ВЭЖХ инъекций без величины ошибок.
[0027] На фигуре 8 представлена серия графиков, демонстрирующих окисление A) Fab в mAb1, и B) Fc в mAb1 после шестнадцати часов воздействия света при 250 Вт/м2. Все флаконы помещали в лайтбокс, кроме mAb1 Ref Mat. Foil CTRL флаконы покрывали фольгой перед помещением в лайтбокс. Три отдельные экспериментальные флаконы были усреднены для каждого образца, кроме L-триптофанамида (*), который был средним двух экспериментальных флаконов, и mAb1 Ref Mat, который был одним флаконом с тремя независимыми инъекциями на ВЭЖХ. Величины ошибок представляют одно стандартное отклонение.
[0028] На фигуре 9 представлена серия графиков, демонстрирующих окисление A) Fab в 3 мг/мл mAb1, и B) Fc в 3 мг/мл mAb1 после реакции Фентона с применением 10 ч/млн H2O2 и 0,2 мМ Fe(III). Реакция проводили при 40°C в течение 3 часов, с погашением посредствием 100 мМ L-Met и анализировали с применением ОФ-ВЭЖХ после папаинового гидролизата. Все образцы являются средними от трех отдельных флаконов, и mAb1 контроль (Ref Mat) был одним флаконом с пятью независимыми инъекциями на ВЭЖХ. Величины ошибок представляют одно стандартное отклонение.
[0029] На фигуре 10 представлена серия диаграмм, демонстрирующих гипотетический механизм возбуждения A) L-Trp и B) 5-гидрокси-L-триптофана и при образовании, и при гашении 1O2. k25C представляет второй порядок константы скорости для гашения 1O2 (Dad et al., J Photochem Photobiol B, 78(3):245-51 (2005)) в то время как Eox является окислительным потенциалом молекулы против Ag/AgCl.
ПОДРОБНОЕ ОПИСАНИЕ
I. Определения.
[0030] Перед подробным описанием изобретения следует понимать, что настоящее изобретение не ограничено конкретными композициями или биологическими системами, которые несомненно могут варьировать. Также следует понимать, что терминология, применяемая в настоящем документе, предназначена только для целей описания конкретных вариантов осуществления, и не предназначена быть ограничивающей.
[0031] Термин “фармацевтический состав” относится к препарату, который находится в такой форме, которая позволяет биологической активности активного ингредиента быть эффективной, и которая не содержит дополнительных компонентов, которые являются неприемлемо токсичными для индивидуума, которому состав следовало бы ввести. Такие составы являются стерильными.
[0032] “Стерильный” состав является асептическим или свободным или существенно свободным от всех живых микроорганизмов и их спор.
[0033] “Стабильным” составом является такой, в котором находящийся там белок существенно сохраняет свою физическую стабильность и/или химическую стабильность и/или биологическую активность при хранении. Предпочтительно, состав существенно сохраняет свою физическую и химическую стабильность, а также свою биологическую активность при хранении. Период хранения, как правило, выбирают на основе предполагаемого срока годности состава. Различные аналитические методы для измерения стабильности белка являются доступными в данной области и описаны, например, в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991) и Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993). Стабильность можно измерять при выбранном количестве светового воздействия и/или температуре в течение выбранного периода времени. Стабильность можно оценивать качественно и/или количественно всевозможными способами, включая оценку образования агрегата (например, применение эксклюзионной хроматографии, посредством измерения мутности, и/или посредством визуального осмотра); оценка образования ROS (например, с применением анализа стресса от света или от 2,2'-азобис(2-амидинопропана) дигидрохлорида (AAPH)); окисления специфических аминокислотных остатков белка (например, остатка Trp и/или остатка Met моноклонального антитела); посредством оценки гетерогенности заряда с применением катионообменной хроматографии, капиллярного изоэлектрофокусирования (icIEF) или капиллярного зонного электрофореза; анализ концевой амино- или концевой карбокси-последовательности; масс-спектрометрический анализ; анализ SDS-PAGE для сравнения пониженного и интактного антитела; анализ пептидной карты (например, триптической или LYS-C); оценка биологической активности или таргетной связывающей функции белка (например, функции связывания антигена антителом); и т.д. Нестабильность может включать любое одно или несколько из: аггрегации, деамидирования (например, деамидирование Asn), окисления (например, окисление Met и/или окисление Trp), изомеризации (например, изомеризацию Asp), клипирования/гидролиза/фрагментации (например, фрагментации шарнирной области), образования сукцинимида, непарного цистеина(ов), N-концевого расширения, C-концевого процессинга, различий гликозилирования и т.д.
[0034] Белок “сохраняет свою физическую стабильность” в фармацевтическом составе, если он не демонстрирует никаких признаков или очень небольшую аггрегацию, осаждение и/или денатурацию при визуальном осмотре цвета и/или прозрачности, или измерении посредством УФ светорассеяния или посредством эксклюзионной хроматографии.
[0035] Белок “сохраняет свою химическую стабильность” в фармацевтическом составе, если химическая стабильность в данное время является таковой, что белок, как считают, все еще сохраняет свою биологическую активность, как определено ниже. Химическую стабильность можно оценивать посредством детекции и количественного измерения химически измененных форм белка. Химическое изменение может включать окисление белка, которое можно оценивать с применением, например, триптического пептидного картирования, обращенно-фазовой жидкостной хроматографии высокого разрешения (ВЭЖХ) и жидкостной хроматографии с масс-спектрометрией (LC/MS). Другие типы химического изменения включают изменения заряда белка, которое можно оценивать, например, посредством ионообменной хроматографии или icIEF.
[0036] Белок “сохраняет свою биологическую активность” в фармацевтическом составе, если биологическая активность белка в данное время находится в пределах приблизительно 10% (в пределах ошибок анализа) биологической активности, демонстрируемой в то время, как фармацевтический состав получали как определено, например, в анализе связывания антигена для моноклонального антитела.
[0037] Как применяют в настоящем документе, “биологическая активность” белка относится к способности белка связываться с его мишенью, например, способность моноклонального антитела связываться с антигеном. Он может дополнительно включать биологический ответ, который можно измерять in vitro или in vivo. Такая активность может антагонистической или агонистической.
[0038] Белок, который “подвержен окислению”, является таким, который содержит один или несколько остатков, которые, как было выявлено, склонны к окислению в качестве неограничивающих примеров такие, как метионин (Met), цистеин (Cys), гистидин (His), триптофан (Trp), и тирозин (Tyr). Например, аминокислота триптофан Fab части моноклонального антитела или аминокислота метионин в Fc части моноклонального антитела могут быть подвержены окислению.
[0039] Под “изотоническим” понимают, что состав, представляющий интерес, обладает тем же осмотическим давлением, что и кровь человека. Изотонические составы, как правило, имеют осмотическое давление от приблизительно 250 до 350 мОсм. Изотоничность можно измерять, например, с применением осмометра давления пара или типа заморозки льда.
[0040] Как применяют в настоящем документе, “буфер” относится к буферному раствору, который является устойчивым к изменению в pH посредством действия своих компонентов, представляющих кислотно-основные конъюгаты. Буфер по настоящему изобретению предпочтительно имеет pH в диапазоне от приблизительно 4,5 до приблизительно 8,0. Например, гистидин ацетат является примером буфера, который контролирует pH в этом диапазоне.
[0041] “Консервант” является соединением, которое необязательно может быть включено в состав, чтобы существенно уменьшить его бактериальное действие, таким образом, например, облегчая получение универсального состава. Примеры потенциальных консервантов включают октадецилдиметилбензил хлорид аммония, гексаметониум хлорид, хлорид бензалкония (смесь алкилбензилдиметилхлоридов аммония, в которых алкильные группы являются длинноцепочечными соединениями) и хлорид бензетония. Другие типы консервантов включают ароматические спирты, такие как фенол, бутил и бензиловый спирт, алкил парабены, такие как метил или пропил парабен, катехол, резорцин, циклогексанол, 3-пентанол и m-крезол. В одном из вариантов осуществления, консервант в данном документе является бензиловым спиртом.
[0042] Как применяют в настоящем документе, “поверхностно-активное вещество” относится к поверхностно-активному средству, предпочтительно неионному поверхностно-активному веществу. Примеры поверхностно-активных веществ в настоящем документе включают полисорбат (например, полисорбат 20 и полисорбат 80); полоксамер (например, полоксамер 188); тритон; додецилсульфат натрия (SDS); лаурел сульфат натрия; октил гликозид натрия; лаурил-, миристил-, линолеил- или стеарил-сульфобетаин; лаурил-, миристил-, линолеил- или стеарил-саркозин; линолеил-, миристил-, или сэтил-бетаин; лауроамидопропил-, кокамидопропил-, линолеамидопропил-, миристамидопропил-, пальмидопропил-, или изостеарамидопропил-бетаин (например, лауроамидопропил); миристамидопропил-, пальмидопропил-, или изостеарамидопропил-диметиламин; натрия метил кокоил-, или динатрия метил олеил-таурат; и серия MONAQUAT™ (Mona Industries, Inc., Paterson, N.J.); полиэтил гликоль, полипропил гликоль, и сополимеры этилена и пропиленгликоля (например, Плюроники, PF68 и т.д.); и т.д. В одном из вариантов осуществления поверхностно-активное вещество в настоящем документе является полисорбатом 20.
[0043] “Фармацевтически приемлемые” эксципиенты или носители, как применяют в настоящем документе, включают фармацевтически приемлемые носители, стабилизаторы, буферы, кислоты, основания, сахара, консерванты, поверхностно-активные вещества, средства придания тоничности и т.п., которые хорошо известны в данной области (Remington: The Science and Practice of Pharmacy, 22nd Ed., Pharmaceutical Press, 2012). Примеры фармацевтически приемлемых эксципиентов включают буферы, такие как фосфат, цитрат, ацетат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту, L-триптофан и метионин; полипептиды с низкой молекулярной массой (менее чем приблизительно 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды, и другие углеводы, включая глюкозу, маннозу или декстрины; комплексные соединения с металлами, такие как комплексы Zn-белок; хелатирующие средства, такие как EDTA; сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионные поверхностно-активные вещества, такие как полисорбат, полоксамер, полиэтиленгликоль (PEG) и ПЛЮРОНИКИ™. “Фармацевтически приемлемыми” эксципиентами или носителями являются такие, которые могут обоснованно быть введены индивидууму, чтобы обеспечить эффективную дозу применяемого активного ингредиента и которые являются нетоксичными для индивидуума при воздействии в применяемых дозах и концентрациях.
[0044] Белок, который формулируют, является предпочтительно существенно чистым и предпочтительно существенно однородным (например, свободным от загрязняющих белков и т.д.). “Существенно чистый” белок означает композицию, содержащую по меньшей мере приблизительно 90% по массе белка (например, моноклональное антитело), на основе общей массы композиции, предпочтительно, по меньшей мере, приблизительно 95% по массе. “Существенно однородный” белок означает композицию, содержащую по меньшей мере приблизительно 99% по массе белка (например, моноклональное антитело), на основе общей массы композиции.
[0045] Термины “белок”, “полипептид” и “пептид” используют взаимозаменяемо в настоящем документе по отношению к полимерам аминокислот любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированными аминокислоты, и он может быть прерван посредством неаминокислот. Термины также охватывают полимер аминокислот, который был модифицирован естественным образом или посредством вмешательства; например, образования дисульфидной связи, гликозилирования, липидизации, ацетилирования, фосфорилирования или любой другой манипуляции или модификации, такой как конъюгация с меченым компонентом. В это определение также включены, например, белки, содержащие один или несколько аналогов аминокислоты (включая, например, ненатуральные аминокислоты и т.д.), а также другие модификации, известные в данной области. Примеры белков, охваченных этим определением в настоящем документе, включают белки млекопитающих, такие как, например, ренин; гормон роста, включая гормон роста человека и гормон роста быка; рилизинг-фактор гормона роста; паратиреоидный гормон; тиреотропный гормон; липопротеины; альфа-1-антитрипсин; инсулин A-цепь; инсулин B-цепь; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; лептин; факторы свертывания, такие как фактор VIIIC, фактор IX, тканевой фактор и фактор Виллебранда; противосвертывающие факторы, такие как белок C; атриальный натрийуретический фактор; сурфактант легких; активатор плазминогена, такой как урокиназа или мочевина человека или активатор тканевого плазминогена (t-PA); бомбезин; тромбин; гемопоэтический фактор роста; фактор некроза опухоли-альфа и -бета; рецептор фактора некроза опухоли, такой как рецептор смерти 5 и CD120; ФНО-связанный апоптоз-индуцирующий лиганд (TRAIL); антиген созревания B-клеток (BCMA); стимулятор B-лимфоцитов (BLyS); лиганд, индуцирующий пролиферацию (APRIL); энкефалиназа; RANTES (хемокин, экспрессируемый и секретируемый Т-клетками при активации); макрофагальный воспалительный белок человека (MIP-1-альфа); сывороточный альбумин, такой как сывороточный альбумин человека; мюллерова ингибирующая субстанция; A-цепь релаксина; B-цепь релаксина; прорелаксин; пептид мыши, связанный с гонадотропином; микробный белок, такой как бета-лактамаза; ДНКаза; IgE; антиген цитотоксических T-лимфоцитов (CTLA), такой как CTLA-4; ингибин; активин; фактор роста эндотелиальных клеток, выделяемый тромбоцитами (PD-ECGF); белок семейства факторов роста эндотелия сосудов (например, VEGF-A, VEGF-B, VEGF-C, VEGF-D и P1GF); белок семейства факторов роста тромбоцитов (PDGF) (например, PDGF-A, PDGF-B, PDGF-C, PDGF-D и их димеры); белок семейства факторов роста фибробластов (FGF), такой как aFGF, bFGF, FGF4 и FGF9; эпидермальный фактор роста (EGF); рецепторы для гормонов или факторов роста, таких как рецептор(ы) VEGF (например, VEGFR1, VEGFR2 и VEGFR3), рецептор(ы) эпидермального фактора роста (EGF) (например, рецептор ErbB1, ErbB2, ErbB3 и ErbB4), рецептор(ы) фактора роста тромбоцитов (PDGF) (например, PDGFR-α и PDGFR-β), и рецептор(ы) фактора роста фибробластов; лиганды TIE (ангиопоэтины, ANGPT1, ANGPT2); рецептор ангиопоэтина, такой как TIE1 и TIE2; белок A или D; ревматоидные факторы; нейротрофический фактор, такой как костный нейротрофический фактор (BDNF), нейротрофин-3, -4, -5, или -6 (NT-3, NT-4, NT-5, или NT-6), или фактор роста нервов, такой как NGF-b; трансформирующий фактор роста (TGF), такой как TGF-альфа и TGF-бета, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобный фактор роста-I и -II (IGF-I и IGF-II); дес(1-3)-IGF-I (мозговой IGF-I), белки, связывающие инсулиноподобные факторы роста (IGFBP); CD белки, такие как CD3, CD4, CD8, CD19 и CD20; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; морфогенетический белок кости (BMP); хемокины, такие как CXCL12 и CXCR4; интерферон, такой как интерферон-альфа, -бета, и -гамма; колониестимулирующие факторы (CSF), например, M-CSF, GM-CSF и G-CSF; цитокин, такой как интерлейкины (IL), например, от IL-1 до IL-10; мидкин; супероксиддисмутаза; T-клеточные рецепторы; поверхностные мембранные белки; фактор, усиливающий гниение; вирусный антиген, такой как, например, часть оболочки AIDS; транспортные белки; хоуминг рецепторы; адрессины; регуляторные белки; интегрины, такие как CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 и VCAM; эфрины; Bv8; дельта-подобный лиганд 4 (DLL4); Del-1; BMP9; BMP10; фоллистатин; фактор роста гепатоцитов (HGF)/рассеивающий фактор (SF); Alk1; Robo4; ESM1; перлекан; EGF-подобный домен, множественный 7 (EGFL7); CTGF и члены семейства тромбоспондинов; тромбоспондины, такие как тромбоспондин1 и тромбоспондин2; коллагены, такие как коллаген IV и коллаген нейропилин XVIII; нейропилины, такие как NRP1 и NRP2; плеотрофин (PTN); програнулин; пролиферин; Notch белки, такие как Notch1 и Notch4; семафорины, такие как Sema3A, Sema3C и Sema3F; опухоль-ассоциированный антиген, такой как CA125 (антиген рака яичников); иммуноадгезины; и фрагменты и/или варианты любых из вышеперечисленных белков, а также антитела, включая фрагменты антител, связывающиеся с одним или несколькими белками, включая, например, любой из вышеперечисленных белков.
[0046] Термин “антитело” в настоящем документе применяют в самом широком смысле, и конкретно охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, полиспецифические антитела (например, биспецифические антитела), и фрагменты антител при условии, что они проявляют желательную биологическую активность.
[0047] “Выделенный” белок (например, выделенное антитело) является таким, который идентифицируют и выделяют и/или восстанавливают из компонента его естественного окружения. Загрязняющие компоненты его естественного окружения являются материалами, которые вмешались бы в исследование, диагностическое или терапевтическое применение белка и может включать ферменты, гормоны и другие белковоподобные или небелковоподобные растворы. Выделенный белок включает белок in situ внутри рекомбинантных клеток, ввиду того что, по меньшей мере, один компонент естественного окружения белка не присутствует. Как правило, однако, выделенный белок получают посредством по меньшей мере одного этапа очистки.
[0048] “Нативные антитела” являются, как правило, гетеротетрамерными гликопротеинами приблизительно 150000 дальтонов, составленными из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью посредством одной ковалентной дисульфидной связи, в то время как ряд дисульфидных связей варьирует среди тяжелых цепей различных изотипов иммуноглобулинов. Каждая тяжелая и легкая цепь также имеет равномерно распределенные внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следует ряд константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на своем другом конце; константный домен легкой цепи сопряжен с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи сопряжен с вариабельным доменом тяжелой цепи. Считают, что конкретные аминокислотные остатки образуют границу раздела между вариабельными доменами легкой цепи и тяжелой цепи.
[0049] Термин “константный домен” относится к части молекулы иммуноглобулина, имеющей более консервативную аминокислотную последовательность по отношению к другой части иммуноглобулина, вариабельному домену, который содержит антигенсвязывающий участок. Константный домен содержит домены CH1, CH2 и CH3 (обобщенно, CH) тяжелой цепи и CHL (или CL) домен легкой цепи.
[0050] “Вариабельная область” или “вариабельный домен” антитела относится к амино-концевым доменам тяжелой или легкой цепи антитела. Вариабельный домен тяжелой цепи может обозначаться как “VH” Вариабельный домен легкой цепи может обозначаться как “VL.” Эти домены, как правило, являются наиболее вариабельными частями антитела и содержать антигенсвязывающие участки.
[0051] Термин “вариабельный” относится к тому факту, что некоторые части вариабельных доменов сильно различаются последовательностью среди антител и применяются при связывании и специфичности каждого конкретного антитела для его конкретного антигена. Однако вариабельность распределена не равномерно на всем протяжении вариабельных доменов антител. Она сконцентрирована в трех сегментах, называемых гипервариабельными областями (HVR) в вариабельных доменах и легкой цепи, и тяжелой цепи. Наиболее высоко консервативные части вариабельных доменов называются каркасными областями (FR). Вариабельные домены нативных тяжелых и легких цепей каждая содержит четыре FR области, главным образом принимая бета-складчатую конфигурацию, соединенную тремя HVR, которые образуют петли, соединяющие и в некоторых случаях образующие часть бета-складчатой структуры. HVR в каждой цепи держаться вместе в непосредственной близости посредством FR областей и с HVR из другой цепи принимают участие в образовании антигенсвязывающего участка антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, National Institute of Health, Bethesda, Md. (1991)). Константные домены не вовлечены непосредственно в связывание антитела с антигеном, но демонстрируют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной токсичности.
[0052] “Легкие цепи” антител (иммуноглобулины) любых видов млекопитающих могут быть соотнесены с одним из двух очевидно различных типов, называемых каппа (“κ”) и лямбда (“λ”), на основе аминокислотных последовательностей их константных доменов.
[0053] Термин “изотип” или “подкласс” IgG, как применяют в настоящем документе, означает любой из подклассов иммуноглобулинов, определяемый посредством химических и антигенных характеристик их константных областей. В зависимости от аминокислотных последовательностей константных доменов их тяжелых цепей, антитела (иммуноглобулины) могут быть отнесены к различным классам. Существует пять главных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов называются α, γ, ε, γ и μ, соответственно. Структуры и трехмерные конфигурации субъединиц различных классов иммуноглобулинов хорошо известны и описаны в общих чертах, например, в Abbas et al. Cellular and Mol. Immunology, 4th ed., W.B. Saunders, Co., 2000. Антитело может быть частью большей молекулы слияния, образованной посредством ковалентной или нековалентной связи антитела с одним или несколькими другими белками или пептидами.
[0054] Термины “полноразмерное антитело”, “интактное антитело” и “полное антитело” используют в настоящем документе взаимозаменяемо в отношении антитела в его по существу интактной форме, не фрагментов антител, как определено ниже. Термины конкретно относятся к антителу с тяжелыми цепями, которые содержат Fc область.
[0055] “Фрагменты антител” содержат часть интактного антитела, предпочтительно содержащего его антигенсвязывающую область. Примеры фрагментов антител включают Fab, Fab', F(ab')2 и Fv фрагменты; диатела; линейные антитела; одноцепочечные молекулы антител и полиспецифические антитела, образованные из фрагментов антител.
[0056] Расщепление папаином антител приводит к образованию двух идентичных антигенсвязывающих фрагментов, называемых “Fab” фрагментами, каждого с единичным антигенсвязывающим участком, и остаточным “Fc” фрагментом, чье имя отражает его способность легко кристаллизоваться. Обработка трипсином дает F(ab')2 фрагмент, который имеет два антигенсвязывающих участка и все еще способен к перекрестному сшиванию антигена. Fab фрагмент содержит вариабельные домены тяжелой и легкой цепи и также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Fab' фрагменты отличаются от Fab фрагментов добавлением нескольких остатков на карбокси конце тяжелой цепи CH1 домена, включая один или несколько цистеинов из шарнирной области антитела. Fab'-SH является обозначением в настоящем документе для Fab', в котором остаток(и) цистеина константных доменов несут свободную тиольную группу. F(ab')2 фрагменты антител исходно были образованы в качестве пары Fab' фрагментов, которые имеют шарнирные цистеины между ними. Другие химические соединения фрагментов антител также известны.
[0057] “Fv” является минимальным фрагментом антитела, который содержит весь антигенсвязывающий участок. В одном из вариантов осуществления, двухцепочечные виды Fv состоят из димера одной тяжелой и одной легкой цепи вариабельного домена в прочной нековалентной связи. В одноцепочечных видах Fv (scFv) одна тяжелая и одна легкая цепь вариабельного домена может быть ковалентно связана посредством гибкого пептидного линкера, так что легкая и тяжелая цепи могут связываться в “димерную” структуру, аналогичную той, что в двухцепочечных видах Fv. Он находится в этой конфигурации таким образом, что три HVR каждого вариабельного домена взаимодействуют, чтобы определить антигенсвязывающий участок на поверхности димера VH-VL. В совокупности шесть HVR придают антигенсвязывающую специфичность антителу. Однако, даже единичный вариабельный домен (или половина Fv, содержащая только три HVR, специфичных для антигена) обладает способностью распознать и связать антиген, хотя с более низкой аффинностью, чем цельный участок связывания.
[0058] “Одноцепочечный Fv” или “scFv” фрагменты антител содержат VH и VL домены антитела, где эти домены присутствуют в единичной полипептидной цепи. Как правило, scFv полипептид дополнительно содержит полипептидный линкер между VH и VL доменами, который позволяет scFv образовывать желаемую структуру для связывания антигена. Для обзора scFv, см., например, Pluckthün, in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315, 1994.
[0059] Термин “диатела” относится к фрагментам антител с двумя антигенсвязывающими участками, фрагменты которых содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в той же полипептидной цепи (VH-VL). С применением линкера, который является слишком коротким, чтобы позволить спаривание между двумя доменами в той же цепи, домены принудительно спаривают с комплементарными доменами другой цепи и создают два антигенсвязывающих участка. Диатела могут быть бивалентными или биспецифичными. Диатела описаны более полно, например, в EP 404097; WO 1993/01161; Hudson et al., Nat. Med. 9:129-134 (2003); и Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). Триатела и тетратела также описаны в Hudson et al., Nat. Med. 9:129-134 (2003).
[0060] Термин “моноклональное антитело”, как применяют в настоящем документе, относится к антителу, полученному из популяции по существу гомогенных антител, например, индивидуальные антитела, содержащие популяцию, являются идентичными за исключением возможных мутаций, например, природных мутаций, которые могут присутствовать в незначительных количествах. Таким образом, модификатор “моноклональный” указывает на характер антитела как не присутствующего в смеси отдельных антител. В определенных вариантах осуществления, такое моноклональное антитело обычно включает антитело, содержащее полипептидную последовательность, которая связывает мишень, где полипептидную последовательность, связывающую мишень, получали посредством процесса, который включает выбор единичной полипептидной последовательности, связывающей мишень из множества полипептидных последовательностей. Например, процесс выбора может быть выбором уникального клона из множества клонов, такого как пул клонов гибридом, клонов бактериофагов или клонов рекомбинантной ДНК. Следует понимать, что выбранная последовательность, связывающая мишень, может быть дополнительно изменена, например, чтобы улучшить аффинность для мишени, чтобы гуманизировать последовательность, связывающую мишень, чтобы улучшить ее продуцирование в клеточной культуре, чтобы уменьшить иммуногенность in vivo, чтобы создать полиспецифическое антитело и т.д., и что антитело, содержащее измененную последовательность, связывающую мишень, также является моноклональным антителом по настоящему изобретению. В отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело препарата моноклонального антитела направлено против единичной детерминанты на антигене. Вдобавок к их специфичности препараты моноклональных антител являются предпочтительными потому, что они обычно не контаминированы другими иммуноглобулинами.
[0061] Модификатор “моноклональный” обозначает характер антитела как полученного из по существу гомогенной популяции антител, и не должно толковаться как требующий продуцирования антитела любым конкретным методом. Например, моноклональные антитела, которые применяют в соответствии с изобретением, могут быть сделаны посредством разнообразных методов, включая, например, гибридомный метод (например, Kohler and Milstein, Nature, 256:495-97 (1975); Hongo et al., Hybridoma, 14 (3): 253-260 (1995), Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981)), способы, связанные с рекомбинантной ДНК, (см., например, патент США № 4816567), методы с использованием фагового отображения (см., например, Clackson et al., Nature, 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); и Lee et al., J. Immunol. Methods 284(1-2): 119-132 (2004), и методы для продуцирования человеческих или подобных человеческим антител у животных, которые имеют часть или все из локусов иммуноглобулинов человека или генов, кодирующих последовательности иммуноглобулинов человека (см., например, WO 1998/24893; WO 1996/34096; WO 1996/33735; WO 1991/10741; Jakobovits et al., Proc. Natl. Acad. Sci. USA 90: 2551 (1993); Jakobovits et al., Nature 362: 255-258 (1993); Bruggemann et al., Year in Immunol. 7:33 (1993); U.S. Pat. No. 5,545,807; 5,545,806; 5,569,825; 5,625,126; 5,633,425; и 5,661,016; Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368: 812-813 (1994); Fishwild et al., Nature Biotechnol. 14: 845-851 (1996); Neuberger, Nature Biotechnol. 14: 826 (1996); and Lonberg and Huszar, Intern. Rev. Immunol. 13: 65-93 (1995).
[0062] Моноклональные антитела в настоящем документе, в частности, включают “химерные” антитела, в которых часть тяжелой и/или легкой цепи является идентичной с или гомологичной соответствующей последовательности в антителе, полученном из конкретного вида или принадлежащей конкретному классу или подклассу антител, в то время как остаток цепи(ей) является идентичным с или гомологичным соответствующей последовательности в антителе, полученном из других видов, или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют желательную биологическую активность (см., например, патент США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)). Химерные антитела включают PRIMATTZED® антитела, где антигенсвязывающая область антитела получена из антитело продуцированного, например, посредством иммунизации обезьян макак антигеном, представляющим интерес.
[0063] “Гуманизированные” формы антител, не принадлежащих человеку (например, мышиных) являются химерными антителами, которые содержат минимальную последовательность, полученную из не принадлежащего человеку иммуноглобулина. В одном из вариантов осуществления, гуманизированное антитело является иммуноглобулином человека (реципиентное антитело), в котором остатки из HVR реципиента заменены остатками из HVR не являющихся человеком видов (донорское антитело), таких как мышь, крыса, кролик или не являющийся человеком примат, имеющий желаемую специфичность, аффинность и/или способность. В некоторых случаях, FR остатки иммуноглобулина человека замещены соответствующими не принадлежащими человеку остатками. Кроме того, гуманизированные антитела могут содержать остатки, которые не обнаруживаются в реципиентном антителе или донорском антителе. Эти модификации могут быть сделаны, чтобы дополнительно улучшить активность антитела. В основном, гуманизированное антитело содержит по существу все из по меньшей мере одного, и обычно два вариабельных домена, у которых все или по существу все из гипервариабельных петель относятся к не принадлежащим иммуноглобулину человека, и все или по существу все из FR принадлежат последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также содержит по меньшей мере часть константной области иммуноглобулина (Fc), как правило, часть иммуноглобулина человека. Более подробно, см., например, Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). См. также, например, Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1:105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994); и патенты США № 6982321 и 7087409.
[0064] “Антитело человека” является тем, которое обладает аминокислотной последовательностью, которая относится к антителу, продуцируемому человеком, и/или было сделано с применением любого метода для создания антитела человека, как описано в настоящем документе. Это определение антитела человека, в частности, исключает гуманизированное антитело, содержащее не принадлежащие человеку антигенсвязывающие остатки. Антитела человека можно получать с применением различных методов, известных в данной области, включая библиотеки фагового отображения. Hoogenboom and Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581 (1991). Также доступными для получения моноклональных антител человека являются способы, описанные в Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., J. Immunol., 147(1):86-95 (1991). См. также van Dijk and van de Winkel, Curr. Opin. Pharmacol., 5: 368-74 (2001). Антитела человека можно получать посредством введения антигена трансгенному животному, которое было модифицировано, чтобы продуцировать такие антитела в ответ на стимуляцию антигеном, но чьи эндогенные локусы были деактивированы, например, иммунизированная ксеномышь (см., например, патенты США № 6075181 и 6150584 относительно технологии XENOMOUSE™). См. также, например, Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006) относительно антител человека, образованных посредством технологии на основе гибридомы B-клеток человека.
[0065] Термин “гипервариабельная область,” “HVR” или “HV”, как применяют в настоящем документе, относится к определенным областям вариабельного домена антитела, которые являются гипервариабельными в отношении последовательности и/или образуют определяемые структурой петли. Как правило, антитела содержат шесть HVR; три в VH (H1, H2, H3), и три в VL (L1, L2, L3). В нативных антителах H3 и L3 отражают наибольшее разнообразие шести HVR, и H3 конкретно, как полагают, играют уникальную роль в придании узкой специфичности антителам. См., например, Xu et al., Immunity 13:37-45 (2000); Johnson and Wu, in Methods in Molecular Biology 248:1-25 (Lo, ed., Human Press, Totowa, N.J., 2003). Фактически, природные антитела верблюдов, состоящие из тяжелой цепи, являются функциональными и стабильными в отсутствие легкой цепи. См., например, Hamers-Casterman et al., Nature 363:446-448 (1993); Sheriff et al., Nature Struct. Biol. 3:733-736 (1996).
[0066] Ряд описаний HVR применяются и включены в настоящий документ. Kabat определяющие комплементарность области (CDR) основаны на вариабельности последовательности и являются наиболее широко используемыми (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Chothia ссылается вместо положения структурных петель (Chothia и Lesk J. Mol. Biol. 196:901-917 (1987)). AbM HVR представляют компромисс между Kabat HVR и Chothia структурными петлями, и применяют посредством программного обеспечения для моделирования антител Oxford Molecular's AbM. “Контактные” HVR основаны на анализе доступных комплексных кристаллических структур. Остатки от каждого из этих HVR отмечены ниже.
[0067] HVR могут содержать “расширенные HVR” как указано далее: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 или 89-96 (L3) в VL и 26-35 (H1), 50-65 или 49-65 (H2) и 93-102, 94-102 или 95-102 (H3) в VH. Остатки вариабельных доменов пронумерованы в соответствии с Kabat et al., supra, для каждого из этих определений.
[0068] “Каркас” или остатки “FR” являются остатками вариабельных доменов иными, чем HVR остатки, как определено в настоящем документе.
[0069] Термин “нумерация остатка вариабельного домена как в Kabat” или “нумерация положения аминокислоты как Kabat,” и их вариации относится к системе нумерации, применяемой для вариабельных доменов тяжелых цепей или вариабельных доменов легких цепей компиляции антител в Kabat et al., supra. С применением этой системы нумерации, фактическая линейная аминокислотная последовательность может содержать меньше или дополнительные аминокислоты в соответствии с укорачиванием, или вставкой внутрь, FR или HVR вариабельного домена. Например, вариабельный домен тяжелой цепи может включать единичную аминокислотную вставку (остаток 52a в соответствии с Kabat) после остатка 52 H2 и вставленные остатки (например, остатки 82a, 82b, и 82c, и т.д. в соответствии с Kabat) после FR остатка 82 тяжелой цепи. Нумерацию остатков Kabat можно определять для данного антитела посредством анализа первичной структуры области гомологии последовательности антитела со “стандартной” пронумерованной последовательностью по Kabat.
[0070] Систему нумерации Kabat, как правило, применяют в отношении остатка в вариабельном домене (приблизительно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (например, Kabat et al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). “EU система нумерации” или “EU индекс”, как правило, применяют по отношению к остатку в константной области тяжелой цепи иммуноглобулина (например, EU индекс, сообщаемый в Kabat et al., supra). “EU индекс как в Kabat” относится к нумерации остатка EU антитела IgG1 человека.
[0071] Выражение “линейные антитела” относится к антителам, описанным в Zapata et al. (1995 Protein Eng, 8(10):1057-1062). В кратком изложении, эти антитела содержат пару тандемных Fd сегментов (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи, образуют пару антигенсвязывающих областей. Линейные антитела могут биспецифичными или моноспецифичными.
[0072] Термин “приблизительно”, как применяют в настоящем документе, относится к диапазону приемлемой погрешности для соответствующей величины, как определено специалистом в данной области, которая зависит отчасти от того, как величину измеряют или определяют, т.е. ограничений системы измерения. Например, “приблизительно” может означать в пределах 1 или больше, чем 1 стандартное отклонение, в практике в данной области. Ссылка на “приблизительно” величина или параметр в настоящем документе включает и описывает варианты осуществления, которые направлены на это значение или параметр per se. Например, описание, относящееся к “приблизительно X”, включает описание “X”.
[0073] Как применяют в этом описании изобретения и приложенной формуле изобретения, формы единственного числа включают множественные объекты, если содержанием явным образом не продиктовано другое. Таким образом, например, ссылка на “соединение” необязательно включает комбинацию двух или более таких соединений и т.п.
[0074] Следует понимать, что аспекты и варианты осуществления по изобретению, описываемые в настоящем документе, включают “содержащий”, “состоящий” и “состоящий по существу из” аспекты и варианты осуществления.
II. Белковые составы и получение
[0075] Изобретение в настоящем документе относится к жидким составам, содержащим белок и соединению, которое предотвращает окисление белка в жидком составе, где соединение выбрано из группы, состоящей из 5-гидрокси-триптофана, 5-гидрокси индола, 7-гидрокси индола и серотонина. В некоторых вариантах осуществления, соединение в составе составляет от приблизительно 0,3 мМ до приблизительно 10 мМ, или до высшей концентрации, при которой это соединение является растворимым в составе. В некоторых вариантах осуществления, соединение в составе составляет до приблизительно 1 мМ. В некоторых вариантах осуществления, соединение предотвращает окисление одной или нескольких аминокислот в белке, выбранных из группы, состоящей из триптофана и/или метионина. В некоторых вариантах осуществления, соединение предотвращает окисление белка посредством активных форм кислорода (ROS). В дополнительном варианте осуществления, активные формы кислорода выбраны из группы, состоящей из атомарного кислорода, супероксида (O2-), алкоксил радикала, пероксил радикала, пероксида водорода (H2O2), триоксида водорода (H2O3), гидротриокси радикал (HO3•), озона (O3), гидроксильного радикала и алкил пероксида. В некоторых вариантах осуществления белок, описываемый в настоящем документе, является подверженным окислению. В некоторых вариантах осуществления, метионин, цистеин, гистидин, триптофан, и/или тирозин в белке являются подверженными окислению. В некоторых вариантах осуществления, триптофан и/или метионин в белке являются подверженными окислению. Например, аминокислота триптофан в Fab части моноклонального антитела и/или аминокислота метионин в Fc части моноклонального антитела может быть подвержена окислению. В некоторых вариантах осуществления, белок является терапевтическим белком. В некоторых вариантах осуществления в настоящем документе белок является антителом. В некоторых вариантах осуществления антитело является поликлональным антителом, моноклональным антителом, гуманизированным антителом, антителом человека, химерным антителом или фрагментом антитела. В дополнительном варианте осуществления соединение предотвращает окисление одной или нескольких аминокислот в Fab части антитела. В другом дополнительном варианте осуществления, соединение предотвращает окисление одной или нескольких аминокислот в Fc части антитела. В некоторых вариантах осуществления, состав, приводимый в данном документе, является фармацевтическим составом, пригодным для введения индивидууму. Как применяют в настоящем документе, “субъект” или “индивидуум” для целей лечения или введения относится к любому животному, классифицируемому как млекопитающее, включая человека, домашних и сельскохозяйственных животных, и животных зоопарка, спортивных животных или питомцев, таких как собаки, лошади, кошки, коровы и т.д. Предпочтительно, млекопитающее является человеком. В некоторых вариантах осуществления, состав является водным. В некоторых вариантах осуществления в настоящем документе, концентрация белка (например, антитела) в составе составляет от приблизительно 1 мг/мл до приблизительно 250 мг/мл. В некоторых вариантах осуществления состав содержит дополнительно один или несколько эксципиентов, выбранных из группы, состоящей из стабилизатора, буфера, поверхностно-активного вещества и средства придания тоничности. Например, состав по изобретению может содержать моноклональное антитело, соединение, как представлено в настоящем документе, которое предотвращает окисление белка (например, 5-гидрокси индол), и буфер, который поддерживает pH состава на желаемом уровне. В некоторых вариантах осуществления, состав, представленный в настоящем документе имеет pH от приблизительно 4,5 до приблизительно 7,0.
[0076] Белки и антитела в составе можно получать с применением известных в данной области способов. Антитело (например, полноразмерные антитела, фрагменты антител и полиспецифические антитела) в составе получают с применением методов, доступных в данной области, не ограничивающих приводимых в качестве примеров способов, которые более подробно описаны в следующих разделах. Способы в настоящем документе могут быть адаптированы специалистом в данной области для получения составов, содержащих другие белки, такие как ингибиторы на основе пептидов. См. Molecular Cloning: A Laboratory Manual (Sambrook et al., 4th ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 2012); Current Protocols in Molecular Biology (F.M. Ausubel, et al. eds., 2003); Short Protocols in Molecular Biology (Ausubel et al., eds., J. Wiley and Sons, 2002); Current Protocols in Protein Science, (Horswill et al., 2006); Antibodies, A Laboratory Manual (Harlow and Lane, eds., 1988); Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications (R.I. Freshney, 6th ed., J. Wiley and Sons, 2010) для широко распространенных и обычно применяемых методов и процедур для получения терапевтических белков, которые все включены в настоящий документ в качестве ссылки полностью.
A. Получение антитела
[0077] Антитело в жидких составах, приводимое в данном документе, направлено против антигена, представляющего интерес. Предпочтительно, данный антиген является биологически важным полипептидом и введение антитела млекопитающему, страдающему от заболевания, может привести к терапевтической эффективности у этого млекопитающего. Однако антитела, направленные против неполипептидных антигенов также рассматриваются.
[0078] Когда антиген является полипептидом, он может быть трансмембранной молекулой (например, рецептором) или лигандом, таким как фактор роста. Приводимые в качестве примеров антигены включают молекулы, такие как фактор роста эндотелия сосудов (VEGF); CD20; ox-LDL; ox-ApoB100; ренин; гормон роста, включая гормон роста человека и бычий гормон роста; рилизинг-фактор гормона роста; паратиреоидный гормон; тиреотропный гормон; липопротеины; альфа-1-антитрипсин; инсулин A-цепь; инсулин B-цепь; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания крови, такие как фактор VIIIC, фактор IX, тканевой фактор, и фактор фон Виллебранда; противосвертывающие факторы, такие как белок C; атриальный натрийуретический фактор; сурфактант легких; активатор плазминогена, такой как урокиназа или мочевина человека или активатор плазминогена тканевого типа (t-PA); бомбезин; тромбин; гемопоэтический фактор роста; рецептор фактора некроза опухоли, такой как рецептор смерти 5 и CD120; фактор некроза опухоли-альфа и -бета; энкефалиназа; RANTES (хемокин, экспрессируемый и секретируемый нормальными T-клетками при активации); макрофагальный воспалительный белок человека (MIP-1-альфа); сывороточный альбумин, такой как сывороточный альбумин человека; мюллерова ингибирующая субстанция; релаксин A-цепь; релаксин B-цепь; прорелаксин; гонадотропин-ассоциированный пептид мыши; микробный белок, такой как бета-лактамаза; ДНКаза; IgE; антиген цитотоксических T-лимфоцитов (CTLA), такой как CTLA-4; ингибин; активин; рецепторы для гормонов или факторов роста; белок A или D; ревматоидные факторы; нейротрофический фактор, такой как костный нейротрофический фактор (BDNF), нейротрофин-3, -4, -5, или -6 (NT-3, NT4, NT-5, или NT-6), или фактор роста нервов, такой как NGF-β; тромбоцитарный фактор роста (PDGF); фактор роста фибробластов, такой как aFGF и bFGF; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF-альфа и TGF-бета, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4, или TGF-β5; инсулиноподобный фактор роста-I и -II (IGF-I и IGF-II); дес(1-3)-IGF-I(мозг IGF-I), белки, связывающие инсулиноподобный фактор роста; CD белки, такие как CD3, CD4, CD8, CD19 и CD20; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; морфогенетический белок кости (BMP); интерферон, такой как интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSF), например, M-CSF, GM-CSF, и G-CSF; интерлейкины (IL), например, от IL-1 до IL-10; супероксиддисмутаза; T-клеточные рецепторы; поверхностные мембранные белки; фактор, усиливающий гниение; вирусный антиген, такой как, например, часть оболочки AIDS; транспортные белки; хоминговые рецепторы; адрессины; регуляторные белки; интегрины, такие как CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 и VCAM; опухоль-ассоциированный антиген, такой как рецептор HER2, HER3 или HER4; и фрагменты любых из вышеперечисленных полипептидов.
(i) Получение антигена
[0079] Растворимые антигены или их фрагменты, необязательно конъюгированные с другими молекулами, можно использовать в качестве иммуногенов для образования антител. Для трансмембранных молекул, таких как рецепторы, их фрагменты (например, внеклеточный домен рецептора) можно использовать в качестве иммуногена. Альтернативно, клетки, экспрессирующие трансмембранную молекулу, можно использовать в качестве иммуногена. Такие клетки могут быть получены из природного источника (например, раковой клеточной линии) или могут быть клетками, которые были трансформированы посредством рекомбинантных способов, чтобы экспрессировать трансмембранную молекулу. Другие антигены и их формы, пригодные для получения антител будут очевидными для специалистов в данной области.
(ii) Отдельные способы на основе антител
[0080] Поликлональные антитела предпочтительно поднимаются у животных посредством множественных подкожных (sc) или интраперитонеальных (ip) инъекций релевантного антигена и адъюванта. Может быть полезным конъюгировать релевантный антиген с белком, который является иммуногенным в видах, которые подлежат иммунизации, например, гемоцианин морского блюдца, сывороточный альбумин, бычий тиреоглобулин или соевый ингибитор трипсина, с применением бифункционального или дериватизирующего средства, например, малеимидобензоил сульфосукцинимид сложный эфир (конъюгирование посредством остатков цистеина), N-гидроксисукцинимид (посредством остатков лизина), глутаральдегид, янтарный ангидрид, SOCl2, или R1N=C=NR, где R и R1 являются различными алкильными группами.
[0081] Животные являются иммунизированными против антигена, иммуногенных конъюгатов или производных посредством комбинирования, например, 100 мкг или 5 мкг белка или конъюгата (для кроликов или мышей, соответственно) с 3 объемами полного адъюванта Фрейнда и инъецирования раствора интрадермально во множество сайтов. Спустя один месяц животным вводят бустерную инъекцию от 1/5 до 1/10 исходного количества пептида или конъюгата в полном адъюванте Фрейнда посредством подкожной инъекции в множественные сайты. От семи до 14 дней спустя у животных делают забор крови, и сыворотку исследуют на предмет титра антител. Животным вводят бустер-инъекцию до тех пор, пока титр не достигает плато. Предпочтительно, животному вводят бустерн-инъекцию с конъюгатом того же антигена, но конъюгированного с различными белками и/или посредством различных перекрестносвязывающих реагентов. Конъюгаты также могут быть сделаны в культуре рекомбинантных клеток в качестве белков слияния. Также, препараты, вызывающие аггрегацию тромбоцитов, такие как such as квасцы применяют соответствующим образом, чтобы усилить иммунный ответ.
[0082] Моноклональные антитела, представляющие интерес, могут быть сделаны с применением гибридомного способа, впервые описанного Kohler et al., Nature, 256:495 (1975), и дополнительно описанного, например, в Hongo et al., Hybridoma, 14 (3): 253-260 (1995), Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981), и Ni, Xiandai Mianyixue, 26(4):265-268 (2006) относительно гибридом человек-человек. Дополнительные способы включают описанные, например, в патенте США № 7189826 относительно продукции моноклональных естественных IgM антител человека из гибридомных клеточных линий. Технология гибридомы человека (Trioma technology) описана в Vollmers and Brandlein, Histology and Histopathology, 20(3):927-937 (2005) и Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3):185-91 (2005).
[0083] Для различных других гибридомных способов, см., например, US 2006/258841; US 2006/183887 (целиком антитела человека), US 2006/059575; US 2005/287149; US 2005/100546; US 2005/026229; и патенты США № 7078492 и 7153507. Примерный протокол для продуцирования моноклональных антител с применением гибридомного способа описан, как представлено далее. В одном из вариантов осуществления, мышь или другое подходящее животное-хозяин, такое как хомяк, иммунизируют, чтобы извлечь лимфоциты, которые продуцируют или способны к продуцированию антител, которые специфическим образом свяжутся с белком, применяемым для иммунизации. Антитела поднимаются у животных посредством множественных подкожных (sc) или интраперитонеальных (ip) инъекций полипептида, представляющего интерес или его фрагмента, и адъюванта, такого как монофосфорил липид A (MPL)/трегалоза дикриномиколят (TDM) (Ribi Immunochem. Research, Inc., Hamilton, Mont.). Полипептид, представляющий интерес (например, антиген) или его фрагмент можно получать с применением способов, хорошо известных в данной области, таких как рекомбинантные способы, некоторые из которых дополнительно описаны в настоящем документе. Сыворотку из иммунизированных животных оценивают на предмет антител против антигена, и необязательно вводят бустерные иммунизации. Лимфоциты из животных, продуцирующие противоантигенные антитела, выделяют. Альтернативно, лимфоциты можно иммунизировать in vitro.
[0084] Лимфоциты затем сливают с миеломными клетками с применением подходящего фактора, вызывающего слияние клеток, такого как полиэтиленгликоль, чтобы образовать гибридомную клетку. См., например, Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986). Можно использовать миеломные клетки, которые эффективно сливаются, поддерживают стабильную продукцию антител на высоком уровне выбранными антитело-продуцирующими клетками, и являются чувствительными к среде, такой как HAT. Типичные миеломные клетки в качестве неограничивающих примеров включают линии миеломы крысы, такие как полученные из MOPC-21 и MPC-11 опухолей мыши, доступных в Salk Institute Cell Distribution Center, San Diego, Calif. USA, и SP-2 или X63-Ag8-653 клетки, доступные в Американской коллекции типовых культур, Rockville, Md. USA. Клеточные линии миеломы человека и гетеромиеломы мышь-человек также были описаны для продукции моноклональных антитела человека (Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
[0085] Гибридомные клетки, полученные таким образом, высевают и выращивают в подходящей среде для культивирования, например, среде, которая содержит одно или несколько веществ, которые ингибируют рост или выживаемость не слитых, родительских миеломных клеток. Например, если у родительских миеломных клеток отсутствует фермент гипоксантин гуанин фосфорибозил трансфераза (HGPRT или HPRT), среда для культивирования для гибридом, как правило, будет включать гипоксантин, аминоптерин и тимидин (среда HAT), вещества которой предотвращают рост HGPRT-дефицитных клеток. Предпочтительно, способы на основе бессывороточной гибридомной клеточной культуры применяют, чтобы уменьшить применение сыворотки, получаемой из животных, такой как эмбриональная телячья сыворотка, как описано, например, в Even et al., Trends in Biotechnology, 24(3), 105-108 (2006).
[0086] Олигопептиды в качестве инструментов для улучшения продуктивности гибридомных клеточных культур описаны в Franek, Trends in Monoclonal Antibody Research, 111-122 (2005). Конкретно, стандартные среды для культивирования обогащены определенными аминокислотами (аланин, серин, аспарагин, пролин), или белковыми фракциями гидролизата, и апоптоз может быть значительно подавлен посредством синтетических олигопептидов, составленных из от трех до шести аминокислотных остатков. Пептиды присутствуют в миллимолярных или более высоких концентрациях.
[0087] Среда для культивирования, в которой растут гибридомные клетки, может быть протестирована на предмет продукции моноклональных антител, которые связываются с антителом, описываемым в настоящем документе. Специфичность связывания моноклональных антител, образованных гибридомными клетками, можно определять посредством иммунопреципитации или посредством in vitro анализа связывания, такого как радиоиммунологический анализ (RIA) или иммуноферментный анализ (ELISA). Аффинность связывания моноклонального антитела можно определять, например, посредством анализа Скэтчарда. См., например, Munson et al., Anal. Biochem., 107:220 (1980).
[0088] После того, как идентифицированы гибридомные клетки, которые продуцируют антитела желаемой специфичности, аффинности, и/или активности, клоны могут быть субклонированы посредством серийных разведений и выращены посредством стандартных способов. См., например, Goding, supra. Подходящие среды для этой цели включают, например, среду D-MEM или RPMI-1640. Вдобавок, гибридомные клетки можно выращивать in vivo в качестве асцитных опухолей у животного. Моноклональные антитела, секретируемые посредством субклонов подходящим образом, отделены от среды для культивирования, асцитной жидкости или сыворотки посредством известных методов очистки иммуноглобулинов, таких как, например, белок A-сефароза, хроматография на гидроксиапатите, электрофорез в геле, диализ или аффинная хроматография. Одна процедура для выделения белков из гибридомных клеток описана в US 2005/176122 и патенте США № 6919436. Способ включает применение минимальных солей, таких как лиотропные соли, в процессе связывания и предпочтительно также применение небольших количеств органических растворителей в процессе элюирования.
(iii) Некоторые способы скрининга библиотек
[0089] Антитела в составах и композициях, описываемые в настоящем документе, могут быть сделаны с применением комбинаторных библиотек для скрининга антител с желаемой активностью или активностями. Например, в данной области известно разнообразие способов для образования библиотек фагового отображения и скрининг таких библиотек для антител, обладающих желаемыми характеристиками связывания. Такие способы описаны, как правило, в Hoogenboom et al. in Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, N.J., 2001). Например, один метод образования антител, представляющих интерес, осуществляется посредством применения библиотеки фаговых антител, как описано в Lee et al., J. Mol. Biol. (2004), 340(5):1073-93.
[0090] В принципе, синтетические клоны антител выбраны посредством скрининга фаговых библиотек, содержащих фаг, который демонстрирует различные фрагменты вариабельной области антитела (Fv), слитые с белком оболочки фага. Такие фаговые библиотеки разделяются методом аффинной хроматографии против желаемого антигена. Клоны, экспрессирующие Fv фрагменты, ответственные за связывание с желаемым антигеном, адсорбируются к антигену и, таким образом, отделяются от несвязывающих клонов в библиотеке. Связывающие клоны затем элюируются от антигена, и могут быть дополнительно обогащены посредством дополнительных циклов адсорбции/элюирования антигена. Любые антитела можно получать посредством проектирования подходящей процедуры скрининга с помощью антигена, чтобы выбирать клон фага, представляющий интерес, с последующим конструированием клона полноразмерного антитела, с применением Fv последовательности из клона фага, представляющего интерес, и подходящих последовательностей константной области (Fc), описанных в Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda Md. (1991), vols. 1-3.
[0091] В определенных вариантах осуществления, антигенсвязывающий домен антитела образован из двух вариабельных (V) областей из приблизительно 110 аминокислот, по одной из легкой (VL) и тяжелой (VH) цепей, так что обе представляют три гипервариабельные петли (HVR) или определяющие комплементарность области (CDR). Вариабельные домены могут быть представлены функциональным образом на фаге, как и одноцепочечные Fv (scFv) фрагменты, в которых VH и VL ковалентно связаны посредством короткого, гибкого пептида или как Fab фрагменты, в которых каждый из них слит с константным доменом и взаимодействует нековалентно, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Как применяют в настоящем документе, scFv, кодирующие клоны фагов и Fab, кодирующие клоны фагов, в совокупности обозначают как “Fv клоны фагов” или “Fv клоны”.
[0092] Репертуар генов VH и VL может быть раздельно клонирован посредством полимеразной цепной реакции (ПЦР) и рекомбинирован произвольным образом в фаговые библиотеки, которые затем можно использовать для поиска антигенсвязывающих клонов, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Библиотеки из иммунизированных источников обеспечивают высокоаффинные антитела к иммуногену без необходимости конструирования гибридом. Альтернативно, наивный репертуар может быть клонирован, чтобы обеспечить единичный источник антител человека к широкому диапазону не ауто- и также аутоантигенов без какой-либо иммунизации, как описано Griffiths et al., EMBO J, 12: 725-734 (1993). В конечном счете, наивные библиотеки также могут быть сделаны синтетически посредством клонирования нереаранжированных сегментов V-гена из стволовых клеток, и применения ПЦР праймеров, содержащих случайную последовательность для кодирования высоко вариабельных CDR3 областей и чтобы завершить реаранжировку in vitro, как описано Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992).
[0093] В определенных вариантах осуществления, нитевидный фаг применяют, чтобы проявить фрагменты антител посредством слияния с минорным белком оболочки pIII. Фрагменты антител могут быть отображены как одноцепочечные Fv фрагменты, в которых VH и VL домены соединены на одной и той же полипептидной цепи посредством гибкого полипептидного спейсера, например, как описано в Marks et al., J. Mol. Biol., 222: 581-597 (1991), или как Fab фрагменты, в которых одна цепь слита с pIII, а другая секретируется в бактериальной клетке-хозяине периплазме, где сборка структуры Fab- белок оболочки, которая становится отображаемой на поверхности фага посредством демонстрации некоторых из белков оболочки дикого типа, например, как описано в Hoogenboom et al., Nucl. Acids Res., 19: 4133-4137 (1991).
[0094] В основном нуклеиновые кислоты, кодирующие фрагменты генов антител, получают из иммунных клеток, взятых от человека или животных. Если библиотека, направленная на получение анти-антигенных клонов, является желаемой, субъект иммунизируют с применением антигена, чтобы вызвать иммунный ответ, и клетки селезенки и/или циркулирующие B клетки, другие лимфоциты периферической крови (PBL) извлечены из конструкции библиотеки. В одном из вариантов осуществления, библиотеку фрагментов гена антитела человека, направленная на получение анти-антигенных клонов, получают посредством образования анти-антигенного иммунного ответа в трансгенных мышах, несущих генетическую информацию о функциональном иммуноглобулине человека (и отсутствие функциональной эндогенной системы продуцирования антител), таким образом, что антигенная иммунизация увеличивает продукцию B клетками антител человека против антигена. Получение трансгенных мышей, продуцирующих антитело человека, описано ниже.
[0095] Дополнительное обогащение клеточных популяций, реактивных против антигена, можно получать с использованием процедуры скрининга для выделения В клеток, экспрессирующих антиген-специфическое мембраносвязанное антитело, например, посредством отделения клеток с применением антигенной аффинной хроматографии или адсорбции клеток к флуорохроммеченному антигену с последующим сортировкой клеток с возбуждением флуоресценции (FACS).
[0096] Альтернативно, применение клеток селезенки и/или B клеток или других PBL из неиммунизированного донора представляет лучшее отображение возможного репертуара антител, и также позволяет конструкции библиотеки антител использовать любой вид животного (человек или не относящийся к человеку), в котором антиген не является антигенным. Для библиотек, содержащих in vitro генную конструкцию антител, стволовые клетки берут от субъекта, чтобы обеспечить нуклеиновые кислоты, кодирующие сегменты гена нереаранжированного антитела. Иммунные клетки, представляющие интерес, можно получать из разнообразия видов животных, таких как человек, мышь, крыса, зайцеобразные, волчьи, псовые, кошачьи, свиньи, бычьи, лошадиные и птичьи виды и т.д.
[0097] Нуклеиновая кислота, кодирующая сегменты вариабельного гена антитела (включая сегменты VH и VL), извлекают из клеток, представляющих интерес, и амплифицируют. В случае библиотек реаранжированных генов VH и VL, желаемую ДНК можно получать посредство выделения геномной ДНК или mRNA из лимфоцитов с последующей полимеразной цепной реакцией (ПЦР) с праймерами, подходящими к 5' и 3' концам реаранжированных VH и VL генов, как описано в Orlandi et al., Proc. Natl. Acad. Sci. (USA), 86: 3833-3837 (1989), таким образом, создавая различные репертуары V гена для экспрессии. V гены можно амплифицировать из кДНК и геномной ДНК, с обратными праймерами на 5' конце экзона, кодирующего зрелый V-домен и прямые праймеры на основе J-сегмента, как описано в Orlandi et al. (1989) и в Ward et al., Nature, 341: 544-546 (1989). Однако, для амплификации из кДНК, обратные праймеры могут также быть основаны на лидерном экзоне, как описано в Jones et al., Biotechnol., 9: 88-89 (1991), и прямые праймеры внутри константной области, как описано в Sastry et al., Proc. Natl. Acad. Sci. (USA), 86: 5728-5732 (1989). Чтобы максимизировать комплементарность дегенерация может быть включена в праймеры, как описано в Orlandi et al. (1989) или Sastry et al. (1989). В определенных вариантах осуществления, разнообразие библиотек максимизировано посредством использования ПЦР праймеров, таргетных к каждому семейству V-генов, чтобы амплифицировать все доступные расположения VH и VL, присутствующие в образце нуклеиновой кислоты иммунных клеток, например, как описано в способе Marks et al., J. Mol. Biol., 222: 581-597 (1991) или как описано в способе Orum et al., Nucleic acids Res., 21: 4491-4498 (1993). Для клонирования амплифицированной ДНК в экспрессирующих векторах, редкие участки рестрикции могут быть введены внутрь ПЦР праймера в качестве меткина на одном конце, как описано в Orlandi et al. (1989), или посредством дополнительной ПЦР амплификации с меченным праймером, как описано в Clackson et al., Nature, 352: 624-628 (1991).
[0098] Репертуары синтетически реаранжированных V генов могут быть получены in vitro из сегментов V гена. Большинство сегментов VH-гена человека было клонировано и секвенировано (сообщается в Tomlinson et al., J. Mol. Biol., 227: 776-798 (1992)), и картировано (сообщается в Matsuda et al., Nature Genet., 3: 88-94 (1993); эти клонированные сегменты (включая все главные конформации H1 и H2 петли) можно использовать, чтобы получать различные репертуары VH гена с ПЦР праймерами, кодирующими H3 петли различных последовательностей и длины, как описано в Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992). Репертуары VH могут также быть созданы со всем разнообразием последовательностей, сосредоточенных в длинной H3 петле единичной длины, как описано в Barbas et al., Proc. Natl. Acad. Sci. USA, 89: 4457-4461 (1992). Сегменты Vκ и Vλ человека были клонированы и секвенированы (сообщается в Williams and Winter, Eur. J. Immunol., 23: 1456-1461 (1993)) и их можно использовать для создания репертуаров синтетических легких цепей. Репертуары синтетического V гена, на основе диапазона кратности VH и VL, и длин L3 и H3, будут кодировать антитела значительного структурного разнообразия. Последующая амплификация ДНК, кодирующей V-ген, сегменты зародышевого V-гена могут быть реаранжированы in vitro в соответствии со способами Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992).
[0099] Репертуары фрагментов антител можно конструировать посредством комбинирования репертуаров VH и VL генов вместе различными путями. Каждый репертуар может быть создан в различных векторах, а векторы рекомбинированы in vitro, например, как описано в Hogrefe et al., Gene, 128: 119-126 (1993), или in vivo посредством комбинаторной инфекции, например, системы loxP, описанной в Waterhouse et al., Nucl. Acids Res., 21: 2265-2266 (1993). Рекомбинационный подход in vivo применяет двухцепочечную природу фрагментов Fab, чтобы преодолеть ограниченность размера библиотеки, навязанной E. coli эффективности трансформации. Репертуары наивных VH и VL клонируют раздельно, один в фаг mid и другой в фаговый вектор. Две библиотеки затем комбинируются посредством фаговой инфекции фаговой mid-содержащей бактерии, чтобы каждая клетка содержала различную комбинацию, и размер библиотеки был ограничен только числом присутствующих клеток (приблизительно 1012 клонов). Оба вектора содержат in vivo рекомбинационные сигналы, таким образом, что VH и VL гены рекомбинированы в единый репликон и соупакованы в фаговые вирионы. Эти громадные библиотеки предоставляют большие числа различных антител хорошей аффинности (Kd-1 приблизительно 10-8 M).
[0100] Альтернативно, репертуары могут быть клонированы последовательно в тот же вектор, например, как описано в Barbas et al., Proc. Natl. Acad. Sci. USA, 88: 7978-7982 (1991), или собраны вместе посредством ПЦР, а затем клонированы, например, как описано в Clackson et al., Nature, 352: 624-628 (1991). ПЦР сборку также можно использовать для соединения VH и VL ДНК с ДНК, кодирующей гибкий пептидный спэйсер, для образования репертуаров одноцепочечных Fv (scFv). В другом методе “ПЦР сборке в клетке” применяют, чтобы комбинировать VH и VL внутри лимфоцитов посредством ПЦР, а затем репертуары клонов связанных генов, как описано в Embleton et al., Nucl. Acids Res., 20: 3831-3837 (1992).
[0101] Антитела, полученные посредством наивных библиотек (природных или синтетических), могут быть умеренной аффинности (Kd-1 приблизительно от 106 до 107 M-1), но созревание аффинности может также быть имитировано in vitro посредством конструирования и повторного отбора из вторичных библиотек, как описано в Winter et al. (1994), supra. Например, мутация может быть введена случайным образом in vitro посредством использования ошибающейся полимеразы (сообщается в Leung et al., Technique 1: 11-15 (1989)) в способе Hawkins et al., J. Mol. Biol., 226: 889-896 (1992) или в способе Gram et al., Proc. Natl. Acad. Sci USA, 89: 3576-3580 (1992). Дополнительно, созревание аффинности можно проводить посредством случайного мутирования одного или нескольких CDR, например, с применением ПЦР с праймерами, несущими случайную последовательность, охватывающую CDR, представляющую интерес, в отобранных индивидуальных Fv клонах и скрининг на предмет клонов с более высокой аффинностью. В WO 9607754 (опубликованный 14 марта 1996) описан способ индуцирования мутагенеза в определяющей комплементарность области легкой цепи иммуноглобулина для создания библиотеки генов легких цепей. Другой эффективный подход предназначен для рекомбинирования VH или VL доменов, отобранных посредством фагового дисплея с репертуарами природных вариантов V-домена, полученных из неиммунизированных доноров и скрининга на предмет более высокой аффинности в нескольких витках цепи, перегруппированных, как описано в Marks et al., Biotechnol., 10: 779-783 (1992). Этот метод обеспечивает продуцирование антител и фрагментов антител с аффинностью приблизительно 10-9 M или менее.
[0102] Скрининг библиотек может быть завершен посредством различных методик, известных в данной области. Например, антиген можно использовать, чтобы покрыть лунки адсорбционных планшетов, экспрессируемых на клетках-хозяевах, прикрепленных к адсорбционным планшетам или применяемым клеточной сортировке, или конъюгированным с биотином для захвата с покрытыми стрептавидином гранулами, или применяемые в других способах для пэннинга библиотек фагового дисплея.
[0103] Образцы фаговых библиотек приводят в контакт с иммобилизованным антигеном в условиях, пригодных для связывания, по меньшей мере, части фаговых частиц с адсорбентом. Обычно, условия, включая pH, ионную силу, температуру и т.п. выбирают, чтобы имитировать физиологические условия. Фаги, связанные с твердой фазой, отмывают, а затем элюируют посредством кислоты, например, как описано в Barbas et al., Proc. Natl. Acad. Sci USA, 88: 7978-7982 (1991), или посредством щелочи, например, как описано в Marks et al., J. Mol. Biol., 222: 581-597 (1991), или посредством антигенной конкуренции, например, во время процедуры, сходной с методом антигенной конкуренции Clackson et al., Nature, 352: 624-628 (1991). Фаги могут быть обогащены в 20-1000 раз за один виток отбора. Кроме того, обогащенные фаги можно выращивать в бактериальной культуре и подвергнуты дополнительным виткам отбора.
[0104] Эффективность отбора зависит от многих факторов, включая кинетику диссоциации во время отмывания, и то, могут ли множественные фрагменты антител на единичном фаге одновременно связываться с антигеном. Антитела с быстрой кинетикой диссоциации (и слабыми связывающими аффинностями) могут поддерживаться посредством использования коротких отмывок, мультивалентного фагового дисплея и высокой плотности покрытия антигена в твердой фазе. Высокая плотность не только стабилизирует фаг через мультивалентные взаимодействия, но способствует повторному связыванию фага, который диссоциировал. Отбор антител с медленной кинетикой диссоциации (и хорошими связывающими аффиностями) могут быть промотированы посредством использования длинных отмывок и моновалентного фагового дисплея, как описано в Bass et al., Proteins, 8: 309-314 (1990) и в WO 92/09690, и низкая плотность покрытия антигена, как описано в Marks et al., Biotechnol., 10: 779-783 (1992).
[0105] Возможно выбрать между фаговыми антителами различной аффинности, даже с аффинностями, которые слегка отличаются для антигена. Однако случайная мутация выбранного антитела (например, как происходит при некоторых методах созревания аффинности) похоже вызывает многочисленные мутации, большинство связывания с антигеном, и немного с более высокой аффинностью. С применением лимитирующего антигена, редкий фаг с высокой аффиностью может конкурировать. Чтобы сохранить все мутанты с более высокой аффинностью, фаги можно инкубировать с избыточным биотинилированным антигеном, но с биотинилированным антигеном при концентрации более низкой молярности, чем таргетная молярная аффинность, постоянная для антигена. Фаги с высокой аффинностью-связыванием могут затем быть захвачены посредством стрептавидин-покрытых парамагнитных гранул. Такой “равновесный захват” позволяет антителам быть выбранными в соответствии с их аффинностями связывания, с чувствительностью, которая позволяет выделить мутантные клоны с всего лишь в два раза большей аффинностью из большого избытка фагов с более низкой аффинностью. Условия, применяемые при отмывке фагов, связанных с твердой фазой, можно также регулировать, чтобы дискриминировать на основе кинетики диссоциации.
[0106] Анти-антигенные клоны можно выбирать на основе активности. В определенных вариантах осуществления, изобретение относится к анти-антигенным антителам, которые связываются с живыми клетками, которые в природе экспрессируют антиген или связываются со свободно перемещающимися антигенами или антигенами, прикрепленными к другим клеточным структурам. Fv клоны, соответствующие таким анти-антигенным антителам, можно выбирать посредством (1) выделения анти-антигенных клонов из фаговой библиотеки, как описано выше, и необязательно амплифицируя выделенную популяцию фаговых клонов посредством выращивания популяции в подходящем бактериальном хозяине; (2) выбор антигена и второго белка, против которого есть блокирующая и неблокирующая активность, соответственно, является желаемым; (3) адсорбирование анти-антигенных клонов фагов к иммобилизованному антигену; (4) применение избытка второго белка для элюирования любых нежелательных клонов, которые распознают антигенсвязывающие детерминанты, которые перекрывают или разделяют со связывающими детерминантами второго белка; и (5) элюирование клонов, которые остаются адсорбированными после этапа (4). Необязательно, клоны с желаемыми блокирующими/неблокирующими свойствами могут быть дополнительно обогащены повторением процедур отбора, описываемых в настоящем документе один или несколько раз.
[0107] ДНК, кодирующая полученные из гибридомы моноклональные антитела или клоны фагового дисплея Fv, легко выделяют и секвенируют с применением общепринятых процедур (например, с применением олигонуклеотидных праймеров, предназначенных для специфичной амплификации кодирующих областей тяжелой и легкой цепи, представляющих интерес, из гибридомы или матрицы фага ДНК). Будучи выделенной, ДНК можно поместить в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E. coli, клетки обезьян COS, клетки яичника китайского хомяка (CHO) или миеломные клетки, которые иначе не продуцируют белки иммуноглобулинов, чтобы получить синтез желаемых моноклональных антител в рекомбинантных клетках-хозяевах. Обзорные статьи по рекомбинантной экспрессии в бактериях антитело-кодирующей ДНК включают Skerra et al., Curr. Opinion in Immunol., 5: 256 (1993) и Pluckthun, Immunol. Revs, 130: 151 (1992).
[0108] ДНК, кодирующую Fv клоны, можно комбинировать с известными ДНК последовательностями, кодирующими константные области тяжелой цепи и/или легкой цепи (например, соответствующие последовательности ДНК можно получать из Kabat et al., supra) чтобы образовывать клоны, кодирующие полно- или частично-размерные тяжелые и/или легкие цепи. Следует понимать, что константные области любого изотипа можно использовать для этой цели, включая константные области IgG, IgM, IgA, IgD и IgE, и что эти константные области можно получать из любого человека или вида животного. Fv клон, полученный из вариабельного домена ДНК одного вида животного (такого как человек), а затем слитого с константной областью ДНК другого вида животного для образования кодирующей последовательности(ей) для “гибридной” полноразмерной тяжелой цепи и/или легкой цепи включен в определение “химерного” и “гибридного” антитела, как применяют в настоящем документе. В определенных вариантах осуществления, Fv клон, полученный вариабельной ДНК человека слит с константной областью ДНК человека, чтобы образовать кодирующую последовательность(и) для полно- или частично размерной тяжелой и/или легкой цепей человека.
[0109] ДНК кодирующая анти-антигенное антитело, полученное из гибридомы также может быть модифицировано, например, посредством замены кодирующей последовательности на константные домены тяжелой и легкой цепи человека вместо однородных мышиных последовательностей, полученных из клона гибридомы (например, как в способе Morrison et al., Proc. Natl. Acad. Sci. USA, 81: 6851-6855 (1984)). ДНК, кодирующая антитело или фрагмент, полученные из гибридомы или Fv клона, могут быть дополнительно модифицированы посредством ковалентного связывания с кодирующей иммуноглобулин последовательностью всей или частью кодирующей последовательности для неиммуноглобулинового полипептида. Таким образом, получают “химерные” или “гибридные” антитела, которые обладают специфичностью связывания антител, полученных из Fv клона или клона гибридомы.
(iv) Гуманизированные антитела и антитела человека
[0110] Различные способы гуманизирования не принадлежащих человеку антител известны в данной области. Например, гуманизированное антитело имеет один или несколько аминокислотных остатков, введенных в него из источника, который не является человеком. Эти не принадлежащие человеку аминокислотные остатки часто обозначаются как “импортируемые” остатки, которые, как правило, взяты из “импортируемого” вариабельного домена. Гуманизация может быть по существу совершена по способу Winter и коллег (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)), посредством замены CDR крысы или CDR последовательностей для соответствующих последовательностей антитела человека. Таким образом, такие “гуманизированные” антитела являются химерными антителами (патент США № 4816567), где существенно менее чем интактный вариабельный домен человека был заменен соответствующей последовательностью из не являющихся человеком видов. На практике, гуманизированные антитела, как правило, являются антителами человека, в которых некоторые остатки CDR и возможно некоторые остатки FR заменены остатками из аналогичных сайтов в крысиных антителах.
[0111] Выбор вариабельных доменов человека, как легких, так и тяжелых, предназначенных для создания гуманизированных антител является очень важным для уменьшения антигенности. В соответствии с так называемым “наилучшим подобранным” способом, последовательность вариабельного домена крысиного антитела скринируют против общей библиотеки известных последовательностей вариабельных доменов человека. Последовательность человека, которая является самой близкой к последовательности крысы, также принимается человеческий каркас (FR) для гуманизированного антитела (Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987)). В другом способе применяют конкретный каркас, полученный из консенсусной последовательности всех антител человека конкретной подгруппы легкой или тяжелой цепей. Тот же каркас можно использовать для нескольких различных гуманизированных антитела (Carter et al., Proc. Natl. Acad Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993)).
[0112] Дополнительно является важным, что антитела являются гуманизированными с сохранением высокой аффинности антигена и других предпочтительных биологических свойств. Для достижения этой цели, в соответствии с одним из вариантов осуществления этого способа, гуманизированные антитела получают посредством процесса анализа родительских последовательностей и различных концептуальных гуманизированных продуктов с применением трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов являются обычно доступными и хорошо известными специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и демонстрируют возможные трехмерные конформационные структуры выбранных кандидатных последовательностей иммуноглобулинов. Инспекция этих дисплеев дает возможность анализа подходящей роли этих остатков в функционировании кандидатной последовательности иммуноглобулина, т.е. анализ остатков, который влияет на способность кандидатного иммуноглобулина связываться со своим антигеном. Таким образом, FR остатки можно выбирать и комбинировать из реципиента и импортируемых последовательностей, чтобы желаемая характеристика антитела, такая как увеличенная аффинность для таргетного антигена(ов), была достигнута. В основном, гипервариабельная область остатков напрямую и наиболее существенным образом вовлечена в воздействие на связывание антигена.
[0113] Антитела человека в составах и композициях, описываемых в настоящем документе, можно конструировать посредством комбинирования последовательности(ей) вариабельного домена Fv клона, выбранных библиотек фагового дисплея, относящихся к человеку, с известными последовательностью(ями) константного домена человека, как описано выше. Альтернативно, моноклональные антитела человека могут быть сделаны посредством гибридомного способа. Миелома человека и клеточные линии гетеромиеломы мышь-человек для продуцирования моноклональных антител человека были описаны, например, Kozbor J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987); и Boerner et al., J. Immunol., 147: 86 (1991).
[0114] Является возможным получать трансгенных животных (например, мышей), которые способны при иммунизации продуцировать полный репертуар антител человека в отсутствие эндогенного продуцирования иммуноглобулина. Например, было описано, что гомозиготная делеция гена области, связывающей тяжелую цепь (JH) антитела в химерных и зародышевых линиях мутантных мышей, приводит к полному ингибированию эндогенного продуцирования антител. Перенос генетической информации иммуноглобулина зародышевой линии человека в такой зародышевой линии мутантной мыши вызовет продуцирование антител человека при стимуляции антигеном. См., например, Jakobovits et al, Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immuno., 7:33 (1993); и Duchosal et al. Nature 355:258 (1992).
[0115] Генную перетасовку также можно использовать, чтобы получать антитела человека из антител, не принадлежащих человеку, например, крыс, антител, где антитело человека имеет подобные аффиности и специфичности к исходному, не принадлежащему человеку антителу. В соответствии с этим способом, который также называется “эпитопный импринтинг”, вариабельная область или тяжелой или легкой цепи фрагмента антитела, не принадлежащего человеку, полученного посредством методов фагового дисплея, как описано в настоящем документе, заменена репертуаром генов V-домена человека, создавая популяцию scFv или Fab химер не принадлежащей человеку цепи/цепи человека. Выбор антигенов приводит к выделению химерной scFv или Fab не принадлежащей человеку цепи/ цепи человека, где цепь человека восстанавливает антигенсвязывающий участок, разрушенный при удалении соответствующей цепи, не принадлежащей человеку, в первичном клоне фагового дисплея, т.е. эпитоп управляет (отпечатывает) выбором партнера цепи человека. Когда процесс повторяют, чтобы заменить оставшуюся не принадлежащую человеку цепь, получают антитело человека (см. PCT WO 93/06213 опубликованное 1 апреля 1993). Несмотря на традиционную гуманизацию не принадлежащих человеку антител посредством пересадки CDR, эта техника предоставляет полностью человеческие антитела, которые не имеют FR или CDR остатков источника, не принадлежащего человеку.
(v) Фрагменты антител
[0116] Фрагменты антител можно получать традиционными средствами, такими как ферментативное расщепление, или посредством рекомбинантных способов. В определенных обстоятельствах существуют преимущества использования фрагментов антител, скорее чем целых антител. Чем меньше размер фрагментов, тем он легче позволяет быстрое очищение, и может приводить к улучшенному доступу к солидным опухолям. Для обзора определенных фрагментов антител, см. Hudson et al. (2003) Nat. Med. 9:129-134.
[0117] Были разработаны различные технические средства для получения фрагментов антител. Традиционно, эти фрагменты получали посредством протеолитического расщепления интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992); и Brennan et al., Science, 229:81 (1985)). Однако эти фрагменты в настоящее время могут быть получены непосредственно рекомбинантными клетками-хозяевами. Fv и ScFv фрагменты антитела Fab все могут быть экспрессированы и секретированы из E. coli, таким образом, способствуя более легкому получению больших количеств этих фрагментов. Фрагменты антител могут быть выделены из антител фаговых библиотек, обсуждаемых выше. Альтернативно, Fab'-SH фрагменты могут быть непосредственно восстановлены из E. coli и химически спарены для образования F(ab')2 фрагментов (Carter et al., Bio/Technology 10:163-167 (1992)). В соответствии с другим подходом F(ab')2 фрагменты могут быть выделены непосредственно из рекомбинантной клеточной культуры-хозяина. Fab и F(ab')2 фрагмент с увеличенным in vivo временем полужизни, содержащий остатки эпитопа, связывающего рецептор реутилизации, описаны в патенте США № 5869046. Другие методы для продуцирования фрагментов антител очевидны практикующим специалистам. В определенных вариантах осуществления, антитело является одноцепочечным Fv фрагментом (scFv). См. WO 93/16185; патенты США № 5571894 и 5587458. Fv и scFv являются единственными видами с интактными комбинирующими сайтами, которые лишены константных областей; таким образом, они могут быть пригодными для уменьшенного неспецифического связывания во время использования in vivo. scFv слитые белки можно конструировать, чтобы получать слияние эффекторного белка либо на амино или карбокси конце scFv. См. Antibody Engineering, ed. Borrebaeck, supra. Фрагмент антитела может также быть “линейным антителом”, например, как описано в патенте США № 5641870, например. Такие линейные антитела могут быть моноспецифическими или биспецифическими.
(vi) Полиспецифические антитела
[0118] Полиспецифические антитела обладают специфичностью связывания для, по меньшей мере, двух различных эпитопов, где эпитопы, как правило, из различных антигенов. В то время как такие молекулы нормально только связывают два различных эпитопа (т.е. биспецифические антитела, BsAb), антитела с дополнительными специфичностями, такие как триспецифические антитела, охватываются этой экспрессией, когда применяют в настоящем документе. Биспецифические антитела можно получать в качестве полноразмерных антител или фрагментов антител (например, F(ab')2 биспецифических антител).
[0119] Способы создания биспецифических антител известны в данной области. Традиционное получение полноразмерных биспецифических антител основано на коэкспрессии двух пар тяжелой цепи и легкой цепи, где эти две цепи имеют различные специфичности (Millstein et al., Nature, 305:537-539 (1983)). Из-за случайной реаранжировки тяжелой и легкой цепей иммуноглобулина, эти гибридомы (квадромы) производят потенциальную смесь 10 различных молекул антител, из которых только одно имеет правильную биспецифическую структуру. Очистка правильной молекулы, которая, как правило, сделана посредством этапов аффинной хроматографии, является довольно трудоемкой, и выход продуктов является низким. Подобные процедуры описаны в WO 93/08829, и в Traunecker et al., EMBO J., 10:3655-3659 (1991).
[0120] В соответствии с различным подходом, вариабельные домены антитела с желаемыми специфичностями связывания (антитело-антигенсвязывающие участки) слиты с последовательностями константного домена иммуноглобулина. Слияние предпочтительно с константным доменом тяжелой цепи иммуноглобулина, содержащим, по меньшей мере, части шарнирных областей CH2 и CH3. Обычным является иметь первую константную область тяжелой цепи (CH1), содержащую сайт, необходимо для связывания легкой цепи, присутствующего в, по меньшей мере, одном из слияний. ДНК, кодирующие слияния тяжелых цепей иммуноглобулина и, при желании, легкая цепь иммуноглобулина, вставлены в отдельные экспрессирующие векторы, и совместно трансфицируются в подходящий организм-хозяин. Это обеспечивает большую гибкость в корректировке взаимных пропорций трех полипептидных фрагментов в варианте осуществления, когда неравные соотношения трех полипептидных цепей, применяемых в конструкции, предоставляют оптимальные выходы. Однако возможным является вставить кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессирующий вектор, когда экспрессия по меньшей мере двух полипептидных цепей в равных соотношениях приводит к высоким выходам, или когда соотношения не являются особенно значимыми.
[0121] В одном из вариантов осуществления этого подхода, биспецифические антитела составлены из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания в одном режиме, и гибридной пары тяжелой цепь-легкая цепь иммуноглобулина (представляющая вторую специфичность связывания) в другом режиме. Было выявлено, что эта ассиметричная структура облегчает разделение желаемого биспецифического соединения от нежелательных комбинаций цепей иммуноглобулинов, так как присутствие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы представляет легкий путь разделения. Этот подход описан в WO 94/04690. Более подробно об образовании биспецифических антител см., например, Suresh et al., Methods in Enzymology, 121:210 (1986).
[0122] В соответствии с другим подходом, описанным в WO96/27011, граница взаимодействия между парой молекул антител может быть сконструирована, чтобы максимизировать процент гетеродимеров, которые восстановлены из рекомбинантной культуры клеток. Одна граница взаимодействия содержит, по меньшей мере, часть домена CH 3 константного домена антитела. В этом способе, одна или несколько небольших аминокислотных боковых цепей из границы взаимодействия первой молекулы антитела заменены большими боковыми цепями (например, тирозином или триптофаном). Компенсаторные “полости” идентичного или подобного размера с большой боковой цепью(ями) созданы на границе взаимодействия второй молекулы антитела посредством замещения больших аминокислотных боковых цепей небольшими (например, аланин или треонин). Это представляет механизм для повышения выхода гетеродимера над другими нежелательными конечными продуктами, такими как гомодимеры.
[0123] Биспецифические антитела включают поперечно-сшитые или “гетероконъюгированные” антитела. Например, одно из антител в гетероконъюгате может быть спарено с авидином, другое с биотином. Предполагалось, что такие антитела, например, направлять клетки иммунной системы к нежелательным клеткам (патент США № 4676980), и для лечения HIV инфекции (WO 91/00360, WO 92/200373 и EP 03089). Гетероконъюгированные антитела могут быть сделаны с применением любых целесообразных способов поперечного сшивания. Подходящие сшивающие средства хорошо известны в данной области, и описаны в патенте США № 4676980, наряду с рядом методов поперечного сшивания.
[0124] Способы образования биспецифических антител из фрагментов антител также были описаны в литературе. Например, биспецифические антитела можно получать с применением химической связи. Brennan et al., Science, 229: 81 (1985) описывают процедуру, где интактные антитела протеолитическим образом расщепляют для образования F(ab')2 фрагментов. Эти фрагменты уменьшают в присутствии дитиолового комплексообразователя натрий арсенита, чтобы стабилизировать вицинальные дитиолы и предотвратить образование межмолекулярных дисульфидов. Образованные Fab' фрагменты затем превращают в производные тионитробензоата (TNB). Один из Fab'-TNB производных затем повторно превращают в Fab'-тиол посредством восстановления с применением меркаптоэтиламина и смешивают с эквимолярным количеством другого Fab'-TNB производного, чтобы образовать биспецифическое антитело. Продуцированные биспецифические антитела можно использовать в качестве средств для селективной иммобилизации ферментов.
[0125] Недавний прогресс облегчил прямое восстановление Fab'-SH фрагментов из E. coli, которые могут быть химически спарены для образования биспецифических антител. Shalaby et al., J. Exp. Med., 175: 217-225 (1992) описывает продуцирование полностью молекулы гуманизированного биспецифического антитела F(ab')2. Каждый Fab' фрагмент был отдельно секретирован из E. coli и подвергнут прямому химическому спариванию in vitro для образования биспецифического антитела.
[0126] Различные методы для создания и выделения фрагментов биспецифических антител непосредственно из рекомбинантной клеточной культуры также были описаны. Например, биспецифические антитела были продуцированы с применением лейциновых застежек. Kostelny et al., J. Immunol., 148(5):1547-1553 (1992). Пептиды лейциновой застежки из белков Fos и Jun белки были связаны с Fab' частями двух различных антитела посредством слияния генов. Гомодимеры антител были уменьшены в шарнирной области, чтобы образовать мономеры, а затем повторно окислены, чтобы образовать гетеродимеры антител. Этот способ также может быть использован для продуцирования гомодимеров антител. Технология “диател”, описанная Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993) предоставила альтернативный механизм для создания фрагментов биспецифического антитела. Эти фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) посредством линкера, который слишком мал, чтобы позволить образовать пару между двумя доменами на той же цепи. Таким образом, VH и VL домены одного фрагмента вынуждены образовать пару с комплементарными VL и VH доменами другого фрагмента, таким образом, формируя два антигенсвязывающих участка. О другой стратегии создания фрагментов биспецифического антитела посредством применения одноцепочечных Fv (sFv) димеров также сообщалось. См. Gruber et al, J. Immunol, 152:5368 (1994).
[0127] Рассматриваются антитела с более чем двумя валентностями. Например, можно получать триспецифические антитела. Tuft et al. J. Immunol. 147: 60 (1991).
(vii) Однодоменные антитела
[0128] В некоторых вариантах осуществления, антитело является однодоменным антителом. Однодоменное антитело является единичной полипептидной цепью, содержащей весь или часть вариабельного домена тяжелой цепи или весь или часть вариабельного домена легкой цепи антитела. В определенных вариантах осуществления, однодоменное антитело является однодоменным антителом человек (Domantis, Inc., Waltham, Mass.; См., например, патент США № 6248516 B1). В одном из вариантов осуществления, однодоменное антитело состоит из всех или части вариабельного домена тяжелой цепи антитела.
(viii) Варианты антител
[0129] В некоторых вариантах осуществления рассматривают модификация(и) аминокислотных последовательностей антител, описываемых в настоящем документе. Например, может быть желательным улучшить аффинность связывания и/или другие биологические свойства антитела. Варианты аминокислотной последовательности антитела можно получать посредством введения соответствующих изменений в нуклеотидную последовательность кодирующего антитела или посредством пептидного синтеза. Такие модификации включают, например, делеции из, и/или вставки в и/или замены остатков внутри аминокислотных последовательностей антитела. Любая комбинация делеции, вставки и замены может быть произведена для получения конечного конструкта, при условии, что конечный конструкт обладает желаемыми характеристиками. Сдвиги аминокислот могут быть произведены в указанной аминокислотной последовательности антитела в то время, когда эта последовательность сделана.
(ix) Производные антител
[0130] Антитела в составах и композициях по изобретению могут быть дополнительно модифицированы, чтобы содержать дополнительные небелковые функциональные группы, которые известны в данной области и легкодоступны. В определенных вариантах осуществления, функциональные группы, пригодные для дериватизации антитела, являются водорастворимыми полимерами. Неограничивающие примеры водорастворимых полимеров в качестве неограничивающих примеров включают, полиэтиленгликоль (PEG), сополимеры этилен гликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинил пирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилен/малеиновый ангидрид, полиаминокислоты (или гомополимеры или статистические сополимеры), и декстран или поли(n-винил пирролидон)полиэтиленгликоль, гомополимеры пропропиленгликоля, сополимеры пролипропилен оксид/этилен оксид, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Полиэтиленгликоль пропиональдегид может обладать преимуществами при производстве вследствие его стабильности в воде. Полимер может быть любой молекулярной массы, и может быть разветвленным или неразветвленным. Количество полимеров, прикрепленных к антителу, может варьировать, и если прикреплен более чем один полимер, они могут быть одной и той же или различными молекулами. В основном, число и/или тип полимеров, применяемых для дериватизации, можно определять на основе рекомендаций, включая в качестве неограничивающих примеров, конкретные свойства или функции антитела, которое надо улучшить, будет ли применяться производное антитела в терапии при определенных условиях и т.д.
(x) Векторы, клетки-хозяева и способы рекомбинации
[0131] Антитела могут также быть образованы с применением рекомбинантных способов. Для рекомбинантного продуцирования анти-антигенного антитела, нуклеиновую кислоту, кодирующую антитело выделяют и вставляют в реплицируемый вектор для дополнительного клонирования (амплификация ДНК) или для экспрессирования. ДНК, кодирующая антитело, может быть с легкостью выделена и секвенирована с применением общепринятых методов (например, посредством применения олигонуклеотидных зондов, которые способны к специфическому связыванию к генам, кодирующим тяжелую и легкую цепи антитела). Многие векторы являются доступными. Компоненты вектора, как правило, в качестве неограничивающих примеров включают, один или несколько из следующих: сигнальную последовательность, участок начала репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
(a) Компонент сигнальной последовательности
[0132] Антитело в составах и композициях, описываемых в настоящем документе, можно получать рекомбинантным образом не только напрямую, но также в качестве полипептида слияния с гетерологичным полипептидом, который предпочтительно является сигнальной последовательностью или другим полипептидом, имеющим специфический участок расщепления на N-конце зрелого белка или полипептида. Выбранная гетерологичная сигнальная последовательность предпочтительно является одной, которая распознается и обрабатывается (например, расщепляется сигнальной пептидазой) клеткой-хозяином. Для прокариотических клеток-хозяев, которые не распознают и не обрабатывают сигнальную последовательность нативного антитела, сигнальная последовательность заменена выбранной прокариотической сигнальной последовательностью, например, из лидеров группы щелочной фосфатазы, пенициллиназы, lpp или термостабильного энтеротоксина II. Для секреции в дрожжах нативная сигнальная последовательность может быть заменена посредством, например, лидера инвертазы дрожжей, факторного лидера (включая Saccharomyces и Kluyveromyces α-фактор лидеры), или лидера кислой фосфатазы, лидера глюкоамилазы C. albicans или сигнала, описанного в WO 90/13646. При экспрессии в клетке млекопитающего доступными являются сигнальные последовательности млекопитающего, а также вирусные секреторные лидеры, например, gD сигнал вируса простого герпеса.
(b) Участок начала репликации
[0133] И экспрессирующий и клонирующие векторы содержат последовательность нуклеиновой кислоты, которая позволяет вектору реплицироваться в одном или нескольких выбранных клетках-хозяевах. Как правило, В клонирующих векторах эта последовательность позволяет вектору реплицироваться независимо от хромосомной ДНК хозяина, и включает участки начала репликации или автономно реплицирующиеся последовательности. Такие последовательности хорошо известны для разнообразных бактерий, дрожжей и вирусов. Участок начала репликации из плазмиды pBR322 является пригодным для большинства грамотрицательных бактерий, 2µ, плазмидный источник пригоден для дрожжей и различных вирусных источников (SV40, полиома, аденовирус, VSV или BPV) пригодны для клонирующих векторов в клетках млекопитающих. Как правило, компонент участка начала репликации не нужен для экспрессирующих векторов млекопитающих (SV40 источник может в основном использоваться только потому, что содержит ранний промотор.
(c) Компонент селективного гена
[0134] Экспрессирующие и клонирующие векторы могут содержать селективный ген, также называемый селектируемый маркер. В основном селективные гены кодируют белки, которые (a) придают устойчивость к антибиотикам или другим токсинам, например, ампициллину, неомицину, метотрексату или тетрациклину, (b) дополняют ауксотрофные недостаточности, или (c) снабжают критическими питательными веществами, не доступными из комплексной среды, например, ген, кодирующий D-аланин рацемазу для Bacilli.
[0135] Один пример селективной схемы использует лекарственный препарат, чтобы подавить рост клетки-хозяина. Те клетки, которые успешно трансформируются гетерологичным геном, продуцируют белок, придающий устойчивость к лекарственному препарату и таким образом выживаемость при выбранном режиме. Примеры такого доминантного отбора применяют препараты неомицин, микофеноловая кислота и гигромицин.
[0136] Другим примером подходящих селектируемых маркеров клеток млекопитающих являются те, которые обеспечивают идентификацию компонентов клеток, чтобы захватить антитело-кодирующую нуклеиновую кислоту, такие как DHFR, глутамин синтетаза (GS), тимидин киназа, металлотионеин-I и -II, предпочтительно гены металлотионеина приматов, аденозин деаминазы, орнитин декарбоксилаза и т.д.
[0137] Например, клетки, трансформированные геном DHFR идентифицируют посредством культивирования трансформантов в среде для культивирования, содержащей метотрексат (Mtx), конкурентный антагонист DHFR. В этих условиях, ген DHFR амплифицируют наряду с любой другой котрансформированной нуклеиновой кислотой. Можно использовать клеточную линию яичника китайского хомячка (CHO), дефицитную в отношении эндогенной DHFR активности (например, ATCC CRL-9096).
[0138] Альтернативно, клетки, трансформированные GS геном, идентифицируют посредством культивирования трансформантов в среде для культивирования, содержащей L-метионин сульфохимин (Msx), ингибитор GS. В этих условиях, ген GS амплифицируют наряду с любой другой котрансформированной нуклеиновой кислотой. Систему отбора/амплификации GS можно использовать в комбинации с системой отбора/амплификации DHFR, описанной выше.
[0139] Альтернативно, клетки-хозяева (конкретно хозяева дикого типа, которые содержат эндогенный DHFR), трансформированные или контрансформированные с применением последовательности ДНК, кодирующей антитело, представляющее интерес, гена DHFR дикого типа, и другого селектируемого маркера, такого как аминогликозид 3'-фосфотрансфераза (APH), можно отбирать на основе клеточного роста в среде, содержащей средство отбора для селектируемого маркера, такого как аминогликозидный антибиотик, например, канамицин, неомицин или G418. См. патент США № 4965199.
[0140] Подходящим селективным геном для применения в дрожжах является ген trp1, присутствующий в дрожжевой плазмиде YRp7 (Stinchcomb et al., Nature, 282:39 (1979)). Ген trp1 представляет селективный маркер для мутантного штамма дрожжей, у которых отсутствует способность расти в триптофане, например, ATCC No. 44076 или PEP4-1. Jones, Genetics, 85:12 (1977). Наличие повреждения trp1 в геноме дрожжевой клетки-хозяине затем предоставляет эффективное окружение для детекции трансформации посредством роста в отсутствие триптофана. Сходным образом, Leu2-дефицитные штаммы дрожжей (ATCC 20622 или 38626) дополнены известными плазмидами, несущими ген Leu2.
[0141] Вдобавок, векторы, полученные из 1,6 мкм кольцевой плазмиды pKD1, можно использовать для трансформации дрожжей Kluyveromyces. Альтернативно, сообщалось об экспрессирующей системе для крупномасштабного производства рекомбинантного химозина теленка для K. lactis. Van den Berg, Bio/Technology, 8:135 (1990). Также были описаны стабильные многокопийные экспрессирующие векторы для секреции зрелого рекомбинантного сывороточного альбумина человека посредством промышленных штаммов Kluyveromyces. Fleer et al., Bio/Technology, 9:968-975 (1991).
(d) Компонент промотора
[0142] Экспрессирующие и клонирующие векторы, как правило, содержат промотор, который распознается организмом-хозяином и является функционально связанным с нуклеиновой кислотой, кодирующей антитело. Промоторы, пригодные для использования с прокариотическими хозяевами, включают промотор phoA, β-лактамазную и лактозную промоторные системы, промотор щелочной фосфатазы, триптофановую (trp) промоторную систему, и гибридные промоторы, такие как tac промотор. Однако другие известные бактериальные промоторы являются подходящими. Промоторы для применения в бактериальных системах также содержат последовательность Shine-Dalgarno (S.D.), функционально связанную с ДНК, кодирующей антитело.
[0143] Промоторные последовательности известны для эукариот. Фактически все эукариотические гены имеют AT-богатую область, расположенную приблизительно от 25 до 30 основания вверх от сайта, где начинается транскрипция. Другой последовательностью, обнаруженной от 70 до 80 основания вверх от начала транскрипции многих генов, является CNCAAT область, где N может быть любым нуклеотидом. На 3' конце большинства эукариотических генов находится последовательность AATAAA, которая может быть сигналом для добавления поли A хвоста к 3' концу кодирующей последовательности. Все эти последовательности соответствующим образом вставлены в эукариотические экспрессирующие векторы.
[0144] Примеры подходящих промоторных последовательностей для применения с дрожжевыми хозяевами включают промоторы для 3-фосфоглицераткиназы или других гликолитических ферментов, таких как энолаза, глицеральдегид-3-фосфат дегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкоза-6-фосфат изомераза, 3-фосфоглицерат мутаза, пируват киназа, триозофосфат изомераза, фосфоглюкоза изомераза и глюкокиназа.
[0145] Другие дрожжевые промоторы, которые являются индуцибельными промоторами, имеющими дополнительное преимущество транскрипции, контролируемой посредством условий роста, являются промоторные области для алкогольдегидрогеназы 2, изоцитохрома C, кислой фосфатазы, деструктивных ферментов, связанных с метаболизмом азота, металлотионеин, глицеральдегид-3-фосфат дегидрогеназа, и ферменты, ответственные за усвояемость мальтозы и галактозы. Подходящие векторы и промоторы для применения в дрожжевой экспрессии дополнительно описаны в EP 73657. Дрожжевые энхансеры также преимущественно применяют с дрожжевыми промоторами.
[0146] Транскрипцию антител из векторов в клетках-хозяевах млекопитающих можно контролировать, например, посредством промоторов, полученных из геномов вирусов, таких как вирус полиомы, вирус куриной оспы, аденовирус (такой как аденовирус 2), вирус папилломы быка, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита-B, вирус обезьян 40 (SV40), или из гетерологичных промоторов млекопитающих, например, актиновый промотор или иммуноглобулиновый промотор, промоторы белков теплового шока, в случае если представленные промоторы являются совместимыми с системой клетка-хозяин.
[0147] Ранние и поздние промоторы вируса SV40 беспрепятственно получают в качестве рестрикционного фрагмента SV40, который также содержит SV40 вирусный участок начала репликации. Предранний промотор цитомегаловируса человека беспрепятственно получают как рестрикционный фрагмент HindIII E. Система, экспрессирующая ДНК в клетках-хозяевах млекопитающих с применением вируса папилломы быка в качестве вектора, описана в патенте США № 4419446. Модификация этой системы описана в патенте США № 4601978. См. также Reyes et al., Nature 297:598-601 (1982) на экспрессию кДНК β-интерферона человека в клетках мыши под контролем тимидин киназного промотора из вируса простого герпеса. Альтернативно, длинный концевой повтор вируса саркомы Рауса можно использовать в качестве промотора.
(e) Компонент энхансерного элемента
[0148] Транскрипцию ДНК, кодирующей антитело, высшими эукариотами часто повышают посредством вставки энхансерной последовательности в вектор. Многие энхансерные последовательности сейчас известны из генов млекопитающих (глобин, эластаза, альбумин, α-фетобелок, и инсулин). Как правило, однако, используют энхансер из вируса эукариотической клетки. Примеры включают энхансер SV40 на поздней стороне от точки начала репликации (bp 100-270), ранний промоторный энхансер цитомегаловируса, энхансер полиомы на поздней стороне от точки начала репликации, и аденовирусные энхансеры. См. также Yaniv, Nature 297:17-18 (1982) на предмет энхансерных элементов для активации эукариотических промоторов. Энхансер может быть сплайсирован внутрь вектора в положении 5' или 3' к антитело-кодирующей последовательности, но предпочтительно расположен в сайте 5' от промотора.
(f) Компонент терминации транскрипции
[0149] Экспрессирующие векторы, применяемые в эукариотических клетках-хозяевах (дрожжи, грибы, насекомое, растение, животное, человек или ядросодержащие клетки от других многоклеточных организмов), также содержат последовательности, необходимые для терминации транскрипции и для стабилизации mRNA. Такие последовательности широко доступны из 5' и, иногда 3', нетранслируемых областей эукариотической или вирусной ДНК или кДНК. Эти области содержат нуклеотидные сегменты, транскрибируемые как полиаденилатные фрагменты в нетранслируемой части mRNA, кодирующей антитело. Одним пригодным компонентом терминации транскрипции является область полиаденилирования гормона роста быка. См. WO94/11026 и экспрессирующий вектор, описанные в настоящем документе.
(g) Отбор и трансформация клеток-хозяев
[0150] Подходящими клетками-хозяевами для клонирования или экспрессии ДНК в векторах в настоящем документе являются прокариоты, дрожжи, или клетки высших эукариот, описанные выше. Подходящие прокариоты для этой цели включают эубактерии, такие как грамотрицательные или грамположительные организмы, например, Enterobacteriaceae, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например, Serratia marcescans, и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P, описанные в DD 266710, опубликованном 12 апреля 1989 года), Pseudomonas, такие как P. aeruginosa, и Streptomyces. Предпочтительным E. coli клонирующим хозяином является E. coli 294 (ATCC 31446), хотя другие штаммы, такие как E. coli B, E. coli X1776 (ATCC 31537), и E. coli W3110 (ATCC 27,325), являются подходящими. Эти примеры являются иллюстративными, а не ограничивающими.
[0151] Полноразмерное антитело, слитые белки антител и фрагменты антител можно получать в бактериях, конкретно, когда нет необходимости в гликозилировании и эффекторной функции Fc, например, когда терапевтическое антитело конъюгировано с цитотоксическим средством (например, токсином), который сам по себе демонстрирует эффективность при разрушении опухолевых клеток. Полноразмерные антитела обладают большим временем полувыведения из кровотока. Продуцирование в E. coli быстрее и более экономически эффективно. Для экспрессии фрагментов антител и полипептидов в бактериях, см., например, патент США № 5648237 (Carter et. al.), патент США № 5789199 (Joly et al.), патент США № 5840523 (Simmons et al.), где описаны область инициации трансляции (TIR) и сигнальные последовательности для оптимизации экспрессии и секреции. См. также Charlton, Methods in Molecular Biology, Vol. 248 (B. K. C. Lo, ed., Human Press, Totowa, N.J., 2003), pp. 245-254, описывающие экспрессию фрагментов антител в E. coli. После экспрессии антитело можно выделять из клеточной массы E. coli в растворимой фракции и можно очищать посредством, например, колонки белка A или G в зависимости от изотипа. Окончательную очистку можно проводить сходным образом со способом очистки антитела, экспрессируемого, например, в клетках CHO.
[0152] Вдобавок к прокариотам, эукариотические микробы, такие как нитевидные грибы или дрожжи, являются подходящими клонирующими или экспрессирующими хозяевами для антитело-кодирующих векторов. Saccharomyces cerevisiae, или обычные пекарские дрожжи, являются наиболее широко используемыми среди низших эукариотических микроорганизмов-хозяев. Однако, ряд других родов, видов и штаммов широко доступен и пригоден в настоящем документе, такие как Schizosaccharomyces pombe; Kluyveromyces хозяева, такие как, например, K. lactis, K. fragilis (ATCC 12,424), K. bulgaricus (ATCC 16,045), K. wickeramii (ATCC 24,178), K. waltii (ATCC 56,500), K. drosophilarum (ATCC 36,906), K. thermotolerans, и K. marxianus; yarrowia (EP 402,226); Pichia pastoris (EP 183,070); Candida; Trichoderma reesia (EP 244,234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и нитевидные грибы, такие как, например, Neurospora, Penicillium, Tolypocladium, и Aspergillus хозяева, такие как A. nidulans и A. niger. Для обзорного обсуждения применения дрожжей и нитевидных грибов для продуцирования терапевтических белков, см., например, Gerngross, Nat. Biotech. 22:1409-1414 (2004).
[0153] Можно выбирать определенные штаммы грибов и дрожжей, в которых пути гликозилирования были “гуманизированы”, что привело к продуцированию антитела с частично или полностью человеческим паттерном гликозилирования. См., например, Li et al., Nat. Biotech. 24:210-215 (2006) (в котором описывают гуманизирование пути гликозилирования в Pichia pastoris); и Gerngross et al., supra.
[0154] Подходящие клетки-хозяева для экспрессии гликозилированного антитела также получают из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток позвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы и варианты и соответствующие пермиссивные клетки-хозяева насекомых от таких хозяев, как Spodoptera frugiperda (гусеница), Aedes aegypti (москит), Aedes albopictus (москит), Drosophila melanogaster (плодовая мушка), и Bombyx mori. Разнообразие вирусных штаммов для трансфекции является общедоступным, например, L-1 вариант Autographa californica NPV и Bm-5 штамм Bombyx mori NPV, и такие вирусы можно использовать в качестве вируса в настоящем документе по изобретению, конкретно для трансфекции клеток Spodoptera frugiperda.
[0155] Растительные клеточные культуры хлопка, кукурузы, картофеля, соевых бобов, петунии, томатов, ряски (Leninaceae), люцерны (M. truncatula) и табака также можно использовать в качестве хозяев. См., например, патенты США № 5959177, 6040498, 6420548, 7125978 и 6417429 (описывающие технологию PLANTIBODIES™ для получения антител в трансгенных растениях).
[0156] Клетки позвоночных можно использовать в качестве хозяев, и размножение клеток позвоночных в культуре (тканевая культура) стало рутинной процедурой. Примерами пригодных клеточных линий-хозяев млекопитающих является линия почки обезьяны CV1, трансформированная SV40 (COS-7, ATCC CRL 1651); линия эмбриональной почки человека (293 или 293 клетки, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки новорожденного хомячка (BHK, ATCC CCL 10); клетки Сертоли мыши (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой обезьяны (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени серой крысы (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); опухоль молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4; и линия гепатомы человека (Hep G2). Другие пригодные клеточные линии-хозяева млекопитающих включают клетки яичника китайского хомячка (CHO), включая DHFR- CHO клетки (Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); и клеточные линии миеломы, такие как NS0 и Sp2/0. Для обзора определенных клеточных линий-хозяев млекопитающих, пригодных для продуцирования антител, см., например, Yazaki and Wu, Methods in Molecular Biology, Vol. 248 (B. K. C. Lo, ed., Human Press, Totowa, N.J., 2003), pp. 255-268.
[0157] Клетки-хозяева трансформируют с применением вышеописанных экспрессирующих и клонирующих векторов для продуцирования антител и культивируют в общепринятых питательных средах, модифицированных при необходимости для индуцирования промоторов, отбора трансформантов или амплифицирования генов, кодирующих желаемые последовательности.
(h) Культивирование клеток-хозяев
[0158] Клетки-хозяева, применяемые для продуцирования антител можно культивировать в разнообразных средах. Коммерчески доступные среды, такие как Ham's F10 (Sigma), минимальная питательная среда ((MEM), (Sigma), RPMI-1640 (Sigma), и среда Игла, модифицированная Дульбекко ((DMEM), Sigma), пригодны для культивирования клеток-хозяев. Кроме того, любые из сред, описанных в Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), U.S. Pat. Nos. 4,767,704; 4,657,866; 4,927,762; 4,560,655; или 5,122,469; WO 90/03430; WO 87/00195; или U.S. Pat. Re. 30,985, можно использовать в качестве среды для культивирования клеток-хозяев. Любые из этих сред могут быть дополнены при необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, кальция, магния и фосфат), буферы (такие как HEPES), нуклеотиды (такие как аденозин и тимидин), антибиотики (такие как препарат GENTAMYCIN™), микроэлементы (определяемые как неорганические соединения, как правило, присутствующие в конечных концентрациях в микромолярном диапазоне), и глюкозой или эквивалентным источником энергии. Любые другие необходимые добавки могут также быть включены в соответствующих концентрациях, которые должны были бы быть специалистам в данной области. Условия культивирования, такие как температура, pH и т.п., такие которые ранее применяли к клетке-хозяину, отобранному для экспрессии, и будут очевидны специалисту в данной области.
(xi) Очистка антитела
[0159] При использовании рекомбинантных способов, антитело можно получать внутриклеточно, в периплазматическом пространстве, или непосредственно секретированным в среду. Если антитело получено внутриклеточно, в качестве первого этапа, дебрис из макрочастиц, или клетки-хозяева или лизированные фрагменты, удаляют, например, посредством центрифугирования или ультрафильтрации. Carter et al., Bio/Technology 10:163-167 (1992) описали процедуру для выделения антител, которые секретируются в периплазматическое пространство E. coli. В кратком изложении, клеточную массу размораживают в присутствии ацетата натрия (pH 3,5), EDTA, и фенилметилсульфонилфторида (PMSF) в течение приблизительно 30 минут. Клеточный дебрис может быть удален посредством центрифугирования. Когда антитело секретируется в среду, супернатанты из таких экспрессирующих систем, как правило, сначала концентрируют с применением коммерчески доступного концентрирующего белкового фильтра, например, ультрафильтрационная единица Amicon или Millipore Pellicon. Ингибитор протеазы, такой как PMSF может быть включен в любой из последующих этапов для ингибирования протеолиза, и антибиотики могут быть включены для предотвращения роста случайных контаминантов.
[0160] Композицию антител, полученную из клеток, можно очищать с применением, например, хроматографии на гидроксиапатите, хроматографии на основе гидрофобных взаимодействий, электрофорезе в геле, диализе и аффинной хроматографии, при этом аффинная хроматография является, как правило, одним из предпочитаемых этапов очистки. Пригодность белка A в качестве аффинного лиганда зависит от вида и изотипа любого домена иммуноглобулина Fc, который присутствует в антителе. Белок A можно использовать, чтобы очищать антитела, которые основаны на γ1, γ2, или γ4 тяжелых цепях человека (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Белок G рекомендуют для всех изотипов мыши и для γ3 человека (Guss et al., EMBO J. 5:15671575 (1986)). Матриксом, к которому прикреплен аффинный лиганд, наиболее часто является агароза, но другие матриксы являются доступными. Механически стабильные матриксы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол обеспечивают более высокую скорость потока и более короткие этапы процессинга, которые могут быть достигнуты с применением агарозы. Когда антитело содержит CH3 домен, смола Bakerbond ABX™ (J. T. Baker, Phillipsburg, N.J.) является пригодной для очистки. Другие методы очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, обращенно-фазовая ВЭЖХ, хроматография на диоксиде кремния, хроматография на гепариновой SEPHAROSETM, хроматография на анион- или катионнообменной смоле (такой как колонка на полиаспарагиновой кислоте), хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония также доступны в зависимости от антитела, которое надо восстановить.
[0161] В основном, различные методологии для получения антител для применения в исследовании, тестировании и клинической практике хорошо установлены в данной области, согласуясь с вышеописанными методологиями и/или, как считается, подходят специалистам в данной области для конкретного антитела, представляющего интерес.
B. Отбор биологически активных антител
[0162] Антитела, полученные, как описано выше, могут быть подвержены одному или нескольким испытаниям “биологической активности” для отбора антитела с благоприятными свойствами с точки зрения терапевтической перспективы. Антитело можно скринировать по его способности связывать антиген, против которого оно возникло. Например, для анти-DR5 антитела (например, дрозитумаба), антигенсвязывающие свойства антитела можно оценивать в тесте, который детектирует способность связывания с рецептором смерти 5 (DR5).
[0163] В другом варианте осуществления, аффинность антитела можно определять, например, посредством насыщения связывания; ELISA; и/или конкурентных анализов (например, RIA's).
[0164] Кроме того, антитело может быть подвергнуто другим анализам биологической активности, например, чтобы оценить эффективность в качестве терапевтического средства. Такие анализы известны в данной области и зависят от таргетного антигена и предназначенного применения для антитела.
[0165] Чтобы произвести скрининг антител, которые связываются с конкретным эпитопом на антигене, представляющем интерес, можно произвести рутинный перекрестный конкурентный анализ, такой как описан в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988), можно проводить. Альтернативно, картирование эпитопов, например, как описано в Champe et al., J. Biol. Chem. 270:1388-1394 (1995), можно проводить, чтобы определить связывается ли антитело с эпитопом, представляющим интерес.
C. Получение составов
[0166] Представленные в настоящем документе способы получения состава, содержащего белок и соединение, которое предотвращает окисление белка в составе. Состав можно получать посредством смешивания белка, обладающего желаемой степенью чистоты с соединением, которое предотвращает окисление белка в жидком составе. В определенных вариантах осуществления, белок, который нужно включить в состав, не был подвергнут предварительной лиофилизации и состав, представляющий интерес, в настоящем документе является водным составом. В некоторых вариантах осуществления, белок является терапевтическим белком. В определенных вариантах осуществления, белок является антителом. В дополнительных вариантах осуществления, антитело является поликлональным антителом, моноклональным антителом, гуманизированным антителом, антителом человека, химерным антителом или фрагментом антитела. В определенных вариантах осуществления, антитело является полноразмерным антителом. В одном из вариантов осуществления, антитело в составе является фрагментом антитела, таким как F(ab')2, в случае которого проблемы, которые могут не возникнуть для полноразмерного антитела (такие как клипирование антитела Fab) может возникнуть необходимость обратиться. Терапевтически эффективное количество белка, присутствующего в составе, определяют учитывая желаемые объемы доз и режим(ы) введения, например. От приблизительно 1 мг/мл до приблизительно 250 мг/мл, от приблизительно 10 мг/мл до приблизительно 250 мг/мл, от приблизительно 15 мг/мл до приблизительно 225 мг/мл, от приблизительно 20 мг/мл до приблизительно 200 мг/мл, от приблизительно 25 мг/мл до приблизительно 175 мг/мл, от приблизительно 25 мг/мл до приблизительно 150 мг/мл, от приблизительно 25 мг/мл до приблизительно 100 мг/мл, от приблизительно 30 мг/мл до приблизительно 100 мг/мл или от приблизительно 45 мг/мл до приблизительно 55 мг/мл является примерной концентрацией белка в составе. В некоторых вариантах осуществления, белок, описываемый в настоящем документе, подвержен окислению. В некоторых вариантах осуществления, одна или несколько аминокислот, выбранных из группы, состоящей из метионина, цистеина, гистидина, триптофана и тирозина, в белке является подверженной окислению. В некоторых вариантах осуществления, триптофан в белке является подверженным окислению. В некоторых вариантах осуществления, метионин в белке является подверженным окислению. В некоторых вариантах осуществления, антитело, приводимое в данном документе, подвержено окислению в части Fab и/или части Fc антитела. В некоторых вариантах осуществления, антитело, приводимое в данном документе, подвержено окислению в аминокислоте триптофан в Fab части антитела. В дополнительном варианте осуществления, аминокислота триптофан, подверженная окислению, находится в CDR антитела. В некоторых вариантах осуществления, антитело, приводимое в данном документе подвержено окислению в аминокислоте метионин в Fc части антитела.
[0167] Жидкие составы, представленные в настоящем документе, содержат белок и соединение, которое предотвращает окисление белка в жидком составе, где соединение выбрано из группы, состоящей из 5-гидрокси-триптофана, 5-гидрокси индола, 7-гидрокси индола и серотонина.
[0168] В некоторых вариантах осуществления, жидкий состав дополнительно содержит один или несколько эксципиентов, выбранных из группы, состоящей из стабилизатора, буфера, поверхностно-активного вещества и средства придания тоничности. Жидкий состав получают в pH-буферном растворе. Буфер по настоящему изобретению имеет pH в диапазоне от приблизительно 4,5 до приблизительно 7,0. В определенных вариантах осуществления pH находится в диапазоне от pH 4,5 до 6,5, в диапазоне от pH 4,5 до 6,0, в диапазоне от pH 4,5 до 5,5, в диапазоне от pH 4,5 до 5,0, в диапазоне от pH 5,0 до 7,0, в диапазоне от pH 5,5 до 7,0, в диапазоне от pH 5,7 до 6,8, в диапазоне от pH 5,8 до 6,5, в диапазоне от pH 5,9 до 6,5, в диапазоне от pH 6,0 до 6,5, или в диапазоне от pH 6,2 до 6,5. В определенных вариантах осуществления, состав имеет pH 6,2 или приблизительно 6,2. В определенных вариантах осуществления, состав имеет pH of 6,0 или приблизительно 6,0. Примеры буферов, которые будут контролировать pH в этом диапазоне, включают органические и неорганические кислоты и их соли. Например, ацетат (например, гистидин ацетат, аргинин ацетат, ацетат натрия), сукцинат (например, гистидин сукцинат, аргинин сукцинат, сукцинат натрия), глюконат, фосфат, фумарат, оксалат, лактат, цитрат и их сочетания. Концентрация буфера может составлять от приблизительно 1 мМ до приблизительно 600 мМ, в зависимости, например, от буфера и желаемой изотоничности состава. В определенных вариантах осуществления, состав содержит гистидиновый буфер (например, в концентрации от приблизительно 5 мМ до 100 мМ). Примеры гистидиновых буферов включают гистидин хлорид, гистидин ацетат, гистидин фосфат, гистидин сульфат, гистидин сукцинат и т.д. В определенных вариантах осуществления, состав содержит гистидин и аргинин (например, гистидин хлорид-аргинин хлорид, гистидин ацетат-аргинин ацетат, гистидин фосфат-аргинин фосфат, гистидин сульфат-аргинин сульфат, гистидин сукцинат-аргинин сукцинат и т.д.). В определенных вариантах осуществления, состав содержит гистидин в концентрации от приблизительно 5 мМ до 100 мМ и аргинин присутствует в концентрации от 50 мМ до 500 мМ. В одном из вариантов осуществления, состав содержит гистидин ацетат (например, приблизительно 20 мМ)-аргинин ацетат (например, приблизительно 150 мМ). В определенных вариантах осуществления, состав содержит гистидин сукцинат (например, приблизительно 20 мМ)-аргинин сукцинат (например, приблизительно 150 мМ). В определенных вариантах осуществления, гистидин в составе от приблизительно 10 мМ до приблизительно, 35 мМ, от приблизительно 10 мМ до приблизительно 30 мМ, от приблизительно 10 мМ до приблизительно 25 мМ, от приблизительно 10 мМ до приблизительно 20 мМ, от приблизительно 10 мМ до приблизительно 15 мМ, от приблизительно 15 мМ до приблизительно 35 мМ, от приблизительно 20 мМ до приблизительно 35 мМ, от приблизительно 20 мМ до приблизительно 30 мМ или от приблизительно 20 мМ до приблизительно 25 мМ. В дополнительных вариантах осуществления, аргинин в составе составляет от приблизительно 50 мМ до приблизительно 500 мМ (например, приблизительно 100 мМ, приблизительно 150 мМ, или приблизительно 200 мМ).
[0169] Жидкий состав по изобретению может дополнительно содержать сахарид, такой как дисахарид (например, трегалоза или сахароза). A “сахарид”, как применяют в настоящем документе, включает общую композицию (CH2O)n и его производных, включая моносахариды, дисахариды, трисахариды, полисахариды, сахарные спирты, восстанавливающие сахара, невосстанавливающие сахара и т.д. Примеры сахаридов в настоящем документе включают глюкозу, сахарозу, трегалозу, лактозу, фруктозу, мальтозу, декстран, глицерин, эритрит, глицерин, арабит, силитол, сорбит, маннит, мелибиозу, мелицитозу, раффинозу, маннотриозу, стахиозу, лактулозу, мальтулозу, глюцитол, мальтитол, лактитол, изомальтозу и т.д.
[0170] Поверхностно-активное вещество может необязательно быть добавлено к жидкому составу. Примерные поверхностно-активные вещества включают неионные поверхностно-активные вещества, такие как полисорбаты (например, полисорбаты 20, 80 и т.д.) или полоксамеры (например, полоксамер 188 и т.д.). Определенные количества добавленного поверхностно-активного вещества такое, что оно снижает аггрегацию антитела в лекарственной форме и/или минимизирует образование твердых частиц в составе и/или снижает адсорбцию. Например, поверхностно-активное вещество может быть представлено в составе в количестве от приблизительно 0,001% до приблизительно 0,5%, от приблизительно 0,005% до приблизительно 0,2%, от приблизительно 0,01% до приблизительно 0,1%, от приблизительно 0,02% до приблизительно 0,06%, или от приблизительно 0,03% до приблизительно 0,05%. В определенных вариантах осуществления, поверхностно-активное вещество присутствует в составе в количестве 0,04% или приблизительно 0,04%. В определенных вариантах осуществления поверхностно-активное вещество присутствует в составе в количестве 0,02% или приблизительно 0,02%. В одном из вариантов осуществления, состав не содержит поверхностно-активное вещество.
[0171] В одном из вариантов осуществления состав содержит идентифицированные выше средства (например, антитело, буфер, сахарид и/или поверхностно-активное вещество) и является по существу свободным от одного или нескольких консервантов, таких как бензиловый спирт, фенол, m-крезол, хлорбутанол и бензетоний Cl. В другом варианте осуществления, консервант может быть включен в составе, конкретно, где состав является мультидозовым составом. Концентрация консерванта может находиться в диапазоне от приблизительно 0,1% до приблизительно 2%, предпочтительно от приблизительно 0,5% до приблизительно 1%. Один или несколько других фармацевтически приемлемых носителей, эксципиентов или стабилизаторов, таких как описанные в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980) могут быть включены в состав при условии, что они противоположным образом не влияют на желаемые характеристики состава. Примерные фармацевтически приемлемые эксципиенты в настоящем документе дополнительно включают средство диспергирования лекарственных средств в межклеточном пространстве, такое как растворимые нейтрально активные гликопротеины гиалуронидазы (sHASEGP), например, растворимые PH-20 гликопротеины гиалуронидазы человека, такие как rHuPH20 (HYLENEX®, Baxter International, Inc.). Определенные примерные sHASEGP и способы их использования, включая rHuPH20, описаны в патентной публикации US No. 2005/0260186 и 2006/0104968. В одном из аспектов, sHASEGP комбинируют с одним или несколькими дополнительными гликозаминогликанами, такими как хондроитиназы.
[0172] Состав может дополнительно содержать хелаторы ионов металла. Хелаторы ионов металла хорошо известны специалистам в данной области и включают, но в качестве неограничивающих примеров, аминополикарбоксилаты, EDTA (этилендиаминтетрауксусная кислота), EGTA (этилен гликоль-бис(бета-аминоэтиловый эфир)-N,N,N',N'-тетрауксусная кислота), NTA (нитрилотриуксусная кислота), EDDS (этилен диамин дисукцинат), PDTA (1,3-пропилендиаминтетрауксусная кислота), DTPA (диэтилентриаминпентауксусная кислота), ADA (бета-аланиндиуксусная кислота), MGCA (метилглициндиуксусная кислота) и т.д. Дополнительно, некоторые варианты осуществления в настоящем документе содержат хелаторы на основе фосфонатов/фосфоновой кислоты.
[0173] Средства придания тоничности присутствуют для корректировки или поддержания тоничности жидкости в композиции. Когда их применяют с крупными заряженными биомолекулами, такими как белки и антитела, они также могут служить в качестве “стабилизаторов”, потому что они могут взаимодействовать с заряженными группами аминокислотных боковых цепей, таким образом, уменьшая потенциал для меж- и внутримолекулярных взаимодействий. Средства придания тоничности могут присутствовать в любом количестве от 0,1% до 25% по массе, или более предпочтительно от 1% до 5% по массе, учитывая относительные количества других ингредиентов. Предпочитаемые средства придания тоничности включают многоатомные сахарные спирты, предпочтительно трехосновные или высшие сахарные спирты, такие как глицерин, эритрит, арабит, ксилит, сорбит и маннит.
[0174] Состав в настоящем документе может также содержать больше, чем один белок или низкомолекулярное лекарственное средство при необходимости для конкретного показания, подвергаемого лечению, предпочтительно те с дополнительной активностью, которые не влияют отрицательно на другой белок. Например, где антитело является анти-DR5 (например, дрозитумаб), его можно комбинировать с другим средством (например, химиотерапевтическим средством, и антинеопластическим средством).
[0175] В некоторых вариантах осуществления состав предназначен для введения in vivo. В некоторых вариантах осуществления, состав является стерильным. Состав может быть превращен в стерильный посредством фильтрации через стерильные фильтрационные мембраны. Терапевтические составы по настоящему изобретению, как правило, помещают в контейнер, имеющий стерильное входное отверстие, например, мешок с раствором для внутривенного введения или флакон, имеющий пробку, поддающуюся прокалыванию иглой для подкожных инъекций. Путь введения находится в соответствии с известными и общепринятыми способами, такими как прием единичного или множества болюсов или инфузия в течение долгого периода времени подходящим образом, например, инъекция или инфузия посредством подкожного, внутривенного, интраперитонеального, внутримышечного, внутриартериального, внутриочагового или внутрисуставного пути введения, местного введения, ингаляции или посредством способов замедленного или длительного высвобождения.
[0176] Жидкий состав по изобретению может быть стабильным при хранении. В некоторых вариантах осуществления, белок в жидком составе является стабильным при хранении при приблизительно от 0 до 5°C в течение по меньшей мере приблизительно 12 месяцев, по меньшей мере приблизительно 18 месяцев, по меньшей мере приблизительно 21 месяца или по меньшей мере приблизительно 24 месяцев (или по меньшей мере приблизительно 52 недель). В некоторых вариантах осуществления, белок в жидком составе является стабильным при хранении при приблизительно -20°C в течение по меньшей мере приблизительно 12 месяцев, по меньшей мере приблизительно 18 месяцев, по меньшей мере приблизительно 21 месяца или по меньшей мере приблизительно 24 месяцев (или по меньшей мере приблизительно 52 недель). В некоторых вариантах осуществления, белок в жидком составе является стабильным во время производства состава. В некоторых вариантах осуществления, белок в жидком составе является стабильным при хранении в металлическом контейнере (например, контейнере из нержавеющей стали). В некоторых вариантах осуществления, белок в жидком составе является стабильным при хранении в стеклянном флаконе. В некоторых вариантах осуществления, белок в жидком составе является стабильным при хранении в пластиковом контейнере. В некоторых вариантах осуществления, физическую стабильность, химическую стабильность или биологическую активность белка в составе оценивают или измеряют. Любые известные в данной области способы можно использовать, чтобы оценить стабильность и биологическую активность. В некоторых вариантах осуществления, стабильность измеряют посредством окисления белка в жидком составе после хранения. Стабильность может быть протестирована посредством оценки физической стабильности, химической стабильности, и/или биологической активности антитела в составе приблизительно за время изготовления состава, а также последующего хранения. Физическую и/или химическую стабильность можно оценивать качественно и/или количественно большим разнообразием способов, включая оценку образования аггрегатов (например, применение эксклюзионной хроматографии, посредством измерения мутности, и/или посредством визуального осмотра); посредством оценки гетерогенности заряда с применением катионообменной хроматографии или капиллярного зонного электрофореза; анализ амино-концевых или карбокси-концевых последовательностей; масс-спектроскопический анализ; SDS-PAGE анализ для сравнения сокращенного и интактного антитела; анализ пептидной карты (например, триптической или LYS-C); оценку биологической активности или функции антигенного связывания антитела; и т.д. Нестабильность может приводить к аггрегации, дезаминированию (например, дезаминированию Asn), окислению (например, окислению Trp), изомеризации (например, изомеризации Asp), клиппированию/гидролизу/фрагментации (например, фрагментации шарнирной области), образованию сукцинимида, непарного цистеина(ов), N-концевому расширению, C-концевому процессингу, различиям гликозилирования и т.д. В некоторых вариантах осуществления, окисление в белке определяют с применением одного или нескольких ОФ-ВЭЖХ, LC/MS или триптического пептидного картирования. В некоторых вариантах осуществления, окисление в антителе определяют как процент с применением одного или нескольких из ОФ-ВЭЖХ, LC/MS или триптического пептидного картирования и по формуле:
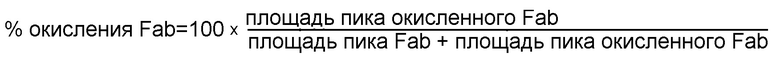
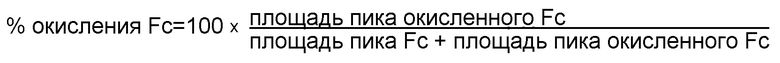
[0177] Составы, предназначенные для введения in vivo, должны быть стерильными. Это легко осуществить посредством фильтрации через стерильные фильтрационные мембраны перед или после получения состава.
[0178] Также в настоящем документе представлены способы создания белкового состава или предотвращения окисление белка в жидком составе, содержащем добавление некоторого количества соединения, которое предотвращает окисление белка в жидком составе, где соединение выбрано из группы, состоящей из 5-гидрокси-триптофана, 5-гидрокси индола, 7-гидрокси индола и серотонина. В определенных вариантах осуществления, жидкий состав содержит антитело. Количество соединения, которое предотвращает окисление белка, как представлено в настоящем документе, составляет приблизительно от 0,3 мМ до приблизительно 10 мМ или любое из количеств, описываемых в настоящем документе.
III. Введение белковых составов
[0179] Жидкий состав вводят млекопитающему, нуждающемуся в лечении с применением белка (например, антитела), предпочтительно человеку, в соответствии с известными способами, такими как внутривенное введение в виде болюса или посредством непрерывной инфузии в течение некоторого времени, посредством внутримышечного, интраперитонеального, интрацереброспинального, подкожного, внутрисуставного, внутрисуставного, интратекального, перорального, местного или ингаляционного пути введения. В одном из вариантов осуществления, жидкий состав вводят млекопитающему посредством внутривенного введения. Для этих целей состав можно инъецировать, например, с применением шприца или посредством капельницы. В одном из вариантов осуществления, жидкий состав вводят млекопитающему посредством подкожного введения.
[0180] Адекватная доза (“терапевтически эффективное количество”) белка будет зависеть, например, от состояния, которое подлежит лечению, тяжести и течения заболевания, вводят ли белок для профилактических или терапевтических целей, истории болезни пациента и ответа на белок, типа применяемого белка, и выбора лечащего врача. Белок подходящим образом вводят пациенту за один раз или в течение серии введения, и может быть введен пациенту в любое время с момента постановки диагноза. Белок можно вводить в качестве монотерапии или в сочетании с другими лекарственными препаратами или методами лечения, пригодными при рассматриваемом состоянии. Как применяют в настоящем документе термин “лечение” относится как к терапевтическому лечению, так и профилактическим или превентивным мерам. При необходимости лечения они включают те, при которых заболевание уже присутствует, а также те, при которых заболевание должно быть предотвращено. Как применяют в настоящем документе “заболеванием” является любое состояние, которое улучшится от лечения, включая в качестве неограничивающих примеров, хронические и острые нарушения или заболевания, включая такие патологические состояния, которые провоцируют возникновение у млекопитающего рассматриваемого заболевания.
[0181] В фармакологическом смысле, в контексте по изобретению, “терапевтически эффективное количество” белка (например, антитела) относится к количеству, эффективному при предотвращении или лечении заболевания, для лечения которого антитело является эффективным. В качестве общей нормы, терапевтически эффективное количество введенного белка будет находиться, например, в диапазоне от приблизительно 0,1 до приблизительно 50 мг/кг масса тела пациента посредством одного или нескольких введений, с обычным диапазоном применяемого белка от приблизительно 0,3 до приблизительно 20 мг/кг, предпочтительно от приблизительно 0,3 до приблизительно 15 мг/кг, вводимого ежедневно. Однако другие режимы дозирования могут быть пригодны. Например, белок можно вводить в дозе приблизительно 100 или 400 мг каждые 1, 2, 3, или 4 недели или вводят в дозе приблизительно 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0, 15,0 или 20,0 мг/кг каждые 1, 2, 3 или 4 недели. Дозу можно вводить в качестве однократной дозы или множества доз (например, 2 или 3 доз), таких как инфузии. Прогресс этой терапии легко мониторировать посредством общепринятых способов.
IV. Способы скрининга соединений для предотвращения окисления белка
[0182] Также в настоящем документе представлены способы скрининга соединения, которое предотвращает окисление белка в белковой композиции. В некоторых вариантах осуществления, способ включает выбор соединения, которое обладает более низким окислительным потенциалом и меньшей фоточувствительностью по сравнению с L-триптофаном, и тестирование эффекта выбранного соединения на предотвращение окисления белка. В некоторых вариантах осуществления, фоточувствительность измеряют на основе определенного количества H2O2, продуцируемого соединением при воздействии света. Например, жидкая композиция, содержащая соединение может быть подвергнута воздействию 250 Вт/м2 света в течение определенного количества времени и количественно определяют полученное образование H2O2. Соединение с меньшей фоточувствительностью продуцирует меньше H2O2 при воздействии определенного количества света, чем соединение, которое обладает более высокой фоточувствительностью при воздействии того же количества света. В некоторых вариантах осуществления, выбирают соединение, которое продуцирует менее чем приблизительно 15%, менее чем приблизительно 20%, менее чем приблизительно 25% определенного количества H2O2. H2O2 можно получать посредством окисления аминокислотных остатков в белке, которые подвержены окислению. В некоторых вариантах осуществления, окислительный потенциал измеряют посредством циклической вольтамметрии.
[0183] В некоторых вариантах осуществления, выбранное соединение тестируют на предмет эффекта на предотвращение окисления белка посредством активных форм кислорода, образованных посредством 2,2'-азобис(2-амидинопропан)дигидрохлорида (AAPH), света и/или реагента Фентона. В любых вариантах осуществления в настоящем документе, способ, описанный в этих примерах (примеры 2 и 3) можно использовать для скрининга соединения, которое предотвращает окисление белка в белковой композиции.
V. Промышленные изделия
[0184] В другом варианте осуществления по изобретению, представлено промышленное изделие, содержащее контейнер, в котором находится состав по изобретению и необязательно представлены инструкции для их применения. Подходящие контейнеры включают, например, бутылки, флаконы и шприцы. Контейнер может быть образован из разнообразия материалов, таких как стекло, металлический сплав (такой как нержавеющая сталь) или пластик. Примерный контейнер является 300 см3 контейнером из металлического сплава (например, для хранения при -20°C). Примерный контейнер является 3-20 см3 одноразовым стеклянным флаконом. Альтернативно, для мультилекарственного состава, контейнер может быть 3-100 см3 стеклянным флаконом. Контейнер содержит состав и этикетку на нем или привязанную к нему, контейнер может содержать руководство по использованию. Промышленное изделие может дополнительно включать другие материалы, желаемые с коммерческой точки зрения и позиции пользователя, включая другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши в упаковке с инструкциями по применению.
[0185] Спецификацию рассматривают как достаточную, чтобы позволить специалисту в данной области использовать изобретение в практике. Различные спецификации по изобретению при добавлении к представленным и описываемым в настоящем документе будут очевидны специалистам в данной области из вышеизложенного описания и находятся в пределах объема приложенной формулы изобретения. Все публикации, патенты и патентные заявки, процитированные в настоящем документе, включены, таким образом, в качестве ссылки полностью для всех целей.
ПРИМЕРЫ
[0186] Данное изобретение можно более полно уяснить, ссылаясь на следующие примеры. Не следует, однако, толковать их как ограничивающие объем изобретения. Следует понимать, что эти примеры и варианты осуществления, описываемые в настоящем документе, приводятся исключительно с иллюстративными целями и что различные модификации или изменения с их учетом будут предложены специалистам в данной области и должны быть включены в содержание данной заявки и объем приложенной формулы изобретения.
Пример 1: Антиоксидант L-Trp продуцирует ROS, который окисляет моноклональные антитела в белковых составах.
[0187] Было продемонстрировано, что моноклональные антитела образуют ROS посредством катализируемого антителом пути окисления воды (ACWOP), где антитела потенциально катализируют реакцию между водой и атомарным кислородом, образуя пероксид водорода (Wentworth et al., Science 293(5536):1806-11 (2001); Wentworth et al., Proc Natl Acad Sci USA 97(20):10930-5 (2000)). В ACWOP разнообразие ROS, включая супероксид анион, первичный кислый триоксид, озон и даже гидротриокси радикал, образуется в метаболическом пути в направлении образования пероксида водорода (Zhu et al., Proc Natl Acad Sci USA 101(8):2247-52 (2004)). Показано, что триптофаны, обращенные к поверхности, в моноклональном анти-DR5 антителе, дрозитумаб (CAS-номер 912628-39-8), также называемый здесь как mAb1, действует в качестве субстрата генераторов (1O2 и O2-), которые облегчают ACWOP даже при условиях умеренного освещения образом, зависящим от времени и концентрации (Sreedhara et al., Mol. Pharmaceutics (2013)). Было продемонстрировано, что mAb1 был конкретно подвержен окислению во время хранения при фармацевтически релевантных условиях (Sreedhara et al., Mol. Pharmaceutics (2013)). Окисление, как было продемонстрировано, является сайт-специфичным и локализуется в Trp53 (W53) на тяжелой цепи CDR (Fab), как было оценено посредством триптической пептидной карты. Дополнительно, обращенно-фазную ВЭЖХ применяли для измерения общего окисления в HC Fab и Fc областях mAb1 посредством расщепления папаином, DTT восстановления, и обращенно-фазного разделения. Пики из ОФ-ВЭЖХ были идентифицированы с применением LC/MS, и была продемонстрирована сильная корреляция с результатами триптической пептидной карты, указывающие, что RP может быть применен в качестве заместителя для детекции окисления W53 (т.е. % Fab) (Sreedhara et al., Mol. Pharmaceutics (2013)). В методе RP папаинового гидролизата пики окисления Fab и Fc, элюированные до их соответствующих главных пиков, позволяют сделать количественный анализ % Fab и % Fc окисления по отношению к их общим площадям пиков. Данное исследование дополнительно продемонстрировало, что пероксид водорода мог служить в качестве замены для ряда ROS, включая супероксид и атомарный кислород.
[0188] Чтобы определить, можно ли ограниченное (т.е. контролируемое) воздействие света использовать в качестве модели форсированной нагрузки для исследования окисления белка, то же самое моноклональное антитело человека IgG1 (mAb1) применяли для скрининга и оценки потенциальных антиоксидантов. L-триптофан (L-Trp), антиоксидант, применяемый в белковых составах, как было недавно продемонстрировано, является светочувствительным (Igarashi et al., Anal Sci 23(8):943-8 (2007)) и обладает способностью образовывать H2O2 при воздействии света. Чувствительность mAb1 к L-Trp при световом стрессе оценивали, с и без добавления L-метионина (L-Met) в качестве потенциального антиоксиданта. mAb1 экспрессировали в клетках яичника китайского хомячка (CHO) и очищали посредством серии хроматографических способов, включая аффинную очистку посредством хроматографии белка A и ионообменной хроматографии. mAb1 получали в концентрации 5 мг/мл в составе 20 мМ гистидин ацетата, 250 мМ трегалозы и 0,02% полисорбата 20 в стеклянной флаконе и с 1 мМ L-Trp и различными концентрациями L-Met, в диапазоне от 10 мМ до 100 мМ, и после воздействия восьми часов света при 250 Вт/м2 в контрольно-измерительном приборе Atlas SunTest CPS+ Xenon (Chicago, IL). Контрольные флаконы были завернуты в алюминиевую фольгу и обработаны сходным образом. После воздействия света, для анализа посредством обращенно-фазовой ВЭЖХ получали растворы. Для ОФ-ВЭЖХ, раствор mAb1 из исследования под воздействием получали в концентрации 1,1 мг/мл в 0,1 M триса, 4,4 мМ EDTA и 1,1 мМ цистеина. 150 мкл 0,1 мг/мл папаина добавляли к 1,35 мл раствора mAb1 до инкубации при 37°C в течение двух часов. После инкубации 900 мкл раствора объединяли со 100 мкл 1 M дитиотреитола (DTT) и инкубировали в течение еще тридцати минут при 37°C. Образцы затем разгоняли на Agilent, Inc. 1100/1200 ВЭЖХ системе (Santa Clara, CA), оснащенной УФ детекцией при 280 нм в сочетании с Varian, Inc. Pursuit 3 мкм, 2 мМ ID × 250 мМ дифениловой колонкой (Palo Alto, CA). Подвижная фаза A представляла собой 0,1% TFA в воде. Подвижная фаза B представляла собой 0,1% TFA в ацетонитриле. Градиент подвижной фазы увеличивался линейно от 34% B при 0 минутах до 43% B при 50,0 минутах, затем до 95% B при 50,1 минутах. Градиент сохранялся при 95% B до 60,1 минут, а затем снижался линейно от 95% B до 34% B между 60,1 и 60,2 минутами. Градиент сохранялся при 34% B до конца цикла при 80,2 минутах. Температура колонки составляла 65°C, общая скорость потока составляла 0,2 мл/мин, и объем впрыска каждого образца составлял 6 мкл. Хроматограммы затем интегрировали для количественной оценки окисления.
[0189] Дополнительно, было выявлено, что mAb1 является стабильным в буфере на основе L-His при pH 6,0. Анализ эффектов L-Trp и L-Met на окисление mAb1 Fab при воздействии света продемонстрировал, что эталонный материал mAb1 (no световому воздействию) и контроль в фольге имели приблизительно 2% окисление Fab (фиг. 1A). Так как контроль в фольге и эталонный материал продемонстрировали одинаковый уровень окисления Fab, было весьма маловероятным, что нагревание само по себе вызывает окисление Fab. Когда mAb1 подвергали воздействию света (образец “Отсутствие эксципиента”), окисление Fab удваивалось до 4%. При добавлении 1 мМ L-Trp, окисление Fab увеличивалось почти до 9%, предполагая, что L-Trp образовывал ROS при воздействии света, что могло приводить к окислению W53 на Fab. Дополнительное добавление 10, 25, 50, и 100 мМ L-Met к составу, содержащему 1 мМ L-Trp, как оказалось, слегка снижает окисление Fab, но даже 100 молярный избыток L-Met не снижал окисление Fab до уровня контроля в фольге (фиг. 1A).
[0190] Было продемонстрировано, что окисление в Fc области mAb1 происходит преимущественно в Met остатках Met 254 и Met 430 (Sreedhara et al., Mol. Pharmaceutics (2013)). Анализ эффектов при воздействии света L-Trp и L-Met на окисление Fc mAb1 продемонстрировал, что эталонный материал mAb1 и контроль в фольге имели приблизительно 8% окисление Fc даже до воздействия света (фиг. 1B). Воздействие света приводило лишь к незначительному увеличению окисления Fc (“Отсутствие эксципиента”) для mAb1 в буферной смеси. Однако инкубация с 1 мМ L-Trp привела к более чем 20% окислению в этих участках Met в Fc области, как было выявлено посредством ОФ-ВЭЖХ. Добавление различных концентраций L-Met (10, 25, 50 и 100 мМ) к составам, содержащим 1 мМ L-Trp, снижало величину окисления Fc, хотя даже 100 мМ L-Met не снижал окисление Fc до уровня контролей (фиг. 1B).
[0191] Ранее сообщалось, что L-Trp производил H2O2 через супероксид ион и субстехиометрическим образом посредством антител при сходных условиях были произведены каталитические количества (Wentworth et al., Science 293(5536):1806-11 (2001); McCormick et al., Journal of the American Chemical Society 100:312-313 (1978)). Чтобы протестировать подверженность свободного L-Trp при фармацевтически релевантных условиях, таких как воздействие и ICH, и естественного освещения, составы, содержащие от 0,32 мМ до 7,5 мМ L-Trp (L-Trp растворяли в натрий фосфатном буфере при pH 7,1) подвергали 3 часам при 250 Вт/м2 УФ света и приблизительно 150 к люкс видимого свет. Образцы брали и анализировали сразу же посредством теста Amplex, чтобы детектировать определенное количество H2O2, образовавшегося в этих условиях. Большое количество H2O2 получали посредством свободного L-Trp при воздействии света образом, зависимым от концентрации (фиг. 2). Это образование H2O2 было значительно снижено в присутствии 50 мМ азида натрия, известного гасителя атомарного кислорода (фиг. 2). Когда L-Trp инкубировали с комбинацией 50 мМ NaN3 и 150 U супероксиддисмутазой (SOD) или SOD в отдельности, значительные количества H2O2 все еще были детектированы в образцах, не содержащих NaN3. Это указывало на то, что при добавлении к атомарному кислороду, супероксид ион также образовывался при фотооблучении, которое было преобразовано в H2O2 посредством SOD.
[0192] Помимо подтверждения фоточувствительности свободного L-Trp в условиях ICH света, изучали эффект естественного освещения, который, как правило, наблюдают в лабораториях. Измерения с применением цифрового измерителя освещенности DLM1 в различных лабораториях показал в среднем 300 люкс на лабораторном столе (с белым флуоресцентным излучением), в среднем 3000 люкс в ламинарном шкафу (с белым флуоресцентным излучением) и приблизительно 10000 люкс для подоконника, подверженного экспозиции юго-восточного солнечного света. В этих условиях, L-Trp в составе буферов, содержащих 50 мг/мл mAb1, производил пероксид водорода в микромолярном диапазоне, как было детектировано с применением теста Amplex Ultra Red (фиг. 3A). Образование пероксида увеличивалось и с освещенностью (300, 3000, и 10000 люкс) и со временем (1, 3 и 7 дней). Образцы белка были дополнительно проанализированы с применением mAb1 специфичной ОФ-ВЭЖХ и показали увеличенное окисление тяжелой цепи Fab в соответствии с окислением в W53 с повышением освещенности (фиг. 3B). В то же время, % окисления Fc в mAb1 в этих условиях увеличился с 5 до 40% между 300 и 10000 люкс, соответственно. Эти уровни воздействия света и времени определяли как фармацевтически релевантные для лекарственного вещества, который держат при естественном освещении и температуре до операций полного цикла производства и потенциально во время проверки флаконов с лекарственным препаратом. Эти результаты обосновали, что L-Trp является фоточувствительным и что он производит несколько активных форм кислорода, включая атомарный кислород, супероксид и H2O2, который может быть неблагоприятным для качества продукта mAb, и что необходимо следить за буферами, содержащими L-Trp, во время их обработки и хранения.
Пример 2: Скрининг предполагаемых антиоксидантных соединений.
[0193] Триптофан (Trp) является богатой электронами аминокислотой, которая подвергается окислительным и электрофильным реакциям присоединения в присутствии ROS, такого как гидроксильные радикалы и атомарный кислород. Любой потенциальный антиоксидант чтобы предотвратить окисление Trp в белках должен иметь сходную, если не превосходную реакционную способность по отношению к этим ROS. Оценивали серию соединений, которые были или на основе структуры L-Trp, или для них сообщалось наличие антиоксидантных свойств. Соединения, просматриваемые на предмет антиоксидантной способности в данном исследовании, включали производные триптофана, индола, ароматических кислот, таких как салициловая кислота и антраниловая кислота, и некоторые витамины. Химические структуры различных применяемых соединений были на основе (A) производных триптофана (B) кинуренина (C) производных индола и (D) производных ароматических кислот:
[0] A) Производные триптофана
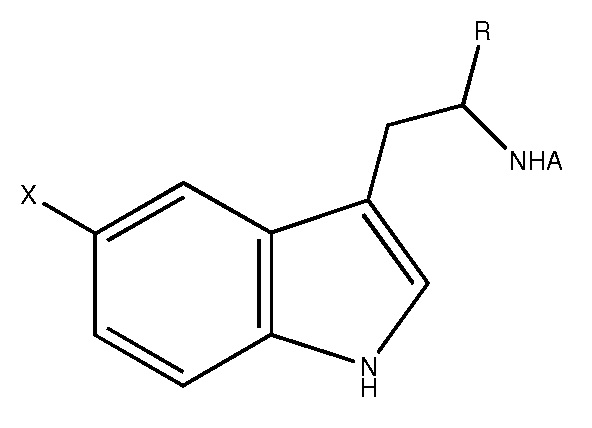
(B) Кинуренин

(C) Производные индола
(D) Производные ароматических кислот
Кандидатные антиоксидантные соединения, полученные из скринингового испытания по оценке фоточувствительности.
[0194] В то время как L-Trp мог быть эффективным антиоксидантом при определенных обстоятельствах, его фоточувствительность может ограничивать его утилитарность во время нормальной обработки без специальных мер предосторожности. Хотя фоточувствительность указанных выше молекул была исследована, и молекулы были классифицированы по их способности образовывать H2O2 в отношении L-Trp. В качестве инструмента скрининга антиоксидантные кандидаты подвергались воздействию света в течение четырех часов при 250 Вт/м2 и полученное в результате образование H2O2 количественно определяли посредством теста Amplex Ultra Red. Конкретно, антиоксиданты получали к 1 мМ в 20 мМ гистидин ацетатном буфере при pH 5,5. 1 мМ растворы антиоксидантов разделяли на аликвоты в стеклянных флаконах (2 мл/стеклянный флакон) и подвергали воздействию света в течение четырех часов при 250 Вт/м2 в контрольно-измерительном приборе Atlas SunTest CPS+ Xenon (Chicago, IL). Общая доза УФ составляла 90 Ватт-часов/квадратный метр и общая видимая доза составляла 0,22 миллиона люкс часов за 4-часовой период. Контрольные флаконы были завернуты в алюминиевую фольгу и были обработаны сходным образом. Количество пероксида водорода, образованное после воздействия света измеряли с применением теста Amplex® Ultra Red (Invitrogen, Carlsbad, CA) следуя рекомендуемым производителем процедурам. На добавление пероксидазы хрена (HRP), краситель реагировал 1:1 стехиометрически с H2O2, что приводило к образованию продукта флуоресцентного окисления резоруфину. В этом исследовании данные флуоресценции получали с применением Spectra Max M2 микро-спектрофотометр для чтения планшетов (Molecular Devices, Sunnyvale, CA) с возбуждением и эмиссией при 560 нм и 590 нм, соответственно. Окончательные концентрации H2O2 определяли с применением стандартной кривой в диапазоне от 0 мкм до 20 мкм.
[0195] Анализ образования пероксида водорода (H2O2) посредством производных триптофана при воздействии света показал, что при сходных условиях в отношении света (соответствующего 0,22 миллионам люкс часов за 4-часовой период) и буфера (20 мМ L-His-ацетат, pH 5,5), 5-гидрокси-L-триптофан (5-HT) образовывал приблизительно одну десятую H2O2, в то время как кинуренин образовывал приблизительно одну пятую H2O2, при сравнении с L-Trp (фиг. 4A). Другие производные триптофана образовывали где-то между 30% и 105% H2O2, образованного L-Trp. В сравнении с L-Trp, Trolox (водорастворимое производное витамина E) образовывало в 123 раза больше H2O2, и пиридоксин (витамин B6) образовывал в 5 раз больше H2O2 (таблица 1). Индол, который имеет основную структуру как у L-Trp, вел себя подобно L-Trp, но индол-3-уксусная кислота образовывала вдвое больше H2O2 (фиг. 4B). Гидрокси производные индола вели себя как 5-HT в том аспекте, что образовывали пренебрежимо малые количества H2O2 при воздействии света. Некоторые биохимически релевантные производные L-Trp, а именно триптамин, серотонин и мелатонин, также были протестированы. Триптамин образовывал приблизительно половину того количества H2O2, что производил L-Trp (таблица 1). Интересно, что серотонин (5-гидрокситриптамин) вел себя больше как 5-OH производные индола и триптофана, продуцируя очень немного H2O2 при воздействии света, пока мелатонин (N-ацетил-5-метокситриптамин) продуцировал менее чем треть H2O2, образованного L-Trp (таблица 1).
[0196] Чтобы понять, какие ROS образовались во время фотооблучения, несколько производных Trp в присутствии 50 мМ NaN3, известного гасителя атомарного кислорода, тестировали при воздействии света, как описано выше. Все протестированные соединения продемонстрировали существенное снижение количеств пероксида водорода, образованных в этих условиях, указывая, что атомарный кислород был главным ROS, образовавшимся при фотооблучении Trp и его производных (фиг. 5).
[0197] Другие ароматические соединения, такие как салициловая кислота и производные, также были протестированы на основе сообщаемых для них антиоксидантных свойств (Baltazar et al., Curr Med Chem 18(21):3252-64 (2011)). Салициловая кислота образовывала очень немного H2O2 при воздействии света, в то время как ее 5-OH производное вело себя подобно L-Trp (таблица 1). С другой стороны, антраниловая кислота образовывала вдвое больше H2O2 чем L-Trp, но 5-OH-антраниловая кислота образовывала половину количества H2O2 по сравнению с L-Trp (таблица 1).
Кандидатные антиоксидантные соединения, полученные из CV скринингового исследования.
[0198] На основе результатов скринингового исследования фоточувствительности соединения с замещениями в ароматическом кольце, как оказалось, влияют на количество образованного пероксида водорода. Так как целью было предпочтительное окисление эксципиента, а не белкового лекарственного препарата, эксципиенты, которые обладали низкими окислительными потенциалами, могли служить в качестве эффективных антиоксидантов. Были исследованы характеристики окисления/восстановления соединений. Некоторые соединения, включая L-Trp и его производные, оценивали на предмет защиты окисления Trp в белках с применением циклической вольтамметрии (CV) и ранжировали на основе их окислительных потенциалов (таблица 2). Конкретно, кандидатные антиоксиданты растворяли в деионизированной воде, а затем добавляли к 0,2 M раствору электролита литий перхлората. Растворы были охарактеризованы с применением полярографа/вольтамперметра EG&G Princeton Applied Research Model 264A со стеклоуглеродным электродом Model 616 RDE в качестве рабочего электрода. Растворы были просканированы от -0,10 В до +1,50 В при скорости сканирования или 100, или 500 мВ/сек. Аналитическая ячейка прочищали в течение четырех минут с применением азота перед сканированием каждого раствора антиоксиданта. Входные данные представляли линейное сканирование потенциала рабочего электрода, и выходная информация была измерением результирующего тока. Когда потенциал был просканирован (линейно снижался или повышался), электрохимически активные соединения в CV ячейке претерпевали окисление и реакции восстановления на поверхности рабочего электрода, что приводило к возникновению тока, который непрерывно измеряли. Окислительно-восстановительные реакции характеризовались резким ростом или снижениями тока (пики). Потенциал, при котором происходила окислительная реакция, обозначаемый как анодный пиковый потенциал (или окислительный потенциал), и потенциал, при котором происходило восстановление, обозначаемый как катодный пиковый (или восстановительный) потенциал.
[0199] Окислительные потенциалы эксципиентов в данном исследовании варьировали от 0,410 до 1,080 В против Ag/AgCl (Таблица 2). В этих условиях, L-Trp обладал необратимым окислительным потенциалом 0,938 В против Ag/AgCl. Было обнаружено, что девять соединений имели более низкий окислительный потенциал, чем L-Trp, включая все из 5-OH соединений, которые имели окислительные потенциалы между 0,535 и 0,600 В против Ag/AgCl. Из всех протестированных соединений 5-амино-DL-триптофан имел наиболее низкий окислительный потенциал при 0,410 В, в то время как N-ацетил соединения (0,730-0,880 В), и 5-метокси-DL-триптофан (0,890 В) также были ниже L-Trp. Семь соединений имели более высокий окислительный потенциал, чем L-Trp (таблица 2). Это были индол-3-уксусная кислота, 5-фтор-L-триптофан, триптамин, L-триптофанамид, L-кинуренин, 5-нитро-DL-триптофан и салициловая кислота. Салициловая кислота имела наиболее высокий окислительный потенциал в данном исследовании (1,080 В против Ag/AgCl). Все протестированные соединения продемонстрировали необратимый CV, обозначавший, что, будучи единожды окисленными, соединения не имели тенденции получать электроны и возможно не могли быть вовлечены в дополнительные электрохимические реакции.
Окислительные (анодный пик) потенциалы измеряли с применением циклической вольтамметрии с применением стеклоуглеродного рабочего электрода в 0,2 M литий перхлорате.
[0200] Определяли корреляцию между окислительным потенциалом и индуцированным светом образованием H2O2 для 16 соединений, которые обладали окислительными потенциалами выше и ниже окислительного потенциала L-Trp, и уровнями образования H2O2 выше и ниже, чем у L-Trp (фиг. 6). Так как индол и триптофан вели себя сходным образом в отношении образования H2O2 при воздействии света, было вероятно, что замены в положении C3 пятичленного кольца не влияли на это свойство. Однако, триптамин с заменой -CH2CH2NH2 и индол-3-уксусная кислота с заменой -CH2COOH в C3 положении образовывали в два раза меньше и в два раза больше H2O2, соответственно, чем L-Trp. Эти данные указывают на то, что C3 замены играли роль в фотоактивации и образовании пероксида. C3 замены не влияли на окислительные потенциалы молекул, тогда как индол в чистом виде обладал значительно более низким окислительным потенциалом, чем L-Trp при этих экспериментальных условиях. Замены в C5 6-членного ароматического кольца вели себя вполне предсказуемо. В основном, соединения с электронодонорными группами, такие как -NH2 и -OH, имели более низкие окислительные потенциалы, чем их родительские соединения и также демонстрировали низкие уровни образования H2O2 при фотоактивации (например, 5-амино-DL-триптофан, 5-гидроксииндол-3-уксусная кислота, 5-гидрокси-L-триптофан, 5-гидроксииндол, серотонин). Сходным образом, соединения с высоким окислительным потенциалом образовывали больше H2O2 (5-метокси-DL-триптофан, L-Trp, индол-3-уксусная кислота, 5-фтор-L-триптофан) в этих условиях. Из этих корреляций были исключения; некоторые соединения имели высокий окислительный потенциал, но не образовывали много H2O2 (например, салициловая кислота и L-кинуренин), что указывало на существование потенциально других механизмов, которые играли важную роль для этих шестичленных ароматических соединений, которые могли не наблюдаться у соединений, содержащих индольный остов L-Trp. Областью интереса был квадрант, который содержал соединения с более низким окислительным потенциалом и более низким образованием H2O2 при воздействии света, чем L-Trp (фиг. 6, заштрихованный прямоугольник). Соединения с этими двумя качествами рассматривали в качестве новых кандидатных антиоксидантов, потому что они могли (1) окисляться быстрее, чем Trp в белке и (2) образовывать очень немного H2O2 во время длительного хранения и/или обработки в условиях окружающей среды во время производства лекарственного препарата и вследствие этого могли защищать белок от дополнительного окисления в этих условиях.
Пример 3: Кандидатные антиоксидантные соединения снижали окисление составов моноклональных антител.
[0201] Соединения, которые по сравнению с L-Trp образуют меньше H2O2 при световой обработке, а также те, у которых окислительные потенциалы ниже, чем у L-Trp, были выбраны для оценки их возможных антиоксидантных свойств с применением AAPH, света и реакции Фентона в качестве возможных моделей окислительного стресса (таблица 3). mAb1 применяли в качестве модельного белка, чтобы оценить эффективность выбранных кандидатных антиоксидантов для защиты против окисления Trp посредством различных моделей окислительного стресса. Каждая модель стресса продуцировала окисление посредством различных механизмов и в связи с этим каждая была ценной для оценки биофармацевтической стабильности. AAPH, или 2,2'-азобис(2-амидинопропан) дигидрохлорид, применяют в качестве модели стресса, чтобы сымитировать алкил пероксиды, потенциально образованные из составов эксципиентов, таких как деградировавший полисорбат. В результате разложения AAPH образуется алкильные, алкоксильные и алкил пероксильные радикалы, которые, как было продемонстрировано, окисляют аминокислотные остатки в белках, включая остатки метионина, тирозина и триптофана (Ji et al., J Pharm Sci 98(12):4485-500 (2009); Chao et al., Proc Natl Acad Sci USA 94(7):2969-74 (1997)). Сходным образом, управляемый свет мог быть использован в качестве модели стресса, чтобы сымитировать воздействие естественного освещения, которое лекарственные препараты могут претерпевать во время обработки и хранения. Индуцированное светом окисление биофармацевтических веществ, как было показано, происходит через механизм, связанный с атомарным кислородом (1O2) и/или супероксид анионом (O2-) (Sreedhara et al., Mol. Pharmaceutics (2013)). Реакция Фентона также широко используется в качестве модели окислительного стресса. Эта смесь H2O2 и ионов Fe ions приводит к окислению через катализируемый металлом механизм, связанный с гидроксил радикалом (Prousek et al., Pure and Applied Chemistry 79(12):2325-2338 (2007)), и применяют, чтобы смоделировать остаточное количество металла из поверхностей из нержавеющей стали, применяемых в производстве и хранении.
[0202] Окисление триптофана (W53) на mAb1 было тщательно охарактеризовано ранее с применением ОФ-ВЭЖХ и LC-MS метода (Sreedhara et al., Mol. Pharmaceutics (2013)). В кратком изложении, mAb1 расщепляли с применением папаина, чтобы образовать фрагменты тяжелой цепи (HC) Fab, HC Fc, и легкой цепи. Фрагменты были окислены с применением DTT, а затем разделены и идентифицированы посредством метода жидкостной хроматографии-масс-спектрометрии (LC-MS). Было выявлено, что окисленные версии HC Fab и HC Fc элюируются ранее, чем их нативные эквиваленты. Сравнение площади, интегрированной под окисленными и нативными пиками, применяли, чтобы подсчитать окисление HC Fab и Fc. Вдобавок, LC-MS/MS пептидные карты (посредством расщепления трипсином и посредством расщепления Lys-C) продемонстрировали, что окисление HC Fab было в первую очередь остатка Trp, W53, тогда как окисление HC Fc предпочтительно относилось к окислению двух остатков Met, M254 и M430. Посредством применения ОФ-ВЭЖХ метода с расщеплением папаином в настоящем исследовании было возможно исследовать окисление остатка Trp посредством подсчета окисления HC Fab, и окисление остатка Met посредством подсчета окисления HC Fc.
[0203] % окисления Fab и % окисления Fc рассчитывали, как указано далее (следует отметить, что каждая молекула антитела имеет два Fab; следовательно, полученный % окисления Fab не отражал % окисленного цельного антитела, содержащего окисление Fab):
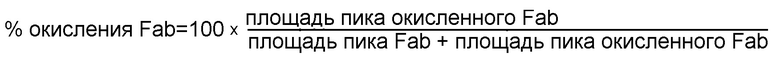
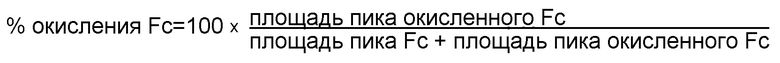
[0204] Для исследования светового стресса в отношении mAb1, получали до 5 мг/мл mAb1 в составе 20 мМ гистидин ацетата pH 6,0, 250 мМ трегалозы и 0,02% полисорбата 20. Антиоксиданты добавляли при концентрации 1 мМ (конечная концентрация) из 10 мМ исходных растворов, полученных в 20 мМ гистидин ацетате pH 6,0, 250 мМ трегалозе и 0,02% полисорбате 20. Исключением был L-Met, который добавляли до конечной концентрации 1, 10, 25, 50 и 100 мМ из исходного раствора 200 мМ L-Met в том же буфере (т.е. 20 мМ гистидин ацетат pH 6,0, 250 мМ трегалоза и 0,02% полисорбат 20). Стеклянные флаконы, содержащие эти составы подвергали воздействию 250 Вт/м2 света в контрольно-измерительном приборе Atlas SunTest CPS+ Xenon (Chicago, IL) при температуре окружающей среды. Контрольные флаконы были завернуты в алюминиевую фольгу и были обработаны сходным образом. После воздействия света растворы подготавливали для анализа посредством обращенно-фазовой ВЭЖХ, как описано выше.
[0205] Для исследования AAPH стресса в отношении mAb1, получали до 4 мг/мл mAb1 в составе 20 мМ гистидин ацетата pH 6,0, 250 мМ трегалозы и 0,02% полисорбата 20. Антиоксиданты добавляли при концентрации 1 мМ (конечная концентрация) из 10 мМ исходных растворов, полученных в 20 мМ гистидин ацетате pH 6,0, 250 мМ трегалозе и 0,02% полисорбате 20. 200 мкл 10 мМ AAPH добавляли к 2 мл каждого раствора mAb1, а затем инкубировали при 40°C в течение 24 часов. После инкубации в каждом растворе произвели замену буфера с применением буфера состава (20 мМ гистидин ацетат pH 6,0, 250 мМ трегалоза и 0,02% полисорбат 20) с применением колонки PD-10 таким образом, что окончательная концентрация mAb1 составляла 2,3 мг/мл. После замены буфера каждый раствор подготавливали для анализа посредством обращенно-фазовой ВЭЖХ, как описано выше.
[0206] Для исследования стресса посредством реакции Фентона в отношении mAb1, получали до 3 мг/мл mAb1 в составе 20 мМ гистидин гидрохлорида pH 6,0. Антиоксиданты добавляли в конечной концентрации 1 мМ из 10 мМ исходных растворов, полученных в 20 мМ гистидин гидрохлориде. Конечная концентрация 0,2 мМ FeCl3 и 10 ppm H2O2 добавляли к каждому раствору mAb1, а затем инкубировали при 40°C в течение 3 часов. После инкубации каждую реакцию гасили посредством добавления 100 мМ L-Met (полученного из исходного раствора 200 мМ L-Met в 20 мМ гистидин гидрохлориде), а затем подготавливали для анализа посредством обращенно-фазовой ВЭЖХ, как описано выше.
[0207] Было определено, что инкубация mAb1 с AAPH в течение 24 часов при 40°C приводила к окислению 27% Fab (остаток Trp) (фиг. 7A) и окислению 47% Fc (остаток Met) (фиг. 7B). Семь эксципиентов, которые были предварительно проскринированы с применением светового стресса и циклической вольтамметрии инкубировали с mAb1 при AAPH условиях, чтобы оценить антиоксидантные способности. Было обнаружено, что шесть из семи соединений значительно снижают AAPH-индуцированное окисление Fab (фиг. 7A). Все шесть из этих соединений содержали индольный каркас. Кроме того, все гидрокси протестированные производные (5-гидрокси-L-Trp, 5-гидроксииндол, 7-гидроксииндол и серотонин) снижали окисление Fab, приближаясь к контрольным уровням (около 2%). Тем временем, салициловая кислота практически не оказывала эффекта на окисление Fab при AAPH стрессе. Никакие из эксципиенты не проявили влияние на уровень AAPH-индуцированного окисления Fc (фиг. 7B).
[0208] Для исследования светового стресса mAb1 подвергали воздействию света в течение 16 часов при 250 Вт/м2 во время тестирования указанных выше семи эксципиентов (фиг. 8). Воздействие света на mAb1 (“Отсутствие эксципиента”) увеличивала окисление Fab в 3,5 раза по сравнению с контрольным уровнем (“mAb1 Ref Mat”, Фиг. 8A). Ранее было продемонстрировано, что L-Trp мог защищать против окисления Trp в модельном белке паратиреоидном гормоне (PTH) (Ji et al., J Pharm Sci 98(12):4485-500 (2009)). Однако в этом исследовании было обнаружено, что добавление 1мМ L-Trp к mAb1 увеличивало окисление Fab более чем в 11 раз, возможно, посредством образования ROS, таких как атомарный кислород, посредством L-Trp под воздействием света (фиг. 2). Добавление гидрокси соединений (5-гидрокси-L-Trp, 5-гидроксииндол, 7-гидроксииндол и серотонин) защищало от индуцированного светом окисления Fab, снижая окисление Fab до уровней, близких к контрольным (фиг. 8A). С другой стороны, салициловая кислота проявляла себя сходным образом с L-триптофанамидом, увеличивая окисление Fab более чем в 8 раз по сравнению с контрольным уровнем. Сходные результаты наблюдали для окисления Fc при световом стрессе (фиг. 8B). Воздействие света на mAb1 приводило к 40% повышению окисления Fc по сравнению с контрольным уровнем, тогда как добавление L-Trp повышало окисление Fc до 7 раз по сравнению с контрольным уровнем. По сравнению с контролем (отсутствие эксципиента) L-Триптофанамид и салициловая кислота также приводили к большему окислению Fc. Гидрокси соединения продуцировали сходное окисление Fc, как и контроль с отсутствием эксципиента потенциально, так как они продуцировали гораздо меньше ROS, чем L-Trp при воздействии света. Результаты светового скрининга и исследования с использованием NaN3 в Примере 2 продемонстрировали хорошую корреляцию между определенным количеством H2O2, образованным посредством эксципиента, и окислением Fc Met в mAb1.
[0209] Реакция Фентона с применением смеси H2O2 и ионов Fe производит окисление посредством катализируемой металлом реакции гидроксильного радикала (Prousek et al., Pure and Applied Chemistry 79(12):2325-2338 (2007)). В ходе этой реакции происходит окисление Fab, т.е. триптофана, в mAb1. Эту реакцию также проводили в присутствии выбранных антиоксидантов, которые были пригодными против окисления, индуцированного как AAPH, так и светом, как сообщалось выше. Данные, относящиеся к свойствам антиоксидантов против реакции, опосредованной реакцией Фентона, анализировали с применением ОФ-ВЭЖХ анализа, как описано выше (фиг. 9). При тестируемых условиях в реакции Фентона происходило приблизительно в четыре раза больше окисления в Fab области mAb1 по сравнению с контролем. Большинство протестированных антиоксидантов, за исключением салициловой кислоты, продемонстрировали сходные свойства гашения гидроксильного радикала с L-Trp, который защищал от окисления Fab на приблизительно 25% по сравнению со случаем отсутствия эксципиента (фиг. 9A). В отношении защиты против окисления Fc протестированные эксципиенты (не считая салициловой кислоты) вели себя немного лучше, чем L-Trp (фиг. 9B).
[0210] Электронодонорные замены в ароматическом кольце могут облегчить образование индолил катион-радикала и потенциально ускорить реактивность с радикалами. Гидроксильные группы, присоединенные к ароматическим кольцам, являются электронодонорами, так как атом кислорода имеет неподеленную пару электронов, которые могут быть резонансной структурой, ведущей к более низким окислительным потенциалам и потенциально большей восприимчивости к электрофильным атакам. Как видно в таблице 2, гидроксильные замены вели к существенно более низким окислительным потенциалам, указывая на то, что эти соединения могли сделать лучшие антиоксиданты, чем L-Trp и/или индол. Гидроксил замещенный индол и производные Trp также продуцировали наименьшее количество пероксида водорода при облучении светом (таблица 1). Это могло происходить вследствие низкого квантового выхода этих молекул при переносе энергии света к молекулярному кислороду, в сочетании с их более высокими константами гашения, как было продемонстрировано для 5-гидрокси-L-триптофана (Dad et al., J Photochem Photobiol B, 78(3):245-51 (2005)). Как показано на фиг. 7 и фиг. 8, гидроксил замещенные производные индола и триптофана обеспечивали значительную защиту против окисления, индуцированного AAPH, светом и реакцией Фентона, в W53 в Fab области mAb1. Однако ни одно из этих соединений не обеспечивало существенной антиоксидантной защиты от окисления Met в Fc области mAb1 при индуцированной AAPH деградации. Напротив, производные индола и триптофана вели себя, как и ожидалось при окислении под воздействием света. Молекулы, которые продуцировали более высокие количества пероксида при фотоактивации (например, L-Trp и Trp-амид) также приводили к более сильному окислению Met в Fc области mAb1, в то время как -OH производные продуцировали меньше H2O2, и также наименьшее количество окисления Met в Fc области в условиях фотоокисления. Метионин легко окислялся до метионин сульфоксида посредством H2O2 и алкил пероксидов посредством реакции нуклеофильного замещения (Li et al., Biotechnology and Bioengineering 48:490-500 (1995)). Фотоокисление метионина до метионин сульфоксида происходит через атомарный кислород, хотя эта реакция происходит через различных посредников (Li et al., Biotechnology and Bioengineering 48:490-500 (1995)). AAPH деградирует при термическом стрессе, давая алкил пероксиды и алкоксильные радикалы, которые обладают различной реактивностью по отношению к Met и Trp, соответственно (Werber et al., J Pharm Sci 100(8):3307-15 (2011)). Более ранние исследования показали, что L-Trp был способен предотвращать окисление Trp в PTH, индуцированное AAPH и что L-Trp не предотвращал окисление Met в PTH в тех же условиях (Ji et al., J Pharm Sci 98(12):4485-500 (2009)). Сходным образом, L-Met был способен защищать PTH от индуцированного AAPH окисления, но не защищал от окисления Trp. Эти наблюдения согласовывались с механизмами реакции, где окисление Met преимущественно происходит через реакции нуклеофильного замещения, тогда как окисление Trp происходит в основном посредством свободно радикальных механизмов.
[0211] Предполагаемый механизм фотоактивации L-Trp, ведущий к атомарному кислороду и, наконец, к H2O2 и образованию и гашению атомарного кислорода посредством 5-HT, показан на фиг. 10.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОСТАВЫ СО СНИЖЕННЫМ ОКИСЛЕНИЕМ | 2014 |
|
RU2707550C2 |
| СПОСОБЫ КУЛЬТИВИРОВАНИЯ КЛЕТОК | 2018 |
|
RU2758674C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИСПЕЦИФИЧЕСКИХ АНТИТЕЛ, БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ТАКИХ АНТИТЕЛ | 2018 |
|
RU2795240C2 |
| КОМПОЗИЦИИ И СПОСОБЫ, ВКЛЮЧАЮЩИЕ АЛКИЛГЛИКОЗИДЫ, ДЛЯ СТАБИЛИЗАЦИИ СОДЕРЖАЩИХ БЕЛКИ СОСТАВОВ | 2011 |
|
RU2575830C2 |
| ПРОКОАГУЛЯНТНЫЕ АНТИТЕЛА | 2018 |
|
RU2810094C2 |
| СПОСОБЫ ОЧИСТКИ АНТИТЕЛ | 2017 |
|
RU2759909C2 |
| АНТИТЕЛА ПРОТИВ TFR И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ПРОЛИФЕРАТИВНЫХ И ВОСПАЛИТЕЛЬНЫХ РАССТРОЙСТВ | 2016 |
|
RU2737637C2 |
| КОНСТРУКЦИИ ПОЛИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2015 |
|
RU2784673C2 |
| КОНСТРУКЦИИ ПОЛИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2015 |
|
RU2725812C2 |
| АНТИТЕЛА ПРОТИВ BTN3A И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ РАКА ИЛИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2800726C2 |
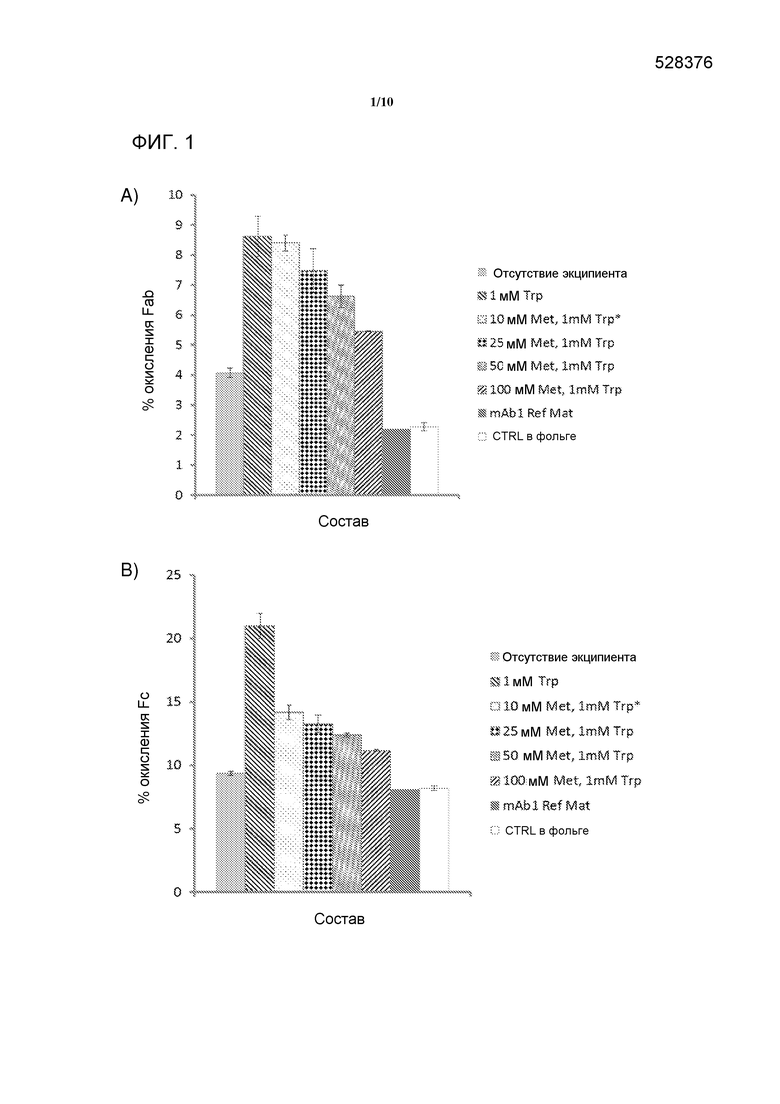
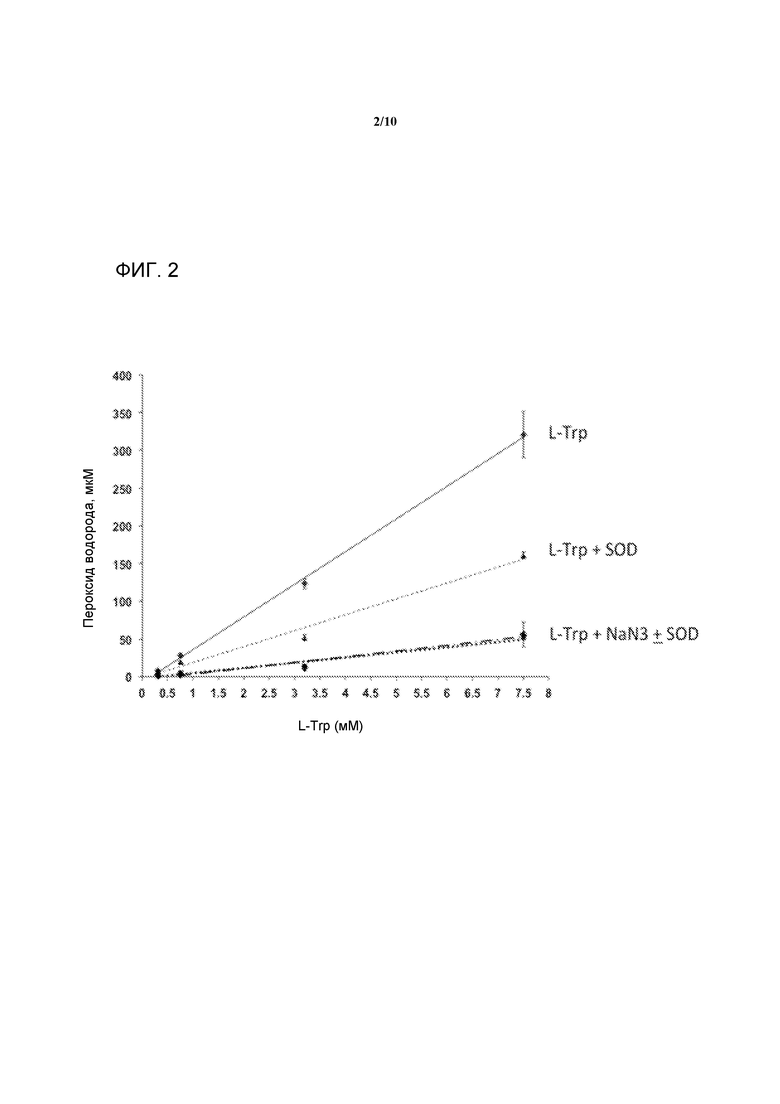
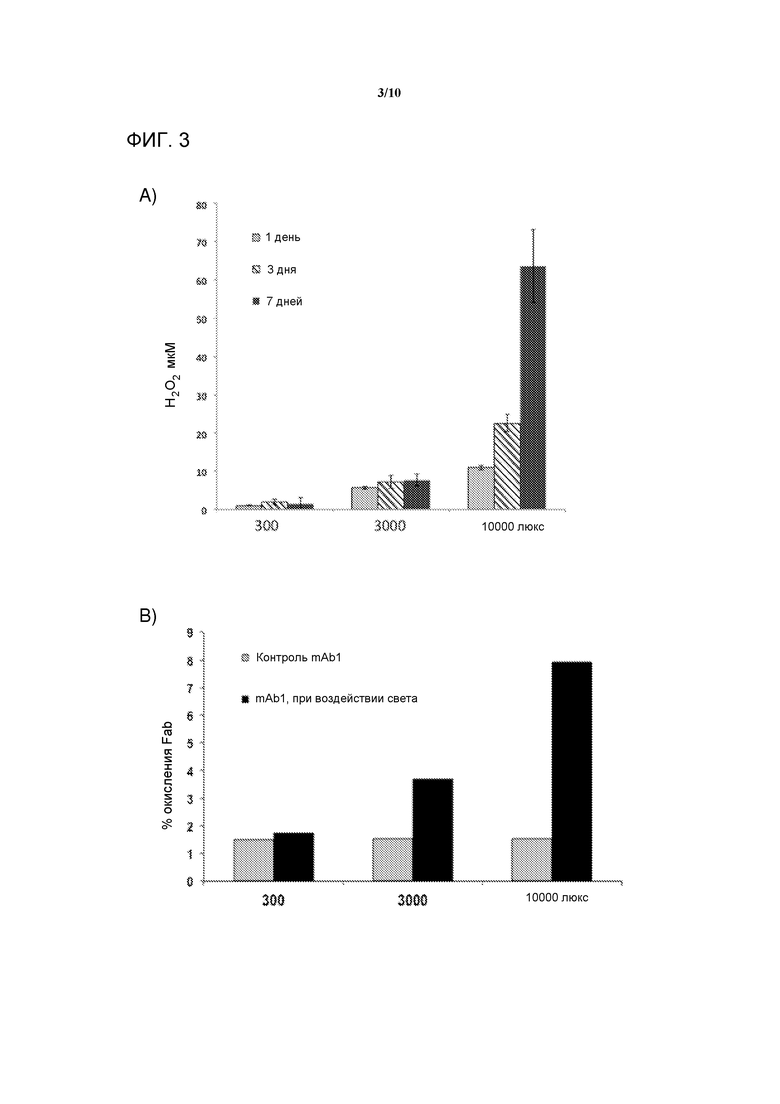
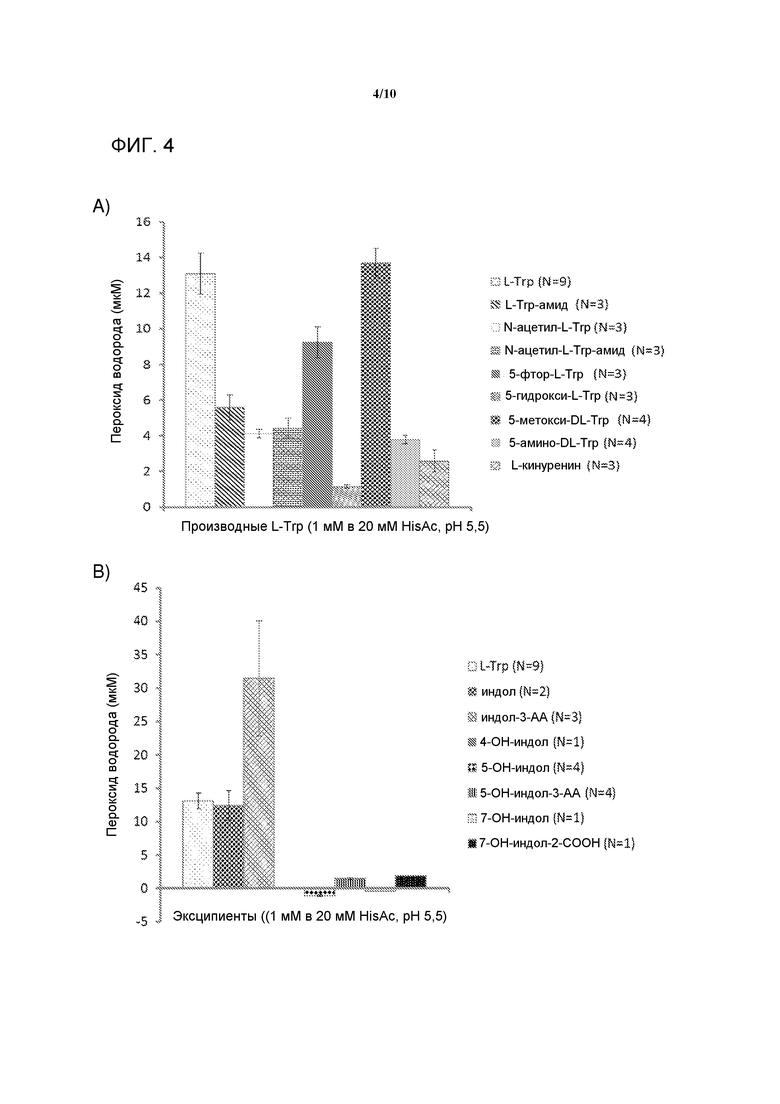
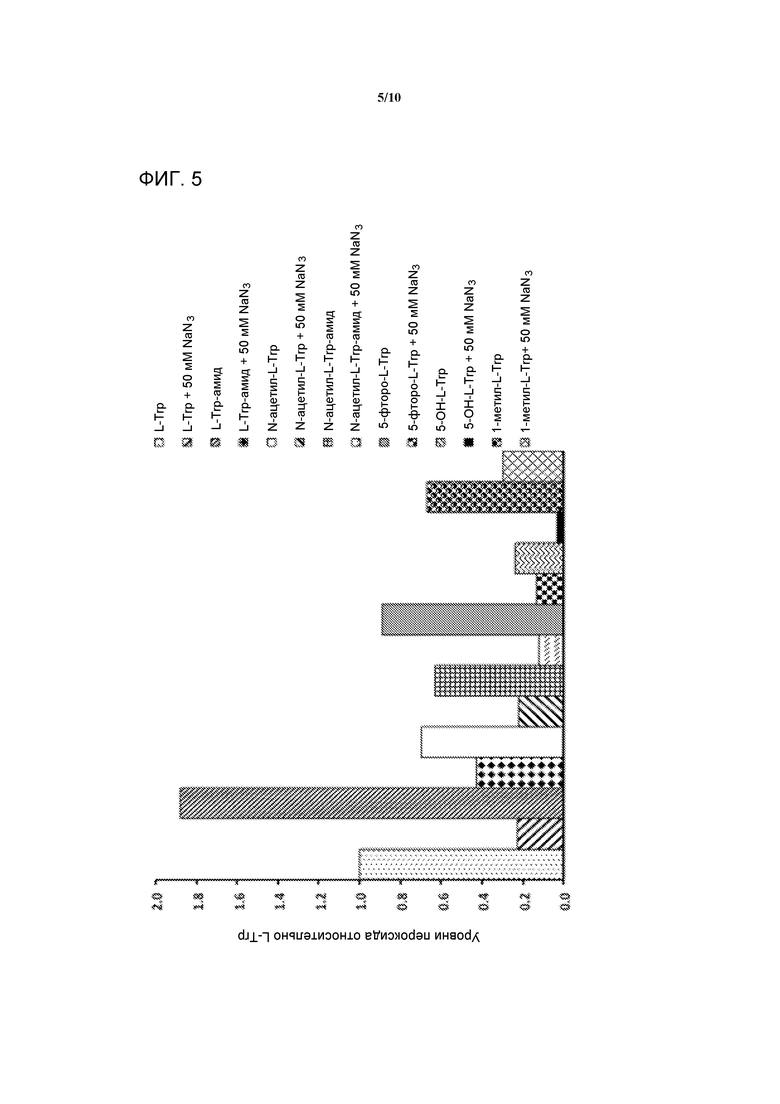
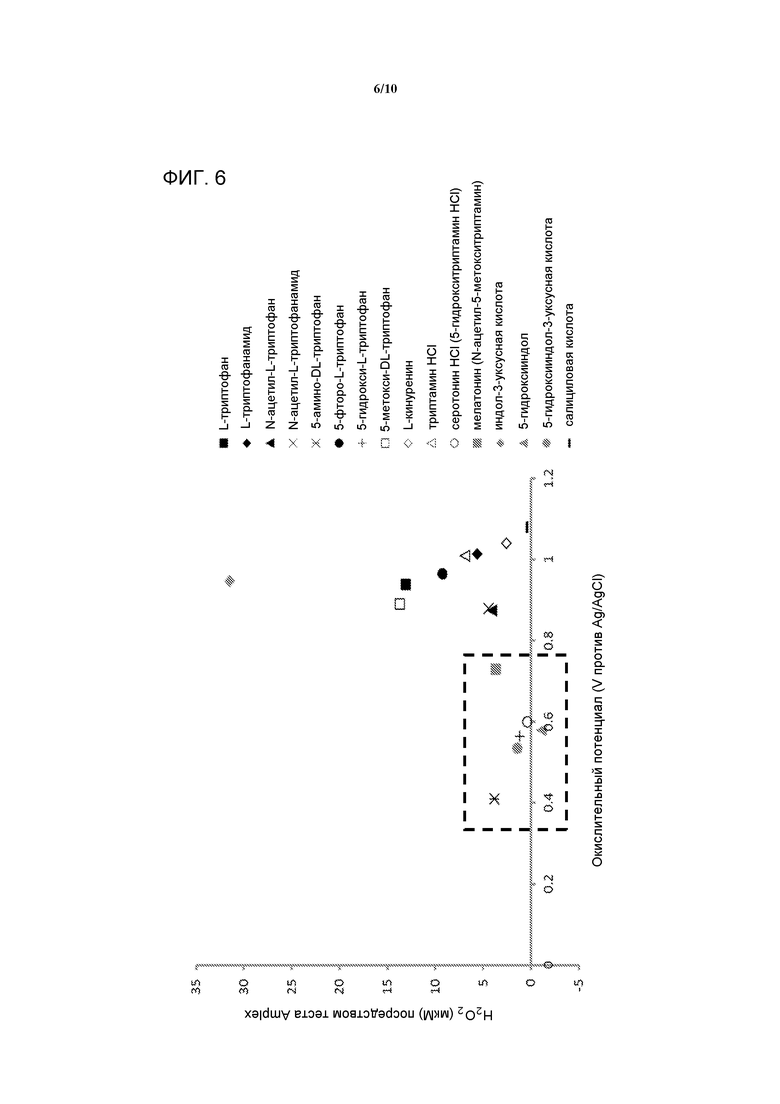
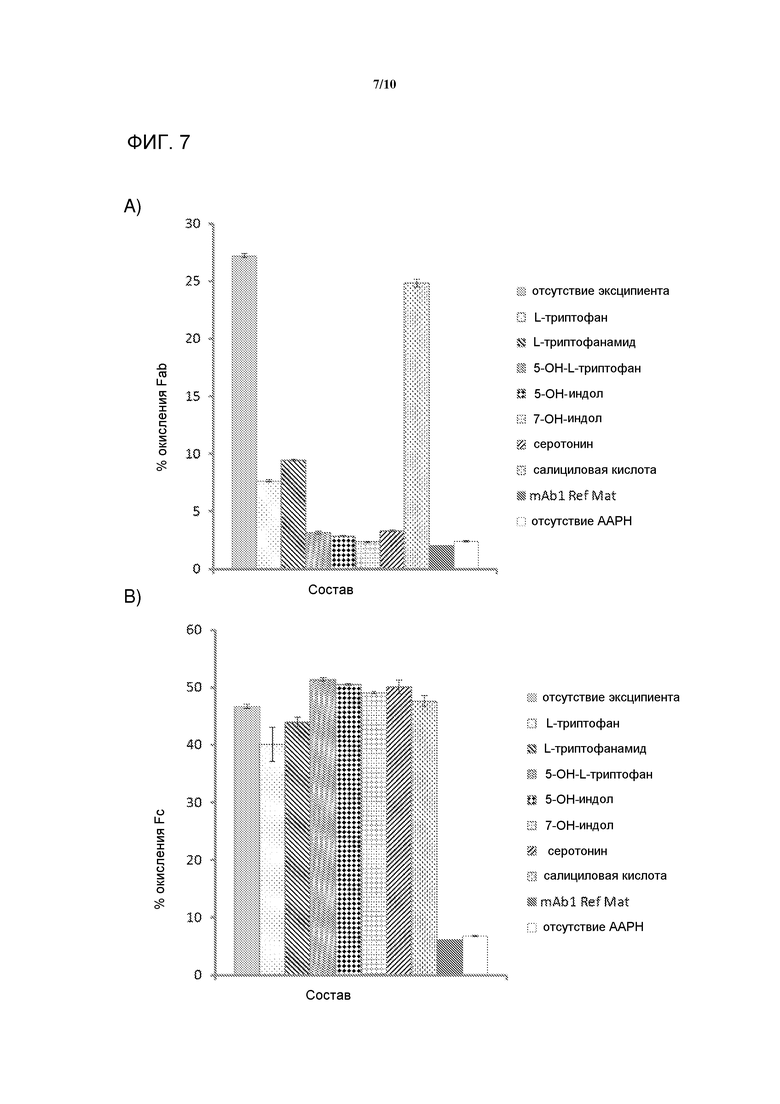
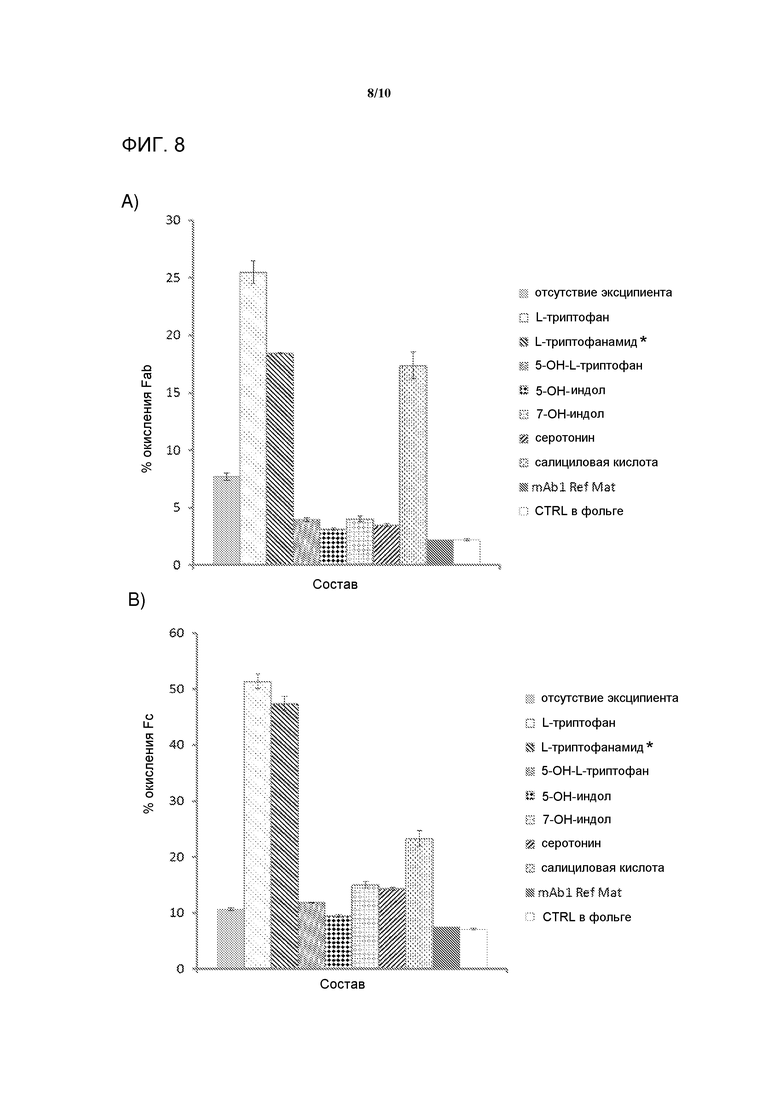
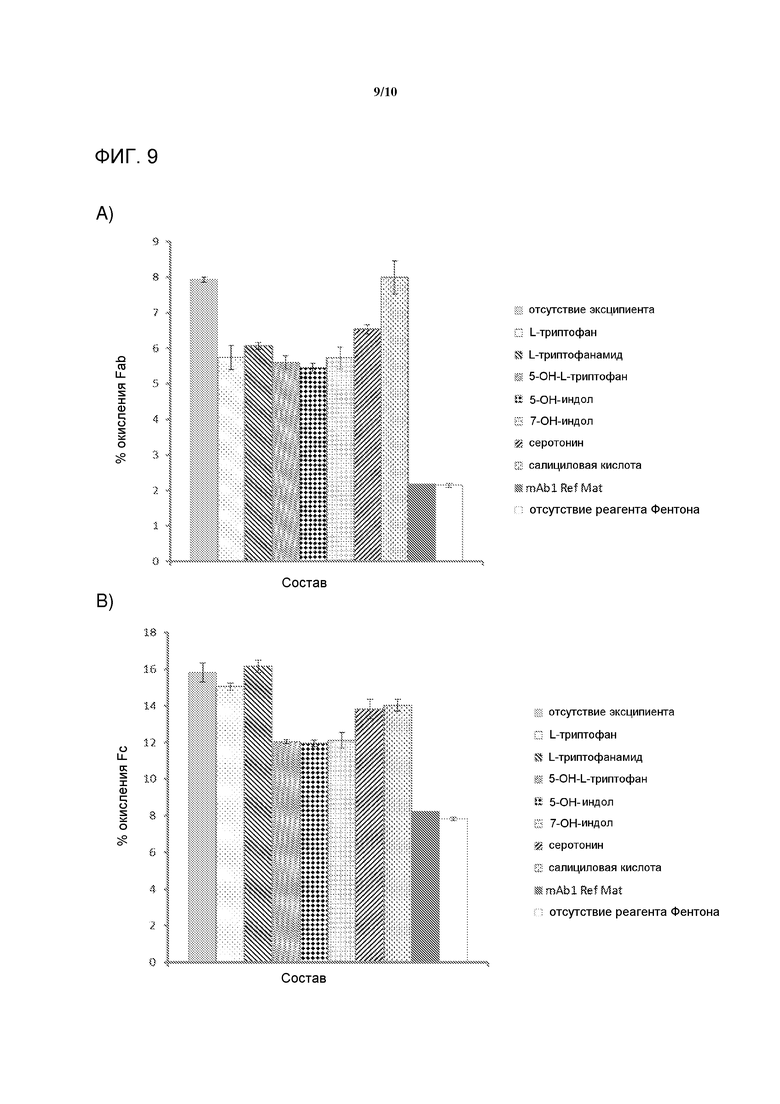

Группа изобретений относится к химико-фармацевтической промышленности и представляет собой способ предотвращения окисления антитела в фармацевтически стабильном жидком составе и сам фармацевтически стабильный жидкий состав, содержащий антитело и соединение, которое предотвращает окисление антитела в жидком составе, где соединение выбрано из группы, состоящей из 5-гидрокси-триптофана, 5-гидрокси индола, 7-гидрокси индола и серотонина. Изобретение также относится к способу создания указанного выше фармацевтически стабильного жидкого состава. Группа изобретений позволяет обеспечить антиоксидантную активность антитела без разложения с образованием активных форм кислорода. 3 н. и 29 з.п. ф-лы, 10 ил., 3 табл., 3 пр.
1. Фармацевтически стабильный жидкий состав, содержащий антитело и соединение, которое предотвращает окисление антитела в жидком составе, где соединение выбрано из группы, состоящей из 5-гидрокси-триптофана, 5-гидрокси индола, 7-гидрокси индола и серотонина.
2. Состав по п. 1, который является фармацевтическим составом, пригодным для введения индивидууму.
3. Состав по п. 1, который является водным.
4. Состав по п. 2, который является водным.
5. Состав по п. 1 или 4, где соединение в составе составляет от 0,3 до 5 мМ.
6. Состав по п. 1 или 4, где соединение в составе составляет 1 мМ.
7. Состав по п. 1 или 4, где соединение предотвращает окисление триптофана и/или метионина в антителе.
8. Состав по п. 1 или 4, где соединение предотвращает окисление антитела посредством активных форм кислорода.
9. Состав по п. 8, где активные формы кислорода выбраны из группы, состоящей из атомарного кислорода, супероксида (O2-), пероксида водорода, гидроксильного радикала и алкил пероксида.
10. Состав по п. 1 или 4, где антитело подвержено окислению.
11. Состав по п. 1 или 4, где триптофан в антителе подвержен окислению.
12. Состав по п. 1, где антитело является поликлональным антителом, моноклональным антителом, гуманизированным антителом, антителом человека, химерным антителом или фрагментом антитела.
13. Состав по п. 1 или 4, где концентрация антитела в составе составляет от 1 до 250 мг/мл.
14. Состав по п. 1 или 4, который дополнительно содержит один или несколько эксципиентов, выбранных из группы, состоящей из стабилизатора, буфера, поверхностно-активного вещества и средства придания тоничности.
15. Состав по п. 1 или 4, где состав имеет pH от 4,5 до 7,0.
16. Способ получения фармацевтически стабильного жидкого состава, включающий добавление количества соединения, которое предотвращает окисление антитела, к жидкому составу, где соединение выбрано из группы, состоящей из 5-гидрокси-триптофана, 5-гидрокси индола, 7-гидрокси индола и серотонина.
17. Способ по п. 16, где состав является фармацевтическим составом, пригодным для введения индивидууму.
18. Способ по п. 17, где состав является водным.
19. Способ предотвращения окисления антитела в фармацевтически стабильном жидком составе, включающий добавление количества соединения, которое предотвращает окисление антитела, к жидкому составу, где соединение выбрано из группы, состоящей из 5-гидрокси-триптофана, 5-гидрокси индола, 7-гидрокси индола и серотонина.
20. Способ по п. 19, где состав является фармацевтическим составом, пригодным для введения индивидууму.
21. Способ по п. 19, где состав является водным.
22. Способ по любому одному из пп. 16-21, где соединение в составе составляет от 0,3 до 5 мМ.
23. Способ по любому одному из пп. 16-21, где соединение в составе составляет 1 мМ.
24. Способ по любому одному из пп. 16-21, где соединение предотвращает окисление триптофана и/или метионина в антителе.
25. Способ по любому одному из пп. 16-21, где соединение предотвращает окисление антитела посредством активных форм кислорода.
26. Способ по п. 25, где активные формы кислорода выбраны из группы, состоящей из атомарного кислорода, супероксида (O2-), пероксида водорода, гидроксильного радикала и алкил пероксида.
27. Способ по любому одному из пп. 16-21, где антитело подвержено окислению.
28. Способ по любому одному из пп. 16-21, где триптофан в антителе подвержен окислению.
29. Способ по п. 16, где антитело является поликлональным антителом, моноклональным антителом, гуманизированным антителом, антителом человека, химерным антителом или фрагментом антитела.
30. Способ по любому одному из пп. 16-21, где концентрация антитела в составе составляет от 1 до 250 мг/мл.
31. Способ по любому одному из пп. 16-21, где состав дополнительно содержит один или несколько эксципиентов, выбранных из группы, состоящей из стабилизатора, буфера, поверхностно-активного вещества и средства придания тоничности.
32. Способ по любому одному из пп. 16-21, где состав обладает pH от 4,5 до 7,0.
| CHRISTEN, S et al | |||
| Antioxidant Activities of Some Tryptophan Metabolites: Possible Implication for Inflammatory Diseases | |||
| Способ приготовления консистентных мазей | 1919 |
|
SU1990A1 |
| Торфодобывающая машина с вращающимся измельчающим орудием | 1922 |
|
SU87A1 |
| Коромысловые весы инспекторского типа | 1925 |
|
SU2506A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Литьевая форма для изготовления полимерных изделий | 1985 |
|
SU1260230A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| CADENAS E et al.: "Antioxidant activity of | |||
Авторы
Даты
2019-11-22—Публикация
2014-03-13—Подача