Изобретение относится к области медицинской техники, а именно к технологии получения биологически совместимых кальций-фосфатных покрытий, обладающих свойствами остеоинтеграции, и может быть использовано в стоматологии, травматологии и ортопедии при изготовлении покрытий титановых имплантатов для совмещения с костной тканью и для улучшения их биологической адаптации с живым организмом.
Известен способ изготовления биосовместимого покрытия на медицинский имплантат, включающий подготовку поверхности титанового имплантата и последующее формирование покрытия путем первоначального напыления порошка титана дисперсностью 60-150 мкм слоем толщиной 50-100 мкм на титановый имплантат и последующего напыления порошка биокерамики, в качестве которой используют порошок гидроксиапатита или порошок биоситала, дисперсностью 40-60 мкм слоем толщиной 30-50 мкм на слой титана. При этом используют плазменное напыление с использованием плазмотрона током дугового разряда, А 6-7, рабочим плазмообразующим и транспортирующим газом аргоном на дистанции от титанового имплантата, составляющей 30-40 мм (патент RU 2157245, МПК7 A61L 27/06, A61F 2/02).
Основными недостатками данного способа изготовления биосовместимого покрытия на медицинский имплантат являются невысокий уровень адгезионной прочности сцепления покрытия с титановым имплантатом как основой, что не позволяет обеспечить продолжительное функционирование имплантатов, вследствие присутствия в фазовом составе покрытия небольшого количества продуктов эрозии от медьсодержащих материалов сопла плазмотрона, и повышенный расход используемых порошковых материалов.
Наиболее близким к предложенному способу по технической сущности и достигаемому результату, выбранным в качестве прототипа, является способ получения биопокрытия на медицинский имплантат, включающий подготовку поверхности титанового имплантата и последующее формирование покрытия путем напыления порошка гидроксиапатита, который предварительно спекают и измельчают с микродобавками оксидов магния, кремния, никеля, титана, марганца, железа, хрома, ванадия, дисперсностью 0,1-0,5 мкм слоем толщиной 50-1000 мкм на титановый имплантат. Используют газотермическое плазменное или газоплазменное напыление, при получении адгезионной прочности сцепления покрытия с титановым имплантатом как основой, составляющей 20,5-20,7 МПа (авторское свидетельство SU 1743024, МПК6 A61F 2/00, A61F 2/02).
Однако вышеописанный способ получения биопокрытия на медицинский имплантат не обеспечивает высокую адгезионную прочность сцепления покрытия с титановой основой не только из-за большого различия характеристик металла основы и материала покрытия, но и из-за невысокой скорости частиц напыляемого материала. Кроме того, названный способ не позволяет обеспечить заданную шероховатость и исходный фазовый состав покрытия, так как для газоплазменного напыления характерно длительное нахождение напыляемого материала в потоке продуктов сгорания, что, как правило, приводит к перегреву напыляемого порошка и оказывает влияние на фазовый состав покрытия, а также является достаточно энергоемким, так как приводит к значительным затратам электроэнергии.
Задачей предлагаемого изобретения является разработка способа получения детонационного биосовместимого покрытия на медицинский имплантат с повышенной адгезионной прочностью сцепления с титановым имплантатом как основой, обеспечением заданной шероховатости и исходного фазового состава покрытия и пониженной энергоемкости.
Поставленная задача решается тем, что в способе получения детонационного биосовместимого покрытия на медицинский имплантат, включающем подготовку поверхности титанового имплантата и последующее формирование покрытия путем напыления порошка гидроксиапатита на титановый имплантат, согласно изобретению используют детонационно-газовое напыление с соотношением в рабочей смеси кислорода и пропанобутановой смеси, составляющим 70:65, регулируя подачу пропанобутановой смеси при постоянном расходе кислорода по режимам 90 л/час, 150 л/час и 200 л/час, частотой циклов 4 Гц, порошка гидроксиапатита дисперсностью 150-300 мкм на дистанции от титанового имплантата, составляющей 70 мм.
Повышение адгезионной прочности сцепления покрытия с титановым имплантатом как основой обусловлено получением путем детонационно-газового напыления порошка гидроксиапатита дисперсностью 150-300 мкм пористой поверхности покрытия заданного гранулометрического размера и близкого к минеральному составу костной ткани, что обеспечивает вживление имплантата за счет прорастания костной ткани в поры покрытия.
Получаемое покрытие обладает развитой топографией поверхности, достаточной для успешной остеоинтеграции костной ткани и позволяет придавать покрытиям заданную шероховатость и фазовый состав за счет использования разной гранулометрической размерности порошков гидроксиапатита, от 150 до 300 мкм.
Снижение энергоемкости процесса получения детонационного биосовместимого покрытия на медицинский имплантат обусловлено тем, что процесс детонационного напыления характерен проведением химической реакции взрывного разложения углеводорода с кислородом, процесс организован циклически - расход газов рабочих минимален.
Соотношение в рабочей смеси кислорода и пропанобутановой смеси, составляющее 70:65 является оптимальным, так как при других соотношениях смеси кислорода и пропанобутановой смеси падает скорость и температура продукта детонации, что приводит к снижению адгезионной прочности сцепления напыляемого покрытия с титановым имплантатом.
Расход кислорода по режимам 90 л/час, 150 л/час и 200 л/час является оптимальным, так как эти режимы обеспечивает стехиометрическое соотношение газов для реакции горения.
Частота следования циклов напыления, составляющая 4 Гц, является оптимальной, так как при частоте следования циклов напыления более 4 Гц сложно отрегулировать подачу газов, а при частоте следования циклов напыления менее 4 Гц падает производительность напыления.
Дисперсность порошка гидроксиапатита, составляющая 150-300 мкм, является оптимальной, так как при напылении частиц порошка менее 150 мкм на титановом имплантате формируется покрытие, неоднородное по толщине и фазовому составу, обнаруживаются участки с оголенным титановым основанием, что обусловлено недостаточно высокой скоростью мелких частиц гидроксиапатита при детонационно-газовом напылении, а использовать дисперсность порошка гидроксиапатита более 300 мкм параметры установки детонационно-газового напыления не позволяют.
Дистанция напыления порошка гидроксиапатита, составляющая 70 мм, является оптимальной, так как при дистанции напыления порошка гидроксиапатита меньше 70 мм возникает отраженная ударная волна от стенки напыления, а при дистанции напыления порошка гидроксиапатита больше 70 мм наблюдается падение скорости напыляемых частиц.
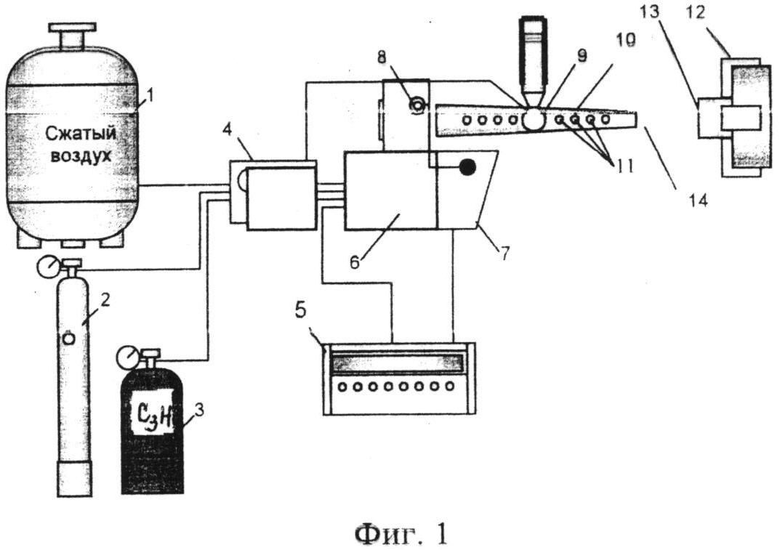
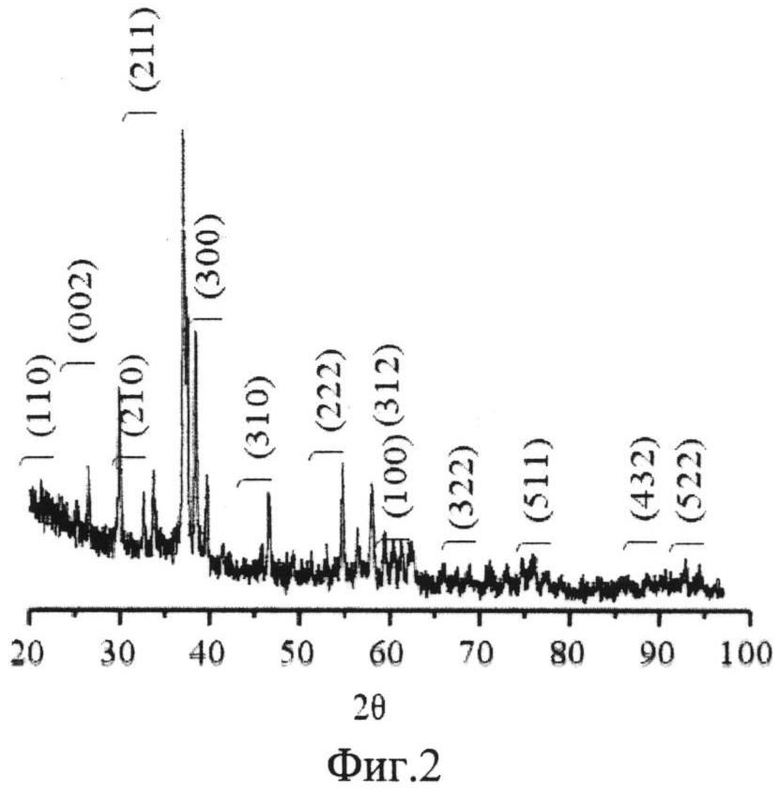
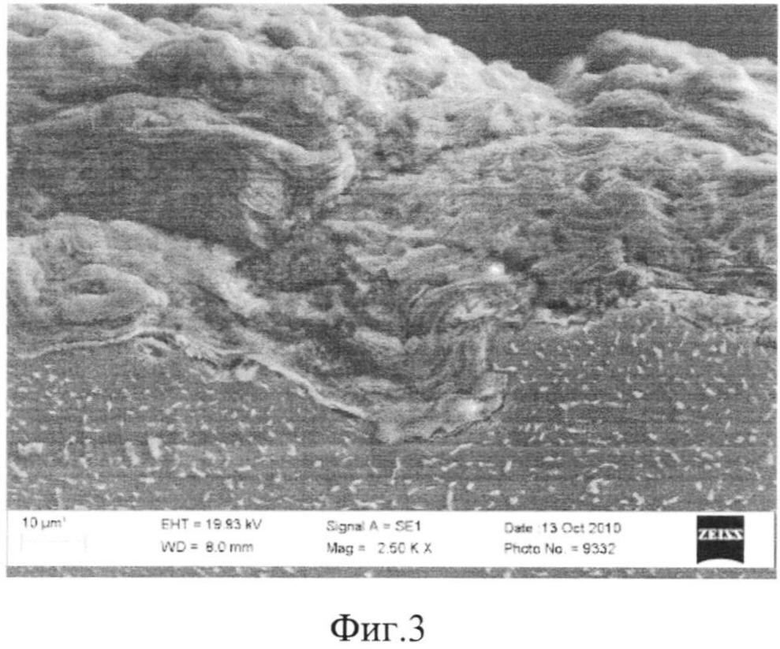
Предлагаемый способ получения детонационного биосовместимого покрытия на медицинский имплантат поясняется фиг 1, на которой приведена схема установки для детонационно-газового напыления порошковых материалов, реализующая способ; фиг.2, на которой представлена рентгенограмма полученного покрытия; фиг.3, на которой представлено электронно-микроскопическое изображение структуры поверхности детонационного биосовместимого покрытия из гидроксиапатита.
Установка для детонационно-газового напыления порошковых материалов, реализующая способ получения детонационного биосовместимого покрытия на медицинский имплантат, содержит ресивер 1 со сжатым воздухом, емкость 2 с кислородом, емкость 3 с пропанобутановой смесью, систему 4 газораспределения, блок 5 управления, инжекционный смеситель 6, блок 7 электронного зажигания, свечу зажигания 8, дозатор 9, ствол 10 с отверстиями 11 для установки дозатора 9, манипулятор 12, подложку 13, выполненную в виде титанового имплантата. Установка предназначена для работы в импульсном режиме.
Ресивер 1 со сжатым воздухом, емкость 2 с кислородом, емкость 3 с пропанобутановой смесью подключены к системе 4 газораспределения, которая в свою очередь связана с инжекционным смесителем 6 и стволом 10. Инжекционный смеситель 6 связан со стволом 10, со свечой зажигания 8, а также с блоком 7 электронного зажигания и блоком 5 управления, соединенным с блоком 7 электронного зажигания. Дозатор 9 связан со стволом 10 с возможностью закрепления в одном из отверстий последнего. Ствол 10 предназначен для подачи газодисперсного потока 14 к подложке 13, прикрепленной к манипулятору 12.
Блок 5 управления представляет собой электронный контролер, задающий временные интервалы срабатывания исполнительных механизмов на детонационно-газовой установке. Блок 7 электронного зажигания представляет собой высоковольтный трансформатор и разрядник для создания искры зажигания.
Способ получения детонационного биосовместимого покрытия на медицинский имплантат осуществляется следующим образом.
Сначала подготавливают поверхность титанового имплантата путем механической и химической обработки, а порошок гидроксиапатита сушат в печи. Затем осуществляют формирование покрытия путем детонационно-газового напыления порошка гидроксиапатита на титановый имплантат. Детонационно-газовое напыление используют с соотношением в рабочей смеси кислорода и пропанобутановой смеси, составляющим 70:65, регулируя подачу пропанобутановой смеси при постоянном расходе кислорода по режимам 90 л/час, 150 л/час и 200 л/час, частотой циклов 4 Гц, порошка гидроксиапатита дисперсностью 150-300 мкм на дистанции от титанового имплантата, составляющей 70 мм.
Изобретение иллюстрируется следующим примером.
Предварительно выбирали в качестве материала титанового имплантата сплав марки ВТ-1.0, который широко используется в медицинской практике, а в качестве биоактивного материала покрытия выбирали порошок гидроксиапатита дисперсностью 150-300 мкм, который обеспечивает заданные параметры пористости получаемого покрытия. Порошок гидроксиапатита сушили в муфеле при температуре 100-200°C.
Перед формированием покрытия поверхность титанового имплантата подвергали механической и химической обработке. Механическую обработку поверхности титанового имплантата осуществляли путем пескоструйной отделки воздушно-абразивной смесью с использованием порошка окиси алюминия Al2O3 фракции 250-380 мкм. Последующую химическую обработку поверхности титанового имплантата для увеличения его исходной удельной поверхности и обеспечения увеличения прочности покрытия осуществляли путем протравливания в кислотном травителе, нагретом до температуры кипения,:
0,1 НСl+0,8 H2SO4+0,1 Н2O
при следующем соотношении компонентов, мас.%: раствор соляной кислоты - 30; раствор серной кислоты - 60; вода - 10.
Цикл детонационно-газового напыления порошка гидроксиапатита на титановый имплантат начинали согласно сигналам, вырабатываемым блоком 5 управления, подачей рабочей смеси кислорода и пропанобутановой смеси в соотношении, составляющем 70:65, в течение заданного времени в систему 4 газораспределения. Для снижения температуры нагрева частиц напыляемого порошка гидроксиапатита рабочую смесь разбавляли воздухом из ресивера 1. Напыляемый порошок гидроксиапатита дисперсностью 150-300 мкм подавали из дозатора 9, закрепленного в одном из отверстий 11, в ствол 10. После загрузки порошка производили зажигание рабочей смеси свечой зажигания 8 через инжекционный смеситель 6 и блок 7 электронного зажигания. Газодисперсный поток 14 подавали на подложку 13, выполненную в виде титанового имплантата, на расстоянии от среза ствола 10 до подложки 13, составляющем 70 мм. Число циклов напыления составляет от 250 до 400, так как при количестве циклов напыления менее 250 толщина покрытия получается неравномерной, а более 400 - адгезионная прочность сцепления покрытия с титановым имплантатом значительно снижается.
Изменение режимов напыления производили регулировкой подачи пропанобутановой смеси при постоянном расходе кислорода по трем фиксированным точкам: 35 единиц, 50 единиц, 65 единиц, что соответствует 90 л/час, 150 л/час, 200 л/час. В качестве измерительного прибора использовали ротаметр РМ 2.5. Покрытие на поверхность подложки 13 наносили с частотой следования циклов напыления 4 Гц.
Как следует из рентгенограммы полученного покрытия (фиг.2), в нем не выявлено других линий помимо основной фазы гидроксиапатита, что указывает на его однородность.
Покрытие из гидроксиапатита на имплантате из титана марки ВТ-1.0 имеет толщину 15-500 мкм (фиг.3), пористую структуру с общей пористостью от 1,5 до 50% и средним размером пор от 2 до 60 мкм, развитую шероховатую поверхность со средней шероховатостью 4,5-10 мкм. Покрытие имеет адгезионную прочность сцепления с титановым имплантатом 35-68 МПа.
Таким образом, предлагаемый способ получения детонационного биосовместимого покрытия на медицинский имплантат позволяет повысить адгезионную прочность сцепления покрытия с титановым имплантатом как основой, обеспечить заданную шероховатость и исходный фазовый состав покрытия, а также пониженную энергоемкость процесса.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗГОТОВЛЕНИЯ ВНУТРИКОСТНОГО СТОМАТОЛОГИЧЕСКОГО ИМПЛАНТАТА С УГЛЕРОДНЫМ НАНОПОКРЫТИЕМ | 2012 |
|
RU2490032C1 |
| СПОСОБ ЭЛЕКТРОПЛАЗМЕННОГО НАПЫЛЕНИЯ БИОСОВМЕСТИМЫХ ПОКРЫТИЙ НА ОСНОВЕ МАГНИЙСОДЕРЖАЩЕГО ТРИКАЛЬЦИЙФОСФАТА | 2016 |
|
RU2641597C1 |
| Способ нанесения гидроксиапатитового покрытия на имплантаты из титанового сплава | 2022 |
|
RU2782100C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВНУТРИКОСТНЫХ ИМПЛАНТАТОВ С БИОАКТИВНЫМ ПОКРЫТИЕМ | 2013 |
|
RU2530573C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВНУТРИКОСТНЫХ ИМПЛАНТАТОВ | 2010 |
|
RU2443434C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОСОВМЕСТИМОГО ПОКРЫТИЯ НА ОСНОВЕ МАГНИЙ-ЗАМЕЩЕННОГО ГИДРОКСИАПАТИТА | 2015 |
|
RU2604134C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВНУТРИКОСТНОГО СТОМАТОЛОГИЧЕСКОГО ИМПЛАНТАТА С ИОННО-ЛУЧЕВОЙ МОДИФИКАЦИЕЙ ПЛАЗМОНАПЫЛЕННОГО МНОГОСЛОЙНОГО БИОАКТИВНОГО ПОКРЫТИЯ | 2011 |
|
RU2458707C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВНУТРИКОСТНОГО СТОМАТОЛОГИЧЕСКОГО ИМПЛАНТАТА | 2013 |
|
RU2525737C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ БИОАКТИВНОГО ПОРИСТОГО ПОКРЫТИЯ ДЛЯ ВНУТРИКОСТНЫХ ИМПЛАНТАТОВ, ВЫПОЛНЕННЫХ ИЗ СПЛАВОВ ТИТАНА | 2019 |
|
RU2734415C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛАНТАНСОДЕРЖАЩЕГО ПОКРЫТИЯ | 2012 |
|
RU2494764C1 |
Изобретение относится к медицине. Описан способ получения детонационного биосовместимого покрытия на медицинский имплантат, включающий механическую и химическую подготовку поверхности титанового имплантата, и затем осуществляют формирование покрытия путем напыления порошка гидроксиапатита на титановый имплантат. Используют детонационно-газовое напыление с соотношением в рабочей смеси кислорода и пропанобутановой смеси, составляющим 70:65, регулируя подачу пропанобутановой смеси при постоянном расходе кислорода по режимам 90 л/час, 150 л/час и 200 л/час, частотой циклов 4 Гц, порошка гидроксиапатита дисперсностью 150-300 мкм на дистанции от титанового имплантата, составляющей 70 мм. Значительно повышается адгезионная прочность сцепления покрытия с титановым имплантатом как основой, обеспечиваются заданная шероховатость и исходный фазовый состав покрытия, снижается энергоемкость процесса. 3 ил.
Способ получения детонационного биосовместимого покрытия на медицинский имплантат, включающий подготовку поверхности титанового имплантата и последующее формирование покрытия путем напыления порошка гидроксиапатита на титановый имплантат, отличающийся тем, что используют детонационно-газовое напыление с соотношением в рабочей смеси кислорода и пропанобутановой смеси, составляющим 70:65, регулируя подачу пропанобутановой смеси при постоянном расходе кислорода по режимам 90 л/час, 150 л/час и 200 л/час, частотой циклов 4 Гц, порошка гидроксиапатита дисперсностью 150-300 мкм на дистанции от титанового имплантата, составляющей 70 мм.
| БИОАКТИВНОЕ ПОКРЫТИЕ НА ИМПЛАНТАТ ИЗ ТИТАНА | 1990 |
|
SU1743024A1 |
| RU 2157245 С1, 10.10.2000 | |||
| РОТАЦИОННЫЙ ЭКСЦЕНТРИКОВЫЙ МАСЛОБОЙНЫЙ ПРЕСС | 1928 |
|
SU18049A1 |
Авторы
Даты
2015-07-27—Публикация
2014-04-09—Подача