Способ прогнозирования риска развития сочетанных пролиферативных заболеваний репродуктивной системы у женщин
Изобретение относится к области медицинской диагностики, может быть использовано в гинекологии для прогнозирования риска развития сочетанных пролиферативных заболеваний репродуктивной системы, включающих сочетания миомы матки с эндометриозом и гиперпластическими процессами эндометрия.
Несмотря на многолетнюю историю изучения проблемы пролиферативных заболеваний и доброкачественных опухолей матки в последние десятилетия во всем мире отмечается рост частоты встречаемости миомы матки, эндометриоза и гиперпластических процессов эндометрия, причем многие авторы отмечают высокую частоту (до 85%) сочетания этих болезней. Об этом свидетельствуют схожий преморбидный фон, идентичные клинические проявления, а также некоторые клинико-патогенетические особенности миомы, эндометриоза и гиперпластических процессов эндометрия. При сочетании пролиферативных заболеваний нарушаются многие функции репродуктивной системы, являясь частой причиной как первичного, так и вторичного бесплодия, выраженного болевого синдрома, нарушения функции соседних органов, анемии как следствие кровотечения, осложнения беременности, родов и послеродового периода, что в совокупности приводит к временной, а нередко и длительной потери трудоспособности. Несмотря на значительное количество работ, посвященных изучению преморбидного фона, патогенеза, диагностике и лечению изолированных форм пролиферативных заболеваний матки, актуальным является изучение сочетания миомы матки с эндометриозом и гиперпластическими процессами эндометрия, так как многие вопросы остаются неуточненными, трактовка полученных результатов неоднозначной и тактика ведения больных противоречивой. До настоящего времени нет четких критериев, позволяющих прогнозировать повышенный риск развития сочетанных пролиферативных заболеваний репродуктивной системы [Адамян Л.В. Эндометриозы. /Л.В Адамян., В.И. Кулаков., E.H. Андреева /Руководство для врачей. М.: Медицина. - 2006. - 416 с.].
Пролиферативные заболевания матки относятся к мультифакториальным заболеваниям, которые развиваются в результате комплексного действия генов, гормонов, факторов роста, цитокинов при воздействии неблагоприятных факторов окружающей среды [Аксенович, Т. И. Картирование генов, детерминирующих распространенные болезни человека /Т. И. Аксенович //Медицинская генетика. - 2006. - Т. 5, №2. - С. 11-15.]. В настоящее время во всем мире идет активное молекулярно-генетическое исследование пролиферативных заболеваний матки с использованием различных методов.
Цитокины являются посредниками межклеточных взаимодействий, регулируют кроветворение, иммунный ответ, клеточный цикл, участвуют во многих физиологических и патологических процессах. Цитокины редко, если вообще действуют в одиночку. Как правило, наблюдаемый конечный эффект является результатом комплексного действия цитокинов, иногда обладающих антагонистическими свойствами. В последние годы большое внимание уделяется роли цитокинов в патогенезе пролиферативных процессов матки. К цитокинам относят хемокины, интерлейкины, факторы некроза опухоли.
Нарушение продукции цитокинов, как их гипо- и гиперпродукция, а также нарушение процесса их рецепции способны приводить к различным заболеваниям. Развивающийся при заболеваниях цитокиновый дисбаланс, в свою очередь, способен выступать фактором, отягощающим их течение [Uterine cavity matrix metalloproteinases and cytokines in patients with leiomyoma, adenomyosis or endometrial polyp /Inagaki N., Ung L., Otani T., Ikeo T. //Eur. J. Obstet. Gynecol. Reprod. Biol. 2003. Vol.111, №2. P. 197-203.].
Известен метод для диагностики и прогнозирования онкологических заболеваний, основанный на изучении соматических мутаций в гене многофункционального опухолевого супрессора (MTS) в случае неоплазий человека. Патент США №2164419, 27.03.2001. «Ген MTS, Мутации данного гена и способы диагностики злокачественных опухолей с использованием последовательности гена MTS» (Мириад Дженетикс, инк. (US) и др). Изобретение относится к мутациям гена MTS в зародышевой линии и использованию данных мутаций для диагностики предрасположенности к таким формам рака, как меланома, окулярная меланома, лейкоз, астроцитома, глиобластома, лимфома, глиома, лимфома Ходжкина, множественная миелома, саркома, миосаркома, хлоангиосаркома, чешуеклеточная карцинома, хронический лимфоидный лимфолейкоз, а также опухоли поджелудочной железы, яичников, матки, семенников, почек, желудка, ободочной и прямой кишки. Изобретение также имеет отношение к терапии тех неоплазий человека, при которых произошла мутация в гене MTS, включая генотерапию, заменяющую белковую терапию и использование миметиков. Техническим результатом изобретения является расширение арсенала средств диагностики и терапии опухолей.
Недостаток метода заключается в сложности анализа, его длительности и дороговизне.
За прототип выбран патент РФ №2466390 по заявке №2011105301/15, 20.08.2012, «Способ прогнозирования развития рака тела матки при патологических процессах эндометрия у женщин репродуктивного возраста» (Сидорова И.С. Унанян А.Л. (RU), Власов Р.С. (RU) и др.), где предложен способ прогнозирования развития рака тела матки, включающий определение клинических признаков и проведения метил-чувствительной полимеразной цепной реакции (МЧ-ПЦР) генов MLH1, RASSF1, GSTP1, р16, RAR-b, CDX1, и расчет коэффициента вероятности развития рака тела матки. При величине р больше 0,6 прогнозируют высокую вероятность развития рака тела матки, при р, равном 0,3-0,59, - умеренную вероятность развития рака, при р ниже 0,29 - низкую вероятность развития рака.
Недостаток прототипа заключается в том, что он повышает точность прогнозирования развития рака тела матки при уже имеющихся патологических процессах эндометрия у женщин репродуктивного возраста и не дает возможность спрогнозировать склонность пациенток к сочетанию пролиферативных заболеваний репродуктивной системы.
Задачей настоящего исследования является расширение арсенала способов диагностики, а именно создание способа прогнозирования пролиферативных заболеваний репродуктивной системы по сочетаниям генетических полиморфизмов: -403 А RANTES, G MCP-1,+1931 A MIP 1β, -590 C IL-4 и -403 А RANTES,+1931 A MIP 1β, -801 G SDF1, -511 C IL-1B.
Технический результат использования изобретения - получение критериев оценки риска развития сочетания пролиферативных заболеваний репродуктивной системы у женщин русской национальности, являющиеся уроженцами Центрального Черноземья России.
В соответствии с поставленной задачей был разработан способ прогнозирования сочетания пролиферативных заболеваний репродуктивной системы, включающий:
- выделение ДНК из периферической венозной крови;
- типирование генетических полиморфизмов гена регулятора активности нормальной экспрессии и секреции Т-клеток (-403 G/А RANTES), макрофагального воспалительного протеина -1β (+1931 A/T MIP 1β), фактора стромальных клеток (-801 G/A SDF1), интерлейкин-1 (-511 C/T IL-1B), моноцитарного хемоаттарактанта протеина -1 (C/G MCP-1), интерлейкина-4 (-590 С/T IL-4);
- анализ сочетаний полиморфизмов гена регулятора активности нормальной экспрессии и секреции Т-клеток (-403 А RANTES), макрофагального воспалительного протеина -1β (+1931 A MIP 1β), фактора стромальных клеток (-801 G SDF1), интерлейкин-1 (-511 C IL-1B), моноцитарного хемоаттарактанта протеина -1 (G MCP-1), интерлейкина-4 (-590 С IL-4);
- прогнозирование повышенного риска развития сочетания пролиферативных заболеваний репродуктивной системы таких как миома матки с эндометриозом и гиперпластическими процессами эндометрия в случае выявления сочетаний -403 А RANTES, G MCP-1,+1931 A MIP 1β, -590 C IL-4 или сочетаний -403 А RANTES,+1931 A MIP 1β, -801 G SDF1, -511 C IL-1B.
Новизна и изобретательский уровень заключается в том, что из уровня техники не известна возможность прогноза развития пролиферативных заболеваний по наличию сочетаний аллеля -403 А гена регулятора активности нормальной экспрессии и секреции Т-клеток (полиморфизм -403 А RANTES), аллеля+1931 A гена макрофагального воспалительного протеина -1β (полиморфизм+1931 A MIP 1β), аллеля -801 G гена фактора стромальных клеток (полиморфизм -801 G SDF1), аллеля -511 C гена интерлейкин-1 (полиморфизм -511 C IL-1B), аллеля G гена моноцитарного хемоаттарактанта протеина -1 (полиморфизм G MCP-1), аллеля 590 C гена интерлейкина-4 (полиморфизм С IL-4).
Изобретение характеризуется следующими графическими материалами:
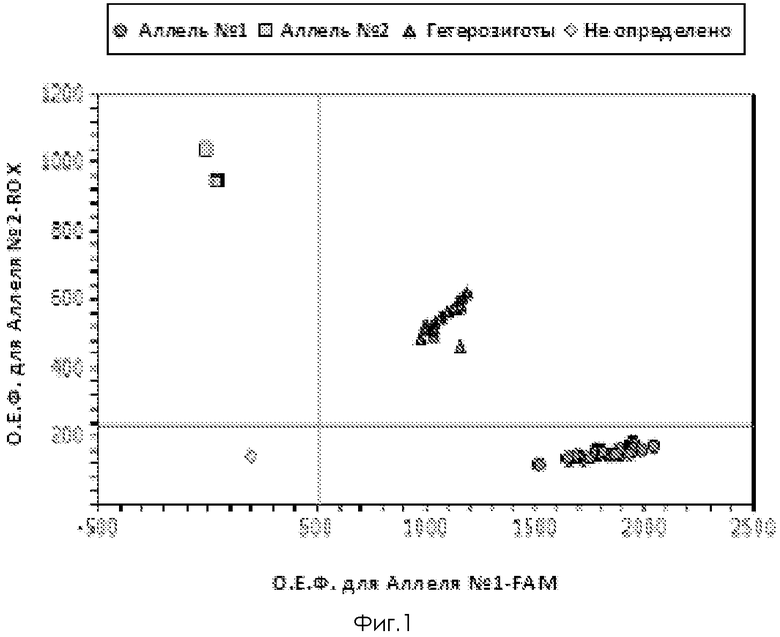
Фиг. 1. Дискриминация аллелей по локусу -590 C/T IL-4, где  - гомозиготы по аллелю -590С,
- гомозиготы по аллелю -590С,  - гомозиготы по аллелю -590 Т,
- гомозиготы по аллелю -590 Т,  - гетерозиготы -590 СТ,
- гетерозиготы -590 СТ,  - отрицательный контроль.
- отрицательный контроль.
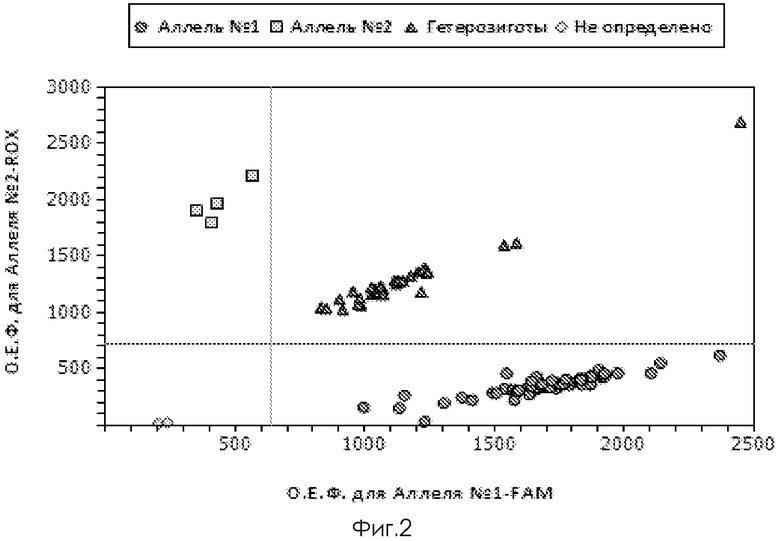
Фиг.2. Дискриминация аллелей по локусу -801G/A SDF-1, где  - гомозиготы по аллелю -801 A,
- гомозиготы по аллелю -801 A,  - гомозиготы по аллелю -801 AG,
- гомозиготы по аллелю -801 AG,  - гетерозиготы -801 G,
- гетерозиготы -801 G,  - отрицательный контроль.
- отрицательный контроль.
Фиг. 3. Электрофоретическое разделение продуктов рестрикции гена IL-1 В -511, где 1, 9 - гомозиготы -511ТТ; 2, 3, 5, 7, 8- гетерозиготы -511СТ, 4, 6,- гомозиготы -511СС.
Способ осуществляют следующим образом
ДНК выделяют из образцов периферической венозной крови пациентки методом фенольно-хлороформной экстракции в 2 этапа. На первом этапе к 4 мл крови добавляют 25 мл лизирующего буфера, содержащего 320 мМ сахарозы, 1% тритон Х-100, 5 мМ MgCl2, 10 мМ трис-HCl (pH=7,6). Полученную смесь перемешивают и центрифугируют при 4ºС, 4000 об/мин в течение 20 минут. После центрифугирования надосадочную жидкость сливают, к осадку добавляют 4 мл раствора, содержащего 25 мМ ЭДТА (рН=8,0) и 75 мМ NaCl, ресуспензируют. Затем прибавляют 0,4 мл 10% SDS, 35 мкл протеиназы К (10 мг/мл) и инкубируют образец при 37ºС в течение 16 часов.
На втором этапе из полученного лизата последовательно проводят экстракцию ДНК равными объемами фенола, фенол-хлороформа (1:1) и хлороформа с центрифугированием при 4000 об/мин в течение 10 минут. После каждого центрифугирования производят отбор водной фазы. ДНК осаждают из раствора двумя объемами охлажденного 96% этанола. Сформированную ДНК растворяют в бидистиллированной, деионизованной воде и хранят при -200С.
Выделенную ДНК затем подвергают полимеразной цепной реакции с использованием стандартных олигонуклеотидных праймеров.
Молекулярно-генетический анализ проводят методом полимеразной цепной реакции синтеза ДНК на амплификаторах IQ5 (BioRad) и ТП4-ПЦР-01-«ТЕРЦИК».
На амплификаторе IQ5 (Bio-Rad) проводят анализ полиморфизмов генов +1931 А/Т MIP-1, C/G МСP-1, -801 G/A SDF-1, -403 G/A RANTES, -590 C/T IL-4 методом полимеразной цепной реакции синтеза ДНК с использованием стандартных олигонуклеотидных праймеров и специфических зондов с последующим анализом полиморфизма методом дискриминации аллелей. Реакционная смесь объемом 25 мкл включает: 6,7 мМ трис-НСl (рН=8,8), 2,5 мМ MgCl2, 0,1 мкг геномной ДНК, по 10 пМ каждого праймера, по 5 пкмоль каждого зонда, по 200 мкМ dATP, dGTP, dCTP, dTTP и 1 единицу активной Taq-полимеразы. После денатурации выполняют 40 циклов амплификации по схеме: отжиг праймеров и денатурация.
На амплификаторе ТП4-ПЦР-01-«ТЕРЦИК» проводят анализ полиморфизма гена -511 С/Т IL-1B методом полимеразной цепной реакции синтеза ДНК с использованием стандартных олигонуклеотидных праймеров. Реакцию проводят в 12,5 мкл общего объема смеси, содержащей 33,5 мМ трис-НСl (рН=8,8), 1,25 мМ MgCl2, 0,5 мкг геномной ДНК, по 5 пМ каждого праймера, по 100 мкМ dATP, dGTP, dCTP, dTTP и 1 единицу активной Taq-полимеразы. После денатурации выполняют 32 цикла амплификации по схеме: денатурация, отжиг праймеров и элонгация. Затем пробы выдерживают 5 мин при 72°С и охлаждают. Продукты амплификации анализируют в 2%-ном агарозном геле, окрашенным бромистым этидием, в течение 30 минут при 160V. В качестве электрофорезного буфера используют 1×TAE (трис-ацетатный буфер). Затем пробы идентифицируют в проходящем УФ-свете.
Генотипирование осуществляют методом дискриминации аллелей с использованием Tag Man зондов. При проведении ПЦР в амплификаторе с флюоресцентной детекцией (амплификатор IQ5) генотипирование осуществляют методом Tag Man зондов по данным величин ОЕФ (относительная единица флуоресценции) каждого зонда.
Две полосы, вертикальная и горизонтальная, делят график на четыре секции: одна для каждого гомозиготного состояния, одна для гетерозиготного состояния и секция без реакции. Присвоение генотипов неизвестным образцам определяется вычерчиванием ОЕФ для одного флуорофора на оси x относительно ОЕФ для другого флуорофора на оси y на диаграмме дискриминации аллелей.
• Если значения ОЕФ неизвестного образца находятся выше горизонтальной полосы и правее вертикальной полосы, генотип гетерозиготен (GA).
• Если значения ОЕФ неизвестного образца находятся выше горизонтальной полосы и левее вертикальной полосы, генотип гомозиготен по аллелю 2 (RFU аллелю 2 отложены по оси y).
• Если значения ОЕФ неизвестного образца находятся ниже горизонтальной полосы и правее вертикальной, генотип гомозиготен по аллелю 1 (RFU аллеля 1 отложены по оси x).
• Если значения ОЕФ неизвестного образца находятся ниже горизонтальной полосы и левее вертикальной, определение генотипа невозможно (в данном случае неопределенный образец - отрицательный контроль)
Генотипирование ДНК-маркеров по локусу -511 С/T IL-1В производят методом анализа полиморфизма длин рестрикционных фрагментов (ПДРФ) продуктов ПЦР-амплификации специфических участков генома (фиг.3) с использованием соответствующих ферментов рестрикции производства фирмы «Сибэнзим» (Новосибирск).
После инкубации рестрикционной смеси в течение 16 часов при температуре 37°С проводят разделение фрагментов ДНК с помощью горизонтального электрофореза на электрофоретических ячейках производства фирмы «Хеликон» (Россия). В зависимости от размера разделяемых фрагментов ДНК используют агарозный гель 2-3% концентрации, приготовленный на основе ТВЕ-буфера, окрашенный раствором бромистого этидия (0,01%). Визуализацию фореграмм осуществляют в темном боксе с трансиллюминатором фирмы UVP (Швеция).
Проводят контроль качества генотипирования с использованием положительных контрольных образцов ДНК с разными генотипами и отрицательного контрольного образца, в котором вместо ДНК к реакционной смеси добавляют воду.
Формирование базы данных и статистические расчеты осуществляют с использованием программы «STATISTICA 6.0» [Endometrial hyperplasia: a review /Brun J.L., Descat E., Boubli В., Dallay D. //J. Gynecol. Obstet. Biol. Reprod. (Paris). Пер. с франц., 2006. Vol.35, №6. P. 542-550].
Изучение роли комбинаций генетических вариантов полиморфных маркеров генов цитокинов в формирование пролиферативных процессов матки проводят с помощью программного обеспечения APSampler [http:sources.redhat.com/cygwin/], использующего метод Монте-Карло марковских цепей и байесовсовскую непараметрическую статистику [Favorov A. V. A Gibbs sampler for identification of symmetrically structured, spaced DNA motifs with improved estimation of the signal length /A. V. Favorov, M. S. Gelfand, A. V. Gerasimova [et al.] //Вioinformatics. - 2005. - Vol.21, №10. - Р. 2240-2245].
Оценку уровня статистической значимости полученных результатов проводят с использованием поправки Бонферрони (рcor), т.е. поправки, минимизирующей вероятность получения ложноположительных результатов [Реброва О.Ю. Статистический анализ медицинских данных. https://sites.google.com/site/oyurebrova/book" \t "_blank /О.Ю. Реброва//М.: МедиаСфера. - 2006 г. - 312 с.].
Возможность использования предложенного способа для оценки риска развития пролиферативных заболеваний матки подтверждает анализ результатов наблюдений 713 больных с различными пролиферативными процессами репродуктивной системы, такими как миома матки, эндометриоз, гиперпластические процессы эндометрия. Среди 713 обследуемых у 78 женщин наблюдается сочетание миомы матки, эндометриоза, гиперпластических процессов эндометрия. Группа популяционного контроля составила 500 человек. Пациенты включались в соответствующую группу больных только после установления диагноза заболевания, подтвержденного с помощью клинических, лабораторно-инструментальных методов обследования и подтвержденного результата гистологического исследования.
В исследуемую группу включались индивидуумы русской национальности, являющиеся уроженцами Центрального Черноземья России и не имеющие родства между собой.
Установлено, что сочетание молекулярно-генетических маркеров -403 А RANTES, G MCP-1,+1931 A MIP 1β, -590 C IL-4 встречается у 28,07% пациенток, что в 3,5 раза чаще, чем в контрольной группе (8,08%, р=0,000007, pcor=0,05, OR=4,43 95%CI 2,21 - 8,92). Также у больных с сочетанными пролиферативными заболеваниями репродуктивной системы (миома матки, эндометриоз, гиперпластические процессы эндометрия) встречается комбинация генетических вариантов -403 А RANTES,+1931 A MIP 1β, -801 G SDF1, -511 C IL-1B (50,72%) в 2,1 раза чаще по сравнению с контролем (24,45%, р=0,000007, pcor=0,05, OR=3,18, 95%CI 1,78 - 5,67).
Конкретные примеры.
Пример 1.
Пациентке М. русской национальности, уроженке Центрального Черноземья России, был проведен забор периферической венозной крови, выделение ДНК из периферической венозной крови; типирование генов+1931 А/Т MIP-1, C/G MCP-1, -801 G/A SDF-1, -403 G/A RANTES, -590 C/T IL-4 методом полимеразной цепной реакции.
Выявлено, что в связи с наличием сочетания аллелей-403 А RANTES, G MCP-1,+1931 A MIP 1β, -590 C IL-4, пациентку можно отнести в группу риска (OR=4,43).
Пример 2.
Пациентке К. русской национальности, уроженке Центрального Черноземья России, был проведен забор периферической венозной крови, выделение ДНК из периферической венозной крови; типирование генов -403 G/А RANTES,+1931 A/T MIP 1β, -801 G/A SDF1, -511 C/T IL-1B. Выявлено, что в связи с наличием сочетания аллелей-403 А RANTES,+1931 A MIP 1β, -801 G SDF1, -511 C IL-1B, пациентку можно отнести в группу риска (OR=3,18).
Контроль качества генотипирования с использованием положительных контрольных образцов ДНК с разными генотипами и отрицательного контрольного образца, в котором вместо ДНК к реакционной смеси добавляют воду, показал практически полное совпадение результатов исследования (98,5%) и отсутствие контаминации отрицательного контрольного образца.
Таким образом, полученные данные подтверждают, что сочетания аллелей -403 А RANTES, G MCP-1,+1931 A MIP 1β, -590 C IL-4 или сочетания аллелей -403 А RANTES,+1931 A MIP 1β, -801 G SDF1, -511 C IL-1B являются факторами риска развития миомы матки в сочетании с эндометриозом и гиперпластическими процессами эндометрия (OR=4,43 и OR=3,18, соответственно).
Применение данного способа позволит сформировать группу больных с повышенным риском развития сочетанных пролиферативных заболеваний репродуктивной системы, эти знания помогут разобраться врачу в конкретной клинической ситуации, вовремя назначить адекватную терапию, что послужит профилактикой дальнейшего прогрессирования/рецидивирования заболевания и улучшит качество жизни пациента в целом.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования риска развития сочетания миомы матки и аденомиоза с использованием генетических данных | 2018 |
|
RU2677866C1 |
| Способ прогнозирования риска развития сочетания миомы матки и гиперпластических процессов эндометрия | 2018 |
|
RU2678970C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ЭНДОМЕТРИОЗА | 2014 |
|
RU2558854C1 |
| Способ прогнозирования риска развития гиперплазии эндометрия у женщин с нормальной массой тела | 2024 |
|
RU2834521C1 |
| Способ прогнозирования риска развития гиперплазии эндометрия с использованием молекулярно-генетических данных | 2024 |
|
RU2834523C1 |
| Способ прогнозирования риска развития гиперплазии эндометрия у женщин с избыточной массой тела или ожирением | 2024 |
|
RU2834146C1 |
| Способ прогнозирования риска развития генитального эндометриоза | 2017 |
|
RU2650994C1 |
| Способ прогнозирования риска развития миоматозных узлов больших размеров у пациенток с миомой матки | 2016 |
|
RU2616246C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ПРЕЭКЛАМПСИИ У ЖЕНЩИН С НЕОТЯГОЩЕННОЙ НАСЛЕДСТВЕННОСТЬЮ | 2014 |
|
RU2568893C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА ФОРМИРОВАНИЯ ГИПЕРПЛАСТИЧЕСКИХ ПРОЦЕССОВ ЭНДОМЕТРИЯ | 2014 |
|
RU2557977C1 |

Изобретение относится к медицине, а именно к гинекологии, и может быть использовано для прогнозирования риска развития сочетания пролиферативных заболеваний репродуктивной системы у женщин русской национальности, являющихся уроженками Центрального Черноземья России. Для этого выделяют ДНК из периферической венозной крови. Проводят анализ комбинаций генетических вариантов полиморфных маркеров генов цитокинов гена регулятора активности нормальной экспрессии и секреции Т-клеток (-403 G/А RANTES), макрофагального воспалительного протеина -1β (+1931 A/T MIP 1β), фактора стромальных клеток (-801 G/A SDF1), интерлейкин-1 (-511 C/T IL-1B), моноцитарного хемоаттарактанта протеина -1 (C/G MCP-1), интерлейкина-4 (-590 С/T IL-4). Прогнозируют повышенный риск развития сочетания миомы матки с эндометриозом и гиперпластическими процессами эндометрия при выявлении сочетания аллелей -403 А RANTES, G MCP-1,+1931 A MIP 1β, -590 C IL-4 или сочетания аллелей -403 А RANTES,+1931 A MIP 1β, -801 G SDF1, -511 C IL-1B. Использование данного способа позволяет выявить группу больных с риском развития сочетанных пролиферативных заболеваний репродуктивной системы, что позволяет назначить адекватную терапию для профилактики дальнейшего прогрессирования заболевания. 3 ил., 2 пр.
Способ прогнозирования риска развития сочетанных пролиферативных заболеваний репродуктивной системы у женщин русской национальности, являющихся уроженками Центрального Черноземья России, включающий выделение ДНК из периферической венозной крови, отличающийся тем, что проводят анализ комбинаций генетических вариантов полиморфных маркеров генов цитокинов гена регулятора активности нормальной экспрессии и секреции Т-клеток (-403 G/А RANTES), макрофагального воспалительного протеина -1β (+1931 A/T MIP 1β), фактора стромальных клеток (-801 G/A SDF1), интерлейкин-1 (-511 C/T IL-1B), моноцитарного хемоаттарактанта протеина -1 (C/G MCP-1), интерлейкина-4 (-590 С/T IL-4) и прогнозируют повышенный риск развития сочетания миомы матки с эндометриозом и гиперпластическими процессами эндометрия при выявлении сочетания аллелей -403 А RANTES, G MCP-1,+1931 A MIP 1β, -590 C IL-4 или сочетания аллелей -403 А RANTES,+1931 A MIP 1β, -801 G SDF1, -511 C IL-1B.
| АЛТУХОВА О.Б | |||
| Изучение молекулярно-генетических маркеров, ассоциированных с миомой матки // Автореферат кмн, Белгород, 2010, [он-лайн], [найдено 10.02 | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Найдено из Интернет: | |||
Авторы
Даты
2015-07-27—Публикация
2014-05-16—Подача