Предлагаемое изобретение относится к области органического синтеза, в частности, к способу получения 3-ацетилбензо[f]хинолина (1).
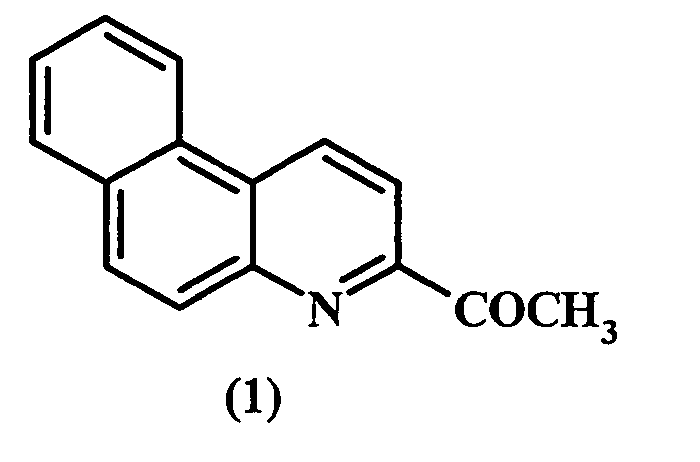
Кислородсодержащие производные бензо[f]хинолинов обладают физиологической активностью, являются аналогами антималярийных препаратов [[1]. Козлов Н.С. 5,6-Бензохинолины. Мн., «Наука и техника», 1970, 136 с.], используются в синтезе фотокатализаторов [[2]. Weissenfels М., Punkt J. Light Absorption und Konstitution Heterocyclischer 1,2-Endiole // Tetrahedron. - 1978. - V.34. - №3. p.311-316; [3]. Пилюгин Г.Т., Чернюк И.Н., Рудько А.П. Исследование в области синтетических красителей. II. Стирилы из производных N-арилхинальдиниевых солей // Журн. орг. химии. - 1965. - Т.I. - Вып.9. - С.1685-1687; [4]. Кобаса И.М., Кондратьева И.В., Гнатюк Ю.И. Фотокаталитическое восстановление метиленового голубого формальдегидом в присутствии диоксида титана и сульфида кадмия, сенсибилизированных (1-фенил-5,6-бензохинолин-2)-2,4-дигидроксистирилиодидом // Теоретическая и экспериментальная химия. - 2008. - Т.44. - №1. - C.40-45] и азагелиценов - соединений, обладающих уникальными оптическим, спектральными и структурными свойствами [[5]. Shen W., Graule S., Crassous J., Lescop C, Gornitzka H., Rerau R. Stereoselective coordination of ditopic phospholyl-azahelicenes: a novel approach towards structural diversity in chiral π-conjugated assemblies // Chem. Commun. - 2008. - №7. - P.850-852.1.
В литературе методы синтеза 3-ацетилбензо[f]хинолина (1) нам найти не удалось. В работе [[6]. Klemm L.H., Klopfenstein С.Е., Zell R. 2-Acetylbenzo[f]quinoline by Direct Synthesis of a β-Acylpyridine Structure // J. Heterocycl. Chem. - 1970. - V.7. - №4. - P.951-953] приведен метод получения изомера 3-ацетилбензо[f]хинолина (1), а именно 2-ацетилбензо[f]хинолина (2), синтез которого основан на циклизации 2-нафтиламина (3) с диметилацеталем ацетоацетальдегида. Выход соединения (2) составляет 86%.
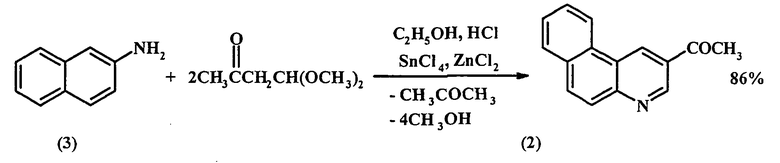
Недостатки метода:
1) труднодоступность и высокая стоимость исходных реагентов;
2) 2-нафтиламин (3) является канцерогеном;
3) большой расход катализатора (на 71 г 2-нафтиламина (1) берется 87 г SnCl4 и 20 г ZnCl2).
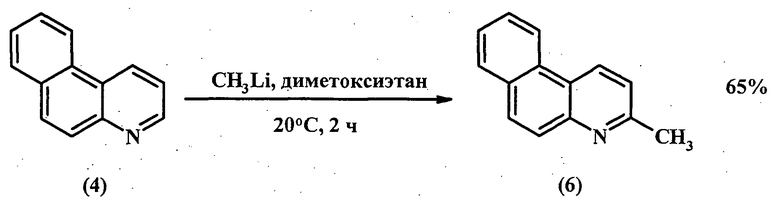
Близким аналогом предлагаемого способа является метод прямой функционализации молекулы бензо[f]хинолина (4) с образованием метилового эфира бензо[f]хинолина-3-карбоновой кислоты (5) [[7]. Mamane V., Louërat F., Fort Y. Direct Functionalization of Benzoquinolines // Lett. Org. Chem. - 2010. - V.7. - №1. - P.90-93.]. Сначала реакцией CH3Li. и бензо[f]хинолина (4) получают 3-метилбензо[f]хинолин (6):
Затем соединение (6) обрабатывают избытком диизопропиламида калия и диметилдисульфида и получают ортотиоэфир (7) с 83%-ным выходом:

На завершающей стадии под действием солей ртути проходит десульфуризация тиоэфира (7) и образуется целевой продукт (5):
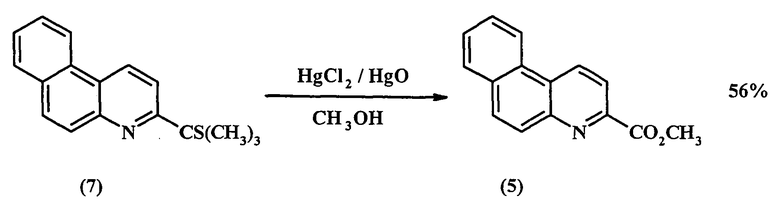
Недостатки метода:
1) многостадийность, длительность и трудоемкость процесса;
2) используется пожароопасный CH3Li;
3) необходимо поддерживать низкие температуры;
4) применяются труднодоступные и дорогостоящие реагенты.
Авторами предлагается способ получения 3-ацетилбензо[f]хинолина (1), не имеющий вышеперечисленных недостатков.
Задачей предлагаемого изобретения является разработка нового простого и удобного метода синтеза 3-ацетилбензо[f]хинолина (1) с использованием доступных исходных реагентов.
Сущность предлагаемого способа заключается во взаимодействии бензо[f]хинолина (4) с этиловым спиртом в присутствии четыреххлористого углерода под действием медьсодержащего катализатора, выбранного из ряда CuI, CuBr2, Cu(acac)2, Cu(OAc)2, Cu(C6H5CO2)2·2H2O, Cu(C6H4(OH)CO2)2, CuCl2·2H2O, при температуре 150-160°C в течение 3-9 ч при мольном соотношении: [Cu]:[бензо[f]хинолин(4)]:[этанол]:[CCl4]=[1]:[100]:[1500-10000]:[400-1500]. Реакцию проводили в автоклаве под аргоном.
При проведении реакции при температуре 150°C в течение 6 ч и использовании следующих мольных соотношений катализатора и реагентов: [Cu(OAc)2]:[бензо[f]хинолин(4)]:[этанол]:[CCl4]=[1]:[100]:[3000]:[750] общий выход 3-ацетилбензо[f]хинолина (1) составляет 60%. При использовании других медьсодержащих катализаторов CuI, CuBr2, Cu(acac)2, Cu(C6H5CO2)2·2H2O, Cu(C6H4(OH)CO2)2, CuCl2·2H2О выход 3-ацетилбензо[f]хинолина (1) был меньше и составил 20-50%.
Преимущества предлагаемого метода:
1) одностадийность процесса;
2) доступность и низкая стоимость исходных реагентов - 5,6-бензохинолина, этанола, CCl4 и Cu-содержащих катализаторов;
3) селективность процесса;
4) отсутствие агрессивных реагентов.
Предлагаемый способ поясняется примерами:
ПРИМЕР 1. Реакции проводили в стеклянной ампуле объемом 10 мл, помещенной в микроавтоклав из нержавеющей стали объемом 17 мл, при постоянном перемешивании и регулируемом нагреве.
В ампулу в токе аргона загружали 0.5 мг (0.0027 ммоль) Cu(OAc)2, 50 мг (0.27 ммоль) бензо[f]хинолина (4), 0.19 мл (1.96 ммоль) CCl4 и 0.49 мл (8.29 ммоль C2H5OH). Запаянную ампулу помещали в автоклав, автоклав герметично закрывали и нагревали при 150°C в течение 6 часов с постоянным перемешиванием. После окончания реакции автоклав охлаждали до комнатной температуры, ампулу вскрывали. Реакционную массу пропускали через слой Al2O3, нейтрализовали водным раствором Na2CO3 и экстрагировали хлороформом. Растворитель отгоняли. Полученный 3-ацетилбензо[f]хинолин (1) очищали на колонке, заполненной силикагелем (элюент-хлороформ). Образец 3-ацетилбензо[f]хинолина (1) 98%-ной чистоты получили перекристаллизацией из смеси этилацетат:гексан = 1:1.
Общий выход 3-ацетилбензо[f]хинолина (1) составляет 60%.
Выделенный (1) имел Тпл 146.5°C.
Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.91 с (3Н, COCH3), 7.71-8.61 м (4Н), 8.01 с (2Н), 8.25 д (1Н, J=8.6 Гц), 8.98 д (1Н, J=8.6 Гц).
Спектр ЯМР 13С (CDCl3, δ, м.д.): 25.66 (С12), 118.49 (С2), 123.24 (С10), 127.39 (С9), 127.43 (С10''), 128.24 (С8), 128.48 (С6), 128.78 (С7), 129.17 (С10'), 131.36 (С1), 131.44 (С5), 132.47 (С6'), 147.22 (С4'), 152.63 (С3), 200.49 (С11).
Масс-спектр, m/z (Iотн (%)): 221.05 [М]+ (97.33), 194.05 (12.92), 193.05 (81.33), 180.05 (13.11), 179.05 (100.00), 178.05 (83.16), 177.05 (27.48), 176.05 (5,51), 152.10 (19.21), 151.10 (49.87), 150.10 (22.01), 126.05 (4.48), 89.00 (4.65), 76.05 (4.60), 75.05 (10.89), 63.00 (4.07), 51.00 (3.52).
Другие примеры, подтверждающие способ, приведены в таблице 1.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2-АЦЕТИЛБЕНЗО[h]ХИНОЛИНА | 2012 |
|
RU2515990C2 |
| СПОСОБ ПРИГОТОВЛЕНИЯ 1-(4-МЕТАНСУЛЬФОНИЛ-2-ТРИФТОРМЕТИЛБЕНЗИЛ)-2-МЕТИЛ-1H-ПИРРОЛО[2,3-B]ПИРИДИН-3-ИЛ-УКСУСНОЙ КИСЛОТЫ | 2018 |
|
RU2756507C2 |
| КАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ 3-(3-ФЕНИЛПРОП-2-ИН-1-ИЛ)-1,3-ОКСАЗОЛИДИНА | 2016 |
|
RU2653989C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИКЛОГЕПТАТРИЕНА-1,3,5 | 2005 |
|
RU2285689C1 |
| ПОВЕРХНОСТНО-МОДИФИЦИРОВАННЫЙ КАРБОНАТ КАЛЬЦИЯ В КАЧЕСТВЕ НОСИТЕЛЯ ДЛЯ КАТАЛИЗАТОРОВ НА ОСНОВЕ ПЕРЕХОДНЫХ МЕТАЛЛОВ | 2017 |
|
RU2742335C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ХИНОЛИНОВ ИЗ АНИЛИНА, 1,2-ДИОЛОВ И ССl ПОД ДЕЙСТВИЕМ ЖЕЛЕЗОСОДЕРЖАЩИХ КАТАЛИЗАТОРОВ | 2015 |
|
RU2614251C2 |
| Способ получения бензимидазолов | 2022 |
|
RU2789332C1 |
| Способ получения хинолинов в присутствии иерархического цеолита H-Ymmm | 2021 |
|
RU2789408C1 |
| Способ получения хинолинов в присутствии иерархического цеолита H-ZSM-5mmm | 2021 |
|
RU2789409C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОКСИПРОИЗВОДНЫХ СТИРИЛХИНОЛИНОВ | 2010 |
|
RU2462455C2 |
Изобретение относится к области органической химии, а именно к способу получения 3-ацетилбензо[f]хинолина, заключающемуся во взаимодействии бензо[f]хинолина с CCl4 и этанолом в автоклаве под аргоном в присутствии медьсодержащего катализатора, выбранного из ряда CuI, CuBr2, Cu(acac)2, Cu(OAc)2, Cu(C6H5CO2)2·2H2O, Cu(C6H4(OH)CO2)2, CuCl2·2H2O, при температуре 150-160°C в течение 3-9 ч при мольном соотношении: [Cu]:[бензо[f]хинолин]:[этанол]:[CCl4]=[1]:[100]:[1500-10000]:[400-1500]. Технический результат: разработан способ получения 3-ацетилбензо[f]хинолина, исходного соединения для синтеза антималярийных препаратов, фотокатализаторов, азагелиценов. 1 табл., 1 пр.
Способ получения 3-ацетилбензо[f]хинолина формулы
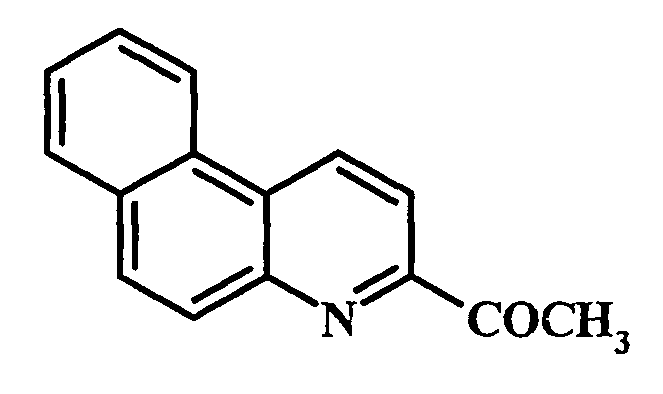
характеризующийся тем, что бензо[f]хинолин подвергают взаимодействию с CCl4 и этанолом в автоклаве под аргоном в присутствии медьсодержащего катализатора, выбранного из ряда CuI, CuBr2, Cu(acac)2, Cu(OAc)2, Cu(C6H5CO2)2·2H2O, Cu(C6H4(OH)CO2)2, CuCl2·2H2O, при температуре 150-160°C в течение 3-9 ч при мольном соотношении: [Cu]:[бензо[f]хинолин]:[этанол]:[CCl4]=[1]:[100]:[1500-10000]:[400-1500].
| Хуснутдинов Р.И | |||
| и др | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Victor Mamane at al: "Direct Functionalization of Benzoquinolines", Letters in Organic Chemistry, 2010, 7, pp.90-93 | |||
Авторы
Даты
2015-08-10—Публикация
2014-04-04—Подача