Изобретение относится к области органической химии, в частности к методу получения гидроксипроизводных стирилхинолинов общей формулы:
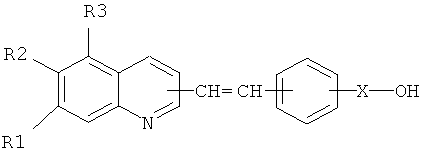
где R1=H, алкил или хлор, R2=H или арил, R3=H или арил, Х=хиллическая связь или СО.
Гидроксипроизводные стирилхинолинов используются для получения фармакологических агентов, являющихся ингибиторами липоксигеназы или фосфолипазы и/или антагонистами лейкотриена, обладающими противоаллергическими и противовоспалительными свойствами [Huang; Fu-Chi (Gwynedd, PA), Galemmo, Jr.; Robert A. (Ambler, PA), Campbell; Henry F.Quinoline derivatives and use thereof as antagonists of leukotriene d4. Патент США. 1990. N 4918081, Hayashi; Yoshio (Ushiku, JP), Oguri Tomei (Ushiku, JP), Shinoda; Masaki (Ami, JP), Takahashi; Kazuo (Komae, JP), Hashimoto; Munehiro. Carboxystyrene derivatives and drugs containing them as effective ingredients. Патент США. 1990. N 4925861]. Обычно для получения таких соединений проводят конденсацию метилхинолина с соответствующим бензальдегидом в среде уксусного ангидрида (в качестве растворителя и активирующего агента) при нагревании в течение 12 часов. В последнее время большой интерес вызывает так называемый "solvent-free" или "neat" синтез производных гетероциклов в отсутствие растворителей, позволяющий сократить время, энергозатраты, расходы на реактивы и количество отходов, а также избежать трудоемких процедур выделения продуктов [Martins M., Frizzo С., Moreira D., Buriol L, Machado P. // Chem. Rev. 2009. V.109. N.9. Р.4140-4182].
Известен способ получения 2-(4-гидроксистирил)хинолина (прототип) [патент США. 1990. N 4918081], заключающийся в том, что смесь 2-метилхинолина и 4-гидроксибензальдегида нагревают в уксусном ангидриде в течение 12 часов при 130°С, затем делят на колонке с силикагелем (элюент ацетон-гексан), полученный 2-(4-ацетоксистирил)хинолин перекристаллизовывают из смеси эфир-гексан. Затем проводят вторую стадию - гидролиз 2-(4-ацетоксистирил)хинолина; для этого к суспензии 2-(4-ацетоксистирил)хинолина в метаноле добавляют Na2CO3, смесь перемешивают 24 часа при комнатной температуре, добавляют буфер (25% NH4OH), отфильтровывают осадок, промывают его метанолом и сушат. Получают 2-(4-гидроксистирил)хинолин.
Недостатками этого способа является длительное нагревание, использование в качестве растворителя и катализатора уксусного ангидрида, который реагирует с гидроксигруппой, что приводит к образованию 2-(4-ацетоксистирил)хинолина, который необходимо гидролизовать до целевого 2-(4-гидроксистирил)хинолина. Таким образом, реакция протекает в две стадии, причем требуется очистка получающегося на первой стадии 2-(4-ацетоксистирил)хинолина на колонке с силикагелем с последующей перекристаллизацией, что приводит к затратам на силикагель, элюент для хроматографии и растворитель для перекристаллизации.
Задачей технического решения является разработка простого одностадийного способа получения гидроксипроизводных стирилхинолинов.
Поставленная задача решается предлагаемым способом гидроксизамещенных стирилхинолинов взаимодействием метилхинолинов с сответствующим бензальдегидом при повышенной температуре, в котором синтез проводят в одну стадию путем нагревания расплава исходных реагентов при температуре 130-160 С.
Сущность заявляемого изобретения заключается в следующем. Реакцию конденсации проводят путем нагревания расплава соответствующего бензальдегида и метилхинолина без добавления уксусного ангидрида, что позволяет существенно сократить время реакции конденсации (с 12 до 1-2 часов), провести реакцию в одну стадию, увеличить выход, исключить расходы на уксусный ангидрид, элюенты и силикагель для хроматографии, которые применяются в прототипе. Важным моментом является то, что в этом случае исключается необходимость стадии гидролиза, так как проведение реакции конденсации путем нагревания расплава реагентов, а не их раствора в уксусном ангидриде, позволяет получить целевые гидроксипроизводные стирилхинолинов напрямую, а не путем гидролиза образующихся на первой стадии ацетоксипроизводных стирилхинолинов. Это позволяет существенно упростить как синтез, так и очистку целевых соединений.
Осуществимость предложенного способа иллюстрируется примерами:
Пример 1 по прототипу. К 2.5 г 4-гидроксибензальдегида добавили 2.8 мл 2-метилхинолина и 10 мл уксусного ангидрида. Смесь нагревали 12 часов при 130°С (масляная баня), после охлаждения низкокипящие компоненты отогнали в вакууме, добавили гексан и пропустили через колонку с силикагелем (Silpearl), используя в качестве элюента смесь гексана с ацетоном (15%). Собрали фракцию, содержащую 2-(4-ацетоксистирил)хинолин (контроль по ТСХ), отогнали растворители на роторном испарителе, остаток перекристаллизовали из смеси серного эфира с гексаном. Получили 2-(4-ацетоксистирил)хинолин (т.пл. 127-128°С). Далее к полученному 2-(4-ацетоксистирил)хинолину добавили 50 мл метанола и 0.26 г Na2CO3, смесь перемешивали 24 часа при комнатной температуре, затем к ней добавили буфер рН7 (25% NH4OH), образовавшийся осадок отфильтровали, промыли метанолом и высушили. Получили 2-(4-гидроксистирил)хинолин (I). Выход 67%, светло-желтые кристаллы, т.пл. 268°С (из изопропанола) (т.пл. 268-270°С [Huang; Fu-Chi (Gwynedd, PA), Galemmo, Jr.; Robert A. (Ambler, PA), Campbell; Henry F./Quinoline derivatives and use thereof as antagonists of leukotriene d4/Патент США. 1990. N 4918081]). Спектр ПМР, d, м.д.: 6.76 (2Н, д, J=8.4, о-С6Н4); 7.18 (1Н, д, J=16.2, =СН-); 7.47-7.55 (ЗН, м, м-С6Н4, хинолин-6); 7.66-7.72 (2Н, м, -СН=, хинолин-7); 7.78 (1Н, д, J=8.6, хинолин-3); 7.88 (1Н, д, J=8.0, хинолин-5); 7.92 (1Н, д, J=8.4, хинолин-8); 8.26 (1Н, д, J=8.6, хинолин-4); 10.25 (1Н, уш.с, ОН). ИК-спектр, ν, см-1: 1636 (-С=С), 968 (внеплос. δ транс НС=С-Н), 2430-3090 (ОН). УФ спектр (в этаноле), λmах, нм: 293, 359.
Пример 2. Реакция 4-гидроксибензальдегида с 2-метилхинолином в отсутствие уксусного ангидрида. К 2.5 г 4-гидроксибензальдегида добавили 1.4 г 2-метилхинолина. Смесь нагревали 2 часа при 130°С (масляная баня). Реакционную смесь обработали водным этанолом, затем нерастворившийся осадок отфильтровывали и промыли ацетоном (20 мл) и этанолом (3*20 мл). Получили 2-(4-гидроксистирил)хинолин (I). Выход 90%, светло-желтые кристаллы, т.пл. 268°С (из изопропанола) (т.пл. 268-270°С [Huang; Fu-Chi (Gwynedd, PA), Galemmo, Jr.; Robert A. (Ambler, PA), Campbell; Henry F./Quinoline derivatives and use thereof as antagonists of leukotriene d4/Патент США. 1990. N 4918081]). Спектр ПМР, d, м.д.: 6.76 (2Н, д, J=8.4, o-С6Н4); 7.18 (1Н, д, J=16.2, =СН-); 7.47-7.55 (3Н, м, м-С6Н4, хинолин-6); 7.66-7.72 (2Н, м, -СН=, хинолин-7); 7.78 (1Н, д, J=8.6, хинолин-3); 7.88 (1Н, д, J=8.0, хинолин-5); 7.92 (1Н, д, J=8.4, хинолин-8); 8.26 (1Н, д, J=8.6, хинолин-4); 10.25 (1Н, уш.с, ОН). ИК-спектр, ν, см-1: 1636 (νC=C), 968 (внеплос. δ транс НС=С-Н), 2430-3090 (ОН). УФ спектр (в этаноле), λmах, нм: 293, 359.
Пример 3. Реакция 4-гидроксибензальдегида с 7-хлор-2-метилхинолином в отсутствие уксусного ангидрида. К 0.25 г 4-гидроксибензальдегида добавили 0.36 г 7-хлор-2-метилхинолина. Смесь нагревали 2 часа при 140°С (масляная баня). Реакционную смесь обработали водным этанолом, затем нерастворившийся осадок отфильтровывали и промыли ацетоном (2 мл) и этанолом (3*2 мл). Получили 2-(4-гидроксистирил)-7-хлорхинолин (II). Выход 71%, желтые кристаллы, т.пл. 266-267°С (из изопропанола). Спектр ПМР, d, м.д.: 6.81 (2Н, д, J=8.6, o-С6Н4); 7.22 (1Н, д, J=16.3, =СН-); 7.50-7.58 (3Н, м, м-С6Н4, хинолин-3); 7.75 (1Н, д, J=16.3, -СН=); 7.83 (1Н, д, J=7.8, хинолин-6); 7.93-7.97 (2Н, м, хинолин-8,5); 8.32 (1Н, д, J=8.6, хинолин-4); 9.85 (1Н, уш.с, ОН). ИК-спектр, ν, см-1: 1636 (-С=С), 968 (внеплос. δ транс НС-С-Н), 2430-3090 (ОН). УФ спектр (в этаноле), λmах, нм: 218, 233, 287, 367. Найдено (%) С 72.28; Н 4.18; N 4.81. Вычислено (%) С 72.47; Н 4.29; N 4.97.
Пример 4. Реакция 4-гидроксибензальдегида с 3-метил-бензо[f]хинолином в отсутствие уксусного ангидрида. К 0.25 г 4-гидроксибензальдегида добавили 0.39 г 3-метил-бензо[f]хинолина. Смесь нагревали 3 часа при 140°С (масляная баня). Реакционную смесь обработали водным этанолом, затем нерастворившийся осадок отфильтровывали и промыли ацетоном (2 мл) и этанолом (3*2 мл). Получили 3-(4-гидроксистирил)бензо[f]хинолин (III). Выход 52%, светло-желтые кристаллы, т.пл. 299-300°С (из этанола). Спектр ПМР, d, м.д.: 6.84 (2Н, д, J=8.4, o-С6Н4); 7.31 (1Н, д, J=16.1, =СН-); 7.59 (2Н, д, J=8.4, м-С6Н4); 7.68 (1Н, т, J=7.6, бензохинолин); 7.74 (1Н, т, J=7.3, бензохинолин); 7.79 (1Н, д, J=16.1, -СН=); 7.89 (1Н, д, J=9.1, бензохинолин); 7.92 (1Н, д, J=8.8, бензохинолин); 8.04 (1Н, д, J=7.7, бензохинолин); 8.09 (1Н, д, J=9.1, бензохинолин); 8.82 (1Н, д, J=7.7, бензохинолин); 9.17 (1Н, д, J=8.5, бензохинолин); 9.78 (1Н, с, ОН). ИК-спектр, ν, см-1: 1638 (νc=c), 982 (внеплос. δ транс НС=С-Н), 2430-3090 (ОН). УФ спектр (в этаноле), λmах, нм: 240, 279, 296, 332, 344, 362, 379. Найдено (%) С 84.65; Н 5.18; N 4.55. Вычислено (%) С 84.82; Н 5.08; N 4.71.
Пример 5. Реакция 4-карбоксибензальдегида с 2-метилхинолином в отсутствие уксусного ангидрида. К 0.30 г 4-карбоксибензальдегида добавили 0.14 г 2-метилхинолина. Смесь нагревали 2 часа при 160°С (масляная баня). После охлаждения к реакционной смеси добавили 10 мл хлороформа, нерастворившийся осадок отфильтровали, промыли на стеклянном фильтре горячим хлороформом (3 раза по 5 мл), сушили на воздухе. Получили 2-(4-карбоксистирил)хинолин (IV). Выход 77%, светло-желтые кристаллы, т.пл. 298-300°С (т.пл. 295-300°С [Hayashi; Yoshio (Ushiku, JP), Oguri Tomei (Ushiku, JP), Shinoda; Masaki (Ami, JP), Takahashi; Kazuo (Komae, JP), Hashimoto; Munehiro. Carboxystyrene derivatives and drugs containing them as effective ingredients. Патент США. 1990. N 4925861]). Спектр ПМР, d, м.д.: 7.72 (1H, д, J=16.4, =СН-); 7.73-7.77 (м, 1H, Н-6); 7.86 (2Н, д, J=8.31, С6Н4), 7.95 (1H, т, J=7.80, Н-7); 8.02 (2Н, д, J=8.31, С6Н4), 8.09-8.21 (3Н, м, Н-3,5, -СН=); 8.25 (1H, д, J=8.78, Н-4); 8.77 (1H, д, J=8.70, Н-8).
| название | год | авторы | номер документа |
|---|---|---|---|
| ФОТОХРОМНЫЕ ПРОИЗВОДНЫЕ 5'-ВИНИЛ-6-НИТРО-СПИРОБЕНЗОПИРАНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2458927C1 |
| 4-ЗАМЕЩЕННЫЕ N-АРИЛ-1,8-НАФТАЛИМИДЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА ФЛУОРЕСЦЕНТНЫХ СЕНСОРОВ НА КАТИОНЫ МЕТАЛЛОВ, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2515195C1 |
| ПРОИЗВОДНЫЕ ФЕНИЛ-3-АМИНОМЕТИЛ-ХИНОЛОНА-2 В КАЧЕСТВЕ ИНГИБИТОРОВ NO-СИНТЕТАЗЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, БИОЛОГИЧЕСКИ АКТИВНЫЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2003 |
|
RU2284325C2 |
| Способ получения 6-стирил-4-трифторметил-2-тиоксо-1,2-дигидропиридин-3-карбонитрилов | 2023 |
|
RU2827934C1 |
| 3-АРИЛ-4а-ИЗОПРОПИЛ-4аН-ХРОМЕНО[6',7':4,5]ФУРО[3,2-с][1,2]ОКСАЗИН-8-ОНЫ, ОБЛАДАЮЩИЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ И АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2622768C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-АРИЛ-2-ОКСО-2Н-ХРОМЕН-3-КАРБОНИТРИЛОВ | 2015 |
|
RU2577524C1 |
| 5-АМИНО-3-(2-АМИНОПРОПИЛ)-[1,2,4]ТИАДИАЗОЛЫ | 2011 |
|
RU2449997C1 |
| [N'-(Изо)хинолилметилен]гидразиды 3-метокси-13,17-секоэстра-1,3,5(10)-триен-17-овой кислоты | 2023 |
|
RU2801166C1 |
| 11b-(ГEТ)АРИЛ-2,3,6,11b-ТЕТРАГИДРООКСАЗОЛО[2',3':2,1]ПИРРОЛО[3,4-b]ХИНОЛИН-5,11-ДИОНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2381229C2 |
| КРАУНСОДЕРЖАЩИЕ СТИРИЛОВЫЕ КРАСИТЕЛИ С АММОНИЙНОЙ ГРУППОЙ В N-ЗАМЕСТИТЕЛЕ ГЕТЕРОЦИКЛИЧЕСКОГО ОСТАТКА В КАЧЕСТВЕ ФОТО- И ТЕРМОЧУВСТВИТЕЛЬНЫХ СОЕДИНЕНИЙ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2278134C1 |
Изобретение относится к области органической химии, в частности к способу получения гидроксипроизводных стирилхинолинов, используемых в синтезе ингибиторов липоксигеназы или фосфолипазы и/или антагонистов лейкотриена, обладающих противоаллергическими и
противовоспалительными свойствами. Способ осуществляют в отсутствие катализаторов и растворителей, в одну стадию путем нагревания расплава метилхинолина с соответствующим бензальдегидом при температуре 130-160°С. Технический результат заключается в упрощении способа получения целевых соединений с более высоким выходом. 5 пр.
Способ получения гидроксизамещенных стирилхинолинов взаимодействием метилхинолинов с соответствующим бензальдегидом при повышенной температуре, отличающийся тем, что синтез проводят в одну стадию путем нагревания расплава исходных реагентов при температуре 130-160°С.
| ПРОИЗВОДНЫЕ ПИРИДИНА И ХИНОЛИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, АССОЦИИРОВАННЫХ С DPP-IV | 2003 |
|
RU2285693C2 |
| US 4918081 А1, 17.04.1990 | |||
| US 4925861 А, 15.05.1990 | |||
| US 4820841 А, 11.04.1989 | |||
| RU 2005139393 А, 27.07.2006 | |||
| Marcos А.P | |||
| Martins et al | |||
| "Solvent-Free Heterocyclic Synthesis" Chem | |||
| Rev | |||
| Аппарат для радиотелеграфирования | 1926 |
|
SU4140A1 |
Авторы
Даты
2012-09-27—Публикация
2010-12-01—Подача