Изобретение относится к области биотехнологии и касается гибридных белков на основе рекомбинантной L-аспарагиназы Wolinella succinogenes, обладающих противоопухолевой активностью и характеризующихся повышенной протеолитической стабильностью и гепарин-связывающей активностью.
В качестве ферментов медицинского назначения L-аспарагиназы широко используют во всем мире для лечения острого лимфобластного лейкоза (ОЛЛ) [Горошкова с соавт., 2008], кроме того, имеются данные об эффективности L-аспарагиназ при лечении миелобластной лейкемии [Duval et al, 2002], Ходжкинской и не-Ходжкинской лимфом, миелосаркомы и множественной миеломы [Perel et al, 2002]; NK/T-клеточной и кожной Т-клеточной лимфом [Obama et al, 1999; Yong et al, 2003; Jaccard et al, 2009]; метастазирующих опухолей, имеющих неблагоприятный прогноз [Jaccard et al, 2011]; саркомы мягких тканей [Tardito et al, 2007], гепатоклеточной саркомы и гастросаркомы [Cappelletti et al, 2008; Scotti et al, 2011].
Биологической мишенью L-аспарагиназ являются непосредственно злокачественные клетки, пролиферация которых в естественных условиях зависит от поступления извне аминокислоты L-аспарагина. Введение L-аспарагиназ в системный кровоток пациентов обеспечивает расщепление свободно циркулирующего L-аспарагина с образованием аспарагиновой кислоты и аммония [Красоткина и Соколов, 2011]. Механизм противоопухолевого действия L-аспарагиназ основан на индукции "голодания", приводящего к гибели лейкозных клеток в результате ограничения доступа к источнику L-аспарагина.
Практически все известные L-аспарагиназы в большей или меньшей степени обладают L-глутаминазной активностью, вносящей вклад и в противоопухолевую активность ферментов и в проявление негативных эффектов [Reinert et al., 2006; Chan et al., 2014].
Известны препараты на основе немодифицированной L-аспарагиназы ЕсА бактерий Escherichia coli и на основе химически модифицированной, пэгилированной L-аспарагиназы ПЭГ-ЕсА [Avramis et al., 2002]. Спектр побочных эффектов обоих вариантов ЕсА довольно широкий и в значительной степени схожий. Кроме того, вследствие перекрывания иммунного ответа модифицированный вариант ЕсА не подходит на роль препарата второй очереди после обычной ЕсА [van den Berg, 2011].
Альтернативой ЕсА является L-аспарагиназа ErA бактерий Erwinia chrysanthemi (эрвиназа) [Duval et al., 2002], которая вызывает меньшее количество осложнений [Durden et al., 1983; Eden et al., 1990; Duval et al., 2002; Appel et al., 2006], но имеет худшие показатели эффективности [Duval et al., 2002; van den Berg, 2011]. Кроме того, у одной трети пациентов с чувствительностью к L-аспарагиназе ЕсА наблюдаются антитела, распознающие ErA [Billett et al., 1992; Vrooman et al., 2010], что затрудняет последовательное применение этих ферментов.
Поскольку L-аспарагиназы являются весьма эффективными, но не идеальными агентами для лечения ОЛЛ [Covini et al., 2012], первостепенный интерес представляют направления их качественного усовершенствования [Patel et al., 2009].
Известно, что эффективность клинического применения L-аспарагиназ коррелирует со временем их жизни в системном кровотоке [Asselin, 1999]. Вместе с тем детальный механизм инактивации и последующей элиминации L-аспарагиназ из системного кровотока до сих пор остается неизвестным [Patel et al., 2009], хотя имеются данные, что L-аспарагиназы деградируют под действием различных протеолитических ферментов крови, таких как ферменты трипсинового ряда [Newsted et al., 1995; Kotzia et al., 2007], и лизосомальные цистеиновые протеиназы [Patel et al., 2009].
Увеличения устойчивости к действию протеиназ достигают в результате направленного изменения аминокислотных последовательностей L-аспарагиназ путем замены чувствительных остатков на альтернативные, не узнаваемые соответствующими протеиназами [Kotzia et al., 2007; Patel et al., 2009; Offman et al., 2011].
Известны другие способы стабилизации L-аспарагиназ, а именно: упаковка L-аспарагиназ в матриксы на основе липосом, гидрогелей и др. [Verma et al., 2007], специфическое и неспецифическое экранирование сайтов протеолиза на поверхности молекул L-аспарагиназ с использованием генетически коньюгированных фрагментов антител [Newsted et al., 1995; Ramjeesingh et al., 1992] или химически коньюгированных природных и искусственных молекул, такие как альбумин, белок шелка, декстран, полисиаловые и жирные кислоты, полиэтиленгликоль, поливиниловый спирт, полимеры на основе повторяющихся аминокислотных остатков и др., соответственно [Poznansky et al., 1982; Zhang et al., 2005; Fu & Sakamoto, 2007; Abribat, 2011; Martins et al., 1990; Martins et al., 1996; Verma et al., 2007], инкапсуляции в живые клетки эритроцитов [Covini et al., 2012; van den Berg, 2011; Kwon et al., 2009; Kravtzoff et al., 1990; Kravtzoff et al., 1996; Hamidi et al., 2007; Domenech et al., 2011].
Одно из недавних открытий свидетельствует, что стабилизация и удлинение времени жизни фармацевтически активных белков достигается в результате их связывания с гепарансульфатсодержащими протеогликанами (ГСПГ) [Xia et al., 2012; Dubrac et al., 2010; Bramono et al., 2012; Sommer & Rifkin, 1989; Xu & Esko, 2014; http://sportswiki.ru/%D0%93%D0%B5%D0%BF%D0%B0%25Dl%80%D0%B8%D00/oBDl].
Гепарансульфаты (ГС) представляют собой модифицированные линейные отрицательно заряженные (кислые) полисахариды подкласса гликозаминогликанов, синтезируемые на белковой подложке [Bourin and Lindahl, 1993].
Один из видов ГС, гепарин представляет собой отделенный от белковой основы свободный гликозаминогликан, являющийся компонентом противосвертывающей системы крови. Гепарин играет важную роль в воспалительных, в частности, аллергических реакциях, однако в плазме здоровых людей его выявить не удается, так как его быстро захватывают и разрушают макрофаги [Forsberg et al., 1999].
Другой вид ГС постоянно связан с сердцевинным белком (core protein) в составе ГСПГ и содержит по сравнению с гепарином больше D-глюкуроновой кислоты и N-ацетилглюкозамина и меньше сульфатных групп. Доля ГС в общей массе ГСПГ составляет 90-95%.
ГС вовлечены во множество физиологических процессов и участвуют во взаимодействии с множеством различных белков [Rosenberg & Damus, 1973; Jin et al., 1997; Karlsson et al, 1988; van der Strate et al, 2001; Bramono et al, 2012; McKenzie, 2007; ; Bernfield et al., 1992; Rostand & Esko, 1997; Dechecchi et al., 2000; Dechecchi et al., 2001; Nicol et al., 2004; Smith et al., 2003a; Smith et al., 2003b; Tiwari et al., 2011; Ali et al., 2012; Lin et al., 2013; Galdiero et al., 2013; Shin et al., 2003; Wu et al., 2006; Dubrac et al., 2010; Zhao et al., 2010; Sommer & Rifkin, 1989; Xia et al., 2012]. Высокая аффинность ГС обусловлена наличием в их составе большого количества отрицательно заряженных сульфатных и карбоксильных групп, представляющих собой сильные природные полианионы, способные к электростатическим взаимодействиям со многими белковыми и синтетическими соединениями поликатионной природы.
Одним из органов, наиболее богатых ГС, является печень [http://www.medical-/enc.ru/4/heparinum.shtml]. Известно также, что печень способна задерживать до 20% всей крови организма, замедляя ее ток в 10-20 раз [http://www.medical-enc.ru/15/liver.shtml; Бабский с соавт., 1985]. Тем самым в печени создаются благоприятные условия для аккумулирования различных гепарин-связывающих белков, в том числе и L-аспарагиназ [Dubrac et al., 2010; Zhao et al, 2010; Xia et al., 2012]. В этой связи, для снижения гепатотоксичного действия представляется актуальным использование L-аспарагиназ со сниженной глутаминазной активностью.
Известны успешные попытки по снижению глутаминазной активности L-аспарагиназы ЕсА путем изменения аминокислотной последовательности фермента [Derst et al., 2000; Offman et al., 2011; Chan et al., 2014]. Мутации в положениях N24, R195, Y250 [Offman et al., 2011], а также N248 [Derst et al., 2000] и Q59 [Chan et al., 2014] приводят к снижению и аспарагиназной активности, и соотношения глутаминазной и аспарагиназной активности, в то время как другие мутации не влияют на аспарагиназную активность [Offman et al., 2011] или изменяют ее незначительно [Chan et al., 2014],
В этой связи особый интерес вызывает L-аспарагиназа WsA бактерий Wolinella succinogenes, природно обладающая исключительно низкой глутаминазной активностью, составляющей 0.015% от аспарагиназной, что в 130-600 раз меньше, чем у ферментов ЕсА или ErA [Distasio & Niederman, 1976], при том, что другие физико-химические свойства этого фермента схожи со свойствами ферментов ЕсА или ErA [Distasio et al., 1977; Distasio et al., 1982; Lubkowski et al., 1996]..
Выделение нативной L-аспарагиназы из биоиассы, полученной путем культивирования W. succinogenes, оказалось затруднительным в связи с низкой эффективностью процесса культивирования [Albanese & Kafkewitz, 1978]. Биосинтез рекомбинантной формы этого белка в гетерологичной системе экспрессии также не был удачным: результирующий фермент обладал высоким уровнем глутаминазной активности [Chan et al., 2014; Derst et al., 2000].
Одним из основных препятствий для эффективного применения L-аспарагиназ является их иммуногенность, связанная с бактериальным происхождением этих ферментов [Покровский с соавт., 2008; Kwon et al., 2009]. При этом рекомбинантная L-аспарагиназа W. succinogenes может проявлять дополнительную иммуногенность, обусловленную присутствием N-концевого формилметионина, характерного для цитоплазматических белков бактериального происхождения, в особенности получаемых в условиях сверхпродукции [Ben-Bassat & Bauer, 1987]. Наличие N-концевого метионина или формилметионина невыгодно отличает рекомбинантную L-аспарагиназу WsA, продуцируемую в цитоплазме бактериальных клеток, от секретируемых L-аспарагиназ ЕсА или ErA, подвергающихся внутриклеточному N-концевому процессингу и поэтому не содержащих N-концевой метионин или формилметионин.
Известны приемы получения в клетках бактерий безметиониновых форм цитоплазматических белков, основанные на использовании технологии гибридных предшественников этих белков [Shatzman and Rosenberg, 1987]. В этом случае осуществляют синтез гибридного предшественника, включающего целевой белок, слитый с белком-носителем, занимающим в составе предшественника N-концевое положение. Высвобождение целевого белка осуществляют, как правило, in vitro в процессе очистки с использованием высокоспецифичных протеиназ. Недостатком такой технологии является значительная ее дороговизна, обусловленная: необходимостью использования высокоочищенных препаратов протеиназ, а также количественными потерями, возникающими вследствие неспецифического протеолиза.
Исключить использование протеиназ позволяют способы, основанные на применении интеин-опосредованных систем биосинтеза и очистки белков [Fong et al, 2010], в частности, системы IMPACT (Intein-Mediated Purification and Affinity-Chitin binding Tag, NEB) [Chong et al., 1997]. В этом случае в качестве составной части гибридного белка, являющегося предшественником целевого белка, используют молекулу одного из интеинов, представляющих собой белки размером около 150 аминокислотных остатков, способные к автокаталитическому процессингу (гидролизу) пептидной связи на границе интеин-целевой белок и позволяющие таким образом получать безметиониновые формы целевых продуктов [Chong et al., 1997]. Примеров использования интеинов для получения безметиониновых форм L-аспарагиназ не известно.
На основе синтетического структурного гена нами получен вариант немодифицированной рекомбинантной L-аспарагиназы бактерий Wolinella succinogenes (обозначен Was02) имеющей аминокислотную последовательность [САА58658, GenBank], соответствующую продукту трансляции природного гена ansA [Х83689, GenBank] и разработан мутантный вариант этой L-аспарагиназы (обозначен как Was72), характеризующийся аминокислотной последовательностью, соответствующей аминокислотной последовательности L-аспарагиназы бактерий Wolinella succinogenes, в которой аминокислотный остаток валина в положении 23 заменен на остаток глутамина, а аминокислотный остаток лизина в положении 24 заменен на остаток треонина. Мутантный вариант Was72 рекомбинантной L-аспарагиназы Wolinella succinogenes обладает устойчивостью к протеолизу под действием трипсина (даже после 60 минут
инкубации) и пониженным более чем в 8 раз уровнем глутаминазной активности (по сравнению с Was02) при сохранении уровня специфической аспарагиназной активности. Задача заявляемого изобретения - расширить арсенал рекомбинантных белков на основе L-аспарагиназы Wolinella succinogenes. Задача решена путем
- получения гибридного белка, обладающего противоопухолевой активностью и заключающего в своем составе аминокислотную последовательность мутантной L-аспарагиназы бактерий Wolinella succinogenes Was72, слитую с аминокислотной последовательностью гепарин-связывающего пептида НВ1, где гибридный белок имеет последовательность, указанную в SEQ ID NO: 3 (обозначен как форма Was79M), или последовательность, указанную в положениях 161-508 SEQ ID NO: 1 (обозначен как форма Was79);
- конструирования штамма Escherichia coli ECR-89 - продуцента гибридного белка в форме Was79M, полученного путем трансформации реципиентного штамма E.coli BL21(DE3) плазмидой pET28-Was89, сконструированной на основе вектора pET28b(+) и содержащей структурный ген гибридного белка имеющего последовательность SEQ ID NO: 3;
- конструирования штамма Escherichia coli ECR-86- продуцента гибридного белка в форме Was79, имеющего последовательность, указанную в положениях 161-508 SEQ ID NO: 1, и депонированного во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) как Escherichia coli ВКПМ В-11955;
- разработки способа получения гибридного белка в форме Was79, путем культивирования штамма Escherichia coli ВКПМ В-11955 в условиях, обеспечивающих рост клеток этого штамма и биосинтез гибридного белка, с последующим отделением полученной клеточной биомассы и выделением из нее гибридного белка в условиях, обеспечивающих перевод гибридного белка либо во фракцию растворимых клеточных белков, либо во фракцию нерастворимых клеточных белков, и дальнейшей очисткой гибридного белка из белок-содержащей фракции с использованием методов ионообменной хроматографии и ультрафильтрации.
Штаммы Escherichia coli ВКПМ В-11955 (Escherichia coli ECR-86) и Escherichia coli ECR-79 - продуценты гибридного белка получены на основе реципиентного штамма E.coli BL21(DE3) [Novagen, ВКПМ В-10189].
Для получения гибридного белка Was79 использован подход, ранее не применявшийся в отношении L-аспарагиназ. Подход основан на первоначальном
биосинтезе белка в виде гибридного предшественника, содержащего дополнительную N-концевую область, заключающую в своем составе последовательность мутантного варианта int4b интеина Pch PRP8 Intein Penicillium chrysogenum (InBase, http://www.neb.com/neb/inteins.html). Мутантный вариант содержит в N-концевой части мутации CyslAla и Cys8Tyr, инактивирующие способность интеина к сплайсингу, но не затрагивающие его способность к C-концевому автокаталитическому процессингу, в результате которого в клетках штамма-продуцента образуется зрелая безметиониновая форма гибридного белка Was79.
Таким образом, получение гибридного белка Was79 осуществляют путем биосинтеза предшественника и его последующего автокаталитического процессинга (созревания), происходящего непосредственно в клетках штамма-продуцента in vivo исключительно за счет функциональной активности интеина.
Получение гибридного белка Was79M осуществляют путем непосредственного микробиологического синтеза зрелого гибридного белка в клетках штамма-продуцента (без биосинтеза предшественника и его последующего процессинга).
Полученный гибридный белок в форме Was79 или Was79M подвергают очистке.
Очистку гибридного белка осуществляют либо из фракции растворимых, либо из фракции нерастворимых клеточных белков, которые получают в результате разрушения биомассы штамма-продуцента и последующего центрифугирования. Очистку проводят с использованием методов хроматографии и ультрафильтрации, очистки позволяет
Предлагаемый способ очистки позволяет выделять целевой белок из той или другой фракции в зависимости от объема и возможностей производства.
Способ в общем виде
Биосинтез гибридного белка в форме Was79M или Was79 осуществляют следующим образом. Посевной материал штамма - продуцента культивируют в подходящей питательной среде, включающей источники углерода, азота и минеральные соли, обычно используемые для выращивания клеток E. coli при температуре от 24°С до 37°С [Маниатис с соавт., 1984, Москва, Мир]. Культивирование осуществляют в колбах или в биореакторах (ферментерах). Индукцию синтеза целевого гибридного белка осуществляют путем внесения в среду культивирования индуктора изопропил-β-D-1-тиогалактопиранозида в концентрации от 0,1 до 2 мМ или лактозы в концентрации от 0,5% до 3%. Индуктор вносят на стадии роста культуры, предшествующей стационарной фазе роста. Индукцию осуществляют на протяжении не менее 1 часа. В результате индукции клетки штамма-продуцента накапливают целевой гибридный белок в количестве до 30% от суммарного белка клеток.
Выделение и очистку гибридного белка осуществляют следующим образом. Гибридный белок выделяют из биомассы штамма-продуцента. С этой целью проводят разрушение клеток биомассы преимущественно с использованием механической гомогенизации, используя буфер, содержащий ингибиторы протеиназ фенилметилсульфонилфторид (PMSF) и динатриевую соль этилендиаминтетрауксусной кислоты (ЭДТА), со значением pH, близким к нейтральному, предпочтительно 5-10 мМ калий-натрий фосфатный буфер, pH 6,2-7,2. С целью перевода гибридного белка либо во фракцию растворимых клеточных белков, либо во фракцию нерастворимых клеточных белков, изменяют ионную силу буфера для разрушения. Предпочтительно для этого в буфер для разрушения вносят хлористый натрий в концентрации от 0 до 3 М.
Выделение и очистку гибридного белка проводят в присутствии ингибитора, преимущественно в присутствии 1-10 мМ ЭДТА.
Выделение гибридного белка из фракции нерастворимых белков. В присутствии в буфере для дезинтеграции хлористого натрия в концентрации от 0,1 до 0,3 M гибридный белок преимущественно переходит во фракцию нерастворимых клеточных белков. Эту фракцию выделяют из общего клеточного лизата с помощью центрифугирования.
Гибридный белок экстрагируют из нерастворимой фракции клеточного лизата экстрагентом с высокой ионной силой (от 0 до 3 М NaCl), преимущественно 1 M раствором NaCl. Экстракт отделяют от клеточной массы центрифугированием и подвергают дальнейшей очистке.
Выделение гибридного белка из фракции растворимых белков. В присутствии в буфере для дезинтеграции хлористого натрия в концентрации менее 0,1 M или более 0,3 M гибридный белок преимущественно переходит во фракцию растворимых клеточных белков. Эту фракцию отделяют от фракции нерастворимых клеточных белков центрифугированием и подвергают дальнейшей очистке.
Очистка выделенного гибридного белка
Далее очистку гибридного белка проводят методом ионообменной хроматографии при pH 5,8-7,2 на катионообменнике, преимущественно на сорбенте SP-Сефароза (GE Healthcare, Швеция). Для этого содержащий гибридный белок центрифугат, полученный при выделении либо из растворимой фракции, либо из нерастворимой фракции клеточных белков доводят до содержания хлористого натрия 0,5-0,7 M и наносят на колонку с сорбентом SP-Сефароза. Элюируют целевой белок, повышая ионную силу до 1М NaCl.
Затем элюат гибридного белка подвергают ультрафильтрации производя замену буфера на более щелочной со значением pH 8,5-9,3, содержащий 0,15 М NaCl.
Затем фильтрат подвергают анионообменной хроматографии, в частности на сорбенте HiTrapQ (GE Healthcare, Швеция). Целевой белок выходит в проскоке. Полученный раствор подкисляют до достижения pH 5,8-7,2 и дочищают методом катионообменной хроматографии в частности на сорбенте SP-сефароза. После промывки сорбента натрий-фосфатноым буфером, содержащим до 0,5 М NaCl целевой белок элюируют буфером, содержащим 1 М NaCl. Элюат, содержащий гибридный белок, обессоливают и концентрируют с помощью ультрафильтрации, предпочтительно в тангенциальном потоке с использованием мембранного модуля с отсекающим размером 50 кДа. Выход очищенного гибридного белка, выделеного либо из растворимой фракции, либо из нерастворимой фракции клеточных белков составляет не менее 30% от исходного содержания в клеточном лизате. Чистота очищенного гибридного белка по данным электрофореза в полиакриламидном геле в денатурирующих условиях составляет не менее 95%.
Фиг. 1 - Профиль элюции белков Was02 и Was79 в условиях хроматографии на колонке HiTrap Heparin (GE Healthcare), содержащей в качестве сорбента гепарин-сефарозу. Элюцию осуществляют градиентом концентрации буфера В, представляющего собой раствор 1М NaCl в буфере нанесения. По горизонтали время элюции (мин). Вертикальная ось (слева) - оптическая плотность ОД280 (mAU, верхняя кривая) и ОД254 (mAU, нижняя кривая) раствора, элюируемого с колонки. Вертикальная ось (справа) - концентрация буфера В (%). Изображена наклонная линия градиента.
Фиг. 2 - Зависимость уровня излечивания лимфаденоза Фишера у мышей от дозировки препарата L-аспарагиназы, использованного для лечения. По горизонтали - дозировка фермента (МЕ/кг), по вертикали - доля излеченных животных (%). Условные обозначения препаратов L-аспарагиназ: ромб - Was02, квадрат - Was79, треугольник - Медак.
Пример 1. Конструирование синтетического гена рекомбинантной немодифицированной L-аспарагиназы W. succinogenes Was02
Синтетический структурный ген L-аспарагиназы W. succinogenes получают с использованием традиционных методов химического синтеза в составе BamHI/XhoI фрагмента ДНК (SEQ ID NO 4). Синтетический структурный ген представляет собой нуклеотидную последовательность ДНК, кодирующую немодифицированную L-
аспарагиназу W.succinogenes, имеющую аминокислотную последовательность [САА58658, GenBank], соответствующую продукту трансляции природного гена ansA [Х83689, GenBank]. В составе синтетического гена в области стартового кодона ATG локализован сайт узнавания рестриктазы NcoI. BamHI/XhoI фрагмент ДНК, заключающий синтетический ген немодифицированной L-аспарагиназы W.succinogenes, клонируют в векторе pUC57 (Y14837, GenBank), результирующую плазмиду называют pUC57-WAS.
Результирующая плазмида pUC57-WAS содержит в своем составе нуклеотидную последовательность NcoI/XhoI фрагмента ДНК, заключающего структурный ген немодифицированной L-аспарагиназы W.succinogenes.
Пример 2. Конструирование вектора pET28-Was02 и получение штамма BL21-Was02 - продуцента рекомбинантной немодифицированной L-аспарагиназы Was02 W.succinosenes
Рекомбинантная плазмида pET28-Was02 представляет собой совокупность XhoI/NcoI фрагмента ДНК векторной плазмиды pET28b(+) (Novagen) размером 5231 п.о. и NcoI/XhoI фрагмента ДНК плазмиды pUC57-WAS (пример 1) размером 995 п.о., заключающего структурный ген рекомбинантной немодифицированной L-аспарагиназы W.succinogenes.
Для получения плазмиды pET28-Was02 плазмиду pUC57-WAS расщепляют с помощью рестриктаз NcoI и XhoI, образовавшийся фрагмент ДНК размером 995 п.о. элюируют из геля с использованием кита Qiagen (Qiagen, cat. №28706) и лигируют с ДНК вектора pET28b(+), расщепленного с помощью рестриктаз NcoI и XhoI. Лигирование проводят с помощью ДНК-лигазы фага Т4. В результате получают плазмиду pET28-Was02 размером 6226 п.о.
Плазмида pET28-Was02 является экспрессионной, ее используют для биосинтеза немодифицированной L-аспарагиназы Was02 W.succinogenes в клетках E. coli. В составе плазмиды pET28-Was02 структурный ген немодифицированной L-аспарагиназы Was02 W.succinogenes находится под контролем промотора фага Т7.
Пример 3. Конструирование структурного гена рекомбинантной мутантной L-аспарагиназы Was72, содержащей мутации VK23,24QT, и получение плазмиды pUC57-Was72
Фрагмент ДНК, заключающий структурный ген рекомбинантной мутантной L-аспарагиназы Was72, получают в процессе ПЦР-амплификации с использованием в качестве матрицы ДНК плазмиды pET28-Was02. Амплификацию проводят в две стадии. Сначала амплифицируют два перекрывающихся фрагмента ДНК, для чего используют следующие пары праймеров:


Амплифицированные фрагменты ДНК элюируют из агарозного геля с использованием кита Qiagen (Qiagen, cat. №28706) и используют для ПЦР-лигирования. Для этого проводят ПЦР-амплификацию на смеси фрагментов 1 и 2 в качестве матрицы. Праймерами для амплификации служат N685 и N898. Полученный в результате ПЦР фрагмент ДНК размером 1093 п.о. элюируют из агарозного геля, обрабатывают рестриктазами Eco91I и Xhol и клонируют в векторе pUC57-WAS, расщепленном по уникальным сайтам с помощью рестриктаз Eco91I и XhoI. Сайт узнавания рестриктазы Eco91I локализован в области между стартовым кодоном ATG структурного гена L-аспарагиназы и областью, в которую были введены мутации. В результате клонирования получают плазмиду pUC57-Was72, в составе которой нуклеотидную последовательность клонированного фрагмента ДНК подтверждают с помощью секвенирования.
Плазмида pUC57-Was72 содержит уникальный BamHI/XhoI фрагмент ДНК, заключающий структурный ген рекомбинантной мутантной L-аспарагиназы Was72 W.succinogenes, в составе которой произведена замена VK23,24QT, в результате которой 23-й и 24-й аминокислотные остатки валина и лизина заменены на остатки глутамина и треонина, соответственно.
Пример 4. Конструирование вспомогательной плазмиды рЕТ28-Bam
Для получения вспомогательной плазмиды рЕТ28-Bam концы векторной части плазмиды pET28b(+) (Novagen), расщепленной с помощью рестриктаз NcoI и XhoI, лигируют в присутствии двуцепочечного ДНК-адаптера, полученного в результате отжига следующих олигонуклеотидов:
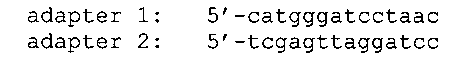
В результате получена вспомогательная плазмида рЕТ28-Bam, в составе которой между сайтами узнавания рестриктаз NcoI и XhoI сконструирован сайт узнавания рестриктазы BamHI.
Вспомогательную плазмиду рЕТ28-Bam используют для клонирования BamHI/XhoI или BglII/XhoI фрагментов ДНК.
Пример 5. Клонирование фрагмента ДНК, кодирующего мутантный вариант int4b интеина Pch PRP8 Intein, и конструирование плазмиды pET28-Int4b
Фрагмент ДНК, кодирующий мутантный вариант int4b интеина Pch PRP8 Intein, содержащего аминокислотные замены CyslAla и Cys8Tyr, получают с помощью ПЦР. Источником информации о нуклеотидной последовательности гена интеина служит файл базы данных GenBank: АМ042015. Источником информации об аминокислотной последовательности интеина служит файл базы данных InBase (New England Biolabs, USA): Pch PRP8 Intein. Матрицей для амплификации служит хромосомная ДНК штамма Penicillium chrysogenum ВКПМ F4. Амплификацию осуществляют с использованием праймеров:

Полученный в результате ПЦР фрагмент ДНК размером 497 п.о. элюируют из агарозного геля, обрабатывают рестриктазами BglII и XhoI и клонируют в векторе рЕТ28-Bam, расщепленном с помощью рестриктаз BamHI и XhoI. В результате клонирования получают плазмиду pET28-int4b, в составе которой нуклеотидную последовательность клонированного фрагмента ДНК подтверждают с помощью секвенирования.
Плазмида pET28-int4b содержит уникальный NcoI/XhoI фрагмент ДНК, заключающий структурный ген мутантного варианта int4b интеина Pch PRP8 Intein Penicillium chrysogenum. В 3′-концевой области клонированного фрагмента ДНК локализован уникальный сайт узнавания рестриктазы BamHI, который используют для получения гибридных конструкций.
Пример 6. Клонирование фрагмента ДНК, кодирующего гепарин-связываюший пептид НВ1, и конструирование плазмиды рЕТ28-НВ1
Плазмиду рЕТ28-НВ1 получают путем лигирования концов векторной части плазмиды рЕТ28-Bam, расщепленной с помощью рестриктаз BamHI и XhoI, в присутствии двуцепочечного ДНК-адаптора, полученннного в результате отжига олигонуклеотидов:

В результате получена плазмида рЕТ28-НВ1, содержащая фрагмент ДНК, кодирующий гепарин-связывающий пептид НВ1. В 3′-концевой области этого фрагмента локализован уникальный сайт узнавания рестриктазы BamHI.
Пример 7. Конструирование вспомогательной плазмиды pET28-Int4b-HB1
Плазмиду pET28-Int4b-HB1 получают путем лигирования концов векторной части плазмиды pET28-Int4b, расщепленной с помощью рестриктаз BamHI и XhoI, в присутствии двуцепочечного ДНК-адаптора, полученннного в результате отжига олигонуклеотидов N867 и N868 (пример 6):
В результате получена плазмида pET28-Int4b-HB1, содержащая фрагмент ДНК, кодирующий белок, заключающий в своем составе мутантный вариант int4b интеина Pch PRP8 Intein, слитый с гепарин-связывающим пептидом НВ1. В 3′-концевой области этого фрагмента локализован уникальный сайт узнавания рестриктазы BamHI.
Пример 8. Конструирование плазмиды pET28-Was79 для экспрессии гибридного белка Was79
Плазмиду pET28-Was79 получают путем лигирования концов векторной части вспомогательной плазмиды pET28-Int4b-HB1, расщепленной с помощью рестриктаз BamHI и XhoI, с фрагментом ДНК BamHI/XhoI плазмиды pUC57-Was72, содержащим структурный ген рекомбинантной мутантной L-аспарагиназы Was72 W.succinogenes, в составе которой присутствует замена VK23,24QT, в результате которой 23-й и 24-й аминокислотные остатки валина и лизина заменены на остатки глутамина и треонина, соответственно.
Плазмида pET28-Was79 содержит фрагмент ДНК, кодирующий белок-предшественник, характеризующийся последовательностью SEQ ID NO 1, заключающей в своем составе мутантный вариант int4b интеина Pch PRP8 Intein, слитый с последовательностью гибридного белка Was79. Гибридный белок Was79 включает в свой состав гепарин-связывающий пептид НВ1 и аминокислотную последовательность рекомбинантной мутантной L-аспарагиназы Was72 W.succinogenes, в составе которой присутствует замена VK23,24QT, в результате которой 23-й и 24-й аминокислотные остатки валина и лизина заменены на остатки глутамина и треонина, соответственно.
Плазмида pET28-Was79 является экспрессионной и может быть использована для получения гибридного белка Was79.
Состав кодонов в последовательности ДНК, кодирующей мутантный вариант int4b интеина Pch PRP8 Intein, в составе плазмиды pET28-Was79 отличается от оптимального для экспрессии в клетках Escherichia coli, и его подвергают оптимизации с получением плазмиды pET28-Was86.
Пример 9. Синтез фрагмента ДНК с оптимизированным кодоновым составом и конструирование плазмиды pET28-Was86 для экспрессии гибридного белка Was79
С использованием подходящих компьютерных программ оптимизируют состав кодонов в последовательности ДНК, кодирующей мутантный вариант int4b интеина Pch PRP8 Intein в составе плазмиды pET28-Was79, для экспрессии в клетках Escherichia coli. Далее с использованием традиционных методов синтеза генов синтезируют BglII/SalI фрагмент ДНК, содержащий оптимизированный состав кодонов и кодирующий 142 N-концевых остатка мутантного варианта int4b интеина Pch PRP8 Intein, включающего аминокислотные замены Cys1Ala и Cys8Tyr. Синтезированный BglII/SalI фрагмент ДНК клонируют в векторе pUC57, результирующую плазмиду называют pUC57-Sint4b.
Плазмиду pET28-Was86 получают путем лигирования трех фрагментов ДНК:
- уникального MluI/BamHI фрагмента ДНК вспомогательной плазмиды рЕТ28-Bam, заключающего промоторную область РНК-полимеразы фага Т7;
- BglII/SalI фрагмента ДНК плазмиды pUC57-Sint4b, заключающего оптимизированную часть структурного гена мутантного варианта int4b интеина Pch PRP8 Intein;
- SalI/MluI векторного фрагмента ДНК плазмиды pET28-Was79, заключающего C-концевую неоптимизированную часть последовательности ДНК, кодирующей мутантный вариант int4b интеина Pch PRP8 Intein, и последовательность ДНК, кодирующую гибридный белок Was79.
В результате получают плазмиду pET28-Was86, которая содержит последовательность ДНК (SEQ ID NO 2), имеющую оптимизированный состав кодонов и кодирующую белок-предшественник, заключающий в своем составе мутантный вариант int4b интеина Pch PRP8 Intein, слитый с последовательностью гибридного белка Was79.
Плазмида pET28-Was86 является экспрессионной, ее используют для биосинтеза гибридного белка Was79, содержащего в качестве N-концевого остатка серии.
Пример 10. Конструирование плазмиды pET28-Was89 для экспрессии гибридного белка Was79M
Плазмиду pET28-Was89 получают путем лигирования концов векторной части вспомогательной плазмиды рЕТ28-НВ1, расщепленной с помощью рестриктаз BamHI и XhoI, и BamHI/XhoI фрагмента ДНК плазмиды pUC57-Was72, заключающего последовательность ДНК, кодирующую мутантную L-аспарагиназу Was72 W.succinogenes, в составе которой присутствует замена VK23,24QT, в результате которой 23-й и 24-й аминокислотные остатки валин и лизин заменены на остатки глутамина и треонина, соответственно.
Результирующая плазмида pET28-Was89 содержит последовательность ДНК, кодирующую гибридный белок Was79M (SEQ ID NO 3), включающий гепарин-связывающий пептид НВ1, слитый с последовательностью мутантной L-аспарагиназы Was72 W.succinogenes, в составе которой присутствует замена VK23,24QT, в результате которой 23-й и 24-й аминокислотные остатки валин и лизин заменены на остатки глутамина и треонина, соответственно.
Плазмида pET28-Was89 является экспрессионной, ее используют для биосинтеза гибридного белка Was79M, содержащего N-концевой метионин или формилметионин.
Пример 11. Получение штамма E. coli ECR-79 - продуцента гибридного белка Was79
Штамм E. coli ECR-79, продуцент гибридного белка Was79, получают путем трансформации реципиентного штамма E. coli BL21(DE3) (Novagen) - ВКПМ В-10189 плазмидой pET28-Was79, содержащей не оптимизированную по составу кодонов последовательность ДНК, кодирующую мутантный вариант int4b интеина Pch PRP8 Intein. Трансформацию осуществляют с применением реактива CaCl2 [Маниатис с соавт., 1984]. Колонии трансформированного штамма отбирают на селективной среде, содержащей антибиотик канамицин.
В результате трансформации получают штамм E. coli ECR-79, который используют для биосинтеза гибридного белка Was79.
Клетки штамма E. coli ECR-79 содержат экспрессионную плазмиду pET28-Was79 и в ответ на внесение в среду культивирования индукторов изопропил-β-D-1-тиогалактопиранозида (ИПТГ) или лактозы синтезируют гибридный белок Was79.
Пример 12. Получение штамма E. coli ВКПМ В-11955 - продуцента гибридного белка Was79
Второй штамм - продуцент гибридного белка Was79, а именно штамм E. coli ECR-86 - получают как описано в примере 11, за исключением того, что для трансформации используют плазмиду pET28-Was86, содержащую оптимизированную по составу кодонов последовательность ДНК, кодирующую мутантный вариант int4b интеина Pch PRP8 Intein.
Штамм E. coli ECR-86 используют для биосинтеза гибридного белка Was79.
Клетки штамма E. coli ECR-86 содержат экспрессионную плазмиду pET28-Was86 и в ответ на внесение в среду культивирования индукторов ИПТГ или лактозы синтезируют гибридный белок Was79.
Штамм E. coli ECR-86 депонирован в коллекции Всероссийской коллекции промышленных микроорганизмов под регистрационным номером ВКПМ В-11955.
Пример 13. Получение штамма E. coli ECR-89 - продуцента гибридного белка Was79M
Штамм E. coli ECR-89 - продуцент гибридного белка Was79M, содержащего N-концевой метионин или формилметионин, получают как описано в примере 11, за исключением того, что для трансформации используют плазмиду pET28-Was89.
Штамм E. coli ECR-89 используют для биосинтеза гибридного белка Was79M.
Клетки штамма E. coli ECR-89 содержат экспрессионную плазмиду pET28-Was89 и в ответ на внесение в среду культивирования индукторов ИПТГ или лактозы синтезируют гибридный белок Was79M.
Пример 14. Получение штамма E. coli ECR-02 - продуцента рекомбинантной немодифицированной L-аспарагиназы Was02
Штамм E. coli ECR-02 - продуцент рекомбинантной немодифицированной L-аспарагиназы Was02 W.succinogenes получают как описано в примере 11, за исключением того, что для трансформации используют плазмиду pET28-Was02.
Штамм E. coli ECR-02 используют для биосинтеза рекомбинантной немодифицированной L-аспарагиназы W.succinogenes.
Клетки штамма E. coli ECR-02 содержат экспрессионную плазмиду pET28-Was02 и в ответ на внесение в среду культивирования индукторов ИПТГ или лактозы синтезируют рекомбинантную немодифицированную L-аспарагиназу W.succinogenes Was02, которую используют далее в качестве контроля.
Пример 15. Биосинтез гибридного белка Was79 в колбах с использованием индуктора-лактозы
Биосинтез гибридного белка Was79 в колбах осуществляют следующим образом. Сначала получают посевную культуру. Для этого одну колонию штамма E. coli ECR-79 или штамма E. coli ВКПМ В-11955 засевают в пробирку, содержащую 3 мл среды YTS следующего состава (мас. %): дрожжевой экстракт - 1, триптон бакто - 2, NaCl - 1, канамицин - 0,003, вода - остальное. Культуру выращивают на роторной качалке со скоростью 250 об/мин в течение 18 часов при температуре 37°С.
На втором этапе выросшую посевную культуру переносят в среду для индукции. С этой целью 0,5 мл посевной культуры переносят в колбу, содержащую 50 мл среды TRB следующего состава (мас. %): дрожжевой экстракт - 2,4; триптон бакто - 1,2; одномолярный фосфатный буфер (рН7) - 10; одномолярный раствор сульфата магния - 0,2; лактоза - 0,5; глицерин - 0,5; канамицин - 0,009; вода - остальное. Культивирование в среде для индукции продолжают в течение 20 часов в тех же условиях.
Для индукции синтеза гибридного белка Was79 в описанных условиях используют лактозу, изначально входящую в состав среды TRB.
Полученную в результате культивирования биомассу осаждают центрифугированием в пластмассовых пробирках объемом 50 мл в течение 10 минут со скоростью 9000 об/мин с охлаждением (4°С). Надосадочную жидкость сливают. Клеточный осадок суспедируют в 30 мл буфера PBS следующего состава: 137 мМ NaCl, 2 мМ KCl, 10 мМ фосфатный буфер, pH 7,4, после чего вновь подвергают центрифугированию в течение 10 минут со скоростью 9000 об/мин с охлаждением (4°С). Надосадочную жидкость сливают, и остатки жидкости тщательно удаляют с помощью вакуумного насоса.
В результате культивирования получают 12 г биомассы штамма E. coli ECR-79 или 12 г биомассы штамма E. coli ECR-86 с 1 литра культуры. Полученную биомассу замораживают и хранят при температуре минус 20°С.
Согласно данным анализа, выполненного методом электрофореза в полиакриламидном геле в денатурирующих условиях, содержание гибридного белка Was79 в биомассе штамма E. coli ECR-79 составляет 15%, а в биомассе штамма E. coli ECR-86 - 17% относительно суммарного растворимого белка клеток.
Пример 16. Биосинтез гибридного белка Was79 в колбах с использованием индуктора-ИПТГ
Биосинтез рекомбинантной L-аспарагиназы Was79 в колбах осуществляют следующим образом. Сначала получают посевную культуру. Для этого одну колонию штамма E. coli ECR-79 или штамма E. coli ВКПМ В-11955 засевают в пробирку, содержащую 3 мл среды YTS следующего состава (мас. %): дрожжевой экстракт - 1, триптон бакто - 2, NaCl - 1, канамицин - 0,003, вода - остальное. Культуру выращивают на роторной качалке со скоростью 250 об/мин в течение 18 часов при температуре 37°С.
На втором этапе выросшую посевную культуру переносят в среду для индукции. С этой целью 0,5 мл посевной культуры переносят в колбу, содержащую 50 мл среды следующего состава (мас. %): дрожжевой экстракт - 2,4; триптон бакто - 1,2; одномолярный фосфатный буфер (рН7) - 10; одномолярный раствор сульфата магния -0,2; NaCl - 1, канамицин - 0,009; вода - остальное. Культивирование в среде для индукции продолжают в тех же условиях в течение 2-3 часов до достижения культурой оптической плотности ОД600=1-2. Затем в среду вносят индуктор ИПТГ до конечной концентрации 1 мМ и продолжают культивирование в тех же условиях в течение 5-6 часов.
Полученную в результате культивирования биомассу осаждают центрифугированием в пластмассовых пробирках объемом 50 мл в течение 10 минут со скоростью 9000 об/мин с охлаждением (4°С). Надосадочную жидкость сливают. Клеточный осадок суспедируют в 30 мл буфера PBS следующего состава: 137 мМ NaCl, 2 мМ KCl, 10 мМ фосфатный буфер, pH 7,4, после чего вновь подвергают центрифугированию в течение 10 минут со скоростью 9000 об/мин с охлаждением (4°С). Надосадочную жидкость сливают, и остатки жидкости тщательно удаляют с помощью вакуумного насоса.
В результате культивирования получают 3 г биомассы штамма E. coli ECR-79 или 3 г биомассы штамма E. coli ВКПМ В-11955 с 1 литра культуры. Полученную биомассу замораживают и хранят при температуре минус 20°С.
Согласно данным анализа, выполненного методом электрофореза в полиакриламидном геле в денатурирующих условиях, содержание гибридного белка Was79 в биомассе штамма E. coli ECR-79 составляет 15%, а в биомассе штамма E. coli ВКПМ В-11955 - 17% относительно суммарного растворимого белка клеток.
Пример 17. Биосинтез гибридного белка Was79M в колбах с использованием индуктора-лактозы
Биосинтез гибридного белка Was79M в колбах осуществляют, как описано в примере 15 за исключением того, что культивируют штамм E. coli ECR-89.
В результате культивирования получают 15 г биомассы штамма E. coli ECR-89 с 1 литра культуры.
Полученную биомассу замораживают и хранят при температуре минус 20°С.
Согласно данным анализа, выполненного методом электрофореза в полиакриламидном геле в денатурирующих условиях, содержание рекомбинантной L-аспарагиназы Was79M в биомассе штамма E. coli ECR-89 составляет 25% относительно суммарного растворимого белка клеток.
Пример 18. Биосинтез рекомбинантной немодифицированной L-аспарагиназы Was02 в колбах
Биосинтез рекомбинантной немодифицированной L-аспарагиназы Was02 (контроль) в колбах осуществляют, как описано в примере 15 за исключением того, что культивируют штамм E. coli ECR-02.
В результате культивирования получают 15 г биомассы штамма E. coli ECR-02 с 1 литра культуры.
Полученную биомассу замораживают и хранят при температуре минус 20°С.
Согласно данным анализа, выполненного методом электрофореза в полиакриламидном геле в денатурирующих условиях, содержание рекомбинантной немодифицированной L-аспарагиназы Was02 в биомассе штамма E. coli ECR-02 составляет 25% относительно суммарного растворимого белка клеток.
Пример 19. Биосинтез гибридного белка Was79 в биореакторе
Биосинтез гибридного белка Was79 в биореакторе осуществляют следующим образом. На первом этапе одну колонию штамма E. coli ВКПМ В-11955 засевают в колбу, содержащую 50 мл среды YTS следующего состава (мас. %): дрожжевой экстракт 0207/0-MG-L ("Springer") - 1, пептон-140 соевый (Р-140, "Amresco") - 2, NaCl - 1, канамицин - 0,003, вода - остальное. Культуру выращивают на роторной качалке со скоростью 250 об/мин при температуре 37°С до оптической плотности ОД600=1,5.
На втором этапе 50 мл выросшей посевной культуры переносят в рабочую колбу биореактора «Applicon» (Applicon, Нидерланды) общим объемом 1 л, содержащую 450 мл стерильной среды следующего состава (на 1 л): дрожжевой экстракт 0207/0-MG-L ("Springer") - 24 г; пептон-140 соевый (Р-140, "Amresco") - 12; глюкоза - 10 г; пеногаситель А-204 ("Sigma") - 0,1 мл; сульфат аммония - 3,4 г; одномолярный фосфатный буфер (рН7) - 100 мл; одномолярный раствор сульфата магния - 2 мл; канамицин - 90 мг; вода - остальное.
Культивирование ведут 3 часа до истощения уровня глюкозы в культуральной среде до минимальных значений, используя следующие параметры ферментации: температура - 37°С; расход воздуха - 1 л\л\мин; скорость перемешивания культуры - 700 об\мин; pH=6,9±0,1 (pH-статирование культуры производят с помощью автоматической подтитровки растворами 10% H2SO4 и 10% аммиаком).
Далее в ферментер стерильно вносят 10 мл стерильного 50% раствора глюкозы и культивирование продолжают 1,5 часа. Затем в ферментер добавляют 50 мл 50% раствора глицерина (конечная концентрация 5%) и 25 мл 20% раствора лактозы (конечная концентрация 1%). Культивирование продолжают в течение 18-20 часов в тех же условиях.
По окончании ферментации культуру клеток штамма-продуцента центрифугируют при 4°С и 8000 об/мин в течение 30 мин. Надосадочную жидкость сливают. Клеточный осадок суспедируют в в буфере PBS следующего состава: 137 мМ NaCl, 2 мМ KCl, 10 мМ фосфатный буфер, pH 7,4, после чего вновь подвергают центрифугированию. Надосадочную жидкость сливают, и остатки жидкости тщательно удаляют с помощью вакуумного насоса.
В результате культивирования получают 60 г биомассы штамма E. coli ВКПМ В-11955 с 1 литра культуры.
Полученную биомассу замораживают и хранят при температуре минус 20°С, а в дальнейшем используют для выделения гибридного белка Was79.
Согласно данным анализа, выполненного методом электрофореза в полиакриламидном геле в денатурирующих условиях, содержание гибридного белка Was79 в биомассе штамма E. coli ВКПМ В-11955 составляет 20% относительно суммарного растворимого белка клеток.
Пример 20. Выделение и очистка гибридного белка Was79 из фракции нерастворимых белков
Для выделения и очистки гибридного белка Was79 из фракции нерастворимых белков используют биомассу штамма E. coli ECR-79 или биомассу штамма E. coli ВКПМ В-11955, полученную, как описано в примере 15 или в примере 19.
Стадия 1. Разрушение биомассы и получение нерастворимой фракции клеточного лизата
Биомассу (60 г) с суммарной аспарагиназной активностью 291000 ME ресуспендируют на ледяной бане в 1 л холодного 5 мМ калий-натрий фосфатного буфера, pH 7,0, содержащего 0,2 M NaCl и 5 мМ динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТА). К суспензии клеток добавляют 5 мл 0,2 M раствора фенилметилсульфонилфторида (PMSF), тщательно перемешивают на диспергаторе (IKA Т18 basic ULTRA-TURRAX, Германия). Разрушение клеток производят на дезинтеграторе APV1000 (APV1000, "SPX Flow Technology", США) при давлении 970 бар. Проводят 4 цикла, с охлаждением биомассы до 15°С между циклами.
В результате получают 1 л общего клеточного лизата, из которого после центрифугирования (25000 об/мин, 4°С, 60 мин) получают осадок в количестве 15 г, представляющий собой нерастворимую фракцию клеточного лизата.
Стадия 2. Экстрагирование гибридного белка Was79 из нерастворимой фракции клеточного лизата
Полученный на стадии 1 осадок (15 г) суспендируют в 0,5 л 10 мМ раствора натрия фосфата, содержащего 5 мМ ЭДТА и 1 M NaCl, pH 6,2 (буфер 1). Надосадочную жидкость отделяют центрифугированием, как описано выше.
Стадия 3. Очистка методом ионообменной хроматографии на колонке с сорбентом SP-Сефароза
Хроматографию проводят с помощью хроматографической системы AKTABasic, оснащенной программой UNICORN
К 0,5 л полученной на стадии 2 надосадочной жидкости прибавляют 0,27 л 10 мМ раствора натрия фосфата, содержащего 5 мМ ЭДТА, pH 6,2 (буфер 2). В результате получают 0,77 л разбавленного экстракта гибридного белка Was79, который наносят на колонку с SP-Сефарозой, уравновешенную 10 мМ раствором натрия фосфата, содержащим 5 мМ ЭДТА и 0,65 M NaCl, pH 6,2. Сорбент промывают этим же буфером, затем элюируют белок буфером 1. Полученный элюат (0,12 л) содержит гибридный белок Was79.
Стадия 4. Очистка методом ультрафильтрации
Ультрафильтрацию в тангенциальном потоке осуществляют на установке «VivaFlow» (Sartorius stedim, Германия) с использованием модуля ПЭС (общей площадью 0,02 м2) с отсекающим размером пор 50 кДа. Раствор гибридного белка Was79 (0,12 л), полученный на стадии 3, заливают в приемную емкость ультрафильтрационной установки и добавляют 0,65 л 20 мМ буфера Трис-HCl, pH 9,0, содержащего 5 мМ ЭДТА. Раствор концентрируют в 6 раз и к нему добавляют 0,66 л 20 мМ буфера Трис-HCl, pH 9,0, содержащего 5 мМ ЭДТА и 0,15 M NaCl и вновь концентрируют в 6 раз. Проводят эту процедуру дважды и получают раствор (0,10 л), содержащий гибридный белок Was79.
Стадия 5. Очистка методом ионообменной хроматографии на колонке с сорбентом HiTrapQ
Раствор со стадии 4 наносят на колонку HiTrapQ, уравновешенную охлажденным (4-8°С) раствором 0,15 M NaCl в 0,02 M Трис-HCl буфере, pH 9,0, содержащим 5 мМ ЭДТА. Проскок (около 100 мл) и промывку колонки этим же раствором (20 мл), содержащие Was79, объединяют. В результате получают 0,12 л раствора гибридного белка Was79.
Стадия 6. Очистка методом ионообменной хроматографии на колонке с SP-Сефарозой
К полученному на стадии 5 раствору гибридного белка Was79 (0,12 л) добавляют 30 мл 0,1 н. HCl до достижения pH 6,2. Затем наносят на колонку с сорбентом SP-Сефароза с объемной скоростью 4 мл/мин. Далее сорбент последовательно промывают буферными смесями, содержащими 0,2 M и 0,5 M NaCl в 0,01 M натрий-фосфатном буфере, pH 6,2, в присутствиии 5 мМ ЭДТА.
Целевой белок элюируют буферной смесью, содержащей 1 M NaCl.
Получают 0,04 л раствора гибридного белка Was79.
Стадия 7. Обессоливание раствора методом ультрафильтрации
Раствор гибридного белка Was79, полученный на стадии 6, обессоливают с помощью ультрафильтрации, используя мембрану и установку, описанные выше (стадия 4). К 0,04 л раствора гибридного белка Was79 добавляют 0,66 л очищенной воды и концентрируют в 6 раз. Процедуру повторяют еще три раза.
Получают 20 мл концентрата гибридного белка Was79.
В результате проведения семи стадий очистки получают раствор гибридного белка Was79 с суммарной аспарагиназной активностью 110000 ME. По данным электрофореза в полиакриламидном геле в денатурирующих условиях содержание основного белка в общем пуле белков очищенного препарата превышает 97%.
Пример 21. Выделение и очистка гибридного белка Was79 из фракции растворимых белков
Для выделения и очистки гибридного белка Was79 используют биомассу, указанную в примере 20.
Стадия 1. Разрушение биомассы и получение растворимой фракции клеточного лизата
Порцию биомассы (60 г) с суммарной аспарагиназной активностью 291000 ME ресуспендируют на ледяной бане в 1 л холодного 5 мМ калий-натрий фосфатного буфера, pH 7,0, содержащего 1 M NaCl и 5 мМ ЭДТА. К суспензии клеток добавляют 5 мл 0,2 M раствора PMSF. Далее разрушение клеток проводят как в примере 20.
В результате получают 1 л клеточного лизата, из которого после центрифугирования (25000 об/мин, 4°С, 60 мин) получают 0,98 л центрифугата, содержащего гибридный белок Was79. К нему добавляют 0,53 л буфера 2. В результате получают 1,51 л раствора, содержащего гибридный белок Was79
Дальнейшую очистку гибридного белка Was79 проводят согласно стадиям 3-7 примера 20 за исключением того, что стадия 2 не используется.
В результате очистки получен раствор гибридного белка Was79 с суммарной аспарагиназной активностью 106400 ME. По данным электрофореза в полиакриламидном геле в денатурирующих условиях содержание основного белка в общем пуле белков очищенного препарата превышает 97%.
Пример 22. Выделение и очистка гибридного белка Was79M из фракции растворимых белков
Для выделения и очистки гибридного белка Was79M из фракции растворимых белков используют биомассу штамма E. coli ECR-89, полученную, как описано в примере 17. Очистку проводят из 2 г биомассы с суммарной аспарагиназной активностью 9000 ME так же как в примере 21.
В результате очистки получают раствор гибридного белка Was79M с суммарной аспарагиназной активностью 2900 ME. По данным электрофореза в полиакриламидном геле в денатурирующих условиях содержание основного белка в общем пуле белков очищенного препарата превышает 95%.
Пример 23. Очистка рекомбинантной немодифицированной L-аспарагиназы Was02
Стадия 1. Разрушение биомассы и ультрафильтрация.
Биомассу штамма E. coli ECR-02 в количестве 50 г с суммарной аспарагиназной активностью 265000 ME размораживают при комнатной температуре и суспендируют в 450 мл 5 мМ фосфатного буфера Na2HPO4-KH2PO4 pH 6,0, содержащего 1М NaCl, 5 мМ ЭДТА, 1 мМ PMSF. Дезинтеграцию биомассы проводят в ячейке Френч-пресса (French Press, Thermo Electron Corp., model FA 078A-E240).
Затем для осаждения неразрушенных клеток и клеточных мембран проводят цетрифугирование при 9000g в течение 40 мин.
Образовавшийся центрифугат подвергают ультрафильтрации на установке «Владисарт» (ЗАО «Владисарт» Россия) на мембране PES (общая площадь 0,1 м2, отсекающий размер пор 50 кДа). Проводят трехкратную промывку центрифугата 5 мМ фосфатным буфером pH 6,0, содержащим 1 мМ PMSF и 1М NaCl (5 объемов фосфатного буфера / объем центрифугата в каждой промывке), затем в 10 раз промывают 5 мМ фосфатным буфером pH 6,0.
В результате получают раствор белка, который осветляют центрифугированием в течение 45 мин при 9000 g.
Стадия 2. Очистка методом ионообменной хроматографии на колонке с сорбентом SP-Сефароза
Центрифугат разводят в 8 раз 5 мМ фосфатным буфером pH 6,0 и наносят на колонку с SP-Сефарозой (GE Healthcare), (2,6 см * 11,4 см), уравновешенную этим же буфером (используют хроматограф ÄCTAprime фирмы GE Healthcare). Колонку промывают 60 мл уравновешивающего буфера. Сорбированную на SP-Сефарозе L-аспарагиназу элюируют линейным градиентом концентрации хлористого натрия от 0 M до 1 М. Собирают фракцию целевого белка в интервале 0,07-0,14 M градиента.
Стадия 3. Очистка методом ионообменной хроматографии на колонке с сорбентом Q-Сефароза
Полученную фракцию с целью уменьшения ионной силы до значения не более 1 мСм/см разводят в 16 раз водой и доводят до значения pH 9,5 с помощью 1 M NaOH. Затем наносят на колонку с Q-Сефарозой (1,6 см * 15 см) (GE Healthcare, Щвеция), предварительно уравновешенную 5 мМ Трис-HCl-буфером pH 9,5. Колонку промывают 5 мМ Трис-HCl-буфером pH 8,5. Сбор целевого белка начинают при достижении показаний спектрофотометра 8±1 mAu при длине волны 280 нм и заканчивают сбор после прохождения максимума пика при этом же значении.
Стадия 4. Очистка методом ультрафильтрации
Раствор белка со стадии 3 обессоливают и концентрируют с помощью ультрафильтрации в тангенциальном потоке на установке «VivaFlow» с использованием модуля PES (общая площадь 0,02 м2, отсекающий размер пор 50 кДа). Полученный концентрат (100 мл) осветляют центрифугированием в течение 10 мин при 28000g.
В результате проведения четырех стадий очистки получен раствор рекомбинантной немодифицированной L-аспарагиназы Was02 с суммарной аспарагиназной активностью 130000 ME. Содержание целевого белка в общем пуле белков по данным электрофореза в полиакриламидном геле в денатурирующих условиях превышает 95%.
Пример 24. Оценка аспарагиназной и глутаминазной активности очищенного белка
Специфическую аспарагиназную и неспецифическую глутаминазную активности очищенных гибридных белков Was79 или Was79M и немодифицированной рекомбинантной L-аспарагиназы Was02 (контроль) определяют путем проведения энзиматических реакций гидролиза аспарагина (специфическая активность) или глутамина (неспецифическая активность), протекающих с образованием аммиака, с последующим определением количества выделившегося аммиака по реакции с реактивом Несслера [Государственная фармакопея РФ, издание XII, часть 1, стр. 471].
Измерение аспарагиназной или глутаминазной энзиматической активности испытуемого белка осуществляют в две стадии: сначала проводят собственно энзиматическую реакцию гидролиза L-аспарагина или L-глутамина под действием испытуемого белка, а затем определяют количество аммиака, выделившегося в результате энзиматической реакции.
Проведение энзиматической реакции для определения специфической активности.
В микропробирку на 1,7 мл (Eppendorf) помещают 80 мкл 0,1 M раствора L-аспарагина (в качестве субстрата) и 300 мкл 0,1 M K-фосфатного буфера, pH 8,0, смесь нагревают до температуры 37°С, после чего в пробирку вносят 20 мкл раствора испытуемого белка и содержимое перемешивают. Реакционную смесь инкубируют в течение 15 мин при температуре 37°С. Реакцию останавливают добавлением 100 мкл раствора, содержащего 24,5 г трихлоруксусной кислоты в 100 мл воды, содержимое перемешивают, охлаждают до 20°С и центрифугируют 5 мин на настольной центрифуге с ускорением 20700 g.. Полученный раствор называют «испытуемым».
Проведение энзиматической реакции для определения неспецифической активности осуществляют так, как описано для определения специфической активности, за исключением того, что в реакционную смесь вносят в 10-20 раз большее количество испытуемого белка, а в качестве субстрата используют 0,1 M раствор L-глутамина.
Количественное определение выделившегося аммиака. К 80 мкл «испытуемого раствора» прибавляют по 80 мкл реактива Несслера, смесь инкубируют в течение 15 минут при комнатной температуре, после чего измеряют оптическую плотность результирующего раствора на спектрофотометре при длине волны 450 нм.
Удельную величину ферментативной активности испытуемого белка расчитывают, нормируя измеренную активность на концентрацию очищенного белка в исследуемом образце.
Определение концентрации L-аспарагиназы. Концентрацию испытуемого белка определяют по методу Брэдфорд с использованием реагента #R1271 (Fermentas) и прилагаемой к нему инструкции.
Измеренные величины удельной специфической аспарагиназной гибридных белков Was79, Was79M, контроля Was02 и коммерческой L-аспарагиназы "Медак» (Германия), а также уровень неспецифической глутаминазной активности этих белков приведены в табл. 2.
Данные табл. 2, показывают, что для всех испытуемых белков характерны близкие значения аспарагиназной активности. В то же время относительные уровни их глутаминазной активности различаются значительно. Гибридный белок в форме Was79 или Was79M обладает самым низким уровнем глутаминазной активности, примерно в 2 раза ниже уровня активности коммерческой L-аспарагиназы "Медак», и почти в 10 раз ниже уровня глутаминазной активности немодифицированной рекомбинантной L-аспарагиназы Was02.
Пример 25. Оценка способности гибридного белка, Was79 связывать гепарин
Способность гибридного белка Was79 специфически связывать гепарин устанавливают методом хроматографии, путем оценки взаимодействия с сорбентом, активированным гепарином, в следующих условиях.
Очищенный белок наносят на колонку, содержащую 1 мл сорбента HiTrap Heparin (GE Healthcare), уравновешенную 10 мМ фосфатным буфером pH 7,5, содержащем 0,15 M натрия хлорида, близко имитирующем состав плазмы крови животных.
Элюцию проводят градиентом концентрации натрия хлорида в том же буфере.
Для оценки способности гибридного белка Was79 специфически связывать гепарин используют следующие препараты:
- в качестве отрицательного контроля - препарат очищенного белка немодифицированной рекомбинантной L-аспарагиназы Was02. На колонку наносят 7 мл раствора белка с концентрацией 46,8 МЕ/мл в 10 мМ фосфатном буфере, pH 7,5, содержащем 0,15 М натрия хлорида;
- препарат очищенного гибридного белка Was79. На колонку наносят 10 мл раствора белка с концентрацией 27,8 МЕ/мл в 10 мМ фосфатном буфере, pH 7,5, содержащем 0,15 М натрия хлорида.
Как видно из результатов хроматографии, представленных на фиг. 1, контрольная немодифицированная L-аспарагиназа Was02 не взаимодействует с сорбентом и выходит в проскоке. В то же время, гибридный белок Was79, содержащий гепарин-связывающий пептид НВ1, задерживается на колонке, прочно взаимодействуя с сорбентом. Причем прочность этого взаимодействия достаточно велика, поскольку элюция белка с колонки достигается лишь в результате использовании раствора 0,75 М натрия хлорида.
Таким образом, эти данные иллюстрируют способность гибридного белка Was79 связывать гепарин. Эта способность обусловлена наличием в составе гибридного белка Was79 гепарин-связывающего пептида НВ1.
Пример 26. Оценка влияния гепарина на аспарагиназную активность гибридного белка
Оценку влияния гепарина на ферментативную активность гибридного белка Was79 и контроля Was02 проводят в присутствии и в отсутствии гепарина. Для этого исследуемые препараты инкубируют в реакционной смеси с аспарагином в 200 мкл буфера 25 мМ Трис-HCl, pH 7,4 в присутствии или отсутствии гепарина (36 USP единиц, 100 мкл, USP Ref St) в течение 50 мин при температуре 37°С. Концентрация гибридного белка Was79 или контроля Was02 в реакционной смеси составляет 0,5 мг/мл. Результаты представлены в табл.1.

Как показывают данные табл. 1, присутствие гепарина в реакционной смеси не оказывает ингибирующего влияния на аспарагиназную активность гибридного белка Was79 и контроля Was02.
Пример 27. Оценка противоопухолевой активности гибридного белка Was79 на модели лимфаденоза Фишера у мышей
Исследование проводят на опухолевой модели с использованием штамма лимфаденоза Фишера L5178y, который получают из Банка опухолевых штаммов РОНЦ им. Н.Н. Блохина РАМН. В опытах используют 3-й пассаж этого штамма in vivo. Опухоль трансплантируют мышам внутрибрюшинно по стандартной методике [Руководство под ред. Хабриева, 2005; Chabner & Longo, 2001]. Используют мышей-самок линии DBA2 массой тела 18-24 г, которых содержат при естественном освещении на брикетированном корме и постоянном доступе к воде. Перед лечением мышей распределяют на группы по 7 особей в каждой. Одну группу оставляют без специфического лечения и считают контрольной.
Препараты гибридного белка Was79, немодифицированной рекомбинантной L-аспарагиназы Was02 (контроль), а также коммерческую L-аспарагиназу «Медак» (Германия) используют в сопоставимом диапазоне доз. Препараты вводят 1 раз в день внутрибрюшинно (в/б) ежедневно в течение с 1-х по 10-е сутки после трансплантации опухолевых клеток в разовых дозах 500-8000 МЕ/кг в концентрации 50-200 МЕ/мл, растворитель - 0,9% раствор натрия хлорида. Мышам контрольной группы вводят 0,3 мл растворителя в/б в том же режиме.
Эффективность лечения оценивают по критерию полного излечивания мышей. Излеченными считают мышей, проживших более 60 суток с момента трансплантации опухоли без признаков опухолевого процесса на аутопсии (асцит, узловой рост, поражение брыжеечных лимфатических узлов) при условии, что все мыши контрольной группы погибают не позднее 25 суток, начиная с момента трансплантации опухоли [Руководство под ред. Хабриева, 2005; Chabner & Longo, 2001]. Уровень излечивания определяют как долю полностью излеченных мышей в каждой группе и выражают в процентных пунктах.
Из результатов эксперимента, представленных на фиг. 2, следует, что:
- в разовых дозах 1000, 2000, 4000 и 8000 МЕ/кг противоопухолевая активность гибридного белка Was79 превышает активность коммерческой L-аспарагиназы «Медак» по критерию излечения мышей;
- в разовых дозах 1000 и 2000 МЕ/кг противоопухолевая активность гибридного белка Was79 превышает активность контроля Was02 по критерию излечения мышей;
- в диапазоне разовых доз 2000, 4000 и 8000 МЕ/кг гибридный белок Was79 обеспечивает эффект полного 100%-ого излечения мышей, в отличие от препаратов сравнения Was02 и коммерческой L-аспарагиназы «Медак».
Таким образом, гибридный белок Was79 обладает более высокой противоопухолевой активностью, подтвержденной in vivo на модели лимфаденоза Фишера, по сравнению с коммерческой L-аспарагиназой «Медак» и контрольной немодифицированной L-аспарагиназой Was02.
Для наглядности свойства гибридного белка в форме Was79M или Was79, суммированы в таблице 2 в сравнении со свойствами контроля - L-аспарагиназы Was02 и коммерческого препарата L-аспарагиназы «Медак».
Данные таблицы 2 показывают, что заявляемый гибридный белок как в форме Was79, так и в форме Was79M обладает повышенной протеолитической стабильностью, отсутствующей у L-аспарагиназы Was02, а также пониженным в 2 и 10 раз уровнем глутаминазной активности по сравнению с препаратами L-аспарагиназ «Медак» и Was02, соответственно. При этом по уровню противоопухолевой активности заявляемый гибридный белок в форме Was79 значительно превосходит как немодифицированную рекомбинантную L-аспарагиназу Was02, так и коммерческую L-аспарагиназу «Медак», что делает его перспективным для практического использования.

Список цитируемых источников научно-технической информации
Бабский Е.Б., Косицкий Г.И., Ходоров Б.И. (1985). Физиология человека. Медицина (Москва), 560 стр.
Горошкова с соавт., 2008. Горошкова М.Ю. с соавт. (2008). Оптимизация терапии нативной Е. coli-аспарагиназой в протоколе ALL-MB 2002 у детей с острым лимфобластным лейкозом стандартной группы риска. Онкогематология, 3: 25-33.
Красоткина и Соколов, 2011; Красоткина Ю.В., Соколов Н.Н. (2011). О необходимости создания отечественного противоопухолевого препарата бактериальной L-аспарагиназы (обзор). Вопросы биологической, медицинской и фармацевтической химии, 7: 37-44.
Покровский с соавт., 2008; Покровский B.C., Лесная Н.А., Трещалина Е.М., Лукашева Е.В., Березов Т.Т. (2011). Перспективы разработки новых ферментных противоопухолевых препаратов. Вопросы онкологии, 57(2): 155-164.
Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ (2005). Под общей ред. Р.У. Хабриева. - 2 изд. - М. - Медицина. - С. 637-651.
Abribat, 2011; Abribat, T. (2011). Pegylated L-asparaginase. WO 2011003633.
Albanese & Kafkewitz, 1978; Albanese E. & Kafkewitz D. (1978). Effect of Medium Composition on the Growth and Asparaginase Production of Vibrio succinogenes. Applied and Environmental Microbiology, 36(1): 25-30.
Ali et al,, 2012; Ali M.M., Karasneh G.A., Jarding M.J., Tiwari V., Shukla D. (2012). A 3-O-Sulfated Heparan Sulfate Binding Peptide Preferentially Targets Herpes Simplex Virus 2-Infected Cells. Journal of Virology, 86(12): 6434-6443.
Appel et al,, 2006; Appel I.M., Hop W.C., Pieters R. (2006). Changes in hypercoagulability by asparaginase: a randomized study between two asparaginases. Blood Coagul Fibrinolysis, 17: 139-146.
Asselin, 1999; Asselin BL. (1999). The three asparaginases. Comparative pharmacology and optimal use in childhood leukemia. Adv Exp Med Biol, 457: 621-629.
Avramis et al., 2002; Avramis, V.I., Sencer, S., Periclou, A.P., Sather, H., Bostrom, B.C. & Cohen, L.J. (2002). A randomized comparison of native Escherichia coli asparaginase and polyethylene glycol conjugated asparaginase for treatment of children with newly diagnosed standard-risk acute lymphoblastic leukemia: a Children′s Cancer Group study. Blood, 99, 1986-1994.
Ben-Bassat & Bauer, 1987; Ben-Bassat Α., Bauer K. (1987). Amino-terminal processing of proteins. Nature 326, 315.
Bernfield et al., 1992; Bernfield M., Kokenyesi R., Kato M., Hinkes M.T., Spring J., Gallo R.L., Lose E.J. (1992). Biology of the syndecans: A Family of Transmembrane Heparan Sulfate Proteoglycans. Annu. Rev. Cell Bioi, 8: 365-393.
Billett et al., 1992; Billett AL, Carls A, Gelber RD, Sallan SE. (1992). Allergic reactions to Erwinia asparaginase in children with acute lymphoblastic leukemia who had previous allergic reactions to Escherichia colt asparaginase. Cancer, 70:201-206.
Bourin MC, Lindahl U. (1993). Glycosaminoglycans and the regulation of blood coagulation. Biochem J., 289(Pt 2): 313-330.
Bramono et al., 2012; Bramono DS, Murali S, Rai B, Ling L, Poh WT, Lim ZX, Stein GS, Nurcombe V, van Wijnen AJ, Cool SM. (2012). Bone marrow-derived heparan sulfate potentiates the osteogenic activity of bone morphogenetic protein-2 (BMP-2). Bone, 50(4):954-964
Cappelletti et al., 2008; Cappelletti D., Chiarelli L.R., Pasquetto M.V., Stivala S., Valentini G., Scotti C. (2008). Helicobacter pylori L-asparaginase: A promising chemotherapeutic agent. Biochem. Biophys. Res. Commun., 377: 1222-1226
Chan et al., 2014; Chan W.K., Lorenzi P.L., Anishkin Α., Purwaha P., Rogers D.M., Sukharev S., Rempe S.B., Weinstein J.N. (2014). The glutaminase activity of L-asparaginase is not required for anticancer activity against ASNS-negative cells. Blood, 123 (23): 3596-3606.
Chabner B.A., Longo D.L. (2001). Cancer Chemotherapy and Biotherapy: Principles and Practice. - 3rd ed., Philadelphia: Lippincott-Raven, - p. 678-699.
Chong et al., 1997; Chong S, Mersha FB, Comb DG, Scott ME, Landry D, Vence LM, Perler FB, Benner J, Kucera RB, Hirvonen CA, Pelletier JJ, Paulus H, Xu MQ. (1997). Single-column purification of free recombinant proteins using a self-cleavable affinity tag derived from a protein splicing element. Gene, 192(2): 271-281.
Covini et al., 2012; Covini D., Tardito S., Bussolati O., Chiarelli L.R., Pasquetto M.V., Digilio R., Valentini G., Scotti C. (2012). Expanding Targets for a Metabolic Therapy of Cancer: L-Asparaginase. Recent Patents on Anti-Cancer Drug Discovery, 7: 4-13.
Dechecchi et al., 2000; Dechecchi M.С., Tamanini Α., Bonizzato Α. & Cabrini G. (2000). Heparan sulfate glycosaminoglycans are involved in adenovirus type 5 and 2-host cell interactions. Virology 268, 382-390.
Dechecchi et al., 2001; Dechecchi, M.С., Melotti P., Bonizzato Α., Santacatterina M., Chilosi M. & Cabrini G. (2001) Heparan sulfate glycosaminoglycans are receptors sufficient to mediate the initial binding of adenovirus types 2 and 5. J Virol 75, 8772-8780.
Derst et al., 2000; Derst С., Henseling J., Röhm K.-H. (2000). Engineering the substrate specificity of Escherichia coli asparaginase II. Selective reduction of glutaminase activity by amino acid replacements at position 248. Protein Science, 9:2009-2017.
Distasio & Niederman, 1976; Distasio J.A., Niederman R.A. (1976). Purification And Characterization Of L-Asparaginase With Anti-Lymphoma Activity From Vibrio Succinogenes. J. Biol. Chem., 251: 6929-6933.
Distasio et al., 1977; Distasio J.A., Niederman R.A., Kafkewitz D. (1977). Antilymphoma Activity of a Glutaminase-Free L-Asparaginase of Microbial Origin. Exp Biol Med, 155: 528-531.
Distasio et al., 1982; Distasio J.Α., Salazar A.M., Nadji M., Durden D.L. (1982). Glutaminase-Free Asparaginase From Vibrio Succinogenes: An Antilymphoma Enzyme. Lacking Hepatotoxicity. Znt. J. Cancer, 30: 343-347.
Domenech C. et al. (2011). L-asparaginase loaded red blood cells in refractory or relapsing acute lymphoblastic leukaemia in children and adults: results of the GRASPALL 2005-01 randomized trial. British Journal of Haematology, 153: 58-65.
Dubrac et al., 2010; Dubrac Α., Quemener С, Lacazette Ε., Lopez F., Zanibellato С., Wu W.-G., Bikfalvi Α., Prats H. (2010). Functional divergence between 2 chemokines is conferred by single amino acid change. Blood, 116(22): 4703-4711.
Durden et al., 1983; Durden D.L., Salazar A.M., Distasio J.A. (1983). Kinetic analisys of hepatotoxicity associated with antineoplastic asparaginases. Cancer Res., 43: 1602-1605.
Duval et al., 2002; Duval M, Suciu S, Ferster A, Rialland X, Nelken B, Lutz P, et al. (2002) Comparison of Escherichia coli-asparaginase with Erwinia asparaginase in the treatment of childhood lymphoid malignancies: results of a randomized European Organisation for Research and Treatment of Cancer Children′s Leukemia Group phase 3 trial. Blood, 99: 2734-2739.
Eden et al., 1990; Eden O.B., Shaw M.P., Lilleyman J.S., Richards S. (1990). Non-randomised study comparing toxicity of Escherichia coli and Erwinia asparaginase in children with leukaemia. Med. Pediatr. Oncol., 18(6): 497-502.
Fong et al., 2010; Fong B.A., Wu W.-Y., Wood D.W. (2010). The potential role of self-cleaving purification tags in commercial-scale processes. Trends in Biotechnology, 28(5): 272-279.
Forsberg E, Pejler G, Ringvall M, Lunderius C, Tomasini-Johansson B, Kusche-Gullberg M, Eriksson I, Ledin J, Hellman L, Kjellén L. (1999). Abnormal mast cells in mice deficient in a heparin-synthesizing enzyme. Nature, 400(6746): 773-776.
Fu & Sakamoto, 2007; Fu CH, Sakamoto KM. (2007). PEG-asparaginase. Expert Opin Pharmacother, 8: 1977-1984.
Galdiero et al., 2013; Galdiero S, Falanga A, Tarallo R, Russo L, Galdiero E, Cantisani M, Morelli G, Galdiero M. (2013). Peptide inhibitors against herpes simplex virus infections. J Pept Sci., 19(3): 148-158.
Hamidi et al., 2007; Hamidi M., Zarrin A, Foroozesh M, Mohammadi-Samani S. (2007) Applications of carrier erythrocytes in delivery of biopharmaceuticals. J Control Release, 118: 145-160.
Jaccard et al., 2009; Jaccard Α., Petit В., Girault S. et al. (2009). L-asparaginase-based treatment of 15 western patients with extranodal NK/T-cell lymphoma and leukemia and a review of the literature. Ann Oncol., 20: 110-116.Obama et al., 1999; Obama К., Tara M., Niina К. (1999). L-asparaginase induced complete remission in Epstein-Barr virus positive, multidrug resistant, cutaneous T-cell lymphoma. Int. J. Hematol., 69: 260-262.
Jaccard et al., 2011; Jaccard A, Gachard N, Marin B, Rogez S, Audrain M, Suarez F, et al. (2011). Efficacy of L-asparaginase with methotrexate and dexamethasone (AspaMetDex regimen) in patients with refractory or relapsing extranodal NK/T-cell lymphoma, a phase 2 study. Blood, 117: 1834-9.
Jin et al., 1997; Jin L., Abrahams J.P., Skinner R., Petitou M., Pike R.N., Carrell R.W. (1997). The anticoagulant activation of antithrombin by heparin. Proc Natl Acad Sci USA, 94(26): 14683-14688.
Karlsson et al., 1988; Karlsson К, Lindahl U, Marklund SL. (1988). Binding of human extracellular superoxide dismutase С to sulphated glycosaminoglycans. Biochem J., 256(1): 29-33.
Kotzia et al., 2007; Kotzia G.A., Lappa K., Labrou N.E. (2007). Tailoring structure-function properties of L-asparaginase: Engineering resistance to trypsin cleavage. Biochem J., 404: 337-343.
Kravtzoff et al., 1990; Kravtzoff R, Ropars C, Laguerre M, Muh JP, Chassaigne M. (1990). Erythrocytes as carriers for L-asparaginase. Methodological and mouse in-vivo studies. J Pharm Pharmacol, 42: 473- 476.
Kravtzoff et al., 1996; Kravtzoff R, Colombat PH, Desbois I, et al. (1996). Tolerance evaluation of L-asparaginase loaded in red blood cells. Eur J Clin Pharmacol, 51: 221-225.
Kwon et al., 2009; Kwon YM, Chung HS, Moon C, et al. (2009). L-asparaginase encapsulated intact erythrocytes for treatment of acute lymphoblastic leukemia (ALL). J Control Release, 139: 182-189.
Lin et al., 2013; Lin L.T., Chen T.Y., Lin S.C., Chung C.Y., Lin T.C., Wang G.H., Anderson R., Lin C.C., Richardson C.D. (2013). Broad-spectrum antiviral activity of chebulagic acid and punicalagin against viruses that use glycosaminoglycans for entry. BMC Microbiology, 13:187
Lubkowski et al, 1996; Lubkowski J., Palm G.J., Gilliland G.L., Derst C., Rohm K.-H., Wlodawer A. (1996). Crystal structure and amino acid sequence of Wolinella succinogenes L-asparaginase. Eur. J. Biochem., 241: 201-207.
Newsted et al., 1995; Newsted W.J., Ramjeesingh M., Zywulko M., Rothstein S.J., Shami E.Y. (1995). Engineering resistance to trypsin inactivation into L-asparaginase through the production of a chimeric protein between the enzyme and a protective single-chain antibody. Enzyme and Microbial Technology, 17: 757-764.
Nicol et al., 2004; Nicol С.G., Graham, D., Miller, W.H., White, S.J., Smith, Τ.Α., Nicklin, S.Α., Stevenson, S.C. & Baker, A.H. (2004). Effect of adenovirus serotype 5 fiber and penton modifications on in vivo tropism in rats. Mol Ther 10, 344-354.
Martins et al., 1990; Martins MB, Jorge JC, Cruz ME. (1990) Acylation of L-asparaginase with total retention of enzymatic activity. Biochimie, 72: 671-5.
Martins et al., 1996; Martins B.M.A.F., Goncüalves A.P.V., Cruz M.E.M. (1996). Biochemical Characterization of an L-Asparaginase Bioconjugate. Bioconjugate Chem., 7: 430-435.
McKenzie E.A. (2007). Heparanase: a target for drug discovery in cancer and inflammation. British Journal of Pharmacology 151, 1-14
Offman et al., 2011; Offman M.N., Krol M., Patel N., Krishnan S., Liu J.Z., Saha V., Bates P.A. (2011). Rational engineering of L-asparaginase reveals importance of dual activity for cancer cell toxicity. Blood, 117: 1614-1621.
Patel et al., 2009; Patel Ν., Krishnan S., Offman M.N., et al. (2009). A dyad of lymphoblastic lysosomal cysteine proteases degrades the antileukemic drug L-asparaginase. J. Clin. Invest. 119: 1964-1973.
Perel et al., 2002; Perel Y, Auvrignon A, Leblanc Τ, Vannier J, Michel G, Nelken В, et al. (2002). Impact of addition of maintenance therapy to intensive induction and consolidation chemotherapy for childhood acute myeloblastic leukemia: results of a prospective randomized trial, LAME 89/91. Leucámie Aiqüe Myéloïde Enfant. J Clin Oncol, 20: 2774-2782.
Poznansky et al., 1982; Poznansky MJ, Shandling M, Salkie MA, Elliott JF, Lau E. (1982). Advantages in the use of L-asparaginase-albumin polymer as an antitumor agent. Cancer Res., 42(3): 1020-1025.
Ramjeesingh et al., 1992; Ramjeesingh M., Zywulko M., Rothstein Α., Shami E.Y. (1992). Monoclonal antibodies can protect L-asparaginase against inactivation by trypsin. Biotechnology, 10: 442-445.
Reinert et al., 2006; Reinert R.B., Oberle L.M., Wek S.A., Bunpo P., Wang X.P., Mileva I., Goodwin L.O., Aldrich C.J., Durden D.L., Mcnurlan M.A., Wek R.C., Anthony T.G. (2006). Role Of Glutamine Depletion In Directing Tissue-Specific Nutrient Stress Responses To L-Asparaginase. J. Biol. Chem., 281: 31222-31233.
Rosenberg & Damus, 1973; Rosenberg RD, Damus PS. (1973). The purification and mechanism of action of human antithrombin-heparin cofactor. J Biol Chem., 248: 6490-6505.
Rostand & Esko, 1997; Rostand K.S. & Esko J.D. (1997). Microbial adherence to and invasion through proteoglycans. Infect Immun 65, 1-8.
Shatzman A.R., Rosenberg M. (1987). Expression, identification, and characterization of recombinant gene products in Escherichia coll Methods Enzynol, 152: 661-673.
Scotti et al., 2011; Scotti С, Sommi Ρ, Pasquetto MV, Cappelletti D, Stivala S, Mignosi P, et al. (2011). Cell-cycle inhibition by Helicobacter pylori Lasparaginase. PLoS One, 5: e13892.
Shin et al., 2003; Shin H., Jo S., Mikos A.G. (2003). Biomimetic materials for tissue engineering. Biomaterials, 24: 4353-4364.
Smith et al., 2003a; Smith T.Α., Idamakanti, N., Marshall-Neff, J. & 12 other authors (2003a). Receptor interactions involved in adenoviral-mediated gene delivery after systemic administration in non-human primates. Hum Gene Ther 14, 1595-1604.
Smith et al., 2003b; Smith, Τ.Α., Idamakanti, N., Rollence, M.L., Marshall-Neff, J., Kim, J., Mulgrew, K., Nemerow, G.R., Kaleko, M. & Stevenson, S.C. (2003b). Adenovirus serotype 5 fiber shaft influences in vivo gene transfer in mice. Hum Gene Ther 14, 777-787.
Sommer & Rifkin, 1989; Sommer A, Rifkin DB. (1989). Interaction of heparin with human basic fibroblast growth factor: protection of the angiogenic protein from proteolytic degradation by a glycosaminoglycan. J Cell Physiol, 138(1): 215-220.
Tardito et al., 2007; Tardito S, Uggeri J, Bozzetti C, Bianchi MG, Rotoli BM, Franchi-Gazzola R, et al. (2007). The inhibition of glutamine synthetase sensitizes human sarcoma cells to L-asparaginase. Cancer Chemother Pharmacol, 60: 751-758.
Tiwari et al., 2011; Tiwari V., Liu J., Valyi-Nagy T., Shukla D. (2011). Anti-heparan Sulfate Peptides That Block Herpes Simplex Virus Infection in Vivo. The Journal of Biological Chemistry, 286(28): 25406-25415.
van den Berg, 2011; van den Berg H. (2011). Asparaginase revisited. Leuk Lymphoma; 52: 168-178.
van der Strate et al., 2001; van der Strate B.W., Beljaars L., Molema G., Harmsen M.C., Meijer D.K. (2001). Antiviral activities of lactoferrin. Antiviral. Res., 52(3), 225-239
Verma et al., 2007; Verma Ν., Kumar К., Kaur G., Anand S. (2007). L-asparaginase: a promising chemotherapeutic agent. Critical reviews in biotechnology, 27: 45-62.
Vrooman et al., 2010; Vrooman LM, Supko JG, Neuberg DS, et al. (2010). Erwinia asparaginase after allergy to E.coli asparaginase in children with acute lymphoblastic leukemia. Pediatr Blood Cancer, 54: 199-205.
Wu et al., 2006; Wu S.C., Yu J.C., Hsu S.H., Chen D.C. (2006). Artificial extracellular matrix proteins contain heparin-binding and RGD-containing domains to improve osteoblast-like cell attachment and growth. J Biomed Mater Res A, 79(3): 557-565.
Xia et al., 2012; Xia X., Babcock J.P., Blaber S.I., Harper K.M., Blaber M. (2012). Pharmacokinetic Properties of 2nd-Generation Fibroblast Growth Factor-1 Mutants for Therapeutic Application. PLOS ONE, 7(11): e48210.
Xu & Esko, 2014; Xu D., Esko J.D. (2014). Demystifying Heparan Sulfate-Protein Interactions. Annu. Rev. Biochem., 83: 129-157
Yong et al., 2003; Yong W., Zheng W., Zhang Y. et al. (2003). L-asparaginase-based regimen in the treatment of refractory midline nasal/nasal-type T/NK-cell lymphoma. Int. J. Hematol., 78: 163-167.
Zhang et al., 2005; Zhang YQ, Zhou WL, Shen WD, Chen YH, Zha XM, Shirai K, et al. (2005). Synthesis, characterization and immunogenicity of silk fibroin-L-asparaginase bioconjugates. JBiotechnol, 120: 315-26.
Zhao et al., 2010; Zhao В., Zhang С., Forsten-Williams K., Zhang J., Fannon M. (2010). Endothelial Cell Capture of Heparin-Binding Growth Factors under Flow. PLoS Computational Biology, 6(10): e1000971
| название | год | авторы | номер документа |
|---|---|---|---|
| МУТАНТНАЯ РЕКОМБИНАНТНАЯ L-АСПАРАГИНАЗА Wolinella succinogenes (ВАРИАНТЫ) | 2014 |
|
RU2545722C1 |
| Полипептид для понижения уровня сахара в крови на основе глюкагоноподобного пептида-1 человека, рекомбинантный штамм-продуцент E. coli и способ получения этого полипептида | 2016 |
|
RU2642260C1 |
| Генетическая конструкция, кодирующая предшественник белка YB-1 человека, штамм Escherichia coli - продуцент предшественника белка YB-1 человека, способ микробиологического синтеза этого предшественника | 2019 |
|
RU2728237C1 |
| Температурочувствительный мутантный интеин для нерастворимой экспрессии предшественника целевого белка | 2015 |
|
RU2619217C1 |
| ГИБРИДНЫЙ БЕЛОК (ВАРИАНТЫ), ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ГИБРИДНОГО БЕЛКА (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ БЕЗМЕТИОНИНОВОГО ИНТЕРФЕРОНА АЛЬФА-2 ЧЕЛОВЕКА | 2011 |
|
RU2453604C1 |
| Применение полипептида, полученного на основе глюкагоноподобного пептида 1 человека, в качестве средства для контроля за весом тела | 2017 |
|
RU2670983C1 |
| ГИБРИДНЫЙ БЕЛОК, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ГИБРИДНОГО БЕЛКА И СПОСОБ ПОЛУЧЕНИЯ БЕЗМЕТИОНИНОВОГО ИНТЕРФЕРОНА АЛЬФА-2b ЧЕЛОВЕКА ИЗ ЭТОГО ГИБРИДНОГО БЕЛКА | 2010 |
|
RU2441072C1 |
| МОДИФИЦИРОВАННЫЙ ГЕН tsA, КОДИРУЮЩИЙ ТЕРМОСТАБИЛЬНУЮ L-АСПАРАГИНАЗУ ИЗ АРХЕИ THERMOCOCCUS SIBIRICUS, РЕКОМБИНАНТНЫЙ ШТАММ ESCHERICHIA COLI - ПРОДУЦЕНТ ТЕРМОСТАБИЛЬНОЙ L-АСПАРАГИНАЗЫ И СПОСОБ ОЧИСТКИ ЭТОГО ФЕРМЕНТА | 2022 |
|
RU2794225C1 |
| СПОСОБ УЛУЧШЕНИЯ КАТАЛИТИЧЕСКИХ СВОЙСТВ ГИПЕРТЕРМОФИЛЬНЫХ L-АСПАРАГИНАЗ I ТИПА, L-АСПАРАГИНАЗА I ТИПА ИЗ ГИПЕРТЕРМОФИЛЬНОЙ АРХЕИ THERMOCOCCUS SIBIRICUS, ПОЛУЧЕННАЯ ТАКИМ СПОСОБОМ | 2023 |
|
RU2836049C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУБСТАНЦИИ РЕКОМБИНАНТНОЙ L-АСПАРАГИНАЗЫ ERWINIA CAROTOVORA | 2010 |
|
RU2441914C1 |









Изобретение относится к биотехнологии и представляет собой гибридный белок на основе мутантной рекомбинантной L-аспарагиназы бактерий Wolinella succinogenes с пониженной глутаминазной активностью и повышенной устойчивостью к действию трипсина, слитой с N-концевой аминокислотной последовательностью гепарин-связывающего пептида. Изобретение относится также к штаммам-продуцентам и к способу получения этого гибридного белка. Изобретение позволяет расширить ассортимент гибридных белков на основе аспарагиназы, обладающих противоопухолевой активностью. 4 н.п. ф-лы, 2 ил., 2 табл., 27 пр.
1. Гибридный белок, обладающий противоопухолевой активностью и заключающий в своем составе аминокислотную последовательность мутантной L-аспарагиназы бактерий Wolinella succinogenes, в которой аминокислотный остаток валина в положении 23 природной последовательности заменен на аминокислотный остаток глутамина, а аминокислотный остаток лизина в положении 24 природной последовательности заменен на остаток треонина, слитую с аминокислотной последовательностью гепарин-связывающего пептида НВ1, где гибридный белок имеет последовательность, указанную в SEQ ID NO: 3, или последовательность, указанную в положениях 161-508 SEQ ID NO: 1.
2. Штамм Escherichia coli ECR-89 - продуцент гибридного белка по п. 1, имеющего последовательность SEQ ID NO: 3, полученный путем трансформации реципиентного штамма E. coli BL21(DE3) плазмидой pET28-Was89, сконструированной на основе вектора pET28b(+) и содержащей структурный ген гибридного белка, имеющего последовательность SEQ ID NO: 3.
3. Штамм Escherichia coli ВКПМ В-11955 - продуцент гибридного белка по п. 1, имеющего последовательность, указанную в положениях 161-508 SEQ ID NO: 1.
4. Способ получения гибридного белка по п. 1, имеющего последовательность, указанную в положениях 161-508 SEQ ID NO: 1, путем культивирования штамма по п. 3 в условиях, обеспечивающих рост клеток этого штамма и биосинтез гибридного белка, с последующим отделением полученной клеточной биомассы и выделением из нее гибридного белка в условиях, обеспечивающих перевод гибридного белка либо во фракцию растворимых клеточных белков, либо во фракцию нерастворимых клеточных белков, и дальнейшей очисткой гибридного белка из белоксодержащей фракции с использованием методов ионообменной хроматографии и ультрафильтрации.
| Устройство для очистки от снега железнодорожных путей | 1929 |
|
SU17305A1 |
| LUBKOWSKI J et al | |||
| Crystal structure and amino acid sequence of Wolinella succinogenes L-asparaginase, Eur J Biochem | |||
| Предохранительное устройство для паровых котлов, работающих на нефти | 1922 |
|
SU1996A1 |
| REINERT RB et al | |||
| Role of glutamine depletion in directing tissue-specific nutrient stress responses to L-asparaginase, J Biol Chem | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
Авторы
Даты
2015-09-10—Публикация
2014-10-09—Подача