Область техники
Настоящим документом предусмотрены способы, соединения и композиции для ослабления экспрессии мРНК и белка гентингтина у животного. Такие способы, соединения и композиции применимы, на пример, для лечения, профилактики или облегчения болезни Гентингтона.
Уровень техники
Болезнь Гентингтона (БГ) является тяжелым аутосомным доминантным нейродегенеративным заболеванием, вызванным экспансией тринуклеотидных CAG-повторов, кодирующих аномально длинный полиглутаминовый (PolyQ) участок в белке гентингтине. Ген болезни Гентингтона впервые картировали в 1993 г. (The Huntington's Disease Collaborative Research Group. Cell. 1993, 72:971-83), он состоит из гена IT15, который содержит полиморфный тринуклеотидный повтор, являющийся удлиненным и нестабильным в хромосомах БГ. Хотя повторы CAG в диапазоне нормального размера обычно наследуются как менделевские аллели, удлиненные повторы БГ являются нестабильными при мейотической передаче и, как обнаружили, превышают диапазон нормального размера (6-34 единицы повтора) у больных БГ.
И нормальный, и вариантный белки гентингтина локализованы главным образом в цитоплазме нейронов (DiFiglia et al., Neuron 1995, 14:1075-81). В результате чрезмерной длины полиглутамина белок гентингтина образует агрегаты в цитоплазме и в ядре нейронов ЦНС (Davies et al., Cell 1997, 90:537-548). Для исследования эффектов удлиненных polyQ повторов на локализацию и процессинг гентингтина использовали и трансгенных животных, и линии генно-модифицированных клеток. Однако все еще неясно, является ли образование агрегатов per se важным цитотоксическим этапом или следствием клеточной дисфункции.
БГ характеризуется развитием хореи, психиатрических изменений и умственного ухудшения. Это доминирующее нарушение поражает в равной степени как мужчин, так и женщин и наблюдается у всех рас (Gusella and MacDonald, Curr. Opin. Neurobiol. 1995 5:656-62). Симптомы БГ возникают в результате гибели нейронов во многих участках головного мозга, но чаще всего это наблюдается в полосатом теле, в частности, в хвостатом ядре, которое претерпевает нарастающую потерю клеток, что в конечном счете уничтожает всю структуру. Хотя ген, кодирующий гентингтин, экспрессируется убиквитарно (Strong, T.V. et al., Nat. Genet. 1995, 5:259-263), селективная потеря клеток и фибриллярный астроцитоз наблюдаются в головном мозге, в частности, в хвостатом ядре и ограде полосатого тела, а также в коре головного мозга больных БГ (Vonsattel, J-P. et al., Neuropathol. Exp.Neurol. 1985, 44:559-577), и в меньшей степени в гиппокампе (Spargo, E. et al., J. Neurol. Neurosurg. Psychiatry 1993, 56:487-491) и в субталамусе (Byers, R.K. et al., Neurology 1973, 23:561-569).
Гентингтин важен для нормального развития и может рассматриваться как ген выживания клеток (Nasir et al., Human Molecular Genetics, Vol 5, 1431-1435). Нормальная функция гентингтина о стается н е полностью охарактеризованной, но на основе белок-белковых взаимодействий полагают, что она связана с цитоскелетом и необходима для развития нервной клетки (Walling et al., J. Neurosci Res. 1998, 54:301-8). Гентингтин специфично расщепляется во время апоптоза ключевой цистеиновой протеазой апопаином, как известно, играющей основную роль в апоптической клеточной смерти. Скорость расщепления усиливается более длинными полиглутаминовыми участками, что указывает на то, что в основе БГ лежит неадекватный апоптоз.
Метод на основе использования антисмысловых соединений становится эффективным средством для ослабления экспрессии специфичных генных продуктов и, следовательно, может оказаться исключительно применимым в ряде терапевтических, диагностических и исследовательских применений для модуляции экспрессии гентингтина (см. патентные публикации США №№2008/0039418 и 2007/0299027).
Антисмысловые соеди нения для модуляции э кспрессии гентингтина раскрыты в вышеупомянутых опубликованных патентных заявках. Однако остается потребность в дополнительных таких соединениях.
Сущность изобретения
Настоящим документом предусмотрены способы, соединения и композиции для модуляции экспрессии гентингтина и лечения, профилактики, замедления или облегчения болезни Гентингтона и/или ее симптома.
Краткое описание чертежей
Фиг.1
Отношение PK/PD экспрессии мРНК гентингтина в ткани полосатого тела с концентрацией ISIS 387898 в головном мозге мыши. Мышам C57/BL6 вводили один болюс 50 мкг ISIS 387898 и измеряли экспрессию мРНК гентингтина, а также концентрацию антисмыслового олигонуклеотида в ткани. Также рассчитывали ЕС50 ISIS 387898.
Фиг.2
Сравнение экспрессии мРНК гентингтина в ткани полосатого тела и концентрации ISIS 387898 в различных точках времени. Мышам C57/BL6 вводили один болюс 50 мкг ISIS 387898 и измеряли экспрессию мРНК гентингтина, а также концентрацию антисмыслового олигонуклеотида в ткани. Продолжительность действия (измеренная по экспрессии htt мРНК) ISIS 387898 (пунктирная линия), как наблюдали, была больше, даже после концентрации олигонуклеотида (сплошная линия) в ткани.
Фиг.3
Отношение PK/PD экспрессии мРНК гентингтина в ткани передней коры с концентрацией ISIS 387898 в головном мозге мыши. Мышам BACHD вводили внутрицеребровентрикулярную инфузию 75 мкг ISIS 387898 в течение 2 недель и измеряли экспрессию мРНК гентингтина, а также концентрацию антисмыслового олигонуклеотида в ткани. Также рассчитывали EC50 ISIS 387898.
Фиг.4
Сравнение экспрессии мРНК гентингтина в ткани передней коры и концентрации ISIS 387898 в различных точках времени. Мышам BACHD вводили внутрицеребровентрикулярную инфузию 75 мкг ISIS 387898 в течение 2 недель и измеряли экспрессию мРНК гентингтина, а также концентрацию антисмыслового олигонуклеотида в ткани. Продолжительность действия (измеренная по экспрессии htt мРНК) ISIS 387898 (пунктирная линия), как наблюдали, была больше, даже после концентрации олигонуклеотида (сплошная линия) в ткани.
Фиг.5
Сравнение экспрессии мРНК гентингтина в ткани задней коры и концентрации ISIS 388241 в различных точках времени. Мышам BACHD вводили внутрицеребровентрикулярную инфузию 50 мкг ISIS 388241 в течение 2 недель и измеряли экспрессию мРНК гентингтина, а также концентрацию антисмыслового олигонуклеотида в ткани. Продолжительность действия (измеренная по экспрессии htt мРНК) ISIS 388241 (пунктирная линия), как наблюдали, была больше, даже после концентрации олигонуклеотида (сплошная линия) в ткани.
Фиг.6
Сравнение экспрессии мРНК гентингтина в ткани задней коры и концентрации ISIS 443139 точках времени. Мышам BACHD вводили внутрицеребровентрикулярную инфузию 50 мкг ISIS 443139 в течение 2 недель и измеряли экспрессию мРНК гентингтина, а также концентрацию антисмыслового олигонуклеотида в ткани. Продолжительность действия (измеренная по экспрессии htt мРНК) ISIS 443139 (пунктирная линия), как наблюдали, была больше, даже после концентрации олигонуклеотида (сплошная линия) в ткани.
Фиг.7
Эффект обработки антисмысловым олигонуклеотидом на двигательную характеристику мышей BACHD с использованием анализа с вращающимся стержнем. Мышей BACHD обрабатывали 50 мкг/сутки ICV ISIS 388241 или PBS в течение двух недель. Контрольные группы нетрансгенных детенышей одного помета обрабатывали подобным образом ISIS 388241 или PBS. Затем выполняли анализ с ускоряющимся вращающимся стержнем. Животных помещали на вращающийся стержень при скорости 2 оборота в минуту; вращающийся стержень ускоряли до 40 оборотов в минуту за 5 минут.Регистрировали отрезок времени до падения. Исходные значения в 6-месячном возрасте брали перед лечением, и данными точками времени являлся возраст мышей, в котором выполняли анализ. Столбики представляют длительность периода до падения в секундах у мышей BACHD, обработанных ISIS 388241 (черный); у мышей BACHD, обработанных PBS (заштрихованный); и у нетрансгенных детенышей одного помета, обработанных PBS (белый). У обработанных ISIS 388241 мышей наблюдали увеличенный отрезок времени до падения и, следовательно, улучшенную двигательную характеристику на вращающемся стержне по сравнению с контролем PBS.
Фиг.8
Эффект обработки антисмысловым олигонуклеотидом на массу головного мозга мышей R6/2. Шестимесячных мышей R6/2 обрабатывали 50 мкг/сутки ICV ISIS 388817 или контрольным олигонуклеотидом ISIS 141923 или PBS в течение 4 недель. Контрольные группы нетрансгенных детенышей одного помета обрабатывали подобным образом ISIS 388817 или PBS. В исследование включали контрольную группу восьминедельных не проявляющих симптомов мышей R6/2, не получающих какой-либо обработки. Столбики представляют массу головного мозга восьминедельных необработанных мышей R6/2; мышей R6/2, обработанных ISIS 141923; мышей R6/2, обработанных PBS; мышей R6/2, обработанных ISIS 388817; нетрансгенных детенышей одного помета, обработанных PBS; и нетрансгенных детенышей одного помета, обработанных ISIS 388817. У мышей R6/2, обработанных ISIS 388817, была увеличена масса головного мозга по сравнению с контролем PBS.
Фиг.9
Поведенческая характеристика обработанных антисмысловым олигонуклеотидом мышей YAC128 с использованием анализа открытого поля. П ятимесячных мышей YAC128 обрабатывали 50 мкг/сутки ICV ISIS 388241 или контрольным олигонуклеотидом ISIS 141923 или PBS в течение 14 дней. В исследование включали нетрансгенных детенышей одного помета FVB/NJ, не получающих какой-либо обработки. Мышей помещали на арену открытого поля с применением прерываний луча света для измерения горизонтального и вертикального передвижений за 30-минутный сеанс тестирования. Данные анализировали с использованием программного обеспечения Activity Monitor для проверки полного передвижения в виде ходьбы по арене и передвижения в центре арены как меры тревожности. Столбики представляют время в секундах, проведенное в центре поля мышами FVB/NJ, мышами YAC128, обработанными PBS, и мышами YAC128, обработанными ISIS 388241. Мыши YAC128, обработанные ISIS 388241, провели больше времени в центре и, следовательно, считались менее склонными к тревожности, чем контроль PBS.
Фиг.10
Поведенческая характеристика обработанных антисмысловым олигонуклеотидом мышей YAC128 с использованием анализа с приподнятым крестообразным лабиринтом. Пятимесячных мышей YAC128 обрабатывали 50 мкг/сутки ICV ISIS 388241, или контрольным олигонуклеотидом ISIS 141923, или PBS в течение 14 дней. В качестве необработанного контроля включали контрольную группу нетрансгенных детенышей одного помета FVB/NJ. Мышей помещали в центр аппарата, который состоял из двух открытых отделений и двух закрытых отделений, каждый размером 65х6,25 см, и приподнимали на 50 см над поверхностью. Регистрировали расположение мышей в аппарате и количество времени, проведенного в открытых отделениях, за 5-минутный сеанс тестирования как меру тревожности. Столбики представляют процентное отношение времени, проведенного в открытых отделениях контрольными мышами FVB/NJ, мышами YAC128, обработанными PBS, и мышами YAC128, обработанными ISIS 388241. Мыши YAC128, обработанные ISIS 388241, провели больше времени в открытых отделениях и, следовательно, считались менее склонными к тревожности, чем контроль PBS.
Подробное описание изобретения
Следует понимать, что и приведенное выше краткое раскрытие, и последующее подробное раскрытие являются иллюстративными и исключительно пояснительными, а не ограничивают заявленное настоящее изобретение. В настоящем документе применение единственного числа предусматривает множественное число, если конкретно не указано иное. Как используется в настоящем документе, применение «или» означает «и/или», если не указано иное. Кроме того, применение термина «содержащий», а также других форм, таких как «содержит» и «содержащийся», не является ограничивающим. Также термины, такие как «элемент» или «компонент», охватывают и элементы, и компоненты, содержащие одну единицу, а также и элементы, и компоненты, которые содержат более чем одну субъединицу, если конкретно не указано иное.
Подзаголовки разделов, используемые в настоящем документе, служат исключительно организационным целям и не должны истолковываться как ограничивающие описываемый субъект.Все документы или части документов, цитированные в настоящей заявке, включая без ограничения патенты, заявки на выдачу патента, статьи, книги и научные труды, тем самым определенно включены ссылкой как части документа, обсуждаемого в настоящем документе, а также во всей их полноте.
Определения
Если не представлены особенные определения, номенклатура, используемая по отношению к перечисленному далее, процедуры и методы аналитической химии, химии органического синтеза, а также медицинской и фармацевтической химии, описанные в настоящем документе, хорошо известны и широко применимы в предшествующем уровне техники. Стандартные методы могут быть использованы для химического синтеза и химического анализа. Там, где это допустимо, все патенты, заявки, опубликованные заявки и другие публикации, номера доступа в GENBANK и связанная с ними информация о последовательностях, доступная в базах данных, таких как Национальный центр биотехнологической информации (NCBI), и другие данные, упомянутые в раскрытии настоящего документа, включены посредством ссылки на части документа, обсуждаемого в настоящем документе, а также во всей их полноте.
Если не указано иное, следующие выражения характеризуются следующими значениями.
Термин «2'-O-метоксиэтил» (также 2'-МОЕ и 2'-O(СН2)2-ОСН3) относится к модификации O-метоксиэтила в 2'-положении фурозильного кольца. 2'-O-метоксиэтил-модифицированный сахар является модифицированным сахаром.
Термин «2'-O-метоксиэтилнуклеотид» означает нуклеотид, содержащий 2'-O-метоксиэтил-модифицированную сахарную часть.
Термин «5-метилцитозин» означает цитозин, модифицированный метильной группой, присоединенной в 5'-положении. 5-Метилцитозин является модифицированным нуклеотидным основанием.
Термин «активное фармацевтическое средство» означает вещество или вещества в фармацевтической композиции, которые обеспечивают терапевтическое благоприятное воздействие при введении субъекту. Например, согласно определенным вариантам осуществления активным фармацевтическим средством является антисмысловой олиго нуклеотид, нацеленный на гентингтин.
Термин «активный мишеневый участок» или «мишеневый участок» означает участок, на который нацелены одно или несколько активных антисмысловых соединений. Термин «активные антисмысловые соединения» означает антисмысловые соединения, которые снижают содержание мишеневой нуклеиновой кислоты или содержание белка.
Термин «вводимые одновременно» относится к совместному введению двух средств каким-либо путем, при котором фармакологические эффекты обоих проявляются у пациента в одно и то же время. Одновременное введение не требует, чтобы оба средства вводились в одной фармацевтической композиции, в одной лекарственной форме или одним и тем же путем введения. Эффекты обоих средств не должны проявляться в одно и то же время. Эффекты только должны перекрываться за период времени и не должны быть совпадающими.
Термин «введение» означает предоставление фармацевтического средства субъекту и предусматривает без ограничения введение медиком и самостоятельное введение.
Термин «облегчение» относится к уменьшению по меньшей мере одного показателя, признака или симптома ассоциированного заболевания, нарушения или состояния. Тяжесть показателей может быть определена субъективными или объективными измерениями, к оторые известны специалистам в настоящей области техники.
Термин «животное» относится к человеку или отличному от человека животному, включая без ограничения мышей, крыс, кроликов, собак, кошек, свиней и отличных от человека приматов, включая без ограничения обезьян и шимпанзе.
Термин «антисмысловая активность» означает какую-либо выявляемую или измеряемую активность, свойственную гибридизацию антисмыслового соединения с его мишеневой нуклеиновой кислотой. Согласно определенным вариантам осуществления антисмысловая активность заключается в снижении количества или экспрессии мишеневой нуклеиновой кислоты или белка, кодируемого такой мишеневой нуклеиновой кислотой.
Термин «антисмысловое соединение» означает олигомерное соединение, которое способно претерпевать гибридизацию с мишеневой нуклеиновой кислотой посредством водородной связи.
Термин «антисмысловое ингибирование» означает снижение содержания мишеневой нуклеиновой кислоты или содержания мишеневого белка в присутствии антисмыслового соединения, комплементарного мишеневой нуклеиновой кислоте, по сравнению с содержанием мишеневой нуклеиновой кислоты или содержания мишеневого белка в отсутствие антисмыслового соединения.
Термин «антисмысловой олигонуклеотид» означает одноцепочечный олигонуклеотид, характеризующийся последовательностью нуклеотидных оснований, которая обеспечивает гибридизацию с соответствующим участком или сегментом мишеневой нуклеиновой кислоты.
Термин «бициклический сахар» означает фурозильное кольцо, модифицированное путем образования мостиковой связи двух негеминальных кольцевых атомов. Бициклический сахар является модифицированным сахаром.
Термин «бициклическая нуклеиновая кислота» или «BNA» относится к нуклеозиду или нуклеотиду, где фуранозная часть нуклеозида или нуклеотида содержит мостик, соединяющий два атома углерода в фуранозном кольце, таким образом, образуя бициклическую кольцевую систему.
Термин «кэп-структура» или «концевая кэп-часть» означает химические модификации, которые были включены на одном из двух концов антисмыслового соединения.
Термин «химически отличающийся участок» относится к участку антисмыслового соединения, который некоторым образом химически отличается от другого участка того же антисмыслового соединения. Например, участок, содержащий 2'-O-метоксиэтильные нуклеотиды, является химически отличающимся от участка, содержащего нуклеотиды без 2'-O-метоксиэтильных модификаций.
Термин «химерное антисмысловое соединение» означает антисмысловое соединение, которое содержит по меньшей мере два химически отличающихся участка.
Термин «совместное введение» означает введение двух или более фармацевтических средств субъекту. Два или более фармацевтических средства могут находиться в одной фармацевтической композиции или могут находиться в отдельных фармацевтических композициях. Каждое из двух или более фар мацевтических средств может быть введено одним и тем же или различными путями введения. Совместное введение подразумевает параллельное или последовательное введение.
Термин «комплементарность» означает способность к спариванию между нуклеотидными основаниями первой нуклеиновой кислоты и второй нуклеиновой кислоты.
Термин «смежные нуклеотидные основания» означают нуклеотидные основания, непосредственно прилегающие друг к другу.
Термин «разбавитель» означает ингредиент композиции, который не обладает фармакологической активностью, но фармацевтически необходим или желателен. Например, разбавителем в инъекционной композиции может быть жидкость, например, солевой раствор.
Термин «доза» означает определенное количество фармацевтического средства, введенного в одном введении или за определенный период времени. Согласно определенным вариантам осуществления доза может быть введена в виде одного, двух или более болюсов, таблеток или инъекций. Например, согласно определенным вариантам осуществления, когда желательно подкожное введение, для желаемой дозы необходим объем, который не помещается в одной инъекции, следовательно, могут быть использованы две или более инъекции для достижения желаемой дозы. Согласно определенным вариантам осуществления фармацевтическое средство вводится путем инфузии в течение длительного периода времени или постоянно. Дозы могут быть установлены как количество фармацевтического средства в час, сутки, неделю или месяц.
Термин «эффективное количество» означает количество активного фармацевтического средства, достаточное для достижения желаемого физиологического результата у субъекта, нуждающегося в указанном средстве. Эффективное количество может быть разным для субъектов в зависимости от состояния здоровья и физического состояния субъекта, подлежащего лечению, таксономической группы субъектов, подлежащих лечению, состава композиции, оценки клинического состояния субъекта и других соответствующих факторов.
Термин «нуклеиновая кислота гентингтина» означает какую-либо нуклеиновую кислоту, кодирующую гентингтин. Например, согласно определенным вариантам осуществления нуклеиновая кислота гентингтина содержит последовательность ДНК, кодирующую гентингтин, последовательность РНК, транскрибированную с ДНК, кодирующей гентингтин (в том числе геномной ДНК, содержащей интроны и экзоны), и последовательность мРНК, кодирующую гентингтин. Термин «мРНК гентингтина» означает мРНК, кодирующую белок гентингтин.
Термин «полностью комплементарное» или «на 100% комплементарное» означает, что каждое нуклеотидное основание последовательности нуклеотидных оснований первой нуклеиновой кислоты имеет комплементарное нуклеотидное основание во второй последовательности нуклеотидных оснований второй нуклеиновой кислоты. Согласно определенным вариантам осуществления первой нуклеиновой кислотой является антисмысловое соединение, а мишеневая нуклеиновая кислота является второй нуклеиновой кислотой.
Термин «гэпмер» означает химерное антисмысловое соединение, в котором внутренний участок, содержащий несколько нуклеозидов, которые обеспечивают расщепление РНКазой Н, расположен между внешними участками, содержащими один или несколько нуклеозидов, где нуклеозиды внутреннего участка химически отличаются от нуклеозида или нуклеозидов внешних участков. Внутренний участок может быть назван «гэп-сегментом», а внешние участки могут быть названы «фланкирующими сегментами».
Термин «гэп-фланкированный» означает химерное антисмысловое соединение, содержащее гэп-сегмент из 12 или более смежных 2'-дезоксирибонуклеозидов, расположенных между 5'- и 3'-фланкирующими сегментами, содержащими от одного до шести нуклеозидов, и непосредственно прилегающих к ним.
Термин «гибридизация» означает отжиг комплементарной молекулы нуклеиновой кислоты. Согласно определенным вариантам осуществления комплементарные молекулы нуклеиновой кислоты содержат антисмысловое соединение и мишеневую нуклеиновую кислоту.
Термин «непосредственно прилегающие» означает отсутствие промежуточных элементов между непосредственно прилегающими элементами.
Термин «субъект» означает человека или отличного от человека животного, выбранного для лечения или терапии.
Термин «межнуклеозидная связь» относится к химической связи между нуклеозидами.
Термин «связанные нуклеозиды» означают прилегающие нуклеозиды, которые связаны вместе.
Термин «ошибочное спаривание» или «некомплементарное нуклеотидное основание» относится к случаю, когда нуклеотидное основание первой нуклеиновой кислоты не способно спариваться с соответствующим нуклеотидным основанием второй или мишеневой нуклеиновой кислоты.
Термин «модифицированная межнуклеозидная связь» относится к замене или какому-либо изменению природной межнуклеозидной связи (т.е. фосфодиэфирной межнуклеозидной связи).
Термин «модифицированное нуклеотидное основание» относится к какому-либо нуклеотидному основанию, отличному от аденина, цитозина, гуанина, тимидина или урацила. Термин «немодифицированное нуклеотидное основание» означает пуриновые основания - аденин (А) и гуанин (G), и пиримидиновые основания - тимин (Т), цитозин (С) и урацил (U).
Термин «модифицированный нуклеотид» означает нуклеотид, независимо содержащий модифицированную сахарную часть, модифицированную межнуклеозидную связь или модифицированное нуклеотидное основание. Термин «модифицированный нуклеозид» означает нуклеозид, независимо содержащий модифицированную сахарную часть или модифицированное нуклеотидное основание.
Термин «модифицированный олигонуклеотид» означает олигонуклеотид, содержащий по меньшей мере один модифицированный нуклеотид.
Термин «модифицированный сахар» относится к замене или изменению в нормальном сахаре.
Термин «мотив» означает паттерн химически отличающихся участков в антисмысловом соединении.
Термин «природная межнуклеозидная связь» означает 3'- - 5'-фосфодиэфирную связь.
Термин «природная сахарная часть» означает сахар, встречающийся в ДНК (2'-Н) или РНК (2'-ОН).
Термин «нуклеиновая кислота» относится к молекулам, состоящим из мономерных нуклеотидов. Нуклеиновая кислота включает в себя рибонуклеиновые кислоты (РНК), дезоксирибонуклеиновые кислоты (ДНК), одноцепочечные нуклеиновые кислоты, двухцепочечные нуклеиновые кислоты, малые интерферирующие рибонуклеиновые кислоты (siRNA) и ми кроРНК (miRNA). Нуклеиновая кислота также может содержать комбинацию из этих элементов в одной молекуле.
Термин «нуклеотидное основание» означает гетероциклическую часть, способную к спариванию с основанием другой нуклеиновой кислоты.
Термин «последовательность нуклеотидных оснований» означает порядок смежных нуклеотидных оснований, независимый от какой-либо модификации сахара, связи или нуклеотидного основания.
Термин «нуклеозид» означает нуклеотидное основание, связанное с сахаром.
Термин «нуклеотид» означает нуклеозид, содержащий фосфатную группу, ковалентно связанную с сахарной частью нуклеозида.
Термин «олигомерное соединение» или «олигомер» означает полимер из связанных мономерных субъединиц, который способен гибридизоваться по меньшей мере с участком молекулы нуклеиновой кислоты.
Термин «олигонуклеотид» означает полимер из связанных нуклеозидов, каждый из которых может быть модифицированным или немодифицированным независимо друг от друга.
Термин «парентеральное введение» означает введение путем инъекции или инфузии. Парентеральное введение включает в себя подкожное введение, внутривенное введение, внутримышечное введение, внутриартериальное введение, внутрибрюшинное введение или внутричерепное введение, например, внутриоболочечное или внутрицеребровентрикулярное введение. Введение может быть постоянным или хроническим или коротким или интермиттирующим.
Термин «пептид» означает молекулу, образованную посредством связывания по меньшей мере двух аминокислот амидными связями. Пептид относится к полипептидам и белкам.
Термин «фармацевтическая композиция» означает смесь веществ, подходящих для введения субъекту. Например, фармацевтическая композиция может содержать одно или несколько активных фармацевтических средств и стерильный водный раствор.
Термин «фармацевтически приемлемые соли» означают физиологически и фармацевтически приемлемые соли антисмысловых соединений, т.е. соли, которые сохраняют желаемую биологическую активность исходного олигонуклеотида и при этом не обладают нежелательными токсикологическими эффектами.
Термин «фосфоротиоатная связь» означает связь между нуклеозидами, при этом фосфодиэфирная связь модифицирована путем замещения одного из необразующих мостиковую связь атомов кислорода атомом серы. Фосфоротиоатная связь является модифицированной межнуклеозидной связью.
Термин «часть» означает определенное число смежных (т.е. связанных) нуклеотидных оснований нуклеиновой кислоты. Согласно определенным вариантам осуществления частью является определенное число смежных нуклеотидных оснований мишеневой нуклеиновой кислоты. Согласно определенным вариантам осуществления частью является определенное число смежных нуклеотидных оснований антисмыслового соединения.
Термин «профилактика» относится к задерживанию или к предупреждению начала или развития заболевания, нарушения или состояния в течение периода времени от минут до неограниченного периода. Термин «профилактика» также означает снижение риска развития заболевания, нарушения или состояния.
Термин «пролекарство» означает терапевтическое средство, которое получают в неактивной форме, которая превращается в активную форму в организме или в его клетках под действием эндогенных ферментов или других химических веществ или условий.
Термин «побочные эффекты» означает физиологические ответы, сопровождающие лечение, отличные от желаемых эффектов. Согласно определенным вариантам осуществления побочными эффектами являются реакции в месте инъекции, патологии при тесте функции печени, патологии функции почек, печеночная токсичность, почечная токсичность, патологии центральной нервной системы, миопатии и дискомфорт.Например, повышенное содержание аминотрансферазы в сыворотке крови может указывать на печеночную токсичность или патологию функции печени. Например, повышенное содержание билирубина может указывать на печеночную токсичность или патологию функции печени.
Термин «одноцепочечный олигонуклеотид» означает олигонуклеотид, который не гибридизован с комплементарной нитью.
Термин «специфично гибридизуемый» относится к антисмысловому соединению, характеризующемуся достаточной степенью к омплементарности между антисмысловым олигонуклеотидом и мишеневой нуклеиновой кислотой для индуцирования желаемого эффекта, при этом оказывающему минимальные эффекты или не оказывающему эффектов на немишеневые нуклеиновые кислоты, при условиях, при которых желательно специфичное связывание, т.е. при физиологических условиях в случае анализов in vivo и методов терапевтического лечения.
Термин «нацеливание» или «нацеленный» означает процесс разработки и выбора антисмыслового соединения, которое будет специфично гибридизоваться с мишеневой нуклеиновой кислотой и индуцировать желаемый эффект.
Термины «мишеневая нуклеиновая кислота», «мишеневая РНК» и «транскрипт мишеневой РНК» относятся к нуклеиновой кислоте, способной быть мишенью антисмыслового соединения.
Термин «мишеневый сегмент» означает последовательность нуклеотидов мишеневой нуклеиновой кислоты, на которую нацелено антисмысловое соединение. Термин «5'-мишеневый сайг» относится к самому крайнему нуклеотиду с 5'-конца мишеневого сегмента. Термин «3'-мишеневый сайт» относится к самому крайнему нуклеотиду с 3'-конца мишеневого сегмента.
Термин «терапевтически эффективное количество» означает количество фармацевтического средства, которое оказывает терапевтический эффект на субъекта.
Термин «лечение» относится к введению фармацевтической композиции для эффекта изменения или положительной динамики заболевания, нарушения или состояния.
Термин «немодифицированный нуклеотид» означает нуклеотид, состоящий из природных нуклеотидных оснований, сахарных частей и межнуклеозидных связей. Согласно определенным вариантам осуществления немодифицированным нуклеотидом является нуклеотид РНК (т.е. β-D-рибонуклеозиды) или нуклеотид ДНК (т.е. β-D-дезоксирибонуклеозид).
Определенные варианты осуществления
Согласно определенным вариантам осуществления предусмотрены способы, соединения и композиции для ингибирования экспрессии гентингтина.
Согласно определенным вариантам осуществления предусмотрены антисмысловые соединения, нацеленные на нуклеиновую кислоту гентингтина. Согласно определенным вариантам осуществления нуклеиновой кислотой гентингтина является любая из последовательностей, изложенных под №доступа в GENBANK NM_002111.6 (включенных в настоящий документ как SEQ ID NO:1), под №доступа в GENBANK NT_006081.17, процессированных из нуклеотидов 462000-634000 (включенных в настоящий документ как SEQ ID NO:2), под №доступа в GENBANK NM_010414.1 (включенных в настоящий документ как SEQ ID NO:3), комплементарной последовательности с №доступа в GENBANK NW_001109716.1, процессированной из нуклеотидов 698000-866000 (включенной в настоящий документ как SEQ ID NO:4), и под №доступа в GENBANK NM_024357.2 (включенной в настоящий документ как SEQ ID NO:5).
Согласно определенным вариантам осуществления предусмотрены соединения, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, где связанные нуклеозиды содержат по меньшей мере 8 смежных нуклеотидных оснований последовательности, выбранной из последовательностей нуклеотидных оснований, изложенных в SEQ ID NO:6, 9, 10, 11, 12, 13, 14, 15, 18, 19, 20, 21, 23, 24, 25, 26, 27, 28, 29, 30, 32, 33, 35, 36, 10, 11, 12, 13, 18, 22, 32. Согласно определенным вариантам ос уществления модифицированный о лигонуклеотид содержит по меньшей мере 9, по меньшей мере 10, по меньшей мере 11 или по меньшей мере 12 смежных нуклеотидных оснований последовательности, выбранной из последовательностей нуклеотидных оснований, изложенных в SEQ ID NO:6, 9, 10, 11, 12, 13, 14, 15, 18, 19, 20, 21, 23, 24, 25, 26, 27, 28, 29, 30, 32, 33, 35, 36, 10, 11, 12, 13, 18, 22, 32. Согласно определенным вариантам осуществления последовательности нуклеотидных оснований изложены в SEQ ID NO:24, 25, 26, 6, 12, 28, 21, 22, 32, 13. Согласно определенным вариантам ос уществления модифицированный о лигонуклеотид содержит по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, или по меньшей мере 12 смежных нуклеотидных оснований последовательности, выбранной из последовательностей нуклеотидных оснований, изложенных в SEQ ID NO:12, 22, 28, 30, 32 и 33.
Согласно определенным вариантам осуществления предусмотрены соединения, содержащие модифицированный олигонуклеотид, состоящий из 15-25 связанных нуклеозидов, где связанные нуклеозиды содержат по меньшей мере 8 смежных нуклеотидных оснований последовательности, выбранной из последовательностей нуклеотидных оснований, изложенных в SEQ ID NO:6, 9, 10, 11, 12, 13, 14, 15, 18, 19, 20, 21, 23, 24, 25, 26, 27, 28, 29, 30, 32, 33, 35, 36, 10, 11, 12, 13, 18, 22, 32. Согласно определенным вариантам ос уществления модифицированный о лигонуклеотид содержит по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14 или по меньшей мере 15 смежных нуклеотидных оснований последовательности, выбранной из последовательностей нуклеотидных оснований, изложенных в SEQ ID NO:6, 9, 10, 11, 12, 13, 14, 15, 18, 19, 20, 21, 23, 24, 25, 26, 27, 28, 29, 30, 32, 33, 35, 36, 10, 11, 12, 13, 18, 22, 32. Согласно определенным вариантам осуществления последовательности нуклеотидных оснований изложены в SEQ ID NO:24, 25, 26, 6, 12, 28, 21, 22, 32, 13. Согласно определенным вариантам осуществления модифицированный олигонуклеотид содержит по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14 или по меньшей мере 15 смежных нуклеотидных оснований последовательности, выбранной из последовательностей нуклеотидных оснований, изложенных в SEQ ID NO:12, 22, 28, 30, 32 и 33.
Согласно определенным вариантам осуществления предусмотрены соединения, содержащие модифицированный олигонуклеотид, состоящий из 18-21 связанных нуклеозидов, где связанные нуклеозиды содержат по меньшей мере 8 смежных нуклеотидных оснований последовательности, выбранной из последовательностей нуклеотидных оснований, изложенных в SEQ ID NO:6, 9, 10, 11, 12, 13, 14, 15, 18, 19, 20, 21, 23, 24, 25, 26, 27, 28, 29, 30, 32, 33, 35, 36, 10, 11, 12, 13, 18, 22 и 32. Согласно определенным вариантам ос уществления модифицированный о лигонуклеотид содержит по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17 или по меньшей мере 18 смежных нуклеотидных оснований последовательности, выбранной из последовательностей нуклеотидных оснований, изложенных в SEQ ID NO:6, 9, 10, 11, 12, 13, 14, 15, 18, 19,20, 21,23, 24, 25, 26, 27, 28, 29, 30, 32, 33, 35, 36, 10, 11, 12, 13, 18, 22 и 32. Согласно определенным вариантам осуществления последовательности нуклеотидных оснований изложены в SEQ ID NO:24, 25, 26, 6, 12, 28, 21, 22, 32, 13. Согласно определенным вариантам осуществления модифицированный олигонуклеотид содержит по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, или по меньшей мере 18 смежных нуклеотидных оснований последовательности, выбранной из последовательностей нуклеотидных оснований, изложенных в SEQ ID NO:12, 22, 28, 30, 32 и 33.
Согласно определенным вариантам осуществления предусмотрены соединения, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, где связанные нуклеозиды содержат по меньшей мере часть 8 смежных нуклеотидных оснований, которая комплементарна в участке, выбранном из нуклеотидов 4384-4403, 4605-4624, 4607-4626, 4608-4627, 4609-4628, 4610-4629, 4617-4636, 4622-4639, 4813-4832, 4814-4833, 4823-4842, 4860-4877, 4868-4887, 4925-4944, 4928-4947, 4931-4950, 4931-4948, 4955-4974, 4960-4977, 5801-5820, 5809-5828, 5809-5826, 101088-101105,115066-115085, 4607-4626, 4608-4627, 4609-4628. 4610-4629, 4813-4832, 4862-4881, 5809-5828, 4928-4947 SEQ ID NO:1. Согласно определенным вариантам осуществления участок выбран из 4384-4403, 4609-4628, 4610-4629, 4860-4877, 4862-4881, 4925-4944, 4928-4947, 4931-4950, 4955-4974 и 5809-5828 SEQ ID NO:1. Согласно определенным вариантам осуществления участок выбран из 4862-4881, 4609-4628, 5809-5828, 5809-5826, 5801-5820 и 4955-4974. Согласно определенным вариантам осуществления модифицированный олигонуклеотид содержит часть из по меньшей мере 9, по меньшей мере 10, по меньшей мере 11 или по меньшей мере 12 смежных нуклеотидных оснований, которая комплементарна в участке, описанном в настоящем документе.
Согласно определенным вариантам осуществления предусмотрены соединения, содержащие модифицированный олигонуклеотид, состоящий из 15-25 связанных нуклеозидов, где связанные нуклеозиды содержат по меньшей мере часть 8 смежных нуклеотидных оснований, которая комплементарна в участке, выбранном из нуклеотидов 4384-4403, 4609-4628, 4610-4629, 4860-4877, 4862-4881, 4925-4944, 4928-4947, 4931-4950, 4955-4974 и 5809-5829 SEQ ID NO:1. Согласно определенным вариантам осуществления модифицированный олигонуклеотид содержит часть из по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13 или по меньшей мере 15 смежных нуклеотидных оснований, которая комплементарна в участке, описанном в настоящем документе.
Согласно определенным вариантам осуществления предусмотрены соединения, содержащие модифицированный олигонуклеотид, состоящий из 15-25 связанных нуклеозидов, где связанные нуклеозиды содержат по меньшей мере часть 8 смежных нуклеотидных оснований, которая комплементарна в участке, выбранном из нуклеотидов 4862-4881, 4609-4628, 5809-5828, 5809-5826, 5801-5820 и 4955-4974. Согласно определенным вариантам ос уществления модифицированный о лигонуклеотид содержит часть из по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13 или по меньшей мере 15 смежных нуклеотидных оснований, которая комплементарна в участке, описанном в настоящем документе.
Согласно определенным вариантам осуществления предусмотрены соединения, содержащие модифицированный олигонуклеотид, состоящий из 18-21 связанных нуклеозидов, где связанные нуклеозиды содержат по меньшей мере часть 8 смежных нуклеотидных оснований, которая комплементарна в участке, выбранном из нуклеотидов 4384-4403, 4609-4628, 4610-4629, 4860-4877, 4862-4881, 4925-4944, 4928-4947, 4931-4950, 4955-4974 и 5809-5829 SEQ ID NO:1. Согласно определенным вариантам осуществления модифицированный олигонуклеотид содержит часть из по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17 или по меньшей мере 18 смежных нуклеотидных оснований, которая комплементарна в участке, описанном в настоящем документе.
Согласно определенным вариантам осуществления предусмотрены соединения, содержащие модифицированный олигонуклеотид, состоящий из 18-21 связанных нуклеозидов, где связанные нуклеозиды содержат по меньшей мере часть 8 смежных нуклеотидных оснований, которая комплементарна в участке, выбранном из нуклеотидов 4862-4881, 4609-4628, 5809-5828, 5809-5826, 5801-5820 и 4955-4974. Согласно определенным вариантам осуществления модифицированный о лигонуклеотид содержит часть из по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17 или по меньшей мере 18 смежных нуклеотидных оснований, которая комплементарна в участке, описанном в настоящем документе.
Согласно определенным вариантам осуществления модифицированный олигонуклеотид состоит из одноцепочечного модифицированного олигонуклеотида.
Согласно определенным вариантам осуществления модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов.
Согласно определенным вариантам осуществления последовательность нуклеотидных оснований модифицированного олигонуклеотида по меньшей мере на 90% комплементарна по всей ее длине последовательности нуклеотидных оснований SEQ ID NO:1, 2, 3, 4 или 5. Согласно определенным вариантам осуществления последовательность нуклеотидных оснований модифицированного олигонуклеотида по меньшей мере на 95% комплементарна по всей ее длине последовательности нуклеотидных оснований SEQ ID NO:1, 2, 3, 4 или 5. Согласно определенным вариантам осуществления модифицированный олигонуклеотид по меньшей мере на 99% комплементарен по всей его длине SEQ ID NO:1, 2, 3, 4 или 5. Согласно определенным вариантам осуществления последовательность нуклеотидных оснований модифицированного олигонуклеотида на 100% комплементарна по всей ее длине последовательности нуклеотидных оснований SEQ ID NO:1, 2,3, 4 или 5.
Согласно определенным вариантам осуществления соединение содержит по меньшей мере одну модифицированную межнуклеозидную связь. Согласно определенным вариантам осуществления межнуклеозидной связью является фосфоротиоатная межнуклеозидная связь.
Согласно определенным вариантам осуществления соединение содержит по меньшей мере один нуклеозид, содержащий модифицированный сахар. Согласно определенным вариантам осуществления по меньшей мере одним модифицированным сахаром является бициклический сахар. Согласно определенным вариантам осуществления по меньшей мере один бициклический сахар содержит мостик 4'-СН(СН3)-O-2'. Согласно определенным вариантам осуществления по меньшей мере один модифицированный сахар содержит 2'-O-метоксиэтил.
Согласно определенным вариантам осуществления соединение содержит по меньшей мере один тетрагидропирановый модифицированный нуклеозид, где тетрагидропирановое кольцо заменяет фуранозное кольцо. Согласно определенным вариантам осуществления по меньшей мере один тетрагидропирановый модифицированный нуклеозид характеризуется структурой:
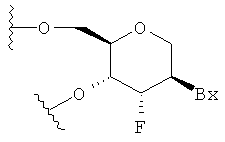 ,
,
где Вх представляет собой необязательно защищенную гетероциклическую основную часть.
Согласно определенным вариантам осуществления соединение содержит по меньшей мере один нуклеозид, содержащий модифицированное нуклеотидное основание. Согласно определенным вариантам осуществления модифицированным нуклеотидным основанием является 5-метилцитозин.
Согласно определенным вариантам осуществления модифицированный олигонуклеотид соединения содержит:
(i) гэп-сегмент, состоящий из связанных дезоксинуклеозидов;
(ii) 5'-фланкирующий сегмент, состоящий из связанных нуклеозидов;
(iii) 3'-фланкирующий сегмент, состоящий из связанных нуклеозидов, где гэп-сегмент расположен между 5'-фланкирующим сегментом и 3'-фланкирующим сегментом, и где каждый нуклеозид каждого фланкирующего сегмента содержит модифицированный сахар.
Согласно определенным вариантам осуществления модифицированный олигонуклеотид соединения содержит:
(i) гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов;
(ii) 5'-фланкирующий сегмент, состоящий из пяти связанных нуклеозидов;
(iii) 3'-фланкирующий сегмент, состоящий из пяти связанных нуклеозидов, где гэп-сегмент расположен непосредственно рядом с 5'-фланкирующим сегментом и 3'-фланкирующим сегментом и между таковыми, где каждый нуклеозид каждого фланкирующего сегмента содержит 2'-0-метоксиэтил-модифицированный сахар; и где каждая межнуклеозидная связь является фосфоротиоатной связью.
Согласно определенным вариантам осуществления модифицированный олигонуклеотид соединения содержит:
(i) гэп-сегмент, состоящий из восьми связанных дезоксинуклеозидов;
(ii) 5'-фланкирующий сегмент, состоящий из шести связанных нуклеозидов;
(iii) 3'-фланкирующий сегмент, состоящий из шести связанных нуклеозидов, где гэп-сегмент расположен непосредственно рядом с 5'-фланкирующим сегментом и 3'-фланкирующим сегментом и между таковыми, где каждый нуклеозид каждого фланкирующего сегмента содержит 2'-O-метоксиэтил-модифицированный сахар; и где каждая межнуклеозидная связь является фосфоротиоатной связью.
Согласно определенным вариантам осуществления модифицированный олигонуклеотид соединения содержит:
(i) гэп-сегмент, состоящий из восьми связанных дезоксинуклеозидов;
(ii) 5'-фланкирующий сегмент, состоящий из пяти связанных нуклеозидов;
(iii) 3'-фланкирующий сегмент, состоящий из пяти связанных нуклеозидов, где гэп-сегмент расположен непосредственно рядом с 5'-фланкирующим сегментом и 3'-фланкирующим сегментом и между таковыми, где каждый нуклеозид каждого фланкирующего сегмента содержит 2'-O-метоксиэтил-модифицированный сахар; и где каждая межнуклеозидная связь является фосфоротиоатной связью.
Согласно определенным вариантам осуществления предусмотрена композиция, содержащая соединение, как описано в настоящем документе, или его соль и фармацевтически приемлемый носитель или разбавитель. Согласно определенным вариантам осуществления композиция содержит модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и характеризующийся последовательностью нуклеотидных оснований, содержащей по меньшей мере 12 смежных нуклеотидных оснований последовательности нуклеотидных оснований, выбранной из последовательностей нуклеотидных оснований, изложенных в SEQ ID NO:6, 9, 10, 11, 12, 13, 14, 15, 18, 19, 20, 21, 23, 24, 25, 26, 27, 28, 29, 30, 32, 33, 35, 36, 10, 11, 12, 13, 18, 22 и 32, или его соль и фармацевтически приемлемый носитель или разбавитель.
Согласно определенным вариантам осуществления предусмотрена композиция, содержащая соединение, как описано в настоящем документе, или его соль и фармацевтически приемлемый носитель или разбавитель. Согласно определенным вариантам осуществления композиция содержит модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и характеризующийся последовательностью нуклеотидных оснований, содержащей по меньшей мере 12 смежных нукпеотидных оснований последовательности нуклеотидных оснований, выбранной из последовательностей нуклеотидных оснований, изложенных в SEQ ID NO:12, 22, 28, 30, 32 и 33, или его соль и фармацевтически приемлемый носитель или разбавитель.
Согласно определенным вариантам осуществления предусмотрены способы лечения, профилактики или облегчения болезни Гентингтона.
Согласно определенным вариантам осуществления предусмотрены способы, предусматривающие введение животному соединения, как описано в настоящем документе по отношению к животному. Согласно определенным вариантам осуществления способ предусматривает введение животному модифицированного олигонуклеотида, состоящего из 12-30 связанных нуклеозидов и характеризующегося последовательностью нуклеотидных оснований, содержащей по меньшей мере 8 смежных нуклеотидных оснований последовательности нуклеотидных оснований, выбранной из последовательностей нуклеотидных оснований, изложенных в SEQ ID NO:6, 9, 10, 11, 12, 13, 14, 15, 18, 19, 20, 21, 23, 24, 25, 26, 27, 28, 29, 30, 32, 33, 35, 36, 10, 11, 12, 13, 18, 22 и 32.
Согласно определенным вариантам осуществления предусмотрены способы, предусматривающие введение животному соединения, как описано в настоящем документе по отношению к животному. Согласно определенным вариантам осуществления способ предусматривает введение животному модифицированного олигонуклеотида, состоящего из 12-30 связанных нуклеозидов и характеризующегося последовательностью нуклеотидных оснований, содержащей по меньшей мере 8 смежных нуклеотидных оснований последовательности нуклеотидных оснований, выбранной из последовательностей нуклеотидных оснований, изложенных в SEQ ID NO:12, 22, 28, 30, 32 и 33.
Согласно определенным вариантам осуществления животным является человек.
Согласно определенным вариантам осуществления введение позволяет предотвращать, лечить, облегчать или замедлять развитие болезни Гентингтона, как описано в настоящем документе.
Согласно определенным вариантам осуществления соединение вводится совместно со вторым средством.
Согласно определенным вариантам осуществления соединение и второе средство вводятся одновременно.
Согласно определенным вариантам осуществления введением является парентеральное введение. Согласно определенным вариантам осуществления парентеральным введением является внутричерепное введение. Согласно определенным вариантам осуществления внутричерепным введением является внутриоболочечное или внутрицеребровентрикулярное введение.
Кроме того, согласно определенным вариантам осуществления предусматривается способ ослабления экспрессии мРНК или белка гентингтина у животного, предусматривающий введение животному соединения или композиции, как описано в настоящем документе, для ослабления экспрессии мРНК или белка гентингтина у животного. Согласно определенным вариантам осуществления животным является человек. Согласно определенным вариантам осуществления ослабление экспрессии мРНК или белка гентингтина позволяет предотвращать, лечить, облегчать болезнь Гентингтона или замедлять ее развитие.
Согласно определенным вариантам осуществления предусмотрен способ лечения больного болезнью Гентингтона, предусматривающий идентификацию человека с заболеванием и введение человеку терапевтически эффективного количества соединения или композиции, как описано в настоящем документе. Согласно определенным вариантам осуществления лечение уменьшает симптом, выбранный из группы, состоящей из тревожности, отсутствия координации, непреднамеренного начала движений, непреднамеренных незавершенных движений, неустойчивой походки, хореи, оцепенелости, корченных движений, аномальной позы, неустойчивости, ненормальных выражений лица, затруднения жевания, затруднения глотания, затруднения речи, припадка, нарушений сна, ухудшенного планирования, ухудшенной гибкости, ухудшенного абстрактного мышления, ухудшенного усвоения правил, ухудшенного начала надлежащих действий, ухудшенного подавления ненадлежащих действий, ухудшенной кратковременной памяти, ухудшенной долговременной памяти, паранойи, дезориентации, спутанности сознания, галлюцинации, деменции, тревожности, депрессии, эмоциональной тупости, эгоцентризмов, агрессии, компульсивного поведения, раздражительности, суицидального настроения, сниженной массы головного мозга, мышечной атрофии, сердечной недостаточности, сниженной толерантности к глюкозе, потери массы, остеопороза и атрофии яичка.
Кроме того, предусмотрен способ ослабления проявления или профилактики болезни Гентингтона, предусматривающий введение человеку терапевтически эффективного количества соединения или композиции, как описано в настоящем документе, что, таким образом, снижает проявление или предотвращает болезнь Гентингтона.
Кроме того, предусмотрен способ облегчения симптома болезни Гентингтона, предусматривающий введение человеку, нуждающемуся в этом, соединения, содержащего модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, где указанный модифицированный олигонуклеотид специфично гибридизуется с SEQ ID NO:1, 2, 3, 4 или 5, что, таким образом, облегчает симптом болезни Гентингтона у человека.
Кроме того, предусмотрен способ снижения скорости развития симптома, связанного с болезнью Гентингтона, предусматривающий введение человеку, нуждающемуся в этом, соединения, содержащего модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, где указанный модифицированный олигонуклеотид специфично гибридизуется с SEQ ID NO:1, 2, 3, 4 или 5, что, таким образом, снижает скорость развития симптома болезни Гентингтона у человека.
Кроме того, предусмотрен способ обращения дегенерации, характеризуемой симптомом, связанным с болезнью Гентингтона, предусматривающий введение человеку, нуждающемуся в этом, соединения, содержащего модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, где указанный модифицированный олигонуклеотид специфично гибридизуется с SEQ ID NO:1, 2, 3, 4 или 5, что, таким образом, обращает дегенерацию, характеризуемую симптомом болезни Гентингтона у человека.
Согласно определенным вариантам осуществления симптомом является физический, когнитивный, психиатрический или периферический симптом. Согласно определенным вариантам осуществления симптомом является физический симптом, выбранный из группы, состоящей из тревожности, отсутствия координации, непреднамеренного начала движений, непреднамеренных незавершенных движений, неустойчивой походки, хореи, оцепенелости, корченных движений, аномальной позы, неустойчивости, ненормальных выражений лица, затруднения жевания, затруднения глотания, затруднения речи, припадка и нарушений сна. Согласно определенным вариантам осуществления симптом является когнитивный симптом, выбранный из группы, состоящей из ухудшенного планирования, ухудшенной гибкости, ухудшенного абстрактного мышления, ухудшенного усвоения правил, ухудшенного начала надлежащих действий, ухудшенного подавления ненадлежащих действий, ухудшенной кратковременной памяти, ухудшенной долговременной памяти, паранойи, дезориентации, спутанности сознания, галлюцинации и деменции. Согласно определенным вариантам осуществления симптомом является психиатрический симптом, выбранный из группы, состоящей из тревожности, депрессии, эмоциональной тупости, эгоцентризмов, агрессии, компульсивного поведения, раздражительности и суицидального настроения. Согласно определенным вариантам осуществления симптомом является периферический симптом, выбранный из группы, состоящей из сниженной массы головного мозга, мышечной атрофии, сердечной недостаточности, сниженной толерантности к глюкозе, потери массы, остеопороза и атрофии яичка.
Также предусмотрены способы и соединения для получения лекарственного препарата для лечения, профилактики или облегчения болезни Гентингтона.
Согласно определенным вариантам осуществления предусмотрено применение соединения, как описано в настоящем документе, в производстве лекарственного препарата для лечения, облегчения или профилактики болезни Гентингтона.
Согласно определенным вариантам осуществления предусмотрено соединение, как описано в настоящем документе, для применения в лечении, профилактике или облегчении болезни Гентингтона, как описано в настоящем документе, с помощью комбинированной терапии с дополнительным средством или терапии, как описано в настоящем документе. Средства могут вводиться или типы терапии могут применяться совместно или одновременно.
Согласно определенным вариантам осуществления предусмотрено применение соединения, как описано в настоящем документе, в производстве лекарственного препарата для лечения, профилактики или облегчения болезни Гентингтона, как описано в настоящем документе, с помощью комбинированной терапии с дополнительным средством или терапии, как описано в настоящем документе. Средства могут вводиться или типы терапии могут применяться совместно или одновременно.
Согласно определенным вариантам осуществления предусмотрено применение соединения, как описано в настоящем документе, в производстве лекарственного препарата для лечения, профилактики или облегчения болезни Гентингтона, как описано в настоящем документе, у пациента, которому затем вводят дополнительное средство или проводят терапию, как описано в настоящем документе.
Согласно определенным вариантам осуществления предусмотрен набор для лечения, профилактики или облегчения болезни Гентингтона, как описано в настоящем документе, причем набор содержит:
(i) соединение, как описано в настоящем документе; и, альтернативно,
(ii) дополнительное средство или терапию, как описано в настоящем документе.
Кроме того, набор, как описано в настоящем документе, может содержать инструкции по использованию набора для лечения, профилактики или облегчения болезни Гентингтона, как описано в настоящем документе, с помощью комбинированной терапии, как описано в настоящем документе.
Согласно определенным вариантам осуществления предусмотрены соединения, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, где связанные нуклеозиды содержат по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или по меньшей мере 20 смежных нуклеотидных оснований последовательности, изложенной в SEQ ID NO:6,9, 10, 11, 12, 13, 14, 15, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 32, 33, 35 или 36, для применения в лечении животного с заболеванием или состоянием, связанным с гентингтином, путем введения животному терапевтически эффективного количества соединения так, что экспрессия гентингтина ингибируется. Согласно определенным вариантам осуществления заболеванием или состоянием является неврологическое нарушение. Согласно определенным вариантам осуществления заболеванием или состоянием является болезнь Гентингтона. Согласно определенным вариантам осуществления животным является человек.
Согласно определенным вариантам осуществления предусмотрены соединения, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, где связанные нуклеозиды содержат по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или по меньшей мере 20 смежных нуклеотидных оснований последовательности, изложенной в SEQ ID NO:6, 9, 10, 11, 12, 13, 14, 15, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 32, 33, 35 или 36, для применения у животного с заболеванием или состоянием, связанным с гентингтином, путем введения животному терапевтически эффективного количества соединения для профилактики, лечения, облегчения или замедления развития болезни Гентингтона.
Согласно определенным вариантам осуществления предусмотрены соединения, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, где связанные нуклеозиды содержат по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или по меньшей мере 20 смежных нуклеотидных оснований последовательности, изложенной в SEQ ID NO:12, 22, 28, 30, 32 или 33, для применения у животного с заболеванием или состоянием, связанным с гентингтином, путем введения животному терапевтически эффективного количества соединения так, что экспрессия гентингтина ингибируется. Согласно определенным вариантам осуществления заболеванием или состоянием является неврологическое нарушение. Согласно определенным вариантам осуществления заболеванием или состоянием является болезнь Гентингтона. Согласно определенным вариантам осуществления животным является человек.
Согласно определенным вариантам осуществления предусмотрены соединения, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, где связанные нуклеозиды содержат по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или по меньшей мере 20 смежных нуклеотидных оснований последовательности, изложенной в SEQ ID NO:12, 22, 28, 30, 32 или 33, для применения у животного с заболеванием или состоянием, связанным с гентингтином, путем введения животному терапевтически эффективного количества соединения для профилактики, лечения, облегчения или замедления развития болезни Гентингтона.
Согласно определенным вариантам осуществления предусмотрены соединения, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, где связанные нуклеозиды содержат часть из по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или по меньшей мере 20 смежных нуклеотидных оснований, комплементарную в участке, выбранном из нуклеотидов 4384-4403, 4605-4624, 4607-4626, 4608-4627, 4609-4628, 4610-4629, 4617-4636, 4622-4639, 4813-4832, 4814-4833, 4823-4842, 4860-4877, 4868-4887, 4925-4944, 4928-4947, 4931-4950, 4931-4948, 4955-4974, 4960-4977, 5801-5820, 5809-5828, 5809-5826, 101088-101105, 115066-115085, 4607-4626, 4608-4627, 4609-4628, 4610-4629, 4813-4832, 4862-4881, 5809-5828 и 4928-4947 SEQ ID NO:1, для применения у животного с заболеванием или состоянием, связанным с гентингтином, путем введения животному терапевтически эффективного количества соединения так, что экспрессия гентингтина ингибируется.
Согласно определенным вариантам осуществления предусмотрены соединения, содержащие модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, где связанные нуклеозиды содержат часть из по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или по меньшей мере 20 смежных нуклеотидных оснований, комплементарную в участке, выбранном из нуклеотидов 4384-4403, 4605-4624, 4607-4626, 4608-4627, 4609-4628, 4610-4629, 4617-4636, 4622-4639, 4813-4832, 4814-4833, 4823-4842, 4860-4877, 4868-4887, 4925-4944, 4928-4947, 4931-4950, 4931-4948, 4955-4974, 4960-4977, 5801-5820, 5809-5828, 5809-5826, 101088-101105, 115066-115085, 4607-4626, 4608-4627, 4609-4628, 4610-4629, 4813-4832, 4862-4881, 5809-5828 и 4928-4947 SEQ ID NO:1, для применения у животного с заболеванием или состоянием, связанным с гентингтином, путем введения животному терапевтически эффективного количества соединение для профилактики, лечения, облегчения или замедления развития болезни Гентингтона.
Антисмысловые соединения
Олигомерные соединения содержат без ограничения олигонуклеотиды, олигонуклеозиды, олигонуклеотидные аналоги, олигонуклеотидные миметики, антисмысловые соединения, антисмысловые олигонуклеотиды и siRNA. Олигомерное соединение может быть «антисмысловым» по отношению к мишеневой нуклеиновой кислоте, что означает способность претерпевать гибридизацию с мишеневой нуклеиновой кислотой посредством водородной связи.
Согласно определенным вариантам осуществления антисмысловое соединение содержит последовательность нуклеотидных оснований, которая, будучи записанной в 5'-3'-направлении, содержит обратную ко мплементарную последовательность мишеневого сегмента мишен евой н уклеиновой кислоты, н а которую она н ацелена. Согласно таким определенным вариантам осуществления антисмысловой олигонуклеотид характеризуется последовательностью нуклеотидных оснований, которая, будучи записанной в 5'-3'-направлении, содержит обратную комплементарную последовательность мишеневого сегмента мишеневой нуклеиновой кислоты, на которую она нацелена.
Согласно определенным вариантам осуществления антисмысловое соединение, нацеленное на нуклеиновую кислоту гентингтина, характеризуется длиной 12-30 нуклеотидов. Другими словами, антисмысловые соединения состоят из 12-30 связанных нуклеотидных оснований. Согласно другим вариантам осуществления антисмысловое соединение содержит модифицированный олигонуклеотид, состоящий из 8-80, 12-50, 15-30, 18-24, 19-22 или 20 связанных нуклеотидных оснований. Согласно таким определенным вариантам осуществления антисмысловое соединение содержит модифицированный олигонуклеотид, состоящий из 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79 или 80 связанных нуклеотидных оснований или характеризуется диапазоном, определенным любыми двумя из вышеупомянутых значений.
Согласно определенным вариантам осуществления антисмысловое соединение содержит укороченный или процессированный модифицированный олигонуклеотид. У укороченного или процессированного модифицированного олигонуклеотида один нуклеозид может быть удален с 5'-конца (5'-отсечение) или, альтернативно, с 3'-конца (3'-отсечение). У укороченного или процессированного олигонуклеотида два нуклеозида могут быть удалены с 5'-конца, или, альтернативно, две субъединицы могут быть удалены с 3'-конца. Альтернативно, удаление нуклеозидов может происходить по всему модифицированному олигонуклеотиду, например, у антисмыслового соединения один нуклеозид удален с 5'-конца, и один нуклеозид удален с 3'-конца.
Если в удлиненном олигонуклеотиде присутствует один дополнительный нуклеозид, дополнительный нуклеозид может быть расположен на 5'- или 3'-конце олигонуклеотида. Когда присутствуют два или более дополнительных нуклеозидов, добавочные нуклеозиды могут прилегать друг к другу, например, в олигонуклеотиде с двумя нуклеозидами, добавленными на 5'-конце (5'-добавление) или, альтернативно, на 3'-конце (3'-добавление) олигонуклеотида. Альтернативно, добавление нуклеозида может происходить по всему антисмысловому соединению, например, в олигонуклеотиде один нуклеозид добавлен на 5'-конце, и одна субъединица добавлена на 3'-конце.
Можно увеличить или уменьшить длину антисмыслового соединения, такого как антисмысловой олигонуклеотид и/или ввести ошибочно спаренные основания без устранения активности. Например, Woolf et al. (Proc. Natl. Acad. Sci. USA 89:7305-7309, 1992) тестировали ряд антисмысловых олигонуклеотидов длиной 13-25 нуклеотидных оснований на их способность индуцировать расщепление мишеневой РНК на модели инъекции яйцеклеток. Антисмысловые олигонуклеотиды длиной 25 нуклеотидных оснований с 8 или 11 ошибочно спаренными основаниями возле концов антисмысловых олигонуклеотидов были способны управлять специфичным расщеплением мишеневой мРНК, хотя в меньшей степени, чем антисмысловые олигонуклеотиды, у которых не было ошибочных спариваний. Подобным образом, специфичное по отношению к мишени расщепление достигали с использованием антисмысловых олигонуклеотидов из 13 нуклеотидных оснований, в том числе таковыми с 1 или 3 ошибочными спариваниями.
Gautschi et al. (J. Natl. Cancer Inst. 93:463-471, March 2001) показали способность олигонуклеотида, характеризующегося 100% комплементарностью к bcl-2 мРНК и характеризующегося 3 ошибочными спариваниями с bcl-xL мРНК, снижать экспрессию и bcl-2, и bcl-xL in vitro и in vivo. Кроме того, этот олигонуклеотид продемонстрировал сильную противоопухолевую активность in vivo.
Maher и Dolnick (Nuc. Acid. Res. 16:3341-3358,1988) тестировали ряд тандемных антисмысловых олигонуклеотидов из 14 нуклеотидных оснований и антисмысловых олигонуклеотидов из 28 и 42 нуклеотидных оснований, состоящих из последовательности двух или трех тандемных антисмысловых олигонуклеотидов, соответственно, на их способность тормозить трансляцию DHFR человека в анализе ретикулоцитов кролика. Каждый из трех антисмысловых олигонуклеотидов из 14 нуклеотидных оснований отдельно был способен ингибировать трансляцию, хотя на более умеренном уровне, чем антисмысловые олигонуклеотиды из 28 или 42 нуклеотидных оснований.
Мотивы антисмыслового соединения
Согласно определенным вариантам осуществления антисмысловые соединения, нацеленные на нуклеиновую кислоту гентингтина, содержат химически модифицированные субъединицы, упорядоченные в паттернах или мотивах, для обеспечения свойств антисмысловых соединений, таких как усиленная ингибиторная активность, повышенная аффинность связывания с мишеневой нуклеиновой кислотой или устойчивость к разрушению нуклеазами in vivo.
Химерные антисмысловые соединения типично содержат по меньшей мере один участок, модифицированный так, чтобы обеспечивать повышенную устойчивость к разрушению нуклеазами, усиленное клеточное поглощение, повышенную аффинность связывания с мишеневой нуклеиновой кислотой и/или повышенную ингибиторную активность. Второй участок химерного антисмыслового соединения необязательно может служить субстратом для клеточной эндонуклеазы РНКазы Н, которая расщепляет нить РНК дуплекса РНК:ДНК.
Антисмысловые соединения, содержащие гэпмерный мотив, считаются химерными антисмысловыми соединениями. В гэпмере внутренний участок, содержащий несколько нуклеотидов, который обеспечивает расщепление РНКазой Н, расположен между внешними участками, содержащими несколько нуклеотидов, которые химически отличаются от нуклеозидов внутреннего участка. В случае антисмыслового олигонуклеотида, содержащего гэпмерный мотив, гэп-сегмент обычно служит субстратом для расщепления эндонуклеазой, тогда как фланкирующие сегменты содержат модифицированные нуклеозиды. Согласно определенным вариантам осуществления участки гэпмера отличаются типами сахарных частей, содержащих каждый отличающийся участок. Типы сахарных частей, которые используются для дифференциации участков гэпмера согласно некоторым вариантам осуществления могут содержать (3-D-рибонуклеозиды, (3-О-дезоксирибонуклеозиды, 2'-модифицированные нуклеозиды (такие 2'-модифицированные нуклеозиды могут содержать 2'-МОЕ и 2'-O-СН3 среди прочих) и нуклеозиды с бициклическим модифицированным сахаром (такими нуклеозидами с бициклическим модифицированным сахаром могут быть нуклеозиды с 4'-(СН2)n-O-2'-мостиком, где n=1 или n=2). Предпочтительно каждый отличающийся участок содержит одинаковые сахарные части. Мотив фланкирующий участок-гэп-фланкирующий участок часто описывается как «X-Y-Z», где «X» представляет длину 5'-фланкирующего участка, «Y» представляет длину гэп-участка, a «Z» представляет длину 3'-фланкирующего участка. Как используется в настоящем документе, гэпмер, описанный как «X-Y-Z», характеризуется такой конфигурацией, что гэп-сегмент расположен непосредственно рядом с каждым из 5'-фланкирующего сегмента и 3'-фланкирующего сегмента. Таким образом, нет промежуточных нуклеотидов между 5'-фланкирующим сегментом и гэп-сегментом или между гэп-сегментом и 3'-фланкирующим сегментом. Любое из антисмысловых соединений, описанных в настоящем документе, может содержать гэпмерный мотив. Согласно некоторым вариантам осуществления Х и Z являются одинаковыми, согласно другим вариантам осуществления они отличаются. Согласно предпочтительному варианту осуществления Y составляет от 8 до 15 нуклеотидов. X, Y или Z могут составлять любое число из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30 или более нуклеотидов. Таким образом, гэпмеры включают в себя без ограничения, например, 5-10-5, 4-8-4, 4-12-3, 4-12-4, 3-14-3, 2-13-5, 2-16-2, 1-18-1, 3-10-3, 2-10-2, 1-10-1, 2-8-2, 6-8-6 или 5-8-5.
Согласно определенным вариантам осуществления антисмысловое соединение как мотив «фланкирующего участка», характеризуется конфигурацией фланкирующий участок-гэп или гэп-фланкирующий участок, т.е. конфигурацией X-Y или Y-Z, как описано выше для гэпмерной конфигурации. Таким образом, конфигурации фланкирующего участка включают в себя без ограничения, например, 5-10, 8-4, 4-12, 12-4, 3-14, 16-2, 18-1, 10-3, 2-10, 1-10, 8-2, 2-13 или 5-13.
Согласно определенным вариантам осуществления антисмысловые соединения, нацеленные на нуклеиновую кислоту гентингтина, содержат гэпмерный мотив 5-10-5.
Согласно определенным вариантам осуществления антисмысловые соединения, нацеленные на нуклеиновую кислоту гентингтина, содержат гэпмерный мотив 6-8-6.
Согласно определенным вариантам осуществления антисмысловые соединения, нацеленные на нуклеиновую кислоту гентингтина, содержат гэпмерный мотив 5-8-5.
Согласно определенным вариантам осуществления антисмысловое соединение, нацеленное на нуклеиновую кислоту гентингтина, содержит гэп-фланкированный мотив.
Согласно определенным вариантам осуществления гэп-фланкированный антисмысловой олигонуклеотид, нацеленный на нуклеиновую кислоту гентингтина, содержит гэп-сегмент из десяти 2'-дезоксирибонуклеотидов, расположенных непосредственно рядом с фланкирующими сегментами из пяти химически модифицированных нуклеозидов и между таковыми. Согласно определенным вариантам осуществления химическая модификация включает в себя 2'-сахарную модификацию. Согласно другому варианту осуществления химическая модификация включает в себя 2'-МОЕ сахарную модификацию.
Согласно определенным вариантам осуществления гэп-фланкированный антисмысловой олигонуклеотид, нацеленный на нуклеиновую кислоту гентингтина, содержит гэп-сегмент из восьми 2'-дезоксирибонуклеотидов, расположенных непосредственно рядом с фланкирующими сегментами из пяти химически модифицированных нуклеозидов и между ними. Согласно определенным вариантам осуществления химическая модификация включает в себя 2'-сахарную модификацию. Согласно другому варианту осуществления химическая модификация включает в себя 2'-МОЕ сахарную модификацию.
Согласно определенным вариантам осуществления гэп-фланкированный антисмысловой олигонуклеотид, нацеленный на нуклеиновую кислоту гентингтина, содержит гэп-сегмент из восьми 2'-дезоксирибонуклеотидов, расположенных непосредственно рядом с фланкирующими сегментами из шести химически модифицированных нуклеозидов и между ними. Согласно определенным вариантам осуществления химическая модификация включает в себя 2'-сахарную модификацию. Согласно другому варианту осуществления химическая модификация включает в себя 2'-МОЕ сахарную модификацию.
Мишеневые нуклеиновые кислоты, мишеневые участки и нуклеотидные последовательности
Нуклеотидные последовательности, которые кодируют гент ингтин, содержат бе з ограничения следующее: №доступа в GENBANK NM_002111.6, первоначально депонированную в GENBANK® 31 мая 2006 г., включенную в настоящий документ как SEQ ID NO:1; №доступа в GENBANK NT_006081.17, процессированную из нуклеотидов 462000-634000, первоначально депонированную в GENBANK® 19 августа 2004 г. и включенную в настоящий документ как SEQ ID NO:2; №доступа в GENBANK NM_010414.1, первоначально депонированную в GENBANK® 23 марта 2004 г., включенную в настоящий документ как SEQ ID NO:3; комплементарную последовательность к №доступа в GENBANK NW_001109716.1, процессированной из нуклеотидов 698000-866000, первоначально депонированной в GENBANK® 14 июня 2006 г., включенной в настоящий документ как SEQ ID NO:4, и №доступа в GENBANK NM_024357.2, первоначально депонированную в GENBANK® 5 июня 2008 г., включенную в настоящий документ как SEQ ID NO:5.
Следует понимать, что последовательность, изложенная в каждой SEQ ID NO:в примерах, содержащихся в настоящем документе, не зависит от какой-либо модификации сахарной части, межнуклеозидной связи или нуклеотидного основания. Как таковые, антисмысловые соединения, определенные с помощью SEQ ID NO, независимо могут содержать одну или несколько модификаций сахарной части, межнуклеозидной связи или нуклеотидного основания. Антисмысловые соединения, описанные под номером Isis (№Isis), указывают комбинацию последовательности нуклеотидных оснований и мотива.
Согласно определенным вариантам осуществления м ишеневый участок является структурно определенным участком мишеневой нуклеиновой кислоты. Например, мишеневый участок может охватывать 3'-UTR, 5'-UTR, экзон, интрон, объединение экзона с интроном, кодирующий участок, участок инициации трансляции, участок терминации трансляции или другой определенный участок нуклеиновой кислоты. Структурно определенные участки для гентингтина могут быть получены с помощью номера доступа из базы данных последовательностей, такой как NCBI, и такая информация включена в настоящий документ посредством ссылки. Согласно определенным вариантам осуществления мишеневый участок может охватывать последовательность от 5'-мишеневого сайта одного мишеневого сегмента на мишеневом участке до 3'-мишеневого сайта другого мишеневого сегмента на мишеневом участке.
Нацеливание предусматривает определение по меньшей мере одного мишеневого сегмента, с которым гибридизуется антисмысловое соединение, так, чтобы наблюдался желаемый эффект.Согласно определенным вариантам осуществления желаемым эффектом является снижение содержания мишеневой нуклеиновой кислоты мРНК. Согласно определенным вариантам осуществления желаемым эффектом является снижение содержания белка, кодированного мишеневой нуклеиновой кислотой, или фенотипическое изменение, связанное с мишеневой нуклеиновой кислотой.
Мишеневый участок может содержать один или несколько мишеневых сегментов. Множественные мишеневые сегменты в мишеневом участке могут быть перекрывающимися. Альтернативно, они могут быть неперекрывающимися. Согласно определенным вариантам осуществления мишеневые сегменты в мишеневом участке отделяются не более чем приблизительно 300 нуклеотидами. Согласно определенным вариантам осуществления мишеневые сегменты в мишеневом участке отделяются числом нуклеотидов, составляющим приблизительно, не более чем, не более чем приблизительно 250, 200, 150, 100, 90, 80, 70, 60, 50, 40, 30, 20 или 10 нукпеотидов, на мишеневой нуклеиновой кислоте, или диапазоном, определенным любыми двумя из предшествующих значений. Согласно определенным вариантам осуществления мишеневые сегменты в мишеневом участке отделяются не более чем или не более чем приблизительно 5 нуклеотидами на мишеневой н уклеиновой кислоте. Согласно определенным вариантам осуществления мишеневые сегменты являются смежными. Предполагаются мишеневые участки, определенные диапазоном, содержащим исходную нуклеиновую кислоту, которая является любой из 5'-мишеневых сайтов или 3'-мишеневых сайтов, перечисленных в настоящем документе.
Подходящие мишеневые сегменты могут находиться в 5'-UTR, кодирующем участке, 3'-UTR, интроне, экзоне или объединении экзона с интроном. Мишеневые сегменты, содержащие старт-кодон или стоп-кодон, также являются подходящими мишеневыми сегментами. Подходящий мишеневый сегмент, в частности, может не включать некоторый структурно определенный участок, такой как старт-кодон или стоп-кодон.
Определение подходящих мишеневых сегментов может предусматривать сравнение последовательности мишеневой нуклеиновой кислоты с другими последовательностями по всему геному. Например, для идентификации участков подобия среди различных нуклеиновых кислот может быть использован алгоритм BLAST. Это сравнение может предотвращать выбор по следовательностей антисмысловых соединений, которые могут гибридизоваться неспецифичным образом с последовательностями, отличными от выбранной мишеневой нуклеиновой кислоты, (т.е. немишеневыми или внемишеневыми последовательностями).
Может наблюдаться вариация в активности (например, как определено по проценту снижения содержания мишен евой нуклеиновой кислоты) антисмысловых соединений в активном мишеневом участке. Согласно определенным вариантам осуществления снижения содержания мРНК гентингтина является показателем ингибирования экспрессии гентингтина. Снижения содержания белка гентингтина также свидетельствуют об ингибировании экспрессии мишеневой мРНК. Кроме того, фенотипические изменения свидетельствуют об ингибировании экспрессии гентингтина. Например, могут быть проанализированы увеличение размера головного мозга до нормального, улучшение координации движений, уменьшение постоянных мышечных спазмов (дистонии), уменьшение раздражительности и/или тревожности, улучшение памяти или усиление активности, наряду с другими фенотипическими изменениями. Также могут быть оценены другие фенотипические показатели, например, симптомы, связанные с болезнью Гентингтона, как описано ниже.
Гибридизация
Согласно некоторым вариантам осуществления гибридизация происходит между антисмысловым соединением, раскрытым в настоящем документе, и нуклеиновой кислотой гентингтина. Наиболее общий механизм гибридизации включает водородное спаривание (например, водородное спаривание по Уотсону-Крику, по Хугстену или обратное хугстеновское) между комплементарными нуклеотидными основаниями молекул нуклеиновой кислоты.
Гибридизация может происходить при варьирующих условиях. Жесткие условия зависят от последовательности и определяются природой и композицией молекул нуклеиновой кислоты, подлежащих гибридизации.
Способы определения способности последовательности специфично гибридизоваться с мишеневой нуклеиновой кислотой хорошо известны из предшествующего уровня техники. Согласно определенным вариантам осуществления антисмысловые соединения, предусмотренные в настоящем документе, специфично гибридизуются с нуклеиновой кислотой гентинггина.
Комплементарность
Антисмысловое соединение и мишеневая нуклеиновая кислота являются комплементарными друг другу, если достаточное число нуклеотидных оснований антисмыслового соединения могут связываться водородной связью с соответствующими нуклеотидными основаниями мишеневой нуклеиновой кислоты так, что будет происходить желаемый эффект (например, антисмысловое ингибирование мишеневой нуклеиновой кислоты, такой как нуклеиновая кислота гентингтина).
Антисмысловое соединение может гибридизоваться по одному или нескольким сегментам нуклеиновой кислоты гентингтина так, что промежуточные или прилегающие сегменты не вовлекаются в событие гибридизации (например, петлеобразная структура, ошибочного спаривания или шпилечная структура).
Согласно определенным вариантам осуществления антисмысловые соединения, предусмотренные в настоящем документе, или определенная их часть являются или являются по меньшей мере на 70%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% комплементарными нуклеиновой кислоте гентингтина, мишеневому участку, мишеневому сегменту или определенной ее части. Процент комплементарности антисмыслового соединения с мишеневой нуклеиновой кислотой может быть определен с использованием стандартных способов.
Например, антисмысловое соединение, в котором 18 из 20 нуклеотидных оснований антисмыслового соединения комплементарны мишеневому участку и, следовательно, будут специфично гибридизоваться, будет представлять 90-процентную комплементарность. В этом примере остальные некомплементарные нуклеотидные основания могут быть сгруппированы или разбросаны с комплементарными нуклеотидными основаниями и не должны соприкасаться друг с другом или с комплементарными нуклеотидными основаниями. По сути антисмысловое соединение длиной 18 нуклеотидных оснований, содержащее 4 (четыре) некомплементарных нуклеиновых основания, которые фланкированы двумя участками полной комплементарности с мишеневой нуклеиновой кислотой, будет характеризоваться 77,8% полной комплементарностью с мишеневой нуклеиновой кислотой и, таким образом, будет подпадать под объем настоящего изобретения. Процент комплементарности антисмыслового соединения с участком мишеневой нуклеиновой кислоты может быть определен с тандартно с использованием п рограмм BLAST (средство поиска основного локального выравнивания) и программ PowerBLAST, известных из предшествующего уровня техники (Altschul et al., J. Mol. Biol., 1990, 215, 403 410; Zhang and Madden, Genome Res., 1997, 7, 649 656). Процент гомологии, идентичности или комплементарности последовательности может быть определен, например, с помощью программы Gap (Wisconsin Sequence Analysis Package, версия 8 для Unix, Genetics Computer Group, University Research Park, Madison Wis.) с использованием настроек по умолчанию, в которой используется алгоритм Smith и Waterman (Adv. Appl. Math., 1981, 2, 482 489).
Согласно определенным вариантам осуществления антисмысловые соединения, предусмотренные в настоящем документе, или определенные их части являются полностью комплементарными (т.е. комплементарными на 100%) мишеневой нуклеиновой кислоте или определенной ее части. Например, антисмысловое соединение может быть полностью комплементарным нуклеиновой кислоте гентингтина или его мишеневому участку, или мишеневому сегменту, или мишеневой последовательности. Используемый в настоящем документе термин «полностью комплементарное» означает, что каждое нуклеотидное основание антисмыслового соединения способно к точному спариванию оснований с соответствующими нуклеотидными основаниями мишеневой нуклеиновой кислоты. Например, антисмысловое соединение из 20 нуклеотидных оснований полностью комплементарно мишеневой последовательности длиной 400 нуклеотидных оснований, при условии, что имеется соответствующая часть из 20 нуклеотидных оснований мишеневой нуклеиновой кислоты, которая полностью комплементарна антисмысловому соединению. Термин «полностью комплементарная» также может использоваться по отношению к определенной части первой и/или второй нуклеиновой кислоты. Например, часть из 20 нуклеотидных оснований антисмыслового соединения из 30 нуклеотидных оснований может быть «полностью комплементарной» мишеневой последовательности длиной 400 нуклеотидных оснований. Часть из 20 нуклеотидных оснований олигонуклеотида из 30 нуклеотидных оснований полностью комплементарна мишеневой последовательности, если мишеневая последовательность содержит соответствующую часть из 20 нуклеиновый оснований, где каждое нуклеотидное основание комплементарно части из 20 нуклеотидных оснований антисмыслового соединения. В то же время, все антисмысловое соединение из 30 нуклеотидных оснований может быть или может не быть полностью комплементарным мишеневой последовательности в зависимости от того, являются ли также остальные 10 нуклеотидных оснований антисмыслового соединения комплементарными мишеневой последовательности.
Расположение некомплементарного нуклеотидного основания может находиться на 5'-конце или 3'-конце антисмыслового соединения. Альтернативно, некомплементарное нуклеотидное основание или нуклеотидные основания могут характеризоваться внутренним положением в антисмысловом соединении. Если присутствуют два или более некомплементарных нуклеотидных оснований, они могут быть смежными (т.е. связанными) или несмежными. Согласно одному варианту осуществления некомплементарное нуклеотидное основание расположено во фланкирующем сегменте гэпмерного антисмыслового олигонуклеотида.
Согласно определенным вариантам осуществления антисмыеловые соединения, которые представляют собой или характеризуются длиной до 12, 13, 14, 15, 16, 17, 18, 19 или 20 нуклеотидных оснований, содержат не более чем 4, не более чем 3, не более чем 2 или не более чем 1 некомплементарное(ых) нуклеотидное(ых) основание(ия) относительно мишеневой нуклеиновой кислоты, такой как нуклеиновая кислота гентингтина или определенная ее часть.
Согласно определенным вариантам осуществления антисмысловые соединения, которые представляют собой или характеризуются длиной до 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеотидных оснований, содержат не более чем 6, не более чем 5, не более чем 4, не более чем 3, не более чем 2 или не более чем 1 некомплементарное(ых) нуклеотидное(ых) основание(ия) относительно мишеневой нуклеиновой кислоты, такой как нуклеиновая кислота гентингтина или определенная ее часть.
Антисмысловые соединения, предусмотренные в настоящем документе, также включают в себя такие, которые комплементарны части мишеневой нуклеиновой кислоты. Используемый в настоящем документе термин «часть» относится к определенному числу смежных (т.е. связанных) нуклеотидных оснований в участке или сегменте мишеневой нуклеиновой кислоты. Термин «часть» также может относиться к определенному числу смежных нуклеотидных оснований антисмыслового соединения. Согласно определенным вариантам осуществления антисмысловые соединения комплементарны части мишеневого сегмента по меньшей мере из 8 нуклеотидных оснований. Согласно определенным вариантам осуществления антисмысловые соединения комплементарны части мишеневого сегмента по меньшей мере из 12 нуклеотидных оснований. Согласно определенным вариантам осуществления антисмысловые соединения комплементарны части мишеневого сегмента по меньшей мере из 15 нуклеотидных оснований. Также предусмотрены антисмысловые соединения, которые комплементарны части мишеневого сегмента по меньшей мере из 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более нуклеотидных оснований или из диапазона, определенного любыми двумя из этих значений.
Идентичность
Антисмысловые соединения, предусмотренные в настоящем документе, также могут характеризоваться определенной процентной идентичностью конкретной нуклеотидной последовательности, SEQ ID NO, или соединению, представленному особым номером Isis, или его части. Как используется в настоящем документе, антисмысловое соединение является идентичным последовательности, раскрытой в настоящем документе, если оно характеризуется одинаковой способностью с паривания нуклеотидных оснований. Например, РНК, которая содержит урацил вместо тимидина в раскрытой последовательности ДНК, будет считаться идентичной последовательности ДНК, поскольку и урацил, и тимидин спариваются с аденином. Также предполагаются укороченная и удлиненная версии антисмысловых соединений, описанных в настоящем документе, а также соединения, содержащие неидентичные основания по отношению к антисмысловым соединениям, предусмотренным в настоящем документе. Неидентичные основания могут быть прилегающими друг к другу или распределенными по всему антисмысловому соединению. Процент идентичности антисмыслового соединения рассчитывается по числу оснований, которые характеризуются идентичным спариванием оснований по отношению к последовательности, с которой оно сравнивается.
Согласно определенным вариантам осуществления антисмысловые соединения или их части по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны одному или нескольким из антисмысловых соединений или SEQ ID NO, или их части, раскрытым в настоящем документе.
Модификации
Нуклеозид представляет собой комбинацию основания и сахара. Частью нуклеотидного основания (также известного как основание) нуклеозида обычно является часть гетероциклического основания. Нуклеотидами являются нуклеозиды, которые дополнительно содержат фосфатную группу, ковалентно связанную с сахарной частью нуклеозида. Для таких нуклеозидов, которые содержат пентофуранозильный сахар, фосфатная группа может быть связана с 2'-, 3'- или 5'-гидроксильной частью сахара. Олигонуклеотиды образуются посредством ковалентной связи прилегающих нуклеозидов друг с другом с образованием линейного полимерного олигонуклеотида. В олигонуклеотидной структуре фосфатные группы, как правило, рассматриваются как образование межнуклеозидных связей олигонуклеотида.
Модификации по отношению к антисмысловым соединениям охватывают замены или изменения в межнуклеозидных связях, сахарных частях или нуклеотидных основаниях. Модифицированные антисмысловые соединения часто являются предпочтительней нативных форм, благодаря желаемым свойствам, таким как, например, усиленное клеточное поглощение, усиленная аффинность по отношению к мишени-нуклеиновой кислоте, повышенная стабильность в присутствии нуклеаз или повышенная ингибиторная активность.
Химически модифицированные нуклеозиды также могут быть использованы для повышения аффинности связывания укороченного или процессированного антисмыслового олигонуклеотида с его мишеневой нуклеиновой кислотой. Следовательно, сопоставимые результаты часто могут быть получены с более короткими антисмысловыми соединениями, которые содержат такие химически модифицированные нуклеозиды.
Модифицированные межнуклеозидные связи
Природная межнуклеозидная связь в РНК и ДНК является 3'- - 5'-фосфодиэфирной связью. Антисмысловые соединения, содержащие одну или несколько модифицированных, т.е. неприродных, межнуклеозидных связей, выбираются чаще антисмысловых соединений, содержащих природные межнуклеозидные связи, благодаря желаемым свойствам, таким как, например, усиленное клеточное поглощение, усиленная аффинность по отношению к мишеневым нуклеиновым кислотам, повышенная стабильность в присутствии нуклеаз.
Олигонуклеотиды с модифицированными межнуклеозидными связями содержат межнуклеозидные связи, в которых сохраняется атом фосфора, а также межнуклеозидные связи, в которых нет атома фосфора. Типичными предусматривающими фосфор межнуклеозидными связями являются без ограничения фосфодиэфирные, фосфотриэфирные, метилфосфонатные, фосфорамидатная и фосфоротиоатные. Способы получения содержащих фосфор и не содержащих фосфор связей хорошо известны.
Согласно определенным вариантам осуществления антисмысловые соединения, нацеленные на нуклеиновую кислоту гентингтина, содержат одну или несколько модифицированных межнуклеозидных связей. Согласно определенным вариантам осуществления модифицированными межнуклеозидными связями являются фосфоротиоатные связи. Согласно определенным вариантам осуществления каждая межнуклеозидная связь антисмыслового соединения является фосфоротиоатной межнуклеозидной связью.
Модифицированные сахарные части
Антисмысловые соединения необязательно могут содержать один или несколько нуклеозидов, в которых сахарная группа была модифицирована. Такие нуклеозиды с модифицированным сахаром могут обеспечивать улучшенную стабильность к нуклеазам, повышенную аффинность связывания или некоторое другое полезное биологическое свойство антисмысловым соединениям. Согласно определенным вариантам осуществления нуклеозиды содержат химически модифицированные рибофуранозные кольцевые части. Примеры химически модифицированных рибофуранозных колец предусматривают без ограничения добавление замещающих групп (включая 5'- и 2'-замещающие группы, образование мостиковой связи негеминальных кольцевых атомов с образованием бициклических нуклеиновых кислот (BNA), замещение рибозильного кольцевого атома кислорода на S, N(R) или C(R1)(R)2 (R=Н, С1-С12алкил или защитная группа) и их комбинации). Примерами химически модифицированных Сахаров являются замещенный 2'-F-5'-метилом нуклеозид (другие раскрытые 5',2'-бис-замещенные нуклеозиды см. в международной заявке PCT/WO2008/101157, опубликованной 21 августа 2008 г.) или замещение риброзильного кольцевого атома кислорода на S с последующей заменой в 2'-положении (см. опубликованную заявку на выдачу патента США №2005-0130923, опубликованную 16 июня 2005 г.) или, альтернативно, 5'-заменав BNA (см. международную заявку PCT/WO2007/134181, опубликованную 22 ноября 2007 г., где LNA замещена, например, 5'-метильной или 5'-винильной группой).
Примерами нуклеозидов, содержащих модифицированные сахарные части, являются без ограничения нуклеозиды, содержащие 5'-винильную, 5'-метильную (R или S), 4'-S, 2'-F, 2'-ОСН3 и 2'-O(СН2)2OCH3 замещающие группы. Заместитель в 2'-положении также может быть выбран из аллила, амино, азидо, тио, O-аллила, О-С1-С10алкила, OCF3, O(CH2)SCH3, O(CH2)2-O-N(Rm)(Rn) и O-CH2-C(=O)-N(Rm)(Rn), где каждый Rm и Rn независимо представляют собой Н или замещенный, или незамещенный C1-С10алкил.
Примерами бициклических нуклеиновых кислот (BNA) являются без ограничения нуклеозиды, содержащие мостик между 4'- и 2'-рибозильными кольцевыми атомами. Согласно определенным вариантам осуществления антисмысловые соединения, предусмотренные в настоящем документе, содержат один или несколько нуклеозидов BNA, где мостик характеризуется одной из формул: 4'-(СН2)-O-2' (LNA); 4'-(CH2)-S-2'; 4'-(СН2)-O-2' (LNA); 4'-(CH2)2-O-2' (ENA); 4'-С(СН3)2-O-2' (см. PCT/US2008/068922); 4'-СН(СН3)-O-2' и 4'-СН(CH2OCH3)-O-2' (см. патент США №7399845, выданный 15 июля 2008 г.); 4'-СН2-N(ОСН3)-2' (см. PCT/US2008/064591); 4'-CH2-O-N(CH3)-2' (см. опубликованную заявку на выдачу патента США US2004-0171570, опубликованную 2 сентября 2004 г.); 4'-CH2-N(R)-O-2' (см. патент США №7427672, выданный 23 сентября 20085 г.); 4'-СН2-С(СН3)-2' и 4'-СН2-С(=СН2)-2' (см. PCT/US2008/066154); и где R независимо представляет собой Н, С1-С12алкил или защитную группу. Каждая из вышеупомянутых BNA содержит различные стереохимические конфигурации сахара, включая, например, α-L-рибофуранозу и β-D-рибофуранозу (см. международную заявку РСТ PCT/DK98/00393, опубликованную 25 марта 1999 г. как WO 99/14226).
Согласно определенным вариантам осуществления нуклеозиды модифицированы путем замещения рибозильного кольца заменителем сахара. Такая модификация предусматривает без ограничения замещение рибозильного кольца кольцевой системой заместителя (иногда называемой аналогами ДНК), такой как морфолиновое кольцо, циклогексенильное кольцо, циклогексильное кольцо или тетрагидропиранильное кольцо, такое как характеризующееся одной из формул:
 .
.
Также из предшествующего уровня техники известны многие другие бициклические и трициклические кольцевые системы заменителей сахара, которые могут использоваться для модификации нуклеозидов для включения в антисмысловые соединения (см., например, обзорную статью Leumann, J. С, Bioorganic & Medicinal Chemistry, 2002, 10, 841-854). Такие кольцевые системы могут подлежать различным дополнительным заменам для усиления активности.
Способы получений модифицированных Сахаров хорошо известны специалистам в настоящей области техники.
В нуклеотидах с модифицированными сахарными частями части нуклеотидных оснований (природные, модифицированные или их комбинации) содержатся для гибридизации с надлежащей нуклеиновой кислотой-мишенью.
Согласно определенным вариантам осуществления антисмысловые соединения, нацеленные на нуклеиновую кислоту гентингтина, содержат один или несколько нуклеотидов с модифицированной сахарной частью. Согласно определенным вариантам осуществления модифицированной сахарной частью является 2'-МОЕ. Согласно определенным вариантам осуществления модифицированные 2'-МОЕ нуклеотиды упорядочены в гэпмерный мотив.
Модифицированные нуклеотидные основания
Модификации или замены нуклеотидного основания (или основания) являются структурно отличающимися от природных или синтетических немодифицированных нуклеотидных оснований, хотя функционально равнозначны им. И природные, и модифицированные нуклеотидные основания способны участвовать в водородном спаривании. Такие модификации нуклеотидного основания могут обеспечивать антисмысловым соединениям стабильность по отношению к нуклеазам, аффинность связывания или некоторое другое полезное биологическое свойство. Модифицированные нуклеотидные основания содержат синтетические и природные нуклеотидные основания, такие как, например, 5-метилцитозин (5-me-С). Определенные замены нуклеотидного основания, включая 5-метилцитозиновые замены, особенно применимы для усиления аффинности связывания антисмыслового соединения с мишеневой нуклеиновой кислотой. Например, 5-метилцитозиновые замены, как было показано, повышают стабильность дуплексной нуклеиновой кислоты на 0,6-1,2°С (Sanghvi, Y.S., Crooke, S.T. and Lebleu, В., eds., Antisense Research and Applications, CRC Press, Boca Raton, 1993, pp.276-278).
Дополнительные немодифицированные нуклеотидные основания содержат 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил и другие алкильные производные аденина и гуанина, 2-пропил и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галогенурацил и цитозин, 5-пропинил(-С≡С-СН3)урацил и цитозин, а также другие алкинильные производные пиримидиновых оснований, 6-азоурацил, цитозин и тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-галоген, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-галоген, в частности, 5-бром, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 2-F-аденин, 2-аминоаденин, 8-азагуанин и 8-азааденин, 7-дезазагуанин и 7-дезазааденин, а также 3-дезазагуанин и 3-дезазааденин.
Части гетероциклического основания также могут содержать такие, в которых пуриновое или пиримидиновое основание замещено другими гетероциклами, например, 7-дезазааденин, 7-дезазагуанозин, 2-аминопиридин и 2-пиридон. Нуклеотидные основания, которые особенно применимы для усиления аффинности связывания антисмысловых соединений, содер жат 5-замещенные п иримидины, 6-азапиримидины и N-2, N-6 и О-6 замещенные пурины, в том числе 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин.
Согласно определенным вариантам осуществления антисмысловые соединения, нацеленные на нуклеиновую кислоту гентингтина, содержат одно или несколько модифицированных нуклеотидных оснований. Согласно определенным вариантам осуществления гэп-фланкированные антисмысловые олигонуклеотиды, нацеленные на нуклеиновую кислоту гентингтина, содержат одно или несколько модифицированных нуклеотидных оснований. Согласно определенным вариантам осуществления модифицированным нуклеотидным основанием является 5-метилцитозин. Согласно определенным вариантам осуществления каждый цитозин является 5-метилцитозином.
Композиции и способы составления фармацевтических композиций Антисмысловые олигонуклеотиды могут быть смешаны с фармацевтически приемлемым активным или инертным веществом для получения фармацевтических композиций или составов. Композиции и способы для состава фармацевтических композиций зависят от ряда критериев, включая без ограничения путь введения, степень заболевания или дозу, подлежащую введению.
Антисмысловое соединение, нацеленное на нуклеиновую кислоту гентингтина, может быть использовано в фармацевтических композициях путем комбинирования антисмыслового соединения с подходящим фармацевтически приемлемым разбавителем или носителем. Фармацевтически приемлемый разбавитель содержит фосфатно-солевой буферный раствор (PBS). PBS является разбавителем, подходящим для применения в композициях, подлежащих парентеральной доставке. Соответственно, согласно одному варианту осуществления в с пособах, описанных в настоящем документе, используется фармацевтическая композиция, содержащая антисмысловое соединение, нацеленное на нуклеиновую кислоту гентингтина, и фармацевтически приемлемый разбавитель. Согласно определенным вариантам осуществления фармацевтически приемлемым разбавителем является PBS. Согласно определенным вариантам осуществления антисмысловым соединением является антисмысловой олигонуклеотид.
Фармацевтические композиции, содержащие антисмысловые соединения, предусматривают любые фармацевтически приемлемые соли, сложные эфиры или соли таких сложных эфиров или любой другой олигонуклеотид, который при введении животному, в том числе человеку, способен обеспечивать (непосредственно или косвенно) биологически активный метаболит или его остаток. Соответственно, например, раскрытие также предусматривает фармацевтически приемлемые соли антисмысловых соединений, пролекарства, фармацевтически приемлемые соли таких пролекарств и другие биоэквиваленты. Подходящими фармацевтически приемлемыми солями являются без ограничения натриевая и калиевая соли.
Пролекарство может характеризоваться включением дополнительных нуклеозидов на одном или обоих концах антисмыслового соединения, которые отщепляются эндогенными нуклеазами в организме с образованием активного антисмыслового соединения.
Сопряженные антисмысловые соединения
Антисмысловые соединения могут быть ковалентно связаны с одной или несколькими частями или конъюгатами, которые усиливают активность, к леточное распределение или клеточное поглощение образованных антисмысловых олигонуклеотидов. Типичные сопряженные группы содержат холестериновые части и липидные части. Дополнительные сопряженные группы содержат углеводы, фосфолипиды, биотин, феназин, фолат, фенантридин, антрахинон, акридин, флуоресцеины, родамины, кумарины и красители.
Антисмысловые соединения также могут быть модифицированы с включением одной или нескольких стабилизирующих групп, которые обычно присоединяются к одному или обоим концам антисмысловых соединений для усиления свойств, таких как, например, стабильность по отношению к нуклеазе. Стабилизирующие группы содержат кэп-структуры. Эти концевые модификации защищают антисмысловое соединение с концевой нуклеиновой кислот ой от разрушения экзонуклеазой и могут способствовать доставке и/или локализации в клетке. Кэп может присутствовать на 5'-конце (5'-кэп) или на 3'-конце (3'-кэп) или может присутствовать на обоих концах. Кэп-структуры хорошо известны из предшествующего уровня техники и содержат, например, преобразованные дезокси-кэпы с удаленными азотистыми основаниями. Дополнительные 3'- и 5'-стабилизирующие группы, которые могут использоваться для кэпирования одного или обоих концов антисмыслового соединения, для обеспечения стабильности по отношению к нуклеазе предусматривают раскрытые в WO 03/004602, опубликованной 16 января 2003 г.
Клеточная культура и обработка антисмысловым соединением
Эффекты антисмысловых соединений на содержание, активность или экспрессию нуклеиновых кислот гентингтина могут быть протестированы in vitro на различных типах клеток. Типы клеток, использованные для таких анализов, доступны от коммерческих производителей (например. Американская коллекция типовых культур, Manassus, VA; Zen-Bio, Inc., Research Triangle Park, NC; Clonetics Corporation, Walkersville, MD), и клетки культивируются в соответствии с инструкциями производителя с использованием коммерчески доступных реагентов (например, Invitrogen Life Technologies, Carlsbad, CA). Иллюстративные типы клеток содержат без ограничения клетки HepG2, клетки Нер3В, первичные гепатоциты, клетки А549, фибробласты GM04281 и клетки LLC-MK2.
In vitro тестирование антисмысловых олигонуклеотидов
В настоящем документе описаны способы обработки клеток антисмысловыми олигонуклеотидами, которые могут быть модифицированы надлежащим образом для обработки другими антисмысловыми соединениями.
В основном клетки обрабатываются антисмысловыми олигонуклеотидами при достижении приблизительно 60-80% конфлюентности клеток в культуре.
Одним реагентом, обычно используемым для введения антисмысловых олигонуклеотидов в культивированные клетки, является реагент для катионной липидной трансфекции LIPOFECTIN® (Invitrogen, Carlsbad, СА). Антисмысловые олигонуклеотиды смешиваются с LIPOFECTIN® в OPTI-MEM® 1 (Invitrogen, Carlsbad, СА) для достижения желаемой конечной концентрации антисмыслового олигонуклеотида и концентрации LIPOFECTIN®, которая типично варьирует от 2 до 12 мкг/мл на 100 нМ антисмыслового олигонуклеотида.
Другим реагентом, используемым для введения антисмысловых олигонуклеотидов в культивируемые клетки, является LIPOFECTAMINE 2000® (Invitrogen, Carlsbad, CA). Антисмысловой олигонуклеотид смешивается с LIPOFECTAMINE 2000® в среде с пониженным содержанием сыворотки крови OPTI-MEM® I (Invitrogen, Carlsbad, СА) для достижения же лаемой к онцентрации ан тисмыслового олигонуклеотида и концентрации LIPOFECTAMINE®, которая типично варьирует от 2 до 12 мкг/мл на 100 нМ антисмыслового олигонуклеотида.
Другим реагентом, используемым для введения антисмысловых олигонуклеотидов в культивируемые клетки, является Cytofectin® (Invitrogen, Carlsbad, СА). Антисмысловой олигонуклеотид смешивается с Cytofectin® в среде с пониженным содержанием сыворотки крови OPTI-MEM® 1 (Invitrogen, Carlsbad, СА) для достижения желаемой концентрации антисмыслового олигонуклеотида и концентрации Cytofectin®, которая типично варьирует от 2 до 12 мкг/мл на 100 нМ антисмыслового олигонуклеотида.
Другой технологией, используемой для введения антисмысловых олигонуклеотидов в культивируемые клетки, является электропорация.
Клетки обрабатываются антисмысловыми олигонуклеотидами с помощью стандартных способов. Клетки, как правило, собираются через 16-24 часа после обработки антисмысловым олигонуклеотидом, в это время содержание РНК или белка мишеневых нуклеиновых кислот измеряются способами, известными из предшествующего уровня техники и описанными в настоящем документе. В основном, когда обработки выполняются в нескольких повторностях, данные представляются как среднее повторных обработок.
Концентрация используемого антисмыслового олигонуклеотида варьирует между клеточными линиями. Способы определения оптимальной концентрации антисмыслового олигонуклеотида для конкретной клеточной линии хорошо известны из предшествующего уровня техники. Антисмысловые олигонуклеотиды типично используются при концентрациях, варьирующих от 1 нМ до 300 нМ при трансфекции с LIPOFECTAMINE 2000®, липофектином или цитофектином. Антисмысловые олигонуклеотиды используются при более высоких концентрациях, варьирующих от 625 до 20000 нМ, при трансфекции с использованием электропорации.
Выделение РНК
Анализ РНК может быть выполнен на общей клеточной РНК или poly(A)+мРНК. Способы выделения РНК хорошо известны из предшествующего уровня техники. РНК получается с использованием способов, хорошо известных из предшествующего уровня техники, например, с использованием реагента TRIZOL® (Invitrogen, Carlsbad, CA) в соответствии с протоколами, рекомендованными изготовителем.
Анализ ингибирования содержания или экспрессии мишени
Ингибирование содержания или экспрессии нуклеиновой кислоты гентингтина может быть проанализировано различными путями, известными из предшествующего уровня техники. Например, содержание мишеневой нуклеиновой кислоты может быть определено количественно, например, анализом нозерн-блоттинга, конкурентной полимеразной цепной реакцией (ПЦР) или количественной ПЦР в реальном времени. Анализ РНК может быть выполнен на общей клеточной РНК или poly(A)+мРНК. Способы выделения РНК хорошо известны из предшествующего уровня техники. Также стандартным в предшествующем уровне техники является анализ нозерн-блоттинга, Количественная ПЦР в реальном времени может традиционно выполняться с использованием коммерчески доступной системы выявления последовательностей ABI PRISM® 7600, 7700 или 7900, доступной от PE-Applied Biosystems, Foster City, CA, и используемой в соответствии с инструкциями изготовителя.
Анализ количественной ПЦР в реальном времени содержания мишеневой РНК
Количественное определение содержания мишеневой РНК может быть выполнено с помощью количественной ПЦР в реальном времени с использованием системы выявления последовательностей ABI PRISM® 7600, 7700 или 7900 (PE-Applied Biosystems, Foster City, CA) в соответствии с инструкциями изготовителя. Способы количественной ПЦР в реальном времени хорошо известны из предшествующего уровня техники.
Перед ПЦР в реальном времени выделенную РНК подвергают воздействию реакции обратной транскриптазы (RT), которая продуцирует комплементарную ДНК (кДНК), которую затем используют в качестве субстрата для амплификации при ПЦР в реальном времени. Реакции RT и ПЦР в реальном времени выполняют последовательно в одной и той же лунке с образцом. Реагенты для RT и ПЦР в реальном времени получают от Invitrogen (Carlsbad, CA). Реакции RT и ПЦР в реальном времени выполняют способами, хорошо известными специалистам в настоящей области техники.
Количества мишеневого гена (или РНК), полученные с помощью ПЦР в реальном времени, нормализуют либо с использованием уровня экспрессии гена, чья экспрессия является постоянной, такого как циклофилин А, либо с помощью количественного определения общей РНК с использованием RIBOGREEN® (Invitrogen, Inc., Carlsbad, CA). Экспрессию циклофилина А количественно определяют с помощью ПЦР в реальном времени, что проводят одновременно с мишенью, совместно или отдельно. Общую РНК количественно определяют с использованием реагента для количественного определения РНК RIBOGREEN® (Invitrogen, Inc., Eugene, OR). Способы количественного определения РНК с помощью RIBOGREEN® изложены у Jones, L.J., et al, (Analytical Biochemistry, 1998, 265, 368-374). Для измерения флуоресценции RIBOGREEN® используют инструмент CYTOFLUOR® 4000 (РЕ Applied Biosystems).
Зонды и праймеры разработаны для гибридизации с нуклеиновой кислотой гентингтина. Способы разработки зондов и праймеров для ПЦР в реальном времени хорошо известны из предшествующего уровня техники и могут предусматривать применение программного обеспечения, такого как про граммное обеспечение PRIMER EXPRESS® (Applied Biosystems, Foster City, CA).
Анализ содержания белка
Антисмысловое ингибирование нуклеиновых кислот гентингтина можно оценить путем измерения содержания белка гентингтина. Содержание белка гентингтина может быть оценено или количественно определено различными путями, хорошо известными из предшествующего уровня техники, такими как им мунопреципитация, вестерн-блоттинг (иммуноблоттинга), иммуносорбентный анализ с ферментной меткой (ELISA), анализы количественного определения белка, анализы активности белка (например, анализы активности каспазы), иммуногистохимия, иммуноцитохимия или клеточная сортировка с возбуждением флуоресценции (FACS). Направленные на мишень антитела могут быть идентифицированы и получены из ряда источников, таких как каталог антител MSRS (Aerie Corporation, Birmingham, MI), или могут быть получены путем традиционных способов образования моноклональных или поликлональных антител, хорошо известных из предшествующего уровня техники. Антитела, применимые для выявление гентингтина человека и крысы, коммерчески доступны.
In vivo тестирование антисмысловых соединений
Антисмысловые соединения, например антисмысловые олигонуклеотиды, тестируются на животных для оценки их способности ингибировать экспрессию гентингтина и производить фенотипические изменения. Тестирование может быть выполнено на нормальных животных или на экспериментальных моделях заболевания. Для введения животным антисмысловые олигонуклеотиды включают в состав с фармацевтически приемлемым разбавителем, таким как фосфатно-солевой буферный раствор. Введение предусматривает парентеральные пути введения. После периода обработки антисмысловыми олигонуклеотидами из ткани выделяют РНК и измеряют изменения экспрессии нуклеиновой кислоты гентингтина. Также измеряют изменения содержания белка гентингтина.
Определенные соединения
Около тысячи семисот новых разработанных антисмысловых соединений различной длины, мотивов и композиции скелета тестировали по их влиянию на мРНК гентингтина человека in vitro на нескольких типах клеток. Новые соединения сравнивали с приблизительно двумястами пятьюдесятью ранее разработанными соединениями, включая ISIS 387916, которое ранее было определено как одно из наиболее эффективных антисмысловых соединений in vitro (смотри, например, патентные публикации США №№2008/0039418 и 2007/0299027). Из приблизительно тысячи семисот новых разработанных антисмысловых соединений приблизительно шестьдесят соединений отбирали для дальнейшего исследования на основе in vitro эффективности по сравнению с ISIS 387916. Отобранные соединения тестировали по системной переносимости (см. пример 3), а также активности и переносимости в головном мозге мышей BACHD (см. пример 4) по сравнению с ранее разработанными ISIS 388241 и ISIS 387916. Согласно этим исследованиям соединения, характеризующиеся последовательностью нуклеотидных оснований последовательности, изложенной в SEQ ID NO:6, 9, 10, 11, 12, 13, 14, 15, 18, 19, 20, 21, 23, 24, 25, 26, 27, 28, 29, 30, 32, 33, 35, 36, 10, 11, 12, 13, 18, 22 или 32,выбирали по высокой переносимости и высокой эффективности in vivo. На основании их комплементарной последовательности соединения комплементарны участкам 4384-4403, 4605-4624, 4607-4626, 4608-4627, 4609-4628, 4610-4629, 4617-4636, 4622-4639, 4813-4832, 4814-4833, 4823-4842, 4860-4877, 4868-4887, 4925-4944, 4928-4947, 4931-4950, 4931-4948, 4955-4974, 4960-4977, 5801-5820, 5809-5828, 5809-5826, 101088-101105, 115066-115085, 4607-4626, 4608-4627, 4609-4628, 4610-4629, 4813-4832, 4862-4881, 5809-5828 или 4928-4947 SEQ ID NO:1. Согласно определенным вариантам осуществления соединения, нацеливающиеся на перечисленные участки, как далее описано в настоящем документе, содержат модифицированный олигонуклеотид с некоторой частью нуклеотидных оснований последовательности, изложенной в SEQ ID NO, как далее описано в настоящем документе. Согласно определенным вариантам осуществления соединения, нацеливающиеся на перечисленные участки или содержащие часть нуклеотидных оснований последовательности, изложенной в перечисленных SEQ ID NO, могут характеризоваться различной длиной, как далее описано в настоящем документе, и могут содержать один из различных мотивов, как далее описано в настоящем документе. Согласно определенным вариантам осуществления соединение, нацеливающееся на участок или содержащее часть нуклеотидных оснований последовательности, изложенной в перечисленных SEQ ID NO, характеризуется определенной длиной и мотивом, как показано с помощью №№ ISIS: ISIS 419628, ISIS 419637, ISIS 419640, ISIS 419641, ISIS 451541, ISIS 419642, ISIS 436665, ISIS 436671, ISIS 436684, ISIS 436689, ISIS 436754, ISIS 437168, ISIS 437175, ISIS 437441, ISIS 437442, ISIS 437507, ISIS 437527, ISIS 443139, ISIS 444578, ISIS 444584, ISIS 444591, ISIS 444607, ISIS 444608, ISIS 444615, ISIS 444618, ISIS 444627, ISIS 444652, ISIS 444658, ISIS 444659, ISIS 444660, ISIS 444661 или ISIS 444663.
Соединения, описанные выше как характеризующиеся высокой эффективностью in vivo и переносимостью, за тем тестировали с помощью болюсной инъекции в ЦНС на крысе для дальнейшего оценивания нейротоксичности (см. пример 5) вместе с некоторыми дополнительными соединениями, содержащими последовательность нуклеотидных оснований последовательности, изложенной в SEQ ID NO:7, 8, 11, 16, 17. Из них отбирали десять соединений с последовательностью нуклеотидных оснований последовательности, изложенной в SEQ ID NO:24, 25, 26, 6, 12, 28, 21, 22, 32 или 13, как характеризующиеся высокой переносимостью. На основании их комплементарной последовательности соединения являются комплементарными участкам 4384-4403, 4609-4628, 4610-4629, 4860-4877, 4862-4881, 4925-4944, 4928-4947, 4931-4950, 4955-4974 или 5809-5829 SEQ ID NO:1. Согласно определенным вариантам осуществления соединения, нацеливающиеся на перечисленные участки, как далее описано в настоящем документе, содержат модифицированный олигонуклеотид с некоторой частью нуклеотидных оснований последовательности, изложенной в SEQ ID NO, как далее описано в настоящем документе. Согласно определенным вариантам осуществления соединения, нацеливающиеся на перечисленные участки или содержащие часть нуклеотидных оснований последовательности, изложенной в перечисленных SEQ ID NO, могут характеризоваться различной длиной, как далее описано в настоящем документе, и могут содержать один из разнообразных мотивов, как далее описано в настоящем документе. Согласно определенным вариантам осуществления соединение, нацеливающееся на участок или содержащее часть нуклеотидных оснований последовательности, изложенной в перечисленных SEQ ID NO, характеризуется определенной длиной и мотивом, как показано с помощью №№ ISIS: ISIS 419640, ISIS 419641, ISIS 419642, ISIS 436665, ISIS 436671, ISIS 436689, ISIS 437507, ISIS 443139, ISIS 444591 и ISIS 444661. Выбранные соединения сравнивали с ранее разработанным соединением ISIS 388241 путем ICV введения мышам BACHD.
Затем проводили дополнительные исследования на соединениях, описанных выше как характеризующиеся высокой эффективностью in vivo и переносимостью. Дополнительные исследования разрабатывали для дальнейшего оценивания нейротоксичности. Исследования предусматривают ICV введение мыши дикого типа (см. пример 16) и болюсное введение крысе (см. пример 17). SEQ ID NO:12, 22, 28, 30, 32 и 33 выбирали как характеризующиеся высокой нейропереносимостью. На основании их комплементарной последовательности соединения комплементарны участкам 4862-4881, 4609-4628, 5809-5828, 5809-5826, 5801-5820 и 4955-4974 SEQ ID NO:1. Согласно определенным вариантам осуществления соединения, нацеливающиеся на перечисленные участки, как далее описано в настоящем документе, со держат модифицированный олигонуклеотид, содержащий некоторую часть нуклеотидных оснований последовательности, изложенной в SEQ ID NO, как далее описано в настоящем документе. Согласно определенным вариантам осуществления соединения, нацеливающиеся на перечисленные участки или содержащие часть нуклеотидных оснований последовательности, изложенной в перечисленных SEQ ID NO, может характеризоваться различной длиной, как далее описано в настоящем документе, и может содержать один из различных мотивов, как далее описано в настоящем документе. Согласно определенным вариантам осуществления соединение, нацеливающееся на участок или содержащее часть нуклеотидных оснований последовательности, изложенной в перечисленных SEQ ID NO, характеризуется определенной длиной и мотивом, как показано с помощью ISIS 388241, ISIS 443139, ISIS 436671, ISIS 444591, ISIS 437527, ISIS 444584, ISIS 444652 и ISIS 436689.
Соответственно, настоящим документом предусмотрены антисмысловые соединения с улучшенными характеристиками. Согласно определенным вариантам осуществления настоящим документом предусмотрены соединения, содержащие модифицированный олигонукпеотид, как далее описано в настоящем документе, нацеленный на участок нуклеотидов SEQ ID NO:1 или специфично гибридизуемый с таковым.
Согласно определенным вариантам осуществления соединения, как описано в настоящем документе, являются эффективными на основании по меньшей мере одного из IC50 in vitro менее чем 7 мкМ, менее чем 6 мкМ, менее чем 5 мкМ, менее чем 4 мкМ, менее чем 3 мкМ, менее чем 2 мкМ, менее чем 1 мкМ при доставке в клеточную линию фибробластов человека, как описано в настоящем документе, или ED50 менее чем 10 мкг, менее чем 9 мкг, менее чем 8 мкг, менее чем 7,5 мкг, менее чем 7,4 мкг, менее чем 7,0 мкг, менее чем 6 мкг, менее чем 5 мкг, менее чем 4 мкг, менее чем 3 мкг или менее чем 2 мкг при болюсной инъекции. Как описано в настоящем документе, ICV инфузия может приводить к значениям ED50 в 3-4 выше для соединений, описанных в настоящем документе. Согласно определенным вариантам осуществления соединения, как описано в настоящем документе, являются высоко переносимыми, как показано по меньшей мере одним из увеличения значения ALT или AST не более чем в 4 раза, 3 раза или 2 раза по сравнению с таковым у животных, обработанных солевым раствором; увеличения массы печени, селезенки или почки не более чем на 30%, 20%, 15%, 12%, 10%, 5% или 2% или увеличения содержания AIF1 не более чем на 350%, 300%, 275%, 250% 200%, 150% или 100% по сравнению с контролем.
Определенные критерии
Согласно определенным вариантам осуществления настоящим документом предусмотрены способы лечения субъекта, предусматривающие введение одной или нескольких фармацевтических композиций, как описано в настоящем документе. Согласно определенным вариантам осуществления субъект страдает болезнью Гентингтона.
Как показано в примерах ниже, соединения, нацеленные на гентингтин, как описано в настоящем документе, вызывали уменьшение тяжести физиологических симптомов болезни Гентингтона. В некоторых из экспериментов соединения снижали скорость дегенерации, например, у животных продолжали наблюдаться симптомы, но симптомы были менее тяжелыми по сравнению с необработанными животными. Однако в других экспериментах соединения, как выявлено, с течением времени приводят к восстановлению функции; например, у животных, обрабатываемых в течение более длительного периода времени, наблюдались менее тяжелые симптомы, чем у тех, которым вводили соединения в течение более короткого периода времени. Как обсуждалось выше, болезнь Гентингтона является дегенеративным заболеванием с развитием, охарактеризованным увеличением тяжести симптомов с течением времени. Способность соединений, приведенных ниже по отношению к восстановлению функции, следовательно, демонстрирует, что симптомы заболевания могут быть обращены с помощью лечения соединением, как описано в настоящем документе.
Соответственно, настоящим документом предусмотрены способы облегчения симптома, связанного с болезнью Гентингтона, у субъекта, нуждающегося в этом. Согласно определенным вариантам осуществления предусмотрен способ снижения скорости возникновения симптома, связанного с болезнью Гентингтона. Согласно определенным вариантам осуществления предусмотрен способ уменьшения тяжести симптома, связанного с болезнью Гентингтона. Согласно определенным вариантам осуществления предусмотрен способ восстановления неврологической функции, как показано положительной динамикой симптома, с вязанного с болезнью Гентингтона. В таких вариантах осуществления способы предусматривают введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения, нацеленного на нуклеиновую кислоту гентингтина.
Болезнь Гентингтона характеризуется рядом физических, неврологических, психиатрических и/или периферических симптомов. Любой симптом, известный специалисту в настоящей области, являющийся связанным с болезнью Гентингтона, может быть облегчен или иным путем модулирован, как изложено выше, способами, описанными выше. Согласно определенным вариантам осуществления симптомом является физический симптом, выбранный из группы, состоящей из тревожности, отсутствия координации, непреднамеренного начала движений, непреднамеренных незавершенных движений, неустойчивой походки, хореи, оцепенелости, корченных движений, аномальной позы, неустойчивости, ненормальных выражений лица, затруднения жевания, затруднения глотания, затруднения речи, припадка и нарушений сна. Согласно определенным вариантам осуществления симптомом является когнитивный симптом, выбранный из группы, состоящей из ухудшенного планирования, ухудшенной гибкости, ухудшенного абстрактного мышления, ухудшенного усвоения правил, ухудшенного начала надлежащих действий, ухудшенного подавления ненадлежащих действий, ухудшенной кратковременной памяти, ухудшенной долговременной памяти, паранойи, дезориентации, спутанности сознания, галлюцинации и деменции. Согласно определенным вариантам осуществления симптомом является психиатрический симптом, выбранный из группы, состоящей из тревожности, депрессии, эмоциональной тупости, эгоцентризмов, агрессии, компульсивного поведения, раздражительности и суицидального настроения. Согласно определенным вариантам осуществления симптомом является периферический симптом выбранный из группы, состоящей из сниженной массы головного мозга, мышечной атрофии, сердечной недостаточности, сниженной толерантности к глюкозе, потери массы, остеопороза и атрофии яичка.
Согласно определенным вариантам осуществления симптомом является тревожность. Согласно определенным вариантам осуществления симптомом является отсутствие координации. Согласно определенным вариантам осуществления симптомом является непреднамеренное начало движения. Согласно определенным вариантам осуществления симптомом является непреднамеренное незавершенное движение. Согласно определенным вариантам осуществления симптомом является неустойчивая походка. Согласно определенным вариантам осуществления симптомом является хорея. Согласно определенным вариантам осуществления симптомом является оцепенелость. Согласно определенным вариантам осуществления симптомом являются корченные движения. Согласно определенным вариантам осуществления симптомом является аномальная поза. Согласно определенным вариантам осуществления симптомом является неустойчивость. Согласно определенным вариантам осуществления симптомом являются ненормальные выражения лица. Согласно определенным вариантам осуществления симптомом является затруднение жевания. Согласно определенным вариантам осуществления симптомом является затруднение глотания. Согласно определенным вариантам осуществления симптомом является затруднение речи. Согласно определенным вариантам осуществления симптомом являются припадки. Согласно определенным вариантам осуществления симптомом является нарушения сна.
Согласно определенным вариантам осуществления симптомом является ухудшенное планирование. Согласно определенным вариантам осуществления симптомом является ухудшенная гибкость. Согласно определенным вариантам осуществления симптомом является ухудшенное абстрактное мышление. Согласно определенным вариантам осуществления симптомом является ухудшенное усвоение правил. Согласно определенным вариантам осуществления симптомом является ухудшенное начало надлежащих действий. Согласно определенным вариантам осуществления симптомом является ухудшенное подавление ненадлежащих действий. Согласно определенным вариантам осуществления симптомом является ухудшенная кратковременная память. Согласно определенным вариантам осуществления симптомом является ухудшенная долговременная память. Согласно определенным вариантам осуществления симптомом является паранойя. Согласно определенным вариантам осуществления симптомом является дезориентация. Согласно определенным вариантам осуществления симптомом является спутанность сознания. Согласно определенным вариантам осуществления симптомом является галлюцинация. Согласно определенным вариантам осуществления симптомом является деменция.
Согласно определенным вариантам осуществления симптомом является тревожность. Согласно определенным вариантам осуществления симптомом является депрессия. Согласно определенным вариантам осуществления симптомом является эмоциональная тупость. Согласно определенным вариантам осуществления симптомом является эгоцентризм. Согласно определенным вариантам осуществления симптомом является агрессия. Согласно определенным вариантам осуществления симптомом является компульсивное поведение. Согласно определенным вариантам осуществления симптомом является раздражительность. Согласно определенным вариантам осуществления симптомом является суицидальное настроение.
Согласно определенным вариантам осуществления симптомом является сниженная масса головного мозга. Согласно определенным вариантам осуществления симптомом является мышечная атрофия. Согласно определенным вариантам осуществления симптомом является сердечная недостаточность. Согласно определенным вариантам осуществления симптомом является сниженная толерантность к глюкозе. Согласно определенным вариантам осуществления симптомом является потеря массы. Согласно определенным вариантам осуществления симптомом является остеопороз. Согласно определенным вариантам осуществления симптомом является атрофия яичка.
Согласно определенным вариантам осуществления симптомы болезни Гентингтона могут поддаваться количественному определению. Например, остеопороз может быть измерен и определен количественно, например, с помощью сканирования плотности кости. Для таких симптомов согласно определенным вариантам осуществления симптом может быть уменьшен на приблизительно 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99% или на диапазон, определенный какими-либо двумя из этих значений.
Согласно определенным вариантам осуществления предусмотрены способы лечения субъекта, предусматривающие введение одной или нескольких фармацевтических композиций, как описано в настоящем документе. Согласно определенным вариантам осуществления субъект страдает болезнью Гентингтона.
Согласно определенным вариантам осуществления введение антисмыслового соединения, нацеленного на нуклеиновую кислоту гентингтина, приводит к ослаблению экспрессии гентингтина по меньшей мере на приблизительно 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99% или на диапазон, определенный какими-либо двумя из этих значений.
Согласно определенным вариантам осуществления фармацевтические композиции, содержащие антисмысловое соединение, нацеленное на гентингтин, используются для получения лекарственного препарата для лечения пациента, страдающего болезнью Гентингтона или восприимчивого к таковой.
Согласно определенным вариантам осуществления способы, описанные в настоящем документе, предусматривают введение соединения, содержащего модифицированный олигонуклеотид с частью смежных нуклеотидных оснований, как описано в настоящем документе, последовательности, изложенной в SEQ ID NO:6, 9, 10, 11, 12, 13, 14, 15, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 32, 33, 35, 36, 10, 11, 12, 13, 18, 22 или 32. Согласно определенным вариантам осуществления способы, описанные в настоящем документе, предусматривают введение соединения, содержащего модифицированный олигонуклеотид с частью смежных нуклеотидных оснований, как описано в настоящем документе, последовательности, изложенной в SEQ ID NO:12, 22, 28, 30, 32 и 33.
Введение
Согласно определенным вариантам осуществления соединения и композиции, как описано в настоящем документе, вводятся парентерально.
Согласно определенным вариантам осуществления парентеральное введение осуществляется с помощью инфузии. Инфузия может быть хронической или постоянной или краткой или интермиттирующей. Согласно определенным вариантам осуществления инфузируемые фармацевтические средства доставляются с насосом. Согласно определенным вариантам осуществления парентеральное введение осуществляется с помощью инъекции.
Согласно определенным вариантам осуществления соединения и композиции доставляются в ЦНС. Согласно определенным вариантам осуществления соединения и композиции доставляются в цереброспинальную жидкость. Согласно определенным вариантам осуществления соединения и композиции вводятся в паренхиму головного мозга. Согласно определенным вариантам осуществления соединения и композиции доставляются животному путем внутриоболочечного введения или внутрицеребровентрикулярного введения. Широкое распределение соединений и композиций, описанных в настоящем документе, в центральной нервной системе может быть достигнуто с внутрипаренхимальным введением, внутриоболочечным введением или внутрицеребровентрикулярным введением.
Согласно определенным вариантам осуществления парентеральное введение осуществляется с помощью инъекции. Инъекция может доставляться шприцем или насосом. Согласно определенным вариантам осуществления инъекцией является болюсная инъекция. Согласно определенным вариантам осуществления инъекция вводится непосредственно в ткань, такую как полосатое тело, хвостатое ядро, кора, гиппокамп и мозжечок.
Среднюю эффективную концентрацию (EC50) антисмысловых соединений для ингибирования экс прессии мРНК гентингтина рассчитывали либо после ICV инфузии, либо после болюсной инъекции (см. примеры 9 и 10). ЕС50 для соединения после инъекции внутрь полосатого тела определяли как 0,45 мг/г. EC50 после ICV введения определяли как 26,4 мкг/г.
Следовательно, согласно определенным вариантам осуществления доставка соединения или композиции, описанных в настоящем документе, может влиять на фармакокинетический профиль соединения или композиции. Согласно определенным вариантам осуществления инъекция соединения или композиции, описанных в настоящем документе, в мишеневую ткань улучшает фармакокинетический профиль соединения или композиции по сравнению с инфузией соединения или композиции. В определенном варианте осуществления инъекция соединения или композиции улучшает эффективность по сравнению с широкой диффузией, требуя введения меньшего количества соединения или композиции для достижения подобного фармакологического результата. Согласно определенным вариантам осуществления подобный фармакологический результат относится ко времени, за которое мишеневая мРНК и/или мишеневый белок понижающе регулируются (например, длительность действия). Согласно определенным вариантам осуществления способы определенной локализации фармацевтического средства, такой как с помощью болюсной инъекции, уменьшают среднюю эффективную концентрацию (ЕС50) с коэффициентом приблизительно 50 (например, для достижения того же или подобного фармакодинамического эффекта требуется в 50 раз меньшая концентрация в ткани). Согласно определенным вариантам осуществления способы определенной локализации фармацевтического средства, такие как с помощью болюсной инъекции, снижают среднюю эффективную концентрацию (EC50) с коэффициентом 20, 25, 30, 35, 40, 45 или 50. Согласно определенным вариантам осуществления фармацевтическим средством является антисмысловое соединение, как далее описано в настоящем документе. Согласно определенным вариантам осуществления мишеневой тканью является ткань головного мозга. Согласно определенным вариантам осуществления мишеневой тканью является стриарная ткань. Согласно определенным вариантам осуществления снижение EC50 желательно, поскольку оно уменьшает дозу, необходимую для достижения фармакологического результата у пациента, нуждающегося в этом.
Период полувыведения МОЕ-гэпмерных олигонуклеотидов в ткани головного мозга составляет приблизительно 20 суток (см. примеры 9-11). Длительность действия, как измерено с помощью ингибирования мРНК гентингтина, пролонгируется в головном мозге (см. примеры 9 и 10). Внутрицеребровентрикулярная инфузия антисмысловых олигонуклеотидов в течение 2 недель приводит к ингибированию мРНК гентингтина по меньшей мере на 50% в стриарной ткани мышей BACHD в течение по меньшей мере 91 суток после прекращения дозирования. Введение с помощью болюсной инъекции приводило к подобной длительности действия.
Согласно определенным вариантам осуществления доставка соединения или композиции, как описано в настоящем документе, в ЦНС приводит к 47% понижающей регуляции мишеневой мРНК и/или мишеневого белка в течение по меньшей мере 91 суток.
Согласно определенным вариантам осуществления доставка соединения или композиции приводит к по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70% или по меньшей мере 75% понижающей регуляции мишеневой мРНК и/или мишеневого белка в течение по меньшей мере 20 суток, по меньшей мере 30 суток, по меньшей мере 40 суток, по меньшей мере 50 суток, по меньшей мере 60 суток, по меньшей мере 70 суток, по меньшей мере 80 суток, по меньшей мере 85 суток, по меньшей мере 90 суток, по меньшей мере 95 суток, по меньшей мере 100 суток, по меньшей мере 110 суток, по меньшей мере 120 суток. Согласно определенным вариантам осуществления доставка в ЦНС осуществляется путем внутрипаренхимального введения, внутриоболочечного введения или внутрицеребровентрикулярного введения.
Согласно определенным вариантам осуществления антисмысловой олигонуклеотид доставляется инъекцией или инфузией один раз каждый месяц, каждые два месяца, каждые 90 суток, каждые 3 месяца, каждые 6 месяцев, дважды в год или один раз в год.
Определенные комбинированные типы терапии
Согласно определенным вариантам осуществления одна или несколько фармацевтических композиций вводятся совместно с одним или несколькими другими фармацевтическими средствами. Согласно определенным вариантам осуществления такое одно или несколько других фармацевтических средств разрабатываются для лечения одного и того же заболевания, нарушения или состояния как одна или несколько фармацевтических композиций, описанных в настоящем документе. Согласно определенным вариантам осуществления такое одно или несколько других фармацевтических средств разрабатываются для лечения другого заболевания, нарушения или состояния как одна или несколько фармацевтических композиций, описанных в настоящем документе. Согласно определенным вариантам осуществления такое одно или несколько других фармацевтических средств разрабатываются для лечения нежелательного побочного эффекта одной или нескольких фармацевтических композиций как описано в настоящем документе. Согласно определенным вариантам осуществления одна или несколько фармацевтических композиций вводятся совместно с другим фармацевтическим средством для лечения нежелательного эффекта указанного другого фармацевтического средства. Согласно определенным вариантам осуществления одна или несколько фармацевтических композиций вводятся совместно с другим фармацевтическим средством для получения комбинационного эффекта. Согласно определенным вариантам осуществления одна или несколько фармацевтических композиций вводятся совместно с другим фармацевтическим средством для получения синергического эффекта.
Согласно определенным вариантам осуществления одна или несколько фармацевтических композиций и одно или несколько других фармацевтических средств вводятся в одно и то же время. Согласно определенным вариантам осуществления одна или несколько фармацевтических композиций и одно или несколько других фармацевтических средств вводятся в разное время. Согласно определенным вариантам осуществления одна или несколько фармацевтических композиций и одно или несколько других фармацевтических средств получены вместе в одном составе. Согласно определенным вариантам осуществления одна или несколько фармацевтических композиций и одно или несколько других фармацевтических средств получены отдельно.
Согласно определенным вариантам осуществления фармацевтическими средствами, которые могут быть введены совместно с фармацевтической композицией, являются антипсихотические средства, такие как, например, галоперидол, хлорпромазин, клозапин, кветапин и оланзапин; антидепрессивные средства, такие как, например, флуоксетин, сетралина гидрохлорид, венлафаксин и нортиптилин; транквилизирующие средства, такие как, например, бензодиазепины, клоназепам, пароксетин, венлафаксин и бета-блокаторы; средства, стабилизирующие настроение, такие как, например, литий, валпроат, ламотригин и карбамазепин; паралитические средства, такие как, например, ботулинический токсин; и/или другие экспериментальные средства, включая без ограничения тетрабеназин (ксеназин), креатин, кофермент Q10, трегалозу, докозагексановые кислоты, ACR16, этил-ЕРА, атомоксетин, циталопрам, димебон, мемантин, фенилбутират натрия, рамелтеон, урсодиол, зипрекса, ксеназин, тиаприд, рилузол, амантадин, [123I]MNI-420, атомоксетин, тетрабеназин, дигоксин, детрометорфан, варфарин, алпрозам, кетоконазол, омепразол и миноциклин.
Примеры
Неограничивающее раскрытие и включение признаков посредством ссылки Тогда как определенные соединения, композиции и способы, описанные в настоящем документе, охарактеризованы конкретно в соответствии с определенными вариантами осуществления, следующие примеры служат исключительно для иллюстрации соединений, описанных в настоящем документе, и не предназначены для их ограничения. Каждая из ссылок, изложенных в настоящей заявке, включена в настоящий документ посредством ссылки во всей своей полноте.
Пример 1: Антисмысловые олигонуклеотиды, нацеленные на последовательности гена гентингтина человека
Около тысячи семисот недавно разработанных антисмысловых соединений с различной длиной, мотивами и композицией скелета, нацеливающиеся на последовательность гена гентингтина человека, тестировали в отношении их эффекта на мРНК гентингтина человека in vitro на нескольких типах клеток. Кроме того, эти гэпмеры разрабатывали с межнуклеозидными связями, которые представляют собой либо только лишь фосфоротиоатные связи (описанные в таблице 1), либо фосфоротиоатные и фосфодиэфирные связи (описанные в таблице 5). В таблицах 1 и 5 представлен целый ряд недавно разработанных олигоформ и два эталонных олигонуклеотида (разработанных и раскрытых ранее).
Гэпмеры с полностью фосфоротиоатными межнуклеозидными связями Некоторые из соединений, представленных в таблице 1, содержат мотив 5-10-5 МОЕ, 6-8-6 МОЕ или 5-8-5 МОЕ. Гэпмеры 5-10-5 содержат двадцать связанных нуклеозидов, где центральный гэп-сегмент характеризуется десятью 2'-дезоксинуклеозидами и фланкирован с обеих сторон (в 5'- и 3'-направлениях) фланкирующими сегментами, содержащими по пять нуклеозидов. Гэпмер 6-8-6 содержит двадцать связанных нуклеозидов, где центральный гэп-сегмент содержит восемь 2'-дезоксинуклеозидов и фланкирован с обеих сторон (в 5'- и 3'-направлениях) фланкирующими сегментами, содержащими по шесть нуклеозидов. Гэпмеры 5-8-5 содержат восемнадцать связанных нуклеозидов, где центральный гэп-сегмент содержит восемь 2'-дезоксинуклеозидов и фланкирован с обеих сторон (в 5'- и 3'-направлениях) фланкирующими сегментами, содержащими по пять нуклеозидов. Для всех гэпмеров, приведенных в таблице 1, каждый нуклеозид в 5'-фланкирующем сегменте и каждый нуклеозид в 3'-фланкирующем сегменте содержит модификацию 2'-МОЕ. Межнуклеозидные связи в каждом гэпмере являются фосфоротиоатными (P=S) межнуклеозидными связями. Все цитозины в каждом гэпмере являются 5-метилцитозинами. Каждый гэпмер в таблице 1 нацелен на SEQ ID NO:1 (№доступа в GENBANK NM_002111.6) или SEQ ID NO:2 (№доступа в GENBANK NTJ)06081.17, процессированную из нуклеотидов 462000-634000). «Сайт инициации» означает самый крайний с 5'-конца нуклеотид, на который нацелен гэпмер, в генной последовательности человека. «Сайт терминации» означает самый крайний с 3'-конца нуклеотид, на который нацелен гэпмер, в генной последовательности человека.
вая SEQ ID NO.
Комплементарность гэпмеров в таблице 1 последовательностям гена гентингтина мыши, макака-резуса и крысы также описаны в таблицах 2, 3 и 4.
Гэпмеры в таблице 2 являются комплементарными мРНК гентингтина мыши (№доступа в GENBANK NM_010414.1, обозначенной в настоящем документе как SEQ ID NO:3). «Мышиный мишеневый сайт инициации» означает самый крайний с 5'-конца нуклеотид, на который нацелен гэпмер в мышиной мРНК. «Мышиный мишеневый сайт терминации» означает самый крайний с 3'-конца нуклеотид, на который нацелен гэпмер в мышиной мРНК. «Человеческий мишеневый сайт инициации» означает самый крайний с 5'-конца нуклеотид, на который нацелен гэпмер, в человеческой генной последовательности. «Человеческий мишеневый сайт терминации» означает самый крайний с 3'-конца нуклеотид, на который нацелен гэпмер, в человеческой генной последовательности. «Число ошибочных спариваний» означает число ошибочных спариваний между человеческим олигонуклеотидом и последовательностью мРНК мыши.
Гэпмеры в таблице 3 являются комплементарными геномной последовательности гентингтина макака-резуса (комплементарной последовательности с №доступа в GENBANK NW_001109716,1, процессированной из нуклеотидов 698000-866000, обозначенной в настоящем документе как SEQ ID NO:4). «Мишеневый сайт инициации макака-резуса» означает самый крайний с 5'-конца нуклеотид, на который нацелен гэпмер, в генной последовательности макака-резуса. «Мишеневый сайт терминации макака-резуса» означает самый крайний с 3'-конца нуклеотид, на который нацелен гэпмер, в генной последовательности макака-резуса. «Человеческий мишеневый сайт инициации» означает самый крайний с 5'-конца нуклеотид, на который нацелен гэпмер, в человеческой генной последовательности. «Человеческий мишеневый сайт терминации» означает самый крайний с 3'-конца нуклеотид, на который нацелен гэпмер, в человеческой генной последовательности. «Число ошибочных спариваний» означает число ошибочных спариваний между человеческим олигонуклеотидом и генной последовательностью макака-резуса.
вая SEQ ID NO. человека
Гэпмеры в таблице 4 являются комплементарными мРНК гентингтина крысы (№доступа в GENBANK NM_024357.2, обозначенной в настоящем документе как SEQ ID NO:5). «Мишеневый сайт инициации крысы» означает самый крайний с 5'-конца нуклеотид, на который нацелен гэпмер, в мРНК крысы. «Мишеневый сайт терминации крысы» означает самый крайний с 3'-конца нуклеотид, на который нацелен гэпмер, в мРНК крысы. «Человеческий мишеневый сайт инициации» означает самый крайний с 5'-конца нуклеотид, на который нацелен гэпмер, в человеческой генной последовательности. «Человеческий мишеневый сайт терминации» означает самый крайний с 3'-конца нуклеотид, на который нацелен гэпмер, в генной последовательности человека. «Число ошибочных спариваний» означает число ошибочных спариваний между человеческим олигонуклеотидом и последовательностью мРНК крысы.
Гэпмеры со смешанными фосфоротиоатными и фосфодиэфирными межнуклеозидными связями
Химерные антисмысловые олигонуклеотиды в таблице 5 разрабатывали как гэпмеры 5-10-5 МОЕ. Гэпмеры 5-10-5 содержат двадцать связанных нуклеозидов, где центральный гэп-сегмент содержат десять 2'-дезоксинуклеотидов и фланкирован с обеих сторон (в 5'- и 3'-направлениях) фланкирующими сегментами, содержащими по пять нуклеозидов. Каждый нуклеозид в 5'-фланкирующем сегменте и каждый нуклеозид в 3'-фланкирующем сегменте содержит модификацию 2'-МОЕ. Межнуклеозидные связи в центральном гэп-сегменте, связи, соединяющие гэп-сегмент с 5'- или 3'-фланкирующим сегментом, и связи для самого крайнего с 5'-конца и самого крайнего 3'-конца нуклеозидов каждого из фланкирующих сегментов, являются фосфоротиоатными (P=S) связями; межнуклеозидные связи, соединяющие остальные нуклеозиды обоих 5'- и 3'-фланкирующих сегментов, являются фосфодиэфирными связями; т.е. гэпмер характеризуется смешенным скелетом. Все цитозины в каждом гэпмере являются 5-метилцитозинами. Каждый гэпмер в таблице 5 нацелен на человеческую последовательность мРНК (№доступа в GENBANK NM_002111.6, обозначенную в настоящем документе как SEQ ID NO:1). «Сайт инициации» означает самый крайний с 5'-конца нуклеотид, на который нацелен гэпмер, в человеческой мРНК. «Сайт терминации» означает самый крайний с 3'-конца нуклеотид, на который нацелен гэпмер, в человеческой мРНК.
невая SEQ ID NO.
Комплементарность гэпмеров в таблице 5 последовательностям гена гентингтина мыши, макака-резуса и крысы описаны далее в таблицах 6, 7 и 8.
Гэпмеры в таблице 6 являются комплементарными мРНК гентингтина мыши (№доступа в GENBANK NM_010414,1; SEQ ID NO:3). «Мышиный мишеневый сайт инициации» означает самый крайний с 5'-конца нуклеотид, на который нацелен гэпмер, в мышиной мРНК. «Мышиный мишеневый сайт терминации» означает самый крайний с 3'-конца нуклеотид, на который нацелен гэпмер, в мышиной мРНК. «Человеческий мишеневый сайт инициации» означает самый крайний с 5'-конца нуклеотид, на который нацелен гэпмер, в человеческой мРНК (№доступа в GENBANK NM_002111.6). «Человеческий мишеневый сайт терминации» означает самый крайний с 3'-конца нуклеотид, на который нацелен гэпмер, в человеческой мРНК (№доступа в GENBANK NM_002111.6). «Число ошибочных спариваний» означает число ошибочных спариваний между человеческим олигонуклеотидом и последовательностью мРНК мыши.
Гэпмеры в таблице 7 являются комплементарными геномной последовательности гентингтина макака-резуса (комплементарной последовательности с №доступа в GENBANK NW_001109716.1, процессированной из нуклеотидов 698000-866000; SEQ ID NO:4). «Мишеневый сайт инициации макака-резуса» означает самый крайний с 5'-конца нуклеотид, на который нацелен гэпмер, в генной последовательности макака-резуса. «Мишеневый сайт терминации макака-резуса» означает самый крайний с 3'-конца нуклеотид, на который нацелен гэпмер, в генной последовательности макака-резуса. «Человеческий мишеневый сайт инициации» означает самый крайний с 5'-конца нуклеотид, на который нацелен гэпмер, в человеческой мРНК (№доступа в GENBANK NM_002111.6). «Человеческий мишеневый сайт терминации» означает самый крайний с 3'-конца нуклеотид, на который нацелен гэпмер, в человеческой мРНК (№доступа в GENBANK NM_002111.6). «Число ошибочных спариваний» означает число ошибочных спариваний между олигонуклеотидом человека и генной последовательностью макака-резуса.
Гэпмеры в таблице 8 являются комплементарными мРНК гентингтина крысы (№доступа в GENBANK NM_024357.2; SEQ ID NO:5). «Мишеневый сайт инициации крысы» означает самый крайний с 5'-конца нуклеотид, на который нацелен гэпмер, в мРНК крысы. «Мишеневый сайт терминации крысы» означает самый крайний с 3'-конца нуклеотид, на который нацелен гэпмер, в мРНК крысы. «Человеческий мишеневый сайт инициации» означает самый крайний с 5'-конца нуклеотид, на который нацелен гэпмер, в мРНК человека (№доступа в GENBANK NM_002111.6). «Человеческий мишеневый сайт терминации» означает самый крайний с 3'-конца нуклеотид, на который нацелен гэпмер, в мРНК человека (№доступа в GENBANK NM_002111.6). «Число ошибочных спариваний» означает число ошибочных спариваний между человеческим олигонуклеотидом и последовательностью мРНК крысы.
Пример 2: Зависимое от дозы антисмысловое ингибирование мРНК гентингтина т vitro
Около тысячи семисот недавно разработанных антисмысловых соединений с различной длиной, мотивами и композицией скелета протестировали в отношении их эффекта на мРНК гентингтина человека in vitro на нескольких типах клеток. Эти соединения сравнивали с приблизительно двумястами пятьюдесятью ранее разработанными соединениями, в том числе с соединением ISIS 387916, которое, как предварительно установили, является соединением с достаточной эффективностью in vivo. Как показано в этом примере, обнаружили, что ISIS 419640, ISIS 419641, ISIS 419642, ISIS 436665, ISIS 436671, ISIS 436689, ISIS 437507, ISIS 443139, ISIS 444591, ISIS 444661, ISIS 437527, ISIS 444584 и ISIS 444652, а также ранее разработанный ISIS 388241 характеризуются подобной или лучшей эффективностью, чем эталонное соединение ISIS 387916, in vitro.
А. Фибробласты GM04281
Культивируемые фибробласты GM04281 с плотностью 25000 клеток на лунку, трансфицировали с использованием электропорации с 500 нМ, 1000 нМ, 2000 нМ, 4000 нМ или 8000 нМ антисмыслового олигонуклеотида. После периода обработки, составляющего приблизительно 16 часов, РНК выделяли из клеток и измеряли содержание мРНК гентингтина посредством количественной ПЦР в реальном времени. Набор праймерных зондов человека RTS2617 (прямую последовательность CTCCGTCCGGTAGACATGCT, обозначенную в настоящем документе как SEQ ID NO:37-обратную последовательность GGAAATCAGAACCCTCAAAATGG, обозначенную в настоящем документе как SEQ ID NO:38; зондовую последовательность TGAGCACTGTTCAACTGTGGATATCGGGAX, обозначенную в настоящем документе как SEQ ID NO:39) применяли для измерения содержания мРНК. Содержание мРНК гентингтина устанавливали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. Результаты представлены в таблице 9 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина.
Полумаксимальная ингибирующая концентрация (IC50) каждого олигонуклеотида также представлена в таблице 9 и рассчитана посредством нанесения на график концентраций используемых олигонуклеотидов по отношению к процентному ингибированию экспрессии мРНК гентингтина, достигаемому при каждой концентрации, и отметки концентрации олигонуклеотида, при которой достигалось 50% ингибирование экспрессии мРНК гентингтина по сравнению с контролем. IC50 выражается в мкМ.
ISIS 387916, ISIS 388241 и ISIS 437507 далее тестировали в отношении их эффекта на мРНК гентингтина человека т vitro. Культивируемые фибробласты GM04281 тестировали в подобной процедуре, как описано выше. Результаты представлены в таблице 10 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 10 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в мкМ.
Далее тестировали ISIS 387916, ISIS 388241 и ISIS 437507 в отношении их эффекта на мРНК гентингтина человека in vitro. Культивируемые фибробласты GM04281 тестировали в подобной процедуре, как описано выше. Результаты представлены в таблице 11 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 11 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в мкМ.
Далее ISIS 387916, ISIS 388241, ISIS 419641 и ISIS 436754 тестировали в отношении их эффекта на мРНК гентингтина человека in vitro. Культивируемые фибробласты GM04281 тестировали в подобной процедуре, как описано выше. Результаты представлены в таблице 12 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 12 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в мкМ.
Далее ISIS 387916, ISIS 388241 и ISIS 437507 тестировали в отношении их эффекта на мРНК гентингтина человека т vitro. Культивируемые фибробласты GM04281 с плотностью 25000 клеток на лунку трансфицировали с использованием электропорации с 250 нМ, 500 нМ, 1000 нМ, 2000 нМ, 4000 нМ или 8000 нМ антисмыслового олигонуклеотида. После периода обработки продолжительностью приблизительно 16 часов РНК выделяли из клеток и измеряли содержание мРНК гентингтина с помощью количественной ПЦР в реальном времени. Набор праймерных зондов человека RTS2617 применяли для измерения содержания мРНК. Содержание мРНК гентингтина устанавливали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. Результаты представлены в таблице 13 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 13 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в мкМ.
Далее ISIS 387916, ISIS 388241, ISIS 419628, ISIS 419629, ISIS 419637, ISIS 436684, ISIS 443139, ISIS 444584, ISIS 444615, ISIS 444627, ISIS 444652, ISIS 444658, ISIS 444659, ISIS 444660 и ISIS 444661 тестировали в отношении их эффекта на мРНК гентингтина человека in vitro. Культивируемые фибробласты GM04281 с плотностью 25000 клеток на лунку трансфицировали с использованием электропорации с 156,25 нМ, 312,5 нМ, 625 нМ, 1250 нМ или 2500 нМ антисмыслового олигонуклеотида. После периода обработки продолжительностью приблизительно 16 часов РНК выделяли из клеток и измеряли содержание мРНК гентингтина с помощью количественной ПЦР в реальном времени. Набор праймерных зондов человека RTS2617 применяли для измерения содержания РНК. Содержание мРНК гентингтина устанавливали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. Результаты представлены в таблице 14 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Представленные данные являются средним значением двух экспериментов. Также в таблице 14 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в мкМ.
Далее ISIS 387916, ISIS 436671, ISIS 444661, ISIS 419641 и ISIS 436665 тестировали в отношении их эффекта на мРНК гентингтина человека т vitro. Культивируемые фибробласты GM04281 с плотностью 25000 клеток на лунку трансфицировали с использованием электропорации с 13,6719 нМ, 27,3438 нМ, 54,6875 нМ, 109,375 нМ, 218,75 нМ, 437,5 нМ, 875 нМ, 1750 нМ, 3500 нМ или 7000 нМ антисмыслового олигонуклеотида. После периода обработки продолжительностью приблизительно 16 часов РНК выделяли из клеток и измеряли содержание мРНК гентингтина с помощью количественной ПЦР в реальном времени. Набор праймерных зондов человека RTS2617 применяли для измерения содержания РНК. Содержание мРНК гентингтина устанавливали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. Результаты представлены в таблице 15 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 15 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в мкМ.
Далее ISIS 387916, ISIS 388241, ISIS 437168 и ISIS 437175 тестировали в отношении их эффекта на мРНК гентингтина человека in vitro. Культивируемые фибробласты GM04281 с плотностью 25000 клеток на лунку трансфицировали с использованием электропорации с 250 нМ, 500 нМ, 1000 нМ, 2000 нМ, 4000 нМ и 8000 нМ антисмыслового олигонуклеотида. После периода обработки продолжительностью приблизительно 16 часов РНК выделяли из клеток и измеряли содержание мРНК гентингтина с помощью количественной ПЦР в реальном времени. Набор праймерных зондов человека RTS2617 применяли для измерения содержания РНК. Содержание мРНК гентингтина устанавливали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. Результаты представлены в таблице 15.1 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 15.1 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в мкМ.
Далее ISIS 387916, ISIS 388241, ISIS 437441 и ISIS 437442 тестировали в отношении их эффекта на мРНК гентингтина человека in vitro. Культивируемые фибробласты GM04281 тестировали в подобной процедуре, как описано выше. Результаты представлены в таблице 15.2 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 15.2 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в мкМ.
Далее ISIS 387916, ISIS 388241, ISIS 437175 и ISIS 437527 тестировали в отношении их эффекта на мРНК гентингтина человека in vitro. Культивируемые фибробласты GM04281 тестировали в подобной процедуре, как описано выше. Результаты представлены в таблице 15.3 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 15.3 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в мкМ.
В. Клетки А549
Некоторые из антисмысловых олигонуклеотидов, описанных в примере 1, тестировали в отношении их эффекта на мРНК гентингтина человека in vitro. Культивируемые клетки А549 с плотностью 4000 клеток на лунку трансфицировали с использованием реагента трансфекции липофектина с 7,4074 нМ, 22,222 нМ, 66,667 нМ или 200 нМ антисмыслового олигонуклеотида. После периода обработки продолжительностью приблизительно 16 часов РНК выделяли из клеток и измеряли содержание мРНК гентингтина с помощью количественной ПЦР в реальном времени. Набор праймерных зондов человека RTS2617 применяли для измерения содержания РНК. Содержание мРНК гентингтина устанавливали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. Результаты, представлены в таблице 16 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 16 представлены 1Сзо каждого антисмыслового олигонуклеотида, выраженные в нМ.
Далее ISIS 387916, ISIS 388241 и ISIS 437507 тестировали в отношении их эффекта на мРНК гентингтина человека in vitro. Культивируемые клетки А549 с плотностью 20000 клеток на лунку трансфицировали с использованием электропорации с 250 нМ, 500 нМ, 1000 нМ, 2000 нМ, 4000 нМ или 8000 нМ антисмыслового олигонуклеотида. После периода обработки продолжительностью приблизительно 16 часов РНК выделяли из клеток и измеряли содержание мРНК гентингтина с помощью количественной ПЦР в реальном времени. Набор праймерных зондов человека RTS2617 применяли для измерения содержания РНК. Содержание мРНК гентингтина устанавливали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. В таблице 17 представлены результаты, выраженные как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрирующие опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 17 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в мкМ.
С. Клетки LLC-MK2
Некоторые из антисмысловых олигонуклеотидов, описанных в примере 1 и нацеленных на нуклеиновую кислоту гентингтина человека, тестировали в отношении их эффекта на мРНК гентингтина макака-резуса in vitro. Культивируемые клетки LLC-MK2 с плотностью 25000 клеток на лунку трансфицировали с использованием электропорации с 625 нМ, 1250 нМ, 2500 нМ, 5000 нМ, 10000 нМ или 20000 нМ антисмыслового олигонуклеотида. После периода обработки продолжительностью приблизительно 16 часов РНК выделяли из клеток и измеряли содержание мРНК гентингтина с помощью количественной ПЦР в реальном времени. Набор праймерных зондов человека RTS2686 (прямую последовательность GTCTGAGCCTCTCTCGGTCAA, обозначенную в настоящем документе как SEQ ID NO:40; обратную последовательность AAGGGATGCTGGGCTCTGT, обозначенную в настоящем документе как SEQ ID NO:41; зондовую последовательность AGCAAAGCTTGGTGTCTTGGCACTGTTAGTX, обозначенную в настоящем документе как SEQ ID NO:42) применяли для измерения содержания РНК. Содержание мРНК гентингтина устанавливали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. Результаты представлены в таблице 18 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 18 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в мкМ.
Далее ISIS 387916, ISIS 388241, ISIS 436684, ISIS 437168, ISIS 437175, ISIS 437441, ISIS 437507, ISIS 437527, ISIS 444578, ISIS 444584, ISIS 444591 и ISIS 444607 тестировали в отношении их эффекта на мРНК гентингтина макака-резуса in vitro. Культивируемые клетки LLC-MK2 тестировали в подобной процедуре, как описано выше. Результаты представлены в таблице 19 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 19 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в мкМ.
Далее ISIS 387916, ISIS 388241, ISIS 444608, ISIS 444615, ISIS 444618, ISIS 444627, ISIS 444652, ISIS 444658, ISIS 444659, ISIS 444660 и ISIS 444661 тестировали в отношении их эффекта на мРНК гентингтина макака-резуса in vitro. Культивируемые клетки LLC-MK2 тестировали в подобной процедуре, как описано выше. Результаты представлены в таблице 20 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 20 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в мкМ.
Далее ISIS 387916, ISIS 419627, ISIS 419628, ISIS 419629, ISIS 419630, ISIS 419636, ISIS 419637, ISIS 419640, ISIS 419641 и ISIS 419642 тестировали в отношении их эффекта на мРНК гентингтина макака-резуса т vitro. Культивируемые клетки LLC-MK2 с плотностью 3000 клеток на лунку трансфицировали с использованием реагента трансфекции липофектина с 6,25 нМ, 12,5 нМ, 25 нМ, 50 нМ, 100 нМ, или 200 нМ антисмыслового олигонуклеотида. После периода обработки продолжительностью приблизительно 16 часов РНК выделяли из клеток и измеряли содержание мРНК гентингтина с помощью количественной ПЦР в реальном времени. Набор праймерных зондов человека RTS2686 применяли для измерения содержания РНК. Содержание мРНК гентингтина устанавливали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. Результаты представлены в таблице 21 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 21 представлены 1Сзо каждого антисмыслового олигонуклеотида, выраженные в нМ.
Далее ISIS 387916, ISIS 419641 и ISIS 436689 тестировали в отношении их эффекта на мРНК гентингтина макака-резуса in vitro. Культивируемые клетки LLC-MK2 с плотностью 3000 клеток на лунку трансфицировали с использованием реагента трансфекции Lipofectamine 2000 с 6,25 нМ, 12,5 нМ, 25 нМ, 50 нМ, 100 нМ или 200 нМ антисмыслового олигонуклеотида. После периода обработки продолжительностью приблизительно 16 часов РНК выделяли из клеток и измеряли содержание мРНК гентингтина с помощью количественной ПЦР в реальном времени. Набор праймерных зондов человека RTS2686 применяли для измерения содержания РНК. Содержание мРНК гентингтина устанавливали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. Результаты представлены в таблице 22 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 22 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в нМ.
Далее ISIS 387916, ISIS 388241, ISIS 436665, ISIS 436671 и ISIS 436689 тестировали в отношении их эффекта на мРНК гентингтина макака-резуса in vitro. Культивируемые клетки LLC-MK2 с плотностью 3000 клеток на лунку трансфицировали с использованием реагента трансфекции липофектина с 4,6875 нМ, 9,375 нМ, 18,75 нМ, 37,5 нМ, 75 нМ или 150 нМ антисмыслового олигонуклеотида. После периода обработки продолжительностью приблизительно 16 часов РНК выделяли из клеток и измеряли содержание мРНК гентингтина с помощью количественной ПЦР в реальном времени. Набор праймерных зондов человека RTS2686 применяли для измерения содержания РНК. Содержание мРНК гентингтина устанавливали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN. Результаты представлены в таблице 23 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 23 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в нМ.
D. Трансгенные мышиные гепатоциты BACHD
Некоторые из антисмысловых олигонуклеотидов, описанных в примере 1 и нацеленных на нуклеиновую кислоту гентингтина человека, тестировали в отношении их эффекта на мРНК гентингтина человека т vitro. Культивируемые мышиные гепатоциты BACHD с плотностью 10000 клеток на лунку трансфицировали с использованием реагента трансфекции цитофектина с 7,4074 нМ, 22,222 нМ, 66,667 нМ или 200 нМ антисмыслового олигонуклеотида. После периода обработки продолжительностью приблизительно 16 часов РНК выделяли из клеток и измеряли содержание мРНК гентингтина с помощью количественной ПЦР в реальном времени. Набор праймерных зондов человека RTS2617 применяли для измерения содержания РНК. Содержание мРНК гентингтина устанавливали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. Результаты представлены в таблице 24 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Представленные данные являются средним значением двух экспериментов. Также в таблице 24 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в нМ.
Далее ISIS 387916, ISIS 388241 и ISIS 419641 тестировали в отношении их эффекта на мРНК гентингтина человека in vitro. Культивируемые мышиные гепатоциты BACHD с плотностью 10000 клеток на лунку трансфицировали с использованием реагента трансфекции цитофектина с 12,5 нМ, 25 нМ, 50 нМ, 100 нМ или 200 нМ антисмыслового олигонуклеотида. После периода обработки продолжительностью приблизительно 16 часов РНК выделяли из клеток и измеряли содержание мРНК гентингтина с помощью количественной ПЦР в реальном времени. Набор праймерных зондов человека RTS2617 применяли для измерения содержания РНК. Содержание мРНК гентингтина устанавливали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. Результаты представлены в таблице 25 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 25 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в нМ.
Далее ISIS 387916, ISIS 388241, ISIS 419641, ISIS 436665, ISIS 436671 и ISIS 436689 тестировали в отношении их эффекта на мРНК гентингтина человека in vitro. Культивируемые мышиные гепатоциты BACHD тестировали аналогичным образом, как описано выше. Результаты представлены в таблице 26 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентингтина. Также в таблице 26 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в нМ.
Далее ISIS 387916, ISIS 419640, ISIS 419641 и ISIS 419642 тестировали в отношении их эффекта на мРНК гентингтина мыши т vitro. Культивируемые мышиные гепатоциты BACHD с плотностью 20000 клеток на лунку трансфицировали с использованием реагента трансфекции цитофектина с 6,667 нМ, 20 нМ, 60 нМ или 180 нМ антисмыслового олигонуклеотида. После периода обработки продолжительностью приблизительно 16 часов РНК выделяли из клеток и измеряли содержание мРНК гентингтина с помощью количественной ПЦР в реальном времени. Набор мышиных праймерных зондов RTS2633 (прямую последовательность CAGAGCTGGTCAACCGTATCC, обозначенную в настоящем документе как SEQ ID NO:43; обратную последовательность GGCTTAAACAGGGAGCCAAAA, обозначенную в настоящем документе как SEQ ID NO:44; зондовую последовательность ACTTCATGATGAGCTCGGAGTTCAACX, обозначенную в настоящем документе как SEQ ID NO:45) применяли для измерения содержания РНК. Содержание мРНК гентингтина устанавливали в соответствии с общим содержанием РНК, которое измеряли с помощью RIBOGREEN®. Результаты представлены в таблице 27 как процентное ингибирование мРНК гентингтина по отношению к необработанным контрольным клеткам и демонстрируют опосредованное антисмысловым олигонуклеотидом зависимое от дозы уменьшение содержания мРНК гентинггина. Также в таблице 27 представлены IC50 каждого антисмыслового олигонуклеотида, выраженные в нМ.
Пример 3: Системное введение антисмысловых олигонуклеотидов против мРНК гентинггина у мышей BACHD
Из приблизительно тысячи семисот недавно разработанных антисмысловых соединений отбирали шестьдесят шесть соединений на основе эффективности in vitro no сравнению с ISIS 387916 для скрининг-тестирования системной переносимости.
Мышей BACHD обрабатывали олигонуклеотидами ISIS и оценивали изменения содержания различных метаболических маркеров, а также ингибирование мРНК гентинггина в печени. Антисмысловые олигонуклеотиды, которые вызывали неблагоприятные изменения массы тела, массы органа или содержания метаболических маркеров, считали непригодными для использования в дальнейших исследованиях.
Исследование 1
Обработка
Девятнадцати группам, из четырех мышей BACHD каждая, инъецировали внутрибрюшинно 12,5 мг/кг ISIS 387916, ISIS 388241, ISIS 419629, ISIS 419637, ISIS 436684, ISIS 444578, ISIS 444584, ISIS 444591, ISIS 444607, ISIS 444608, ISIS 444615, ISIS 444618, ISIS 444627, ISIS 444652, ISIS 444658, ISIS 444659, ISIS 444660, ISIS 444661 или ISIS 444663 дважды в неделю в течение 2 недель. Контрольную группу из четырех мышей инъецировали внутрибрюшинно PBS дважды в неделю в течение 2 недель. Через двое суток после последней дозы мышей анестезировали изофлураном и обескровливали для забора плазмы, после чего производили смещение шейных позвонков и собирали органы.
Анализ РНК
РНК экстрагировали из ткани печени для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени. Содержание мутантной мРНК гентингтина человека измеряли с использованием набора праймерных зондов человека RTS2617. Содержание нормального гентингтина мыши измеряли с использованием набора мышиных праймерных зондов RTS2633. Результаты представлены в таблицах 28 и 29 и рассчитаны как процентное ингибирование уровней экспрессии человеческого и мышиного гентингтина, соответственно, по отношению к контролю PBS. Все антисмысловые олигонуклеотиды вызывают существенное ингибирование содержания мРНК гентингтина человека. ISIS 388241 характеризуется более чем тремя ошибочными спариваниями с мышиной мРНК гентингтина (SEQ ID NO:3) и поэтому не показывает существенного ингибирования содержания мышиной мРНК по сравнению с контролем.
Измерения массы органа
Массу печени, селезенки и почки измеряли в конце исследования и представили в таблице 30 как процент от контроля с применением солевого раствора, нормированный к массе тела.
Оценка функции печени
Для оценки влияния олигонуклеотидов ISIS на печеночную функцию мышей, описанных выше, измеряли концентрации трансаминаз в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Измерения аланинтрансаминазы (ALT) и аспартаттрансаминазы (AST) выражены в МЕ/л, а результаты представлены в таблице 31.
Исследование 2 Обработка
Четырнадцать групп, из четырех мышей BACHD каждая, инъецировали внутрибрюшинно 12,5 мг/кг или 50 мг/кг ISIS 419581, ISIS 419602, ISIS 419628, ISIS 419629, ISIS 419640, ISIS 419641 или ISIS 419642 дважды в неделю в течение 2 недель. Группу из четырех мышей BACHD инъецировали внутрибрюшинно с 12,5 мг/кг ISIS 387916 дважды в неделю в течение 2 недель. Контрольную группу из четырех мышей инъецировали внутрибрюшинно PBS дважды в неделю в течение 2 недель. Через двое суток после последней дозы мышей анестезировали изофлураном и обескровливали для забора плазмы, после чего выполняли смещение шейных позвонков и собирали органы.
Анализ РНК
РНК экстрагировали из ткани печени для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени. Содержание мРНК мутантного гентингтина человека измеряли с использованием набора праймерных зондов человека RTS2617. Содержание нормального гентингтина мыши измеряли с использованием набора праймерных зондов мыши RTS2633. Результаты представлены в таблицах 32 и 33 и рассчитаны как процентное ингибирование уровней экспрессии человеческого и мышиного гентингтина, соответственно, по отношению к контролю PBS.
Измерения массы органа
Массу печени, селезенки и почки измеряли в конце исследования и представили в таблице 34 как процент от контроля с применением солевого раствора, нормированный к массе тела.
Оценка функции печени
Для оценки влияния олигонуклеотидов ISIS на функцию печени мышей, описанных выше, измеряли концентрации трансаминаз в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Измерения ALT и AST выражены в МЕ/л, а результаты представлены в таблице 35.
Исследование 3
Обработка
Восемнадцать групп, из четырех мышей BACHD каждая, инъецировали внутрибрюшинно 12,5 мг/кг или 50 мг/кг ISIS 388250, ISIS 388251, ISIS 388263, ISIS 388264, ISIS 419641, ISIS 436645, ISIS 436649, ISIS 436668 или ISIS 436689 дважды в неделю в течение 2 недель. Группу из четырех мышей BACHD инъецировали внутрибрюшинно 12,5 мг/кг ISIS 388241 дважды в неделю в течение 2 недель. Контрольную группу из четырех мышей инъецировали внутрибрюшинно PBS дважды в неделю в течение 2 недель. Через двое суток после последней дозы мышей анестезировали изофлураном и обескровливали для забора плазмы, после чего выполняли смещение шейных позвонков и собирали органы.
Анализ РНК
РНК экстрагировали из ткани печени для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени. Содержание мРНК мутантного гентингтина человека измеряли с использованием набора праймерных зондов человека RTS2617. Содержание нормального гентингтина мыши измеряли с использованием набора праймерных зондов мыши RTS2633. Результаты представлены в таблицах 36 и 37 и рассчитаны как процентное ингибирование уровней экспрессии человеческого и мышиного гентингтина, соответственно, по отношению к контролю PBS. Все антисмысловые олигонуклеотиды вызывали существенное ингибирование содержания человеческой мРНК гентингтина. ISIS 388241, ISIS 388250, ISIS 388251, ISIS 388263, ISIS 388264 и ISIS 436645 характеризуются более чем тремя ошибочными спариваниями с мышиной мРНК гентингтина (SEQ ID NO:3) и поэтому не вызывали существенного ингибирования содержания мРНК мыши по сравнению с контролем. ISIS 436649 и ISIS 436689 характеризуются тремя ошибочными спариваниями с мышиной мРНК гентингтина (SEQ ID NO:3) и поэтому не вызывали существенного ингибирования содержания мышиной мРНК по сравнению с контролем.
Измерения массы органа
Массу печени, селезенки и почки измеряли в конце исследования и представили в таблице 38 как процент от контроля с применением солевого раствора, нормированный к массе тела. Мыши, обработанные ISIS 388263 и ISIS 436645, претерпевали увеличения массы печени при дозе 50 мг/кг по сравнению с контролем PBS.
Оценка функции печени
Для оценки влияния олигонуклеотидов ISIS на функцию печени мышей, описанных выше, измеряли концентрации трансаминаз в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Измерения аланинтрансаминазы (ALT) и аспартаттрансаминазы (AST) выражены в МЕ/л, а результаты представлены в таблице 39.
Исследование 4
Обработка
Восемнадцать групп, из четырех мышей BACHD каждая, инъецировали внутрибрюшинно 12,5 мг/кг или 50 мг/кг ISIS 388241, ISIS 437123, ISIS 437132, ISIS 437140, ISIS 437442, ISIS 437446, ISIS 437477, ISIS 437478 или ISIS 437490 дважды в неделю в течение 2 недель. Группу из четырех мышей BACHD инъецировали внутрибрюшинно 12,5 мг/кг ISIS 387916 дважды в неделю в течение 2 недель. Контрольную группу из четырех мышей инъецировали внутрибрюшинно PBS дважды в неделю в течение 2 недель. Через двое суток после последней дозы мышей анестезировали изофлураном и обескровливали для забора плазмы, после чего выполняли смещение шейных позвонков и собирали органы.
Анализ РНК
РНК экстрагировали из ткани печени для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени. Содержание мРНК мутантного гентингтина человека измеряли с использованием набора праймерных зондов человека RTS2617. Содержание нормального гентингтина мыши измеряли с использованием набора праймерных зондов мыши RTS2633. Результаты представлены в таблицах 40 и 41 и рассчитаны как процентное ингибирование уровней экспрессии человеческого и мышиного гентингтина, соответственно, по отношению к контролю PBS. ISIS 388241 и ISIS 437490 характеризуются более чем тремя ошибочными спариваниями с мышиной мРНК гентингтина (SEQ ID NO:3) и поэтому не вызывали существенного ингибирования содержания мышиной мРНК по сравнению с контролем. ISIS 437132 характеризуется тремя ошибочными спариваниями с мышиной мРНК гентингтина (SEQ ID NO:3) и поэтому не вызывал существенного ингибирования содержания мышиной мРНК по сравнению с контролем. ISIS 437123 и ISIS 437140 характеризуются двумя ошибочными спариваниями с мышиной мРНК гентингтина (SEQ ID NO:3) и не вызывали существенного ингибирования содержания мышиной мРНК по сравнению с контролем.
Измерения массы органа
Массу печени, селезенки и почки измеряли в конце исследования и представили в таблице 42 как процент от контроля с применением солевого раствора, нормированный к массе тела.
Оценка функции печени
Для оценки влияния олигонуклеотидов ISIS на функцию печени мышей, описанных выше, измеряли концентрации трансаминаз в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Измерения аланинтрансаминазы (ALT) и аспартаттрансаминазы (AST) выражены в МЕ/л, а результаты представлены в таблице 43.
Исследование 5
Обработка
Одиннадцать групп, из четырех мышей BACHD каждая, инъецировали внутрибрюшинно 12,5 мг/кг ISIS 388241, ISIS 419640, ISIS 419641, ISIS 419642, ISIS 436665, ISIS 436671, ISIS 436689, ISIS 437507, ISIS 443139, ISIS 444591 или ISIS 444661 дважды в неделю в течение 2 недель. Контрольную группу из четырех мышей инъецировали внутрибрюшинно фосфатно-солевым буферным раствором (PBS) дважды в неделю в течение 2 недель. Через двое суток после последней дозы мышей анестезировали изофлураном и обескровливали для забора плазмы, после чего выполняли смещение шейных позвонков и собирали органы.
Анализ РНК
РНК экстрагировали из ткани печени для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени. Содержание мРНК мутантного гентингтина человека измеряли с использованием набора праймерных зондов человека RTS2617. Содержание нормального гентингтина мыши измеряли с использованием набора праймерных зондов мыши RTS2633. Результаты представлены в таблицах 44 и 45 и рассчитаны как процентное ингибирование уровней экспрессии человеческого и мышиного гентингтина, соответственно, по отношению к контролю PBS. Все антисмысловые олигонуклеотиды вызывают существенное ингибирование содержания мРНК гентингтина человека. ISIS 388241, ISIS 437507 и ISIS 443139 характеризуются более чем тремя ошибочными спариваниями с мышиной мРНК гентингтина (SEQ ID NO:3) и поэтому не показывают существенного ингибирования содержания мышиной мРНК по сравнению с контролем. ISIS 436689 характеризуется 3 ошибочными спариваниями с мышиной мРНК гентингтина (SEQ I D NO:3) и не показывает существенного ингибирования содержания мышиной мРНК по сравнению с контролем.
Измерения массы тела и массы органа
Массу тела мышей измеряли в начале исследования, а затем дважды в неделю. Значения массы тела мышей представлены в таблице 46 и выражены как процент изменения относительно массы, зафиксированной в начале исследования. Результаты показывают, что обработка этими олигонуклеотидами не вызывает какого-либо неблагоприятного изменения массы тела мышей на протяжении всего исследования.
Массу печени, селезенки и почки измеряли в конце исследования и представили в таблице 47 как процент от контроля с применением солевого раствора, нормированный к массе тела.
Оценка функции печени
Для оценки влияния олигонуклеотидов ISIS на функцию печени мышей, описанных выше, измеряли концентрации трансаминаз в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Измерения ALT и AST выражены в МЕ/л. Содержание билирубина и альбумина в плазме также измеряли с использованием того же клинического химического анализатора и выражали в г/дл. Результаты представлены в таблице 48.
Измерения функции почки
Для оценки влияния олигонуклеотидов ISIS на функцию почки мышей, описанных выше, измеряли концентрации азота мочевины крови (BUN) и креатинина в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Результаты, выраженные в мг/дп, представлены в таблице 49.
Измерение других метаболических параметров Для оценки влияния олигонуклеотидов ISIS на другие метаболические функции у мышей, описанных выше, измеряли концентрации глюкозы, холестерина и триглицеридов в плазме с использованием автоматизированного клинического химического анализатора (Hitachi Olympus AU400e, Melville, NY). Результаты представлены в таблице 50, выражены в мг/дп и демонстрируют, что лечение с помощью данных олигонуклеотидов не вызывает каких-либо неблагоприятных изменений в содержания этих метаболических маркеров между группами контроля и лечения.
Пример 4: Болюсное введение антисмысловых олигонуклеотидов против мРНК гентингтина в полосатое тело мышей BACHD
Мышей BACHD обрабатывали олигонуклеотидами ISIS посредством болюсного введения в определенную зону головного мозга мыши - полосатое тело - с целью скрининга активности олигонуклеотидов в ткани головного мозга против экспрессии мРНК гентингтина человека и мыши.
Обработка и хирургическое вмешательство
Группам, из четырех мышей BACHD каждая, вводили ISIS 388241, ISIS 419628, ISIS 419637, ISIS 419640, ISIS 419641, ISIS 419642, ISIS 436665, ISIS 436671, ISIS 436684, ISIS 436689, ISIS 436754, ISIS 437168, ISIS 437175, ISIS 437441, ISIS 437442, ISIS 437507, ISIS 437527, ISIS 443139, ISIS 444578, ISIS 444584, ISIS 444591, ISIS 444607, ISIS 444608, ISIS 444615, ISIS 444618, ISIS 444627, ISIS 444652, ISIS 444658, ISIS 444659, ISIS 444660, ISIS 444661 или ISIS 444663, доставленные в виде однократной болюсной инъекции при концентрациях 3 мкг, 10 мкг или 25 мкг в полосатое тело.
Контрольную группу из 4 мышей BACHD подобным образом обрабатывали PBS. ISIS 388241 вводили семи группам, из 4 мышей каждая, и представленные результаты являются средним значением от данных, полученных от 28 мышей. ISIS 419628 вводили 2 группам, из 4 мышей BACHD каждая, и представленные результаты являются средним значением от данных, полученных от 8 мышей. Через семь суток после болюсного введения мышей подвергали эвтаназии с использованием изофлурана и удаляли органы. Животных декапитировали и удаляли головной мозг для препарирования стриарной ткани.
Анализ РНК
РНК экстрагировали из стриарной ткани для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени. Содержание мРНК мутантного гентингтина человека измеряли с использованием набора праймерных зондов человека RTS2617. Содержание мРНК нормального гентингтина мыши измеряли с использованием набора мышиных праймерных зондов RTS2633. Результаты по содержанию мРНК гентингтина человека представлены в таблице 51 и выражены как процентное ингибирование по сравнению с контрольной группой PBS. Все антисмысловые олигонуклеотиды вызывают зависимое от дозы ингибирование содержания мРНК гентингтина человека. Результаты по содержанию мРНК мышиного гентингтина представлены в таблице 52 и выражены как процентное ингибирование по сравнению с контрольной группой PBS.
Эффективные дозы (ED5o) каждого олигонуклеотида для мРНК гентингтина человека и мРНК гентингтина мыши рассчитывали путем нанесения на график концентраций применяемых олигонуклеотидов против процентного ингибирования содержания экспрессии мРНК гентингтина каждого вида и отметки концентраций, при которых 50% ингибирование экспрессии мРНК гентингтина достигалось для каждого вида по сравнению с соответствующими контролями. Также в таблицах 51 и 52 представлена EDso (мкг) для каждого антисмыслового олигонуклеотида для мРНК гентингтина человека и мыши, соответственно.
Каждый из ISIS 388241, ISIS 436684, ISIS 436754, ISIS 437175, ISIS 437507, ISIS 443139 и ISIS 444584 ошибочно спаривался по 8 парам оснований или более с мышиной мРНК гентингтина (SEQ ID NO:3) и поэтому не показывал существенного ингибирования содержания мышиной мРНК по сравнению с контролем. Каждый из ISIS 437168 и ISIS 437441 характеризуется 2 ошибочными спариваниями с мышиной мРНК гентингтина (SEQ ID NO:3) и не показывает существенного ингибирования содержания мышиной мРНК по сравнению с контролем. ISIS 436689 характеризуется 3 ошибочными спариваниями с мышиной мРНК гентингтина (SEQ ID NO:3) и не показывает существенного ингибирования содержания мышиной мРНК по сравнению с контролем.
Десять соединений, помеченных звездочкой, характеризовались улучшенной ED50 по сравнению с ISIS 388241.
Пример 5: Анализ нейротосических эффектов болюсного введения антисмысловых олигонуклеотидов в стриарную ткань крыс
Около 30 соединений отобрали как характеризующиеся высокой переносимостью и высокой эффективностью. Затем соединения тестировали с помощью болюсной инъекции в ЦНС крысы для дальнейшей оценки нейротоксичности,
Каждую крысу Sprague-Dawley обрабатывали олигонуклеотидами ISIS посредством болюсного введения в определенную зону головного мозга - полосатое тело - с целью скринирования на индукцию микроглиального маркера AIF1 в качестве меры токсичности для ЦНС.
Обработка и хирургическое вмешательство
Группам из четырех крыс Sprague-Dawley вводили ISIS 387916, ISIS 388241, ISIS 419627, ISIS 419628, ISIS 419629, ISIS 419630, ISIS 419636, ISIS 419637, ISIS 419640, ISIS 419641, ISIS 419642, ISIS 436665, ISIS 436668, ISIS 4196671, ISIS 436684, ISIS 436689, ISIS 436754, ISIS 443168, ISIS 437175, ISIS 437441, ISIS 437442, ISIS 437507, ISIS 437527, ISIS 443139, ISIS 444578, ISIS 444584, ISIS 444591, ISIS 444607, ISIS 444608, ISIS 444615, ISIS 444618, ISIS 444627, ISIS 444652, ISIS 444658, ISIS 444659, ISIS 444660, ISIS 444661 или ISIS 444663, доставленные в виде однократной болюсной инъекции при концентрации 50 мкг в полосатое тело.
Контрольную группу из 4 крыс подобным образом обрабатывали PBS. Группу из 4 крыс подобным образом обрабатывали антисмысловым олигонуклеотидом ISIS 104838 против TNF-α в качестве отрицательной контрольной группы. ISIS 387916 вводили четырем группам, из 4 крыс каждая, и представленные результаты являются средним значением от данных, полученных от 16 крыс.ISIS 419628 вводили двум группам, из 4 крыс каждая, и представленные результаты являются средним значением данных от 8 крыс.Также в этом исследовании тестировали ISIS 419629, ISIS 444584 и ISIS 444618, которые характеризовались токсическими индикаторами при исследовании системного введения (пример 3). Через семь дней после болюсного введения крыс подвергали эвтаназии с использованием изофлурана и удаляли органы. Животных декапитировали и головной мозг удаляли для препарирования стриарной ткани.
РНК анализ уровней экспрессии AIF1 РНК экстрагировали из стриарной ткани для анализа содержания мРНК AIF1 с помощью ПЦР в реальном времени. Содержание AIF1 крыс измеряли с использованием набора праймерных зондов крысы rAif1_LTS00219 (прямой последовательности AGGAGAAAAACAAAGAACACCAGAA, обозначенной в настоящем документе как SEQ ID NO:46; обратной последовательности CAATTAGGGCAACTCAGAAATAGCT, обозначенной в настоящем документе как SEQ ID NO:47; зондовой последовательности CCAACTGGTCCCCCAGCCAAGAX, обозначенной в настоящем документе как SEQ ID NO:48). Результаты рассчитывали как процентное отношение экспрессии AIF1 относительно таковой в контроле PBS и представили в таблице 53. ISIS 419629, ISIS 444584 и ISIS 444618, которые характеризовались токсическими индикаторами в исследовании системного введения (в примере 3), также характеризовались токсическими индикаторами в этом исследовании (более чем 300% по отношению к контролю с использованием солевого раствора). Последние исследования показали, что ISIS 444584 является нейропереносимым и характеризуется незначительными токсическими индикаторами (см. примеры 16 и 17).
Анализ уровней экспрессии РНК гентингтина РНК экстрагировали из стриарной ткани для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени. Содержание мРНК гентингтина крысы измеряли с использованием набора праймерных зондов крысы rHtt_LTS00343 (прямой последовательности CAGAGCTGGTGAACCGTATCC, обозначенной в настоящем документе как SEQ ID NO:49; обратной последовательности GGCTTAAGCAGGGAGCCAAAA, обозначенной в настоящем документе как SEQ ID NO:50; зондовой последовательностью ACTTCATGATGAGCTCGGAGTTCAACX, обозначенной в настоящем документе как SEQ ID NO:51). Результаты рассчитывали как уменьшение в процентном отношении экспрессии гентингтина относительно таковой в контроле PBS и представили в таблице 54. Каждый из ISIS 388241, ISIS 436684, ISIS 436754, ISIS 437175, ISIS 437507 и ISIS 443139 ошибочно спаривался по 6 парам оснований или более с крысиной генной последовательностью (SEQ ID NO:5) и поэтому не показывал существенного ингибирования содержания мРНК крысы по сравнению с контролем. Каждый из ISIS 419640, ISIS 419641, ISIS 419642, ISIS 436665, ISIS 436668, ISIS 437442, ISIS 444615 и ISIS 444627 характеризовался 1 ошибочным спариванием с крысиной генной последовательностью (SEQ ID NO:5) и не показывал существенного ингибирования содержания мРНК крысы по сравнению с контролем. Каждый из ISIS 437168 и ISIS 437441 характеризовался 2 ошибочными спариваниями с крысиной генной последовательностью (SEQ ID NO:5) и не показывал существенного ингибирования содержания мРНК крысы по сравнению с контролем. Каждый из ISIS 436689 и ISIS 444584 характеризовался 3 ошибочными спариваниями с крысиной генной последовательностью (SEQ ID NO:5) и не показывал существенного ингибирования содержания мРНК крысы по сравнению с контролем.
Пример 6: Исследование переносимости антисмысловых олигонуклеотидов против мРНК гентингтина при интрацеребровентрикулярном введении у мышей BACHD
Выбранные соединения сравнивали с ранее разработанным соединением ISIS 388241 посредством ICV введения мышам BACHD.
Выбранные соединения, а также эталонное соединение 388241 отобрали на основании in vitro и системной эффективности, системной переносимости, а также эффективности и переносимости для ЦНС.
Мышей BACHD обрабатывали олигонуклеотидами ISIS посредством интрацеребровентрикулярного (ICV) введения в определенную зону головного мозга мыши - в правый боковой желудочек - с целью оценивания переносимости дозировки ICV у мышей.
Обработка и хирургическое вмешательство
Группам, из пяти мышей BACHD каждая, вводили ISIS 388241, ISIS 437507, ISIS 443139, ISIS 419640, ISIS 419641, ISIS 419642, ISIS 444591, ISIS 436665, ISIS 436671, ISIS 444661 или ISIS 436689 по 150 мкг/сутки, доставляемые ICV с помощью насосов Alzet 2002 со скоростью 12 мкл/сутки в течение 2 недель. Контрольную группу из 4 мышей BACHD подобным образом обрабатывали PBS. Мышам хирургическим путем имплантировали насосы следующим образом: мышей индивидуально анестезировали 3% изофлураном для имплантации насоса. Через две недели мышей снова анестезировали и насос удаляли хирургическим путем. Затем животным позволяли восстанавливаться в течение следующих двух недель перед тем, как подвергнуть эвтаназии.
Массу тела мышей определяли еженедельно в течение периодов обработки и восстановления. Через 4 недели мышей подвергали эвтаназии с использованием изофлурана и декапитировали. Головной мозг удаляли для оценки тканевой восприимчивости из переднего и заднего отделов.
Анализ РНК
РНК экстрагировали из правого полушария передней коры и заднего мозжечкового отдела участка катетеризации для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени. Содержание мРНК мутантного гентингтина человека измеряли с использованием набора праймерных зондов человека RTS2617. Содержание мРНК нормального гентингтина мыши измеряли с использованием набора мышиных праймерных зондов RTS2633. Результаты рассчитывали как процентное ингибирование экспрессии мРНК человеческого и мышиного гентингтина по сравнению с контролем и представили в таблицах 56 и 57, соответственно. Все антисмысловые олигонуклеотиды вызывали существенное ингибирование содержания мРНК гентингтина человека. Каждый из ISIS 388241, ISIS 437507 и ISIS 443139 ошибочно спаривался по 8 парам оснований или более с мышиной мРНК гентингтина (SEQ ID NO:3) и поэтому не показывал существенного ингибирования содержания мышиной мРНК по сравнению с контролем. ISIS 444591 характеризуется 1 ошибочным спариванием с мышиной мРНК гентингтина (SEQ ID NO:3) и не показывает существенного ингибирования содержания мышиной мРНК по сравнению с контролем. ISIS 436689 характеризуется 3 ошибочными спариваниями с мышиной мРНК гентингтина (SEQ ID NO:3) и не показывает существенного ингибирования содержания мышиной мРНК по сравнению с контролем.
Измерение массы тела
Массу тела мышей измеряли в начале исследования, а затем раз в неделю. Значения массы тела мышей представлены в таблице 58 и выражены как процентное изменение относительно значений массы, измеренных в начале исследования. Значения массы тела рассматривали как меру переносимости мышами ICV введенных антисмысловых олигонуклеотидов. «Н.д.» означает отсутствие доступных данных на данный период времени.
Выживаемость мышей
Выживаемость мышей оценивали на протяжении всего периода исследования. В таблице 59 ниже показан паттерн выживания в группах мышей, обработанных олигонуклеотидами ISIS, а также в контроле.
Пример 7: Интрацеребровентрикулярное введение антисмысловых олигонуклеотидов против гентингтина мышам C57/BL6
Мышей дикого типа C57/BL6 обрабатывали олигонуклеотидами ISIS посредством интрацеребровентрикулярного (ICV) введения в определенную зону головного мозга мыши - в правый боковой желудочек - с целью оценивания эффективности олигонуклеотидов против мышиного гентингтина у этих мышей.
Обработка и хирургическое вмешательство
Группам, из десяти мышей C57/BL6 каждая, вводили ISIS 408737 (5' TCCTAGTGTTACATTACCGC 3' (SEQ ID NO:52), сайт инициации 5263 SEQ ID NO:3) no 50 мкг/сутки, доставляемого ICV с помощью насосов Alzet 2002 со скоростью 0,5 мкл/сутки в течение 7 суток или 14 суток. Контрольную группу из шести мышей C57/BL6 подобным образом обрабатывали PBS. Мышам хирургически имплантировали насосы следующим образом: вкратце, осмотические насосы Alzet (модель 2002) собирали в соответствии с инструкциями производителя. Насосы наполняли раствором, содержащим антисмысловой олигонуклеотид, и инкубировали на протяжении ночи при 37°С 24 часа до имплантации. Животных анестезировали 3% изофлураном и помещали в стереотаксическую рамку. После стерилизации хирургического поля делали срединный разрез по черепу и создавали подкожный карман по спине, в который имплантировали предварительно наполненный осмотический насос. Делали небольшое трепанационное отверстие в черепе над правым боковым желудочком. Затем в желудочек помещали канюлю, соединенную с осмотическим насосом посредством пластикового катетера, и приклеивали к месту с использованием клейкого материала Loctite. Разрез закрывали наложением швов. Антисмысловой олигонуклеотид или PBS вводили в течение 7 или 14 суток, после чего животных подвергали эвтаназии в соответствии с протоколом гуманного обращения, одобренным Институциональным комитетом по содержанию и использованию животных. Ткань головного и спинного мозга собирали и мгновенно замораживали в жидком азоте. Перед замораживанием ткань мозга разрезали в поперечном направлении на пять сегментов (S1, S2, S3, S4 и S5) с использованием матрицы мозга мыши. Сегменты с 1 по 5 отделяли друг от друга приблизительно на 2 мм, причем S1 является наиболее ростральным, а S5 - наиболее каудальным.
Анализ РНК и белка
Общую РНК экстрагировали из головного и спинного мозга мыши с помощью набора RNeasy Protect Mini Kit (Qiagen, Mississauga, ON, Canada) для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени с использованием набора RNeasy Mini prep kit (Qiagen). Q-ПЦР реакции проводили и анализировали на детекторе последовательности ABI Prism 7700 (Applied Biosystems). Содержание мРНК гентингтина мыши измеряли с использованием набора мышиных праймерных зондов ABI номер по каталогу Mm01213820_m1 (Applied Biosystems) и нормировали к содержанию мРНК пептидилпролилизомеразы А. Лизаты белка получали из полосок головного мозга мыши, как описано ранее (Li S.H. and Li X.J., Methods in Molecular Biology (2008), 217:1940-6029). Лизаты подвергали разделению в 3-8% трис-ацетатном геле и переносили с использованием системы сухого блоттинга iBIot (Invitrogen). Блоты исследовали с помощью антитела против бета-тубулина (Chemicon) и моноклонального антитела МАВ2166 (Millipore), которое специфично реагирует с мышиным белком гентингтином. Иммуноблоты количественно определяли с использованием программного обеспечения Odyssey V3,0. Результаты представлены в таблице 60 как процентное уменьшение по сравнению с контролем PBS и демонстрируют существенное ингибирование содержания мРНК и белка гентингтина с помощью антисмыслового олигонуклеотида как на день 7, так и надень 14.
Пример 8: Интрацеребровентрикулярное введение антисмысловых олигонуклеотидов против мРНК гентингтина у яванских макаков
Яванских макаков обрабатывали олигонуклеотидами ISIS посредством интрацеребровентрикулярного (ICV) введения в определенную зону головного мозга - в боковые желудочки - с целью определения активности олигонуклеотидов в ткани головного мозга против экспрессии мРНК гентингтина.
Обработка и хирургическое вмешательство
Двум группам, из 3 яванских макаков каждая, вводили либо 0,635 мг/мл (1,5 мг/сутки), либо 1,67 мг/мл (4 мг/сутки) ISIS 436689, доставляемого ICV с помощью индивидуальных амбулаторных насосов (Pegasus Vario) со скоростью 0,05 мл/час в течение 4 недель. Контрольной группе из 2 яванских макаков вводили PBS подобным образом. Группам билатерально вводили ISIS 436689. Одному животному вводили ISIS 436689 при дозе 4 мг/сутки односторонне в правый желудочек.
Животным позволяли восстанавливаться в течение 10 суток после хирургического вмешательства перед выполнением инфузии. Во время периода восстановления после хирургического вмешательства животных поддерживали на ICV инфузии PBS со скоростью потока 0,05 мл/час с использованием одного амбулаторного инфузионного насоса на желудочек. В конце периода восстановления каждую канюлю соединяли с индивидуальным амбулаторным насосом (Pegasus Vario), помещенным в корсет примата (Lomir, PJ-02NB). Насосы оставляли соединенными до завершения периода инфузии. После 4 недель введения животных подвергали эвтаназии и собирали головной мозг, печень и почку.
РНК анализ мРНК htt
РНК экстрагировали из передней части хвостатого ядра, задней части хвостатого ядра, височной коры, теменной коры, гипоталамуса, среднего мозга, гиппокампа и спинного мозга, а также печени и почки для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени. Измеряли содержание мРНК гентингтина с использованием набора праймерных зондов человека RTS2617 и нормировали к содержанию циклофилина А обезьяны. Результаты рассчитывали как процентное ингибирование экспрессии мРНК гентингтина по сравнению с контролем PBS и представили в таблице 61. ISIS 436689 вызывал существенное ингибирование содержания мРНК гентингтина человека в ЦНС.
Пример 9: Измерение периода полувыведения ISIS 387898 в полосатом теле мышей C57/BL6 посредством однократного болюсного введения
Мышам C57/BL6 вводили ISIS 387898 как однократный болюс в полосатое тело с целью измерения периода полувыведения и продолжительности действия антисмыслового олигонуклеотида против экспрессии мРНК гентингтина в этой ткани,
Обработка
Сорок мышей C57/BL6 обрабатывали ISIS 387898 (5' CTCGACTAAAGCAGGATTTC 3' (SEQ ID NO:53); начальное положение 4042 в SEQ ID NO:1 и начальное положение 4001 в SEQ ID NO:3), доставляемым как однократный болюс по 50 мкг в соответствии с процедурой, подобной описанной в примере 5. Восемь контрольных мышей C57/BL6 обрабатывали PBS в подобной процедуре. Группы, из 4 мышей каждая, подвергали эвтаназии в различные моменты времени и стриарную ткань экстрагировали в соответствии с процедурой, подобной описанной в примере 5.
Анализ РНК
РНК экстрагировали из стриарной ткани для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени. Содержание мРНК нормального гентингтина мыши измеряли с использованием набора мышиных праймерных зондов RTS2633. Результаты представлены в таблице 62 и выражены как процентное ингибирование по сравнению с контрольной группой PBS на день 7. Наблюдали ингибиторный эффект ISIS 387898, продолжающийся в течение по меньшей мере 91 суток.
Анализ концентрации антисмыслового олигонуклеотида в головном мозге Ткани головного мозга измельчали, взвешивали, гомогенизировали и экстрагировали с использованием способа фенол/хлороформной экстракции жидкости жидкостью. Затем выполняли твердофазную экстракцию супернатанта на фенил-связанной колонке перед электрокинетическим введением при капиллярном гель-электрофорезе. Устройство для капиллярнного электрофореза Р/АСЕ MDQ (Beckman Coulter, Fullerton, СА) применяли для электрофоретического анализа с использованием заполненных гелем капилляров. Пики олигонуклеотидов выявляли посредством поглощения UV при 260 нм. Концентрацию ISIS 387898 в головном мозге (мкг/г) наносили на график против экспрессии гентингтина человека как процентное отношение к контролю PBS (таблица 63 и фигура 1). Рассчитывали концентрацию ISIS 387898, которая достигает 50% ингибирования экспрессии мРНК гентингтина (ЕС50). EC50 определили как 0,45 мкг/г. Также зависимую от времени концентрацию ISIS 387898 в ткани головного мозга и соответствующее процентное отношение экспрессии мРНК гентингтина наносили на график (таблица 64 и фигура 2) и рассчитали период полувыведения олигонуклеотида как 21 сутки.
Пример 10: Измерение периода полувыведения ISIS 387898 в боковых желудочках мышей BACHD посредством ICV введения
Мышам BACHD вводили ISIS 387898 ICV путем в боковые желудочки головного мозга с целью измерения периода полувыведения и продолжительности действия антисмыслового олигонуклеотида против экспрессии мРНК гентингтина в этой ткани.
Обработка
Двадцать восемь мышей BACHD обрабатывали ISIS 387898, доставляемым путем ICV введения при 75 мкг/сутки в течение 2 недель в соответствии с процедурой, подобной описанной в примере 9. Двадцать восемь контрольных мышей BACHD обрабатывали PBS в соответствии с процедурой, подобной описанной в примере 9. Группы, из 4 мышей каждая, как группы обработки, так и контрольные, подвергали эвтаназии с двухнедельной периодичностью и экстрагировали переднюю кортикальную ткань в соответствии с процедурой, подобной описанной в примере 9.
Анализ РНК
РНК экстрагировали из правого полушария и передней, и задней части участка канюлирования для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени. Содержание мРНК мутантного гентингтина человечка измеряли с использованием набора праймерных зондов человека RTS2617. Содержание мРНК нормального гентингтина мыши измеряли с использованием набора мышиных праймерных зондов RTS2633. Уровни экспрессии мРНК мутантного гентингтина человека представлены в таблице 65 и выражены как процентное ингибирование по сравнению со средним значением, которое измеряли в контрольных группах PBS. Уровни экспрессии нормальной мышиной мРНК гентингтина представлены в таблице 66 и выражены как процентное ингибирование по сравнению со средним значением такового, измеренного в контрольных группах PBS. Наблюдали, что ингибиторный эффект ISIS 387898 продолжался в течение 91 суток.
Анализ концентрации антисмыслового олигонуклеотида в головном мозге Ткань головного мозга обрабатывали в соответствии с процедурой, подобной описанной в примере 9. Концентрацию ISIS 387898 в передней коре головного мозга (мкг/г) наносили на график против ингибирования гентингтина человека как процентное отношение к контролю PBS (таблица 67 и фигура 3) и рассчитали, что ЕС50 составляет 26,4 мкм/г. Также зависимую от времени концентрацию ISIS 387898 в ткани головного мозга наносили на график (таблица 68 и фигура 4) и рассчитали, что период полувыведения олигонуклеотида составляет 21 сутки.
Пример 11: Измерение периода полувыведения ISIS 388241 и ISIS 443139 в боковых желудочках мышей BACHD посредством ICV введения
Мышам BACHD вводили ISIS 388241 или ISIS 443139 ICV путем в боковые желудочки головного мозга с целью измерения периода полувыведения и продолжительности действия антисмыслового олигонуклеотида против экспрессии мРНК гентингтина в этой ткани.
Обработка
Двадцать мышей BACHD обрабатывали ISIS 38241, доставляемым путем ICV введения при 50 мкг/сутки в течение 2 недель в соответствии с процедурой, подобной описанной в примере 9. Двадцать мышей BACHD обрабатывали ISIS 443139, доставляемым путем ICV введения при 50 мкг/сутки в течение 2 недель в соответствии с процедурой, подобной описанной в примере 9. Двадцать контрольных мышей BACHD обрабатывали PBS в соответствии с процедурой, подобной описанной в примере 9. Группы, из 4 мышей каждая, как группы обработки, так и контрольную группу, подвергали эвтаназии с двухнедельной периодичностью и экстрагировали ткань в соответствии с процедурой, подобной описанной в примере 9.
Анализ РНК
РНК экстрагировали из правого полушария и передней, и задней части участка канюлирования для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени. Содержание мРНК мутантного гентингтина человека измеряли с использованием набора праймерных зондов человека RTS2617. Результаты представлены в таблице 69 и выражены как процентное ингибирование по сравнению со средним значением такового, которое измеряли в контрольных группах PBS. Наблюдали, что ингибиторный эффект как ISIS 388241, так и ISIS 443139 продолжался в течение по меньшей мере 16 недель. И ISIS 388241, и его эквивалент со смешанным скелетом - ISIS 443139 - характеризуются более чем 3 ошибочными спариваниями с мышиной мРНК гентингтина (SEQ ID NO:5) и поэтому не показывают существенного ингибирования содержания мышиной мРНК по сравнению с контролем.
Анализ концентрации антисмыслового олигонуклеотида в головном мозге Ткань мозга обрабатывали в соответствии с процедурой, подобной описанной в примере 9. Зависимую от времени концентрацию ISIS 388241 в ткани заднего мозга наносили на график (таблица 70 и фигура 5) и рассчитали, что период полувыведения олигонуклеотида составляет 20 суток. Зависимую от времени концентрацию ISIS 443139 в ткани заднего мозга наносили на график (Таблица 71 и Фигура 6) и рассчитали, что период полувыведения олигонуклеотида составляет 20 суток.
Пример 12: Эффект антисмыслового ингибирования мутантного гентингтина человека на двигательную активность мышей BACHD
Мышей BACHD обрабатывали олигонуклеотидоами ISIS посредством интрацеребровентрикулярного (ICV) введения с целью оценивания эффекта олигонуклеотидов против экспрессии мРНК гентингтина на их двигательную активность с помощью анализа с вращающимся стержнем.
Обработка
Анализ с ускоряющимся вращающимся стержнем выполняли на вращающемся стержне Ugo Basile. Животных помещали на вращающийся стержень со скоростью 2 оборота в минуту, вращающийся стержень ускоряли до 40 оборотов в минуту за 5 минут. Регистрировали отрезок времени до падения. Отрезок времени до падения определяли либо по падению животного с вращающегося стержня, либо по остановке бега с удержанием на вращающемся стержне и вращением на нем. Шестимесячных мышей BACHD и их нетрансгенных детенышей одного помета обучали бегать на вращающемся стержне в течение одной недели до обработки. Это составляло три последовательных испытания по 5 минут каждое с 20 минутным периодом отдыха между испытаниями. Затем группу из 15 мышей BACHD обрабатывали ISIS 388241 при 50 мкм/сутки, доставляемым ICV с помощью насосов Alzet 2002 со скоростью 12 мкл/сутки в течение 2 недель. Мышам хирургически имплантировали насосы в соответствии с процедурой, подобной описанной в примере 6. Контрольную группу из 14 мышей BACHD обрабатывали PBS подобным образом. Контрольную группу из 9 нетрансгенных детенышей одного помета обрабатывали PBS подобным образом.
Анализ способности удерживаться на вращающемся стержне
В конце периода обработки насосы удаляли и через две недели проводили первый после обработки анализ с вращающимся стержнем. Поведение на вращающемся стержне анализировали ежемесячно до тех пор, пока мыши не достигали возраста 11 месяцев. Каждый месяц животных помещали на вращающийся стержень для трех испытательных пробежек в сутки в течение 2 суток. Результаты представлены на фиг.7, а также в таблице 72 и выражены как отрезок времени до падения в секундах. Исходные значения в 6-месячном возрасте регистрировали перед обработкой, и данными точками времени являлся возраст мышей, в котором выполняли анализ. Данные показывают, что обработка мышей BACHD ISIS 388241 увеличивала отрезок времени до падения по сравнению с таковым, наблюдаемым у необработанных мышей BACHD.
Пример 13: Эффект антисмыслового ингибирования мРНК мутантного гентингтина человека и гентингтина дикого типа мышей на двигательную активность мышей BACHD
Мышей BACHD обрабатывали олигонуклеотидами ISIS посредством интрацеребровентрикулярного (ICV) введения с целью оценивания эффекта олигонуклеотидов против экспрессии мРНК гентингтина на их двигательную активность посредством анализа с вращающимся стержнем.
Обработка
Анализ с ускоряющимся вращающимся стержнем выполняли на вращающемся стержне Ugo Basile. Животных помещали на вращающийся стержень со скоростью 2 оборота в минуту, вращающийся стержень ускоряли до 40 оборотов в минуту за 5 минут. Регистрировали отрезок времени до падения. Отрезок времени до падения определяли либо по падению животного с вращающегося стержня, либо по остановке бега с удержанием на вращающемся стержне и вращением на нем. Двухмесячных мышей BACHD и их нетрансгенных детенышей одного помета обучали бегать на вращающемся стержне в течение одной недели до обработки. Это составляло три последовательных испытания по 5 минут каждое с 20 минутным периодом отдыха между испытаниями. Затем группы, из 17-21 мышей BACHD каждая, обрабатывали ISIS 388241 при 50 мкм/сутки, ISIS 408737 при 75 мкг/сутки или ISIS 387898 при 75 мкг/сутки, доставляемых ICV с помощью насосов Alzet 2002 со скоростью 0,5 мкл/час в течение 2 недель. Мышам хирургически имплантировали насосы в соответствие с процедурой, подобной описанной в примере 6. Контрольную группу из 20 мышей BACHD обрабатывали PBS подобным образом. Группы нетрансгенных контрольных мышей также обрабатывали подобным образом олигонуклеотидами ISIS или PBS.
Анализ способности удерживаться на вращающемся стержне
В конце периода обработки насосы удаляли и через две недели проводили первый после обработки анализ с вращающимся стержнем. Поведение на вращающемся стержне анализировали ежемесячно до тех пор, пока мыши не достигали возраста 10 месяцев. Каждый месяц животных помещали на вращающийся стержень для 3-5 испытательных пробежек в сутки в течение 3 последовательных суток. Результаты представлены в таблице 73 и выражены как отрезок времени до падения в секундах. Исходные значения в 2-месячном возрасте регистрировали перед обработкой, и данными точками времени являлся возраст мышей, в котором выполняли анализ. ISIS 387898 (обозначенный в таблице как человеко-мышиный ASO) перекрестие реагирует с мРНК гентингтина и мыши, и человека и поэтому будет ингибировать и мРНК мутантного гентингтина человека, и мышиную мРНК гентингтина дикого типа у мышей. ISIS 388241 (обозначенный в таблице как человеческий ASO) специфично нацеливается на мРНК гентингтина человека и ошибочно спаривается по 8 парам оснований с мышиной мРНК гентингтина. Следовательно, ISIS 388241 будет специфично ингибировать только мРНК мутантного гентингтина человека, но не мышиной мРНК гентингтина дикого типа у мышей. ISIS 408737 (обозначенный в таблице как мышиный ASO) специфично нацеливается на мышиную мРНК гентингтина и ошибочно спаривается по 7 парам оснований с мРНК гентингтина человека. Следовательно, ISIS 408737 будет специфично ингибировать только мышиную мРНК гентингтина дикого типа, но не мРНК мутантного гентингтина человека у мышей. «Tg» означает мышей BACHD, а «не Tg» означает нетрансгенных контрольных мышей.
Результаты исследования показывают, что ингибирование мРНК мутантного гентингтина человека посредством ISIS 388241 (Tg-человеческий ASO) значительно улучшало способность мышей в анализе с вращающимся стержнем по сравнению с контролем (Tg-PBS). Также результаты показывают, что обработка мышей посредством ISIS 387898 (Tg-человеко-мышиный ASO), который нацеливается на мРНК мутантного и дикого-типа гентингтина у мышей, не вызывала каких-либо вредных эффектов на двигательную активность мышей и фактически также значительно улучшала способности удерживаться на вращающемся стержне по сравнению с контролем (Tg-PBS). Мыши, обработанные ISIS 408737 (Tg-мышиным ASO), не показывали улучшенной способности удерживаться на вращающемся стержне по сравнению с контролем PBS, как ожидалось, поскольку олигонуклеотид не нацелен на мРНК мутантного гентингтина. Нетрансгенные контроли использовали в качестве положительных контролей в этом анализе.
меся-
ца
меся-
ца
меся-
ца
меся-
цев
меся-
цев
меся-
цев
меся-
цев
меся-
цев
меся-
цев
кий-мышиный ASO
Пример 14: Эффект антисмыслового ингибирования мРНК гентингтина на массу головного мозга мышей R6/2
Мышей R6/2 обрабатывали олигонуклеотидами ISIS посредством интрацеребровентрикулярного (ICV) введения с целью оценивания эффекта олигонуклеотидов против экспрессии мРНК гентингтина на массу и объем головного мозга.
Обработка
Мышей R6/2 помещали в группы, до 5 на клетку, (смешанные генотипы, один пол). Всех мышей помещали в клетки из обувных коробок с дном, покрытым стерильной древесной подстилкой, которую меняли так часто, как требовалось, чтобы обеспечить животных сухой подстилкой. Эту основную среду обитания дополняли игровыми туннелями, гнездами из измельченных кусочков и пластиковыми косточками для всех мышей; т.е. клетка с дополненной средой обитания содержала мышиный туннель (янтарного цвета, сертифицированный, прозрачный, BioServ Product № по каталогу К3323), Petite Green Gumabone (BioServ Product № по каталогу К3214) и гнездо (Hockley et al., Ann Neurol. 2002, 51: 235-242). Еда и вода были доступны мышам ad libitum в их домах-клетках.
Группе из десяти шестимесячных мышей R6/2 вводили 50 мкг/сутки ISIS 388817, доставляемого ICV посредством насосов Alzet 1004 со скоростью 0,12 мкл/час в течение 4 недель. Группе из двух нетрансгенных детенышей одного помета вводили 50 мкг/сутки ISIS 388817, доставляемого подобным образом. Контрольной группе из пяти мышей R6/2 вводили 50 мкг/сутки ISIS 141923, доставляемого подобным образом. Контрольной группе из девяти мышей R6/2 вводили PBS, доставляемый подобным образом. Группе из восьми нетрансгенных детенышей одного помета вводили PBS, доставляемый подобным образом. Группу из четырех необработанных восьми-недельных R6/2 до проявления симптомов также включали в исследование.
Измерение массы головного мозга
Животных анестезировали изофлураном, а затем подвергали транскардиальной перфузии ледяным фосфатным буфером Sorenson (SPB) и фиксировали с помощью 4% параформальдегида в SPB. Головной мозг удаляли и усекали корональными срезами, непосредственно рострально к переднему мозгу (удаляя обонятельные луковицы) и непосредственно каудально к мозжечку (удаляя спинной мозг). Остальной головной мозг взвешивали в мг. Результаты представлены на фиг.8 и в таблице 74 и демонстрируют увеличение массы головного мозга у мышей R6/2, обработанных ISIS 388817 по сравнению с контролем PBS.
Пример 15; Эффект антисмыслового ингибирования мРНК гентингтина на характеристику тревожности мышей YAC128
Мышей YAC128 обрабатывали олигонуклеотидами ISIS посредством интрацеребровентрикулярного (ICV) введения с целью оценивания эффекта олигонуклеотидов против экспрессии мРНК гентингтина на тревожность у этих мышей, которую измеряли по их характеристике в открытом поле и в анализах с приподнятым крестообразным лабиринтом.
Обработка
Группе из семи пятимесячных мышей YAC128 вводили 50 мкг/сутки ISIS 388241, доставляемого ICV с помощью насосов Alzet 1004 со скоростью 0,5 мл/час в течение 14 суток. Контрольную группу из четырех мышей YAC128 подобным образом обрабатывали PBS. Контрольную группу из восьми нетрансгенных детенышей одного помета FVB/NJ включали в исследование, и они не получали какой-либо обработки. Мышам хирургически имплантировали насосы следующим образом: вкратце, осмотические насосы Alzet (Модель 2002) собирали в соответствии с инструкциями производителя. Насосы наполняли раствором, содержащим антисмысловой олигонуклеотид, и инкубировали на протяжении ночи при 37°С 24 часа до имплантации. Животных анестезировали 3% изофлураном и помещали в стереотаксическую рамку. После стерилизации хирургического поля делали срединный разрез по черепу и создавали подкожный карман по спине, в который имплантировали предварительно наполненный осмотический насос. Делали небольшое трепанационное отверстие в черепе над правым боковым желудочком. Затем в желудочек помещали канюлю, соединенную с осмотическим насосом посредством пластикового катетера, и приклеивали к месту с использованием клейкого материала Loctite. Разрез закрывали наложением швов. Антисмысловой олигонуклеотид или PBS вводили в течение 14 суток, после чего насосы удаляли. Животным позволяли восстанавливаться в течение 2 недель, после чего выполняли поведенческий анализ и в конечном итоге мышей подвергали эвтаназии в соответствии с протоколом гуманного обращения, одобренным Институциональным комитетом по содержанию и использованию животных. Ткань головного и спинного мозга собирали и мгновенно замораживали в жидком азоте. Перед замораживанием ткань мозга разрезали в поперечном направлении на пять сегментов (S1, S2, S3, S4 и S5) с использованием матрицы головного мозга мыши. Сегменты с 1 по 5 отделяли друг от друга приблизительно на 2 мм, причем S1 является наиболее ростральным, а S5 - наиболее каудальным.
Анализ открытого поля
Мышей помещали на арену открытого поля (Med Associates) с применением прерываний луча света для измерения горизонтального и вертикального передвижений за 30-минутный сеанс тестирования. Данные анализировали с использованием программного обеспечения Activity Monitor для проверки полного передвижения в виде ходьбы по арене и передвижения в центре арены как меры тревожности. Ожидалось, что контрольные мыши YAC128 проводили меньше времени в центре арены по сравнению с их нетрансгенными, менее склонными к тревожности детенышами одного помета FVB/NJ. Результаты представлены на фиг.9 и в таблице 75 и показывают, что обработка мышей YAC128 антисмысловыми олигонуклеотидами уменьшала тревожность у этих мышей в соответствии параметрами анализа открытого поля.
Анализ с приподнятым крестообразным лабиринтом
Аппарат состоял из двух открытых отделений и двух закрытых отделений, каждый размером 65×6,25 см, и приподнимался на 50 см над поверхностью. Мышей помещали в центр аппарата и их расположение записывали в течение 5-минутного сеанса тестирования. Ожидалось, что контрольные мыши YAC128 проведут меньше времени в открытых отделениях аппарата по сравнению с их нетрансгенными, менее склонными к тревожности детенышами одного помета FVB/NJ. Результаты представлены на фиг.10 и в таблице 76 и показывают, что обработка мышей YAC128 антисмысловым олигонуклеотидом уменьшала тревожность у этих мышей в соответствии с параметрами анализа с приподнятым крестообразным лабиринтом.
Анализ РНК и белка
Общую РНК экстрагировали из головного и спинного мозга мыши с помощью набора RNeasy Protect Mini Kit (Qiagen, Mississauga, ON, Canada) для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени с использованием набора RNeasy Mini prep kit (Qiagen). Проводили Q-ПЦР реакции и анализировали на детекторе последовательности ABI Prism 7700 (Applied Biosystems). Содержание мРНК гентингтина человека измеряли с использованием набора праймерных зондов человека RTS2686 и нормировали к содержанию мРНК пептидилпролилизомеразы А.
Белковые лизаты получали из полосок головного мозга мыши, как описано ранее (Li S.H. and Li X.J., Methods in Molecular Biology (2008), 217:1940-6029). Лизаты прогоняли на 3-8% трис-ацетатном геле и переносили с использованием системы сухого блоттинга iBlot (Invitrogen). Блоты исследовали с использованием антитела против бета-тубулина (Chemicon) и мышиного моноклонального антитела ЕМ48, которое специфично реагирует с белком гентингтина человека (Millipore). Иммуноблоты количественно определяли с использованием программного обеспечения Odyssey V3.0. Результаты представлены в таблице 77 как процентное уменьшение по сравнению с контролем PBS и демонстрируют существенное ингибирование содержания мРНК гентингтина и белка антисмысловым олигонуклеотидом.
Пример 16: Интрацеребровентрикулярное введение антисмысловых олигонуклеотидов против гентингтина у мышей C57/BL6
Мышей C57/BL6 обрабатывали олигонуклеотидами ISIS посредством интрацеребровентрикулярного (ICV) введения в правый боковой желудочек с целью оценивания переносимости олигонуклеотидов у этих мышей.
Обработка и хирургическое вмешательство Группам, из пяти мышей C57/BL6 каждая, вводили ISIS 387916, ISIS 437527, ISIS 444578, ISIS 444584, ISIS 444607, ISIS 444608, ISIS 444627, ISIS 444652, ISIS 444659, ISIS 444660 или ISIS 444661 по 150 мкг/сутки, доставляемого ICV с помощью насосов Alzet 2002 со скоростью 0,5 мкл/сутки в течение 2 недель. Контрольную группу из шести мышей C57/BL6 подобным образом обрабатывали PBS. Процедура имплантации насосов и введения олигонуклеотидов описана в примере 6.
Животным позволяли восстанавливаться в течение двух недель перед тем, как подвергнуть эвтаназии с использованием изофлурана. Ткань головного мозга и спинного мозга собирали и мгновенно замораживали в жидком азоте. Перед замораживанием ткань мозга разрезали в поперечном направлении на пять сегментов (S1, S2, S3, S4 и S5) с использованием матрицы мозга мыши. Сегменты с 1 по 5 были отделены приблизительно на 2 мм друг от друга, причем S1 являлся самым ростральным, a S5 - самым каудальным.
Анализ РНК
Общую РНК экстрагировали из передней и задней коры головного мозга для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени с использованием набора RNeasy Mini p rep kit (Qiagen). RT-ПЦР реакции проводили на детекторе последовательностей ABI Prism 7700 (Applied Biosystems). Содержание мРНК гентингтина мыши измеряли с использованием набора мышиных праймерных зондов RTS2633 и нормировали к содержанию мРНК циклофилина. Результаты представлены в таблице 78 как процентное уменьшение по сравнению с контролем PBS. Все из ISIS 387916, ISIS 437527, ISIS 444627 и ISIS 444652 характеризуются одним ошибочным спариванием с мышиной мРНК гентингтина (SEQ ID NO:3) и поэтому не показывают существенного ингибирования содержания мышиной мРНК по сравнению с контролем.
Микроглиальный маркер AIF1 также измеряли с помощью анализа RT-ПЦР с использованием набора мышиных праймерных зондов mAIF1_LTS00328 (прямой последовательности TGGTCCCCCAGCCAAGA, обозначенной в настоящем документе как SEQ ID NO:54; обратной последовательности CCCACCGTGTGACATCCA, обозначенной в настоящем документе как SEQ ID NO:55; зондовой последовательности AGCTATCTCCGAGCTGCCCTGATTGG, обозначенной в настоящем документе как SEQ ID NO:56). Результаты представлены в таблице 79 и показывают, что тестируемые олигонуклеотиды ISIS не вызывают воспалительного ответа.
Измерения массы тепа
Массу тела измеряли с регулярными интервалами на протяжении всего периода исследования и представили в таблице 80. Эти значения массы применяли в качестве индикатора переносимости. Мыши, обработанные ISIS 437527, ISIS 444584 и ISIS 444652, характеризовались постоянной массой тела на протяжении всего периода исследования, и указанные олигонуклеотиды считались самыми переносимыми из всех олигонуклеотидов ISIS, предусмотренных исследованием. «Н.д.» означает отсутствие данных для этой группы мышей.
Пример 17: Анализ нейротоксических эффектов болюсного введения антисмысловых олигонуклеотидов в стриарную ткань крыс
Крыс Sprague-Dawley обрабатывали олигонуклеотидами ISIS посредством болюсного введения в полосатое тело с целью скрининга по индукции микроглиального маркера AIF1 в качестве меры токсичности для ЦНС.
Обработка и хирургическое вмешательство Группам из четырех крыс Sprague-Dawley вводили ISIS 388241, ISIS 443139, ISIS 436671, ISIS 437527, ISIS 444584, ISIS 444591 или ISIS 444652, доставляемые как однократный болюс при концентрации 25 мкг, 50 мкг, 75 мкг или 100 мкг.
Группу из 4 крыс подобным образом обрабатывали ISIS 387916, доставляемым как однократный болюс при концентрациях 10 мкг, 25 мкг, 50 мкг или 75 мкг. Контрольную группу из 4 крыс подобным образом обрабатывали PBS. Через семь дней после болюсного введения крыс подвергали эвтаназии с использованием изофлурана и удаляли органы. Животных декапитировали и головной мозг удаляли для препарирования стриарной ткани. Пару тонких изогнутых щипцов помещали непосредственно в головной мозг точно впереди гиппокампа для того, чтобы сделать поперечный разрез коры и подлежащих тканей путем тупого препарирования. Концы еще одной пары тонких изогнутых щипцов помещали непосредственно по середине среднесагитального синуса между гиппокампом и обонятельной луковицей, чтобы сделать продольный разрез, разрезая мозолистое тело путем тупого препарирования. Первую пару щипцов затем использовали для того, чтобы отогнуть назад образующийся угол коры, раскрывая полосатое тело и внутреннюю капсулу, а затем иссекали внутреннюю капсула из полосатого тела. Второй набор щипцов помещали так, чтобы изогнутые концы располагались на одной из двух сторон полосатого тела, и нажимали вниз для выделения ткани. Первый набор щипцов использовали для отщепления заднего конца полосатого тела и удаления полосатого тела из головного мозга.
Анализ РНК уровней экспрессии AIF1
РНК экстрагировали из стриарной ткани для анализа содержания мРНК AIF1 с помощью ПЦР в реальном времени. Содержание AIF1 крысы измеряли с использованием набора крысиных праймерных зондов rAif1_LTS00219. Результаты рассчитывали как процентное отношение экспрессии AIF1 к таковой в контроле PBS и представили в таблице 81. Результаты показывают, что ISIS 388241, ISIS 443139, ISIS 436671, ISIS 444591, ISIS 437527, ISIS 444584 и ISIS 444652 являлись достаточно переносимыми в мозге крысы.
Анализ уровней экспрессии РНК гентингтина
РНК экстрагировали из стриарной ткани для анализа ПЦР в реальном времени содержания мРНК гентингтина. Содержание мРНК гентингтина крысы измеряли с использованием набора крысиных праймерных зондов rHtt_LTS00343. Результаты рассчитывали как процентное отношение уменьшения экспрессии гентингтина к таковой в контроле PBS и представили в таблице 82. Каждый из ISIS 388241 и ISIS 443139 ошибочно спаривался по 6 парам оснований или более с генной последовательностью крысы (SEQ ID NO:5) и, следовательно, не показывал существенного ингибирования содержания мРНК крысы по сравнению с контролем. ISIS 444584 характеризуется 3 ошибочными спариваниями с генной последовательностью крысы (SEQ ID NO:5) и, следовательно, не показывает существенного ингибирования содержания мРНК крысы по сравнению с контролем.
Пример 18: Зависимое от дозы антисмысловое ингибирование мРНК гентингтина в первичных гепатоцитах яванского макака
ISIS 437527, ISIS 444584 и ISIS 444652 тестировали в первичных гепатоцитах яванского макака при разных дозах. Эталонные олигонуклеотиды ISIS 387916 и ISIS 388241 также предусматривали для сравнения. Клетки высевали с плотностью 35000 клеток на лунку и трансфицировали с использованием электропорации при концентрациях 39,0625 нМ, 78,125 нМ, 156,25 нМ, 312,5 нМ, 625 нМ, 1,250 нМ, 2500 нМ, 5000 нМ, 10000 нМ и 20000 нМ каждого антисмыслового олигонуклеотида. Через приблизительно 16 часов РНК выделяли из клеток и содержание транскрипта мРНК гентингтина измеряли с помощью количественной ПЦР в реальном времени с использованием праймерного зондового набора RTS2686. Содержание транскрипта мРНК гентингтина нормировали к общему содержанию РНК, которое измеряли с помощью RIBOGREEN®. Результаты представлены в таблице 83 как процентное ингибирование гентингтина по отношению к необработанным контрольным клеткам. Контрольный олигонуклеотид ISIS 141923 включали в этот анализ, и он не демонстрировал ингибирования мРНК гентингтина, как ожидалось.
ISIS 437527, ISIS 444584 и ISIS 444652 характеризовались более низкими значениями IC50, чем эталонный олигонуклеотид ISIS 388241. ISIS 437527 и ISIS 444652 характеризовались такими же низкими или еще более низкими значениями IC50, чем эталонный олигонуклеотид ISIS 387916.
Пример 19: Измерение периода полувыведения олигонуклеотидов ISIS у мышей BACHD посредством однократного внутристриарного болюсного введения
Мышам BACHD вводили олигонуклеотиды ISIS в виде однократного болюса в полосатое тело с целью измерения продолжительности действия антисмысловых олигонуклеотидов против экспрессии мРНК гентингтина или его периода полувыведения в этой ткани.
Обработка и хирургическое вмешательство Группы, из 25 BACD мышей каждая, обрабатывали ISIS 388241, ISIS 436689, ISIS 436671 или ISIS 444591, доставляемыми в виде однократного болюса по 40 мкг в соответствии с процедурой, подобной описанной в примере 4. Контрольную группу из 25 мышей BACHD обрабатывали PBS в подобной процедуре. В различные точки времени 5 мышей из каждой группы подвергали эвтаназии и стриарную ткань экстрагировали. Пару тонких изогнутых щипцов помещали непосредственно в головной мозг точно впереди гиппокампа для того, чтобы сделать поперечный разрез коры и подлежащих тканей путем тупого препарирования. Концы еще одной пары тонких изогнутых щипцов помещали непосредственно по середине среднесагитального синуса между гиппокампом и обонятельной луковицей, чтобы сделать продольный разрез, разрезая мозолистое тело путем тупого препарирования. Первую пару щипцов затем использовали для того, чтобы отогнуть назад образующийся угол коры, раскрывая полосатое тело и внутреннюю капсулу, а затем иссекали внутреннюю капсула из полосатого тела. Второй набор щипцов помещали так, чтобы изогнутые концы располагались на одной из двух сторон полосатого тела, и нажимали вниз для выделения ткани. Первый набор щипцов использовали для отщепления заднего конца полосатого тела и удаления полосатого тела из головного мозга.
Анализ РНК
РНК экстрагировали из передних и задних сегментов стриарной ткани для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени. Содержание мРНК мутантного гентингтина человека измеряли с использованием RTS2617. Содержание мРНК нормального гентингтина мыши измеряли с использованием набора мышиных праймерных зондов RTS2633. Результаты представлены в таблицах 84 и 85 и выражены как процентное ингибирование по сравнению со средним значением контрольной группы PBS на неделе 1, неделе 10 и неделе 20. Период полувыведения олигонуклеотидов ISIS в переднем сегменте мозга рассчитывали, исходя из данных ингибирования, и представили в таблице 86.
Измерения массы тела
Массу тела измеряли через регулярные интервалы и представили в таблице 87 как процент от массы мышей в начале исследования. Эти значения массы применяли как индикатор переносимости. Не отмечалось неблагоприятных изменений массы тела у какой-либо мыши, обработанной олигонуклеотидами ISIS.
Пример 20: Эффект внутриоболочечного введения ISIS 437527 у крыс Spragne-Dawley
Крысам Sprague-Dawley внутриоболочечно (IT) вводили ISIS 437527 либо однократной дозой, повторяемыми дозами, либо непрерывной инфузией.
Обработка и хирургическое вмешательство
Крыс анестезировали изофлураном и помещали 28-калибровый полиуретановый катетер в IT люмбальное пространство каждой крысы. Проксимальный конец катетера присоединяли к дозирующему основанию, которое выступало из кожи у животных в группах, получающих болюсные инъекции. Катетер у животных в группе, получающей непрерывную инфузию, присоединяли к насосу ALZET (Модель 2ML1), который помещали в подкожный карман на спинной части каждого животного. После хирургического вмешательства животные получали однократную внутримышечную дозу цефтиофура натрия (5 мг/кг) и тартрата буторфанола (0,05 мг/кг). Крысам, получающим непрерывную инфузию, сразу же начинали вводить дозы олигонуклеотида. Животным, которые получали болюсные инъекции, обеспечивали восстановительный период после хирургического вмешательства по меньшей мере пять суток, после чего оценивали проходимость катетера.
Группе из 5 крыс Sprague-Dawley вводили однократную болюсную инъекцию по 350 мкг ISIS 437527, доставляемого внутриболочечно. Еще одной группе из 5 крыс Sprague-Dawley вводили болюсные инъекции по 120 мкг ISIS 437527, доставляемого внутриболочечно в три приема на протяжении курса в 1 неделю. Другой группе из 5 крыс Sprague-Dawley вводили болюсные инъекции по 350 мкг ISIS 437527, доставляемого внутриоболочечно в три приема на протяжении курса в 1 неделю. Еще одной группе из 5 крыс Sprague-Dawley вводили по 50 мкг/сутки ISIS 437527, доставляемого с помощью непрерывной инфузии со скоростью 0,01 мл/час в течение 7 суток. Контрольной группе из 5 крыс Sprague-Dawley вводили болюсные инъекции PBS, доставляемые внутриоболочечно в три приема на протяжении курса в 1 неделю. Каждой группе обеспечивали восстановительный период 7 суток, после чего крыс подвергали эвтаназии. У всех групп собирали и анализировали головной мозг и спинной мозг.
Анализ уровней экспрессии РНК гентингтина
РНК экстрагировали из лобной коры, височной коры и шейного отдела спинного мозга для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени. Содержание мРНК гентингтина крыс измеряли с использованием праймерного зондового набора rHtt_LTS00343 и нормировали к содержанию циклофилина. Результаты представлены в таблице 88 и выражены как процентное ингибирование по сравнению со средним значением контрольных групп PBS.
Анализ уровней экспрессии PHK AIF1
РНК экстрагировали из лобной коры, височной коры и шейного отдела спинного мозга для анализа содержания мРНК AIF1 с помощью ПЦР в реальном времени. Содержание AIF1 крыс измеряли с использованием набора крысиных праймерных зондов rAif1_LTS00219. Результаты рассчитывали как процентное отношение экспрессии AIF1 к таковому контроля PBS и представили в таблице 89. Результаты показывают, что повторные IT болюсные введения ведут к воспалению в тканях шейного отдела спинного мозга. Непрерывное IT введение и однократные IT болюсные введения хорошо переносились крысами.
Пример 21: Измерение периода полувыведения ISIS 436689 в тканях ЦНС яванских макаков посредством внутриоболочечного введения
Яванским макакам вводили ISIS 436689 внутриоболочечно (IT) с целью измерения периода полувыведения и продолжительности действия антисмыслового олигонуклеотида против экспрессии мРНК гентингтина в различных тканях ЦНС.
Обработка
Исследование проводили в Северном биомедицинском исследовательском центре, MI. До начала обработки обезьян держали на карантине в течение 4-недельного периода, во время которого проводили стандартные панели химических и гематологических анализов сыворотки крови, исследование фекальных образцов на наличие яиц и паразитов, и туберкулезный тест для выявления ненормальных или больных обезьян. Обезьянам имплантировали внутриоболочечно люмбальные катетеры с использованием полиуретановых катетеров, соединенных с подкожным титановым портом доступа (пластиковый/титановый портал Р.A.S. PORT® Elite с замковым соединителем Ultra). Для непрерывной инфузии с использованием внешнего насоса животных анестезировали, чтобы прикрепить дозирующий аппарат к порту. Животных предварительно обрабатывали атропина сульфатом путем подкожной инъекции при дозе 0,04 мг/кг. Через приблизительно 15 минут вводили внутримышечную дозу 8 мг/кг кетамина HCl, чтобы индуцировать седативный эффект.Животным надевали маску для хирургической анестезии, интубировали и поддерживали на приблизительно 1 л/минута кислороде и 2% галотане или изофлуране. Животные получали однократную внутримышечную дозу 5 мг/кг антибиотика цефтиофура натрия. Рассечение делали около порта для помещения держателя модифицированной иглы. Модифицированную иглу помещали в порт и закрепляли наложением швов. При восстановлении после хирургического вмешательства на животном устанавливали корсет.
Пятнадцати самцам яванских макаков вводили 4 мг/сутки ISIS 436689 при концентрации 1,67 мг/мл и со скоростью потока 2,4 мл/сутки в течение 21 суток. Контрольной группе из 3 яванских макаков водили PBS подобным образом в течение того же периода. Группам, из 3 обезьян каждая, обеспечивали восстановительные периоды в 1 сутки, 2 недели, 4 недели или 8 недель, после чего их подвергали эвтаназии. Во время периода исследования за обезьянами наблюдали ежедневно на предмет признаков заболевания или дистресса.
Всем животным давали успокоительное путем внутримышечной инъекции 8,0 мг/кг кетамина HCl, поддерживали на галотане или смеси изофлурана с кислородом и обеспечивали внутривенным болюсом гепарина Na при 200 МЕ/кг. Животных перфузировали через левый желудочек сердца при 0,001% нитрита натрия в солевом растворе.
Во время умерщвления головной мозг разрезали в матрице головного мозга с толщиной коронарного среза 3 мм. Отбирали образцы из нескольких структур головного мозга с использованием 4 мм дерматома. Один образец диаметром 4 мм от каждой структуры помещали в 2 мл пробирки с завинчивающимися крышками, содержащие 1,0 мл стабилизирующего РНК раствора RNAtoer (Qiagen, CA), инкубировали в течение 1 часа при окружающей температуре, а затем замораживали. Смежные образцы диаметром 6 мм помещали в 2 мл пробирки с завинчивающимися крышками и замораживали для фармакокинетического анализа.
Спинной мозг делили на части в шейном, грудном и люмбальном отделах и сегменты толщиной приблизительно 3 мм из каждой зоны спинного мозга брали для анализа РНК и фармакокинетического анализа. Эти образцы обрабатывали подобным образом, как и образцы головного мозга.
Образцы печени собирали для анализа РНК и фармакокинетического анализа. Эти образцы обрабатывали образом, подобным описанному выше для образцов головного и спинного мозга.
Анализ РНК
РНК экстрагировали из люмбального отдела спинного мозга, грудного отдела спинного мозга, шейного отдела спинного мозга, из лобной коры, затылочной коры, коры мозжечка, ткани хвостатого ядра, гиппокампа, среднего мозга и варолиевого моста для анализа содержания мРНК гентингтина с помощью ПЦР в реальном времени посредством праймерного зондового набора RTS2617. Результаты, измеренные в различных отделах спинного мозга, представлены в таблице 90 и выражены как процентное ингибирования по сравнению с таковым, измеренным в контрольной группе PBS на 8 неделях. Результаты, измеренные в различных сегментах головного мозга, представлены в таблице 91 и выражены как процентное ингибирование по сравнению с таковым, измеренным в контрольной группе PBS на 8 неделях.
Измерение концентрации олигонуклеотида с помощью ELISA
Ткани (20 мг) измельчали, взвешивали и гомогенизировали перед экстракцией жидкости жидкостью с использованием фенола/хлороформа. Супернатант удаляли, лиофилизировали и восстанавливали в человеческой плазме (1 мл), содержащей EDTA, перед тем как анализировать с использованием процедуры гибридизации ELISA.
ISIS 436689 определяли в тканях с помощью гибридизации с меченым комплементарным зондом разрезания (дигоксигенин на 5'-конце, С18-спейсер и BioTEG на 3'-конце). Затем комплекс наносили на покрытый нейтравидином планшет и добавляли нуклеазу S1 для расщепления негибридизовавшихся зондов разрезания. Поскольку ISIS 436689 защищал зонд разрезания от расщепления, нерасщепленный зонд разрезания использовали как меру концентрации олигонуклеотида. Нерасщепленный зонд разрезания определяли с использованием антитела против дигоксигенина, конъюгированного со щелочной фосфатазой, с последующим считыванием флуорогенного субстрата. Концентрации олигонуклеотида измеряли в шейном, грудном и люмбальном отделах спинного мозга и в печени на 7, 20, 34 и 62 сутки восстановительного периода и представили в таблице 92. Период полувыведения ISIS 436689 в этих тканях рассчитывали из этих данных и представили в таблице 93. Данные показывают, что олигонуклеотид в основном концентрировался в ЦНС с незначительными концентрациями в системных тканях.
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДУЛЯЦИЯ ЭКСПРЕССИИ ГЕНТИНГТИНА | 2010 |
|
RU2751847C2 |
| МОДУЛЯЦИЯ ЭКСПРЕССИИ ФАКТОРА 11 | 2009 |
|
RU2535964C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ МОДУЛЯЦИИ ЭКСПРЕССИИ ДИСТРОФИЧЕСКОЙ МИОТОНИН-ПРОТЕИНКИНАЗЫ (DMPK) | 2014 |
|
RU2690333C2 |
| МОДУЛЯЦИЯ ЭКСПРЕССИИ ФАКТОРА 11 | 2014 |
|
RU2739594C2 |
| МОДУЛЯЦИЯ ЭКСПРЕССИИ АНГИОПОЭТИН-ПОДОБНОГО БЕЛКА 3 | 2014 |
|
RU2706964C2 |
| Модулирование экспрессии рецептора андрогенов | 2013 |
|
RU2670486C9 |
| МОДУЛЯТОРЫ ФАКТОРА В КОМПЛЕМЕНТА | 2014 |
|
RU2662967C2 |
| КОМПОЗИЦИИ ДЛЯ МОДУЛИРОВАНИЯ ЭКСПРЕССИИ SOD-1 | 2015 |
|
RU2704619C2 |
| АНТИСМЫСЛОВАЯ РЕГУЛЯЦИЯ ЭКСПРЕССИИ GCGR | 2012 |
|
RU2598709C2 |
| КОМПОЗИЦИИ ДЛЯ МОДУЛЯЦИИ ЭКСПРЕССИИ АТАКСИНА 2 | 2015 |
|
RU2702838C2 |






































































































































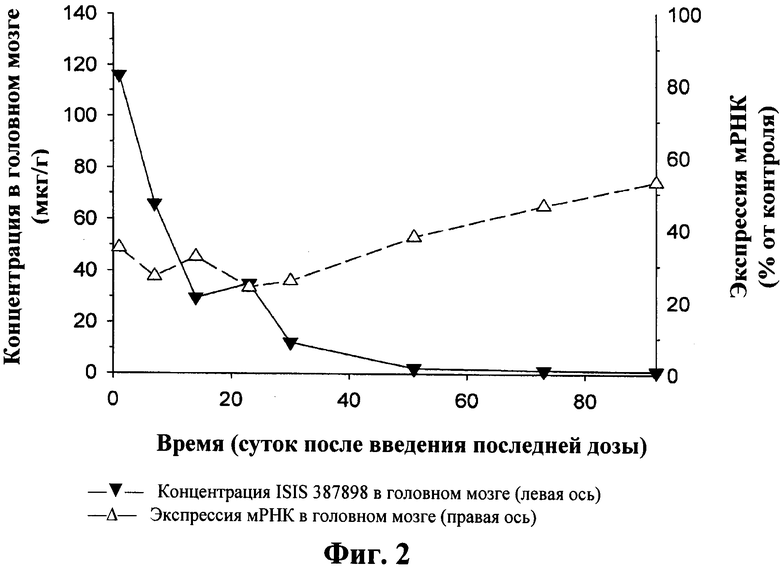

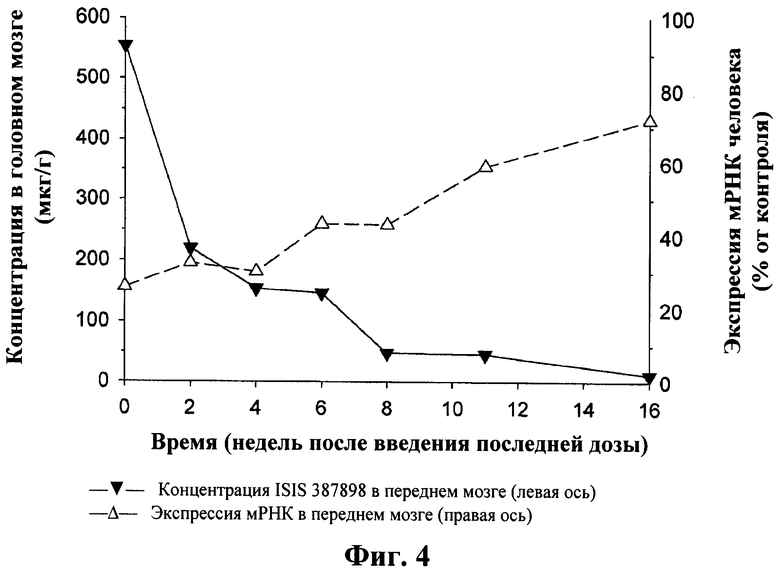
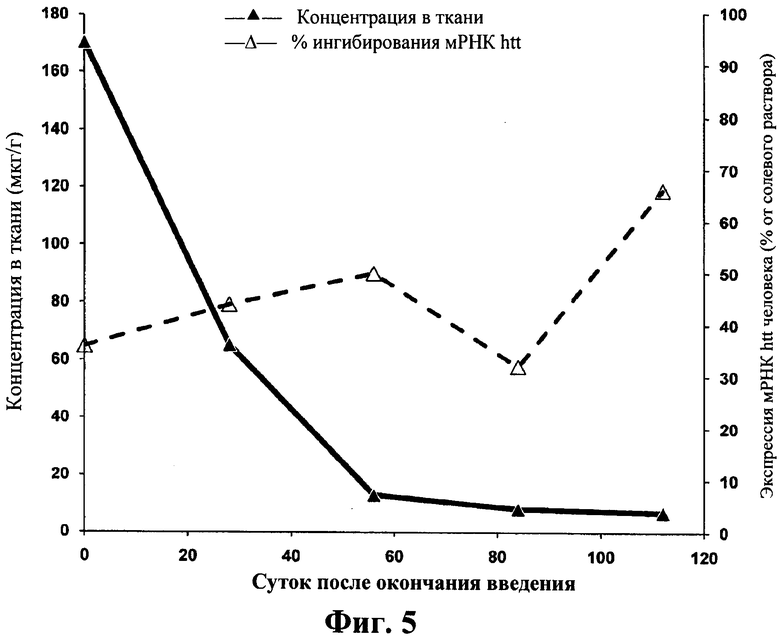
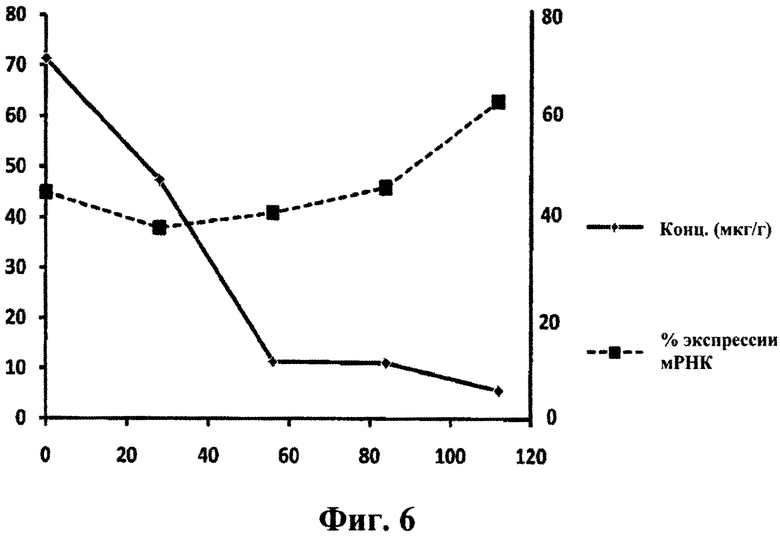
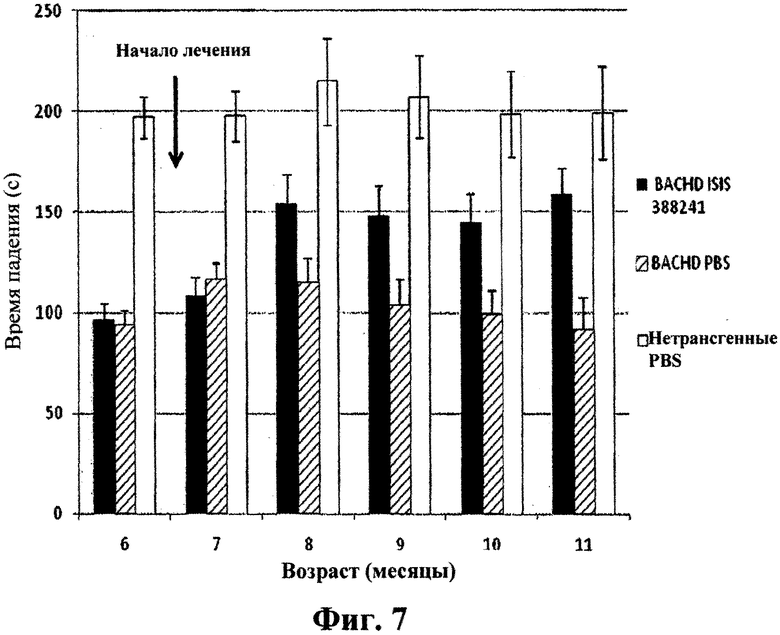
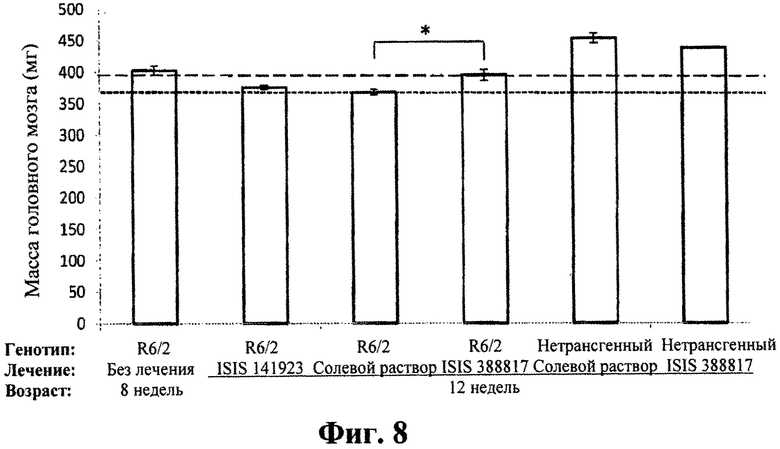
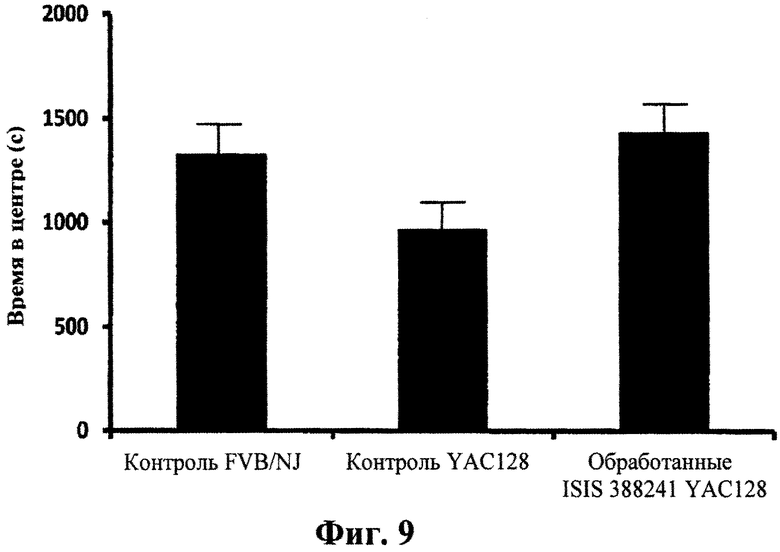
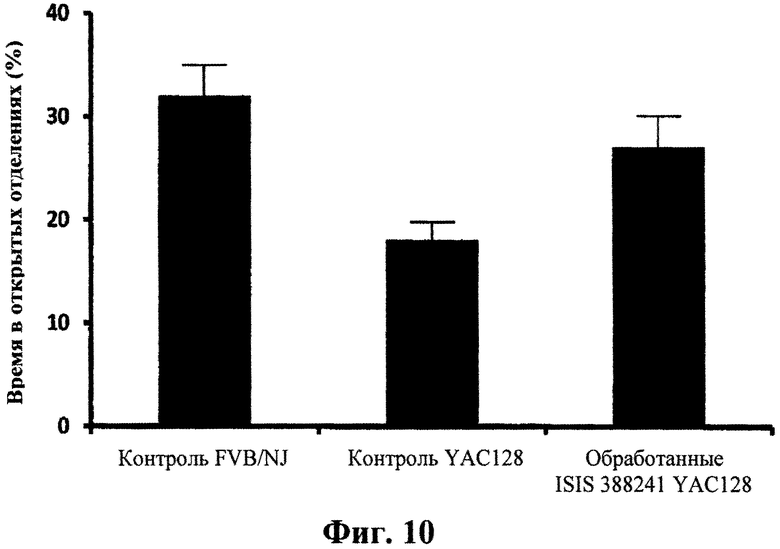
Изобретение относится к области биохимии, в частности к соединениям и композициям для ослабления экспрессии гентингтина. Заявлены варианты одноцепочечного модифицированного олигонуклеотида, ингибирующего экспрессию гентингтина. Олигонуклеотид содержит гэп-сегмент из десяти дезоксинуклеозидов, 5′-фланкирующий сегмент из пяти нуклеозидов и 3′-фланкирующий сегмент из пяти нуклеозидов. Гэп-сегмент расположен между 5′- и 3′-фланкирующими сегментами, где все нуклеозиды фланкирующих сегментов содержат 2′-O-метоксиэтил-модифицированный сахар. Межнуклеозидные связи в гэп-сегменте, связи, соединяющие гэп-сегмент с 5′- или 3′-фланкирующим сегментом, и связи для самого крайнего с 5′-конца и самого крайнего с 3′-конца нуклеозидов каждого из фланкирующих сегментов являются фосфоротиоатными связями; межнуклеозидные связи, соединяющие остальные нуклеозиды обоих фланкирующих сегментов, являются фосфодиэфирными связями. Все цитозины являются 5-метилцитозинами. Также заявлены композиция и способы для лечения, профилактики, замедления или облегчения болезни Гентингтона или ее симптомов. Изобретение позволяет повысить ингибирующую активность в ингибировании экспрессии гентингтина. 10 ил., 95 табл., 21 пр.
1. Одноцепочечный модифицированный олигонуклеотид, нацеленный на нуклеиновую кислоту, кодирующую гентингтин, и способный ингибировать экспрессию гентингтина, содержащий:
гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов;
5′-фланкирующий сегмент, состоящий из пяти связанных нуклеозидов; и
3′-фланкирующий сегмент, состоящий из пяти связанных нуклеозидов;
где гэп-сегмент расположен между 5′-фланкирующим сегментом и 3′-фланкирующим сегментом,
где каждый нуклеозид каждого фланкирующего сегмента содержит 2′-O-метоксиэтил-модифицированный сахар,
где межнуклеозидные связи в гэп-сегменте, связи, соединяющие гэп-сегмент с 5′- или 3′-фланкирующим сегментом, и связи для самого крайнего с 5′-конца и самого крайнего с 3′-конца нуклеозидов каждого из фланкирующих сегментов являются фосфоротиоатными связями; межнуклеозидные связи, соединяющие остальные нуклеозиды обоих 5′- и 3′-фланкирующих сегментов, являются фосфодиэфирными связями;
где все цитозины являются 5-метилцитозинами, и
где последовательность нуклеотидных оснований олигонуклеотида состоит из последовательности, приведенной в SEQ ID NO: 22.
2. Одноцепочечный модифицированный олигонуклеотид, нацеленный на нуклеиновую кислоту, кодирующую гентингтин, и способный ингибировать экспрессию гентингтина, содержащий:
гэп-сегмент, состоящий из десяти связанных дезоксинуклеозидов;
5′-фланкирующий сегмент, состоящий из пяти связанных нуклеозидов; и
3′-фланкирующий сегмент, состоящий из пяти связанных нуклеозидов;
где гэп-сегмент расположен между 5′-фланкирующим сегментом и 3′-фланкирующим сегментом,
где каждый нуклеозид каждого фланкирующего сегмента содержит 2′-O-метоксиэтил-модифицированный сахар,
где межнуклеозидные связи в гэп-сегменте, связи, соединяющие гэп-сегмент с 5′- или 3′-фланкирующим сегментом, и связи для самого крайнего с 5′-конца и самого крайнего с 3′-конца нуклеозидов каждого из фланкирующих сегментов являются фосфоротиоатными связями; межнуклеозидные связи, соединяющие остальные нуклеозиды обоих 5′- и 3′-фланкирующих сегментов, являются фосфодиэфирными связями;
где все цитозины являются 5-метилцитозинами, и
где последовательность нуклеотидных оснований олигонуклеотида состоит из последовательности, приведенной в SEQ ID NO: 32.
3. Олигонуклеотид по п. 1 или 2, где олигонуклеотид является конъюгированным.
4. Композиция для лечения, профилактики или облегчения болезни Гентингтона, содержащая олигонуклеотид по любому из пп.1-3 или его соль и по меньшей мере один фармацевтически приемлемый носитель или разбавитель.
5. Способ лечения человека с болезнью Гентингтона, включающий введение человеку терапевтически эффективного количества олигонуклеотида по любому из пп.1-3 или композиции по п.4.
6. Способ профилактики, лечения, облегчения или снижения скорости развития болезни Гентингтона, включающий введение животному олигонуклеотида по любому из пп.1-3 или композиции по п.4.
7. Способ по п. 5 или 6, где лечение уменьшает по меньшей мере одно из: тревожности, отсутствия координации, непреднамеренного начала движений, непреднамеренных незавершенных движений, неустойчивой походки, хореи, оцепенелости, корченных движений, аномальной позы, неустойчивости, ненормальных выражений лица, затруднения жевания, затруднения глотания, затруднения речи, припадка, нарушений сна, ухудшенного планирования, ухудшенной гибкости, ухудшенного абстрактного мышления, ухудшенного усвоения правил, ухудшенного начала надлежащих действий, ухудшенного подавления ненадлежащих действий, ухудшенной кратковременной памяти, ухудшенной долговременной памяти, паранойи, дезориентации, спутанности сознания, галлюцинации, деменции, тревожности, депрессии, эмоциональной тупости, эгоцентризмов, агрессии, компульсивного поведения, раздражительности, суицидального настроения, сниженной массы головного мозга, мышечной атрофии, сердечной недостаточности, сниженной толерантности к глюкозе, потери массы, остеопороза и атрофии яичка у человека.
8. Способ по любому из пп.5-6, где введение происходит в ЦНС.
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| US 20080039418 A1, 14.02.2008 | |||
| US 20090092981 A1, 09.04.2009 | |||
| GRAY M | |||
| et al., Full-Length Human Mutant Huntingtin with a Stable Polyglutamine Repeat Can Elicit Progressive and Selective Neuropathogenesis in BACHD Mice, The Journal of Neuroscience, 11 June 2008, vol.28(24), pp | |||
| АНКЕРНЫЙ БОЛТ | 1927 |
|
SU6182A1 |
| Цепной ветряный двигатель | 1923 |
|
SU1625A1 |
| НОВОЕ ПРИМЕНЕНИЕ 2-[5-(4-ФТОРФЕНИЛ)-3-ПИРИДИЛМЕТИЛАМИНОМЕТИЛ]-ХРОМАНА И ЕГО ФИЗИОЛОГИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 2002 |
|
RU2297833C2 |
Авторы
Даты
2015-09-10—Публикация
2010-09-10—Подача