Изобретение относится к устройству и способу определения и мониторинга компонентов или свойств измеряемой среды, в частности, значений физиологических показателей крови, с признаками преамбулы независимых пунктов формулы изобретения. Мониторинг и измерение компонентов или свойств среды измерения в настоящее время осуществляется в многочисленных медицинских и немедицинских приложениях. К примеру, компоненты крови пациента (например, содержание сахара в крови или степень насыщения крови кислородом) или технологических сред (жидкостей или газов) в случае немедицинских приложений (например, мониторинг процесса) должны определяться в режиме онлайн и постоянно контролироваться.
К примеру, пульсоксиметрия представляет собой способ, который определяет частоту пульса (pulse rate (PR)) и процент насыщения крови кислородом (% SpO2) в артериальной крови. В наши дни данный способ представляет собой стандартный способ и используется во многих областях медицины, например, в интенсивной терапии, для мониторинга сна и во время операций.
В базовой технологии обычно с использованием оптического датчика регистрировать сигналы на двух длинах волн (как правило, 660 нм и 940 нм), которые генерируются с большой тактовой частотой посредством светоизлучающих диодов (light-emitting diode (LED)). Различная интенсивность сигналов в областях спектра, где измеряемый параметр варьирует или не меняется, соответственно, позволяет вычленить значения желаемых измеряемых величин. Вследствие прозрачности тканей в наблюдаемом спектральном диапазоне, в случае сильного и, особенно, изменяющегося внешнего света, могут быть получены дополнительные сигналы, обусловленные изменениями внешнего освещения. Как правило, они, соответственно, регистрируются в третьей точке измерения, которая не освещается светоизлучающим диодом.
Общая проблема заключается в том, что количество света, которое может быть проведено в ткань, в случае оптических способов измерений ограничено. В противном случае можно ожидать повреждения ткани в результате теплового воздействия. По этой причине в известных способах измерения или измерительных устройствах измерения занимают сравнительно долгое время. Это приводит к низкому отношению сигнал/шум. В то же время, при измерении содержания веществ, которые присутствуют в очень малых концентрациях (например, при измерении содержания сахара в крови, где концентрации измеряются в диапазоне ммоль/л) необходимо добиваться максимально высокого соотношения сигнал/шум.
В настоящее время желательно регистрировать, в дополнение к степени насыщения гемоглобина кислородом, также и другие значения крови в целях получения важных параметров во время мониторинга пациента.
Прежде всего, важно контролировать баланс газов в крови. В заявке WO 2008/132205 А1 описывается датчик, который может быть использован для определения парциального давления С02 в ткани в дополнение к пульсоксиметрии.
Другие важные значения показателей в рамках мониторинга представляют собой значения, обусловленные различными производными гемоглобина. К ним относятся определение общей концентрации гемоглобина (ctHb), определение концентрации карбокисленного гемоглобина (НbСО) или другие значения показателей крови. Однако данные дополнительные значения показателей крови не могут регистрироваться с помощью описанной выше технологии (двухволновой). Предпосылкой для их регистрации является очень точное определение спектральных свойств артериальной крови и тканей в большом спектральном диапазоне.
Другой подлежащий измерению показатель крови представляет собой содержание сахара в крови. Сахарный диабет (Diabetes mellitus) является одним из наиболее распространенных метаболических заболеваний во всем мире, и его распространенность значительно увеличивается в результате изменения пищевых привычек. Таким образом, если в 2010 году этим заболеванием страдают примерно 285 млн. человек (6,4% населения земного шара), то предполагается, что в 2030 году число больных будет уже составлять 439 млн. человек (7,7% населения). Распространенность данного заболевания является одной из причин, почему концентрация глюкозы в жидкостях организма является одним из наиболее часто определяемых параметров в клинической химии. При этом было бы идеально определять точное значение уровня сахара в крови с помощью неинвазивных способов.
Для мониторинга состояния пациента в WO 2006/094169 А1 предложена основанная на светоизлучающих диодах фотометрическая система для оценки дополнительных параметров крови, причем в данной системе имеется несколько светоизлучающих диодов (обычно 8), излучающих на различных длинах волн, что, следовательно, позволяет регистрировать сигналы в различных участках спектра. Тем не менее, данная технология обладает рядом недостатков. Светоизлучающие диоды включаются последовательно, и сигналы регистрируются широкодиапазонным датчиком по очереди, что часто приводит к наложению помех, обусловленных изменениями внешней освещенности и движениями. Поскольку в данной технологии измерения в различных участках спектра с помощью многочисленных светоизлучающих диодов должны производиться последовательно, и так как обработка регистрируемых сигналов должна осуществляться, преимущественно исходя из относительной интенсивности сигналов по отношению друг к другу, влияние помех особенно выражено. Кроме того, светоизлучающие диоды имеют зависимый от температуры спектр излучения, и излучение светоизлучающих диодов, как правило, характеризуется полушириной спектральной линии (шириной данной кривой при половине от максимальной интенсивности для данного светоизлучающего диода), составляющей от 20 нм до 30 нм, что не позволяет точно выделять узкие спектральные диапазоны, а, следовательно, не позволяет точно определять соответствующие химические компоненты. Кроме того, вследствие небольшого числа спектральных участков в сочетании с варьирующими от человека к человеку свойствами поверхности кожи и тканей, точное разделение и количественная обработка данных показателей компонентов крови возможны только в ограниченной степени. На основе измерения можно определить отношения измеряемых величин только для нескольких спектральных участков с тем, чтобы использовать указанные отношения для анализа химических компонентов. Однако, поскольку спектральные особенности крови и, особенно, свойства тканей, через которые должен проходить свет (различающиеся от человека к человеку, а также зависимые от длины волны способности к светорассеянию) оказывают большое влияние на результаты измерений, измерение с помощью данного способа подвержено ошибкам.
В настоящее время различные разработки делают возможным надежное определение концентрации глюкозы в крови и в полученных из нее жидкостях, таких как плазма крови и сыворотка, а также и в других жидкостях организма, таких как, например, моча. В последние годы особенно смогли этаблироваться различные способы, основанные на использовании ферментов. Однако, в данном случае, в большинстве таких способов требуется забор небольшого количества крови, и, следовательно, они относятся к инвазивным способам.
Современная практика измерений содержания глюкозы варьирует от практики редкого измерения значений - при обращении к врачу - до практики измерения значений несколько раз в час в случае пациентов, находящихся в отделениях интенсивной терапии. Больные инсулинозависимым сахарным диабетом осуществляют самоконтроль, производящийся до шести раз в день с помощью приборов, работающих с тест-полосками, что является обычным для получения улучшенного, но не идеального регулирования концентрации глюкозы в крови. Такие измерения требуют забора крови, который представляет собой неудобство для пациента. Кроме того, в результате выжимания кровь не всегда находится в равновесии с тканевой жидкостью. Это приводит к неточностям.
Таким образом, развитие неинвазивного способа и связанного с ним устройства было бы очень желательно для медицинской техники.
Для того чтобы определить уровень сахара в крови, необходимо количественно определить концентрацию глюкозы в крови.
Были уже разработаны спектроскопические способы, которые позволяют безреагентное определение концентрации глюкозы в сложных жидкостях организма. К примеру, известны спектроскопические измерения в ближней инфракрасной области (NIR(near-infrared range)-спектроскопия). При этом должны быть обнаружены низкие концентрации глюкозы (составляющие от приблизительно 2 ммоль/л до приблизительно 30 ммоль/л; целевой диапазон от 5,0 до 7,0 ммоль/л). Кроме того, кровь характеризуется очень высоким содержанием воды (обычно составляющим более 80%), что, следовательно, вызывает значительно более сильные поглощения в NIR-спектроскопии. Кроме того, в крови содержатся и другие вещества в различных и неизвестных концентрациях и должна быть исключена перекрестная чувствительность. Когда нужно измерять неинвазивно, необходимо выполнять измерения в организме внутри окружающих тканей, и должны быть приняты во внимание или отделены воздействия различных сред.
Кроме того, при неинвазивном способе измерения необходимо выбрать точку измерения на теле. Предпочтительные точки измерения не всегда представляют собой кровь отдельно, а представляют собой кровь, наполняющую ткань. Кроме того, ткань покрыта слоем кожи, который обладает свойствами, различающимися от человека к человеку, которые также могут сильно меняться с течением времени. Так, например, содержание воды в коже сильно колеблется и зависит, в частности, от деятельности потовых желез. Кроме того, в состав кожи входят разные структурные элементы, и во многих местах может находиться подкожный жировой слой, который характеризуется, во-первых, значительно более низким содержанием воды и, во-вторых, заметно более низким уровнем кровообращения, и в котором, соответственно, содержание сахара может отличаться от содержания сахара в крови. Кроме того, часто необходимо принимать во внимание, что спектральные характеристики костной ткани также находятся в оптическом диапазоне измерений. При этом не очевидно, что костная ткань находится в равновесии с наполняющими ее компонентами.
Зависимое от длины волны изучение химических компонентов может происходить по-разному. Можно проводить измерение в дискретных реперных точках. В целом, такой способ проведения измерений называется фотометрическим способом измерения или мультиспектральной фотометрией и осуществляется с использованием либо нескольких источников света с различными длинами волн, либо характеризующегося широким диапазоном излучения источника «белого света» в сочетании с несколькими приемниками с ограниченной областью спектральной чувствительности (технология фильтров). Подобные источники света, излучающие на различных длинах волн, могут быть реализованы с помощью светоизлучающих диодов или лазеров, а также посредством широкодиапазонного освещения в сочетании с узкополосными фильтрами перед фотоприемниками. При использовании светоизлучающих диодов появляются дополнительные технические трудности, заключающиеся в том, что, во-первых, светоизлучающие диоды характеризуются относительно большими распределениями излучения и, во-вторых, распределение излучения изменяется при нагревании излучателя. К примеру, один пример данной технологии был описан в патенте США 5086229.
В данных способах измерений обычно используются от трех до приблизительно десяти длин волн или диапазонов длин волн, в которых производится регистрация и обработка данных.
Также данный способ измерения не целесообразен для применения при определении уровня сахара в крови. Во-первых, при использовании данной методики измерения должны осуществляться в нескольких спектральных реперных точках в эффективном диапазоне длин волн от 800 нм до 1200 нм. При этом данные спектральные реперные точки должны удовлетворять трем требованиям:
1. Они должны лежать как в областях оптического поглощения глюкозы и воды, так и за пределами этих областей.
2. Они должны быть независимы от перекрестной чувствительности, обусловленной другими веществами, которые могут встречаться в крови или ткани.
3. Они должны быть подобраны таким образом, чтобы было возможно вычленять вклады, обусловленные светорассеянием и различием световых путей, и, соответственно, базовые сигналы.
Таким образом, в заключение, для неинвазивного измерения содержания сахара в крови должны быть выполнены следующие условия: должно быть возможно определение спектроскопическим путем концентраций глюкозы, малых по сравнению с концентрацией воды. Необходимым условием является глубокое проникновение света в ткань (как правило, на глубину, составляющую более 3 мм). Должно быть возможно исключить перекрестную чувствительность, обусловленную другими веществами. Должно быть возможно различать значения показателей, обусловленных кровью и тканями (чувствительный к пульсу контроль). Приборы должны быть экономически эффективными и небольшими и, следовательно, портативными. Источник света не должен быть слишком сильным, чтобы не появилось никаких ожогов на пальце, источник света должен быть предпочтительно на основе светоизлучающих диодов.
До сегодняшнего дня не было возможности разработать серийный прибор, который позволял бы производить неинвазивное, регулярное, безопасное и надежное определение уровня сахара в крови у больных диабетом. Многие из ранее предложенных способов и устройств не годятся для решения данной проблемы или не удовлетворяют вышеперечисленным требованиям.
Неинвазивный датчик для измерения сахара в крови известен, например, из патентов США 5070874 и США 5360004.
Кроме того, хорошо известны способы измерения отражающих свойств объектов. Степень их применимости для измерения уровня сахара в крови варьирует от ограниченной до никакой. Во-первых, преобладающая часть излучения исходит непосредственно от поверхности, во-вторых, кожа имеет структуру, которая отличается у разных людей, а также в разных местах на теле. Кроме того, невозможно надежно определить рассеивающие свойства. Поэтому стабильное количественное измерение требуемых низких значений концентраций веществ в рамках поставленной задачи с помощью спектроскопических способов, основанных на измерении отражения, не достижимо.
Спектроскопия используется для определения концентрации органических веществ и в качестве базовой технологии часто употребляется в медицинских исследованиях. При этом является обычным забор небольшого количества крови и исследование последней in vitro с помощью фотометрических или спектроскопических способов. Временные и приборные затраты при осуществлении подобной инвазивной технологии весьма велики. Кроме того, получение результатов при использовании данной технологии возможно только с временной задержкой. Способы анализа, основанные на определении in vitro, имеют для мониторинга состояния пациента только очень ограниченное применение.
При спектроскопическом способе измерений происходит расщепление света на спектр широкого диапазона с помощью спектрометра, причем в настоящее время для спектрального разложения используется, в основном, дифракционная решетка, и спектр светового сигнала регистрируется и анализируется датчиком со многими линейно расположенными фотоприемниками (пикселями). Еще одна возможность представляет собой способ преобразования Фурье (ИК-спектроскопия с преобразованием Фурье (FTIR-Spektroskopie)), который предпочтительно используется в ближней инфракрасной области.
Данный способ также не является идеальным для определения уровня сахара крови. Во-первых, данный способ больше подходит для измерения излучения в более длинноволновом диапазоне. Во-вторых, даже если он хорошо подходит для узких пиков благодаря применению преобразования Фурье, данный способ измерений является относительно неточным и подверженным ошибкам в случае широких полос поглощения, которые характерны для воды и глюкозы в крови при их определении в диапазоне длин волн от 800 нм до 1200 нм.
Авторы признали, что для измерений содержания сахара в крови должны применяться только способы, использующие спектральный диапазон длин волн от 650 нм до приблизительно 1200 нм, поскольку иначе световой путь внутри ткани слишком короток, и помехи, обусловленные кожей и внешними покровами, слишком велики. Данный спектральный диапазон известен в медицинской технике как диагностическое окно. В данном диапазоне возможно проводить анализ веществ, даже если они находятся под поверхностью кожи. Кроме того, известно, что эффективная длина светового пути сильно превышает длину прямого пути из-за сильных рассеивающих свойств ткани. Согласно оценке, типичное превышение эффективной длины пути по отношению к длине прямого пути составляет от 4 до 8 раз.
Поскольку в большинстве известных способов измерения содержания сахара в крови измерения проводятся на длинах волн выше 1300 нм из-за появляющихся там более сильных сигналов полос поглощения, остаются лишь немногие из известных способов определения содержания сахара в крови.
Дальнейшие подходы для определения содержания сахара в крови были предложены Fischbacher et al. (Ch. Fischbacher, K.-U. Jagemann, K. Danzer, U.A. Muller, L. Papenkordt, J. Schuler; Enhancing calibration models for non-invasive near-infrared spectroscopical blood glucose determination; Fresenius J Anal Chem (1997) 359: 78-82 Springer-Verlag 1997) и Meuer et al. (Non-invasive glucose determination in the human eye; Wolfgang Schrader, Petra Meuer, Jurgen Popp, Wolfgang Kiefer, Johannes-Ulrich Menzebach and Bernhard Schrader; Journal of Molecular Structure, Volumes 735-736, 14 February 2005, pages 299-306 and Dissertation Petra Meuer, University of Wurzburg 2002).
Fischbacher et al. показывают наличие хорошей корреляции. В то же время отношение сигнал/шум у традиционных спектроскопических приборов оказалось недостаточным. Кроме того, измерения проводились в режиме отражения, который не позволяет достичь цели в случае тканевых образцов, как описано выше.
Meuer et al. также показывают хорошие результаты в измерениях на глазном яблоке. Благодаря ясной, нерассеивающей среде, предложенный способ также может быть использован в режиме отражения. Тем не менее, было также ясно показано, что в данном случае коммерчески доступные спектроскопические методики не обеспечивают необходимое отношение сигнал/шум для надежного определения низких концентраций.
Дальнейшие области применения, в которых компоненты, содержащиеся в среде измерения, должны определяться с временным разрешением, связаны с измерением содержания лактата в крови, диализом или контролем за кровью в аппарате искусственного кровообращения сердце-легкие, где также должны определяться значения показателей крови (но необязательно in vitro), либо связаны с немедицинскими применениями, где, например, должны контролироваться технологические жидкости. К примеру, к типичным немедицинским применениям относятся измерения цвета жидкостей в производственных процессах. Также возможно таким образом измерять содержание газов в процессах горения. К примеру, дополнительные возможности применений появляются в пищевой технологии при добавлении ингредиентов, которые добавляются непрерывно.
Уже известно использование лабораторных спектрометров для изучения компонентов крови и тканей in vivo. В соответствии с известным уровнем техники, современные лабораторные спектрометры работают в настоящее время с использованием линейных датчиков. Лабораторные спектрометры обычно работают со стекловолоконными разъемами, и поэтому сложная система световодов необходима для освещения, регистрации света и его доставки от точки измерения (датчик на ткани) до блока оборудования со спектрометром. Поскольку оно сопровождается значительной светопотерей (особенно в местах соединения световодов), измерение с временным разрешением может быть осуществлено только с низким отношением сигнал/шум.
Поэтому применение таких лабораторных спектрометров для мониторинга или измерения значений показателей крови, таких как, например, степень насыщения кислородом или определение содержания сахара в крови, не позволяет достичь поставленных целей.
Монохроматорные системы и ИК-спектрометры не удовлетворяют, в силу недостаточного временного разрешения, требованиям комбинированного спектрального анализа и мониторинга пульса.
Световод из стекловолокна можно захватывать только небольшую часть эффективного света. Поэтому измерительные системы обычно требуют длительных времен интеграции в процессе измерения. В патенте ЕР 522674 А2 раскрыт пульсоксиметр для определения степени насыщенности крови кислородом у плода. С этой целью применяют спектрометр, в котором измеряемый свет передается от точки - измерения к спектрометру при помощи стекловолоконного световода.
В патенте США 2006/0167348 раскрыта практика получения инфракрасных спектров in vivo с помощью обычного спектрометра FTIR. Для этого также предложено передавать измеряемый свет с помощью стекловолоконного световода.
В заявке WO 2009/043554 раскрыт способ и измерительная аппаратура для снятия сигналов спектрометрических измерений с живой ткани. Однако в данном документе не показано, каким образом измеряемый свет передается в сенсорное устройство.
Из-за необходимого расщепления света в спектрометрах и ограниченной интенсивности света, которая может воздействовать на поверхность кожи тела, данные измерения до настоящего времени не могли проводиться с временным разрешением, то есть с разрешением, позволяющим отслеживать связанные с пульсом изменения. Однако, подобное разрешение необходимо, чтобы проводить различие между обусловленной пульсом компонентой и тканевой компонентой измеренных значений.
Кроме того, датчики, или по крайней мере их части, которые крепятся к телу, не должны превышать определенных размеров, так чтобы на практике они не доставляли неудобств пациентам в случае долгосрочного мониторинга.
Система для спектральных фотометрических измерений, в которой значения измерений записываются с временным разрешением, предложена в заявке WO 03/071939 А1. Здесь сигнал от широко диапазонного источника света измеряется последовательно с помощью различных спектральных фильтров. Данная система является очень большой и сложной. Кроме того, запись данных с временным разрешением всегда идет только на одной длине волны и длины волн регистрируются по очереди. Следовательно, данная система, которая также должна быть использована в другом спектральном диапазоне и для контроля содержания сахара в крови, не подходит для долгосрочного мониторинга параметров пульса и крови.
В патенте США 5879294 предлагается система, в которой осуществляются спектроскопические измерения хромофоров в ткани. Здесь для оценки используется вторая производная спектра, и обработка данных проводится в спектральных реперных точках (как правило, две на вещество). Таким образом, например, можно определить степень насыщения крови кислородом в ткани. С помощью данного способа можно проводить статическое, то есть не разрешающее временные или связанные с пульсом изменения, количественное определение хромофоров. Производный от вышеописанного способ контроля за концентрацией кислорода в ткани (8Ю2-концентрация) представлен в заявке WO 2007/048989 A1.
Кроме того, в рамках мониторинга состояния пациента (например, для определения степени насыщения кислородом) необходимо делать различие между компонентами в крови (гемоглобин) и компонентами в ткани (миоглобин). Спектральные свойства модификаций гемоглобина и миоглобина очень похожи, но различны в случае исследования с большим спектральным разрешением. Способ, который позволяет выявить такое различие, описан в патенте США 5931779.
С другой стороны, различение тканей и крови не обязательно требуется при измерении содержания сахара в крови. Таким образом, учет обусловленных пульсом изменений не является обязательным при измерении содержания сахара в крови. Точные значения удается получить (при наличии ткани с хорошим кровообращением без, например, подкожного жира и костей), если существует равновесие между содержанием сахара в крови и в ткани. Однако, отслеживая обусловленные пульсом изменения, можно проверить, присутствует ли такое равновесие.
Еще одна ограничивающая трудность, связанная с анализом крови in vivo, заключается в сильном уменьшении поглощения или молярной экстинкции соответствующих компонентов крови, тканей и кожи в спектральном диапазоне длин волн от 500 нм до 850 нм, который имеет важное медицинское значение для мониторинга пациентов. Так, гемоглобин и содержащийся в коже меланин имеют очень большие значения коэффициентов поглощения в видимой области спектра, в то время как в самом ближнем инфракрасном диапазоне (very near infrared range (VNIR)) их коэффициенты поглощения имеют значительно меньшие значения.
При измерении содержания сахара в крови, которое, предпочтительно, как правило, определяется в диапазоне длин волн от 800 нм до 1200 нм, величина поглощения в ткани меньше, и поэтому при измерении содержания сахара в крови данная проблема не так важна.
Тем не менее, сопоставимые проблемы могут возникать в случае измерения значений показателей крови in vitro, например, в случае диализных больных, или в случае немедицинского измерения и мониторинга технологических параметров на труднодоступных частях приборов, например, в трубах. В случае таких применений также требуется измерение с временным разрешением, и лабораторные спектрометры больших размеров не могут быть легко доставлены к месту измерения.
Все известные решения, следовательно, страдают от недостатков. В частности, отсутствует спектроскопическая система, которая в совокупности удовлетворяет всем требованиям, касающимся измерения пульса, анализа крови in vivo с различением обусловленной пульсом компоненты (артериальная кровь) и статической компоненты (венозная кровь и ткани, миоглобин), миниатюризации блока датчиков для непрерывного использования на пациенте, неинвазивного измерения содержания сахара в крови или измерения содержания компонентов среды измерения в труднодоступных точках измерения.
До настоящего время казалось, что ограничения, изложенные выше, делают невозможным проведение исследований in vivo и с временным разрешением и/или с использованием устройства, которое требует немного места и является надежным.
Поэтому задачей настоящего изобретения является избежание известных недостатков и, в частности, разработка устройства и способа, которые не имеют перечисленных выше недостатков, и которые, в частности, позволяют проводить желаемые анализы in vivo и с временным разрешением, то есть с физиологическим распознаванием параметров, связанных с артериальной кровью, и зависимых от тканей параметров. Кроме того, следует сделать возможным проводить с временным разрешением измерения уровня сахара в крови in vivo и значений показателей крови in vitro, либо также измерения с временным разрешением, надежно и также в труднодоступных точках измерения в немедицинских областях применения.
В соответствии с изобретением данная задача и дальнейшие задачи изобретения решаются с помощью устройства и способа с признаками отличительной части независимых пунктов формулы изобретения.
Теоретической основой для спектроскопических или фотометрических исследований является закон Ламберта-Бера (Beer-Lambert). Данный закон может быть использован для определения концентрации ci светопоглощающих молекул в растворах при прохождении через них света.

где Iλ представляет собой интенсивность света после прохождения через изучаемое вещество, I0,λ представляет собой излучаемую интенсивность света, µα,λ представляет собой зависимый от длины волны (λ) общий коэффициент поглощения и 1 представляет собой длину светового пути через вещество. В связи с рассеивающими свойствами ткани здесь надо учитывать эффективную длину светового пути, которая, в общем случае, также зависит от длины волны, хотя в данном случае и для рассматриваемого спектрального диапазона этим можно пренебречь. В результате алгебраического преобразования получается:
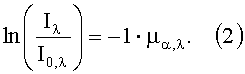
Данный общий закон теперь должен быть дополнительно диверсифицирован, поскольку вещество, такое как, например, кровь человека, состоит из многих химических компонентов (молекулярных соединений), и коэффициенты поглощения данных веществ отличаются в зависимости от длины волны. В случае п веществ получается следующее:
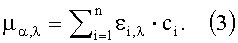
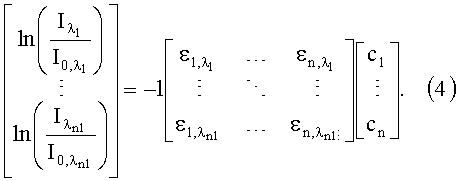
В предположении, что длины светового пути остаются одинаковыми для всех длин волн, данное соотношение может теперь быть записано следующим образом для m длин волн:
Данное соотношение может теперь снова быть записано в следующем виде:
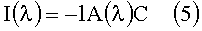
или
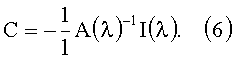
Исходя из данного соотношения, можно непосредственно определить концентрацию веществ.
Дополнительной теоретической основой служат представления о квантово-химических взаимодействиях между светом и молекулами. Так, в результате зависимого от длины волны поглощения квантов света происходит переход возбуждения между дискретными колебательно-вращательными или электронными уровнями, специфичными для каждой молекулы. При этом в представляющей интерес области спектра энергия возбуждения соответствует энергиям переходов между колебательно-вращательными уровнями, обусловленными высшими гармониками и комбинированными колебаниями молекул, или энергиям сложных электронных переходов в хромофорах. Данные переходы специфичны для определенной длины волны и специфичны для определенного вещества. Таким образом, на разных длинах волн можно анализировать различные вещества. Однако, поскольку человеческое тело, например, содержит очень много различных веществ, что приводит к наложению информационных сигналов, для того, чтобы учесть квантово-механическое взаимодействие, необходимо использовать спектроскопический способ, а не мультиспектральную фотометрию или фотометрический анализ, основанные на измерениях в спектральных реперных точках.
При очень подробном рассмотрении спектроскопии высших гармоник двух веществ, воды и глюкозы, в спектральном диапазоне длин волн от 800 нм до 1200 нм необходимо, например, учитывать дальнейшие детали. В данном случае вода представляет собой очень необычную молекулу. Во-первых, это обусловлено сильной полярностью воды, а также угловым расположением ее атомов. Кроме того, в жидкой воде водородные связи оказывают влияние на спектры. Поэтому, с одной стороны, спектроскопия жидкой воды очень сильно зависит от температуры. Однако, в данном случае этим можно пренебречь, поскольку температурные значения в точке измерения на теле ограничены узким температурным диапазоном от 35°С до 40°С. Кроме того, оказывают влияние растворенные в воде молекулы. Таким образом, при изменении концентрации изменяются также силы, действующие между молекулами, а также получаемые спектры. Хотя данные изменения являются относительно небольшими, они значимы и должны приниматься во внимание при обработке хемометрических данных.
Устройство согласно изобретению служит для определения и мониторинга компонентов среды измерения, в частности, для определения и мониторинга значений физиологических показателей крови. Устройство имеет по меньшей мере один источник света для генерации широкодиапазонного светового излучения. В данной связи, «широкодиапазонный» означает, что спектральный диапазон излучаемого света является в любом случае подходящим для анализа соответствующих компонентов в крови или ткани или в другой среде измерения. Как правило, используется источник света, который излучает, по меньшей мере, свет в диапазоне длин волн от 500 нм до 850 нм при мониторинге пациентов (например, измерение степени насыщения кислородом) и излучает, по меньшей мере, свет в диапазоне длин волн от 800 нм до 1200 нм при определении содержания уровня сахара в крови. В частности, источник света представляет собой белый светоизлучающий диод, который и в диапазоне NIR (near infrared, ближний инфракрасный) излучает количество света, достаточное для измерения содержания сахара в крови. Источник света служит для излучения широкодиапазонного света по меньшей мере в одной области измерения. Область измерения представляет собой, как правило, точку на поверхности живого существа, более конкретно, человека, например, на кончике пальца или на мочке уха. Однако, область измерения также может представлять собой трубопровод, через который протекает измеряемая среда, например, отвод для транспорта крови во время диализа или трубопровод, в который во время определенного процесса вводятся или из которого отводятся жидкости.
Кроме того, в данном устройстве имеются средства для разложения в спектр или диспергирования анализируемого света, отражаемого от точки измерения. Анализируемый свет может представлять собой, с одной стороны, свет, отраженный непосредственно от области измерения, или, с другой стороны, свет, выходящий из другого места после прохождения через ткани. Кроме того, в данном устройстве имеется матрица-датчик для регистрации разложенного в спектр света. Матрица-датчик представляет собой, как правило, двумерное КМОП-устройство. В зависимости от применения и подходящих диапазонов частот, также могут быть использованы другие двумерные матрицы-датчики, например, InGaAs-датчики (арсенид индия-галлия). КМОП-датчики изображения обладают высоким разрешением и обычно содержат один миллион или более пикселей (датчик, применяемый здесь, имеет 1,6 Мп (мегапикселей) или также 5 Мп).
Первое преимущество при использовании матриц-датчиков и, как правило, матриц КМОП-датчиков, заключается в их легкой доступности. Двумерные матрицы-датчики позволяют также, в частности, проводить измерения с более высокой скоростью и с более высоким отношением сигнал/шум. В результате спектрального разложения измеряемого света, измеряемый свет отображается на одной строке датчика. Однако пучок измеряемого света имеет определенную ширину, поэтому спектрально разложенный измеряемый свет (то есть спектр) может быть одновременно зарегистрирован многими строками матрицы-датчики, которые расположены параллельно рядом друг с другом. Вследствие того, что множество строк матрицы-датчики считываются параллельно, результаты считывания отдельных строк могут быть суммированы, т.е. отдельные спектры могут быть сложены вместе. Как правило, можно получать спектр путем интегрирования сигналов от до 1000 соседних строк матриц. В настоящем устройстве для данной цели имеются средства для одновременного регистрации сигналов от множества соседних строк двумерной матрицы. Кроме того, данное устройство разработано таким образом, что спектры данных соседних строк суммируются.
Таким образом, в соответствии с изобретением двумерные датчики не используются для проведения измерений с пространственным разрешением. Скорее, соседние строки используются для создания в течение короткого периода времени большего количества спектров и, следовательно, получения сигналов лучшего качества. Здесь под параллельным измерением понимается практически одновременное измерение. Естественно, ясно, что отдельные пиксели и строки датчиков считываются последовательно. Тем не менее, частота сканирования является настолько высокой, что можно говорить практически об одновременном измерении на параллельных строках.
Таким образом, достигается считывание частичных изображений и, следовательно, более высокие скорости. Таким образом, достигается более высокое отношение сигнал/шум в спектре.
В зависимости от типа применения существуют различные требования к отношениям сигнал/шум. При применениях в рамках мониторинга (таких как, например, измерение степени насыщения крови), во многих случаях представляет интерес только артериальная кровь. Тканевая компонента не представляет никакого интереса. Именно по этой причине, при таких применениях в рамках мониторинга необходимо проводить измерения в режиме разрешения компоненты сигнала, связанной с пульсом. Кроме того, для измерений в режиме разрешения компоненты сигнала, связанной с пульсом, отношение сигнал/шум должно, по возможности, быть таким, чтобы из разницы между сигналом, измеренным в период систолы, и сигналом, измеренным в период диастолы, был получен достаточно четкий сигнал. Измерение в режиме разрешения компоненты сигнала, связанной с пульсом, является менее важным при измерении содержания компонентов крови, таких как, например, сахара в крови, жира или алкоголя. Так, например, в случае сахара в крови, через относительно короткое время достигается равновесие между компонентой в артериальной крови и компонентой в ткани. В связи с этим, измерение в режиме разрешения компоненты сигнала, связанной с пульсом, не является обязательным, но может вполне давать преимущества при перепроверке результатов измерений.
В настоящее время КМОП-датчики изображения используются преимущественно в сотовых телефонах, камерах видеонаблюдения и цифровых камерах. Высококачественные миниатюрные мегапиксельные объективы доступны особенно из первых двух упомянутых областей применения.
Такие датчики очень малы и имеют типичные размеры сторон краев изображения, равные 3 мм. Кроме того, они являются параметризируемыми для области считывания. Поэтому в случае уменьшенной площади изображения возможна очень высокая частота кадров, составляющая, например, более 100 Гц, которая как раз позволяет измерять с разрешением по времени компоненту сигнала, связанную с пульсом.
В случае КМОП-датчиков электронная схема интегрирована непосредственно в датчик. В оптических матрицах имеются схемы, такие как, например, схемы считывания, регулируемые усилители и аналого-цифровые преобразователи. Это позволяет передавать данные быстро и с помощью тонких кабелей. Все устройство, содержащее спектрометр, источник освещения, электронную схему и систему регистрации изображения, таким образом, может иметь очень небольшие габариты (предпочтительно менее 20 мм × 30 мм × 100 мм, как правило, около 10 мм × 15 мм × 50 мм). Поэтому такое устройство может быть оснащено только одним тонким электрическим кабелем и непосредственно прикреплено к пациенту. Можно обойтись без стекловолоконного световода и т.д. Благодаря размерам КМОП-устройств в несколько миллиметров, для данных устройств хватает места в миниатюрной системе, например, на пальце или на мочке уха или в точках с ограниченным доступом.
Благодаря достигнутому в настоящее время очень хорошему качеству изображения и низким требованиям к свету, можно также использовать небольшие, миниатюрные осветительные блоки.
Поскольку в CCD-матрицах (Charge Coupled Device), до сих пор частично используемых на современном уровне техники, всегда требуется считывание всего детектора, то оказывается невозможным достижение считывания с достаточно высокой частотой, поскольку CCD-матрицы считывают с частотой, составляющей несколько Гц. В КМОП-датчиках можно ограничиться оконным просмотром "области интереса" (Region-Of-Interest (ROI)) и тем самым сделать их быстрее, поскольку необходимо считывать только те данные, которые используются. В КМОП-датчиках можно ограничиться оконным просмотром "области интереса" (Region-Of-Interest (ROI)) и тем самым сделать их быстрее, поскольку необходимо считывать только те данные, которые используются. Хотя КМОП-датчики также считывают с относительно низкой частотой в случае полного изображения, в случае ограничения "областью интереса" ROI может быть достигнута частота считывания до обычно 200 Гц.
Это также дает возможность регистрировать спектры со скоростью, позволяющей работать в режиме разрешения компоненты сигнала, связанной с пульсом. Максимальная частота пульса составляет, как правило, 3 Гц. В случае четырехкратного сканирования, таким образом, необходимо иметь частоту, составляющую приблизительно 12 Гц.
Измерение параметров крови in vivo может быть осуществлено на основе компоненты сигнала, связанной с пульсом. Благодаря различию между связанной с пульсом компонентой и статической компонентой можно отделить эффекты, обусловленные кровью, от эффектов, обусловленных тканью. Данный эффект и возможность его измерения также описаны в патенте DE 195 18511.
Из-за дикротической выемки происходит удвоение основной частоты. Поскольку Фурье-анализ частотного состава кривой артериального давления может содержать компоненты до восьмой гармоники, с технической точки зрения целесообразно сканирование на частоте 50 Гц.
Кроме того, быстрое сканирование уменьшает артефакты, связанные с подвижностью, которая приводит к появлению высокочастотных компонентов сигнала. Нарушая условия теоремы отсчетов, такие помехи отражаются непосредственно в диапазоне применения сигнала.
Если на частоте 50 Гц при каждой регистрации изображения на соседних строках датчика регистрируется приблизительно 1000 спектров, которые после суммирования или интегрирования обеспечивают достаточные глубину данных и отношение сигнал/шум, то можно провести спектральную оценку компонентов крови не только для тканевой компоненты, но и по для компоненты сигнала, связанной с пульсом (спектральный сигнал артериальной крови, составляет приблизительно 1% от величины всего спектрального сигнала).
Матрица-датчик расположена так, что свет разных длин волн попадает на различные точки на матрице. Кроме того, разложенный в спектр свет направляется предпочтительно параллельно на множество соседних строк датчика.
Основной принцип устройства в соответствии с изобретением и преимущества данного устройства являются одинаковыми для различных применений. В зависимости от веществ, содержания которых нужно измерить, необходимо подбирать диапазон частот. Соответственно измерительной ситуации должны быть подобраны источники света, датчики, дифракционные решетки и используемые оптические элементы. Изобретение будет подробно объяснено на примерах определения значения показателей крови во время мониторинга состояния пациента и измерения содержания сахара в крови.
Устройство предпочтительно имеет корпус и выполнено в виде компактного блока. Компактный блок содержит, по меньшей мере, источник света, средство для разложения в спектр анализируемого света и матрицу-датчик. Благодаря такой форме устройства осветительная и спектроскопическая системы могут быть интегрированы непосредственно в датчик в точке измерения. Источник света и миниатюрный спектрометр могут быть прикреплены непосредственно к области измерения. Благодаря этому можно отказаться от относительно жестких и больших оптических волокон. Это приводит к многократном выигрышу в интенсивности света.
Если свет передается в точку измерения через стекловолоконный световод, это само по себе приводит к потере его большей части. Если стекловолоконный световод направляет свет в ткань и вернувшийся свет собирается другим стекловолоконным световодом, это приводит к дальнейшей потере света. Более того, если свет перед разложением на спектр проходит через щель спектрометра, для измерения остается только небольшое количество света. Это приводит к тому, что в известных устройствах используются самые большие технически доступные лампы и, в то же время, измерения проводятся с длительными временами экспозиции.
В противоположность этому, заключенные в общем корпусе очень маленький источник света (например, светоизлучающий диод) и спектрометр предпочтительно доставляются непосредственно к ткани. Это увеличивает светоотдачу, так что времена экспозиции являются очень короткими.
Источник света, средство для разложения в спектр измеряемого света и матрица-датчик позволяют проведение спектроскопического анализа крови и тканей в области, соответствующей области измерений.
В спектроскопии существуют различные способы. Один новый способ представляет собой область, связанную с получением спектральных изображений (Spectral Imaging). При этом свет спектрально расщепляемый с помощью эффективных оптических устройств, имеющих дифракционную решетку, поступает на двумерные матрицы-датчики. Таким образом, на датчике получают в одном направлении пространственную информацию и в другом направлении спектральную информацию. При этом каждая отдельная точка изображения представляет собой пиксель, который содержит информацию об интенсивности, как правило, с глубиной данных 8, 12, 14 или 16 бит. В данной технологии наилучшими оказались КМОП-датчики изображения, которые обладают свойствами, предпочтительными особенно для описанного здесь изобретения. Для более длинноволнового спектрального диапазона при этом подходят InGaAs-датчики, но в них также имеются отдельные фотоэлементы, в которых необходимая схема интегрирована на КМОП-основе.
Согласно изобретению, такие дифракционные решетки предпочтительно используются в качестве средства для разложения в спектр измеряемого света и такие матрицы-датчики используются для регистрации разложенного света.
Спектральное дисперсионное устройство, таким образом, предпочтительно содержит дисперсионный оптический элемент, обычно оптическую решетку, в частности, голографическую решетку, который в предпочтительном варианте представляет собой решетку, нарезанную таким образом, чтобы обеспечить высокий выход светового излучения в порядке дифракции, соответствующем спектру, регистрируемому камерой или датчиком изображения, и в подходящем диапазоне длин волн, например, от 500 нм до 850 нм для измерения концентраций SpO2 или от 800 нм до 1200 нм для измерений содержания сахара в крови.
Для измерения содержания сахара в крови спектральный диапазон определяется как диапазон длин волн приблизительно от 800 нм до 1200 нм. В данном спектральном диапазоне самый сильные изменения сигнала были обнаружены в диапазоне 960 нм +/-50 нм и 1150 нм +/-50 нм. В спектрах наблюдается корреляция с изменяющимися сигналами воды. Технология InGaAs-датчиков позволяет проводить измерения одновременно в обоих диапазонах. Надо отметить, что в настоящее время коммерчески доступные датчики для данного спектрального диапазона значительно хуже КМОП-датчиков, которые, однако, реагируют только на свет с длиной волны менее 1100 нм. При этом, InGaAs-датчики имеют значительно меньшее количество пикселей (обычно от 100k пикселей до 1000k пикселей), и, следовательно, характеризуются меньшим отношением сигнал/шум.
Максимальная эффективность дифракции может быть выбрана так, что она попадает в диапазон длин волн, в котором используемый датчик имеет самую низкую чувствительность. К примеру, нарезная решетка может представлять собой пропускающую решетку с асимметричным пилообразным решеточным профилем, в которой пилообразные фланги разработаны, соответственно, в виде отдельных зеркал так, что они пропускают свет в направлении желаемого порядка дифракции. Кроме того, возможно также использование голографических решеток. Так, например, можно использовать объемные фазовые голографические решетки (VPH-решетки (volume phase holographic)) в качестве определенных нарезных или голографических решеток. Данные VPH-решетки представляют собой пропускающие решетки, представляющие собой заключенный между двумя стеклянными или пластиковыми панелями прозрачный светочувствительный материал, в котором была получена желаемая структура с изменяющимся показателем преломления, например, в результате топографического выжигания и, как следствие этого, изменения в структуре материала. Согласно изобретению при использовании нарезных решеток такого рода можно достичь высокой эффективности, составляющей более чем 80% интенсивности дифракции в узком заданном диапазоне длин волн.
Таким образом, может быть создана спектроскопическая система очень небольших размеров с дифракционной решеткой и входной щелью, которая, во-первых, охватывает весь спектральный диапазон и, во-вторых, обладает временным разрешением, имеющим важное значение для зависимой от пульса регистрации сигнала. Кроме того, с помощью двумерного изображения можно записать и оценить многие спектры одновременно, что приводит к значительному увеличению отношения сигнал/шум.
Данная комбинация технологий дает возможность для построения небольших, обладающих высоким разрешением и очень быстрых датчиков, которые могут быть прикреплены непосредственно к точкам на теле, обычно используемым для пульсоксиметрии.
Так, возможны датчики, которые могут быть присоединены к предпочтительным точкам измерения, таким как кончики пальцев, подушечки на ладонях рук или мочки ушей, или на поверхности кожи. Таким образом, особенно предпочтительно, чтобы можно было прикрепить корпус в точке на теле больного человека, в частности, на пальцах или мочках ушей.
Качество измерений в теле существенно зависит от выбранной точки измерения. В частности, при измерении содержания сахара в крови место, соответствующее точке измерения, должно хорошо снабжаться кровью, должно по возможности содержать мало жировой ткани и быть легко доступной для измерений. Поэтому для измерения содержания сахара в крови больше всего подходят следующие точки измерения в названной последовательности: пропускание света через палец, подушечки на ладонях рук или мочки ушей. В случае пальца необходимо учитывать, что измерение по возможности производится без участия костей или ногтей. Поэтому имеет смысл освещать палец сбоку и считывать сигнал с центральной линии на кончике пальца.
Предлагаемое сочетание технологий делает возможными следующие, очень важные свойства датчиков: датчики обладают пиксельным разрешением, которое позволяет регистрировать весь спектр со спектральным разрешением, составляющем менее приблизительно 5 нм.
Существует возможность считывать сигнал только с части датчика и, следовательно, осуществлять регистрацию с высокими частотами считывания (с частотой, как правило, более 100 Гц) и, таким образом, оценивать спектральные свойства ткани и крови в режиме разрешения компоненты, связанной с пульсом.
Особенно предпочтительным является наличие у устройства щелевой диафрагмы. Щелевая диафрагма расположена между входной областью анализируемого пучка света и средством для разложения в спектр анализируемого света. Щелевая диафрагма дает возможность точно определить спектральную область измерения. В частности, щелевая диафрагма расположена по отношению к средству разложения в спектр так, что удлиненное изображение при разложении спектра передается расширенным в другом направлении, предпочтительно перпендикулярно. Таким образом на двумерной матрице-датчике возможно получить для измеряемого участка в одном направлении изображение со спектральным разрешением и в другом направлении изображение с пространственным разрешением. Особенно предпочтительно непосредственное оснащение данное устройства аналого-цифровым преобразователем. Современные КМОП-датчики изображения обычно уже содержат такие аналого-цифровые преобразователи. Надо отметить, что в соответствии с изобретением пространственное разрешение изображения не используется для анализа с пространственным разрешением. Скорее, использование соседних строк для параллельного измерения многих спектров служит для улучшения сигнала.
В данном случае под диафрагмой понимаются все оптические средства, которые вырезают удлиненную в виде полосы область из отображенной через первый оптический блок обработки изображения (объектива) области. При этом, область в виде полосы не является обязательно сплошной, но также может, например, состоять из последовательности отдельных элементов изображения.
Кроме того, устройство предпочтительно имеет усилитель сигналов, параметры которого могут задаваться извне. В КМОП-датчиках изображения часто уже имеются такие интегральные усилители, параметры которых могут быть заданы извне.
Благодаря цифровому преобразованию сигналов в схеме, цифровые сигналы могут в виде электрических сигналов быть переданы легко, без потерь, на относительно большие расстояния к блоку для обработки сигналов.
В качестве источника света служит предпочтительно светоизлучающий диод. Светоизлучающие диоды представляют собой источники света, которые можно переключать очень быстро (как правило, за 10-1000 мкс). Они работают без проблем с перегревом при высоких мощностях, которые, однако, не являются критическими для ткани.
Для применения при мониторинге пациента (например, определении степени насыщения крови кислородом), используется предпочтительно свет в видимой (visible (VIS)) и ближней инфракрасной (near-infrared (NIR)) областях спектра, в частности, в ближайшей инфракрасной области, например, в области VNIR (very near infrared range) с длинами волн от 500 нм до 850 нм. Данный свет, предпочтительно, генерируется светоизлучающим диодом или комбинацией светоизлучающих диодов. К примеру, для этого подходят обычные белые светоизлучающие диоды, которые характеризуются излучением в широком диапазоне, при использовании в сочетании с дополнительным флуоресцентным красителем. В качестве красителей здесь могут быть использованы неорганические флуоресцентные красители, которые, например, содержат иттербий или другие редкоземельные элементы в YAG (иттрий-гадолиниевый гранат) или аналогичных кристаллических решетках.
С помощью сочетания различных красителей можно получать свет во всем, определяющемся потребностями спектральном диапазоне, например, в диапазоне длин волн от 800 нм до 1200 нм при измерении содержания сахара в крови. Также возможно сочетать свет различных светоизлучающих диодов. Следует отметить, однако, что излучатели должны быть стабилизированы по температуре, и излучение должно характеризоваться хорошей пространственной однородностью.
Кроме того, устройство имеет предпочтительно разъем для подключения электрического кабеля. Кроме того, в частности, устройство предпочтительно не имеет разъемов для подключения дополнительных оптических кабелей для подведения или отведения света. Наличие тонкого кабеля с несколькими электрическими проводами достаточно для работы устройства в соответствии с изобретением, в частности, поскольку для источника света в соответствии с изобретением и для датчиков в соответствии с изобретением не требуется большой силы тока и высокого напряжения, и, в частности, если кабель не должен быть экранирован для защиты аналоговых сигналов от помех.
Благодаря тому, что регистрируется весь спектр, можно определять и контролировать множество различных значений физиологических показателей крови. В частности, возможна обработка данных следующих параметров:
Частота пульса
Форма и структура пульса
Степень насыщения гемоглобина кислородом (SHbO2)
Общее содержание Hb (CTHB)
Концентрации НbСО
Концентрация MetHb
Концентрация восстановленного гемоглобина
Индекс перфузии PI (perfusion index)
Индекс изменчивости Pleth PVI (pleth variability index)
Степень насыщения тканей кислородом StO2
Концентрация сахара в крови
Содержание лактозы
В рамках настоящего описания значениями физиологических показателей крови являются все значения, которые определяются у пациента в диагностических целях или в рамках мониторинга, в частности, значения физиологических показателей крови, перечисленные выше.
Кроме того, также возможны различные применения в немедицинской области, такие, как мониторинг процессов горения (путем измерения содержания технологических газов) или в производстве, например, пищевых продуктов или фармацевтической продукции при добавлении компонентов.
Данное устройство особенно предпочтительно предназначено для применения в случае измерений сигнала в режимах пропускания и отражения. С помощью данного устройства, для того, чтобы компенсировать сильное поглощение в диапазоне длин волн от 500 нм до 850 нм, значения показателей компонентов крови могут быть измерены в видимой области спектра в режиме отражения сигнала и в области VNIR в режиме пропускания сигнала.
Если количество излученного света достаточно(либо также в зависимости от измеряемой длины волны), возможно также проведение измерений только в режиме пропускания сигнала. Особенно в случае измерений содержания глюкозы, проводимых в спектральной области выше 800 нм, проблема, обусловленная сильным поглощением в диапазоне длин волн от 500 нм до 850 нм не столь велика. Однако, при излучении достаточно большого количества света можно проводить измерения в режиме чистого пропускания сигнала также в ходе мониторинга, например, при измерении степени насыщения кислородом.
Для реализации комплексной регистрации сигнала в режимах отражения и пропускания существуют различные варианты.
В первом варианте осуществления для мониторинга пациентов проводят регистрацию сигналов в режимах отражения и пропускания последовательно во времени. При этом, поочередно освещаются два участка кожи. Сначала освещается участок регистрации, имеющий форму линии, и считывается отраженное изображение. На следующей стадии освещаются одна или более точка за пределами линии регистрации, и пропущенный свет регистрируется на линии и считывается. Оба набора данных сопрягаются друг с другом в блоке обработки сигналов. В частности, данное устройство оснащено с этой целью компьютерным блоком, который разработан таким образом, что можно попеременно проводить измерение сигнала в режимах отражения и пропускания. Кроме того, для этой цели в данном устройстве имеется источник света, который позволяет освещать две различные точки измерения. Это может быть достигнуто за счет использования нескольких источников света или с помощью подходящих средств отклонения света.
Во втором варианте осуществления для мониторинга пациентов осуществляется пространственное разделение областей отражения и пропускания сигнала. Для этого в устройстве и, в частности, в его корпусе, имеются средства для разделения анализируемого света на компоненты, соответствующие области отражения сигнала и области пропускания сигнала. Падающий свет освещает участок кожи, который находится в поле «зрения» датчика (Sichtbereich). Вторая часть поля зрения датчика закрывается от излучаемого света механической диафрагмой. Таким образом, только тот свет, который проходит через ткани человека, может попасть в данную область.
Отраженный свет, а также прошедший через кожу пропущенный свет могут быть захвачены с помощью объектива и первоначально преобразованы с помощью удлиненной диафрагмы (щели) в существенно удлиненное (одномерное) изображение, которое впоследствии может быть разложено, в частности, с помощью дифракционной решетки, в спектр, растянутый в другом, предпочтительно перпендикулярном направлении. Тем самым можно использовать относительно простые средства для простого получения двумерного изображения, несущего спектрально разрешенную информацию об имеющей форму линии области кожи и ткани где производится регистрация сигнала. После того, как излучение регистрируется датчиком изображения или преобразователем изображения, возможен последующий анализ, заключающийся в количественном и зависимом от пульса определении компонентов в коже и в ткани с целью быстрого получения заключения о составе, в частности, химическом составе крови, измеренном in vivo.
Таким образом, в соответствии с изобретением можно совместить функциональность зависимой от пульса и осуществляемой с временным разрешением регистрации с помощью датчиков со спектроскопическим изучением и анализом. Благодаря имеющейся конструкции свет может быть зарегистрирован, во-первых, в области отражения и, во-вторых, в области пропускания.
Содержание сахара в крови определяется сопоставимым образом, причем измерение в режиме отражения не является обязательным.
В соответствии с изобретением щель может по существу соответствовать направлению, имеющей форму линии зоны регистрации на коже. Направление дифракции (направление спектральной дисперсии) может проходить перпендикулярно к данному направлению щели, так что строки и столбцы двумерной пиксельной матрицы-датчика изображения могут соответствовать данным направлениям. Таким образом, полученное изображение характеризуется одномерной пространственной компонентой, соответствующей, например, линии регистрации на коже, и направлением дифракции, перпендикулярным к ней, для создания дифракционного изображения и соответствующих спектров.
Система линз предпочтительно разработана с использованием миниатюрных объективов. Для этого могут быть использованы либо мегапиксельные объективы из области технологии, разработанной для камер наблюдения, или миниатюрные объективы (например, объективы на основе полимерных материалов), которые уже имеют широкое применение в камерах сотовых телефонов. Альтернативно, для регистрации изображения могут быть использованы также другие системы линз или также ахроматические объективы.
Данные объективы можно хорошо комбинировать с предлагаемыми для использования, очень маленькими датчиками. Искажения, которые часто встречаются в подобных очень маленьких объективах, могут быть компенсированы, благодаря их статическому характеру, с помощью программного обеспечения.
Например, устройство в соответствии с изобретением может иметь три оптических блока обработки изображения или объектива. Из них первый оптический блок обработки изображения создает двумерное изображение освещенной области на удлиненной или щелевой диафрагме, которая предпочтительно расположена в плоскости изображения, создаваемого данным первым оптическим блоком обработки изображения. Второй оптический блок обработки изображения направляет изображение, полученное на щелевой диафрагме, например, в бесконечность, так что данное устройство служит для коллимации прошедшей через щель полосы света. За данным вторым оптическим блоком обработки изображения расположено дисперсионное устройство с предпочтительно оптической решеткой, которая позволяет производить дисперсионное разложение света во втором направлении.
Третий объектив, в свою очередь, производит обратное преобразование изображения, полученного на диафрагме, которое к настоящему моменту уже было дисперсионно расщеплено в виде спектра. Таким образом, на датчике получают развернутое по спектру изображение имеющего форму линии участка кожи, на котором производится регистрация.
В соответствии с изобретением датчик изображения может быть поэтому установлен в диапазоне длин волн, оптимальном для соответствующего применения, и может охватить, например, лишь относительно узкий пространственный угловой диапазон.
С помощью первого оптического блока обработки изображения изображение анализируемой области может быть сфокусировано на щели диафрагмы, так что диафрагма будет эффективно отсекать области за пределами линейного участка регистрации. Поэтому, в принципе, использование диафрагмы также дает возможность осветить данным устройством область несколько больший участок, чем впоследствии исследуемая спектроскопическим способом область, которая ограничена диафрагмой.
Светодиодный источник освещения предпочтительно управляется в импульсном режиме. Таким образом можно уменьшить помехи, обусловленные иными источниками света.
Кроме того, может быть обеспечен внутренний баланс черного цвета. В новом поколении КМОП-датчиков имеется возможность внутренней коррекции значений параметров черного цвета. На пиксели по краям датчика нанесено черное покрытие. Сигналы с этих пикселей считываются вместе с сигналами с остальных пикселей и используются для внутренней оптимизации значений параметров черного цвета. Хотя такой подход и не решает проблему внешних световых помех, он решает обычно наблюдающиеся проблемы, связанные с тем, заключающиеся в том, что показания датчиков медленно изменяются в случае колебаний температуры или колебаний в системах поддержки электроники. Таким образом, можно регистрировать изображения с очень короткими временами экспозиции и высокой интенсивностью света. При этом помехи, обусловленные внешними источниками света, как правило, бывают небольшими. В случае появления помех, обусловленных внешними источниками света, имеется возможность в каждом случае дополнительно зарегистрировать фоновое изображение без светодиодного освещения со значительно уменьшенной ROI (областью интереса; диапазон исследованных частот), и с помощью такого фонового изображения может корригироваться основное изображение. Перед использованием датчика в блоке обработки данных запоминается фиксированное белое изображение. В уравнении (1) оно соответствует I0(λ).
После каждой регистрации все приблизительно от 500 до 1000 соседних спектров с пространственным разрешением складываются с получением спектра большой глубиной данных, и с помощью вышеприведенного уравнения 5 рассчитывается величина I(λ). Кроме того, рассчитывается вторая производная одного из использованных при суммировании спектров. При этом могут быть непосредственно определены необходимые концентрации. При оценке зависимых от времени значений теперь могут быть - как принято в пульсоксиметрии - определены из зависимой от пульса компоненты и значения показателей для компоненты артериальной крови. Если при этом имеется возможность получать спектроскопические данные в режиме разрешения обусловленной пульсом компоненты сигнала, то при определении содержания сахара в крови также возможно отдельно интегрировать спектры, полученные во время систолы и во время диастолы, и путем простого получения разности спектров вычленить чистый спектр артериальной крови и, следовательно, определить не уровень сахара в крови для ткани, а уровень сахара в крови для артериальной крови тела.
Регистрируемый спектр варьирует в зависимости от давления, с которым палец (или другое место измерения) прижимается к датчику. Данную зависимость от давления можно избежать, если анализируется вторая производная спектра. Кроме того, вторая производная позволяет измерять поглощение, только обусловленное артериальной кровью. Удается избежать эффектов, обусловленных рассеянием света в окружающих тканях. При определенных обстоятельствах контактное давление оказывает на спектр больший эффект, чем поглощение артериальной кровью. Поэтому очень важно, что можно провести измерения, которые не зависят от контактного давления. Это возможно при анализе второй производной.
Кроме того, для определения различных значений можно суммировать полученные в различных областях данные или по-разному освещать и анализировать части изучаемых областей.
Для информации о пульсе предпочтительно объединять и оценивать массивы спектрально расщепленных информационных сигналов на относительно больших спектральных диапазонах, особенно в диапазоне длин волн от 520 нм до 570 нм. Так как сигнал от пульса присутствует во всем спектральном диапазоне, то в качестве альтернативы для оценки можно суммировать все пиксели. Так, например, в случае сканирования с частотой 50 Гц можно интегрировать обычно 500 000 пикселей с глубиной данных 12 бит в случае каждого изображения, что приводит к очень большой глубине данных и, следовательно, также позволяет обнаружить очень слабые колебания интенсивности, обусловленные пульсом.
Основываясь на информации о пульсе можно выразить индекс перфузии PI как отношение амплитуды пульса к фиксированному, не изменяющемуся во времени поглощению тканью и венозной кровью, согласно формуле
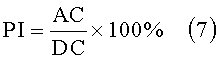
Здесь АС представляет собой амплитуду зависимого от пульса сигнала и DC представляет собой максимальный сигнал поглощения. Данное значение PI зависит от длины волны, но может нормироваться в соответствии с публикацией "The wavelength dependence of pulse oximetry" (Damia-nou, D.; Crowe, J.A.; Pulse Oximetry: A Critical Appraisal, IEE Colloquium; Volume 1996, Issue 124, 29 May 1996 Page(s):7/1-7/3)
Изменения данного показателя указывают на ранней стадии на различные, клинически значимые изменения в состоянии пациента.
Еще один важный показатель представляет собой "индекс изменчивости Pleth" (pleth variability index (PVI)), который устанавливает взаимосвязь между дыханием и пульсом. PVI определяется за несколько дыхательных циклов по формуле
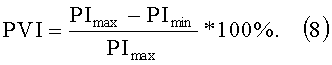
Расчет значений % SрO2-концентрации и содержания общего гемоглобина может быть осуществлен, как описано в "The light-tissue interaction of pulse oximetry" (Mannheimer Ph.D.; Anesth. Analg. 2007 Dec; 105(6 Suppi): S10-7. Review) или "LED Based Sensor System for Non-Invasive Measurement of the Hemoglobin Concentration in Human Blood" (U. Timm, E. Lewis, D. McGrath, J. Kraiti and H. Ewald; 13th International Conference on Biomedical Engineering; Volume 23, Springer Berlin Heidelberg, 2009).
При обработке данных возможно, сравнимо с обычной оксиметрией, сравнение двух спектральных областей. Так, например, спектральные каналы на длинах волн от 640 нм до 680 нм могут быть интегрированы для получения обычного сигнала на длине волны 660 нм. При этом можно, например, эффективно интегрировать 50000 пикселей для получения одной спектральной точки измерения.
Однако предпочтительной оценкой является хемометрическая обработка данных опосредованного пульсом компонента.
Концентрации различных производных гемоглобина определяются непосредственно из количественного спектрального анализа.
Максимумы или минимумы поглощения во второй производной:
В блоке обработки сигналов могут быть очень быстро обработаны последовательно полученные массивы спектральной информации, причем например, можно проводить многомерный статистический анализ, как это принято в спектроскопии, для определения спектральных характеристических компонентов отражения или поглощения зарегистрированного спектра. При этом можно использовать различные способы многомерного статистического анализа, такие как, например, корреляции, регрессии, вариантный анализ, дискриминантный анализ и анализ главных компонент (Principal Component Analysis (PCA)).
Вычислительная обработка данных может быть выполнена в блоке обработки сигналов, расположенном отдельно от устройства. Если в устройстве в соответствии с изобретением измеряемые значения оцифровываются и передаются в центральный блок обработки сигналов с помощью электрического соединения, передающий кабель может быть тонким.
Одновременно не требуется, чтобы датчик или устройство в соответствии с изобретением имел, из-за необходимых вычислительных устройств, устройств ввода или вывода данных, большие габариты, делающие невозможным его прикрепление к местам измерений. Внешний блок обработки сигналов также предоставляет возможность временного хранения данных или обработки данных с помощью более сложных математических методов.
Благодаря зависимой от времени обработке данных, можно различать информацию, обусловленную тканью и артериальной кровью. С одной стороны, данная связанная с кровью информация может быть оценена с теоретической точки зрения с помощью известных молярных коэффициентов экстинкции. С другой стороны, в анализируемом спектральном диапазоне также можно оценить очень слабое поглощение воды на длине волны приблизительно 730 нм. Поскольку значения концентрации воды в крови всегда находятся очень точно в диапазоне от 80 до 85 процентов при пересчете на объем, то при каждом измерении сигналов на основе данной оценки можно выполнить вторую, независимую калибровку измерений. Устройство, или, более конкретно, блок обработки сигналов, может быть поэтому предназначен для определения абсолютных значений концентраций использованного сигнала воды.
Еще одно преимущество комбинированного способа измерения в режимах отражения и пропускания со спектральным разрешением заключается в том, что обусловленный пульсом сигнал может быть зарегистрирован более стабильно. Средняя разность между максимальным и минимальным значениями обусловленного пульсом сигнала, отнесенная к базовому сигналу, значительно больше в видимом диапазоне спектра в области 570 нм, чем в спектральном диапазоне VNIR. Данное различие может составлять более, чем до 5 раз. Кроме того, при оценке пульса можно проводить интегрирование по спектральным диапазонам, представляющим интерес, и таким образом, даже для отдельных измерений можно достигать очень большой глубины сигнала, которая при использовании отдельных датчиков может быть технически реализована только с большим трудом.
При применении изобретения для измерения содержания сахара в крови можно измерять очень низкие концентрации глюкозы, благодаря высокому отношению сигнал/шум, обусловленному использованием двумерной спектроскопии. Как правило, интегрируется до 1 млн. спектров. Не возникает никаких проблем с кожей, поскольку при выбранном спектральном диапазоне достигается достаточная глубина проникновения света в ткань. Измерение происходит в режиме временного разрешения. Кроме того, регистрация спектров с высоким разрешением помогает обработке и обратному расчету сигналов поглощения и второй производной сигналов поглощения. Вторая производная минимизирует влияние рассеяния ткани на результаты обработки сигналов.
Для оценки значений концентраций воды и глюкозы регистрируется весь типичный спектральный диапазон с длиной волн от 800 нм до 1200 нм. Обработка данных может проводиться с использованием либо необработанного спектра, либо второй производной.
Используя вторую производную, можно различать измеряемые значения, связанные с рассеянием света в ткани, и измеряемые значения в крови.
Для более точной количественной оценки можно использовать хемометрические способы, такие как анализ главных компонент (Principal Component Analysis (PCA)) и способ проекций на латентные структуры-2 (Projection on Latent Structures (PLS2)). Здесь также можно интегрировать в КМОП-датчик электронные схемы для выставления ROI (region of interest) и аналого-цифрового преобразования.
Датчик изображения предпочтительно может быть монолитно интегрирован в полупроводниковой элементной схеме уже вместе с блоком обработки сигналов и необязательно с контрольной аппаратурой и необязательно с устройством для хранения справочных данных, так что возможен компактный и экономически эффективный дизайн, позволяющий минимизировать сложную дополнительную электропроводку или обойтись без нее.
Испускаемый осветительными устройствами свет (испускаемое излучение) предпочтительно имеет спектрально однородное распределение в диапазоне длин волн, в котором производятся измерения. При этом, осветительный блок предпочтительно излучает коллимированный свет. В качестве осветительного блока можно использовать различные широкодиапазонные светоизлучающие диоды. Кроме того, можно использовать источник света со светоизлучающими диодами других длин волн в сочетании с флуоресцентным красителем, который служит источником широко диапазонного излучения в спектральном диапазоне длин волн от 500 нм до 850 нм при мониторинге состояния пациента или в диапазоне длин волн от 800 нм до 1200 нм при измерения содержания сахара в крови.
Осветительный блок (источник света) может работать в непрерывном режиме, но должен был бы предпочтительно работать в режиме генерации импульсов в желаемый момент времени. При этом, функционирование в импульсном режиме обладает тем преимуществом, что, во-первых, блок регистрации не зависит от изменяющихся внешних световых помех и, во-вторых, регистрация происходит в течение только очень коротких моментов времени.
В соответствии с изобретением спектры могут быть обрабатываться в ходе анализа, в частности, с получением нормированных по белому цвету необработанных спектров и, дополнительно, их вторых производных, благодаря чему способ может быть осуществлен более независимо от таких зависящих от инструмента воздействий, как изменения освещения либо широкодиапазонные паразитарные поглощения, которые могут накладываться на основной сигнал, будучи обусловленными различной концентрацией меланина в коже или в тканевых структурах.
Еще одна задача изобретения относится к использованию вышеописанного устройства для определения и мониторинга компонентов или свойств среды измерения, например, для мониторинга пациентов, или, в более общем виде, для определения и мониторинга значений физиологических показателей крови живого существа предпочтительно во время неинвазивного измерения in vivo, а также во время измерений in vitro или при немедицинских применениях.
Еще одна дальнейшая задача изобретения относится к способу определения и мониторинга компонентов или свойств среды измерения, в частности, значений физиологических показателей крови живого существа, и к компьютерному программному продукту для осуществления данного способа. При этом, на первой стадии к области измерения прикрепляется заключенный в корпус датчик. При медицинских применениях область измерения представляет собой, как правило, палец или мочку уха.
Таким образом также могут быть выполнены измерения в точках тела в центре тела, поскольку при определенных обстоятельствах (если тело функционирует только в центральной области), определение пульса в конечностях возможно только в данных точках.
Область измерения далее освещается светом, выходящим из широкодиапазонного источника света, расположенного в корпусе.
Возвращенный от точки измерения анализируемый свет затем регистрируется в режиме отражения и/или в режиме пропускания. Зарегистрированное анализируемое световое изображение далее разлагается в спектр, и отдельные, зависящие от длины волны компоненты зарегистрированного света отображаются на двумерной матрице-датчике, находящихся внутри корпуса. В частности, в данном случае двумерная матрица-датчик представляет собой двумерную КМОП-матрицу. Далее предпочтительно, чтобы световое изображение отображалось на множестве параллельных строк матрицы. Спектры, полученные на параллельных строках, затем суммируются.
Спектр, полученный таким образом, затем обрабатывается с целью определения компонентов или свойств среды измерения (как правило, для определения значений физиологических показателей крови).
Анализируемый отраженный свет особенно предпочтительно разлагается с помощью дифракционной решетки. Это позволяет обеспечить особенную компактность устройства.
Анализируемый отраженный свет особенно предпочтительно регистрируется как в режиме отражения, так и в режиме пропускания. Такая регистрация может осуществляться последовательно во времени посредством попеременного освещения различных точек измерения или параллельно посредством регистрации света, выходящего из различных областей измерения.
Зарегистрированный свет особенно предпочтительно обрабатывается с временным разрешением. Благодаря этому может быть определено и принято во внимание множество дополнительных значений параметров. Особенно предпочтительным при обработке сигнала является расчет второй производной зарегистрированного спектра или зарегистрированных спектров. Также предпочтительным при обработке сигнала является одновременное определение содержания воды в крови и определение на основе установленного содержания воды абсолютных значений концентраций.
Данное изобретение объясняется в последующем тексте с использованием некоторых вариантов осуществления на основании прилагаемых чертежей. При этом:
на фигурах 1а и 1b представлено схематическое изображение устройства согласно изобретению, вид сбоку (фигура 1а) и вид сверху (фигура 1b);
на фигуре 2 представлено схематическое изображение блока датчика;
на фигурах 3а и 3b представлено устройство согласно изобретению для комбинированной регистрации свойств, связанных с отражением и пропусканием в случае временного разрешения (фигура 3а) и пространственного разрешения (фигура 3b);
на фигуре 4 показана блок-схема устройства в соответствии с изобретением;
на фигуре 5 представлено разделение сигналов поглощения в зависимости от их происхождения;
на фигурах 6а и 6b представлено спектральное распределение белого светодиодного источника освещения (фигура 6а), а также спектр поглощения воды в спектральном диапазоне длин волн от 600 нм до 850 нм и в виде второй производной (фигура 6b); а также
на фигуре 7 показаны спектры различных компонентов крови в виде спектров поглощения и их первой и второй производных;
на фигуре 8 представлены различные спектры с различными интегрированиями и для двух типов датчиков (слева 38 дБ/справа 64 дБ);
на фигуре 9 представлено схематичное изображение предпочтительного датчика;
на фигуре 10 представлены типичные спектры;
на фигуре 11 представлены вторые производные типичных спектров.
На фигуре 1а представлено устройство 1 согласно изобретению, вид сбоку. Данное устройство 1 содержит один или несколько осветительных устройств 20 (см. фигуру 4), которые излучают измеряемый свет 2. При этом осветительные устройства 20 служат для освещения области измерения 3, которая должна быть подвергнута исследованию, как правило, области кожи и ткани, в виде по существу двумерной области, или области, растянутой в виде относительно узкой полосы в Y-направлении. В различных вариантах осуществления имеющая форму линии область измерения 3, таким образом, освещается с помощью осветительных устройств соответственно либо в режиме отражения, либо в режиме пропускания и излучает анализируемый свет 4 в зависимости от использованного режима пропускания или отражения. Анализируемый свет 4 направляется через отклоняющее зеркало 5 в спектрометрический блок 22. В данном случае для определения степени насыщения крови кислородом и дальнейших значений показателей крови анализируемый свет 4 анализируется в видимом (VIS) и ближнем инфракрасном (ИК) диапазоне, например в диапазоне длин волн от 500 нм до 850 нм, и его спектральное распределение зависит от состава веществ, как будет объяснено ниже со ссылкой на фигуру 5. Таким образом, анализируемый свет 4 содержит спектры в соответствующем диапазоне длин волн для количественного определения состава веществ в области измерения 3, т.е. типичного состава веществ артериальной крови и ткани. То же устройство может также использоваться для определения концентрации сахара в крови, если диапазон длин волн заменяется, как правило, до диапазона от 800 нм до 1200 нм.
Анализируемый свет 4 попадает через отклоняющее зеркало 5 и оптический блок обработки изображения 6 на диафрагму 7. Оптический блок обработки изображения 6 служит в качестве входного объектива для спектрометрического блока 22. Диафрагма 7 имеет вытянутую форму, предпочтительно в виде щели или паза, например, с шириной, составляющей обычно от 10 мкм до 30 мкм, и растянутую в горизонтальном направлении (или Z-направлении) (перпендикулярно к плоскости чертежа на фигуре 1а). Если на пути луча присутствуют дополнительные оптические элементы, такие как, например, фильтры или дополнительные зеркала, то это должно быть соответственно учтено, в соответствии с изобретением имеет значение только то, что изображение области измерения 3 фокусируется на щель диафрагмы 7 таким образом, что его растяжение в Z-направлении соответствует направлению щели.
Полоса изображения области измерения 3, которая пропускается через диафрагму 7, отбрасывается в виде света через второй оптический блок обработки изображения 8 на дифракционную решетку 9. Дифракционная решетка, используемая для измерений значений показателей крови в рамках мониторинга, представляет собой, как правило, "объемную фазовую топографическую (Volume Phase Holographic)" пропускающую дифракционную решетку, с вытравленным рельефом для длины волны 700 нм и с плотностью штрихов, составляющей приблизительно 300-600 штрихов/мм. Дифракционная решетка для измерений содержания сахара в крови представляет собой, например, "объемную фазовую топографическую пропускающую решетку (Volume Phase Holographic Transmission Grating)", имеющую плотность штрихов, составляющую 600 штрихов/мм в области 900 нм (производитель: Wasatch Photonics). Решетка 9 устроена и расположена таким образом, что разложение в спектр анализируемого света 4 идет перпендикулярно к направлению щели в диафрагме 7, то есть в поперечном направлении или Y-направлении; при этом возможны также соответственно измененные варианты осуществления. Разложенный свет отображается через третий оптический блок для обработки изображения 10 в виде дифракционной картины на поверхности 11 датчика изображения 12. Таким образом, на поверхности 11 датчика образуется дифракционная картина диафрагмы 7 или ее щели, с продольным направлением щели в (Z-направление) в одном направлении и разложением в спектр дифракционного изображения в другом направлении. Датчик изображения для измерений значений показателей крови в рамках мониторинга представляет собой, как правило, датчик-камеру КМОП типа Aptina MT9m032 (1,6 МР) или МТ9Р031 (5 МР).
К примеру, используется датчик от Photonfocus (типа А13121, 60 дБ) или от Cypress (тип IВI85,1,3 МР, 64 дБ).
На фигуре 1b представлено устройство, вид сверху.
На фигуре 2 схематически представлено устройство в соответствии с изобретением. Различные компоненты, в частности, два источника света 20а/20b, вышеупомянутые зеркала 5, оптические блоки обработки изображения 6, 8 и 10, диафрагма 7 и дифракционная решетка 9 расположены внутри корпуса 16.
Кроме того, в корпусе 16 находится также электронная схема 13, который имеет микроконтроллер (например, РХ2-компонент от Cypress), обладающий высокой скоростью последовательного преобразования данных (например, USB2/USB3). Здесь также могут быть размещены регуляторы постоянного тока светоизлучающих диодов. Кабельный USB-разъем 14 обеспечивает последовательную передачу данных и питание головки датчика.
Корпус 16 представляет собой, как правило, литую деталь, изготовленную из полимерного материала. При использовании линз из известных миниатюрных объективов с диаметром корпуса, равным приблизительно 12 мм, можно достичь габаритов корпуса датчика, равных приблизительно 10×15×50 мм. Альтернативно, может быть непосредственно использован также объектив с диаметром корпуса, равным 8 мм. Корпус 16 имеет форму, благодаря которой он может быть присоединен к месту измерения, например, к мочке уха или к пальцу, или, в случае применений при диализе или в немедицинской области, например, также к трубкам для доставки среды измерения. Кроме того, корпус может быть дополнительно обеспечен специалистом в данной области известными крепежными средствами. В месте выхода или входа света корпус 16 закрыт антибликовым стеклом.
При этом разделяющая стенперегородка 17 разделяет два различные области излучения 3', 3'' для различения между измерением отражения (область излучения 3') и измерением пропускания (область излучения 3''), см. также фигуру 3b.
Из-за сильного изменения молярных коэффициентов экстинкции в спектральном диапазоне важно осуществлять запись как в режиме отражения, так и в режиме трансфлексии. На фигурах 3а и 3b представлены две возможности достижения этого с помощью одной системы датчиков.
На фигуре 3а предусмотрен вариант пространственно-временного разделения. При этом сначала область 3' освещают короткими импульсами (см. фигуру 2) для измерения в режиме отражения. В этом случае спектрометрический блок 22 с входным объективом направлен на линию изображения 15. После того как изображение было считано, включают второй импульсный источник света, который освещает область 3'' на коже. При этом, благодаря разделительной перегородке 17, свет не может попадать непосредственно на линию регистрации 15. Свет проходит через ткань трансфлективным образом и его часть при этом выходит в месте линии регистрации 15 и затем используется для регистрации и обработки пропущенного сигнала.
При использовании варианта, представленного на фигуре 3b, свет освещает только область 3'. Тем не менее, 2D-спектрометрический блок направлен на обе области 3' и 3'' на линии 15. Вследствие пространственного разрешения на матрице можно различать свет от обеих областей, 3' и 3''.
Благодаря разделительной перегородке 17, в области 3'' регистрируется только сигнал пропускания. Ожидаемые различия в интенсивности освещения соответствующих областям 3' и 3'' участков датчика могут быть скомпенсированы за счет прочно вставленного нейтрального светофильтра на пути луча за входным отверстием 7 или перед поверхностью 11 датчика.
На фигуре 4 представлена блок-схема предпочтительного варианта осуществления системы датчиков. Осветительный блок 20 излучает свет 2 на область измерения 3. Как описано выше, данный свет теперь вводится в спектрометрический блок 22 в измененном виде, в режиме отражения или в режиме трансфлексии, в качестве анализируемого света. После разложения в спектр в спектрометрическом блоке 22 разложенный в спектр свет 23 поступает на датчик изображения 11. Датчик изображения 11 состоит из отдельных фотоэлементов 24, расположенных в матрице. Датчик изображения 11 представляет собой двумерный КМОП датчик от цифровой камеры: как указано в блок-схеме фигуры 4, в нем имеется пиксельная матрица из отдельных пикселей, чувствительных в спектральных диапазонах VIS и VNIR, которые расположены в виде матрицы. В одном направлении (например, Х-направление), вследствие разложения света в спектр, компоненты света с различными длинами волн отображаются на отдельные пиксели. Спектр анализируемого света, следовательно, зарегистрирован на одной строке датчика в Х-направлении. В Y-направлении параллельно рядом друг с другом расположено множество измеряющих строк датчика. Спектр анализируемого света измеряется на каждой из данных строк. Поскольку считываются и суммируются данные для множества параллельных, соседних строк, как правило, 1000 строк (или обычно 2000 строк в случае датчиков с разрешением 4 МР или 5 МР), возможно получить сигнал в соответствии с изобретением с увеличенным отношением сигнал/шум.
Фотоэлектрические сигналы усиливаются и оцифровываются уже в датчике. Затем данные сигналы передаются через соединительный кабель 25 параллельно или последовательно на микропроцессор 26. Микропроцессор 26, во-первых, проводит преобразование сигналов, во-вторых, он также осуществляет через управляющий кабель 28 управление светоизлучающий диодным осветительным устройством 20 и через кабель параметризации 27 параметризацию датчика изображения 11.
Такой КМОП-датчик изображения 11 дает возможность, при одной единственной записи изображения, регистрировать одновременно до одной тысячи спектров, то есть один спектр в строке с глубиной данных, например, 12 бит. Каждый из данных спектров поэтому соответствует спектру одного элемента изображения диафрагмы, то есть соответствует части изображения, выделенного щелевой диафрагмой 7, величина которой зависит от числа пикселей датчика, которые расположены рядом друг с другом в Y-направлении (см. фигуру 1а).
Датчик изображения 11 может повторять регистрацию изображения, например, со скоростью повторения изображения, например, 50 регистрации в секунду. Поскольку в соответствии с изобретением, к примеру, только узкий спектральный диапазон, а именно диапазон длин волн от 500 нм до 850 нм при применении в мониторинге и диапазон длин волн от 800 нм до 1200 нм при измерении содержания сахара в крови, может иметь значение, или также только ограниченная область пространства должна быть считана, можно использовать в таких датчиках изображения 11 регистрацию частичного изображения, таким образом что частичные изображения выставляются как "область интереса" ("region of interest" (ROI)), что дает возможность считывать только установленную, представляющую интерес (соответствующую желаемой области частот) область изображения датчика изображения 12, и одновременно поддерживать базовую скорость считывания данных (скорость пикселей), что увеличивает количество передаваемых кадров, то есть изображений или частичных изображений в секунду.
Микропроцессор 26 перенимает, кроме того, через кабель связи 29 связь с главным процессором 30 системы. При этом, данные изображения передаются на главный процессор 30, и главный процессор передает данные параметризации на систему датчиков 33. Питание системы датчиков 33 также осуществляется через кабель связи 29. Предпочтительный вариант осуществления соединения представляет собой соединение через USB-порт, которое одновременно обеспечивает высокую скорость передачи данных и подачу напряжения 5 вольт. Главный процессор 30 снабжен блоком 31 входных сигналов, имеющим дисплей, с помощью которого пользователем может быть установлен важный для системы параметр и могут быть представлены к настоящему времени установленные данные. Процессор, память и пользовательский терминал могут быть размещены в блоке 32, который могут выставляться важные для системы параметры и могут отслеживаться полученные к настоящему времени данные. Процессор, память и пользовательский терминал могут быть размещены в блоке 32, который может быть установлен на расстоянии от пациента. Главный процессор представляет собой, как правило, компьютер с двухъядерным процессором, причем обработка изображений происходит в первом ядре и обработка данных для определения значений показателей ткани и крови происходит во втором ядре.
На фигуре 5 схематично представлен типичный временной профиль сигнала при измерении показателей крови in vivo. При этом, оптический сигнал имеет постоянную компоненту и компоненту, связанную с пульсом. Постоянная компонента, или, точнее, компонента, которая претерпевает только долгосрочные изменения, обусловлена, в первую очередь, венозной кровью и, во-вторых, тканями. При этом, в сигнале, обусловленном тканями, также надлежит различать две компоненты. Одна компонента зависит от содержащихся в ткани веществ, а другая компонента зависит от рассеивающих свойств тканей, которые влияют на актуальную длину пути прохождения света.
Компонента сигнала, связанная с пульсом, возникает при перекачивании артериальной крови из сердца. Поглощение артериальной крови в период систолы отличается от поглощения артериальной крови в период диастолы. Данное явление позволяет дифференциацию. При этом, сильно насыщенная кислородом кровь закачивается в часть тела, где проводится измерение. При этом, степень насыщения гемоглобина кислородом у здорового человека находится в области от 95% до 99%. Компонента сигнала, связанная с пульсом, зависит от длины волны и зависит от точки измерения и типа измерения (отражающий/пропускающий). Кроме того, имеет значение, нагревается ли место измерения. В случае измерений, проводимых на пальце у здоровых людей, вклад компоненты сигнала, связанной с пульсом, может (в случае измерений в режиме пропускания) составлять от 3% до 20%. В случае измерений в режиме отражения, например, проводимых на мочке уха, вклад компоненты может составлять от 0,5% до 1,5%. Компонента сигнала, связанная с пульсом, имеет еще меньшие значения в случае пациентов с плохим кровоснабжением или острыми медицинскими заболеваниями.
По этой небольшой компоненте должны быть определены пульс и содержание кислорода или содержание сахара в крови. В соответствии с изобретением спектры могут быть зарегистрированы с очень высокой скоростью (с частотой, составляющей приблизительно 50-100 Гц), и при каждой регистрации 1000 индивидуальных спектров могут быть суммированы в один спектр. Пользуясь этим, в спектроскопии можно разделить в спектре постоянную компоненту и компоненту, связанную с пульсом.
На фигуре 6а показан спектр типичного светодиодного осветительного устройства для применений в рамках мониторинга. Для системы требуется осветительное устройство, которое обеспечивает свет в спектральном диапазоне длин волн от 500 нм до 850 нм.
Здесь представлен спектр подходящего широкодиапазонного светоизлучающего диода, который как светоизлучающий диод белого света имеет синий излучатель (450 нм) для возбуждения красителя. Данный светоизлучающий диод имеет хорошее распределение интенсивности, особенно в спектральном диапазоне длин волн от 500 нм до 650 нм. В зависимости от области применения также может быть использован светоизлучающий диод белого света с существенно более низкой цветовой температурой, могут быть использованы другие композиции красителей или данный светоизлучающий диод имеет хорошее распределение интенсивности, особенно в спектральном диапазоне длин волн от 500 нм до 650 нм. В зависимости от области применения также может быть использован светоизлучающий диод белого света с существенно более низкой цветовой температурой, могут быть использованы другие композиции красителей или к осветителю могут быть дополнительно добавлены монохромные светоизлучающие диоды.
На фигуре 6b представлена кривая поглощения воды и ее вторая производная. Вода слабо поглощает на длинах волн 730 нм и 830 нм (комбинированное колебание av1+bv3; c a+b=4). Однако величину данного поглощения можно хорошо оценить с помощью представленной здесь методики. Поскольку из литературных источников известно, что содержание воды в крови является весьма постоянным и находится в диапазоне от 80 до 85 процентов при пересчете на объем, то возможно, используя компоненту сигнала, связанную с пульсом, провести абсолютное определение концентраций также с помощью сигнала, полученного от воды. Это можно применять в ходе мониторинга, а также, например, при измерении содержания сахара в крови.
С другой стороны, для измерений содержания сахара в крови требуется осветительное устройство, которое обеспечивает свет в спектральном диапазоне длин волн от 800 нм до 1200 нм (не представлено).
На фигуре 7 соответствующие спектры окисленного гемоглобина (НbO2) и других производных гемоглобина показаны в виде спектров поглощения и в виде их первой и второй производных, причем по оси абсцисс откладывается длина волны λ, в диапазоне от 500 нм до 800 нм. Эти очень точно известные данные позволяют рассчитывать составные компоненты веществ с использованием ранее описанной многомерной регрессии.
В данном случае важно, что с помощью представленной здесь методики может быть осуществлена не только оценка сигналов поглощения, но также, с использованием второй производной, проведено очень точное разграничение с другими веществами. При обработке данных дополнительно используется многомерный статистический анализ. Индивидуальные спектры всех соответствующих веществ, которые должны быть определены, предпочтительно заранее измеряют и хранят.
Фигуры с 8 по 11 показывают конкретную конструкцию одного датчика и результаты осуществленных с его помощью измерений.
На фигуре 8 представлены симуляции различных спектров. Спектры в левой колонке были получены на основе первого типа датчика (38,10 dB (децибел, decibel). Спектры в правой колонке были получены на основе второго типа датчика (64 дБ). К примеру, такой датчик представляет собой 1,3 Мп КМОП-датчик изображения IBIS5-B-1300 от Cypress с разрешением 1280×1024 пикселей с размером пикселя 6,7 мкм × 6,7 мкм. Для целей симуляции в качестве начальной точки берут пять очень хорошо измеренных спектров. Из данных спектров получают, соответственно, 30 индивидуальных спектров, на которые накладывают искусственный шум датчика. Результат откладывается в виде графика. Данный результат показывает, какие рассеяния можно было бы ожидать в случае отдельных измерений.
В направлении сверху вниз различные изображения показывают влияние числа интегрирования спектров. Изображения показывают вторую производную спектра, полученного при измерении на человеческом пальце, произведенном в диапазоне длин волн от 890 до 920 нм. В направлении сверху вниз отдельные изображения показывают такое же количество (симулированных) спектров, которые были получены путем суммирования все большего числа отдельных спектров. В одном "кадре" здесь проинтегрированы уже 1000 строк. Самое верхнее изображение показывает 1 рамку считывания. Самое нижнее изображение показывает 3000 рамок считывания.
На фигуре 9 представлен предпочтительный вариант устройства 1 в соответствии с изобретением. На данной фигуре те же ссылочные обозначения обозначают те же компоненты, что и в предыдущих фигурах. Устройство 1 имеет корпус, в котором расположены различные оптические и электронные компоненты. Измерение производится на пальце. Палец вводится в область измерения 3. Данный датчик особенно подходит для измерения содержания сахара в крови. Широкодиапазонный светоизлучающий диод 20 обычно излучает свет в спектральном диапазоне длин волн от 800 до 1200 нм в сторону области измерения 3. Корпус 16 имеет отверстие для выхода света. Отверстие может быть прикрыто покрытием 19, прозрачным для выходящего света. Свет, снова выходящий через палец, направляется в корпус 16 через второе отверстие в корпусе 16, которое также снабжено покрытием 19, прозрачным для света. Свет отклоняется на дифракционную решетку 9 через расположение зеркал 5, щелевую диафрагму 7 и первый оптический блок для обработки изображения 8. Свет разлагается в спектр на дифракционной решетке 9 и через второй оптический блок для обработки изображения 10 направляется на поверхность 11 датчика изображения 12. Датчик изображения 12 и светоизлучающий диод 20 расположены на общей печатной плате 18 в корпусе 16. Печатная плата 18 снабжена, кроме того, электронными компонентами для управления светоизлучающим диодом 20 и датчиком изображения 12. В частности, печатная плата 18 также имеет USB-контроллер 36 и USB-разъемы (не представлены более подробно). Данный USB-интерфейс обеспечивает, с одной стороны, энергоснабжение устройства 1. С другой стороны, данный USB-интерфейс обеспечивает обмен данными с внешним компьютером или дисплеем. Как правило, в датчике, данные, считанные с 4×4 пикселей, объединяются вместе (биннинг). Данные, объединенные таким образом, передаются в компьютер через USB- интерфейс. Там спектры суммируются после корректировки на статического оптического искажения датчика.
В качестве светоизлучающих диодов используются мощные светоизлучающие диоды. Подходящие ахроматические линзы используются в качестве линз.
Дифракционная решетка представляет собой решетку, оптимизированную в соответствии со спектральным диапазоном, как правило, имеющую плотность штрихов, составляющую 300 штрихов/мм или 600 штрихов/мм.
На фигуре 10 представлен спектр в масштабе времени, зарегистрированный датчиком в соответствии с фигурой 9. Измерение спектра проводили на пальце в спектральном диапазоне длин волн от 500 до 850 нм в режиме трансфлекции (свет вводится в ткань в одном месте и выходит в другом месте на той же стороне). На фигуре 10 представлены спектры в масштабе времени с двумя разными величинами контактного давления (слабое контактное давление в течение от 0 до приблизительно 10 сек и от 20 сек и далее/более высокое контактное давление от приблизительно 10 сек до 20 сек). Пульс может быть легко определен в спектральном диапазоне длин волн от 520 до 580 нм вследствие сильного поглощения окисленного гемоглобина. Пульс может также быть четко определяем в диапазоне длин волн от 650 до 850 нм, поскольку свет проникает глубже в палец, где большее количество артериальной крови вкладывается в сигнал. Данные две области обозначаются цифрой 1 на фигуре 10. Однако, при сильном контактном давлении в течение от 10 сек до 20 сек пульс значительно менее выражен. Таким образом, особенно в рамках мониторинга, где важно измерение в режиме разрешения компоненты сигнала, связанной с пульсом, необходимо обращать внимание на то чтобы контактное давление было не слишком велико.
Цифры 2 указывают на характерные особенности спектра поглощения окисленного гемоглобина (НbO2 артериальной крови). Максимумы двойного пика наблюдается при 540/578 нм. Очень низкое поглощение наблюдается в диапазоне длин волн от 660 до 680 нм.
Цифра 3 на фигуре 10 указывает на максимум спектра поглощения восстановленного гемоглобина при 760 нм.
На более коротких длинах волн поглощение сильно падает при относительно высоком контактном давлении (цифра 4 на фигуре 10). Поглощение уменьшается, поскольку сравнительно уменьшается количество наличной крови (кровь выдавливается из пальца).
Сдвиги двойного максимума спектра поглощения (обозначенного цифрой 5) предоставляют информацию о содержании НbСО в крови.
Область в районе длины волны 650 нм, обозначенная цифрой 6, служит для определения содержания метгемоглобина (MetHb).
На фигуре 11 представлен график второй производной спектров, представленных на фигуре 10. Известен методический подход, использующий вторую производную спектра (спектроскопия производных спектров). Используя данный подход, можно удалить все постоянные компоненты спектра. Благодаря этому можно удалить артефакты, возникающие из-за изменений в освещении, а также из-за различий в интенсивности света, обусловленных светорассеянием в ткани. Кроме того, увеличивается относительный вклад значимой информации. Использование производных особенно полезно в том случае, если максимумы спектров поглощения компонентов в смеси нескольких веществ отличаются друг от друга незначительно или накладываются друг на друга. График второй производной дает много дополнительной информации. При регистрации второй производной спектра все еще можно различить пульс. Однако, сигнал пульса хорошо заметен только там, где существует большая разница в спектрах поглощения между артериальной кровью (НbO2) и тканью/венозной кровью. Это особенно верно в случае спектрального диапазона длин волн от 600 до 630 нм (обозначено цифрой 1). Разница в поглощении проявляется меньше в более длинноволновом спектральном диапазоне. Значение амплитуды второй производной сигнала, связанного с пульсом, в данном спектральном диапазоне, следовательно, значительно ниже (смотри цифру 2 в центральной области на фигуре 11).
Пульс также хуже определяется из графика второй производной в случае сильного контактного давления. При увеличении давления изменяется не только амплитуда пульса, но и форма и положение максимумов спектра поглощения на участке спектрального диапазона, обозначенном цифрой 3. Это показывает на то, что при увеличении давления из пальца, в первую очередь выдавливается артериальная кровь.
На графике второй производной очень четко виден двойной пик спектра поглощения оксигемоглобина (обозначен цифрой 4).
Содержание дезоксигемоглобина (ННb) больше в ткани и в венозной крови. Значимый пик спектра поглощения в данном случае находится при длине волны 760 нм. Величина данного поглощения практически не меняется в зависимости от контактного давления, поскольку артериальная кровь почти полностью оксигенирована. Из соотношения интенсивности данного пика спектра поглощения и количества оксигемоглобина (определяемого по двойному пику спектра поглощения в области 4), можно определить степень насыщения тканей кислородом (StiO2).
Из графика второй производной и, в частности, из его профиля и позиций отдельных пиков спектра поглощения возможно определить концентрацию НbСО. На основании известных, зависимых от длины волны коэффициентов поглощения НbO2, ННВ, НbСО и HbMet, могут быть определены их концентрации.
Для анализа компонентов крови или их изменения целесообразно регистрировать данные с временным разрешением (и, следовательно, с разрешением компонентов сигнала, связанных с пульсом). Это позволяет целенаправленно раздельно регистрировать, а также раздельно анализировать данные, полученные из периода систолы и из периода диастолы (см. также изображение на фигуре 4, где большие величины поглощения указывают на период систолы и сравнительно низкие величины поглощения артериальной крови указывают на период диастолы). В частности, спектр чисто артериального компонента крови получают из разницы между спектрами периода диастолы и периода систолы. Однако, как представлено на фигуре 5, разница в поглощении между периодом систолы и периодом диастолы сравнительно невелика по сравнению с величиной общего поглощения. Из-за суммарного большого поглощения на датчик поступают только слабые световые сигналы. Поскольку в соответствии с изобретением спектры множества соседних строк двумерного датчика регистрируются одновременно и суммируются, получают сигнал достаточно высокого качества. Таким образом, также возможно оценивать очень небольшую разницу между спектрами периода систолы и спектрами периода диастолы.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОРТАТИВНОЕ УСТРОЙСТВО И СПОСОБ ДЛЯ НЕИНВАЗИВНОГО ИЗМЕРЕНИЯ ЭЛЕМЕНТОВ КРОВИ | 2022 |
|
RU2793540C1 |
| Способ и устройство для оптической регистрации изменений ткани с повышенной точностью | 2015 |
|
RU2696242C2 |
| ПОРТАТИВНОЕ УСТРОЙСТВО ДЛЯ ИЗМЕРЕНИЯ ХРОМОФОРОВ В КОЖЕ И СПОСОБ ПРИМЕНЕНИЯ УСТРОЙСТВА | 2014 |
|
RU2601678C2 |
| ИЗМЕРЕНИЕ КОНЦЕНТРАЦИИ ГЛЮКОЗЫ В ПУЛЬСИРУЮЩЕЙ КРОВИ | 2007 |
|
RU2453266C2 |
| НОСИМОЕ УСТРОЙСТВО С ФУНКЦИЕЙ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ГЕМОГЛОБИНА, СПОСОБ И СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ГЕМОГЛОБИНА | 2023 |
|
RU2805810C1 |
| ПОРТАТИВНОЕ УСТРОЙСТВО И СПОСОБ ДЛЯ НЕИНВАЗИВНОЙ ОЦЕНКИ УРОВНЯ ГЛЮКОЗЫ В КРОВИ | 2020 |
|
RU2793778C2 |
| Система и способ для указания состояния десен человека | 2019 |
|
RU2799877C2 |
| Аналитическая система и способ для определения параметров гемоглобина в цельной крови | 2016 |
|
RU2730366C2 |
| МАРКЕР СО СВЕТОИЗЛУЧАЮЩЕЙ ОБЛАСТЬЮ ДЛЯ ИСПОЛЬЗОВАНИЯ В ОПРЕДЕЛЕНИИ ИНФОРМАЦИИ О ПОКАЗАТЕЛЯХ ЖИЗНЕДЕЯТЕЛЬНОСТИ | 2014 |
|
RU2664600C2 |
| НОСИМОЕ УСТРОЙСТВО, СПОСОБ И СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ УРОВНЯ ГЛИКИРОВАННОГО ГЕМОГЛОБИНА | 2024 |
|
RU2832523C1 |
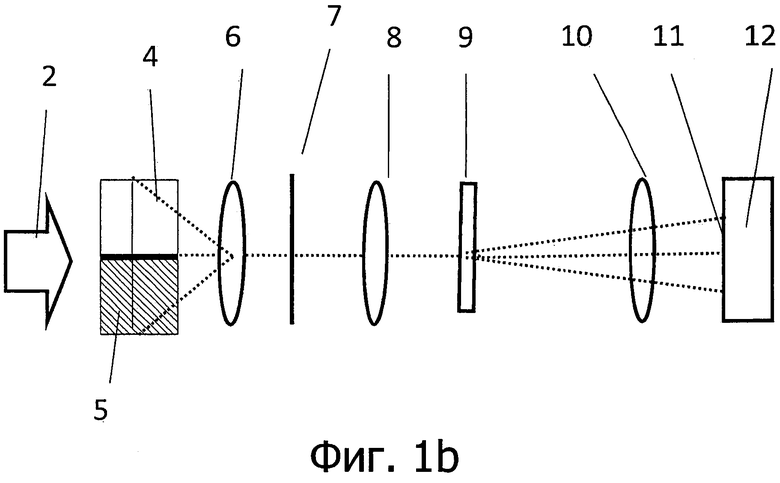
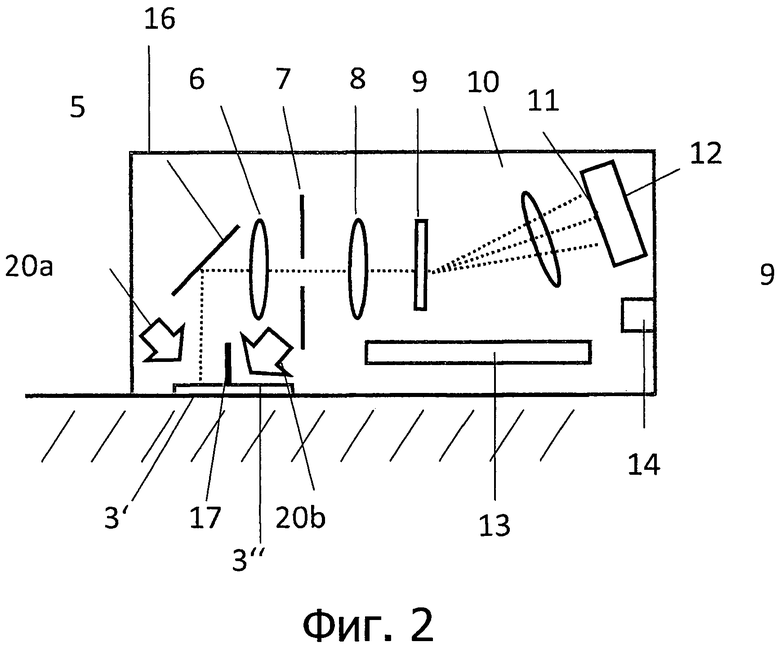
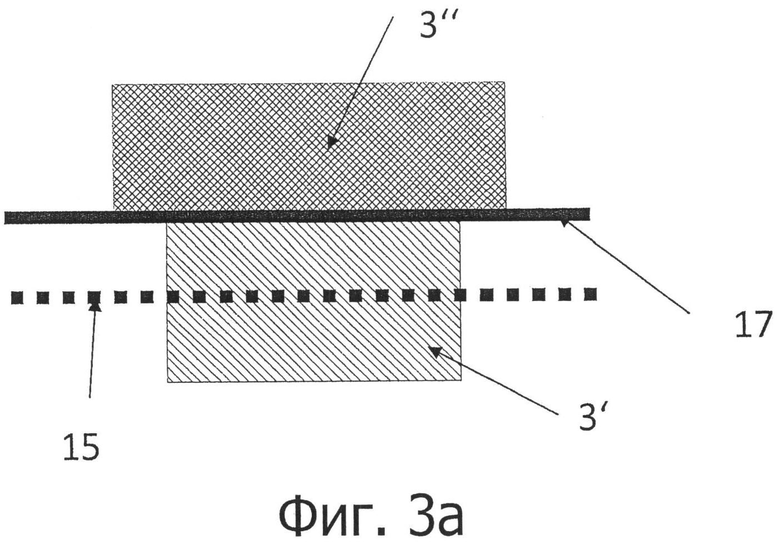
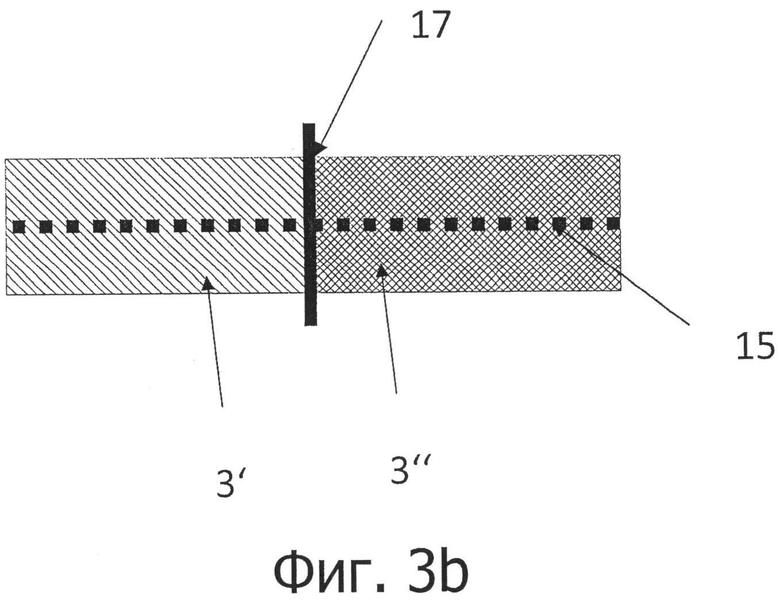
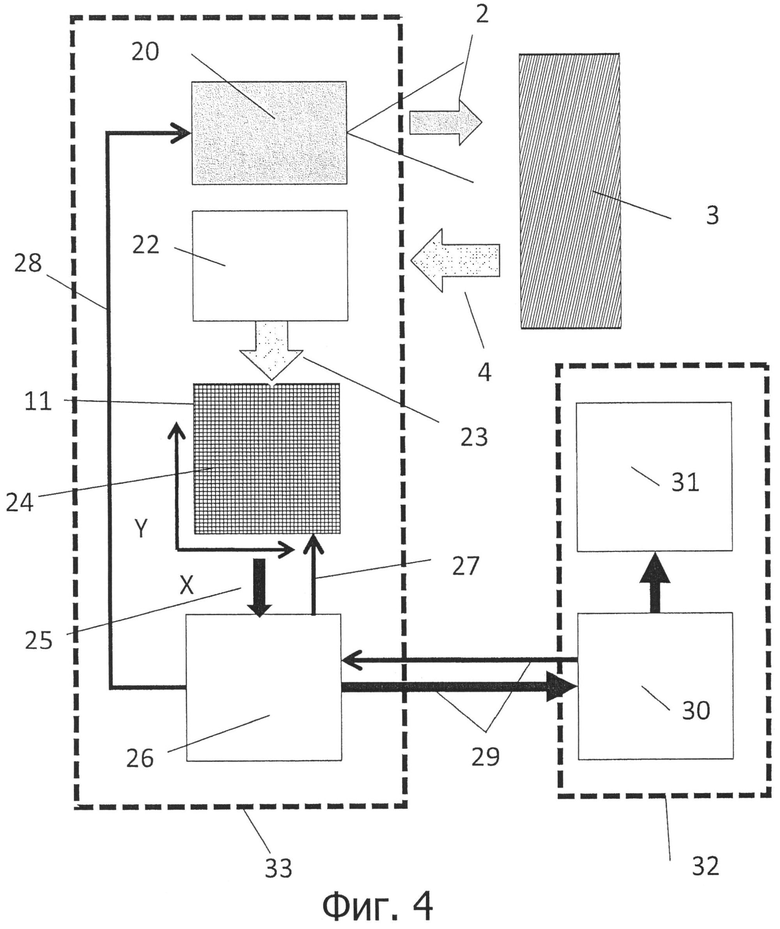
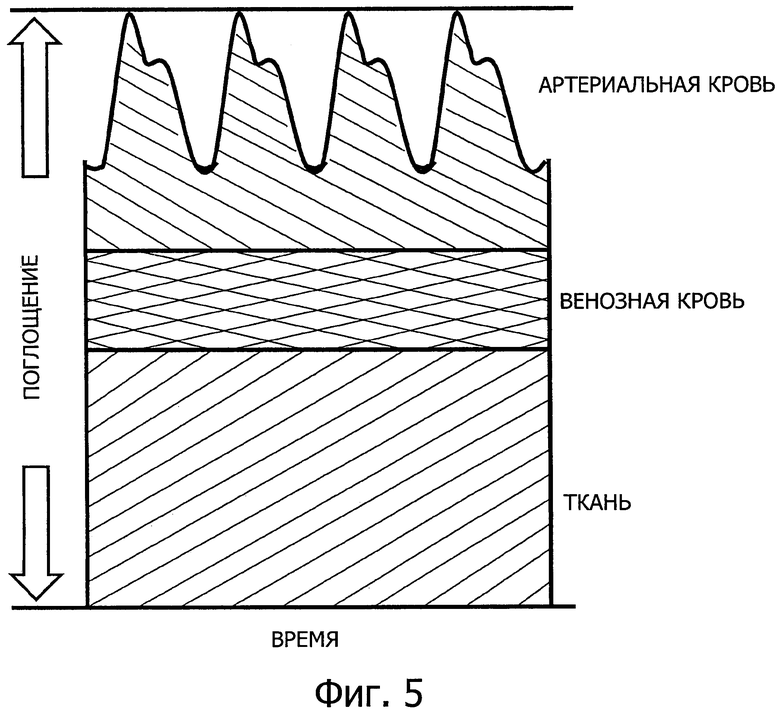
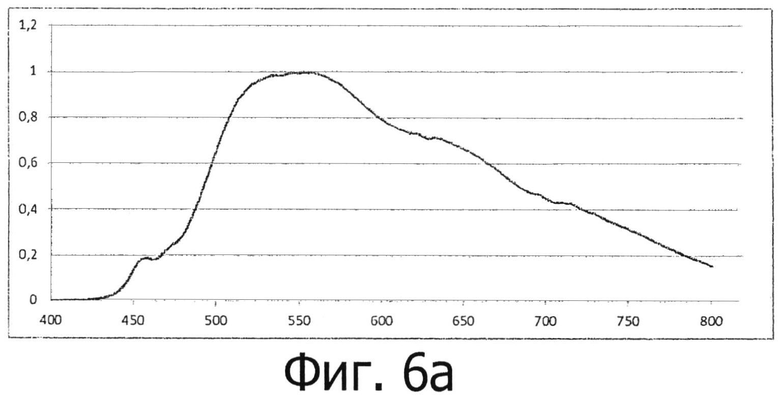
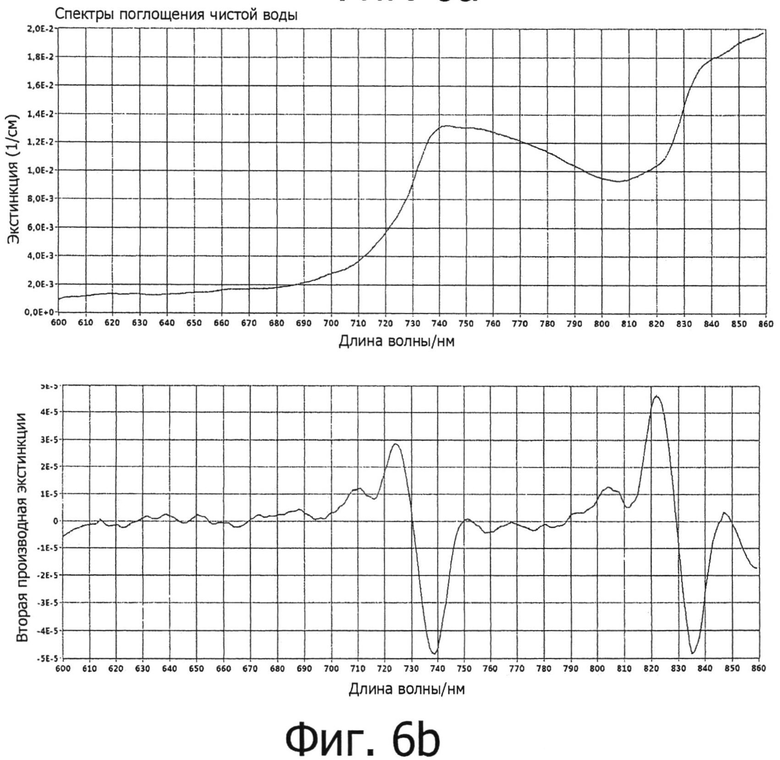
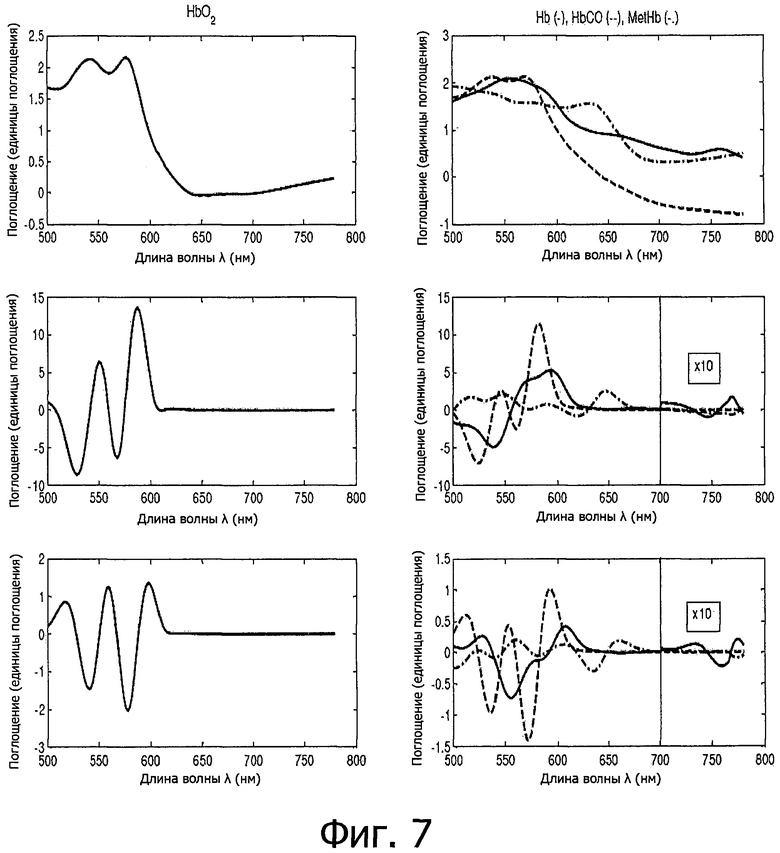
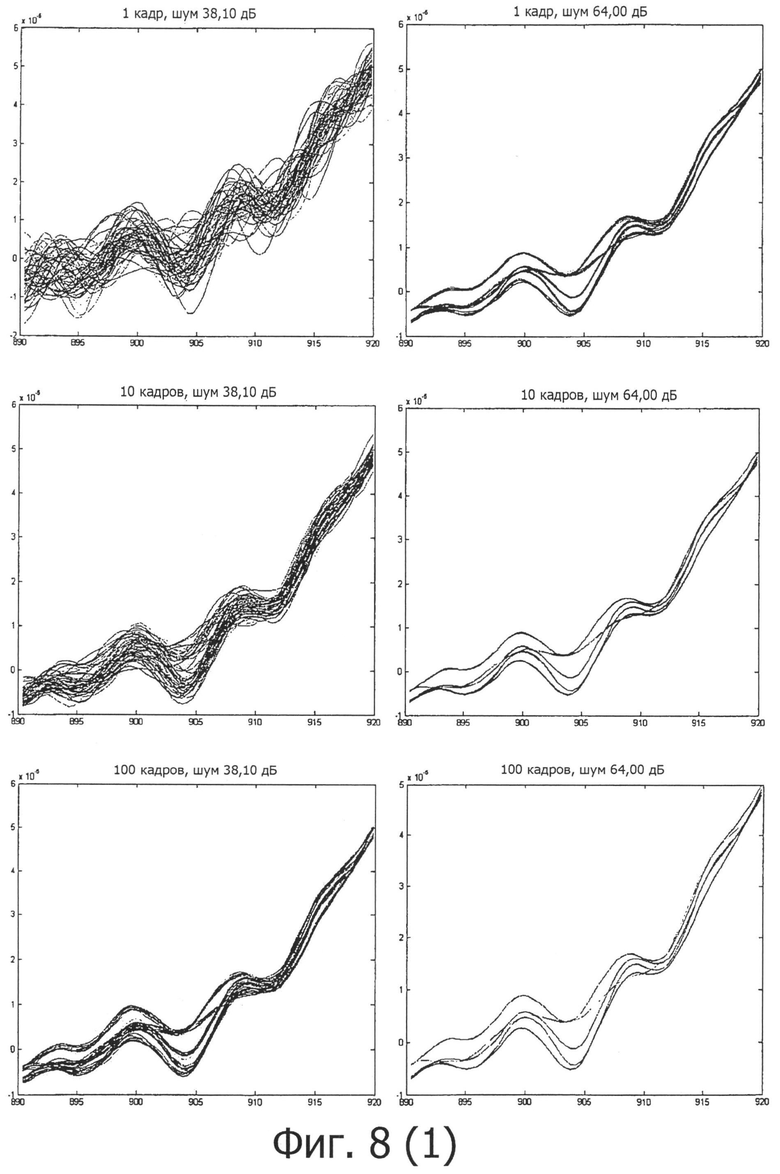
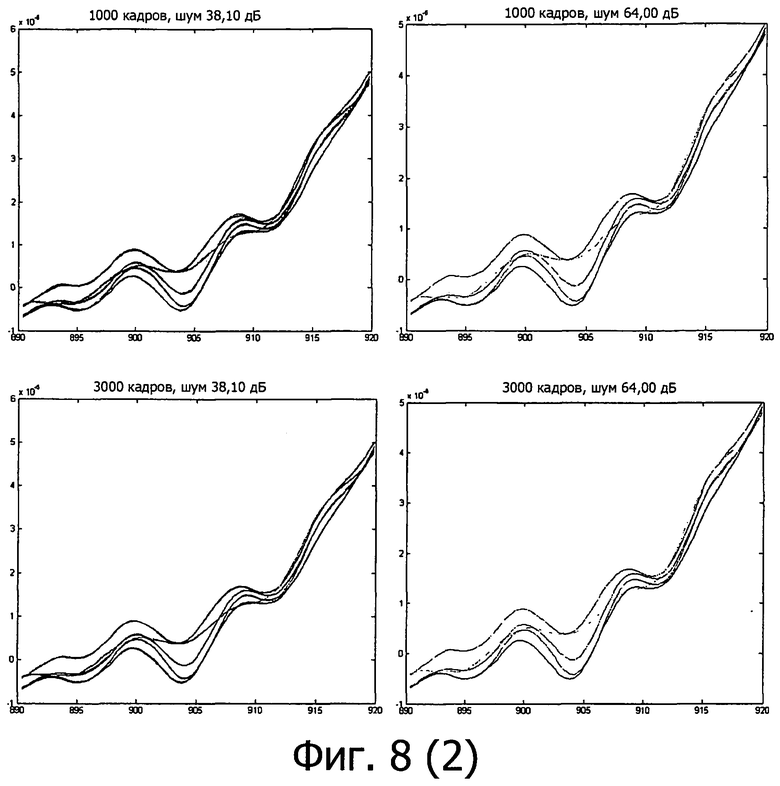
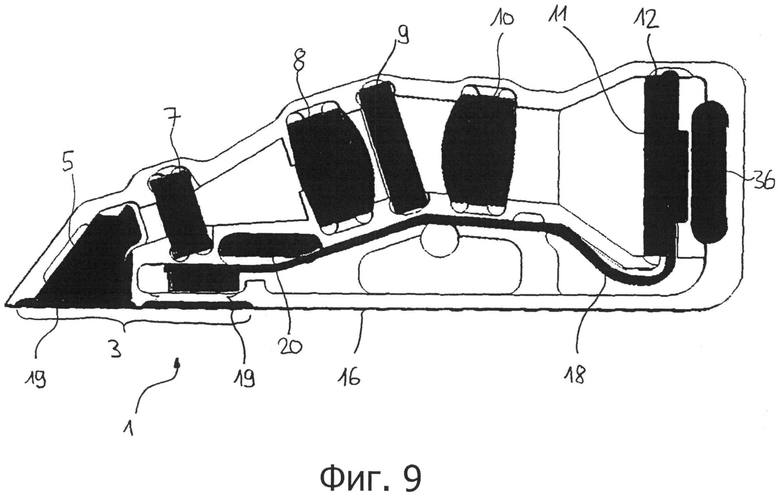
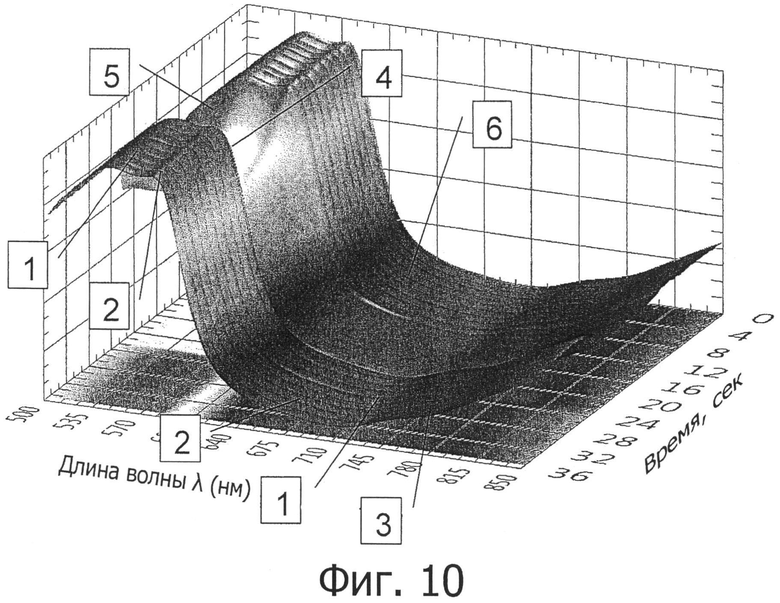

Группа изобретений относится к медицине. Устройство и способ для определения и мониторинга компонентов или свойств измеряемой среды, например значений физиологических показателей крови, используют источник света для генерации измерительного света в широком диапазоне длин волн и для освещения области измерения, а также средство для спектрального разложения анализируемого света, возвращающегося из области измерения. Устройство содержит также матрицу-датчик для регистрации разложенного в спектр света. Матрица-датчик, источник света и средство для спектрального разложения анализируемого света образуют компактную конструкцию, заключенную в корпус. Группа изобретений позволяет проводить анализы in vivo и с временным разрешением, причем в труднодоступных точках измерения. 3 н. и 22 з.п. ф-лы, 11 ил.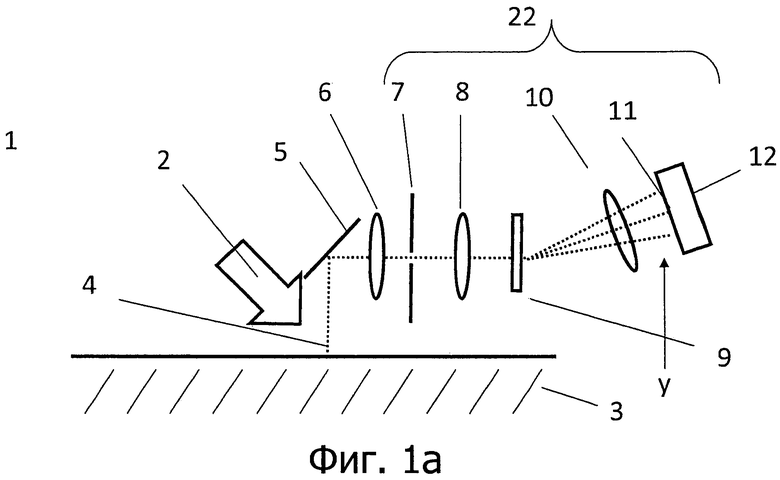
1. Устройство для определения и мониторинга значений физиологических показателей крови, содержащее:
по меньшей мере один источник света (20; 20а, 20b) для генерации света в широком диапазоне (2; 2а, 2b) длин волн для воздействия на область измерения (3; 3′, 3″), предпочтительно, содержащего, по меньшей мере, диапазон длин волн от 500 до 850 нм и/или от 800 до 1200 нм, в частности светоизлучающий диод;
средство для спектрального разложения анализируемого света (4), причем анализируемый свет (4) является отраженным светом по меньшей мере от одного места измерения (3; 3′, 3″) или светом, прошедшим через место измерения;
двумерную матрицу-датчик (11), в частности двумерную КМОП матрицу для регистрации разложенного в спектр анализируемого света (13), причем матрица-датчик размещена таким образом, что свет с разными длинами волн попадает на различные точки матрицы-датчика (11);
при этом устройство (1) имеет корпус (16) и выполнено в виде компактного блока, который включает в себя, по меньшей мере, источник света (20; 20а, 20b), средство для спектрального разложения света (9) и матрицу-датчик (11), причем двумерная матрица-датчик (11) расположена таким образом, что разложенный в спектр анализируемый свет падает на множество соседних строк двумерной матрицы-датчика (11), при этом устройство (1) содержит вычислительный блок, выполненный с возможностью суммирования спектров, полученных в соседних строках.
2. Устройство по п. 1, в котором корпус (16) выполнен с возможностью прикрепления на теле пациента, в частности на пальце или на мочке уха, или на трубке с измеряемой средой.
3. Устройство по п. 1, в котором средства для спектрального разложения содержат дифракционную решетку (9), в частности топографическую решетку.
4. Устройство по п. 1, характеризующееся тем, что устройство (1) содержит щелевую диафрагму (7), расположенную между областью входа анализируемого света (4) и средством (9) для спектрального разложения.
5. Устройство по п. 3, характеризующееся тем, что устройство (1) содержит щелевую диафрагму (7), расположенную между областью входа анализируемого света (4) и средством (9) для спектрального разложения.
6. Устройство по п. 4, в котором щелевая диафрагма (7) установлена относительно средства (9) для спектрального разложения света таким образом, что спектр раскладывается в направлении, отличном от направления удлиненного изображения, предпочтительно перпендикулярно.
7. Устройство по п. 5, в котором щелевая диафрагма (7) установлена относительно средства (9) для спектрального разложения света таким образом, что спектр раскладывается в направлении, отличном от направления удлиненного изображения, предпочтительно перпендикулярно.
8. Устройство по п. 1, характеризующееся тем, что содержит аналого-цифровой преобразователь.
9. Устройство по п. 8, характеризующееся тем, что содержит усилитель, который, предпочтительно, является параметризуемым.
10. Устройство по п. 1, характеризующееся тем, что содержит разъем для подключения электрического коммуникационного соединения (29), и, в частности, указанное устройство не имеет разъемов для подвода или отвода света.
11. Устройство по п. 1, характеризующееся тем, что выполнено с возможностью измерения в режимах пропускания и отражения.
12. Устройство по п. 1, характеризующееся тем, что устройство (1) содержит щелевую диафрагму (7), расположенную между областью входа анализируемого света (4) и средством (9) для спектрального разложения, при этом
щелевая диафрагма (7) установлена относительно средства (9) для спектрального разложения света таким образом, что спектр раскладывается в направлении, отличном от направления удлиненного изображения, предпочтительно перпендикулярно, и
устройство выполнено с возможностью измерения в режимах пропускания и отражения.
13. Устройство по п. 11 или 12, характеризующееся тем, что содержит вычислительный блок (26), выполненный с возможностью проводить попеременно измерение в режиме пропускания и измерение в режиме отражения, причем устройство содержит первый источник света для проведения измерения в режиме отражения при освещении первой области измерения (3′) и второй источник света (20b) для освещения второй области измерения (3″) для проведения измерения в режиме пропускания.
14. Устройство по п. 11 или 12, характеризующееся тем, что снабжено средством (17) для разделения анализируемого света (4), поступающего из области отражения (3′) и области пропускания (3″).
15. Устройство по любому из пп. 1-12, характеризующееся тем, что выполнено с возможностью сканирования с частотой более 50 Гц, с тем чтобы определять в измеренных значениях физиологических показателей крови компонент, связанный с тканью, и компонент, связанный с пульсом.
16. Устройство по любому из пп. 1-12, характеризующееся тем, что для указанного устройства предназначен предпочтительно внешний вычислительный блок (26, 30), при этом вычислительный блок выполнен с возможностью проведения измерений с временным разрешением.
17. Устройство по любому из пп. 1-12, характеризующееся тем, что для указанного устройства предназначен предпочтительно внешний вычислительный блок (26, 30), при этом вычислительный блок выполнен с возможностью определения второй производной зарегистрированных спектров и на основании этой второй производной, в частности, определять значения физиологических показателей крови.
18. Комбинация из внешнего вычислительного блока (32) и устройства по любому из пп. 1-17, в которой устройство (1) и вычислительный блок (32) соединены или соединимы между собой посредством кабеля связи (29).
19. Способ определения и мониторинга значений физиологических показателей крови живого существа, включающий следующие этапы, в частности, в сочетании с устройством по любому из пп. 1-17:
освещение, по меньшей мере, области измерения (3; 3′, 3″) светом (2; 2а, 2b) от источника света (20; 20а, 20b) с широким диапазоном длин волн,
сбор анализируемого света (4), возвращенного в режимах отражения и/или пропускания,
разложение в спектр собранного анализируемого света (4) и отображение отдельных зависимых от длины волны компонентов собранного анализируемого света (4) на двумерной матрице-датчике (11), в частности на двумерной CCD-камере для получения спектра,
оценка полученного спектра для определения компонентов или свойств измеряемой среды, в частности значений показателей крови,
при этом, в частности, предварительно к области измерения (3; 3′, 3″), в частности живого существа, прикрепляют корпус, который содержит источник света и матрицу-датчик, причем разложенный в спектр анализируемый свет попадает на множество соседних строк матрицы-датчика (11) и спектры, полученные из отдельных строк, суммируют.
20. Способ по п. 19, в котором анализируемый свет (4) разлагают в спектр с помощью дифракционной решетки (9).
21. Способ по п. 19, в котором анализируемый свет (4) регистрируют в режиме отражения и в режиме пропускания.
22. Способ по п. 20, в котором анализируемый свет (4) разлагают в спектр с помощью дифракционной решетки (9), причем анализируемый свет (4) регистрируют в режиме отражения и в режиме пропускания.
23. Способ по п. 19, в котором анализируемый свет (4) оценивают в режиме временного разрешения.
24. Способ по п. 19, в котором для определения значений физиологических показателей крови определяют вторую производную зарегистрированных спектров.
25. Способ по п. 19, в котором указанную оценку осуществляют с частотой более 50 Гц и определяют компонент измеренных значений физиологических показателей крови, связанный с тканью, и компонент, связанный с пульсом.
| US 5361758 A, 08.11.1994 | |||
| УСТРОЙСТВО ДЛЯ МОНИТОРИНГА ЖИДКОЙ БИОЛОГИЧЕСКОЙ СРЕДЫ | 1998 |
|
RU2161791C2 |
| US 2007216898 A1, 20.09.2007 | |||
| US 6315955 B1, 13.11.2001 | |||
| US 2005154277 A1, 14.07.2005 | |||
Авторы
Даты
2015-09-10—Публикация
2011-06-21—Подача