Изобретение относится к области фармацевтики и медицины, в частности, онкологии, и касается новых синергетических комбинаций ингибитора протеасом и витамина К для ингибирования роста и пролиферации опухолевых клеток, фармацевтических композиций и противоопухолевых лекарственных средств на ее основе. Изобретение может быть использовано для лечения гепатоклеточной карциномы, меланомы, карциномы молочной железы, карциномы щитовидной железы, множественной миеломы и др. злокачественных новообразований.
Ингибиторы протеасом относятся к лекарственным средствам, блокирующим протеазную активность протеасомы, которая является важной мишенью для терапевтических вмешательств при раковых, иммунных, аутоиммунных заболеваниях и многих других заболеваниях (Ротанова Т.В., Абрамова Е.Б., Шарова Н.П. От парадокса - к Нобелевской премии // Биологические мембраны, 2005, т.22, №2, с. 146-151).
Протеасома представляет собой мультипротеазный и мультисубъединичный белковый комплекс, присутствующий в ядре и в цитоплазме всех эукариотических клеток и катализирующий расщепление белков, участвующих в регуляции клеточных процессов. Установлено, что деградация 80-90% внутриклеточных белков происходит при участии протеасомы (Rock KL, Goldberg AL. Degradation of cell proteins and the generation of MHC class I-presented peptides // Annual Rev. Immunol., 1999, v.17, pp.739-779).
В протеасоме осуществляется прямой гидролиз клеточных белков посредством трех главных протеолитических активностей - химотрипсинподобной, трипсинподобной и постглутамилгидролазной (каспазаподобной). Описаны также две другие дополнительные протеолитические активности: активность BrAAP, которая расщепляет пептидные связи на карбоксильной стороне разветвленной цепи аминокислот, и активность SNAAP, которая расщепляет связи между небольшими нейтральными аминокислотами (Абрамова Е.Б., Шарова Н.П., Карпов В.Л. Протеасома: разрушать, чтобы жить // Мол. биол., 2002, т.36, №5, с. 761-776).
Протеасомная деградация белка в клетке является одним из важнейших процессов, необходимых для ее нормального функционирования. В злокачественных опухолях протеасомы несут дополнительную нагрузку, связанную с активной пролиферацией клеток и усиленным белковым обменом. Поэтому рост злокачественных опухолей, как правило, сопровождается увеличением содержания в них различных форм протеасом, что приводит к повышению протеолитических активностей (Sharova NP, Zakharova LA. Multiple forms of proteasomes and their role in tumor fate // Recent Patents on Endocrine, Metabolic & Immune Drug Discovery, 2008, v.2(3), pp.152-161; Шарова Н.П., Астахова T.M., Карпова Я.Д., Абатурова С.Б., Люпина Ю.В., Богомягкова Ю.В., Абрамова Е.Б., Ерохов П.А. Множественные формы протеасом как мишени противоопухолевых лекарств нового поколения // Онкохирургия, 2011, т.3, №2, с. 37-42). Показано, что в клетках асцитной карциномы Krebs II увеличено содержание конститутивных протеасом и повышена химотрипсинподобная активность по сравнению с контролем (Астахова Т.М., Шарова Н.П. Исключение иммунных протеасом из асцитной карциномы Krebs-II мыши // Известия РАН. Серия Биол., 2006, №3, с. 275-283). При росте карциномы щитовидной железы увеличивается содержание конститутивных и иммунных протеасом и повышаются химотрипсин- и каспазаподобная активности (Sharova NP, Astakhova ТМ, Karpova YaD, Lyupina YuV, Alekhin Al, Goncharov NG, Sumedi IR, Cherner VA, Rodoman GV, Kuznetsov NA, Erokhov PA. Changes in proteasome pool in human papillary thyroid carcinoma development. Cent. Eur. J. Biol., 2011, v. 6(4), pp.486-496; Шашова E.E., Астахова Т.М., Плеханова A.C., Богомягкова Ю.В., Люпина Ю.В., Сумеди И.Р., Слонимская Е.М., Ерохов П.А., Абрамова Е.Б., Родоман Г.В., Кузнецов Н.А., Кондакова И.В., Шарова Н.П., Чойнзонов Е.Л. Изменение химотрипсинподобной активности протеасом в развитии карцином молочной и щитовидной желез человека // Бюлл. Эксп. Биол. Мед., 2013, т. 155, №8, с. 209-211). Все это указывает на то, что протеасомы являются перспективными мишенями для противоопухолевой терапии.
Доказано, что ингибирование протеасом в клетках приводит к их апоптозу (Palombella VJ, Rando OJ, Goldberg AL, Maniatis ST. The ubiquitinproteasome pathway is required for processing the NF-kappa B1 precursor protein and the activation of NF-kappa В // Cell, 1994, v. 78, pp. 773-785).
Первым протеасомным ингибитором, одобренным в США в 2003 г. для клинического применения в онкологии, является противоопухолевый препарат Велкейд®, содержащий активный компонент бортезомиб в количестве 3,5 мг и вспомогательные вещества маннитол и азот. Препарат требует строгой дозировки и не рекомендуется для длительного применения. При превышении рекомендуемой дозы более чем в 2 раза наблюдается острое падение АД и тромбоцитопения со смертельным исходом (Регистр лекарственных средств России РЛС Аптекарь, М., РЛС-Медиа, 2009, с. 167-168).
Механизм противоопухолевого действия бортезомиба связан с подавлением функций протеасом за счет конкурентного ингибирования активных центров протеасом. В последние годы установлено, что ключевой мишенью в противоопухолевом действии бортезомиба является ингибирование химотрипсинподобной активности протеасом (Регистр лекарственных средств России РЛС Аптекарь, М, РЛС-Медиа, 2009, с. 167-168).
К настоящему времени препарат Велкейд® (бортезомиб), используется в клиниках более 50-ти стран для лечения множественной миеломы. За 10 лет применения этого лекарства выяснено, что применение бортезомиба в монотерапии множественной миеломы обычно сопровождается нежелательными побочными эффектами, включающими нарушение функций иммунной системы, желудочно-кишечного тракта, почек, вызывает сильную слабость и ухудшение общего состояния пациентов (Orlowski RZ, Kuhn DJ. Proteasome inhibitors in cancer therapy: lessons from the first decade // Clin. Cancer Res., 2008, v. 14(6), pp. 1649-1657). В связи с этим основным недостатком ингибитора протеасом бортезомиба является его высокая токсичность, обусловленная воздействием на тотальный пул протеасом всех органов, что приводит к необходимости ограничения доз, которые могут быть введены пациентам. Еще одним осложняющим фактором для успешного лечения рака с помощью ингибиторов протеасом является резистентность к бортезомибу, которая, как упомянуто выше, не может быть преодолена увеличением дозы по причине связанного с этим риска смертельного исхода.
Несмотря на это, поиск оптимальных путей повышения эффективности лечения рака и снижения побочных эффектов на фоне приема ингибитора протеасом крайне актуален, в связи с многофункциональностью протеасом и регуляцией ими всех клеточных процессов, в том числе в злокачественных опухолях.
В течение ряда последних лет предпринимались многочисленные попытки снижения токсичности и/или усиления противоопухолевого действия малотоксичных доз ингибиторов протеасом. Одним из таких подходов, используемых для решения данных задач, является объединение в одну комбинацию нескольких противоопухолевых лекарственных средств с различными механизмами индукции гибели раковых клеток.
К настоящему времени было разработано и обосновано применение большого числа фармацевтических комбинаций, содержащих ингибитор протеасом в комплексе с другими противоопухолевыми средствами.
Например, в международной заявке WO 2007098719 описаны фармацевтические комбинации для лечения и хемосенсибилизации опухолей, устойчивых к противораковым средствам, которые содержат ингибитор сайта фосфорилирования на субстратах СК2 (пептид Р15) в сочетании с традиционным цитостатическим средством и фармацевтически приемлемыми вспомогательными веществами. В одном из вариантов изобретения комбинация содержит в качестве цитостатического средства препарат Велкейд® (бортезомиб) (WO 2007098719, А61К 31/00, опубл. 07.09.2007).
В международной заявке WO 2009053038 описана фармацевтическая композиция, включающая антитела анти-CD20 типа II и ингибитор протеасом, а также один или более фармацевтически приемлемых носителей. Композиция предназначена для применения при лечении рака, экспрессирующего CD20 (WO 2009053038, А61К 31/00, опубл. 30.04.2009).
Из международной заявки WO 2010099601 известно, что композиция, содержащая ингибитор протеасом бортезомиб в комбинации с веществом 5AHQ (5-амино-8-гидроксихинолин), связывающим а-субъединицу 208-протеасомы, проявляет синергетическое противоопухолевое действие в отношении гематологических опухолей (WO 2010099601, А61К 31/47, опубл. 10.09.2010).
Из патента RU 2456990 известна синергетическая комбинация протеасомного ингибитора и ингибитора гистоновой деацетилазы для ингибирования роста и пролиферации опухолевых клеток, в которой протеасомным ингибитором является бортезомиб, а ингибитором гистоновой деацетилазы является соединение R306465 (Патент RU 2456990, А61К 31/506, опубл. 27.07.2012).
Известна также синергетическая противораковая комбинация, ингибирующая клеточную пролиферацию, включающая цитотоксический циклический депсипептид аплидин в сочетании с другим лекарственным средством, где вторым лекарственным средством является бортезомиб. Комбинация предназначена предпочтительно для лечения множественной миеломы (Патент RU 2481853, А61К 38/12, опубл. 20.05.2013).
Существенным недостатком известных синергетических комбинаций, содержащих бортезомиб, является использование в комбинации двух и более цитотоксических препаратов, каждый из которых обладает высоким токсическим действием, и поэтому такие комбинированные противоопухолевые препараты предполагают высокую токсичность для организма и не рекомендуются для длительного применения в виду неблагоприятных побочных реакций. Кроме того, недостатком всех известных аналогов является узкий спектр их противоопухолевого действия, охватывающего один-два типа опухолей.
Наиболее близким аналогом заявленной группы изобретений является синергетическая комбинация ингибитора протеасом бортезомиба с аналогам витамина К (плюмбагин) для ингибирования роста и пролиферации клеток множественной миеломы линии U266 in vitro, содержащая 20 нмоль/л бортезомиба и 2,5 мкмоль/л плюмбагина в качестве активных компонентов. Плюмбагин (5-гидрокси-2-метил-1,4-нафтохинон) выделен из корней аюрведического лекарственного растения Pumbago zeylanica и обладает самостоятельной противоопухолевой активностью, связанной с подавлением активационного сигнального пути STAT3. Согласно приведенным данным, плюмбагин в концентрации 2,5 мкМоль/л вызывает гибель 10% клеток, бортезомиб в концентрации 20 нМоль/л вызывает гибель 12% клеток. Совместно эти соединения вызывают гибель 40% клеток, проявляя синергетический цитотоксический эффект, при котором величина синергизма активных компонентов составляет 18% (Sandur SK, Pandey МК, Sung В, Aggarwal BD. 5-Hydroxy-2-methyl-1,4-naphthoquinone, a vitamin К3 analogue, suppresses STAT3 activation pathway through induction of protein tyrosine phosphatase, SHP-1: potential role in chemosensitization. Published OnlineFirst January 12, 2010; DOI: 10.1158/1541-7786.MCR-09-0257).
Однако известная комбинация характеризуется умеренной противоопухолевой активностью из-за незначительного синергетического потенцирования цитотоксического эффекта бортезомиба, что обусловлено действием плюмбагина на систему STAT3, очевидно, не столь критичную для выживания, по сравнению с системой протеасом, при индукции гибели опухолевых клеток. Существенным недостатком известной комбинации являются также ограниченный спектр цитотоксического действия, направленный только против опухолевых клеток множественной миеломы. К тому же соотношение компонентов и применение аналога витамина К плюмбагина в известной комбинации не позволяют обеспечить противоопухолевую эффективность для лечения резистентных к бортезомибу форм опухолей, требующих гораздо более высоких доз для преодоления лекарственной устойчивости к бортезомибу. Кроме того, наличие в составе известной комбинации труднодоступного компонента - плюмбагина, выделенного из редкого тропического растения, существенно ограничивает ее применение при промышленном производстве противоопухолевых лекарственных средств.
Задачей, на решение которой направлена заявленная группа изобретений, является разработка более эффективных и безопасных синергетических комбинаций активных веществ, композиций и лекарственных средств на основе ингибитора протеасом бортезомиба, обладающих улучшенным профилем противоопухолевого действия, в том числе более высокой цитотоксической активностью в отношении широкого круга опухолевых клеток, включая опухоли, устойчивые к бортезомибу, и имеющих меньшую степень токсичности в сравнении с бортезомибом, применяемым отдельно или в комбинации с другими лекарственными средствами.
Данная задача решается тем, что в качестве активных веществ фармацевтических композиций и лекарственных средств противоопухолевого действия, предложена новая комбинация ингибитора протеасом бортезомиба с аналогом витамина К - соединением 2,3-дигидро-2-метил-1,4-нафтохинон-2-сульфонатом натрия, содержащая упомянутые активные компоненты в терапевтически эффективных количествах согласно изобретению.
При создании изобретения было установлено, что сочетание этих двух активных компонентов в комбинации в соответствии с изобретением позволяет значительно усилить желательные противоопухолевые эффекты бортезомиба и одновременно с этим существенно снизить токсичность бортезомиба, обеспечивая применение последнего в широком диапазоне терапевтических дозировок и с минимизированной токсичностью.
В отличие от плюмбагина, входящего в состав комбинации-прототипа, соединение 2,3-дигидро-2-метил-1,4-нафтохинон-2-сульфонат натрия (далее именуемое в контексте описания как ДМНСН) в заявленных терапевтически эффективных количествах какой-либо значимой самостоятельной антипролиферативной активностью не обладает. Неожиданно оказалось, что ДМНСН в комбинации с бортезомибом по изобретению обеспечивает значительно более сильный синергетический противоопухолевый эффект, превосходящий в количественном отношении синергетический эффект ближайшего аналога в 3 раза.
Технические результаты заявленной группы изобретений заключаются в обеспечении неожиданных синергетических эффектов на гибель злокачественных клеток различного вида опухолей, в том числе и при формах, резистентных к бортезомибу, с одновременным снижением токсичности основного противоопухолевого агента бортезомиба за счет качественного и количественного состава комбинации активных веществ по изобретению. В частности, заявленной группой изобретений обеспечивается синергетическое усиление ингибирующей способности бортезомиба подавлять химотрипсинподобную активность протеасом, синергетическое повышение антипролиферативной цитотоксической активности в условиях in vitro; синергетическое усиление подавления роста и изменения объема различных видов опухолей в условиях in vivo и тем самым расширение спектра противоопухолевой активности; повышение чувствительности резистентных форм опухолей к цитотоксическому действию бортезомиба, снижение токсичности бортезомиба даже в случае использования высоких доз, одновременное снижение токсичности и проявление более выраженного противоопухолевого эффекта по сравнению с действием отдельно взятого ингибитора протеасом.
Изобретение основано на открытии того, что способность противоопухолевого агента - ингибитора протеасом бортезомиба угнетать активность протеасом существенно усиливается в сочетании с ДМНСН и одновременно с этим неожиданно снижается токсичность бортезомиба, даже в случае превышения предельно допустимой дозы бортезомиба в комбинации. Так, при усилении ингибирующего действия бортезомиба на химотрипсинподобную активность протеасом в 2 раза его токсичность снижается в 4-14 раз.
Токсический эффект бортезомиба обусловлен его воздействием на тотальный пул протеасом здоровых клеток, поэтому снижение токсичности бортезомиба в комбинациях по изобретению, вероятно, объясняется тем, что повышается специфичность действия ингибитора протеасом по отношению к опухолевым клеткам и в меньшей степени затрагиваются протеасомы в нормальных клетках здоровых тканей.
Благодаря этим неожиданным и удивительным свойствам, комбинация бортезомиба с ДМНСН имеет большие преимущества по сравнению с синергетическими комбинациями бортезомиба с другими активными веществами известного уровня техники, поскольку интервал используемых доз бортезомиба в комбинации с ДМНСН может изменяться в широком диапазоне в зависимости от тяжести заболевания, возраста и относительного состояния здоровья пациента. Полученные экспериментальные данные показывают, что заявленная синергетическая комбинация бортезомиба с ДМНСН обеспечивает не только более высокую противоопухолевую активность в тех даже дозах, которые являются неэффективными в случае индивидуального использования бортезомиба, но и неожиданно приводит к значительному снижению токсичности даже в случае превышения предельно допустимой дозы бортезомиба, что может быть существенным при лечении резистентных типов опухолей или для тяжелых случаев онкологических заболеваний.
Сущность изобретения заключается в следующем.
Предложена группа изобретений, объединенная единым изобретательским замыслом.
Синергетическая комбинация для ингибирования роста и пролиферации опухолевых клеток содержит бортезомиб и аналог витамина К в качестве активных компонентов и отличается тем, что из аналогов витамина К она содержит 2,3-дигидро-2-метил-1,4-нафтохинон-2-сульфонат натрия, при этом терапевтически эффективные количества активных веществ составляют от 0,05 до 10 мг бортезомиба и от 2 до 100 мг аналога витамина К.
Комбинация активных веществ в соответствии с изобретением предназначена для изготовления фармацевтических композиций и противоопухолевых лекарственных средств.
Термин "терапевтически эффективное количество", используемый в настоящем описании, означает количество каждого из активных компонентов в комбинации, при котором повышается эффективность противоопухолевого действия и снижается токсичность бортезомиба в комбинации по изобретению в сравнении с отдельно взятым бортезомибом.
Активные компоненты, составляющие комбинацию по изобретению, известны из предшествующего уровня техники.
Бортезомиб (химическое название [(1R)-3-Метил-1-[[(2S)-1-оксо-3-фенил-2-[(пиразинилкарбонил)амино]пропил]амино]бутил]бороновая кислота) представляет собой производное дипептидилбороновой кислоты и является обратимым ингибитором химотрипсинподобной активности протеасомы 26S в клетках млекопитающих. Бортезомиб может быть синтезирован способами, известными в данной области, например, такими как описаны в патентных публикациях WO 9613266, US 5780454, US 6066730 или способами, аналогичными этим.
Соединение 2,3-дигидро-2-метил-1,4-нафтохинон-2-сульфонат натрия (фармакопейное название: викасол; международное непатентованное наименование: менадиона натрия бисульфит) представляет собой синтетический водорастворимый аналог витамина К, который широко применяется в медицинской практике в качестве кровеостанавливающего средства (Машковский М.Д., Лекарственные средства, часть 2, Кишинев, изд. Картя Молдовеняскэ, 1990, с. 34-36).
В международной заявке WO 0191740 описано новое применение фармацевтически приемлемых нафтохинонов, в частности, менадиона (химическое название: 2 метил-1,4-нафтохинона) для улучшения противоопухолевого эффекта антипролиферативного агента. Согласно приведенным экспериментальным данным, менадион в количестве 700 мг в комбинации с цисплатином обладает умеренным синергетическим антипролиферативным действием, вызывая задержку роста опухоли в 1,2 раза более эффективную по сравнению с цисплантином, взятым отдельно.
Однако из уровня техники не известна комбинация бортезомиба и ДМНСН (менадиона натрия бисульфит) в терапевтически эффективных количествах согласно изобретению, и было неочевидно, что такая комбинация активных веществ способна обеспечить в количественной мере значительно более сильный синергетический противоопухолевый эффект в отношении широкого круга опухолевых клеток, включая опухоли, устойчивые к бортезомибу, по сравнению с аналогами, входящими в уровень техники, при одновременном существенном снижении токсичности, даже в случае превышения предельно допустимой дозы бортезомиба в комбинации.
Объектом изобретения также является фармацевтическая композиция противоопухолевого действия, содержащая качестве активных веществ комбинацию бортезомиба и аналога витамина К, и отличающаяся тем, что содержит комбинацию бортезомиба и 2,3-дигидро-2-метил-1,4-нафтохинон-2-сульфонат натрия в терапевтически эффективных количествах, как определено выше, и, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество.
В качестве фармацевтически приемлемых вспомогательных веществ в составе фармацевтической композиции согласно изобретению могут быть использованы любые фармацевтически приемлемые компоненты, которые совместимы с активными ингредиентами и не наносят вреда пациентам. Подходящие вспомогательные вещества хорошо известны специалистам в данной области и выбираются в соответствии с требуемой фармацевтической формой и способом введения из традиционно используемых для приготовления лекарственных форм, например, такие как, наполнители, связующие агенты, гранулирующие агенты, солюбилизирующие агенты, средства для скольжения, стабилизаторы, разбавители, адъюванты, консерванты, компоненты буферных систем, растворители, диспергирующие агенты, смазывающие агенты, вкусовые добавки, загустители, пищевые красители, эмульгаторы, регуляторы пролонгированной доставки и т.п.
Фармацевтически приемлемыми вспомогательными веществами являются, например, лактоза, инозит, глюкоза, маннит, декстран, циклодекстрин, сорбит, крахмал и его модификации, сахароза, алюмосиликат магния, синтетический алюмосиликат, кристаллическая целлюлоза, карбоксиметилцеллюлоза натрия, гидроксипропилированный крахмал, карбоксиметилцеллюлоза кальция, ионообменные смолы, метилцеллюлоза, желатин, гуммиарабик, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон, поливиниловый спирт, альгиновая кислота, альгинат натрия, безводная кремниевая кислота, стеарат магния, тальк, карбоксивиниловый полимер, оксид титана, эфир жирной кислоты и сорбита, натрия лаурилсульфат, глицерин, глицериновый эфир жирной кислоты, ланолин, глицерожелатин, полисорбат, макроголь, растительное масло, воск, парафины, пропиленгликоль, полиэтиленгликоль, вода, этанол, полиспирты, полиоксиэтиленгидрированное касторовое масло, хлорид натрия, гидроксид натрия, соляная кислота, двухосновный фосфат натрия, моноосновный фосфат натрия, лимонная кислота, глутаминовая кислота, бензиловый спирт, метил п-оксибензоат, этил п-оксибензоат и тому подобное.
Фармацевтические композиции по настоящему изобретению могут быть выполнены в виде пероральной формы введения, например, в форме таблеток, гранул, шариков, порошков, капсул, суспензий, сиропов, эмульсий и т.д.; в инъекционной форме; суппозиторий для ректального или вагинального введения; аэрозоли, спрея, трансдермальных, интраназальных, интраокулярных форм введения и т.п. Твердые формы фармацевтических композиций для перорального применения и растворы для инъекций являются предпочтительными.
Фармацевтические композиции могут быть приготовлены любым известным способом в данной области, используя одно или несколько фармацевтически приемлемых вспомогательных веществ. Например, при производстве таблеток активный ингредиент смешивают с традиционными таблетирующими ингредиентами, такими как наполнители, связывающие агенты, разрыхлители, гранулирующие агенты, смазывающие агенты и средства для скольжения, с последующим прессованием полученной смеси в таблетировочной машине. В качестве наполнителей и разрыхлителей могут быть использованы лактоза, цитрат натрия, карбонат кальция и дикальций фосфат и т.п.; связующих агентов - крахмал или его производные, желатин, глюкоза, лактоза, натуральные или синтетические камеди, такие как аравийская камедь, трагакант или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воск, натрий лаурилсульфат, тальк и т.п. Смазывающие вещества, используемые в этих лекарственных формах, включают, без ограничения, олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. При желании, таблетки можно покрыть сахарной, желатиновой, пленочной или кишечной оболочками посредством стандартных способов, например, таблетка может включать внутреннее ядро, содержащее активный ингредиент, и внешний слой в виде оболочки, покрывающей ядро. Внешняя оболочка может служить для защиты от распадаемости в желудке, что позволит внутреннему ядру проходить интактным в двенадцатиперстную кишку и медленно высвобождаться. Для образования подобных защитных слоев или оболочек можно использовать разнообразные вещества, включая ряд полимерных кислот и смеси полимерных кислот с обычными веществами, такими как щеллак, цетиловый спирт и ацетат целлюлозы. Для улучшения вкуса пероральной формы можно добавить подсластители и ароматизаторы.
Фармацевтическая композиция в форме капсул может быть приготовлена смешиванием активного ингредиента с наполнителями, такими, как, например, сорбит или лактоза, и расфасовыванием полученной смеси в капсулы.
Фармацевтическая композиция в форме пероральных микстур, эликсиров или сиропов может содержать в качестве фармацевтически приемлемых вспомогательных веществ воду, полиолы, сахарозу, инвертированный сахар, глюкозу, пищевые масла, например, масло семян хлопчатника, кунжутное масло, кокосовое масло или арахисовое масло, пищевые ароматизаторы, красители и т.п. Микстуры, эликсиры или сиропы могут дополнительно содержать суспендирующие вещества и загустители, такие как, синтетические и натуральные камеди (трагакант, аравийская камедь), альгинат, декстран, натриевая соль карбоксиметилцеллюлозы, желатин, глицерин, метилцеллюлоза или поливинилпирролидон, или консерванты, например, гидроксибензоаты.
Фармацевтическая композиция в форме для инъекций может быть получена растворением активного ингредиента и возможных вспомогательных добавок в части растворителя для инъекций, предпочтительно в стерильной воде, доведением полученного раствора до требуемого объема, в случае необходимости, добавлением буферного агента, регулирующего pH, солюбилизатора, стабилизатора или антисептика, стерилизацией полученного раствора и заполнением им подходящих ампул или емкостей. В качестве растворителя могут использоваться физиологический раствор, спирты, полиолы, гликолевые эфиры, например, полиоксиэтиленсорбитан, монолаурат, моноолеат или моностеарат, глицерин, растительные масла и т.п.
Фармацевтически приемлемыми вспомогательными веществами при получении фармацевтической композиции в форме суппозиториев являются, например, природные или отвержденные масла, например, масло какао, воска, жиры, эфир глицерина и насыщенной жирной кислоты, глицерожелатин, макрогол, полужидкие или жидкие полиолы, триглицериды и т.п. Основа суппозиториев может включать также поверхностно-активное вещество или стабилизатор.
Композиция по изобретению может содержать также такие компоненты, которые обеспечат быстрое продолжительное или замедленное высвобождение активного ингредиента после приема пациентами. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например моностеарат алюминия и желатин.
Еще одним объектом изобретения является противоопухолевое лекарственное средство, содержащее в качестве активных веществ комбинацию бортезомиба и аналога витамина К, и отличающееся тем, из аналогов витамина К оно содержит 2,3-дигидро-2-метил-1,4-нафтохинон-2-сульфонат натрия и, по крайней мере, одно фармацевтически приемлемое вспомогательное вещество при следующем соотношении компонентов (в масс. %):
Количество активных веществ, содержащихся в лекарственном средстве, может составлять от 0,05 до 10 мг ингибитора протеасом бортезомиба и от 2 до 100 мг аналога витамина К 2,3-дигидро-2-метил-1,4-нафтохинон-2-сульфоната натрия.
В качестве фармацевтически приемлемых вспомогательных веществ в составе лекарственного средства согласно изобретения могут быть использованы любые фармацевтически приемлемые компоненты, которые традиционно используются для приготовления лекарственных форм, как определено выше.
Процентное содержание активных и вспомогательных веществ в единичной лекарственной форме может варьировать в вышеуказанном диапазоне так, чтобы получалась подходящая дозировка. Терапевтически эффективное количество активных веществ зависит от нескольких факторов, включая путь введения, продолжительность лечения, тяжесть заболевания, состояние пациента, его реакцию на лечение и т.п. В некоторых вариантах осуществления изобретения дозировка основного противоопухолевого агента бортезомиба в комбинации активных веществ, содержащаяся в единичной лекарственной форме, может быть значительно более низкой, чем дозировка обычно используемая при монотерапии бортезомибом. В некоторых вариантах осуществления используют высокие дозы бортезомиба в единичной лекарственной форме в сравнении с количеством, обычно используемом для монотерапии.
В предпочтительном варианте противоопухолевое лекарственное средство настоящего изобретения может быть приготовлено в виде растворов или лиофилизированных порошков для парентерального введения. Перед использованием лиофилизаты могут быть воссозданы путем добавления подходящего разбавителя или иного фармацевтически приемлемого носителя. Данный жидкий препарат обычно представляет собой забуференный изотонический водный раствор. Примеры подходящих разбавителей представляют собой изотонический физиологический раствор, стандартная 5%-ная декстроза в воде, раствор, забуференный ацетатом натрия или ацетатом аммония и т.п.
Противоопухолевая активность и общетоксическое действие комбинации активных веществ, фармацевтических композиций и противоопухолевого лекарственного средства настоящего изобретения были определены с использованием тестов, принятых для оценки новых фармакологических веществ (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под ред. Р.У. Хабриева. - 2-изд., перераб. и доп. - М.: ОАО "Издательство "Медицина", 2005).
Противоопухолевая активность фармацевтических композиций и лекарственных средств, включающих в себя комбинации активных веществ по настоящему изобретению, продемонстрирована посредством описанных ниже примеров на нескольких экспериментальных моделях опухолей in vivo и in vitro. Полученные экспериментальные данные свидетельствуют, что эффективность терапевтического действия фармацевтических композиций и лекарственного средства по изобретению существенно превышает действие отдельно взятого ингибитора протеасом, причем эффективные концентрации ингибитора протеасом в комбинации с витамином К в 4-10 раз уменьшаются по сравнению с эффективной дозой, когда ингибитор протеасом используется отдельно. Альтернативно фармацевтические композиции и лекарственные средства по настоящему изобретению могут также обеспечивать максимальную терапевтическую эффективность при высоких дозах ингибитора протеасом. Такие комбинации особенно пригодны для лечения больных с неблагоприятным прогнозом, которые не реагируют на лечение бортезомибом в стандартной терапевтической дозе. Конкретный уровень терапевтически эффективной дозы для конкретного пациента может варьировать в обеспечивающем эффективность диапазоне в зависимости от возраста, веса тела пациента, тяжести заболевания, вида опухоли, способа введения и других известных факторов.
Кроме того, более выраженный противоопухолевый эффект фармацевтических композиций и лекарственного средства по изобретению сопровождается более низким уровнем токсичности, что позволит исключить возможность проявления отрицательных побочных эффектов у пациента.
Фармацевтические композиции и лекарственные средства по изобретению применимы для лечения широкого спектра онкологических заболеваний, в т.ч. множественной миеломы, рака молочной железы, рака печени, рака щитовидной железы, меланомы и других злокачественных новообразований.
Изобретение иллюстрируется, но не ограничивается следующими примерами.
Пример 1. Составы комбинаций, фармацевтических композиций и противоопухолевого средства по изобретению
Приготовление комбинаций активных веществ по изобретению, соответствующих терапевтически эффективным количествам бортезомиба, выбранным из диапазона от 0,05 до 10 мг, и терапевтически эффективным количествам ДМНСН, выбранным из диапазона от 2 до 100 мг, проводят в два этапа. Соответствующие навески активных веществ независимо друг от друга растворяют при перемешивании в отмеренном объеме растворителя для инъекций, например, физиологическом растворе хлорида натрия с таким расчетом, чтобы обеспечить их финальную дозировку в единичной лекарственной форме (на 5 л крови) в указанном диапазоне терапевтически эффективных количеств.
(1) Например, если терапевтически эффективное количество бортезомиба должно составлять в комбинации 0,9 мг (на 5 л кровотока человека), что соответствует концентрации 0,18 мкг/мл, то навеску бортезомиба (180 мкг), соответствующую рассчитанному для работы конечному объему раствора (1000 мл), растворяют в немного меньшем объеме (950 мл) физиологического раствора хлорида натрия (0,9%) при перемешивании.
(2) Если терапевтически эффективное количество ДМНСН должно составлять в комбинации 33 мг (на 5 л кровотока человека), что соответствует концентрации 6,6 мкг/мл, то навеску ДМНСН (6600 мкг или 6,6 мг), соответствующую заданному конечному объему раствора (1000 мл), растворяют в полученном на этапе (1) растворе при перемешивании. Затем доводят объем до 1000 мл физиологическим раствором хлорида натрия при перемешивании.
Полученную комбинацию активных веществ преобразуют в соответствующую фармацевтическую композицию или лекарственную форму путем добавления вспомогательных веществ.
Альтернативно, при изготовлении фармацевтических композиций и лекарственных форм навески любого из активных веществ и вспомогательные вещества могут быть предварительно смешаны и затем растворены в смеси.
Например, раствор для инъекций получают следующим образом:
Навески с расчетным количеством ДМНСН и маннитола (вспомогательное вещество) загружают в колбу и добавляют отмеренный объем воды инъекционной. Перемешивают смесь до полного растворения ингредиентов. Полученный раствор стерилизуют путем фильтрации через предварительный и стерилизующий фильтры.
Далее к раствору добавляют навеску стерильного бортезомиба (ингибитор протеасом), перемешивают до гомогенизации и раствор полученной композиции вновь стерилизуют.
В машину розлива и укупорки загружают стерильные флаконы и наполняют стерильным раствором полученной композиции. Флаконы неплотно закрывают резиновыми крышками и лиофилизируют. После лиофилизации производят укупоривание флаконов при помощи гидравлического устройства путем вдавливания насаженной резиновой пробки в горлышко флакона.
Флаконы с лиофилизированным продуктом закрывают металлическими колпачками, обвальцовывают и направляют на контроль. Далее флаконы с полученным противоопухолевым лекарственным веществом маркируют и упаковывают.
Перед применением лиофилизированный продукт растворяют с использованием стерильной воды для инъекций, физиологического раствора хлорида натрия (0,9%) или любого другого фармацевтически приемлемого разбавителя.


Пример 2. Синергетическое действие комбинаций по изобретению на ингибирование пролиферации и гибель клеток in vitro
Влияние полученных по примеру 1 комбинаций на ингибирование пролиферации и гибель клеток (цитотоксичность) изучают на модели клеточной линии НЕК 293 Т с использованием МТТ-теста.
МТТ-тест основан на способности дегидрогеназ живых клеток конвертировать бесцветный водорастворимый 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолиум бромид (МТТ) в голубые кристаллы формазана, растворимые в диметилсульфоксиде или других растворителях. Реакция происходит только в живых клетках, поэтому величина оптической плотности (ОП) раствора формазана характеризует количество выживших клеток после воздействия исследуемыми препаратами, что позволяет рассчитать процент ингибирования роста и гибели клеток после такого воздействия и тем самым оценить антипролиферативную цитотоксическую активность исследуемых препаратов.
В качестве препарата сравнения используют противоопухолевый препарат Велкейд® (производства фирмы Янссен-Силаг), содержащий бортезомиб в стандартной терапевтической дозе 3,5 мг, что соответствует концентрации 0,7 мкг/мл в растворе.
В качестве контроля используют среду для клеток без добавления исследуемых препаратов.
Для постановки ММТ-теста клетки линии НЕК 293 Т рассевают на 96 луночный планшеты в количествах 25000, 12500, 6250 в лунку в объеме 200 мкл. Через 24 часа культуральную среду клеток заменяют на среду с исследуемыми препаратами: комбинациями бортезомиба и ДМНСН в различных концентрациях, выбранных из заявленного диапазона терапевтически эффективных количеств; либо отдельно взятыми бортезомибом и ДМНСН в тех же концентрациях, что и в исследуемых комбинациях; либо препаратом сравнения Велкейд®; либо культуральную среду без активных веществ (контроль). При этом для удобства эксперимента концентрации исследуемых активных агентов в среде рассчитывают в мкг/мл исходя из количеств (терапевтической дозы) этих агентов в готовой лекарственной форме препарата (рассчитанных в мг и соответствующих 5 л кровотока человека). Опыт ставят в трипликатах.
Еще через 24 часа в каждую лунку добавляют по 20 мкл МТТ (Sigma, Germany) (конц. 5 мг/мл) и инкубируют 4 ч в СО2 инкубаторе при 37°C. Затем отбирают среду, добавляют 100 мкл изопропанола в каждую лунку и инкубируют 5 мин при комнатной температуре для экстракции образовавшегося формазана.
Далее в лунках измеряют оптическую плотность при 550 нм (поглощение формазана) и рефренсной длине волны 620 нм (фон клеток), используя микропланшетный фотометр Anthos 2020 (Biochrom, UK).
Среднее значение оптической плотности образца (X) рассчитывают по формуле:
{X=среднее значение ОП550 нм образца - среднее значение ОП620 нм образца - (среднее значение ОП550 нм отрицательного контроля - среднее значение ОП620 нм отрицательного контроля)},
где ОП550 нм - оптическая плотность при 550 нм, ОП620 нм -оптическая плотность при 620 нм, отрицательный контроль - среда без клеток.
Затем рассчитывают, насколько в процентном выражении среднее значение оптической плотности образца меньше, чем среднее значение оптической плотности контроля (клетки без добавления препаратов). Этот подход позволяет вычислить долю погибших клеток.
Результаты определения антипролиферативной цитотоксической активности исследуемых препаратов представляют как количество погибших клеток в % по отношению к контролю (контроль принимают за 100%).
Антипролиферативную цитотоксическую активность комбинаций по изобретению сравнивают с цитотоксичностью бортезомиба и ДМНСН, взятых по отдельности в соответствующих концентрациях, а также с препаратом Велкейд®.
Синергетические эффекты антипролиферативного цитотоксического действия комбинаций по изобретению оценивают по увеличению количества погибших клеток (%) после обработки клеток линии НЕК 293 Т исследуемыми комбинациями по сравнению с суммарным действием отдельно взятых компонентов в тех же концентрациях, используя в качестве количественного показателя величину синергизма (ΔСц). Показатель ΔСц определяют как арифметическую разницу между значениями количества клеток, погибших под действием комбинаций по изобретению, и суммой значений количества клеток, погибших под действием отдельно взятых компонентов в тех же концентрациях.
Результаты исследований суммированы в табл. 2.
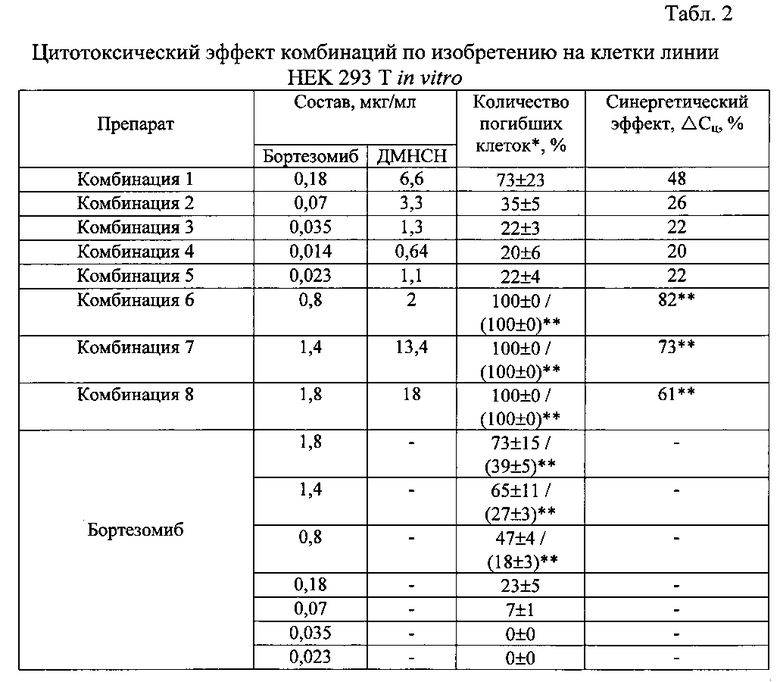

Полученные результаты указывают на то, что противоопухолевая активность ингибитора протеасом бортезомиба in vitro, проявляющаяся в индуцировании апоптоза клеток линии НЕК 293 Т, существенно усиливается при добавлении ДМНСН. Эффективность сочетанного противоопухолевого действия ингибитора протеасом с ДМНСН в комбинации 1 превышает действие отдельно взятого ингибитора протеасом в составе препарата сравнения Велкейд® в два раза. При этом комбинация 1 содержит в 4 раза меньше бортезомиба (0,18 мкг/мл), чем препарат сравнения Велкейд® (0,7 мкг/мл). Комбинация 2, содержащая в 10 раз меньше бортезомиба (0,07 мкг/мл), чем препарат сравнения Велкейд® (0,7 мкг/мл), оказывает противоопухолевое действие, соизмеримое с препаратом сравнения.
Результаты проведенного исследования свидетельствуют о более высокой эффективности комбинаций по изобретению по сравнению с отдельно взятым бортезомибом и противоопухолевым препаратом Велкейд®. Как видно из табл. 2, комбинации бортезомиба с ДМНСН согласно настоящему изобретению обеспечивают усиленное антипролиферативное цитотоксическое действие благодаря выраженному синергетическому эффекту, превышающему действие отдельно взятого бортезомиба на 20-82%. При этом ДМНСН в заявленном диапазоне терапевтически эффективных концентраций значимой цитотоксической активностью не обладает.
Так, сочетанное действие бортезомиба с ДМНСН в комбинации 1 превышает действие отдельно взятого бортезомиба на 50% и вызывает гибель 73% клеток в течение 24 часов. Комбинация 2 превышает цитотоксическое действие отдельно взятого бортезомиба на 28%, вызывая гибель 35% клеток. Величина синергизма (ΔСц) для комбинаций 1 и 2 характеризуется значениями 48% и 26%.
Комбинации 3-5, содержащие бортезомиб в сверхмалых дозах по сравнению со стандартной терапевтической дозой (0,7 мкг/мл), вызывают гибель 20-22% клеток через 24 ч после начала воздействия, при этом ни бортезомиб, ни ДМНСН сами по себе в тех же концентрациях антипролиферативного цитотоксического действия на клетки линии НЕК 293Т не оказывают.
Величина синергизма (ΔСц) для комбинаций 6-8, содержащих бортезомиб в высоких дозах, составляет 61-82%. Следует отметить, что под действием этих комбинаций происходит полная гибель клеток уже через 4 часа после начала воздействия. В связи с этим расчет показателя ΔСц для комбинаций 6-8 проводили исходя из количества клеток, погибших через 4 часа после начала воздействия.
Пример 3. Сравнительная оценка синергетической антипролиферативной активности комбинаций по изобретению и ближайшего аналога
Антипролиферативную активность комбинаций бортезомиба с ДМНСН по изобретению исследуют в ММТ-тесте in vitro в отношении клеточной линии множественной миеломы U266, т.е на такой же экспериментальной модели, которая использовалась в ближайшем аналоге. Эксперименты и оценку результатов проводят так, как описано в примере 2.
Синергетические эффекты антипролиферативного цитотоксического действия комбинаций по изобретению и комбинации-прототипа оценивают по увеличению количества погибших клеток (%) после обработки клеток линии U266 исследуемыми комбинациями по сравнению с действием отдельно взятых компонентов в тех же концентрациях, используя в качестве количественного показателя величину синергизма (ΔСц). Результаты суммированы в табл. 3.
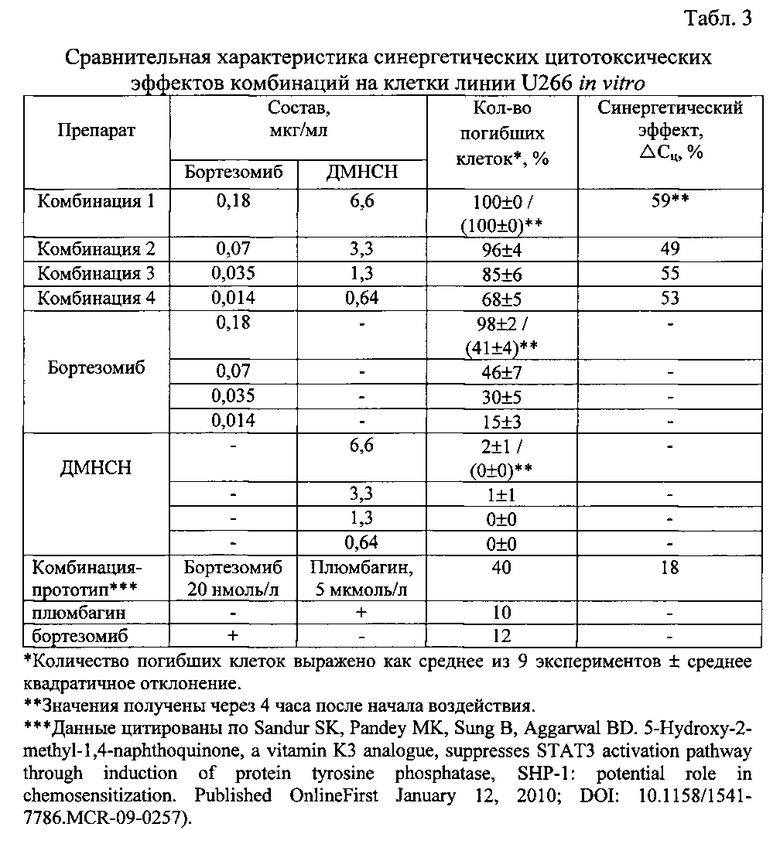
Как видно их табл. 3, комбинации по изобретению позволяют достичь более значительный синергетический цитотоксический эффект, чем комбинация-прототип.
Так, сочетанное применение бортезомиба с плюмбагином в комбинации-прототипе дает увеличение цитотоксического эффекта по сравнению с суммой эффектов каждого компонента комбинации на 18% (величина синергизма ΔСц) через 24 ч после начала воздействия на клетки линии U266, при этом сам по себе плюмбагин вызывает 10%-ную гибель клеток, а бортезомиб - 12%-ную гибель клеток.
Комбинация 1 по изобретению вызывает полную гибель клеток уже через 4 часа, при этом величина синергизма компонентов комбинации 1 (ΔСц) составляет 59% через 4 ч после начала воздействия на клетки линии U266.
Комбинация 2 вызывает гибель 96% клеток через 24 ч после начала воздействия на клетки, а величина синергизма цитотоксического действия компонентов комбинации 2 (ΔСц) составляет 49%.
При действии на клетки линии U266 комбинации 3 и 4 проявляют 85%-ный и 68%-ный противоопухолевый эффект через 24 ч. Значения величин синергизма (ΔСц) для комбинаций 3 и 4 составляют 55% и 53%, соответственно.
Причем ДМНСН, в отличие от аналога витамина К - плюмбагина, сам по себе не оказывая цитотоксического действия на клетки линии U266, усиливает цитотоксический эффект бортезомиба в комбинациях по изобретению на 49-59%.
Известная комбинации плюмбагина и бортезомиба приводит к потенцированию цитотоксического эффекта бортезомиба, в то время как заявленные комбинации ДМНСН и бортезомиба проявляют качественно иной тип синергизма, сенситизацию, и неожиданно обеспечивают в количественной мере более выраженный противоопухолевый синергизм в отношении усиления антипролиферативной цитотоксической активности.
Полученные данные свидетельствуют о том, что синергетический цитотоксический эффект заявленных комбинаций по показателю ΔСц превосходит синергетический цитотоксический эффект известной комбинации по отношению к клеткам множественной миеломы линии U266 в количественном отношении в 2,7-3,3 раза.
Таким образом, комбинация по изобретению вследствие замены плюмбагина на другой аналог витамина К - соединение 2,3-дигидро-2-метил-1,4-нафтохинон-2-сульфонат натрия - и изменения количественных характеристик активных веществ приводит к улучшенному фармакокинетическому профилю.
Пример 4. Синергетическое действие комбинаций по изобретению на химотрипсинподобную активность протеасом
Учитывая, что антипролиферативное цитотоксическое действие ингибиторов протеасом связано с ингибированием химотрипсинподобной активности протеасом, полученные по примеру 1 комбинации тестируют на способность подавлять химотрипсинподобную активность протеасом в иммортализованных пролиферирующих клетках млекопитающих.
В качестве экспериментальной модели протеасом используют протеасомы, полученные из клеток линии ПЕК 293 Т.
Для получения протеасом клетки линии НЕК 293 Т гомогенизируют в гомогенизаторе (стекло-стекло) в 50 мМ Tris-HCl буфере (pH 7,5), содержащем 100 мМ NaCl, 1 мМ ЭДТА, 1 мМ дитиотреитол, 10%-ный глицерин, 5 мМ MgCb, 1 мМ АТР, 10 мМ Na2S2O5, в соотношении 1:3 (вес:объем). Гомогенаты центрифугируют при 15400g в течение 30 мин при 4° и отделяют надосадочную жидкость (осветленный гомогенат клеток), содержащую протеасомы.
К полученному осветленному гомогенату с протеасомами добавляют исследуемые препараты: комбинации с различными концентрациями бортезомиба и ДМНСН, выбранными из заявленного диапазона терапевтически эффективных количеств; либо отдельно взятые бортезомиб и ДМНСН в тех же концентрациях, что и в исследуемых комбинациях; либо физиологический раствор хлорида натрия (контрольный образец). Для удобства эксперимента концентрации препаратов рассчитывают в мкг/мл.
В качестве флуоресцентного индикатора химотрипсинподобной активности протеасом используют коммерческий флуорогенный субстрат Suc-LLVY-AMC (Sigma, США) и определяют химотрипсинподобную активность протеасом по его гидролизу.
Для исключения вклада примесных протеолитических активностей в ряд проб добавляют ингибитор химотрипсинподобной активности протеасом MG132 (Z-leucyl-leucyl-leucinal) (Sigma, США). Реакцию проводят при 37° в течение 20 мин после внесения 5-10 мкл осветленного гомогената с исследуемыми препаратами в реакционную смесь (до 100 мкл конечного объема), содержащую 20 мМ Tris-HCl (pH 7,5), 1 мМ дитиотреитол, 30 мкМ Suc-LLVY-AMC, 5 мМ MgCl2 и 1 мМ АТР, и останавливают 1%-ным раствором Ds-Na.
Образовавшийся продукт регистрируют на флуориметре (Bio-Rad VersaFluor Fluorometer, США) при значениях возбуждающей длины волны 380 нм и эмиссии 440 нм. Химотрипсинподобную активность протеасом оценивают по интенсивности флуоресценции гидролизованного субстрата в единицах показаний флуориметра.
Для оценки эффекта ингибирования активности протеасом препаратами принимают активность контрольного образца (в отсутствие исследуемого препарата), зарегистрированную в единицах показаний флуориметра, за 100%, далее переводят в %-ное выражение активность протеасом, зарегистрированную в единицах показаний флуориметра, в образцах в присутствии того или иного препарата. Величина ингибирующего действия (ИД) рассчитывается в % как разница между активностью в контрольном образце и образце в присутствии того или иного препарата.
Для каждого исследуемого препарата ставят не менее 6-ти независимых экспериментов.
Синергетические эффекты в усилении способности ингибитора протеасом бортезомиба в комбинациях по изобретению снижать химотрипсинподобную активность протеасом количественно оценивают по показателю степени синергизма Сид по формуле:
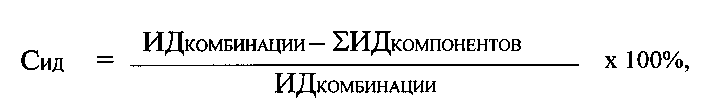
Полученные результаты представлены в табл. 4.
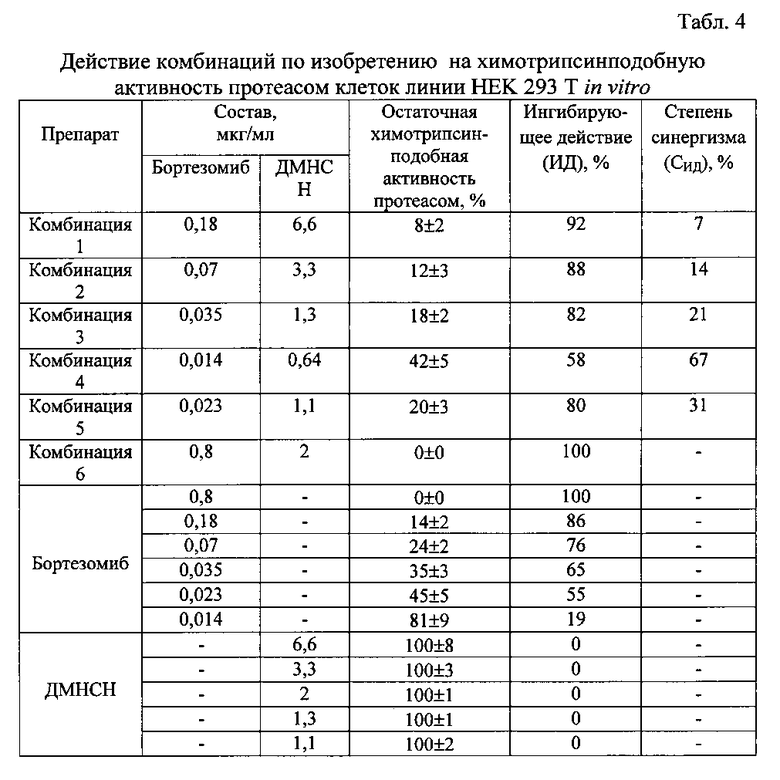

Из табл. 4 видно, что величина ингибирующего действия препаратов на активность протеасом обратно пропорциональна остаточной активности протеасом. Величина степени синергизма при ингибировании активности протеасом для компонентов комбинаций №1-№5 составляет 7-67%. При этом ДМНСН сам по себе не оказывает действия на активность протеасом in vitro. Это означает, что ДМНСН и протеасомный ингибитор бортезомиб проявляют сенситизирующее синергетическое действие на химотрипсинподобную активность протеасом. Комбинация 6, содержащая бортезомиб в более высокой концентрации (0,8 мкг/мл), так же, как и отдельно взятый бортезомиб в той же концентрации, полностью подавляют активность протеасом.
Пример 5. Исследование токсических свойств противоопухолевого средства
Уровень токсичности заявленного противоопухолевого лекарственного средства определяют в серии экспериментов на мышах линии C57B1/6 с привитыми опухолями и на интактных белых беспородных мышах и крысах.
Клетки штамма перевиваемой опухоли меланомы В-16 и клетки гепатоклеточной карциномы Нера 1-6 прививают самцам мышей линии C57B1/6 подкожно, аденокарциному молочной железы 755 (Са 755) прививают самкам мышей линии C57B1/6 подкожно, при этом каждой мыши вводят по 0,3 мл суспензии опухолевых клеток, приготовленной на среде 199 (клетки, полученные после гомогенизирования 1 г опухоли в 10 мл среды).
В качестве тестируемых препаратов используют образцы лекарственного средства, полученные по примеру 1, включающие в себя комбинации активных веществ №1, №2 и №7.
В качестве препарата сравнения используют противоопухолевый лекарственный препарат Велкейд® (фирмы Янссен-Силаг) (доза 38,5 мг препарата содержит активное вещество бортезомиб в количестве 3,5 мг). В качестве контроля используют физиологический раствор.
Рабочие разведения тестируемых препаратов и препарата сравнения в физиологическом растворе хлорида натрия (0,9%) для инфузий готовят в асептических условиях, растворы хранят при температуре +4-+8°C и используют в тесте не позднее седьмых суток после приготовления.
Дозы рассчитывают в мг на 1 кг веса животного в соответствии со стандартом проведения доклинических испытаний.
Параметры токсичности тестируемых препаратов и препарата сравнения оценивают по величинам максимальной переносимой дозы (МПД) и полулетальной дозы (ЛД50 - доза, вызывающая 50% гибели животных).
Экспериментальные и контрольные группы животных формируют методом случайной выборки с учетом массы тела в качестве ведущего показателя.
Для определения МПД тестируемые препараты и препарат сравнения вводят животным экспериментальных групп (мыши линии C57B1/6 с привитыми опухолями) внутрибрюшинно шестикратно (по два раза в неделю). Животным контрольных групп вводят растворитель - физиологический раствор хлорида натрия (0,9%) - в таком же объеме, как и препараты. В период наблюдения (в течение 21 дня после введения) оценивают общее состояние животных по их двигательной активности, потреблению корма и воды, состоянию шерсти и слизистых оболочек, массе тела.
Для определения ЛД50 тестируемые препараты и препарат сравнения вводят интактным белым беспородным мышам и крысам внутривенно однократно в заданных по условиям эксперимента дозах.
Каждую дозу испытывают на 5 самцах и 5 самках. Животным контрольных групп вводят растворитель - физиологический раствор хлорида натрия (0,9%) - в таком же объеме, как и препараты в максимальной дозе. Вводимые объемы корректируют с учетом индивидуальной массы тела животного. Появление клинических признаков и подсчет павших животных проводят в течение суток после введения препаратов. Расчет ЛД50 проводят пробит-методом.
Для проверки токсичности маннитола его вводят в количестве по 100 мг/кг (количество, превышающее содержание маннитола в инъецируемых дозах исследуемых композиций по изобретению) мышам линии C57B1/6 с привитыми опухолями внутрибрюшинно шестикратно (по два раза в неделю). Наблюдение за мышами проводят в течение 21 дня после последнего введения и оценивают их состояние и появление клинических признаков.
Наблюдение за животными показало, что маннитол не вызывает у них ухудшения состояния ни по одному из исследованных признаков.
Результаты экспериментов по изучению токсических свойств суммированы в табл. 5.
Результаты проведенных экспериментов свидетельствуют о том, что лекарственное средство по изобретению, содержащее в качестве активных веществ комбинацию бортезомиба и ДМНСН, отличается более низким уровнем токсичности по сравнению с препаратом Велкейд® по всем исследованным признакам. При этом второй активный ингредиент комбинации, ДМНСН, в количествах, соответствующих его количествам в лекарственных средствах, сам по себе не оказывает токсического действия.
Лекарственное средство, включающее комбинацию №1 и содержащее в 4 раза более низкую дозу бортезомиба, чем препарат Велкейд®, проявляет в сравнении с ним в 6-7 раз более низкую токсичность по отношению к крысам и в 4 раза более низкую токсичность по отношению к мышам.
Лекарственное средство, включающее комбинацию №2 и содержащее в 10 раз более низкую дозу бортезомиба, чем препарат Велкейд®, проявляет в сравнении с ним в 12-14 раз более низкую токсичность по отношению к крысам и в 10-13 раз боле низкую токсичность по отношению к мышам.
Лекарственное средство, включающее комбинацию №7 с содержанием бортезомиба, превышающим его содержание в препарате Велкейд® в 2 раза, проявляет в сравнении с ним в 1,2-1,3 раза более низкую токсичность по отношению к крысам и в 1,2 раза более низкую токсичность по отношению к мышам, и может быть использовано для тяжелых случаев онкологических заболеваний.
Пример 6. Исследование противоопухолевой активности лекарственного средства на модели перевиваемой опухоли меланома В-16 in vivo
Противоопухолевую активность лекарственного средства по настоящему изобретению оценивают на модели перевиваемой опухоли меланома В-16. Исследуют лекарственные средства, полученные по примеру 1 (включающие в себя комбинации активных веществ №1, №2 и №7).
В качестве препарата сравнения используют противоопухолевый препарат Велкейд® (фирмы Янссен-Силаг).
Для оценки синергетического эффекта активных компонентов композиций отдельным группам мышей вводят бортезомиб или ДМНСН в соответствующих количествах.
Рабочие разведения тестируемых препаратов и препарата сравнения готовят аналогично примеру 5.
Клетки штамма перевиваемой опухоли меланомы В-16 прививают мышам (самцам) подкожно аналогично примеру 5.
Животных распределяют на десять опытных и одну контрольную группы (по 10 животных в группе) с использованием в качестве основного критерия массы тела (отклонение значений показателя массы тела в пределах группы ±10%). Лечение начинают через 48 часов после прививки.
Первая группа животных получает препарат, включающий комбинацию №1. Вторая группа животных получает препарат, включающий комбинацию №2. Третья группа животных получает препарат, включающий комбинацию №7. Четвертая группа мышей получает бортезомиб в количестве, соответствующем его количеству в комбинации №1. Пятая группа мышей получает бортезомиб в количестве, соответствующем его количеству в комбинации №2. Шестая группа мышей получает бортезомиб в количестве, соответствующем его количеству в комбинации №7. Седьмая группа мышей получает ДМНСН в количестве, соответствующем его количеству в комбинации №1. Восьмая группа мышей получает ДМНСН в количестве, соответствующем его количеству в комбинации №2. Девятая группа мышей получает ДМНСН в количестве, соответствующем его количеству в комбинации №7. Десятая группа мышей получает препарат сравнения Велкейд®. Животные контрольной группы остаются без лечения.
Тестируемые препараты и препарат сравнения вводят мышам внутрибрюшинно шестикратно, по два раза в неделю. Дозы для введения рассчитывают аналогично примеру 5 так, чтобы они не превышали максимально переносимую дозу (МПД) для каждого из этих лекарственных средств. Наименьшее значение МПД принадлежит препарату сравнения Велкейд®, которое составляет для мышей 5,5 мг/кг. В связи с этим для корректности эксперимента все остальные препараты вводят в той же дозе - 5,5 мг/кг.
Животных наблюдают ежесуточно и отмечают клинические признаки. Рост опухолей контролируют, измеряя объем опухолей один раз в неделю. Противоопухолевую активность тестируемых препаратов оценивают по показателю торможения роста опухоли (ТРО), который рассчитывают по формуле:
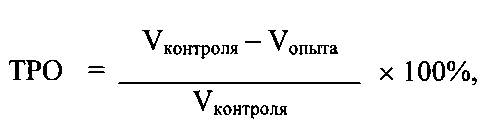
где V - средний объем опухоли (мм3) в опытной и контрольной группах на конкретный срок измерений.
Усиление противоопухолевого эффекта (показатель ТРОК/ТРОВ) под действием исследуемых композиций по изобретению по сравнению с Велкейдом® рассчитывается как отношение между значением ТРО для каждой композиции и значением ТРО для Велкейда®.
Степень синергизма рассчитывают по формуле:
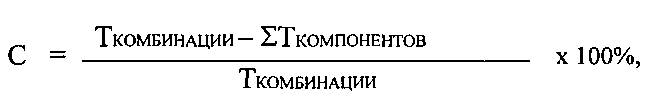
где Т - показатель торможения роста опухоли (ТРО).
Полученные результаты представлены в табл. 6.
Результаты данного эксперимента показывают, что лечение меланомы лекарственными средствами, включающими комбинации №2 и №7, является достоверно более эффективным по сравнению с Велкейдом®. В день последнего введения и через 7 дней после последнего введения, препараты, включающие комбинации №2 и №7 оказывают противоопухолевое действие, в среднем в 2 и 3 раза превышающее действие препарата Велкейд®, соответственно. Эффект торможения роста опухоли под действием препарата с комбинацией №1 сравним с эффектом торможения роста опухоли под действием Велкейда®. При этом комбинации №1 и №2 содержат бортезомиб в меньших количествах, чем препарат Велкейд®, в 4 и 10 раз, соответственно.
Компоненты комбинаций №1 и №2 проявляют высокую степень синергизма. Степень синергизма (показатель С) в проявлении противоопухолевой активности компонентами комбинации №1 составляет 83% и 85%, соответственно, в день последнего введения препаратов и через 7 дней после последнего введения препаратов. Противоопухолевый эффект этого лекарственного средства превосходит противоопухолевый эффект отдельно взятого бортезомиба в 6-7 раз.
Компоненты комбинации №2 проявляют в день последнего введения препаратов и через 7 дней после последнего введения препаратов 100%-ную степень синергизма, то есть проявляют сенситизирующий синергетический эффект, при котором ни бортезомиб, ни ДМНСН сами по себе не вызывают торможения роста опухоли.
Следует отметить, что препарат с комбинацией №7 вызывает почти полное рассасывание опухоли (ТРО=92%) к 7-му дню после последнего введения препарата. При этом отдельно взятый бортезомиб в том же количестве, что и в комбинации №7 вызывает гибель всех мышей еще до окончания курса лечения. Таким образом, лекарственное средство, включающее комбинацию №7, резко снижает токсичность бортезомиба и может быть полезно при лечении тяжелых случаев онкологических заболеваний.
Пример 7. Исследование противоопухолевой активности лекарственного средства на модели перевиваемой опухоли аденокарцинома молочной железы 755 in vivo
Противоопухолевую активность лекарственного средства по настоящему изобретению оценивают на модели перевиваемой опухоли аденокарцинома молочной железы 755, проявляющей резистентность к действию бортезомиба (в препарате Велкейд®).
Аденокарциному молочной железы 755 (Са 755) прививают мышам (самкам) подкожно аналогично примеру 5, лечение начинают через 48 часов после прививки.
Лекарственные средства, включающие комбинации №1, №2, №7 и препарат сравнения Велкейд® вводят шестикратно внутрибрюшинно, по 2 введения в неделю, в одинаковых дозах 5,5 мг/кг, не превышающих максимально переносимую дозу для каждого из этих лекарственных средств.
В каждую экспериментальную группу берут по 10 животных. Противоопухолевый эффект оценивают по показателю ТРО, усиление противоопухолевого эффекта под действием исследуемых композиций по изобретению по сравнению с Велкейдом® оценивают по показателю ТРОК/ТРОВ (аналогично примеру 6).
Результаты эксперимента представлены в табл. 7.
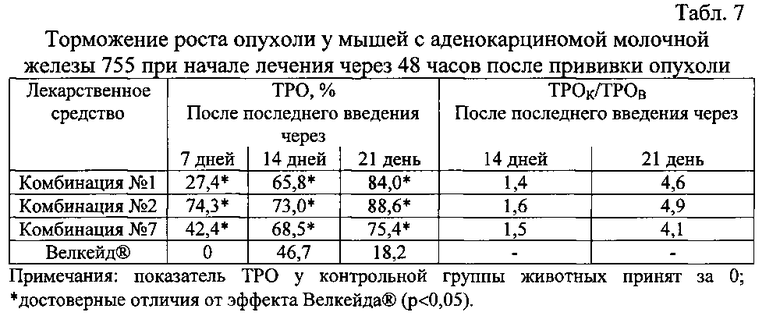
Результаты данного эксперимента показывают, что лекарственные средства с комбинациями №1, №2 и №7 по изобретению проявляют значительный противоопухолевый эффект уже через 7 дней после последнего введения. Противоопухолевый эффект композиций усиливается к 21 дню и достигает 75-89%-ного торможения роста опухоли.
Препарат Велкейд® не действует через 7 дней после последнего введения, значение показателя ТРО составляет 0%. К 14-му дню противоопухолевое действие Велкейда® проявляется, но резко уменьшается к 21-му дню.
По показателю ТРОК/ТРОВ противоопухолевое действие исследуемых лекарственных средств по изобретению превосходит противоопухолевое действие препарата сравнения Велкейд® через 21 день после последнего введения в 4,1-4,9 раза.
Таким образом, на примере аденокарциномы молочной железы 755, привитой самкам мышей, показано преодоление резистентности этой опухоли к бортезомибу (в составе препарата Велкейд®) под действием лекарственных композиций по изобретению.
Пример 8. Исследование противоопухолевой активности лекарственного средства на модели перевиваемой опухоли гепатоклеточная карцинома Нера 1-6 in vivo
Противоопухолевую активность лекарственного средства по настоящему изобретению оценивают на модели перевиваемой опухоли гепатоклеточная карцинома Нера 1-6.
Гепатоклеточную карциному Нера 1-6 прививают мышам (самцам) подкожно аналогично примеру 5, лечение начинают после достижения размеров опухоли не менее 400 мм3. Лекарственные средства, включающие комбинации активных веществ №1, №2, №7, и препарат сравнения вводят шестикратно внутрибрюшинно, по 2 введения в неделю, в одинаковых дозах 5,5 мг/кг, не превышающих максимально переносимую дозу для каждого из этих лекарственных средств.
Для оценки синергетического эффекта активных компонентов композиций отдельным группам мышей вводят бортезомиб или ДМНСН в соответствующих количествах аналогично примеру 6.
В каждую экспериментальную группу берут по 8-10 животных. Противоопухолевый эффект оценивают по показателю ТРО, усиление противоопухолевого эффекта под действием исследуемых лекарственных средств по изобретению по сравнению с Велкейдом® оценивают по показателю ТРОК/ТРОВ (аналогично примеру 6). Степень синергизма оценивают по показателю С аналогично примеру 6.
Результаты эксперимента представлены в табл. 8.
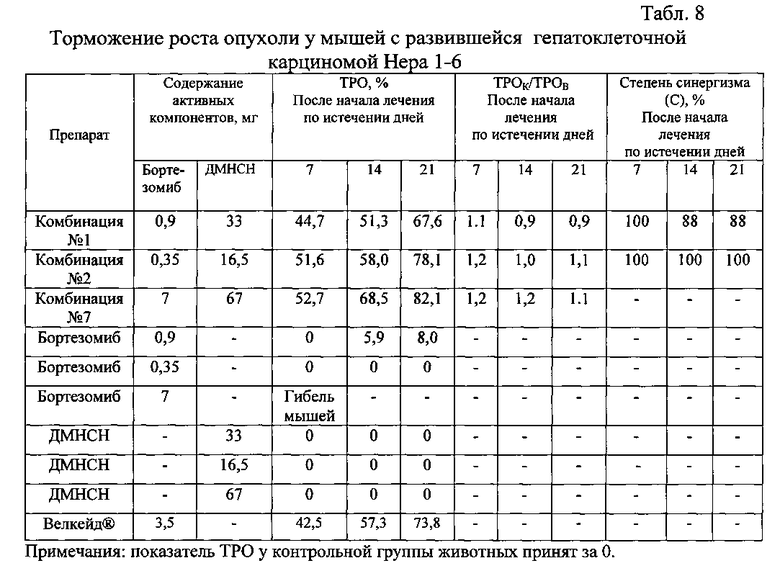
Полученные результаты свидетельствуют о том, что все исследованные лекарственные композиции по изобретению по показателям ТРО и ТРОК/ТРОВ проявляют соизмеримый друг с другом и с препаратом Велкейд® противоопухолевый эффект на 7, 14 и 21 дни после начала лечения. При этом лекарственными композициями №1 и №2 достигается противоопухолевый эффект при терапевтических дозах соответственно в 4 и 10 раз меньших, чем терапевтическая доза бортезомиба в препарате Велкейд®.
Лекарственные средства с комбинациями №1 и №2 проявляют высокую степень синергизма. Степень синергизма (показатель С) в проявлении противоопухолевой активности компонентами композиции №1 составляет 100% через 7 дней после начала лечения и 88% по истечении 14 и 21 дней после начала лечения. Противоопухолевый эффект этого препарата превосходит противоопухолевый эффект отдельно взятого бортезомиба в 8-9 раз через 14 и 21 день после начала лечения.
Лекарственное средство с комбинацией №2 проявляют на всех исследованных сроках 100%-ную степень синергизма, то есть проявляют сенситизирующий синергетический эффект, при котором ни бортезомиб, ни ДМНСН сами по себе не вызывают торможения роста опухоли.
Следует отметить, что лекарственная композиция №7 проявляет значительный противоопухолевый эффект (ТРО=52,7%) уже через 7 дней после начала лечения. Вместе с тем, к этому сроку уже не остается живых мышей, получающих лечение одним бортезомибом, взятым в той же концентрации, что и в композиции №7. К 14 и 21 дням после начала лечения композицией №7 противоопухолевый эффект усиливается до 68,5% и 82,1% по показателю ТРО. При этом все мыши остаются живыми. Результаты свидетельствуют о том, что лекарственное средство с комбинацией №7 по изобретению не только проявляет выраженный противоопухолевый эффект, но и резко снижает токсичность бортезомиба.
В целом, результаты экспериментов in vivo указывают на то, что лекарственные средства по изобретению проявляют противоопухолевый эффект, в 2-5 раз превосходящий противоопухолевый эффект препарата Велкейд® или соизмеримый с ним при одновременном резком снижении токсичности. При этом компоненты комбинации активных веществ при подавлении роста опухолей проявляют высокую степень синергизма 85-100%.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ПРОТИВООПУХОЛЕВЫМ АЛКАЛОИДОМ | 2018 |
|
RU2767664C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ПРОТИВООПУХОЛЕВЫМ АЛКАЛОИДОМ | 2018 |
|
RU2757373C2 |
| НОВЫЕ СИНЕРГИЧЕСКИЕ ЭФФЕКТЫ | 2009 |
|
RU2471499C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ПРОТИВООПУХОЛЕВЫМ АЛКАЛОИДОМ | 2011 |
|
RU2743643C2 |
| ПРИМЕНЕНИЯ ИММУНОКОНЪЮГАТОВ, МИШЕНЬЮ КОТОРЫХ ЯВЛЯЕТСЯ CD138 | 2010 |
|
RU2561041C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ПРОТИВООПУХОЛЕВЫМ АЛКАЛОИДОМ | 2011 |
|
RU2605335C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ АНТИТЕЛАМИ АНТИ-CD20 ТИПА II В СОЧЕТАНИИ С ИНГИБИТОРОМ ПРОТЕАСОМ | 2008 |
|
RU2520757C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АПИЛИМОДА | 2016 |
|
RU2738934C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМБИНАЦИИ ИНГИБИТОРА ГИСТОНДЕАЦЕТИЛАЗ И ИНГИБИТОРА ПРОТЕАСОМ ИЛИ ИММУНОМОДУЛИРУЮЩЕГО ЛЕКАРСТВЕННОГО СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ РАКА КРОВИ | 2017 |
|
RU2721409C1 |
| УЛУЧШЕННЫЕ СПОСОБЫ ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2007 |
|
RU2481853C2 |
Группа изобретений относится к медицине и касается синергетической комбинации ингибитора протеасом бортезомиба в количестве от 0,05 мг до 10 мг и аналога витамина К 2,3-дигидро-2-метил-1,4-нафтохинон-2-сульфоната натрия в количестве от 2 мг до 100 мг для ингибирования роста и пролиферации опухолевых клеток, фармацевтической композиции на основе указанной комбинации и противоопухолевого лекарственного средства, включающего бортезомиб и указанный аналог витамина К. Технический результат: показан синергизм заявленной комбинации, резкое снижение токсичности бортезомиба по сравнению с его самостоятельным применением. Изобретение может быть использовано для лечения гепатоклеточной карциномы, меланомы, карциномы молочной железы, карциномы щитовидной железы, множественной миеломы и др. злокачественных новообразований. 3 н. и 6 з.п. ф-лы, 8 табл., 8 пр.
1. Синергетическая комбинация для ингибирования роста и пролиферации опухолевых клеток, содержащая в качестве активных веществ бортезомиб и аналог витамина К, отличающаяся тем, что из аналогов витамина К она содержит 2,3-дигидро-2-метил-1,4-нафтохинон-2-сульфонат натрия, при этом терапевтически эффективные количества активных веществ составляют от 0,05 до 10 мг бортезомиба и от 2 до 100 мг аналога витамина К.
2. Синергетическая комбинация по п. 1, отличающаяся тем, что предназначена для изготовления фармацевтических композиций и противоопухолевых лекарственных средств.
3. Фармацевтическая композиция противоопухолевого действия, содержащая в качестве активных веществ комбинацию бортезомиба и аналога витамина К, отличающаяся тем, что содержит в качестве активных веществ комбинацию по п. 1 и, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество.
4. Фармацевтическая композиция по п. 3, отличающаяся тем, что предназначена для лечения злокачественных новообразований.
5. Фармацевтическая композиция по п. 4, отличающаяся тем, что злокачественные новообразования выбраны из группы, включающей гепатоклеточную карциному, меланому, карциному молочной железы, карциному щитовидной железы и множественную миелому.
6. Противоопухолевое лекарственное средство, содержащее в качестве активных веществ комбинацию бортезомиба и аналога витамина К, отличающееся тем, что из аналогов витамина К оно содержит 2,3-дигидро-2-метил-1,4-нафтохинон-2-сульфонат натрия и, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество при следующем соотношении компонентов (в масс. %):
7. Лекарственное средство по п. 6, отличающееся тем, что содержит в качестве фармацевтически приемлемых вспомогательных веществ маннитол или сахарозу.
8. Лекарственное средство по п. 6, отличающееся тем, что представлено в жидкой форме в виде раствора для инъекций или в лиофилизированной форме.
9. Лекарственное средство по п. 8, отличающееся тем, что дополнительно включает, по крайней мере, один фармацевтически приемлемый разбавитель или растворитель.
| SANDUR SK et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Mol.Cancer Res | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| СПРАВОЧНИК | |||
Авторы
Даты
2015-09-27—Публикация
2013-12-05—Подача