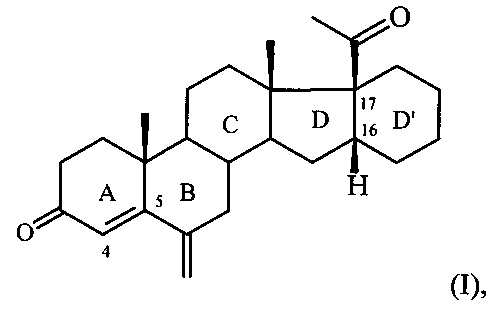
Изобретение относится к области химии природных и физиологически активных веществ, а именно к способу получения 6-метилено-16α,17α-циклогексанопрегн-4-ен-3,20-диона формулы:
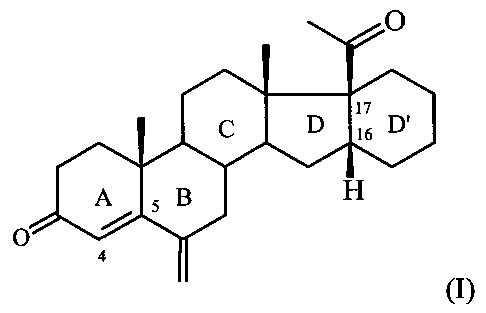
6-Метилено-16α,17α-циклогексанопрегн-4-ен-3,20-дион формулы I является промежуточным продуктом в синтезе стероидных гормонов прегнанового ряда, содержащих дополнительный шестичленный карбоцикл [М. Ibrahim-Quali. Synthesis of pentacyclic steroids. Steroids, 2008, 73, N 8, 775-97], конденсированный со стероидным скелетом в 16α,17α-положениях [А.В. Камерницкий, И.С. Левина. Прегна-D′-пентараны. Прогестины и антипрогестины. Биоорганическая химия, 2005, Т. 31, с. 115 и 227], а именно непосредственным предшественником в синтезе высокоэффективного прогестина - 6α-метил-16α,17α-циклогексанопрогестерона.
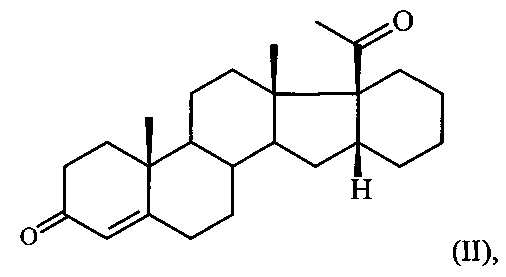
Известен единственный способ получения 6-метилено-16α,17α-циклогексанопрегн-4-ен-3,20-диона (I) путем прямого γ-метиленирования 16α,17α-циклогексанопрегн-4-ен-3,20-диона формулы:
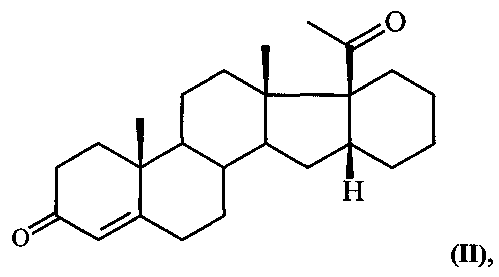
т.е. введение метилиденовой группы в 6-положение стероидной молекулы путем кипячения в течение 5 часов сопряженного кетона II с производным формальдегида (диэтилацеталем формальдегида) в присутствии хлорокиси фосфора и ацетата натрия в растворе хлорированного углеводорода [И.С. Левина, А.В. Камерницкий. Синтез 6α-метил-16α,17α-циклогексанопрогестерона через γ-метиленирование 16α,17α-циклогексанопрегн-4-ен-3,20-диона. Изв. АН СССР, сер. хим., 1997, №6, 1234-35]. Выход целевого продукта не превышает 55%.
Этот способ имеет ряд существенных недостатков, которые не позволяют использовать его в промышленных масштабах, а именно достаточно жесткие условия проведения реакции (длительное кипячение реакционной смеси), необходимость хроматографической очистки продукта реакции и недостаточно высокий выход целевого продукта.
Задачей настоящего изобретения является увеличение выхода 6-метилено-16α,17α-циклогексанопрегн-4-ен-3,20-диона формулы I и упрощение технологии его получения.
Поставленная задача достигается предлагаемым способом получения 6-метилено-16α,17α-циклогексанопрегн-4-ен-3,20-диона формулы I путем взаимодействия 16α,17α-циклогексанопрегн-4-ен-3,20-диона формулы II с триметилортоформиатом (СН(ОМе)3) в среде метанола либо с триэтилортоформиатом (CH(OEt)3) в среде этанола в присутствии пара-толуолсульфокислоты (p-TsOH) при комнатной температуре с последующим взаимодействием полученного при этом соответствующего 3,5-диенольного эфира формулы:
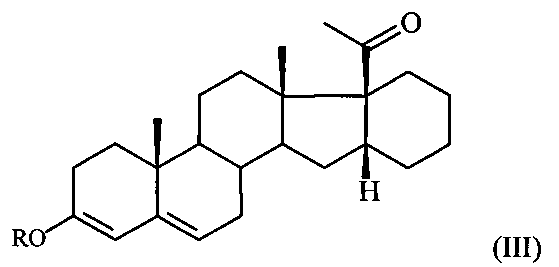
где R = Me либо Et,
в среде ДМФА с оксихлоридом фосфора (POCl3) при температуре 5-10°C и обработкой реакционной смеси водным раствором углекислого калия, содержащего хлористый натрий и полученный при этом соответствующий ненасыщенный альдегид формулы:
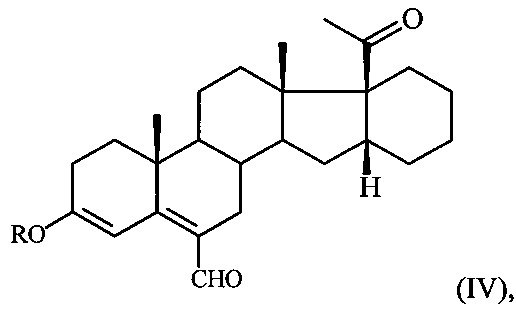
где R имеет вышеуказанные значения,
подвергают взаимодействию с борогидридом натрия в среде метанола при комнатной температуре с последующей обработкой реакционной смеси концентрированной соляной кислотой и выделением целевого продукта I.
Процесс протекает по следующей схеме:
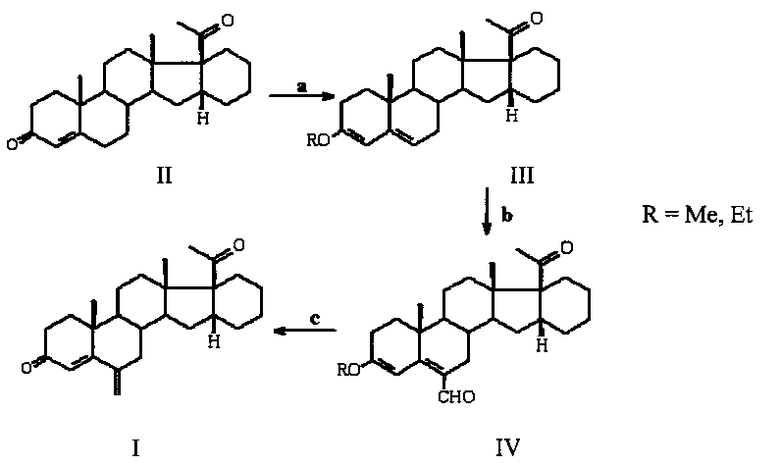
а) СН(ОМе)3 или CH(OEt)3, МеОН или EtOH, p-TsOH, b) POCl3, DMF, K2CO3-NaCl; с) NaBH4, МеОН; HCl.
На всех стадиях получаются легковыделяемые кристаллические продукты практически с количественным выходом. Общий выход целевого продукта I составляет 82%.
Отличительной особенностью способа получения 6-метилено-16α,17α-циклогексанопрегн-4-ен-3,20-диона (I) является использование метода формилирования по Вильсмейеру 3,5-диенольного эфира III с образованием иминиевой соли, гидролиз которой дает ненасыщенный альдегид IV, и его восстановление в 6-гидроксиметиленовое производное с последующей дегидратацией в целевой продукт I.
Общая совокупность предлагаемых признаков способа позволила повысить выход целевого продукта, при этом удалось сохранить инертность второй оксогруппы при С(20) в молекуле альдегида IV в условиях его восстановления борогидридом натрия, что было неочевидным исходя из уровня техники.
Техническим результатом предлагаемого способа является повышение выхода целевого продукта до 82%, осуществление процесса в мягких условиях (не требуется повышенной температуры), простота выделения промежуточных и целевого продуктов (не требуется хроматографического разделения получаемых соединений).
Изобретение может быть использовано при производстве промежуточного продукта в синтезе стероидных гормонов прегнанового ряда, которые являются ценными гормональными препаратами, применяемыми в медицине для лечения гормональных дисфункций, невынашиваемости при беременности и в качестве компонентов контрацептивов.
Изобретение иллюстрируется следующими примерами.
Пример 1
A. К суспензии 1 г (2,7 ммоля) сопряженного кетона II в 15 мл СН(ОМе)3 и 40 мл безв. МеОН добавляют 200 мг п-толуолсульфокислоты и перемешивают на магнитной мешалке при 26-28°C в течение 1 часа (ТСХ - контроль: элюент - гексан:ацетон=2:1 и 1 капля Et3N). По окончании реакции в реакционную массу добавляют несколько капель триэтиламина до ее обесцвечивания и при температуре 15-16°C небольшими порциями прибавляют раствор 300 мл H2O и 10 мл 25%-ного водного NH3. Полученную суспензию выдерживают при этой температуре 30 минут, кристаллический осадок отфильтровывают, промывают водой и сушат на воздухе. Получают 0,98 г диенола III (R=Me) (выход 94%). Спектр ЯМР 1Н (δ, м.д.): 0.70 с (3Н, 18-СН3), 0.98 с (3Н, 19-СН3), 2,15 (3Н, 21-СН3), 2,98 м (1Н, Н16), 3,55 с (3Н, ОСН3), 5,13 д (J=1,2 Гц, 1Н, Н4), 5,22-5,25 м (1Н, Н6).
B. К раствору 0,7 г (1,8 ммоля) 3-метилового енолэфира III (R=Me) в 30 мл ДМФА при 5-10°C при перемешивании на магнитной мешалке прибавляют раствор Вильсмейера, полученный из 0,34 мл (3,6 ммоля) POCl3 и 9 мл DMF. Реакционную массу выдерживают 1 час при 5°C (контроль ТСХ: элюент гексан:ацетон=1:1, 1 капля Et3N) и небольшими порциями при перемешивании выливают в охлажденный до 15°C 5%-ный водный раствор K2СО3 (100 мл), содержащий 5 г NaCl. Выпавший осадок отфильтровывают, промывают водой до pH 7 и сушат при комнатной температуре. Получают 0,71 г альдегида IV (выход 95%). Спектр ЯМР 1Н (δ, м.д.): 0,70 с (3Н, 18-СН3), 1,12 с (3Н, 19-СН3), 2,15 (3Н, 21-СН3), 2,98 м (1Н, Н16), 3,65 с (3Н, ОСН3), 6,30 с (1Н, Н4), 10,28 с (1Н, СНО).
С. К раствору 0,7 г (1,7 ммоля) альдегида IV в 40 мл МеОН при 20-22°C и перемешивании небольшими порциями прибавляют 0,37 г (9,7 ммоля) (5,7-кратный избыток) NaBH4. Реакционную массу перемешивают 30 минут при 20-22°C (контроль ТСХ: элюент - гексан:ацетон=2:1), охлаждают до 10°C, добавляют по каплям конц. соляную кислоту до pH 2 и перемешивают в течение 1 ч при 10°C. Затем реакционную массу разбавляют 60 мл воды и экстрагируют хлористым метиленом (40 мл × 2). Экстракт промывают водой до pH 7, сушат сульфатом натрия и растворитель упаривают в вакууме Получают кристаллический остаток 0,6 г (выход 92%) целевого соединения I. Т.пл. 182-185°C (из смеси эфир-гексан). [α]D +144.4 (с 1.40). Масс-спектр: Найдено: m/z 391,2594 [M+Na]+. C26H36O2. Вычислено: М=380,2715. Спектр ЯМР 1Н (δ, м.д.): 0,70 с (3Н, 18-СН3), 1,10 с (3Н, 19-СН3), 2,15 (3Н, 21-СН3), 2,98 м (1Н, Н16), 4,94-5.06 д (2Н, С6=СН2), 5,92 с (1Н, Н4).
Пример 2
А. В суспензию 1 г (2,7 ммоля) сопряженного кетона II в 20 мл CH(OEt)3 и 40 мл абсолютного этанола добавляют 200 мг п-толуолсульфокислоты.
Реакционную массу (раствор) перемешивают на магнитной мешалке при температуре 26-28°C в течение 15 минут (контроль ТСХ: элюент - гексан:ацетон=2:1 и 1 капля Et3N). По окончании реакции в реакционную массу добавляют 3 капли триэтиламина до ее обесцвечивания и небольшими порциями при перемешивании прибавляют раствор 200 мл H2O и 10 мл 25%-ного водного NH3. Через 30 мин реакционную массу разбавляют 400 мл воды, осадок отфильтровывают, промывают водой, разбавленным этанолом, содержащим 2 капли 25%-ного водного раствора аммиака и сушат на воздухе. Получают 0,98 г (91%) 3-этилового енолэфира III (R=Et).
В и С. Аналогично примеру 1 на стадиях В и С из 0,98 г 3-этилового енолэфира II (R=Et) получают 0,98 г альдегида IV (выход 89%) и 0,82 г (90%) целевого 6-метилено-16α,17α-циклогексанопрегн-4-ен-3,20-диона формулы I.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 6-МЕТИЛЕНО-16α,17α-ЦИКЛОГЕКСАНОПРЕГН-4-ЕН-3,20-ДИОНА | 2014 |
|
RU2566366C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6α-МЕТИЛГИДРОКОРТИЗОНА ИЛИ ЕГО 11β-АЛКАНОИЛОКСИПРОИЗВОДНЫХ (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ 6α-МЕТИЛПРЕДНИЗОЛОНА ИЛИ ЕГО 11β-АЛКАНОИЛОКСИПРОИЗВОДНЫХ С ИСПОЛЬЗОВАНИЕМ ПОЛУЧЕННОГО 6α-МЕТИЛГИДРОКОРТИЗОНА ИЛИ ЕГО 11β-АЛКАНОИЛОКСИПРОИЗВОДНЫХ | 2006 |
|
RU2337918C9 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТАТА 16α,17α-ЦИКЛОГЕКСАНО-5α,6α-ЭПОКСИПРЕГН-3β-ОЛ-20-ОНА | 2011 |
|
RU2480477C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6α-МЕТИЛГИДРОКОРТИЗОНА ИЛИ ЕГО ЭФИРОВ ИЗ 21-АЦЕТАТА ГИДРОКОРТИЗОНА | 2017 |
|
RU2663484C1 |
| СПОСОБ ПОЛУЧЕНИЯ 11БЕТА, 17АЛЬФА, 21-ТРИГИДРОКСИ-16АЛЬФА-МЕТИЛ-9АЛЬФА-ФТОРПРЕГНА-1,4-ДИЕН-3,20-ДИОНА (ДЕКСАМЕТАЗОНА) ИЗ ФИТОСТЕРИНА | 2013 |
|
RU2532902C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6-ДЕГИДРО-6-МЕТИЛГИДРОКОРТИЗОНА ИЛИ ЕГО ЭФИРОВ ИЗ 21-АЦЕТАТА ГИДРОКОРТИЗОНА | 2017 |
|
RU2663893C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6α-МЕТИЛГИДРОКОРТИЗОНА | 2006 |
|
RU2297423C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6-МЕТИЛЕНГИДРОКОРТИЗОНА ИЛИ ЕГО ЭФИРОВ ИЗ 21-АЦЕТАТА ГИДРОКОРТИЗОНА | 2017 |
|
RU2664101C1 |
| 4-ГЕТЕРО-16α, 17α-ЦИКЛОГЕКСАНОПРЕГНАНЫ | 2009 |
|
RU2426737C1 |
| СПОСОБ ПОЛУЧЕНИЯ НОВЫХ 3β-АЦЕТОКСИ-17α-ГИДРОПЕРОКСИ-16α-МЕТИЛПРЕГНАНОВ ИЗ Δ-20-КЕТОСТЕРОИДОВ И СПОСОБ ПОЛУЧЕНИЯ 3β-АЦЕТОКСИ-17α-ГИДРОКСИ-16α-МЕТИЛПРЕГНАНОВ С ИСПОЛЬЗОВАНИЕМ 3β-АЦЕТОКСИ-17α-ГИДРОПЕРОКСИ-16α-МЕТИЛПРЕГНАНОВ | 2009 |
|
RU2418805C1 |
Изобретение относится к способу получения 6-метилено-16α,17α-циклогексанопрегн-4-ен-3,20-диона формулы (I), который является непосредственным предшественником в синтезе высокоэффективного прогестина - 6α-метил-16α,17α-циклогексано-прогестерона. Способ заключается в том, что 16α,17α-циклогексанопрегн-4-ен-3,20-дион подвергают взаимодействию с триметилортоформиатом в среде метанола либо с триэтилортоформиатом в среде этанола в присутствии пара-толуолсульфокислоты при комнатной температуре с последующим взаимодействием полученного при этом соответствующего 3,5-диенольного эфира в среде ДМФА с оксихлоридом фосфора при температуре 5-10°C и обработкой реакционной смеси водным раствором углекислого калия, содержащего хлористый натрий, и полученный при этом соответствующий ненасыщенный альдегид подвергают взаимодействию с борогидридом натрия в среде метанола при комнатной температуре с последующей обработкой реакционной смеси концентрированной соляной кислотой. Техническим результатом предлагаемого способа является повышение выхода целевого продукта до 82%, осуществление процесса в мягких условиях (не требуется повышенной температуры), простота выделения промежуточного и целевого продуктов (не требуется хроматографического разделения получаемых соединений). 2 пр.
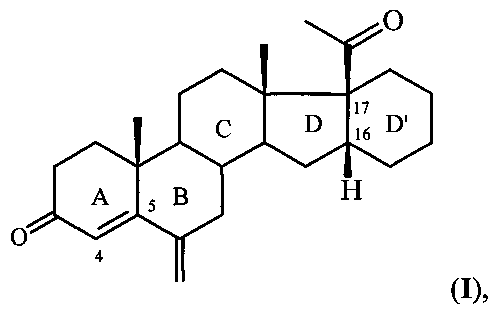
Способ получения 6-метилено-16α,17α-циклогексанопрегн-4-ен-3,20-диона формулы:
из 16α,17α-циклогексанопрегн-4-ен-3,20-диона формулы:
отличающийся тем, что 16α,17α-циклогексанопрегн-4-ен-3,20-дион формулы II подвергают взаимодействию с триметилортоформиатом в среде метанола либо с триэтилортоформиатом в среде этанола в присутствии пара-толуолсульфокислоты при комнатной температуре с последующим взаимодействием полученного при этом соответствующего 3,5-диенольного эфира формулы:
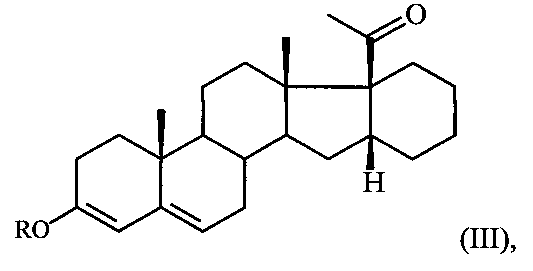
где R=Me либо Et, в среде ДМФА с оксихлоридом фосфора при температуре 5-10°С и обработкой реакционной смеси водным раствором углекислого калия, содержащего хлористый натрий, и полученный при этом соответствующий ненасыщенный альдегид формулы:
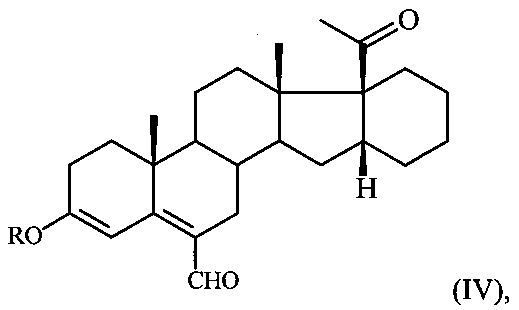
где R имеет вышеуказанные значения, подвергают взаимодействию с борогидридом натрия в среде метанола при комнатной температуре с последующей обработкой реакционной смеси концентрированной соляной кислотой.
| И.С | |||
| Левина, А.В | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
Авторы
Даты
2015-10-27—Публикация
2014-12-05—Подача