Изобретение относится к области химии природных и физиологически активных веществ, а именно к способу получения промежуточного продукта в синтезе стероидных гормонов прегнанового ряда, содержащих дополнительный шестичленный карбоцикл [М.Ibrahim-Quali. Synthesis of pentacyclic steroids. Steroids, 2008, 73, N 8, 775-97], конденсированный со стероидным скелетом в 16α,17α-положениях [Биоорган. химия, 2005, т.31, c.115 и 227], а именно к способу получения ацетата 16α,17α-циклогексано-5α,6α-эпоксипрегн-3β-ол-20-она (I).
Соединение формулы I является интермедиатом в синтезе высокоэффективного прогестина - 6α-метил-16α,17α-циклогексанопрогестерона.
Известен единственный способ получения с высоким выходом соединения формулы I путем взаимодействия ацетата 16α,17α-циклогексанопрегн-5-ен-3β-ол-20-она с 10%-ным эфирным раствором моноперфталевой кислоты (2 мол.экв.) в хлороформе [А.А.Ахрем, А.В.Камерницкий, Л.Е.Куликова, И.С.Левина. Синтез Δ6-6-замещенных циклогексано[1',2';16α,17α] прогестеронов. Изв. АН СССР, сер. хим., 1978, №2,444-447]. Описано, что эта реакция приводит к полному исчезновению исходного ацетата 16α,17α-циклогексанопрегн-5-ен-3β-ол-20-она и, соответственно, к образованию продукта эпоксидирования - 5α,6α-окиси I. Процесс протекает при большом разбавлении длительное время, сутки при охлаждении и затем 48 ч при комнатной температуре. Выход целевого продукта составил 95%. Для доказательства структуры был использован только элементный анализ. Однако проведенный нами тщательный анализ продукта реакции с помощью спектроскопии ЯМР показал, что в этой реакции при полном превращении исходного олефина образуется также определенное (до 30%) количество нежелательного 5β,6β-эпоксида (см. сравнительный пример 4). К недостаткам известного способа относится также проведение эпоксидирования в сильно разбавленной среде с использованием взрыво- и пожароопасного диэтилового эфира, неустойчивой перкислоты и длительность процесса. Указанные условия не применимы при масштабировании процесса.
Задачей предлагаемого изобретения является упрощение указанного процесса, уменьшение реакционного объема и длительности процесса, а также повышение направленности процесса в сторону получения целевого α-изомера.
Поставленная задача достигается предлагаемым способом получения ацетата 16α,17α-циклогексано-5α,6α-эпоксипрегн-3β-ол-20-она формулы
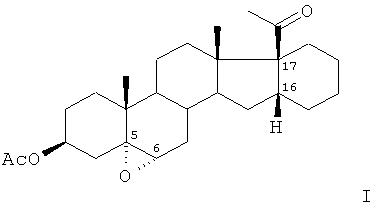
путем обработки ацетата 16α,17α-циклогексанопрегн-5-ен-3β-ол-20-она органической перкислотой в среде полярного органического растворителя, отличительной особенностью которого является то, что в качестве органической перкислоты используют п-карбометоксипербензойную кислоту и процесс проводят при температуре 25-30°C и мольном соотношении ацетат 16α,17α-циклогексанопрегн-5-ен-3β-ол-20-она : п-карбометоксипербензойная кислота 1:1,1-1,5.
В качестве органического растворителя предпочтительно используют хлористый метилен. П-карбометоксипербензойную кислоту используют в виде суспензии в хлористом метилене. Целевой продукт, содержащийся в растворе, легко отделяется после фильтрования осадка п-карбометоксибензойной кислоты.
Выход целевого продукта составляет 76-80%, что подтверждается данными физико-химического анализа.
Технический результат - безопасность и упрощение предлагаемого способа и увеличение направленности процесса в сторону получения α-изомера целевого продукта.
Преимуществом предлагаемого способа является: а) использование взрыво- и пожаробезопасной п-карбометоксипербензойной кислоты; б) проведение процесса при комнатной температуре (25-30°C) без нагрева и охлаждения; в) уменьшение времени реакции до 1-2 часов; г) уменьшение объема реакционной массы; д) упрощение процесса выделения целевого продукта.
Изобретение соответствует критерию «новизна», так как в известной научно-технической и патентной литературе отсутствует полная совокупность признаков, характеризующих предлагаемое изобретение.
П-карбометоксипербензойная кислота доступна и может быть получена с высоким выходом окислением метилового эфира п-формилбензойной кислоты кислородом, инициированного озоном (0.5-1%) в растворе четыреххлористого углерода [Г.С.Былина, Г.А.Толстиков, Г.И.Рутман, П.Н.Зернов, В.Н.Одиноков, У.М.Джемилев. А.с. СССР №656130, бюл. изобр. №15, с.21 (1979)]. Исходное соединение для получения этой перкислоты является побочным продуктом при промышленном получении монометилтерефталата. Полученная таким образом перкислота 78-85%-ной чистоты представляет собой устойчивое кристаллическое вещество, растворимое в большинстве органических растворителей, разлагаемое без взрыва при 120°C. В литературе имеется единственная публикация по окислению некоторых природных Δ5-стероидов п-карбометоксипербензойной кислотой, в которой показано, что при этом получаются смеси изомерных эпоксидов, причем стереоспецифичность эпоксидирования зависит, наряду с другими факторами, от структуры взятого стероидного олефина [Г.С.Былина, У.М.Джемилев, Н.С.Востриков, Г.А.Толстиков, A.M.Моисеенков, А.В.Семеновский, С.С.Шаванов. Окисление п-карбометоксинадбензойной кислотой. 1. Стереохимия эпоксидирования Δ5-стероидов].
Предлагаемое изобретение соответствует критерию «изобретательский уровень», так как было неочевидным, что применение этой перкислоты для класса используемых в настоящем изобретении пентаранов приведет к преимущественному образованию целевого 5α,6α-эпоксида.
Изменение мольного соотношения реагентов привело к преимущественному получению α-изомерной окиси. Такая направленность процесса была неочевидна, поскольку использование меньшего количества перкислоты при эпоксидировании природных Δ5-стероидов привело к значительному количеству β-окиси (Г.С.Былина, У.М.Джемилев, Н.С.Востриков, Г.А.Толстиков, A.M.Моисеенков, А.В.Семеновский, С.С.Шаванов. Окисление п-карбометоксинадбензойной кислотой. 1. Стереохимия эпоксидирования Δ5-стероидов). А использование большего количества перкислоты может привести к значительному снижению выхода α-окиси.
Изобретение соответствует условию «промышленная применимость», так как оно может быть использовано при производстве промежуточного продукта в синтезе стероидных гормонов прегнанового ряда, которые являются ценными гормональными препаратами, применяемыми в медицине для лечения гормональных дисфункций, невынашиваемости при беременности и в качестве компонентов контрацептивов.
Пример 1
К раствору 30 г (0.073 моль) ацетата 16α,17α-циклогексанопрегн-5-ен-3β-ол-20-она в 150 мл сух. хлористого метилена при энергичном перемешивании быстро прибавили суспензию 19.33 г (1.12 мол. экв) 78%-ной п-карбометоксипербензойной кислоты в 150 мл сух. хлористого метилена. Реакционную смесь перемешивали 2 ч при комнатной температуре (контроль ТСХ), после чего выпавший осадок п-карбометоксибензойной кислоты отфильтровали и тщательно промыли на фильтре хлористым метиленом. Фильтрат обработали 5%-ным раствором бикарбоната натрия, водой и растворитель удалили в вакууме. Полученный кристаллический остаток перекристаллизовали из водного ацетона. Получают 23.73 г (76%) ацетата 16α,17α-циклогексано-5α,6α-эпоксипрегн-3β-ол-20-она с т.пл. 244-247°C. Спектр ЯМР 1H (δ, м.д.): 0.62 (с 3H, Ме(18)); 1.08 (с, 3H, Ме(19)); 2.02 (с, 3H, 3-ОАс); 2.12 (с, 3H, Ме(21)); 2.90 (д, 1H, 6H, J 3.6 Гц); 4.97 (м, 1H, 3H). Из маточника после 3-кратного отделения более трудно растворимого целевого продукта - ацетата 16α,17α-циклогексано-5α,6α-эпоксипрегн-3β-ол-20-она - и перекристаллизации остатка после удаления растворителей из смеси эфир-гексан выделен изомер целевого продукта - ацетат 16α,17α-циклогексано-5β,6β-эпоксипрегн-3β-ол-20-она с т.пл. 166-168°C.
Пример 2
К раствору 30 г (0.073 моль) ацетата 16а,17а-циклогексанопрегн-5-ен-3,20-диона в 150 мл сух. хлористого метилена при энергичном перемешивании быстро прибавили суспензию 33 г (2 мол. экв) 80.5%-ной п-карбометоксипербензойной кислоты в 200 мл сух. хлористого метилена. Реакционную смесь перемешивали 2 ч при комнатной температуре, после чего выпавший осадок п-карбометоксибензойной кислоты отфильтровали и промыли на фильтре хлористым метиленом. После обработки, аналогичной описанной в Примере 1, получают 23.8 г (76%) ацетата 16α,17α-циклогексано-5α,6α-эпоксипрегн-3β-ол-20-она.
Пример 3
К раствору 30 г (0.073 моль) ацетата 16α,17α-циклогексанопрегн-5-ен-3,20-диона в 150 мл сух. хлористого метилена при энергичном перемешивании быстро прибавили суспензию 33 г (2 мол. экв) 80.5%-ной п-карбометоксипербензойной кислоты в 200 мл сух. хлористого метилена. Реакционную смесь перемешивали 1 ч при 30°C и обработали аналогично вышеописанному. Получают 25.3 г (80%) ацетата 16α,17α-циклогексано-5α,6α-эпоксипрегн-3β-ол-20-она.
Пример 4 (сравнительный)
Раствор 30 г (0.073 моль) ацетата 16α,17α-циклогексанопрегн-5-ен-3,20-диона в 250 мл сух. хлористого метилена охладили льдом и при перемешивании прилили 313 мл эфирного раствора моноперфталевой кислоты (26.57 г (0.146 моль) 100%-ной перкислоты). Реакционную смесь выдержали при комнатной температуре 48 ч, отфильтровали выпавшую монофталевую кислоту, после чего обработали насыщенным раствором Na2CO3, промыли водой и сушили Na2SO4. Растворители удалили в вакууме и полученный кристаллический остаток перекристаллизовали из водного ацетона. Получают 17.1 г (55%) ацетата 16α,17α-циклогексано-5α,6α-эпоксипрегн-3β-ол-20-она формулы I.
Из маточника дополнительно выделено 5.02 г продукта, содержащего по спектру ПМР значительную примесь изомерного 5β,6β-эпоксида.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТАТА 16α,17α-ЦИКЛОГЕКСАНОПРЕГН-5-ЕН-3β-ОЛ-20-ОНА | 2012 |
|
RU2495047C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6-МЕТИЛЕНО-16α,17α-ЦИКЛОГЕКСАНОПРЕГН-4-ЕН-3,20-ДИОНА | 2014 |
|
RU2566366C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТАТА 16α,17α-ЦИКЛОГЕКС-3',4'-ЕНОПРЕГН-5-ЕН-3β-ОЛ-20-ОНА | 2011 |
|
RU2480476C1 |
| 6-ОКСИМЫ 16А,17А-ЦИКЛОГЕКСАНОПРЕГНЕНОВ, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К ОПУХОЛЕВЫМ КЛЕТКАМ ЧЕЛОВЕКА | 2013 |
|
RU2534995C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6-МЕТИЛЕНО-16α,17α-ЦИКЛОГЕКСАНОПРЕГН-4-ЕН-3,20-ДИОНА | 2014 |
|
RU2566368C1 |
| СПОСОБ ПОЛУЧЕНИЯ НОВЫХ 3β-АЦЕТОКСИ-17α-ГИДРОПЕРОКСИ-16α-МЕТИЛПРЕГНАНОВ ИЗ Δ-20-КЕТОСТЕРОИДОВ И СПОСОБ ПОЛУЧЕНИЯ 3β-АЦЕТОКСИ-17α-ГИДРОКСИ-16α-МЕТИЛПРЕГНАНОВ С ИСПОЛЬЗОВАНИЕМ 3β-АЦЕТОКСИ-17α-ГИДРОПЕРОКСИ-16α-МЕТИЛПРЕГНАНОВ | 2009 |
|
RU2418805C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТАТА 16α,17α-ЦИКЛОГЕКС-3',4'-ЕНОПРЕГН-5-ЕН-3β-ОЛ-20-ОНА | 2011 |
|
RU2472802C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОРТИКОИДНЫХ СОЕДИНЕНИЙ | 1964 |
|
SU224401A1 |
| СПОСОБ ПОЛУЧЕНИЯ 11БЕТА, 17АЛЬФА, 21-ТРИГИДРОКСИ-16АЛЬФА-МЕТИЛ-9АЛЬФА-ФТОРПРЕГНА-1,4-ДИЕН-3,20-ДИОНА (ДЕКСАМЕТАЗОНА) ИЗ ФИТОСТЕРИНА | 2013 |
|
RU2532902C1 |
| СПОСОБ ПОЛУЧЕНИЯ 16α-МЕТИЛИРОВАННЫХ СТЕРОИДОВ, СОЕДИНЕНИЯ | 1993 |
|
RU2125575C1 |
Изобретение относится к области химии природных и физиологически активных веществ, а именно к способу получения промежуточного продукта в синтезе стероидных гормонов прегнанового ряда. Способ получения ацетата 16α,17α-циклогексано-5α,6α-эпоксипрегн-3β-ол-20-она включает обработку ацетата 16α,17α-циклогексанопрегн-5-ен-3β-ол-20-она п-карбометоксипербензойной кислотой в среде полярного хлористого метилена и процесс проводят при температуре 25-30°C и мольном соотношении ацетат 16α,17α-циклогексанопрегн-5-ен-3β-ол-20-она : п-карбометоксипербензойная кислота 1:1,1-1,5, при этом целевой продукт, содержащийся в растворе, легко отделяется после фильтрования осадка п-карбометоксибензойной кислоты. Технический результат - безопасность и упрощение предлагаемого способа и увеличение направленности процесса в сторону получения α-изомера целевого продукта; может использоваться при производстве промежуточного продукта в синтезе стероидных гормонов прегнанового ряда, которые являются ценными гормональными препаратами, применяемыми в медицине. 1 з.п. ф-лы, 4 пр.
Способ получения ацетата 16α,17α-циклогексано-5α,6α-эпоксипрегн-3β-ол-20-она
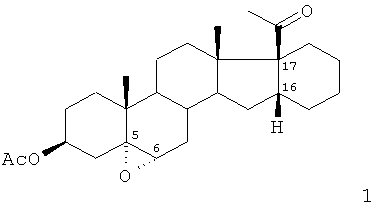
путем обработки ацетата 16α,17α-циклогексанопрегн-5-ен-3β-ол-20-она органической перкислотой в среде полярного органического растворителя, отличающийся тем, что в качестве органической перкислоты используют п-карбометоксипербензойную кислоту и процесс проводят при температуре 25-30°C и мольном соотношении ацетата 16α,17α-циклогексанопрегн-5-ен-3β-ол-20-она: п-карбометоксипербензойная кислота 1:1,1-1,5.
2. Способ по п.1, отличающийся тем, что в качестве органического растворителя используют хлористый метилен.
| АХРЕМ А.А | |||
| и др | |||
| // Изв | |||
| АН СССР сер | |||
| хим | |||
| Чугунный экономайзер с вертикально-расположенными трубами с поперечными ребрами | 1911 |
|
SU1978A1 |
| БЫЛИНА Г.С | |||
| и др.// Изв | |||
| АН СССР сер | |||
| хим | |||
| Чугунный экономайзер с вертикально-расположенными трубами с поперечными ребрами | 1911 |
|
SU1978A1 |
| Способ получения 6-хлор-(1,2,16 ,17 ) циклогексанопрегна-4,6-диен-3,20-диона | 1973 |
|
SU482083A1 |
Авторы
Даты
2013-04-27—Публикация
2011-12-28—Подача