Изобретение касается способа приготовления биомассы, содержащей плантарицин, и ее применения в медицинских целях. В частности, изобретение касается способа приготовления плантарицинов А, N или K или их смесей или биомассы, содержащей один или большее число из упомянутых выше плантарицинов совместно с молочнокислыми бактериями, для приготовления и их применения для стимуляции барьерной функции клеток кишечника или эпидермальных кератиноцитов человека.
Известно, что эпидермис и кишечная стенка осуществляют барьерную функцию против внешней среды и вредных агентов. Барьерная функция эпидермиса и кишечной стенки может быть ослаблена под действием различных факторов. Одним из условий, часто приводящих к изменению барьерной функции эпидермиса, является взаимодействие с внешними факторами различного происхождения. В нормальных условиях эпидермис способен адаптироваться к возможным внешним повреждениям, причем адаптация приводит к достижению «стационарного состояния» и адекватной степени чувствительности. Постоянное агрессивное воздействие на эпидермис раздражающих детергентов и химических веществ (органических растворителей, моющих средств, растворов детергентов) может повреждать, например, не только липидные компоненты поверхностной пленки эпидермиса, но также и ороговевший межклеточный слой, приводя к деградации барьерной функции.
Это приводит к слабо выраженным дерматитам, для которых характерно увеличение транс-эпидермальной потери воды, небольшое шелушение и потеря эластичности ороговевшего слоя, возможно, сопровождающиеся образованием небольшого постоянного намокания на поверхности. Это небольшое раздражение, зачастую субклиническое, стимулирует способы восстановления, которые благодаря увеличению синтеза липидов и стимуляции активности пролиферации базальных кератиноцитов способствует достижению нового равновесия и восстановления барьерной функции. Когда кожный барьер не способен более адекватно выполнять внутренние защитные функции, возрастает риск возникновения воспалительных кожных патологий, запускаемых высвобождением цитокина, приводя к образованию in situ флогогенных медиаторов и свободных радикалов. Последние помимо генерации непосредственных окислительных повреждений DNA и белков могут вызывать перекисное окисление клеточных мембран кожи.
Хотя эпидермис не содержит кровеносных сосудов, он содержит, однако, некоторое количество воды, существенной для физиологического равновесия и целостности ороговевшей ткани. Вода из кожных капилляров протекает через кожно-эпидермальные соединения, и каналы между корнеоцитами располагаются рядами, как в большинстве тканей, то есть около 60-70% в глубокой зоне (компактный роговой слой) и 10-35% в более внешних областях (разделенный роговой слой). Тот факт, что в более внешней части, контактирующей с воздухом, эпидермис способен поддерживать влажный резервуар, основан на двух отдельных функциях: барьерной активности, препятствующей испарению жидкости, и глобальной гидрофильной активности ороговевшего слоя (способности удерживать воду), возникающей в результате присутствия высоко гигроскопических частиц. Эксперименты, основанные на прогрессивном отщеплении тончайших чешуек корнеоцитов из разделенного рогового слоя и гидролипидной перекрывающей пленки, свидетельствуют о том, что барьерная функция не изменена существенным образом, хотя, с другой стороны, хорошо известно, что она постепенно снижается при удалении более глубоких компактных ороговевших слоев, скрепляющих ячеистую структуру из корнеоцитов, состоящих из компактно упакованных кератиновых кластеров, покрытых жестким белком. С помощью электронной микроскопии было показано, что корнеоциты плотно изолированы модифицированными десмосомальными пластинками (корнеосомами) и погружены в липидный адгезивный слой, известный как межкорнеоцитное уплотнение, образующий пленку эластичного и почти непроницаемого барьера. Условия стресса могут влиять острым или хроническим образом на кожный барьер, и против него организм генерирует ряд гомеостатических механизмов, приводящих к тому, что способность эпидермиса отслеживать и восстанавливать эффективность барьера, если ее недостаточность не зависит от острого повреждающего воздействия. Эпидермис реагирует на хронические стрессорные воздействия на кожу, вызванные длительным влиянием сухого воздуха, что типично для сухого климата, при компенсаторных адаптивных явлениях, приводящих к повышенной пролиферации базальных клеток и соответствующему утолщению ороговевшего слоя и всего эпидермиса. Кроме того, образование и экзоцитоз телец Одланда и межкорнеоцитных липидов (сохраняющих обычный состав) возрастают таким образом, что эпидермис может лучше сохранять запас воды. Во всяком случае недостаток влаги приводит к фазовому изменению, расслоению липид-липидных взаимодействий межкорнеоцитного уплотнения с последующей кристаллизацией. В результате возникает меньшая пластичность и большая жесткость в результате сил сцепления за счет мышечно-суставных движений и внешних динамических стимулов, приводящих к небольшим микроповреждениям. Другое приложение подобных адаптивных реакций заключается в гиперкератозе: увеличение пролиферирующего слоя не скомпенсировано повышенной скоростью отшелушивания корнеоцитов, которые вместо того, чтобы отделяться в виде чешуек, остаются включенными в ороговевшие массивные кластеры и отделяются только в виде больших чешуек. Более того, хронические стрессовые воздействия внешней среды активируют каскад цитокинов с воспалительными гистологическими проявлениями, связанными с гипертрофией и дегрануляцией кожных мастоцитов. Это может объяснять наблюдаемое зимой обострение воспалительных дерматопатологий.
Каждое острое повреждение барьерной функции эпидермиса индуцирует реакцию цитокина участвующими в этом способе ороговевшими клетками, действие которых отражается на кератиноцитах и расположенной под ними коже, приводя к существенным морфологическим и функциональным последствиям, стремящимся восстановить барьерную функцию, текстуру эпидермальной поверхности и, в конце концов, стимулировать активность фибробластов, лежащих в основе улучшения плотности и тургора кожи.
На самом деле, способы, используемые для восстановления барьерной функции, основаны на применении восстанавливающих и гидрорегулирующих веществ, способных преодолеть недостаточность кожной защиты, возникающей из-за изменения барьерной функции. Эти вещества представляют собой соединения с регидратирующей и реструктурирующей активностью. Многие дермокосметические продукты способствуют восстановлению гидратации кожи и соответственно способствуют регенерации кожи. Однако они действуют просто «косметически маскируя» грубую поверхность и не оказывают настоящего терапевтического эффекта, который должен осуществляться путем восстановительной и регенеративной активности, направленной на восстановление морфофункциональной целостности кожи.
Недавно было установлено, что бактерии способны к высвобождению и детектированию сигнальных молекул как реакции на изменения условий внешней среды, включая изменения их клеточной плотности и/или количества других видов микробных клеток, находящихся в экосистеме (Sturme et al., 2007. Making sense of quorum sensing in lactobacilli: a special focus on Lactobacillus plantarum WCFA1. Microbilogy 153:3939-3947). Что касается молочнокислых бактерий, эти реакции, происходящие согласно механизму дистанционного микроб-микробного взаимодействия «quorum sensing» (QS), включают сигнальные молекулы, называемые молекулами типа 2 (AI-2, главным образом, производные фуранонов) ауто-индукторы, синтезированные с помощью ферментативной активности LuxS (Miller e Bassler, 2003. LuxS quorum sensing: more than just a numbers game. Curr Opin Microbiol 6:191-197), или сигнальные молекулы, названные пептидными феромонами или пептидными ауто-индукторами (AIP)(Nakajama et al., 2001. Gelatinase biosynthesis-activating pheromone: a peptide lactone that mediates a quorum sensing in Enterococcus faecalis. Mol Microbiol 41:145-154). Недавно было доказано, что геном L. plantarum WCFS1 содержит большое число генов, кодирующих пептиды AIP, а также другие гены, кодирующие другие функции, участвующие в механизмах межмикробных взаимодействий (Sturme et al., 2007. Making sense of quorum sensing in lactobacilli: a special focus on Lactobacillus plantarum WCFA1. Microbilogy 153:3939-3947). Некоторые исследования показали, что эта система, направленная на синтез пептидного феромона типа плантарицина, участвует во внутривидовых механизмах клеточных взаимодействий. В этом случае пептидный феромон используют как средство для измерения плотности клеток вида, синтезирующего данную молекулу. (Diep et al., 1994. The gene, encoding plantaricin A, a bacteriocin from Lactobacillus plantarum С11, is located on the same transcription unit as an agr-like regulatory system. Appl Environ Microbiol 60:160-166). Другие исследования показали также, что пептидные феромоны типа плантарицина могут участвовать в механизмах межвидовых клеточных взаимодействий. В частности, присутствие конкурирующих микроорганизмов может активировать регулирующую систему, участвующую в механизмах антагонизма микробов (Maldonado et al., 2004. Production of plantaricin NC8 by Lactobacillus plantarum NC8 is induced in the presence of different types of Gram-positive bacteria. Arch Microbiol 181:8-16). В присутствии других видов микробов с высокой плотностью клеток пептидный феромон вызывает каскад реакций фосфорилирования, участвующих в сложном способе метаболической регуляции, приводящем к синтезу сигнальных молекул, специфически действующих как антимикробные соединения типа бактериоцина (например, плантарицинов А, K и N) (Hauge et al., 1998. Plantaricin A is an ampkiphilic alpha-helical bacteriocin-like pheromone which exerts antimicrobial and pheromone activities through different mechanisms. Biochemistry 37:16026-16032).
Хотя механизм клеточных взаимодействий между прокариотными и эукариотными клетками частично установлен, существует очень небольшое количество литературы, касающейся взаимодействий сигнальных молекул, принимающих участие в механизмах "quorum sensing» бактерий (например, пептидных феромонов) и клеток слизистой кишечника человека. Единственный пример - это CSF пентапептид, синтезированный пробиотическим микроорганизмом Bacillus subtilis в качестве молекулы, участвующей в явлении конкуренции и споруляции (Fujija et al., 2007. The Bacillus subtilis quorum-sensing molecule CSF contributes to intestinal homeostasis via OCTN2 a host cell membrane transporter. Cell Host Microbe 1:299-308). Было показано, что пентапептид способен индуцировать р38 MAP киназу, В киназу (Akt) и устойчивость к замораживанию, предотвращая, таким образом, окислительное повреждение на кишечном уровне и восстанавливая барьерную функцию. Кроме того, при настоящем уровне техники отсутствуют публикации или патенты, связанные с влиянием сигнальных молекул, участвующих в механизмах взаимодействия бактериальных клеток с эпидермисом человека.
Авторы изобретения показали, что плантарицин, особенно плантарицин А, оказывает положительный эффект на барьерную функцию кератиноцитов эпидермиса человека, а также клеток кишечника.
Известны исследования способов приготовления плантарицина с помощью монокультур бактерий (внутривидовые культуры). Однако культивирование представляющих интерес микроорганизмов осуществляется в сложной и слишком дорогой культуральной среде, чтобы использовать его в промышленном масштабе для приготовления сигнальных молекул, предназначенных для терапевтических целей.
Авторы изобретения разработали способ приготовления плантарицина с помощью совместного культивирования двух специфических видов молочнокислых бактерий, пригодных для получения большего выхода по сравнению с имеющимся уровнем техники. В частности, культивирование L. plantarum DC400 (заявленного как DSMZ 21 декабря 2009 под номером DSM 23213) совместно с L. rossiae DPPMA174 (заявленного как DSMZ December 2009 под номером DSM 23214) позволяет активировать синтез пептидного феромона плантарицинового типа (в частности, плантарицина А), получая концентрации приблизительно в 50 раз большие, чем в присутствии монокультуры L. plantarum DC400 (DSM 23213). Кроме того, было показано, что культивирование L. plantarum DC400 (DSM 23213) вместе с другими видами молочнокислых бактерий, также выделенных с помощью «естественной закваски», не подходит для стимуляции синтеза пептидного феромона в сочетании с L. rossiae. Еще один важный аспект способа, связанного с изобретением, - это то обстоятельство, что синтез плантарицина А возможен не только в обычно применяемой для молочнокислых бактерий культуральной среде, но также и на виноградном сусле, молочной сыворотке и водных экстрактах продуктов фруктов и овощей.
Согласно современному уровню техники нет публикаций или патентов, описывающих синтез плантарицина типа А (PlnA) как механизм ответа совместного культивирования двух видов молочнокислых бактерий (например, L. plantarum и L. sanfranciscensis), происходящего в той же пищевой экосистеме, что и «естественная закваска», применяемая для образования дрожжевых пекарских продуктов. Кроме того, согласно литературе не было сообщений о повышенном синтезе плантарицина А в совместной культуре (межвидовой культуре) по сравнению с условиями монокультуры (внутривидовой культуре). Вдобавок, как упоминалось выше, известные способы очень дороги и используют сложную культуральную среду.
Кроме того, было обнаружено, что биомасса, полученная по изобретению, содержащая один или несколько плантарицинов в совместной культуре молочнокислых бактерий L. plantarum DC400 (DSM 23213) и L. rossiae DPPMA174 (DSM 23214), обладает большей эффективностью в восстановлении барьерной функции эпидермиса и стенки кишечника по сравнению с плантарицином одного типа.
По изобретению молочнокислые бактерии относились к виду Lactobacillus, и их выделяли из «натуральной закваски» обычно для выпечки хлеба в Южной Италии.
Биотехнологический протокол, включающий совместное культивирование двух упомянутых видов бактерий в CDM (Химически определенной среде), WFH (Гидролизате пшеничной муки) (Gobbetti, 1998. The sourdough microflora: interactions of lactic acid bacteria and sourdoughs. Trends Food Sci Technol 9:267-274), виноградном сусле (разбавленном в 1% растворе углеводов с добавлением 0.5% мальтозы и 0.5% дрожжевого экстракта, рН 5.6), молочной сыворотки (с добавлением 0.5% мальтозы и 0.5% дрожжевого экстракта, рН 5.6) или водных экстрактов овощных и фруктовых продуктов (с добавлением 0.5% мальтозы и 0.5% дрожжевого экстракта, рН 5.6) в течение 18-24 ч при 30-37°С был стандартизирован и оптимизирован. В конце культивирования клетки могут быть удалены или не удалены из культурального бульона путем центрифугирования, после чего супернатант дегидратируют путем высушивания или лиофильного высушивания. Ниже описана схема биотехнологического протокола для технологии приготовления лекарственного средства на основе плантарицина А.
Культивирование молочнокислых бактерий при 30°С в течение 24 ч, промывание, суспендирование в воде при плотности клеток 9.0 log КОЕ/мл и Ко-инокуляция в (1-4%) культуральную среду (CDM, WFH, виноградное сусло, молочная сыворотка, водные экстракты фруктовых и овощных продуктов)
↓
Культивирование при 30-37°С в течение 18-24 ч
↓
Удаление клеток центрифугированием
↓
Дегидратация супернатанта путем высушивания или лиофильного высушивания.
Приготовление препарата для аппликации при лечении патологий кожи.
Если выполняется культивирование L. plantarum DC400 (DSM 23213) и L. rossiae DPPMA174 (DSM 23214) в условиях совместного культивирования на любом из упомянутых выше субстратов, отмечается синтез плантарицина А в концентрациях от 2.5 до 4.0 мкг/мл. В условиях монокультуры концентрация плантарицина А, синтезируемого L. plantarum DC400 (DSM 23213), составляет приблизительно 0.06 мкг/мл. В условиях совместного культивирования с другими видами молочнокислых бактерий (например, Pediococcus pentosaceus, Lactobacillus pentosus, Lactobacillus brevis, Lactobacillus rossiae, Lactobacillus rhamnosus) синтез плантарицина А значительно меньше. В условиях совместного культивирования с L. rossiae DPPMA174 (DSM 23214) наблюдается синтез других пептидных феромонов, таких как плантарицин типа K и N, хотя в меньших концентрациях, чем плантарицин А, главным образом, в интервале от 0.02 до 0.06 мкг/мл. Согласно одной возможной лекарственной форме аппликация 2.5 мкг/мл плантарицина А стимулирует барьерные функции, как видно на модели восстановленного эпидермиса (SkinEthic®) и следует из исследования Трансэпителиального Электрического Сопротивления (TEER). Аналогичные результаты были получены на кишечных клетках Сасо-2/ТС7, применяемых для восстановления слизистой оболочки кишечника.
Согласно дополнительным исследованиям, выполненным с помощью микробиологических и хроматографических способов и исследований in vitro и ex-vivo на клеточных культурах, никогда не применявшееся ранее совместное культивирование L. plantarum DC400 (DSM 23213) и L. rossiae DPPMA174 (DSM 23214) в соответствии с изобретением позволяет (i) синтезировать сигнальные молекулы, участвующие в механизмах межвидовых клеточных взаимодействий в концентрациях, не регистрируемых в присутствии других сочетаний молочнокислых бактерий в одной экосистеме; (ii) синтезировать плантарицин А и другие плантарицины (K и N), также использующие недорогие субстраты; и (iii) оказывать защитное действие, увеличивающее барьерную функцию эпидермиса и кишечных клеток, что свидетельствует о том, что сигнальные молекулы, синтезированные клетками прокариотов, влияют также на клетки эукариотов.
Таким образом, специфической целью изобретения является биотехнологический способ, обеспечивающий синтез биомассы, содержащей или состоящей из, по меньшей мере, одного плантарицина, выбранного из плантарицинов А, K или N, предпочтительно А, или их смесей и молочнокислых бактерий Lactobacillus plantarum DSM 23213 и Lactobacillus rossiae DSM 23214 или приготовление одного или большего числа плантарицинов, выбранных из плантарицинов А, K или N, предпочтительно А, или их смесей, причем упомянутый способ состоит из следующих этапов или содержит их:
a) культивирование молочнокислых бактерий Lactobacillus plantarum DSM 23213 и Lactobacillus rossiae DSM 23214;
b) ко-инокуляция водной суспензии молочнокислых бактерий, описанных в этапе а), на субстрат, выбранный из группы, состоящей из CDM, WFH, виноградного сусла или экстрактов фруктовых или овощных продуктов.
c) инкубация; и
d) при необходимости, центрифугирование культуральной среды для удаления клеток молочнокислых бактерий.
В частности, клеточная плотность суспензии на этапе а) может равняться приблизительно 9.0 log КОЕ/мл для каждого вида молочнокислых бактерий, и клетки добавляют к субстрату в концентрациях от 1 до 4% объема субстрата. Этап инкубации можно осуществлять при температуре от 30 до 37°С в течение 18-24 ч, предпочтительно 18 ч, а центрифугирование можно выполнять при 10000 g в течение 15 мин при 4°С.
Способ по изобретению может также включать этап е) для дегидратации супернатанта, полученного в результате d), путем высушивания или лиофильного высушивания.
Следующая цель изобретения - получение согласно описанному выше способу биомассы, состоящей из или содержащей по меньшей мере, один плантарицин, выбранный из плантарицинов А, K или N, предпочтительно А, или их смесей и молочнокислых бактерий Lactobacillus plantarum DSM 23213 е Lactobacillus rossiae DSM 23214.
Изобретение также относится к фармацевтической или косметической композиции, содержащей или состоящей из описанной выше биомассы в качестве активного агента в сочетании с одним или большим количеством фармацевтически приемлемых наполнителей и/или адьювантов.
Особый аспект изобретения также относится к применению описанных выше биомассы или композиции для приготовления лекарственного препарата, предназначенного для увеличения барьерной функции эпидермиса или кишечной стенки или для заживления ран.
Молочнокислые бактерии Lactobacillus plantarum DSM 23213 или Lactobacillus rossiae DSM 23214 или их смеси являются дополнительной целью изобретения.
Изобретение также относится к применению одного или большего числа плантарицинов, выбранных из плантарицинов А, K или N, предпочтительно А, для приготовления лекарственного препарата, предназначенного для увеличения барьерной функции эпидермиса или кишечной стенки, или для заживления ран.
Изобретение будет описано иллюстративным, но не ограничивающим способом согласно предпочтительным воплощениям, в частности, со ссылкой на приложенные рисунки.
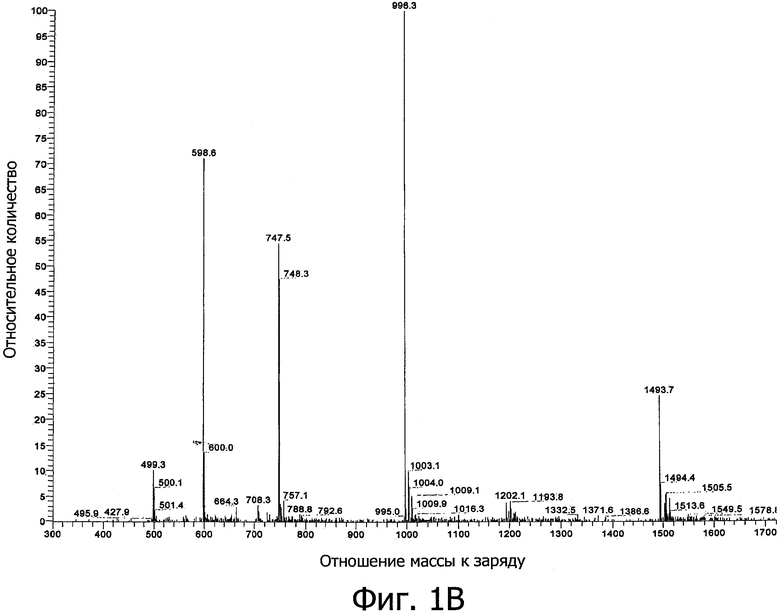
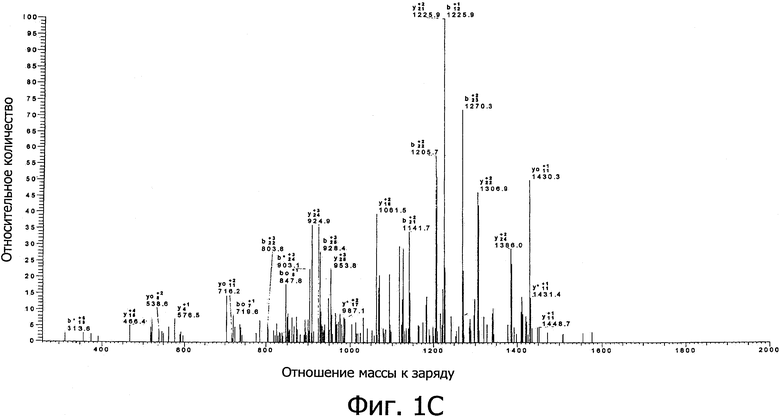
Фиг. 1а демонстрирует результаты действия ионной ловушки с ионизацией электроспреем (ESI) MS (нано-ESI/MS-MS), сопряженной с многомерным HPLC (MDLC) анализом бесклеточного супернатанта культуральной среды, полученного при совместном культивировании Lactobacillus plantarum DC400 (DSM 23213) и Lactobacillus rossiae DPPMA174 (DSM 23214). Фиг. 1b демонстрирует хроматограмму, полученную из реальной хроматограммы фиг. 1а, на основе времени специфического поступления в зависимости от отношения массы к заряду для плантарицина А. Фиг. 1c демонстрирует MS/MS спектр, регистрирующий виды на основе отношения m/z, равного 1493.7, как на хроматограмме фиг. 1а.
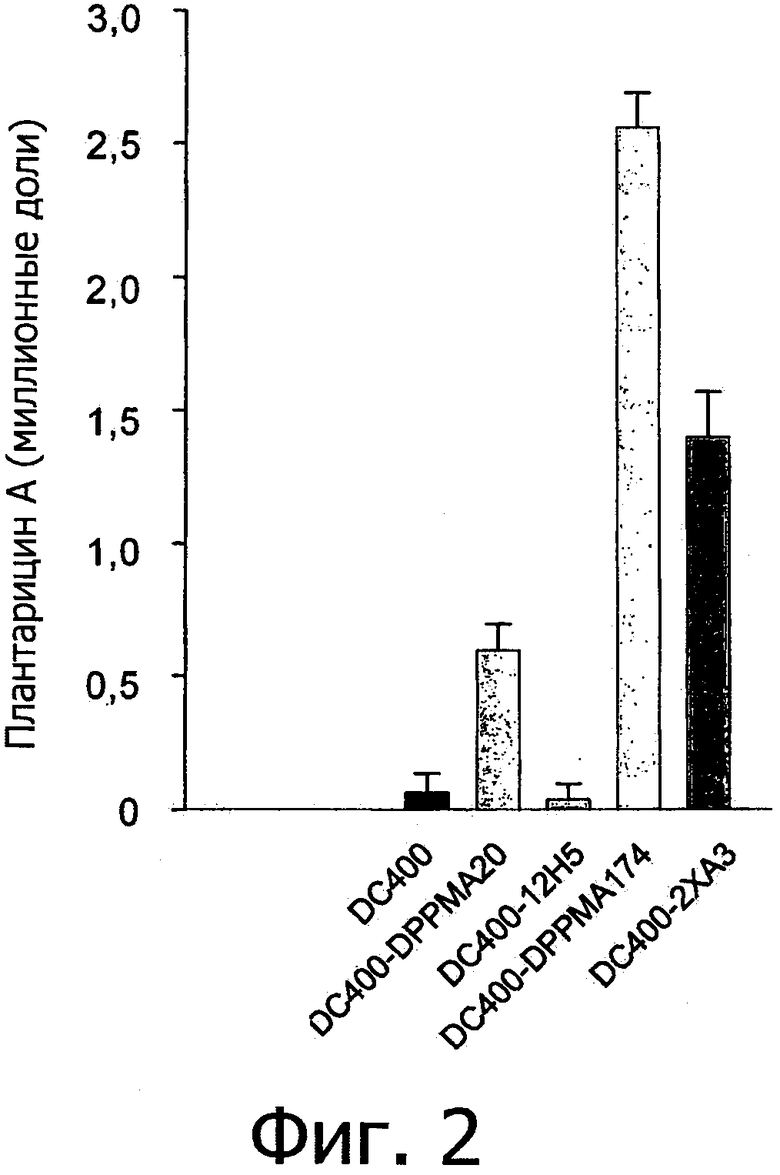
Фиг. 2 демонстрирует концентрацию плантарицина А, синтезированного монокультурами Lactobacillus plantarum DC400 (DC400), L. plantarum DPPMA 20 (DPPMA20), Lactobacillus pentosus 12H5 (12H5), Lactobacillus rossiae DPPMA174 (DPPMA174) и Pediococcus pentosaceus 2XA£ (2XA3) и совместными культурами L. plantarum DC400 с L. plantarum DPPMA20 (DC400-DPPMA20), L. pentosus 12H5 (DC400-12H5); L. rossiae DPPMA174 (DC400-DPPMA174) или Р. pentosaceus 2XA3 (DC400-2XA3). Приведены средние значения из трех экспериментов.
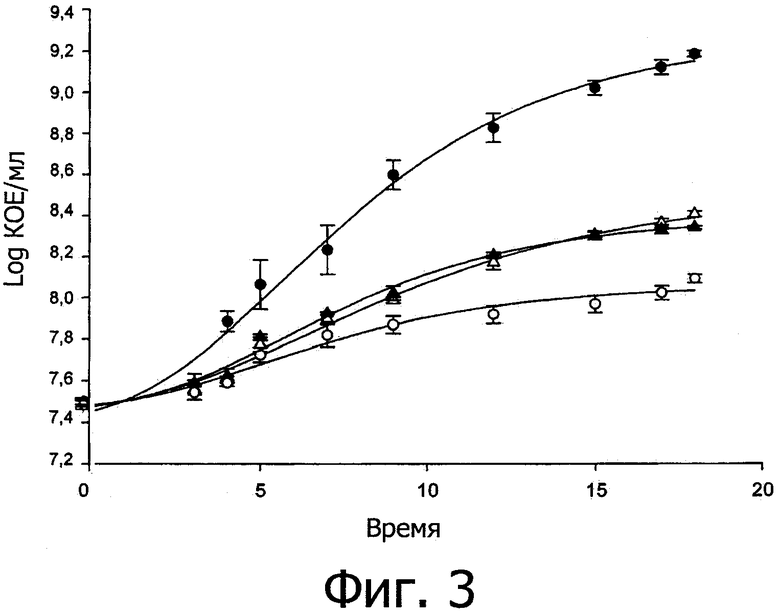
Фиг. 3 демонстрирует кинетику роста Lactobacillus rossiae DPPMA174. Монокультура (•); совместная культура с Lactobacillus plantarum DC400 (○); монокультура с очищенным плантарицином А (2.5 мкг/мл) (Δ); и монокультура с химически синтезированным плантарицином А (2.5 мкг/мл) (▲). Очищенный плантарицин А соответствует плантарицину А, синтезированному совместной культурой L. plantarum DC400 и L. rossiae DPPMA174. Приведены средние значения из трех экспериментов.
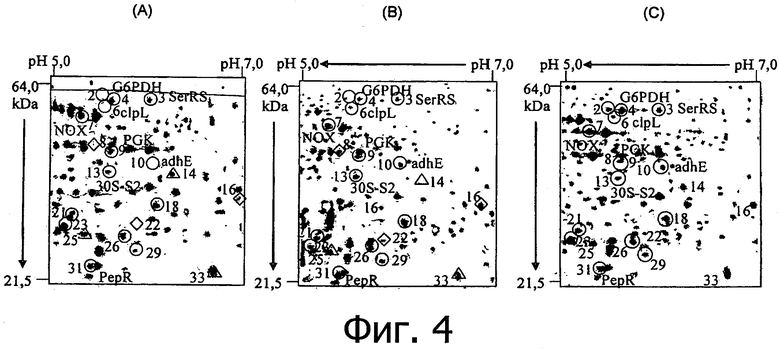
Фиг. 4 демонстрирует участки геля, относящиеся к двумерному электрофоретическому анализу белков, экспрессированных Lactobacillus rossiae DPPMA174, после культивирования в течение 18 ч. Панель А, монокультура; панель В, совместная культура с Lactobacillus plantarum DC400; и панель С, монокультура в присутствии очищенного плантарицина А (2.5 мкг/мл). Числа с овальными или треугольными значками относятся к белкам, обозначая степень увеличения или уменьшения их экспрессии в культуре L. plantarum DC400 или в очищенном плантарицине А. Числа с ромбическими или двойными треугольными значками относятся к белкам, обозначая степень увеличения или уменьшения их экспрессии только в совместной культуре с L. plantarum DC400.
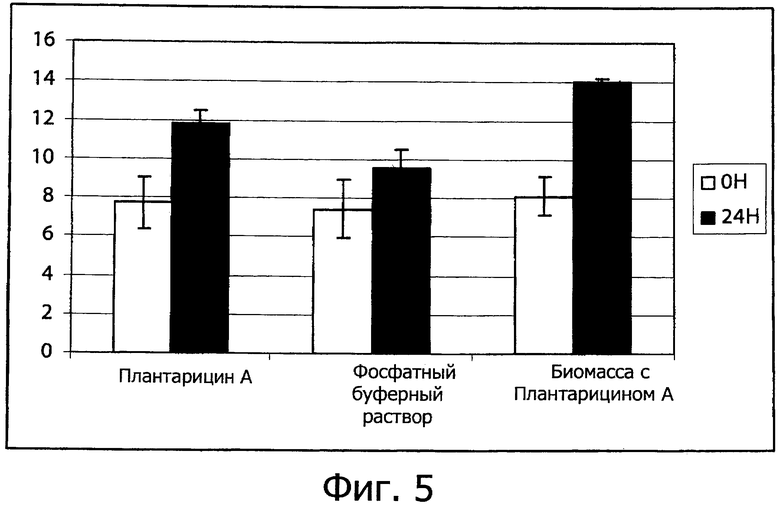
Фиг. 5 демонстрирует Трансэпитеплиальное Электрическое Сопротивление (TEER) (Ом·см2) восстановленного эпидермиса (SkinEthic®) после выдерживания от 0 до 24 ч в PBS буфере, плантарицине А (2.5 мкг/мл) или в биомассе, содержащей 2.5 мкг/мл плантарицина А, соответственно. Приведены средние значения из трех экспериментов.
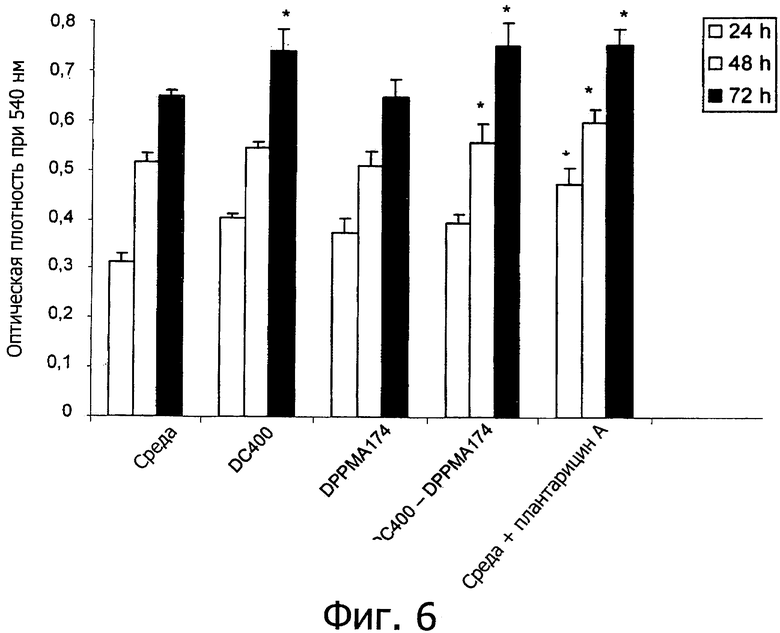
Фиг. 6 демонстрирует жизнеспособность клеток Сасо2/ТС7, измеренную по поглощению Нейтрального Красного после 24, 48 и 72 ч инкубации с очищенным плантарицином А (2.5 мкг/мл), образованным монокультурой Lactobacillus plantarum DC400 (DC400) или ее совместной культурой с Lactobacillus rossiae DPPMA174 (DC400-DPPMA174). Очищенную фракцию монокультуры L. rossiae DPPMA174, элюированную в хроматографических условиях, как для плантарицина А, использовали в качестве отрицательного контроля (DPPMA174). Другой отрицательный контроль - это DMEM культуральная среда (DMEM). Химически синтезированный плантарицин А (2.5 мкг/мл) использовали в качестве положительного контроля (PlnA). Приведены средние значения из трех экспериментов. Звездочкой отмечены достоверные отличия (Р<0.01) от отрицательного контроля
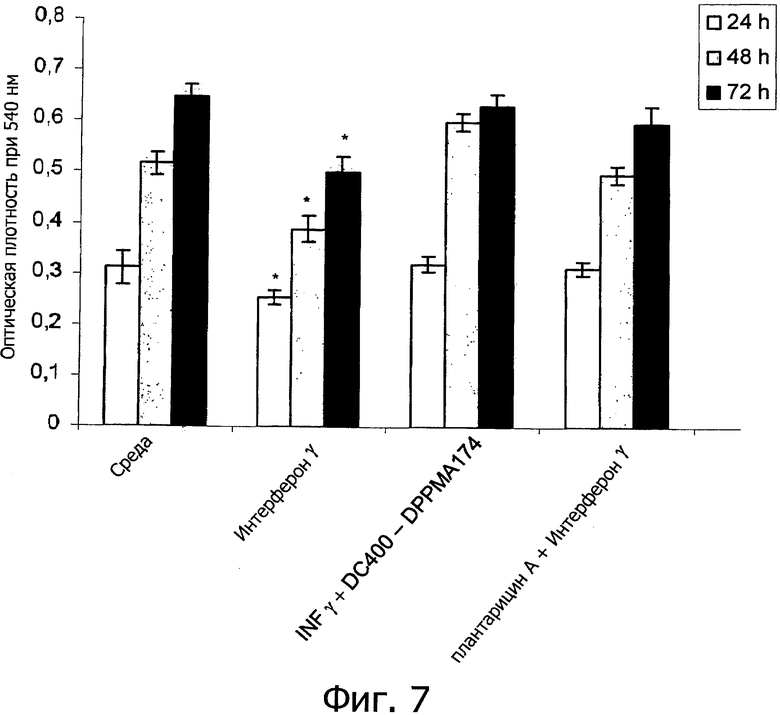
Фиг. 7 демонстрирует жизнеспособность клеток Сасо2/ТС7, измеренную по поглощению Нейтрального Красного после 24, 48 и 72 ч инкубации только с γ-интерфероном (IFN-γ) (1000 ед/мл) и с IFN-γ + очищенный плантарицин А (2.5 мкг/мл) (IFN-γ+DC400-DPPMA174). Очищенный плантарицин получают из совместной культуры Lactobacillus plantarum DC400 и Lactobacillus rossiae DPPMA174. Культуру в среде DMEM использовали в качестве отрицательного контроля (DMEM). Химически синтезированный плантарицин А (2.5 мкг/мл) вместе с IFN-γ использовали в качестве положительного контроля (PlnA). Приведены средние значения из трех экспериментов. Звездочкой отмечены достоверные отличия (Р<0.01) от отрицательного контроля.
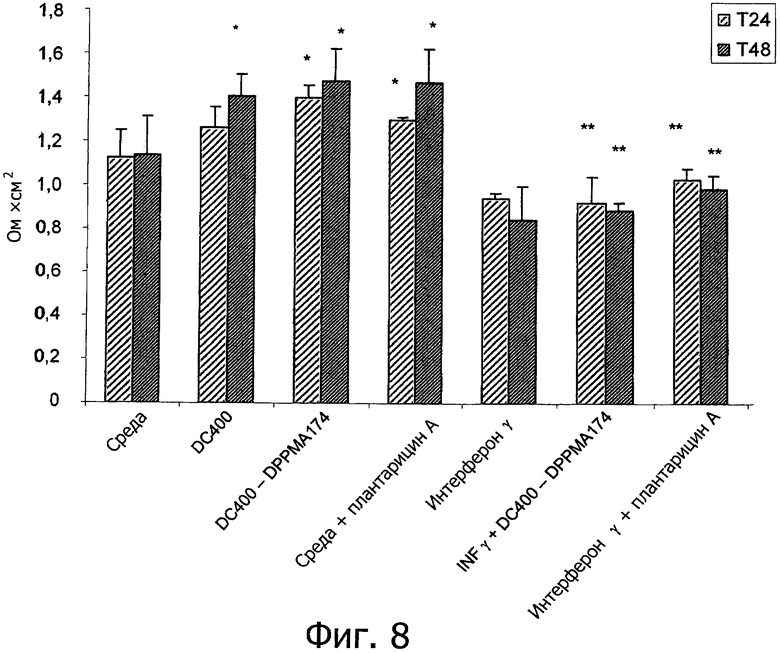
Фиг. 8 демонстрирует Трансэпителиальное Электрическое Сопротивление (Ом·см2) клеток Сасо2/ТС7 после 24 и 48 ч инкубации. Инкубацию осуществляли с очищенным плантарицином А (2.5 мкг/мл) из монокультуры Lactobacillus plantarum DC400 (DC400); очищенным плантарицином А (2.5 мкг/мл) из совместной культуры L. plantarum DC400 и Lactobacillus rossiae DPPMA174 (DC400-DPPMA174); химически синтезированным плантарицином А (2.5 мкг/мл) (PlnA); γ-интерфероном (IFN-γ) (1000 Ед/мл) и очищенным плантарицином А из совместной культуры L. plantarum DC400 и L. rossiae DPPMA174 (IFN-γ+DC400-DPPMA174); и с IFN-γ и химически синтезированным плантарицином А (PlnA+IFN-γ). Культуру в среде DMEM использовали в качестве отрицательного контроля (DMEM). Приведены средние значения из трех экспериментов.
Звездочкой отмечены достоверные отличия (Р<0.01) от отрицательного контроля
Фиг. 9 демонстрирует результаты исследований по заживлению ран на контрольных кератиноцитах, кератиноцитах обработанных плантарицином А или биомассой, содержащей плантарицин А, соответственно.
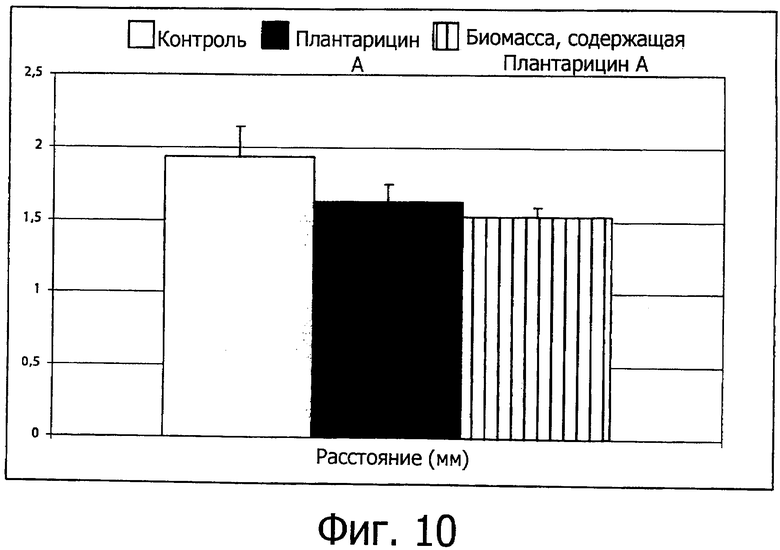
Фиг. 10 демонстрирует расстояние между краями раны, обработанной контрольным раствором, плантарицином А или биомассой, содержащей плантарицин А.
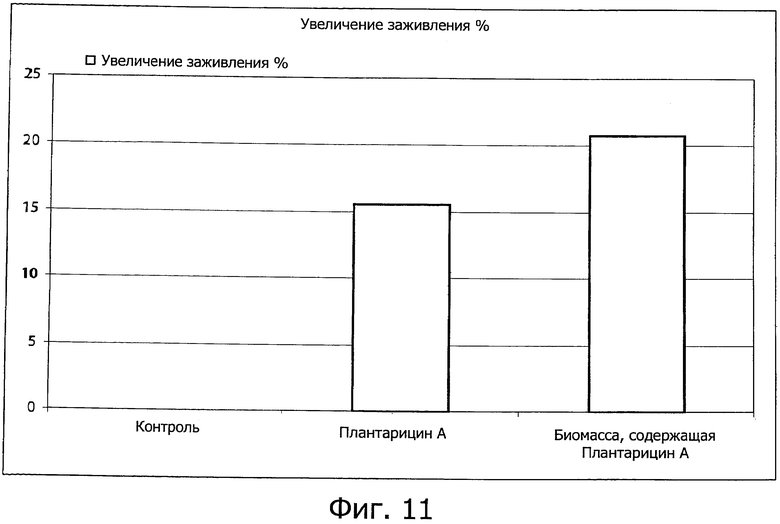
Фиг. 11 демонстрирует процентное возрастание заживления раны, обработанной контрольным раствором, плантарицином А или биомассой, содержащей плантарицин А.
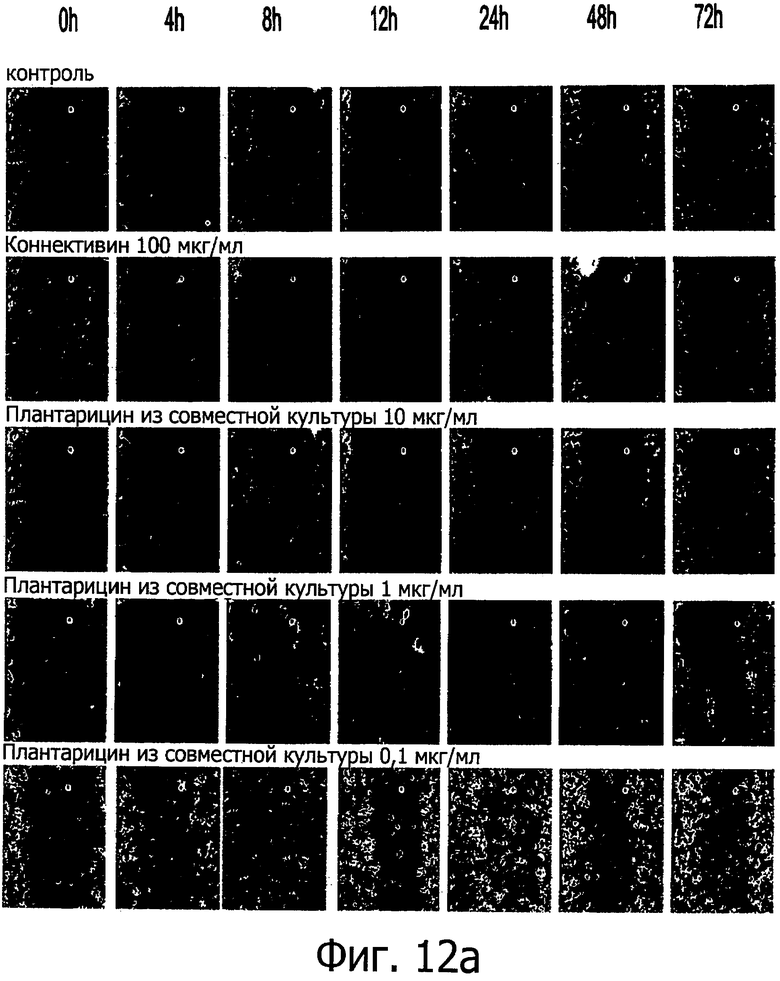
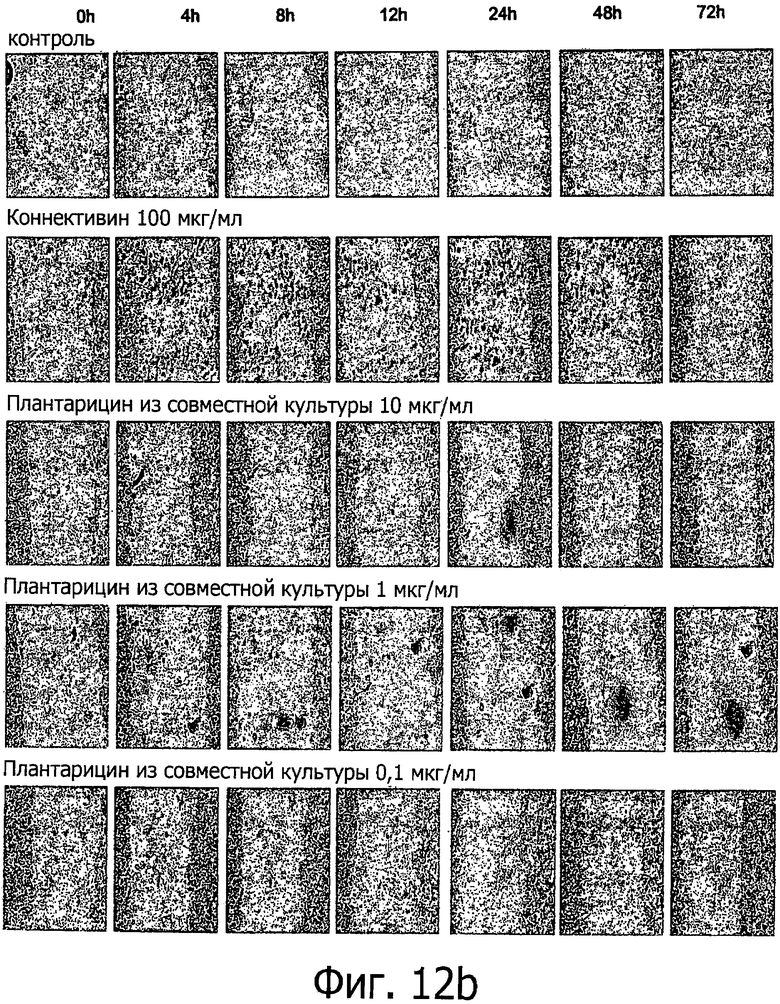
Фиг. 12 демонстрирует репрезентативные изображения монослоя кератиноцитов человека 2544, обработанных после вырезания плантарицином из совместной культуры (а) и синтетическим плантарицином (b), при указанных разных временных интервалах. Вырезание монослоя выполняли с помощью кончика пипетки на 200 мкл. Клетки обрабатывали совместной культурой и синтетическим плантарицином независимо при концентрациях 0.1, 1 и 10 мкг/мл.
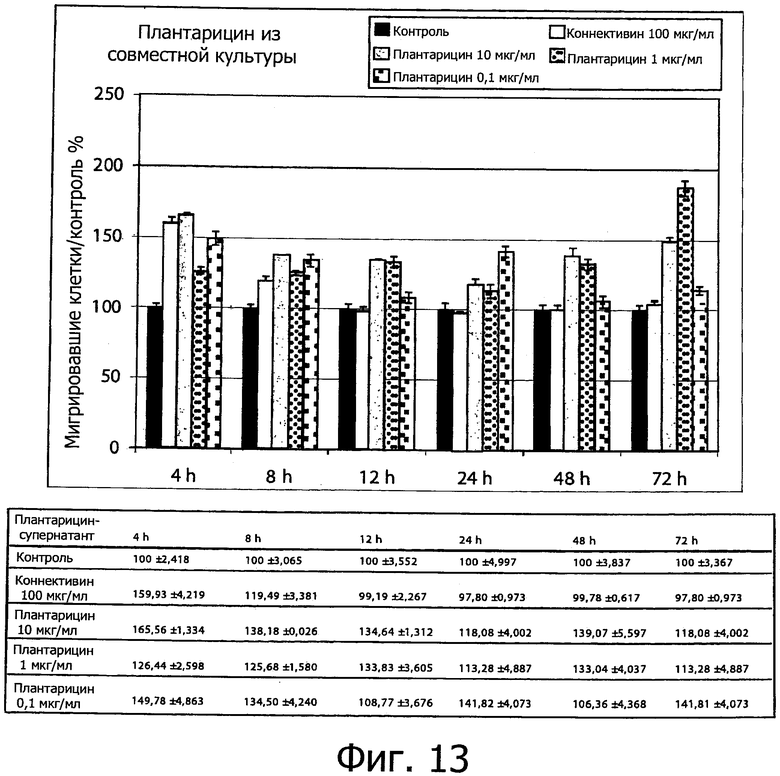
Фиг. 13 демонстрирует процентное содержание клеток, мигрирующих через площадь выреза после обработки плантарицином, получаемым при совместном культивировании (0.1, 1 и 10 мкг/мл). Процент миграции определяли, измеряя величину не заполненной площади между двумя линиями отсечения после 0, 4, 8, 12, 24, 48 и 72 ч после выреза. Столбцы соответствуют средним значениям ± S.E.M из двух трижды повторенных независимых экспериментов.
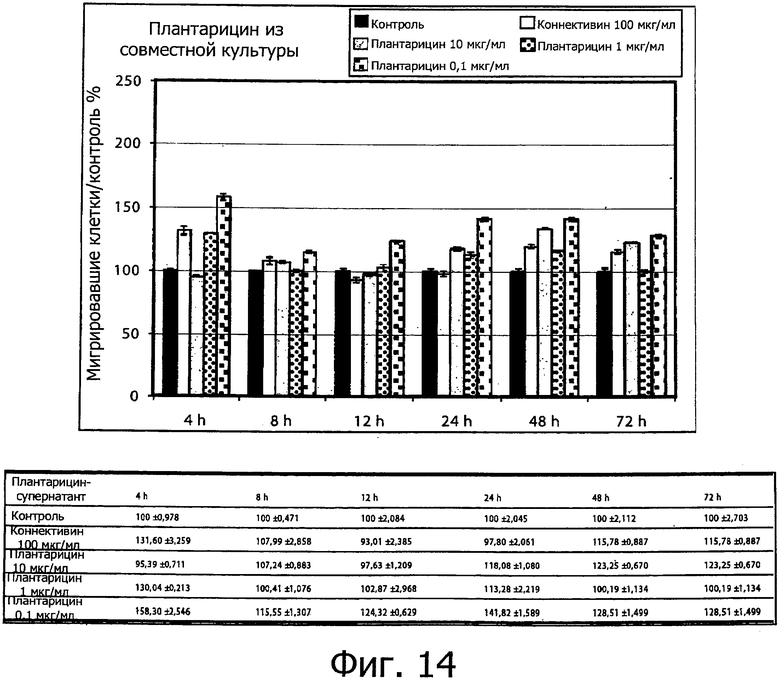
Фиг. 14 демонстрирует процентное содержание клеток, мигрирующих через площадь выреза после обработки синтетическим плантарицином (0.1, 1 и 10 мкг/мл). Процентное содержание клеток определяли, измеряя величину не заполненной площади между двумя линиями отсечения через 0, 4, 8, 12, 24, 48 и 72 ч после выреза по сравнению с исходной не заполненной площадью. Столбцы соответствуют средним значениям ± S.E.M из двух трижды повторенных независимых экспериментов.
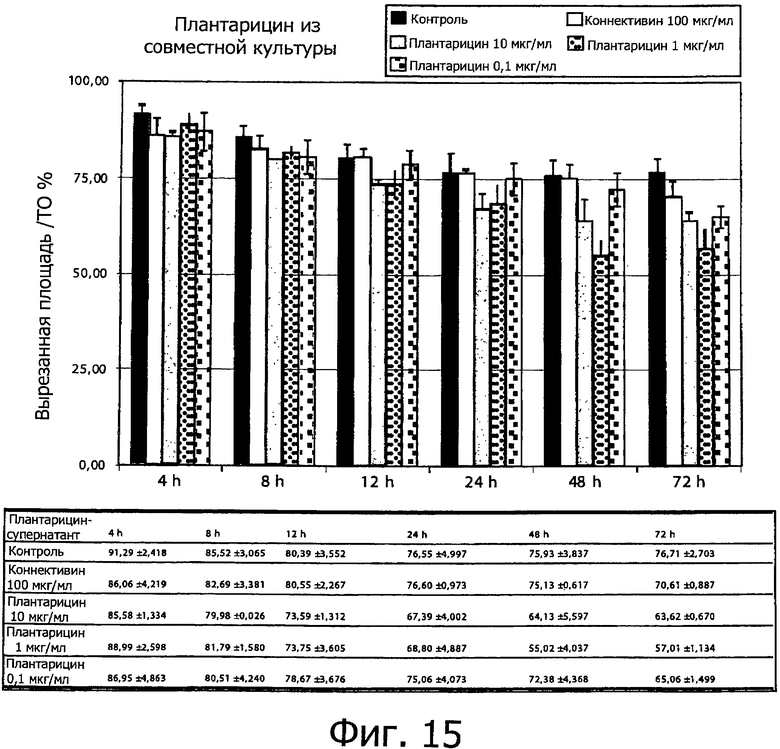
Фиг. 15 демонстрирует процентное отношение не заполненной площади по отношению к исходной площади выреза после обработки монослоя кератиноцитов человека NCTC2544 плантарицином из совместной культуры (0.1, 1 и 10 мкг/мл). Процентное содержание миграции определяли, измеряя величину не заполненной площади между двумя линиями отсечения через 0, 4, 8, 12, 24, 48 и 72 ч после выреза по сравнению с исходной не заполненной площадью. Столбцы соответствуют средним значениям ± S.E.M из двух трижды повторенных независимых экспериментов.
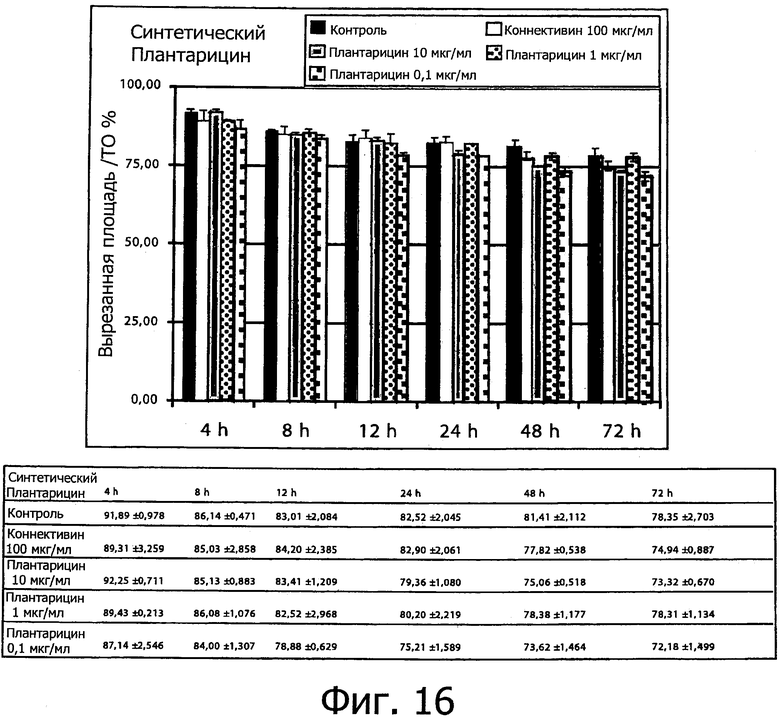
Фиг. 16 демонстрирует процентное отношение не заполненной площади по отношению к исходной площади выреза после обработки монослоя кератиноцитов человека NCTC2544 плантарицином из совместной культуры (0.1, 1 и 10 мкг/мл). Процентное содержание миграции определяли, измеряя величину не заполненной площади между двумя линиями отсечения после 0, 4, 8, 12, 24, 48 и 72 ч после выреза по сравнению с исходной не заполненной площадью. Столбцы соответствуют средним значениям ± S.E.M из двух трижды повторенных независимых экспериментов.
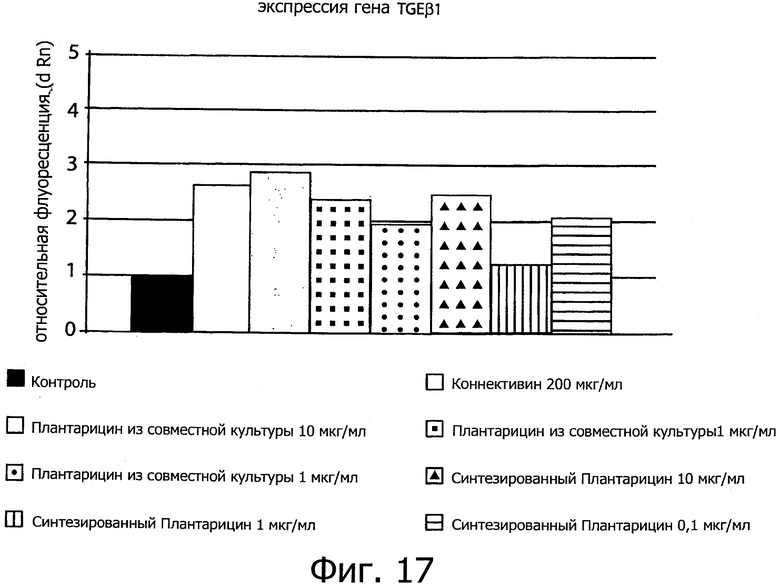
Фиг. 17 демонстрирует влияние плантарицина из совместной культуры (0.1, 1 и 10 мкг/мл), синтетического плантарицина (0.1, 1 и 10 мкг/мл) и коннективина (200 мкг/мл) на экспрессию TGF β.1 в монослое кератиноцитов человека NCTC 2544, вырезанном с помощью кончика пипетки на 200 мкл.
Сведения, подтверждающие возможность осуществления изобретения
Пример 1. Синтез и очистка пептидных феромонов типа плантарицина и исследование их влияния на эпидермис и клетки Сасо-2
L. plantarum DC400 (DSM 23213) и L. rossiae DPPMA174 (DSM) из Collezione di Colture del Dipartimento di Protezione delle Piante e Microbiologia Applicata dell'Universita degli Studi di Bari, предварительно выделенные из «натуральной закваски», культивировали при 30°С в течение 24 ч в модифицированной MRS среде (mMRS), содержащей помимо обычных ингредиентов 5% мальтозы и 10% дрожжевой воды - конечный рН 5.6.
Клетки, культивированные 24 ч, собранные центрифугированием (10000 g в течение 15 мин при 4°С), дважды промытые 50 мМ фосфатным буфером, рН 7.0 и ресуспендированные в воде при плотности клеток 9.0 log КОЕ/мл, инокулировали (4%, для каждого вида) в условиях моно- или совместной культуры в WFH культуральную среду (Gobbetti, 1998. The sourdough microflora: interactions of lactic acid bacteria and sourdoughs. Trends Food Ski Technol 9:267-274). Аналогичная процедура была выполнена, и описанные ниже аналогичные результаты были получены с применением виноградного сусла (разбавленного 1% раствором углевода с добавлением 0.5% мальтозы и 0.5% дрожжевого экстракта, рН 5.6), молочной сыворотки (см. предыдущую комбинацию) или водных экстрактов овощных и фруктовых продуктов (см. предыдущую комбинацию) в качестве культуральных субстратов. Инкубацию осуществляли в течение 18 ч при 30°С. После удаления клеток центрифугированием (10000 g в течение 10 мин при 4°С), добавляли супернатанты моно- и совместной культуры с трифторуксусной кислотой (0.05%) и центрифугировали при 10000 g в течение 10 мин. Супернатант фильтровали через фильтры с диаметром пор 0.22 мкм. Хроматографический HPLC анализ выполняли, используя AKTA очистительную (GE Healthcare) аппаратуру, снабженную детектором, действующим при 214 нм, и колонку с обращенной фазой С18 XTerra (Waters, Mildford). В качестве жидкой фазы использовали смесь воды, 2-пропанолола и трифторуксусной кислоты (0.05%). Все типы фракций, содержащих плантарицин А, анализировали с помощью масс-спектрометра MS с ионной ловушкой ESI, сопряженного с многомерным хроматографом (MDLC). Условия анализа для идентификации и количественного определения плантарицинов А, K и N соответствуют Di Cagno et al. (Di Cagno et al., 2010.Quorum sensing in sourdough Lactobacillus plantarum DC400 (DSM 23213): induction of plantaricin A (PlnA) under co-cultivation with other lactic acid bacteria and effect of PlnA on bacterial and Caco-2 cells. Proteomics in press).
(2) Кинетика роста Lactobacillus rossiae DPPMA174 (DSM 23214)
Данные по кинетике роста L. rossiae DPPMA174 (DSM 23214) обрабатывали с помощью успешно модифицированного уравнения Gompertz equation (Zwietering et al., 1990. Modelling of bacterial growth curve. Appl Environ Microbiol 56:1875-1881). Количество клеток определяли путем выращивания в SDB культуральной среде при 30°С в течение 48 ч. Жизнеспособность клеток и число поврежденных и/или погибших клеток определяли с помощью LIVE/DEAD набора с фоновой подсветкой для определения жизнеспособности бактерий (Molecular Probes, INc., Cambridge).
(3) Анализ с помощью двумерного электрофореза и идентификация белков
Анализ цитоплазматических белков из моно- или совместной культуры L. rossiae DPPMA174 (DSM 23214) осуществляли с помощью двумерного электрофореза на иммобилизованной полиакриламидной системе (De Angelis et al., 2005. Biochim. Biophys. Acta. 1762:80-93). Анализировали четыре геля для каждого условия, и результаты стандартизовали согласно процедуре Bini et al. (Bini et al., 1997. Protein expression profiles in human breast ductal carcinoma and histologically normal tissue. Electrophoresis. 18:2831-2841).
Идентификацию белка осуществляли, используя анализ LC-ESI-MS/MS и сравнение полученных последовательностей с различными базами данных (National Center for Biotechnology Information, Bethesda, MD, USA; Propound, http://www.prowl.rockefeller.edu/cgibin/ProFound).
(4) Исследования реконструированного эпидермиса и определение EER (Трансэпителиального Электрического Сопротивления)
Реконструированный эпидермис человека SkinEthic® (Reconstructed Human Epidermis) состоит из нормальных кератиноцитов многослойного эпидермиса человека. Это полностью дифференцированная культура кератиноцитов человека в химически определенной культуре (MCDM 153), без добавления телячьей сыворотки, на инертной поликарбонатной пористой подложке на границе воздух-жидкость в течение свыше 17 дней. На этом этапе роста морфологический анализ демонстрирует многослойный жизнеспособный эпидермис и ороговевший слой, состоящий из более десяти компактных клеточных слоев. Использовали реконструированный эпидермис человека в соответствии с ранее описанным протоколом SkinEthic® (Di Cagno et al., 2009. Synthesis of γ-amino butyric acid (GABA) by Lactobacillus plantarum DSMZ19463: functional grape must beverage and dermatological application. Appl Biotechnol Microbiol DOI: 10.1007/s00253-009-23704).
Определение TEER осуществляли с помощью Millicell-ERS Вольтметра (Di Cagno et al., 2010. Quorum sensing in sourdough Lactobacillus plantarum DC400: induction of plantaricin A (PlnA) under co-cultivation with other lactic acid bacteria and effect of PlnA on bacterial and Caco-2 cells. Proteomics in press).
(5) Исследования на клетках Сасо-2/ТС7
Клетки Сасо-2/ТС7 человека (ТС7 клон) культивировали в среде Dulbecco (DMEM), добавляли телячью сыворотку (10%), неэссенциальные аминокислоты (1%), гентамицин/стрептомицин (50 мкг/мл), глутамин (2 мМ) и 4-2-гидроксиэтил-1-пиперазинил-этансульфоновую кислоту (1%) (Di Cagno et al., 2010. Quorum sensing in sourdough Lactobacillus plantarum DC400: induction of plantaricin A (PlnA) under co-cultivation with other lactic acid bacteria and effect of PlnA on bacterial and Caco-2 cells. Proteomics in press). Жизнеспособность клеток определяли по поглощению Нейтрального Красного (Balls et al., 1987. Approaches to validation alternative methods in toxicology. In: Goldber A.M. (Ed). N.Y. Academic Press pp.45-58). После 24-72 ч обработки различными препаратами, клетки отмывали PBS буфером и инкубировали 4 ч 37°С раствором Нейтрального Красного (33 мг/л). Затем клетки снова отмывали PBS буфером и обрабатывали лизирующим раствором (50% этанолом в воде, содержащей 1% уксусной кислоты). Величину посева определяли с помощью Novapath plate reader (Biorad, Hercules, CA). (Di Cagno et al., 2010. Quorum sensing in sourdough Lactobacillus plantarum DC400: induction of plantaricin A (PlnA) under co-cultivation conditions with other lactic acid bacteria and effect of PlnA on bacterial and Caco-2 cells. Proteomics in press).
Для определения TEER клетки Caco-2/TC7 высевали (7.5·104 клеток/мл) в 24-ячеечную плашку и полиэтиленовый фильтр (поры 0.4 мкм). Перед обработкой клетки инкубировали в течение 21 дня при 37°С. Обработку различными препаратами выполняли в течение 18, 24 и 48 ч. Целостность клеточного слоя определяли, таким образом, с помощью определения TEER.
Результаты
(1) Синтез и очистка пептидных феромонов типа плантарицина
После 18 ч роста в WFH культуральной среде плотность клеток монокультуры L. plantarum DC400 (DSM 23213) составляла 9.27±0.18 log KOE/мл. Значения µmax и λ составляли соответственно около 0.27 log КОЕ/мл/ч и 3.77 ч. Плотность клеток молочнокислых бактерий изменялась от 9.0±0.05 (L. brevis CR13) до 9.43±0.31 log КОЕ/мл (L. plantarum DPPMA20). Значения µmax изменялись от 0.11±0.05 (L. pentosus 12H5) до 0.15±0.04 log КОЕ/мл/ч (L. plantarum DPPMA20), так что значение λ изменялось от 0.37±0.07 (Р. pentosaceus 2XA3) до 4.20±0.36 ч (L. rossiae DPPMA174 (DSM 23214)). По сравнению с монокультурой плотность клеток L. plantarum DC400 (DSM 23213) не изменялась существенно (Р>0.05) (9.06±0.34 - 9.28±0.42 log КОЕ/мл), если микроорганизм культивировали совместно с другими молочнокислыми бактериями. Выход клеток L. plantarum DPPMA20, Lactobacillus paralimentarius 8D, L. pentosus 12H5, Lactobacillus reuteri e Weissella cibaria 10XA16 не зависел от условий совместного культивирования. Напротив, плотность клеток L. rossiae DPPMA174 (DSM 23214) и Р. pentosaceus 2XA3 достоверно снижена (Р<0.05) (около 8.08 и 8.39 log КОЕ/мл) по сравнению с культивированием в монокультуре. Вообще говоря, значения µmax снижены для всех молочнокислых бактерий при совместном культивировании с L. plantarum DC400 (DSM 23213). За исключением L. plantarum DPPMA20, латентная фаза λ увеличивается для всех молочнокислых бактерий. Штаммы молочнокислых бактерий, которые демонстрируют ингибирование (L. rossiae DPPMA174 (DSM 23214) и Р. pentosaceus 2XA) как следствие совместного культивирования С L. plantarum DC400 (DSM 23213), а некоторые штаммы в последующих экспериментах не зависели от условий совместного культивирования (L. plantarum DPPMA20 and L. pentosus 12H5).
В соответствии с предыдущими результатами число жизнеспособных клеток L. rossiae DPPMA174 (DSM 23214) снижено с 9.0±0.28 до 8.32±0.25 log клеток/мл в монокультуре по сравнению с совместной культурой с L. plantarum DC400 (DSM 23213). Число жизнеспособных и способных к культивированию клеток не проявляет достоверных различий (Р>0.05). Кроме того, по отношению к условиям монокультуры, число погибших или поврежденных клеток L. rossiae DPPMA174 (DSM 23214) достоверно (Р<0.05) увеличено в условиях совместного культивирования с L. plantarum DC400 (DSM 23213). Кроме того, количество культивируемых клеток Р. pentosaceus cells достоверно (Р<0.05) снижалось, когда молочные бактерии совместно культивировали с L. plantarum DC400 (DSM 23213).
После удаления клеток супернатанты моно- и совместной культуры использовали для определения пептидных феромонов типа плантарицина с помощью MDLC анализа, сопряженного с нано-ESI/MS-MS массспектрометром. Фиг. 1а демонстрирует хроматограмму, сканированную в полном диапазоне, образца совместной культуры L. plantarum DC400 (DSM 23213) и L. rossiae DPPMA174 (DSM 23214). Вследствие сложности матрикса было возможно идентифицировать некоторые формы, хотя, напротив, трудно осуществить полное разделение соседних пиков. Однако было возможно разделить элюируемые вместе формы фильтрацией сигнала в соответствии со специфическими значениями m/z. Пример идентифицированных форм представлен на фиг. 1b. Для всех форм были получены спектры MS/MS. Например, фиг. 1 с демонстрирует спектр, соответствующий значению 1493.7 m/z, выбранный для образца из совместной культуры L. plantarum DC400 (DSM 23213) и L. rossiae DPPMA174 (DSM 23214). Для последовательного исследования базы данных NCBInr были выбраны следующие параметры: вид (Lactobacillus), резистентность отношения массы к заряду m/z для распознавания иона (0.2 Да) и прибор, используемый для анализа. Присутствие плантарицина A (SEQ ID NO:1 Lys-Ser-Ser-Ala-Tyr-Ser-Leu-Gln-Met-Gly-Ala-Thr-Ala-Ile-Lys-Gln-Val-Lys-Lys-Leu-Phe-Lys-Lys-Trp-Gly-Trp) наблюдалось как для L. plantarum DC400 (DSM 23213) и DPPMA20 монкультур, так и для всех совместных культур, в которых штамм DC400 культивировали вместе с другими молочнокислыми бактериями.
Основываясь на предварительных результатах, образцы моно- и совместной культур очищали, используя 4-кратную хроматографию, и затем анализировали, используя нано- -ESI-MS, чтобы исключить загрязнение другими пептидами. Концентрацию плантарицина А, синтезированного L. plantarum DC400 (DSM 23213), определяли хроматографическим анализом, используя С18 XTerra колонку с обратной фазой (Waters, Mildford) и способ ориентированного полиамида ОРА. Фиг. 2 демонстрирует концентрацию плантарицина А при различных условиях. Можно видеть, что величина синтеза пептидного ферромона увеличивается в условиях совместной культуры в присутствии L. rossiae DPPMA174 (DSM 23214) (приблизительно 2.5 мкг/мл) по сравнению с монокультурой (приблизительно 0.06 мкг/мл). В определенных экспериментальных условиях концентрация плантарицина А составляет приблизительно 4.0 мкг/мл. Хотя в условиях совместной культуры с другими штаммами молочнокислых бактерий наблюдалось значительно меньшее образование плантарицина А, чем в совместной культуре L. plantarum DC400 (DSM 23213) и L. rossiae DPPMA174 (DSM 23214).
Этот результат свидетельствует о том, что синтез пептидного феромона специфичен в присутствии специфических взаимодействий, способствующих индукции высвобождения сигнальных молекул. Синтез плантарицина А начинается в способе промежуточной экспоненциальной фазы роста (приблизительно 7 ч) и возрастает до конца экспоненциальной фазы (приблизительно 12 ч). Хотя при меньших концентрациях, то есть приблизительно 0.02-0.06 мкг/мл, плантарицины типа K и N регистрировались только в совместных культурах L. plantarum DC400 (DSM 23213) и L. rossiae DPPMA174 (DSM 23214). Такие же результаты получались на следующих субстратах для совместного культивирования: DSM, виноградном сусле, молочной сыворотке или водных экстрактах фруктовых и овощных продуктов.
(2) Кинетики роста Lactobacillus rossiae DPPMA174 (DSM 23214)
L. rossiae DPPMA174 (DSM 23214) культивировали на культуральной среде WFH с добавлением 2.5 мкг/мл очищенного или химически синтезированного плантарицина А. На фиг. 3 показано, что присутствие очищенного плантарицина А приводит к существенному уменьшению числа клеток, то есть снижению от 9.18±0.26 (в условиях монокультуры) до 8.4±0.14 log КОЕ/мл. Аналогичные результаты были получены с химически синтезированным плантарицином А. В обоих случаях наблюдались результаты, аналогичные полученным с совместной культурой L. plantarum DC400 (DSM 23213) и L. rossiae DPPMA174 (DSM 23214). Количество поврежденных или погибших клеток L. rossiae DPPMA174 (DSM 23214) было достоверно (Р<0.05) выше при культивировании в присутствии очищенного или химически синтезированного плантарицина А, чем в монокультуре (приблизительно 8.80±0.14 против 6.08±0.22 log клеток/мл).
Полученные данные показывают, что ингибирующий эффект L. plantarum DC400 (DSM 23213) по сравнению с L. rossiae DPPMA174 (DSM 23214) связан с синтезом плантарицина А и, вероятно, других пептидных феромонов, принадлежащих к тому же химическому классу.
(3) Изменение уровня экспрессии белка в L. rossiae DPPMA174 (DSM 23214)
Двумерный электрофоретический анализ экстрактов цитозоля L. rossiae DPPMA174 (DSM 23214) в совместной культуре с L. plantarum DC400 (DSM 23213) или в присутствии очищенного плантарицина А по сравнению с монокультурой продемонстрировал изменение уровня экспрессии белков от 51 до 27 соответственно. Все белки, гипер-экспрессированные в присутствии плантарицина А, являются гипер-экспрессированными также в условиях совместной культуры. В качестве примера фиг. 4 демонстрирует участки геля, относящиеся к условиям с монокультурой, совместной культурой с L. plantarum DC440 и монокультурой в присутствии очищенного плантарицина А. Некоторые из более гиперэкспрессированных белков идентифицировали с помощью масс-спектрометрического анализа и обнаружили, что они участвуют в биосинтезе белков (серил-tRNA синтетаза), энергетическом метаболизме (глюкозо-6-фосфат дегидрогеназа, фосфоглицератмутаза, ацетальдегид-СоА дегидрогеназа, 6-фосфо-глюконат дегидрогеназа и β-фосфо-глюко-мутаза), катаболизме белков и аминокислот (АТР-зависимая Clp протеиназа и R аминопептидаза), реакциях на внешний стресс (GroEL, GroES, S2 и S5 рибосомальные белки) и в гомеостазе редокс потенциала (NADH оксидаза). Большая часть этих белков была также идентифицирована в других молочнокислых бактериях в качестве реакции на условия внешнего стресса и/или механизмов клеточных взаимодействий (Di Cagno et al., 2007. Cell-cell communication in sourdough lactic acid bacteria: a protomic study in Lactobacillus sanfranciscensis CB1. Proteomics 7:2430-2446). В частности, фермент глюкозо-6-фосфат дегидрогеназа катализирует высвобождение фратрицидного пентапептида, участвующего в механизмах запрограммированной гибели клеток Escherichia coli (Kolodkin-Gal et al., 2007. A linear pentapeptide is a quorum-sensing factor required for mazef-mediated cell death in Escherichia coli. Science 318:652-655).
Полученные результаты показывают, что ингибирующее действие L. rossiae DPPMA174 (DSM 23214) в результате синтеза плантарицина А основано на механизме клеточных взаимодействий и, вероятно, способно запустить реакции, приводящие к прицельной гибели микроорганизма. Эти результаты свидетельствуют о бактерицидной способности сигнальной молекулы.
(4) Исследования реконструированного эпидермиса и определение TEER (Трансэпителиального электрического Сопротивления)
Исследовали образец биомассы из совместной культуры Plantarum DC400 (DSM 23213) и L. rossiae DPPMA174 (DSM 23214) с плантарицином А в концентрации 2.5 мкг/мл, с одной стороны, и очищенного плантарицина А, полученного из совместной культуры, в той же концентрации 2.5 мкг/мл, с другой стороны, при обработке реконструированного эпидермиса человека в SkinEthic® модели. Эта модель была широко принята и использовалась научным сообществом (Di Cagno et al., 2009. Synthesis of γ-amino butyric acid (GABA) by Lactobacillus plantarum DSMZ19463: functional grape must beverage and dermatological application. Appl Biotechnol Microbiol DOI: 10.1007/s00253-009-23704). После 24 ч обработки выполняли измерения TEER. Этот тип анализа, широко принятый международным научным сообществом, оценивает коррозию ткани по отношению к целостности ороговевшего слоя и барьерной функции. В частности, используя эту оценку, можно получить информацию о присутствии ламеллярной компактной структуры на уровне ороговевшего слоя, жестких интегральных связях и толщине эпидермиса. В целом, эти факторы определяют эффективность барьерной функции. Фиг. 5 показывает, что как в присутствии биомассы, содержащей плантарицин, так и в присутствии образующегося в совместной культуре плантарицина А наблюдается достоверное увеличение (Р<0.05) величины TEER, что демонстрирует защитную активность этой молекулы на уровне кожи. Такой же результат был получен при применении химически синтезированного плантарицина А.
Согласно существующему уровню техники это первый пример применения пептидного гормона, принимающего участие в механизмах межклеточных взаимодействий бактериальных клеток, воспринимаемых клетками эпидермиса человека, приводя к стимуляции барьерной функции.
(5) Исследование клеток Сасо-2/ТС7
Жизнеспособность клеток Сасо-2/ТС7 оценивали по их способности поглощать Нейтральный Красный. По сравнению со средой DMEM (отрицательный контроль), инкубация в течение 24-72 ч с очищенным плантарицином А (2.5 мкг/мл) значительно увеличивала жизнеспособность клеток Сасо-2/ТС7 cells (фиг. 6). Такой же результат был получен с химически синтезированным плантарицином А. Не наблюдалось индукции при обработке образцом очищенной фракции, полученной из монокультуры L. rossiae DPPMA174 (DSM 23214), элюированной при тех же хроматографических условиях, которые использовали для плантарицина А. Как ожидалось, экспозиция клеток Сасо-2/ТС7 с γ-интерфероном (IFN-γ) приводила к достоверному снижению жизнеспособности (Р<0.05) (фиг. 7). С другой стороны, отрицательный эффект IFN-γ полностью элиминируется при одновременной обработке очищенным или химически синтезированным плантарицином А. Добавление очищенного плантарицина А приводит к достоверному увеличению (Р<0.05) значений TEER для клеток Сасо-2/ТС7 (фиг. 8). Такой же результат наблюдался при применении клеток Саро-2/ТС7 cells. По сравнению со средой DMEM добавление IFN-γ достоверно {Р<0.05) снижало значения TEER. Однако добавление очищенного или химически синтезированного плантарицина А в этом случае также отменяло отрицательные эффекты.
Клетки Сасо-2/ТС7 представляют собой одну из наиболее широко используемых in vitro систем для стимуляции слизистой оболочки кишечника. Несмотря на неопластическое происхождение упомянутые клетки способны спонтанно дифференцироваться в зрелые энтероциты и экспрессировать ферменты щеточной каемки. В условиях культуры клетки Сасо-2/ТС7 могут проявлять морфологические и функциональные характеристики, включая жесткие межклеточные связи, целостность которых оценивают путем определения TEER (Sambuy et al., 2005. The Caco-2 cell line as a model of the intestinal barrier: influence of cell and culture-related factors on Cao-2 cell functional characteristics. Cell Biol Toxicol 21:1-26). Результаты этого исследования показывают, что очищенный плантарицин А из совместной культуры L. plantarum DC400 (DSM 23213) и L. rossiae DPPMA174 (DSM 23214) или химически синтезированный плантарицин А способны стимулировать барьерную функцию слизистой оболочки кишечника и предотвращать отрицательные эффекты обработки γ-интерфероном.
(6) Развитие биотехнологического протокола для синтеза плантарицина А и его применение в области дерматологии.
Как отмечалось выше в другой части текста, был разработан биотехнологический способ для синтеза плантарицина А и его применения в области дерматологии. Упомянутый способ содержит:
a) культивирование L. plantarum DC400 (DSM 23213) и L. rossiae DPPMA174 (DSM 23214) в чистой культуре в культуральной среде mMRS;
b) сбор клеток, их промывание, ресуспендирование в WFH, CDM, виноградном сусле, молочной сыворотке или водных экстрактах фруктов или овощей, соответствующим образом объединенных для питательной доступности в качестве культуральной среды;
c) инкубация совместной культуры в течение 18-24 ч, предпочтительно в течение 24 ч при 30-37°С, предпочтительно при 30°С;
d) отделение клеток центрифугированием. Согласно одному из вариантов способа приготовление может содержать клетки молочнокислых бактерий;
e) дегидратация путем способа высушивания или лиофильного высушивания;
f) создание дерматологического препарата.
Пример 2. Исследование эффекта биомассы по изобретению и плантарицина А при заживлении ран
Способ
Культивированные кератиноциты человека инкубировали с плантарицином А (2.5 мкг/мл) или с биомассой, содержащей плантарицин А, в течение 1 ч.
В конце инкубации клетки отмывали и восстанавливали культуральную среду.
Заживление ран
Тест состоит из выполнения механического прерывания клеточного монослоя, чтобы оценить эффект обработки, способствующий или не способствующий способности кератиноцитов мигрировать за пределы края повреждения и таким образом «заживлять рану».
Для этого монослой кератиноцитов, обработанный как описано выше, инкубировали в течение еще 24 ч после приложения стимула и затем фиксировали и окрашивали, используя гематоксилин/эозин. Изображения получали с помощью светового микроскопа с объективом 5Х.
Для каждого изображения регистрировали пределы миграции клеток и соответственно вычисляли расстояния или промежутки между ними (фиг. 9 и 10).
Результаты
Фиг. 9 демонстрирует результаты исследования заживления ран. После 24 ч инкубации вслед за прерыванием клеточного слоя не стимулированный монослой кератиноцитов (контроль) обнаруживает некоторое распространение клеток от краев раны. Миграция клеток, однако, особенно заметна, когда клетки стимулированы гиалуроновой кислотой. В этом случае поврежденная площадь уже, чем в необработанных клетках (контроль), демонстрируя миграционную способность к заживлению ран.
Для аналитической оценки способности к миграции клеток края раны должны быть выделены, измерены и проанализированы, как показано на фиг.10.
Кератиноциты, проинкубированные с плантарицином А или биомассой, содержащей плантарицин А, уменьшали промежутки между краями раны по сравнению с контрольными клетками, увеличение доли заживления по сравнению с контролем показано на фиг. 11.
Система исследования: реконструированный эпидермис человека
Применяли модель эпидермиса, произведенную в Skinethic® Лабораториях Ниццы (Франция) и использовали в виде образца 0.5 см2 из ткани через 17 дней дифференцирования, имеющего среднюю толщину 120 мкм (ороговевший слой и живой эпидермис).
Полностью дифференцированный эпидермис получали из кератиноцитов человека, культивированных в химически определенной среде (MCDB 153) без добавления телячьей сыворотки на инертной подложке из пористого поликарбоната на границе воздух-жидкость в течение 17 дней; на этом этапе дифференцирования морфологический анализ показывает наличие многослойного живого эпидермиса и ороговевшего слоя, состоящего из более чем 10 компактных клеточных слоев.
ОПРЕДЕЛЕНИЕ TEER
Транс-эпителиальное электрическое сопротивление (TEER) - это прямое измерение функциональной активности кожного барьера, он отражает сопротивление ткани в целом, определяемое толщиной и структурой. Оно отражает целостность межклеточных контактов на уровне жестких связей, бислойной структуры липидов, защищающих от проникновения внешних соединений.
TEER - это определяемый исследованием параметр. Электрическое сопротивление крысиной кожи (В 40) - EU проверяемый тест для оценки коррозивности, рассматриваемой в качестве конечных точек целостности ороговевшего слоя и барьерной функции.
По данным in vivo он обратно пропорционален TEWL, который является мерой потери транс-эпителиальной воды, более высокий TEWL соответствует более высокому повреждению барьерной функции.
После дозированного введения 1 мл PBS измеряют транс-эпителиальное электрическое сопротивление с помощью прибора Millicell-ERS (0-20 кОм).
Различные измерения были выполнены для каждой ткани.
Фиг. 5 демонстрирует значения TEER, относящиеся в среднем к трем тканям, причем для каждой ткани выполняли по 3 определения.
Для величины TEER существенны следующие свойства: присутствие ламеллярной компактной структуры на уровне ороговевшего слоя, жесткие интегральные связи и толщина эпидермиса, которые в целом определяют эффективную барьерную функцию. Для каждой ткани имеется собственная ссылка при t=0 и t=24 ч.
Полученные результаты особенно интересны, если иметь в виду, что наблюдается заметное увеличение как в присутствии плантарицина А, так и в присутствии биомассы, содержащей плантарицин А.
Это увеличение является прямым следствием как возрастания толщины эпидермиса, так и большей компактности и целостности ороговевшего слоя на уровне жестких связей.
Пример 3. Плантарицин А, исследование его роли в поддержании и восстановлении барьерной функции кожи
Исследование основано на применении плантарицина А, полученного из совместной культуры L. plantarum DC400 (DSM 23213) и L. rossiae DPPMA174 (DSM 23214) для достижения следующих целей:
оценка эффектов биомассы на заживление ран с помощью исследования миграции и пролиферации монослоя кератиноцитов человека (NCTC2544) по сравнению с положительным контролем (не обработанными клетками) и коммерчески доступным контролем с отрицательной активностью. Обработку будут осуществлять при различных концентрациях плантарицина (после исследования цитотоксичности) после трех последовательных интервалов (24, 48, 72 ч);
анализ реакции повреждения клеток в рассматриваемые моменты и при разных концентрациях, оценивая модулирование медиаторами, такими как IL-8, KGF (фактор роста кератиноцитов), TGF-β1 (трансформирующий фактор роста-β), по сравнению с положительным контролем (не обработанные клетки) и коммерчески доступным контролем с отрицательной активностью с помощью полимеразной цепной реакции PCR в реальном времени.
МАТЕРИАЛЫ И СПОСОБЫ
Клеточные культуры
Использованная клеточная линия - это клеточная линия кератиноцитов человека NCTC 2544 (Perry, V.P, Sanford, K.K., Evans, V.J., Hyatt, G.W, Earle, W.R, 1957. Establishment of clones of epithelial cells from human skin. J Natl Cancer Inst. 18(5):709-717), культивированная в стерильных колбах, инкубированных при 37°С во влажной атмосфере с 5% CO2 в культуральной среде MEM (Минимальная Эссенциальная Среда) с добавлением 10% телячьей сыворотки (FBS), 2 мМ L-глутамина, 1% не эссенциальных аминокислот, в присутствии 1% пенициллина и стрептомицина. Клетки растут in vitro, адгезируя к поверхности культуральной плашки в виде монослоя.
ИССЛЕДОВАНИЕ ЗАЖИВЛЕНИЯ ТКАНЕЙ С ТЕЧЕНИЕМ ВРЕМЕНИ С ПОМОЩЬЮ СРЕДСТВА ДЛЯ ЗАЖИВЛЕНИЯ РАН
Принцип способа
Эксперимент в первую очередь включает развитие монослоя конфлуентных клеток. Последовательно делают разрез и наблюдают под микроскопом в образовавшемся отверстии, как двигаясь постепенно, клетки восстанавливают повреждение.
Этот способ рубцевания (вышеупомянутое «заживление») может продолжаться от нескольких часов до более суток в зависимости от клеточной линии, типа и размера раны.
Экспериментальная процедура
Клетки NCTC 2544 размещали на плашке и культивировали при 37°С, с 5% CO2 в течение 24 ч.
- После 24 ч инкубации полную культуральную среду замещали средой, не содержащей сыворотки, чтобы избежать влияния сыворотки на пролиферацию клеток, и инкубировали клетки еще 24 ч при 37°С, с 5% CO2.
- Через 24 ч клеточный монослой был механически поврежден с помощью мягкого кончика 200 мкл пипетки, прокладывая горизонтальный след шириной около 1 мм. Затем монослой отмывали и после добавления исследуемых веществ плашки инкубировали 72 ч при 37°С, с 5% CO2.
- Влияние веществ на клеточную подвижность оценивали с помощью инвертированного фазово-контрастного микроскопа, получая изображения в различные произвольно выбранные моменты времени.
- Восстановление повреждений определяли, измеряя не заполненную площадь между двумя фронтами миграции через 0, 4, 8, 12, 24, 48, 72 ч после разреза, используя программное обеспечение обрабатывающее изображение (Набор Leica application).
- Все данные в каждом эксперименте статистически обработаны в Excel для определений через 0, 4, 8, 12, 24, 48 и 72 ч.
АНАЛИЗ ОТВЕТА КЛЕТОК НА ПОВРЕЖДЕНИЕ ПО ЭКСПРЕССИИ ГЕНОВ IL-8, KGF, TGF-β С ПОМОЩЬЮ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ В РЕАЛЬНОМ ВРЕМЕНИ
Процедура состоит из трех основных этапов:
I. Экстракция полной RNA из клеток
II. Ретро-транскрипция в cDNA
III. PCR в реальном времени
I. Экстракция полной RNA из клеток
Иммортализованную линию кератиноцитов NCTC 2544, поддерживаемую в культуральных колбах, инкубировали при 37°С во влажной атмосфере с 5% CO2 в культуральной среде MEM (Минимальной Эссенциальной Среде) с добавлением 10% телячьей сыворотки, 2 мМ глутамина, 1% не эссенциальных аминокислот, в присутствии 1% пенициллина и стрептомицина. Клеточную линию соскабливали с помощью наконечника 200 мкл пипетки и обрабатывали разными концентрациями в разные моменты времени.
II. Ретротранскрипция RNA в cDNA
Способ включает амплификацию образцов RNA, экстрагированных с помощью набора "High Capacity cDNA Reverse Transcription Kit" (Applied Byosistem).
III. PCR в реальном времени
Способ включает амплификацию cDNA с помощью специфического исследования набором Taqman Gene и «TaqMan Universal PCR Master Mix с Amperase UNG 2X» (Applied Biosystem).
Относительный тип количественного определения возможных целенаправленных изменений экспрессии генов по сравнению с положительным контролем (не обработанные клетки) будет использоваться с помощью гена «домашнего хозяйства» для нормирования и анализа данных по способу 2-ΔΔCt.
РЕЗУЛЬТАТЫ
Заживление раны
Оценивали способность плантарицина из совместной культуры модифицировать миграцию кератиноцитов человека NCTC 2544, исследуя заживление раны.
Исследование относилось также к сравнительной оценке действия синтетического и полученного из совместной культуры L. plantarum DC400 и L. rossiae DPPMA174 плантарицина.
После разреза клеточного монослоя с помощью наконечника 200 мкл пипетки и полного удаления клеток из отверстия между двумя линиями надреза упомянутые клетки обрабатывали синтетическим и образованным в совместной культуре плантарицином в следующих концентрациях: 0.1-1-10 мкг/мл. Положительные и отрицательные контроли (коннективин при 100 мкг/мл) тестировали по два раза.
Изображения одной и той же площади среза получали в моменты 0 и через 4, 8, 12, 24, 48 и 72 ч мониторирования миграции клеток по площади среза.
Фиг. 12-16 демонстрируют временной анализ влияния Плантарицина из совместной культуры (0.1, 1 и 10 мкг/мл) (а) и синтетического Плантарицина (0.1, 1 и 10 мкг/мл) (b) на миграцию клеточной линии NCTC 2544.
Фиг. 12 демонстрирует прогрессирование рубцевания (ΔмкМ/время) в каждый рассматриваемый момент (с 4-часовым интервалом) для обеих исследуемых активностей и положительного и отрицательного контролей.
На ранних этапах рубцевания невозможно зарегистрировать в нулевой момент значимые различия клеточной миграции между контрольным и исследуемым видами активности. Как следует из фиг. 12а, плантарицин из совместной культуры в концентрации 0.1 и 1 мкг/мл не способен значительно ускорить миграцию клеток по сравнению с контролем. Этот эффект значителен уже через 4 ч после разреза и остается постоянным и значимым до 72 ч. Обработка плантарицином из совместной культуры в концентрации 10 мкг/мл вызывает вместо лечения повреждение ткани, сравнимое с положительным контролем, то есть с необработанными клетками для всех рассмотренных временных интервалов.
Аналогичный эксперимент с обработкой клеток синтетическим плантарицином для того же периода времени при тех же концентрациях свидетельствует о том, что в этом случае плантарицин (синтетический) обладает большей способностью ускорять миграцию клеток между двумя линиями среза по сравнению с отрицательным контролем.
В частности, в этом случае на ранних этапах ороговения клеток невозможно заметить в нулевой момент значимые отличия в миграции клеток как для двух использованных контрольных значений, так и для двух типов исследуемых видов активности.
Фиг. 12b показывает, что синтетический плантарицин в концентрации 0.1 и 10 мкг/мл, соответственно, вызывает большее увеличение миграции клеток, чем положительный и отрицательный контроль, уже через 4 ч после разреза, и эффект остается постоянным при всех рассмотренных интервалах времени вплоть до 72 ч. Обработка синтетическим плантарицином в концентрации 10 мкг/мл приводит вместо лечения ткани к ее повреждению, сравнимому с положительным и отрицательным контролем. Чтобы более детально суммировать и проанализировать влияние обработки плантацирином из совместной культуры и синтетическим плантацирином по отношению к значениям положительного и отрицательного контроля при всех рассмотренных интервалах времени, были статистически проанализированы измерения, полученные с помощью анализа изображений.
Фиг. 13 и 14 демонстрируют данные по процентному содержанию клеток, мигрировавших через две линии отсечения по сравнению с положительным контролем обработки как плантарицина из совместной культуры (фиг.13), так и синтетического плантарицина (фиг.14), соответственно. Кроме того, результаты представлены как процентная доля площади для двух линий отсечения и исходной площади, соответственно (фиг.15 и 16).
В таблицах, представленных на фиг. 13 и 14, показаны данные, относящиеся к процентному содержанию клеток, мигрировавших за различные рассмотренные интервалы времени для положительного и отрицательного контроля, для плантарицина из совместной культуры (0.1-1 и 10 мкг /мл) и синтетического плантарицина (0.1-1 и 10 мкг/мл) соответственно. Согласно данным, полученным при обработке изображений, после первых 8 ч обработки отрицательный контроль не проявляет активности рубцевания и демонстрирует долю мигрировавших клеток, аналогичную положительному контролю.
Что касается плантарицина из совместной культуры (фиг. 13), можно утверждать, что при всех трех применявшихся для обработки концентрациях можно отметить большее увеличение миграции клеток от нулевого момента до 72 ч обработки, в том числе при наименьших концентрациях обработки.
В частности, обработка плантарицином из совместной культуры в концентрации 10 мкг/мл демонстрирует наибольшую процентную долю миграции для всех рассмотренных интервалов времени за исключением 72 ч после обработки, но эти данные не отличаются значимым образом от процентных значений мигрировавших клеток, соответственно, 165.56%, 138.18%, 134.64%, 118.08%, 139.07% и 149.04%.
Фиг. 14 показывает процентное отношение клеток, мигрировавших после обработки в различные интервалы времени при тех же концентрациях, что и синтетический плантарицин
Обработка синтетическим плантарицином в концентрации 0.1 мкг/мл вызывает наибольшие процентные значения мигрировавших клеток для всех рассмотренных интервалов времени, считая от начального момента до 72 ч обработки: 158.30%, 115.15%, 124.32%, 141.82%, 141.91% и 128.51% соответственно. Обработка синтетическим плантарицином в концентрации 10 мкг/мл проявляется в увеличении процентной доли мигрировавших клеток для всех рассмотренных интервалов времени по сравнению с обработкой тем же соединением в концентрации 0.1 мкг/мл, но в то же время проявляется в большем увеличении процентной доли мигрировавших клеток по сравнению с отрицательным контролем через 8-72 ч обработки с увеличением процентной доли на +4.62%, +20.28%, +14.84% и +7.47% соответственно. Напротив, обработка синтетическим плантарицином в концентрации 1 мкг/мл приводит к большему увеличению процентной доли мигрировавших клеток по сравнению с отрицательным контролем только после 12 и 24 ч обработки при значениях процентной доли +9.86% и 15.48% соответственно.
Хотя обработка клеток теми же концентрациями плантарицина из совместной культуры и синтетического плантарицина не проявляется в увеличении процентной доли мигрировавших клеток, большем, чем отрицательный контроль при всех рассмотренных интервалах времени, сравнение результатов исследования заживления ран на кератиноцитах NCTC 2544 человека с помощью плантарицина из совместной культуры с результатами, полученными в тех же условиях с синтетическим плантарицином, позволяют показать, что плантарицин из совместной культуры оказывает больший эффект на миграцию клеток через образованную площадь разреза по сравнению с рассматриваемым отрицательным контролем.
Ген TGFβ_1 принимает максимальное участие в способе ороговения.
Среди всех интервалов времени, применявшихся для регистрации заживления ран, оценку экспрессии гена выполняли через 8 ч после обработки для подтверждения данных, полученных при оценке ороговения.
Полученные результаты подчеркивают и подтверждают замечательный эффект коннективина на рубцевание.
Что касается данных по синтетическому плантарицину, отмечается, что экспрессия гена заметно увеличивается, даже если можно доказать, что при тех же концентрациях (1 и 10 мкг/мл) ко-культуральный плантарицин стимулирует большее увеличение экспрессии гена, дополнительно подтверждая эффект биомассы.


Группа изобретений относится к вариантам штаммов молочнокислых бактерий, предназначенных для получения плантарицина А, K и N, и применению указанных штаммов. Предложены штамм молочнокислых бактерий Lactobacillus plantarum DSM 23213 и штамм молочнокислых бактерий Lactobacillus rossiae DSM 23214, совместное культивирование которых позволяет активировать синтез плантарицина А, K и N и получить продукт, содержащий плантарицин А, K и N. Продукт получают путем культивирования указанных штаммов, ко-инокуляции водной суспензией молочнокислых бактерий субстрата, инкубацией при 30-37°C, предпочтительно 30°C, в течение 18-24 ч, предпочтительно 18 ч. Упомянутая суспензия имеет клеточную плотность приблизительно 9.0 log КОЕ/мл для каждого вида молочнокислых бактерий и добавляется к субстрату в процентном отношении к объему субстрата от 1 до 4%. Полученный продукт используют в составе фармацевтической и косметической композиций, а также при приготовлении медикамента для увеличения барьерной функции эпидермиса или стенки кишечника или для заживления ран. Группа изобретений обеспечивает повышение уровня синтеза плантарицина А, K и N. 10 н. и 3 з.п. ф-лы, 19 ил., 3 пр. 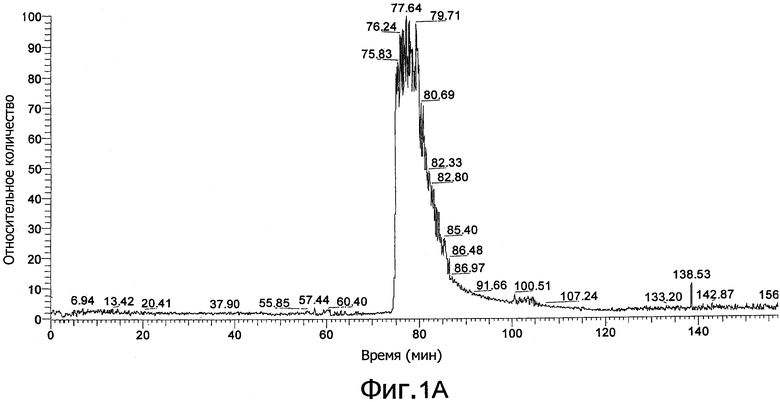
1. Штамм молочнокислых бактерий Lactobacillus plantarum DSM 23213 для получения плантарицина А, K и N.
2. Штамм молочнокислых бактерий Lactobacillus rossiae DSM 23214 для получения плантарицина А, K и N.
3. Способ получения продукта, содержащего плантарицин А, K и N, который включает:
a) культивирование штаммов молочнокислых бактерий Lactobacillus plantarum DSM 23213 и Lactobacillus rossiae DSM 23214;
b) ко-инокуляцию субстрата, выбранного из группы, состоящей из химически определенной среды, гидролизата пшеничной муки, виноградного сусла, молочной сыворотки или экстрактов фруктовых или овощных продуктов, водной суспензией молочнокислых бактерий этапа а), которая имеет клеточную плотность приблизительно 9.0 log КОЕ/мл для каждого вида молочнокислых бактерий и добавляется к субстрату в процентном отношении к объему субстрата от 1 до 4%;
c) инкубацию при температуре от 30 до 37°C, предпочтительно 30°C, в течение 18-24 ч, предпочтительно 18 ч.
4. Способ по п.1, дополнительно включающий этап d) центрифугирования культуральной среды для удаления клеток молочнокислых бактерий.
5. Способ по п.1, в котором центрифугирование осуществляют при 10000 g в течение 15 мин при 4°C.
6. Способ по п.1, включающий этап е) дегидратации супернатанта, полученного на этапе d), с помощью высушивания или лиофильного высушивания.
7. Продукт, содержащий плантарицин А, К и N, полученный с помощью способа по любому из пп.1-6.
8. Фармацевтическая композиция для увеличения барьерной функции эпидермиса или стенки кишечника, содержащая продукт по п.7 в качестве активного агента и один или большее количество фармацевтически приемлемых наполнителей и/или адьювантов.
9. Фармацевтическая композиция для заживления ран, содержащая продукт по п.7 в качестве активного агента и один или большее количество фармацевтически приемлемых наполнителей и/или адьювантов.
10. Косметическая композиция для увеличения барьерной функции эпидермиса, содержащая продукт по п.7 в качестве активного агента и один или большее количество фармацевтически приемлемых наполнителей и/или адьювантов.
11. Косметическая композиция для заживления ран, содержащая продукт по п.7 в качестве активного агента и один или большее количество фармацевтически приемлемых наполнителей и/или адьювантов.
12. Применение продукта по п.7 при приготовлении медикамента, предназначенного для увеличения барьерной функции эпидермиса или стенки кишечника.
13. Применение продукта по п.7 при приготовлении медикамента, предназначенного для заживления ран.
| CN 101353633 A, 28.01.2009 | |||
| NISSEN-MEYER J | |||
| ET AL | |||
| Purification and characterization of plantaricin A, a Lactobacillus plantarum bacteriocin whose activity depends on the action of two peptides // J Gen Microbiol, 1993, 139(9):1973-8 | |||
| PARENTE E | |||
| ET AL | |||
| Production, recovery and purifcation of bacteriocins from lactic acid bacteria // Appl Microbiol |
Авторы
Даты
2015-10-27—Публикация
2011-01-04—Подача