Область техники, к которой относится изобретение
Данное изобретение относится к пробиотическим бактериям и, в частности, хотя не исключительно, к медицинским и косметическим применениям пробиотических бактерий и их лизатов.
Уровень техники, предшествующий изобретению
Люди живут в постоянном контакте с множеством микроорганизмов. Кишечник, безусловно, является наиболее интенсивно колонизированным, и было показано, что микробиота кишечника играет множество ролей в нормальной физиологии, включая нутриентную секвестрацию (3) и развитие нормальных иммунных ответов (22).
В микробиоте нормального кишечника имеются так называемые пробиотические бактерии. Их прием внутрь, как было показано, предотвращает или лечит желудочно-кишечные нарушения, такие как ассоциированная с антибиотиком диарея (47) и воспалительные заболевания кишечника (42). Механизмы, лежащие в основе этих эффектов, являются по большей части неизвестными. Однако в ходе исследований было предположено, что пробиотики могут ингибировать колонизацию кишечника патогенами. В работе in vitro было предположено, что пробиотики используют различные механизмы для ингибирования патогенов, включая прямое конкурирование за связывающие участки на эпителиальных клетках (12) и конкурирование с патогенными бактериями за нутриенты. Пробиотические организмы также способны вырабатывать ингибирующие вещества, такие как бактериоцины (13) и органические кислоты (25), которые могут уничтожать или ограничивать рост патогенов. Отобранные пробиотики, такие как L. plantarum 299v, как было показано, повышающе регулируют выработку муцина эпителиальными клетками, тем самым предотвращая прикрепление патогена (33). Пробиотики могут также вырабатывать биологические поверхностно-активные вещества, которые позволяют прикрепление пробиотика, при этом ингибируя прикрепление патогенных бактерий к клеткам (43).
В отличие от кишечника очень мало известно о нормальных взаимодействиях между кожной микрофлорой и эпидермисом. Недавняя работа предполагает, что кожные симбионты могут также быть способны ограничивать колонизацию кожи патогенными бактериями (48). Исследования также предполагают, что некоторые кожные заболевания (такие как вульгарные угри и атопический дерматит) могут быть связаны с разрушениями нормальной микрофлоры (4, 6, 8). Следовательно, было уделено некоторое внимание концепции, заключающейся в том, что кожная микрофлора может подвергаться модуляции с применением специфических кожных симбионтов для стимулирования здоровья или ингибирования заболевания (30, 31). Однако кожные симбиотические бактерии могут также являться патогенными при некоторых обстоятельствах (16). В отличие от этого, пробиотики, как правило, считаются безопасными (GRAS) и, следовательно, такие бактерии потенциально могут быть применены местно, если они имеют терапевтическое значение (17). К настоящему времени ограниченное количество исследований в этой области предполагает, что общепринятые пробиотические бактерии могут иметь существенное значение при применении на кожу. Например, местное нанесение лизата B. longum reuter, как было показано, индуцирует клиническое улучшение "реактивной кожи". Это представляет собой кожу, которая более чувствительна к физическим изменениям, таким как атмосферная температура, и к химическим изменениям, таким как наблюдаемые с наносимыми местно продуктами (20). Было показано, что нанесение лизата B. longum на кожу добровольцев снижает чувствительность и снижает трансэпидермальную потерю влаги (TEWL) после соскоба липкой лентой. Дополнительно, было показано, что нанесение лизата на кожу ex-vivo снижает признаки воспаления, такие как вазодилатация, эдема и высвобождение TNF-α (20). Также было продемонстрировано, что местное нанесение L. plantarum улучшает восстановление тканей в мышиной модели ожога и предотвращает инфекцию в хронических ножных язвах и ожогах у людей (40, 41, 46). Однако в целом механизмы, лежащие в основе этих эффектов, не известны.
Staphylococcus aureus является кратковременным колонизатором кожи преимущественно во влажных, теплых участках тела, таких как пах, подмышечная впадина и ноздри (28). Вплоть до 60% людей являются периодическими носителями, тогда как 20% людей могут являться стабильно колонизированными (28). Хотя нормальное носительство является бессимптомным, S. aureus может проникать в ткани (например, через разрушенную кожу), где она вызывает заболевания, варьирующиеся от относительно небольшого импетиго и токсического эпидермального некролиза до угрожающих жизни состояний, таких как септицемия (29). Кроме того, S. aureus инфекция часто является вторичным явлением в коже с соответствующими состояниями, такими как атопический дерматит (27).
Плотные сочленения (tight junctions, TJ) являются многобелковыми комплексами, заполняющими параклеточное пространство между смежными эпителиальными клетками и ограничивающими транспорт через этот путь для маленьких гидрофильных молекул и ионов (55). Трансэпителиальное электрическое сопротивление (Transepithelial electrical resistance, TEER) является мерой функционирования TJ (56, 57). Функция TJ часто отражается уровнями экспрессии конкретных белков, задействованных в комплексах. Главные белки TJ, экспрессруемые кератиноцитами, содержат клаудин 1, клаудин 4, ZO-1 и окклюдин.
В частности, изменения выражения уровней клаудинов, как было показано много раз ранее, связаны с изменениями в барьерной функции. К настоящему времени 24 клаудина млекопитающих были идентифицированы и их, как правило, разделяют на два класса: которые упрочняют барьер и которые формируют селективные поры (58). Несколько доказательств указывают на роль клаудинов 1 и 4 в качестве упрочняющих барьер клаудинов. В клеточных линиях сверхэкспрессия клаудина 1 повышала TEER и снижала проницаемость клеток для параклеточных маркеров. Клаудин 4 изолирует параклеточное пространство от прохождения ионов и посредством этого повышает TEER монослоев [59, 60]. Повышения экспрессии ZO-1 увеличивают TEER клеток A431 (61) и гормон GLP1 также увеличивает функцию TJ в клетках caco-2 повышением экспрессии ZO-1 и окклюдина (62). Наличие TJ в коже было открыто лишь относительно недавно. Следовательно, в настоящее время вклад конкретных видов белков TJ в барьерную функцию кожи остается по большей части неизвестным. Однако, известно, что генетическая потеря клаудина 1 является смертельной для мышей (63).
Кератиноциты воспринимают наличие бактерий посредством образ-распознающих рецепторов, таких как толл-подобные рецепторы (TLR). Несколько линий наблюдения указывало на то, что в кишечнике имеет место зависимость между активацией TLR и изменением барьерной функции TJ. Недавняя работа Yuki et al. (53) продемонстрировала TLR-опосредованную аугментацию функции TJ в кератиноцитах в ответ на бактериальные лиганды, такие как пептидогликан.
WO 2011/029784 описывает противовоспалительное действие штамма Lactobacillus rhamnosus штамма LMG P-25211 на коже, и применение в предотвращении или обработке воспалительных или аллергических кожных состояний.
WO 2010/056198 описывает препараты, пригодные для лечения индуцированных стафилококком инфекций, которые содержат комбинацию одного или более жизнеспособных штаммов α-стрептококка и одного или более жизнеспособных штаммов молочнокислой бактерии, выбранных из групп из Lactobacillus rhamnosus штамма LB21, Lactobacillus plantarum штамма LB3, Lactobacillus plantarum штамма LB7.
WO 2006/000992 описывает косметические виды лечения, предназначенные для предотвращения и/или обработки сухой или чувствительной кожи, где пробиотический микроорганизм, часть или его метаболит комбинируется с по меньшей мере одним двухвалентным неорганическим катионом.
Marsella et al (Veterinary Immunology and Immunopathology 146 (2012) 185-189) описывает иммуномодуляторные эффекты орального введения Lactobacillus rhamnosus GG в модели аллергического/атопического дерматита.
EP 2161329A1 описывает иммуномодуляторные эффекты экстрактов из молочнокислых бактерий и описывает применение в лечении воспалительных нарушений.
Hoang et al (Inflammation & Allergy - Drug Targets, 2010, 9, 192-196) описывает применение орально вводимого клеточного лизата Lactobacillus rhamnosus в качестве ежедневного иммунобиотического дополнения в лечении атопической экземы.
WO 2011/045471 описывает применение Lactobacillus rhamnosus GG в комбинации с Lactobacillus rhamnosus LC705 для применения в лечении респираторной инфекции, в частности для применения против вирусов, вызывающих респираторные инфекции, например, вирус гриппа.
Сущность изобретения
Изобретение относится к пробиотическим бактериям и их лизатам для применения в способах медицинского лечения, в способах косметического лечения и для применения в качестве противобактериального агента. Раскрыты применение в лечении инфекций, включая кожные инфекции, и способы, содержащие регенерацию или восстановление кожного барьера.
Изобретение относится к пробиотической бактерии для применения в способе лечения. Пробиотическая бактерия может быть представлена в виде лизата. В предпочтительных вариантах осуществления пробиотическая бактерия является штаммом L. rhamnosus, L. reuteri или Bifidobacterium longum. Предпочтительно, пробиотическая бактерия является L. rhamnosus GG. L. rhamnosus GG депонирована в ATCC под номером доступа 53103. Способ лечения может содержать введение L. rhamnosus GG пациенту. Способ может содержать введение L. rhamnosus GG в кожу пациента. Способы по изобретению приводят к лечению или облегчению состояния пациента, подвергающегося лечению.
В некоторых вариантах осуществления способ медицинского лечения является способом лечения или предотвращения инфекции, например, бактериальной инфекции, такой как инфекция стафилококком. Инфекция может являться инфекцией Staphylococcus aureus. Инфекция может являться кожной инфекцией. Пробиотическая бактерия, лизат или композиция может быть введена отдельно, последовательно или одновременно с инфекционным агентом, например, на рану или другое повреждение в кожном барьере.
В некоторых вариантах осуществления (или дополнительно) способ медицинского лечения является способом, содержащим восстановление или регенерацию кожного барьера. В способах, включающих восстановление или регенерацию кожного барьера, пробиотическая бактерия может являться штаммом L. rhamnosus, L. reuteri или Bifidobacterium longum. Пробиотическая бактерия может являться L. rhamnosus GG. В этих способах два различных штамма пробиотической бактерии могут быть введены в одном и том же способе лечения, например, L. reuteri и L. rhamnosus GG могут быть введены совместно. Пробиотическая бактерия может быть введена живой, инактивированной или в виде лизата. Когда две или более пробиотических бактерии должны быть введены, одна или более могут быть введены в виде лизата.
Способы лечения, содержащие восстановление или регенерацию кожного барьера, могут содержать восстановление или регенерацию кожи после поражения.
Способы лечения, включающие восстановление или регенерацию кожного барьера могут быть пригодны в лечении псориаза, ихтиоза, дерматита, в заживлении ран, в лечении акне (включая Hiradenitis Suppurativa), ожогов, опрелости кожи, синдрома Незертона, актинического кератоза, дерматомикозов, дерматоза или эктодермальной дисплазии или других нарушений, ассоциированных с разрушением или разрывом кожного барьера. Другие такие нарушения легко поддаются оценке специалисту в данной области. Предпочтительно, способы содержат введение пробиотической бактерии на кожу.
Изобретение дополнительно относится к применению пробиотической бактерии или ее лизата в производстве лекарственного препарата для лечения кожной инфекции и/или восстановлении или регенерации кожного барьера. Пробиотическая бактерия может представлять собой L. rhamnosus, L. reuteri или штамм Bifidobacterium longum. Это может представлять собой L. rhamnosus GG. Лекарственный препарат может содержать два или более штаммов пробиотической бактерии или может быть введен совместно с другим штаммом пробиотической бактерии или ее лизатом. Лекарственный препарат может быть пригоден в восстановлении или регенерации кожи после поражения или в лечении псориаза, ихтиоза, дерматита, заживлении ран, акне (включая Hiradenitis Suppurativa), ожогов, опрелости кожи, синдрома Незертона, актинического кератоза, дерматомикоза, дерматоза или эктодермальной дисплазии или других нарушений, ассоциированных с разрушением или разрывом кожного барьера. Другие такие нарушения легко будут определены специалистом в данной области.
Изобретение также относится к фармацевтической композиции, содержащей пробиотическую бактерию. Фармацевтическая композиция может содержать пробиотическую бактерию L. rhamnosus, такую как L. rhamnosus GG или L. reuteri, или может содержать пробиотическую бактерию Bifidobacterium longum. Фармацевтическая композиция может дополнительно содержать еще один другой штамм пробиотической бактерии, такой как одна из L. reuteri, L. rhamnosus GG или Bifidobacterium longum. Фармацевтическая композиция может содержать лизаты одного или более пробиотических бактериальных штаммов или смесь лизатов, живые или инактивированные пробиотические бактерии. Фармацевтическая композиция может быть составлена для введения в кожу пациента, нуждающегося в таком лечении.
Изобретение дополнительно относится к способам косметического лечения, содержащим введение пробиотической бактерии или ее лизата пациенту, или применению такой пробиотической бактерии или ее лизата в способе косметического лечения. Такие варианты осуществления не содержат лечение человека или животного организма посредством терапии или хирургии. В таких косметических способах пробиотическая бактерия предпочтительно содержит пробиотическую бактерию L. rhamnosus или ее лизат, например, пробиотическую бактерию L. rhamnosus GG или L. reuteri или ее лизат или пробиотическую бактерию Bifidobacterium longum или ее лизат. Способы могут содержать введение пробиотической бактерии в кожу пациента.
Изобретение также относится к косметическим композициям, содержащим пробиотик L. rhamnosus, такой как L. rhamnosus GG, L. reuteri, Bifidobacterium longum или их лизаты. Косметическая композиция может содержать одну или более из пробиотической бактерии L. rhamnosus, такой как L. rhamnosus GG, L. reuteri, Bifidobacterium longum или лизаты или одну, две или каждую из этих пробиотических бактерий.
Изобретение дополнительно относится к антибактериальным композициям, содержащим пробиотическую бактерию или ее лизат. Пробиотическая бактерия может представлять собой L. rhamnosus GG. Такие композиции могут быть пригодны для уничтожения или ингибирования действия или роста бактерий. Композиции могут быть пригодны для очистки или предварительной обработки поверхности, которая имеет или предполагается, что на ней имеются бактерии или вероятно подвержена воздействию бактерий. В некоторых вариантах осуществления антибактериальная композиция может быть составлена так, чтобы она не была пригодна для введения пациенту или субъекту.
Изобретение также относится к способам приготовления композиций, например, пригодных для терапевтического и/или косметического, и/или противобактериального применения. Способ может содержать подвергание популяции пробиотических бактерий лизису и составление полученного в результате лизата в композицию. Альтернативно, способ может содержать составление интактных бактерий в композицию. Способ может содержать этап обработки бактерий или лизата так, чтобы удалить или инактивировать интактные бактерии, например, выделением интактных бактерий из лизата. Лизат может быть подвержен этапу очистки или фильтрации, например, для удаления интактных бактерий, сред для бактериального роста или загрязняющих веществ.
Композиции, приготовленные таким способом, могут быть пригодны для применения в лечении, например, в обработке бактериальных инфекций или для восстановления кожного барьера. Такие способы могут содержать добавление одного или более фармацевтически или косметически приемлемых вспомогательных веществ. Другие композиции могут не быть пригодны для применения в лечении, например, противобактериальные композиции, такие как лосьоны.
Следующие пронумерованные параграфы (абзацы) содержат изложения обширного ряда комбинаций технических характеристик изобретения, изложенных в данном документе.
1. Пробиотическая бактерия или ее лизат для применения в способе лечения, в котором пробиотическая бактерия представляет собой Lactobacillus rhamnosus GG.
2. Пробиотическая бактерия или ее лизат для применения в соответствии с параграфом 1, в котором способ лечения содержит введение пробиотической бактерии или ее лизата в кожу пациента, подвергаемого лечению.
3. Пробиотическая бактерия или ее лизат для применения в соответствии с параграфом 1 или параграфом 2 для применения в способе лечения или предотвращения инфекции.
4. Пробиотическая бактерия или ее лизат для применения в соответствии с параграфом 3, в котором инфекция содержит бактериальную инфекцию.
5. Пробиотическая бактерия или ее лизат для применения в соответствии с параграфом 4, в котором бактериальная инфекция представляет собой инфекцию стафилококком, предпочтительно инфекцию S. aureus.
6. Пробиотическая бактерия или ее лизат для применения в соответствии с любым из предшествующих параграфов, в котором способ лечения предназначен для кожной инфекции.
7. Пробиотическая бактерия или ее лизат для применения в способе лечения, включающем восстановление или регенерацию кожного барьера, в котором пробиотическая бактерия представляет собой пробиотическую бактерию L. rhamnosus или L. reuteri.
8. Пробиотическая бактерия или ее лизат для применения в соответствии с параграфом 7, в котором способ содержит введение пробиотической бактерии или ее лизата в кожу.
9. Пробиотическая бактерия или ее лизат для применения в соответствии с параграфом 7, в котором пробиотическая бактерия представляет собой L. rhamnosus GG.
10. Пробиотическая бактерия для применения в соответствии с любым из параграфов 7-9, в котором способ предназначен для лечения псориаза, ихтиоза, дерматита, заживления ран, акне (включая Hiradenitis Suppurativa), ожогов, опрелости кожи, синдрома Незертона, актинического кератоза, дерматомикозов, дерматоза или эктодермальной дисплазии.
11. Пробиотическая бактерия для применения в соответствии с любым из предшествующих параграфов, в котором пробиотическую бактерию вводят совместно с пробиотической бактерией другого штамма или ее лизатом.
12. Пробиотическая бактерия или ее лизат в соответствии с любым из предшествующих параграфов, в котором способ лечения содержит совместное введение с L. reuteri или ее лизатом.
13. Фармацевтическая композиция, содержащая L. rhamnosus GG или ее лизат.
14. Фармацевтическая композиция в соответствии с параграфом 13, дополнительно содержащая штамм пробиотической бактерии, отличный от L. rhamnosus, или ее лизата, в котором предпочтительно пробактерия штамма, отличного от L. rhamnosus, представляет собой L. reuteri.
15. Косметический способ, содержащий введение субъекту одной или более из пробиотической бактерии L. rhamnosus, такой как L. rhamnosus GG, L. reuteri, или их лизатов.
16. Косметический способ в соответствии с параграфом 15, в котором пробиотическую бактерию или лизат вводят в кожу субъекта.
17. Косметическая композиция, содержащая пробиотическую бактерию L. rhamnosus или ее лизат и/или пробактерию L. reuteri или ее лизат.
18. Способ медицинского лечения, содержащий введение L. rhamnosus GG или ее лизата пациенту, посредством этого осуществляя лечение пациента.
19. Способ в соответствии с параграфом 18, в котором пробиотическую бактерию или ее лизат вводят в кожу пациента.
20. Способ медицинского лечения в соответствии с параграфом 18 или параграфом 19, дополнительно содержащий введение пробиотической бактерии, отличной от L. rhamnosus GG или ее лизата, пациенту, в котором пробиотическая бактерия, отличная от L. rhamnosus, предпочтительно представляет собой L. reuteri.
21. Способ медицинского лечения в соответствии с параграфом 18, в котором медицинское лечение представляет собой лечение или предотвращение инфекции.
22. Способ медицинского лечения в соответствии с любым из параграфов 18-21, в котором медицинское лечение представляет собой лечение или предотвращение инфекции кожи, и в котором кожная инфекция подвергается лечению или ослабляется после лечения.
23. Способ медицинского лечения, содержащий введение L. rhamnosus, L. rhamnosus GG или L. reuteri пациенту, нуждающемуся в этом, в котором лечение осуществляется для восстановления или регенерации кожного барьера, в котором кожный барьер восстанавливается или регенерируется после лечения.
24. Способ медицинского лечения в соответствии с параграфом 23, в котором L. rhamnosus, L. rhamnosus GG или L. reuteri вводят в кожу пациента.
25. Способ в соответствии с параграфом 22 или параграфом 23, в котором способ лечения предназначен для псориаза, ихтиоза, дерматита, заживления ран, акне (включая Hiradenitis Suppurativa), ожогов, опрелости кожи, синдрома Незертона, актинического кератоза, дерматомикозов, дерматоза или эктодермальной дисплазии.
26. Применение пробиотической бактерии или ее лизата в производстве лекарственного препарата для применения в лечении инфекции, в котором пробиотическая бактерия представляет собой L. rhamnosus GG.
27. Применение пробиотической бактерии или ее лизата в производстве лекарственного препарата для применения в лечении, в котором лечение включает восстановление или регенерацию кожного барьера и в котором пробиотическая бактерия представляет собой пробиотическую бактерию L. rhamnosus или L. reuteri.
28. Применение в соответствии с параграфом 26 или параграфом 27, в котором лекарственный препарат составляют для введения в кожу.
29. Применение в соответствии с параграфом 28, в котором способ предназначен для лечения псориаза, ихтиоза, дерматита, заживления ран, акне (включая Hiradenitis Suppurativa), ожогов, опрелости кожи, синдрома Незертона, актинического кератоза, дерматомикозов, дерматоза или эктодермальной дисплазии.
30. Применение пробиотической бактерии или лизата в соответствии с любым из параграфов 26-29, в котором лечение включает совместное введение более чем одной пробиотической бактерии или ее лизата.
31. Лизат L. rhamnosus GG.
32. Композиция, составленная для введения в кожу и содержащая L. rhamnosus GG, L. rhamnosus и/или L. reuteri или лизат одной или более из указанных бактерий.
33. Противобактериальная композиция, содержащая L. rhamnosus GG или ее лизат.
Описание предпочтительных вариантов осуществления
Изобретение содержит комбинацию аспектов и описанные предпочтительные свойства, за исключением случаев, когда комбинация является очевидно невозможной или ее однозначно следует избегать.
Заголовки разделов, применяемые в данном документе, предназначены только для целей организации и не должны рассматриваться как ограничивающие описываемый субъект изобретения.
Аспекты и варианты осуществления данного изобретения далее будут проиллюстрированы посредством примеров, ссылаясь на прилагаемые фигуры. Дополнительные аспекты и варианты осуществления будут очевидны специалисту в данной области. Все документы, упомянутые в тексте, включены в данный документ посредством ссылки.
Кожа является первичным барьером между организмом и окружающей средой. Она должна как предотвращать инвазию патогенов, так и в то же время предотвращать потерю воды и электролита из организма. До настоящего времени считалось, что барьерная функция кожи является исключительно ролью рогового слоя. Однако, комплексы, известные как плотные сочленения, также являются критичными для барьерной функции кожи. Изредка барьер кожи поврежден из-за ран или царапин. В этих случаях кожа должна восстановиться сама. Однако изредка восстановление не происходит достаточно быстро и в результате этого кожа остается открытой для инфекции. Авторы изобретения проскринировали диапазон пробиотических бактерий на их способность к:
1) защите кожи от вредного патогена Staphyloccus aureus (включая устойчивые к метициллину штаммы)
2) стимулированию регенерации и улучшения барьерной функции клеток кожи.
Авторы идентифицировали штамм пробиотической бактерии (L. rhamnosus GG) с защитными и регенерирующими свойствами клеток кожи. Что показательно, лизаты этого штамма улучшают способность кератиноцитов кожи противодействовать опасной токсичности, индуцированной S. aureus (SA) (Фиг. 9A). При применении в комбинации с лизатом второго штамма (L. reuteri), комбинация является даже более эффективной в защите против S. aureus, чем когда какой-либо из штаммов применяется отдельно (Фиг. 9B). Авторы также продемонстрировали, что когда кератиноцитные монослои поцарапаны для удаления клеток (т.е. модельная рана), наличие свойства по изобретению у пробиотических лизатов значительно и неожиданно ускоряет восстановление монослоя и повторное установление барьера (Фиг. 10).
Агенты, которые увеличивают и восстанавливают барьерную функцию кератиноцитов, являются весьма перспективными не только в качестве терапевтических агентов, но также в качестве косметических улучшающих кожу средств. Увеличение барьерной функции увеличивает уровень гидратации кожи и известно, что он улучшает внешний вид кожи и приводит к более здоровому косметическому внешнему виду.
Наблюдения авторов расширяют полезность и применение пробиотиков. Первоначальные наблюдения авторов указывают на то, что пробиотики могут быть использованы в ряде применений в уходе за кожей, которые включают: заживление ран, технологию покрытий для раневых повязок, кремы с улучшенным кожным барьером для косметических и терапевтических применений (например, атопический дерматит); противобактериальные продукты, такие как лосьоны для рук и мыла, и косметические препараты, направленные на поддержание/восстановление барьерной функции кожи, и видах лечения для восстановления разрушенного барьера из-за воздействия солнца и старения.
С возможностью предотвращения пагубных эффектов вредных бактерии и одновременного активного восстановления разрушенного кожного барьера коммерческие применения пробиотиков в уходе за кожей имеют большое значение. Для все большего количества людей требуется естественные, безопасные и эффективные виды лечения для общего выравнивания кожи, и технология авторов изобретения представляет значительный прогресс в удовлетворении этих потребностей рынка.
Технология авторов изобретения может не только предоставить новое терапевтическое средство для установления/восстановления кожного барьера, но может устранить потребность в существующих агрессивных методах терапии, например, в антибиотиках. В настоящее время предотвращающие способы содержат противобактериальные агенты, которые, несмотря на то, что являются эффективными, имеют ряд пагубных эффектов. Лечение основано на применении антибиотика для уничтожения вредных бактериальных инфекций. Подход авторов изобретения не только ингибирует вредные кожные патогены, но и активно стимулирует восстановление барьера на клеточном уровне. Так как снижение барьерной функции/восстановления неразрывно связано со сниженной способностью к сдерживанию инфекции, лизат авторов изобретения предоставляет технологию, которая увеличивает как барьер, так и его способность к защите против патогенов.
В настоящее время на рынке существует совсем немного продуктов с живым бактериями в качестве компонентов (например, косметический ряд живых кожных пробиотиков Nude). Подход с очищенным лизатом авторов изобретения имеет ряд функциональных и коммерческих преимуществ по сравнению с другими, что выражается в представлении контролируемой и определяемой активности при низких концентрациях; повышенной стабильности и облегченного производства; и улучшенного срока хранения. Все это в совокупности делает технологию авторов изобретения более пригодной для терапевтических и косметических применений в отличие от сложных в изготовлении и распространении живых бактериальных кремов.
Краткое описание фигур
Варианты осуществления и эксперименты, иллюстрирующие принципы изобретения, описаны далее со ссылками на прилагаемые фигуры, в которых:
Фиг. 1. График, показывающий, что S. aureus обладает дозозависимыми эффектами на жизнеспособность кератиноцитов. Неинфицированные клетки имели жизнеспособность 81,2±4,1%. Клетки, подвергаемые 105 КОЕ/мл S. aureus, имели жизнеспособность 49,4±11,1%. Клетки, подвергаемые 106 КОЕ/мл S. aureus, имели жизнеспособность 30,5±9,8%. Клетки, подвергаемые 107 КОЕ/мл S. aureus, имели жизнеспособность 12,1±1,1%, тогда как клетки, подвергаемые 108 КОЕ/мл S. aureus, имели жизнеспособность 3,3±1,1%. Анализ линейной регрессии подтвердил линейную зависимость между концентрацией и процентной жизнеспособностью (p<0,001). Результаты выражены как среднее ± SEM.
Фиг. 2. Молочнокислые бактерии защищают кератиноциты от цитотоксических эффектов S. aureus. (A) График, показывающий процентную жизнеспособность для неинфицированных NHEK (86,9±5,1%) и NHEK, инфицированных с 108 КОЕ/мл S. aureus (SA), (8,8±7,1%) L. reuteri (LR), (80,8±4,5%); L. rhamnosus (LRH), (84,8±2,1%) L. salivarius (LS), (71,7±2,9%) S. aureus и L. reuteri (SA+LS), (53,1±4,2%) S. aureus и L. rhamnosus (SA+LRH), (42,7±7,4%) и S. aureus и L. salivarius (SA+LS) (31,1±6,5%). (B) Репрезентативные изображения инфицированных клеток, окрашенных трипановым синим (Увеличение ± 200). A) без обработки, B) инфицированные с 108 КОЕ/мл S. aureus, C) подверженные 108 КОЕ/мл L. reuteri, или D) инфицированные с 108 КОЕ/мл S. aureus и 108 КОЕ/мл L. reuteri одновременно. (C) График, показывающий жизнеспособность клеток, инфицированных или с 106 S. aureus (SA) (31,6±4,1%), или с S. aureus и 106 L. reuteri (A) (54,8±2,7%), S. aureus и 107 L. reuteri (B) (55,4±4,3%) и S. aureus и 108 L. reuteri (C) (56,2±4,1%) (D) График, показывающий, что кератиноциты, подверженные S. aureus (SA), имели сниженные жизнеспособности 37,4±1,3% по сравнению с контролями (92±1,9%), тогда как кератиноциты, подверженные убитой нагреванием L. reuteri (HKLR), имели небольшое изменение жизнеспособности (88,3±3,3%). Кератиноциты, предварительно подверженные убитой нагреванием L. reuteri (Pre-HKLR), имели жизнеспособности, подобные подверженным S. aureus кератиноцитам (33±2,1%). (E) График, показывающий, что лизат L. reuteri (Лизат LR) был способен защищать кератиноциты, P=0,01. Клетки, подвергаемые S. aureus (SA) отдельно, имели значительно более низкую жизнеспособность (38,3±4,7 log КОЕ), чем клетки, предварительно подверженные лизату L. reuteri (пре-лизат)(57,7±2,4 log КОЕ). Результаты выражены, как среднее ± SEM.
Фиг. 3. L. reuteri защищает только кератиноциты при добавлении перед инфекцией S. aureus. (A) График, показывающий, что процентная жизнеспособность была значительно выше в клетках, которые были коинфицированы (SA+LR) (57,1±2, P=0,0016) и предварительно подвергались в течение 1 (1 ч перед) (63,6±5,6%, P=0,0003), 2 (2 ч перед) (56,1±1,2%, P=0,0022) и 4 часов (4 ч перед) L. reuteri (52,4±4,1%, P=0,0066) по сравнению с инфицированными S. aureus (SA) клетками (29,8±3,8). (B) График, показывающий, что не было значительного различия между жизнеспособностью клеток, обрабатываемых с L. reuteri 1 (после 1 ч) (25,8±0,6%), 2 (после 2 ч) (29,3±2,6%) или 4 часов (после 4 ч) (33,57±4,9%), после того как инфекция началась, и клетками, которые были инфицированы с S. aureus (SA) отдельно (29,9±3,4%) (P>0,05). Результаты выражены как среднее ± SEM.
Фиг. 4a. L. reuteri не ингибирует рост S. aureus в совместной культуре. График, показывающий результаты конкурентного анализа, выявляющего отсутствие значительного различия между группами с течением времени (P=0,146).
Фиг. 4b (Таблица 1). L. reuteri не воздействует на стафилококковую жизнеспособность в клеточной культуре. S. aureus, выращиваемая в отсутствие клеток, имела счет жизнеспособности 8,0 (log КОЕ). S. aureus, выращиваемая в присутствии кератиноцитов, имела счет жизнеспособности 8,6±0,2. S. aureus, инкубированная совместно с L. reuteri в отсутствие клеток, имела счет жизнеспособности 8,4±0,4, хотя S. aureus, инкубированная совместно с L. reuteri в присутствии клеток, имела счет жизнеспособности 8,0±0,2. Не было обнаружено значительного различия между группами (P=0,34). Результаты выражены как среднее ± SEM.
Фиг. 5. L. reuteri ингибирует стафилококковую адгезию и инвазию кератиноцитов. Графики демонстрируют: (A) S. aureus адгезирует с приблизительно 5,5±0,3 log КОЕ/мл и L. reuteri адгезирует с приблизительно 6,2±0,1 log КОЕ/мл. (B) Вытеснение. Клетки, предварительно подверженные L. reuteri перед инфекцией S. aureus (Пре-LR), имели значительно меньше адгезированных к ним стафилококков (5,7±0,2 log КОЕ) по сравнению с клетками, инфицированными с S. aureus (SA) отдельно (4,4±0,4 log КОЕ). (C) Конкурирование. Клетки, коинфицированные с L. reuteri (SA+LR), имели значительно меньше адгезированных к ним стафилококков (4,4±0,4 log КОЕ) по сравнению с клетками, инфицированными с S. aureus (SA) отдельно (5,6±0,1 log КОЕ). (D) Замещение. Не имело место значительное различие в количестве адгезивных стафилококков на клетках, подвергаемых L. reuteri после того, как инфекция S. aureus началась (Пост-LR) (5,3±0,5 log КОЕ), по сравнению с клетками, инфицированными с S. aureus (SA) отдельно (5,7±0,3 log КОЕ, P=0,47). (E) Клетки, коинфицированные с L. reuteri, имели значительно меньше интернализованных стафилококков (4,5±0,1 log КОЕ), чем клетки, инфицированные с S. aureus отдельно (6,1±0,1 log КОЕ). Результаты выражены как среднее ± SEM.
Фиг. 6. Убитая нагреванием L. reuteri не была способна ингибировать стафилококковую адгезию к кератиноцитам, но лизаты были способны. Графики демонстрируют: (A) Количество стафилококков, адгезивных к NHEK, при применении отдельно (SA) (6,5±0,2 log КОЕ), при добавлении после NHEK, предварительно подверженных живым L. reuteri (Pre-LR) (5,3±0,1 log КОЕ), и предварительно подверженных убитой нагреванием L. reuteri (Pre-HKLR) (6,1±0,3 log КОЕ). Клетки подвергали необработанной L. reuteri и имели значительно меньше стафилококков, связанных с ними (P=0,003), но клетки, подвергаемые убитой нагреванием L. Reuteri, не имели значительного различия в адгезивных стафилококках (P=0,09). (B) Количество стафилококков, адгезивных к NHEK при применении отдельно (SA) (6,3±0,1 log КОЕ), было значительно больше, чем при добавлении после того как NHEK были предварительно подвержены живым L. reuteri (PRE-LR) (5,6±0,2 log КОЕ, P=0,0002), и чем при предварительном подвергании лизатам L. reuteri (PRE-LYS) (6,0±0,2 log КОЕ, P=0,032). Результаты выражены как среднее ± SEM.
Фиг. 7. S. aureus использует интегрин α5β1 для связывания с кератиноцитами, и блокирование этого интегрина достаточно для защиты кератиноцитов от эффектов S. aureus. Графики показывают: (A) Значительно меньше стафилококков, адгезированных к клеткам, обрабатываемым с 60 мкг/мл блокирующего антитела (5,7±0,1 log КОЕ), по сравнению с необработанными кератиноцитами (6,1±0,1 log КОЕ, P=0,007). Результаты выражены как среднее ± SEM. (B) Значительно больше кератиноцитов являлись жизнеспособными после инфекции с S. aureus в течение 24 часов, если их предварительно подвергали анти-α5β1 интегрин (PRE-INT) антителу перед инфекцией (47,9±6,0%) по сравнению с кератиноцитами, инфицированными с S. aureus отдельно (SA) (19,3±2,0%, P=0,03). Результаты выражены как среднее ± SEM.
Фиг. 8. L. salivarius не была способна ингибировать стафилококковую адгезию к кератиноцитам. Графики показывают: (A) Кератиноциты, предварительно подверженные L. salivarius (PRE-LS), имели подобные количества адгезивных стафилококков (4,5±0,2 log КОЕ) по сравнению с клетками, подверженными S. aureus отдельно (SA) (4,9±0,2 log КОЕ). (B) L. reuteri (LR) адгезировали значительно лучше (6,7±0,1 log КОЕ), чем L. salivarius (LS) (5,6±0,1 log КОЕ, P=0,005). Результаты выражены как среднее ± SEM.
Фиг. 9. Графики показывают: (A) Человеческие первостепенные кератиноциты, подверженные патогену S. aureus (SA) в течение 24 часов. Это приводит к приблизительно 80% умирающих клеток с только 20% кератиноцитов, жизнеспособными после 24 часов. В присутствии лизатов P1 (LGG) или P2 (L. reuteri) значительно большее количество кератиноцитов остаются жизнеспособными после 24 часов подвергания патогену (50% и 60%, соответственно), (B) Пробиотические лизаты P1 (LGG) и P2 (L. reuteri) являются более эффективными при применении одновременно и имеют больший защитный эффект на жизнеспособность кератиноцитов, чем когда каждый штамм применяется отдельно.
Фиг. 10. Изображения анализов методом зарастания царапины. В анализах методом зарастания царапины как P1 (LGG), так и P2 (L. reuteri) лизаты ускоряли восстановление барьера. Через 18 часов после оцарапавания клетки в обработанных лизатом образцах (P1 и P2) почти восстанавливали разрушение, вызванное царапиной, тогда как в необработанных клетках (con) царапина оставалась все еще видимой.
Фиг. 11. Изображение луночного диффузионного анализа. Луночный диффузионный анализ показывает, что AC413 не ингибирует рост S. aureus. Для этого эксперимента S. aureus высеивали в виде сплошного слоя бактерий. Затем лунки погружали в агар и AC413 помещали в лунки. Любое уничтожение S. aureus посредством AC413 было бы заметно в виде области ингибирования вокруг лунки.
Фиг. 12. График, показывающий, что LGG снижает скорость роста S. aureus. В этом эксперименте S. aureus (SA) и LGG выращивали вместе (SA+LGG). Добавочный эксперимент также содержал рост S. aureus с лизатом LGG (SA+LGG LYS). Графики демонстрируют, что рост S. aureus медленней в присутствии или живой LGG, или лизата.
Фиг. 13. График, показывающий, что LGG и ее лизат убивает S. aureus. В этом эксперименте количество мертвых S. aureus измеряли в присутствии живых LGG или лизата LGG. Наибольшее количество мертвых бактерии заметно с лизатом LGG.
Фиг. 14. График, показывающий, что лизаты LGG или L. reuteri увеличивают скорость реэпителизации кератиноцитных монослоев. В этом эксперименте кератиноцитный монослой царапали и измеряли скорость реэпителизации в присутствии или LGG, L. reuteri (LR), L. plantarum (LP), L. fermentum (LF) S. epidermidis (S EPI) или Bifidobacterium longum (BIF). Только LGG или L. reuteri увеличивают скорость реэпителизации.
Фиг. 15. График, показывающий, что LGG и L. reuteri увеличивают скорость кератиноцитной миграции. В этом эксперименте миграцию кератиноцитов измеряли из-за того, что она является важным механизмом, посредством которого монослои реэпителизуются. Только LGG или L. reuteri увеличивают миграцию кератиноцитов.
Фиг. 16. График, показывающий, что пробиотические бактерии обладают зависимыми от штамма эффектами на кератиноцитную жизнеспособность. Человеческие первичные эпидермические кератиноциты инкубировали с 108 КОЕ/мл бактерий в течение 24 часов. После подвергания воздействию жизнеспособность кератиноцитов измеряли с применением МТТ-теста. Жизнеспособность кератиноцитов, инкубированных в присутствии B. longum reuter (BLR), L. plantarum (LP), L. reuteri (LR) или L. rhamnosus Goldwin и Gorbach (LGG), не была значительно отличающейся от жизнеспособности необработанных клеток (CON). Однако кератиноцитные культуры, обработанные L. fermentum (LF), снижали жизнеспособность по сравнению с контролем (-50% снижение жизнеспособности, p<0,005).
Фиг. 17. Графики, показывающие, что пробиотические бактерии увеличивают барьерную функцию плотного сочленения со штамм-специфичными эффектами. Человеческие первичные кератиноциты индуцировали для образования TJ и за TEER монослоев наблюдали с течением времени в необработанных монослоях по сравнению с монослоями, инфицированными с пробиотическими бактериями. В контрольных монослоях TEER развивалась с течением времени после кальциевого сдвига и достигала пика около 255 Ом.см2 +/- 50,4. За исключением L. fermentum (которая понижала TEER по сравнению с контрольными монослоями) все пробиотические бактерии повышали TEER больше контрольных уровней зависимым от штамма образом. L. rhamnosus GG и B. longum reuter продуцировали наибольшие и наиболее устойчивые эффекты. На Фиг. 17 незакрашенные кружки являются обработанными монослоями и закрашенные кружки являются необработанными монослоями. 17(a) развитие TEER в необработанных клетках в ответ на повышение концентрации кальция, (b) эффект L. Fermentum, (c) L. reuteri, (d) L. Plantarum, (e) B. longum reuter, (f) L. rhamnosus GG на развитие TEER по сравнению с необработанным контролем.
Фиг. 18. Графики, показывающие, что пробиотические бактерии имеют дозозависимый эффект на TEER в человеческих кератиноцитах. Человеческие кератиноциты обрабатывали с лизатами, приготовленными из B. longum reuter (BLR) или L. rhamnosus GG (LGG) при концентрациях 108, 106, 104 и 102 КОЕ/мл и эффекты на TEER измеряли с течением времени. B. longum reuter была эффективна только при концентрации 108 КОЕ/мл. Однако L. rhamnosus GG также была эффективной при 106 и 104 КОЕ/мл. (a) Эффекты на TEER B. longum reuter, (b) эффекты на TEER L. rhamnosus GG. Для 18(a) и (b) Δ является необработанным контролем, ▄ является эффектом 102 бактерий, ▲ является эффектом 104 бактерий, ○ является эффектом 106 бактерий, ● является эффектом 108 бактерий.
Фиг. 19. Иммуноблот и график, показывающие, что пробиотические бактерии модулируют экспрессию белков плотного сочленения в человеческих кератиноцитах. Человеческие кератиноциты обрабатывали с лизатами из или 108 КОЕ/мл L. rhamnosus GG (LGG), или B. longum reuter (BLR) в течение 24 ч. В дальнейшем кератиноциты собирали и экспрессию клаудина 1, клаудина 4, ZO-1 и окклюдина исследовали с применением иммуноблотинга (a) и последующей денситометрии (b). BLR повышала экспрессию всех четырех белков TJ по сравнению с контролем (клаудин 1 (cld-1) 3,7X +/- 0,08 (p<0,05), клаудин 4 (cld-4) -2,15 +/- 0,02 (p<0,05), окклюдин (occ), 2,53X +/- 0,14 (P<0,005), ZO-1, 2X+/- 0,024 (p<0,05). Однако LGG не вызывала изменения уровней клаудина 4, но повышала экспрессию других трех белков (клаудин 1 - 3,27x +/-0,36 (p<0,05), окклюдин 2,65x +/- 0,17 (p<0,005), ZO-1 - 2,22x +/- 0,036 (p<0,05).
Фиг. 20. Иммуноблот и график, показывающие, что нейтрализация TLR2 аннулирует специфические опосредованные пробиотиком эффекты на барьерную функцию TJ и экспрессию белка. Кератиноциты обрабатывали с TLR2 нейтрализующим антителом перед инкубированием с лизатами из B. longum reuter (BLR) или L. rhamnosus GG (LGG). (A) График, показывающий, что в клетках, обрабатываемых с BLR, но не LGG, индуцированное пробиотиком увеличение TEER было аннулировано инкубированием с антителом. (B) Иммуноблот, подобным образом показывающий увеличение в экспрессии белков TJ, также был аннулирован нейтрализацией TLR 2 в BLR, но не в LGG-обработанных клетках.
Подробное описание изобретения
Подробности одного или более вариантов осуществления изобретения изложены в прилагаемом описании, включая специфические подробности лучшего способа, предложенного авторами для осуществления изобретения, в качестве примера. Специалисту в данной области будет очевидно, что данное изобретение может быть осуществлено на практике без ограничения этими специфическими подробностями.
Везде в этом описании, включая последующую формулу изобретения, если по контексту не требуется иное, слово "содержат" и вариации, такие как "содержит" и "содержащий" должны быть поняты, как подразумевающие включение указанного целого числа или интервала или группы целых чисел или интервалов, но не исключение любого другого целого числа или интервала или группы целых чисел или интервалов.
Необходимо отметить что, как это применяется в описании и прилагаемой формуле изобретения, формы единственного числа включают в себя множественное число, если контекст не указывает однозначно иное. Так, например, ссылка на "фармацевтический носитель" включает в себя смеси двух или более таких носителей и тому подобное.
Пробиотические бактерии
Изобретение относится к применению пробиотических бактерий. Пробиотики обычно определяют как "живые микроорганизмы, которые при введении в соответствующих количествах предоставляют пользу для здоровья хозяина". Исследования в кишечнике продемонстрировали способность пробиотических бактерий ингибировать колонизацию патогенами посредством механизмов, включая вытеснение, конкурирование и замещение патогена, прикрепившегося к тканям хозяина. Как это применяется в данном документе, термин "пробиотическая бактерия" может также относиться к таким бактериям, когда они больше не являются живыми, например, после инактивации нагреванием или облучением.
Lactobacillus rhamnosus
Изобретение относится в частности к пробиотическим бактериям видов Lactobacillus rhamnosus. Такие бактерии изначально считались подвидами Lactobacillus casei, но позже в генетическом исследовании было обнаружено, что они являются видами сами по себе. Известен ряд штаммов L. rhamnosus. Например, штаммы I-1720 (Pasteur Collection Nationale de Cultures de Microorganismes), AC413, GR-1 (Karlsson et al., BMC microbiology 2012, 12:15), JB-1 (Bravo et al., PNAS2011, 108 (38) 16050-16055), GG и Lc705 (Savijok et al., J. Proteome Res. 2011 10(8): 3460-3473). Другие штаммы L. rhamnosus могут быть легко выделены. По желанию некоторые варианты осуществления данного изобретения не содержат применение Lactobacillus rhamnosus штамма LB21.
Изобретение в частности относится к L. rhamnosus GG. L. rhamnosus GG (также обозначаемая в данном документе LGG) депонирована в ATCC (American Tissue Culture Collection) под номером доступа ATCC 53103. L. rhamnosus GG выделили в 1983 году из кишечника здорового человеческого организма Gorbach и Goldin.
Lactobacillus reuteri
Изобретение также относится к штаммам Lactobacillus reuteri. L. reuteri является грамположительной бактерией, которая естественно заселяет кишечник млекопитающих и птиц. Известен ряд штаммов L. reuteri. Например, DSM 17938 и депонирования в ATCC 23272, 53608, 53609 и 55148 и 55739. Штаммы L. reuteri описаны, например, в US 6872565 и US 7517681. Другие штаммы L. reuteri могут быть легко выделены.
Особенно предпочтительный штамм L. reuteri в соответствии с изобретением депонирован в ATCC под номером доступа ATCC 55730, описан в US 5837238.
Bifidobacterium longum
Изобретение также относится к штаммам Bifidobacterium longum. Bifidobacterium longum являются видами грамположительной бактерии, обнаруженной в кишечниках детей. Известен ряд штаммов Bifidobacterium longum. Например, депонирования в ATCC 15708, 55816, 55818, 15707, 35183 и 51870. Другие штаммы Bifidobacterium longum могут быть легко выделены.
Особенно предпочтительным штаммом Bifidobacterium longum по изобретению является Bifidobacterium longum reuter. В некоторых вариантах осуществления Bifidobacterium longum reuter депонирована в ATCC под номером доступа ATCC 51870.
Применения
Пробиотические бактерии или их лизаты по изобретению могут быть составлены в виде фармацевтических композиций для клинического применения и могут содержать фармацевтически приемлемый носитель, разбавитель или адъювант. Они могут быть составлены для местного введения.
Введение предпочтительно осуществляется в "терапевтически эффективном количестве", что является количеством, достаточным для предоставления пользы индивидууму. Точное введенное количество и скорость и период действия введения будут зависеть от природы и тяжести заболевания, подвергаемого лечению. Предписание лечения, например, решения относительно дозировки и т.д., находятся в рамках компетенции врача общей практики и других врачей по лечебному делу, и, как правило, принимается во внимание нарушение, которое будет подвергаться лечению, состояние индивидуального пациента, участок доставки, способ введения и другие факторы, известные практикующим врачам. Примеры технологий и протоколов, упомянутых выше, могут быть обнаружены в Remington's Pharmaceutical Sciences, 20th Edition, 2000, pub. Lippincott, Williams & Wilkins. Специалисту в данной области необходимо иметь в виду, что подходящие дозировки активных соединений и композиции, содержащие активные соединения, могут варьироваться от пациента к пациенту.
Терапевтические применения
Соединения и композиции данного изобретения пригодны в лечении широкого диапазона заболеваний и состояний. В частности, соединения и композиции данного изобретения пригодны в лечении нарушений, заболеваний и состояний кожи и находят применение в лечении фиброза (включая послеоперационный фиброз), формирования адгезии тканей и формирования шрамов. Соединения и композиции изобретения пригодны в лечении акне, экземы, ихтиозов и псориазов. Пробиотические бактерии и их лизаты по изобретению пригодны в заживлении ран.
Пробиотические бактерии и их лизаты для применения в терапевтических приложениях могут быть составлены в виде лекарственных препаратов, другими словами, составлены в виде медицинского средства. Лекарственный препарат может содержать другие фармацевтически приемлемые ингредиенты, хорошо известные специалисту в данной области, включая, но без ограничения ими, фармацевтически приемлемые носители, адъюванты, вспомогательные вещества, разбавители, наполнители, буферы, консерванты, антиоксиданты, смазывающие вещества, стабилизаторы, солюбилизаторы, поверхностно-активные вещества (например, смачивающие агенты), маскирующие агенты, окрашивающие агенты, ароматизирующие агенты и подслащивающие агенты. Состав может дополнительно содержать другие активные агенты, например, другие терапевтические или профилактические агенты.
Инфекции
Изобретение относится к лечению инфекций. Пробиотические бактерии и лизаты по изобретению проявляют активность противоинфекционного агента. Например, противобактериальную активность. Таким образом, они пригодны для лечения инфекций, включая бактериальные инфекции. Таким образом, они пригодны в лечении бактериальных инфекций с множественной лекарственной устойчивостью, внутригоспитальных бактериальных инфекций, устойчивых к антибиотику бактериальных инфекций, инфекций грамотрицательными и/или грамположительными бактериальными инфекциями.
Пробиотические бактерии и лизаты по изобретению также пригодны для лечения инфекций Staphylococcus spp., Pseudomonas spp., Staphyloccus saprophytics, Staphyloccocus xylosus, Staphyloccocus lugdunensis, Staphyloccocus schleiferi, Stapylococcus caprae, staphyloccocus epidermidis, Staphyloccocus saprophytics, Staphyloccocus warneri, Staphylococcus aureus, Staphyloccocus hominis, устойчивой к метициллину Staphylococcus aureus (MRSA), Enterococcus faecalis, устойчивой к ванкомицину Enterococcus (VRE), Proprionibacterium acnes, Bacillus cereus, Bacillus subtilis, Listeria monocytogenes, Streptococcus pyrogenes, Streptococcus salivariu, Streptococcus mutans и Streptococcus pneumonia.
В частности, пробиотические бактерии и лизаты по изобретению проявляют активность против Staphylococcus и, таким образом, пригодны для лечения или предотвращения инфекции Staphylococcus. Например, пробиотические бактерии и лизаты по изобретению проявляют активность против Staphylococcus aureus и, таким образом, пригодны в лечении или предотвращении инфекции Staphylococcus aureus.
Инфекции происходят, когда вызывающие заболевания микроорганизмы проникают в ткани тела. Размножение этих микроорганизмов и токсины, которые они вырабатывают, реагируют с тканями тела, часто вызывая иммунные реакции инфицированием хозяина. Инфекции могут быть вызваны бактериями, вирусами, вироидами, грибами и другими паразитами. Инфекции могут осуществляться через любые из тканей тела, такие как кожа, кишечник или мембраны. В некоторых вариантах осуществления изобретения пробиотические бактерии или лизаты по изобретению применяются для лечения инфекций тканей, отличных от кишечника, например, в некоторых вариантах осуществления пробиотическая бактерия или лизат по изобретению не применяется для лечения инфекции пищеварительного канала, пищевода, желудка, кишок, прямой кишки или ануса. В частных аспектах изобретение относится к лечению или предотвращению инфекции внешней поверхности тела, и в частности кожи.
Пробиотическая бактерия, лизаты и композиции по изобретению могут быть применены в лечении или предотвращении инфекций кожи. Инфекция может быть обусловлена бактерией, такой как стафилококковые бактерии. Инфицирующий агент может представлять собой Staphylococcus aureus. Пробиотическая бактерия, лизат или композиция может быть применена отдельно, последовательно или одновременно с воздействием инфицирующего агента. В некоторых случаях пробиотическую бактерию, лизат или композицию применяют после воздействия инфицирующего агента.
Барьерные эффекты
Пробиотические бактерии и лизаты данного изобретения обладают активностью восстановления, укрепления и/или регенерации барьера. Кожа составлена из двух компартментов, глубокий компартмент (дерма) и поверхностный компартмент (эпидермис). Это составляет барьер против внешних воздействий, в частности химических, механических или инфекционных воздействий, и, следовательно, там происходит ряд защитных реакций против факторов внешней среды (климат, ультрафиолетовые лучи, табак и т.д.) и/или ксенобиотика, такого как, например, микроорганизмы. Это свойство называется барьерная функция и главным образом обеспечивается самым поверхностным слоем эпидермиса, а именно роговидным слоем, называемым роговой слой. Пагубные изменения в барьере могут проявляться в виде кожного дискомфорта, сенсорных явлений и, в частности, неприятных явлений или сухости кожи, определяемой незаметной потерей воды. Композиции по изобретению пригодны для предотвращения снижения барьера и/или для восстановления или регенерации барьерной функции. Снижение барьерной функции ассоциировано с рядом нарушений, таких как приведенные ниже. Если барьер поврежден, например, ранами или царапинами, кожа должна восстанавливаться сама. Однако, изредка восстановление не происходит достаточно быстро и это оставляет кожу открытой для инфекции.
Нарушения, ассоциированные с разрушением кожного барьера, содержат псориаз, акне (включая Hiradenitis Suppurativa), ожоги, опрелость кожи, синдром Незертона, актинический кератоз, дерматомикозы, дерматоз или эктодермальную дисплазию, атопический дерматит, контактный дерматит, дерматит, себорейный дерматит, вульгарный ихтиоз или другие нарушения, ассоциированные с разрушением или разрывом кожного барьера.
Экзема/дерматит
Экзема (атопический дерматит) является конкретным типом воспалительной реакции, в которой, как правило, имеют место везикулы (мельчайшие пузырчатые выпуклые площади) в первой стадии, затем следует эритема (покраснение), отек (опухание), папулы (наросты) и коркообразование на коже, затем в заключение следует лихенификация (утолщение) и отшелушивание кожи. Экзема обычно вызывает зуд и обжигание кожи.
Экзема является очень распространенной и может впервые возникнуть в любом возрасте. Она зачастую является хронической и сложной в лечении и имеет тенденцию исчезать и рецидивировать. Зуд может быть непомерным и тяжелым. Существует ряд типов экземы. Распространенность экземы является высокой с примерно 33 миллионами людей, пораженных только в США.
Ихтиоз
Вульгарный ихтиоз является генетическим заболеванием кожи, которое характеризуется наличием избыточных количеств сухих поверхностных чешуек на коже, вызванных аномальной эпидермальной дифференциацией или метаболизмом. Он обычно является наиболее тяжелым на ногах, но могут также быть задействованы руки, кисти и в некоторых случаях туловище. Он также может быть ассоциирован с атопическим дерматитом, волосяным кератозом (маленькие выпуклости на обратной стороне рук) или другими расстройствами кожи. Он обычно исчезает во время взрослого возраста, но может рецидивировать в более пожилом возрасте.
Другие типы ихтиоза содержат X-связанный ихтиоз, ламеллярный ихтиоз, эпидермолитический ихтиоз, арлекиновый ихтиоз, синдром Незертона и синдром Шегрена-Ларссона, хотя на вульгарный ихтиоз приходится 95% случаев ихтиоза. На наследственный (врожденный) вульгарный ихтиоз приходится более чем 95% случаев вульгарного ихтиоза. Первоначально он проявляется в детстве. Ген, ответственный за вульгарный ихтиоз, был отнесен к сегменту хромосомы 1q21. Продукт этого гена является веществом, называемым филагрин (FLG), который может действовать в качестве "белка кератинового матрикса" в клетках рогового слоя. Моделью наследования является аутосомная доминанта. Приобретенный вульгарный ихтиоз, как правило, развивается во взрослом состоянии и возникает вследствие внутреннего заболевания или применения некоторых средств для лечения. Наследственный вульгарный ихтиоз является распространенным заболеванием в Соединенных Штатах с распространенностью приблизительно 1 случай на 300 человек. Из-за того, что симптомы улучшаются с возрастом, истинная распространенность, вероятно, еще выше. Приобретенный ихтиоз является чрезвычайно редким. Его распространенность в Соединенных Штатах неизвестна. В Соединенном королевстве инцидентность вульгарного ихтиоза, как сообщалось, составляет 1 на 250. В Китае вульгарный ихтиоз имеет распространенность 2,29%.
Псориаз
Псориаз является хроническим, генетическим, неконтагиозным кожным нарушением, характеризуемым вызывающими зуд или причиняющими боль пятнами из толстой, красной кожи c серебристыми чешуйками. Чешуйчатые пятна, вызванные псориазом, называемые псориатические бляшки, являются областями воспаления и избыточной выработки кожи. Нарушение является хроническим рецидивирующим состоянием, которое варьируется по тяжести от маленьких локализованных пятен до полного покрытия тела. Псориаз может также вызывать воспаление суставов, которое известно как псориатический артрит. Существует ряд форм заболевания. В соответствии с Национальными институтами здравоохранения (National Institutes of Health, NIH) вплоть до 7,5 миллионов американецев (приблизительно 2,2 процента популяции) имеют псориаз, при этом по оценкам 125 миллионов поражено во всем мире. Между 150000 и 260000 новых случаев псориаза происходит каждый год. Инцидентность псориаза имеет тенденцию быть подверженной климату и генетической наследственности популяции. Он менее распространен в тропиках и среди темнокожих людей и наиболее распространен среди европеоидов. Общие прямые и непрямые затраты здравоохранения на пациентов насчитывают 11,25 миллиардов ежегодно, с потерями на работе, насчитывающими 40% стоимости расходов16. Приблизительно 60% пациентов с псориазом пропустили в среднем 26 дней работы в год из-за их болезни17.
Заживление ран
В применяемом в данном документе значении заживление ран относится к процессу, посредством которого кожа репарирует себя после поражения. В нормальной коже эпидермис (самый внешний слой, преимущественно составленный из кератиноцитов) и дерма (внутренний или более глубокий слой) находятся в установившемся равновесии, формируя защитный барьер против внешней среды. Если защитный барьер разрушен, т.е. нанесением раны, нормальный (физиологический) процесс заживления ран незамедлительно приводится в действие. В применяемом в данном документе значении термин "рана" относится к типу поражения, при котором кожа разорвана, порезана или проколота или при котором кожа разрушена после травмы от удара тупым предметом или медицинского состояния, приводящего к повреждению кожного барьера. Пробиотические бактерии или их лизаты по изобретению могут быть пригодны в заживлении ран in vivo, включая восстановление, регенерацию и/или замену ткани. Например, они могут быть применены в заживлении рубцовой ткани, ускорении заживления ран или когда применены трансплантаты ткани, такие как кожные трансплантаты.
В некоторых вариантах осуществления восстановление или регенерация кожного барьера включает восстановление или регенерацию слизистой оболочки. Слизистые оболочки содержат слизистую оболочку полости рта (включая слизистую оболочку щеки, мягкого неба, языка, включая нижнюю поверхность языка и дно полости рта), носа, горла (включая слизистую оболочку глотки, гортани, трахеи и пищевода), бронхов, легких, глаза, уха, влагалища, пениса, уретры, мочевого пузыря и ануса.
Пациент, который будет подвергаться лечению, может быть животным или человеком. Пациент предпочтительно является млекопитающим кроме человека или пациентом-человеком. Пациент может быть самцом или самкой.
Косметические применения
В некоторых аспектах изобретение относится к косметическому лечению, содержащему введение пробиотической бактерии или лизата по изобретению. Термин "косметический" в применяемом в данном документе значении обозначает нетерапевтический. Такие способы не содержат лечение человека или животного организма посредством терапии. Косметическое лечение может быть применено для улучшения внешнего вида и/или структуры кожи.
Изобретение также предполагает применение пробиотических бактерий или их лизатов в способе косметического лечения, и способах косметического лечения с применением пробиотических бактерий или их лизатов. Например, в способе улучшения уровня гидратации или внешнего вида кожи. В применяемом в данном документе значении термин "косметический способ" не относится к способу лечения человека или животного организма посредством хирургии или терапии или диагностических способов, применяемых на практике в отношении человеческого или животного организма в соответствии со статьей 53(c) EPC.
Изобретение также относится к косметической композиции, содержащей пробиотическую бактерию. Композиция может быть применена для улучшения внешнего вида кожи. Например, композиция может увеличивать уровень гидратации кожи. Известно, что повышенный уровень гидратации улучшает внешний вид кожи и приводит к более здоровому косметическому внешнему виду. Косметические композиции могут быть составлены образом, подобным фармацевтическим композициям, как описано далее.
Субъект, который будет подвергаться лечению, может являться любым животным или человеком. Субъект может являться млекопитающим кроме человека, но более предпочтительно является человеком. Субъект может являться самцом или самкой. Субъекту не требуется восстановление его кожного барьера. В некоторых случаях субъекту не требуется лечение от инфекции, такой как бактериальная инфекция. В некоторых случаях субъекту не требуется лечение участка, на котором должно быть применено косметическое лечение.
Косметические способы по изобретению предпочтительно содержат введение "косметически эффективного количества". Это имеет отношение к введению соединений, ингредиентов, материалов, композиций, форм дозировки и т.д., в количестве, эффективном для индуцирования косметического эффекта. Это является частью тщательной оценки соответствующего практикующего клинициста. Специалисту в данной области необходимо иметь в виду, что подходящие дозировки активных соединений и композиций, содержащих активные соединения, могут варьироваться от субъекта к субъекту.
Пробиотические бактерии, их лизаты и композиции по изобретению обладают активностью к поддержанию и восстановлению барьера. В этой связи они пригодны для предотвращения снижения и/или укрепления барьерной функции. Это может быть пригодно для улучшения гидратации кожи и/или улучшения внешнего вида кожи.
Необязательные применения
Последующее представляет самостоятельные необязательные и разделяемые варианты осуществления, которые в некоторых случаях могут не формировать часть данного изобретения.
По желанию, некоторые варианты осуществления данного изобретения не содержат комбинацию пробиотической бактерии или ее лизата со штаммом Streptococcus, например, штаммом α-Streptococcus.
По желанию, некоторые варианты осуществления данного изобретения не содержат комбинацию Lactobacillus rhamnosus GG (или ее лизата) с Lactobacillus rhamnosus LC705 (или ее лизатом).
По желанию, некоторые варианты осуществления данного изобретения не содержат косметическое или дерматологическое лечение сухой и/или чувствительной кожи.
По желанию, в некоторых вариантах осуществления способы лечения, включающие восстановление или регенерацию кожного барьера, предназначены не для лечения аллергического заболевания/состояния или воспалительного заболевания/состояния. Например, такие варианты осуществления по желанию не содержат лечение одного или более из атопического дерматита, себорейного дерматита, экземы, атопической экземы, ихтиоза, псориаза, акне или аллергических заболеваний или воспалительных состояний.
По желанию, некоторые варианты осуществления данного изобретения не содержат противовоспалительное или противовирусное применение пробиотической бактерии или ее лизата.
По желанию, некоторые варианты осуществления данного изобретения не содержат лечение респираторных инфекций.
Лизаты
Пробиотические бактерии по изобретению могут быть введены в виде живых бактерий, инактивированных или умерщвленных бактерий или в виде их лизатов. В применяемом в данном документе значении "лизаты" относится к образцу пробиотической бактерии, которая подверглась лизису. Лизат может содержать один или более растворимых метаболитов пробиотической бактерии, пригодные в способах, описанных в данном документе. Лизис может осуществляться химическим или физическим разрушением, например, добавлением осмотического агента или фермента к бактериям или приложением физического давления, например, посредством разрушения звуком. Gueniche et al., например, приготовили лизат посредством ультразвука (20).
Бактерии могут быть промыты перед лизисом. Лизат может быть профильтрован и/или стерилизован после лизиса для удаления всех остающихся целыми бактерий. Лизат может содержать бесклеточный супернатант. Лизат может представлять собой смесь, содержащую клеточное содержимое пробиотической бактерии. Например, один или более фрагментов клеточной стенки или клеточной мембраны, белки, нуклеиновые кислоты, углеводы и органоиды (разрушенные или интактные). Лизат может быть суспендирован, например, в водной среде.
Лизированные клетки могут предоставить возможность высвобождения многих веществ, например, растворимых метаболитов, из внутренней части бактериальной клеточной мембраны, которые могут внести вклад в биоактивность. Следовательно, в некоторых случаях применение клеточного лизата может иметь преимущество по сравнению с применением целых бактерий.
В некоторых вариантах осуществления бесклеточный супернатант является супернатантом клеточной культуры, из которой были удалены клетки. Клетки могут быть удалены центрифугированием, и супернатант может быть отфильтрован. Супернатант сам по себе (как форма лизата) может быть применен непосредственно в составах по данному изобретению. Бесклеточный супернатант может содержать один или более растворимых метаболитов.
Композиции
Композиция может быть введена отдельно или в комбинации с другими видами лечения, или одновременно, или последовательно в зависимости от состояния, которое будет подвергаться лечению.
Пробиотическая бактерия или ее лизат могут быть растворены, суспендированы или примешаны с одним или более других фармацевтически приемлемых ингредиентов. Пробиотическая бактерия или ее лизат могут быть помещены в липосому или другую микрочастицу.
В некоторых вариантах осуществления пробиотическая бактерия может быть предоставлена в виде суспензии в фармацевтически приемлемом вспомогательном веществе, разбавителе или носителе. В некоторых вариантах осуществления пробиотическая бактерия может быть предоставлена в виде лиофилизата.
В особенно предпочтительных вариантах осуществления пробиотические бактерии или их лизаты по изобретению составляют для местного введения, в частности для применения или нанесения в или на кожу.
Составы, пригодные для трансдермального введения, содержат гели, пасты, мази, кремы, лосьоны и масла, а также накладки, лейкопластыри, повязки, перевязки, депо, скрепляющие вещества, клеи и емкости.
Мази, как правило, готовят из пробиотической бактерии или ее лизата и парафиновой или водорастворимой мазевой основы.
Кремы, как правило, готовят из пробиотической бактерии или лизата и основы для крема типа масло-в-воде. Если требуется, водная фаза основы для крема может содержать, например, по меньшей мере около 30% масс./масс. многоатомного спирта, т.е. спирта, имеющего две или более гидроксильных группы, такие как пропиленгликоль, бутан-1,3-диол, маннит, сорбит, глицерин и полиэтиленгликоль и их смеси. Местные составы могут по желанию содержать соединение, которое увеличивает абсорбцию или проникновение активных соединений через кожу или другие пораженные области. Примеры таких усилителей кожного проникновения содержат диметилсульфоксид и его аналоги.
Эмульсии, как правило, готовят из пробиотической бактерии или лизата и масляной фазы, которые могут необязательно содержать только эмульсификатор (по-другому называемый эмульгатор) или она может содержать смесь по меньшей мере одного эмульсификатора с жиром или маслом или как с жиром, так и маслом. Предпочтительно, гидрофильный эмульсификатор включается в состав вместе с липофильным эмульсификатором, который действует в качестве стабилизатора. Он также предпочтительно содержит как масло, так и жир. Совместно, эмульсификатор(ы) с или без стабилизатор(ов) составляют так называемый эмульгирующий воск, и воск вместе с маслом и/или жиром составляют так называемую эмульгирующую мазевую основу, которая формирует масляную диспергированную фазу кремовых составов.
Пригодные эмульгаторы и стабилизаторы эмульсии содержат Tween 60, Span 80, цетостеариловый спирт, миристиловый спирт, глицерилмоностеарат и лаурилсульфат натрия. Выбор пригодных масел или жира для состава основан на достижении требуемых косметических свойств, так как растворимость активных соединений, которые, вероятно, будут использованы в большинстве составов фармацевтической эмульсии, в маслах может являться очень низкой. Таким образом, крем должен предпочтительно являться нежирным, не оставляющим пятен и смываемым продуктом с пригодной консистенцией для избегания вытекания из тюбика или других контейнеров. Прямая или разветвленная цепь, моно- или двухосновные алкиловые эфиры, такие как диизоадипат, изоцетилстеарат, пропиленгликолевый диэфир жирных кислот кокосового масла, изопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат или смесь эфиров с разветвленными цепями, известная под названием Кродамол CAP, могут быть применены, причем последние три являются предпочтительными сложными эфирами. Они могут быть применены отдельно или в комбинации в зависимости от требуемых свойств. Альтернативно, липиды с высокой точкой плавления, такие как мягкий парафин и/или жидкий парафин, или другие минеральные масла, могут быть применены.
Другие составы содержат зубные спреи, жидкости для полоскания рта, зубные пасты, леденцы, противобактериальные промывки, напитки (например, молоко, йогурт), пищевые продукты (такие как йогурт, мороженное, конфеты) или порошкообразные продукты (такие как сухое молоко).
Составы могут быть пригодным образом предоставлены в виде накладки, лейкопластыря, повязки, перевязки или тому подобного, которые являются пропитанными с или покрытыми с одной или более пробиотических бактерий или ее лизатом по изобретению и необязательно одним или более из других фармацевтически приемлемых ингредиентов, включая, например, усилители проникновения, просачивания и абсорбции. Пробиотические бактерии или лизаты могут также быть представлены в форме покрытий медицинских устройств, таких как имплантат, протезы, хирургические инструменты, перчатки, катетеры, лампы, ритмоводители и тому подобное.
Состав может содержать одиночную (единичную) дозу пробиотических бактерий или ее лизата. Пригодные дозы пробиотических бактерий (интактные или лизированные) могут быть в диапазоне от 104 до 1012 КОЕ, например, одном из от 104 до 1010, от104 до 108, от 106 до 1012, от 106 до 1010 или от 106 до 108 КОЕ. В некоторых вариантах осуществления дозы могут быть введены один или два раза ежедневно.
В некоторых вариантах осуществления состав для применения в соответствии с данным изобретением может содержать по меньшей мере около 0,01%, около 0,05%, около 0,1%, около 0,2%, около 0,3%, около 0,4%, около 0,5%, около 0,6%, около 0,7%, около 0,8%, около 0,9%, около 1,0%, около 1,5%, около 2,0%, около 3,0%, около 4,0%, около 5,0%, около 6,0%, около 7,0%, около 8,0%, около 9,0%, около 10,0%, около 11,0%, около 12,0%, около 13,0%, около 14,0%, около 15,0%, около 16,0%, около 17,0%, около 18,0%, около 19,0%, около 20,0%, около 25,0%, около 30,0%, около 35,0%, около 40,0%, около 45,0%, около 50,0% по массе пробиотических бактерий или их лизата.
В некоторых вариантах осуществления состав может содержать одно из по меньшей мере около 0,01% до около 30%, от около 0,01% до около 20%, от около 0,01% до около 5%, от около 0,1% до около 30%, от около 0,1% до около 20%, от около 0,1% до около 15%, от около 0,1% до около 10%, от около 0,1% до около 5%, от около 0,2% до около 5%, от около 0,3% до около 5%, от около 0,4% до около 5%, от около 0,5% до около 5%, от около 1% до около 5% по массе пробиотических бактерий или их лизата.
Противобактериальные композиции
Изобретение также относится к антибактериальным композициям в форме очищающих продуктов, полосканий, поверхностных покрытий или других композиций, которые не предусмотрены для медицинского лечения человека или животного организма.
Такие агенты могут быть пригодны для удаления, умерщвления или предотвращения накопления бактерий на поверхности или ингибирования действия или роста бактерий.
Противобактериальные композиции по изобретению могут быть пригодны для обработки биоматериалов, имплантатов и протезов (включая стенты, клапаны, глаза, слуховые устройства, желудочные бандажи, зубные протезы, искусственные заменители сустава и т.д.), хирургических инструментов или других медицинских устройств перед введением, или лечением, или применением по отношению к пациенту или субъекту. Противобактериальные композиции могут быть пригодны для обработки поверхностей, подверженных колонизации или подвергаемых бактериям, таких как поручни, поверхности для приготовления пищи, кухонные поверхности или оборудование, столы, раковины, унитазы или другое оборудование ванной комнаты.
Противобактериальные композиции могут содержать средства в добавок к лизату, такие как средства для очистки, стабилизаторы, анионные поверхностно-активные вещества, парфюмерные вещества, хелатирующие агенты, кислоты, щелочи, буферы или детергенты. Такие агенты могут облегчать или увеличивать противобактериальные свойства средства, как например, уничтожая или ингибируя бактерии или предотвращая повторную колонизацию очищенной поверхности.
Способы приготовления композиций
Изобретение также относится к способам приготовления композиций. Способ может включать лизис популяции пробиотических бактерий и составление полученного в результате лизата в композицию. Способ может содержать стадию обработки лизата для того, чтобы удалить или инактивировать интактные бактерии в лизате, например, отделением интактных бактерии от лизата. Лизат может быть подвергнут очистке на стадии фильтрации для удаления других компонентов, таких как бактериальные ростовые среды или загрязняющие вещества.
В альтернативных композициях интактные бактерии составляют в виде композиции. Бактерии могут быть инактивированы перед или после составления в композицию. Бактерии могут быть подвергнуты стадии очистки или фильтрации для того, чтобы удалить другие компоненты, такие как бактериальные ростовые среды или загрязняющие вещества.
Композиции, приготовленные таким способом, могут быть пригодны для применения в лечении, например, в обработке бактериальных инфекций или восстановлении кожного барьера. Такие способы могут содержать добавление одного или более фармацевтически или косметически приемлемых вспомогательных веществ.
Другие композиции могут не быть пригодны для применения в лечении, например, противобактериальные композиции, такие как лосьоны. Способы приготовления противобактериальных композиций могут содержать добавление одного или более агентов к лизату или бактериям.
Пример 1: Материалы и способы
Выращивание бактерий
Пробиотические бактерии выращивали по стандартной методике до стабильной фазы в бульоне Уилкинса-Чалгрена (Wilkins-Chalgren Broth, WCB) (Oxoid) при 37°C в анаэробной рабочей станции Mark 3 (Don Whitley Scientific, Shipley, UK). S. aureus выращивали аэробно при 37°C в питательном бульоне (Oxoid). Плотности культур регулировали спектрофотометрически, чтобы среда содержала требуемое количество бактерий. Для экспериментов с использованием кератиноцитов бактерии промывали два раза в 0,85% растворе NaCl, центрифугировали и ресуспендировали в кератиноцитной среде. В некоторых экспериментах применяли селективный агар. Он представлял собой Маннит-солевой агар - MSA (Mannitol Salt Agar (Oxoid) или агар Man-Rogosa Sharpe (MRS) для S. aureus или молочнокислых бактерий, соответственно. Для экспериментов с применением умерщвленных теплом бактерий L. reuteri центрифугировали и ресуспендировали в 0,4% глюкозе и инактивировали помещением в водяную баню при 85°C в течение 45 минут. Образцы окрашивали по Граму для подтверждения того, что не произошел лизис бактериальных клеток, и высевали на чашки на среды для роста для обеспечения того, что они не были убиты. Для экспериментов с примением пробиотических лизатов 10 мл 108 КОЕ/мл L. reuteri центрифугировали, промывали, концентрировали в 1 мл кератиноцитной среды и лизировали с примением шариковой мельницы (FastPrep™ FP120, Thermo Electron Corporation). Образцы стерилизовали с фильтром для удаления всех остающихся целыми бактерий. Приблизительно 100 мкл этого лизата применяли для обработки кератиноцитов.
Культивирование клеток млекопитающих
Нормальные человеческие эпидермические кератиноциты (NHEK) (Promocell, Heidelberg, Germany) поддерживали в кератиноцитной базальной среде (Promocell, Heidelberg, Germany), содержащей смесь добавок (экстракт гипофиза быка 0,004 мг/мл, эпидермический фактор роста (рекомбинантный человеческий) 0,125 нг/мл, инсулин (рекомбинантный человеческий) 5 мкг/мл, гидрокортизон 0,33 мкг/мл, эпинефрин 0,39 мкг/мл и трансферрин, полный (человеческий) 10 мкг/мл) и 0,06 мМ CaCl2 (Promocell Heidelberg, Germany). Среду заменяли два раза в неделю и клетки культивировали при 37°C во влажной атмосфере 5% CO2. Клетки открепляли, когда они вырастали до 80% конфлюентности, и повторно высеивали при приблизительно 5×103 клеток/см2. Для экспериментов с применением продифференцированных клеток хлорид кальция в среде повышали до 1,8 мМ и клетки выращивали в течение 24 часов перед экспериментированием.
Бактериальный конкурентный анализ
Аликвоты (100 мкл) ночных культур L. reuteri и S. aureus инокулировали в свежие 10 мл бульоны (как в виде аксенической культуры, так и в виде совместных культур). pH и оптическую плотность культур измеряли при 0 и 48 часах. Через регулярные промежутки времени (3, 6, 24, 30 и 48 часов) бактерии подсчитывали чашечным подсчетом с серийным разведением с применением селективного и неселективного агаров. Через 48 часов выполняли BacLite™ Живых/мертвых штаммов в соответствии с рекомендациями производителя (Invitrogen).
Выработка ингибирующего вещества посредством L. reuteri
Ингибирование роста S. aureus посредством L. reuteri определяли c применением анализов луночной диффузии, как описано Holder и Boyce (23). Для исследования ингибирования L. reuteri выращивали или в среде Man-Rogosa-Sharpe (MRS) (Oxoid), или в бульоне Уилкинса-Чалгрена (WCB) (Oxoid) анаэробно при 37°C до стационарной фазы. Применяли культуры целых клеток (Whole cell, WC) L. reuteri, выращенные в WCB (1 г/л глюкозы) или MRS (20 г/л глюкозы). В других экспериментах клетки осаждали в микроцентрифуге при 15000×g в течение 5 минут и бесклеточный супернатант (CFS) эктрагировали для применения. Затем чашки инкубировали при 37°C в течение 48 ч и рассчитывали зоны ингибирования. Для измерения выработки органических кислот посредством L. reuteri измеряли pH WC и CFS. В отдельном эксперименте для определения того, продуцирует ли L. reuteri какие-либо другие ингибирующие вещества, бесклеточные супернатанты нейтрализовали с применением 1M NaOH перед применением в анализе луночной диффузии. Для определения того, продуцировала ли L. reuteri органические кислоты в клеточной культуре, измеряли pH инфицированных клеточных культур.
Измерение жизнеспособности кератиноцитов
Клетки NHEK выращивали в 24-луночных культуральных чашках до коэнфлюентности. Клеточную культуральную среду заменяли средой, содержащей указанную концентрацию бактерий. Для экспериментов перед воздействием и после воздействия NHEK обрабатывали с L. reuteri в течение периода между 1 и 4 часами перед добавлением/после добавления S. aureus. Во всех экспериментах клетки инкубировали при 37°C в увлажненной атмосфере 5% CO2 в течение 24 часов. Затем среду удаляли и клетки промывали стерильным PBS. Клетки открепляли с применением трипсина (0,4%)/EDTA (0,3%) (Promocell) и определяли клеточную жизнеспособность анализом вытеснения с трипановым синим (45).
Измерение жизнеспособности S. aureus
Для определения того, способны ли были L. reuteri или NHEK ингибировать рост S. aureus в клеточной культуре, клетки выращивали до конфлюентности в 24-луночной чашке. Их инфицировали или с S. Aureus, или с S. aureus и L. reuteri вместе. Параллельно, в лунки без клеток также добавляли эти комбинации для определения эффекта самих кератиноцитов на стафилококковую жизнеспособность. После 24 часов воздействия среду удаляли и центрифугировали для осаждения внеклеточных бактерий. Затем клетки трипсинизировали и добавляли 500 мкл 0,25% Triton-X-100 (Sigma-Aldrich) в PBS на приблизительно 30 минут для лизиса клеток. Содержимое лунок затем комбинировали с клеточным осадком и выполняли чашечный подсчет с серийным разведением с применением маннит-солевого агара (MSA) для определения общего количества жизнеспособных стафилококков.
Анализы адгезии для L. reuteri, L. salivarius и S. aureus
Конфлюэнтные дифференцирующие NHEK подвергали или пробиотику, или S. aureus в течение 1 часа. После инкубирования клетки промывали три раза в PBS для удаления не прикрепившихся адгезивных бактерий. Клетки трипсинизировали и выполняли чашечный подсчет с серийным разведением для оценки количества прикрепленных адгезивных бактерий. Селективный агар применяли для роста стафилококков. В отдельных экспериментах клетки подвергали L. reuteri в течение 1 часа перед добавлением S. aureus (вытеснение), в то же время (конкурирование) или через 30 минут после того, как началась инфекция S. aureus (замещение) для определения того, могла ли L. reuteri ингибировать S. aureus адгезию к кератиноцитам. Для определения того, могла ли L. reuteri ингибировать инвазию кератиноцитов стафилококками, клетки подвергали или S. aureus, или S. aureus и L. reuteri в течение 1 часа. Клетки промывали три раза в стерильном PBS для удаления неприкрепленных адгезивных бактерий и ростовую среду замещали средой, содержащей 100 мкг/мл гентамицина (Sigma-Aldrich) в течение 2 часов. Клетки затем промывали три раза в стерильном PBS и трипсинизировали и лизировали в 0,25% Triton-X-100 в течение 30 минут для высвобождения интернализованных бактерий. Бактерии в лизатах подсчитывали с применением серийных разведений. В экспериментах с использованием кондиционированных сред (conditioned medium, CM) NHEK подвергали L. reuteri и инкубировали в течение 1 часа при 37°C в 5% CO2. CM удаляли из подверженных воздействию клеток и центрифугировали при 15000×g в течение 3 минут для осаждения бактериальных клеток и фильтровали через фильтр с размером пор 0,22 мкм (Millipore, USA). В экспериментах, исследующих роль α5β1 интегрина в S. aureus адгезии, NHEK предварительно подвергали воздействию 60 мкг/мл антитела анти-α5β1 интегрин (Millipore, USA) в течение 1 часа перед инфекцией клеток. Альтернативный способ для оценки количества прикрепленных адгезивных бактерии использовали для мертвых препаратов L. reuteri. Клетки выращивали на слайд-камерах LabTek (Thermo-Scientific). Анализы адгезии выполняли как обычно, при этом применяя установленные количества бактерий. После того как клетки подвергали бактериям, клетки промывали два раза в PBS и фиксировали в метаноле в течение 20 минут перед выполнением окрашивания по Граму. Количество прикрепленных адгезивных бактерий в расчете на 100 клеток оценивали с применением Keyence All во флуоресцентном микроскопе one Type.
Статистические анализы
Все эксперименты выполняли как минимум три раза, с тремя повторами каждый раз. Для экспериментов, сравнивающих два лечения, применяли t-критерии Стьюдента. Для экспериментов, сравнивающих два или более видов лечения, использовали однофакторный ANOVA с блокированием и апостериорный тест Тьюки. Дозозависимый эффект и конкурентные анализы анализировали с применением линейной регрессии и двухфакторного ANOVA, соответственно. Результаты считали значимыми, если P<0,05.
Пример 2
S. aureus индуцировала клеточную смерть в первичных человеческих кератиноцитах
Авторы изобретения первоначально характеризовали эффекты S. aureus на жизнеспособность кератиноцитов, выполняя анализы вытеснения трипанового синего в NHEK, инкубированных с S. aureus при различных дозах. При концентрации 105 КОЕ/мл S. aureus только 49,4% кератиноцитов являлись жизнеспособными после 24 часов инфекции (Фиг. 1). Это снижалось дозозависимым образом так, что только 3,3% кератиноцитов являлись жизнеспособными при концентрациях 108 КОЕ/мл S. aureus (Фиг. 1). Приблизительно 106 организмов в физиологически релевантных концентрациях могут быть обнаружены, например, в кожной раневой инфекции (7). При этой концентрации 30,5% кератиноцитов являлись жизнеспособными после 24 часов инфекции. Эту концентрацию применяли в анализах адгезии.
L. reuteri защищает кератиноциты от индуцированной S. aureus гибели клеток
Исследовали способность трех штаммов молочнокислых бактерий (L. reuteri ATCC 55730, L. rhamnosus AC413 и L. salivarius UCC118) к защите кератиноцитов от эффектов S. aureus (Фиг. 2a). Инфекция NHEK с S. aureus снижала жизнеспособность до 8,8%. В отличие от S. aureus, инкубирование NHEK с молочнокислыми бактериями не приводило к значительному снижению клеточной жизнеспособности (Фиг. 2a). Коинфекция с S. aureus и либо L. rhamnosus, либо L. reuteri приводила к повышенной жизнеспособности кератиноцитов через 24 часа 42,7% и 53,1% (P=0,0012 и P<0,0001), соответственно. Этот уровень защиты наблюдали или когда клетки были продифференцированы в течение 24 часов в кальции или непродифференцированы (результаты не приведены). Однако коинфекция кератиноцитов с S. aureus и L. salivarius не приводила к значительному повышению жизнеспособности по сравнению с NHEK, инфицированными с S. aureus (P=0,052, Фиг. 2a). Так как L. reuteri являлась более защищающей, чем другие два штамма, авторы дополнительно исследовали эффекты L. reuteri, задаваясь вопросом, являлся ли защитный эффект L. reuteri дозозависимым. Однако не происходило никакого дополнительного значительного увеличения жизнеспособности кератиноцитов с применением L. reuteri при 105, 106, 107 или 108 КОЕ/мл (P>0,05) (Фиг. 2c). Авторы изобретения также исследовали то, являлись ли защитные эффекты пробиотика зависимыми от жизни бактерий. Хотя убитая нагреванием L. reuteri не защищала NHEK от S. aureus, лизат L. reuteri предоставлял значительный защитный эффект (P=0,01) (Фиг. 2d и e, соответственно). Дополнительно в экспериментах использовали 108 КОЕ/мл живых L. reuteri (MOI 1000).
Защитные эффекты L. reuteri являлись зависимыми от времени
Далее авторы изобретения исследовали то, являлся ли выбор времени применения L. reuteri по отношению к S. aureus инфекции критичным для защитного эффекта пробиотика. Авторы оценивали жизнеспособность кератиноцитов предварительно или впоследствии подверженных L. reuteri в течение 1, 2 или 4 часов перед инфекцией S. aureus в течение 24 часов. Предварительно подверженные воздействию кератиноциты имели жизнеспособности, подобные коинфицированным клеткам (P>0,05) (Фиг. 3a). Однако, кератиноциты, подверженные L. reuteri на 1, 2 или 4 часа после S. aureus инфекции, имели сходные жизнеспособности с клетками, подверженными S. aureus (P>0,05) (Фиг. 3b).
L. reuteri не ингибирует рост S. aureus
Авторы изобретения считали, что механизм(ы) лежащий(ие) в основе защитных эффектов S. aureus, возможно был(и) обоснован(ы) прямыми эффектами пробиотика на патоген. Однако конкурентные анализы показали отсутствие значительного снижения в жизнеспособности как L. Reuteri, так и S. aureus во время совместного культивирования в течение 48 часов (Фиг. 4a) по сравнению с аксенической культурой (P>0,05). Дополнительно, в анализе в культуре кератиноцитов общее количество жизнеспособных стафилококков также не подвергалось воздействию наличием пробиотика (Фиг. 4b; таблица 1). Подсчет живых и мертвых клеток в совместном культивировании через 48 часов также продемонстрировал отсутствие значительного снижения в бактериальной клеточной жизнеспособности (данные не приведены). Кроме того, хотя авторы изобретения установили, что L. reuteri могла продуцировать органическую кислоту, которая ингибировала рост патогена на чашках с агаром (данные не приведены), когда авторы измеряли pH среды для кератиноцитов, инфицированных с S. aureus, L. reuteri и обеими одновременно в течение 24 часов, не имело место значительного различия в pH между обработками.
L. reuteri ингибирует адгезию и инвазию стафилококков к кератиноцитам
Известно, что один из механизмов, посредством которого пробиотики защищают эпителий кишечника, заключается в ингибировании патогенной адгезии к эпителиальным клеткам. Следовательно, авторы изобретения исследовали то, могут ли L. reuteri ингибировать адгезию S. aureus к NHEK.
График на Фиг. 5a демонстрирует, что как L. reuteri, так и S. aureus адгезировали к NHEK. Затем авторы установили то, могут ли L. reuteri исключать или конкурировать с S. aureus за сайты связывания при добавлении пробиотика перед или в то же время, что и патоген. Графики на Фиг. 5b и 5c демонстрируют снижение адгезии S. aureus к NHEK, когда L. reuteri добавляли перед или в то же время, что и добавление патогена (P=0,026 и P=0,0078, соответственно). Однако, если L. reuteri добавляли после S. aureus, пробиотик не мог предотвращать патоген от адгезии (P>0,05, Фиг. 5d). Кроме того, анализ защиты от гентамицина продемонстрировал, что пробиотик ингибировал S. aureus инвазию NHEK (P=0,009, Фиг. 5e). Результаты авторов изобретения показали, что убитая нагреванием L. reuteri не ингибировала значительно стафилококковую адгезию (P>0,05, Фиг. 6a). Однако пробиотические лизаты были способны ингибировать стафилококковую адгезию (P=0,032), хотя не в той же степени, что живые L. reuteri (P=0,0002). NHEK имели приблизительно 5,6±0,2 log КОЕ стафилококков, адгезированных при подвергании живым L. reuteri по сравнению с 6,0±0,2 log КОЕ при подвергании лизатам (Фиг. 6b).
L. salivarius UCC118 не предотвращают S. aureus от адгезии к кератиноцитам
Авторы изобретения считали, что защитные эффекты L. reuteri могут быть связаны с ее способностью ингибировать адгезию патогена к NHEK. Для дополнительного исследования этого авторы задались вопросом, приводило ли ингибирование S. aureus от связывания к NHEK к снижению его токсичности. Известно, что S. aureus адгезирует к клеткам посредством связывающего фибронектин белка, который взаимодействует с внеклеточным фибронектином (26, 36). Фибронектин сам по себе связывается с кератиноцитным рецептором, α5β1 интегрином. Как показано в предшествующих исследованиях (27), предварительная обработка клеток с блокирующим антителом к α5β1 интегрину привела к пониженной S. aureus адгезии. Следовательно, авторы обрабатывали NHEK с α5β1 блокирующим антителом и исследовали его способность к ингибированию адгезирования и токсичности к NHEK (Фиг. 7a и b). Блокирующее антитело значительно ингибировало адгезию S. aureus к NHEK (P=0,007), хотя также оказалось, что оно ингибировало способность S. aureus индуцировать гибель клеток в NHEK (P=0,03). Затем авторы исследовали способность L. salivarius, которая не защищала NHEK (Фиг. 2a), к ингибированию адгезии S. aureus. Было обнаружено, что кератиноциты, подверженные L. salivarius и S. aureus, имели сходные количества прикрепленных адгезивных стафилококков (4,5±0,2 log КОЕ) с кератиноцитами, подверженными только S. aureus (4,9±0,2 log КОЕ) (P>0,05, Фиг. 8a). Кроме того, L. salivarius не адгезировала к NHEK так же эффективно (5,6±0,1 log КОЕ), как L. reuteri (6,7±0,1 log КОЕ) (P=0,005, Фиг. 8b).
ОБСУЖДЕНИЕ
В этом исследовании авторы изобретения осуществили подготовительный этап к характеризации применимости пробиотиков для топического применения. Авторы исследовали способность трех штаммов молочнокислых бактерий с известным пробиотическим потенциалом в кишечнике и ротовой полости (9, 38, 44) к защите кератиноцитов от эффектов распространенного кожного патогена S. aureus.
Нанесение S. aureus в физиологически релевантных концентрациях умерщвляло 69,5% NHEK в пределах 24 ч. В противоположность этому, не один из штаммов молочнокислых бактерий не влиял значительно на жизнеспособность NHEK в таких же условиях, что предполагает, что пробиотики хорошо переносились кератиноцитами. Когда NHEK подвергали воздействию как патогена, так и L. reuteri, пробиотик защищал клетки от эффектов патогена, на что указывала значительно более высокая процентная жизнеспособность инфицированных S. aureus NHEK в присутствии L. reuteri в сравнении с отсутствием L. reuteri (Фиг. 2a и b). Защитный эффект также наблюдали с лизатами L. reuteri, но не убитыми нагреванием клетками L. reuteri (Фиг. 2d и e). Кроме того, защитные эффекты пробиотика варьировались между различными видами, так как защита, предоставляемая L. Reuteri, была выше, чем обеспечиваемая посредством L. rhamnosus. В противоположность этому, L. salivarius не обеспечивали кератиноциты какой-либо значительной защитой от S. aureus (Фиг. 2a).
Хотя, насколько авторам изобретения известно, это является первым доказательством, показывающим способность пробиотика защищать кератиноциты от патогенных эффектов S. aureus in vitro, было продемонстрировано, что L. fermentum ингибирует S. aureus инфекцию хирургических имплантатов и образование абсцессов у крыс (18). Ранее было показано, что пробиотики проявляют защитные эффекты против патоген-индуцированной гибели клеток в других эпителиях. Например, было показано, что L. rhamnosus, L. reuteri и L. oris ингибируют индуцированную S. pyogenes клеточную гибель фарингеальных эпителиальных клеток (34). Также было показано, что пробиотические бесклеточные супернатанты являются защищающими. Cупернатанты L. delbruekii защищают энтероциты от C. difficile патогенности (5).
Защитный эффект L. reuteri против S. aureus-индуцированной гибели клеток кератиноцитов может являться результатом нескольких различных механизмов. Известно, что молочнокислые бактерии вырабатывают органические кислоты и бактериоцины, которые могут иметь прямые антимикробные эффекты на патогены. Хотя авторы могли продемонстрировать в диффузионных анализах, что L. reuteri могут продуцировать кислоту, это, по-видимому, не является ответственным за защитные эффекты, наблюдаемые из-за того, что pH кератиноцитной культуральной среды не изменялся в присутствии молочнокислых бактерий. Подобным образом, авторы не детектировали какую-либо другую антимикробную активность, так как в конкурентном анализе, скорость роста и продуктивность S. aureus в присутствии L. reuteri была идентичной продуктивности аксенической культуры (Фиг. 4).
По меньшей мере часть механизма, посредством которого L. reuteri защищает кератиноциты, по-видимому, связана со способностью L. reuteri предотвращать адгезию S. aureus. Несколько наборов данных указывают на это. Во-первых, S. aureus была токсичной для клеток, когда ее адгезия была ингибирована с применением интегрин-блокирующего антитела (Фиг. 8a и b). Во-вторых, лизаты L. reuteri, которые ингибируют адгезию, также являлись защищающими (Фиг. 2e и 6b). С другой стороны, убитая нагреванием L. reuteri не защищала кератиноциты (Фиг. 2d). В-третьих, штаммы молочнокислых бактерий, которые не ингибировали S. aureus адгезию (L. salivarius) (Фиг. 8a), не защищали кератиноциты (Фиг. 2a).
Момент времени добавления L. reuteri к клеткам, по-видимому, является критичным для его защитных эффектов. Когда L. reuteri добавляли перед или в то же время с S. aureus, NHEK были защищены от эффектов патогена (Фиг. 3a и 2a, соответственно). Однако, если пробиотик добавляли после патогена, уровни гибели кератиноцитных клеток были схожими с наблюдаемыми в культурах, не обрабатываемых с пробиотиком (Фиг. 3b). В совокупности данные авторов изобретения указывают на механизм защиты посредством L. reuteri, содержащий конкурентное вытеснение S. aureus из участков связывания кератиноцитов.
То, как S. aureus индуцирует гибель клеток в кератиноцитах, является комплексным процессом. В целом, считается, что первым этапом в S. aureus патогенезе является адгезирование S. aureus к кератиноцитам перед инвазией (27). Для осуществления этого S. aureus использует ряд адгезинов, совместно называемых компоненты микробной поверхности, распознающие адгезивные матричные молекулы (MSCRAMMS) (11). Стафилококковые адгезины, которые, как известно, вовлечены в адгезию к кератиноцитам, содержат связывающие фибронектин белки (FnBP) (27, 36), белок A, факторы слипания и коагулазу (35). Тейхоевая кислота опосредует связывание S. aureus с назальными эпителиальными клетками, хотя неизвестно, верно ли это для кератиноцитов (1). Однако, блокирование интегрина не полностью ингибировало связывание S. aureus с NHEK, что предполагает, что используется более чем один адгезин (Фиг. 8a).
Исследования авторов изобретения и другие исследования (27) показали, что блокирование фибронектиновых рецепторов на кератиноцитах ингибирует адгезию S. aureus (Фиг. 8a). Что интересно, в отдельных экспериментах (данные не приведены) авторы не могли продемонстрировать вовлечение этого интегрина в связывание L. reuteri с NHEK. В действительности, ни протеазная, ни глюкозидазная обработка кератиноцитов не была способна предотвращать L. reuteri от связывания с клетками (данные не приведены). Однако, какой бы ни был механизм, посредством которого пробиотик связывается с клетками, он содержит термолабильную молекулу, так как убитая нагреванием L. reuteri не адгезирует к кератиноцитам так же эффективно (данные не приведены) и не защищает их от S. aureus (Фиг. 2d).
До настоящего времени не было опубликованных сообщений о способности пробиотиков адгезировать к эпидермическим кератиноцитам. В другом месте было предположено, что адгезия пробиотиков к эпителию происходит посредством коллаген-связывающих белков (21), связывающих слизь белков (37), липотейхоевых кислот (19) и белков s-слоя (10, 14). Релевантные адгезины могут быть белковыми, углеводными или может быть использована смесь двух и более чем одного адгезина. L. reuteri была способна ингибировать стафилококковую адгезию к кератиноцитам, когда клетки предварительно подвергали пробиотику (вытеснение из участков связывания) (Фиг. 5b) и коинфицировали с S. aureus (конкурирование за участки связывания) (Фиг. 5c), но не при применении после того, как стафилококковая инфекция началась (замещение из участков связывания) (Фиг. 5d). Другие авторы показали, что конкурентное ингибирование/вытеснение часто является зависимым от штамма, хотя замещение, как правило, не так эффективно или для него может требоваться большее количество времени (32, 49). Результаты авторов изобретения предполагают, что L. reuteri не замещает имеющиеся S. aureus из кератиноцитов и подтверждают обнаружение того, что L. reuteri не могут защищать кератиноциты от S. aureus цитотоксичности при добавлении после того, как инфекция уже началась. Появились некоторые доказательства, предполагающие, что пробиотики могут иметь синергический эффект в отношении адгезии друг друга, что предполагает, что исследование эффекта комбинаций пробиотиков может представлять интерес в будущем (39).
По-видимому, L. reuteri применяет множество механизмов для прикрепления к эпителию хозяина и может использовать несколько стратегий для предотвращения S. aureus от адгезии. Возможно, что L. reuteri может влиять на экспрессию адгезивных структур на поверхности кератиноцитов, эта область еще не была исследована. Предшествующая работа показала, что пробиотик L. rhamnosus GG и L. plantarum 299v могут индуцировать повышающую регуляцию генов, задействованных в экспрессии муцина в кишечном тракте, который, в свою очередь, ингибирует адгезию энтеропатогенной E. coli (33). В исследовании в 1999 году нанесение молочнокислой бактерии S. thermophilus на кератиноциты in vitro и кожу in vivo привело к повышенной выработке церамида (15). В другом исследовании в 2006 году применяли пробиотический ферментированный продукт из молочной сыворотки к NHEK и обнаружили повышенную экспрессию мРНК маркеров дифференциации - кератина-10 и инволюкрина (2), что предполагает, что "постбиотики" или метаболиты пробиотиков могут также иметь применение при кожных расстройствах. Другой пример положительных эффектов метаболитов пробиотиков был продемонстрирован в недавней статье, где была разработана пробиотическая накладка для кожи. Лиофилизированные L. fermentum суспендировали в альгинате с глюкозой, и из нитритных солей мог быть выработан газ оксид азота, вещество способное ингибировать рост патогенных бактерий (24).
Авторы изобретения предоставили доказательство того, что пробиотик обладает защитным эффектом против патогенных эффектов S. aureus на жизнеспособность кератиноцитов in vitro. Эти результаты предполагают, что топический пробиотик для кожи мог исключать патогенные организмы и, следовательно, предотвращать инфекции, и согласуются с работой других. Было показано, что топическое введение L. plantarum на ожоги у мышей ингибирует колонизацию ожогов P. aeruginosa, стимулирует заживление и модифицирует воспалительный ответ (46). Это организм также подвергали сравнению и обнаружили, что он также эффективен, как традиционные виды лечения ожоговых ран с сульфадиазином серебра для ограничения бактериальной нагрузки ран и заживления in vivo (41). В добавление, пробиотик может также находить применение при обработке здоровой кожи для повышения увлажнения и барьерной функции. В 2010 году лизат бифидобактерии наносили местно на кожу добровольцев, и было обнаружено, что он увеличивает барьерную функцию кожи по пониженным измерениям трансэпидермической потери воды (20). Хотя требуются дополнительные исследования для определения полного эффекта пробиотиков на кожу, открытия авторов изобретения показывают, что L. reuteri может защищать кератиноциты от патогенных эффектов S. aureus посредством вытеснения и конкурирования за участки связывания. Авторы изобретения предполагали, что профилактическое применение пробиотиков или их лизатов в барьерных кремах и мылах может помочь в борьбе против стафилококковой кожной колонизации и последующих инфекций.
Пример 3
Как описано выше, авторы продемонстрировали, что Lactobacillus reuteri может частично защищать первичные человеческие кератиноциты от эффектов патогена кожи Staphylococcus aureus. В этом исследовании для улучшения понимания потенциала пробиотиков, авторы оценивали роль второго пробиотика L. rhamnosus GG, а также комбинаций молочнокислых бактерий и бактериальных лизатов в ингибировании S. aureus инфекции кератиноцитов. L. rhamnosus GG была выделена из человеческих экскрементов (см. US 4839281 и US 5032399) и депонирована под номером доступа ATCC 53103.
L. reuteri защищает кератиноциты от индуцированной S. aureus гибели клеток
Нормальные человеческие первичные кератиноциты (keratocytes, KC) подвергали воздействию S. aureus (106/мл) в присутствии или отсутствии L. rhamnosus GG, L. reuteri или отдельно или в комбинации (все при 108/мл). Жизнеспособность KC измеряли после 24 часов, применяя анализ вытеснения трипанового синего.
Когда KC обрабатывали с S. aureus отдельно, только 39% KC оставались жизнеспособными через 24 часа после инфекции (p<0,001). Однако, в присутствии или L. reuteri, или L. rhamnosus GG жизнеспособность инфицированных патогенов KC повышалась до 60% и 59%, соответственно (p=0,008 и 0,009, соответственно). Кроме того, когда авторы применяли оба штамма в комбинации в отношении инфицированных S. aureus клеток, жизнеспособность KC повышалась до 75% (p=0,0025).
Что интересно, лизат L. rhamnosus GG также обеспечивал значительную защиту KC с 70% клеток, являющимися жизнеспособными после 24 часов инкубирования с S. aureus в присутствии лизата пробиотика.
L. rhamnosus ингибирует рост S. aureus
S. aureus выращивали в присутствии L. rhamnosus GG или лизата L. rhamnosus GG. Как показано на Фиг. 12, рост S. aureus был более низким в присутствии или живых L. Rhamnosus, или лизата, чем с S. aureus отдельно.
Этот ингибирующий эффект не наблюдали в L. rhamnosus AC413. Как показано на Фиг. 11, в анализе луночной диффузии рост S. aureus не был ингибирован, так как не было видно зоны ингибирования вокруг лунки после 24 часов.
L. rhamnosus убивает S. aureus
Для дополнительного разъяснения эффекта L. rhamnosus GG на S. Aureus авторы исследовали эффект L. rhamnosus или ее лизата на жизнеспособность S. aureus. Как показано на Фиг. 13, в присутствии живых L. rhamnosus GG было измерено большее количество мертвых S. aureus клеток по сравнению с S. aureus, выращиваемыми в отсутствие L. rhamnosus GG (LGG). Количество мертвых клеток было значительно повышено, когда S. aureus культивировали в присутствии лизата LGG.
Таким образом, авторы идентифицировали штамм пробиотической бактерии с защитой клеток кожи и регенерирующими свойствами. Что особенно важно, лизаты этого штамма улучшают способность кератиноцитов кожи противостоять вредной токсичности, индуцированной S. aureus (SA) (Фиг. 9a). При применении в комбинации с лизатом второго штамма комбинация является даже более эффективной при защите против S. aureus, чем когда любой штамм применяется отдельно (Фиг. 9b).
L. rhamnosus GG и L. reuteri ускоряют восстановление поцарапанного кератиноцитного монослоя и увеличивают кератиноцитную миграцию
Агенты, которые увеличивают и восстанавливают барьерную функцию кератиноцитов, являются весьма перспективными не только в качестве терапевтических агентов, но также в качестве косметических улучшающих кожу агентов. Аугментация барьерной функции увеличивает уровень гидратации кожи и, как известно, улучшает внешний вид кожи и приводит к более здоровому косметическому внешнему виду.
Авторы изобретения также продемонстрировали, что когда кератиноцитные монослои поцарапаны для удаления клеток (т.е. модельная рана), наличие свойства пробиотических лизатов значительно и неожиданно ускоряет восстановление монослоя и повторное установление барьера (Фиг. 10). Как показано на Фиг. 14, лизаты L. rhamnosus GG или L. reuteri повышали скорость повторной эпителизации кератиноцитных монослоев. Такой эффект не наблюдали, когда лизаты экстрактов L. plantarum, L. fermentum, S. epidermidis или Bifidobacterium longum наносили на пораненный кератиноцитный монослой.
Лизаты LGG и L. reuteri также были способны увеличивать скорость кератиноцитной миграции. Как показано на Фиг. 15, только экстракты LGG и L. reuteri были способны увеличивать скорость кератиноцитной миграции по сравнению с контролем. Кератиноцитная миграция является важным механизмом, посредством которого монослои повторно эпителизируются.
Эти данные демонстрируют, что различные штаммы пробиотических Lactobacilli или отдельно, или в комбинации могут защищать человеческие кератиноциты от эффектов кожного патогена S. aureus. Данные авторов изобретения демонстрируют, что пробиотики потенциально могут иметь применения, например, в топических составах для защиты кожи от адвентициальных патогенов.
Пример 4
Материалы и способы
Приготовление пробиотических лизатов.
Все пробиотические штаммы (B. longum reuter ATCC-51870, L. plantarum, ATCC-10241, L. reuteri, ATCC-55730, L. rhamnosus Goldwin и Gorbach, ATCC-53103, L. fermentum, ATCC-14932) приобрели у LGC ltd (UK) и выращивали по стандартной методике до стационарной фазы в бульоне Уилкинса-Чалгрена или на агаре Уилкинса-Чалгрена при 37°C в анаэробной рабочей станции Mark 3 (Don Whitley scientific, UK). Культуры регулировали спектрофотометрически, чтобы они содержали 108 КОЕ/мл. 10 мл этих культур центрифугировали, промывали и затем концентрировали в 1 мл кератиноцитной базальной среды (Promocell, Heidelberg, Germany). Затем образец лизировали с применением шариковой мельницы (FastPrep FP120, Thermo Electron Corporation, UK) и затем стерилизовали фильтрованием для удаления всех остающихся целыми бактерий. 100 мкл этого лизата применяли для обработки кератиноцитных культур.
Первичные кератиноцитные клеточные культуры и измерение TEER.
Нормальные человеческие эпидермические кератиноциты (Normal human epidermal keratinocytes, NHEK) получали и культивировали, как описано в Prince et al (50). Для экспериментов, измеряющих функционирование TJ, клетки высевали на чашки на 12-луночные проницаемые поликарбонатные вставки для клеточных культур Thincert™ с размером пор 0,4 мкм (Greiner Bio-one Ltd, UK). NHEK выращивали в кератиноцитной базальной среде (Promocell, Heidelberg, Germany) до конфлюэнтности. На этой стадии среду замещали средой с высоким содержанием кальция CNT-02-3DP5 (CELLnTEC Advanced cell systems, Switzerland), которая индуцирует образование TJ. Функцию TJ измеряли с применением эпителиального вольтметра, оснащенного палочковыми электродами (World Precision Instruments Ltd, UK). Все эксперименты повторяли по меньшей мере три раза с тремя лунками в отдельных экспериментах. В некоторых экспериментах лизаты пробиотических бактерий добавляли на апикальную сторону вставок и TEER измеряли в обозначенные моменты времени после обработки.
Измерение жизнеспособности NHEK с применением MTT анализа.
3-{4,5-диметилтиазол-2-ил}дифенилтетразолия бромид (MTT, приобретенный у Sigma-Aldrich Ltd., Poole, UK) готовили в виде стокового раствора в 5 мг/мл забуференного фосфатом физиологического раствора. NHEK выращивали до конфлюэнтности в 96-луночных чашках и затем обрабатывали бактериальными лизатами в течение 24 часов. Затем среду замещали свежей средой, содержащей 10% MTT. Чашки инкубировали в течение 4 часов при 37°C и среду замещали диметилсульфоксидом. Поглощение на каждой лунке считывали при 570 нм в считывателе для планшетов.
Выделение белка из NHEK и иммуноблотинг.
Белок выделяли из клеток NHEK в соответствии со способом, описанным в Mclaughlin et al (51). Кратко, клетки из одиночных Thincert™ соскабливали в 100 мкл буфера для экстракции (NaCl (120 мМ), HEPES, pH 7,5 (25 мМ), Triton X-100 (1%), EDTA (2 мМ), NaF (25 мМ), NaVO4 (1 мМ), SDS (0,2%), апротинин (10 мкг/мл), лейпептин, (10 мкг/мл) и пепстатин A (10 мкг/мл)) и затем инкубировали на льду в течение 30 минут. После центрифугирования в микроцентрифуге супернатант отбирали в чистую пробирку и применяли для анализа белковой экспрессии TJ. ДСН-ПААГ-электрофорез выполняли в соответствии со способом Laemmli et al (52) и белки электрофоретически переносили на PVDF мембраны. Далее промывали, блокировали в 5% (масс./об.) обезжиренном молоке и инкубировали с первичными антителами в течение ночи. Они представляли собой кроличий анти-клаудин 1, 4, мышиный анти-окклюдин, мышиный анти-ZO-1 или мышиный анти-P-актин (все получены у InVitrogen). Мембраны в дальнейшем промывали и инкубировали с конъюгированными с пероксидазой хрена вторичными антителами. Иммуноблоты проявляли с применением усиленной хемилюминесценции (Amersham, Bucks, UK) и денситометрию выполняли, как описано в Mclaughlin et al, 2004 (51).
Ингибирование TLR-2.
Для ингибирования TLR2 кератиноциты предварительно обрабатывали рекомбинантным человеческим анти-TLR2 антителом с 10 мкг/мл (Abeam, UK) в течение 1 часа перед стимулированием пробиотическими лизатами.
Статистический анализ.
Все эксперименты выполняли как минимум три раза и анализировали с применением программного обеспечения SPSS версии 20. Для экспериментов, сравнивающих два лечения, применяли t-критерий независимых выборок для статистического анализа всех данных. Для экспериментов, сравнивающих два или более лечений, применяли однофакторный тест ANOVA для статистического анализа всех данных. Результаты считали статистически значимыми при p<0,05. Данные выражены в виде средних ± стандартная ошибка средних (SEM) для по меньшей мере n=3 для каждого эксперимента.
Результаты
Пробиотические лизаты хорошо переносятся NHEK.
Для начала авторы исследовали то, любой ли пробиотический лизат при исследовании воздействовал на жизнеспособность NHEK. С этой целью авторы выполняли MTT анализ на NHEK, которые были инкубированы с бактериальными лизатами в течение 24 часов. Данные на Фиг. 16 иллюстрируют, что за исключением лизатов L. fermentum, ни один из лизатов тестируемых штаммов не воздействовал значительно на жизнеспособность NHEK. Лизат L. fermentum индуцировал 32% (±1,3%, p=<0,01, n=3) снижение жизнеспособности NHEK после 24 часов инкубирования.
Пробиотические бактерии увеличивают функцию TJ в NHEK.
Нормальные человеческие эпидермические кератиноциты развивают TJ, когда они перенесены из среды, содержащей низкие концентрации кальция (~0,2 мМ), в среду, содержащую высокие концентрации кальция (~1,8 мМ). Этот 'кальциевый сдвиг' индуцирует сборку TJ, что может быть детектировано как возрастание в TEER клеток с течением времени. TEER достигает пика через 48 часов после кальциевого сдвига и затем немного понижается, достигая устойчивого состояния через 72 часа (Фиг. 17a). Когда 100 мкл лизата из 108 КОЕ/мл пробиотических бактерий добавляли в апикальную секцию Thincert™, наблюдали значительные различия в развитии TEER между необработанными и обработанными NHEK. Эти различия являлись зависимыми от штамма. С тем наблюдением, что лизаты L. fermentum снижают клеточную жизнеспособность, хорошо согласовалось то, что авторы наблюдали значительное снижение в TEER в NHEK, обрабатываемых с этим лизатом по сравнению с необработанными клетками (Фиг. 17b, p<0,005). В противоположность этому, лизаты L. reuteri первоначально повышали TEER через 24 часа после кальциевого сдвига, но в дальнейшем оно снижалось обратно до уровней, не значительно отличных от уровня контрольных необработанных клеток (Фиг. 17c). L. plantarum также вырабатывала увеличение TEER сверх увеличения контрольных клеток. Это увеличение являлось устойчивым в течение 48 часов после кальциевого сдвига. Однако через 72 часа TEER не было значительно отличающимся от необработанных NHEK (Фиг. 17d). Наибольшие увеличения TEER наблюдали в NHEK, обрабатываемых лизатами B. longum reuter и L. rhamnosus GG. Лизаты из обоих этих штаммов продуцировали увеличение TEER, которое было на ~300 Ом.см2 выше, чем в контрольных клетках (Фиг. 17e и f, p<0,05). Кроме того, эти увеличения являлись устойчивыми, и TEER в обработанных клетках было все еще значительно больше в обработанных в сравнении с необработанными NHEK через 72 часа после кальциевого сдвига. По этим причинам лизаты B. longum reuter и L. rhamnosus GG были применены далее для дополнительного исследования.
Β. longum reuter и L. rhamnosus GG вырабатывают дозозависимые эффекты на TEER в кератиноцитах.
Для дополнительного определения эффектов B. longum reuter и L. rhamnosus GG на функцию TJ в кератиноцитах, авторы измеряли TEER в присутствии 100 мкл лизата, приготовленного из бактерий при 106, 104 и 102 КОЕ/мл. При 106 КОЕ/мл лизаты из обоих штаммов были все еще способны продуцировать TEER, которые были значительно выше, чем в необработанных клетках (Фиг. 18a и b, p<0,005). Дополнительно, лизаты L. rhamnosus GG, полученные из 104 КОЕ/мл, также были способны вызывать и увеличивать TEER (Фиг. 18b). Однако более низкие концентрации любого штамма приводили к лизатам, которые были неспособны вырабатывать TEER, значительно отличающиеся от контрольных клеток (Фиг. 18a и b).
Пробиотические лизаты модулируют экспрессию специфических белков TJ.
Доказательство предполагает, что функция TJ часто отражается в уровнях экспрессии конкретных белков, задействованных в комплексах. Основные белки TJ, экспрессируемые кератиноцитами, содержат клаудин 1, клаудин 4, ZO-1 и окклюдин. Следовательно, авторы применяли иммуноблотинг для исследования экспрессии этих белков в необработанных NHEK в сравнении с NHEK, обрабатываемыми пробиотическими лизатами в течение 72 часов.
Обработка NHEK с лизатом B. longum reuter, продуцировала значительные увеличения всех четырех белков TJ (Фиг. 19a и b). Однако, L. rhamnosus GG индуцировала увеличения только уровней белка клаудина 1, окклюдина и ZO-1 (Фиг. 19a и b). Не было значительного изменения уровней клаудина 4 в L. rhamnosus GG, обработанных NHEK в сравнении с контрольными клетками. Однако, в целом, увеличения экспрессии белка, вызванные посредством L. rhamnosus GG, были больше, чем увеличения, индуцированные B. longum reuter (Фиг. 19b).
Индуцированная Bifidobacterium longum reuter модуляция функции TJ опосредована посредством TLR2.
Кератиноциты воспринимают наличие бактерий посредством рецепторов, распознающих образ, таких как Толл-подобные рецепторы (toll like receptors, TLR). Несколько доказательств в кишечнике указывали на зависимость между TLR активацией и изменениями в барьерной функции TJ. Дополнительно, недавняя работа Yuki et al, (53) продемонстрировала TLR-опосредованную аугментацию функции TJ в кератиноцитах в ответ на бактериальные лиганды, такие как пептидогликан. Следовательно, мы, естественно, задались вопросом, были ли увеличения индуцированной пробиотиком функции TJ опосредованы TLR. Особое внимание уделяли TLR2 из-за того, что он является главным рецептором для грамположительных организмов (54).
Для исследования этого авторы инкубировали NHEK в присутствии нейтрализующего TLR2 антитела в течение 1 часа перед добавлением пробиотических лизатов. Данные на Фиг. 20a демонстрируют, что нейтрализация TLR2 аннулировала возрастание TEER, вызванное как пептидогликаном (хорошо изученный агонист TLR2), так и B. longum reuter. Однако лизат L. rhamnosus GG был все еще способен индуцировать увеличения в функции TJ (Фиг. 20a). Подобным образом, увеличение белковой экспрессии TJ, индуцированное B. longum reuter, но не L. rhamnosus GG, предотвращалось нейтрализацией TLR2 (Фиг. 20b).
Обсуждение
Пять различных штаммов молочнокислых бактерий тестировали на их эффект на функцию TJ. Из них лизаты всех кроме одного штамма L. fermentum были способны увеличивать TEER кератиноцитов. L. fermentum в действительности снижал TEER, что вероятно связано с наблюдением авторов того, что этот штамм также снижал жизнеспособность кератиноцитов. Все другие 4 штамма молочнокислых бактерий усиливали TJ функцию, но с различными эффективностями. В этой связи, L. rhamnosus GG и B. longum reuter продуцировали большие и более устойчивые увеличения TEER, чем L. plantarum или L. reuteri.
Эти зависимые от штамма эффекты, вероятно, обусловлены экспрессией различных белков и углеводов индивидуальными штаммами молочнокислых бактерии. В действительности, увеличение TEER, индуцированное L. rhamnosus GG и B. longum reuter, проявляло дозозависимые эффекты, что предполагает, что задействована(ы) конкретная(ые) молекула(ы) и рецептивный(ые) механизм(ы).
Как L. rhamnosus GG, так и B. longum reuter повышали экспрессию белков TJ в кератиноцитах. Однако конкретный набор молекул был различным в каждом случае. Модуляция белковой экспрессии почти точно является механизмом, посредством которого эти лизаты увеличивают барьерную функцию TJ кератиноцитов. В частности, ранее много раз было показано, что изменения уровней экспрессии клаудинов связаны с изменениями в барьерной функции.
Механизм, посредством которого B. longum reuter, но не L. rhamnosus GG, увеличивает TJ белковую экспрессию и TEER почти точно ассоциирован с сигнализацией через TLR2.
Это продемонстрировано двумя видами доказательств: 1) нейтрализация TLR2 аннулирует индуцированные B. longum reuter увеличения TEER и 2) увеличение экспрессии белков TJ также аннулировалось блокированием TLR2. Это, пожалуй, не удивительно, учитывая, что TLR2 является главной моделью распознавания рецептора для грамположительных бактерий.
Связь между врожденной иммунной системой и барьерной регуляцией в кишечнике была только недавно установлена. Здесь активация TLR может или увеличивать, или снижать функцию эпителиального плотного сочленения в зависимости от конкретного активированного TLR.
Лизат L. rhamnosus GG, по-видимому, вызывает его эффекты посредством механизма, независимого от TLR2, потому что нейтрализация этого рецептора не аннулировала индуцированное L. rhamnosus GG увеличение функции TJ или экспрессии белка. TLR2 является главным рецептором для грамположительных видов и активируется несколькими различными лигандами из таких бактерий, такими как липотейхоевая кислота. То наблюдение, что L. rhamnosus GG индуцирует увеличение функции TJ, как оказывается, не является опосредованным TLR 2, что предполагает, что эта молочнокислая бактерия имеет молекулы, которые сигнализируют через альтернативные рецепторы.
Данные авторов изобретения предполагают, что специфические штаммы молочнокислых бактерий увеличивают функцию TJ в человеческих первичных кератиноцитах. Барьерная функция эпидермиса является критичной для жизни в качестве земных организмов, и недавние данные подчеркнули существенную роль TJ в проницаемости эпидермического барьера по отношению к воде. Данные авторов предполагают, что аугментация TJ барьера, индуцированная пробиотическими бактериальными лизатами, может играть роль в общей кожной барьерной функции.
ССЫЛКИ
1. Aly, R., H.R. Shinefield, C. Litz, and H.I. Maibach. 1980. Role of Teichoic Acid in the Binding of Staphylococcus aureus to Nasal Epithelial Cells. The Journal of Infectious Diseases 141:463-465.
2. Baba, H., A. Masuyama, and T. Takano. 2006. Short Communication: Effects of Lactobacillus helveticus-Fermented Milk on the Differentiation of Cultured Normal Human Epidermal Keratinocytes. Journal of Dairy Science 89:2072-2075.
3. Backhed, F., R.E. Ley, J.L. Sonnenburg, D.A. Peterson, and J.I. Gordon. 2005. Host-Bacterial Mutualism in the Human Intestine. Science 307:1915-1920.
4. Balma-Mena, A., I. Lara-Corrales, J. Zeller, S. Richardson, M.J. McGavin, M. Weinstein, and E. Pope. 2011. Colonization with community-acquired methicillin-resistant Staphylococcus aureus in children with atopic dermatitis: a cross-sectional study. International Journal of Dermatology 50:682-688.
5. Banerjee, P., G. Merkel, and A. Bhunia. 2009. Lactobacillus delbrueckii ssp. bulgaricus B-30892 can inhibit cytotoxic effects and adhesion of pathogenic Clostridium difficile to Caco-2 cells. Gut Pathogens 1:8.
6. Bek-Thomsen, M., H.B. Lomholt, and M. Kilian. 2008. Acne is Not Associated with Yet-Uncultured Bacteria. Journal of Clinical Microbiology 46:3355-3360.
7. Bowler, P. G., B.I. Duerden, and D.G. Armstrong. 2001. Wound Microbiology and Associated Approaches to Wound Management. Clin. Microbiol. Rev. 14:244-269.
8. Burkhart, C. N., and C.G. Burkhart. 2003. Microbiology's principle of biofilms as a major factor in the pathogenesis of acne vulgaris. International Journal of Dermatology 42:925-927.
9. Caglar, E., S. Kavaloglu Cildir, S. Ergeneli, N. Sandalli, and S. Twetman. 2006. Salivary mutans streptococci and lactobacilli levels after ingestion of the probiotic bacterium Lactobacillus reuteri ATCC 55730 by straws or tablets. Acta Odontologica Scandinavica 64:314-318.
10. Chen, X., J. Xu, J. Shuai, J. Chen, Z. Zhang, and W. Fang. 2007. The S-layer proteins of Lactobacillus crispatus strain ZJ001 is responsible for competitive exclusion against Escherichia coli O157:H7 and Salmonella typhimurium. International Journal of Food Microbiology 115:307-312.
11. Clarke, S.R., S.J. Foster, and K.P. Robert. 2006. Surface Adhesins of Staphylococcus aureus, p. 187-224. Advances in Microbial Physiology, vol. Volume 51. Academic Press.
12. Coconnier, M.H., M.F. Bernet, S. Kernels, G. Chauviere, J. Fourniat, and A.L. Servin. 1993. Inhibition of adhesion of enteroinvasive pathogens to human intestinal Caco-2 cells by Lactobacillus acidophilus strain LB decreases bacterial invasion. FEMS microbiology letters 110:299-306.
13. Cotter, P.D., C. Hill, and R.P. Ross. 2005. Bacteriocins: developing innate immunity for food. Nat Rev Micro 3:777-788.
14. Deepika, G., D. Charalampopoulos, I.L. Allen, S. Sima, and M.G. Geoffrey. 2010. Surface and Adhesion Properties of Lactobacilli, p. 127-152. Advances in Applied Microbiology, vol. Volume 70. Academic Press.
15. Di Marzio, L, B. Cinque, C. De Simone, and M.G. Cifone. 1999. Effect of the Lactic Acid Bacterium Streptococcus thermophilus on Ceramide Levels in Human Keratinocytes In Vitro and Stratum Corneum In Vivo. 113:98-106.
16. Edmond, M.B., S.E. Wallace, D.K. McClish, M.A. Pfaller, R.N. Jones, and R.P. Wenzel. 1999. Nosocomial Bloodstream Infections in United States Hospitals: A Three-Year Analysis. Clinical Infectious Diseases 29:239-244.
17. FAO/WHO. 2002. Guidelines for the Evaluation of Probiotics in Food: Report of a Joint FAO/WHO Working Group on Drafting Guidelines for the Evaluation of Probiotics in Food.
18. Gan, B.S., J. Kim, G. Reid, P. Cadieux, and J.C. Howard. 2002. Lactobacillus fermentum RC-14 Inhibits Staphylococcus aureus Infection of Surgical Implants in Rats. The Journal of Infectious Diseases 185:1369-1372.
19. Granato, D., F. Perotti, I. Masserey, M. Rouvet, M. Golliard, A. Servin, and D. Brassart. 1999. Cell Surface-Associated Lipoteichoic Acid Acts as an Adhesion Factor for Attachment of Lactobacillus johnsonii La1 to Human Enterocyte-Like Caco-2 Cells. Appl. Environ. Microbiol. 65:1071-1077.
20. Gueniche, A., P. Bastien, J.M. Ovigne, M. Kermici, G. Courchay, V. Chevalier, L. Breton, and I. Castiel-Higounenc. 2010. Bifidobacterium longum lysate, a new ingredient for reactive skin. Experimental Dermatology 19:e1-e8.
21. Heinemann, C, J.E.T. van Hylckama Vlieg, D.B. Janssen, H.J. Busscher, H.C. van der Mei, and G. Reid. 2000. Purification and characterization of a surface-binding protein from Lactobacillus fermentum RC-14 that inhibits adhesion of Enterococcus faecalis 1131. FEMS Microbiology Letters 190:177-180.
22. Helgeland, L, J.T. Vaage, B. Rolstad, T. Midtvedt, and P. Brandtzaeg. 1996. Microbial colonization influences composition and T-cell receptor V beta repertoire of intraepithelial lymphocytes in rat intestine. Immunology 89:494-501.
23. Holder, I.A., and S.T. Boyce. 1994. Agar well diffusion assay testing of bacterial susceptibility to various antimicrobials in concentrations non-toxic for human cells in culture. Burns 20:426-429.
24. Jones, M., J. Ganopolsky, A. Labbe, and S. Prakash. 2010. A novel nitric oxide producing probiotic patch and its antimicrobial efficacy: preparation and in vitro analysis. Applied Microbiology and Biotechnology 87:509-516.
25. Karska-Wysocki, B., M. Bazo, and W. Smoragiewicz. 2010. Antibacterial activity of Lactobacillus acidophilus and Lactobacillus casei against methicillin-resistant Staphylococcus aureus (MRSA). Microbiological Research 165:674-86.
26. Kintarak, S., S.P. Nair, P.M. Speight, and S.A. Whawell. 2004. A recombinant fragment of the fibronectin-binding protein of Staphylococcus aureus inhibits keratinocyte migration. Archives of Dermatological Research 296:250-257.
27. Kintarak, S., S.A. Whawell, P.M. Speight, S. Packer, and S.P. Nair. 2004. Internalization of Staphylococcus aureus by Human Keratinocytes. Infect. Immun. 72:5668-5675.
28. Kluytmans, J., A. Van Belkum, and H. Verbrugh. 1997. Nasal carriage of Staphylococcus aureus: Epidemiology, underlying mechanisms, and associated risks. Clinical Microbiology Reviews 10:505-520.
29. Krut, O., O. Utermohlen, X. Schlossherr, and M. Kronke. 2003. Strain-Specific Association of Cytotoxic Activity and Virulence of Clinical Staphylococcus aureus Isolates. Infect. Immun. 71:2716-2723.
30. Lai, Y., A.L. Cogen, K.A. Radek, H.J. Park, D.T. MacLeod, A. Leichtle, A.F. Ryan, A. Di Nardo, and R.L. Gallo. 2010. Activation of TLR2 by a Small Molecule Produced by Staphylococcus epidermidis Increases Antimicrobial Defense against Bacterial Skin Infections. J Invest Dermatol 130:2211-2221.
31. Lai, Y., A. Di Nardo, T. Nakatsuji, A. Leichtle, Y. Yang, A. L. Cogen, Z.-R. Wu, L.V. Hooper, R. R. Schmidt, S. von Aulock, K.A. Radek, C.-M. Huang, A.F. Ryan, and R.L. Gallo. 2009. Commensal bacteria regulate Toll-like receptor 3-dependent inflammation after skin injury. Nat Med 15:1377-1382.
32. Lee, Y.-K., K.-Y. Puong, A.C. Ouwehand, and S. Salminen. 2003. Displacement of bacterial pathogens from mucus and Caco-2 cell surface by lactobacilli. Journal of Medical Microbiology 52:925-930.
33. Mack, D.R., S. Michail, S. Wei, L. McDougall, and M. A. Hollingsworth. 1999. Probiotics inhibit enteropathogenic E. coll adherence in vitro by inducing intestinal mucin gene expression. Am J Physiol Gastrointest Liver Physiol 276:G941-950.
34. Maudsdotter, L., H. Jonsson, S. Roos, and A.-B. Jonsson. 2011. Lactobacilli Reduce Cell Cytotoxicity Caused by Streptococcus pyogenes by Producing Lactic Acid that Degrades the Toxic Component Lipoteichoic Acid. Antimicrobial agents and chemotherapy 55:1622-88.
35. Mempel, M., T. Schmidt, S. Weidinger, C. Schnopp, T. Foster, J. Ring, and D. Abeck. 1998. Role of Staphylococcus aureus Surface-Associated Proteins in the Attachment to Cultured HaCaT Keratinocytes in a New Adhesion Assay. Journal of Investigative Dermatology 111:452-456.
36. Mempel, M., C. Schnopp, M. Hojka, H. Fesq, S. Weidinger, M. Schaller, H. C. Korting, J. Ring, and D. Abeck. 2002. Invasion of human keratinocytes by Staphylococcus aureus and intracellular bacterial persistence represent haemolysin-independent virulence mechanisms that are followed by features of necrotic and apoptotic keratinocyte cell death. British Journal of Dermatology 146:943-951.
37. Miyoshi, Y., S. Okada, T. Uchimura, and E. Satoh. 2006. A Mucus Adhesion Promoting Protein, MapA, Mediates the Adhesion of Lactobacillus reuteri to Caco-2 Human Intestinal Epithelial Cells. Bioscience, Biotechnology, and Biochemistry 70:1622-1628.
38. Nikawa, H., S. Makihira, H. Fukushima, H. Nishimura, Y. Ozaki, K. Ishida, S. Darmawan, T. Hamada, K. Hara, A. Matsumoto, T. Takemoto, and R. Aimi. 2004. Lactobacillus reuteri in bovine milk fermented decreases the oral carriage of mutans streptococci. International Journal of Food Microbiology 95:219-223.
39. Ouwehand, A.C, E. Isolauri, P.V. Kirjavainen, S.T. olkko, and S.J. Salminen. 2000. The mucus binding of Bifidobacterium lactis Bb12 is enhanced in the presence of Lactobacillus GG and L. delbrueckii subsp. bulgaricus. Letters in Applied Microbiology 30:10-13.
40. Peral, M.C, M.A. Huaman Martinez, and J.C. Valdez. 2009. Bacteriotherapy with Lactobacillus plantarum in burns. International Wound Journal 6:73-81.
41. Peral, M.C, M.M. Rachid, N.M. Gobbato, M.A. H. Martinez, and J.C. Valdez. 2009. lnterleukin-8 production by polymorphonuclear leukocytes from patients with chronic infected leg ulcers treated with Lactobacillus plantarum. Clinical Microbiology and Infection 16:281-286.
42. Rembacken, B.J., A.M. Snelling, P.M. Hawkey, D.M. Chalmers, and A.T.R. Axon. 1999. Non-pathogenic Escherichia coli versus mesalazine for the treatment of ulcerative colitis: a randomised trial. The Lancet 354:635-639.
43. Ron, E.Z., and E. Rosenberg. 2001. Natural roles of biosurfactants. Environmental Microbiology 3:229-236.
44. Shornikova, A.V., I.A. Casas, E. Isolauri, H. Mykkanen, and T. Vesikari. 1997. Lactobacillus reuteri as a therapeutic agent in acute diarrhoea in young children. J Pediatr Gastroenterol Nutr 24:399-404.
45. Strober, W. 1997. Trypan blue exclusion test of cell viability, p. Appendix 3B. Current Protocols in Immunology. John Wiley & Sons, Inc.
46. Valdez, J.C, M.C. Peral, M. Rachid, M. Santana, and G. Perdigon. 2005. Interference of Lactobacillus plantarum with Pseudomonas aeruginosa in vitro and in infected burns: the potential use of probiotics in wound treatment. Clinical Microbiology & Infection 11:472-479.
47. Vanderhoof, J.A., D.B. Whitney, D.L. Antonson, T.L. Hanner, J.V. Lupo, and R.J. Young. 1999. Lactobacillus GG in the prevention of antibiotic-associated diarrhoea in children. The Journal of Pediatrics 135:564-568.
48. Wanke, I., H. Steffen, C. Christ, B. Krismer, F. Gotz, A. Peschel, M. Schaller, and B. Schittek. 2011. Skin Commensals Amplify the Innate Immune Response to Pathogens by Activation of Distinct Signalling Pathways. J Invest Dermatol 131:382-390.
49. Zarate, G., and M.E. Nader-Macias. 2006. Influence of probiotic vaginal lactobacilli on in vitro adhesion of urogenital pathogens to vaginal epithelial cells. Lett Appl Microbiol 43:174-180.
50. Prince T, Mcbain AJ and O'Neill CA. 2012. Lactobacillus reuteri protects epidermal keratinocytes from Syaphylococcus aureus induced cell death by competitive exclusion. Appl. Environ. Microbiol. 78(15):5119-26.
51. McLaughlin J. Padfield PJ, Burt JP and O'Neill CA. 2004. Ochratoxin A increases permeability through tight junctions by removal of specific claudin isoforms. Am J. Physiol. Cell Physiol. 287(5):C1412-7.
52. Laemmli UK 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature; 227: 680-685.
53. Yuki T, Yoshida H, Akazawa Y, Komiya A, Sugiyama Y, Inoue S. 2011. Activation of TLR2 enhances tight junction barrier in epidermal keratinocytes. J Immunol 187(6):3230-7.
54. Fournier B and Philpott DJ. 2005. Recognition of Staphylococcus aureus by the innate immune system. Clin Microbiol Rev. 18(3):521-40
55. Tsukita S and Furuse M. 2002 Claudin based barrier in simple and stratified cellular sheets. Curr Opin. Cell Biol. 14(5):531-6
56. Miyauchi E, O'Callaghan J, Butto LF, Hurley G, Melgar S, Tanabe S, Shanahan F, Nally K, O'Toole PW. 2012. Mechanism of protection of transepithelial barrier function by Lactobacillus salivarius: strain dependence and attenuation by bacteriocin production. Am J Physiol Gastrointest Liver Physiol. 303(9):G1029-41.
57. Seth A, Yan F, Polk DB and Rao RK. 2008. Probiotics ameliorate the hydrogen peroxide-induced epithelial barrier disruption by a PKC- and MAP kinase-dependent mechanism. Am J Physiol Gastrointest Liver Physiol. 294(4):G1060-9
58. Krause G, Winkler L, Mueller SL, Haseloff RF, Piontek J, Blasig IE. 2008. Structure and function of claudins. Biochim Biophys Acta 1778(3):631-45.
59. Coyne, C.B., Gambling, T.M., Boucher, R.C., Carson, J.L. and Johnson, L.G. 2003. Role of claudin interactions in airway junctional permeability. Am J Physiol Lung Cell Physiol 285(5):L1166-78
60. Michikawa H, Fujita-Yoshigaki J, Sugiya H. 2008. Enhancement of barrier function by overexpression of claudin-4 in tight junctions of submandibular gland cells. Cell Tiss Res 334(2):255-64.
61. Ko JA, Murata S and Nishida T 2009. Up-regulation of the tight-junction protein ZO-1 by substance P and IGF-1 in A431 cells. Cell Biochem Funct. 27(6):388-94.
62. Moran GW, O'Neill CA and McLaughlin JT 2012. GLP-2 enhances barrier formation and attenuates TNFα-induced changes in a Caco-2 cell model of the intestinal barrier. Regul Pept. 178(1-3):95-101.
63. Furuse M, Hata M, Furuse K, Yoshida Y, Haratake A, Sugitani Y, Noda T, Kubo A, Tsukita S. 2002. Claudin-based tight junctions are crucial for the mammalian epidermal barrier: a lesson from claudin-1-deficient mice. J Cell Biol. 156(6):1099-111.
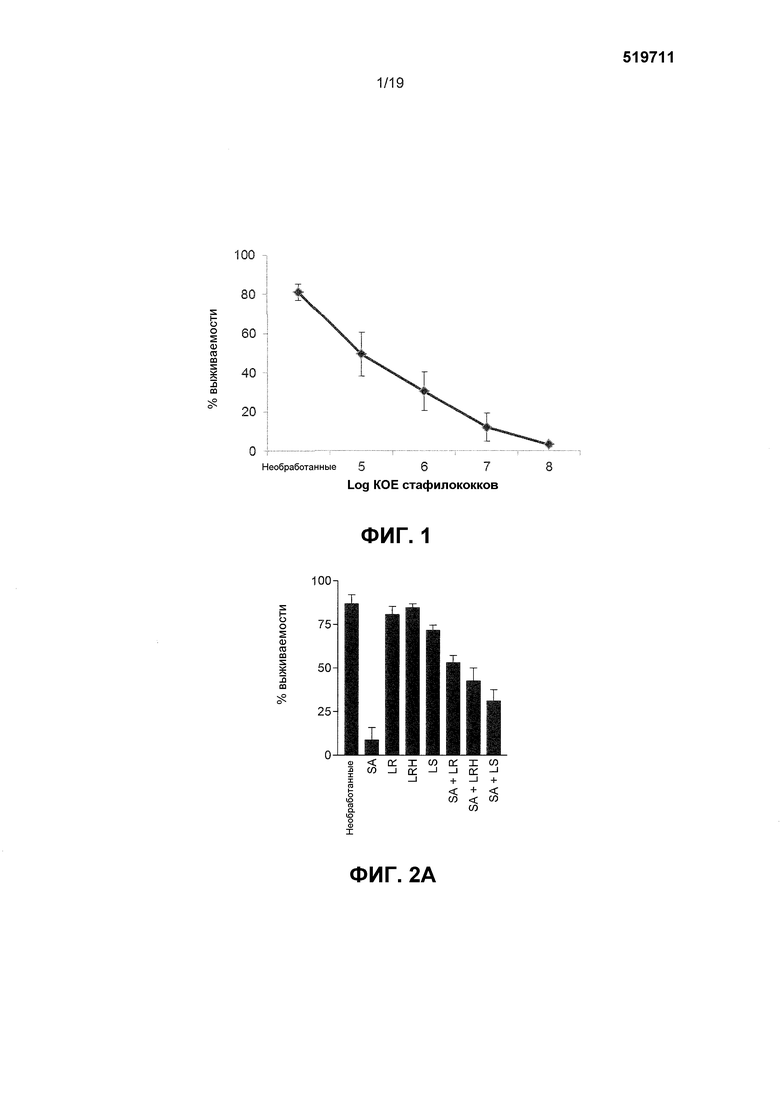
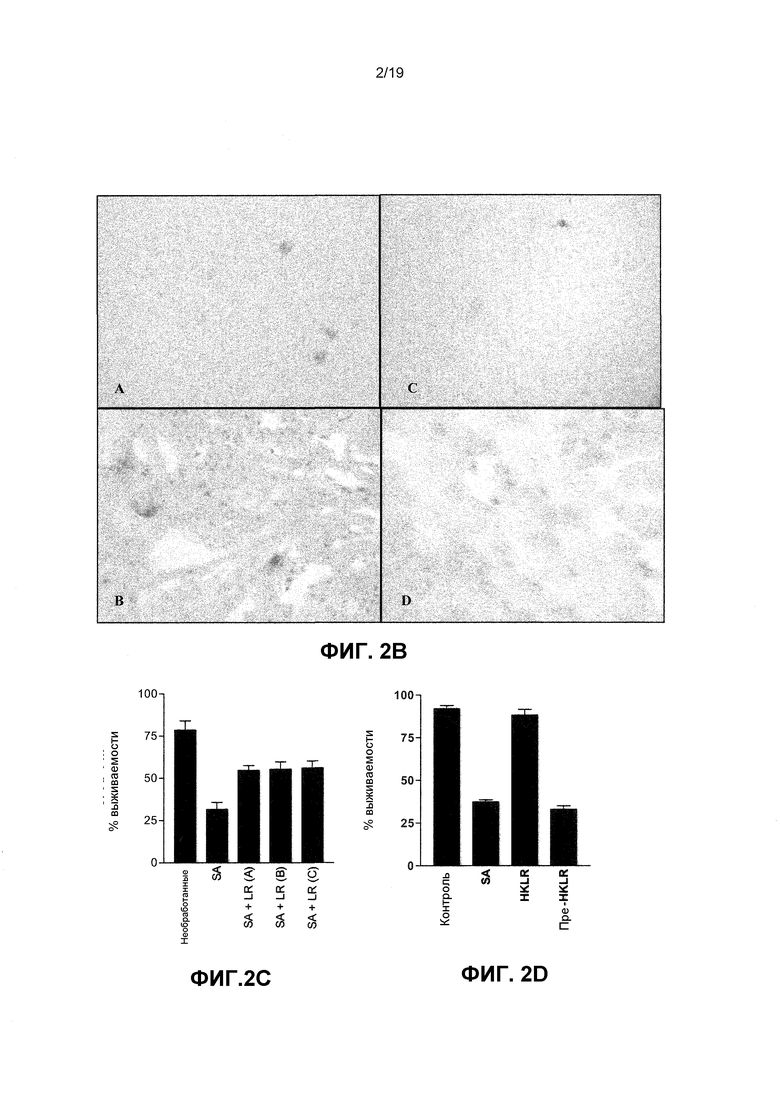
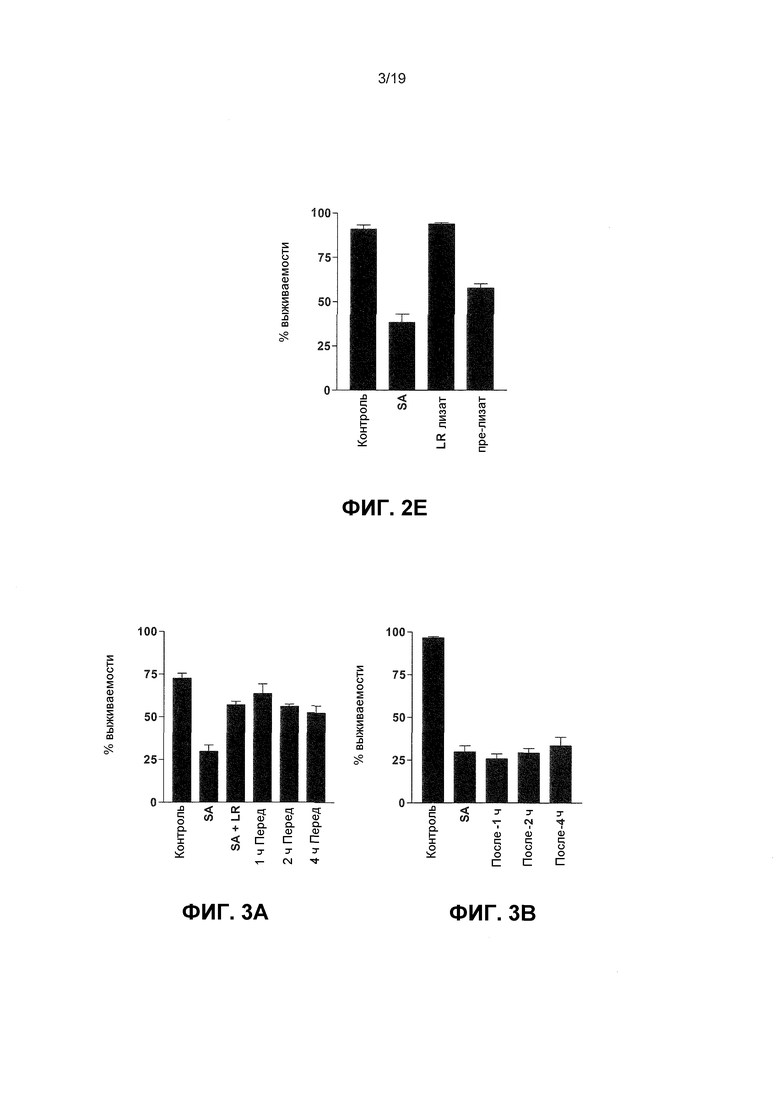

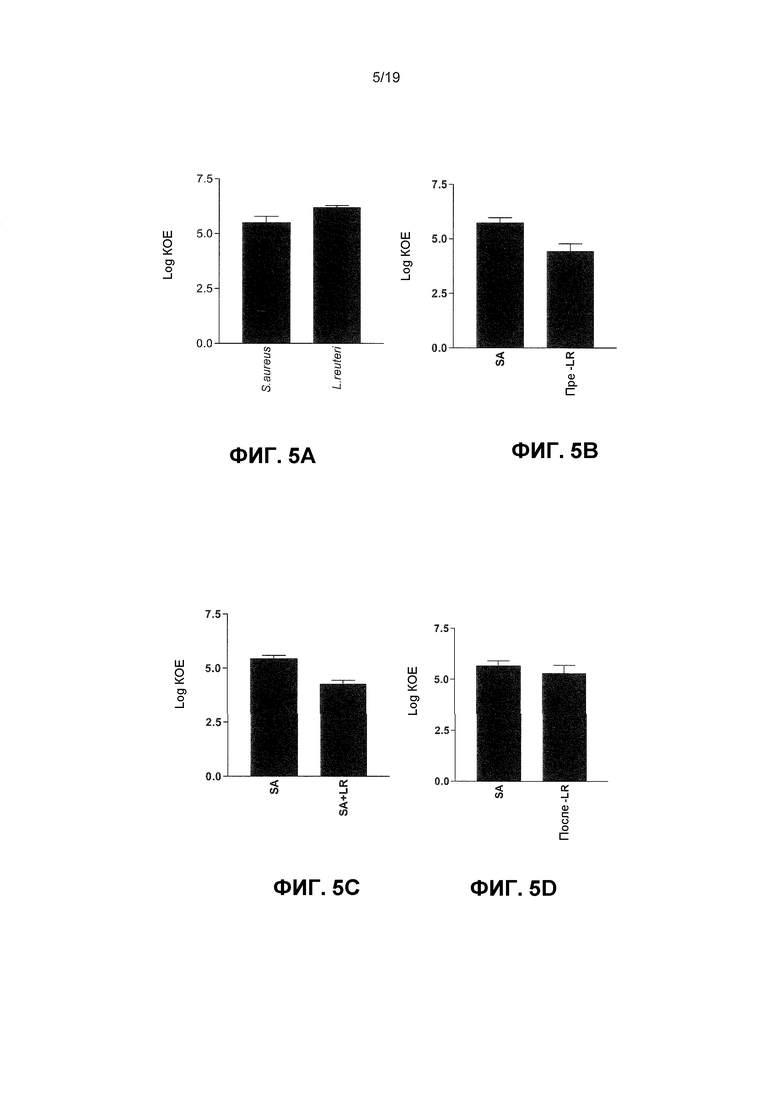
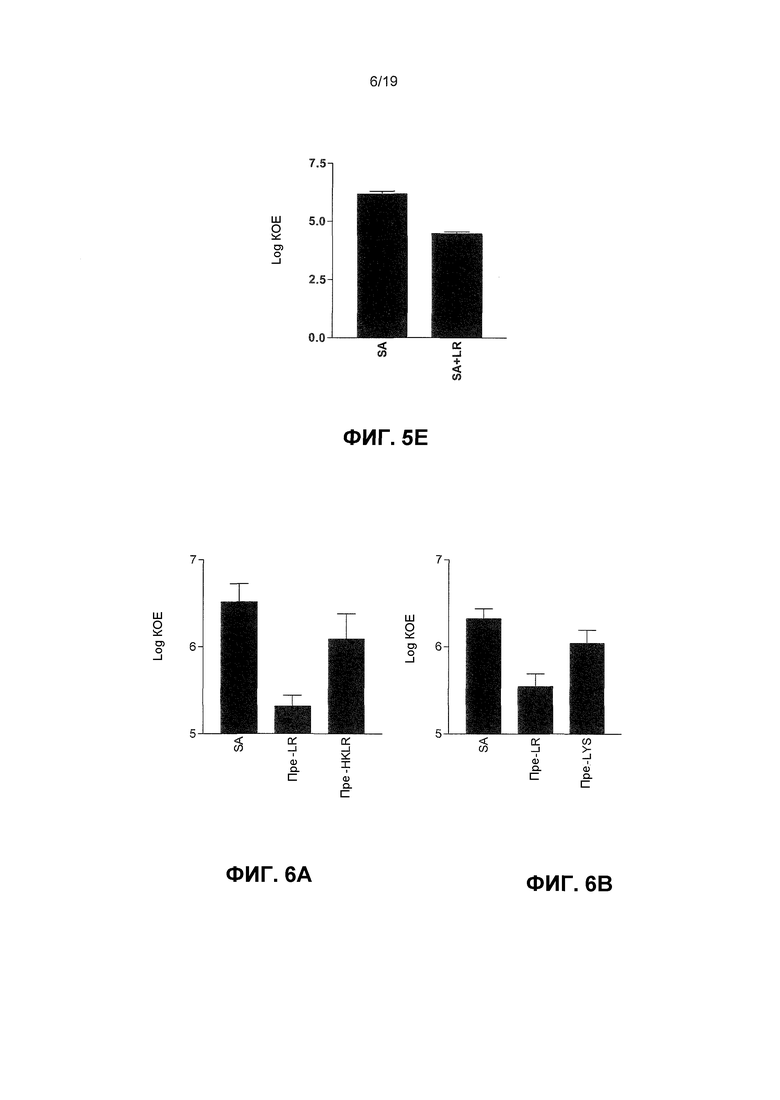
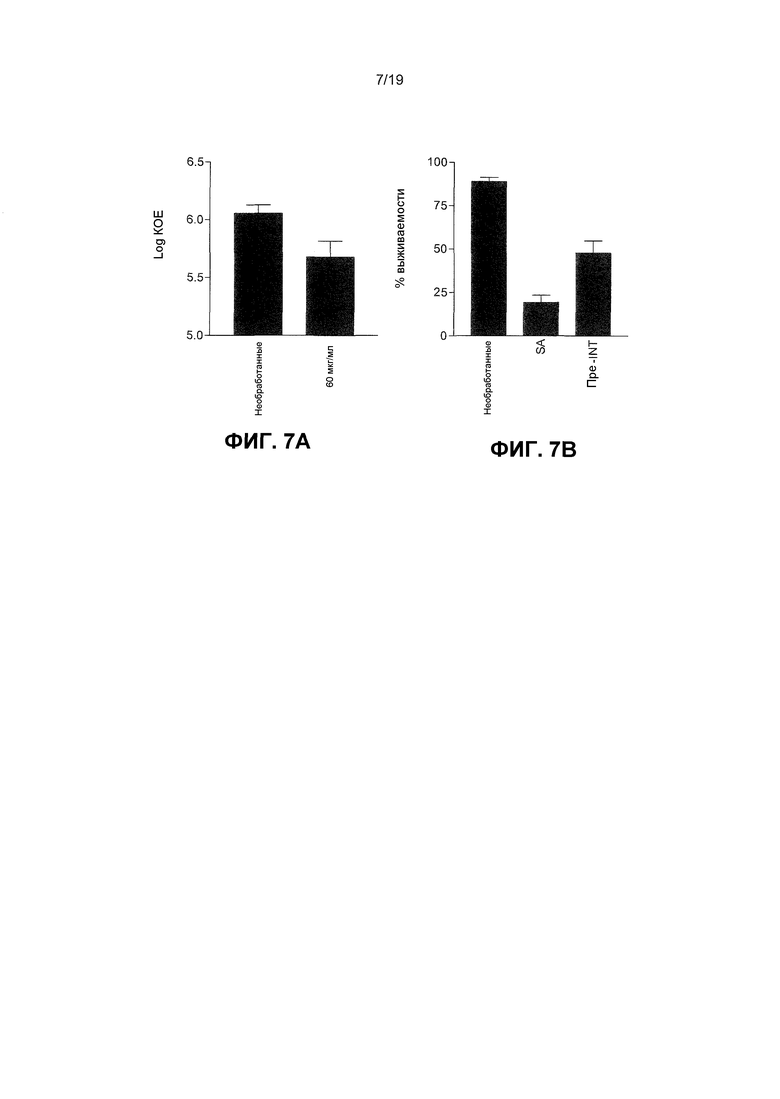

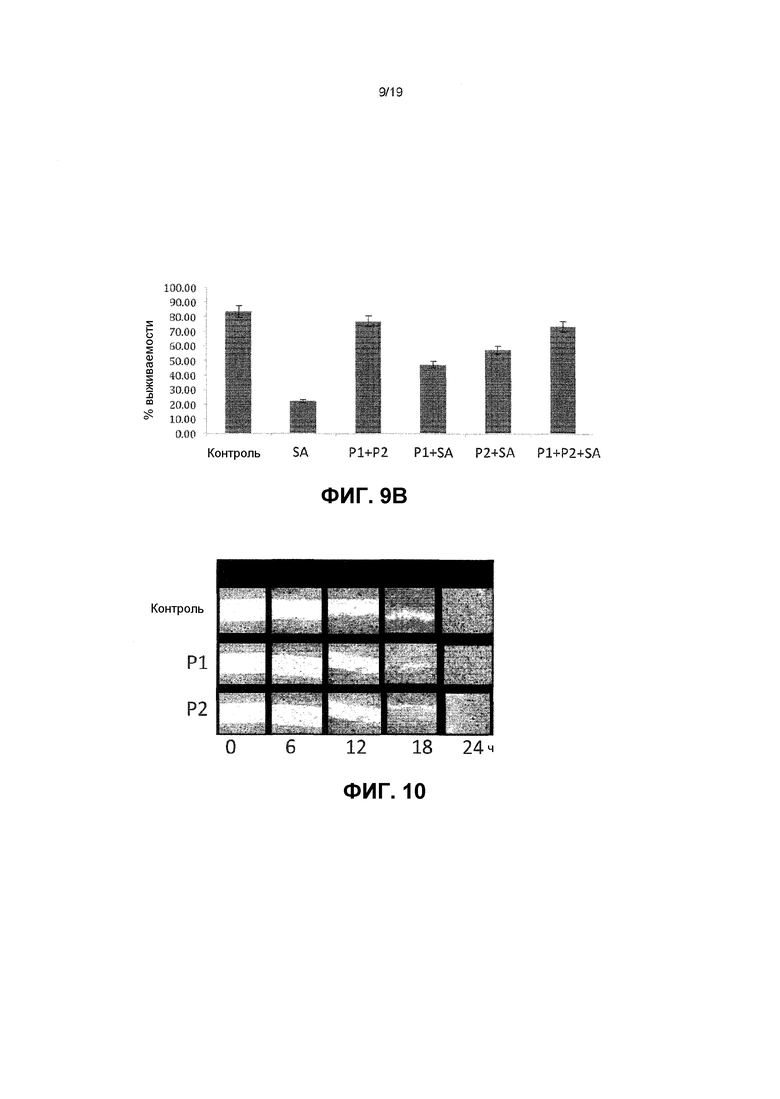
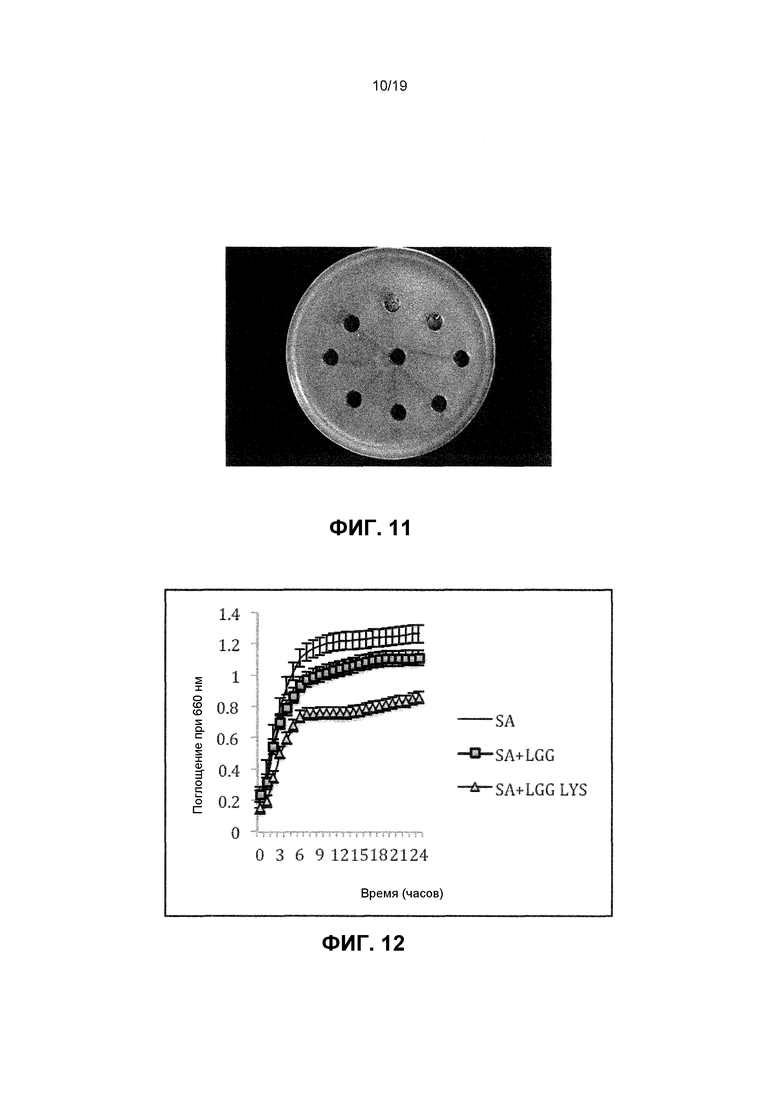

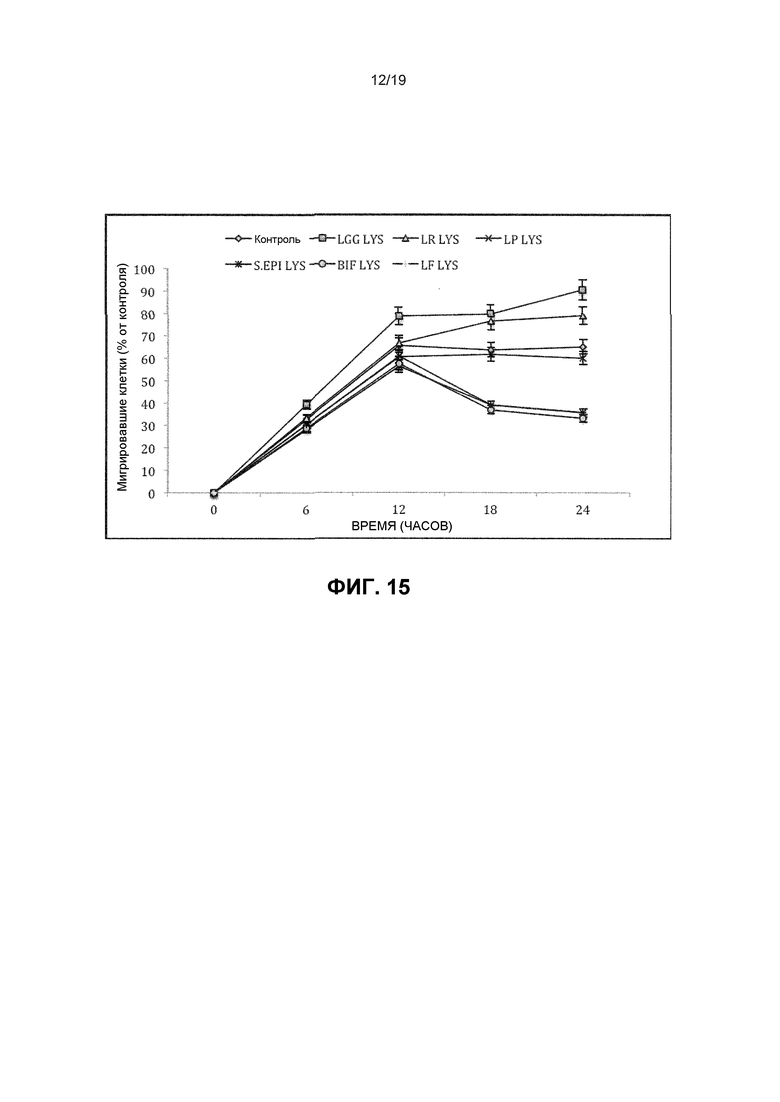
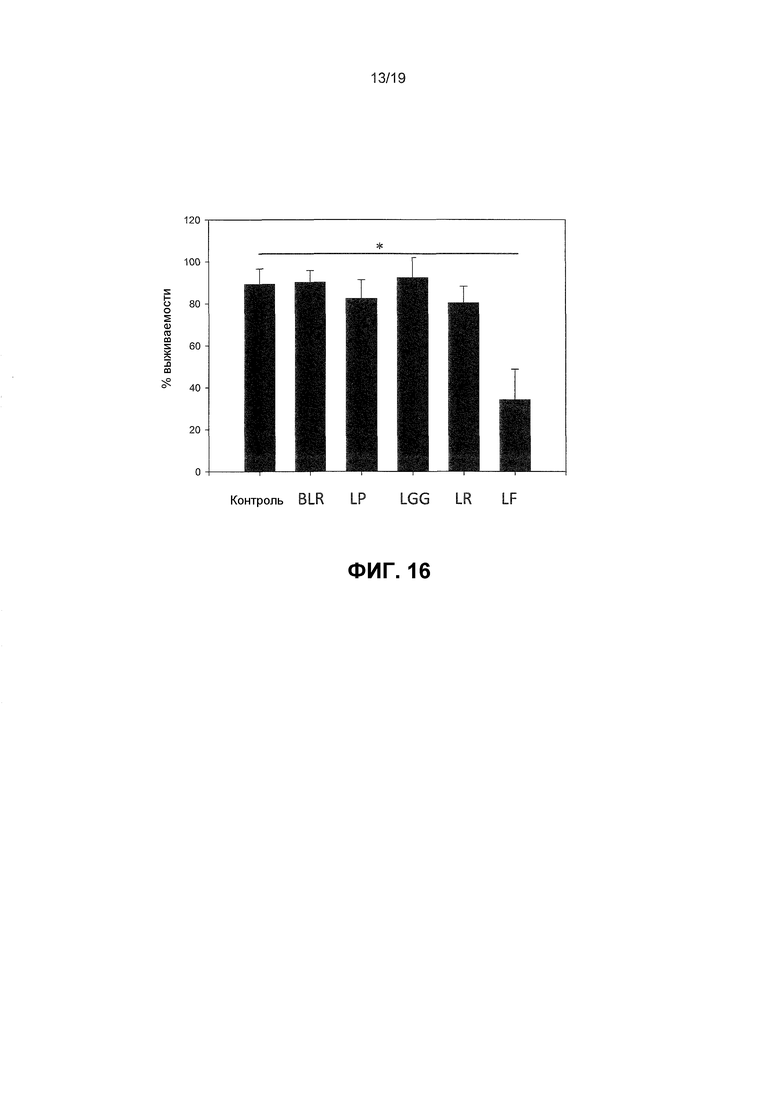
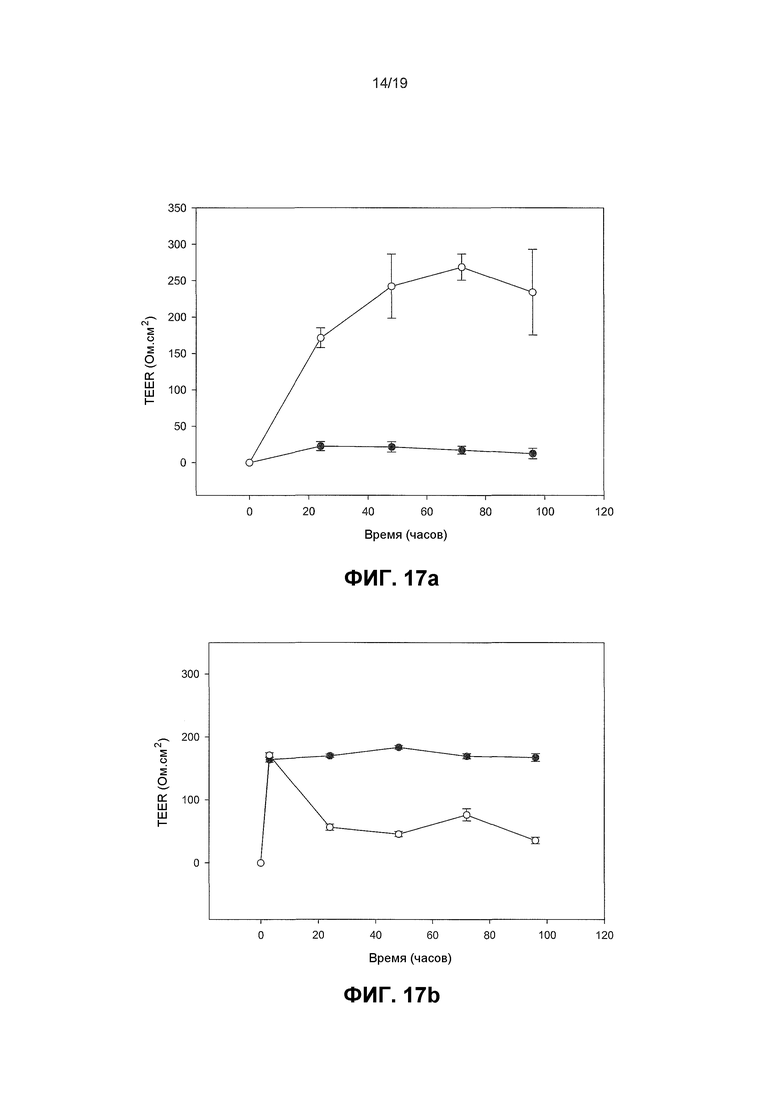
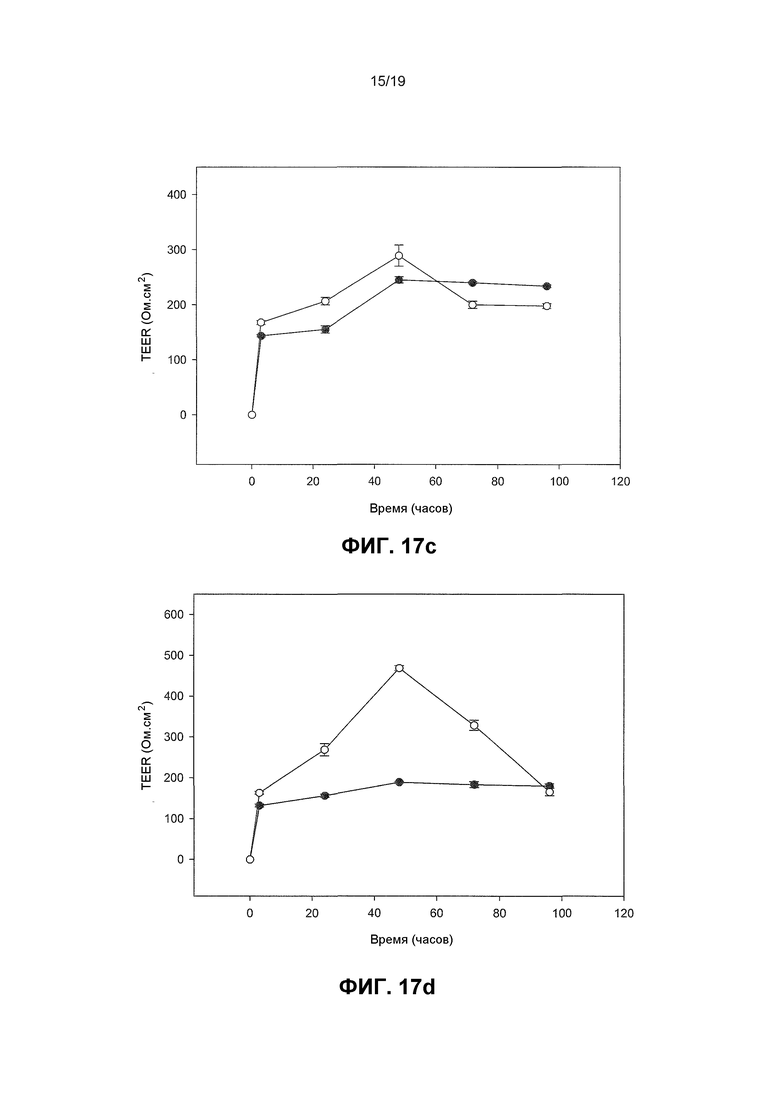
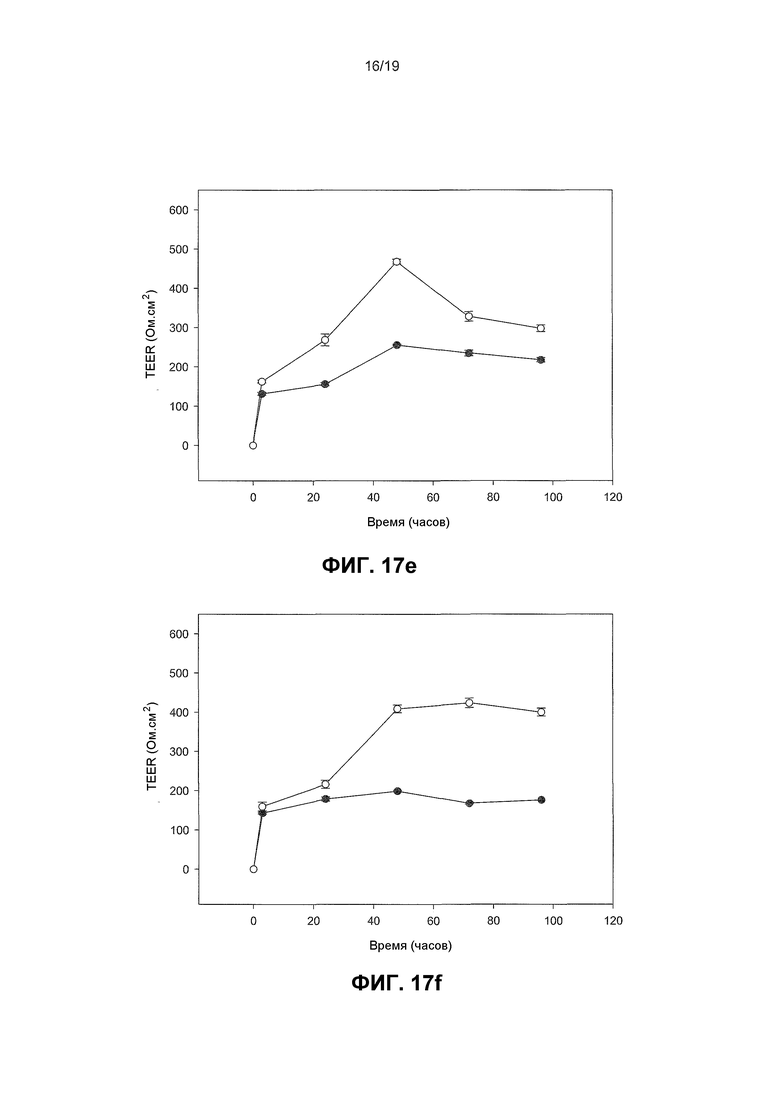
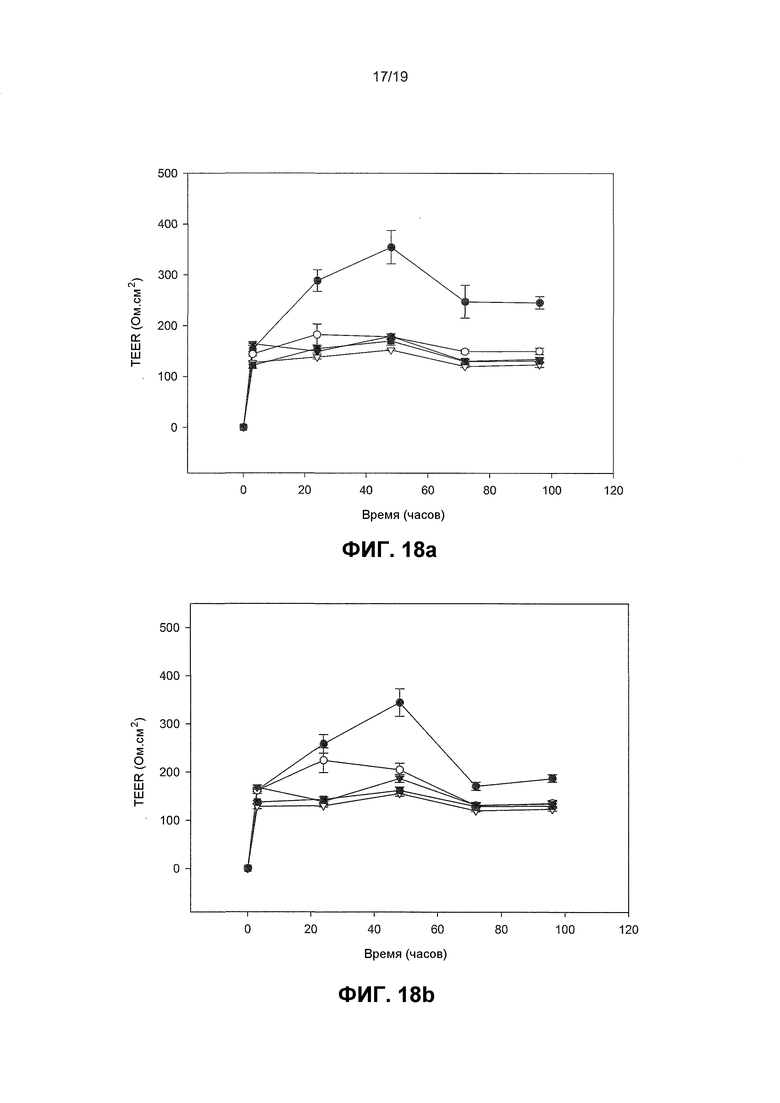
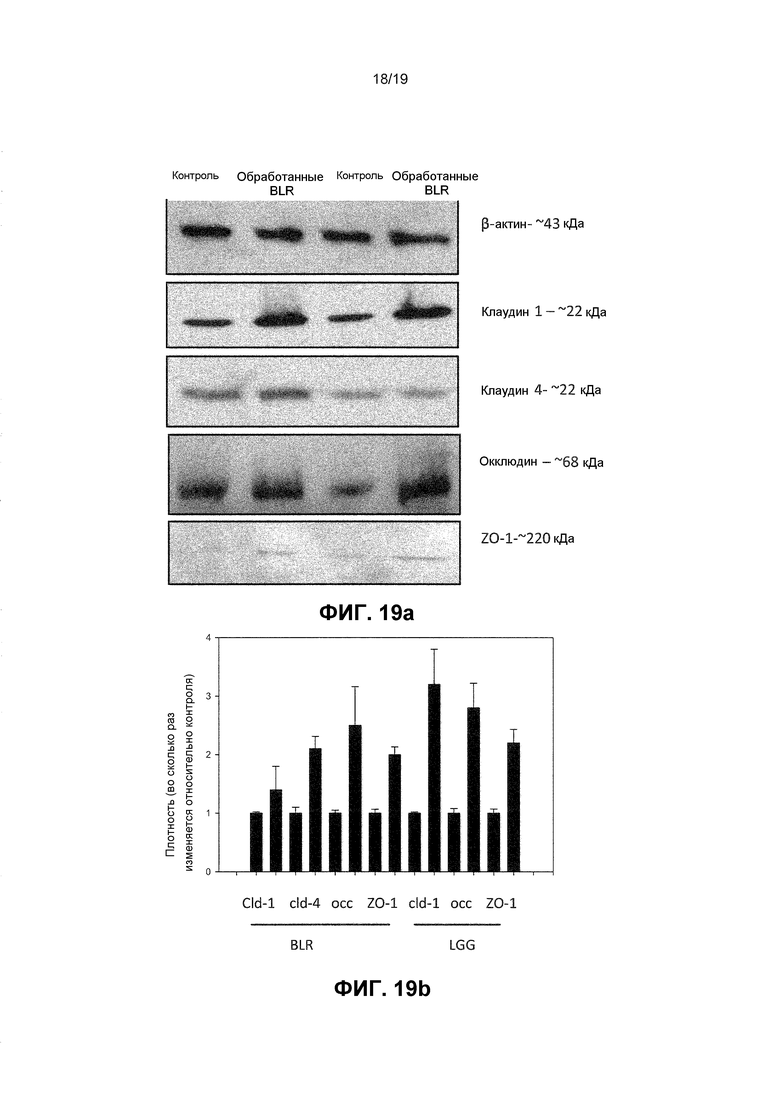
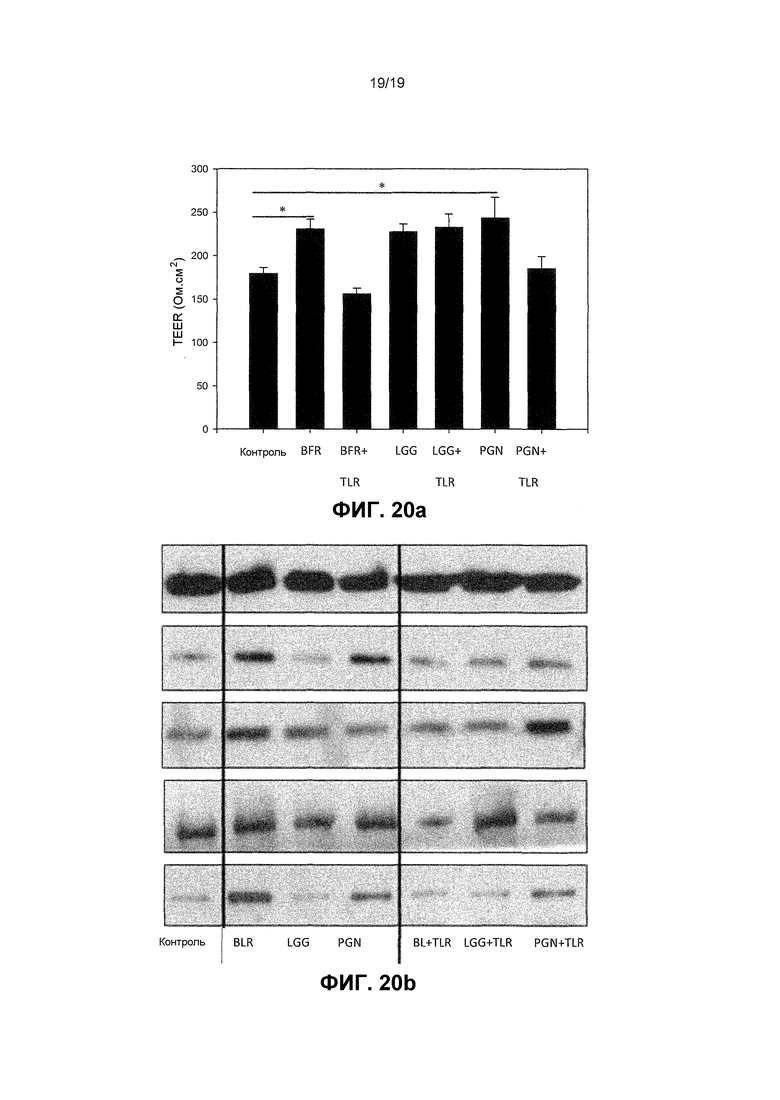
Группа изобретений относится к применению лизата пробиотической бактерии. Лизат пробиотической бактерии Lactobacillus rhamnosus GG ATCC 53103 или Lactobacillus reuteri ATCC 55730 или Bifidobacterium longum ATCC 51870 применяют для местного нанесения на кожу для улучшения и/или восстановления барьерной функции кожи. Указанный лизат применяют в способе улучшения и/или восстановления барьерной функции кожи, включающем местное введение лизата в кожу субъекта. Указанный лизат используют для улучшения и/или восстановления барьерной функции кожи в составе косметической композиции, фармацевтической композиции для местного применения, композиции, составленной для введения в кожу. Также указанный лизат используют в составе противобактериальной композиции для применения при инфекциях Staphylococcus. Группа изобретений обеспечивает увеличение и восстановление барьерной функции кератиноцитов. 6 н. и 16 з.п. ф-лы, 20 ил., 4 пр.
1. Применение лизата пробиотической бактерии для местного нанесения на кожу для улучшения и/или восстановления барьерной функции кожи, где пробиотическая бактерия включает Lactobacillus rhamnosus GG ATCC 53103, Lactobacillus reuteri ATCC 55730 или Bifidobacterium longum ATCC 51870.
2. Применение по п.1, где лизат содержит бесклеточный супернатант пробиотической бактерии.
3. Применение по п.1, где лизат содержит белковый лизат.
4. Применение по п.1, где улучшенная барьерная функция кожи включает улучшенную жизнеспособность кератиноцитов и/или плотность сочленения барьера.
5. Применение по любому из пп.1-4, где лизат пробиотической бактерии предназначен для применения в восстановлении, улучшении или регенерации кожи после поражения.
6. Применение по любому из пп.1-4, где лизат пробиотической бактерии предназначен для применения в способе лечения ран, ожогов, псориаза, ихтиоза, дерматита, акне (включая Hiradenitis Suppurativa), опрелости кожи, синдрома Незертона, актинического кератоза, дерматомикозов, дерматоза или эктодермальной дисплазии.
7. Применение по любому из пп.1-4, где лизат пробиотической бактерии вводят в кожу пациента, подвергаемого лечению.
8. Применение по п.1, где пробиотическая бактерия представляет собой Lactobacillus rhamnosus GG ATCC 53103 и/или Lactobacillus reuteri ATCC 55730 и барьерная функция кожи улучшается посредством лечения или предотвращение инфекции.
9. Применение по п.8, где инфекция является бактериальной инфекцией.
10. Применение по п.9, где бактериальная инфекция представляет собой стафилококковую инфекцию, предпочтительно инфекцию Staphylococcus aureus.
11. Применение по любому из пп.8-10, где инфекция является кожной инфекцией.
12. Применение по любому из пп.1-3, где лизат пробиотической бактерии вводят совместно с пробиотической бактерией другого штамма или ее лизатом.
13. Применение по п.1, где барьерная функция кожи улучшается и/или восстанавливается посредством совместного введения одного из лизата пробиотической бактерии Lactobacillus rhamnosus GG ATCC 53103, лизата пробиотической бактерии Lactobacillus reuteri ATCC 55730 или лизата пробиотической бактерии Bifidobacterium longum ATCC 51870 с по меньшей мере одним другим из указанных лизатов бактерий.
14. Косметический способ улучшения и/или восстановления барьерной функции кожи, включающий местное введение лизата пробиотической бактерии Lactobacillus rhamnosus GG ATCC 53103, и/или лизата пробиотической бактерии Lactobacillus reuteri ATCC 55730, и/или лизата пробиотической бактерии Bifidobacterium longum ATCC 51870 в кожу субъекта.
15. Косметический способ по п.14, где лизат пробиотической бактерии включает Lactobacillus rhamnosus GG.
16. Косметический способ по п.14 или 15, где пробиотическую бактерию или ее лизат вводят в кожу субъекта.
17. Косметическая композиция для улучшения и/или восстановления барьерной функции кожи, содержащая косметически эффективное количество лизата пробиотической бактерии Lactobacillus rhamnosus GG ATCC 53103, и/или лизата пробиотической бактерии Lactobacillus reuteri ATCC 55730 и/или лизата пробиотической бактерии Bifidobacterium longum ATCC 51870, и один или более косметически приемлемых вспомогательных веществ.
18. Косметическая композиция по п.17, включающая Lactobacillus rhamnosus GG ATCC 53103.
19. Фармацевтическая композиция для местного применения для улучшения и/или восстановления барьерной функции кожи, содержащая эффективное количество лизата Lactobacillus rhamnosus GG ATCC 53103, и фармацевтически приемлемое вспомогательное вещество.
20. Фармацевтическая композиция по п.19, дополнительно включающая лизат пробиотической бактерии штамма, отличного от Lactobacillus rhamnosus, в которой предпочтительно лизат пробиотической бактерии штамма, отличного от Lactobacillus rhamnosus, является лизат Lactobacillus reuteri ATCC 55730.
21. Композиция для улучшения и/или восстановления барьерной функции кожи, составленная для введения в кожу и содержащая терапевтически эффективное количество лизата Lactobacillus rhamnosus GG ATCC 53103, и/или лизата Lactobacillus reuteri ATCC 55730, и/или лизата Bifidobacterium longum ATCC 51870 и фармацевтически приемлемое вспомогательное вещество.
22. Противобактериальная композиция для применения при инфекциях Staphylococcus, содержащая терапевтически эффективное количество лизата Lactobacillus rhamnosus GG ATCC 53103 и фармацевтически приемлемое вспомогательное вещество.
| WO 2011070508 А1, 16.06.2011 | |||
| WO 2010069920 А1, 24.06.2010 | |||
| VESTERLUND S | |||
| ET AL | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Жидкостный ступенчатый пусковой реостат | 1916 |
|
SU1819A1 |
| КОСМЕТИЧЕСКАЯ КОМБИНАЦИЯ МИКРООРГАНИЗМА И ПРОИЗВОДНОГО ФИТОСФИНГОЗИНА | 2009 |
|
RU2428967C1 |
Авторы
Даты
2018-05-31—Публикация
2013-03-15—Подача