Изобретение относится к способу комбинирования определения генотипа IL28B с измерением уровня IP-10 в сыворотке до лечения с целью предсказать уровень устойчивого вирусологического ответа (SVR) или его отсутствия на пегинтерферон и рибавирин у индивидуальных пациентов, инфицированных HCV.
Вирус гепатита С (HCV), член семейства flaviviridae, представляет собой вирус крови, который вызывает хроническое воспаление печени и может приводить к фиброзу печени, циррозу и карциноме. В мире приблизительно 170 миллионов человек инфицированы HCV, а возможности лечения ограничены. Современный стандарт ведения лечения хронического гепатита С состоит из еженедельной инъекции пегилированного интерферона α (IFN-α) и орального введения дважды в день рибавирина (Fried and Hadziyannis, 2004, Semin Liver Dis 24 Suppl 2, 47-54). Однако только 40-50% пациентов, инфицированных генотипами 1 или 4 [вируса] и получившие курс лечения в течение 48 недель, дали устойчивый вирусологический ответ (SVR) по сравнению с 80% пациентов, инфицированных генотипами 2 или 3. Очевидно поэтому в ответе на лечение IFN-α/рибавирином присутствует и вирусный генотипический компонент. Далее, современный стандарт ведения [лечения] часто связан с неблагоприятными побочными эффектами, такими как депрессия и анемия (Fried and Hadziyannis, 2004). Следовательно, существует неудовлетворенная медицинская потребность в новых более эффективных и безопасных способах лечения пациентов, страдающих HCV.
Итак, стандарт ведения лечения HCV с генотипом 1 в настоящее время включает в себя 48-недельный [курс] пегилированного IFN-α и рибавирина, с последующим врачебным наблюдением в течение 24 недель для определения того, достигнут ли устойчивый вирусологический ответ. Устойчивый вирусологический ответ (SVR) определяется как отсутствие обнаружимой РНК HCV в течение, по меньшей мере, 24 недель после прекращения терапии. Длительность, стоимость и смертность, связанные с лечением этими агентами вызывают в этой области желание улучшить понимание [этого] ответа и заблаговременную идентификацию пациентов, которые получат пользу от модификации стратегии лечения.
Недавно были получены данные, показывающие генетический вклад в ответ на IFN-α со строгой связью между полиморфизмом IL28B и клинически определенным клиренсом вируса у индивидов, инфицированных HCV, из различных этнических сред. Эти данные подкрепляют [роль] компонента организма-хозяина в безуспешности лечения, которое ранее включало в себя маркеры цитокинов сыворотки, наиболее вероятно - уровня IP-10 в сыворотке, измеренного до начала лечения.
Белки IFN-λ, которые продемонстрировали анти-HCV активность, кодируются генами IL28A/B и IL29 (Kotenko, et al. 2003, Nature Immunol. 4:69; Sheppard et al. 2003, Nature Immunol. 4:63); ген IL28B кодирует интерферон-λ3 (IFN-λ3). Недавние исследования идентифицировали полиморфизм единственного нуклеотида (SNP) (rs12979860, SEQ ID NO: 1) в трех тысячах оснований (3 kb) в 3'-5' направлении гена IL28B как потенциальный прогностический маркер ответа на лечение (Ge et al. 2009, Nature 461:399). Эти открытия были подтверждены другими независимыми исследованиями с использованием других маркеров SNP (rs12980275, SEQ ID NO: 2 и rs8099917, SEQ ID NO: 3), расположенных вблизи от гена IL28B (Suppiah et al. 2009, Nature Genetics 41:1100; Tanaka et al. 2009, Nature Genetics 41:1105). Показано, что предпочтительные варианты четко связаны с более чем двукратной разницей в ответе на лекарственное лечение HCV. В полиэтнической популяции приблизительно 80% пациентов, несущие две копии предпочтительного варианта, освобождаются от вируса в ходе терапии IFN-α и остаются свободными от вируса в течение 24 недель после [курса] лечения. Генетическая связь выглядит важной в прогнозе для всех исследованных этнических групп, включая в себя пациентов-европейцев, африканцев и азиатов. Эти исследования также представили предварительные свидетельства в пользу того, что на экспрессию мРНК IL28B в одноядерных клетках периферической крови (PBMC) влияет генотип IL28B, связанный с усилением ответа на лечение [с помощью] IFN-α. В последнем исследовании показано, что этот генотип значительно усиливает естественное отличие инфекции HCV между индивидами европейского и африканского происхождения (Thomas et al. 2009, Nature 461:798). Эти исследования дали некоторые предпосылки для того, чтобы ответ на IFN-α мог быть спрогнозирован при подборе индивидуальной терапии.
Перед идентификацией IFN-γ-индуцируемого белка 10 (IP-10 или CXCL10) в качестве маркера отсутствия ответа на лечение IFN-α были идентифицированы фактор некроза опухолей α (TNF-a), интерлейкин (IL) 1B, IL-10 и IL-8. Было показано, что IP-10 повышается в печени и в сыворотке пациентов, страдающих HCV, и было обнаружено, что эти уровни в большей степени повышены у пациентов, страдающих HCV и не дающих ответа, чем у тех, у кого ответ на IFN-α присутствует. Это наблюдение было затем подтверждено на больших массивах данных, включающих в себя DITTO-исследование европейцев, принадлежащих белой расе, у которых базовый уровень является наиболее важной детерминантой прогноза ответа на лечение (Romero et al. 2006, JID 194:895; Lagging et al. 2006, Hepatology 44:1617). Затем открытия относительно IP-10 были распространены на пациентов, коинфицированных HCV/HIV (вирус приобретенного иммунодефицита) (Zeremski et al. 2007, JAIDS 45:262), что было позднее подтверждено вторым исследованием и дополнительно коррелировано с воспалением печени и фиброзом у этих пациентов (Reiberger et al. 2008, Antivir Ther 13:969). Связь с IP-10 была также показана в различных расовых группах. (Fried et al. AASLD 2008, poster 1223).
Обобщенный взгляд на [данные] в этой области сводится к тому, что усиленный иммунный ответ, обнаруживаемый на уровне РНК, клеток или белка, может означать меньший ответ на терапию с помощью IFN-α/рибавирина, хотя это не достигло такого уровня анализа или осмысления, чтобы могло быть использовано в клинике. Несмотря на [наличие] известных маркеров, механизм, относящийся к отсутствию ответа, остается неясным. Далее, хотя это и является многообещающим, генотип IL28B не объясняет всех аспектов ответа на интерферон и то, как эти открытия относятся к другим известным биомаркерам, таким как вирусный генотип, вирусная нагрузка, вес, фиброз и IP-10, еще остается неясным. Молекулярные взаимосвязи между активностью продукта гена IL28B IFN-λ3 и экспрессией иммунных генов предполагают, что IL28B и включающиеся затем цитокины и хемокины должны быть зависимыми и, следовательно, последующие сывороточные маркеры, такие как IP-10, должны эффективно описывать те же самые фенотипические феномены.
Недавно описанный генетический полиморфизм IL28B чрезвычайно перспективен и может принести важную прогностическую информацию для достижения устойчивого вирусологического ответа при терапии с помощью пегинтерферона и рибавирина. Однако его клиническая применимость в качестве самостоятельного теста остается ограниченной. Для генотипов CC рассчитанная вероятность SVR составляет приблизительно 80%. В отличие от них для гетерозигот TC вероятность ответа снижается до приблизительно 50%. Таким образом, негативное или позитивное значение генотипического теста относительно невелико, что уменьшает его применение при принятии решения о противовирусной терапии. Способы, основанные на его прогностических возможностях, использующих генетический тест в комбинации с другими легкодоступными маркерами антивирусного ответа, могут улучшить позитивную и негативную прогностическую ценность и повысить его клиническую применимость.
Часть данного изобретения представляет собой анализ образцов HCV от белых и афроамериканцев, причем было неожиданно определено, что уровень IP-10 в сыворотке и генотип IL28B являются комплементарными и независимыми прогностическими факторами, и, в особенности, что уровень IP-10, измеренный у пациентов, инфицированных HCV, гетерозиготных по генотипу IL28B или гомозиготных для генотипа, не дающего ответа, дает дополнительную ценность при определении ответа на лечение IFN-α.
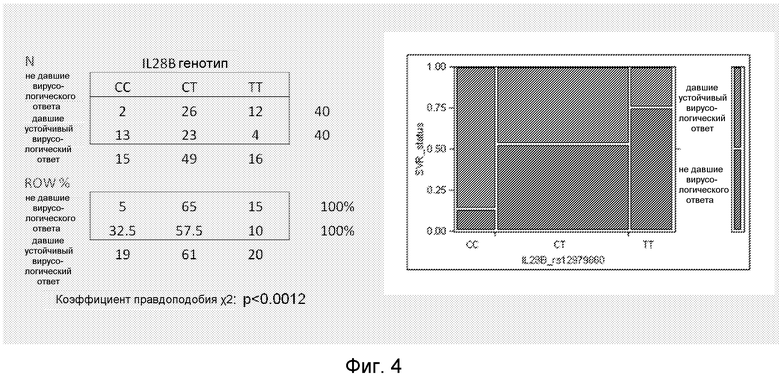
rs12979860 - полиморфный маркер IL28B тестировали с использованием набора для аллельного дискриминантного анализа ABI TaqMan на 80 участниках клинического исследования VIRAHEP-C (вирус, резистентный к противовирусной терапии хронического гепатита С), финансируемого Национальным Институтом Здравоохранения [США] (NIH). Генотипированные пациенты были частью подраздела исследования, в котором измеряли набор сывороточных цитокинов в полученных сыворотках (Fried et al., EASL 2008). Данный контингент включал в себя 40 SVR и 40 [пациентов], не дающих ответа, из которых 39 принадлежали к белой расе, а 41 были афроамериканцами. Генотипы CC, CT или TT были обнаружены у 19%, 61% и 20%, соответственно, с соответствующими величинами SVR 87%, 47% и 25% (χ2=13,4, p=0,0012), что соответствует первоначальному сообщению Ge et al. (2009, Nature 461:399).
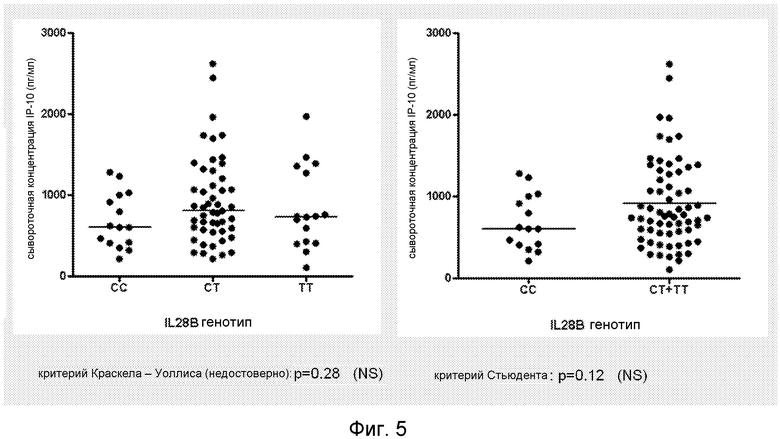
Средний уровень IP-10 в сыворотке был сходным и, вероятно, не связан с генотипом IL28B (p=0,28). Величина SVR 78% была обнаружена у пациентов с низким (<600 пг/мл) по сравнению с 36% у пациентов с высоким (>600 пг/мл) уровнем IP-10 (χ2=17,1, p<0,0001).
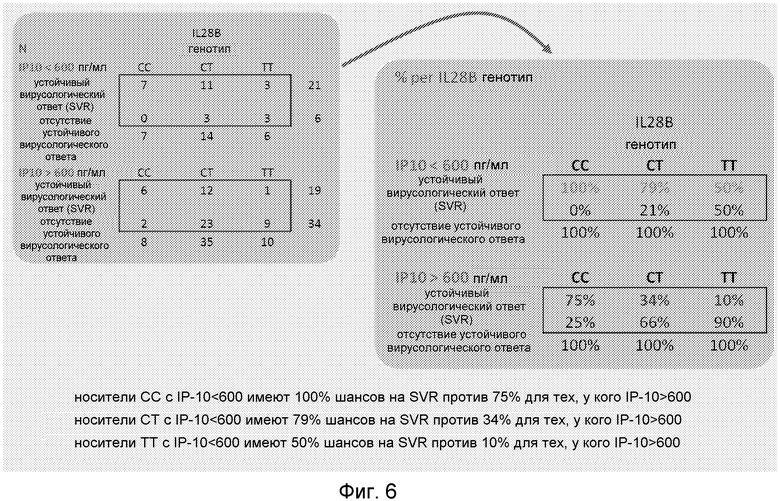
Уровень IP-10 в сыворотке в группах с генотипом IL28B дал дополнительную и независимую информацию относительно вероятности SVR (χ2=27,5, p<0,0001). Более конкретно, носители CT с низким IP-10 имели 79% SVR против 34% - с высоким уровнем IP-10. Среди носителей TT была установлена сходное отношение (50% - для низкого IP-10 против 10% - для высокого IP-10).
Итак, когда данные о генотипе IL28B скомбинированы с измерением IP-10 в сыворотке у [пациентов] с генотипом, не являющимся CC, прогностическая ценность для индивидуальных пациентов увеличена путем дальнейшего учета различия между SVR и пациентами, не дающими ответа на пегинтерферон и рибавирин. Более конкретно, аппроксимация обобщенной линейной модели SVR, включающей в себя и генотип IL28B и сывороточный IP-10 как независимые переменные, показывает существенный вклад генотипа IL28B (p<0,0013) и сывороточного IP-10 (p<0,0016), но не эффект сопряженности между IL28B and IP-10 (p=0,75) при расчете устойчивого вирусологического ответа.
Следовательно, данное изобретение относится к способу комбинирования определения генотипа IL28B с измерением уровня IP-10 перед началом лечения для предсказания получения устойчивого вирусологического ответа (SVR) или отсутствия ответа на пегинтерферон и рибавирин у индивидуальных пациентов, инфицированных HCV.
В более широком смысле данное изобретение относится к способу комбинирования двух или более параметров, выбранных из группы, состоящей из измерения уровня сывороточного IP-10 до начала лечения, определения генотипа IL28B, расы или определения вирусной нагрузки гепатита C для предсказания получения устойчивого вирусологического ответа (SVR) или отсутствия ответа на пегинтерферон и рибавирин для индивидуальных пациентов, инфицированных HCV.
В способ, в котором определение генотипа IL28B комбинировано с измерением уровня сывороточного IP-10, один или оба параметра могут быть добавлены из расы и вирусной нагрузки гепатита С для предсказания получения устойчивого вирусологического ответа (SVR) или отсутствия ответа на пегинтерферон и рибавирин для индивидуальных пациентов, инфицированных HCV.
Еще один объект данного изобретения - это тот, в котором генотип IL28B содержит полиморфный маркер rs12979860, rs12980275 и/или rs8099917, или какой-либо другой генетический маркер, который находится в неравновесном сцеплении с этими маркерами.
Данное изобретение также относится к дополнительному различению между SVR и не дающими ответа на пегинтерферон и рибавирин индивидуальными пациентами, инфицированными HCV, по сравнению с какими-либо из этих двух индивидуальных маркеров (генотип IL28B, уровень сывороточного IP-10).
Неожиданно комбинация результатов по генотипу IL28B и сывороточному IP-10 улучшила негативное прогностическое значение среди генотипов TT или TC по устойчивому вирусологическому ответу.
Часть данного изобретения также представляет собой диагностический анализ, содержащий средства для, по меньшей мере, определения или измерения полиморфизма IL28B и уровня IP-10 в сыворотке от пациентов, инфицированных HCV.
Еще один вариант осуществления данного изобретения представляет собой компьютерную систему, содержащую модельное программное обеспечение, использующее информацию о результатах, полученных способом по данному изобретению для предсказания устойчивого вирусологического ответа (SVR) или отсутствия ответа на пегинтерферон и рибавирин для индивидуальных пациентов, инфицированных HCV.
РАЗДЕЛ ПРИМЕРОВ
ПРИМЕР 1
Пациенты и Лечение
Исследование VIRAHEP-C было мультицентральным исследованием комбинации терапий пегинтерфероном и рибавирином хронического гепатита C, организованное, чтобы выявить величины и прогностические признаки ответа среди [пациентов] AA (афроамериканцев) и CA (белых американцев) с инфекцией генотипа 1 и установить причины отсутствия ответа на терапию. Организация и первичные результаты исследования VIRAHEP-C были сообщены в другом источнике [Conjeevaram, H.S., et al., Peginterferon andribavirin treatment in African American and Caucasian American patients with hepatitis C genotype 1. Gastroenterology, 2006. 131(2): p. 470-7]. Пациенты в возрасте 18 лет и старше, ранее не получавшие лечения и инфицированные [вирусом] генотипа 1, имели обнаружимую РНК HCV и гистологическое подтверждение хронического HCV и были признаны пригодными для участия [в исследовании]. Пациенты, в истории болезни которых присутствовало потребление алкоголя в количестве более, чем 2 стандартные порции алкоголя или эквивалентного количества (20 г) в день или свидетельства алкогольной зависимости в предшествующие 6 месяцев исключались. Все пациенты проходили биопсию печени за 18 месяцев включения пациентов в исследование. Пациенты были классифицированы по расе как афроамериканцы или белые и по этническому происхождению как испанского или неиспанского происхождения со слов пациента. От всех участников требовалось, чтобы они были рождены в Соединенных Штатах.
Пациенты получали пегинтерферон α-2a (Pegasys, фирма Roche Pharmaceuticals, Nutley, Нью-Джерси) 180 мкг в неделю и рибавирин (Copegus, фирма Roche Pharmaceuticals, Nutley, Нью-Джерси) 1000-1200 мг в день в течение, по меньшей мере, 24 недель. Пациенты, которые стали РНК HCV негативными после 24 недель, продолжали получать лечение в течение суммарно 48 недель, тогда как оставшиеся РНК HCV позитивными прекращали получать лечение и рассматривались как не давшие ответа (NR). Первичной конечной точкой клинического исследования был устойчивый вирусологический ответ (SVR), определяемый как отсутствие обнаружимой РНК HCV в течение, по меньшей мере, 24 недель после прекращения терапии.
Анализ цитокинов сыворотки, включающих в себя IP-10
Пятьдесят [пациентов] с устойчивым вирусологическим ответом (SVR) и 50 не давших ответа (NR) на противовирусную терапию были выбраны из контингента VIRAHEP-C и включены в анализ цитокинов. Больные с рецидивом заболевания после 48 недельной терапии, основанной на IFN, не были включены в этот ретроспективный анализ. Контингент состоял из 51 афроамериканца (AA) и 49 белых американцев (CA). Контингент включал в себя 41 женщину и 59 мужчин.
Пятьдесят различных цитокинов были измерены в образцах сыворотки, собранной в исходный момент, с помощью коммерчески доступного набора для анализа цитокинов человека «23-plex и 27-plex panel cytokine BioPlex» (фирма BioRad, каталожные номера №171-A11123 и №171-A11127, соответственно) и системы Luminex в соответствии с инструкциями производителя. Из 50 цитокинов, проанализированных с помощью мультиплексного исследования, 37 могли быть достоверно количественно определены в большинстве образцов. Особое внимание было уделено анализу уровня IP-10 в сыворотке, который определялся как часть анализа набора цитокинов человека 27-plex panel BioPlex. Динамический диапазон измерения IP-10 в этом анализе составлял 3,1-50,938 пг/мл при пределе детектирования 6,5 пг/мл.
Генотипирование IL28B
Генотипирование выполняли на подгруппе из 80 пациентов (40 дающих ответ, 40 не дающих ответа), у которых анализировались концентрации сывороточного IP-10 (см. выше).
Подгруппа пациентов состояла из 39 AA и 41 CA.
Полиморфный маркер IL28B rs12979860 тестировали с помощью набора для аллельной дискриминации ABI TaqMan и системы детектирования последовательностей ABI7900HT (фирма Applied Biosystems), как описано в Thomas et al. (Nature, 461:798-802, 2009).
Статистический анализ
Статистический анализ был выполнен с помощью программного обеспечения SAS или JMP (SAS Institute Inc). Графики были построены с помощью программного обеспечения Tibco Spotfire или GraphPad Prism 4.
IP10 связан с SVR
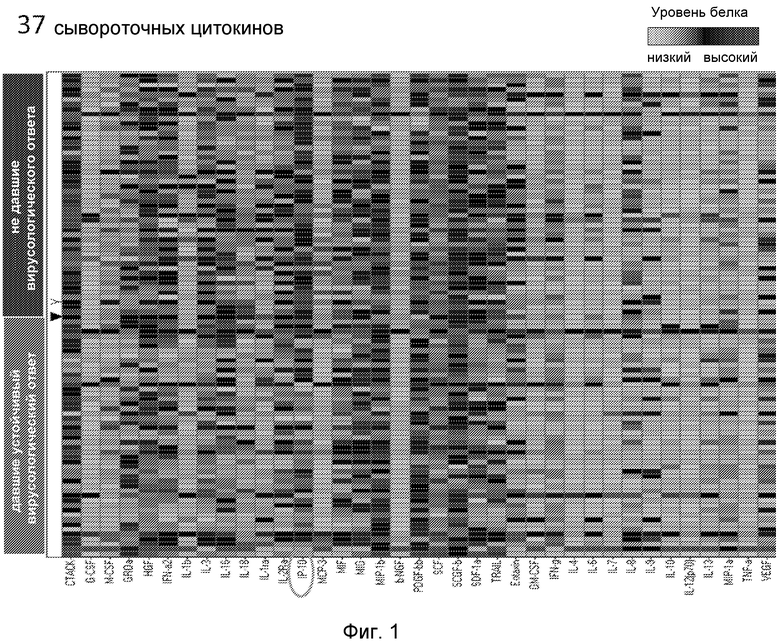
Образцы сыворотки от 100 пациентов из контингента VIRAHEP-C, проходящих лечение HCV, были оценены с помощью комплексного чипа на 50 цитокинов и хемокинов, чтобы определить, являются ли профили выбранных цитокинов до лечения прогностическими в отношении ответа на лечение (устойчивый вирусологический ответ, SVR) на хорошо охарактеризованном контингенте американцев. Из 50 проанализированных цитокинов, 37 могли быть достоверно измерены, как описано в анализе тепловой карты [пациентов], дающих ответ и в сравнении с не дающими ответа на Фиг.1. Исходный уровень всех цитокинов, за исключением IP-10 (см. ниже), существенно не различались между [пациентами], дающими ответ и не дающими ответа.
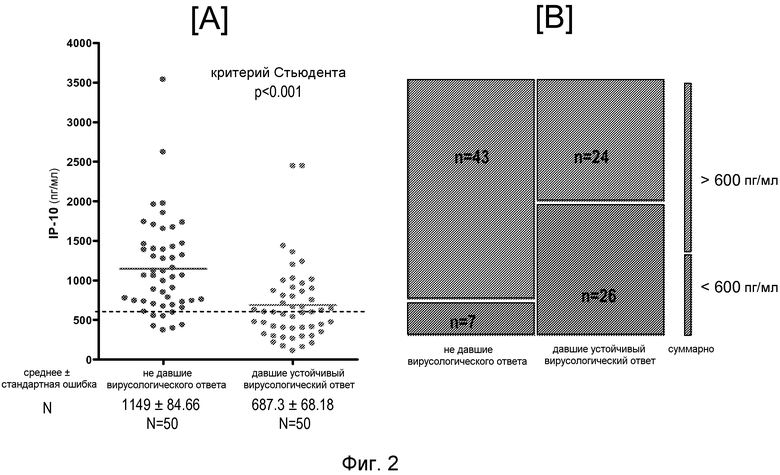
Средняя концентрация сывороточного IP-10 на исходном уровне была существенно ниже у дающих ответ по сравнению с не дающими ответ (687±68 пг/мл против 1149±85 пг/мл, p<0,001) (Фиг.2A). Чтобы получить потенциальное прогностическое значение измерений IP-10, пациенты были стратифицированы по величине порога 600 пг/мл, сходной с применявшейся в других исследованиях ранее.
[Zeremski, M., et al., Interferon gamma-inducible protein 10: a predictive marker of successful treatment response in hepatitis C virus/HIV-coinfected patients. J Acquir Immune Defic Syndr, 2007. 45(3): p. 262-8 // Butera, D., et al., Plasma chemokine levels correlate with the outcome of antiviral therapy in patients with hepatitis C. Blood, 2005. 106(4): p. 1175-82. // Diago, M., et al., Association of pretreatment serum interferon gamma inducible protein 10 levels with sustained virological response to peginterferon plus ribavirin therapy in genotype 1 infected patients with chronic hepatitis C. Gut, 2006. 55(3): p. 374-9. // Lagging, M., et al., IP-10 predicts viral response and therapeutic outcome in difficult-to-treat patients with HCV genotype 1 infection. Hepatology, 2006. 44(6): p. 1617-25. // Narumi, S., et al., Expression of IFN-inducible protein-10 in chronic hepatitis. J Immunol, 1997. 158(11): p. 5536-44. // Romero, A.I., et al., Interferon (IFN)-gamma-inducible protein-10: association with histological results, viral kinetics, and outcome during treatment with pegylated IFN-alpha 2a and ribavirin for chronic hepatitis C virus infection. J Infect Dis, 2006. 194(7): p. 895-903.]
Семьдесят девять процентов (26/33) индивидов с низким исходным уровнем IP-10 (<600 пг/мл) дали ответ (позитивное прогностическое значение = 79%), тогда как 64% (43/67) индивидов с высоким исходным уровнем IP-10 (>600 пг/мл) не дали ответа на терапию (негативное прогностическое значение = 64%) (Фиг.2B). В целом, это дает специфичность 52% (26/50) и чувствительность 86% (43/50) теста, основанного на уровне сывороточного IP-10 до лечения, на ответ на терапию.
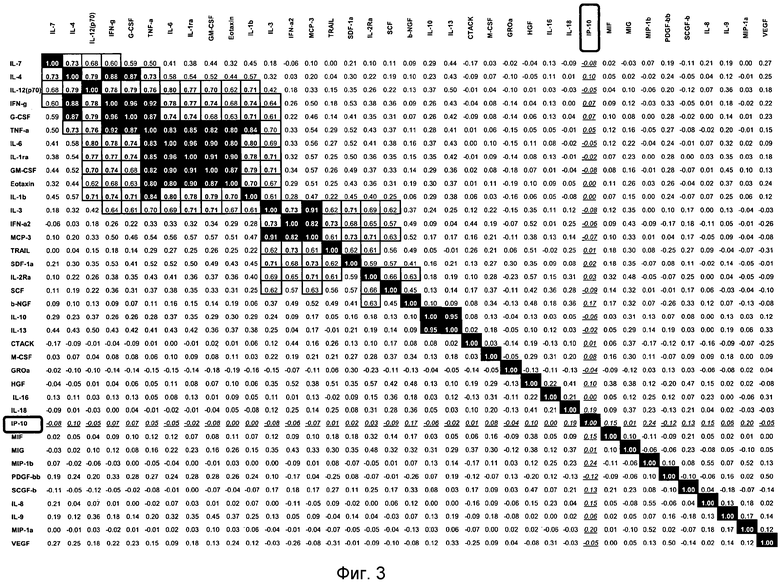
На основании анализа матрицы коэффициентов корреляции для 37 оцениваемых цитокинов, не было обнаружено других цитокинов, которые коррелируют с IP-10 в исходный момент (Фиг.3). Было отмечено, что несколько групп цитокинов коррелируют между собой в исходный момент, но ни один из них не был связан с ответом на лечение. Важно, что анализ 37 цитокинов с помощью модели перекрестной валидизации выявил, что добавление [учета] ни одного из цитокинов к исходному [уровню] IP-10 не улучшало величины неправильной классификации дающих ответ [на лечение] и не дающих его (приблизительно 30%).
Генотип IL28B связан с SVR
Стратификация популяции пациентов в соответствии с генотипом IL28B выявила существенную (отношение правдоподобия χ2: p<0,0012) связь с ответом на лечение (Фиг.4), причем генотип CC связан с высоким уровнем SVR (87% SVR при генотипе CC), тогда как генотип TT связан с не дающими ответа (75% не дающих ответа при генотипе TT).
Аддитивный и независимый эффект уровня сывороточного IP10
и генотипа IL28B
Средний уровень сывороточного IP-10 существенно не различался между тремя группами генотипов IL28B, а также когда генотип CC сравнивали с комбинированными группами с генотипами CT и TT (Фиг.5).
Далее, пациенты были стратифицированы в соответствии с уровнем IP-10 выше или ниже порогового значения 600 пг/мл, которое было использовано в нескольких исследованиях ранее (см. выше). Стратификация, основанная на уровне IP-10 в сыворотке до лечения, была затем проанализирована в комбинации с генотипом IL28B. Табулированные данные такого комбинированного анализа представлены на Фиг.6.
Эти открытия демонстрируют, что предсказуемость ответа (отсутствия ответа) индивидуального пациента на лечение пегинтерфероном и рибавирином может быть существенно улучшено путем комбинированного анализа генотипа IL28B и концентрации IP-10 в сыворотке до лечения.
Более конкретно, носители CT с низким IP-10 имели 79% SVR против 34% - с высоким уровнем IP-10. Среди носителей TT было установлено сходное соотношение (SVR=50% для низкого IP-10 по сравнению с 10% - для высокого IP-10). (См. Таблица 1)
Фиг.7 предоставляет сравнительный обзор индивидуальных анализов (генотип IL28B и уровень IP-10) и комбинированного анализа. Проведенный тест χ2 на однородность проверил, одна или более популяций (например, группы с разным генотипом IL28B) имеют одинаковые пропорции наблюдений с общей характеристикой (т.е. ответом SVR). Оба индивидуальных анализа являются прогностическими для ответа на лечение. Кроме того, имеется и четкий аддитивный эффект при комбинировании двух маркеров, что приводит к улучшению прогностического значения для индивидуальных пациентов, и в отношении [наличия] ответа на лечение и отсутствия ответа. Этот комбинированный анализ дает очень существенную стратификацию дающих ответ по отношению к не дающим ответа. Более конкретно, обобщенное линейное моделирование SVR (SAS proc genmod), включающее в себя и генотип IL28B, и сывороточный IP-10 (выше или ниже 600 пг/мл) в качестве независимых переменных показывает существенный вклад генотипа IL28B (p<0,0013) и сывороточного IP-10 (p<0,0016), но не эффект сопряженности между IL28B и IP-10 (p=0,75) в вычислении устойчивого вирусологического ответа.
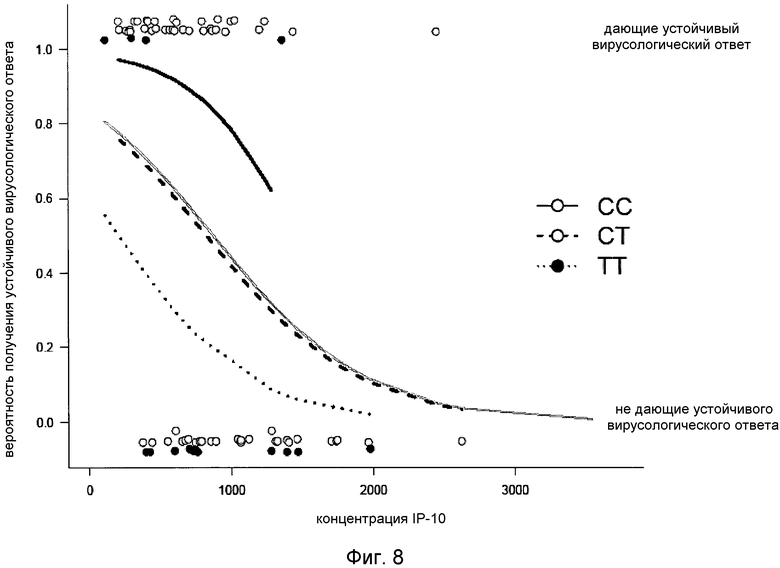
Наконец, моделирование логистической регрессии ответа SVR, основанное на уровне сывороточного IP-10 (используемого как непрерывная переменная) и генотипе IL28B (категориальная переменная) четко разделяют дающих ответ и не дающих ответ [пациентов] в соответствии с уровнем IP-10 в сыворотке со сдвигом кривой ответа в зависимости от генотипа IL28B (Фиг.8).
Взятые вместе, эти открытия демонстрируют, что прогностическое значение комбинации уровня IUP-10 в сыворотке до лечения и генотипа IL28B превосходит каждый из индивидуальных маркеров в предсказании устойчивого вирусологического ответа на терапию пегинтерфероном и рибавирином и является многообещающим в подборе персонализованного лечения пациентов, страдающих HCV.
ПРИМЕР 2
В данном исследовании уровень IP-10 до лечения измеряли в образцах сыворотки 272 пациентов из контингента VIRAHEP-C (115 не дающих ответа и 157 SVR). Этот анализ продемонстрировал, что IP-10 одинаково прогностически ценен для SVR и у пациентов CA, и у AA. Комбинация уровня сывороточного IP-10 до лечения с генотипом IL28B была затем использована в качестве прогностического признака ответа на пегIFN (пегинтерферон) и рибавирин в данном контингенте.
ПАЦИЕНТЫ И СПОСОБЫ
Пациенты. Исследование VIRAHEP-C представляло собой мультицентральное исследование комбинированной терапии хронического гепатита С с помощью пегIFN и рибавирина, организованное, чтобы установить величины и прогностические признаки ответа среди [пациентов] AA и CA с генотипом 1 инфекции и для идентификации причин отсутствия ответа на терапию. Организация и первичные результаты исследования VIRAHEP-C были сообщены в другом источнике [Conjeevaram, H.S., et al., Peginterferon and ribavirin treatment in African American and Caucasian American patients with hepatitis C генотип 1. Gastroenterology, 2006. 131(2): p. 470-7]. Взрослые [пациенты], ранее не получавшие лечения и инфицированные [вирусом] с генотипом 1, обладавшие обнаружимой РНК HCV и имевшие гистологические доказательства [наличия] хронического HCV, были пригодны для участия [в исследовании]. Пациенты были классифицированы по расе как афроамериканцы или белые, а также по этническому происхождению - как испанского происхождения или неиспанского, основываясь на сообщениях пациентов. Требовалось, чтобы все участники были уроженцами Соединенных Штатов. Был включен 401 пациент из 8 клинических центров Соединенных Штатов, а терапия была начата между июлем 2002 г. и декабрем 2003 г.
Для данного исследования образцы сыворотки были получены от подгруппы, состоявшей из 272 пациентов из общего контингента VIRAHEP-C, состоящей из 157 давших устойчивый вирусологический ответ (SVR) (104 CA, 53 AA) и 115 не давших ответа (34 CA, 81 AA). Все образцы, проанализированные в этом исследовании, были получены в соответствии с протоколом, утвержденным IRB (Институт биомедицинских исследований), в соответствии с которым участники предоставили письменное информированное согласие, включающее в себя согласие на генетическое тестирование.
Лечение. Пациенты получали пегинтерферон α-2a (Pegasys, фирма Roche Pharmaceuticals, Nutley, Нью-Джерси) 180 мкг в неделю и рибавирин (Copegus, фирма Roche Pharmaceuticals, Nutley, Нью-Джерси) 1000-1200 мг ежедневно в течение, по меньшей мере, 24 недель. Пациенты, которые становились HCV РНК-негативными через 24 недели, продолжали лечение в течение всего 48 недель, тогда как те, кто оставался HCV РНК-позитивными, прекращали лечение и рассматривались как не давшие ответа [на лечение]. Первичной контрольной точкой испытаний был SVR, который определялся как отсутствие детектируемой РНК HCV в течение, по меньшей мере, 24 недель после прекращения терапии.
Количественное определение РНК HCV. Тестирование на РНК HCV было выполнено в центральной лаборатории (SeraCare BioServices, Gaithersburg, Мэриленд) с помощью анализа Cobas Amplicor Assay (чувствительность 50 IU (международные единицы)/мл: фирма Roche Molecular Diagnostics, Alameda, Калифорния). Отобранные образцы тестировали на уровень РНК HCV с помощью анализа Cobas Amplicor Monitor Assay, а на генотип РНК HCV с помощью анализа Versant HCV Genotype Assay (фирма Bayer, Tarrytown, Нью-Йорк).
Гистология печени. Все пациенты подверглись биопсии печени в период 18 месячного скрининга, которые были проверены слепым методом патологом в центральной лаборатории. Все биопсии были оценены по выраженности гепатита C по уровню воспаления и стадии фиброза с помощью оценочной системы модифицированного индекса гистологической активности Исхака (HAI).
Количественное определение сывороточного IP-10. Интерферон-γ индуцируемый белок-10 (IP-10) измеряли в образцах сыворотки, собранных в исходный момент перед началом лечения с помощью коммерчески доступного анализа Quantikine human CXCL10/IP-10 immunoassay (фирма R&D Systems). Все образцы разбавляли 1:2 и анализировали в дубликатах. Линейный динамический диапазон измерения IP-10 в этом анализе составлял 8-500 пг/мл с пределом детектирования 7,8 пг/мл. Образцы с концентрацией IP-10, превышающей 1000 пг/мл, разбавляли 1:5 и анализировали повторно.
Генотипирование IL28B. Полиморфный маркер IL28B rs12979860 анализировали с помощью набора для аллельной дискриминации ABI TaqMan и системы детектирования последовательностей ABI7900HT (фирма Applied Biosystems), как описано Thomas et al. (Nature, 461:798-802, 2009). Генотипировали образцы ДНК от 210 пациентов из нашего контингента.
Статистические способы. Стандартные статистические анализы выполняли с помощью программного обеспечения JMP 7.0.2 или SAS версия 9.1 (обе - от SAS Institute, Inc). Концентрации IP-10 были перед использованием в статистических тестах логарифмированы, чтобы они соответствовали гипотезе нормального распределения. Общедоступные пакеты программ R (версия 2.8.0) были использованы для получения различных моделей классификации (диагональный линейный дискриминантный анализ, алгоритма «random forest» (случайный лес), метод опорных векторов и bagging (метод формирования ансамблей классификаторов с использованием случайной выборки с возвратом)), так же как анализ кривых графика зависимости чувствительности от частоты ложно положительных заключений (ROC). Модели подобранной логистической регрессии и обобщенные линейные модели строили с помощью, соответственно, процедур proc logistic и proc genmod SAS. Графики строили с использованием статистических программных инструментов или с помощью GraphPad Prism 4 (фирма GraphPad Software, Inc).
РЕЗУЛЬТАТЫ
Пациенты, включенные в контингент для исследования
Образцы сыворотки от 157 [пациентов], давших устойчивый вирусологический ответ (SVR) и 115 не давших ответа на противовирусную терапию были включены в данное исследование из контингента VIRAHEP-C. Определения SVR и не дающих [устойчивого вирусологического ответа] приведены в предшествующих разделах [данного изобретения]. Пациенты с вирусным рецидивом, разрывом в данных или наличием вирусологических данных менее чем за 12 недель были исключены. Контингент состоял из 134 AA и 138 CA. Исходные характеристики пациентов данного контингента были следующими: возраст 48,4±7,4 года; вирусная нагрузка 4,6±5,7×106 IU/мл; число кровяных пластинок 214±73×106 клеток/мм3; аланин трансаминаза (ALT) 90,9±72,9 IU/л; общий билирубин 0,70±0,35 мг/дл; альбумин 4,1±0,40 г/дл; и гематокрит 43,2±3,8% (все данные представляют собой среднее ± стандартное отклонение (SD)). Контингент включал в себя 96 женщин и 176 мужчин, 19% имели оценку фиброза по Исхаку 4-6. Образцы от 210 из 272 пациентов данного контингента были доступны для генотипирования IL28B, 123 SVR и 87 не дающих ответа, из которых 111 были CA и 99 AA.
Измерение исходного сывороточного IP-10 и ответ на терапию
Средний уровень сывороточного IP-10 был существенно ниже у SVR по сравнению с пациентами, не давшими ответа (437±31 пг/мл против 704±44 пг/мл, p<0,001) (Фиг.9A, Таблица 2). Чтобы получить потенциальное прогностическое значение измерения IP-10, пациенты были стратифицированы в соответствии с пороговым значением 600 пг/мл, которое было использовано в предшествующих исследованиях. Шестьдесят девять процентов (129/188) индивидов с низким исходным уровнем IP-10 (<600 пг/мл) были давшими ответ (положительное прогностическое значение, PPV=69%), тогда как 67% (56/83) индивидов с высоким исходным уровнем IP-10 (>600 пг/мл) не дали ответ на терапию (отрицательное прогностическое значение, NPV=67%) (Фиг.9B). Суммарно это дает специфичность 82% (129/157) и чувствительность 49% (56/115) для прогностического теста на ответ на терапию, основанного на уровне сывороточного IP-10 до начала лечения.
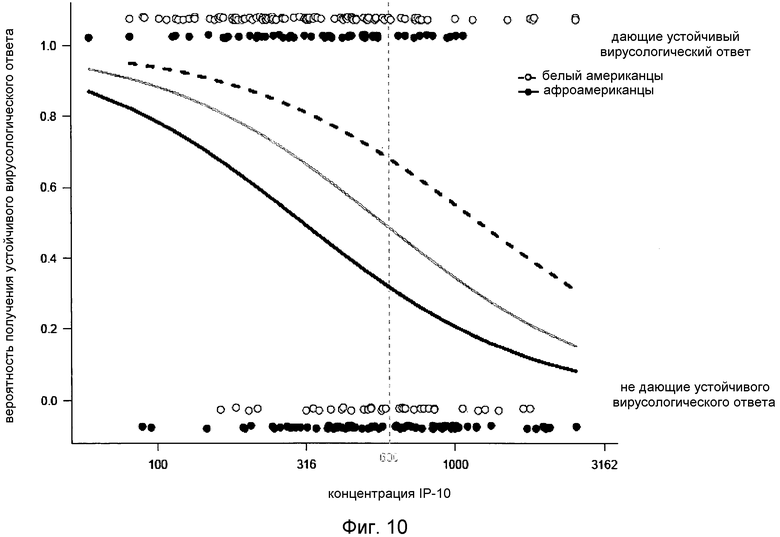
Авторы оценили пороговое значение IP-10 в 600 пг/мл, использованное для идентификации пациентов с SVR, путем вычисления граничного значения с наибольшей дискриминантной способностью, основываясь на анализе кривой ROC. В полученном наборе данных порог концентрации в 370 пг/мл дал оптимальную комбинацию специфичности (80%) и чувствительности (56%) в предсказании пациентов с SVR. Затем авторы изобретения определили оптимальный уровень IP-10 для корректного предсказания как SVR, так и отсутствия ответа. Пороговое значение в 550 пг/мл дало наивысшую величину правильных позитивных и негативных [прогнозов] (69%) и хорошо коррелировало с порогом в 600 пг/мл, который был использован в литературе (68% правильных положительных или отрицательных прогнозов в данной выборке). Наконец, анализ логистической регрессии концентраций IP-10 перед началом лечения сделал возможным подбор вероятности SVR для конкретных уровней IP-10, измеренных у индивидуальных пациентов, и показал очень существенный эффект IP-10 (p<0,0001; Фиг.10, серая кривая).
Эффект расы на уровень сывороточного IP-10
При сравнении уровней сывороточного IP-10 до начала лечения у CA и AA не наблюдалось существенных различий в раздельных анализах давших ответ [на терапию] (p=0,75) и не давших ответа (p=0,97) (Таблица 2). Существенная разница (p=0,015) в исходном уровне сывороточного IP-10 между CA и AA, которая наблюдалась в общем контингенте исследования, может с наибольшей вероятностью быть объяснена несбалансированным составом контингента (величина ответа на лечение IFN в подгруппе CA составляла 75% по сравнению с 40% в подгруппе AA). Очень существенная разница в уровне сывороточного IP-10 между дающими ответ и не дающими ответа на терапию IFN была обнаружена и у CA, и у AA (Таблица 2). Анализы логистической регрессии исходного уровня IP-10 были использованы для получения кривой ответа на терапию для пациентов CA и AA (Фиг.10). Кривые ответа пациентов AA и CA показывают существенное влияние и IP-10 (p<0,0001), и расы (p<0,0001), но не существенный эффект сопряженности между IP-10 и расой (p=0,08).
Генотип IL28B и ответ на терапию
Из 210 генотипированных пациентов 30% имели CC, 49% имели CT, а 21% имели TT. Наблюдалась существенная связь между генотипом IL28B и ответом на терапию: соответствующие величины SVR составили 87% для CC, 50% для CT и 39% для TT (p<0,0001) (Таблица 3). Среди белых американцев 49% имели CC с SVR 91%, 41% имели CT с SVR 67% и 10% имели TT с SVR 45% (p<0,001). Среди афроамериканцев только 9% имели CC с SVR 67%, 58% имели CT с SVR 35% и 33% имели TT с SVR 36% (p=0,20).
Связь генотипа IL28B и уровня IP-10 до начала лечения с ответом на терапию
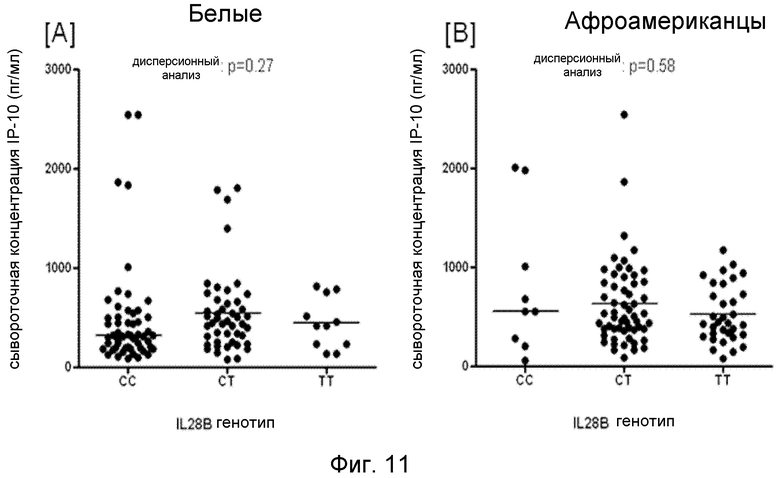
Средний уровень сывороточного IP-10 был схожим у всех пациентов, независимо от генотипа IL28B и у белых (p=0,27) и у афроамериканцев (p=0,58) (Фиг.11). Это отсутствие корреляции между сывороточным IP-10 и генотипом IL28B показывает, что связь с SVR, наблюдающаяся для обоих маркеров, является независимой. При использовании порога 600 пг/мл для уровня IP-10 до начала терапии величина SVR в данном контингенте пациентов с доступными данными и по сывороточному IP-10, и по генотипу IL28B (n=210) составила 69% для тех, у кого уровень IP-10 был низким (<600 пг/мл) и 35% - для тех, у кого уровень IP-10 был высоким (>600 пг/мл) (p<0,0001).
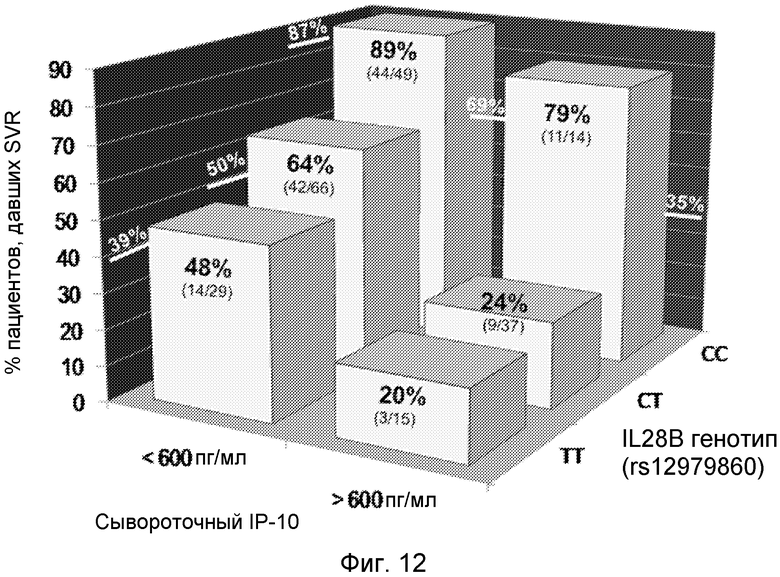
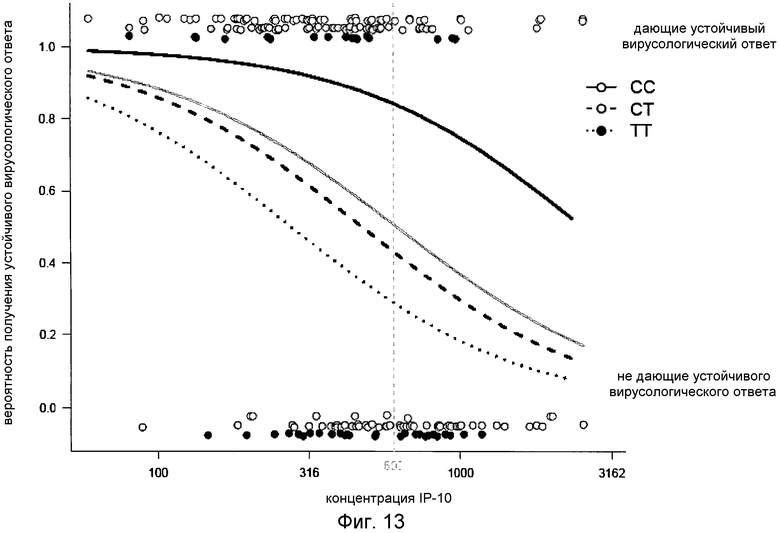
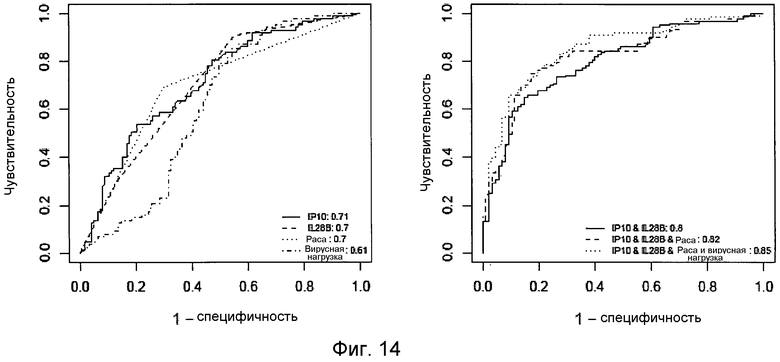
Моделирование SVR как функции генотипа IL28B и сывороточного IP-10 (выше или ниже 600 пг/мл) в номинальной логистической регрессии показало существенный аддитивный эффект генотипа IL28B (p<0,0001) и сывороточного IP-10 (p<0,0015) в прогнозе SVR (χ2=55, p<0,001), но не эффект сопряженности между IL28B и IP-10 (p=0,66). Фиг.12 показывает, что исходный уровень IP-10 в группах генотипа IL28B вносит дополнительную и независимую информацию о величине SVR. Более конкретно, исходный уровень IP-10 был наиболее полезен у носителей Т-аллели IL28B. Суммарная величина ответа для носителей CT составила 50%, однако у тех, у кого был низкий уровень IP-10, SVR был у 64% против 24% у тех, у кого был высокий уровень IP-10. Для генотипа TT 39% имели SVR при 48% в группе с низким IP-10 до начала терапии и 20% в группе с высоким IP-10. Моделирование логистической регрессии ответа SVR, основанное на уровне IP-10, рассматриваемом как непрерывная переменная, и генотипе IL28B, делает возможным более индивидуализированное прогнозирование вероятности SVR в соответствии с уровнем сывороточного IP-10 с дополнительным и существенным сдвигом кривой ответа, зависящим от генотипа IL28B (Фиг.13). Анализ кривых графика зависимости чувствительности от частоты ложно положительных заключений (ROC), который позволяет более количественное сравнение прогностических моделей, дал сходные значения площади под кривой (AUC) ROC для модели, основанной только на сывороточном IP-10 до начала терапии (0,71), по сравнению с [основанной] только на генотипе IL28B (0,70). Более высокая величина ROC AUC (0.80) была достигнута, однако, на модели, которая комбинирует оба маркера (Фиг.14). Вместе эти данные демонстрируют, что комбинирование генотипа IL28B с измерениями сывороточного IP-10 до начала терапии отчетливо улучшает прогностическое значение SVR, особенно в случае генотипов, не относящихся к CC.
Такая же и существенная тенденция также была обнаружена при анализе по расовым группам (Таблица 4). Например, среди афроамериканцев разница между исходными уровнями IP-10 была даже более выраженной для генотипов CT и TT IL28B. Для носителей CT с низким IP-10 SVR наблюдался у 48% против 17% - с высоким IP-10, тогда как у носителей TT с низким IP-10 SVR составлял 43% против 25% - при высоком IP-10.
Комбинирование генотипа IL28B и уровня IP-10 до начала терапии с другими исходными параметрами для прогнозирования ответа на терапию
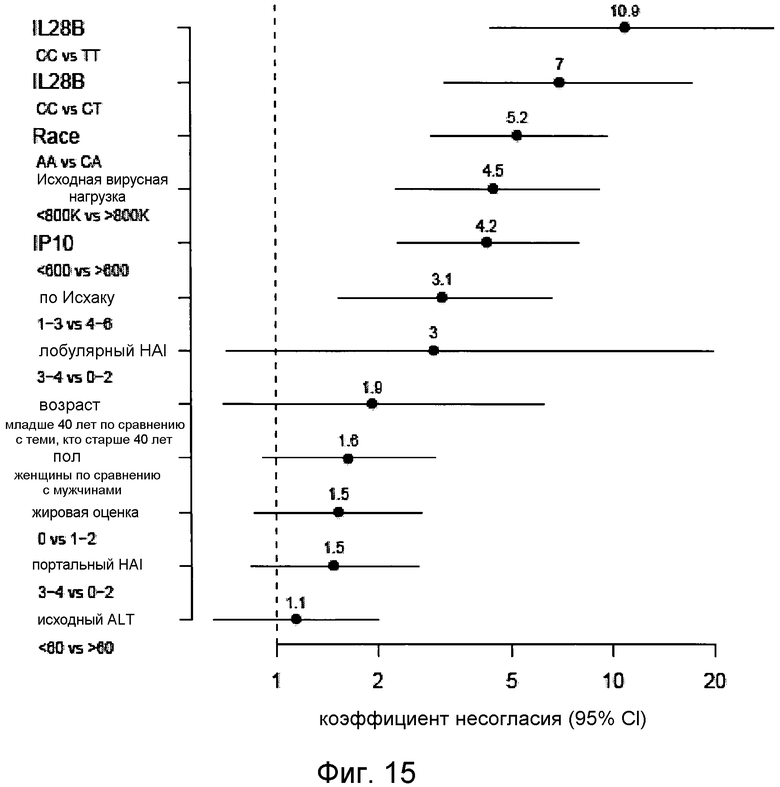
Определяли, могут ли другие исходные параметры в дополнение к генотипу IL28B и сывороточному IP-10 существенно улучшать прогноз SVR. В данном анализе были добавлены возраст, пол, раса, вирусная нагрузка перед началом терапии, оценка фиброза по Исхаку, ALT, стеатоз (жировое перерождение) и гистологический индекс активности в модели логистической регрессии. Из всех включенных параметров только вирусная нагрузка перед началом терапии (p<0,0001), генотип IL28B (p=0,0004), исходный уровень IP-10 (p=0,0033), и раса (p=0,0011) вносили в модель существенный вклад. Ни одна из пар переменных не показала существенного эффекта сопряженности (все p>0,1). Когда все переменные рассматривались как категориальные переменные (например, IP-10 выше или ниже 600 пг/мл, а не как непрерывные переменные), получившаяся обобщенная линейная модель включала в себя те же самые четыре существенные переменные плюс оценка фиброза по Исхаку (Фиг.15).
Анализы кривых ROC проводили, чтобы сравнить прогностическую способность моделей, которые включают в себя наиболее существенные переменные, идентифицированные в этих мультивариантных анализах (Фиг.14). AUC модели, в которой скомбинированы генотип IL28B и сывороточный IP-10 (AUC 0,80) отчетливо превосходят модели, основанные на индивидуальных переменных, включая в себя модель, основанную только на генотипе IL28B (AUC 0,70). Добавление расы и исходной вирусной нагрузки дополнительно улучшает модель, этот дополнительный вклад был скромен (AUC до 0,85).
(n SVR CA/общее n CA)
(n SVR AA/общее n AA)
ОПИСАНИЕ ЧЕРТЕЖЕЙ 1-15
Фиг.1. Тепловая карта, представляющая концентрации 37 цитокинов до начала терапии у 50 пациентов HCV, давших ответ (SVR), и 50, не давших ответа на терапию интерфероном α/рибавирином.
Фиг.2. Измерения IP-10 в исходный момент у давших ответ против не давших ответа на терапию с помощью IFN. [A] Существенно более низкий (p<0,001) уровень сывороточного IP-10 наблюдался в исходный момент у пациентов, дающих ответ на терапию с помощью IFN, по сравнению с не дающими ответа. Горизонтальные линии показывают средние значения в группе. Чтобы получить потенциальное прогностическое значение измерения IP-10, индивиды были стратифицированы по пороговому значению 600 пг/мл (пунктирная линия). [B] Существенно меньшая доля субъектов с высоким (>600 пг/мл) уровнем IP-10 была обнаружена среди [пациентов], давших ответ [на терапию] по сравнению с группой не давших ответа (критерий Пирсона χ2=16,3, p<0,001).
Фиг.3. Матрица коэффициентов корреляции, включающая в себя 37 цитокинов, измеренных в исходной точке у 100 пациентов HCV (образцы, полученные перед терапией). Голубые прямоугольники показывают корреляции между цитокинами выше 60% (светло-голубые), 70% (синие) или 80% (темно-синие), соответственно. Красные прямоугольники показывают корреляции IP-10 со всеми остальными 36 цитокинами (все - ниже 60%).
Фиг.4. Распределение генотипа IL28B (rs12979860) у давших ответ и не давших ответа на терапию IFNα + рибавирин. Данные показаны как число пациентов (n) или как процент давших ответ и не давших ответа, соответственно (Row%). Графическое представление показано в правой части чертежа.
Фиг.5. Генотип IL28B (rs12979860) в связи с концентрацией сывороточного IP-10 перед началом терапии у 80 пациентов, страдающих HCV. Пациенты были сгруппированы либо по генотипу IL28B (слева), либо по сравнению генотипа CC с генотипами CT/TT (справа). Никаких существенных различий, связанных с генотипом IL28B не наблюдалось.
Фиг.6. Комбинированный анализ генотипа IL28B и сывороточной концентрации IP-10 (выше или ниже 600 пг/мл) в связи с результатом терапии. Чертеж показывает число пациентов (N) (левое окно), как и долю (в %) пациентов на генотип и уровень IP-10, которая отвечала или не отвечала на терапию IFNα/рибавирином.
Фиг.7. Графическая сводка, сравнивающая прогностическое значение результата терапии пациентов, страдающих HCV, основанная только на генотипе IL28B (верхнее окно), только на уровне сывороточного IP-10 (среднее окно), и комбинированный анализ, [основанный] на генотипе IL28B и уровне сывороточного IP-10. Проценты в прямоугольниках представляют фракцию [пациентов], дающих SVR в конкретной подгруппе. Общее количество пациентов в каждой подгруппе (прямоугольник) показано с правой стороны прямоугольника.
Фиг.8. Графическое представление подбора с помощью анализа логистической регрессии устойчивого вирусологического ответа (SVR) на лечение пегинтерфероном и рибавирином, основанное на уровне сывороточного IP-10 (серая кривая). Далее, генотип IL28B был добавлен в модель, что дало регрессионную кривую для каждого из генотипов (CC: синий, CT: красный, TT: зеленый). Относительно малое количество пациентов в каждой из подгрупп может объяснить, почему сывороточный IP-10 оказался существенным компонентом, вносящим вклад (p=0,017) в эту модель, а не генотип IL28B (p=0,31) или эффект сопряженности между IP-10 и IL28B (p=0,93). Каждый образец от пациента представлен как кружок в верхней (дающие ответ) или нижней (не дающие ответа) части чертежа; цвет кружков означает генотип IL28B.
Фиг.9. Сывороточный IP-10 (пг/мл) до начала терапии у дающих ответ (SVR) и не дающих ответа пациентов. (A) График распределения данных по IP-10; (B) Составная диаграмма, основанная на уровне IP-10 (стратифицированная выше и ниже 600 пг/мл) и результате терапии.
Фиг.10. Графическая сводка анализа логистической регрессии для подбора вероятности наличия ответа (SVR), основанного на уровне сывороточного IP-10 до начала терапии (пг/мл), в общем контингенте (серая кривая) или стратифицированном по расовым группам (белые американцы: красная, афроамериканцы: синяя). Каждый образец от пациента представлен кружком в верхней (SVR) или нижней (не давшие ответа) части чертежа. Модель логистической регрессии показывает существенный эффект IP-10 (p<0,0001) и расы (p<0,0001), но не наличие существенного эффекта сопряженности между IP-10 и расой (p=0,08).
Фиг.11. Сывороточный IP-10 (пг/мл) до начала терапии у пациентов HCV, стратифицированных в соответствии с генотипом IL28B у (A) белых американцев и (B) афроамериканцев. Однофакторный дисперсионный анализ показал отсутствие существенных различий уровня IP-10 в зависимости от генотипа IL28B.
Фиг.12. Величина устойчивого вирусологического ответа (SVR) (%) у пациентов, страдающих HCV, стратифицированная в соответствии с сывороточным IP-10 до начала терапии (выше и ниже 600 пг/мл) и генотипом IL28B. Величины SVR в соответствии только с сывороточным IP-10 или только генотипом IL28B показаны на вертикальной стенке диаграммы (белый шрифт). Величина SVR и число пациентов (n SVR/n всего в подгруппе) показаны внутри панели для каждой подгруппы. Анализ коэффициента правдоподобия χ2 подтвердил гетерогенность ответа в группе образцов (χ2=55; p<0,0001).
Фиг.13. Графическая сводка анализа логистической регрессии для подбора вероятности наличия устойчивого вирусологического ответа (SVR) на терапию пег-интерфероном и рибавирином, основанная только на уровне сывороточного IP-10 (серая кривая), или основанная на комбинации уровня сывороточного IP-10 (пг/мл) и генотипа IL28B (CC: красная, CT: зеленая, TT: синяя). Каждый образец от пациента представлен кружком в верхней (SVR) или нижней (не давшие ответа) части чертежа; цвета кружков представляют генотипы IL28B. Модель логистической регрессии показывает существенный эффект IP-10 (p<0,0001) и генотипа IL28B (p<0,0001), но не существенный эффект сопряженности между IP-10 и генотипом IL28B (p=0,3).
Фиг.14. Анализ кривой частоты ложно положительных заключений (ROC) для сывороточного IP-10 до начала терапии, генотипа IL28B, расы, исходного уровня вирусной нагрузки HCV или комбинации этих параметров в прогнозировании SVR на терапию пег-интерфероном и рибавирином. Числа в подписи к чертежу показывают статистику площади под кривой ROC (AUC), которая может быть использована для сравнения моделей.
Фиг.15. Прогностические признаки устойчивого вирусологического ответа (SVR) на терапию peglFN и рибавирином. Вероятности благоприятного исхода были рассчитаны на основе модели логистической регрессии, включающей в себя генотип IL28B и исходный уровень (до начала терапии) измерений IP-10, вирусную нагрузку HCV, стадии фиброза (по Исхаку), возраст, пол, аланин трансаминазу (ALT), стеатоз (жировая оценка) и портальный и лобулярный гистологические индексы активности.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОДНОНУКЛЕОТИДНЫЙ ПОЛИМОРФИЗМ НА ХРОМОСОМЕ 15, КОТОРЫЙ ПОЗВОЛЯЕТ ПРОГНОЗИРОВАТЬ ВОСПРИИМЧИВОСТЬ К ЛЕЧЕНИЮ ВИРУСА ГЕПАТИТА С | 2012 |
|
RU2606759C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ БЫСТРОГО ВИРУСОЛОГИЧЕСКОГО ОТВЕТА У БОЛЬНЫХ ХРОНИЧЕСКИМ ГЕПАТИТОМ С | 2013 |
|
RU2563812C2 |
| СПОСОБ ПЕРСОНИФИЦИРОВАННОГО ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ТЕРАПИИ ХРОНИЧЕСКОГО ГЕПАТИТА С ПЕГИЛИРОВАННЫМ ИНТЕРФЕРОНОМ-АЛЬФА И РИБАВИРИНОМ | 2013 |
|
RU2525159C1 |
| ОДНОНУКЛЕОТИДНЫЕ ПОЛИМОРФИЗМЫ ДЛЯ ПРОГНОЗИРОВАНИЯ РЕЗУЛЬТАТОВ ЛЕЧЕНИЯ ЗАРАЖЕНИЯ ВИРУСОМ ГЕПАТИТА С | 2011 |
|
RU2567663C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ УСТОЙЧИВОГО ВИРУСОЛОГИЧЕСКОГО ОТВЕТА ПРИ ПРОТИВОВИРУСНОЙ ТЕРАПИИ ХРОНИЧЕСКОГО ВИРУСНОГО ГЕПАТИТА С НА ФОНЕ ВИЧ-ИНФЕКЦИИ | 2013 |
|
RU2558793C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ПРОТИВОВИРУСНОГО ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ВИРУСНОГО ГЕПАТИТА С | 2013 |
|
RU2546032C2 |
| Способ прогнозирования динамики фиброза печени у пациентов с хроническим гепатитом С, генотипом 1, не ответивших на лечение пегилированными интерферонами и рибавирином | 2015 |
|
RU2623151C2 |
| ПРОГНОЗ КИНЕТИКИ ВИРУСА ГЕПАТИТА С ПРИ ЛЕЧЕНИИ, ИСКЛЮЧАЮЩЕМ ИНТЕРФЕРОН | 2011 |
|
RU2590691C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ФОРМИРОВАНИЯ ВИРУСОЛОГИЧЕСКОГО ОТВЕТА У БОЛЬНЫХ ХРОНИЧЕСКИМ ГЕПАТИТОМ С | 2011 |
|
RU2461834C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ПРОТИВОВИРУСНОЙ ТЕРАПИИ У ВЗРОСЛЫХ БОЛЬНЫХ ХРОНИЧЕСКИМ ГЕПАТИТОМ С С ГЕНОТИПОМ 1b | 2012 |
|
RU2522500C1 |



Изобретение относится к биотехнологии, а именно к способу комбинирования определения генотипа IL28B вместе с измерением сывороточного уровня IFN-γ-индуцируемого белка 10 (IP-10) для прогнозирования получения устойчивого вирусологического ответа (SVR) или отсутствия ответа на пегинтерферон и рибавирин для индивидуальных пациентов, инфицированных HCV, а также к диагностическому набору для применения в данном способе. Способ включает определение генотипа IL28B с помощью полиморфного маркера rs12979860 и сывороточного уровня IP-10 в группах с генотипом IL28B, который обеспечивает дополнительную и независимую информацию в отношении вероятности SVR. Носители СС с IP-10<600 пг/мл имеют вероятность SVR 100% и вероятность 75%, когда IP-10>600 пг/мл. Носители СТ с IP-10<600 пг/мл имеют вероятность SVR 79% и вероятность 34%, когда IP-10>600 пг/мл. Носители ТТ с IP-10<600 пг/мл имеют вероятность SVR 50% и вероятность 10%, когда IP-10>600 пг/мл. Предложенное изобретение позволяет получить информацию об устойчивом вирусологическом ответе на пегинтерферон и рибавирин у индивидуальных пациентов, инфицированных HCV. 2 н. и 5 з.п. ф-лы, 15 ил., 4 табл.
1. Способ комбинирования определения генотипа IL28B вместе с измерением сывороточного уровня IFN-γ-индуцируемого белка 10 (IP-10) до начала терапии для прогнозирования получения устойчивого вирусологического ответа (SVR) или отсутствия ответа на пегинтерферон и рибавирин для индивидуальных пациентов, инфицированных HCV, где указанное определение генотипа IL28B включает полиморфный маркер rs12979860 и где сывороточный уровень IP-10 в группах с генотипом IL28B обеспечивает дополнительную и независимую информацию в отношении вероятности SVR, более конкретно:
носители СС с IP-10<600 пг/мл имеют вероятность SVR 100% и вероятность 75%, когда IP-10>600 пг/мл; или
носители СТ с IP-10<600 пг/мл имеют вероятность SVR 79% и вероятность 34%, когда IP-10>600 пг/мл; или
носители ТТ с IP-10<600 пг/мл имеют вероятность SVR 50% и вероятность 10%, когда IP-10>600 пг/мл.
2. Способ по п. 1, в котором добавлен параметр расы.
3. Способ по п. 1, в котором добавлено определение вирусной нагрузки гепатита С.
4. Способ по п. 1, в котором добавлены параметры расы и определение вирусной нагрузки гепатита С.
5. Способ по любому из пп. 1-4, в котором генотип IL28B дополнительно содержит полиморфный маркер rs12980275 и/или rs8099917 или какой-либо другой генетический маркер, который находится в неравновесном сцеплении с этими маркерами.
6. Способ по п. 5, в котором комбинация измерений дополнительно различает SVR и отсутствие ответа на пегинтерферон и рибавирин индивидуальных пациентов, инфицированных HCV, по сравнению с любым из этих двух индивидуальных маркеров (генотип IL28B, уровень сывороточного IP-10).
7. Диагностический набор для применения в способе по любому из пп. 1-6, включающий средства для по меньшей мере определения или измерения полиморфизма IL28B и уровня IP-10 в сыворотке пациентов, инфицированных HCV.
| GE DONGLIANG ET AL., Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance., NATURE, 2009, v | |||
| Рельсовое стыковое скрепление | 1922 |
|
SU461A1 |
| Способ получения желатинообразных веществ в форме зерен или порошка | 1926 |
|
SU7262A1 |
| ПРИСПОСОБЛЕНИЕ, ЗАТРУДНЯЮЩЕЕ КРАЖУ ЭЛЕКТРИЧЕСКОЙ ЛАМПЫ | 1922 |
|
SU399A1 |
| Механический грохот | 1922 |
|
SU41A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2015-11-10—Публикация
2010-12-21—Подача