ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет по дате подачи предварительной заявки на патент США №61/333887, поданной 12 мая 2010 года, полное содержание которой включено в настоящее описание посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0002] Известны фармацевтические продукты для применения при лечении гиперфосфатемии. Они включают продукты, предложенные в патенте США №7588782, в котором описаны некоторые лантаноидсодержащие соединения, включая диоксикарбонат лантана (также обозначаемый в настоящем описании LDOC), а также патентах США №№5968976; 7381428; и 7465465, в которых описаны различные гидраты карбоната лантана, включая соединения формулы La2(CO3)3.×H2O (также называемые в настоящем описании трикарбонатом лантана). Данные соединения действуют путем связывания фосфата, потребляемого субъектом. Одно из таких соединений продается под товарным знаком ФОСРЕНОЛ (FOSRENOL). Другие продукты для лечения гиперфосфатемии включают РЕНАГЕЛЬ (RENAGEL), представляющий собой полимерное фосфатсвязывающее вещество, также известное как Севеламер HCl (Sevelamer HCl).
[0003] В частности, в патенте США №7588782 описано в числе прочего получение диоксикарбоната лантана по реакции хлорида лантана с карбонатом натрия с получением соединения, называемого в указанном документе оксикарбонатом лантана (La2O(СО3)2.×Н2О). Затем его нагревают в печи при высоких температурах с получением диоксикарбоната лантана. См. в целом патент '782, пример 5. Впоследствии стало известно, что одно из соединений, описанное в патенте 782 как оксикарбонат лантана, в действительности представляет собой гидроксид карбонат лантана (LaCO3OH или LCH) с дополнительно связанной водой или без нее. Именно это соединение нагревают с получением оксикарбоната лантана. Сообщается, что полученное в итоге вещество LDOC является кристаллическим по природе, состоит из почти круглых частиц, размер которых составляет примерно 100 нанометров, и также отмечено, что данное вещество является безводным. На Фиг.20 в патенте 782 показана улучшенная кинетика связывания фосфата для LDOC, полученного в соответствии с примером 5, по сравнению с различными гидратами трикарбоната лантана. В частности, через 10 минут диоксикарбонат лантана связал где-то от примерно 70 до 80 процентов имеющегося фосфата, при этом тетрагидрат трикарбоната лантана связал только примерно 40 процентов. Данный тест проводили при pH 3.
[0004] Однако было обнаружено, что кинетика связывания фосфата диоксикарбонатом лантана, описанная в патенте 782, не была одинаковой при любых значениях pH. При тенденции pH к увеличению, как это происходило бы в пищеварительном тракте млекопитающего, кинетика связывания замедлялась. В патенте 782 описано вещество, имеющее большое фармакологическое значение и большую ценность. Но, как и в большинстве случаев, есть место для дальнейших разработок.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0005] В соответствии с одним из аспектов настоящее изобретение относится к способу получения соединения лантана, включающему: осуществление взаимодействия растворимой соли лантана (часто галогенида лантана) с карбонатом нещелочного металла в растворителе с получением гидроксида карбоната лантана (LCH), который затем осаждают.
[0006] В одном из вариантов реализации относительное соотношение галогенида лантана и карбоната в указанной реакции составляет примерно 1:1. В другом варианте реализации относительное соотношение галогенида лантана и карбоната составляет примерно 1:2 или больше. В другом варианте реализации указанное соотношение составляет примерно 1:3 или больше. В другом варианте реализации количество галогенида лантана относительно количества карбоната в реакции находится в диапазоне от примерно 1:0,8 до примерно 1:4. В целом, вещество LCH согласно настоящему изобретению имеет более высокую площадь поверхности (в 2-3 раза больше площади поверхности LCH из патента 782), более высокую насыпную плотность и плотность после утряски, другую морфологию (сферические первичные частицы по сравнению с иголками и пластинами) и другую полиморфную структуру по данным порошковой рентгеновской дифракции (PXRD или PXD). Рентгенограмма вещества согласно настоящему изобретению совпадает с рентгенограммой файла 26-815 Международного центра дифракционных данных (ICDD), тогда как рентгенограмма соответствующего вещества из патента 782 совпадает с рентгенограммой файла ICDD 49-981. Известное вещество содержит некоторое остаточное количество натрия (до 1%) вследствие натрийсодержащих предшественников, используемых в синтезе соединений, тогда как вещество согласно настоящему изобретению содержит малое количество натрия (случайные следы) или не содержит натрий, поскольку в способах согласно настоящему изобретению не используют реагенты, содержащие натрий или другие щелочные металлы.
[0007] В одном из вариантов реализации температура реакции находится в диапазоне от примерно 65 до примерно ПО градусов Цельсия, и pH реакции составляет по меньшей мере примерно 4,5.
[0008] Используемый карбонат нещелочного металла может включать, без ограничения, любой водорастворимый не содержащий металла 1А группы карбонат или бикарбонат, такой как бикарбонат аммония и карбонат аммония.
[0009] В другом варианте реализации температура реакции находится в диапазоне от примерно 75 до примерно 90 градусов Цельсия, и pH составляет 6,0 или выше.
[0010] В соответствии с одним из аспектов любого из вышеуказанных вариантов реализации, осадок LCH находится в растворителе при концентрации осадка в диапазоне от примерно 20 до примерно 55 г/л.
[0011] В конкретном варианте реализации настоящее изобретение относится к способу получения соединения карбоната лантана, включающему осуществление взаимодействия растворимой соли галогенида лантана с карбонатом нещелочного металла в растворителе при температуре реакции от примерно 65 градусов Цельсия до примерно 110 градусов Цельсия, при pH, равном по меньшей мере 4,5, и осаждение продукта реакции, при этом указанный продукт реакции представляет собой гидроксид карбонат лантана, содержащий примерно 0,5 масс.% или меньше щелочного соединения.
[0012] В других вариантах реализации настоящее изобретение относится к способу получения соединения карбоната лантана, включающему осуществление взаимодействия растворимой соли хлорида лантана с карбонатом аммония в растворителе при температуре реакции от примерно 75 градусов Цельсия до примерно 90 градусов Цельсия, при pH от примерно 6,0 до 7,5, и осаждение продукта реакции, при этом указанный продукт реакции представляет собой гидроксид карбонат лантана, содержащий примерно 0,5 масс.% или меньше натрия. В различных вариантах реализации количество хлорида лантана относительно количества карбоната аммония в реакции находится в диапазоне от примерно 1:0,8 до примерно 1:4. В другом варианте реализации полученный гидроксид карбонат лантана совпадает с рентгенограммой из файла ICDD 26-815.
[0013] Любой из данных способов может дополнительно включать этап обжига LCH, при котором температура порошка достигает от примерно 400 до примерно 700 градусов Цельсия, в течение по меньшей мере двух часов с получением оксикарбоната лантана. В - другом варианте реализации температура обжига порошка находится в диапазоне от примерно 440 до примерно 640 градусов Цельсия, в другом варианте реализации температура обжига порошка находится в диапазоне от примерно 500 до примерно 600 градусов Цельсия. Часто используемая температура составляет примерно 550 градусов Цельсия. Полученный оксикарбонат лантана может представлять собой диоксикарбонат лантана и, в частности, La2O2CO3, который может быть кристаллическим или аморфным и может быть сольватирован или нет.
[0014] В некоторых вариантах реализации полученный диоксикарбонат лантана содержит не более чем примерно 10 масс.% другой полиморфной формы диоксикарбоната лантана, обозначаемой в настоящем описании La2CO5. В другом варианте реализации полученный диоксикарбонат лантана содержит не более чем примерно 5 масс.% La2CO5 и, в частности, не более примерно 1 масс.% La2CO5.
[0015] В некоторых вариантах реализации любого из вышеуказанных способов LCH содержит менее чем примерно 0,5 масс.% (на основе щелочного металла) щелочного соединения и, в частности, натрия. В другом варианте реализации общее количество любого присутствующего щелочного соединения составляет 0,3 масс.% или меньше (из расчета на щелочной металл - масса щелочного соединения в масс.%, из расчета только на металл, определенная с помощью индуктивно-связанной плазмы (ICP)) и в другом варианте реализации 0,1% или меньше.
[0016] В других вариантах реализации любого из вышеуказанных способов полученный оксикарбонат лантана содержит менее чем примерно 0,75 масс.% (из расчета на щелочной металл) щелочного соединения и, в частности, натрия, а в других вариантах реализации 0,4 масс.% или меньше. В другом варианте реализации оксикарбонат лантана согласно настоящему изобретению содержит 0,2 масс.% или меньше.
[0017] Таким образом, в конкретном варианте реализации настоящее изобретение также относится к способу, предложенному выше, для получения соединения, представляющего собой карбонат лантана, дополнительно включающему обжиг продукта реакции при температуре от примерно 400 до примерно 700 градусов Цельсия в течение по меньшей мере двух часов с получением диоксикарбоната лантана, содержащего одну или более полиморфных форм формул La2O2CO3 и La2CO5 и содержащего примерно 0,75 масс.% или меньше натрия. В одном из вариантов реализации температура обжига составляет примерно 550 градусов Цельсия. В дополнительных вариантах реализации полученный диоксикарбонат лантана содержит не более чем примерно 5 масс.% полиморфной формы формулы La2CO5. В другом варианте реализации полученный диоксикарбонат лантана содержит не более примерно 1 масс.%) полиморфной формы формулы La2CO5.
[0018] Также настоящее изобретение включает продукты, получаемые любым из данных способов, описанных выше. Таким образом, в соответствии с конкретным аспектом настоящее изобретение относится к соединению карбоната лантана, выбранному из группы, состоящей из гидроксида карбоната лантана, содержащего примерно 0,5 масс.% или меньше натрия, и диоксикарбоната лантана, содержащего одну или более полиморфных форм формул La2O2CO3 и La2CO5 и содержащего примерно 0,75 масс.% или меньше натрия. В конкретном варианте реализации гидроксид карбонат лантана совпадает с рентгенограммой из файла ICDD 26-815. В другом варианте реализации диоксикарбонат лантана содержит не более примерно 5 масс.% полиморфной формы формулы La2CO5. В другом варианте реализации диоксикарбонат лантана содержит не более примерно 1 масс.% полиморфной формы формулы La2CO5. В конкретном варианте реализации диоксикарбонат лантана имеет либо объем пор, составляющий по меньшей мере 0,015 см3/г, либо содержит примерно 0,75 масс.%) или меньше натрия. В другом варианте реализации диоксикарбонат лантана имеет либо объем пор, составляющий по меньшей мере 0,020 см3/г, либо содержит примерно 0,75 масс.%) или меньше натрия.
[0019] Другой вариант реализации представляет собой водную суспензию, содержащую: гидроксид карбонат лантана и галогенид аммония в водном растворителе.
[0020] Аспекты настоящего изобретения также включают гидроксид карбонат лантана (LCH), характеризующийся по меньшей мере одним из: средним размером агрегатов (D50 по объему агрегатов, измеренный лазерными способами) от примерно 4 до примерно 80 микрон; относительно высокой пористостью (больше, чем достигаемая путем использования того же способа с использованием реагента карбоната натрия); площадью поверхности по методу Брунауэра-Эммета-Теллера (БЭТ), составляющей по меньшей мере примерно 1 м2/г и часто от примерно 1 до примерно 100 м2/г; насыпной плотностью от примерно 0,1 до примерно 1,1 и в другом варианте реализации от примерно 0,5 до примерно 0,8 г/см3; содержанием щелочного металла примерно 0,5 масс.% (из расчета на щелочной металл) или меньше.
[0021] В другом варианте реализации настоящее изобретение включает оксикарбонат лантана, характеризующийся по меньшей мере одним из следующего: средний размер агрегатов (D50 по объему агрегатов, измеренный лазерными способами) от примерно 4 до примерно 80 микрон; относительно более высокая пористость; объем пор, составляющий по меньшей мере 0,015 см3/г или по меньшей мере 0,020 см3/г (больше, чем достигаемый путем использования того же способа с использованием реагента карбоната натрия); площадь поверхность по методу БЭТ, составляющая по меньшей мере примерно 20 м3/г и часто от примерно 30 до примерно 40 м2/г; насыпная плотность от примерно 0,1 до примерно 1,1 и в другом варианте реализации от примерно 0,5 до примерно 0,8 г/см3; содержание щелочного соединения примерно 0,75 масс.% (на основе щелочного металла) или меньше. LCH и оксикарбонаты лантана согласно настоящему изобретению часто имеют относительную плотность, составляющую 5,15 г/см3±0,1 г/см3.
[0022] В некоторых вариантах реализации оксикарбонат лантана представляет собой конкретную полиморфную форму диоксикарбоната лантана, представленного в настоящем описании формулой La2O2CO3. В некоторых вариантах реализации данная полиморфная форма является практически чистой, по существу чистой или чистой относительно других полиморфных форм.
[0023] Также настоящее изобретение включает фармацевтическую композицию, содержащую эффективное количество гидроксида карбоната лантана и/или диоксикарбоната лантана и по меньшей мере один фармацевтически приемлемый наполнитель.
[0024] Также настоящее изобретение включает фармацевтические композиции, содержащие эффективное количество активного фармацевтического ингредиента, который представляет собой гидроксид карбонат лантана или оксикарбонаты лантана, обладающие по меньшей мере одним из физических свойств, указанных выше, и по меньшей мере один фармацевтически приемлемый наполнитель. Таким образом, в соответствии с одним из аспектов настоящее изобретение относится к фармацевтической композиции, содержащей эффективное количество одного или более соединений карбоната лантана выбранных из группы, состоящей из гидроксида карбоната лантана, содержащего примерно 0,5 масс.% или меньше натрия, и диоксикарбоната лантана, содержащего примерно 0,75 масс.% или меньше натрия, и по меньшей мере один фармацевтически приемлемый наполнитель, при этом указанная фармацевтическая композиция представляет собой лекарственную форму, выбранную из группы, состоящей из глотательных таблеток, глотательных таблеток в виде капсул, прессованных лекарственных форм, глотательных твердых желатиновых капсул, глотательных мягких гелевых капсул, растворимых во рту таблеток, растворимых во рту таблеток в виде капсулы, растворимых во рту твердых желатиновых капсул, растворимых во рту мягких желатиновых капсул, жевательных таблеток, жевательных таблеток в виде капсулы, жевательных капсул, порошков, капсул с заключенными внутри мелкими частицами (sprinkles), распадающихся во рту пленок, пищевых продуктов, продуктов со сладким наполнителем, жевательных резинок, сиропов, суспензий, эмульсий или дисперсий. В конкретном варианте реализации фармацевтическая композиция содержит диоксикарбонат лантана, имеющий либо объем пор, составляющий по меньшей мере 0,015 см3/г, либо содержащий примерно 0,75 масс.% или меньше натрия. В другом варианте реализации фармацевтическая композиция содержит диоксикарбонат лантана, имеющий либо объем пор, составляющий по меньшей мере 0,020 см3/г, либо содержащий примерно 0,75 масс.% или меньше натрия.
[0025] Как предполагается в настоящем описании, в конкретном варианте реализации эффективное количество одного или более соединений карбоната лантана (активный фармацевтический ингредиент) находится в диапазоне от примерно 125 до примерно 20000 мг на дозу. В другом конкретном варианте реализации настоящее изобретение относится к фармацевтической композиции, предложенной выше, в которой эффективное количество одного или более соединений карбоната лантана в лекарственной форме находится в диапазоне от примерно 125 мг до примерно 20000 мг и составляет до примерно 95%о от массы каждой лекарственной формы. В другом конкретном варианте реализации настоящее изобретение относится к фармацевтической композиции, предложенной выше, в которой эффективное количество одного или более соединений карбоната лантана находится в диапазоне от примерно 125 мг до примерно 20000 мг и составляет до примерно 95% от массы каждой лекарственной формы, и в которой указанное соединение карбоната лантана содержит диоксикарбонат лантана формулы La202C03. В другом варианте реализации настоящее изобретение относится к фармацевтической композиции, в которой эффективное количество одного или более соединений карбоната лантана находится в диапазоне от примерно 125 мг до примерно 20000 мг, и в которой указанное соединение карбоната лантана содержит диоксикарбонат лантана формулы La2O2CO3. В других вариантах реализации настоящее изобретение относится к фармацевтической композиции, предложенной выше, в которой эффективное количество одного или более соединений карбоната лантана выбрано из группы, состоящей из примерно 100, 125, 150, 250, 500, 750 или 1000 мг.
[0026] В других вариантах реализации любая из фармацевтических композиций, описанных в настоящем документе, дополнительно содержит вторичное фосфатсвязывающее вещество в количестве до 150% от количества активного фармацевтического ингредиента. Таким образом, полученная композиция может содержать в качестве активных веществ примерно 33% АФИ (LCH и/или оксикарбонат лантана согласно настоящему изобретению) и примерно 67% какого-либо другого фосфатсвязывающего активного вещества.
[0027] В настоящем документе предполагается, что LCH и оксикарбонаты лантана согласно настоящему изобретению, и фармацевтические композиции, содержащие данные соединения, можно применять для связывания фосфата in vivo, например, для лечения состояния, характеризующегося аномально повышенным уровнем фосфата в крови, например, выбранного из группы, состоящей из гиперфосфатемии, хронической болезни почек, общей почечной недостаточности, терминальной стадии почечной недостаточности и хронической почечной недостаточности.
[0028] Таким образом, в соответствии с другим аспектом настоящее изобретение относится к способу лечения состояния, характеризующегося аномально повышенным уровнем фосфата в крови, включающему введение нуждающемуся в этом субъекту эффективного количества фармацевтической композиции, описанной в настоящем документе. В различных вариантах реализации состояние, которое лечат, выбрано из группы, состоящей из гиперфосфатемии, хронической болезни почек, общей почечной недостаточности, терминальной стадии почечной недостаточности и хронической почечной недостаточности.
[0029] В дополнительных вариантах реализации эффективное количество фармацевтической композиции, вводимой субъекту, находится в диапазоне от примерно 200 до примерно 12000 мг в сутки или от примерно 500 до примерно 8000 мг/сутки. Эффективное количество фармацевтической композиции, вводимой субъекту, также может находится в диапазоне от примерно 300 до примерно 4000 мг/сутки. [0030] В конкретном дополнительном варианте реализации настоящее изобретение относится к способу лечения гиперфосфатемии у субъекта, нуждающегося в таком лечении, включающему введение указанному субъекту эффективного количества LCH или оксикарбоната лантана, полученного способами согласно настоящему изобретению, или имеющего общее содержание натрия примерно 0,5% или меньше (на основе щелочного металла) или повышенную кинетику связывания фосфата, или большую пористость, по сравнению с указанными свойствами другого LCH или оксикарбоната лантана, при pH 6,5.
[0031] В дополнительных вариантах реализации настоящее изобретение относится к способам лечения состояний, связанных с аномально повышенным уровнем фосфата в крови, например, гиперфосфатемии, у субъекта, нуждающегося в таком лечении, включающим введение указанному субъекту эффективного количества активного фармацевтического ингредиента, представляющего собой гидроксид карбонат лантана и/или диоксикарбонат лантана, обладающий по меньшей мере одним из физических свойств, указанных выше. Таким образом, как предполагается в настоящем описании, настоящее изобретение включает способы лечения, включающие введение эффективного количества фармацевтической композиции, содержащей диоксикарбонат лантана, полученный в соответствии со способами настоящего изобретения и обладающий относительно большей площадью поверхности по методу БЭТ, объемом пор и/или кинетикой связывания фосфата, чем диоксикарбонат лантана, полученный в соответствии со способом, предложенным в US 7588782, с применением реагента карбоната натрия, т.е. LDOC, содержащий более 0,75 масс.%) натрия. Поэтому в дополнительных вариантах реализации настоящее изобретение относится к фармацевтическим композициям, в которых диоксикарбонат лантана имеет относительно большую площадь поверхности по методу БЭТ, чем диоксикарбонат лантана, содержащий более 0,75 масс.% натрия. В конкретном варианте реализации площадь поверхности по методу БЭТ составляет более 20 м2/г. В другом варианте реализации площадь поверхности по методу БЭТ составляет более 30 м2/г. Настоящее изобретение также относится к фармацевтическим композициям, в которых диоксикарбонат лантана имеет относительно больший объем пор, чем диоксикарбонат лантана, содержащий более 0,75 масс.%. натрия. В конкретном варианте реализации объем пор составляет по меньшей мере 0,015 см3/г. В другом варианте реализации объем пор составляет по меньшей мере 0,020 см3/г.
[0032] В различных вариантах данных составов и способов другие ингредиенты, такие как второй АФИ или один или более наполнителей, могут содержать щелочные металлы, включая натрий, так, что общее содержание щелочных металлов в лекарственной форме может быть больше 0,75 масс.%. Но щелочные металлы, добавленные после обжига LCH с образованием оксикарбоната лантана согласно настоящему изобретению, не учитываются при определении содержания щелочных металлов, как описано в настоящем документе.
[0033] Данные способы могут дополнительно включать введение одновременно (в одно и то же время), последовательно (одно за другим, разделенное менее чем примерно получасом) или сопутствующим образом (с интервалом более получаса) вторичного фосфатсвязывающего вещества в количестве до 150% от количества активного фармацевтического ингредиента (LCH и/или LDOC).
[0034] В некоторых вариантах данных способов эффективное количество активного фармацевтического ингредиента, вводимого субъекту, находится в диапазоне от примерно 200 до примерно 12000 мг в сутки.
[0035] Способы и фармацевтические композиции согласно настоящему изобретению могут дополнительно включать введение субъекту вторичного фосфатсвязывающего вещества, которое является биологически доступным в кишечнике, а не в желудке. Также предполагается способ связывания фосфата, включающий осуществление взаимодействия источника фосфата с гидроксидом карбонатом лантана и/или оксикарбонатом лантана, полученным одним из способов согласно настоящему изобретению, описанных в настоящем документе, и/или также предполагается одно из физических свойств, описанных в настоящем документе. Таким образом, в соответствии с другим аспектом настоящее изобретение относится к способу связывания фосфата, включающему осуществление взаимодействия источника фосфата с диоксикарбонатом лантана и возможно гидроксидом карбонатом лантана, предложенным согласно настоящему изобретению.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0036] На Фиг.1 показана морфология и порошковые рентгенограммы для двух полиморфных форм LCH: большая площадь поверхности, файл картотеки ICDD №26-815 слева и меньшая площадь поверхности, файл картотеки ICDD №49-981 справа.
[0037] На Фиг.2 показана взаимозависимость площади поверхности LDOC по методу БЭТ и площади поверхности LCH по методу БЭТ, полученных согласно настоящему изобретению.
[0038] На Фиг.3 показана взаимозависимость насыпной плотности LDOC и насыпной плотности LCH, полученных согласно настоящему изобретению.
[0039] На Фиг.4 показана взаимосвязь между pH реакции LCH и размером агрегатов (частиц) LDOC при конкретной температуре.
[0040] На Фиг.5 показаны снимки со сканирующего электронного микроскопа LCH и LDOC, полученных согласно настоящему изобретению (RZB013 и RZB014 соответственно), по сравнению с веществами, полученными до и после обжига в соответствии с патентом 782 (RZB011 и RZB012 соответственно). Следует отметить разницу между RZB-012 и RZB-014, имеющими сильно различающуюся морфологию.
[0041] Фиг.6 представляет собой рентгенограмму PXRD для RZB-011, полученного в соответствии с патентом 782.
[0042] Фиг.7 представляет собой рентгенограмму PXRD для RZB-012, полученного в соответствии с патентом 782.
[0043] Фиг.8 представляет собой рентгенограмму PXRD для RZB-013, полученного согласно настоящему изобретению.
[0044] Фиг.9 представляет собой рентгенограмму PXRD для RZB-014, полученного согласно настоящему изобретению.
[0045] На Фиг.10 приведено графическое представление кинетики связывания LCH и оксикарбоната лантана в соответствии с патентом 782 (RZB-011, RZB-012), и LCH/La2O2CO3, полученного согласно настоящему изобретению (RZB-013 и RZB-014), через 10, 20, 30, 40, 50 и 60 минут при постоянном pH 6,5, при 20 градусах Цельсия, измеренных, как предложено в настоящем документе.
[0046] На Фиг.11-20 представлены снимки со сканирующего электронного микроскопа (увеличение 200000) LCH (Фиг.11-13) и LDOC (Фиг.14-15), полученных в соответствии со способами US 7588782, и LDOC, полученного в соответствии со способами настоящего изобретения (Фиг.16-20).
ПОДРОБНОЕ ОПИСАНИЕ
[0047] Хотя настоящее описание заканчивается формулой изобретения, в которой, в частности, показано и точно заявлено настоящее изобретение, считается, что настоящее изобретение будет более понятно из следующего описания. Все проценты и соотношения, используемые в настоящем описании, приведены по массе от общей массы композиции и все измерения проведены при 25°С и нормальном давлении, если не указано иное. Все температуры приведены в градусах Цельсия, если не указано иное. Настоящее изобретение может включать (неограниченное) или по существу состоять из компонентов настоящего изобретения, а также других ингредиентов или элементов, описанных в настоящем документе. В настоящем описании термин «содержащий (включающий)» означает перечисленные элементы или их эквивалент по структуре или функции плюс любой другой элемент или элементы, которые не указаны. Термины «имеющий» и «включающий» также следует рассматривать как неограничивающие, если из контекста не следует иное. В настоящем описании термин «по существу состоящий из» означает, что настоящее изобретение может включать ингредиенты в дополнение к перечисленным в формуле изобретения, но только если указанные дополнительные ингредиенты значительно не меняют основные и новые характеристики заявленного изобретения. Предпочтительно, такие дополнительные ингредиенты совсем не будут присутствовать или будут присутствовать только в следовых количествах. Однако может быть возможным включение до примерно 10 масс.% веществ, которые могут значительно менять основные и новые характеристики изобретения, при условии, что сохраняется полезность соединений (в отличие от степени полезности). Все диапазоны, указанные в настоящем описании, включают конечные точки, включая те, которые указывают диапазон «между» двумя значениями. Термины, такие как «примерно», «в целом», «по существу» и т.п.следует рассматривать как модифицирующие термин или значение так, что оно не является абсолютным, но не включает уровень техники, если в настоящем описании не определено иное. Указанные термины будут определяться обстоятельствами, при этом термины, которые они модифицируют, понятны специалисту в данной области техники. Это включает по меньшей мере степень ожидаемой экспериментальной ошибки, ошибки метода и инструментальной ошибки для конкретной методики, применяемой для измерения значения. Полное содержание любых патентов, заявок на патент или других публикаций, упомянутых в настоящем описании, включено в настоящее описание посредством ссылки, как если бы они были полностью изложены в настоящем описании.
[0048] Следует отметить, что тогда как настоящее описание и формула изобретения могут относиться к конечному продукту, такому как, например, таблетка или другая лекарственная форма согласно настоящему изобретению, как, например, содержащему частицы, имеющие определенный размер или распределение, или определенный тип, например, конкретную форму наполнителя, может быть трудно сказать, исходя из конечной лекарственной формы, что данное описание является удовлетворительным. Однако такое описание может быть удовлетворительным, если вещества, используемые до конечного получения (в случае таблетки, например, смешивание и получение состава в виде таблетки), например, соответствуют данному описанию. В действительности, в отношении любого свойства или характеристики конечного продукта, которая не может быть установлена напрямую исходя из лекарственной формы, достаточно, если это свойство присуще компонентам, описанным непосредственно перед конечными этапами получения.
[0049] Когда в данном документе описывают вещество, такое как в данном случае LCH и LDOC, посредством ссылки на рентгенограммы, спектры или другие графические данные, может быть уточнено, что указанные рентгенограммы, спектры или другие графические данные являются «по существу» такими, как показано или изображено на фигуре, или посредством одной или более базовых точек. Под термином «по существу», употребляемом в данном контексте, следует понимать, что рентгенограммы, спектры и другие графические данные могут иметь сдвиги по положениям, относительной интенсивности или другим значениям вследствие ряда факторов, известных специалисту в данной области техники. Например, в области кристаллографической и порошковой рентгеновской дифракции, сдвиги положений пиков или относительной интенсивности одного или более пиков рентгенограммы могут происходить вследствие, без ограничения: используемого оборудования, методики подготовки образца, предпочтительной упаковки и ориентации, источника излучения, ошибки оператора, способа и продолжительности сбора данных и т.п.Однако специалист в данной области техники сможет сравнить фигуры, приведенные в настоящем описании, с рентгенограммой, полученной для неизвестного вещества, и подтвердить ее идентичность как одной из форм, описанных и заявленных в настоящем документе. То же самое относится к другим технологиям, которые могут быть описаны в настоящем документе.
[0050] Кроме того, когда приведена ссылка на фигуру, допускается, и данный документ включает и предполагает, выбор любого количества базовых точек, показанных на указанной фигуре, которые однозначно определяют кристаллическую форму, соль, сольват и/или оптический изомер, в рамках любого связанного и указанного предела погрешности, для целей идентификации.
[0051] Ссылка на молекулу, такую как в данном случае LCH и LDOC, если иное не указано или не является несовместимым с описанием в целом, относится к их любой соли, кристаллической или аморфной форме, оптическому изомеру и/или сольватной форме.
[0052] Когда в настоящем описании молекула или другое вещество определено как «чистое», как правило, это означает, если не указано иное, что указанное вещество является чистым примерно на 99% или более. В целом, это относится к чистоте относительно нежелательных остаточных растворителей, побочных продуктов реакции, примесей и непрореагировавших исходных веществ. В случае полиморфных форм термин «чистый» также означает 99% одного полимера относительно других в соответствующих случаях. Термин «по существу» чистый означает то же самое, что и «чистый» за исключением того, что нижний предел составляет примерно 95% чистоты или более, и подобным образом термин «практически» чистый означает то же самое, что и «чистый» за исключением того, что нижний предел составляет примерно 90% чистоты.
[0053] В соответствии с одним из аспектов настоящего изобретения предложен способ получения соединения лантана и, в частности, гидроксида карбоната лантана со связанной водой или без нее (связанная вода кристаллизации). Было обнаружено, что гидроксид карбонат лантана и его свойства влияют на чистоту фазы, полиморфное состояние, морфологию и характеристики оксикарбоната лантана, полученного из него. В данном способе галогенид лантана (бромид, йодид, фторид, хлорид и т.д.) в водном растворителе подвергают реакции со стехиометрическим избытком карбоната нещелочного металла также, как правило, в воде. В конкретном варианте реализации реакцию проводят при по меньшей мере трехкратном стехиометрическому количестве карбоната нещелочного металла. Стехиометрический избыток способствует поддержанию необходимого pH в ходе реакции, а также обеспечивает превращение всего реагента лантана в гидроксид карбонат лантана. Другие растворители, которые могут быть использованы, включают низкомолекулярные спирты и другие водные растворители.
[0054] Без какого-либо конкретного теоретического обоснования применения, полученная реакция может быть проиллюстрирована следующим уравнением:
2LaCl3(водн.)+3(НН4)2CO3(водн.)+H2O→2LaCO3OH(тв.)+6NH4Cl(водн.)+CO2(г), где (водн.) = водный, (тв.) = твердое вещество и (г) = газ. Другие карбонаты нещелочных металлов также могут быть использованы вместо карбоната аммония. Бикарбонат аммония (NH4HCO3) может быть использован с аналогичными результатами. Соответственно, может быть необходима корректировка количеств реагентов. Кроме того, с использованием бикарбоната труднее поддерживать высокий pH в ходе реакции. Могут быть использованы другие источники карбоната и бикарбоната, при условии, что они являются растворимыми.
[0055] В частности, было обнаружено, что натрийсодержащие карбонатные и бикарбонатные вещества, менее предпочтительны. Без какого-либо конкретного теоретического обоснования действия, даже когда натрий вымывают из полученного гидроксида карбоната лантана, считается, что он влияет на свойства полученного оксикарбоната лантана. Несмотря на то, что способы согласно настоящему изобретению и способы из патента 782 могут обеспечивать относительно большие площади поверхности и малые размеры частиц, считается, что общая эффективная площадь поверхности гидроксидов карбонатов лантана и оксикарбонатов лантана согласно настоящему изобретению относительно больше.
[0056] Термин «относительно большая» означает, что если бы способы из патента 782 и способы согласно настоящему изобретению осуществляли во в целом идентичных условиях, но, например, с использованием карбоната или бикарбоната аммония вместо карбоната натрия, измеряемая методом БЭТ или иным образом площадь поверхности LCH или оксикарбонатов лантана согласно настоящему изобретению была бы даже больше, чем полученная в результате реализации патента 782. Способ с карбонатом аммония согласно настоящему изобретению должен обеспечивать площади поверхности (SA) по методу БЭТ в диапазоне от 1 до 100 м2/г для LCH. Ожидается, что SA LDOC согласно настоящему изобретению будет находиться в диапазоне от примерно 20 до примерно 40 м2/г, тогда как LDOC согласно способу из патента 782 часто будет значительно меньше. Поэтому в настоящем описании термин «относительно большая площадь поверхности по методу БЭТ» относится к большей площади поверхности по методу БЭТ соединения LDOC согласно настоящему изобретению по сравнению с соответствующим соединением в US 7588782, полученным с использованием аналогичных ингредиентов и в схожих условиях, но с использованием способа, описанного в том патенте. Как указано выше, с помощью обоих способов можно получать очень мелкие частицы/большую площадь поверхности. Также без какого-либо конкретного теоретического обоснования действия, может оказаться, что большая пористость веществ, полученных согласно настоящему изобретению, может эффективно увеличивать общую площадь поверхности (или более реакционноспособные поверхности), обеспечивая, в частности, улучшенную кинетику связывания. Это обусловлено пористостью индивидуальных или первичных частиц, не агрегатов. Таким образом, считается, что первичные частицы согласно настоящему изобретению обеспечивают относительно большую пористость, по сравнению с пористостью, измеряемой для частиц, полученных в соответствии с патентом 782. В настоящем описании термин «относительно большая пористость» относится к наблюдению, что общая пористость вещества, полученного в соответствии со способами настоящего изобретения, больше, чем пористость сопоставимого продукта, полученного в соответствии с US 7588782 при всех остальных одинаковых факторах. Более того, в настоящем описании термин «пористость» означает кумулятивный адсорбционный объем пор, определенный с использованием анализатора площади поверхности статического давления с азотом в качестве адсорбата и расчета размера пор методом, описанным в Barrett, Joyner и Halenda (BJH) (Barrett E. P., Loyner L. G. and Halenda P. P., The determination of pore volume and area distributions in porous substances. I. Computations from nitrogen isotherms, J. Am. Chem. Soc. 73 (1951) pp.373-380).
[0057] Подобным образом, в настоящем описании термин «относительно больший объем пор» относится к наблюдению, что общий объем пор вещества, полученного в соответствии со способами согласно настоящему изобретению, больше, чем общий объем пор сопоставимого продукта, полученного в соответствии с US 7588782 при всех остальных одинаковых факторах. В настоящем описании термин «объем пор» относится к кумулятивному адсорбционному объему пор. В одном из вариантов реализации кумулятивный адсорбционный объем пор LDOC согласно настоящему изобретению составляет по меньшей мере 0,015 см3/г. В другом варианте реализации он составляет по меньшей мере 0,020 см3/г.
[0058] Не имеет значения, в чем в конечном итоге может заключаться объяснение, однако наблюдали, что вещества, полученные согласно настоящему изобретению, обладают другими свойствами, чем вещества, полученные в соответствии с патентом 782.
[0059] Например, кроме таких различий, как различия в относительном объеме пор, соединения LCH и LDOC согласно настоящему изобретению, в целом, демонстрируют улучшенную кинетику связывания фосфата по сравнению с соответствующими соединениями, полученными в соответствии с US 7588782. Как приведено выше, термин «улучшенная кинетика связывания фосфата» означает, что если бы кинетику связывания фосфата соединений LDOC из патента 782 и соединений согласно настоящему изобретению измеряли во в целом схожих условиях (например, измерение с использованием анализов методом ICP или ионной хроматографии), способность оксикарбонатов лантана согласно настоящему изобретению связывать фосфат была бы даже выше, чем способность связывать фосфат, характерная соединениям из патента 782 при измерении через 30 минут или меньше и при pH 4,5 или выше.
[0060] Существует ряд параметров, влияющих на получение гидроксида карбоната лантана, включая температуру реакции, pH реакции, концентрацию осадка, смешивание, скорости подачи, чистоту исходных веществ и т.п. И изменения данных параметров реакции могут значительно влиять на технологичность и/или на природу и характеристики оксикарбоната лантана, в конечном итоге полученного из LCH.
[0061] В одном из способов гидроксид карбонат лантана (LCH) получают путем осуществления взаимодействия хлорида лантана с карбонатом аммония в реакции с непрерывной капельной подачей. Количество хлорида лантана подают с фиксированной скоростью, а количество карбоната аммония подают с переменной скоростью. Данные растворы вводят в объем воды при контролируемой температуры и контролируемом перемешивании. Можно поддерживать pH близким к постоянному в ходе реакции, а концентрацию полученного осадка контролируют путем регулирования массового отношения подаваемого хлорида лантана к объему воды в реакторе. После образования осадка его промывают и фильтруют с удалением реакционной соли, которая в данном конкретном случае должна представлять собой хлорид аммония. Это можно осуществлять любым традиционным способом, включая применение стандартного лабораторного фильтрационного аппарата с воронкой Бюхнера (вакуум). LCH можно фильтровать и ресуспендировать в воде, и повторно фильтровать столько раз, сколько необходимо для достижения желаемой проводимости суспензии (показывающей содержание соли). Затем LCH фильтруют последний раз с увеличением нагрузки по твердым веществам для сушки. Можно использовать сушку, при которой осадок LCH на фильтре (как правило, от 40 до 60 массовых процентов твердых веществ) можно загружать в лотки Pyrex и нагревать в сушильной печи с естественной конвекцией, например, конвекционной сушильной печи с выстилкой из нержавеющей стали, в течение 16 часов или более при 110 градусах Цельсия. Можно использовать другие традиционные технологии сушки. Затем вещество можно измельчать в сухом виде и просеивать, например, через 0,6-миллиметровое сито.
[0062] pH данной реакции может варьироваться, но должен быть больше чем pH примерно 4,5. Однако в зависимости от, в частности, используемых температур и концентрации полученного осадка, pH меньше 5 и даже меньше 6 может уменьшать общую площадь поверхности. Полученные вещества также могут испытывать недостатки в аспекте насыпной плотности. Кажется, что тенденция в тестировании, проводимом до сих пор, показывает, что при pH, равном 6,0 или более (до примерно pH 8,0), средняя площадь поверхности по методу БЭТ (БЭТ-SA), в целом, больше. Считается, что площадь поверхности и насыпная плотность улучшаются по мере увеличения pH.
Образцы, указанные в Таблице 1, синтезировали при температуре реакции 85 градусов Цельсия и концентрации LCH 36-45 г/л.
[0063] Данные в Таблице 1 позволяют предположить, что низкий pH, равный 5,5, приводит к осаждению LCH с маленькой SA, который в свою очередь образует LDOC с наблюдаемой маленькой БЭТ-SA (площадь поверхности по методу БЭТ). Также при данном pH наблюдают низкую насыпную плотность, которая, как наблюдали, умеренно коррелирует с БЭТ-SA и, таким образом, не является неожиданной. При pH, равном 6,0 или более, средняя БЭТ-SA больше. По-видимому, БЭТ-SA немного лучше все же при pH, равном 7,0.
[0064] Как показано на Фиг.4, pH, при котором получали LCH, также может играть роль в определении размера агрегатов LDOC, полученного из него. По мере увеличения pH также увеличивался размер агрегатов. Однако исходные данные БЭТ-SA не соответствовали этой тенденции. Таким образом, pH может влиять на относительную силу агломерации агрегатов, а не на фактический размер и площадь поверхности.
[0065] Температура реакции также играет роль. Было обнаружено, что при температурах 75 градусов Цельсия или ниже, или 90 градусов Цельсия или выше, общая площадь поверхности полученного LCH в действительности может быть субоптимальной. Тогда как может быть возможным в зависимости от других условий получать подходящий продукт с желаемой площадью поверхности при температурах ниже 75 и выше 90 градусов Цельсия, процессы, проводимые между этими двумя температурами, могут быть оптимальными. Соответственно, в одном из вариантов реализации температура реакции может составлять от примерно 65 до 110 градусов Цельсия, в другом варианте реализации температура реакции будет находиться в диапазоне от примерно 70 до 100 градусов Цельсия и в другом варианте реализации от 75 до 90 градусов Цельсия. В одном из конкретных вариантов реализации температура реакции будет находиться в диапазоне от примерно 80 до примерно 85 градусов Цельсия. В Таблице 2 ниже показано влияние температуры на БЭТ-SA и некоторое влияние на технологичность.
[0066] Данные показывают, что как при 75°С, так и 90°С, БЭТ-SA уменьшается. Средняя БЭТ-SA является максимальной при 80°С и 85°С. Кроме того, при 75°С большинство партий образовывали гель во время реакции, что указывает на соответствующую проблему с технологичностью. Кроме того, при данной температуре осадки на фильтре сохраняли очень высокое содержание влаги, что довольно усложняет удаление реакционной соли посредством промывки. Следует отметить, что хотя 100% веществ образовывали гель при температуре реакции 80°С, все три образца данной группы также обрабатывали при концентрации 55-60 г/л, которая, как скоро будет отмечено, также создает проблемы, связанные с образованием геля и фильтрацией. Более высокие температуры могут больше подходить при более низких концентрациях.
[0067] Концентрация осадка также может играть роль, в частности, в аспекте технологичности. Если указанная концентрация слишком высока, вязкость становится слишком большой и кажется, что вещество «образует гель», как вкратце отмечено выше. Это затрудняет дальнейшую обработку. Фильтрация затрудняется, время сушки может увеличиваться и может происходить влияние на общие характеристики полученного вещества. Конечно, в зависимости от других используемых условий, таких как, например, pH и температура, возможен более широкий диапазон концентраций осадка. Однако концентрация осадка в общем должна находиться в диапазоне от примерно 20 до примерно 90 грамм/литр, а в другом варианте реализации от примерно 30 до примерно 60 грамм/литр. В другом варианте реализации концентрация осадка должна находиться в диапазоне от примерно 35 до примерно 55 грамм/литр. В Таблице 3 суммировано влияние концентрации LCH на возможность обработки LCH во время реакции и фильтрации, и промывки.
[0068] Указанные данные позволяют предположить, что повышение концентрации снижает способность обработки LCH в ходе реакции. 100% партий с использованием концентрации больше 55 г/л в данных условиях образовывали гель, и многие приводили к высокому содержанию влаги в осадке, равному примерно 70%. По-видимому, в этих условиях концентрацию необходимо поддерживать ниже 55 г/л для обеспечения контроля обработки в данных условиях.
[0069] В зависимости от используемых технологических параметров могут быть получены различные полиморфные фазы LCH. В одном из желательных вариантов реализации процесс осуществляют таким образом, что полученное вещество имеет высоко сферическую морфологию и порошковую рентгенограмму, схожую с рентгенограммой из известной карты 26-815 ICDD (Международный центр дифракционных данных, 12 Campus Blvd., Newton Square, PA 19073-3273) См. Фиг.1A и 1С. При осуществлении в субоптимальных условиях, процесс может приводить к получению вещества, как правило, с меньшей площадью поверхности, которое также может содержать относительно высокий процент другой полиморфной формы, рентгенограмма PXRD которой наиболее точно соответствует файлу картотеки ICDD no. 49-981. Морфология также, в целом, принимает игольчато- и пластиноподобную структуру. См. Фиг.1В и 1D. Необходимо применение способов, описанных в настоящем документе, для получения более высокого процента полиморфной формы, имеющей порошковую рентгенограмму 26-815. Таким образом, в соответствии с одним из аспектов настоящего изобретения LCH, полученный и используемый на дальнейших этапах обработки, будет представлять собой более чем на 50% полиморфную форму 26-815, и в одном из вариантов реализации по меньшей мере примерно 90%) 26-815 данной полиморфной формы относительно других полиморфных форм. В другом варианте реализации процент полиморфной формы 26-815 составляет 95%о или более и в другом варианте реализации 99% или более.
[0070] В соответствии с другим аспектом настоящего изобретения LCH, полученный с использованием карбоната нещелочного металла, затем обрабатывают путем нагрева или обжига, как правило, при высоких температурах с получением оксикарбоната лантана и, в частности, LDOC. Температура и время обжига могут влиять на полученные свойства LDOC, такие как, например, кристалличность, полиморфная форма, пористость, площадь поверхности и насыпная плотность. Однако считается, что влияние условий обжига играет менее важную роль, чем условия, используемые для получения исходного вещества LCH, и природа этого исходного вещества в аспекте этих же свойств.
[0071] Температура обжига (означающая температуру порошка LCH во время обжига), в целом, может находиться в диапазоне от примерно 400 до примерно 700, а чаще от примерно 440 до примерно 640 градусов Цельсия. Но чаще обжиг все же осуществляют при температуре от примерно 500 до 600 градусов Цельсия (например, 550 градусов Цельсия). Минимальное количество времени, при котором применяют данные температуры, зависит от ряда факторов, включая, например, количество вещества и используемую температуру. Однако, в целом, данные температуры будут применять в течение как минимум примерно двух часов и в другом варианте реализации трех часов или больше. Тогда как нет верхнего предела количества времени, которое может быть использовано, время воздействия будет зависеть от этих температур, при которых достигается точка падения эффективности. Соответственно, в целом, вещество не будут подвергать данным температурам в течение более чем примерно одного дня.
[0072] Согласно настоящему изобретению можно использовать различные способы охлаждения, но предпочтительно, обожженное вещество постепенно охлаждают в течение периода времени, составляющего нескольких часов, как, например, в течение периода времени, составляющего примерно восемь часов.
[0073] При осуществлении способа согласно настоящему изобретению было обнаружено, что полученные вещества могут обладать рядом свойств. В целом, LCH в соответствии со способом настоящего изобретения будет иметь средний размер агрегатов (D50 по объему агрегатов, измеренный лазерными способами) от примерно 4 до примерно 80 микрон (часто 4-30 микрон), относительно более высокую пористость, площадь поверхности по методу БЭТ, составляющую по меньшей мере примерно 1 квадратный метр на грамм, часто от примерно 1 до примерно 100 м2/г, насыпную плотность от примерно 0,1 до примерно 1,1 ив другом варианте реализации от примерно 0,5 до примерно 0,8 г/см3, и/или содержание щелочного металла примерно 5 масс.% или меньше (на основе щелочного металла с помощью ICP). Содержание щелочного металла также может составлять 0,3 масс.%) или меньше, или 0,1 масс.%) или меньше (на основе щелочного металла с помощью ICP).
[0074] Подобным образом, оксикарбонат лантана и, в частности, LDOC согласно настоящему изобретению будет иметь средний размер частиц (D50 по объему агрегатов, измеренный лазерными способами) от примерно 4 до примерно 80 микрон, относительно более высокую пористость, площадь поверхности по методу БЭТ, составляющую по меньшей мере примерно 20 квадратных метров на грамм и часто от примерно 30 до примерно 40 м2/г, насыпную плотность от примерно 0,1 до примерно 1,1 и в другом варианте реализации от примерно 0,5 до примерно 0,8 г/см3 и/или содержание щелочного металла примерно 0,75 масс.% или меньше. В некоторых вариантах реализации количество присутствующего щелочного металла составляет 0,4 масс.% или меньше и в других вариантах реализации 0,2 масс.% или меньшее (все рассчитано на основе щелочного металла, определенного с помощью ICP). В некоторых вариантах реализации объем пор составляет по меньшей мере 0,015 см3/г и в других вариантах реализации объем пор составляет по меньшей мере 0,020 см3/г.
[0075] Следует отметить, что измерения среднего размера частиц, описанные в настоящем документе, представляют собой D50 по объему агрегатов. Данные агрегаты состоят из индивидуальных частиц, имеющих размер (часто называемый размером первичных частиц), который намного меньше. Размер первичных частиц можно оценить в некоторой степени эмпирически на основе изображений SEM или можно оценить на основе данных PXRD с использованием уравнения Шеррера. Размер частиц также можно оценить путем решения следующего уравнения: Средний оцениваемый размер частиц = 6000/БЭТ/относительная плотность. Для вещества La2O2CO3 с площадью поверхности по методу БЭТ, равной 25 м2/г, и относительной плотностью 5,15, это означает, что средний оцениваемый размер частиц (для первичных частиц) составляет примерно 47 нанометров по сравнению со средним оцениваемым размером агломератов, измеренным лазерным способом, составляющим примерно 7 микрон. Средний размер первичных частиц может находиться в диапазоне от примерно 50 до примерно 300 нм.
[0076] При реализации настоящего изобретения наблюдали интересное явление, которое не наблюдали при реализации на практике способов, описанных в патенте 782. В обоих способах получают некоторую форму LCH и обжигают с образованием LDOC. С точки зрения полиморфных форм полученный LDOC из обоих способов может быть одинаковым. В некоторых вариантах реализации LDOC демонстрирует порошковую рентгенограмму, обнаруживаемую в файле картотеки ICDD 037-0804 или 023-0322, хотя 037-0804 является предпочтительным. (В патенте 782 рентгенограмма XRD файла картотеки ICDD 023-0322 была обозначена как La2CO5, тогда как рентгенограмма файла картотеки ICDD 037-0804 была идентифицирована как La2O2CO3, и эта номенклатура сохраняется в настоящем описании.) Характеристические пики для LCH, полученного в соответствии с патентом 782, обнаружены на 15,88, 20,44, 23,76, 29,94, 38,18 и 43,46 градусах 2-тета±0,1 градус 2-тета. Характеристические пики для LCH, полученного согласно настоящему изобретению, обнаружены на 17,76, 24,44, 30,39, 42,96 и 43,94 градусах 2-тета±0,1 градус 2-тета. Вещество La2O2CO3, полученное согласно настоящему изобретению, имеет характерные пики на 11,10, 25,86, 30,40, 33,84 и 44,39 градусах 2-тета±0,1 градус 2-тета. Однако интересно то, что морфология LDOC, полученного этими разными способами - из LCH, полученного по-другому - отличается друг от друга. Их некоторые соответствующие свойства, такие как насыпная плотность и площадь поверхности, имеют тенденцию оставаться достаточно согласующимися между LCH и LDOC, когда эти вещества получают согласно настоящему изобретению. Однако этого нельзя сказать о площади поверхности и морфологии в результате реализации патента 782, которые, как отмечали, значительно менялись. Следует отметить, что в Таблице 1 патента 782, например, LCH (определенный там как La2O(CO3)2.×H2O) имел согласованно большую площадь поверхности по методу БЭТ, чем любой оксикарбонат лантана.
[0077] Как показано на Фиг.2, довольно согласованную связь наблюдали между LCH и LDOC, полученными с использованием способа согласно настоящему изобретению. Тот факт, что площадь поверхности по методу БЭТ резко не менялась при обжиге также помогает продемонстрировать важное значение способа, используемого для получения LCH, и важное значение LCH, полученного согласно настоящему изобретению. Фиг.3 доказывает схожее положение, иллюстрируя тот факт, что насыпная плотность также имеет тенденцию оставаться схожей.
[0078] Предпочтительно, чтобы количество полиморфной формы 037-0804 превосходило количество любой другой полиморфной формы по массе. В одном из вариантов реализации количество полиморфной формы 037-0804 составляет более 50% от всех присутствующих полиморфных форм, и в другом варианте реализации по меньшей мере 90% присутствующих полиморфных форм LDOC представляют собой La2O2CO3. В другом варианте реализации полиморфная форма 037-0804 (La2O2CO3) присутствует в количестве, составляющем по меньшей мере 95 масс.% относительно других полиморфных форм, и в другом варианте реализации - по меньшей мере 99 масс.%. Также было определено, что кинетика связывания фосфата LDOC, полученного согласно настоящему изобретению, по сравнению с LDOC, полученным способом из патента '782, также отличается. При pH 3 или меньше, связывание фосфата для обоих веществ было примерно одинаковым. Однако как показано на Фиг.10, при pH примерно 6,5 (pH, как правило, обнаруживаемый в кишечнике), количество фосфата, связанное LDOC согласно настоящему изобретению через 60 минут, составляло приблизительно 240 мг связанного РО4 на грамм соединения, при этом количество, связанное LDOC, полученным в соответствии с патентом 782, составляло только примерно 118 мг связанного РО4 на грамм соединения. Следовательно, в одном из вариантов реализации оксикарбонат лантана и в другом варианте реализации LDOC согласно настоящему изобретению демонстрируют кинетику связывания при pH 6,5 через 60 минут, составляющую по меньшей мере 150 мг PO4 на грамм оксикарбоната лантана/LDOC. В другом варианте реализации оксикарбонат лантана и LDOC согласно настоящему изобретению демонстрируют кинетику связывания, составляющую по меньшей мере примерно 180 мг PO4 на грамм соединения, и в другом варианте - по меньшей мере примерно 200 мг PO4 на грамм соединения. Площадь поверхности по методу БЭТ тестируемого вещества составляла 6-7 м2/г для RZB012 (оксикарбонат лантана в соответствии с патентом 782) и составляла примерно 33,9 для La2O2CO3 согласно настоящему изобретению. Более того, считается, что характеристики пористости, насыпной плотности и текучести LDOC, полученного согласно настоящему изобретению, превосходили указанные характеристики, полученные в соответствии с описанием патента 782.
[0079] Размер агрегатов, описанный в настоящем документе, определяют либо путем сканирующей электронной микроскопии (SEM), либо лазерной дифракции на Coulter LS230. Как можно увидеть на Фиг.1А, партия 100808, по-видимому, имеет достаточно равномерную 100-200 нм (0,1-0,2 мкМ) сферическую форму, тогда как, кажется, что стержни и пластины партии 100908 на Фиг.1 В больше на порядок величины. Но данные частицы кажутся более агрегированными.
[0080] Однако D10, D50 и D90 по объему агрегатов партии 100808 каждый составлял 6,8, 47,0 и 114,0 мкМ соответственно. Это не соответствует визуальным изображениям SEM и снова позволяет предположить агрегацию.
[0081] LCH и LDOC согласно настоящему изобретению вводят посредством пероральной доставки. Можно использовать любое известное устройство или лекарственную форму для пероральной доставки при условии, что они согласуются с соответствующими руководствами для лекарственных средств. Лекарственные средства включают глотательные таблетки (таблетки, не предназначенные для растворения в полости рта, а предназначенные для глотания), глотательные таблетки, как правило, в форме капсул, прессованные лекарственные формы, глотательные твердые желатиновые капсулы, глотательные мягкие гелевые капсулы, растворимые во рту таблетки, растворимые во рту таблетки в виде капсул, растворимые во рту твердые желатиновые капсулы, растворимые во рту мягкие желатиновые капсулы, жевательные таблетки, жевательные таблетки в виде капсул, жевательные капсулы, порошки, капсулы, содержимое которых может быть высыпано, разлагающиеся во рту пленки, пищевые продукты, продукты со сладким наполнителем, жевательные резинки, сиропы, суспензии, эмульсии или дисперсии. Часто, из-за проблем с почками субъектам с гиперфосфатемией необходимо ограничивать потребление жидкости. Следовательно, предпочтительны составы, которые можно принимать без или с ограниченными количествами жидкости. Поэтому, например, согласно настоящему изобретению предполагаются составы в форме, например, зерен, жевательных или измельченных таблеток, порошка или просеянных гранул, которые можно посыпать на пищу.
[0082] Способы приготовления различных лекарственных форм, описанных в настоящем документе, хорошо известны специалисту в данной области техники и указанные лекарственные формы могут быть получены с использованием традиционных способов.
[0083] Кроме активного фармацевтического ингредиента или «АФИ» (LCH или LDOC) лекарственные формы согласно настоящему изобретению также могут содержать другие или вторичные АФИ. Они могут включать другие типы фосфатсвязывающих веществ, такие как севеламера гидрохлорид, продаваемый под товарным знаком РЕНАГЕЛЬ, и карбонат лантана, продаваемый под товарным знаком ФОСРЕНОЛ. Данные вещества могут быть смешаны с LCH и/или LDOC, или могут быть разделены на слои или иным образом. В другом варианте реализации одну или более лекарственных форм согласно настоящему изобретению можно принимать с одной или более лекарственными формами РЕНАГЕЛЯ, ФОСРЕНОЛА или некоторых других дополнительных АФИ (отличных от LCD или LDOC). Данные лекарственные формы можно принимать вместе, например, с едой или после еды, или их можно принимать даже с интервалом в несколько часов.
[0084] Другие АФИ, которые могут быть введены в дополнение к LCH и/или LDOC, включают, без ограничения, системно распространяемые фармацевтические ингредиенты, витамины, минералы, пищевые добавки, а также системно нераспространяемые лекарственные средства. Комбинация или смесь любых из вышеуказанных веществ также предполагается настоящим изобретением. Фармацевтические ингредиенты могут включать, без ограничения, антацидные средства, анальгетики, стимуляторы, улучшающие сон средства, снотворные средства, жаропонижающие средства, противомикробные средства, малые транквилизаторы, слабительные средства, антидепрессанты, антидиуретические средства, ветрогонные средства, спазмолитические средства, противовоспалительные средства, антибиотики, мочегонные средства, анорексические средства, антигистаминные средства, противоастматические средства, антидиуретические средства, ветрогонные средства, средства против мигрени, спазмолитические средства, седативные средства, средства для лечения гиперактивности, антигипертензивные средства, транквилизаторы, противоотечные средства, иммунодепрессанты, противораковые средства, противовирусные средства, противопаразитарные средства, противогрибковые средства, противорвотные средства, антидепрессанты, противосудорожные средства, местные анестетики, вазоактивные агенты, противоастматические средства, миорелаксанты, лекарственные средства от паркинсонизма, антипсихотические средства, гемопоэтические факторы роста, антигиперлипидемические средства, антикоагулянты, фибринолитики, антитромботические средства, гормоны, терапевтические белки и пептиды, противоаритмические средства, антиангинальные средства, бета-блокаторы и комбинации указанных средств. В качестве АФИ согласно настоящему изобретению также включены лекарственные средства и фармацевтически активные ингредиенты, описанные в патенте США No. 5234957 Mantelle, в столбцах с 18 по 21. Данный текст Mantelle включен в настоящее описание посредством в ссылки. В одном из вариантов реализации согласно настоящему изобретению АФИ предпочтительно представляют собой фармацевтические агенты, имеющие высокую вероятность злоупотребления людьми. В другом предпочтительном варианте реализации настоящего изобретения АФИ представляет собой обезболивающее средство, такое как наркотический или ненаркотический анальгетик, указанный на страницах THER-2 и THER-3 справочника Мерк (Merck Index), 13th Ed., Published by Merck & Co., Inc., of Whitehouse Station, N.J., copyright 2001, включенного в настоящее описание посредством в ссылки. Наркотические анальгетики включают, но не ограничиваются ими, анальгетики, болеутоляющие средства, опиаты, такие как оксикодон (oxycodone), кодеин (codeine), гидрокодон (hydrocodone), морфин (morphine), гидроморфон (hydromorphone), оксиморфон (oxymorphone), метадон (methadone), пропоксифен (propoxyphene), меперидин (meperidine), фентанил (fentanyl), бупренорфин (buprenorphine), буторфанол (butorphanol), дезоцин (dezocine), левометадил ацетат (levomethadyl acetate), леворфанол (levorphanol), налбуфин (nalbuphine), пентазоцин (pentazocine), ремифентанил (remifentanil), суфентанил (sufentanil), трамадол (tramadol); Стимуляторы, такие как амфетамин (amphetamine), метамфетамин (methamphetamine), дексамфетамин (dexamphetamine), метилфенидат (methylphenidate), дексметилфенидат (dexmethylphenidate), пемолин (pemoline); Седативные и снотворные средства, включая барбитураты, такие как амобарбитал (amobarbital), апробарбитал (aprobarbital), бутабарбитал (butabarbital), мефобарбитал (mephobarbital), фенобарбитал (phenobarbital), секобарбитал (secobarbital); бензодиазепины, такие как алпразолам (alprazolam), клоназепам (clonazepam), диазепам (diazepam), эстазолам (estazolam), флуразепам (flurazepam), халазепам (halazepam), лоразепам (lorazepam), мидазолам (midazolam), квазепам (quazepam), темазепам (temazepam), триазолам (triazolam), празепам (prazepam), оксазепам (oxazepam), другие классы лекарственных средств включают модафинил (modafinil) и армодафинил (armodafinil). Все из указанных лекарственных средств будут вводить в обычно вводимых количествах.
[0085] В настоящем описании термин «витамин» относится к следовым органическим веществам, необходимым в рационе питания. Для целей настоящего изобретения термин «витамин (витамины)» включает, без ограничения, тиамин, рибофлавин, никотиновую кислоту, пантотеновую кислоту, пиридоксин, биотин, фолиевую кислоту, витамин В12, липоевую кислоту, аскорбиновую кислоту, витамин А, витамин D, витамин Е и витамин К. Также в термин «витамин» включены их коферменты. Коферменты представляют собой особые химические формы витаминов. Коферменты, которые могут быть подходящими для целей настоящего изобретения, включают тиаминпирофосфаты (ТПФ), флавинмононуклеотид (ФМН), флавинадениндинуклеотид (ФАД), никотинамидадениндинуклеотид (НАД), никотинамидадениндинуклеотидфосфат (НАДФ), Кофермент А (СоА), пиридоксальфосфат, биоцитин, тетрагидрофолиевую кислоту, кофермент В12, липоиллизин, 11-цис-ретинал и 1,25-дигидроксихолекальциферол. Термин «витамин (витамины)» также включает холин, карнитин и альфа-, бета- и гамма-каротины. При употреблении в отношении витамина или минерала термин «эффективное количество» означает количество по меньшей мере примерно 10% от рекомендованной суточной нормы («RDA») США данного конкретного ингредиента для пациента. Например, если предполагаемый ингредиент представляет собой витамин С, то эффективное количество витамина С будет включать количество витамина С, достаточное для обеспечения 10% или более от RDA.
[0086] Предполагается, что лекарственные формы согласно настоящему изобретению также могут содержать по меньшей мере один другой ингредиент или фармацевтически приемлемый наполнитель. Данный наполнитель может включать, но не ограничивается ими, маскирующие вкус агенты, покрытия, разбавители массы, связующие вещества, наполнители, сахара, подсластители, включая искусственные подсластители, полимеры, ароматизаторы, красители, смазывающие вещества, вещества, способствующие скольжению, био- или мукоадгезивы, модификаторы вязкости, поверхностно-активные вещества, буферы, разрыхлители, добавки для прессования/инкапсуляции, пластификаторы, агенты, понижающие трение/антиэлектростатические агенты и т.д. Количество любого одного или более из данных наполнителей будет зависеть, в частности, от количества и типа АФИ, размера частиц АФИ и вида лекарственной формы, формы лекарственной формы, необходимой скорости высвобождения активного вещества (например, в течение нескольких секунд или минут после приема внутрь), желаемого места высвобождения активного вещества в организме, от того, сколько используют ингредиентов, какие ингредиенты используют, количества лекарственных форм, которые будут составлять дозу, количества АФИ на дозу и т.п.
[0087] Агент (агенты), маскирующий вкус, согласно настоящему изобретению включает все агенты, которые, как известно, используют в качестве агентов, маскирующих вкус, в данной области техники. Предпочтительные агенты, маскирующие вкус, согласно настоящему изобретению могут включать Эудрагит Е-100 (Eudragit Е-100), этилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, метилцеллюлозу, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, шеллак, зеин, карбомеры и жиры. Агенты, маскирующие вкус, могут быть использованы в обычных количествах и предпочтительно в количестве от примерно 1 до примерно 5% от массы всей лекарственной формы, и более предпочтительно в количестве от примерно 2 до примерно 5% от массы всей лекарственной формы, и наиболее предпочтительно в количестве от примерно 2% до примерно 3% от массы всей лекарственной формы.
[0088] Связующие вещества могут представлять собой любые вещества, которые, как известно, используют в качестве связующих веществ. Данные вещества используют для придания когезионной способности порошкам и обеспечения необходимого связывания для образования гранул, которые можно прессовать в твердые таблетки, обладающие приемлемой механической прочностью для выдерживания последующей обработки или транспортировки и манипуляции. Некоторые связующие вещества, которые могут быть подходящими для целей настоящего изобретения, включают акацию, трагакант, желатин, крахмал (как модифицированный, так и немодифицированный), целлюлозные вещества, такие как метилцеллюлоза, этилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза и натрийкарбоксиметилцеллюлоза, альгиновые кислоты и их соли, например, альгинат натрия, алюмосиликат магния, полиэтиленгликоль, гуаровую камедь, ксантановую камедь, полисахаридные кислоты, бентониты, сахара, инвертные сахара и т.п., жиры, воски, карбопол, повидон, поливинилпирролидон, полиметакрилат и другие акриловые и виниловые полимеры. Связующие вещества могут быть использованы в обычных количествах и предпочтительно в количестве от примерно 0 до примерно 50 и более предпочтительно от примерно 2 до примерно 10% от массы всей лекарственной формы.
[0089] Агенты для покрытия в случае, когда включены, как правило, присутствуют в следовом количестве по массе. Не ограничивающие примеры агентов для покрытия включают фталат целлюлозы, ацетатфталат целлюлозы, этилцеллюлозу, геллановую камедь, мальто декстрин, метакрилаты, метилцеллюлозу, микрокристаллическую целлюлозу и каррагинан, шеллак, сахарозу и производные поливинилового спирта. В случае, когда используют покрытие, его можно добавлять, например, для замедления распада таблетки после введения (например, полимерное покрытие) или для продления срока годности путем защиты таблетки от поглощения влаги.
[0090] Наполнители могут представлять собой любые вещества, известные для применения в качестве наполнителей. Некоторые наполнители, которые могут быть полезны в настоящем изобретении, включают маннит, декстрозу, сорбит, лактозу, сахарозу и карбонат кальция. Наполнители могут быть использованы в обычных количествах и предпочтительно в количестве от примерно 0 до примерно 90, и более предпочтительно от примерно 10 до примерно 50.
[0091] Наиболее предпочтительным типом наполнителя, который можно использовать, являются сахара. Сахара, которые могут быть использованы в настоящем изобретении, включают сахар, сахарные спирты, кетозы, сахариды, полисахариды, олигосахариды и т.п., а также целлюлозы и модифицированные целлюлозы.
[0092] Сахара также могут включать сахара для прямого прессования и/или непрямого прессования. Наиболее предпочтительные сахара для непрямого прессования включают, без ограничения, декстрозу, маннит, сорбит, трегалозу, лактозу и сахарозу. Конечно, данные сахара, как правило, существуют в виде либо сахара для прямого прессования, т.е. сахара, который был модифицирован для увеличения его прессуемости и/или текучести, либо сахара для непрямого прессования, который не обладает достаточной текучестью и/или прессуемостью, позволяющей его использовать в высокоскоростной обработке и многотаблеточных прессах без какого-либо добавления, такого как, без ограничения, вещество, способствующее скольжению, для увеличения текучести, грануляция для увеличения текучести и/или прессуемости и т.п.Конечно, такие способы, как грануляция, также можно использовать для превращения какого-либо сахара, который изначально имеет достаточную текучесть и прессуемость, чтобы считаться сахаром для прямого прессования до обработки, в сахар для непрямого прессования. Это можно измерить путем прямого прессования таблеток, полученных только из сахара, и сравнения текучести и прессуемости как до, так и после обработки. Если текучесть и/или прессуемость уменьшаются после обработки, указанное вещество, вероятно, превратилось в сахар непрямого прессования. Однако очевидно, что то, будет ли достаточно уменьшения свойств для необходимости добавки или дополнительной обработки перед использованием сахара в коммерческом процессе будет зависеть от ряда факторов, включая используемое количество, тип используемого оборудования для обработки и общий состав. Однако, в целом, необходима некоторая дополнительная обработка или добавка. Хотя это и не является определяющим, иногда у сахара для непрямого прессования по меньшей мере 90% частиц будут меньше примерно 200 микрон и более предпочтительно 80% меньше примерно 150 микрон.
[0093] Общее количество сахара может находиться в диапазоне от примерно 0 до примерно 90%. Более предпочтительно, количество сахара будет находиться в диапазоне от примерно 5% до примерно 75% и даже более предпочтительно от примерно 10% до 50%. Другие неуглеводные разбавители и наполнители, которые могут быть использованы согласно настоящему изобретению, включают, например, дигидратированный или безводный карбонат кальция, безводный или гидратированный сульфат кальция и кальция лактата тригидрат. При использовании, данные вещества присутствуют в количестве в диапазоне от 0 до примерно 90%, более предпочтительно от примерно 5% до примерно 75% и наиболее предпочтительно от примерно 10% до примерно 50% от массы лекарственной формы.
[0094] Подсластители для использования с составами согласно настоящему изобретению включают, например, фруктозу DC; мед DC; мальтодекстрин; мальтозу DC; маннит DC, мелассу DC; сорбит, кристаллический; сорбит, специальный раствор; и сахарозу DC. Данные вещества могут быть использованы в обычных количествах.
[0095] Также могут быть использованы искусственные подсластители и они могут представлять собой любые вещества, которые, как известно, используют в качестве искусственных подсластителей. Некоторые искусственные подсластители, которые могут быть подходящими для целей настоящего изобретения, включают, без ограничения, сахарин, аспартам, аспартам и лактозу, аспартам декстрозу, сукралозу, неотам и ацесульфам калия. Искусственные подсластители могут быть использованы в обычных количествах и предпочтительно в количестве в диапазоне от примерно 0,1% до примерно 2%.
[0096] Ароматизаторы могут представлять собой любые вещества, которые известны для применения в качестве ароматизаторов. Ароматизаторы, которые могут быть подходящими для целей настоящего изобретения, могут включать синтетические ароматизированные масла и ароматические вещества и/или натуральные масла, экстракты растений, листьев, цветов, фруктов и т.д., и их комбинации. Данные масла могут включать коричное масло, винтергриновое масло, масла перечной мяты, гвоздичное масло, лавровое масло, анисовое масло, эвкалиптовое масло, тимьяновое масло, масло кедровых листьев, масло мускатного ореха, шалфейное масло, масло горького миндаля и масло кассии. В качестве ароматизаторов также подходят ваниль, цитрусовое масло, включая лимонное, апельсиновое, банановое, виноградное масло, масло лайма и грейпфрутовое масло, и фруктовые эссенции, включая яблочную, грушевую, персиковую, клубничную, малиновую, вишневую, сливовую, ананасовую, абрикосовую эссенции и т.д.
[0097] Ароматизаторы могут быть использованы в обычных количествах и предпочтительно в количестве в диапазоне от примерно 0,01% до примерно 3% от массы лекарственной формы и более предпочтительно от примерно 0,1% до примерно 2,5% от массы лекарственной формы, и наиболее предпочтительно от примерно 0,25% до примерно 2% от массы лекарственной формы.
[0098] Красители могут представлять собой любые вещества, которые известны для применения в качестве красителей. Красители, подходящие для целей настоящего изобретения, могут включать диоксид титана и красители, подходящие для продуктов питания, такие как красители, известные как красители F.D.& С, и натуральные красители, такие как экстракт кожуры винограда, порошок красной свеклы, бета-каротин, аннатто, кармин, куркума, паприка и т.д. Красители могут быть использованы в обычных количествах и предпочтительно в количестве в диапазоне от примерно 0,001% до примерно 1% от массы лекарственной формы.
[0099] Смазывающие вещества могут представлять собой любые вещества, которые известны для применения в качестве смазывающих веществ, и включают, например, глицеринпальмитостеарат, стеарат магния; стеариновую кислоту; стеарат кальция; стеарат щелочного металла; тальк; и стеарилфумарат натрия. Смазывающие вещества, которые могут быть подходящими для целей настоящего изобретения, могут включать внутренние или наружные смазывающие вещества. Внутренние смазывающие вещества могут включать магниевые, кальциевые, цинковые соли стеариновой кислоты, гидрогенизированные и частично гидрогенизированные растительные масла, животные жиры, полиэтиленгликоль, полиоксиэтиленмоностеарат, тальк, легкие минеральные масла, бензоат натрия, лаурилсульфат натрия, оксид магния и т.п.Также могут быть использованы порошкообразные смазывающие вещества; неограничивающие примеры порошкообразных смазывающих веществ включают глицерилбегенат. Смазывающие вещества могут быть использованы в обычных количествах и предпочтительно в количестве от примерно 0,1% до примерно 5% от массы лекарственной формы, от примерно 0,1% до примерно 3,0%, более предпочтительно от примерно 0,25% до примерно 2,5% и наиболее предпочтительно от 0,5% до 2%.
[0100] Модификаторы вязкости могут представлять собой любые вещества, которые известны для применения в качестве модификаторов вязкости. Некоторые модификаторы вязкости, которые могут быть подходящими для целей настоящего изобретения, включают, без ограничения, альгинат натрия, гидроксипропилметилцеллюлозу (ГПМЦ), гидроксиэтилцеллюлозу (ГЭЦ), карбоксиметилцеллюлозу натрия (КМЦ натрия), поливинилпирролидон (PVP), конжаковую муку, каррагинан, ксантановую камедь, другие гидрофильные полимеры или их смеси. Модификаторы вязкости могут быть использованы в обычных количествах и предпочтительно в количестве от примерно 1% до примерно 40%, и более предпочтительно в количестве от примерно 2% до примерно 20% от массы лекарственной формы.
[0101] Поверхностно-активные вещества могут представлять собой любые вещества, которые известны для применения в качестве поверхностно-активных веществ. Некоторые поверхностно-активные вещества, которые могут быть подходящими для целей настоящего изобретения, включают, без ограничения, различные сорта следующих коммерческих продуктов: Арлацель® (Arlacel®), Твин® (Tween®), Капмул® (Capmul®), Centrophase®, Кремофор® (Cremophor®), Лабрафак® (Labrafac®), Лабрафил® (Labrafil®), Лабрасол® (Labrasol®), Миверол® (Myverol®), Тагат® (Tagat®) и любые нетоксичные коротко цепочечные и среднецепочечные спирты. Поверхностно-активные вещества могут быть использованы в обычных количествах и предпочтительно в количестве от примерно 0,01% до примерно 5%, и более предпочтительно в количестве от примерно 0,1% до примерно 2% от массы лекарственной формы.
[0102] Буферы могут представлять собой любые вещества, которые, известны для применения в качестве буферов. Некоторые буферы, которые могут быть подходящими для целей настоящего изобретения, включают любую слабую кислоту или слабое основание, или предпочтительно, любую буферную систему, которая невредна для слизистой оболочки желудочно-кишечного тракта. Указанные вещества включают, но не ограничиваются ими, карбонат натрия, карбонат калия, динатрийгидрофосфат, дигидрофосфат натрия и эквивалентные соли калия. Буферы могут быть использованы в обычных количествах и предпочтительно в количестве от примерно 0,1% до примерно 10%, и более предпочтительно в количестве от примерно 1% до примерно 5% от массы лекарственной формы.
[0103] Разрыхлители, которые могут быть использованы, включают крахмал, целлюлозу, модифицированный крахмал, микрокристаллическую целлюлозу, альгиновую кислоту, глины, вигум (veegum) и суперразрыхлители, включая, без ограничения, перекрестносшитый поливинилпирролидон (PVP), соли кроскармеллозы, такие как кроскармеллоза натрия, производные крахмала, такие как натрия крахмала гликолят. В случае, когда используют такие суперразрыхлители, они традиционно находятся в количестве от примерно 1% до примерно 20%, более предпочтительно от примерно 2% до примерно 10% и наиболее предпочтительно от примерно 2% до примерно 5% от массы готовой лекарственной формы. В добавление к, вместо какой-либо части или вместо какого-либо суперразрыхлителя, лекарственные формы согласно настоящему изобретению могут содержать по меньшей мере одну шипучую пару или разрыхлитель. Данные разрыхлители могут составлять до примерно 20 массовых процентов и предпочтительно от примерно 2% до примерно 10% от общей массы лекарственной формы.
[0104] Конкретные разрыхлители, которые могут быть использованы, включают, например, перекрестносшитые винилпирролидоны (например, ПОЛИКЛАР AT® (POLYCLAR AT®)), перекрестносшитые карбоксиметилцеллюлозы, перекрестносшитые кроскармеллозы (например, АДДИСОЛ® (ADDISOL®)), карбоксиметиламидоны (например, АМИГЕЛЬ® (AMIGEL®)); кросповидон; геллановую камедь; L-HPC; натрия крахмала гликолят; и крахмал DC. Данные разрыхлители в случае, когда включены, как правило, присутствуют в количестве от примерно 0,5 до примерно 15 массовых процентов.
[0105] При необходимости лекарственная форма также может содержать малые количества нетоксичных веществ, таких как смачивающие агенты или эмульгаторы, pH буферные агенты и т.п., например, ацетат натрия, сорбитанмонолаурат, триэтаноламин, ацетат натрия, триэтаноламинолеат, лаурилсульфат натрия, диоктилнатрийсульфосукцинат, полиоксиэтиленовые эфиры сорбитана и жирных кислот.
[0106] Агенты для прессования/добавки для инкапсуляции в случае, когда включены, как правило, присутствует в количестве от 2 до 20 масс.%. Неограничивающие примеры агентов для прессования/добавок для инкапсуляции включают, например, микрокристаллическую целлюлозу (например, АВИЦЕЛ®); PVP с молекулярной массой от 10000 до 30000; карбонат кальция; декстрозу; фруктозу; фруктозу DC; мед DC; ангидрат лактозы; моногидрат лактозы; лактозу и аспартам; лактозу и целлюлозу; лактозу и микрокристаллическую целлюлозу; мальтодекстрин; мальтозу DC; маннит; микрокристаллическую целлюлозу и гуаровую камедь; микрокристаллическую целлюлозу и лактозу; мелассу DC; сорбит, кристаллический; крахмал DC и сахарозу.
[0107] Неограничивающие примеры пластификаторов включают: дибутилсебацат; и поливини л ацетата фталат.
[0108] Понижающие трение/антиэлектростатические агенты в случае, когда включены, как правило, присутствует в количестве от 0,1 до 2,0 массовых процентов. Неограничивающие примеры понижающих трение/антиэлектростатических агентов включают, например, коллоидные диоксиды кремния (например, АЭРОСИЛ® 100/200).
[0109] Кроме способов лечения субъекта, включающих применение фармацевтических составов соединений лантана, описанных в настоящем документе, в других вариантах реализации также предполагается, что LCH и/или LDOC согласно настоящему изобретению могут быть терапевтически введены субъекту в виде части пищи или пищевой добавки. Это может представлять собой продукт питания, продукт со сладким наполнителем, или напиток для потребления человеком или животным, и может быть включено в состав питательного батончика или напитка, как, например, многие продукты, являющиеся источником волокон, для облегчения проглатывания. В таком случае продукт питания можно считать наполнителем.
[0110] Например, LCH и/или LDOC могут быть включены в состав сухого корма для кошек (или любого другого одомашненного млекопитающего) в определенном соотношении. Продукты питания для животных, содержащие LCH и/или LDOC, могут быть получены, как описано в публикации заявки на патент США No. 2009/0317352, полный текст которой включен в настоящее описание посредством ссылки.
[0111] Типичные виды корма для собак содержат источник белка, такой как курица, говядина, баранина, куриная мука или баранья мука. Консерванты, например, токоферолы, ВНТ и ВНА, также являются обычными ингредиентами. Другие ингредиенты могут включать кукурузу, рис и костную муку. Типичные корма для кошек могут содержать, например, рыбную муку, рыбу, яичный продукт, говядину, курицу, рис, кукурузную глютеновую муку, муку из отходов птицепереработки, пшеничную муку, говяжий жир и кукурузу. Корм для лошадей часто содержит такие ингредиенты, как кленовый сироп, мед, яблоко, льняное семя, муку из льняного семени, рисовые отруби и ростки, овес, ячмень, кукурузу и пшеничные отруби.
[0112] Таким образом, композиции согласно настоящему изобретению включают композиции, которые, как правило, могут содержать фосфатсвязывающее вещество в комбинации с кормом для домашних животных. Указанная комбинация может быть в любой подходящей форме. Например, она может быть в форме частиц, зерен, гранул и т.д., содержащих указанное фосфатсвязывающее вещество и корм для домашних животных. В качестве альтернативы, она может быть в форме простой физической смеси компонентов, например, смеси фосфатсвязывающего вещества и корма для домашних животных. Другая форма будет предполагать посыпание композиции, содержащей фосфатсвязывающее вещество, на корм для домашних животных. Затем смесь можно перемешать перед тем, как дать животному.
[0113] На основании вышеизложенного предполагается, что в числе типичных композиций согласно настоящему изобретению включено следующее: частицы, зерна или гранулы, содержащие оксикарбонат лантана или гидроксид карбонат лантана и корм для домашних животных, содержащий по меньшей мере один из следующих ингредиентов: курицу, говядину, баранину, куриную муку или баранью муку, токоферолы, ВНТ и ВНА, кукурузу, рис, костную муку, рыбную муку, рыбу, яичный продукт, говядину, говяжью муку, кукурузную глютеновую муку, муку из отходов переработки птицы, пшеничную муку, говяжий жир, кленовый сироп, мед, яблоко, льняное семя, муку из льняного семени, рисовые отруби и ростки, овес, ячмень и пшеничные отруби.
[0114] В одном из вариантов реализации, когда оксикарбонат лантана или гидроксид карбонат лантана вводят в качестве фосфатсвязывающего вещества, количество, вводимое домашнему животному в ходе одного введения, как правило, находится в диапазоне от примерно 1,0 до примерно 100 мг/кг массы тела. Часто указанное количество находится в диапазоне от примерно 30,0 до примерно 80 мг/кг массы тела. В некоторых случаях количество вводимого оксикарбоната лантана находится в диапазоне от примерно 40,0 до примерно 75,0 мг/кг массы тела. Подходящие диапазоны могут варьироваться в зависимости от субъекта и характера состояния, которое лечат, и специалист в данной области техники может легко их определить.
[0115] Таким образом, на основании вышеизложенного способы согласно настоящему изобретению также включают способ, включающий по меньшей мере этап обеспечения домашнего животного композицией согласно настоящему изобретению в форме для приема внутрь. Настоящее изобретение также относится к способу, включающему по меньшей мере следующие этапы: 1) смешивание связывающего соединения лантана с кормом для домашних животных; и 2) обеспечение домашнего животного указанной смесью в форме для приема внутрь.
[0116] Лекарственные формы, содержащие LCH и LDOC, для потребления человеком или животным могут быть получены традиционным способом с использованием указанных АФИ и различных наполнителей, описанных в настоящем документе. Примеры лекарственных форм для перорального введения, содержащих лантан, например, можно найти в Патенте США No. 5968976, Murrer et al, выданном 19 октября 1999 года, и, в частности, 5 столбце, 8 строка по 6 столбец, 6 строка, включенном в настоящее описание посредством ссылки; патенте США No. 7381428 Ferdinando et al. под названием Стабилизированные композиции карбоната лантана (Stabilized Lanthanum Carbonate Compositions), выданном 3 июня 2008 года, и, в частности примерах в 11 столбце, 54 строка по 13 столбец 13, 59 строка, включенном в настоящее описание посредством ссылки; и патенте США No. 7465465, Haslam et al. под названием Фармацевтический состав, содержащий соединения лантана (Pharmaceutical Formulation Comprising Lanthanum Compounds), выданном 16 декабря 2008 года, и, в частности 1 столбце, 35 строка по 3 столбец, 35 строка; и 5 столбце, 5 строка по 7 столбец, 2 строка; и 8 столбце, 53 строка по 9 столбец, 44 строка, текст которого также включен в настоящее описание посредством ссылки. Все вышеуказанные документы описывают различные лекарственные формы и способы их получения, и относятся конкретно к соединениям лантана, хотя и не к соединениям лантана согласно настоящему изобретению. Тем не менее, в них получают подходящие носители.
[0117] В связи с обнаружением того, что LDOC согласно настоящему изобретению обладает превосходными характеристиками даже по сравнению с LDOC, полученным другим способом, с точки зрения кинетики связывания фосфата при относительно более высоком pH, может быть желательным обеспечивать высвобождение LDOC согласно настоящему изобретению после того, как лекарственная форма (или то, что остается от нее после проглатывания и переработки в желудке) минует желудок и попадает в кишечник. В кишечнике pH обычно начинает увеличиваться и может находиться в диапазоне от примерно 4 до примерно 8 у здоровых пациентов. За счет контроля высвобождения по меньшей мере некоторого количества LDOC согласно настоящему изобретению таким образом, чтобы оно происходило в кишечнике, существует большая вероятность того, что фосфаты, высвобожденные во время переваривания пищи в кишечнике, эффективно связываются. Таким образом, предполагается, что настоящее изобретение включает лекарственные формы композиций лантана, описанных в настоящем документе, с контролируемым высвобождением.
[0118] Лекарственные формы с контролируемым высвобождением, включая, но не ограничиваясь ими, лекарственные формы с отсроченным, пролонгированным или замедленным высвобождением, хорошо известны специалисту в данной области техники и могут быть получены в соответствии с традиционными способами с использованием, например, композиций для покрытия таблеток, пластификаторов, полупроницаемых мембран, pH-независимых и/или pH-независимых покрывающих слоев, пленкообразующих полимеров и т.д. Как правило, модификацию высвобождения можно успешно осуществлять посредством использования энтеросолюбильных покрытий. Ряд разных типов соединений, подходящих для использования в качестве энтеросолюбильных покрытий, известен в данной области техники и включает, например, полимеры ЭУДРАГИТ (EUDRAGIT) (Evonik Röhm GmbH, Дармштадт, Германия). В целом, см. Remington's Pharmaceutical Sciences, 18th Edition, 1990; US 7883722; US 7790755; US 7879362 и приведенные там источники, содержание всех из которых полностью включено в настоящее описание посредством ссылки. В одном из вариантов реализации высвобождение по меньшей мере части соединений согласно настоящему изобретению отсрочивается пока они не достигнут участка в пищеварительном тракте, в котором pH равен 4,5 или более.
[0119] Соединения на основе лантана согласно настоящему изобретению могут быть изготовлены таким образом, чтобы обеспечить уменьшение количества таблеток по сравнению с другими фосфатсвязывающими веществами. Состав, как правило, отличается тем, что его можно проглатывать без разжевывания или разжевав. Составы согласно настоящему изобретению могут содержать следующие вещества: разбавители; связующие вещества; покрытия; добавки для прессования/инкапсуляции; разрыхлители; смазывающие вещества; пластификаторы; понижающие трение/антиэлектростатические агенты; порошкообразные смазывающие вещества; и подсластители, такие как описаны выше.
[0120] В случае, когда состав находится в форме таблетки, она, как правило, имеет объем от примерно 0,3 см3 до примерно 1,2 см3, предпочтительно от примерно 0,35 см3 до примерно 0,50 см3. Каждая таблетка, как правило, содержит достаточное количество фосфатсвязывающего вещества, так что только 3 или менее таблеток необходимо проглатывать каждый день пациенту, страдающему состоянием, связанным с аномально повышенным уровнем фосфата в крови, например, хронической болезнью почек (CKD) и ее различными стадиями; в частности хронической почечной недостаточностью (CRI) или терминальной стадией заболевания почек (ESRD), или общей почечной недостаточностью.
[0121] Как предполагается согласно настоящему изобретению, таблетка для применения в соответствии со способами настоящего изобретения, как правило, может обеспечивать быстрый распад в желудке после проглатывания. Например, желаемое время распада в желудке может составлять менее 30 секунд. В некоторых случаях время распада может составлять 20 секунд или менее. Однако также предполагается проход лекарственных форм согласно настоящему изобретению через желудок для доставки в тонкую кишку. Как очевидно специалисту в данной области техники, доставку таким образом можно осуществлять путем изготовления лекарственной формы с контролируемым высвобождением в соответствии с традиционными способами, и как описано в настоящем документе.
[0122] В идеальном случае лекарственная форма согласно настоящему изобретению (например, таблетка) имеет по существу более длительный срок хранения по сравнению с другими фосфатсвязывающими составами. Например, даже спустя 2 года таблетка, как правило, не должна увеличиваться в объеме более чем на 5 процентов, предпочтительно 2,5 процента, более предпочтительно 1 процент.
[0123] Как описано в настоящем документе, одним из известных показаний для соединений лантана является лечение субъектов, имеющих аномально повышенный уровень фосфата в крови. В настоящем описании термин «аномально повышенный уровень фосфата в крови» относится к более чем примерно 4,5 мг фосфата/дл; нормальный уровень может находиться в диапазоне примерно 2,4-4,5 мг фосфата/дл. Таким образом, одним из известных показаний для соединений лантана является гиперфосфатемия, которая в настоящем описании относится к состоянию пациента, имеющего уровни фосфатов в крови выше примерно 4,5 мг/дл.
[0124] Субъектов, подверженных или страдающих гиперфосфатемией, страдающих или находящихся в группе риска развития хронической болезни почек (CKD), подверженных или страдающих кальцификацией мягких тканей, связанной с хронической болезнью почек, подверженных или страдающих вторичным гиперпаратиреозом, или подверженных или страдающих другими еще неоткрытыми состояниями, требующими контроля абсорбции фосфатов, или иначе связанными с или возникающими в результате аномально повышенного уровня фосфата в крови, можно лечить путем введения терапевтически эффективного количества LCH или LDOC согласно настоящему изобретению.
[0125] Гиперфосфатемия у таких субъектов имеет несколько побочных эффектов. Когда субъект страдает гиперфосфатемией, избыток фосфата в сыворотке осаждает кальций в сыворотке, что вызывает распространенную эктопическую внескелетную кальцификацию. Нежелательное отложение кальция может происходить в сердечно-сосудистой ткани, что приводит к повышенному риску сердечно-сосудистых осложнений, часто приводящих к смерти. Кроме того, повышенный уровень фосфатов в сыворотке уменьшает абсорбцию кальция в кишечнике. Эти два механизма работают одновременно с уменьшением уровней кальция в сыворотке.
[0126] Снижение уровней кальция в сыворотке может вносить вклад в повышение образования паратиреоидного гормона (РТН) и в развитие вторичного гиперпаратиреоза. Более того, последние исследования показывают, что высокие уровни фосфатов могут напрямую стимулировать образование РТН и приводить к вторичному гиперпаратиреозу. Непрерывная стимуляция секреции РТН индуцирует гиперплазию паращитовидной железы и может приводить к тому, что становится необходимой паратиреоидэктомия.
[0127] Считается, что способ согласно настоящему изобретению, включающий введение стабилизированных составов LCH и/или LDOC, не только снижает уровни фосфатов в плазме, но и улучшает следствия CKD у субъектов, подверженных или страдающих данным состоянием, включая, например, гиперфосфатемию, эктопическую внескелетную кальцификацию, гипокальциемию в сыворотке и вторичный гиперпаратиреоз. Однако следует понимать, что настоящее изобретение не ограничивается каким-либо конкретным биохимическим или физиологическим механизмом.
[0128] Субъектов, подверженных или страдающих гиперфосфатемией, можно лечить путем введения терапевтически эффективного количества стабилизированного состава карбоната лантана согласно настоящему изобретению.
[0129] Как указано выше, субъект, которого лечат согласно способам настоящего изобретения, может быть подвержен риску CKD или иметь любую из стадий CKD с первой по пятую, при этом клинические характеристики указанных стадий хорошо известны специалисту в данной области техники. Исходя из этого, подобные патологические состояния также известны в данной области как хроническая почечная недостаточность, терминальная стадия почечной недостаточности и общая почечная недостаточность, и лечение указанных состояний предполагается согласно настоящему изобретению.
[0130] Субъекты, подверженные риску CKD, или имеющие любую из стадий CKD с первой по пятую, которые могут получать лечение, могут иметь один или более из следующих симптомов: уровень фосфатов в крови выше примерно 4,5 мг/дл, концентрация креатинина в плазме крови выше примерно 1,6 мг/дл, азот мочевины крови (BUN) выше примерно 20 мг/дл, какое-либо детектируемое количество крови в моче, концентрация белка в моче выше примерно 100 мг/дл, концентрация альбумина в моче выше примерно 100 мг/дл, концентрация интактного паратиреоидного гормона в крови выше примерно 150 пг/мл, ненормальная скорость клубочковой фильтрации (СКФ) или их комбинацию.
[0131] Кроме того, способы и соединения лантана согласно настоящему изобретению можно использовать для предотвращения прогрессирования патологии почек, например, путем лечения субъекта, имеющего один или более симптомов первой стадии CKD, для предотвращения развития CKD у указанного субъекта, или путем лечения субъекта, имеющего первую стадию CKD, для предотвращения прогрессирования указанного заболевания до второй стадии CKD и т.д.
[0132] Субъекта, имеющего симптом или симптомы CKD, также можно лечить от кальцификации мягких тканей, связанной с CKD, путем введения указанному субъекту терапевтически эффективного количества состава LCH и/или LDOC согласно настоящему изобретению. Кальцификация может происходить в любой мягкой ткани. Мягкая ткань может включать артериальную ткань, сердечную мышцу, клапаны сердца, суставы, кожу и ткань молочной железы.
[0133] Субъекта, страдающего или имеющего один или более симптомов вторичного гиперпаратиреоза, можно лечить путем введения указанному субъекту терапевтически эффективного количества LCH и/или LDOC согласно настоящему изобретению.
[0134] Гиперпаратиреоз определяется как заболевание у субъекта, имеющего уровень интактного РТН примерно 150 пг/мл или выше. Симптомы гиперпаратиреоза включают гипокальциемию (т.е. уровень кальция в крови ниже примерно 8,5 мг/дл), гиперфосфатемию (т.е. уровень фосфатов в крови выше примерно 4,5 мг/дл) и заболевания костей (например, переломы костей или боль в костях).
[0135] В настоящем описании термин «эффективное количество соединений карбоната лантана согласно настоящему изобретению» относится к количеству, которое может снижать уровень фосфатов у субъекта в клинически значимой степени, определяемой медицинским работником. Как очевидно в настоящем описании, желаемый целевой уровень фосфатов в крови для конкретного субъекта, которому вводят фармацевтическую композицию согласно настоящему изобретению, может определять и контролировать с течением времени специалист в области медицины так, что можно избежать гиперфосфатемии, а также гипофосфатемии (например, уровней в крови примерно 2,4 мг/дл или меньше) или других нежелательных побочных эффектов.
[0136] Составы LCH и/или LDOC согласно настоящему изобретению могут быть введены субъектам перорально в соответствии с настоящим изобретением в лекарственных формах в диапазоне от примерно 125 до примерно 20000 мг АФИ, рассчитанного на основе массы элементарного лантана. Они могут быть введены с каждым приемом пищи (или непосредственно перед или после еды), например, до четырех раз в сутки в зависимости от потребностей субъекта и типа лекарственной формы. Если используют стратегии отсроченного или другого контролируемого высвобождения, может быть необходима только однократная доза один раз в сутки или две дозы с интервалом 12 часов. Типичная эффективная величина дозы для взрослого может составлять, например, от примерно 200 до примерно 12000 мг в сутки, или от примерно 500 мг до примерно 8000 мг в сутки. Дозировка также может находиться в диапазоне от примерно 300 до 4000 мг/сутки.
[0137] Таким образом, доза может быть разделена и введена с каждым приемом пищи, например, в форме фармацевтической композиции, при этом эффективное количество одного или более соединений карбоната лантана выбрано из группы, состоящей из примерно 100, 125, 150, 250, 500, 750 или 1000 мг, например, вводимых три раза в сутки. Уровни в сыворотке или плазме можно контролировать раз в неделю и дозы можно изменять до достижения оптимального уровня фосфатов в сыворотке, например, определяемого клиническим врачом субъекта. Введение можно осуществлять в непрерывном режиме; такой режим может представлять собой длительный режим, например, постоянный режим, для лечения хронических состояний.
[0138] Ввиду вероятности того, что фармацевтическую композицию согласно настоящему изобретению может быть необходимо вводить в течение длительного периода времени, например, для лечения хронической болезни почек, в настоящем изобретении предполагаются наборы, содержащие соединения лантана согласно настоящему изобретению, предназначенные для облегчения и/или улучшения соблюдения пациентом режима и схемы лечения. Например, такие наборы могут содержать одну или более удобным образом заранее упакованных и/или предварительно дозированных фармацевтических лекарственных форм, содержащих соединения лантана, описанные в настоящем документе, удобным образом выделенных в наборе или иным образом обозначенных в нем в подходящем количестве для введения в конкретное время суток, например, во время еды так, чтобы обеспечить повышенный уровень удобства для пациента и, таким образом, улучшить соблюдение пациентом режима и схемы лечения. В нем также может быть представлена инструкция - вкладыш или другие инструкции по применению.
[0139] Как предусматривается в настоящем изобретении, площадь поверхности по методу БЭТ соединений лантана, описанных в настоящем документе, может быть определена, как предложено в US 7588782.
[0140] Данные гранулометрического анализа на лазерном анализаторе могут быть получены с использованием, например, Лазерного анализатора гранулометрического состава LS230, производимого Coulter.
[0141] В среднем, он работает с использованием программного обеспечения LS230 и имеет программное обеспечение для расчета результатов необходимого объема D (т.е. для D1,D10, D50, D90 и D99).
- Показатель преломления (RI) твердого вещества необходим для выполнения точного анализа гранулометрического состава (PSD) на лазерном анализаторе для частиц менее 1 мкМ. RI тестируемых веществ не были указаны в литературе в то время, когда этот метод был разработан. Тестирование показало, что корректировка RI от 1,9 до 2,3 заметно не влияла на PSD. Поэтому, был выбран RI, равный 2,1.
[0142] Кинетика связывания фосфата и способность связывать фосфат, показанная на Фиг.10 и описанная в настоящем документе (в частности, в отношении RZB-012), может быть измерена следующим образом: Инструмент:
- Аналитические весы с точностью до четвертого знака
- pH-метр с температурной компенсацией и соответствующие зонды
- Мешалка с лопастями
- Электроплитка с регулированием температуры
- Термометр (способный показывать 37***C)
- Плита магнитной мешалки
- Якоря магнитной мешалки (длиной от 1 У2 до 3 дюймов)
- Стаканы ругех (от 250 до 1500 мл)
- Стеклянная мерная колба (от 100 до 1000 мл)
- Градуированные цилиндры (от 100 до 1000 мл)
- Цифровой таймер
- Тахометр
- Штатив для 10 мл пробирок для образцов
- 10 мл пластиковые пробирки для образцов с крышками
- Автоматический разбавитель
- 10 мл пластиковые шприцы с поршнем
- 0,2 мкм фильтр для шприца (диаметр от 20 до 25 мм)
- Пипетки (от 0,1 до 1 мл, авто)
- Оптический эмиссионный спектрометр с индуктивно-связанной плазмой (ICP-OES) Реагенты
- Деионизированная вода (по меньшей мере 16 МОм)
- pH буферы (1, 3, 7) - Следуют инструкциям производителя по калибровке. Ограничивают ожидаемый диапазон pH с использованием соответствующих буферов. Это делают каждый день перед выполнением какой-либо части процедуры ниже.
- Концентрированная соляная кислота
- Исходный раствор ~0,15 М HCl
1. Добавляют 12,5 мл концентрированной соляной кислоты к 987,5 мл деионизированной воды (D.I.). Хранят до 1 года в герметичной пластиковой емкости
- Гидроксид натрия
- Исходный раствор ~0,15 М NaOH
1. Добавляют 6 г гидроксида натрия в 1,0 л стеклянную мерную колбу
2. Добавляют 500 мл D.I. и встряхивают для растворения солей
3. Заполняют D.I. до отметки 1,0 л и тщательно перемешивают
4. Хранят до 1 года в герметичной пластиковой емкости
- Хлорид натрия (NaCl)
- Безводный двухосновный фосфат натрия (Na2HPO4)
- Исходный раствор фосфата (0,00527 моль PO43 - на литр - 500 мг PO43 - на литр)
1. Помещают 3-дюймовую магнитную мешалку на дно 4,5 л стакана Ругех и добавляют 3,8 л D.I.
2. Помещают на плиту магнитной мешалки
3. В чистом сосуде для взвешивания отмеряют 2,99 г безводного двухосновного фосфата натрия
4. В другом чистом сосуде для взвешивания отмеряют 0,462 г хлорида натрия
5. Количественно переносят Na2HPO4 и NaCl в 4,5 л стакан Pyrex с перемешиванием
6. Используют правильно калиброванный pH-метр для контроля pH раствора
7. По каплям добавляют либо исходный раствор 0,15М HCl, либо исходный раствор 0,15М NaOH и доводят до pH, необходимого для теста. Нормально «проскочить» pH и добавляют больше исходного раствора 0,15М HCl или исходного раствора 0,15М NaOH для повторной корректировки.
8. pH стабилен, если через 5 минут не происходит отклонение более чем на 0,01 единицы pH.
9. Разбавляют до 4,0 л с использованием D.I. и тщательно перемешивают
10. Хранят до 1 месяца в герметичной стеклянной емкости
- Стандартный калибровочный раствор фосфата (10000 мг/л)
- Многоэлементный стандартный раствор для проверки, содержащий фосфор, или независимый стандартный калибровочный раствор фосфата (1000 мг/л)
- Соединение лантана
Методика
Подготовка образцов:
1. Определяют количество выборочных образцов для теста и маркируют соответствующее количество пластиковых пробирок для образцов
2. Помещают указанные пластиковые пробирки для образцов в штатив и откладывают в сторону
3. С использованием градуированного цилиндра отмеряют 1,0 л исходного раствора фосфата
4. Добавляют указанный раствор фосфата в 1,5 л стакан Pyrex. Указанный стакан должен быть достаточно большим для того, чтобы вмещать раствор фосфата и допускать увеличение объема на 30%
5. Проводят при температуре окружающей среды -20°С или 37°С, как указано в условиях для анализа. Если требуется 37°С, помещают 1,5 л стакан, содержащий 1,0 л тестируемого раствора, на электроплитку с контролем температуры. Устанавливают температуру 37°С. Тестирование не начинают пока не будет достигнута указанная температура.
6. Раствор постоянно перемешивают с использованием электрической мешалки, оснащенной лопастью. Скорость перемешивания должна составлять ~180 об/мин (контролируют с помощью тахометра).
7. С использованием 10 мл шприца извлекают 5 мл раствора и вводят в маркированную пробирку для образца. Это образец Т=0.
8. Одновременно добавляют порцию в стакан с перемешиванием и запускают цифровой таймер.
9. Начинают отбор выборочных образцов в предварительно описанные интервалы времени с использованием следующего протокола:
a. 10 мл шприц промывают суспензией из стакана с перемешиванием и промывочные жидкости возвращают обратно в стакан
b. Набирают 5 мл суспензии с использованием того же 10 мл шприца
c. Помещают 0,2 мкм фильтр для шприца плотно на кончик и вводят 2 мл обратно в стакан с перемешиванием
d. Вводят оставшиеся 3 мл в маркированную пробирку для образца
e. Закрывают пробирку крышкой и готовятся к следующему образцу
10. Если необходим постоянный pH:
a. Между выборочными образцами корректируют pH с использованием 0,5 мл автоматической пипетки
b. Корректируют с использованием соответствующего титранта, 0,15М NaOH или 0,15М HCl, для поддержания pH
c. Добавляют столько 0,5 мл аликвот, сколько требуется для поддержания постоянного pH. Фиксируют количество аликвот
d. Фиксируют общий объем, добавляемый для каждого периода времени между выборочными образцами
11. Продолжают забор образцов и поддерживают pH на протяжении всего теста
12. Когда тест завершают тщательно очищают всю стеклянную посуду и промывают D.I. Подготовка образцов, градуировочные кривые и образец для контроля качества:
13. Образцы разводят 1:10 в матрице 10% HCl
а. Разбавляют D.I. до отметки и тщательно перемешивают. Хранят до 2 месяцев в герметичной пластиковой емкости
14. Разбавляют независимый эталонный раствор так, что концентрация фосфора ограничивается значениям градуировочной кривой
15. Включают холостую пробу матрицы с представлением
Анализ образцов с использованием ICP-OES:
16. Позволяют устройству прогреться согласно инструкциям производителя
17. Готовят образцы с концентрацией 0, 5, 10, 20 мг/л для градуировочной кривой:
a. 0 мг/л - это холостая проба матрицы для 10% HCl
b. 5 мг/л - 0,5 мл аликвоту 1000 мг/л сертифицированного водного стандартного раствора помещают в 100 мл стеклянную мерную колбу, содержащую 10 мл концентрированной HCl и 50 мл D.I. Разбавляют D.I. до отметки и тщательно перемешивают. Хранят до 2 месяцев в герметичной пластиковой емкости
c. 10 мг/л - 1,0 мл аликвоту 1000 мг/л сертифицированного водного стандартного раствора помещают в 100 мл стеклянную мерную колбу, содержащую 10 мл концентрированной HCl и 50 мл D.I. Разбавляют D.I. до отметки и тщательно перемешивают. Хранят до 2 месяцев в герметичной пластиковой емкости
d. 20 мг/л - 2,0 мл аликвоту 1000 мг/л сертифицированного водного стандартного раствора помещают в 100 мл стеклянную мерную колбу, содержащую 10 мл концентрированной HCl и 50 мл D.I.
18. Анализируют образцы, образцы для контроля качества и холостую пробу на предмет фосфора с использованием длины волны 214 нм. Градуировочный график 0, 5, 10, 20 мг/л является линейным для ICP при длине волны 214 нм. Относительное стандартное отклонение (RSD) должно быть больше 0,9995
Расчеты:
R (мг/л)=[А-В]×С/D, где: R = Результат (мг/л)
А = показание ICP (мг/л)
В = показание ICP (мг/л) для холостой пробы матрицы
С = Разведение (мл) D = Аликвота (мл)
Строят график зависимости R (мг/л) от времени (мин). Данный график можно сравнить с другими графиками, полученными с использованием этого же протокола. Поверхность некоторых соединений лантана, а также ионы лантана связывают фосфата в растворе. Для лучшего сравнения относительной эффективности связывания для различных соединений лантана количество лантана, добавляемое в тесте, должно быть одинаковым. Градуировочный график необходимо строить с использованием водного стандартного раствора AAS, сертифицированного Национальным институтом стандартов и технологии (NIST). Образец для контроля качества может представлять собой либо независимый стандартный раствор AAS, либо сертифицированный NIST смешанный анионный стандартный раствор, содержащий фосфор. Необходимо проверять спектры ICP для смешанного анионного стандартного раствора для того, чтобы убедиться, что ни один из присутствующих дополнительных анионов не нарушает линию фосфора 214 нм. Окружающая среда: Все кислые растворы должны быть утилизированы на основе принципов экологической ответственности. Нейтрализуют и убеждаются в том, что концентрации металлов ниже городских ограничений по выбросам вредных веществ. Примечания: Карбонат лантана растворим в кислоте. Остаток удаляют из стеклянной посуды с использованием кислоты.
Источники
Данный тест представляет собой вариацию теста, приведенного в патенте США №5968976, Anormed. - «Фармацевтическая композиция, содержащая выбранные гидраты карбоната лантана» ("Pharmaceutical composition containing selected lanthanum carbonate hydrates"), включенном в настоящее описание посредством ссылки в отношении описаний данных аналитических методов.
[0143] Насыпная плотность согласно настоящему изобретению может быть определена стандартными методами.
Гипотетический пример
Определяли массу тары - градуированного цилиндра и она составляла 225 г. 75 грамм образца просеивали в указанный градуированный цилиндр. Определяли массу брутто и она составляла 299,4 г.Определяли объем данного образца и он составлял 141 мл. Таким образом, насыпная плотность порошка равна:
Насыпная плотность (г/см3)=(299,4-225)/141=74,4/141=0,5277 г/см3
Округление данного значения до сотых дает конечное значение 0,53 г/см3.
9.2RSD=(R1-R2)×100/R1,
где: RSD = Относительное стандартное отклонение (%)
R1 и R2 = Результат индивидуального повтора (г/см3)
9.3 SR=R×100/V,
где: SR = Стандартный выход (%)
R = Результат для эталонного стандарта (г/см3)
V = Прошлое среднее значение для стандарта (г/см3)
[0144] ПРИМЕРЫ
[0145] ПРИМЕР 1
[0146] Получали ряд партий LCH и LDOC, как в целом, описано в настоящем документе. В частности, гидроксид карбонат лантана (LCH) получали путем осуществления взаимодействия хлорида лантана и карбоната аммония в реакции с непрерывной капельной подачей. Количество хлорида лантана подавали с фиксированной скоростью, а количество карбоната аммония подавали с переменной скоростью. Данные растворы вводили в объем воды с контролем температуры и контролем смешивания. Поддерживали pH, близкий к постоянному в ходе реакции, и концентрацию полученного осадка контролировали путем регулировки массового отношения подаваемого хлорида лантана к объему воды в реакторе. Общие объемы реагентов подавали в течение четырехчасового периода и температуру контролировали вручную. Рабочий объем составлял примерно 15 литров. pH автоматически контролировал поток карбоната аммония и его поддерживали близким к постоянному в ходе реакции. После образования осадка его промывали и фильтровали с удалением реакционной соли, которая в данном случае должна представлять собой хлорид аммония. Это осуществляли с использованием лабораторного фильтрационного аппарата с воронкой Бюхнера (вакуум). LCH фильтровали и ресуспендировали в воде, и повторно фильтровали до достижения желаемой проводимости суспензии (показывающей содержание соли). Затем LCH фильтровали последний раз с увеличением нагрузки по твердым веществам для сушки. Сушку осуществляли в соответствии со способом, при котором осадок LCH на фильтре (как правило, от 40 до 60 массовых процентов твердых веществ) загружали в лотки ругех и нагревали в сушильной печи с естественной конвекцией в течение минимум 16 часов при 110 градусах Цельсия.. Затем вещество измельчали в сухом виде и превращали в порошок в конусной мельнице (Fritz Mill) посредством 0,6-миллиметрового сита. Указанный порошок обозначали Реназорб 013 (Renazorb 013) (RZB-013).
[0147] Термическая обработка происходила путем помещения Реназорба-013 в алюмооксидные (Al2O3, 99,8%, высокая плотность) открытые лотки и обработки в муфельной печи с алюмооксидной выстилкой под рампой в течение 3 часов при 550 градусах Цельсия, с периодом выдержки в течение 2,5 часов при данной температуре и охлаждением до комнатной температуры в течение минимум 8 часов. Из печи извлекают LDOC и он обозначен ниже как Реназорб-014 (RZB-014).
[0148] Проводили две серии экспериментов с тестированием разных условий реакции. В первой серии экспериментов использовали схожие условия pH, температуры и концентрации, которые, как было обнаружено, являются благоприятными для получения Реназорба-011. В частности, данные условия были направлены на pH 6,0, температуру 85 градусов Цельсия и конечную концентрацию осадка 43,5 г/л. Данные условия поддерживали постоянными и получали несколько партий для определения повторяемости полученных соединений RZB-013 и RZB-014. Во втором блоке экспериментов исследовали влияние различных значений pH реакции, температуры и концентрации осадка на соединения RZB-013 и RZB-014 в соответствии с планом, представленным в Таблице 4.
[0149] Для каждой партии определяли характеристики как Реназорба-013 (LCH), так и Реназорба-014 (LDOC). Определение характеристик Реназорба-013 имеет важное значение, поскольку его свойства (в частности, такие физические свойства, как площадь поверхности по методу БЭТ, гранулометрический состав, кристаллическая фаза по данным XRD, насыпная плотность) сильно влияют на такие же свойства Реназорба-014, имеющие критическое значение. Типичный набор характеристик Реназорба-013 и Реназорба-014 включает площадь поверхности по методу БЭТ (БЭТ-SA), гранулометрический состав (PSD), кристаллическую фазу по данным XRD, насыпную плотность, содержание хлорида, содержание лантана, содержание углерода. Помимо этого, Реназорб-014 тестируют на предмет характеристик связывания фосфата (pH 4,5, 30 мин). Такие анализы, как La, С, Cl, как правило, довольно постоянны и не требуют тщательного рассмотрения. Результаты первой серии экспериментов с точки зрения некоторых физических свойств LCH и LDOC представлены в Таблице 5 ниже.
(м^2 г)
фильтрации (мин)
В большинстве из полученных партий получали Реназорб-013 с большой SA и, соответственно, Реназорб-014 с большой SA. В трех из партий данной группы получали меньшую SA. Следует отметить, что две партии, 042208А и 042208В, синтезировали с использованием бикарбоната аммония в качестве основания вместо карбоната аммония, и они дают одно из веществ с низкой SA. Два из веществ с маленькой SA имеют относительно низкий средний pH реакции, но одно имеет pH в пределах диапазона веществ с большой SA. Изначально считалось, что из-за этого наблюдения pH может влиять на получаемую SA и, таким образом, необходимо осуществлять улучшенный контроль pH, как это выполнено в настоящем изобретении. Результаты второй серии экспериментов представлены в Таблице 6 ниже.
[0150] Для всех партий использовали одинаковое оборудование. Как указано, некоторые параметры специально корректировали (температура реакции, pH, конц.), но остальные процессы и оборудование сохраняли максимально согласованными с уровнем приборов/контроля, содержащегося в данном способе.
[0151] В Таблице 7 ниже показана вариабельность, которую наблюдали в данных тестах. Таким образом, хотя вполне могут быть сделаны определенные выводы, несоответствия этих данных по-прежнему показывают, что дополнительные переменные факторы могут играть роль в контроле желаемых свойств LCH и LDOC.
(м^2/г)
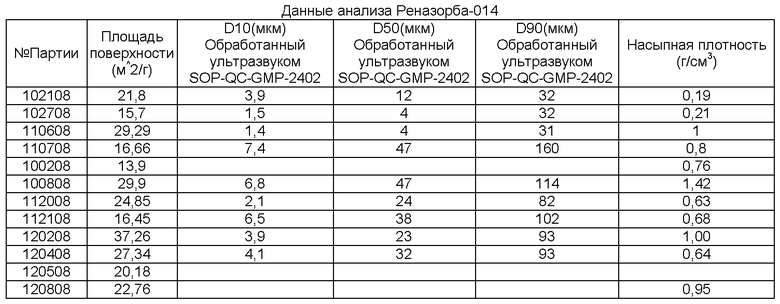
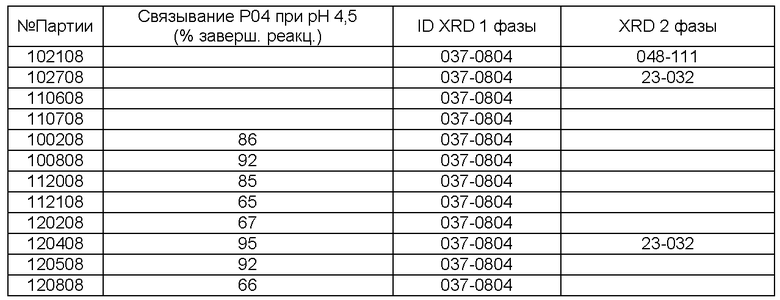
ПРИМЕР 2
[0152] Лекарственную форму для перорального введения в форме глотательной таблетки получали с использованием LDOC («RZB-014») согласно настоящему изобретению, как представлено в Таблице 8 ниже.
Глотательная лекарственная форма RZB
014 для перорального введения
[0154] Получали восемь партий лекарственной формы. Повидон растворяли в одинаковом количестве очищенной воды при каждом получении. Вкратце, активное вещество (RZB-014) добавляли в гранулятор с псевдоожиженным слоем Glatt ("Midi-Glatt") и раствор распыляли со скоростью примерно 7 г/мин. Гранулят сушили в течение примерно одного часа (до достижения потери при сушке (LOD) менее 2%). Гранулы измельчали посредством Comil с ситом № 16 меш. Затем гранулы добавляли в смеситель РК совместно с Просолвом и Ac-Di-Sol, и смешивали в течение 5 минут. В указанный смеситель добавляли стеарат магния и смешивали в течение еще 2 минут. Гранулы прессовали на таблеточном мини-прессе с использованием только 2 станции из доступных 8 станций. Прессовали восемь партий таблеток с использованием круглой/стандартной вогнутой формы диаметром 11,11 мм. Гранулы и таблетки каждой тестируемой композиции оценивали на предмет потери при сушке (LOD), гранулометрического состава, плотности, прессуемости, толщины, хрупкости, твердости, средней массы, времени распада и связывания фосфата in vitro. Ниже приведена таблица полученных результатов:
[0155]
ПРИМЕР 3
[0156] Получали дополнительные составы в форме жевательных таблеток, порошков/гранул для посыпания и суспензий, содержащих RZB-014.
[0157] В частности, изготавливали три состава в виде жевательных таблеток (FS-22, FS-30 и FS-31), содержащие 500 мг RZB-014 (обозначаемый далее «SPI-014»); два состава для посыпания (капсула) (SP-11 и SP-12), содержащие 500 мг SPI-014, и изготавливали два состава в виде суспензии для перорального введения (S-2 и S-7), содержащие 100 мг/мл или 500 мг/5 мл SPI-014. Вещества, используемые в составах, перечислены ниже.
I. Жевательные таблетки:
[0158] Жевательные таблетки с использованием различных комбинаций разбавителей и АФИ SPI-014 изготавливали посредством прямого прессования и компактирования на валках. Цель заключалась в идентификации композиций, демонстрирующих время распада 5-30 минут.
[0159] Способ прямого прессования: различные количества АФИ SPI-014, разбавителей, связующих веществ, разрыхлителей и смазывающих веществ смешивали вручную. Смеси, демонстрировавшие хорошие или умеренные свойства текучести, прессовали с использованием круглых со скошенными краями пуансонов с диаметром 14 мм. Таблетки оценивали на предмет средней массы, толщины, твердости, хрупкости и времени распада в очищенной воде (37°C). Таблица 11, приведенная ниже, включает композиции составов и наблюдения.
[0160] Компактирование на валках: различные количества АФИ SPI-014 и наполнителей подвергали компактированию на валках с использованием Роликового пресса TFC-LAB MICRO при давлении валок 2 тонны, скорости вращения валок 2 об/мин и скорости вращения подающего винта 15 об/мин. Слои гранулировали и пропускали через сито № 16 US. Гранулы внешне/внутренне смешивали с разбавителями, связующими веществами и смазывающими веществами, и тестировали свойства текучести. Гранулы прессовали с использованием круглых со скошенными краями пуансонов с диаметром 14 мм или 16 мм. Таблетки оценивали на предмет средней массы, толщины, твердости, хрупкости и времени распада в очищенной воде (37°C). В Таблице 12, приведенной ниже, представлены композиции составов и наблюдения. Выбранные композиции получали с использованием ароматизатора и подсластителя. В Таблице 13A и 13B перечислены композиции составов.
целлюлоза
Результаты
[0161] Три прототипные композиции (FS-22, FS-30 и FS-31) демонстрировали хорошие характеристики текучести и ожидаемое время распада (5-30 минут). Другие композиции демонстрировали либо быстрый (<5 минут), либо медленный (>45 минут) распад. Содержание SPI-014 (лантан) в данных композиция было следующим:
Композиция жевательных таблеток FS-22: 474,4 мг/таблетка.
Композиция жевательных таблеток FS-30: 501,4 мг/таблетка.
Композиция жевательных таблеток FS-31: 487,0 мг/таблетка. [0162] II. Порошок или гранулы для посыпания для перорального введения:
[0163] Капсулы с заключенными внутри мелкими частицами (sprinkles) представляют собой лекарственные формы в виде капсул или саше, все содержимое (порошки/гранулы) которых посыпают на пищу до приема внутрь. Лекарственные формы в виде таких капсул обеспечивают полезный эффект для пациентов, испытывающих трудности при глотании твердых лекарственных форм. Такие лекарственные формы хорошо известны специалисту в данной области техники.
[0164] Способ сухой грануляции/компактирования на валках: различные количества SPI-014 и выбранных сухих связующих веществ подвергали компактированию на валках с использованием Роликового пресса TFC-LAB MICRO при давлении валок 2 тонны, скорости вращения валок 2 об/мин и скорости вращения подающего винта 15 об/мин. Слои пропускали через сито № 16 US и оценивали на предмет однородности размера частиц. В Таблице 13, приведенной ниже, представлены композиции составов.
[0165] Способ грануляции распылением: SPI-014 загружали в гранулятор с псевдоожиженным слоем MidiGlatt и распыляли с выбранными гранулирующими жидкостями в соответствии с обычными рабочими условиями. В Таблице 13 представлены композиции составов.
[0166] Способ влажной грануляции: как представлено в композициях составов, описанных в Таблице 13, различные количества SPI-014 гранулировали со связующим раствором (таким как 10% масс/об. Опадрай или Klucel-LF) в планетарном смесителе. Влажную массу сушили в лотках при 60°C до достижения LOD менее 3 масс.%. Затем указанную массу пропускали через сито № 14, оценивали на предмет однородности размера путем визуального осмотра и помещали в желатиновые капсулы (размер '00').
[0167] Результаты: Две прототипные композиции (SP-10 и SP-11) давали однородные гранулы и демонстрировали хорошие характеристики текучести. Содержание SPI-014 (лантан) в данных композициях было следующим:
Композиция SP-10 в виде капсул, содержимое которых может быть высыпано: 537,5
мг/капсула;
Композиция SP-11 в виде капсул, содержимое которых может быть высыпано: 510,2 мг/капсула. III. Суспензии:
[0168] Суспензии представляют собой гомогенные смеси, содержащие нерастворимое твердое вещество, диспергированное в жидкости с помощью суспендирующего агента, и хорошо известны специалисту в данной области техники. Хотя суспензии представляют собой термодинамически неустойчивые системы и претерпевают разделение фаз/седиментацию со временем, идеальная суспензия будет равномерно диспергирована при смешивании.
[0169] Суспензии, содержащие АФИ SPI-014 и выбранные суспендирующие агенты, подсластители, ароматизаторы и консерванты, изготавливали как показано в Таблице 14. Суспендирующий агент растворяли в примерно 50% воды с использованием верхнеприводной мешалки. SPI-014 добавляли в примерно 30% воды и гомогенизировали. Суспензию лекарственного средства добавляли к раствору суспендирующего агента и смешивали в течение 30 минут. Добавляли остальные компоненты и объем доводили до 100% с помощью воды.
[0170] Композиции, которые образовывали однородные суспензии, оценивали на предмет микроскопического исследования, плотности и седиментации в течение 7 дней.
[0171] Результаты: композиции S2, S4 и S7 образовывали однородные суспензии и, следовательно, их оценивали на предмет физической стабильности в течение 7 дней.
Плотности этих двух составов составляли 1,09 и 1,07 г/мл соответственно. Содержание SPI-014 (лантан) в данных композиция было следующим:
Композиция суспензии S2: 91,9 мг/мл;
Композиция суспензии S7: 98,2 мг/мл. ПРИМЕР 4
[0172] Метод анализа для определения способности лекарственного вещества (DS), карбоната лантана, и готовых лекарственных форм (DP) связывать фосфат в буфере pH 4,5 с использованием системы ионной хроматографии, подробно приведен ниже. [0173] В частности, областью исследования, приведенного в настоящем описании, является определение кинетики/способности лекарственного вещества (DS), карбоната лантана, и готовой лекарственной формы (DP) связывать фосфат в ацетатных буферных растворах, содержащих известное количество растворенного фосфата при pH=4,5 с использованием аппарата для растворения согласно Фармакопее США (USP) и определенное посредством системы ионной хроматографии.
[0174] Вкратце, содержание фосфатов определяют с использованием системы ИХ (ионной хроматографии), оснащенной детектором проводимости, и определение количества осуществляют путем сравнения реакции неизвестного образца относительно независимого стандартного раствора. Образцы фильтруют и напрямую вводят в систему. Необходимые материалы:
[0175] Реагенты:
Стандартный раствор фосфора для ИХ, прослеживаемый до эталона NIST, 1000 ppm;
Сверхчистая деионизированная (DI) вода, 18,2 МОм;
Буферы pH 4, 7 и 10 (для стандартизации pH-метра);
Ледяная уксусная кислота, степень чистоты, соответствующая стандарту Американского химического общества (ACS);
Гидроксид натрия, степень чистоты, соответствующая стандарту ACS;
Фосфорная кислота, степень чистоты, соответствующая стандарту ACS.
Система ИХ
[0176] Система Dionex ICS-3000
Детектор проводимости;
Автоматический дозатор: способный вводить 10 мкл;
Насос: скорость потока 1,2 мл/мин;
Система данных: Chromeleon 7;
Аналитическая колонка: Dionex Ion®Pac AS 11, 4 мм × 250 мм, P/N: 044076;
Предколонка: Dionex Ion®Pac AG11,4 мм × 50 мм, P/N 044078;
Генератор элюента: EG Картридж КОН;
Виалы и крышки автоматического пробоотборника для ионной хроматографии.
Приготовление стандартных растворов для проверки линейности:
[0177] Готовят следующие растворы с использованием стандартного раствора фосфора 1000 мг/Л, прослеживаемого до эталона NIST, представленного в Таблице 15 ниже:
[0178] Фосфатный реакционный раствор (0,5 М ацетатный буфер, pH 4,5): добавляют следующее количество компонентов в порядке, указанном в Таблице 16 ниже:
Тестируемые образцы
[0179] Масса лекарственного вещества (DS), необходимая для тестирования: Рассчитывают массу АФИ (безводный диоксикарбонат лантана, La2O2CO3), эквивалентную 1,0 г лантана, на основе % содержания La DS, приведенного в Сертификате анализа (CofA).
[0180] Масса готовой лекарственной формы (DP), необходимая для тестирования:
Определяют массу индивидуальной готовой лекарственной формы (таблетки или капсулы) и фиксируют массу в тетради. Рассчитывают количество (г) элементарного лантана в готовой лекарственной форме на основе CofA.
[0181] Приведены следующие условия растворения:
Устройство: Аппарат II USP (лопастная мешалка);
Температура: 37°C±0.5°C;
Скорость перемешивания: 180 об/мин;
Среда: 1000 мл реакционного фосфатного раствора;
(0,5 М ацетатный буфер, pH 4,5);
Средний отбор образцов: 5 мл через 0, 30, 60 и 90 минут для лекарственного вещества; 5 мл через 0, 30, 60 и 90 минут для готовой лекарственной формы.
[0182] Растворы образцов: Образцы фильтруют через 0,45 мкм мембранный фильтр PVDF Acrodics перед введением.
[0183] Анализ методом ИХ
Условия хроматографирования
[0184] Условия хроматографирования приведены ниже в Таблице 17:
Расчеты
[0185] Расчеты для определения содержания фосфора приведены ниже:
[0186] Этап 1: Содержание фосфора (мг/л) R=[А-В]×С÷D; где A = показание ИХ (мг/л); B = показание ИХ (мг/л) для нулевого времени (холостая проба); C = Разбавление (мл); и D = Аликвота (мл).
[0187] Этап 2: Процент завершения реакции (R×N) при Т=30 мин={(R0-R30)÷(1000×30,974)}×100÷М; где R0 = результаты образцов «Т=0» (мг/л); R30 = результаты образцов «Т=30» (мг/л); 1000=объем реакционной смеси (мл); 30,974 = молекулярная масса фосфора; М = моли La, изначально присутствующего в реакции; количество La, взятое в (г)/138,91 молекулярная масса La
[0188] Пример (с теоретическими значениями):
{(248,0-29,3)÷(1000×30,974)}×100÷0,0072=98%
[0189] Этап 3: Процент завершения реакции (R×N) при Т=60, 90 и 120 мин. Заменяют показание Т=30 на Т=60, Т=90 и Т=120, и используют то же уравнение, что и для Т=30.
[0190] Этап 4: Связанный фосфат на грамм лантана при Т=30 мин={(R0-R30)×V×(94,974-30,974)}-L; где R0 = результаты образцов «Т=0» (мг/л); R30 = результаты образцов «Т=30» (мг/л); V = Объем (л) реакционного раствора; 94,974 = Молекулярная масса фосфата (Р04); 30,974 = молекулярная масса фосфора; и L = грамм La, изначально присутствующего в реакции.
[0191] Этап 5: Связанный фосфат на грамм лантана при Т=60, 90 и 120 мин. Заменяют показание Т=30 на Т=60, Т=90 и Т=120, и используют то же уравнение, что и для Т=30.
ПРИМЕР 5
[0192] Данные связывания фосфата для составов лантана согласно настоящему изобретению определяли в соответствии с методом ионной хроматографии, описанным в Примере 4. Результаты указанных экспериментов приведены в настоящем описании в Таблицах 18 и 19.
ПРИМЕР 6
[0193] Пористость соединения LDOC, обозначаемого в настоящем описании RZB-014, анализировали и сравнивали с пористостью соединений LDH и LDOC из патента 782, рассмотренного выше, на анализаторе площади поверхности TriStar 3000, Micromeritics, статического давления с использованием азота в качестве адсорбата. Метод Barrett, Joyner и Halenda (BJH) использовали для расчета размера пор. В данном методе используют модель Кельвина заполнения пор и его применяют только диапазону размеров от мезопор (внутренняя ширина приблизительно от 2 до 50 нм) до макропор (внутренняя ширина от 50 нм до приблизительно 300 нм). Результаты:
[0194] Данные приведены ниже в Таблице 20:
[0195] Результаты показывают, что:
a) площади поверхности двух партий RZB-14 больше, чем площадь поверхности соединений LCH и LDOC, полученных в соответствии со способами, описанными в US 7588782 (RZB-11 и 12 соответственно);
b) соединения LDOC, полученные в соответствии со способами настоящего изобретения (обе партии RZB-14), имеют гораздо большие объемы пор, чем RZB-12 и немного больший объем пор, чем RZB-11;
c) нет большой разницы в значениях диаметра пор среди соединений LCH и LDOC, исследуемых в данном эксперименте (RZB-11, RZB-12 и обе партии RZB-14).
Следовательно, количество пор должно быть намного больше в RZB-14 по сравнению с RZB-12HRZB-11.
[0196] Что касается кинетики связывания фосфата, эти данные позволяют предположить, что больший объем RZB-14 может объяснить большее связывание RZB-14 фосфата при pH 6,5, поскольку связывание фосфата при более высоком pH наиболее вероятно ограничено диффузией фосфата в поры. ПРИМЕР 7
[0197] Морфологию соединений LCH и LDOC, обозначаемых в настоящем описании RZB-011, RZB-012 и RZB-014, анализировали с использованием сканирующей электронной микроскопии (SEM) в соответствии с традиционными методами. См. Фиг.11-20.
[0198] Результаты, приведенные в настоящем описании, подтверждают предыдущие данные, которые показали, что морфология RZB-012 и RZB-14 значительно отличается и, в частности, отличительную сферическую морфологию RZB-014 согласно настоящему изобретению.
ПРИМЕР 8
Следующую методику можно использовать для определения кинетики/способности связывать фосфат в растворах при буфером pH=4,5 для диоксикарбоната лантана. Вкратце, нагретый ацетатный буферный кислый раствор, доведенный до известного значения pH и содержащий известное количество фосфата, непрерывно перемешивают на протяжении всего теста в установке для растворения. К данному перемешиваемому раствору добавляют известное количество соединения лантана в момент времени=0. В заранее определенные интервалы (Т=30, 60 минут) отбирают образцы перемешиваемой суспензии и сразу же фильтруют. Все образцы разбавляют в подходящей матрице и анализируют на предмет фосфора с использованием инструмента с индуктивно-связанной плазмой, оснащенного детектором - оптическим эмиссионным спектрофотометром (ICP-OES).
Аппарат/оборудование:
- Калиброванный утвержденный USP аппарат для растворения
- Калиброванные аналитические весы с точностью до четвертого знака
- Калиброванный таймер
- Калиброванный / с проележиваемостью термометр (способный показывать 37°C)
- pH-метр с температурной компенсацией и соответствующие зонды
- Плита магнитной мешалки
- Якорь магнитной мешалки (длиной 1 и 3 дюйма)
- Стеклянная мерная колба класса А (10, 50, 100, 500, 1000, 2000 мл)
- Градуированные цилиндры класса А (от 100 до 1000 мл)
- Стеклянные мерные пипетки класса А (от 1 до 20 мл)
- Стаканы pyrex (100, 250, 1500 мл и ≥10 л)
- Штатив для 10 мл и 50 мл пробирок для образцов
- 10 мл и 50 мл пластиковые пробирки для образцов с крышками
- 20 мл пластиковые шприцы с поршнем
- 0,2 мкм фильтр для шприца (диаметр от 20 до 25 мм)
- Прибор для количественного анализа ICP-OES
Реагенты
1.1 Деионизированная вода согласно USP<1231>(D.I.)
1.2 Сертифицированный калибровочный стандартный раствор фосфата (1000 мг/л)
1.3 Вторичный стандарт твердого вещества - для использования на протяжения всего тестирования распадаемости
1.4 Эталонный стандарт - то же химическое вещество, что и тестируемое, с прошлыми данными
1.5 Стандартный раствор для контроля качества (QC) - любой и независимый 1000 или 10000 мг/л сертифицированный AAS стандартный раствор или многоэлементный сертифицированный стандартный раствор, содержащий фосфор
1.6 pH буферы (4, 4,62 или буфер, близкий к 4,5, 7) - следуют инструкциям производителя по стандартизации. Стандартизируют каждый день с использованием буферов pH 4 и 7, и проверяют стандартизацию до начала новой серии тестов с использованием буфера pH 4,62. Повторно стандартизируют, когда проверка стандартизации составляет более ±0,05 pH единиц показателя буферности. Регистрируют информацию о стандартизации и проверке в журнале pH
1.7 Соляная кислота (10% об./об.) - В 2 л сосуде добавляют 200 мл концентрированной HCl к 1500 мл D.I.. Разбавляют D.I. до отметки, закрывают крышкой и встряхивают. Хранят до 6 месяцев в герметичной емкости
1.8 Ледяная уксусная кислота (5,0 М НОАс)
1.8.1 В 1500 мл стакан добавляют 3-дюймовый якорь магнитной мешалки и 1 л D.I.
1.8.2 С использованием градуированного цилиндра класса А добавляют 572,0 мл ледяной уксусной кислоты и перемешивают.
1.8.3 Количественно переносят содержимое в 2 л мерную колбу класса А и добавляют D.I. до отметки 2,0 л.
1.8.4 Закрывают крышкой и хорошо встряхивают с перемешиванием.
1.8.5 Переносят в чистый маркированный герметичный 2 л стеклянный сосуд. Хранят до 1 года.
1.9. Гидроксид натрия (50% NaOH или 12,5 Н NaOH)
1.9.1. В 500 мл стакан Pyrex добавляют 1-дюймовый якорь магнитной мешалки и 250 мл D.I. Начинают перемешивать.
1.9.2. Отмеряют 250 г гранул NaOH и переносят в стакан с перемешиванием. ОСТОРОЖНО: Не разбрызгивать! Раствор будет нагреваться! Перемешивают пока гранулы не растворятся, и раствор не вернется к комнатной температуре.
1.9.3. Количественно переносят в 500 мл мерную колбу и добавляют достаточное количество D.I. так, чтобы мениск находился на уровне приблизительно на один дюйм ниже отметки 500 мл.
1.9.4. Закрывают крышкой и осторожно встряхивают с перемешиванием. ОСТОРОЖНО: Раствор будет нагреваться! Оставляют раствор до тех пор, пока его температура не вернется к комнатной температуре.
1.9.5. Заполняют D.I. до отметки 500 мл.
1.9.6. Закрывают крышкой и хорошо встряхивают с перемешиванием.
1.9.7. Переносят в чистую маркированную герметичную 500 мл пластиковую емкость. Хранят до 6 месяцев.
1.10. Фосфорная кислота (1,62 М НЗНР04 или 50,1 г/L Р)
1.10.1. Помешают 3-дюймовый якорь магнитной мешалки на дно 1,0 л стакана Pyrex и добавляют -600 мл D.I. Помещают на плиту магнитной мешалки и начинают перемешивать.
1.10.2. Определяют необходимую массу фосфорной кислоты путем получения процента Н3Р04 в соответствии с Со А и согласно данному расчету:
1.10.2.1. Н3РО4 для взвешивания (г)=50,1×3,164×100÷%H3PO4 в соответствии с СоА Пример: СоА для Н3Р04 показывает 85,5%. Следовательно 50,1×3,164×100÷85,5=185,4 грамма H3PO4
1.10.3. Отмеряют необходимое количество концентрированной фосфорной кислоты в чистый стакан Pyrex.
1.10.4. Медленно и количественно переносят фосфорную кислоту в 1,0 л стакан Pyrex с перемешиванием, содержащий 600 мл D.I. Промывают стакан Н3РО4 D.I. и добавляют промывочные жидкости в 1,0 л стакан. ОСТОРОЖНО: Не разбрызгивать.
1.10.5. Перемешивают раствор и оставляют охлаждаться до комнатной температуры.
1.10.6. Количественно переносят указанный раствор в 1,0 л мерную колбу.
1.10.7. Заполняют D.I. до отметки 1 л.
1.10.8. Закрывают крышкой и хорошо встряхивают с перемешиванием.
1.10.9. Анализируют данный исходный раствор для проверки концентрации фосфора:
1.10.9.1. Разводят исходный раствор 1:100 с последующим разведением 5:100 в матрице 10% HCl. Общее разведение будет составлять 1:2000 и ожидаемая концентрация составляет 25 мг/л Р.
1.10.9.2. Готовят стандартный раствор матрицы 10% HCl 0 и 30 мг/л Р, холостую пробу матрицы и эталонный раствор для контроля качества 20 мг/л Р с использованием сертифицированного третьей стороной раствора фосфора.
1.10.9.3. Анализируют разведенный образец, эталонный раствор для контроля качества и холостую пробу матрицы на предмет фосфора с использованием длины волны 213,617 нм. Градуировочный график 0, 30 мг/л является линейным для ICP при длине волны 213,617 нм.
1.10.9.4. Критерии приемлемости:
1.10.9.4.1. Исходный раствор фосфата = 50,1÷1,3 г/л Р.
1.10.9.4.2. Проверка качества фосфора = 100÷2% обнаружения
1.10.10. Переносят одобренный исходный раствор фосфата в чистую маркированную герметичную 1 л стеклянную емкость. Хранят до 1 года.
2.0 Процедура
УСТАНОВКА ДЛЯ РАСТВОРЕНИЯ И ПРИГОТОВЛЕНИЕ РАБОЧЕГО РАСТВОРА ФОСФАТА:
2.1. Отбор образцов будет происходить при Т=0, 30 и 60 минут. Определяют необходимое количество пластиковых пробирок для образцов. 3 пробирки на тест.
2.2. Предварительно маркируют указанные пластиковые пробирки для образцов и помещают в штатив. Закрывают для того, чтобы они оставались чистыми и откладывают в сторону.
2.3. Помещают адиабатическую баню на аппарат для растворения до отметки с использованием водопроводной воды. Подготавливают данное устройство для тестирования.
2.4. Устанавливают температуру адиабатической бани на 37°C.
2.5. Рабочий раствор фосфата (9 литров)
2.5.1. Помещают 3-дюймовый якорь мешалки на дно 10 л стакана Pyrex.
2.5.2. С использованием градуированных цилиндров класса А добавляют точно 7000 мл D.I., 900 мл 5,0 М НО Ас и 45 мл 1,62 М Н3РО4 в указанный 10 л стакан Pyrex. Помещают на магнитную мешалку и начинают перемешивать.
2.5.3. Осторожно добавляют 155 мл 50% NaOH. Перемешивают в течение 10 минут до перехода к следующему этапу.
2.5.4. При перемешивании с помощью стандартизированного pH-метра контролируют pH раствора в 10 л стакане Pyrex. Доводят pH раствора до pH=4,5±0,05 с использованием 50% NaOH. Продолжают перемешивать в течение 10 минут. Если pH=4,5±0,05, переходят к следующему этапу. Если нет, продолжают корректировать pH.
2.5.4.1. Фиксируют общий объем дополнительно добавленного 50% NaOH.
2.5.5. Добавляют соответствующий объем D.I. с использованием градуированного цилиндра класса А так, чтобы общий объем был равен 9 литрам. Продолжают перемешивать в течение по меньшей мере 10 минут.
2.5.6.

2.5.6.1. Фиксируют pH данного «рабочего раствора фосфата».
2.6. С использованием градуированного цилиндра класса А переносят 1,0 л из 9 л раствора в каждый из сосудов для реакции растворения. Следует отметить, что максимум восемь тестов можно выполнять одновременно.
2.7. Возвращают на место крышку реакционного сосуда и начинают перемешивание в реакционных сосудах со скоростью 180 об/мин. Позволяют температуре водяной бани и растворов в реакционных сосудах повышаться и достигать постоянной температуры 37±1°C. Проверяют температуру с использованием калиброванного термометра с прослеживанием. Фиксируют наблюдения.
ОБРАЗЕЦ Т=0:
2.8. С использованием 20 мл шприца извлекают ~20 мл аликвоту из каждого сосуда для растворения и водят их в подходящим образом маркированные 50 мл пробирки для образцов - одна пробирка для каждого сосуда. Пробирку закрывают крышкой.
2.9. 20 мл шприц выбрасывают.
2.10. Добавляют 1,33±0,003 грамма соединения LDOC при Т=0. Запускают таймер. Добавляют LDOC с ~3-минутными интервалами для того, чтобы образцы из каждого сосуда могли быть извлечены в нужные моменты времени.
ОБРАЗЕЦ Т=30:
2.11. При Т=30±0,25 минут отбирают выборочный образец из каждого сосуда с использованием следующего протокола:
2.11.1. С использованием 20 мл шприца извлекают ~20 мл суспензии.
2.11.2. Помещают 0,2 мкм фильтр для шприца плотно на кончик и сбрасывают исходные 2 мл.
2.11.3. С помощью 0,2 мкм фильтра для шприца, по-прежнему находящегося на том же месте, вводят оставшийся раствор в подходящим образом маркированную 50 мл пробирку для образца. Пробирку закрывают крышкой.
2.11.4. Шприц и 0,2 мкм фильтр выбрасывают. ОБРАЗЕЦ Т=60:
2.12. При Т=60±0,25 минут отбирают выборочные образцы с использованием того же протокола для образца Т=30.
2.13. Определяют pH суспензии в каждом из реакционных сосудов. Фиксируют pH.
2.14. По завершении теста тщательно очищают всю стеклянную посуду и промывают D.I. Соединения карбоната лантана растворимы в кислоте. Остаток удаляют из стеклянной посуды с использованием разбавленной кислоты. Три раза промывают DI.
ПОДГОТОВКА ОБРАЗЦОВ
2.15. Образцы Т=0, 30 и 60 разводят 1:10 и добавляют достаточное количество концентрированной HCl для получения конечной концентрации 10% HCl (об./об.). {пример: 5 мл образца + 5 мл концентрированной HCL, разбавленной D.I. до 50 мл в мерной колбе}
2.16. Закрывают крышкой, встряхивают и представляют на анализ.
АНАЛИЗ ОБРАЗЦОВ:
2.17. Позволяют устройству прогреться согласно инструкциям производителя
2.17.1. Готовят «Соответствующий матрице» стандартный раствор 0, 30 мг/л для калибровочной кривой, холостую пробу матрицы и стандартный раствор для контроля качества (используют стеклянную мерную посуду класса А):
2.17.1.1. ~0,5 М HOAc - С использованием градуированного цилиндра добавляют 57,2 мл ледяной уксусной кислоты в 2 л мерную колбу. Разбавляют D.I. до нужного объема, закрывают крышкой и встряхивают. Любой неиспользованный раствор хранят в сильно герметизированной емкости Nalgene™.
2.17.1.1.1. 0 мг/л - В 100 мл мерную колбу добавляют 10 мл ~0,5 М НОАс и 10 мл концентрированной HCl, и разбавляют D.I. до метки. Закрывают крышкой и встряхивают.
2.17.1.1.2. 30 мг/л - В 100 мл мерную колбу добавляют 10 мл - 0,5 М НОАс и 10 мл концентрированной HCl, и 3 мл сертифицированного стандартного раствора фосфора 1000 мг/л, и разбавляют D.I. до метки. Закрывают крышкой и встряхивают.
2.17.1.1.3. Холостая проба матрицы - В 100 мл мерную колбу добавляют 10 мл ~0,5 М НОАс и 10 мл концентрированной HCl, и разбавляют D.I. до метки. Закрывают крышкой и встряхивают.
2.17.1.1.4. 20 мг/л стандартный раствор для контроля качества - В 100 мл мерную колбу добавляют 10 мл ~0,5 М НОАс и 10 мл концентрированной HCl, и 2 мл НЕЗАВИСИМОГО сертифицированного стандартного раствора фосфора 1000 мг/л, и разбавляют D.I. до метки.
2.17.2. Анализируют разбавленные образцы, стандартные растворы для контроля качества и холостую пробу матрицы на предмет фосфора с использованием длины волны
213,617 нм. Градуировочная кривая 0, 30 мг/л является линейным для ICP при длине волны 213,617 нм.
2.17.3. Фиксируют процент завершения реакции для Т=30 и Т=60.
3.0 Расчеты
3.1. R-[A-B]×C÷D, где: R = Результат (мг/л)
A = показание ICP (мг/л)
B = показание ICP (мг/л) для холостой пробы матрицы
C = Разведение (мл)
D = Аликвота (мл)
3.2. Завершение реакции =
где: R0=Результат «Т=0» (мг/л)
Rt = Результаты «Т=30» или «Т=60» (мг/л)
1000 = Объем реакционной смеси (мл)
30,974 = Атомная масса фосфора
W = Масса образца (г)
factor=(% La в образце)÷100 (%La должен быть приведен в Сертификате анализа для LDOC. Если его нет, приемлемым значением для использования является: factor=0,7512)
138,906 = Атомная масса лантана
Пример - % Завершения реакции для образца LDOC:
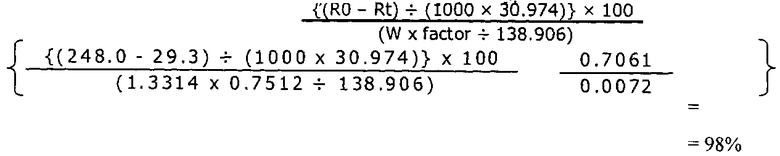
3.3. Среднее значение (m) - описывает метод усреднения. Сложение численных значений (x, y, z и т.д.) из анализа и деление данной суммы на число n измерения дает среднее значение. Выражено в единицах исходных данных.
х=m={х+y+z)÷n, где:
х=m = среднее значение
x,y,z = Индивидуальные измерения
n = Общее число измерений
m = среднее значение (a:z) (Расчет Excel)
где: m = Среднее значение
a:z = Представляет собой диапазон данных в электронной таблице Excel
3.4. σ=ds=ст.откл.(а:z) (Расчет Excel)
где: σ=ds = Стандартное отклонение
a:z = Представляет собой диапазон данных в электронной таблице Excel
3.5. % RSD=σ÷m×100, где: RSD = Относительное стандартное отклонение
σ=ds = Стандартное отклонение
m = Среднее значение
3.6. SR=R×100/V, где: SR = Стандартное обнаружение (%)
R = Рассчитанный результат (% завершения реакции)
V = Принятое значение (% завершения реакции)
4.0 Контроль качества
4.1. Повторности:
4.1.1. Включают один повтор в установку для растворения с каждым набором образцов (для анализов путем тестирования не при выпуске продукции)
4.1.2. Проводят три раза для тестирования при выпуске продукции (т.е. Сертификат анализа).
4.2. Холостые пробы:
4.2.1. Включают холостой реагент в установку для растворения с каждым набором образцов.
4.2.2. Включают холостую пробу матрицы для анализа ICP-OES. Используют результат ICP, полученный для данной холостой пробы матрицы, при расчете результатов образцов (см. раздел «Расчеты»).
4.3. Стандарты:
4.3.1. Включают собственный стандарт в установку для растворения с каждым набором образцов.
4.3.2. Включают сертифицированный стандарт третьей стороны для контроля качества в анализы ICP-OES. Его используют для проверки стандартных растворов и работы инструментов.
4.4. Критерии приемлемости:
4.4.1. Повторности должны быть ≤6% RSD (см. раздел «Расчеты»)
4.4.2. Собственный стандарт: % обнаружения должен составлять от 90 до 110% значения СоА (см. раздел «Расчеты»)
4.4.3. Стандарт для контроля качества: % обнаружения должен составлять от 98 до 102% сертифицированного значения (см. раздел «Расчеты»)
4.4.4. Исходный раствор фосфата должен содержать 50,1±1,3 г/л фосфора. Это обеспечит в образце Т=0 содержание фосфора 250±6,3 мг/л.
4.5. Несоответствие спецификации (OOS) - Следуют собственной стандартной операционной процедуре (SOP) OOS 5.0
Источники
5.1. Также см. Патент США №5968976, Anormed: «Фармацевтическая композиция, содержащая выбранные гидраты карбоната лантана» ("Pharmaceutical composition containing selected lanthanum carbonate hydrates").
[0199] Содержание всех литературных источников, патентов, заявок на патенты или других публикаций, описанных в настоящем документе, включено в настоящее описание посредством ссылки.
[0200] Несмотря на то, что данное изобретение в настоящем документе было описано со ссылкой на конкретные варианты реализации, следует понимать, что данные варианты реализации лишь иллюстрируют принципы и применения настоящего изобретения. Поэтому следует понимать, что возможны многочисленные модификации указанных иллюстративных вариантов реализации, и что могут быть разработаны другие варианты, не выходя за рамки сущности и объема настоящего изобретения, определяемых прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИАЛЛЕРГЕННЫЕ КОМБИНАЦИИ СОЛЕЙ КАЛЬЦИЯ И ЛАНТАНА | 2009 |
|
RU2513948C2 |
| ПРИМЕНЕНИЕ СОЕДИНЕНИЙ РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ ДЛЯ ПРЕДОТВРАЩЕНИЯ МОЧЕКАМЕННОЙ БОЛЕЗНИ | 2002 |
|
RU2296584C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ДОСТАВКИ В ЦНС АРИЛСУЛЬФАТАЗЫ А | 2011 |
|
RU2671503C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2121835C1 |
| ЖИДКИЕ СТАБИЛЬНЫЕ ВИРУСНЫЕ ВАКЦИНЫ | 2013 |
|
RU2641970C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ДОСТАВКИ В ЦНС АРИЛСУЛЬФАТАЗЫ А | 2011 |
|
RU2783380C2 |
| КОМПОЗИЦИЯ ДИОКСИДА ЦЕРИЯ - ДИОКСИДА ЦИРКОНИЯ - ДИОКСИДА АЛЮМИНИЯ С УЛУЧШЕННОЙ ТЕРМИЧЕСКОЙ СТАБИЛЬНОСТЬЮ | 2012 |
|
RU2631511C2 |
| ОРАЛЬНАЯ КОМПОЗИЦИЯ ДЛЯ АБСОРБЦИИ ФОСФОРНЫХ СОЕДИНЕНИЙ | 2005 |
|
RU2392926C2 |
| ТАКСАНОВЫЕ ЧАСТИЦЫ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2750163C2 |
| АДСОРБЕНТ ФОСФАТА НА ОСНОВЕ СОЕДИНЕНИЙ ЖЕЛЕЗА (III) И УГЛЕВОДОВ | 2007 |
|
RU2447933C2 |


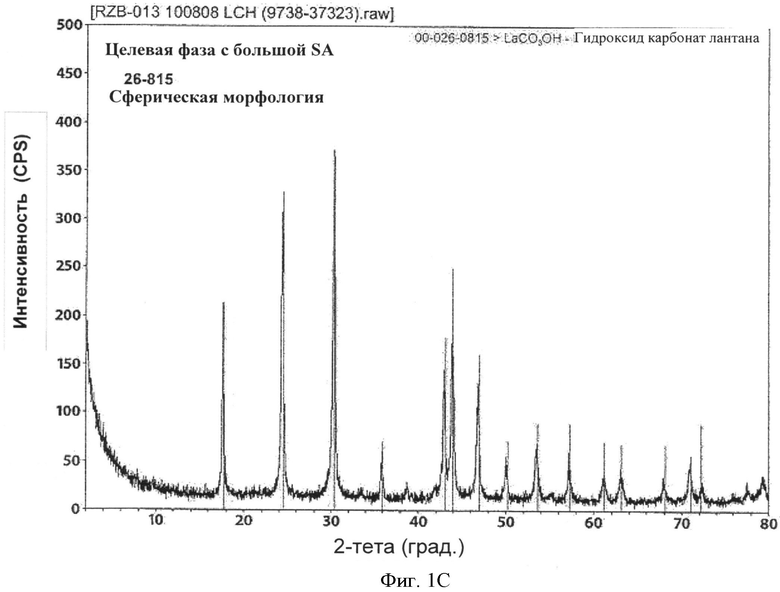
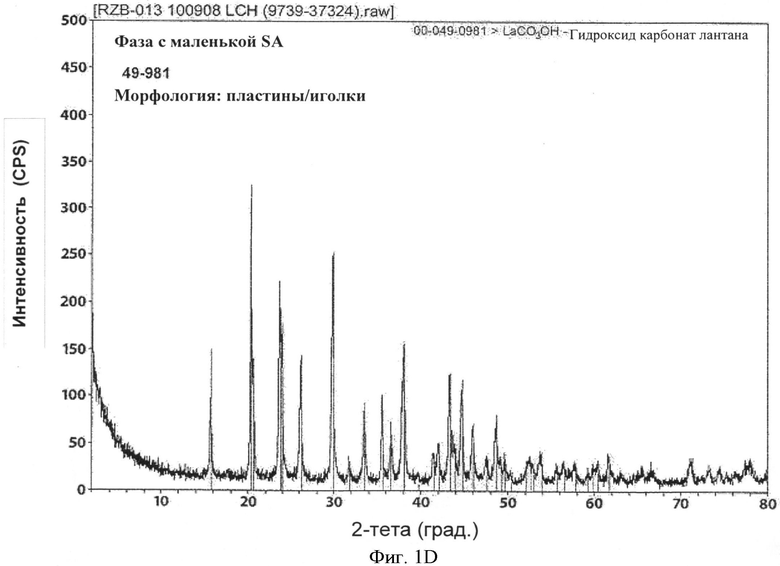
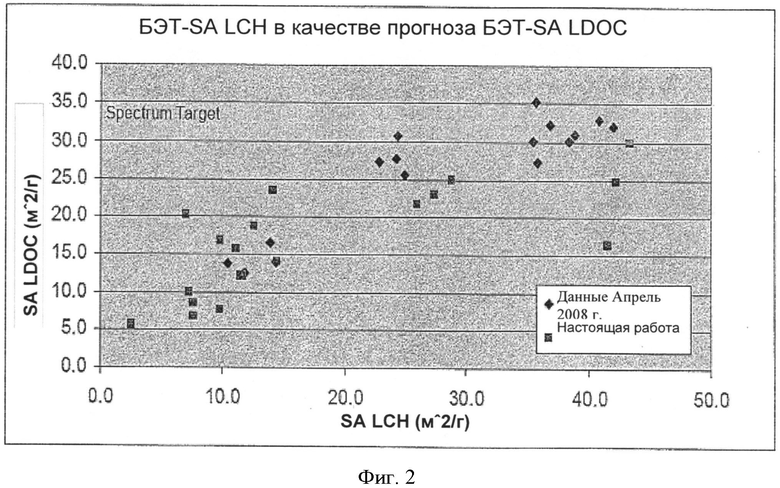
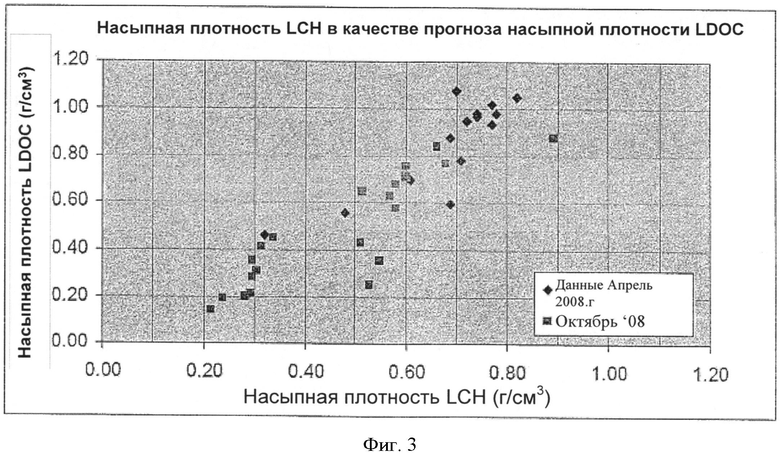
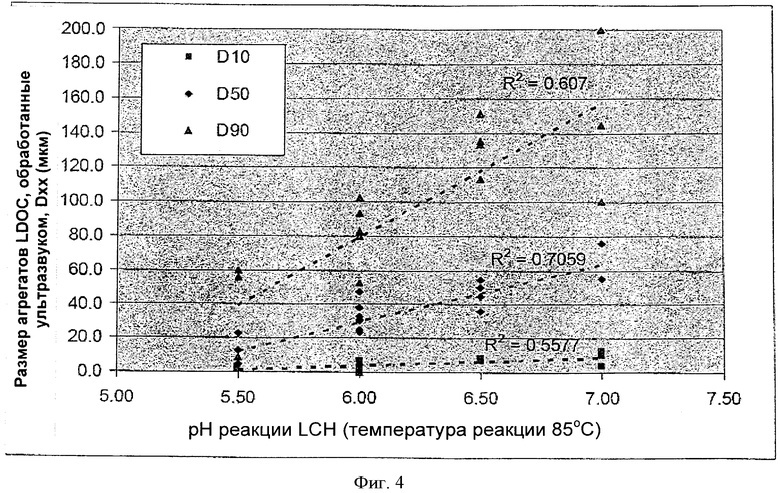

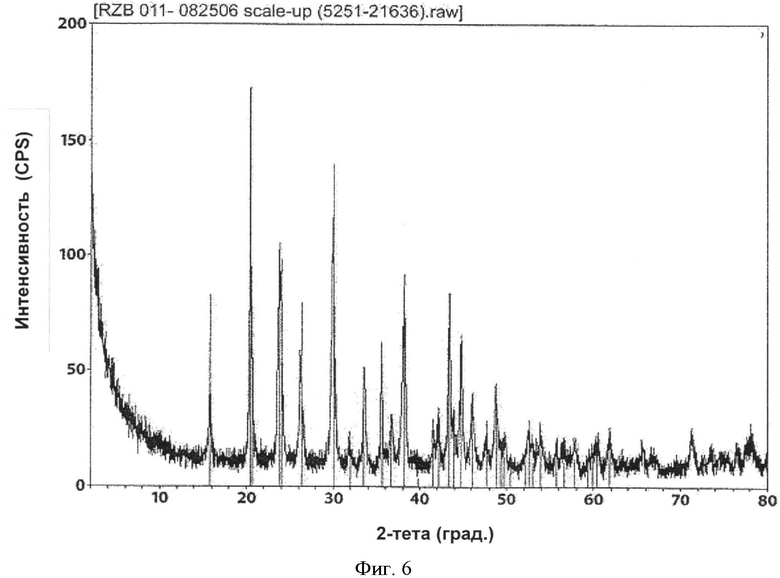
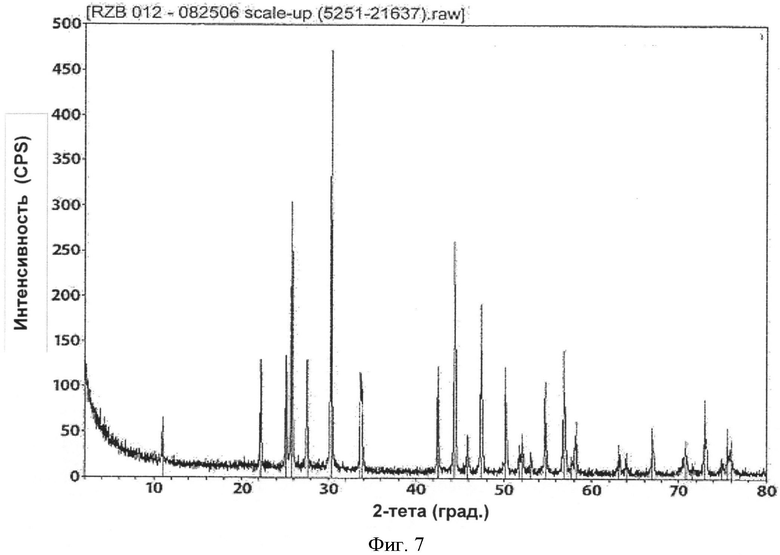
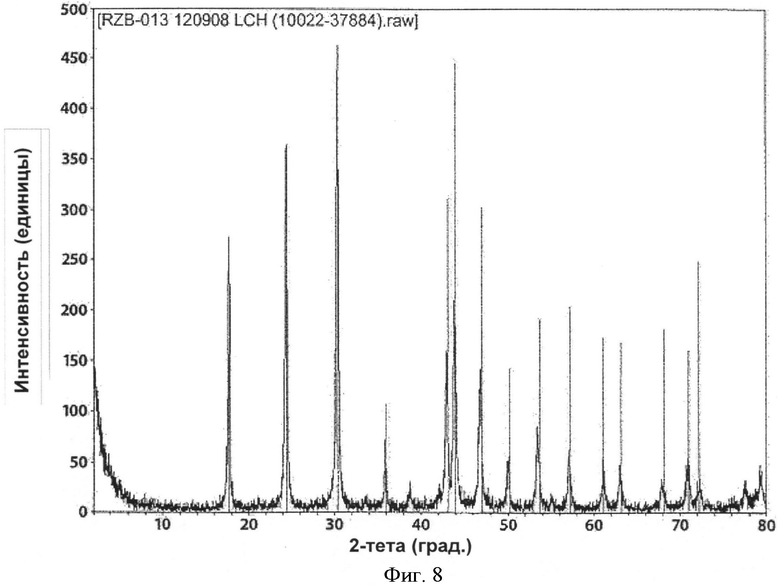
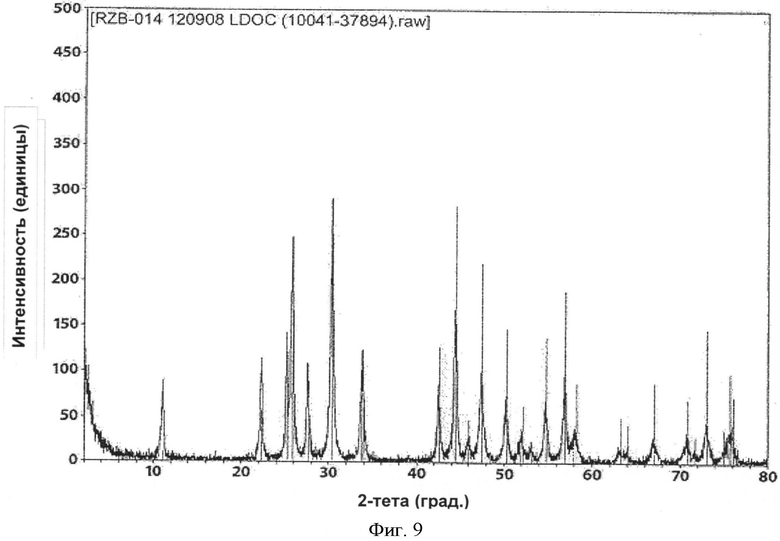


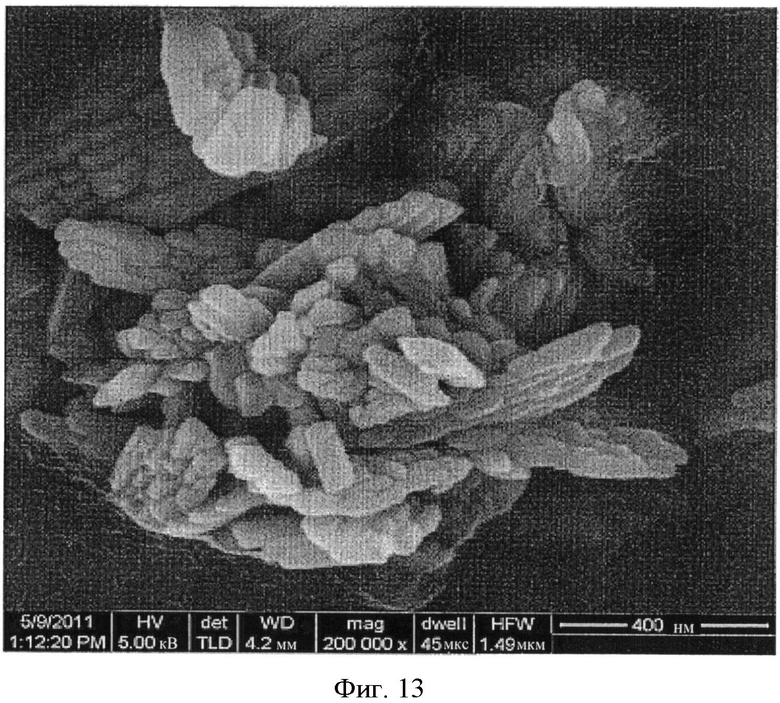
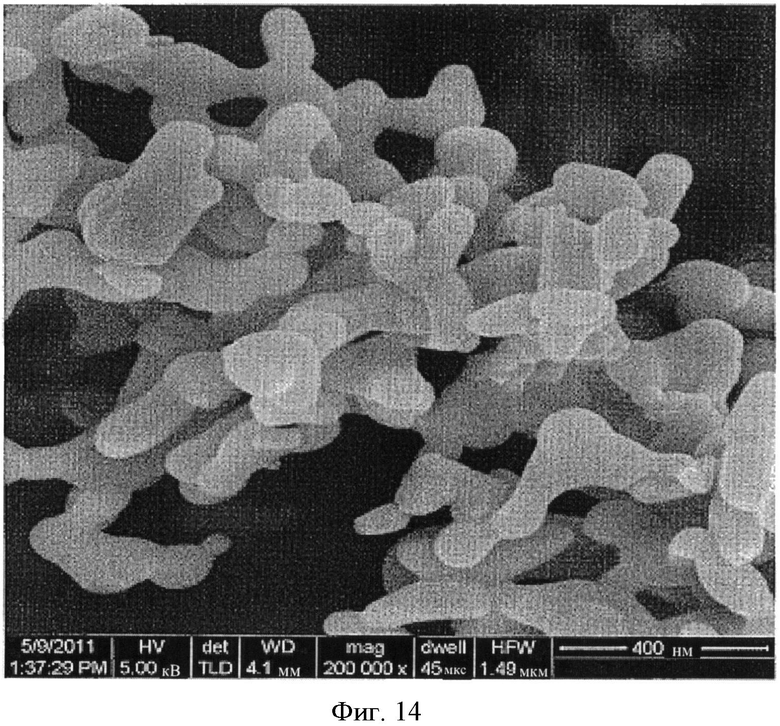
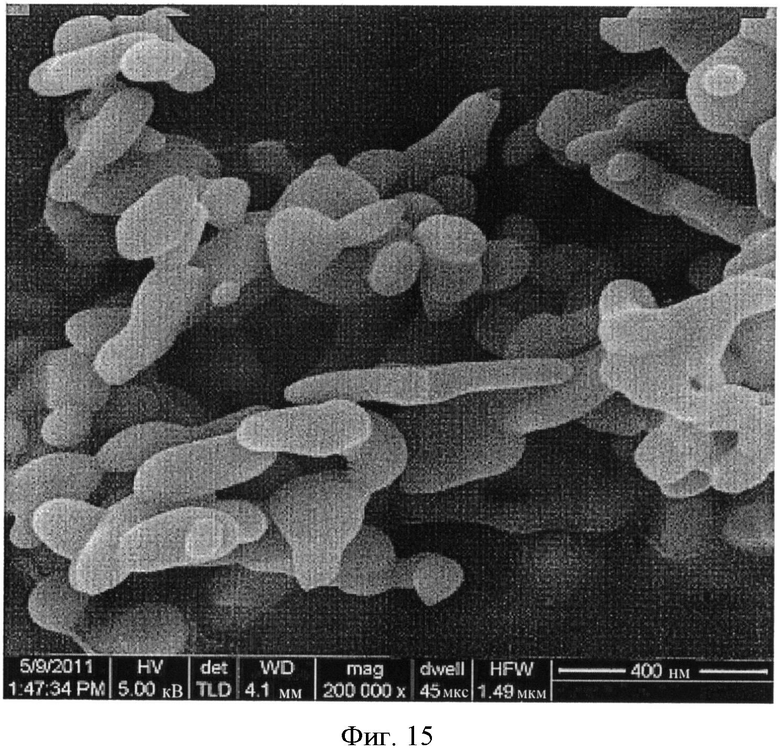


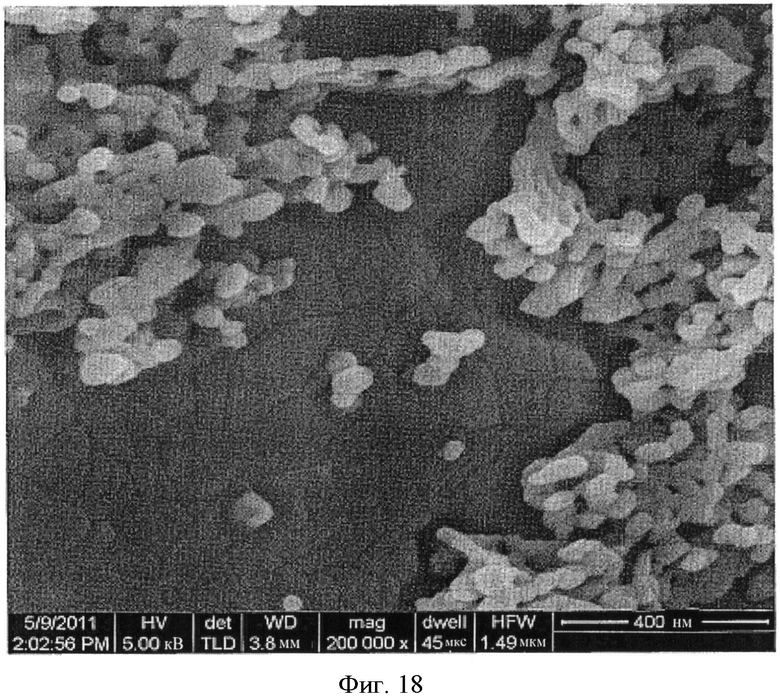


Изобретение относится к способам получения соединений карбоната лантана и их применению, а именно к способам получения гидроксида карбоната лантана и диоксикарбоната лантана и фармацевтической композиции, содержащей диоксикарбонат лантана. Способ получения соединения карбоната лантана включает осуществление реакции растворимой соли хлорида лантана с карбонатом аммония в растворителе при температуре реакции от примерно 75 градусов Цельсия до примерно 90 градусов Цельсия, при рН от примерно 6,0 до 7,5, и осаждение продукта реакции, при этом продукт реакции представляет собой гидроксид карбонат лантана, содержащий примерно 0,5 масс. % или меньше натрия. При дополнительном обжиге продукта реакции при температуре от примерно 400 до примерно 700 градусов Цельсия в течение двух часов получают диоксикарбонат лантана, содержащий одну или более полиморфных форм формул La2O2CO3 и La2CO5 и содержащий примерно 0,75 масс. % или меньше натрия. Изобретение обеспечивает получение соединений карбоната лантана, обладающих улучшенными свойствами. 4 н. и 17 з.п. ф-лы, 23 ил., 20 табл., 8 пр.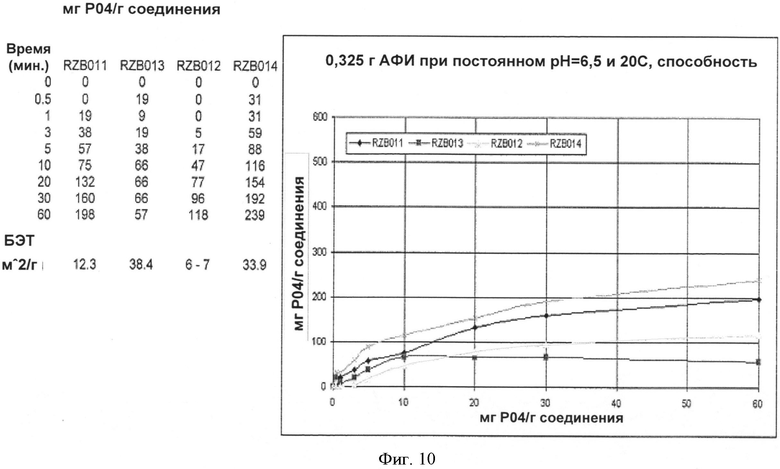
1. Способ получения соединения карбоната лантана, включающий осуществление реакции растворимой соли хлорида лантана с карбонатом аммония в растворителе при температуре реакции от примерно 75 градусов Цельсия до примерно 90 градусов Цельсия, при рН от примерно 6,0 до 7,5, и осаждение продукта реакции, при этом указанный продукт реакции представляет собой гидроксид карбонат лантана, содержащий примерно 0,5 масс. % или меньше натрия.
2. Способ по п. 1, где количество хлорида лантана относительно количества карбоната аммония в реакции находится в диапазоне от примерно 1:0,8 до примерно 1:4.
3. Способ по п. 1, где полученный гидроксид карбонат лантана характеризуется рентгенограммой, совпадающей с рентгенограммой из файла 26-815 Международного центра дифракционных данных (ICDD).
4. Гидроксид карбонат лантана, полученный способом по любому из пп. 1-3.
5. Способ по п. 1, дополнительно включающий обжиг продукта реакции при температуре от примерно 400 до примерно 700 градусов Цельсия в течение по меньшей мере двух часов с получением диоксикарбоната лантана, содержащего одну или более полиморфных форм формул La2O2CO3 и La2CO5 и содержащего примерно 0,75 масс. % или меньше натрия.
6. Способ по п. 5, где температура обжига составляет примерно 550 градусов Цельсия.
7. Способ по п. 5, где полученный диоксикарбонат лантана содержит не более примерно 5 масс. % полиморфной формы формулы La2CO5.
8. Способ по п. 5, где полученный диоксикарбонат лантана содержит не более примерно 1 масс. % полиморфной формы формулы La2CO5.
9. Диоксикарбонат лантана, полученный способом по любому из пп. 5-8.
10. Фармацевтическая композиция, содержащая эффективное количество диоксикарбоната лантана, полученного способом по любому из пп. 5-8, и по меньшей мере один фармацевтически приемлемый наполнитель, при этом указанная фармацевтическая композиция представляет собой лекарственную форму, выбранную из группы, состоящей из глотательных таблеток, глотательных таблеток в виде капсул, прессованных лекарственных форм, глотательных твердых желатиновых капсул, глотательных мягких гелевых капсул, растворимых во рту таблеток, растворимых во рту таблеток в виде капсул, растворимых во рту твердых желатиновых капсул, растворимых во рту мягких желатиновых капсул, жевательных таблеток, жевательных таблеток в виде капсул, жевательных капсул, порошков, капсул с заключенными внутри мелкими частицами (sprinkles), распадающихся во рту пленок, пищевых продуктов, продуктов со сладким наполнителем, жевательных резинок, сиропов, суспензий, эмульсий и дисперсий.
11. Фармацевтическая композиция по п. 10, где эффективное количество диоксикарбоната лантана находится в диапазоне от примерно 125 до примерно 20000 мг и где указанный диоксикарбонат лантана содержит диоксикарбонат лантана формулы La2O2CO3.
12. Фармацевтическая композиция по п. 10, где эффективное количество диоксикарбоната лантана выбрано из группы, состоящей из примерно 100, 125, 150, 250, 500, 750 или 1000 мг.
13. Фармацевтическая композиция по любому из пп. 10-12 для лечения состояния, характеризующегося аномально повышенным уровнем фосфата в крови.
14. Фармацевтическая композиция по п. 13, где состояние выбрано из группы, состоящей из гиперфосфатемии, хронической болезни почек, общей почечной недостаточности, терминальной стадии почечной недостаточности и хронической почечной недостаточности.
15. Фармацевтическая композиция по п. 10, где диоксикарбонат лантана имеет площадь поверхности, определенную по методу Брунауэра-Эммета-Теллера (БЭТ), от примерно 20 м2/г до 40 м2/г.
16. Фармацевтическая композиция по п. 10, где диоксикарбонат лантана имеет объем пор по меньшей мере 0,015 см3/г.
17. Фармацевтическая композиция по п. 10, где диоксикарбонат лантана имеет объем пор по меньшей мере 0,020 см3/г.
18. Фармацевтическая композиция по п. 10, где диоксикарбонат лантана демонстрирует кинетику связывания при рН 6,5 через 60 минут, составляющую по меньшей мере 150 мг РО4 на грамм указанного диоксикарбонат лантана.
19. Фармацевтическая композиция по п. 10, где диоксикарбонат лантана демонстрирует кинетику связывания при рН 6,5 через 60 минут, составляющую по меньшей мере примерно 180 мг РО4 на грамм указанного диоксикарбонат лантана.
20. Фармацевтическая композиция по п. 10, где диоксикарбонат лантана демонстрирует кинетику связывания при рН 6,5 через 60 минут, составляющую по меньшей мере примерно 200 мг PO4 на грамм указанного диоксикарбонат лантана.
21. Фармацевтическая композиция по п. 10, где частицы диоксикарбоната лантана имеют сферическую морфологию.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| US 7588782 B2, 15.09.2009 | |||
| ПРИМЕНЕНИЕ СОЕДИНЕНИЙ РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ ДЛЯ ПРЕДОТВРАЩЕНИЯ МОЧЕКАМЕННОЙ БОЛЕЗНИ | 2002 |
|
RU2296584C2 |
Авторы
Даты
2015-12-10—Публикация
2011-05-12—Подача