Настоящее изобретение относится к применению пара-аминогиппуровой кислоты (ПАГ) или ее фармацевтически приемлемой соли, или карбоксипроизводного для уменьшения у субъекта нефротоксических побочных эффектов меченных радиоактивным изотопом и немеченных радиоактивным изотопом терапевтических и диагностических (например, предназначенных для визуализации) соединений. Настоящее изобретение также относится к фармацевтической композиции, предназначенной для защиты почек во время визуализации или лечения, проводимых с использованием меченных радиоактивным изотопом и/или немеченных радиоактивным изотопом соединений, где композиция содержит меченое радиоактивным изотопом и/или немеченое радиоактивным изотопом фармацевтическое соединение в комбинации с пара-аминогиппуровой кислотой (ПАГ) или ее фармацевтически приемлемой солью, или карбоксипроизводным и фармацевтически приемлемый инертный наполнитель, разбавитель, носитель или их комбинацию. Настоящее изобретение также относится к способу уменьшения у субъекта нефротоксических побочных эффектов меченных радиоактивным изотопом и немеченных радиоактивным изотопом терапевтических и диагностических соединений, способ включает введение пара-аминогиппуровой кислоты (ПАГ) или ее фармацевтически приемлемой соли, или карбоксипроизводного в комбинации с меченным радиоактивным изотопом или немеченным радиоактивным изотопом терапевтическим или диагностическим соединением, где введение ПАГ проводят до и/или во время, и/или после введения меченого радиоактивным изотопом или немеченого радиоактивным изотопом терапевтического или диагностического соединения, и способ включает введение субъекту фармацевтической композиции, предлагаемой в настоящем изобретении, во время визуализации или лечения, проводимых с использованием меченого радиоактивным изотопом и/или немеченого радиоактивным изотопом соединения.
В частности, настоящее изобретение относится к применению ПАГ или ее фармацевтически приемлемой соли, или карбоксипроизводного для подавления накопления в почках и улучшения биологического распределения in vivo меченных радиоактивным изотопом молекул, которые могут вызвать повреждение почек, в особенности, терапевтических радиофармацевтических средств, и/или для улучшения контрастности в случае диагностических радиофармацевтических средств путем применения пара-аминогиппуровой кислоты (ПАГ) или ее соли, или карбоксипроизводного (например, аминогиппурата натрия).
При проведении новейшего медицинского лечения пациенты подвергаются воздействию увеличивающегося количества лекарственных средств, предназначенных для диагностики и лечения. Некоторые из этих лекарственных средств вызывают побочные эффекты, связанные с системной токсичностью, включая нарушение функции почек. В почках происходит очищение от большинства их этих соединений и они повторно абсорбируются и частично остаются в проксимальных канальцах, это вызывает зависимую от дозы нефротоксичность. Нефротоксичность вызывает тяжелые клинические синдромы, включая острое повреждение почек (ОПП). Нефротоксические средства, как этиологические факторы, вовлечены в 17-26% случаев внутрибольничного ОПП. Вызванная лекарственными средствами почечная недостаточность обусловлена лекарственными средствами различных классов и они включают отпускаемые по рецепту средства, а также общеупотребительные отпускаемые без рецепта лекарственные средства.
Токсичность терапевтических и потенциальных диагностических средств может быть связана с самим фармакологическим соединением и степень токсичности может увеличиваться в микросреде почек. Так, например, задачей химиотерапии является уничтожение злокачественных клеток путем использования различных механизмов воздействия, направленных на обеспечение остановки деления клеток. Поскольку в доброкачественных клетках клеточный цикл протекает обычным образом, подвергаются воздействию также здоровые ткани, включая клетки паренхимы почек. Почки, как фильтрующий орган, особенно подвержены воздействию токсичных соединений. Поскольку почки получают существенную долю минутного объема крови, сильный поток крови через почки вызывает воздействие на почки лекарственных средств и метаболитов лекарственных средств. Некоторые из этих средств обладают зарядом и размером, необходимым для фильтрации в клубочках и последующего прохода в эпителиальные клетки почечных канальцев вследствие пиноцетоза или эндоцитоза. Другие лекарственные средства переносятся по околоканальцевым капиллярам и получают доступ к базолатеральной поверхности эпителиальных клеток почечных канальцев, где они захватываются переносчиками органических анионов и органических катионов (ОАТ и ОСТ соответственно) и вытекают в просветы канальцев, где они могут вызывать клинически значимую нефротоксичность.
Известно, что некоторые противораковые терапевтические средства, например, цисплатин, являются нефротоксическими. Цисплатин ((SP-4-2)-диаминдихлоридплатина(II)) представляет собой комплекс атома платины с NH3 и Cl (плоский квадратный комплекс). Его нефротоксичность обусловлена его накоплением в клетках почек и его связыванием в клетках с ДНК (дезоксирибонуклеиновая кислота), таким образом он ингибирует клеточные механизмы, в частности, репликацию клеток. Нефротоксичность цисплатина описана в публикации Natochin et al. (Comp. Biochem Biochem. Physiol Vol. 94С, No.1 рр 115-120, 1989). Описано, что холинхлорид, ПАГ, фуросемид и этакриновая кислота ослабляют нефротоксическое воздействие цисплатина у крыс.
Также известно, что нефротоксичность является нежелательным побочным эффектом при введении терапевтических средств/диагностических средств на основе радиоактивных изотопов.
Диагностические средства, вследствие их не такого частого введения данному субъекту, редко являются в высокой степени нефротоксическими для этого субъекта. Однако при использовании таких диагностических средств для визуализации (в частности, для визуализации с помощью ОФЭКТ (однофотонная эмиссионная компьютерная томография) или ПЭТ (позитронная эмиссионная томография)) необходимы эффективное биологическое распределение и контрастность.
В частности, происходит почечный клиренс, накопление и удерживание в почках меченных радиоактивным изотопом пептидов, пептидомиметиков, фрагментов антител, кнотанов или меченых ингибиторов и других соединений, это приводит, например, к облучению почек большой дозой и, таким образом, к повышенному риску радиотоксичности для почек. Кроме того, быстрое выведение из почек, например, радиофармацевтических средств, приводит к субоптимальному биологическому распределению и низкой степени накопления средств в целевых органах. Обусловленная радиоактивным изотопом нефротоксичность основана на механизме, принципиально отличающимся от механизма нефротоксичности, обусловленной другими противораковыми средствами, например, цисплатином. Радиоактивные изотопы, вследствие их радиоактивности, обычно вызывают оксидативный стресс клеток без проникновения в клетки.
Таким образом, нефротоксичность является хорошо известным побочным эффектом лечения радиолигандами (ЛРЛ), при этом, например, почки являются ограничивающим дозу органом. В публикациях патентов предшествующего уровня техники, ЕР 1196154 В1, ЕР 0094378, ЕР 2021012 В1 и US 2016/0143926 А1, описано, что совместное введение аминокислот, таких как лизин и аргинин или их смесей, и других соединений, таких как амифостин или желатин, может уменьшить накопление и удерживание [177Lu-DOTA0,Tyr3]-октреотата, [177Lu-DOTA0-Tyr3]-октреотида и [111In-DTPA-D-Phel]-октреотида. Использование средств для защиты почек является чрезвычайно важным. Лютатеру, первое меченое с помощью 177Lu лекарственное средство, утвержденное FDA (Управление по надзору за качеством пищевых продуктов и медикаментов), вводят только в комбинации с предназначенной для вливания смесью аминокислот (Receptor-mediated radionuclide therapy with 90Y-DOTATOC in association with amino acid infusion: a phase I study; Lisa Bodei et al. Eur J Nucl Med (2003) 30: 207-216; 86Y-DOTA0)-D-Phel-Tyr3-octreotide (SMT487) - a phase 1 clinical study: pharmacokinetics, biodistribution and renal protective effect of different regimens of amino acid co-infusion. Jamar F et al., Eur J Nucl Med Mol Imaging. 2003 Apr; 30(4): 510-8).
Дозу излучения, абсорбированную почками, можно уменьшить путем совместного вливания средств, которые конкурентно ингибируют повторную абсорбцию меченого радиоактивным изотопом соединения, таких как положительно заряженные аминокислоты, гелофузин, трипсинизированный альбумин или FRALB-C (бычий сывороточный альбумин, фрагментированный бромцианом) (Albumin derived peptides efficiently reduce renal uptake of radiolabeled peptides, Vegt E et al., Eur J Nucl Med Mol Imaging (2010) 37: 226).
В других публикациях заявлено, что намного более существенное уменьшение накопления в почках можно обеспечить путем использования растворов лизин/аргинин в комбинации с такими соединениями, как амифостин и желатин (ЕР 1196154 В1, ЕР 2021012 В1). Для обеспечения более эффективного уменьшения повторной абсорбции меченных радиоактивным изотопом пептидов в почках исследовали использование комбинации двух или большего количества конкурентных ингибиторов эндоцитоза и другие подходы.
Другим подходом для защиты почек является введение меченных радиоактивным изотопом ингибиторов ПСМА (простатспецифический мембранный антиген) и совместное лечение связывающими молекулами, родственными по структуре ПСМА, такими как 2-(фосфонометил)пентандикарбоновая кислота (ФМПК), это улучшает значение отношения количеств соединения в почках и опухоли. Этот подход основан на специфичности кинетики накопления соединения в почках и опухолях соответственно (РМРА for nephroprotection in PSMA-targeted radionuclide therapy of prostate cancer, Kratochwil et al., JNM 2015 Feb; 56(2): 293; US 2018/207299).
Механизм воздействия в настоящее время разработанных и использующихся в клинической практике средств для защиты почек, предназначенных для совместного лечения, таких как раствор аминокислот или ФМПК, основан на ускоренном клиренсе радиофармацевтических средств из почек. Используют их сходство с радиофармацевтическими средствами, заключающееся в сходстве связывающей способности. Поэтому при использовании в клинической практике эти средства для защиты необходимо объединять с радиофармацевтическими средствами, обладающими сходной связывающей способностью в почках. Кроме того, вливание аминокислот, использующихся в качестве средств для защиты почек от воздействия радиоактивного вещества, может привести к клинически неблагоприятным побочным эффектам. Часто наблюдаются рвота и тошнота, вызванные вливанием больших объемов не являющихся изотоническими растворов аминокислот. Тяжелым опасным для жизни побочным эффектом таких вливаний, описанным в литературе, является гиперкалиемия (Effect of amino acid infusion on potassium serum levels in neuroendocrine tumor patients treated with targeted radiopeptide therapy. Giovacchini G et al., Eur J Nucl Med Mol Imaging. 2011 Sep; 38(9): 1675-82). Поэтому количество аминокислот, предназначенное для введения, обычно является ограниченным и составляет 25 г лизина и 25 г аргинина. В публикации Rolleman EJ et al. описано обеспечение уменьшения накопления в почках следующим образом: "(1) с помощью имеющегося в продаже раствора аминокислот (АК) (21±14%, Р<0,02), (2) с помощью 25 г (17±9%, Р<0,04), 50 г (15±13%, Р<0,04) или 75 г (44±11%, Р<0,001) лизина и (3) с помощью комбинации 25 г лизина и 25 г аргинина (LysArg) (33±23%, Р<0,01). Вливание только раствора (500, 1000 или 2000 мл смеси физиологический раствор/глюкоза) не приводило к изменению накопления радиоактивного вещества. У пациентов, которым вводили 75 г лизина (Lys75) и LysArg, существенно увеличивалась концентрации калия в сыворотке" (Safe and effective inhibition of renal uptake of radiolabeled octreotide by a combination of lysine and arginine. Rolleman EJ et al., Eur J Nucl Med Mol Imaging. 2003 Jan; 30(1): 9-15). В этом подходе защиты почек гиперкалиемия все еще остается непреодоленным затруднением, поскольку в качестве компонента смеси используют лизин и аргинин при высоких концентрациях (публикация Giovacchini G et al., приведенная выше).
Лизин и аргинин повторно абсорбируются в проксимальных канальцах с помощью натрий-независимых переносчиков аминокислот (SCL3A1). Механизм клиренса радиофармацевтических средств, таких как [177Lu-DOTA0-Tyr3]-октреотид, не является полностью понятным. Опубликованные результаты указывают на то, что переносчик аминокислоты SCL3A1 может играть некоторую роль в клиренсе радиофармацевтических средств, однако достоверно известно, что этот механизм не является основным и тем более не является единственным вовлеченным механизмом.
Поэтому объектом настоящего изобретения является разработка новейшего способа подавления накопления в почках, предназначенного для применения в качестве средства совместного лечения с широким спектром (радио)фармацевтических средств, независимо от механизма, на котором основано их накопление в почках, и, таким образом, уменьшения нефротоксических побочных эффектов (радио)фармацевтических средств, использующихся в качестве терапевтических, или, реже, в качестве диагностических соединений. Однако для визуализации в диагностических целях в медицине крайне необходимо улучшение их биологического распределения in vivo и улучшение контрастности путем увеличения их накопления в области, предназначенной для визуализации, например, накопления в любой ткани.
Эти задачи решены с помощью основных объектов, раскрытых в настоящем изобретении, в частности, определенных в формуле изобретения.
В основе настоящего изобретения лежит установление того, что пара-аминогиппуровая кислота (ПАГ) или ее фармацевтически приемлемая соль, или карбоксипроизводное может быть пригодно для применения, например, для улучшения биологического распределения терапевтических и диагностических соединений, в частности, содержащих радиоактивные изотопы. С помощью новейшего способа, предлагаемого в настоящем изобретении, можно изменить у субъекта клиренс таких средств, как, например, химиотерапевтические вещества или радиофармацевтические средства, такие как [177Lu-DOTA0-Tyr3]-октреотид, ингибиторы 177Lu-ПСМА или другие, которые могут вызвать повреждение почек. Кроме того, согласно изобретению было установлено, что введение ПАГ можно использовать для подавления повторной абсорбции лекарственного средства почками. Таким образом, концентрацию лекарственного средства в сыворотке можно (но необязательно) увеличить, это обеспечивает улучшенную биологическую доступность лекарственного средства.
Таким образом, настоящее изобретение является особенно подходящим для подавления накопления в почках разнообразных белковоподобных молекул, таких как белки и пептиды или их фрагменты, или фрагменты антител, которые по своей природе являются нефротоксическими. Более того, это справедливо независимо от того конъюгированы ли такие белковоподобные молекулы с токсином, радиоактивным изотопом, цитостатическим средством или другими потенциально токсичными для клеток средствами. В частности, согласно изобретению неожиданно было установлено, что нефротоксичность радиофармацевтических средств, обусловленная их радиоактивностью, также уменьшается при их совместном введении с ПАГ, предлагаемым в настоящем изобретении. Это обнаружение являлось еще более неожиданным, поскольку механизм, лежащий в основе воздействия меченных радиоактивным изотопом терапевтических средств/диагностических средств, является уникальным (радиоактивность) и отличается от других механизмов воздействия, например, наблюдающихся в случае противораковых лекарственных средств, таких как цисплатин.
Кроме того, с помощью настоящего изобретения обеспечена возможность накопления визуализирующих средств (в частности, предназначенным для ОФЭКТ и ПЭТ) в тканях, которые необходимо идентифицировать (например, в целевых областях опухоли), и, таким образом, уменьшения их содержания в не являющихся мишенями тканях. Таким образом, с помощью настоящего изобретения обеспечена возможность улучшения контрастности изображения, например, для заданной конъюгированной молекулы, содержащей радиоактивный изотоп, поскольку уменьшен ее почечный клиренс.
Пара-аминогиппуровая кислота (ПАГ)
Аминогиппуровая кислота или пара-аминогиппуровая кислота (ПАГ), производное гиппуровой кислоты, представляет собой амидное производное (а) аминокислоты-глицина и (b) пара-аминобензойной кислоты, которая не присутствует в организме человекам. Они ковалентно связаны амидной связью. Натриевая соль ПАГ, аминогиппурат натрия, является диагностическим средством, которое широко используют для диагностического исследования функции почек, в частности, для исследования потока почечной плазмы. В приведенном ниже описании аминогиппуровая кислота, пара-аминогиппуровая кислота и аминогиппурат (в частности щелочного или щелочноземельного металла), в частности натрия, используют, как синонимы, и они обозначены, как "ПАГ".
пара-аминогиппуровая кислота (ПАГ):
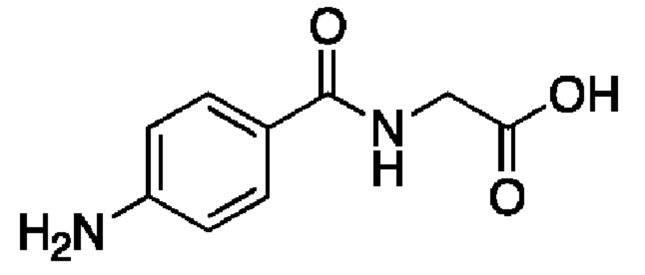
аминогиппурат натрия:

ПАГ обычно поставляют в виде стерильного не содержащего консерванты 20% водного раствора для инъекций. ПАГ фильтруется клубочками и активно секретируется в проксимальных канальцах. При низких концентрациях в плазме (от 1,0 до 2,0 мг/100 мл) в почках субъекта в результате одного цикла циркуляции происходит очистка примерно от 90% ПАГ, содержащейся в почечном кровотоке. ПАГ также используют для определения функциональной емкости механизма канальцевой секреции в почках или максимального транспорта (Tm ПАГ). Это проводят путем увеличения концентрации в плазме до значений (40-60 мг/100 мл), достаточных для насыщения максимальной емкости клеток канальцев для секреции ПАГ. ПАГ практически не вызывает каких-либо побочных эффектов и обладает пренебрежимо малой токсичностью (при внутривенном введении самкам мышей LD50 (полулетальная доза) равна 7,22 г/кг). Такие явления, как рвота и тошнота или гиперкалиемия, не описаны или, если они описаны, то в редких случаях.
В отличие от общепризнанных средств совместного лечения предшествующего уровня техники (например, использование смесей аминокислот), пара-аминогиппуровая кислота (аминогиппурат) обеспечивает возможность неспецифического модулирования клиренса (радио)фармацевтических средств, поскольку она является субстратом и/или функциональным ингибитором целого ряда переносчиков. ПАГ активно секретируется переносчиками в мочу. В настоящее время известно, что ПАГ является субстратом или ингибитором 14 различных переносчиков, включая трансмембранные переносчики органических катионов (например, ОСТ1, ОСТ1А, ОСТ2, ОСТ3, OCTN1, OCTN2, OCTN3) и трансмембранные переносчики органических анионов (например, ОАТ1, ОАТ2, ОАТ3, ОАТ4, ОАТ5, ОАТР, URAT1). Субстратами ПАГ также являются hMRP (белки, считывающие метилирование гистонов), АТФ-зависимые (АТФ = аденозинтрифосфат) переносчики потока.
Поэтому пара-аминогиппуровую кислоту или ее фармацевтически приемлемую соль, или карбоксипроизводное можно применять в качестве средства совместного лечения с широким спектром меченных радиоактивным изотопом или немеченных радиоактивным изотопом терапевтических и диагностических соединений, независимо от природы молекулы-носителя (т.е. пептид, фрагмент антител, пептидомиметик, малая молекула и т.п.). Установлено, что модулирование почечного клиренса с помощью ПАГ приводит к увеличению продолжительности циркуляции введенного лекарственного средства в крови и к увеличению его биологической доступности. Аминогиппуровую кислоту или ее соль можно вводить до и/или во время, и/или после введения (радио)фармацевтических средств, от которых в почках происходит очищение, например, путем вливания или инъекции.
Общие положения
Хотя настоящее изобретение подробно описано ниже, следует понимать, что настоящее изобретение не ограничено конкретными методологиями, протоколами и реагентами, описанными в настоящем изобретении, поскольку они могут меняться. Также следует понимать, что терминология, использованная в настоящем изобретении, не предназначена для ограничения объема настоящего изобретения, который ограничивается только прилагаемой формулой изобретения. Если не приведены другие определения, то все технические и научные термины, использованные в настоящем изобретении, обладают такими же значениями, как это обычно понимает специалист с общей подготовкой в данной области техники.
Ниже описаны элементы настоящего изобретения. Эти элементы приведены для конкретных вариантов осуществления, однако следует понимать, что их можно объединять любым образом и в любом количестве для образования дополнительных вариантов осуществления. Различные описанные примеры и предпочтительные варианты осуществления не следует считать ограничивающими настоящее изобретение только явно описанными вариантами осуществления. Это описание следует понимать, как поддерживающее и охватывающее варианты осуществления, которые объединяют явно описанные варианты осуществления с любым количеством раскрытых и/или предпочтительных элементов. Кроме того, любые перестановки и комбинации всех описанных в настоящей заявке элементов следует считать раскрытыми в описании настоящей заявки, если из контекста не следует иное.
В приведенных ниже описании и формуле изобретения, если из контекста не следует иное, термин "содержать" и его варианты, такие как "содержит" и "содержащий", следует понимать, как включение указанного элемента, целого числа или стадии, но не как исключение любого другого неуказанного элемента, целого числа или стадии. Термин "состоять из" является конкретным вариантом осуществления термина "содержать", согласно которому исключены любой другой неуказанный элемент, целое число или стадия. В контексте настоящего изобретения термин "содержать" охватывает термин "состоять из". Таким образом, термин "содержащий" охватывает "включающий", а также "состоящий из", например, композиция "содержащая" X, может состоять только из X или может включать что-то дополнительное, например, X+Y.
Термины в единственном числе в контексте описания настоящего изобретения (особенно в контексте формулы изобретения) включают термины в единственном числе и во множественном числе, если в настоящем изобретении не указано иное или и это явно не противоречит контексту. Указания диапазонов значений в настоящем изобретении предназначены просто для краткого указания по отдельности на каждое отдельное значение, находящееся в диапазоне. Если в настоящем изобретении не указано иное, каждое отдельное значение включено в описание, как если бы оно было по отдельности указано в настоящем изобретении. Никакое выражение в описании не следует понимать, как указание на какой-либо незаявленный элемент, существенный для практического осуществления настоящего изобретения.
Термин "примерно" для числового значения х означает х±10%.
Термин "субъект" при использовании в настоящем изобретении обычно включает людей и не являющихся людьми животных, и предпочтительно включает млекопитающих (например, не являющихся людьми приматов, включая мартышек, тамаринов, паукообразных обезьян, ночных обезьян, зеленых мартышек, беличьих обезьян и павианов, макак, шимпанзе, орангутанов, горилл; коров; лошадей; овец; свиней; кур; кошек; собак; мышей; крыс; кроликов; морских свинок и т.п.), включая химерных и трансгенных животных, и животных для, использующихся моделей заболеваний. В контексте настоящего изобретения, термин "субъект" предпочтительно означает не являющегося человеком примата или человека, наиболее предпочтительно человека.
Первым объектом настоящего изобретения является применение пара-аминогиппуровой кислоты (ПАГ) или ее фармацевтически приемлемой соли, или карбоксипроизводного для уменьшения нежелательного нефротоксического воздействия меченных радиоактивным изотопом или немеченных радиоактивным изотопом терапевтических и диагностических соединений у субъекта, подвергающегося лечению такими соединениями.
Как отмечено выше, ПАГ или ее соль является субстратом и/или ингибитором различных переносчиков в почки. Поэтому ее можно применять вместе с широким спектром меченных радиоактивным изотопом или немеченных радиоактивным изотопом терапевтических и диагностических соединений, которые предположительно попадают в клетки почечных канальцев, например, вследствие поглощения переносчиками органических анионов (ОАТ) и переносчиками органических катионов (ОСТ), таким образом они проявляют их потенциальную нефротоксичность. Ее также можно применять для защиты клеток почек от радиоактивного воздействия меченных радиоактивным изотопом терапевтических или диагностических средств, например, если они вследствие радиоактивности вызывают оксидативный стресс. Защита от нефротоксического воздействия также может специально включать защиту от гломерулотоксического воздействия.
Примеры терапевтических нефротоксических соединений включают, без наложения каких-либо ограничений, нестероидные противовоспалительные лекарственные средства, которые широко используют для ослабления боли и признаков воспаления; которые однако могут вызвать целый ряд связанных с почками осложнений, таких как преренальная азотемия, острый канальцевый некроз, острый папиллярный некроз, острый интерстициальный нефрит, хронический тубулоинтерстициальный нефрит (анальгетическая нефропатия), болезнь минимальных изменений, мембранозная нефропатия, гиперкалиемия и метаболический ацидоз (гипоренинемия и альдостеронопения, гипонатриемия, гипертензия); ингибиторы ангиотензинконвертирующего фермента и блокаторы рецептора ангиотензина II, которые используют для лечения гипертензии и застойной сердечной недостаточности, и для замедления прогрессирования диабетической нефропатии, и которые могут привести к высокому риску возникновения острого повреждения почек (ОПП) и гиперкалиемии; противомикробные средства, такие как неомицин, гентамицин, тобрамицин, амикацин и стрептомицин, которые обычно используют для лечения вызванных грамотрицательными бактериями инфекций, и внутриклеточное накопление которых приводит или к гибели клеток канальцев, или к функциональным изменениям переносчиков через клеточную мембрану, что приводит к нарушениям электролитного баланса (гипокалиемия, гипомагниемия и гипокальциемия); содержащие серу антибиотики, такие как сульфаметоксазол-триметоприм, который может вызвать гиперкалиемию вследствие ингибирования эпителиального натриевого канала, находящегося в дистальном извитом канальце, это приводит к выведению натрия, и сульфадиазин, который может вызвать острый интерстициальный нефрит и кристаллическую нефропатию; гликопептидные антибиотики, такие как ванкомицин, который может вызвать нефротоксичность вследствие острого канальцевого некроза; фторхинолоновые антибиотики, такие как кипрофлоксацин, который может вызвать острый интерстициальный нефрит и кристаллурию; другие антибиотики, такие как пенициллины и цефалоспорины, которые вызывают острый интерстициальный нефрит и острый канальцевый некроз; и полимиксины, такие как колистин и полимиксин В, которые вызывают острый интерстициальный нефрит вследствие токсического повреждения канальцев; противовирусные средства, такие как ацикловир, который может вызвать острое повреждение почек, обусловленное осаждением кристаллов в почечных канальцах, фоскарнет, который может вызывать острый канальцевый некроз, острое повреждение почек, нарушения электролитного баланса, такие как гипокальциемия, гипомагниемия, гипокалиемия и гипо- или гиперфосфатемия; средства против ретровирусов, такие как тенофовир, который является токсичным для клеток почек и вызывает острое повреждение почек, сопровождающееся или не сопровождающееся проксимальной тубулопатией, которая вызывает хроническое заболевание почек, и ингибиторы протеазы, такие как индинавир, абакавир, ритонавир и атазанавир, которые могут кристаллизоваться в почечных канальцах и вызывать связанное с кристаллами повреждение почек и нефролитиаз; фунгицидные средства, такие как амфотерицин В, который может вызвать острый канальцевый некроз и дисфункцию канальцев, которая проявляется в виде почечноканальцевого ацидоза, нарушений концентрации мочи и нарушений электролитного баланса; иммуносупрессивные средства, такие как ингибиторы кальциневрина (например, такролимус, циклоспорин), которые, в частности, используют для иммуносупрессивного лечения после пересадки цельного органа, и которые могут вызвать острое повреждение почек; литий, который является основным средством лечения пациентов, страдающих биполярным расстройством, и который может вызвать различные виды нефротоксичности, такие как нефрогенный несахарный диабет (ННСД), хроническое заболевание почек и хронический тубулоинтерстициальный нефрит. Другими терапевтическими средствами, вызывающими острое повреждение почек являются ингибиторы протонного насоса; ацетаминофен; ингибиторы HMG-CoA-редуктазы и осмотические средства.
Терапевтические нефротоксические соединения также включают химиотерапевтические средства, которые играют главную роль при лечении различных неоплазий и могут вызвать множество различных связанных с почками осложнений, таких как почечные синдромы, связанные с острым повреждением почек или хроническим заболеванием почек, и почечные синдромы, связанные с электролитными нарушениями. Примеры таких химиотерапевтических средств включают цисплатин (острый канальцевый некроз, проксимальные тубулопатии, гипернатриемия, гипомагниемия, гипокальциемия, дистальный почечноканальцевый ацидоз, тромботическая микроангиопатия), пеметрексед (острый канальцевый некроз), стрептозоцин (накже называющийся стрептозотоцином) (острый канальцевый некроз, проксимальные тубулопатии), митрамицин (острый канальцевый некроз), золедронат (острый канальцевый некроз), интерферон (острый интерстициальный нефрит), аллопуринол (острый интерстициальный нефрит), гемцитабин (тромботическая микроангиопатия), митомицин С (тромботическая микроангиопатия), антиангиогенные средства (тромботическая микроангиопатия), метотрексат (кристаллическая нефропатия) ифосфамид (проксимальные тубулопатии, гипернатриемия), циклофосфамид (гипонатриемия), винкристин (гипонатриемия), цетуксимаб (гипомагниемия), метотрексат (острое повреждение почек).
Так, например, известно, что цисплатин и ифосфамид, которые являются стандартными компонентами, использующимися в режимах лечения различных солидных опухолей органов, включая такие, от которых страдают дети, попадают в клетки, находящиеся в проксимальных канальцах, посредством переносчиков органических катионов (ОСТ2) (Shirali A, Perazella М, Advances in Chronic Kidney Disease, Vol 21, No 1 (January), 2014: pp 56-63). Поэтому полагают, что совместное введение ПАГ может эффективно уменьшить нефротоксические побочные эффекты этих химиотерапевтических средств.
Другие нефротоксические соединения включают радиоконтрастные агенты, такие как йодированные радиоконтрастные агенты, которые необходимы для некоторых процедур диагностической и инвазивной радиологии, и использование которых может привести к вызванной контрастным веществом нефропатии (ВКВН) и острому повреждению почек. Примерами йодированных ионных контрастных веществ являются диатризоат (Hypaque 50), метризоат (Isopaque 370), иоталамат (Сопгау), иоксаглат (Hexabrix); неионные контрастные вещества включают йопамидол (Isovue 370), иогексол (Omnipaque 350), йоксилан (Oxilan 350), йопромид (Ultravist 370), йодиксанол (Visipaque 320), йоверсол.
В предпочтительном варианте осуществления настоящего изобретения ПАГ применяют для уменьшения нефротоксических побочных эффектов радиофармацевтических средств, которые используют в качестве диагностических и терапевтических средств.
Радиофармацевтические средства могут содержать неметаллические (органические) радиоактивные изотопы (18F, 11С, 13N, 15О, 124I и т.п.) или радиометаллы (например, 90Y, 99mTc, 111In, 131l, 67Ga, 68Ga, 64Cu, 161Tb, 225Ac, 44Sc, 47Sc, 67Cu, 89Zr, 177Lu и т.п.). Хотя некоторые радиоактивные металлы, находящиеся в форме соли металла или комплекса металла, могут направленно воздействовать на определенную ткань, чаще всего необходимо конъюгировать радиоактивный изотоп/радиоактивный металл с обладающей направленным воздействием биомолекулой с целью обеспечения доставки радиоактивного изотопа к целевому участку, например, опухолевой ткани, необходимым образом. Биомолекулами могут являться, например, малые органические молекулы, пептиды, моноклональные антитела (mAbs) или фрагменты mAbs. Они выступают в роли средства перемещения ("носителя"), предназначенного для переноса радиоактивного изотопа к целевой ткани.
Имеющиеся в продаже радиофармацевтические средства, представляющие собой комплексы небольшого размера, включают, например, 99mTc-сестамиби (Cardiolite®), который используют для визуализации перфузии миокарда; 99mTc-тетрофосмин (Myoview®), который используют для визуализации перфузии миокарда; 99mTc-пентетат (DTPA) (Technescan®), который используют для визуализации почек и функциональных исследований; 99mTc-бицизат (ECD) (Neurolite®), который используют для визуализации перфузии головного мозга; 99mTc-MDP (Medronate®), который используют для сцинтиграфии скелета; 99mTc-тебороксим (Cardiotec®), который используют для визуализации перфузии миокарда; 111In-оксихинолин (индий-111-оксин®), который используют для сцинтиграфии с лейкоцитами; 111In-пентетат (индий-111-DTPA®), который используют для визуализации кинетики СМЖ (спинномозговая жидкость); 153Sm-EDTMP (Quadramet®), который используют для лечения боли в кости (терапия); 188Re-HEDP, который используют для лечения вызванной метастазами боли в кости.
Наиболее привлекательным подходом для обеспечения конъюгирования радиоактивного изотопа с обладающей направленным воздействием биомолекулой (носителем) является использование подходящего бифункционального хелатообразующего агента или хелатного агента, который прочно связывается или координируется с радиоактивным изотопом и в то же время содержит функциональные фрагменты, предназначенные для его конъюгирования с биомолекулой.
Примеры имеющихся в продаже пептидных конъюгатов или иммуноконъюгатов включают например, 99mTc-депреотид (NeoTect®), который используют для исследования некоторых поражении легких; 99mTc-арцитумомаб (CEA-Scan®99mTc-mAb), который используют для визуализации колоректального рака; 111In-капромабпендетид (ProstaScint®), который используют для визуализации рака предстательной железы; 111In-пентетреотид (Octreoscan®), который используют для визуализации нейроэндокринной опухоли; 111In-имциромабпентетат (MyoScint®), который используют для визуализации боли в груди, предположительно вызванной инфарктом миокарда; 111In-сатумомабпендетид (OncoScint®), который используют для визуализации метастатического заболевания, связанного с колоректальным раком и раком яичников; 90Y-ибритумомабтиуксетан (Zevalin®), который используют для лечения неходжкинской лимфомы (НХЛ); 68Ga-эдотреотид или 68Ga-DOTATE, предназначенный для визуализации нейроэндокринных опухолей; 177Lu-B DOTATETE (лютатера), предназначенный для лечения нейроэндокринных опухолей.
Таким образом, в особенно предпочтительном варианте осуществления настоящего изобретения ПАГ применяют для уменьшения нефротоксических побочных эффектов радиофармацевтических средств, таких как, например, указанные выше, при лечении и/или диагностике радиохимическими средствами/радиолигандами.
При лечении радиолигандами (также известном, как ПРРТ - пептидная рецепторная радионуклидная терапия) радиофармацевтические средства метят радиолигандом, который специфически связывается с мишенью, содержащейся в (опухолевой) клетке, например, с опухолевым клеточным поверхностным белком или маркером. После связывания соединения с целевым участком опухоли, например, с рецептором, радиоактивный изотоп испускает обладающее большой энергией бета-излучение для направленного воздействия на клетки, находящиеся в целевом участке.
При проведении диагностики с использованием радиолигандов меченое радиоактивным изотопом соединение связывается с мишенью, содержащейся в (опухолевой) клетке, например, с рецептором. Распад радиоактивного изотопа можно исследовать с помощью позитронной эмиссионной томографии (ПЭТ) или однофотонной эмиссионной компьютерной томографии (ОФЭКТ).
Поэтому в предпочтительном варианте осуществления настоящего изобретения ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное применяют уменьшения нефротоксических побочных эффектов фармацевтического средства, которое мечено радиоактивным изотопом ("радиофармацевтическое средство"). Предпочтительно, если радиофармацевтическим средством является конъюгированная молекула, которая содержит (i) молекулу-носитель, которая связывается со структурой-мишенью, содержащейся в (опухолевой) клетке (например, с рецептором или антигеном), (ii) хелатный агент (или хелатообразующий агент) и (iii) радиоактивный изотоп. Хелатный агент обычно координируется с радиоактивным изотопом, образуя таким образом меченный радиоактивным изотопом комплекс, который конъюгируется с молекулой-носителем.
Радиоактивный изотоп
Термин "радиоактивный изотоп" (или "радиоизотоп") означает изотопы природного или искусственного происхождения, обладающие нестабильным значением отношения количества нейтронов к количеству протонов, которые распадаются с испусканием корпускулярного излучения (т.е. протонного (альфа-излучение) или электронного (бета-излучение)) или электромагнитного излучения (гамма-излучение)). Другими словами, радиоактивные изотопы подвергаются радиоактивному распаду. В меченом радиоактивным изотопом комплексе, содержащемся в радиофармацевтическом средстве, в комплекс с хелатным агентом может быть включен любой известный радиоактивный изотоп. Такие радиоактивные изотопы могут включать, без наложения ограничений, 18F, 131I, 94Tc, 99mTc, 90In, 111In, 67Ga, 68Ga, 86Y, 90Y, 177Lu, 161Tb, 186Re, 188Re, 64Cu, 67Cu, 55Co, 57Co, 43Sc, 44Sc, 47Sc, 225Ac, 213Bi, 212Bi, 212Pb, 227Tn, 153Sm, 166Ho, 152Gd, 153Gd, 157Gd или 166Dy, предпочтительно 68Ga, 177Lu или 99mTc.
Выбор подходящих радиоактивных изотопов зависит, в частности, от химической структуры и хелатообразующей способности хелатного агента и, наиболее существенным образом зависит от назначения полученной (связанной) конъюгированной молекулы (например, в зависимости от ее использования для диагностики или лечения и, например, от подвергающегося лечению заболевания). Так, например, источники бета-излучения, такие как 90Y, 131I, 161Tb и 177Lu можно использовать для сопутствующего системного лечения радиоактивными изотопами. Использование DOTA, DOTAGA или DOTAM в качестве хелатообразующего агента может с успехом обеспечить возможность использования в качестве радиоактивных изотопов любого из следующих: 68Ga, 43,44,47Sc, 177Lu, 161Tb, 225Ac, 213Bi, 212Bi, 212Pb.
В некоторых предпочтительных вариантах осуществления радиоактивным изотопом может являться 177Lu. В некоторых предпочтительных вариантах осуществления радиоактивным изотопом может являться 111In. В некоторых предпочтительных вариантах осуществления радиоактивным изотопом может являться 90Y. В некоторых предпочтительных вариантах осуществления радиоактивным изотопом может являться 68Ga.
Хелатообразующий агент
Как отмечено выше, молекула-носитель, например, соединение, направленно воздействующее на (раковую) клетку, предпочтительно связано с хелатным агентом или хелатообразующим агентом, координирующимся с радиоактивным изотопом.
Термины "хелатообразующий агент" или "хелатный агент" используют в настоящем изобретении взаимозаменяемым образом. Они означают полидентантные (связанные множеством связей) лиганды, способные образовывать две или большее количество отдельных координационных связей ("координироваться") с центральным ионом (металла). Точнее, такие молекулы или молекулы, у которых одна электронная пара является общей, также могут называться "основаниями Льюиса". Центральный ион (металла) обычно координируется с хелатным агентом с помощью двух или большего количества электронных пар. Термины "бидентатный хелатный агент", "тридентантный хелатный агент" и "тетрадентантный хелатный агент" являются известными в данной области техники и означают хелатные агенты, содержащие две, три или четыре электронные пары, доступные для одновременной отдачи иону металла, координированному с хелатным агентом. Электронные пары хелатного агента обычно образуют координационные связи с одним центральным ионом (металла); однако в некоторых случаях хелатный агент может образовывать координационные связи более чем с одним ионом металла, при этом возможны различные виды связывания.
Термины "координирующийся" и "координирование" означают взаимодействие, при котором один содержащий множество электронных пар донор координационно связывается ("координируется") предпочтительно с одним центральным ионом (металла), т.е. становятся общими две или большее количество неподеленных электронных пар.
Хелатообразующим агентом или хелатным агентом предпочтительно является макроциклический бифункциональный хелатообразующий агент, содержащий расположенную на одном конце группу, образующую хелат с металлом, и расположенную на другом конце реакционноспособную функциональную группу, которая способна связываться с другими молекулами, например, с пептидами. Предпочтительно, если хелатообразующий агент выбирают таким образом, что при образовании комплекса с радиоактивным изотопом хелатообразующий агент образует квадратный бипирамидальный комплекс. В другом варианте осуществления хелатообразующий агент не образует плоский или плоский квадратный комплекс.
Хелатный агент предпочтительно выбирают на основании его способности координироваться с необходимым центральным ионом (металла), обычно радиоактивным изотопом, определенным выше в настоящем изобретении.
Соответственно, хелатообразующий агент может описываться одной из приведенных ниже формул (4a)-(4jj):
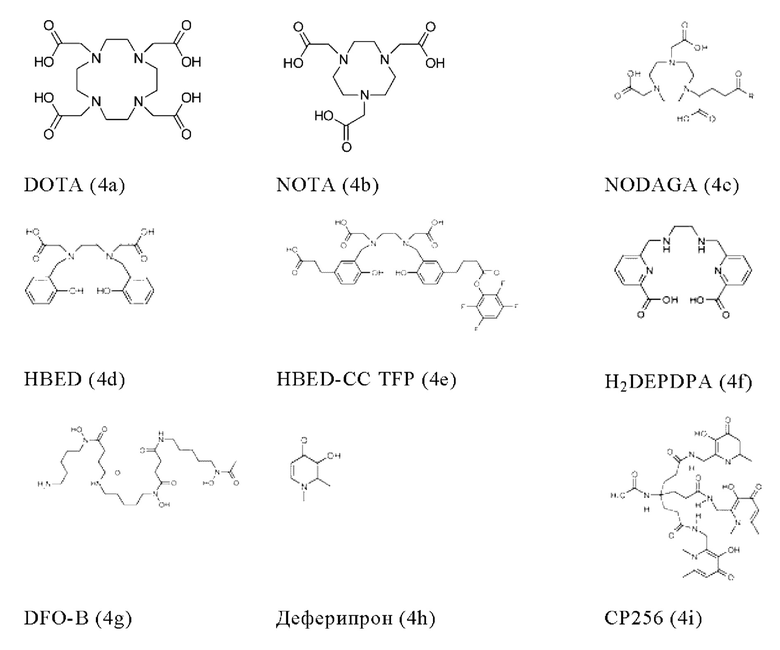
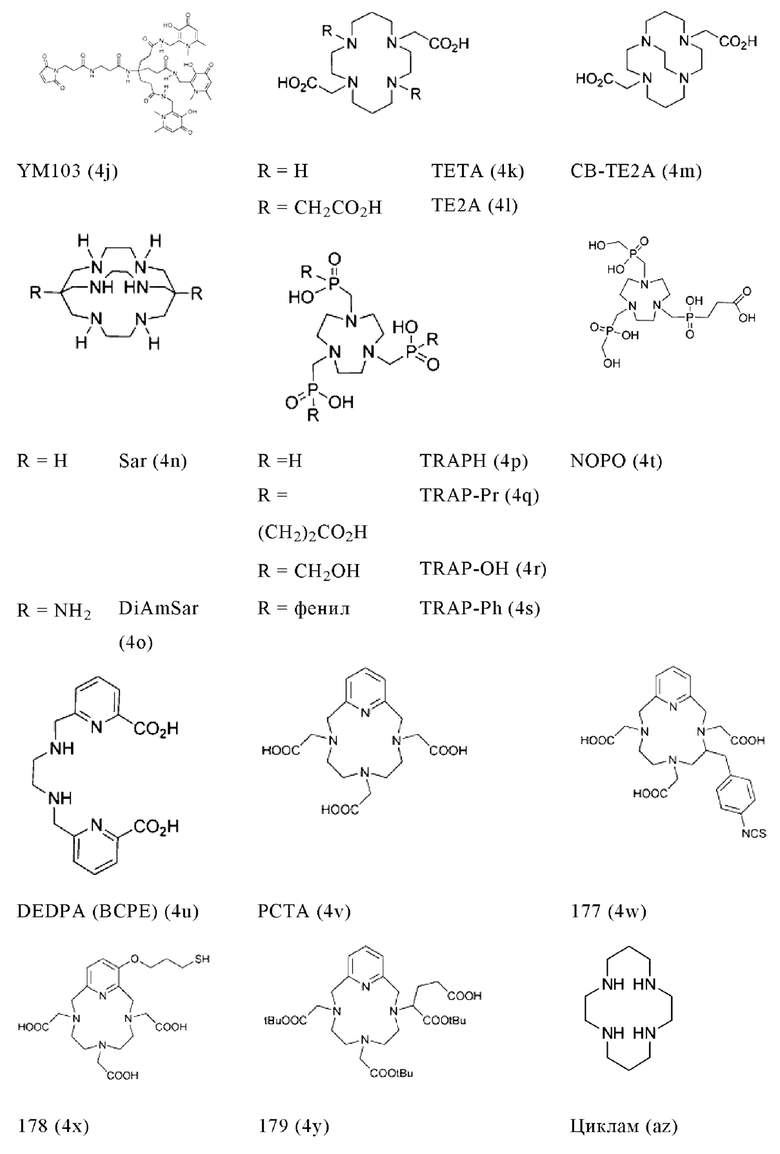
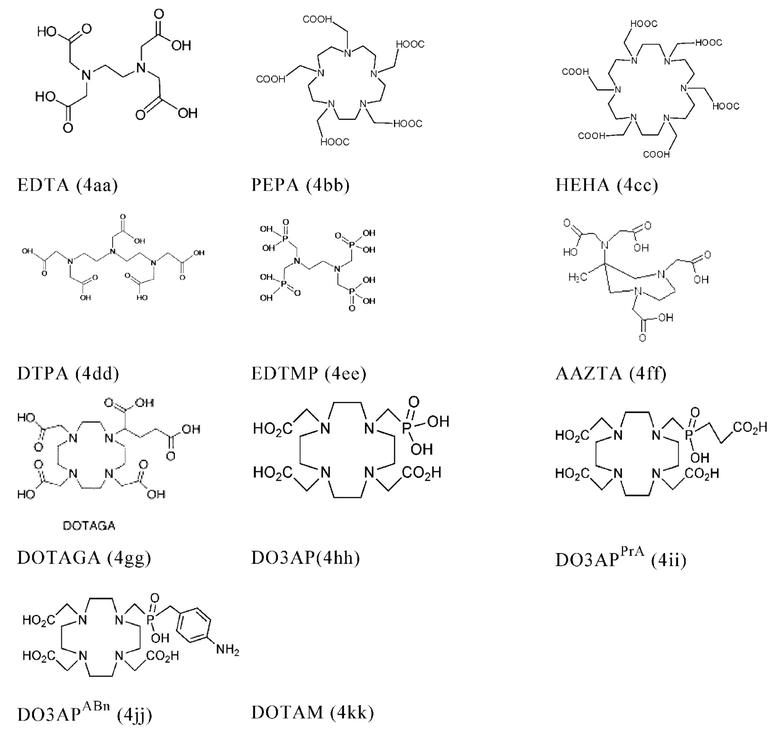
Предпочтительно, если хелатообразующим агентом может являться DOTA (1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота, которая может описываться формулой (4а)), HBED-CC (N,N''-бис[2-гидрокси-5-(карбоксиэтил)бензил]этилендиамин-N,N''-диуксусная кислота, которая может описываться формулой (4е)), DOTAGA (2-[1,4,7,10-тетраазациклододекан-4,7,10-трис(ацетат)]пентандикарбоновая кислота), DOTAM (1,4,7,10-тетракис(карбамоилметил)-1,4,7,10-тетраазациклододекан) или их производные.
Благоприятно, что DOTA эффективно образует комплексы с радиоактивными изотопами, использующими для диагностики (например, 68Ga) и лечения (например, 90Y или 177Lu), и, таким образом, обеспечивает возможность использования одного и того же конъюгата и для визуализации (диагностики), и для лечения, т.е. в качестве терагностического средства. Производные DOTA, способные образовывать комплексы с радиоактивными изотопами скандия (43Sc, 44Sc, 47Sc), включая DO3AP (которое может описываться формулой (4hh)), DO3APPrA (которое может описываться формулой (4ii)) или DO3APABn (которое может описываться формулой (4jj)), также могут являться предпочтительными и они описаны в публикации Kerdjoudj et al. (Dalton Trans, 2016, 45, 1398-1409).
Благоприятно, что HBED-CC эффективно образует комплексы с радиоактивными изотопами, использующими для диагностики (например, 68Ga, 99mTc).
В контексте настоящего изобретения другие предпочтительные хелатообразующие агенты включают (2-(4,7-бис(карбоксиметил)-1,4,7-триазонан-1-ил)пентандикарбоновую кислоту (NODAGA), 1,4,7-триазациклононан-1,4,7-триуксусную кислоту (NOTA), 2-(4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан-1-ил)пентандикарбоновую кислоту (DOTAGA), 1,4,7-триазациклононанфосфиновую кислоту (TRAP), 1,4,7-триазациклононан-1-[метил(2-карбоксиэтил)фосфиновую кислоту]-4,7-бис-[метил(2-гидроксиметил)фосфиновую кислоту] (NOPO), 3,6,9,15-тетра-азабицикло[9,3,1]пентадека-1(15),11,13-триен-3,6,9-триуксусную кислоту (РСТА), N'-{5-[ацетил(гидрокси)амино]пентил}-N-[5-({4-[(5-аминопентил)(гидрокси)амино]-4-оксобутаноил}амино)пентил]-N-гидроксисукцинамид (DFO), диэтилентриаминпентауксусную кислоту (DTPA) и гидразиноникотинамид (HYNIC).
Хелатообразующий агент, например, DOTA, предпочтительно может образовывать комплекс с центральным ионом (металла), предпочтительно с радиоактивным изотопом, определенным в настоящем изобретении. Альтернативно, хелатообразующий агент, например, DOTA, может не образовывать комплекс с центральным ионом (металла), предпочтительно с радиоактивным изотопом, определенным в настоящем изобретении, и, таким образом, может находиться в не образовавшей комплекс форме. Если указанный хелатообразующий агент (например, DOTA) не образует комплекс с указанным ионом металла, то карбоксигруппы, содержащиеся в указанном хелатообразующем агенте, могут быть свободными или образовать соль.
Специалист в данной области техники на основании своих навыков и знаний может выбрать подходящие комбинации хелатообразующего агента и радиоактивных изотопов. Так, например, в некоторых предпочтительных вариантах осуществления хелатообразующим агентом может являться DOTA и радиоактивным изотопом может являться 177Lu. В других предпочтительных вариантах осуществления хелатообразующим агентом может являться DOTA и радиоактивным изотопом может являться 68Ga. В других предпочтительных вариантах осуществления хелатообразующим агентом может являться HYNIC и радиоактивным изотопом может являться 99mTc.
Молекула-носитель
Молекулой-носителем может являться любая молекула, которая связывается с мишенью, содержащейся в (опухолевой) клетке, например, рецептором или другой молекулой, находящаяся в клетке (на поверхности). В предпочтительном варианте осуществления настоящего изобретения молекула-носитель выбрана из группы, включающей пептид, пептидомиметик, фрагмент антитела, миметик антитела, малые молекулы и кнотаны.
Мишенью, содержащейся в клетке, может являться любая мишень, которая находится в целевых клетках или, предпочтительно, на поверхности целевых клеток, с которыми предполагается связывание содержащей радиоактивный изотоп конъюгированной молекулы, предназначенной для лучевой терапии или диагностики.
Так, например, воздействие молекулы-носителя может быть направлено на рецептор или на находящуюся на поверхности клетки молекулу, содержащуюся в больной клетке, например, опухолевой клетке. Ниже подробно описаны примеры рецепторов и находящихся на поверхности клеток молекул, содержащиеся в опухолевых клетках, которые могут являться структурой-мишенью для молекулы-носителя. Однако структуры-мишени не ограничиваются рецепторами и находящимися на поверхности клеток молекулами, описанными ниже. В качестве структур-мишеней для молекул-носителей рассматриваются другие рецепторы и находящиеся на поверхности клеток молекулы, содержащиеся в раковых или других больных клетках. Кроме того, рассматриваются другие молекулы-носители, направленно воздействующие на рецепторы и находящиеся на поверхности клеток молекулы, содержащиеся в раковых или других больных клетках.
Соединения, направленно воздействующие на рецептор соматостатина
В соответствии с настоящим изобретением ПАГ или ее соль, или карбоксипроизводное можно подходящим образом применять для уменьшения нефротоксических побочных эффектов (радио)фармацевтических средств, направленно воздействующих на рецептор соматостатина (SSTR).
Для лечения от хорошо до умеренно дифференцированных нейроэндокринных опухолей (НЭО) можно использовать, например, пептиды, направленно воздействующие на рецептор соматостатина (SSTR). Лечение НЭО радиолигандами является общепринятым и с его помощью можно обеспечить высокие степени длительной ремиссии и стабилизации опухоли. Пептидами, направленно воздействующими на рецептор соматостатина, являются, например, аналоги соматостатина Tyr3-октреотид (D-Phe-c(Cys-Tyr-D-Trp-Lys-Thr-Cys)-Thr(ол)) и Tyr3-октреотат (D-Phe-c(Cys-Tyr-D-Trp-Lys-Thr-Cys)-Thr) (Capello А et al.: Tyr3-octreotide and Tyr3-octreotate radiolabeled with 177Lu or 90Y: peptide receptor radionuclide therapy results in vitro, Cancer Biother Radiopharm, 2003 Oct; 18(5): 761-8). Другими примерами агонистов соматостатина являются пептиды, октреотид (D-Phe-цикло(Cys-Phe-D-Trp-Lys-Thr-Cys)Thr(ол)) и NOC (D-Phe-цикло(Cys-1-Nal-D-Trp-Lys-Thr-Cys)Thr(ол)).
Другими примерами соединений, направленно воздействующих на рецептор соматостатина, являются пептиды-антагонисты соматостатина, такие как JR10 (p-NO2-Phe-c(D-Cys-Tyr-D-Aph(Cbm)-Lys-Thr-Cys)D-Tyr-NH2); JR11 (Cpa-c(D-Cys-Aph(Hor)-D-Aph(Cbm)-Lys-Thr-Cys)D-Tyr-NH2); BASS (p-NO2-Phe-цикло(D-Cys-Tyr-D-Trp-Lys-Thr-Cys)D-Tyr-NH2; LM3 (p-Cl-Phe-цикло(D-Cys-Tyr-D-Aph(Cbm)-Lys-Thr-Cys)D-Tyr-NH2.
В особенно предпочтительном варианте осуществления настоящего изобретения ПАГ применяют для уменьшения нефротоксических побочных эффектов (радио)фармацевтических средств, основанных на аналогах соматостатина; их примеры включают: 177Lu-DOTATOC (177Lu-DOTA0-[Tyr3]-октреотид) (177Lu-DOTA-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Thr-Cys]-Thr(ол), 177Lu-DOTANOC (177Lu-DOTA-D-Phe-цикло(Cys-1-Nal-D-Trp-Lys-Thr-Cys)Thr(ол)), 177Lu-DOTATATE (177Lu-DOTA-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Thr-Cys)Thr), 68Ga-DOTATOC (68Ga-DOTA-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Thr-Cys)Thr(on)), 68Ga-DOTANOC (68Ga-DOTA-D-Phe-цикло(Cys-1-Nal-D-Trp-Lys-Thr-Cys)Thr(ол)), 90Y-DOTATOC (90Y-DOTA-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Thr-Cys)Thr(ол)), 90Y-DOTATATE (90Y-DOTA-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Thr-Cys)Thr), 111In-DTPA-октреотид (111In-DTPA-D-Phe-цикло(Cys-Phe-D-Trp-Lys-Thr-Cys)Thr(ол)).
В другом предпочтительном варианте осуществления ПАГ или ее соль, или карбоксипроизводное применяют для уменьшения нефротоксических побочных эффектов (радио)фармацевтических средств, основанных на соединениях-антагонистах соматостатина; их примеры включают: 111In-DOTA-BASS (111In-DOTA-p-NO2-Phe-цикло-(D-Cys-Tyr-D-Trp-Lys-Thr-Cys)D-Tyr-NH2, 111In-DOTA-JR11 (111In-DOTA-Сра-цикло[D-Cys-Aph(Hor)-D-Aph(Cbm)-Lys-Thr-Cys]D-Tyr-NH2), 68Ga-DOTA-JR11 (Ga-OpS201) (68Ga-DOTA-Cpa-цикло[D-Cys-Aph(Hor)-D-Aph(Cbm)-Lys-Thr-Cys]D-Tyr-NH2), 68Ga-DODAGA-JR11 (Ga-OPS202) (68Ga-NODAGA-Cpa-цикло[D-Cys-Aph(Hor)-D-Aph(Cbm)-Lys-Thr-Cys]D-Tyr-NH2), 177Lu-DOTA-JR11 (Lu-OPS201) (177Lu-DOTA-Cpa-цикло[D-Cys-Aph(Hor)-D-Aph(Cbm)-Lys-Thr-Cys]D-Tyr-NH2).
Соединения, направленно воздействующие на ПСМА
ПАГ или ее соль, или карбоксипроизводное также можно подходящим образом применять для уменьшения нефротоксических побочных эффектов (радио)фармацевтических средств, направленно воздействующих на простатспецифический мембранный антиген (ПСМА).
Простатспецифический мембранный антиген (ПСМА) человека (также называющийся глутаматкарбоксипептидазой II (GCPII), фолатгидролазой 1, фолиполи-гамма-глутаматкарбоксипептидазой (FGCP) и N-ацетилированной альфа-связанной кислой дипептидазой I (NAALADase I)) представляет собой трансмембранную цинксодержащую металлопептидазу типа II, которая сильно экспрессируется в нервной системе, предстательной железе, почках и тонкой кишке. Она также обычно считается опухолевым маркером при раке предстательной железы.
В предшествующем уровне техники разработаны различные содержащие терапевтические или диагностические фрагменты средства, направленно воздействующих на ПСМА.
Совсем недавно были разработаны различные представляющие собой малые молекулы средства, направленно воздействующие на ПСМА, способные связываться с внеклеточным доменом ПСМА, предназначенные для визуализации с помощью ПЭТ/КТ (КТ = компьютерная томография) и ОФЭКТ/КТ, включая меченный радиоактивным изотопом N-[N-[(S)-1,3-дикарбоксипропил]карбамоил]-S-[11С]метил-L-цистеин (DCFBC) и несколько пептидомиметиков-ингибиторов ПСМА на основе мочевины (см. публикацию Bouchelouche et al. Discov Med. 2010 Jan; 9(44): 55-61), включая MIP-1095 (Hillier et al. Cancer Res. 2009 Sep 1; 69(17):6932-40), лиганд ПСМА, использующийся в настоящее время в клинических исследованиях, и конъюгированный с DOTA ингибитор ПСМА, ПСМА-617, разработанный Benesova et al. (JNM 2015, 56: 914-920 и ЕР 2862857 А1).
Лиганды ПСМА на основе мочевины обычно включают три компонента: связывающий мотив (Glu-мочевина-Lys), мостик и содержащий радиоактивную метку фрагмент (хелатообразующая молекула для введения радиоактивной метки или простетическая группа для фторированных агентов). Примерами наиболее часто использующихся обладающих низкой молекулярной массой лигандов ПСМА являются 123I-MIP-1072 и 123I-MIP-1095 (Barrett JA et al. J Nucl Med. 2013; 54:380-387); 99mTc-MIP-1404 и 99mTc-1405 (Hillier SM et al. J Nucl Med. 2013; 54: 1369-1376), предназначенные для визуализации с помощью ОФЭКТ, использующиеся в клинических исследованиях. N-[N-[(S)-1,3-Дикарбоксипропил]карбамоил]-4-18Е-фторбензил-L-цистеин (18F-DCFBC) (Cho SY et al., J Nucl. Med. 2012; 53: 1883-1891) и 68Ga-ПСМА-11 (68Ga-ПСМА-N,N'-бис-[2-гидрокси-5-(карбоксиэтил)бензил]этилендиамин-N,N'-диуксусная кислота) (Eder M et al, Pharmaceuticals (Basel) 2014; 7:779-796) являются средствами для визуализации с помощью ПЭТ. Другими терагностическами средствами являются например, 131I-MIP-1095 (Zechmann et al., Eur J Nucl Med Mol Imaging. 2014; 41:1280-1292), ПСМА-617 на основе хелатообразующего агента (Afshar-Oromieh A et al., J Nucl Med. 2015; 56:1697-1705) и ПСМА-I&Т (I&T = для визуализации и лечения) (Weineisen М et al., J Nucl Med. 2015; 56:1169-1176), ПСМА-I&S (Robu S et al., J Nucl Med. 2017; 58:235-242). В качестве других меченных с помощью 18F являющихся малыми молекулами производных мочевины описаны 18F-DCFPyL (Chen Y et al., Clin Cancer Res. 2011; 17:7645-7653) и 18F-ПСМА-1007 (Giesel FL et al., Eur J Nucl Med Molecular Imaging. 2017; 44:678-688).
Недавно Kelly et al. (J Nucl Med. 2017 pii: jnumed. 116.188722. doi: 10.2967/jnumed. 116.188722. [опубликована в Интернете до официального издания]) исследовали средства, обладающие сродством и к ПСМА, и к сывороточному альбумину человека (САЧ). Лиганды, разработанные Kelly et al., содержат фрагмент п-(йодфенил)масляной кислоты, связывающий САЧ, и фрагмент на основе мочевины, связывающий ПСМА. Содержащийся в соединениях, разработанных Kelly et al., предназначенный для лучевой терапии йод (131I) ковалентно связан со связывающим САЧ фрагментом, который, в свою очередь, непосредственно связан со связывающим ПСМА фрагментом с помощью гидрокарбильной цепи. Другим примером является меченный с помощью 177Lu ингибитор ПСМА на основе фосфороамидата, содержащий связывающий альбумин фрагмент (Choy et al. Theranostics 2017; 7(7): 1928-1939). Хелатообразующий агент на основе DOTA, образующий комплекс с радиоактивным изотопом 177Lu, связан простой эфирной связью с необратимым ингибитором ПСМА, СТТ1298 (ЕР 2970345 А1).
Таким образом, в предпочтительном варианте осуществления настоящего изобретения ПАГ или ее соль, или карбоксипроизводное применяют для уменьшения нефротоксических побочных эффектов (радио)фармацевтических средств, содержащих лиганд, направленно воздействующий на ПСМА, связанный с молекулой хелатообразующего агента, определенного выше, включенного в комплекс с радиоактивным изотопом, определенным выше, например, выбранным из группы, включающей 68Ga, 177Lu, 225Ac, 111In, 99mIc.
В особенно предпочтительном варианте осуществления ПАГ применяют для уменьшения нефротоксических побочных эффектов 68Ga-ПСМА-11.
Фолатные конъюгаты
FR-α (фолатный рецепттор альфа) представляет наибольший интерес в качестве связанной с опухолью мишени, предназначенной для методик визуализации и направленного лечения. Ряд групп исследователей проиллюстрировали направленное воздействие на содержащие FR опухолевые клетки in vitro и in vivo с использованием конъюгатов фолиевой кислоты и различных терапевтических зондов. Таким образом, показано, что фолатный рецептор (FR) является ценной мишенью для радионуклидной визуализации с использованием содержащих радиоактивный изотоп конъюгатов фолиевой кислоты.
Однако использование радиофармацевтических средств на основе фолата для лечения долгое время считалось неосуществимым, поскольку они в существенном количестве накапливаются в почках. В отношении других содержащих радиоактивные изотопы конъюгатов, описанных в настоящем изобретении, с помощью способа, предлагаемого в настоящем изобретении, настоящее изобретение обеспечивает возможность уменьшения накопления радиофармацевтических средств вне мишени in vivo, таким образом, улучшается значение отношения их количеств в почках и опухоли.
В предпочтительных примерах радиофармацевтических средств - фолатных конъюгатов используют 99mTc (Guo et al., J Nucl Med. 1999; 40: 1563-1569; Mathias et al., Bioconjug Chem. 2000; 11:253-257; Leamon et al., Bioconjug Chem. 2002; 13:1200-1210; Reddyet al., J Nucl. Med. 2004; 45:857-866; Müller et al., J Nucl Med Mol Imaging 2006; 33:1007-1016; Müller et al., Bioconjug Chem. 2006; 17:797-806), 111In (Siegel et al., J Nucl Med. 2003; 44:700-707), 66/67/68Ga (Mathias et al., Nucl Med Biol. 1999; 26:23-25; Mathias et al., Nucl Med Biol. 2003; 30:725-731) и 18F (Bettio et al., J Nucl Med. 2006; 47:1153-1160).
Типичными фолатными конъюгатами являются, например, 111In-DTPA-фолат, 177Lu-EC0800, 177Lu-cm09, 149/161Tb-cm09, 99mTc(СО)3, 99mTc-ЕС20, 111In-DTPA-фолат, 111In/177Lu-DOTA-фолат, полученный с помощью клик-химии, 67Ga-DOTA-Bz-фолат (67Ga-EC0800), 68Ga-NODAGA-фолат и соединения, направленно воздействующие на рецептор CCK2.

ПАГ или ее соль, или карбоксипроизводное также можно подходящим образом применять для уменьшения нефротоксических побочных эффектов (радио)фармацевтических средств, направленно воздействующих на рецептор CCK2.
Рецептор ССК2 (холецистокинин) расположен в областях центральной и периферической нервной системы и он сверхэкспрессируется в некоторых типах раковых опухолей человека, таких как медуллярные карциномы щитовидной железы, мелкоклеточный рак легких и стромальные карциномы яичников. Проведены особые исследования, направленные на разработку подходящих радиолигандов, направленно воздействующих на рецептор CCK2 in vivo. Синтезирован и охарактеризован ряд меченных радиоактивным изотопом систем CCK/родственные гастрину пептиды. Все пептиды содержат общую находящуюся на С-конце связывающую рецептор CCK тетрапептидную последовательность Trp-Met-Asp-Phe-NH2 или ее производные. Пептиды можно разделить на категории на основании последовательности их первичных пептидов (гастрин или ССК) и на основании их формы (т.е. линейные, циклические, мультимерные).
Примерами лигандов рецептора CCK являются аналоги гастрина, такие как саргастрин (Gln-Gly-Pro-Trp-Leu-Glu-Glu-Glu-Glu-Glu-Ala-Tyr-Gly-Trp-Nle-Asp-Phe-NH2), минигастрин 0 (MG-0) D-Glu-(Glu)5-Ala-Tyr-Gly-Trp-Met-Asp-Phe-NH2), минигастрин 11 (MG-11) (D-Glu-Ala-Tyr-Gly-Trp-Met-Asp-Phe-NH2), цикло-минигастрин 1 (цикло-MG1) (цикло[γ-D-Glu-Ala-Tyr-D-Lys]-Trp-Met-Asp-Phe-NH2), цикло-минигастрин 2 (цикло-МС2) (цикло[γ-D-Glu-Ala-Tyr-D-Lys]-Trp-Nle-Asp-Phe-NH2, демогастрин 1 (D-Glu-(Glu)5-Ala-Tyr-Gly-Trp-Met-Asp-Phe-NH2), демогастрин 2 (D-Glu-(Glu)5-Ala-Tyr-Gly-Trp-Met-Asp-Phe-NH2, H2-Met (His-His-Glu-Ala-Tyr-Gly-Trp-Met-Asp-Phe-NH2), H2-Nle (His-His-Glu-Ala-Tyr-Gly-Trp-Nle-Asp-Phe-NH2), H6-Met (His)6-Glu-Ala-Tyr-Gly-Trp-Met-Asp-Phe-NH2); и аналоги CCK8, такие как CCK8 (D-Asp-Tyr-Met-Gly-Trp-Met-Asp-Phe-NH2), CCK8(Nle) (D-Asp-Tyr-Nle-Gly-Trp-Nle-Asp-Phe-NH2), sCCK8 (D-Asp-Tyr(OSO3H)-Met-Gly-Trp-Met-Asp-Phe-NH2), sCCK8[Phe2(p-CH2SO3H), Nle3,6] (D-Asp-Phe(p-CH2SO3H)-Nle-Gly-Trp-Nle-Asp-Phe-NH2), sCCK8[Phe2(p-CH2SO3H), HPG3,6] (D-Asp-Phe(p-CH2SO3H)-HPG-Gly-Trp-HPG-Asp-Phe-NH2).
Предпочтительно, если пептиды, направленно воздействующие на рецептор CCK, меченны радиоактивными изотопами, предназначенными для визуализации или для лечения. Подходящие радиоактивные изотопы включают радиоактивные изотопы, описанные выше, и предпочтительно, если они включают следующие радиоактивные изотопы: 99mTc, 111In, 18F, 68Ga, 131I, 90Y и 177Lu. Для обеспечения введения радиоактивного изотопа предпочтительно использовать хелатообразующий агент, конъюгированный с пептидом. В качестве хелатообразующего агента можно использовать хелатообразующие агенты, описанные выше, причем предпочтительными являются DOTA, DOTAGA, DOTAM, DTPA и HYNIC.
Поэтому в предпочтительном варианте осуществления настоящего изобретения ПАГ применяют для уменьшения нефротоксических побочных эффектов (радио)фармацевтических средств, направленно воздействующих на рецептор CCK2, включая, но не ограничиваясь только ими 177Lu-DOTA-саргастрин, 111In-DTPA-MG0, 111In-DOTA-MG11, 111In-DOTA-MG11(Nle), 111In-DOTA-H2-Met, 111In-DOTA-H2-Nle, 111In-DOTA-H6-Met, [99mTc]2N40, D-Glu1-MG (99mTc-демогастрин 1), [99mTc]2N40-1, Gly0, D-Glu1-MG (99mTc-демогастрин 2), 99mTc-HYNIC-MG11, 99mTc-HYNIC-цикло-МС1, 99mTc-HYNIC-цикло-MG2; и аналоги CCK8, такие как 111In-DTPA-CCK8, 111In-DTPA-CCK8(Nle), 99mTc-HYNIC-CCK8, 99mTc-HYNIC-sCCK8, 111In-DOTA-sCCK8[Phe2(p-CH2SO3H), Nle3,6] и 111In-DOTA-sCCK8[Phe2(p-CH2SO3H), HPG3,6].
Связывающие интегрин молекулы
ПАГ или ее соль, или карбоксипроизводное также можно подходящим образом применять для уменьшения нефротоксических побочных эффектов (радио)фармацевтических средств, направленно воздействующих на интегрины.
Интегрины представляют собой гетеродимерные гликопротеины, состоящие из α- и β-субъединиц. Известны 24 различные комбинации 8 β-субъединиц и 18 α-субъединиц. Интегрины опосредуют взаимодействия клетка-клетка и клетка-матрица и преобразуют сигналы через плазматическую мембрану путем передачи сигнала изнутри-наружу и снаружи-внутрь. Некоторые из интегринов играют важную роль во время перемещения эндотелия, а также опухолевых клеток во время вызванного опухолью ангиогенеза и образования метастазов опухоли. Ангиогенез, образование новых кровеносных сосудов вне первичной сосудистой сети, является критически важной стадией развития и распространения различных опухолей человека. Множество терапевтических подходов, использующихся в онкологии, направлены на подавление на вызванного опухолью ангиогенеза. В отношении интегринов значительное внимание уделяли роли интегринов αvβ3 и αvβ5, поскольку они являются наиболее важными при пролиферации клеток эндотелия сосудов. Таким образом, одной из наиболее важных целевых структур, использующихся для разработки радиофармацевтических средств, предназначенных для визуализации ангиогенеза, является интегрин αvβ3.
Вызванный опухолью ангиогенез можно блокировать in vivo путем противодействия воздействию интегрина αvβ3 с помощью небольших пептидов, содержащих аминокислотную последовательность Arg-Gly-Asp (RGD). Эта трипептидная последовательность, встречающаяся в белках внеклеточного матрикса, является первичным сайтом связывания интегрина αvβ3. Вследствие селективного экспрессирования интегрина αvβ3 в опухолях, меченные радиоактивным изотопом пептиды RGD являются привлекательными кандидатами для обеспечения направленного воздействия на интегрин αvβ3 в опухолях. В течение последнего десятилетия исследовано множество меченных радиоактивным изотопом линейных и циклических пептидов RGD, использующихся в качестве радиоактивных индикаторов, предназначенных для визуализации опухолей с помощью ОФЭКТ или ПЭТ, а также в качестве терапевтических средств.
Поэтому, ПАГ или ее соль, или карбоксипроизводное можно особенно подходящим образом применять для уменьшения нефротоксических побочных эффектов (радио)фармацевтических средств, содержащих меченные радиоактивным изотопом пептиды RGD.
Предпочтительно, если пептиды RGD мечены радиоактивными изотопами, предназначенными для визуализации или для лечения. Подходящие радиоактивные изотопы включают радиоактивные изотопы, описанные выше, и предпочтительно, если они включают следующие радиоактивные изотопы: 18F, 99mTc, 68Ga, 111In, 131I, 90Y, 67Cu и 177Lu. Для обеспечения введения радиоактивного изотопа предпочтительно использовать хелатообразующий агент, конъюгированный с пептидом. В качестве хелатообразующего агента можно использовать любые подходящие хелатообразующие агенты, например, такие, как описанные выше, причем предпочтительными являются NOTA, DOTA, DOTAGA, DOTAM, DTPA, HYNIC.
Так, например, ПАГ или ее соль, или карбоксипроизводное также можно подходящим образом применять для уменьшения нефротоксических побочных эффектов 18F-галакто-RGD, 99mTc-NC100692 (99mTc-марациклатид), 18F-AH11185 (18F-флюциклатид), 18F-RGD-K5, 68Ga-NOTA-RGD, 18F-FPPRGD2, 18F-AlF-NOTA-PRGD2 (18F-альфатид), 18F-NOTA-E[PEG4-c(RGDfk)]2 (18F-альфатид II), 68Ga-NOTA-PRGD2, 67Cu-циклам-RAFT-c(-RGDfK-)4, 111In-DOTA-E-[c(RGDfK)]2, 99mTc-HYNIC-E-[c(RGDfK)]2
Соединения, направленно воздействующие на рецептор нейротензина
Рецептор нейротензина 1 (NTR1) сверхэкспрессируется в дуктальной аденокарциноме поджелудочной железы, которая является одним из самых смертельно опасных раковых заболеваний. Разработано несколько антагонистов NTR1, таких как SR142948A и SR48692, и 177Lu-3BP-2273, который представляет собой меченный с помощью 177Lu конъюгированный с DOTA антагонист NTR1, который был разработан на основе SR142948A. Его использовали для лечения дуктальной аденокарциномы поджелудочной железы (Baum RP et al., The Journal of Nuclear Medicine, Vol.59, No. 5, May 2018).
Поэтому ПАГ или ее соль, или карбоксипроизводное также можно подходящим образом применять для уменьшения нефротоксических побочных эффектов (радио)фармацевтических средств, направленно воздействующих на рецептор нейротензина 1, в особенности, меченных радиоактивным изотопом антагонистов NTR1, предназначенных для диагностики или лечения раковых заболевании, предпочтительно меченных с помощью 177Lu или 68Ga антагонистов NTR1, более предпочтительно 177Lu-3BP-2273, хотя можно рассматривать другие радиоактивные изотопы, например, радиоактивные изотопы, описанные выше, а также другие хелатообразующие агенты, например, хелатообразующие агенты, описанные выше.
Соединения, направленно воздействующие на рецептор глюкагоноподобного пептида-1 (GLP-1)
Рецептор GLP-1 сверхэкспрессируется практически во всех доброкачественных инсулиномах, а также в гастриномах. Доброкачественные инсулиномы, которые образуются из р-клеток поджелудочной железы и содержатся в виде небольших узлов, вырабатывают инсулин, это приводит к потенциально опасной для жизни гипогликемии.
Поэтому ПАГ или ее соль, или карбоксипроизводное также можно подходящим образом применять для уменьшения нефротоксических побочных эффектов (радио)фармацевтических средств, направленно воздействующих на рецептор GLP-1. Их неограничивающие примеры включают меченные с помощью 111In, 99mTc и 68Ga пептиды на основе 39-мерного пептида эксендина-4, такие как, например Lys40 (Ahx-DOTA-111In)NH2-эксендин-4. Однако можно рассматривать другие радиоактивные изотопы, например, радиоактивные изотопы, описанные выше, а также другие хелатообразующие агенты, например, хелатообразующие агенты, описанные выше.
Соединения, направленно воздействующие на рецептор гастрин-высвобождающего пептида (GRP)
ПАГ или ее соль, или карбоксипроизводное также можно подходящим образом применять для уменьшения нефротоксических побочных эффектов (радио)фармацевтических средств, направленно воздействующих на рецептор GRP.
Рецепторы GRP были обнаружены в таких важных опухолях человека, как рак молочной железы и рак предстательной железы. Бомбезин является тетрадекапептидным нейрогормоном и амфибийным гомологом GRP млекопитающих (27-мерный пептид). Разработаны различные аналоги бомбезина, предназначенные для введения метки 99mTc и исследования с помощью ОФЭКТ. В частности, обрезанный бомбезин связывали с содержащим N3S хелатообразующим агентом с помощью мостика - Gly-5-аминовалериановой кислоты (99mTc-RP527). Кроме того, разработано несколько аналогов бомбезина и антагонистов бомбезина и в них введены различные радиоактивные изотопы (например, 68Ga, 64Cu, 18F) с использованием различных хелатообразующих агентов. Их примеры включают аналог пан-бомбезина, 68Ga-BZH3 (Zhang Н et al., Cancer Res 2004; 64: 6707-6715), и меченный с помощью 177Lu производное бомбезина(7-14), связанное с DOTA с помощью Gly-4-аминобензоильного мостика (Bodei L et al., Eur J Nucl Med Mol Imaging 2007: 34(suppl 2): S221.
Однако ПАГ или ее соль, или карбоксипроизводное также можно подходящим образом применять для уменьшения нефротоксических побочных эффектов (радио)фармацевтических средств, направленно воздействующих на рецептора GRP, содержащих другие радиоактивные изотопы, например, радиоактивные изотопы, описанные выше, а также другие хелатообразующие агенты, например, хелатообразующие агенты, описанные выше.
Соединения, направленно воздействующие на рецептор нейрокинина типа 1
Рецептор нейрокинина типа 1 конститутивно сверхэкспрессируется в клетках глиомы и сосудах опухоли (Hennig IM et al., Int J Cancer 1995; 61: 786-792). Меченный радиоактивным изотопом состоящий из 11 аминокислот пептид, вещество Р (Arg-Pro-Lys-Pro-Gln-Gln-Phe-Phe-Gly-Leu-Met), воздействующее посредством рецептора нейрокинина типа 1 можно подходящим образом применять для воздействия на злокачественные глиомы. В частности, вещество Р конъюгировали с хелатообразующим агентом DOTAGA и меченный посредством 90Y конъюгат DOTAGA-вещество Р использовали в клинических исследованиях (Kneifel S et al., Eur J Nucl Med Mol Imaging. 2007; 34: 1388-1395). В другом исследовании определяли возможность и эффективность проводимого с помощью α-излучающего радиоактивного изотопа лечения опухоли головного мозга с использованием испускающего α-излучение конъюгата 213Bi-DOTA-[THi8,Met(O2)11]-вещество Р (Cordier et al., Eur J Nucl Med Mol Imaging. 2010; 37: 1335-1344).
Поэтому ПАГ или ее соль, или карбоксипроизводное также можно подходящим образом применять для уменьшения нефротоксических побочных эффектов терапевтических и диагностических соединений, направленно воздействующих на рецептор нейрокинина типа 1, в особенности, конъюгатов вещества Р, содержащих радиоактивный изотоп, предназначенный для диагностики или лечения, и хелатообразующий агент, координирующий радиоактивный изотоп.
Аффилины
ПАГ или ее соль, или карбоксипроизводное также можно подходящим образом применять для уменьшения нефротоксических побочных эффектов миметиков антител, использующихся в качестве терапевтических и диагностических соединений.
Аффилины представляют собой искусственные белки, разработанные для селективного связывания антигенов. Белки аффилина являются структурными производными человеческого убиквитина или кристаллина гамма-В соответственно. Аффилиновые белки получают путем модификации находящихся на поверхности аминокислот, содержащихся в этих белках, и выделяют с помощью таких методик воспроизведения, как фаговый дисплей и скрининг.Они являются сходными с антителами по своей аффинности и специфичности по отношению к антигенам, но не по структуре, это делает их видом миметиков антител. Аффилины были разработан фирмой Scil Proteins GmbH, как потенциальные биофармацевтические лекарственные средства, средства диагностики и аффинные лиганды. Молекулы аффилина можно легко модифицировать и они являются подходящими для введения в качестве метки в опухолевые клетки для диагностики или для уничтожения опухолевых клеток, в особенности, с помощью облучения.
Можно получить поливалентные молекулы аффилина, которые одновременно связывают разные мишени. С белками аффилина можно конъюгировать радиоактивные изотопы или цитотоксины, это делает их потенциальными терапевтическими средствами и диагностическими средствами. Разработаны конъюгаты радиоактивный изотоп-хелатообразующий агент-аффилин, например, 177Lu-DOTA-аффилин и 68Ga-DOTA-аффилин, предназначенные для визуализации и лечения. ПАГ можно использовать для эффективного уменьшения нефротоксических побочных эффектов этих содержащих аффилин конъюгатов. Ее также можно использовать для уменьшения нефротоксических побочных эффектов других содержащих аффилин конъюгатов, содержащих другие радиоактивные изотопы (например, описанные выше) и хелатообразующие агенты (например, описанные выше) соответственно.
Таким образом, в предпочтительном варианте осуществления ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное применяют для уменьшения нефротоксических побочных эффектов (меченных радиоактивным изотопом) терапевтических и диагностических соединений, предназначенных для лечения или визуализации раковых заболеваний, таких как, например, нейроэндокринные опухоли, рак предстательной железы, рак поджелудочной железы, рак почки, рак мочевого пузыря, медуллярные карциномы щитовидной железы, мелкоклеточный рак легких, стромальные карциномы яичников, дуктальная аденокарцинома поджелудочной железы, инсулиномы, гастриномы, рак молочной железы и т.п.
Так, например, ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное применяют для уменьшения нефротоксических побочных эффектов меченных радиоактивным изотопом терапевтических и диагностических соединений, использующихся для лечения или визуализации рака предстательной железы, таких как (радио)фармацевтические средства, направленно воздействующие на рецептор соматостатина, или меченных радиоактивным изотопом терапевтических и диагностических соединений, направленно воздействующих на простатспецифический мембранный антиген (ПСМА). В предпочтительном варианте осуществления ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное применяют для уменьшения нефротоксических побочных эффектов 177Lu-DOTATOC (177Lu-DOTA0-[Tyr3]-октреотид).
В одном варианте осуществления настоящего изобретения, ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное применяют в комбинации с другим веществом, которое уменьшает нефротоксические побочные эффекты меченных радиоактивным изотопом и немеченных радиоактивным изотопом терапевтических и диагностических соединений. Примерами других веществ, которые уменьшают нефротоксические побочные эффекты меченных радиоактивным изотопом и немеченных радиоактивным изотопом терапевтических и диагностических соединений, являются аминокислоты, такие как лизин и аргинин и их смеси, желатин, амифостин, образованные из альбумина пептиды, трипсинизированный альбумин, связывающие ПСМА молекулы, такие как ФМПК, витамины, гелофузин или FRALB-C (бычий сывороточный альбумин, фрагментированный бромцианом).
В особенно предпочтительном варианте осуществления настоящего изобретения фармацевтически приемлемой солью ПАГ является аминогиппурат натрия. Предпочтительно, если ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, применяют в виде раствора в солевом растворе, предпочтительно в воде для инъекций (ВДИ) или в растворе NaCl, более предпочтительно в 20% растворе NaCl.
В настоящем изобретении ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, применяют в количестве, которое является достаточным для эффективного уменьшения нефротоксических побочных эффектов терапевтического и/или диагностического соединения (соединений). Эффективное количество ПАГ можно определить путем проведения стандартных экспериментов, например, с использованием моделей на животных. Такие модели на животных включают, без наложения каких-либо ограничений, модели на кролике, овце, мыши, крысе, собаке и не являющемся человеком примате.
Так, например, вводимое количество ПАГ может находиться в диапазоне, составляющем примерно от 0,1 мг/кг до 10 г/кг, предпочтительно примерно от 0,5 мг/кг до 5 г/кг, более предпочтительно от примерно 1 мг/кг до 1 г/кг (в пересчете на 1 кг массы тела).
В предпочтительном варианте осуществления настоящего изобретения ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, применяют в количестве, составляющем от примерно 5 до примерно 500 мг/(кг массы тела), например, в количестве, составляющем примерно 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500 мг/(кг массы тела) и вплоть до 500 мг/(кг массы тела). Более предпочтительно, если ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, применяют в количестве, составляющем от примерно 50 до примерно 500 мг/(кг массы тела), более предпочтительно, от примерно 50 до примерно 250 мг/(кг массы тела), например, в количестве, составляющем примерно 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, ПО, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240 или 250 мг/(кг массы тела). Более предпочтительно, если ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное применяют в количестве, составляющем от примерно 75 до примерно 200 мг/(кг массы тела), например, в количестве, составляющем примерно 75, 80, 85, 90, 95, 100, 105, ПО, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195 и вплоть до 200 мг/(кг массы тела), или составляющем 200 мг/(кг массы тела). Наиболее предпочтительно, если ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное применяют в количестве, составляющем от примерно 80 до примерно 160 мг/(кг массы тела), например, в количестве, составляющем примерно 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155 и вплоть до 160 мг/(кг массы тела), или составляющем 160 мг/(кг массы тела).
ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное обычно применяют в количестве (молярном и/или массовом), более существенном, чем количество (совместно вводимого) терапевтического или диагностического соединения.
Так, например, терапевтическое или диагностическое соединение и ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, применяют при отношении количеств, составляющем примерно от 1/1000000 до 1/10 (мас./мас.), предпочтительно примерно от 1/500000 до 1/100 (мас./мас.), более предпочтительно от примерно 1/250000 до примерно 1/500 (мас./мас.).
В предпочтительном варианте осуществления настоящего изобретения терапевтическое или диагностическое соединение и ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, применяют при отношении количеств, составляющем от примерно 1/250000 до примерно 1/5000 (мас./мас.), например, при отношении количеств, составляющем от примерно 1/250000, 1/200000, 1/150000, 1/100000 или 1/50000 до примерно 1/5000 (мас./мас.), более предпочтительно при отношении количеств, составляющем от примерно 1/240000 до примерно 1/8000 (мас./мас.), например, при отношении количеств, составляющем примерно 1/240000, 1/230000, 1/220000, 1/210000, 1/200000, 1/190000, 1/180000, 1/170000, 1/160000, 1/150000, 1/140000, 1/130000, 1/120000, 1/110000, 1/100000, 1/90000, 1/80000, 1/70000, 1/60000, 1/50000, 1/40000, 1/30000, 1/20000, 1/19000, 1/18000, 1/17000, 1/16000, 1/15000, 1/14000, 1/13000, 1/12000, 1/11000, 1/10000, 1/9000 или 1/8000 (мас./мас.). В другом предпочтительном варианте осуществления терапевтическое и/или диагностическое соединение (соединения) и ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, применяют при отношении количеств, составляющем от примерно 1/100000 до примерно 1/10000 (мас./мас.), например, при отношении количеств, составляющем примерно 1/100000, 1/95000, 1/90000, 1/85000, 1/80000, 1/75000, 1/70000, 1/65000, 1/60000 1/55000, 1/50000, 1/45000, 1/40000, 1/35000, 1/30000, 1/25000, 1/20000, 1/15000, 1/10000 (мас./мас.). В другом предпочтительном варианте осуществления терапевтическое и/или диагностическое соединение (соединения) и ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, применяют при отношении количеств, составляющем от примерно 1/50000 до примерно 1/40000 (мас./мас.), например, при отношении количеств, составляющем примерно 1/50000, 1/49000, 1/48000, 1/47000, 1/46000, 1/45000, 1/44000, 1/43000, 1/42000, 1/41000, 1/40000 (мас./мас.).
Вторым объектом настоящего изобретения является фармацевтическая композиция, содержащая (а) меченое радиоактивным изотопом и/или немеченое радиоактивным изотопом фармацевтическое соединение (соединения) в комбинации с пара-аминогиппуровой кислотой (ПАГ) или ее фармацевтически приемлемой солью, или карбоксипроизводным и фармацевтически приемлемый инертный наполнитель, разбавитель, носитель или их комбинацию.
Меченным радиоактивным изотопом или немеченным радиоактивным изотопом фармацевтическим соединением может являться любое нефротоксическое терапевтическое или диагностическое соединение, описанное выше, потенциально вызывающее нефротоксические побочные эффекты, предпочтительно, если им является меченое радиоактивным изотопом диагностическое и/или терапевтическое соединение. Предпочтительно, если фармацевтическая композиция содержит меченое радиоактивным изотопом фармацевтическое соединение, которым является содержащий радиоактивный изотоп комплекс, конъюгированный с молекулой-носителем, таким образом содержащий молекулу-носитель, хелатообразующий агент и радиоактивный изотоп.
Предпочтительно, если молекула-носитель для содержащего радиоактивный изотоп комплекса выбрана из числа молекул-носителей, описанных выше, более предпочтительно из группы, включающей малые органические молекулы, пептиды, пептидомиметики, фрагменты антител, миметики антител, малые молекулы и кнотаны, и более предпочтительно, если она выбрана из группы, включающей аналоги соматостатина, ингибиторы ПСМА, аналоги гастрина, связывающие интегрин молекулы и связывающие антиген белки, описанные выше, например, из группы, включающей Tyr3-октреотид, Tyr3-октреотат, JR11, ПСМА-11, саргастрин, RGD, аффилин или фолатные конъюгаты. В особенно предпочтительном варианте осуществления молекула-носитель выбрана из группы, включающей Tyr3-октреотид, и Tyr3-октреотат.
Предпочтительно, если хелатообразующий агент для содержащего радиоактивный изотоп комплекса выбран из числа хелатообразующих агентов, описанных выше, более предпочтительно, если он выбран из группы, включающей DOTA, DOTAM, DOTAG, HBED-CC, NOTA, NODAGA, DOTAGA, TRAP, NOPO, РСТА, DFO, DTPA, DO3AP, DO3APPrA, DO3APABn, HYNIC или их производные.
Предпочтительно, если радиоактивный изотоп для содержащего радиоактивный изотоп комплекса выбран из числа радиоактивных изотопов, описанных выше, и более предпочтительно, если он выбран из группы, включающей 94Tc, 99mTc, 90In, 111In, 67Ga, 68Ga, 86Y, 90Y, 18F, 131I, 177Lu, 161Tb, 186Re, 188Re, 64Cu, 67Cu, 55Co, 57Co, 43Sc, 44Sc, 47Sc, 225Ac, 213Bi, 212Bi, 212Pb, 227Th, 153Sm, 166Но, 225Ac и 166Dy. Еще более предпочтительно, если радиоактивный изотоп для содержащего радиоактивный изотоп комплекса, содержащегося в фармацевтической композиции, выбран из группы, включающей 177Lu, 68Ga, 111In, 90Y, 99mIc, 18F, 131I, 225Ac и 161Tb, или, наиболее предпочтительно, если он выбран из группы, включающей 177Lu, 68Ga, 111In, 90Y, 99mTc, 225Ac и 161Tb. В одном варианте осуществления радиоактивный изотоп специально выбран из числа двухвалентных радиоактивных изотопов, предпочтительно выбран из группы, включающей 64Cu, 67Cu и 212Pb, из числа трехвалентных радиоактивных изотопов, предпочтительно выбран из группы, включающей 177Lu, 90Y, 67Ga, 68Ga, 111In, 225Ac, 161Tb, 44Sc и 47Sc, или из числа четырехвалентных радиоактивных изотопов, предпочтительным является 227Th. В другом варианте осуществления радиоактивным изотопом является 99mIc, который может быть двух-, четырех- или пятивалентным. Более предпочтительно, если радиоактивный изотоп может быть выбран из числа трехвалентных радиоактивных изотопов.
Кроме того, предпочтительно, если радиоактивный изотоп адаптирован для образования комплекса с DOTATOC (DOTA). В частности, 90In, 111In, 67Ga, 68Ga, 86Y, 90Y, 177Lu, 161Tb, 64Cu, 67Cu, 55Co, 57Co, 43Sc, 44Sc, 47Sc, 225Ac, 213Bi, 212Bi, 212Pb, 153Sm, 166Ho, 225Ac и 166Dy можно объединить с DOTATOC, использующимся в качестве хелатообразующего агента.
Как отмечено выше, специалист в данной области техники может соответствующим образом выбрать подходящие комбинации молекул-носителей, хелатообразующего агента и радиоактивных изотопов. Так, например, содержащий радиоактивный изотоп комплекс может быть выбран из группы, включающей [177Lu-DOTA0-Tyr3]-октреотид, 177Lu-DOTA-JA11, 177Lu-RGD, 177Lu-DOTA-аффилин 2, 177Lu-DOTA-саргастрин, 68Ga-HBED-CC-ПСМА-11. Предпочтительно, если содержащий радиоактивный изотоп комплекс выбран из группы, включающей [177Lu-DOTA0-Tyr3]-октреотид и [177Lu-DOTA0-Tyr3]-октреотат.
Предпочтительно, если фармацевтическая композиция содержит меченое радиоактивным изотопом или немеченое радиоактивным изотопом терапевтическое или диагностическое соединение в безопасном и эффективном количестве.
При использовании в настоящем изобретении термин "безопасное и эффективное количество" означает количество средства (средств), которое является достаточным для обеспечения возможности диагностики и/или приводит к существенному положительному изменению протекания подвергающегося лечению заболевания. Однако, в то же время "безопасное и эффективное количество" является достаточно малым, чтобы избежать тяжелых побочных эффектов, другими словами обеспечивающее разумное отношение польза/риск. Кроме того, "безопасное и эффективное количество" будет меняться в зависимости от конкретного диагностируемого или подвергающегося лечению патологического состояния, а также от возраста и физического состояния подвергающегося лечению пациента, тяжести патологического состояния, продолжительности лечения, типа использующегося сопутствующего лечения, конкретного фармацевтически приемлемого инертного наполнителя или носителя и подобных факторов.
В особенно предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция содержит аминогиппурат натрия в качестве фармацевтически приемлемой соли ПАГ.
ПАГ или ее фармацевтически приемлемая соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, обычно содержится в фармацевтической композиции в количестве, более существенном, чем количество (совместно вводимого) терапевтического или диагностического соединения, содержащегося в фармацевтической композиции.
Так, например, терапевтическое или диагностическое соединение и ПАГ или ее фармацевтически приемлемая соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, содержатся в фармацевтической композиции при отношении количеств, составляющем примерно от 1/1000000 до 1/10 (мас./мас.), предпочтительно примерно от 1/500000 до 1/100 (мас./мас.), более предпочтительно от примерно 1/250000 до примерно 1/500 (мас./мас.).
В предпочтительном варианте осуществления настоящего изобретения терапевтическое или диагностическое соединение и ПАГ или ее фармацевтически приемлемая соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, содержатся в фармацевтической композиции при отношении количеств, составляющем от примерно 1/250000 до примерно 1/5000 (мас./мас.), например, при отношении количеств, составляющем от примерно 1/250000, 1/200000, 1/150000, 1/100000 или 1/50000 до примерно 1/5000 (мас./мас.), более предпочтительно при отношении количеств, составляющем от примерно 1/240000 до примерно 1/8000 (мас./мас.), например, при отношении количеств, составляющем примерно 1/240000, 1/230000, 1/220000, 1/210000, 1/200000, 1/190000, 1/180000, 1/170000, 1/160000, 1/150000, 1/140000, 1/130000, 1/120000, 1/110000, 1/100000, 1/90000, 1/80000, 1/70000, 1/60000, 1/50000, 1/40000, 1/30000, 1/20000, 1/19000, 1/18000, 1/17000, 1/16000, 1/15000, 1/14000, 1/13000, 1/12000, 1/11000, 1/10000, 1/9000 или 1/8000 (мас./мас.). Более предпочтительно, если терапевтическое и/или диагностическое соединение (соединения) и ПАГ или ее фармацевтически приемлемая соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, содержатся в фармацевтической композиции при отношении количеств, составляющем от примерно 1/100000 до примерно 1/10000 (мас./мас.), например, при отношении количеств, составляющем примерно 1/100000, 1/95000, 1/90000, 1/85000, 1/80000, 1/75000, 1/70000, 1/65000, 1/60000 1/55000, 1/50000, 1/45000, 1/40000, 1/35000, 1/30000, 1/25000, 1/20000, 1/15000, 1/10000 (мас./мас.). В другом предпочтительном варианте осуществления терапевтическое и/или диагностическое соединение (соединения) и ПАГ или ее фармацевтически приемлемая соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, содержатся в фармацевтической композиции при отношении количеств, составляющем от примерно 1/50000 до примерно 1/40000 (мас./мас.), например, при отношении количеств, составляющем примерно 1/50000, 1/49000, 1/48000, 1/47000, 1/46000, 1/45000, 1/44000, 1/43000, 1/42000, 1/41000, 1/40000 (мас./мас.).
В одном варианте осуществления настоящего изобретения фармацевтическая композиция в дополнение к ПАГ содержит другое вещество, которое уменьшает нефротоксические побочные эффекты меченных радиоактивным изотопом и немеченных радиоактивным изотопом терапевтических и диагностических соединений, где вещество, уменьшающее нефротоксические побочные эффекты меченных радиоактивным изотопом и немеченных радиоактивным изотопом терапевтических и диагностических соединений, отличающееся от ПАГ, предпочтительно выбрано из группы, включающей аминокислоты, например, лизин и аргинин, желатин, амифостин, образованные из альбумина пептиды, связывающие ПСМА молекулы, такие как ФМПК, витамины.
Фармацевтическая композиция, содержащая ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, (а) меченное радиоактивным изотопом и/или немеченое радиоактивным изотопом фармацевтическое соединение (соединения) и необязательно содержащая другое вещество, которое уменьшает нефротоксические побочные эффекты меченных радиоактивным изотопом и немеченных радиоактивным изотопом терапевтических и диагностических соединений, дополнительно содержит фармацевтически приемлемый инертный наполнитель, разбавитель, носитель или их комбинацию. Предпочтительно, если фармацевтическая композиция является жидкой или полужидкой композицией, которая более предпочтительно является жидкой или полужидкой композицией, которая более предпочтительно является водным раствором, который может быть забуференным и/или обладать изотоническими характеристиками.
Термин "фармацевтически приемлемое" означает соединение или средство, которое совместимо с компонентами фармацевтической композиции, предлагаемой в настоящем изобретении, в частности, с диагностическим или терапевтическим фармацевтическим соединением (соединениями), и не препятствует его диагностической или терапевтической активности и/или существенно не уменьшает ее. Фармацевтически приемлемые носители предпочтительно обладают достаточно высокой чистотой и достаточно низкой токсичностью, чтобы их можно было вводить подвергающемуся лечению субъекту.
Препараты, носители и инертные наполнители
Фармацевтически приемлемые инертные наполнители могут выполнять разные функции и они включают, без наложения ограничений, разбавители, наполнители, агенты, увеличивающие объем, носители, разрыхлители, связующие, смазывающие вещества, агенты, придающие скользкость, покрытия, растворители и сорастворители, буферные реагенты, консерванты, вспомогательные вещества, антиоксиданты, смачивающие агенты, противовспенивающие агенты, загущающие агенты, подсластители, вкусовые добавки и влагоудерживающие средства.
Подходящие фармацевтически приемлемые инертные наполнители обычно выбирают на основании состава фармацевтической композиции.
Фармацевтически приемлемые инертные наполнители, применимые для фармацевтических композиций, находящихся в жидкой форме, обычно включают растворители, разбавители или носители, такие как (апирогенная) вода, (изотонические) физиологические растворы, такие как забуференный фосфатом или цитратом физиологический раствор, нелетучие масла, растительные масла, такие как, например, арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло, этанол, полиолы (например, глицерин, пропиленгликоль, полиэтиленгликоль и т.п.); лецитин; поверхностно-активные вещества; консерванты, такие как бензиловый спирт, парабены, хлорбутанол, фенол, аскорбиновая кислота, тимеросал и т.п.; изотонические агенты, такие как сахара, многоатомные спирты, такие как маннит, сорбит, или хлорид натрия; моностеарат алюминия или желатин; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатные агенты, такие как этилендиаминтетрауксусная кислота (ЭДТК); буферы, такие как ацетаты, цитраты или фосфаты, и агенты для регулирования тоничности, такие как хлорид натрия или декстроза. Значение рН можно регулировать с помощью кислот или оснований, таких как хлористоводородная кислота или гидроксид натрия. По сравнению с конкретной эталонной средой буферы могут являться гипертоническими, изотоническими или гипотоническими, т.е. по сравнению с конкретной эталонной средой буфер может обладать более высоким, таким же или более низким содержанием соли, при этом предпочтительно можно использовать такие концентрации указанных выше солей, которые не приводят к повреждению клеток вследствие осмоса или других концентрационных эффектов. Эталонными средами являются, например, жидкости, использующиеся в проводимых in vivo методиках, такие как кровь, лимфа, цитозольная жидкость, или другие жидкости организма, или, например, жидкости, которые можно использовать в качестве эталонных сред в проводимых in vivo методиках, такие как обычные буферы или жидкости. Такие обычные буферы или жидкости известны специалисту в данной области техники.
Жидкие фармацевтические композиции, вводимые путем инъекции и предпочтительно путем внутрисосудистой, более предпочтительно внутривенной (ВВ) инъекции, предпочтительно должны являться стерильными и стабильными при условиях приготовления и хранения. Такие композиции обычно готовят в виде парентерально приемлемых водных растворов, которые являются апирогенными, обладают подходящим значением рН, являются изотоническими и в них поддерживается стабильность активного ингредиента (ингредиентов).
В случае жидких фармацевтических композиций подходящие фармацевтически приемлемые инертные наполнители и носители включают воду, обычно апирогенную воду; изотонический раствор или забуференные (водные) растворы, например, растворы, забуференные фосфатом, цитратом и т.п. В частности, для инъекции (фармацевтических) композиций, предлагаемых в настоящем изобретении, можно использовать воду или предпочтительно буфер, более предпочтительно водный буфер, который может содержать соль натрия, например, не менее 50 мМ соли натрия, соль кальция, например, не менее 0,01 мМ соли кальция, и необязательно соль калия, например, не менее 3 мМ соли калия.
Соли натрия, кальция и необязательно калия могут находиться в форме галогенидов, например, хлоридов, йодидов или бромидов, в форме гидроксидов, карбонатов, гидрокарбонатов или сульфатов и т.п. Примеры солей натрия включают, но не ограничиваются только ими, например, NaCl, Nal, NaBr, Na2CO3, NaHCO3, Na2SO4, примеры необязательных солей калия включают, например, KCl, KI, KBr, K2CO3, KHCO3, K2SO4, и примеры солей кальция включают, например, CaCl2, CaI2, CaBr2, СаСО3, CaSO4, Са(ОН)2. Кроме того, в буфере могут содержаться органические анионы указанных выше катионов.
Буферы, подходящие для инъекций, определенных выше, могут содержать соли, выбранные из группы, включающей хлорид натрия (NaCl), хлорид кальция (CaCl2) и необязательно хлорид калия (KCl), где в дополнение к хлорид-анионам могут содержаться другие анионы. CaCl2 также можно заменить другой солью, такой как KCl. Соли, содержащиеся в буфере для инъекции, обычно содержатся при концентрации, равной не менее 50 мМ в случае хлорида натрия (NaCl), не менее 3 мМ в случае хлорида калия (KCl) и не менее 0,01 мМ в случае хлорида кальция (CaCl2). По сравнению с конкретной эталонной средой буфер для инъекции может являться гипертоническим, изотоническим или гипотоническим, т.е. по сравнению с конкретной эталонной средой буфер может обладать более высоким, таким же или более низким содержанием соли, при этом предпочтительно можно использовать такие концентрации указанных выше солей, которые не приводят к повреждению клеток вследствие осмоса или других концентрационных эффектов.
В случае фармацевтических композиций, находящихся в (полу)жидкой форме, подходящие фармацевтически приемлемые инертные наполнители и носители включают связующие, такие как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; крахмал или лактоза; сахара, такие как, например, лактоза, глюкоза и сахароза; крахмалы, такие как, например, кукурузный крахмал или картофельный крахмал; целлюлоза и ее производные, такие как, например, натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза, ацетат целлюлозы; разрыхлители, такие как альгиновая кислота; смазывающие вещества, такие как стеарат магния; агенты, придающие скользкость, такие как стеариновая кислота, стеарат магния; сульфат кальция, коллоидный диоксид кремния и т.п.; подсластители, такие как сахароза или сахарин; и/или вкусовые агенты, такие как мята перечная, метилсалицилат или апельсиновый ароматизатор.
Фармацевтические композиции, предназначенные для местного введения, обычно приготовлены в виде кремов, мазей, гелей, паст или порошков. Фармацевтические композиции, предназначенные для перорального введения, могут быть приготовлены в виде таблеток, капсул, жидкостей, порошков или в виде формы замедленного высвобождения. Однако в предпочтительных вариантах осуществления фармацевтическую композицию, предлагаемую в настоящем изобретении, вводят парентерально, предпочтительно путем внутривенной или внутриопухолевой инъекции, и, соответственно, она приготовлена в виде жидкой или лиофилизированной формы, предназначенной для парентерального введения, как это описано в других разделах настоящего изобретения. Препараты для парентерального введения обычно хранят во флаконах, в пакетах для ВВ вливания, ампулах, картриджах или предварительно заполненных шприцах, и их можно вводить в виде инъекций, ингаляций или аэрозолей, при этом предпочтительными являются инъекции.
Фармацевтическая композиция может находиться в лиофилизированной форме. Лиофилизированные фармацевтические композиции до введения предпочтительно восстанавливают в подходящем буфере, предпочтительно основанном на водном носителе.
Фармацевтические композиции, предлагаемые в настоящем изобретении, также предназначены для применения для приготовления лекарственного средства, предназначенного для уменьшения нефротоксических побочных эффектов меченных радиоактивным изотопом и немеченных радиоактивным изотопом терапевтических и диагностических соединений.
Фармацевтические композиции или лекарственные средства предпочтительно предназначены для уменьшения нефротоксических побочных эффектов меченных радиоактивным изотопом терапевтических и диагностических соединений, предназначенных для визуализации и лечения заболеваний, предпочтительно опухолевых заболеваний, таких как нейроэндокринные опухоли, рак предстательной железы, рак поджелудочной железы, рак почки, рак мочевого пузыря, рак головного мозга, желудочно-кишечный рак, медуллярные карциномы щитовидной железы, мелкоклеточный и немелкоклеточный рак легких, и стромальные карциномы яичников, дуктальная аденокарцинома поджелудочной железы, инсулиномы, гастриномы, рак молочной железы или саркома.
Наборы
Другим объектом настоящего изобретения является набор, включающий фармацевтические компоненты, применяющиеся в соответствии с настоящим изобретении, например, пара-аминогиппуровую кислоту (ПАГ) или ее фармацевтически приемлемую соль, или карбоксипроизводное, меченное радиоактивным изотопом или немеченое радиоактивным изотопом терапевтическое или диагностическое соединение, описанное выше, и/или фармацевтическую композицию, предлагаемую в настоящем изобретении. Так, например, в одном варианте осуществления набор может включать пара-аминогиппуровую кислоту (ПАГ) или ее фармацевтически приемлемую соль, или карбоксипроизводное в одном компоненте набора, и может включать фармацевтическую композицию, предлагаемую в настоящем изобретении, описанную выше, в другом компоненте набора, или раствор, например, предназначенный для растворения ПАГ или ее фармацевтически приемлемой соли, или карбоксипроизводного в другом компоненте набора. Раствором может являться изотонический или гипертонический раствор, им может являться забуференный раствор, например, необязательно забуференный водный раствор, например, водный раствор NaCl или вода для инъекций (ВДИ). В другом варианте осуществления настоящего изобретения набор может включать пара-аминогиппуровую кислоту (ПАГ) или ее фармацевтически приемлемую соль, или карбоксипроизводное в одном компоненте набора, и меченое радиоактивным изотопом и/или немеченое радиоактивным изотопом терапевтическое или диагностическое соединение, описанное выше, в другом компоненте набора.
Набор необязательно может включать по меньшей мере одно другое средство, определенное в настоящем изобретении в отношении фармацевтической композиции, включая, например, аминокислоты, такие как лизин и аргинин и их смеси, желатин, амифостин, образованные из альбумина пептиды, связывающие ПСМА молекулы, такие как ФМПК, витамины, радиоактивные изотопы, противомикробные средства, солюбилизирующие агенты и т.п.
Набор может представлять собой набор двух или большего количества компонентов, включающих любые из приведенных выше в качестве примера компонентов, находящихся в подходящих контейнерах. Так, например, все контейнеры могут представлять собой флаконы, бутылки, мягкие бутылки, банки, герметизированные мешки или пакеты, пробирки или блистерные упаковки, или они могут находиться в любой другой подходящей форме при условии, что контейнер предпочтительно обеспечивает предупреждение преждевременного смешивания компонентов. Каждый из различных компонентов может находиться отдельно, или несколько разных компонентов могут находиться вместе (т.е. в одном и том же контейнере).
Контейнер также может представлять собой отделение или камеру, находящуюся внутри флакона, пробирки, банки или конверта, или мешка, или блистерной упаковки, или бутылки при условии, что содержимое одного отделения физически не соприкасается с содержимым другого отделения до проведения их преднамеренного смешивания фармацевтом или врачом.
Кроме того, набор или набор компонентов может включать технические инструкции с информацией о введении и дозировке любого из его компонентов.
Способы лечения и диагностики, и случаи применения
Другим объектом настоящего изобретения является применение пара-аминогиппуровой кислоты (ПАГ) или ее фармацевтически приемлемой соли, или карбоксипроизводного, и/или фармацевтической композиции, описанной выше, и/или набора, описанного выше, для приготовления лекарственного средства, включающего пара-аминогиппуровую кислоту (ПАГ) или ее фармацевтически приемлемую соль, или карбоксипроизводное, и/или фармацевтическую композиции, описанную выше, предназначенного для уменьшения у субъекта нефротоксических побочных эффектов меченных радиоактивным изотопом и немеченных радиоактивным изотопом терапевтических и диагностических соединений.
Настоящее изобретение также относится к фармацевтической композиции, описанной выше, или к набору, описанному выше, предназначенному для применения в способе уменьшения у субъекта нефротоксических побочных эффектов меченных радиоактивным изотопом и немеченных радиоактивным изотопом терапевтических и диагностических соединений.
Другим объектом настоящего изобретения также является способ уменьшения у субъекта нефротоксических побочных эффектов меченных радиоактивным изотопом и немеченных радиоактивным изотопом терапевтических и диагностических соединений, способ включает введение субъекту фармацевтической композиции, описанной выше, или набора, описанного выше, во время визуализации или лечения, проводимых с использованием меченого радиоактивным изотопом и/или немеченого радиоактивным изотопом соединения.
Другим объектом настоящего изобретения также является способ уменьшения у субъекта нефротоксических побочных эффектов меченных радиоактивным изотопом и немеченных радиоактивным изотопом терапевтических и диагностических соединений, способ включает введение субъекту пара-аминогиппуровой кислоты (ПАГ) или ее фармацевтически приемлемой соли, или карбоксипроизводного в комбинации с меченным радиоактивным изотопом или немеченным радиоактивным изотопом терапевтическим или диагностическим соединением, где введение ПАГ проводят до и/или во время и/или после введения меченого радиоактивным изотопом или немеченого радиоактивным изотопом терапевтического или диагностического соединения.
В предпочтительном варианте осуществления способ предназначен для уменьшения у субъекта нефротоксических побочных эффектов радиофармацевтических средств при лечении или диагностике с использованием радиолиганда. Предпочтительно, если радиофармацевтическим средством является содержащий радиоактивный изотоп комплекс, включающий молекулу-носитель, хелатообразующий агент и радиоактивный изотоп, определенный выше. В более предпочтительном варианте осуществления молекула-носитель выбрана из группы, включающей пептиды, пептидомиметики, фрагменты антител, миметики антител, малые молекулы, кнотаны, которые могут являться агонистическими или антагонистическими лигандами клеточного рецептора, в частности, рецептора клеточной поверхности. В особенно предпочтительном варианте осуществления молекула-носитель выбрана из группы, включающей аналоги соматостатина, ингибиторы ПСМА, аналоги гастрина, связывающие интегрин молекулы, описанные выше, и, например, выбрана из группы, включающей Tyr3-октреотид, Tyr3-октреотат, JR11, ПСМА-11, саргастрин, RGD.
В другом предпочтительном варианте осуществления хелатообразующий агент, содержащийся в радиофармацевтическом соединении, применяющемся в способе, предлагаемом в настоящем изобретении, выбран из группы, включающей DOTA, HBED-CC, NOTA, NODAGA, DOTAGA, DOTAM, TRAP, NOPO, РСТА, DFO, DTPA, DO3AP, DO3APPrA, DO3APABn, HYNIC или их производные.
В другом предпочтительном варианте осуществления радиоактивный изотоп, содержащийся в радиофармацевтическом соединении, применяющемся в способе, предлагаемом в настоящем изобретении, выбран из группы, включающей 94Tc, 99mTc, 90In, 111In, 67Ga, 68Ga, 86Y, 90Y, 177Lu, 161Tb, 186Re, 188Re, 64Cu, 67Cu, 55Co, 57Co, 43Sc, 44Sc, 47Sc, 225Ac, 213Bi, 212Bi, 212Pb, 227Th, 153Sm, 166Ho, 166Dy, 18F и 131I, и более предпочтительно, если он выбран из группы, включающей 177Lu, 225Ас и 68Ga.
В другом предпочтительном варианте осуществления настоящего изобретения содержащая радиоактивный изотоп конъюгированная молекула, применяющаяся в способе, предлагаемом в настоящем изобретении, выбрана из группы, включающей [177Lu-DOTA0-Tyr3]-октреотид, 177Lu-DOTA-JA11, 177Lu-DOTA-RGD, 177Lu-DOTA-саргастрин, 68Ga-HBED-CC-ПСМА-11, ПСМА11, 177Lu-ПСМА I&T и 99mTc-этарфолатид.
В особенно предпочтительном варианте осуществления настоящего изобретения фармацевтически приемлемой солью ПАГ, применяющейся в способе, предлагаемом в настоящем изобретении, является аминогиппурат натрия.
В способе, предлагаемом в настоящем изобретении, ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, предпочтительно вводят в количестве, которое является достаточным для эффективного уменьшения нефротоксических побочных эффектов терапевтического и/или диагностического соединения, которое обычно вводят субъекту параллельно. Эффективное количество ПАГ можно определить путем проведения стандартных экспериментов, например, с использованием моделей на животных. Такие модели на животных включают, без наложения каких-либо ограничений, модели на кролике, овце, мыши, крысе, собаке и не являющемся человеком примате.
Так, например, вводимое количество ПАГ может находиться в диапазоне, составляющем примерно от 0,1 мг/кг до 10 г/кг, предпочтительно примерно от 0,5 мг/кг до 5 г/кг, более предпочтительно от примерно 1 мг/кг до 1 г/кг (в пересчете на 1 кг массы тела).
В предпочтительном способе, предлагаемом в настоящем изобретении, ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, вводят в количестве, составляющем от примерно 5 до примерно 500 мг/(кг массы тела), обычно вводят параллельно (например, до, во время или после введения нефротоксического терапевтического или диагностического соединения), например, в количестве, составляющем примерно 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500 мг/(кг массы тела). Таким образом, количества, приведенные в настоящем изобретения в качестве примера, можно вводить в один и тот же день (например, как и диагностическое/терапевтическое нефротоксическое соединение). Режимы введения ПАГ или ее соли, или карбоксипроизводного обычно такие же, как режимы введения нефротоксического соединения. Более предпочтительно, если ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, вводят в количестве, составляющем от примерно 50 до примерно 500 мг/(кг массы тела), более предпочтительно, от примерно 50 до примерно 250 мг/(кг массы тела), например, в количестве, составляющем примерно 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, ПО, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240 или 250 мг/(кг массы тела). Более предпочтительно, если ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, вводят в количестве, составляющем от примерно 75 до примерно 200 мг/(кг массы тела), например, в количестве, составляющем примерно 75, 80, 85, 90, 95, 100, 105, ПО, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195 или 200 мг/(кг массы тела). Наиболее предпочтительно, если ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, вводят в количестве, составляющем от примерно 80 до примерно 160 мг/(кг массы тела), например, в количестве, составляющем примерно 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160 мг/(кг массы тела).
ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, обычно вводят в количестве, более существенном, чем количество (совместно вводимого) терапевтического или диагностического соединения.
Так, например, терапевтическое или диагностическое соединение и ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, вводят при отношении количеств, составляющем примерно от 1/1000000 до 1/10 (мас./мас.), предпочтительно примерно от 1/500000 до 1/100 (мас./мас.), более предпочтительно от примерно 1/250000 до примерно 1/500 (мас./мас.).
В предпочтительном способе, предлагаемом в настоящем изобретении, терапевтическое или диагностическое соединение и ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, вводят при отношении количеств, составляющем от примерно 1/250000 до примерно 1/5000 (мас./мас.), например, при отношении количеств, составляющем от примерно 1/250000, 1/200000, 1/150000, 1/100000 или 1/50000 до примерно 1/5000 (мас./мас.), более предпочтительно при отношении количеств, составляющем от примерно 1/240000 до примерно 1/8000 (мас./мас.), например, при отношении количеств, составляющем примерно 1/240000, 1/230000, 1/220000, 1/210000, 1/200000, 1/190000, 1/180000, 1/170000, 1/160000, 1/150000, 1/140000, 1/130000, 1/120000, 1/110000, 1/100000, 1/90000, 1/80000, 1/70000, 1/60000, 1/50000, 1/40000, 1/30000, 1/20000, 1/19000, 1/18000, 1/17000, 1/16000, 1/15000, 1/14000, 1/13000, 1/12000, 1/11000, 1/10000, 1/9000 или 1/8000 (мас./мас.). В другом предпочтительном способе терапевтическое и/или диагностическое соединение (соединения) и ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, вводят при отношении количеств, составляющем от примерно 1/100000 до примерно 1/10000 (мас./мас.), например, при отношении количеств, составляющем примерно 1/100000, 1/95000, 1/90000, 1/85000, 1/80000, 1/75000, 1/70000, 1/65000, 1/60000 1/55000, 1/50000, 1/45000, 1/40000, 1/35000, 1/30000, 1/25000, 1/20000, 1/15000, 1/10000 (мас./мас.). В другом предпочтительном способе терапевтическое и/или диагностическое соединение (соединения) и ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, вводят при отношении количеств, составляющем от примерно 1/50000 до примерно 1/40000 (мас./мас.), например, при отношении количеств, составляющем примерно 1/50000, 1/49000, 1/48000, 1/47000, 1/46000, 1/45000, 1/44000, 1/43000, 1/42000, 1/41000, 1/40000 (мас./мас.).
В другом варианте осуществления настоящего изобретения в способе, предлагаемом в настоящем изобретении, пара-аминогиппуровую кислоту (ПАГ) или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, вводят в комбинации с другим веществом, которое уменьшает нефротоксические побочные эффекты меченных радиоактивным изотопом и немеченных радиоактивным изотопом терапевтических и диагностических соединений. В предпочтительном варианте осуществления вещество, уменьшающее нефротоксические побочные эффекты меченных радиоактивным изотопом и немеченных радиоактивным изотопом терапевтических и диагностических соединений, отличающееся от ПАГ, выбрано из группы, включающей аминокислоты, желатин, амифостин, образованные из альбумина пептиды, связывающие ПСМА молекулы, такие как ФМПК, витамины. Вещество (вещества), уменьшающее нефротоксические побочные эффекты меченных радиоактивным изотопом и немеченных радиоактивным изотопом терапевтических и диагностических соединений, отличающееся от ПАГ, можно вводить до и/или во время и/или после введения ПАГ или ее фармацевтически приемлемой соли, или карбоксипроизводного, предпочтительно аминогиппурата натрия.
Фармацевтические композиции или наборы, предлагаемые в настоящем изобретении, можно вводить нуждающемуся в них субъекту несколько раз в сутки, один раз в сутки, через сутки, один раз в неделю или один раз в месяц. Предпочтительно, если лечение, диагностику или профилактику проводят с использованием эффективной дозы фармацевтических композиций или наборов, предлагаемых в настоящем изобретении.
В способе, предлагаемом в настоящем изобретении, ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, можно вводить субъекту до и/или во время и/или после введения меченого радиоактивным изотопом или немеченого радиоактивным изотопом терапевтического или диагностического соединения, фармацевтической композиции или набора соответственно. Так, например, ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, вводят до введения меченого радиоактивным изотопом или немеченого радиоактивным изотопом терапевтического или диагностического соединения, фармацевтической композиции или набора. В предпочтительном способе, предлагаемом в настоящем изобретении, ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, вводят до введения фармацевтической композиции или набора, предлагаемых в настоящем изобретении, как это определено выше. Альтернативно, ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, можно вводить до и во время или до и после введения меченого радиоактивным изотопом или немеченого радиоактивным изотопом терапевтического или диагностического соединения. Предварительное введение ПАГ можно проводить примерно за 60 мин, 30 мин, 10 мин или 5 мин до введения терапевтического или диагностического соединения, фармацевтической композиции или набора, предпочтительно, если ПАГ вводят примерно за 0,5-5 ч или 10-60 мин до введения терапевтического или диагностического соединения, фармацевтической композиции или набора соответственно. В некоторых вариантах осуществления ПАГ можно вводить до введения терапевтического или диагностического соединения и после, например, через 0,5-5 ч или 10-60 мин, или до, во время и после.
В способе, предлагаемом в настоящем изобретении, ПАГ или ее фармацевтически приемлемую соль, или карбоксипроизводное, предпочтительно аминогиппурат натрия, предпочтительно вводят в виде раствора в забуференном водном растворе, например, в изотоническом или гипертоническом растворе, например, в воде для инъекций (ВДИ) или в растворе NaCl, например, в 20% растворе NaCl.
В способе, предлагаемом в настоящем изобретении, ПАГ, фармацевтические композиции или наборы обычно вводят парентерально. Предпочтительно, если введение проводят системно, например, путем внутрисосудистой, внутривенной (ВВ), подкожной, внутримышечной или внутрикожной инъекции. Альтернативно, введение можно проводить местно, например, путем внутриопухолевой инъекции.
Краткое описание чертежей
На фиг. 1 представлено накопление [177Lu-DOTA0-Tyr3]-октреотида в почках с течением времени при совместном вливании аминокислот и ПАГ, где 0,9% раствор NaCl использован в качестве контроля.
На фиг. 2 представлено выраженное в % уменьшение накопления [177Lu-ООТА0-Tyr3]-октреотида в почках с течением времени по сравнению с исходным значением (вливание 0,9% раствора NaCl), при совместном вливании аминокислот и ПАГ.
На фиг. 3 представлено выраженное в % от введенной дозы количество [177Lu-DOTA0-Tyr3]-октреотида в почках в ранний момент времени, составляющий 0,5 ч после инъекции, при совместном введении 0,9% раствора NaCl, Lys/Arg и ПАГ.
На фиг. 4 представлено выраженное в % от введенной дозы количество [177Lu-DOTA-Tyr3]-октреотида в почках в поздний момент времени, составляющий 24 ч после инъекции, при совместном введении 0,9% раствора NaCl, Lys/Arg и ПАГ.
На фиг. 5 представлено накопление [177Lu-DOTA0-Tyr3]-октреотида в органе ex vivo через 5 и 60 мин после инъекции (N=5). ПАГ существенно уменьшает накопление в почках даже в ранний момент времени (**Р≤0,005, ****Р≤0,0005).
На фиг. 6 представлена концентрация радиоактивного вещества в почках, выраженная в % от концентрации введенного радиоактивного вещества, в разные моменты времени после инъекции (0,5, 1, 4, 24 ч) для различных меченных радиоактивным изотопом (177Lu) средств (DOTA-RGD, аффилин, DOTA-саргастрин, DOTA-JR11) при совместном введении ПАГ (200 мг/мл) и 0,9% раствора NaCl соответственно.
На фиг. 7 представлена концентрация радиоактивного вещества в крови, выраженная в % от концентрации введенного радиоактивного вещества, в разные моменты времени после инъекции (0,5, 1, 4, 24 ч) для различных меченных радиоактивным изотопом (177Lu) средств (DOTA-RGD, аффилин, DOTA-саргастрин, DOTA-JR11) при совместном введении ПАГ (200 мг/мл) и 0,9% раствора NaCl соответственно.
На фиг. 8 представлена концентрация радиоактивного вещества в почках (верхняя диаграмма) и в крови (нижняя диаграмма), выраженная в % от концентрации введенного радиоактивного вещества в разные моменты времени после инъекции (0,1, 0,5, 1, 2, 4 ч) для меченого с помощью 68Ga HBED-CC-ПСМА-11 при совместном введении ПАГ (200 мг/мл) и 0,9% раствора NaCl соответственно.
На фиг. 9 графически представлены результаты исследования биологического распределения 177Lu-DOTATOC, введенного мышам внутривенно после внутрибрюшинной инъекции ПАГ или физиологического раствора.
На фиг. 10 графически представлены результаты исследования биологического распределения 99mIc-этарфолатида, введенного мышам внутривенно после внутрибрюшинной инъекции ПАГ или физиологического раствора.
На фиг. 11 представлена сравнительная столбцовая диаграмма для концентрации радиоактивного вещества в почках, выраженной в % от концентрации введенного радиоактивного вещества, полученная с использованием крыс трех групп, которым вводили 177Lu-ПСМА I&Т, и которым вводили физиологический раствор-OOP (обеспечивающий объем раствор) пробенецид-СЗП2 (СЗП = средство для защиты почек) или раствор ПАГ-СЗП1.
На фиг. 12 представлена сравнительная столбцовая диаграмма для концентрации радиоактивного вещества в крови, взятой из левого желудочка сердца, выраженной в % от концентрации введенного радиоактивного вещества, полученная с использованием крыс трех групп, которым вводили 177Lu-ПСМА I&Т, и которым вводили физиологический раствор-OOP пробенецид-СЗП2 или раствор ПАГ-СЗП1.
На фиг. 13 представлена сравнительная столбцовая диаграмма для концентрации радиоактивного вещества в мозговом веществе почек, выраженной в % от концентрации введенного радиоактивного вещества, полученная с использованием крыс трех групп, которым вводили 177Lu-ПСМА I&Т, и которым вводили физиологический раствор-OOP пробенецид-СЗП2 или раствор ПАГ-СЗП1.
На фиг. 14 представлена сравнительная столбцовая диаграмма для концентрации радиоактивного вещества в корковом веществе почек, выраженной в % от концентрации введенного радиоактивного вещества, полученная с использованием крыс трех групп, которым вводили 177Lu-ПСМА I&Т, и которым вводили физиологический раствор-OOP пробенецид-СЗП2 или раствор ПАГ-СЗП1.
Примеры
Приведенные ниже результаты показывают, что совместное лечение с помощью растворов аминогиппурата натрия (ПАГ) обеспечивает существенное уменьшение удерживания и накопления в почках различных радиофармацевтических средств, содержащих различные молекулы-носители, различные хелатообразующие агенты и различные радиоактивные изотопы соответственно, и что введение ПАГ является намного более эффективным, чем вливание лизина и аргинина. Кроме того, установлено, что при совместном лечении с помощью ПАГ увеличивается биологическая доступность радиофармацевтических средств и увеличивается накопление радиофармацевтических средств в опухоли.
Протоколы проведения экспериментов (примеры 1 и 2):
Эксперименты с использованием ОФЭКТ/КТ:
Биологическое распределение в почках исследовали с помощью однофотонной эмиссионной компьютерной томографии (ОФЭКТ) путем определения представляющих интерес объемов (VOI) на полученных с помощью радиоактивного излучения трехмерных изображениях, полученных для животных 6 групп, для исследования каждого средства для защиты почек и [177Lu-DOTA0-Tyr3]-октреотида использовали 3 животных, использовали здоровых крыс линии Wistar. 50 МБк [177Lu-DOTA0-Tyr3]-октреотида вводили совместно с раствором аминокислот (L-Arg и L-Lys) - 200 мг/мл в воде для инъекций, с раствором пара-аминогиппурата натрия - 200 мг/мл в воде для инъекций (ПАГ) и 0,9% раствором NaCl, использующимся в качестве эталона. Изображения получали через 0,5 ч, 1 ч, 4 ч, 8 ч, 24 ч после инъекции.
Распределение в органе ex vivo
Всем животным за 10 мин до введения радиофармацевтического средства путем инъекции предварительно вводили 1,0 мл NaCl, Arg-Lys или ПАГ. Растворы для инъекций, предназначенные для исследования биологического распределения, получали в виде смеси 12 мкл [177Lu]Lu-DOTA-TOC, 1,5 мл NaCl или Arg-Lys, или ПАГ.
Растворы для инъекций, предназначенные для животных, которых исследовали с помощью ОФЭКТ, получали в виде смеси 80 мкл [177Lu]Lu-DOTA-TOC, 1,5 мл NaCl или Arg-Lys, или ПАГ. Животным путем инъекции вводили вещества и их умерщвляли через 5 мин или 60 мин. Необходимые органы и ткани собирали и определяли концентрацию радиоактивного вещества. Самцы крыс линии Wistar обладали средней массой тела, равной 210±12 г (через 5 мин) и 218±13 г (через 60 мин). Средняя концентрация введенного радиоактивного вещества составляла 4,49±0,38 МБк/(кг массы тела) (через 5 мин) и 159±13 МБк/(кг массы тела) (через 5 мин) в случае животных, которых исследовали с помощью ОФЭКТ, и 4,19±0,57 МБк/(кг массы тела) (через 60 мин) или 139±8 МБк//(кг массы тела) (через 60 мин) в случае животных, которых исследовали с помощью ОФЭКТ.
Для проведения статистического анализа использовали программное обеспечение Microsoft Excel 2010 и Graphpad Prism 6.05. Результаты представляли в виде медианных значений и 25-го и 75-го процентилей, и средних значений с указанием стандартного отклонения (СО) или стандартной погрешности среднего (СПС). Для сопоставления использовали обычный односторонний дисперсионный анализ ANOVA и критерий множественного сравнения Тьюки, двухвыборочный двухсторонний t-критерий. Уровень значимости принимали равным Р<0,05.
Пример 1: Накопление [177Lu-DOTA0-Tyr3]-октреотида в почках
Накопление [177Lu-DOTA0-Tyr3]-октреотида в почках крыс при совместном вливании 0,9% раствора NaCl (контроль), Lys/Arg (250 мг Lys/250 мг Arg) и ПАГ (500 мг) соответственно определяли с помощью предназначенной для исследования маленьких животный количественной ОФЭКТ. Результаты представлены в таблицах 1-3.



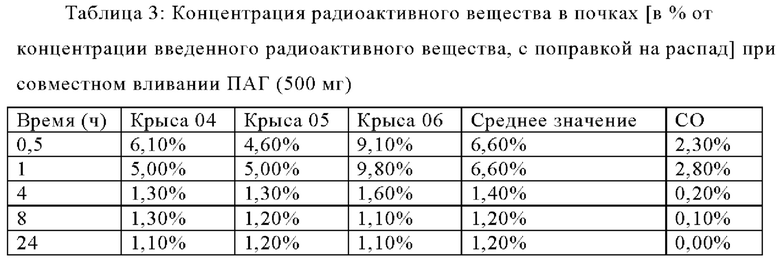
Значения, приведенные в таблицах 1-3, графически представлены на фиг. 1-4.
Из приведенных выше результатов очевидно, что совместное вливание Lys/Arg приводит к уменьшению накопления в почках, составляющему 21 и 26% через 8 и 24 ч соответственно, при этом для разных особей получены существенно различающиеся значения (таблица 2, фиг. 1, 2 и 4). Результат, полученный при вливании аминокислот является сходным с описанным в литературе (33±23%, публикация Rolleman EJ et al., приведенная выше). В отличие от этого совместное вливание ПАГ приводит к уменьшению, составляющему 56%, и составляющему 50% в такие же моменты времени при низком значении стандартного отклонения (таблица 3, фиг. 1 и 2,). Вливания ПАГ также приводят к низкой степени накопления в почках в ранние моменты времени. Через 0,5 ч после инъекции смеси Lys/Arg наблюдается лишь незначительное уменьшение, составляющее 10%, в отличие от ПАГ, в случае которой наблюдается уменьшение, составляющее 50% (таблицы 2 и 3, фиг. 1-3).
Пример 2: Накопление [177Lu-DOTA0-Tyr3]-октреотида в органе ex vivo
Концентрацию [177Lu-DOTA0-Tyr3]-октреотида в органе ex vivo определяли в ранние моменты времени, через 5 мин и 60 мин после инъекции, в соответствии с приведенным выше протоколом. Результаты графически представлены на фиг. 5. По сравнению со случаем совместного лечения путем вливания Lys/Arg использование вливания ПАН даже в ранние моменты времени существенно уменьшает (Р≤0,005) накопление [177Lu-DOTA0-Tyr3]-октреотида по сравнению со значениями, полученными при вливании NaCl.
Таким образом, приведенные выше результаты показывают, что использование растворов аминогиппурата натрия обеспечивает более существенное уменьшение удерживания и накопления [177Lu-DOTA0-Tyr3]-октреотида в почках, чем использование комбинации лизина и аргинина, известной из предшествующего уровня техники.
Протоколы проведения экспериментов (примеры 3-5)
Исследование с помощью визуализации было предназначено для определения эффективности ПАГ для уменьшения накопления в почках пептидов, меченных с помощью 177Lu или 68Ga, которые координированы с помощью хелатообразующих агентов, обладающих различными структурами и связывающими каркасами. Исследование распределения радиоактивного изотопа, содержащегося в меченных радиоактивным изотопом исследуемых соединениях, проводили в двух разных когортах здоровых крыс линии Wistar, при этом уделяли внимание накоплению в почках/почечному клиренсу и концентрациям в крови. Животным одной когорты вводили меченный с помощью 177Lu/68Ga пептид в комбинации с физиологическим раствором, использующимся в качестве контроля (значения МБк/кг и мг/кг необходимо определять в каждом отдельном случае), тогда как животным другой когорты сначала путем внутрибрюшинной инъекции вводили ПАГ до введения меченого с помощью 177Lu/68Ga пептида (за 10 мин до инъекции) вместе с двумя внутривенными инъекциями раствора ПАГ. Почечный клиренс и общие фармакокинетические параметры для каждого меченого с помощью 177Lu/68Ga пептида (введенного без использования или с использованием предварительного введения ПАГ) определяли с помощью ПЭТ или ОФЭКТ. Каждая когорта включала не менее 3 крыс для обеспечения возможности проведения статистического анализа.
Меченные с помощью 177Lu пептиды: радиохимическую чистоту (РХЧ) меченных с помощью 177Lu соединений, полученных от фирмы ITG, определяли после получения с помощью МТСХ (мгновенная тонкослойная хроматография). Для каждого соединения прилагались результаты исследования, РХЧ составляла >95%. Номинальный уровень дозы, концентрация и объем для каждого исследованного меченого с помощью 177Lu пептида приведены в таблице 4.
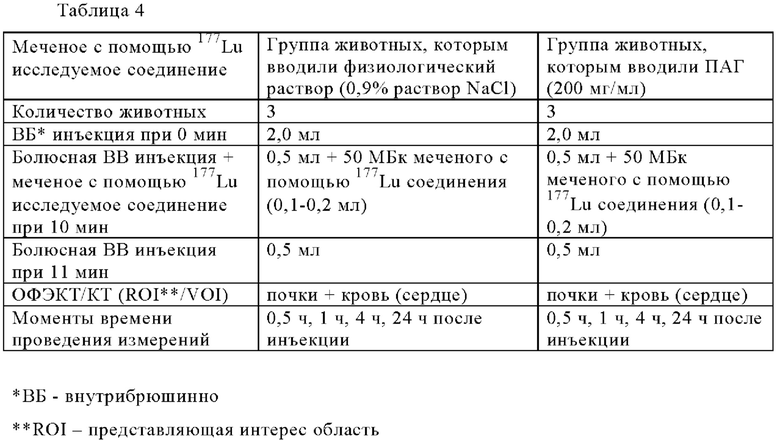
Меченные с помощью 68Ga пептиды: меченные с помощью 68Ga соединения получали непосредственно перед использованием и их радиохимическую чистоту определяли с помощью МТСХ. (Для каждого соединения прилагались данные о введении метки и результаты, полученные при контроле качества, РХЧ составляла >95%) Номинальный уровень дозы, концентрация и объем для каждого исследованного меченого с помощью 168Ga пептида приведены в таблице 5.

Пример 3: Уменьшение накопления в почках различных меченных радиоактивным изотопом соединений с помощью сопутствующего введения ПАГ
Мышам путем инъекции вводили 4 различные молекулы, конъюгированные с циклическим хелатообразующим агентом, DOTA, и меченные терапевтическим радиоактивным изотопом, лютецием-177: 177Lu-DOTA-RGD, 177Lu-DOTA-аффилин, 177Lu-DOTA-саргастрин и 177Lu-DOTA-JR11 соответственно, и путем инъекции совместно вводили ПАГ (200 мг/мл) или физиологический раствор (0,9% раствор NaCl), использующийся в качестве контроля. Зависимость концентрации радиоактивного вещества в почках, в % от концентрации введенного радиоактивного вещества, от времени определяли в соответствии с описанным выше протоколом. Результаты графически представлены на фиг. 6.
В соответствии с фиг. 6 при сопутствующем введении ПАГ наблюдается существенное уменьшение накопления радиоактивного вещества в почках в случае всех исследованных соединений, в частности, в случае небольших пептидов, таких как DOTA-RGD, DOTA-JR11 и DOTA-саргастрин. Из приведенных на фиг. 6 результатов также очевидно, что уменьшение накопления в почках происходит уже в ранние моменты времени, составляющие от 0,5 до 1 ч после введения.
Поэтому приведенные выше экспериментальные результаты показывают, что введение ПАГ приводит к уменьшению накопления в почках меченных радиоактивным изотопом соединений разных типов, т.е. связанных с DOTA пептидов, пептидомиметиков и т.п., накопление которых в почках протекает по различным механизмам.
Пример 4: Влияние ПАГ на концентрацию различных меченных радиоактивным изотопом соединений в крови
Мышам путем инъекции вводили 4 различные молекулы, конъюгированные с циклическим хелатообразующим агентом, DOTA, и меченные терапевтическим радиоактивным изотопом, лютецием-177: 177Lu-DOTA-RGD, 177Lu-DOTA-аффилин, 177Lu-DOTA-саргастрини 177Lu-DOTA-JR11 соответственно, и путем инъекции совместно вводили ПАГ (200 мг/мл) или физиологический раствор (0,9% раствор NaCl), использующийся в качестве контроля. Зависимость концентрации радиоактивного вещества в крови, в % от концентрации введенного радиоактивного вещества, от времени определяли в соответствии с описанным выше протоколом. Результаты графически представлены на фиг. 7.
В соответствии с фиг. 7 при совместном введении ПАГ наблюдается существенное увеличение концентрации аффилина в крови. Поэтому, хотя уменьшение накопления аффилина в почках посредством ПАГ является менее выраженным, чем в случае других исследованных соединений (см. фиг. 6), результаты указывают на то, что в то же время концентрации аффилина в крови увеличиваются при совместном введении ПАГ, это приводит к улучшенной биологической доступности радиофармацевтического средства.
Пример 5: Влияние ПАГ на накопление меченого с помощью 68Ga ПСМА-11 в почках и его концентрацию в крови
Мышам путем инъекции вводили меченный диагностическим 68Ga ПСМА-11, конъюгированный с ациклическим хелатообразующим агентом, HBED-CC, и путем инъекции совместно вводили ПАГ (200 мг/мл) или физиологический раствор (0,9% раствор NaCl), использующийся в качестве контроля. Зависимость концентрации радиоактивного вещества в почках (верхняя диаграмма) и в крови (нижняя диаграмма), в % от концентрации введенного радиоактивного вещества, от времени определяли в соответствии с описанным выше протоколом. Результаты графически представлены на фиг. 8.
Как показано на фиг. 8, при сопутствующем введении ПАГ наблюдается существенное уменьшение накопления меченого с помощью 68Ga HBED-CC, конъюгированного с ПСМА-11, в почках. Из приведенных на фиг. 8 результатов также очевидно, что уменьшение накопления в почках происходит уже в ранние моменты времени, составляющие 0,1, 0,5 и 1 ч после введения.
Соответственно, приведенные выше экспериментальные результаты, полученные в примерах 3-5, показывают, что введение ПАГ приводит к уменьшению накопления в почках меченных радиоактивным изотопом соединений разных типов, содержащих различные молекулы-носители (пептид, пептидомиметики, рекомбинантные белки), различные хелатообразующие агенты (циклический хелатообразующий агент, ациклический хелатообразующий агент) и различные радиоактивные изотопы (терапевтический радиоактивный изотоп, диагностический радиоактивный изотоп) соответственно, и поэтому ее можно подходящим образом применять для уменьшения нефротоксических побочных эффектов целого ряда меченных радиоактивным изотопом и немеченных радиоактивным изотопом диагностических и терапевтических соединений.
Пример 6: Сравнительное исследование биологического распределения 177Lu-DOTATOC, вводимого мышам внутривенно после внутрибрюшинной инъекции ПАГ или физиологического раствора
Голые мыши CD1, у которых имелась содержащая рецептор соматостатина опухоль поджелудочной железы (AR24J), путем ВБ инъекции вводили 50 мкл 0,9% раствора NaCl (группа А) или 50 мкл 20% раствора ПАГ (группы В) точно за 10 мин до ВВ инъекции 177Lu-DOTATOC/NaCl (группа А) или 177Lu-DOTATOC/ПАГ (группа В) через ретроорбитальный венозный синус. Номинальный уровень дозы, концентрация и объем приведены в таблице 6.

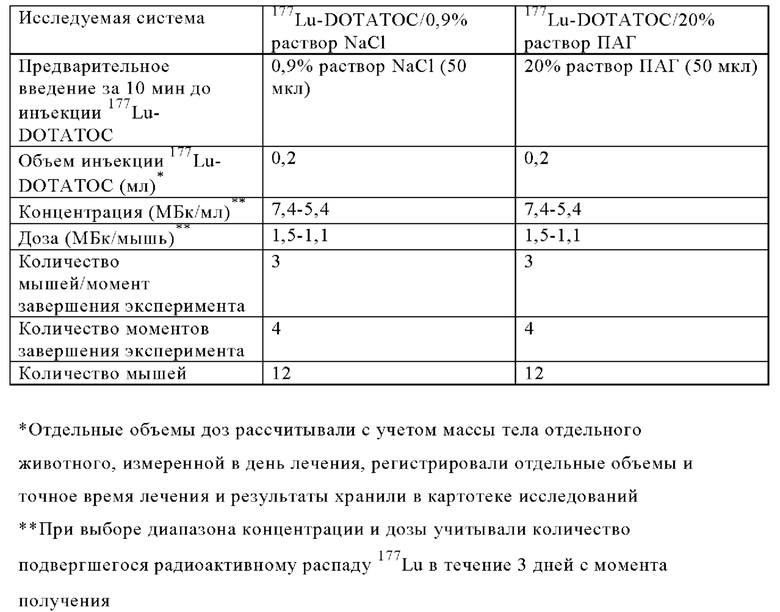
Мышей (по 3 животных в группе) умерщвляли через 0,5, 1, 2 и 4 ч соответственно. Органы быстро промывали 0,9% раствором NaCl и сушили, затем взвешивали и считывали для исключения возможной загрязняющей крови. Из следующих органов/тканей отбирали образцы или их извлекали, взвешивали и считывали для определения концентрации 177Lu: кровь, опухоль, почки, печень, мочевой пузырь (пустой), сердце, селезенка, легкие, головной мозг, мышцы, желудок (без содержимого), тонкая кишка (без содержимого), толстая кишка (без содержимого), оставшийся скелет. Результаты, полученные для органа/ткани выражали в процентах от введенной дозы (доля от ВД/г, %)). Результаты распределения 177Lu-DOTATOC в 0,9% растворе NaCl (группа А) в органах/тканях, а также результаты распределения 177Lu-DOTATOC с добавлением ПАГ (группа В) в органах/тканях графически представлены на фиг. 9.
В соответствии с фиг. 9 наблюдается существенное уменьшения накопления 177Lu-DOTATOC в почках животных группы В (нижняя диаграмма), которым вводили 177Lu-DOTATOC с добавлением ПАГ, по сравнению с накоплением в случае животных группы А (верхняя диаграмма), которым вводили 177Lu-DOTATOC в растворе NaCl. Уменьшение накопления меченого радиоактивным изотопом соединения в почках является особенно выраженным в ранние моменты времени (0,5 ч, 1 ч) после введения 177Lu-DOTATOC. В то же время концентрации 177Lu-DOTATOC в опухоли и в крови у животных группы В существенно выше, чем у животных группы А. Если не ограничиваться какими-либо конкретными теоретическими соображениями, можно предположить, что обеспеченная с помощью ПАГ блокировка выведения 177Lu-DOTATOC посредством почек приводит к увеличению продолжительности циркуляции крови с 177Lu-DOTATOC и, таким образом, к увеличению накопления меченого радиоактивным изотопом соединения также в области опухоли. Таким образом, представленные результаты указывают на улучшенную биологическую доступность 177Lu-DOTATOC в случае животных группы, которым вводили 177Lu-DOTATOC с добавлением ПАГ, по сравнению со случаем животных группы А, которым вводили 177Lu-DOTATOC в растворе NaCl.
Пример 7: Сравнительное исследование биологического распределения 99mTc-этарфолатида, вводимого в комбинации с ПАГ или с физиологическим раствором
7.1. Введение радиоактивного изотопа в этарфолатид
99mTc-этарфолатид обладает следующей химической структурой:

Введение радиоактивного изотопа проводили по методике, описанной в публикации Kim et al. (Ann Nucl Med 2016; 30:369-379). Использовали методику лигандного обмена с использованием тартрата в качестве солиганда. В пробирку типа Эппендорф добавляли 100 мкг этарфолатида, 50 мкл раствора тартрата (20 мг/50 мл в воде, выпускающейся фирмой Millipore) и 80 мкл раствора дигидрата SnCl2 (1 мг/мл в 0,01 М растворе HCl). В экранированном свинцом вытяжном шкафу в реакционный сосуд добавляли примерно 750 МБк (20 мКи) свежеэлюированного 99mTc-пертехнетата и сосуд нагревали на водяной бане при 100°С в течение 30 мин и охлаждали до комнатной температуры.
Эффективность введения радиоактивного изотопа и стабильность определяли с помощью: (i) мгновенной тонкослойной хроматографии с использованием силикагеля (МТСХ-СГ) и с использованием в качестве подвижных фаз воды (Rf 99mTc-этарфолатида и свободного пертехнетата = 0,9-1,0; Rf коллоидного раствора = 0,0-0,1) и ацетона (Rf свободного пертехнетата = 0,9-1,0; Rf коллоидного раствора и 99mTc-этарфолатида = 0,0-0,1), и (ii) ОФ-ВЭЖХ (высокоэффективная жидкостная хроматография с обращенной фазой): растворитель А: 0,1% раствор ТФК (трифторуксусная кислота) в H2O. растворитель В: 0,1% раствор ТФК в AcCN; элюирование в градиентном режиме, скорость потока 1 мл/мин.
В каждый день проведения эксперимента проводили новую процедуру введения радиоактивного изотопа с обеспечением примерно одинаковой активности 99mTc.РХЧ, определенная с помощью ОФ-ВЭЖХ, составляла ~100%, тогда как с помощью ТСХ обнаружено образование коллоидного раствора при максимальном количестве, составляющем 5% или менее. Стабильность 99mTc-этарфолатида исследовали с помощью ВЭЖХ через 24 ч после приготовления и концентрация радиоактивного изотопа не уменьшалась.
Измеренный объем меченого радиоактивным изотопом фолата составлял 1300 мкл, тогда как активность составляла 734 МБк (дата проведения эксперимента: 4 марта). Готовили образец, соответствующий дозе, равной 300 МБк (т.е. 15 МБк ×20 мышей). Отбирали 531 мкл меченого радиоактивным изотопом фолата, который разводили с помощью 1469 мкл физиологического раствора или 1469 мкл ПАГ (2000 мкл 99mTc-этарфолатида, 100 мкл/15 МБк/мышь). Перед введением образец фильтровали через стерильный фильтр с порами размером 0,22 мкм. Введенная доза, равная 15 МБк/мышь, соответствовала количеству, составляющему 2,04 мкг этарфолатида/мышь (введенное количество этарфолатида оставалось постоянным в ходе проведения эксперимента).
Образцы 99mTc-этарфолатида, разведенные физиологическим раствором или с помощью ПАГ, исследовали непосредственно после приготовления, а также через 24 ч после разведения, и при исследовании с помощью ВЭЖХ не обнаружено признаков уменьшения концентрации радиоактивного изотопа (РХЧ составляла 100%), однако при исследовании с помощью ТСХ обнаружено, что система 99mTc-этарфолатид/ПАГ являлась стабильной (РХЧ составляла 100%), тогда как в системе 99mTc-этарфолатид/физиологический раствор происходило образование коллоидного раствора в количестве, составляющем 14%.
7.2. Получение раствора ПАГ
В пробирку Corning отвешивали 2 г натриевой соли ПАГ; добавляли 4 мл Н2О; встряхивали - происходило частичное растворение ПАГ; добавляли 20 мкл NaOH (получали от фирмы ITG), встряхивали - происходило частичное растворение ПАГ; добавляли 20 мкл NaOH, встряхивали - происходило полное растворение ПАГ; добавляли 2 мл Н2О, значение рН равнялось 10; добавляли 80 мкл 37% HCl (порциями по 20 мкл), значение рН равнялось ~6. Определяли конечный объем полученного раствора, и он составлял 7100 мкл, к раствору добавляли 2900 мкл (в другой пробирке Corning) для получения конечного раствора 2 г ПАГ в 10 мл Н2О, т.е. 200 мг ПАГ/мл. После фильтрования через фильтр с порами размером 0,22 мкм пробирку Corning закрывали алюминиевой фольгой и охлаждали.
7.3. Исследование биологического распределения
30 Мышей (самцов и самок) случайным образом разделяли на две группы.
Группа А: После ВБ инъекции ПАГ, проводимой за 10 мин до введения радиофармацевтического средства, мышам вводили 99mTc-этарфолатид, разведенный с помощью ПАГ (2,04 мкг этарфолатида/мышь). Проводили исследования в 5 моментов времени: через 5 мин, 30 мин, 1 ч, 2 ч, 4 ч (в каждый момент времени исследовали 3 мышей).
Введенные дозы в каждый момент времени:




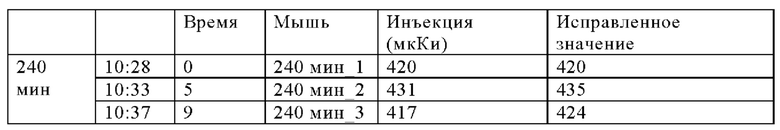
Группа В: После ВБ инъекции физиологического раствора, проводимой за 10 мин до введения радиофармацевтического средства, мышам вводили 99mTc-этарфолатид, разведенный физиологическим раствором (2,04 мкг этарфолатида/мышь). Проводили исследования в 5 моментов времени: через 5 мин, 30 мин, 1 ч, 2 ч, 4 ч (в каждый момент времени исследовали 3 мышей). Введенные дозы в каждый момент времени:


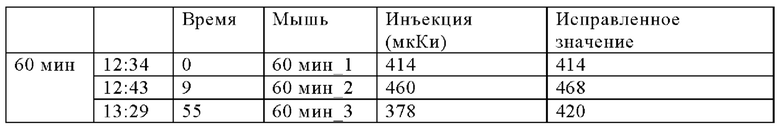
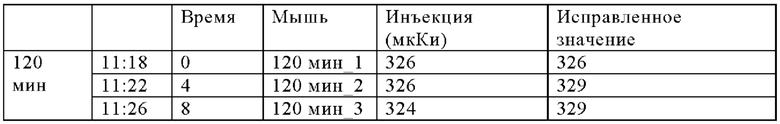

Результаты исследования биологического распределения представлены на фиг. 10. Через 30 мин становилось заметным уменьшение накопления 99mTc-этарфолатида в почках вследствие защитного воздействия ПАГ. Таким образом, результаты, полученные с использованием конъюгированной молекулы на основе 177Lu, подтверждены результатами исследования содержащей 99mTc конъюгированной молекулой, в которой 99mTc обладает валентностью, отличающейся от валентности 177Lu, равной трем.
Пример 8: Исследование биологического распределения меченого с помощью 177Lu ПСМА I&Т
Химическая структура "ПСМА 1&Т" является следующей

Исследуемые соединения (ИС), предназначенные для экспериментов по визуализации

Системы для проведения исследований и значения параметров для экспериментов по визуализации
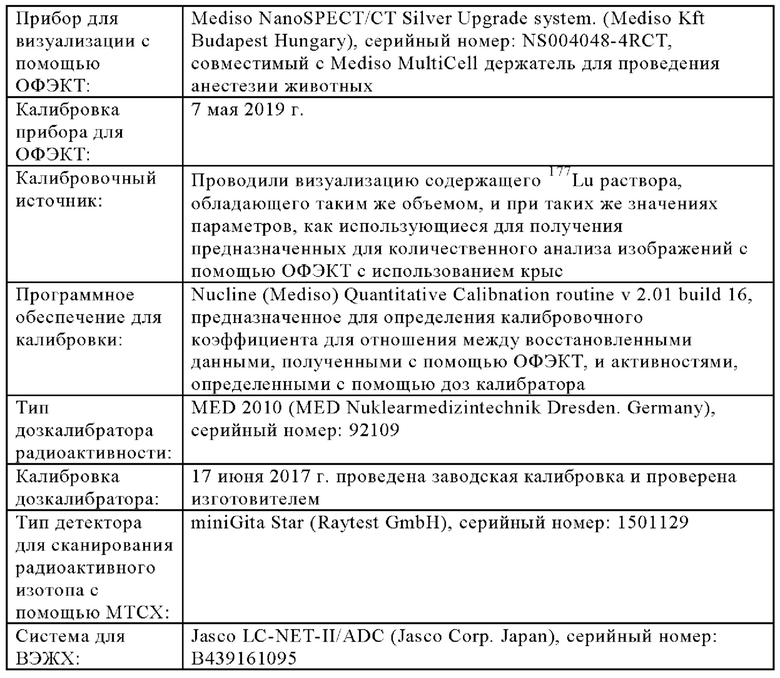
ВЫПОЛНЕНИЕ ПРОТОКОЛА
Протокол выполняли таким образом, чтобы определить концентрацию радиоактивного вещества в почках животных, которых разделяли на 3 отдельные группы и вводили одно ИС, но три различных СЗП. Таким образом, формировали приведенную ниже схему экспериментальных групп.

1. Результаты эксперимента по визуализации для ПСМА I&Т - пробенецид
1.1. Крыса 1

1.2. Крыса 2
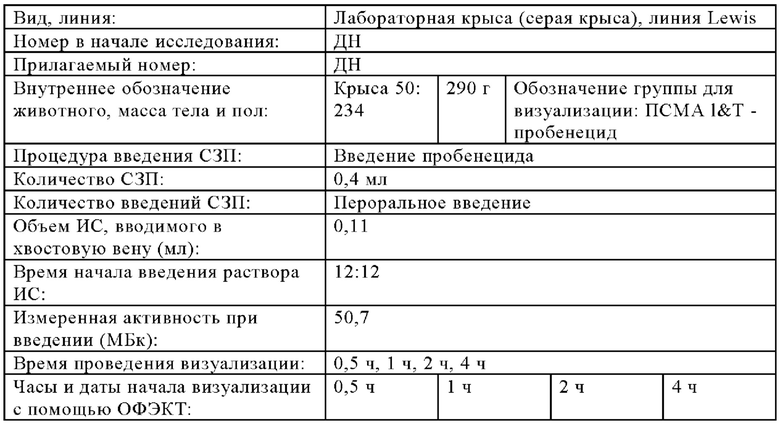
1.3. Крыса 3
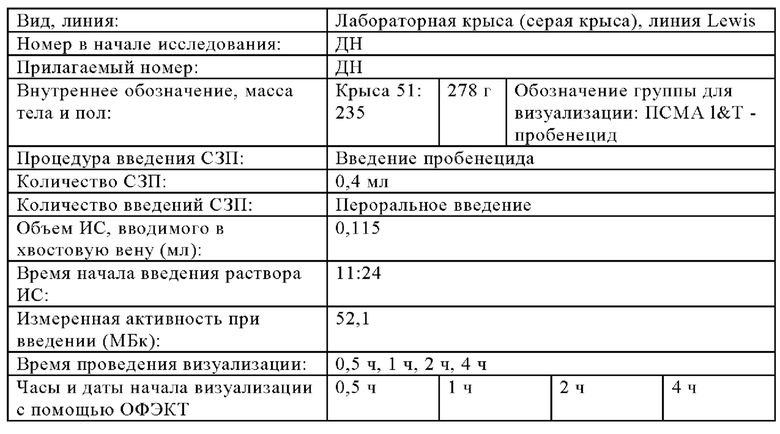
2. Результаты эксперимента по визуализации для ПСМА I&Т - ПАГ
2.1. Крыса 4

2.2. Крыса 5


2.3. Крыса 6
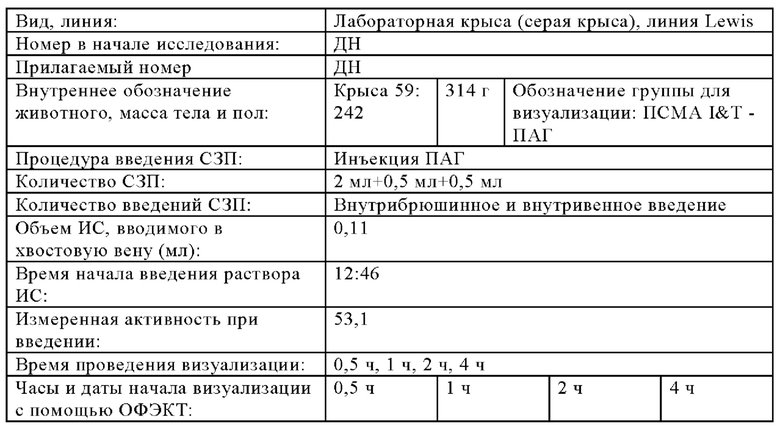
3. Результаты эксперимента по визуализации для ПСМА 1&Т -физиологический раствор 3.1. Крыса 7
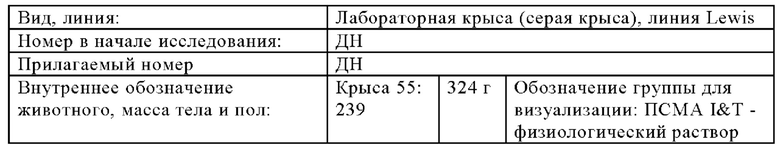

3.2. Крыса 8
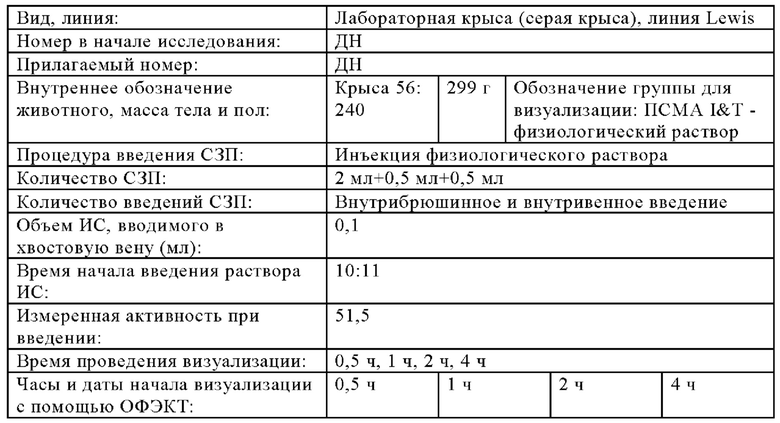
3.3. Крыса 9


РЕЗУЛЬТАТЫ
РЕ1: Наблюдения за проявлением токсичности
Результат: не обнаружены признаки острой непосредственной и острой замедленной токсичности.
РЕ2: Накопление радиоактивного вещества в органах с течением времени

Результат: в представленных ниже таблицах приведены относительные концентрации радиоактивного вещества, с поправкой на распад, в обеих почках, в % от концентрации введенного в весь организм радиоактивного вещества.
Таблица результатов I.
Концентрация радиоактивного вещества в почках, в % от концентрации введенного радиоактивного вещества, с поправкой на распад, в группе животных, которым путем инъекции вводили 177Lu-ПСМА I&Т, и которым ПО (перорально) вводили суспензию пробенецида

Таблица результатов II.
Концентрация радиоактивного вещества в почках, в % от концентрации введенного радиоактивного вещества, с поправкой на распад, в группе животных, которым путем инъекции вводили 177Lu-ПСМА I&Т, и которым ВБ и ВВ вводили раствор ПАГ

Таблица результатов III.
Концентрация радиоактивного вещества в почках, в % от концентрации введенного радиоактивного вещества, с поправкой на распад, в группе животных, которым путем инъекции вводили 177Lu-ПСМА I&Т, и которым ВБ и ВВ вводили физиологический раствор

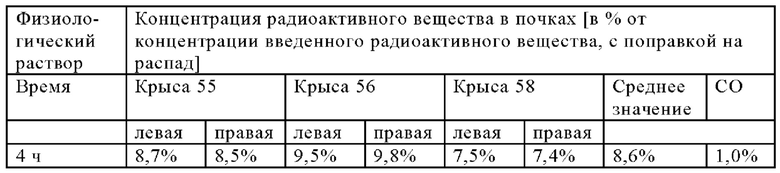
Таблица результатов IV.
Концентрация радиоактивного вещества в крови (левый желудочек), в % от концентрации введенного радиоактивного вещества, с поправкой на распад, в группе животных, которым путем инъекции вводили 177Lu-ПСМА I&Т, и которым ПО вводили суспензию пробенецида
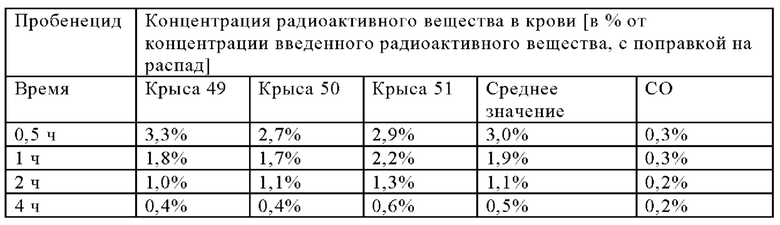
Таблица результатов V.
Концентрация радиоактивного вещества в крови (левый желудочек), в % от концентрации введенного радиоактивного вещества, с поправкой на распад, в группе животных, которым путем инъекции вводили 177Lu-ПСМА I&Т, и которым ВБ и ВВ вводили раствор ПАГ

Таблица результатов VI.
Концентрация радиоактивного вещества в крови (левый желудочек), в % от концентрации введенного радиоактивного вещества, с поправкой на распад, в группе животных, которым путем инъекции вводили 177Lu-ПСМА I&Т, и которым ВБ и ВВ вводили физиологический раствор
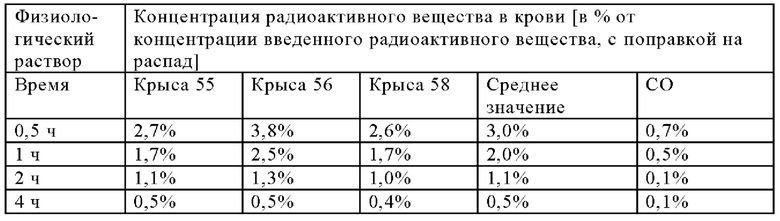
Таблица результатов VII.
Концентрация радиоактивного вещества в мозговом веществе почек, в % от концентрации введенного радиоактивного вещества, с поправкой на распад, в группе животных, которым путем инъекции вводили 177Lu-ПСМА I&Т, и которым ПО вводили суспензию пробенецида

Таблица результатов VIII.
Концентрация радиоактивного вещества в мозговом веществе почек, в % от концентрации введенного радиоактивного вещества, с поправкой на распад, в группе животных, которым путем инъекции вводили 177Lu-ПСМА I&Т, и которым ВБ и ВВ вводили раствор ПАГ


Таблица результатов IX.
Концентрация радиоактивного вещества в мозговом веществе почек, в % от концентрации введенного радиоактивного вещества, с поправкой на распад, в группе животных, которым путем инъекции вводили 177Lu-ПСМА I&Т, и которым ВБ и ВВ вводили физиологический раствор

Таблица результатов X.
Концентрация радиоактивного вещества в корковом веществе почек, в % от концентрации введенного радиоактивного вещества, с поправкой на распад, в группе животных, которым путем инъекции вводили 177Lu-ПСМА I&Т, и которым ПО вводили суспензию пробенецида

Таблица результатов XI.
Концентрация радиоактивного вещества в корковом веществе почек, в % от концентрации введенного радиоактивного вещества, с поправкой на распад, в группе животных, которым путем инъекции вводили 177Lu-ПСМА I&Т, и которым ВБ и ВВ вводили раствор ПАГ

Таблица результатов XII.
Концентрация радиоактивного вещества в корковом веществе почек, в % от концентрации введенного радиоактивного вещества, с поправкой на распад, в группе животных, которым путем инъекции вводили 177Lu-ПСМА I&Т, и которым ВБ и ВВ вводили физиологический раствор
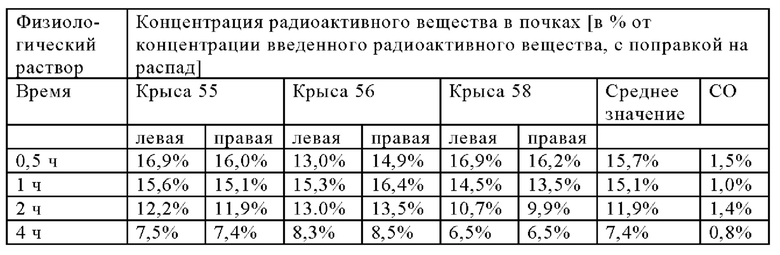
Результаты представлены на фиг. 11-14. Результаты, полученные во всех экспериментах, указывают на выраженное уменьшение концентрации радиоактивного вещества в клетках почек при введении ПАГ по сравнению со случаем введения использующегося в качестве контроля физиологического раствора, а также по сравнению со случаем контрольного эксперимента, в котором вводили пробенецид (фиг. 11). При введении ПАГ во все моменты времени проведения эксперимента наблюдали уменьшение концентрации радиоактивного вещества и в корковом веществе почек (фиг. 13), и в мозговом веществе почек (фиг. 14).
В качестве дополнительного контроля исследовали пробенецид. Известно, что пробенецид является сильным ингибитором выделения OA- (органических анионов) клетками проксимальных канальцев почек. Он ингибирует переносчик органических анионов типа 1 (ОАТ1) в базолатеральной части клетки. Известно, что ОАТ1 переносит органические анионы из крови в клетки почечных канальцев в обмен на дикарбоксилаты, например, сукцинат или 2-оксоглутарат. Результаты всех экспериментов, проведенных в соответствии с примером 8 (см. фиг. 11-14), указывают на отсутствие воздействия на ОАТ1 по механизму ингибирования, основанному на пробенециде. Таким образом, можно заключить, что воздействие ПАГ, приводящее к уменьшению концентрации радиоактивного вещества в клетках почек основано на механизме, отличающемся от механизма, известного для пробенецида.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПСМА-ТАРГЕТНОЕ СОЕДИНЕНИЕ И ЕГО КОМПЛЕКС С РАДИОНУКЛИДАМИ ДЛЯ ТЕРАНОСТИКИ ОПУХОЛЕЙ, ЭКСПРЕССИРУЮЩИХ ПСМА | 2022 |
|
RU2803734C1 |
| АНТАГОНИСТЫ GRPR ДЛЯ ОБНАРУЖЕНИЯ, ДИАГНОСТИКИ И ЛЕЧЕНИЯ GRPR-ПОЗИТИВНОГО ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ | 2013 |
|
RU2693465C2 |
| ОКТАПЕПТИД ДЛЯ ПОЛУЧЕНИЯ РАДИОФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ, РАДИОФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО НА ЕГО ОСНОВЕ И СПОСОБ ДИАГНОСТИКИ ОПУХОЛЕЙ, ЭКСПРЕССИРУЮЩИХ СОМАТОСТАТИНОВЫЕ РЕЦЕПТОРЫ | 2011 |
|
RU2457215C1 |
| АНТАГОНИСТЫ GRPR ДЛЯ ОБНАРУЖЕНИЯ, ДИАГНОСТИКИ И ЛЕЧЕНИЯ GRPR-ПОЗИТИВНОГО ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ | 2013 |
|
RU2821944C2 |
| КОНЪЮГИРОВАННЫЕ БИСФОСФОНАТЫ ДЛЯ ДИАГНОСТИКИ И ТЕРАПИИ ЗАБОЛЕВАНИЙ КОСТЕЙ | 2015 |
|
RU2742660C2 |
| КОНЪЮГАТЫ АНТАГОНИСТА ПЕПТИДА АНАЛОГА БОМБЕЗИНА | 2009 |
|
RU2523531C2 |
| ЦИКЛИЧЕСКИЙ ОКТАПЕПТИД, РАДИОФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО НА ЕГО ОСНОВЕ И СПОСОБ ПРИМЕНЕНИЯ РАДИОФАРМАЦЕВТИЧЕСКОГО СРЕДСТВА ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННЫХ (ФАРМАЦЕВТИЧЕСКИХ) СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ НОВООБРАЗОВАНИЙ, ЭКСПРЕССИРУЮЩИХ СОМАТОСТАТИНОВЫЕ РЕЦЕПТОРЫ | 2013 |
|
RU2528414C1 |
| СОЕДИНЕНИЕ, ЦЕЛЕНАПРАВЛЕННО ВОЗДЕЙСТВУЮЩЕЕ НА ПРОСТАТСПЕЦИФИЧЕСКИЙ МЕМБРАННЫЙ АНТИГЕН, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2022 |
|
RU2832300C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА ПСМА-ТАРГЕТНОГО СОЕДИНЕНИЯ НА ОСНОВЕ МОЧЕВИНЫ Lu-PS-161 И КОМПЛЕКС | 2023 |
|
RU2808636C1 |
| СОЕДИНЕНИЕ ДЛЯ ДИАГНОСТИКИ ОПУХОЛЕЙ, ЭКСПРЕССИРУЮЩИХ ПСМА, И КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2019 |
|
RU2730507C1 |
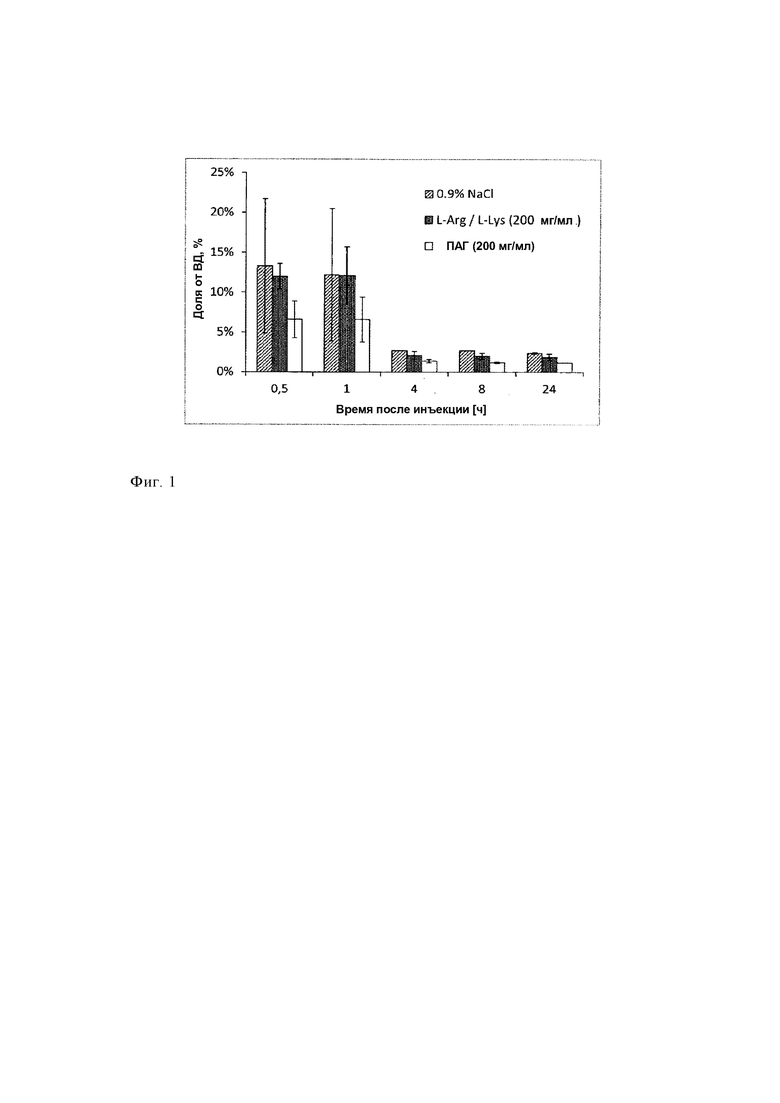
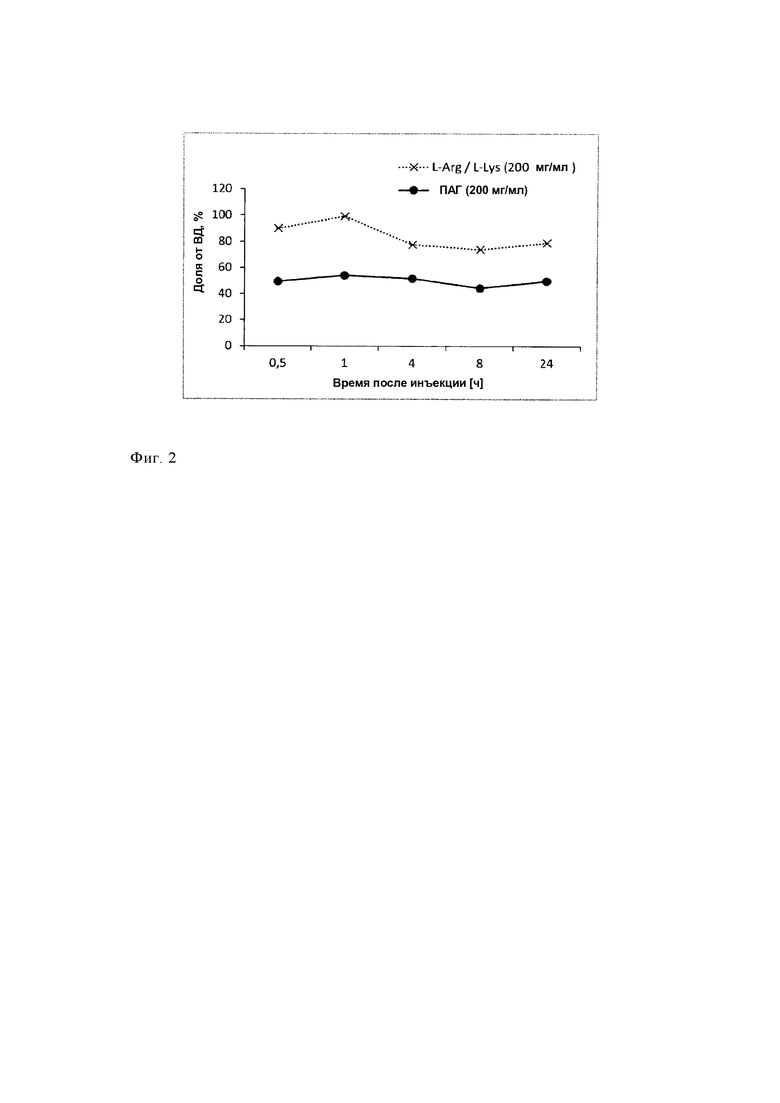
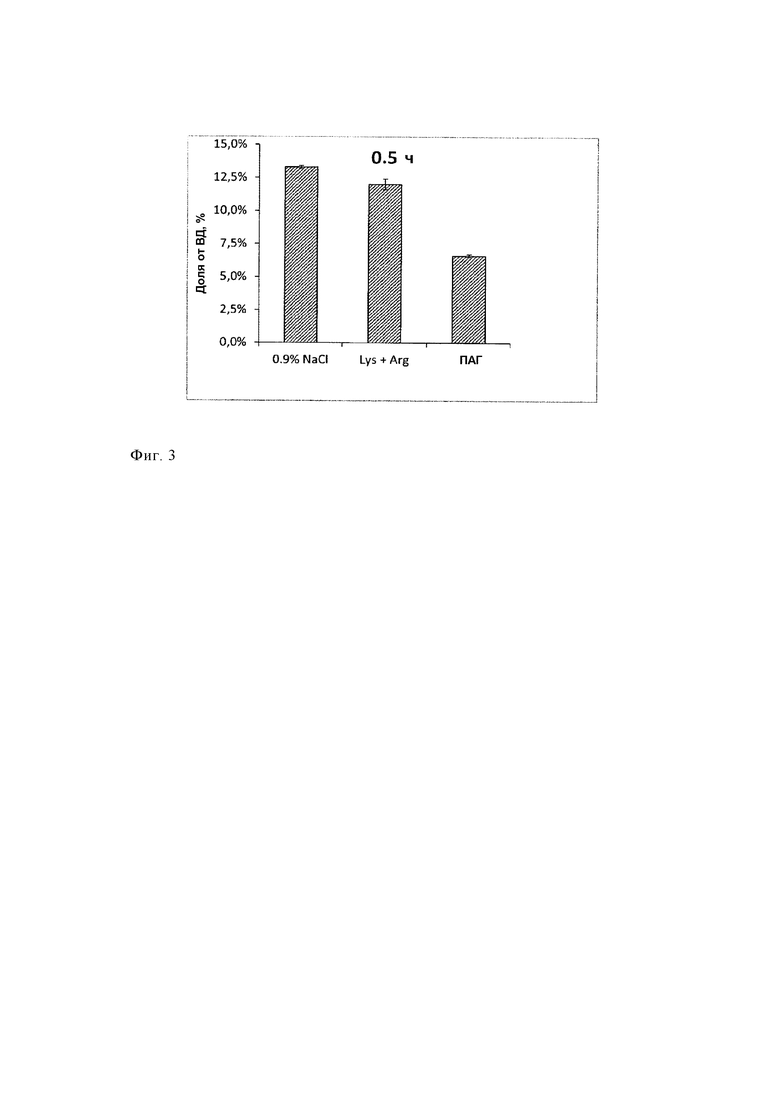











Группа изобретений относится к области лекарственных препаратов, конкретно к применению пара-аминогиппуровой кислоты (ПАГ), к фармацевтической композиции, предназначенной для защиты почек во время визуализации или лечения, проводимых с использованием меченных радиоактивным изотопом соединений, к способу (варианты) и набору для уменьшения у субъекта нефротоксических побочных эффектов. Применение ПАГ или ее фармацевтически приемлемой соли, в способе уменьшения у субъекта нефротоксических побочных эффектов меченных радиоактивным изотопом и терапевтических и диагностических соединений в качестве радиофармацевтических средств при лечении или диагностике с использованием радиолиганда характеризуется тем, что радиофармацевтическое средство является конъюгированной молекулой, содержащей радиоактивный изотоп, молекулу-носитель, хелатообразующий агент и радиоактивный изотоп, где радиоактивный изотоп представляет собой трехвалентный радиоактивный изотоп. Техническими результатами изобретений являются предоставление способа для улучшения биологического распределения терапевтических и диагностических соединений, содержащих радиоактивные изотопы, изменение у субъекта клиренса нефротоксичных химиотерапевтических веществ или радиофармацевтических средств, таких как [177Lu-DOTA0-Tyr3]-октреотид, ингибиторы 177Lu-ПСМА или другие, использование ПАГ для подавления повторной абсорбции лекарственного средства почками, улучшение биологической доступности лекарственного препарата и обеспечение возможности накопления визуализирующих средств, например, предназначенных для ОФЭКТ и ПЭТ в тканях. 5 н. и 22 з.п. ф-лы, 14 ил., 34 табл., 8 пр.
1. Применение пара-аминогиппуровой кислоты (ПАГ) или ее фармацевтически приемлемой соли в способе уменьшения у субъекта нефротоксических побочных эффектов меченных радиоактивным изотопом и терапевтических и диагностических соединений в качестве радиофармацевтических средств при лечении или диагностике с использованием радиолиганда, где радиофармацевтическим средством является содержащая радиоактивный изотоп конъюгированная молекула, содержащая молекулу-носитель, хелатообразующий агент и радиоактивный изотоп, где радиоактивный изотоп представляет собой трехвалентный радиоактивный изотоп.
2. Применение по п. 1, где молекула-носитель выбрана из группы, включающей пептиды, пептидомиметики, фрагменты антител, миметики антител, малые молекулы и кнотаны, где молекула-носитель, предпочтительно, выбрана из группы, включающей аналоги соматостатина, ингибиторы ПСМА (простатспецифический мембранный антиген), аналоги гастрина, связывающие интегрин молекулы и фолат, где молекула-носитель наиболее предпочтительно выбрана из группы, включающей Tyr3-октреотид, Tyr3-октреотат, NOC, JR10, JR11, BASS, LM3, ПСМА-11, саргастрин, RGD и фолат.
3. Применение по любому из пп. 1 или 2, где хелатообразующим агентом является макроциклический хелатообразующий агент, предпочтительно выбранный из группы, включающей DOTA, HBED-CC, NOT A, NODAGA, DOTAGA, DOT AM, TRAP, NOPO, PCTA, DFO, DTPA, DO3AP, DO3APPrA, DO3APAbn и HYNIC или их производные.
4. Применение по любому из пп. 1-3, где радиоактивный изотоп выбран из группы, включающей 111In, 67Ga, 68Ga, 86Y, 90Y, 177Lu, 161Tb, 43Sc, 44Sc, 47Sc, 225Ac, 227Th, 153Sm, 166Ho, 152Gd, 153Gd, 157Gd или 166Dy, предпочтительно из группы, включающей 177Lu, 90Y, 67Ga, 68Ga, 111In, 225Ac, 161Tb, 44Sc, и 47Sc, наиболее предпочтительно из группы, включающей 177Lu, 225Ас и 68Ga.
5. Применение по любому из пп. 1-4, где содержащая радиоактивный изотоп конъюгированная молекула выбрана из группы, включающей [177Lu-DOTA0-Tyr3]-октреотид, 177Lu-DOTANOC (177Lu-DOTA-D-Phe-цикло(Cys-1-Nal-D-Trp-Lys-Thr-Cys)Thr(ол)), 177Lu-DOTATE (177Lu-DOTA-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Thr-Cys)Thr), 68Ga-DOTATOC (68Ga-DOTA-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Thr-Cys)Thr(ол)), 68Ga-DOTANOC (68Ga-DOTA-D-Phe-цикло(Cys-1-Nal-D-Trp-Lys-Thr-Cys)Thr(ол)), 90Y-DOTATOC (90Y-DOTA-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Thr-Cys)Thr(ол)), 90Y-DOTATATE (90Y-DOTA-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Thr-Cys)Thr), 111In-DTPA-октреотид (111In-DTPA-D-Phe-цикло(Cys-Phe-D-Trp-Lys-Thr-Cys)Thr(ол)), 111In-DOTA-BASS (111In-DOTA-p-NO2-Phe-цикло-(D-Cys-Tyr-D-Trp-Lys-Thr-Cys)D-Tyr-NH2, 111In-DOTA-JR11 (111In-DOTA-Cpa-цикло[D-Cys-Aph(Hor)-D-Aph(Cbm)-Lys-Thr-Cys]D-Tyr-NH2), 68Ga-DOTA-JR11 (Ga-OpS201) (68Ga-DOTA-Cpa-цикло[D-Cys-Aph(Hor)-D-Aph(Cbm)-Lys-Thr-Cys]D-Tyr-NH2), 68Ga-DODAGA-JR11 (Ga-OPS202) (68Ga-NODAGA-Cpa-цикло[D-Cys-Aph(Hor)-D-Aph(Cbm)-Lys-Thr-Cys]D-Tyr-NH2), 177Lu-DOTA-JR11, 177Lu-DOTA-RGD, 177Lu-DOTA-саргастрин, 68Ga-HBED-CC-ПСМА-11, и 177Lu-ПСМА I&T.
6. Применение по любому из пп. 1-5, где пара-аминогиппуровая кислота (ПАГ) или ее фармацевтически приемлемую соль вводят в комбинации с другим веществом, которое уменьшает нефротоксические побочные эффекты меченных радиоактивным изотопом терапевтических и диагностических соединений, где другое вещество предпочтительно выбрано из группы, включающей аминокислоты, желатин, амифостин, образованные из альбумина пептиды, связывающие ПСМА молекулы, такие как ФМПК (2-(фосфонометил)пентандикарбоновая кислота), и витамины.
7. Применение по любому из пп. 1-6, где ПАГ или ее фармацевтически приемлемую соль вводят в количестве, составляющем от 5 до 500 мг/(кг массы тела), и/или терапевтическое или диагностическое соединение и ПАГ или ее фармацевтически приемлемую соль вводят при отношении количеств, составляющем от 1/240000 до 1/8000 (мас./мас.).
8. Применение по любому из пп. 1-7, где фармацевтически приемлемой солью ПАГ является аминогиппурат натрия.
9. Применение по любому из пп. 1-8, где лечение или диагностика с использованием радиолиганда представляет собой терапию или диагностику раковых заболеваний, в частности нейроэндокринных опухолей, рака предстательной железы, рака поджелудочной железы, рака почки, рака мочевого пузыря, медуллярных карцином щитовидной железы, мелкоклеточного рака легких, стромальных карцином яичников, дуктальной аденокарциномы поджелудочной железы, инсулиномы, гастриномы и рака молочной железы.
10. Фармацевтическая композиция для уменьшения нефротоксических побочных эффектов меченных радиоактивным изотопом и терапевтических и диагностических соединений, содержащая меченное радиоактивным изотопом фармацевтическое соединение и пара-аминогиппуровую кислоту (ПАГ) или ее фармацевтически приемлемую соль, и фармацевтически приемлемый инертный наполнитель, разбавитель, носитель или их комбинацию, где меченное радиоактивным изотопом фармацевтическое соединение представляет собой содержащую радиоактивный изотоп конъюгированную молекулу, содержащую молекулу-носитель, хелатообразующий агент и радиоактивный изотоп, где радиоактивный изотоп представляет собой трехвалентный радиоактивный изотоп.
11. Фармацевтическая композиция по п. 10, в которой молекула-носитель выбрана из группы, включающей пептиды, пептидомиметики, фрагменты антител, миметики антител, малые молекулы и кнотаны, в которой молекула-носитель, предпочтительно, выбрана из группы, включающей аналоги соматостатина, ингибиторы ПСМА, аналоги гастрина, связывающие интегрин молекулы и фолатные конъюгаты, в которой молекула-носитель, наиболее предпочтительно, выбрана из группы, включающей Tyr3-октреотид, Tyr3-октреотат, JR11, ПСМА-11, саргастрин, RGD и фолат.
12. Фармацевтическая композиция по любому из пп. 10 или 11, в которой хелатообразующий агент выбран из группы, включающей DOTA, HBED-CC, NOTA, NODAGA, DOTAGA, DOTAM, TRAP, NOPO, PCTA, DFO, DTPA, DO3AP, DO3APPrA, DO3APAbn и HYNIC или их производные.
13. Фармацевтическая композиция по по любому из пп. 10-12, в которой радиоактивный изотоп выбран из группы, включающей 111In, 67Ga, 68Ga, 86Y, 90Y, 177Lu, 161Tb, 43Sc, 44Sc, 47Sc, 225Ac, 153Sm, 166Но, или 166Dy, предпочтительно из группы, включающей 177Lu, 90Y, 67Ga, 68Ga, 111In, 225Ac, 161Tb, 44Sc, и 47Sc, наиболее предпочтительно из группы, включающей 177Lu, 225Ас и 68Ga.
14. Фармацевтическая композиция по любому из пп. 10-13, в которой содержащая радиоактивный изотоп конъюгированная молекула выбрана из группы, включающей [177Lu-DOTA0-Tyr3]-октреотид, 177Lu-DOTA-JR11, 177Lu-DOTA-RGD, 177Lu-DOTA-саргастрин, 68Ga-HBED-CC-ПСМА-11, и 177Lu-ПСМА I&T.
15. Фармацевтическая композиция по любому из пп. 10-14, где композиция в дополнение к ПАГ содержит другое вещество, которое уменьшает нефротоксические побочные эффекты меченных радиоактивным изотопом терапевтических и диагностических соединений.
в которой дополнительное вещество, уменьшающее нефротоксические побочные эффекты терапевтических и диагностических соединений, отличающееся от ПАГ, необязательно, выбрано из группы, включающей аминокислоты, желатин, амифостин, образованные из альбумина пептиды, связывающие ПСМА молекулы, такие как ФМПК, и витамины.
16. Фармацевтическая композиция по любому из пп. 10-15, в которой терапевтическое или диагностическое соединение и ПАГ содержатся в фармацевтической композиции при отношении количеств, составляющем от 1/240000 до 1/8000 (мас./мас.).
17. Фармацевтическая композиция по любому из пп. 10-16, в которой фармацевтически приемлемой солью ПАГ является аминогиппурат натрия.
18. Набор для уменьшения нефротоксических побочных эффектов меченных радиоактивным изотопом и терапевтических и диагностических соединений, включающий пара-аминогиппуровую кислоту (ПАГ) или ее фармацевтически приемлемую соль в одном компоненте набора, и дополнительно включающий меченное радиоактивным изотопом терапевтическое или диагностическое соединение в качестве радиофармацевтического средства, описанное в любом из пп. 1-5 в другом компоненте набора.
19. Способ уменьшения у субъекта нефротоксических побочных эффектов меченных радиоактивным изотопом терапевтических и диагностических соединений, включающий введение субъекту фармацевтической композиции по любому из пп. 10-17 или набора по п. 18 до, во время или после визуализации или лечения, проводимых с использованием меченного радиоактивным изотопом соединения.
20. Способ уменьшения у субъекта нефротоксических побочных эффектов меченных радиоактивным изотопом терапевтических и диагностических соединений, включающий введение субъекту пара-аминогиппуровой кислоты (ПАГ) или ее фармацевтически приемлемой соли в комбинации с меченным радиоактивным изотопом терапевтическим или диагностическим соединением, где введение ПАГ проводят до и/или во время и/или после введения меченного радиоактивным изотопом терапевтического или диагностического соединения, предпочтительно (i) до, во время или после, или (ii) до и после введения меченного радиоактивным изотопом терапевтического или диагностического соединения в качестве радиофармацевтического средства при лечении или диагностике с использованием радиолиганда, где радиофармацевтическим средством является содержащая радиоактивный изотоп конъюгированная молекула, содержащая молекулу-носитель, хелатообразующий агент и радиоактивный изотоп, в котором радиоактивный изотоп представляет собой трехвалентный радиоактивный изотоп.
21. Способ по п. 20, в котором молекула-носитель выбрана из группы, включающей пептиды, пептидомиметики, малые молекулы и кнотаны,
в котором молекула-носитель, предпочтительно выбрана из группы, включающей аналоги соматостатина, ингибиторы ПСМА, аналоги гастрина, связывающие интегрин молекулы и фолаты,
в котором молекула-носитель, наиболее предпочтительно выбрана из группы, включающей Tyr3-октреотид, Tyr3-октреотат, NOC, JR10, JR11, BASS, LM3, ПСМА-11, саргастрин, RGD и фолат.
22. Способ по любому из пп. 20 или 21, в котором хелатообразующий агент выбран из группы, включающей DOTA, HBED-CC, NOTA, NODAGA, DOTAGA, DOTAM, TRAP, NOPO, РСТА, DFO, DTPA, DO3AP, DO3APPrA, DO3APABn и HYNIC или их производные.
23. Способ по любому из пп. 20-22, в котором радиоактивный изотоп выбран из группы, включающей 111In, 67Ga, 68Ga, 86Y, 90Y, 177Lu, 161Tb, 43Sc, 44Sc, 47Sc, 225Ac, 153Sm, 166Но, или 166Dy, препочтительно из группы, включающей 177Lu, 90Y, 67Ga, 68Ga, 111In, 225Ac, 161Tb, 44Sc, и 47Sc, наиболее предпочтительно из группы, включающей 177Lu, 225Ас и 68Ga.
24. Способ по любому из пп. 20-23, в котором содержащая радиоактивный изотоп конъюгированная молекула выбрана из группы, включающей [177Lu-DOTA0-Tyr3]-октреотид, 177Lu-DOTANOC (177Lu-DOTA-D-Phe-цикло(Cys-1-Nal-D-Trp-Lys-Thr-Cys)Thr(ол)), 177Lu-DOTATATE (177Lu-DOTA-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Thr-Cys)Thr), 68Ga-DOTATOC (68Ga-DOTA-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Thr-Cys)Thr(ол)), 68Ga-DOTANOC (68Ga-DOTA-D-Phe-цикло(Cys-1-Nal-D-Trp-Lys-Thr-Cys)Thr(ол)), 90Y-DOTATOC (90Y-DOTA-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Thr-Cys)Thr(ол)), 90Y-DOTATATE (90Y-DOTA-D-Phe-цикло(Cys-Tyr-D-Trp-Lys-Thr-Cys)Thr), 111In-DTPA-октреотид (111In-DTPA-D-Phe-цикло(Cys-Phe-D-Trp-Lys-Thr-Cys)Thr(ол)), 111In-DOTA-BASS (111In-DOTA-p-NO2-Phe-цикло-(D-Cys-Tyr-D-Trp-Lys-Thr-Cys)D-Tyr-NH2, 111In-DOTA-JR11 (111In-DOTA-Cpa-цикло[D-Cys-Aph(Hor)-D-Aph(Cbm)-Lys-Thr-Cys]D-Tyr-NH2), 68Ga-DOTA-JR11 (Ga-OpS201) (68Ga-DOTA-Cpa-цикло[D-Cys-Aph(Hor)-D-Aph(Cbm)-Lys-Thr-Cys]D-Tyr-NH2), 68Ga-DODAGA-JR11 (Ga-OPS202) (68Ga-NODAGA-Cpa-цикло[D-Cys-Aph(Hor)-D-Aph(Cbm)-Lys-Thr-Cys]D-Tyr-NH2), 177Lu-DOTA-JR11, 177Lu-DOTA-RGD, 177Lu-DOTA-саргастрин, 68Ga-HBED-CC-ПСМА-11, и 177Lu-ПСМА I&T.
25. Способ по любому из пп. 19-24, в котором пара-аминогиппуровую кислоту (ПАГ) или ее фармацевтически приемлемую соль применяют в комбинации с другим веществом, которое уменьшает нефротоксические побочные эффекты меченных радиоактивным изотопом терапевтических и диагностических соединений, в котором дополнительное вещество, уменьшающее нефротоксические побочные эффекты меченных радиоактивным изотопом терапевтических и диагностических соединений, отличающееся от ПАГ, необязательно, выбрано из группы, включающей аминокислоты, желатин, амифостин, образованные из альбумина пептиды, связывающие ПСМА молекулы, такие как ФМПК, и витамины.
26. Способ по любому из пп. 19-25, в котором ПАГ или ее фармацевтически приемлемую соль вводят в количестве, составляющем от 5 до 500 мг/(кг массы тела) и/или терапевтическое и/или диагностическое соединение (соединения) и ПАГ или ее фармацевтически приемлемую соль применяют при отношении количеств, составляющем от 1/240000 до 1/8000 (мас./мас.).
27. Способ по любому из пп. 19-26, в котором фармацевтически приемлемой солью ПАГ является аминогиппурат натрия.
| Natochin, Y.V., Reznik, L.V., Bakhteeva, V.T., Myazina, E.M., & Brovtsyn, V.K | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
| Cisplatin: Nephrotoxic action in vertebrates and its prevention | |||
| Comparative Biochemistry and Physiology Part C: Comparative Pharmacology, 94(1), 115-120 | |||
| S Hu et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2023-09-28—Публикация
2020-05-08—Подача