Изобретение относится к области экологии, охраны окружающей среды, иммунологии и физиологии, в частности к способам оценки здоровья морских двустворчатых моллюсков.
Моллюски играют важную роль в структуре и функционировании морских бентосных сообществ, являются ценными пищевыми объектами. Эффективность культивирования и добычи промысловых объектов связана с необходимостью своевременной оценки состояния их здоровья и постоянного мониторинга состояния морских экосистем. Отсутствие четких критериев оценки физиологического состояния моллюсков, низкий уровень развития методов ветеринарного контроля и недостаток сведений о связи морфофизиологических признаков с границами нормы и патологии при оценке состояния здоровья этих животных существенным образом ограничивают экономическую эффективность морских хозяйств. В связи с этим разработка критериев и оптимизация методов диагностики для контроля физиологического состояния популяций промысловых моллюсков является важной практической задачей для решения широкого круга проблем, касающихся как развития морских хозяйств, так и сохранения морского биоразнообразия.
Наиболее популярным способом оценки физиологического состояния двустворчатых моллюсков является метод оценки их двигательной активности, проявляющийся в регистрации положения створок. В нормальных условиях створки открыты большую часть времени для обеспечения непрерывного питания и поглощения кислорода из воды. Реагируя на загрязнение воды или другие ухудшения ее качества, моллюски первоначально закрывают раковину, потом изменяются характер их поведения, ритм чередования периодов закрытых и открытых створок.
Одним из последних в данной области является способ биологического мониторинга водной среды на основе регистрации положения створок раковин двухстворчатых раковинных моллюсков и система для его осуществления (RU 2361207, МПК G01N33/18, 10.07.2009). Способ включает закрепление на створках раковины моллюсков датчика положения створок, размещение моллюсков с датчиками в контролируемой воде, формирование и пропускание оптического излучения по оптическим волокнам линии передачи, один из участков каждой из которых выполнен в виде петли и установлен на одной из створок закрепленного основания датчика с упором одной стороной петли в дно паза, выполненного в основании датчика, с возможностью механического взаимодействия другой стороны петли с элементом воздействия на чувствительный элемент, установленным на другой створке раковины, и с возможностью деформации формы петли в ее плоскости в результате механического взаимодействия петли с элементом воздействия на чувствительный элемент и дном паза основания датчика. Далее способ предусматривает преобразование оптического излучения, прошедшего по оптическим волокнам, в электрические сигналы приемниками оптического излучения. В комплексе система содержит датчики положения створок раковины моллюска, усилители, аналого-цифровые преобразователи и компьютер.
Техническими недостатками системы является то, что данные датчики сложны в изготовлении, крепления громоздки и ненадежны, тяжелы для нормальной работы моллюсков, что приводит к ограничению естественных движений животного, система уязвима для реальных природных условий (течений и волн) из-за выступающих частей; провода и датчики легко подвержены быстрому обрастанию (водоросли, гидроиды, молодь моллюсков и т.д.), влияющему на работу системы, что приводит к необходимости его периодического обслуживания и калибровки; при гибели (замене) животного происходит потеря оборудования или его демонтаж. Кроме того, для осуществления заявленного способа необходимо размещение моллюсков в отдельной емкости, например проточном аквариуме; отсутствует возможность проследить влияние хронического загрязнения на состояние моллюсков. Данный способ, исходя из описания предлагаемой системы, включает сложную приборную базу, требующую значительных экономических затрат. Ограничением данного способа также является использование лишь двустворчатых моллюсков, ведущих прикрепленный образ жизни.
Перспективным представляется использование биохимических показателей, поскольку любому физиологическому, а тем более морфологическому отклонению от нормы предшествуют определенные биохимические процессы, которые являются первопричиной изменения физиологического состояния организма, ухудшения качества его потомства или гибели. К биохимическим маркерам токсического загрязнения воды следует отнести, прежде всего, изменение концентрации и активности таких молекул, как ферментов - универсальных катализаторов и регуляторов обменных процессов, а также аккумулированных вредных веществ из окружающей среды.
Способ определения токсического загрязнения сточных и природных пресных вод (RU 2308719, МПК G01N33/18, 20.10.2007) предусматривает помещение моллюсков в отдельные аквариумы с проточной водой, последующее убийство, изъятие печени, получение экстракта белков печени, определение в нем активности гидролитических ферментов - кислой фосфатазы или дезоксирибонуклеазы (ДНКазы). За показатель токсичности тестируемой воды принимают достоверное изменение общей активности тест-фермента или хотя бы одно качественное изменение в составе его множественных форм в опытном варианте по сравнению с контролем.
Техническими недостатками является использование сложной приборной базы, необходимость отдельного содержания и гибель исследуемого моллюска.
Известен способ мониторинга водного загрязнения (US 20130118236 A1, МПК G01N33/18, 16.05.2013), который предусматривает использование датчиков уровня потребления кислорода, клиренса частиц и апикального роста моллюсков, помещенных в специальную камеру.
Известен способ определения лизоцимной активности биологических объектов (RU 2294373, МПК C12Q001/02, G01N033/48, 20.07.2006), который предусматривает выращивание тест-культуры Micrococcus lysodeikticus штамм № 2665 ГИСК им. Тарасевича на жидкой питательной среде при температуре 27°С до оптической плотности 3,2-3,4, подвергание среды лиофильной сушке, приготовление из тест-культуры суспензии, которую вносят в исследуемый биологический объект и оценивают лизоцимную активность биологического объекта по известному методу.
Недостатком данного способа является сложность работы с бактериальной культурой, требующей стерильных условий и постоянного контроля за её состоянием.
Наиболее близким по технической сущности к заявляемому техническому решению является способ оценки состояния экосистемы, основанный на определении концентрации набора молекул-биомаркеров стресса в клетках животных различных систематических групп (WO 2002022859A2, МПК C12Q1/00, G01N33/50, 21.03.2002). В данном способе среди множества методов оценки концентрации биомакерных молекул авторы рекомендуют использовать методы, основанные на взаимодействии по принципу "антиген-антитело" (различные виды иммуноферментного анализа (ИФА), Вестерн блотинг и др.). Антиген - это интересующий биомаркер в клетке, антитела - выделенные и очищенные молекулы после иммунизации лабораторных животных. Авторы рекомендуют для выделения и очистки антител использовать высокоэффективную жидкостную хроматографию с протеином А, специфичным к Fc-ножкам антител. Полученные очищенные антитела, в свою очередь, используют для создания аффинных колонок, специфичных к интересующему биомаркеру. С их помощью можно уже многократно выделять целевые молекулы из материала организмов, подверженных стрессу. Если концентрация полученного белка позволяет, то далее возможно изучить его аминокислотный состав по одной из стандартных методик, например секвенированием по Эдману. Анализ исследуемых молекул авторы также рекомендуют дополнить одномерным электрофорезом в полиакриламидном геле по Леммли (ID SDS-PAGE) с последующим Вестерн блоттингом. Границы нормального содержания биомаркеров определяют методами Вестерн блоттинга и/или ИФА по образцам, полученным из подверженных и не подверженных стрессу животных. В качестве альтернативы в известном способе предлагается определять "нормальные" и "ненормальные" значения концентраций по литературным данным. В итоге исследуемые образцы (жидкие гомогенаты клеток или тканей организмов подверженных стрессу) делят по количеству используемых в анализе биомаркеров и для каждого из них проводят анализ по отработанной стандартизированной методике, пригодной и для лабораторного анализа, и для работы в поле. Полученные результаты сравнивают с ранее определенными границами нормы.
К недостаткам данного способа следует отнести:
- сложность, многоэтапность процедуры пробоподготовки и анализа;
- использование большого набора исследуемых молекул-биомаркеров;
- высокая трудоемкость и значительная отставленность получения во времени результатов, которые ограничивают возможности использования данного способа для проведения экспресс-мониторинговых исследований;
- гибель тест-объекта, поскольку используется гомогенат всех тканей животного.
Данный способ также отличается значительными экономическими затратами поскольку предусматривает содержание тест-объектов в контролируемых условиях, требующих отдельных аквариумов, а также использование дорогостоящих реактивов и оборудования (исходя из заявленного перечня в описании данного способа).
Задача настоящего изобретения - разработка способа биомониторинга на основе биоиндикации клеточных и гуморальных факторов гемолимфы моллюсков, обладающей достаточной чувствительностью к изменениям среды, упрощение и уменьшение трудоемкости способа проведения биомониторинга.
Поставленная задача решается тем, что в известном способе оценки здоровья морских гидробионтов и состояния среды их обитания, включающем отбор морских гидробионтов, приготовление проб тканей, определение биомаркера и сравнение значений биомаркера животных, подверженных стрессу с животными не подверженных стрессу, согласно настоящему изобретению в роли морских гидробионтов берут двустворчатых моллюсков. В качестве исследуемой ткани используют гемолимфу, которую затем разделяют на плазму и гемоциты. В качестве биомаркера для оценки здоровья морских гидробионтов и состояния среды их обитания определяют фагоцитарную активность гемоцитов.
В предлагаемом техническом решении в качестве морских гидробионтов могут быть использованы прикрепленные и не прикрепленные двустворчатые моллюски, в частности приморский гребешок (Mizuhopecten yessoensis), мия аренария (Mya arenaria), модиолус курильский/длиннощетинистий (Modiolus kurilensis), тихоокеанская устрица (Crassostrea gigas) и различные виды мидий. Двустворчатые моллюски, являющиеся тест-объектами, используются непосредственно в день их вылова, т.е. не требуют специальных условий для их содержания, вследствие чего намного упрощается трудоемкость проведения биомониторинга и сокращается время на его проведение.
Использование в качестве исследуемой ткани гемолимфы значительно увеличивает точность и чувствительность оценки состояния здоровья моллюска и среды его обитания. В связи с тем, что гемолимфа является защитно-транспортной разновидностью ткани внутренней среды, отвечающей за поддержание гомеостаза, обеспечение иммунной защиты и формирование физиологических адаптаций к изменениям, происходящих в окружающей среде. Взятие гемолимфы не требует уничтожения гидробионтов, упрощает пробоподготовку и исключает использование сложного дорогостоящего оборудования.
Отделение гемоцитов от плазмы гемолимфы позволяет вести оценку здоровья моллюсков на основе диагностики биомаркера, в качестве которого используют фагоцитарную активность гемоцитов. Клетки-фагоциты осуществляют поглощение и нейтрализацию внедрившихся чужеродных агентов путем их переваривания гидролитическими ферментами лизосом. Фагоцитоз как фундаментальная составляющая защитной функции является высокочувствительным показателем состояния здоровья живых организмов. Вследствие чего значительно повышается чувствительность заявленного способа.
Для повышения уровня чувствительности и надежности способа оценки здоровья моллюсков и состояния среды их обитания предлагается дополнительно использовать в качестве биомаркера гемолитическую активность плазмы. Данная операция не требует дополнительного взятия материала, поскольку используется плазма, отделенная от клеток гемолимфы. Литические вещества (белки-лизины) осуществляют лизис (разрушение) чужеродных агентов (клеток, бактерий и др.).
Дополнительно предлагается использовать в качестве биомаркера концентрацию общего белка плазмы. В плазме постоянно содержатся в различной концентрации вещества: лектины (участвуют во всех взаимодействиях клетка-клетка, что проявляется в митогенетических, сигнальных, цитотоксических и прочих свойствах данных молекул, обеспечивают агглютинацию (склеивание) клеток и молекул), литические и антимикробные (оказывают бактериолитическое или подавляющее рост бактерий воздействие, проявляя бактериостатические свойства). От концентрации набора белков плазмы зависит эффективность реализации и обеспечения взаимодействия защитных реакций. В отличие от прототипа определяют содержание не определенного белка, а содержание общего белка в плазме. Вследствие чего нет необходимости проводить сложные манипуляции по их разделению, очистке на колонках и т.д. Это не только упрощает процесс проведения биомониторинга, сокращает время на его проведение. В конечном результате, это повышает чувствительность способа и точность оценки состояния здоровья двустворчатых моллюсков и состояния среды их обитания.
Использование в комплексе всех трех биомаркеров, сравнение их у животных, подверженных и не подверженных стрессу, позволяет достичь заявленного технического результата, а именно достаточной чувствительности к изменениям среды, упрощение и уменьшение трудоемкости способа проведения биомониторинга.
Способ биомониторинга осуществляют в несколько стадий:
1 стадия - отбор морских гидробионтов - производят отлов тестируемых половозрелых особей двустворчатых моллюсков одинаковой возрастной категории, что определяется посредством измерения размера раковины, в импактной акватории и условно фоновой (чистой) акватории;
2 стадия - приготовление проб тканей, т.е. взятие гемолимфы - у каждого животного берут 2700 мкл гемолимфы с помощью шприца из гемального синуса заднего мускула-аддуктора. Для этого острие скальпеля располагают вдоль створок и, надавливая на него, приоткрывают слегка раковину моллюска;
3 стадия - разделение гемолимфы на гемоциты и плазму - взятую гемолимфу переносят в пробирки на "ледяной бане" до момента отделения клеток от плазмы путем центрифугирования. Пробирки центрифугируют в течение 12 мин при 800g в рефрижераторной центрифуге при 15°C. После центрифугирования надосадочную жидкость, представляющую плазму, снимают и переносят в криопробирки, которые замораживают в жидком азоте при −195,8°С; образовавшийся осадок, содержащий гемоциты, используют для определения фагоцитарной активности (ФА).
4 стадия определения биомаркера - ФА. Данная стадия осуществляется согласно общепринятым методам и включает три операции:
а) приготовление клеточной суспензии гемоцитов - оставшийся осадок после отделения плазмы отмывают добавлением (с последующим ресуспендированием) 2700 мкл физиологической бескальциевой солевой среды (ФБСС) следующего состава: 436 мМ NaCl, 10 мМ KCl, 22 мМ Na2HPO4·7H2O, 16 мМ глюкоза, 12 мМ N-(2-гидроксиэтил) пиперазин-N′-2-этансульфокислота (HEPES), содержащей 0,045 М этилендиаминтетрауксусную кислоту (ЭДТА). Аликвоту (10 мкл) полученной суспензии используют для подсчета в камере Горяева количества гемоцитов. Расчет концентрации проводят по известной формуле: количество клеток/мл = количество клеток над 1 большим квадратом*250*1000. Для получения первичной клеточной культуры клетки вновь центрифугируют при тех же условиях и ресуспендируют в 2700 мкл искусственной солевой среды (ИСС) с осмотичностью 1090 mOsM, содержащей 460 мМ NaCl; 9,4 мМ KCl; 48,3 мМ MgCl2·6H2O; 6 мМ NaHCO3; 10,8 мМ CaCl2·2H2O; 10 мМ HEPES;
б) проведение реакции in vitro фагоцитоза - для постановки реакции фагоцитоза по 50 мкл клеточной суспензии от каждого животного помещают в лунки черного 96-луночного планшета. Образцы инкубируют во влажной камере при 17°С в течение 40 мин для максимальной адгезии клеток к субстрату. В качестве биотических частиц для проведения in vitro реакции фагоцитоза используют инактивировированных нагреванием и окрашенных раствором флуоресцеина-5-изотиоцианата (ФИТЦ, MP Biomedicals) бактерий из расчета 15-20 клеток на 1 гемоцит. Через каждые 10 минут после добавления бактерий к клеткам в лунках в течение 3 часов производят тушение флуоресценции неинтернализованных бактерий путем отбора надосадочной жидкости из лунок, добавлением 50 мкл 0,1% раствора трипанового синего, приготовленном на ИСС, и инкубацией препаратов в течение 12 мин. Препараты отмывают, трижды чередуя отбор и добавление ИСС. Реакцию фагоцитоза останавливают через 1 ч 20 мин с момента добавления бактерий к клеткам фиксацией 50 мкл раствора 4% параформальдегида, приготовленном на ИСС, в течение 1 ч. Реакцию фагоцитоза ставят в трех параллельных повторах.
в) оценка ФА - активность фагоцитов анализируют по интенсивности флуоресценции образцов в планшетах при помощи планшетного флуориметра с возбуждающим светофильтром 485 нм и поглощающим 535 нм. Результатом оценки является оптимальное время проведения реакции in vitro фагоцитоза, которое включает максимальное значение фагоцитарной активности. Данные выражают в условных единицах (усл.ед.).
5 стадия - определение биомаркера - гемолитической активности (ГА) плазмы. Данная стадия осуществляется согласно общепринятым методам и включает две операции:
а) определение ГА - проводят гемолитическую реакцию, для чего предварительно отмывают донорские эритроциты (Эр) от консервирующего раствора изотоничной фосфатной буферной смесью (0,8% NaCl, 0,02% KCl, 10мM Na2HPO4-КH2PO4, pH 7,4) центрифугированием в течение 12 мин при 300g и 15°С до полного осветления надосадочной жидкости. Определение количества Эр в полученной суспензии производят подсчетом их в камере Горяева с дальнейшим разведением ее до концентрации 1,25×105 кл/мкл Трис-HCl буфером с pH 7,5 (ТБС) (10 мМ Трис-HCl, 150 мМ NaCl, 2 мМ CaCl2). В пробирки на 1,5 мл добавляют 50 мкл ранее замороженной плазмы, 50 мкл ТБС и 400 мкл суспензии Эр. Полученную ресуспендированную суспензию инкубируют в течение 1 ч, с периодическим встряхиванием на шейкере каждые 15 мин. Реакцию останавливают добавлением 1 мл ТБС1 (10 мМ трис HCl, 150 мМ NaCl, 30 мМ Na2ЭДТА), в состав которого входит хелатирующий агент, связывающий ионы Са2+, необходимые для активности большинства лизинов беспозвоночных. Центрифугируют в течение 12 мин при 800g и 15°С. Надосадочную жидкость разбавляют раствором ТБС2 (10 мМ Трис-HCl, 150 мМ NaCl) в 6 раз. Полученную суспензию переносят в спектрофотометрическую кювету и измеряют оптическую плотность при длине волны 514 нм в спектрофотометре. В каждой серии реакций проводят негативный контроль (спонтанный гемолиз Эр). Для этой цели в самом начале вместо плазмы в пробирки добавляют 50 мкл ТБС; позитивный контроль (полный лизис Эр) - вместо плазмы добавляют 50 мкл 1% раствора Triton X-100 на ТБС.
б) оценка ГА - показатель ГА выражают в процентах по формуле:
Показатель ГА = ((X-X0)/(X1-X0))*100%, где
Х - оптическая плотность раствора после инкубирования с плазмой,
Х0 - оптическая плотность раствора в негативном контроле,
Х1 - оптическая плотность раствора в позитивном контроле.
6 стадия - определение биомаркера - концентрации общего белка плазмы - проводят с помощью UV-метода, основанного на способности ароматических радикалов, присутствующих, главным образом, в аминокислотах белков, поглощать свет с длиной волны 280 нм. Для этой цели 100 мкл плазмы вносят в кварцевую микрокювету (кат. № 046-25302-11) с длиной оптического пути 10 мм и измеряют оптическую плотность на спектрофотометре при длине световой волны 280 нм и коэффициенте абсорбции 0,667.
7 стадия - статистическую обработку полученных данных проводят при помощи пакета программ Microsoft Excel 2007 и Statistica 6.0. Тест Колмогорова-Смирнова показывает, что полученные значения подчиняются закону нормального распределения с уровнями значимости p > 0,05 для всех выборок; исходя из этого, дальнейший статистический анализ проводят при помощи параметрических критериев. Для проверки значимости гипотезы об отсутствии или наличия различий между исследуемыми выборками животных используют однофакторный дисперсионный анализ (ANOVA) и парный t-критерий. Данные представляются в виде средней ± доверительного интервала (ФА в усл.ед., ГА в %, концентрация общего белка в г/мл).
8 стадия - анализ ФА гемоцитов, ГА и концентрации общего белка плазмы проводят сравнение биомаркеров у животных, подверженных стрессу, выловленных в исследуемой (импактной) акватории и животных не подверженных стрессу из условно фоновой акватории.
Пример 1
Вылавливают 30 экземпляров половозрелых особей двустворчатых моллюсков одинаковой возрастной категории модиолуса курильского/длиннощетинистого (Modiolus kurilensis) из условно фоновой акватории (акватории с уровнем концентрации химического вещества, характерного для районов, не подверженных непосредственному влиянию человеческой деятельности, и обусловленного деятельностью местных природных источников) - зал. Восток залива Петра Великого Японского моря. В данном районе располагается Государственный природный комплексный морской заказник «Залив Восток», хозяйственная деятельность человека незначительна, геохимические условия и содержание поллютантов в воде и грунте соответствуют условно фоновому уровню ([5], [1], [2]). Одновременно собирают животных из импактной акватории (акватории, расположенной возле точечного источника эмиссии поллютантов и подверженной действию локальной токсической нагрузки от этого источника) - Амурский залив (30 экз.). Согласно физико-химическому мониторингу акваторий Дальнего Востока Амурский залив, расположенный вблизи агломерации города Владивостока, не отвечает санитарно-эпидемиологическим нормам и естественным показателям среды по фенолам, нефтепродуктам, численности патогенных бактерий, в частности энтерококков, концентрациям кислорода, фосфора, тяжелых металлов, а также ряду других параметров, которые существенно варьируют из года в год ([5], [6], [3], [4]). Животных используют в эксперименте в день их вылова.
У каждого животного берут 2700 мкл гемолимфы с помощью шприца из гемального синуса заднего мускула-аддуктора.
Взятую гемолимфу разделяют на гемоциты и плазму методом центрифугирования в течение 12 мин при 800g в рефрижераторной центрифуге при 15°C. После центрифугирования плазму снимают и переносят в криопробирки, которые замораживают в жидком азоте при −195,8°С.
Определяют фагоцитарную активность оставшегося осадка из клеток, для чего клеточную суспензию, приготовленную после отмывки гемоцитов, помещают в лунки черного 96-луночного планшета. Образцы инкубируют во влажной камере при 17°С в течение 40 мин для максимальной адгезии клеток к субстрату. Проводят реакцию in vitro фагоцитоза. Активность фагоцитов оценивают по интенсивности флуоресценции образцов в планшетах при помощи планшетного флуориметра.
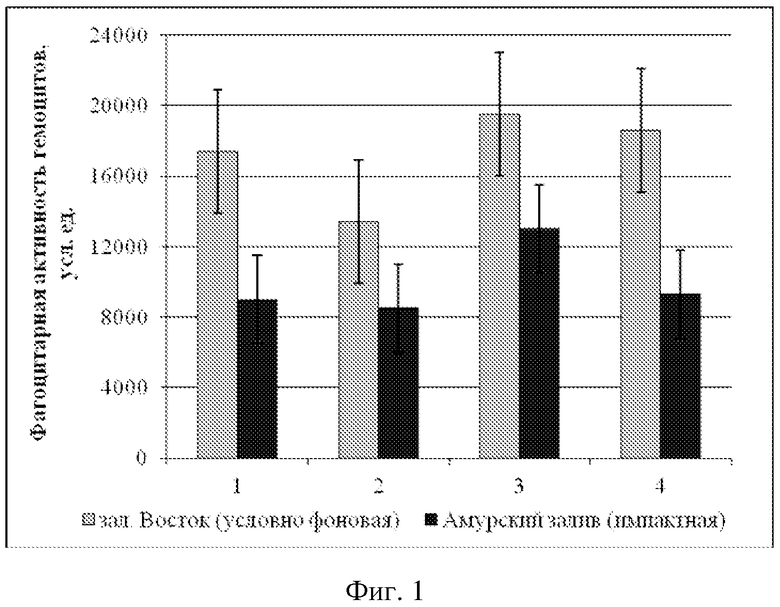
ФА модиолуса курильского из импактной акватории 9000 ± 2000 усл. ед.
ФА модиолуса курильского из условно фоновой акватории 17400 ± 3700 усл. ед.
Пример 2
Осуществляют аналогично примеру 1. Только проводят дополнительное определение биомаркеров ГА и концентрации общего белка плазмы.
Для определения ГА берут 50 мкл ранее замороженной плазмы, смешивают с 50 мкл ТБС и 400 мкл суспензии Эр. Полученную ресуспендированную суспензию инкубируют в течение 1 ч с периодическим встряхиванием на шейкере каждые 15 мин. Реакцию останавливают добавлением 1 мл ТБС1. Центрифугируют в течение 12 мин при 800g и 15°С. Надосадочную жидкость разбавляют раствором ТБС2 в 6 раз. Полученную суспензию переносят в спектрофотометрическую кювету и измеряют оптическую плотность при длине волны 514 нм в спектрофотометре.
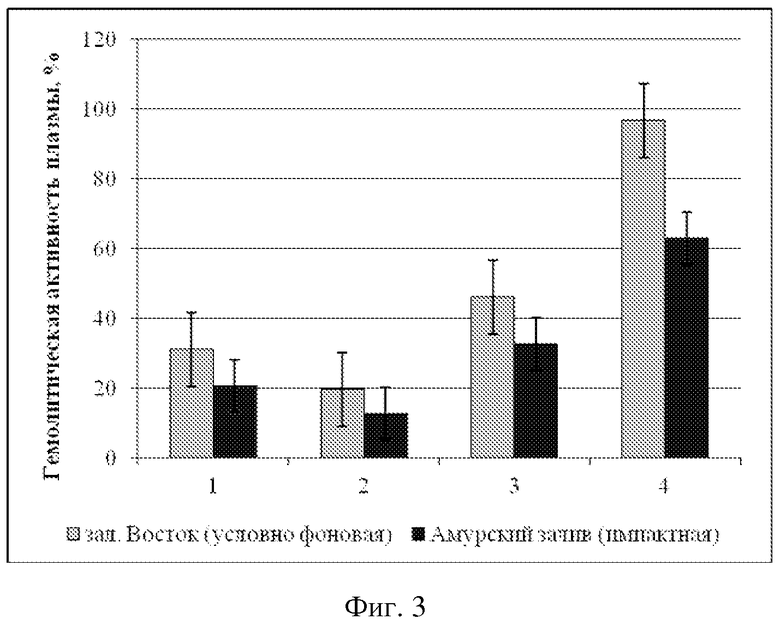
ГА модиолуса курильского из импактной акватории 20,7 ± 10,3 %.
ГА модиолуса курильского из условно фоновой акватории 31,1 ± 10,6 %.
Определение концентрации общего белка плазмы производят с помощью UV-метода, для чего 100 мкл плазмы вносят в кварцевую микрокювету (кат. № 046-25302-11) с длиной оптического пути 10 мм и измеряют оптическую плотность на спектрофотометре при длине световой волны 280 нм и коэффициенте абсорбции 0,667.
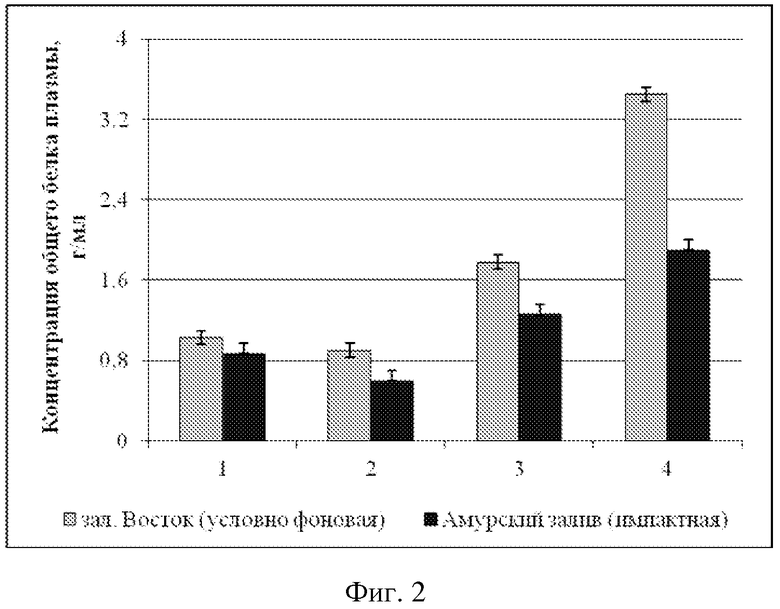
Концентрация общего белка плазмы модиолуса курильского из импактной акватории 0,87 ± 0,09 г/мл.
Концентрация общего белка плазмы модиолуса курильского из условно фоновой акватории 1,03 ± 0,07 г/мл.
Пример 3
Осуществляют аналогично примеру 1 и 2, только в качестве двустворчатого моллюска берут приморского гребешка (Mizuhopecten yessoensis).
ФА приморского гребешка из импактной акватории 9000 ± 2000 усл. ед.
ФА приморского гребешка из условно фоновой акватории 13400 ± 4000 усл. ед.
ГА приморского гребешка из импактной акватории 12,8 ± 7,5 %.
ГА приморского гребешка из условно фоновой акватории 19,7 ± 10,9 %.
Концентрация общего белка плазмы приморского гребешка из импактной акватории 0,6 ± 0,1 г/мл.
Концентрация общего белка плазмы приморского гребешка из условно фоновой акватории 0,9 ± 0,10 г/мл.
Пример 4
Осуществляют аналогично примеру 1 и 2, только в качестве двустворчатого моллюска берут мию аренарию (Mya arenaria).
ФА мии аренарии из импактной акватории 13000 ± 3000 усл. ед.
ФА мии аренарии из условно фоновой акватории 19500 ± 4000 усл. ед.
ГА мии аренарии из импактной акватории 32,7 ± 6,8 %.
ГА мии аренарии из условно фоновой акватории 46,2 ± 9,6 %.
Концентрация общего белка плазмы мии аренарии из импактной акватории 1,26 ± 0,17 г/мл.
Концентрация общего белка плазмы мии аренарии из условно фоновой акватории 1,78 ± 0,07 г/мл.
Пример 5
Осуществляют аналогично примеру 1 и 2, только в качестве двустворчатого моллюска берут мидию гигантскую/Грея (Crenomytilus graynus).
ФА мидии гигантской из импактной акватории 9300 ± 4100 усл. ед.
ФА мидии гигантской из условно фоновой акватории 18600 ± 3300 усл. ед.
ГА мидии гигантской из импактной акватории 62,9 ± 9,4 %.
ГА мидии гигантской из условно фоновой акватории 96,7 ± 27,3 %.
Концентрация общего белка плазмы мидии гигантской из импактной акватории 1,9 ± 0,1 г/мл.
Концентрация общего белка плазмы мидии гигантской из условно фоновой акватории 3,45 ± 0,57 г/мл.
Анализ фагоцитарной активности модиолусов показал, что животные из импактной акватории имеют достоверно более низкие значения средней фагоцитарной активности (9000 ± 2000 усл. ед.) по сравнению с таковыми из условно фоновой акватории (17400 ± 3700 усл. ед.). Примененный t-критерий подтвердил достоверность различий (p > 0,05) (Пример 1). Сравнительный анализ гемолитической активности и общей концентрации белка плазмы M. kurilensis из условно фоновой и импактной акваторий показал достоверное снижение таковых у животных из импактной - Амурского залива (p < 0,05). Гемолитическая активность плазмы модиолусов из импактной акватории достигала 20,7 ± 10,3 %, концентрация общего белка 0,87 ± 0,09 г/мл, тогда как значения этих же параметров у животных условно фоновой акватории составили 31,1 ± 10,6 % и 1,03 ± 0,07 г/мл (Пример 2).
Сравнительный анализ фагоцитарной активности гемоцитов приморского гребешка выявил достоверное снижение таковой у животных из импактной акватории (8500 ± 3200 усл. ед.). Среднее значение фагоцитарной активности моллюсков из зал. Восток составило 13400 ± 4000 усл. ед. Концентрация общего белка составила 0,9 ± 0,10 г/мл, а гемолитическая активность 19,7 ± 10,9 %; из Амурского залива - 0,6 ± 0,1 г/мл и 12,8 ± 7,5 %. Примененный t-критерий подтвердил достоверность различий (p > 0,05) (Пример 3).
Сравнительный анализ фагоцитарной активности гемоцитов мии аренарии выявил различие таковой у животных из импактной (13000 ± 3000 усл. ед.) и условно фоновой (19500 ± 4000 усл. ед.) акваторий. Также у моллюсков из импактной акватории наблюдалось снижение концентрации общего белка 1,26 ± 0,17 г/мл и гемолитической активности - 32,7 ± 6,8 %, тогда как из зал. Восток эти же параметры были соответственно 1,78 ± 0,07 г/мл и 46,2 ± 9,6 %. Примененный t-критерий подтвердил достоверность различий (p > 0,05) (Пример 4).
Среднее значение фагоцитарной активности мидии гигантской из условно фоновой акватории составило 18600 ± 3300 усл. ед. Сравнительный анализ фагоцитарной активности гемоцитов выявил снижение таковой у моллюсков из импактной акватории (9300 ± 4100 усл. ед.). Концентрация общего белка у мидии из зал. Восток составила 3,45 ± 0,57 г/мл, а гемолитическая активность 96,7 ± 27,3 %, из Амурского залива - 1,9 ± 0,1 г/мл и 62,9 ± 9,4 %. Примененный t-критерий подтвердил достоверность различий (p > 0,05) (Пример 5).
Как видно из примеров 1-4 средние значения ФА гемоцитов, ГА и концентрации общего белка плазмы достоверно снижены у двустворчатых моллюсков из импактной акватории по сравнению с выборкой из условно фоновой акватории, что наглядно можно видеть из фиг. 1, 2, 3.
На фиг. 1 представлены сравнительные средние значения фагоцитарной активности (ФА) гемоцитов ± доверительный интервал для двустворчатых моллюсков из условно фоновой акватории (столбики светло-серого цвета) и импактной акваторий (столбики темно-серого цвета), где 1 - модиолус курильский, 2 - приморский гребешок, 3 - мия аренария, 4 - мидия гигантская.
На фиг. 2 представлены сравнительные средние значения гемолитической активности (ГА) плазмы ± доверительный интервал для двустворчатых моллюсков из условно фоновой акватории (столбики светло-серого цвета) и импактной акваторий (столбики темно-серого цвета), где 1 - модиолус курильский, 2 - приморский гребешок, 3 - мия аренария, 4 - мидия гигантская.
На фиг. 3 представлены сравнительные средние значения концентрации общего белка плазмы ± доверительный интервал для двустворчатых моллюсков из условно фоновой акватории (столбики светло-серого цвета) и импактной акваторий (столбики темно-серого цвета), где 1 - модиолус курильский, 2 - приморский гребешок, 3 - мия аренария, 4 - мидия гигантская.
Полученные данные указывают на то, что разработанный способ оценки здоровья морских двустворчатых моллюсков и состояния среды их обитания обладает высокой чувствительностью и может быть реализован на основе имеющейся отечественной или зарубежной техники с использованием простого набора инструментов и реактивов, что упрощает и уменьшает трудоемкость способа проведения биомониторинга. Предложенный способ позволяет отслеживать влияние не только антропогенных, но и естественных текущих изменений природных факторов на морские организмы, регистрируя кумулятивный эффект их действия в реальных полевых условиях. При этом оцениваются изменения на различных уровнях организации живых организмов: клеточном и молекулярном. Способ работает, даже если определять только ФА, поскольку фагоцитоз является врожденным механизмом защитной реакции организма при вторжении чужеродных агентов.
Источники информации
1. Галышева Ю.А., Христофорова Н.К., Чернова Е.Н. и др. Некоторые экологические параметры водной среды и донных отложений бухты Киевка Японского моря // Изв. ТИНРО. 2008. Т. 154. С. 114-124.
2. Журавель Е.В., Христофорова Н.К., Дроздовская О.А. и др. Оценка состояния вод залива Восток (залив Петра Великого, Японское море) по гидрохимическим и микробиологическим показателям // Известия Самарского научного центра РАН. 2012. Т. 14, № 1. С. 2325-2329.
3. Коршенко А.Н., Матвейчук И.Г., Плотникова Т.И. и др. Ежегодник качества морских вод по гидрохимическим показателям (Японское море) за 2009 год. Владивосток: ПУГМС. 2010. 28 с.
4. Маркина Ж.В., Журавель Е.В., Айздайчер Н.А. Оценка состояния вод залива Петра Великого (Японское море) на основе гидрохимических показателей и анализа роста и содержания хлорофилла А микроводоросли Phaeodactylum tricornutum // Изв. Самар. науч. центра Рос. акад. наук. 2011. Т. 13, № 1. С. 1460-1463.
5. Наумов Ю.А. Антропогенез и экологическое состояние геосистемы прибрежно-шельфовой зоны залива Петра Великого Японского моря. Владивосток: Дальнаука. 2006. 300 с.
6. Нигматулина Л.В. Оценка антропогенной нагрузки береговых источников на Амурский залив (Японское море) // Вестн. ДВО РАН. 2007. № 1. С. 73-76.
Изобретение относится к экологии, охране окружающей среды, иммунологии и физиологии, и может быть использовано для оценки здоровья морских двустворчатых моллюсков, подверженных и не подверженных стрессу, и состояния среды их обитания. Для этого у двустворчатых моллюсков берут гемолимфу, разделяют ее на плазму и гемоциты, определяя их фагоцитарную активность. Дополнительно в качестве биомаркеров определяют гемолитическую активность плазмы и концентрацию общего белка в ней. Способ позволяет оценить состояние здоровья морских двустворчатых моллюсков и среды их обитания на основе биоиндикации клеточных и гуморальных факторов гемолимфы моллюсков при упрощении и уменьшении трудоемкости способа. 2 з.п. ф-лы, 3 ил., 5 пр.
1. Способ оценки здоровья морских гидробионтов и состояния среды их обитания, включающий отбор морских гидробионтов, приготовление проб тканей, определение биомаркера и сравнение биомаркера животных, подверженных стрессу с животными не подверженными стрессу, отличающийся тем, что в качестве морских гидробионтов используют двустворчатых моллюсков, в качестве исследуемой ткани берут их гемолимфу, которую затем разделяют на плазму и гемоциты, а в качестве биомаркера определяют фагоцитарную активность гемоцитов.
2. Способ по п.1, отличающийся тем, что в качестве дополнительного биомаркера ведут определение гемолитической активности плазмы.
3. Способ по п.1, отличающийся тем, что в качестве дополнительного биомаркера ведут определение концентрации общего белка в плазме.
| WO0222859 A2, 21.03.2002 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ РАДИОАКТИВНОГО ЗАГРЯЗНЕНИЯ АКВАТОРИЙ | 2010 |
|
RU2441215C1 |
| КОСТЫЛЕВ Э.Ф и др | |||
| "Оценка качества морской среды с использованием биомаркеров у мидий"// Украинский научный центр экологии моря Минэкоресурсов Украины, 03.07.2001 [найдено 05.08.2015 из Интернет на сайте | |||
Авторы
Даты
2015-12-20—Публикация
2014-12-15—Подача