Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции местного аэрозоля, включающей биологически активное производное или аналог витамина D и кортикостероид, и к ее применению для лечения кожных заболеваний и состояний.
Известный уровень техники
Псориаз представляет собой хроническое воспалительное кожное заболевание, которое проявляется как эритематозные, сухие, отслаивающиеся бляшки, возникающие в результате гиперкератоза. Бляшки наиболее часто находятся на локтях, коленях и коже головы, хотя более обширные повреждения могут появляться на других частях тела, особенно в пояснично-крестцовой области. Наиболее обычное лечение слабого или умеренного псориаза включает местное нанесение композиции, содержащей в качестве активного ингредиента кортикостероид. Являясь эффективным, нанесение кортикостероидов имеет недостаток в виде ряда побочных эффектов, таких как атрофия кожи, стрии, угревидная сыпь, периоральный дерматит, избыточный рост кожного грибка и бактерий, гипопигментация пигментированной кожи и розовые угри.
В течение многих лет, однако, рассматривалось преимущество нестероидного лечения псориаза при местной обработке соединением - аналогом витамина D, кальципотриолом, в составе композиции мази (продаваемой LEO Pharma как мазь Daivonex® или Dovonex®), в которой кальципотриол присутствует в растворе, или композиции крема (продаваемой LEO Pharma как крем Daivonex® или Dovonex®). Растворителем в композиции мази является пропиленгликоль, который обладает преимуществом в виде повышения проникновения активного ингредиента в кожу, что ведет к улучшенной эффективности, но, что также известно, который действует как раздражающий кожу агент. Таким образом, сообщалось, что включение пропиленгликоля в композиции для местного действия часто вызывает у больных развитие контактного дерматита (в одном исследовании сообщалось о ряде реакций раздражения на 12,5% пропиленгликоль, подтверждено M. Hannuksela et al., Contact Dermatitis 1, 1975, pp. 112-116), и количество реакций в виде раздражения повышается при использовании пропиленгликоля в высоких концентрациях (как суммировано в обзоре J. Catanzaro and J. Graham Smith, J. Am. Acad. Dermatol. 24, 1991, pp. 90-95). Благодаря улучшенной проницаемости кальципотриола в кожу, возникающей в результате, среди прочего, из-за присутствия пропиленгликоля, мазь Daivonex®, как обнаружено, является более эффективной при лечении псориатических повреждений, чем крем Daivonex®, но также вызывает раздражение кожи у значительной части больных псориазом.
Позднее Leo Pharma начала продавать комбинированный продукт для лечения псориаза под торговой маркой мази Daivobet®. Продукт включает в качестве активных ингредиентов кальципотриол и бетаметазона дипропионат, составленные в композицию мази, в которой кальципотриол растворен в простом полиоксипропилен-15-стеариловом эфире, а бетаметазона дипропионат присутствует в виде суспензии. Несмотря на то, что эффективность комбинированного препарата существенно превосходит эффективность каждого активного ингредиента по отдельности, мазь может восприниматься как обременительная для нанесения, так как она требует продолжительного втирания в кожу пораженной области, и многие больные в особенности те, которые имеют обширные псориатические повреждения должны одобрять более легкое нанесение, такое как предлагаемое в виде композиции аэрозоля. Мазь Daivobet® не содержит какого-либо усилителя проникновения, такого как пропиленгликоль, который, как обнаружено, губителен для химической стабильности кальципотриола (подтверждено в примере 2 патента WO 00/64450). Как желательное рассматривается дополнительное улучшение биологической эффективности сочетания двух активных ингредиентов в результате предоставления носителя состава, с помощью которого улучшается проникновение активных ингредиентов в кожу по сравнению с продаваемым продуктом.
В патенте WO 00/64450 раскрывается фармацевтическая композиция, включающая аналог витамина D и кортикостероид, входящие в состав растворителя, содержащего носитель, в котором оба активных ингредиента химически стабильны. Предпочтительным вариантом осуществления композиции является мазь, и не упоминается о предоставлении композиции в виде аэрозоля с улучшенными свойствами по сравнению с мазью.
В патенте США US 2005/0281749 раскрывается композиция аэрозоля, включающая кортикостероид и производное витамина D, солюбилизованные в масляной фазе, состоящей из одного или более масел. Масло может быть выбрано из растительного, минерального, животного, синтетического или силиконового масла. В патенте не предполагается, что должно быть желательным предоставление окклюзирующих свойств и, следовательно, не предлагается добавление к композиции полутвердого окклюзирующего наполнителя. В нем не существует указания на то, проявляет ли композиция улучшенные свойства в отношении проникновения.
В патенте США US 2005/0281754 раскрывается композиция аэрозоля, включающая кортикостероид и производное витамина D, в составе с носителем, включающим спиртовую фазу и масляную фазу. Спиртовая фаза состоит, например, из этанола, изопропанола или бутанола. Масляная фаза может состоять из минерального, растительного или синтетического масла. В патенте не предполагается включение в композицию полутвердого и окклюзирующего наполнителя и не существует указания на то, проявляет ли композиция улучшенные свойства в отношении проникновения.
Краткое изложение сущности изобретения
Целью настоящего изобретения является предоставление композиции местно действующего аэрозоля, включающей в качестве активных ингредиентов производное или аналог витамина D и кортикостероид, которая обладает свойствами в отношении проникновения в кожу и биологической активности, превосходящими мазь Daivobet®, но содержащая растворитель для активных ингредиентов, который в отличие от пропиленгликоля не опасен для химической стабильности либо производного или аналога витамина D, либо кортикостероида.
Кожа человека, в частности, наружный слой, роговой слой, создает эффективный барьер против проникновения микробных патогенов и токсических химических соединений. Несмотря на то, что это свойство кожи обычно благоприятно, оно осложняет кожное введение фармацевтических агентов потому, что большое количество, если не большая часть, активного ингредиента, наносимого на кожу больного, страдающего кожным заболеванием, может не проникать в жизнеспособные слои кожи, где он проявляет свою активность. Для обеспечения адекватного проникновения активного ингредиента в дерму и эпидермис обычно предпочтительно включать активный ингредиент в растворенном состоянии, обычно в присутствии растворителя в форме спирта, например, этанола, или диола, например, пропиленгликоля. Пропиленгликоль представляет собой хорошо известный усилитель проникновения, т.е. вещество, которое способно проникать в роговой слой и «тянуть» за собой низкомолекулярные компоненты, такие как терапевтически активные компоненты носителя, в эпидермис. Пропиленгликоль может сам по себе вызывать нарастание существенного раздражения кожи, и он также способен, «протаскивать» низкомолекулярные и потенциально раздражающие компоненты носителя в эпидермис, что приводит к суммарному раздражающему эффекту общепринятых носителей, включая пропиленгликоль. По этой причине присутствие пропиленгликоля в качестве растворителя в композициях, предназначенных для лечения воспалительных заболеваний кожи, может усугублять воспалительный ответ.
Другой целью изобретения является предоставление композиции с улучшенным проникновением и биологической активностью активных ингредиентов по сравнению с мазью Daivobet® в отсутствие традиционных усилителей проницаемости, таких как пропиленгликоль, которые являются вредными для стабильности соединений на основе витамина D, таких как кальципотриол.
Дополнительной целью изобретения является предоставление композиции, в которой как производное или аналог витамина D, так и кортикостероид, не должны существенно разрушаться. Хорошо известно, например, из патента WO 00/64450, что соединения на основе витамина D являются химически нестабильными в кислых условиях среды или в присутствии кислых реакционных компонентов или загрязнений в составе носителя. Подобным образом, также хорошо известно, что кортикостероиды являются химически нестабильными в щелочных условиях среды или в присутствии щелочных реакционных компонентов или загрязнений в составе носителя. В композиции, включающей оба ингредиента, проблема химической стабильности не может быть с легкостью разрешена путем добавления агента, нейтрализующего кислоту или щелочь, соответственно. Напротив, выбор наполнителей для включения в композицию должен быть сделан с осторожностью так, чтобы не было включено компонентов, которые неблагоприятно влияют на химическую стабильность любого из активных ингредиентов.
В отличие от композиций аэрозолей, раскрытых в ссылках, цитированных выше, целью настоящего изобретения является предоставление композиции аэрозоля, которая содержит существенные количества окклюзирующего и полутвердого носителя-наполнителя, так как известные составы маслянистого аэрозоля при нанесении с большей вероятностью распылятся в непораженных областях, тогда как полутвердый компонент делает композицию по настоящему изобретению менее «текучей», так что активные ингредиенты предпочтительно наносятся на области пораженной кожи.
Таким образом, в одном аспекте изобретение относится к способной к распылению, стабильной при хранении, по существу безводной композиции для местного применения, включающей терапевтически эффективное количество производного или аналога витамина D и терапевтически эффективное количество кортикостероида, причем производное или аналог витамина D и кортикостероид растворены в фармацевтически приемлемом пропелленте, выбранном из группы, состоящей из простого диметилового эфира, простого диэтилового эфира и простого метилэтилового эфира, или в смеси пропеллентов, включающей первый пропеллент, выбранный из группы, состоящей из простого диметилового эфира, простого диэтилового эфира и простого метилэтилового эфира, и второй пропеллент, выбранный из группы, состоящей из C3-5 алканов, гидрофторалканов, гидрохлоралканов, фторалканов и хлорфторалканов, причем композиция дополнительно включает фармацевтически приемлемый липидный носитель, солюбилизованный или суспендированный в указанном пропелленте или смеси пропеллентов, причем липидный носитель включает один или более липидов, которые при нанесении на кожу и испарения пропеллента образуют полутвердый и окклюзирующий слой в месте нанесения.
Как было неожиданно обнаружено, композиция по изобретению облегчает улучшенное проникновение активных ингредиентов по сравнению с продаваемой мазью Daivobet® даже в отсутствие общепринятого усилителя проникновения. В настоящее время считается, что улучшенное проникновение может быть результатом образования перенасыщенного раствора активных ингредиентов на коже после нанесения и испарения пропеллента или смеси пропеллентов (подтверждено Reid et al., Pharm. Res. 25(11), 2008, pp. 2573-2580). Дополнительно считается, что сами пропелленты могут действовать как усилители проникновения, направляя активные ингредиенты в кожу. Наконец, состав полутвердого и окклюзирующего слоя в месте нанесения может вносить вклад в проникновение активных ингредиентов.
В другом аспекте изобретение относится к композиции, раскрытой в настоящем документе, для применения при лечении кожных заболеваний или состояний.
Композиции по изобретению могут распыляться из аэрозольных контейнеров, обычно такого типа, который включает корпус контейнера и клапанный блок. Корпус контейнера может, например, включать металлический корпус, предпочтительно покрытый химически инертным покрывающим материалом во избежание разрушения композиции из-за взаимодействия между корпусом и композицией.
Клапанный блок может включать клапанную чашку, иногда обозначаемую как монтажная чашка, клапанный корпус или футляр, снабженный стержнем клапана, пружину, трубку для погружения и исполнительный механизм. Внутренняя прокладка обычно изолирует отверстие в стержне клапана, но когда исполнительный механизм действует, стержень клапана перемещается так, что отверстие становится незакрытым. В момент воздействия давление, создаваемое пропеллентом в корпусе контейнера, вынуждает композицию протекать через отверстие в трубку для погружения и в клапанный блок и выходить через исполнительный механизм. Как должно быть понятно, когда исполнительный механизм освобождается, клапанная пружина возвращает стержень клапана в то положение, при котором отверстие опять изолировано.
Стержень клапана и исполнительный механизм, каждый содержит одно или более отверстий (сопел) и каналов, количество, размер и форму которых определяют в зависимости от физических свойств конкретного состава композиции так, чтобы контролировать и скорость потока через клапан, и характеристики аэрозоля, который выходит из исполнительного механизма.
Форму распыления и скорость потока можно контролировать с помощью отдельной вставки, встроенной в выходное сопло исполнительного механизма, и таким образом предоставляется концевое сопло для комплекта исполнительного механизма. Канал через вставку, ведущую к выходу, обычно включает часть, более узкую в диаметре, чем канал в корпусе исполнительного механизма, так что жидкость, выходящую из канала исполнительного механизма в канал вставки, заставляют вращаться и разбиваться на капли. Вставка может быть профилированной, например, она может быть ступенчатой, так что композиция вытесняется вперед и из концевого сопла при движении вперед, а не при более обычном вращательном движении. Это приводит к гомогенной или твердой форме распыления и, следовательно, дает возможность пользователю лучше фокусировать композицию в области участка кожи, подвергаемого лечению.
Так как вдыхание композиции по изобретению нежелательно, предпочтительно, чтобы размеры каналов для жидкости, сопла, вставки и т.д. выбирались так, чтобы избежать продукции мелкого тумана при выталкивании.
Клапанный блок может включать дозирующий клапан для пропускания только дозируемого количества композиции, освобождающейся при каждом запуске исполнительного механизма.
Для хранения, безопасности и/или в связи с требованиями гигиены исполнительный механизм может предлагаться с защитной съемной крышкой или внешним колпачком. Колпачок может переводиться из первого положения, в котором концевое сопло закрыто, во второе положение, в котором сопло открыто; во втором положении колпачок может также функционировать в качестве направляющей форсунки, ограничивая область распыления. Сам исполнительный механизм может включать простую кнопку запуска или может, например, включать запуск со щелчком или поворотный замок. В другом устройстве колпачок, имеющий встроенный исполнительный механизм для управления пальцем, может быть скреплен с контейнером и покрывать нижележащую кнопку исполнительного механизма. Нижняя часть колпачка может включать, например, множество выступов для контактирования с кнопкой исполнительного механизма при движении, обусловленным давлением пальца оператора, и запуска открывания клапана.
Альтернативно или в дополнение к этому исполнительный механизм может передвигаться между первым положением, при котором клапан предохраняется от умышленного или случайного приведения в действие, и вторым положением приведения в действие. Например, часть клапанного блока может вращаться вокруг стержня клапана так, что в одном поворотном положении исполнительный механизм приводится в действие для распыления продукта, тогда как в другом поворотном положении исполнительный механизм выравнивается с выступами или упорами на контейнере для предотвращения приведения в действие. Такой механизм «поворот и распыление» может включать тактильные или звуковые индикаторы открытого и закрытого положений.
Желательно включение петельки защиты от вскрытия, которая должна быть сломана перед первым применением аэрозольного контейнера.
Краткое описание фигур
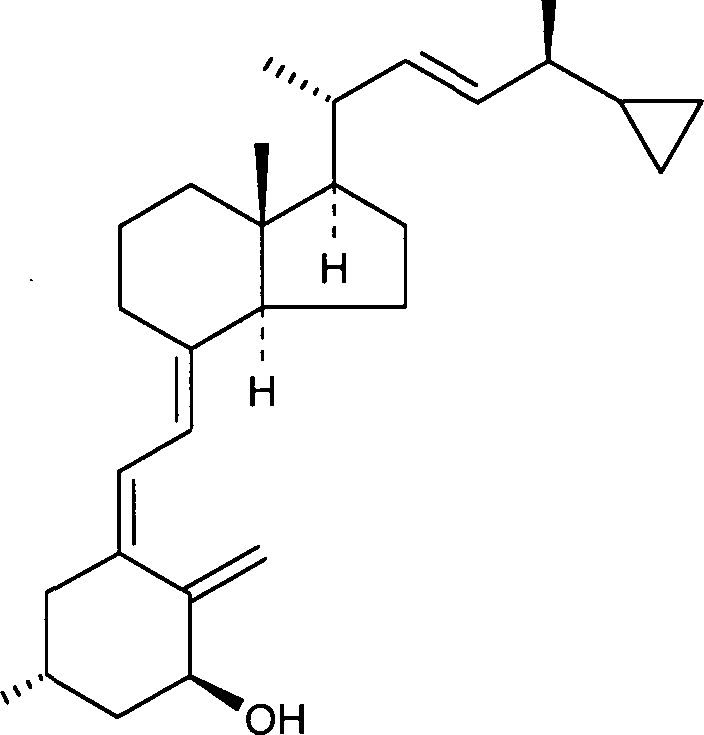
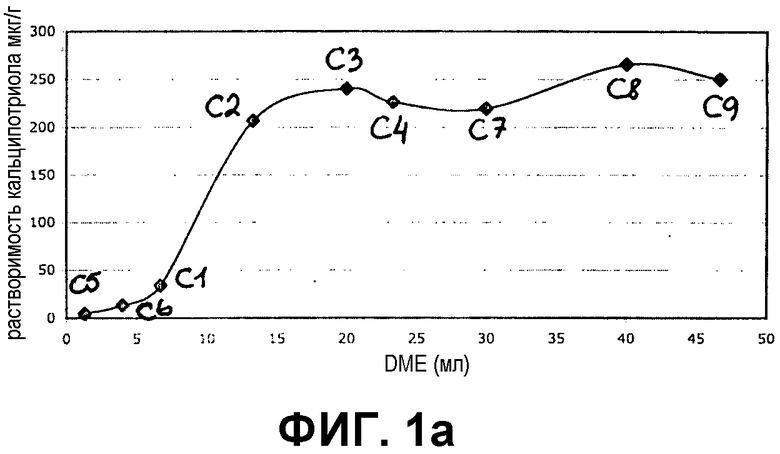
Фиг.1a и 1b представляют собой графики, демонстрирующие растворимость кальципотриола в 100% простом диметиловом эфире (DME) и в различных соотношениях DME и бутана в непрерывной фазе (фиг.1a) и в смеси непрерывной и дисперсной фаз (фиг.1b).
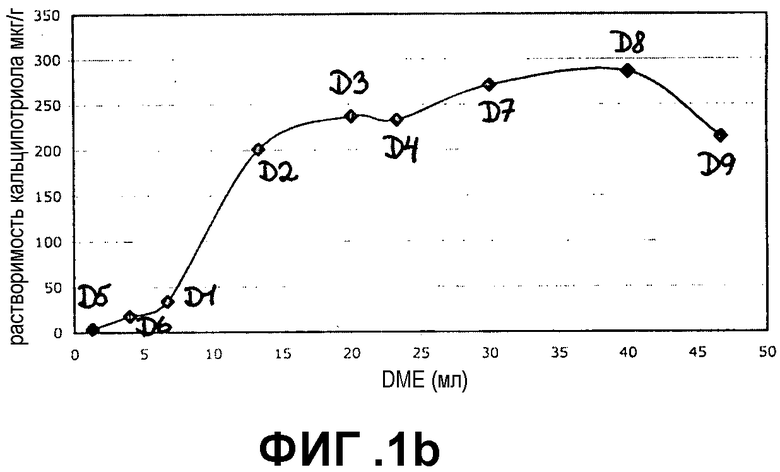
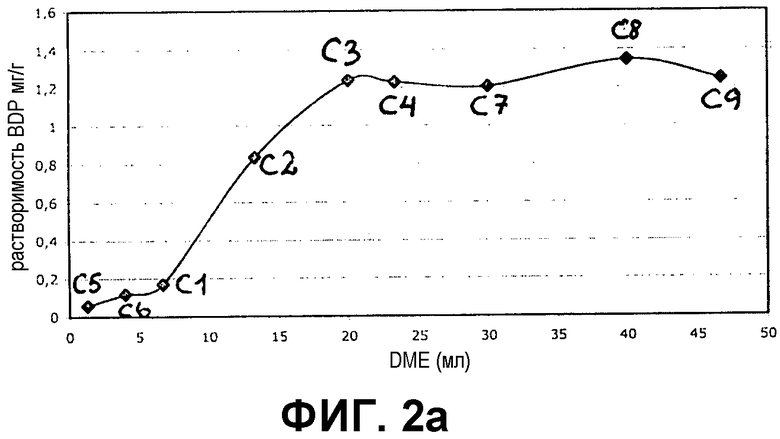
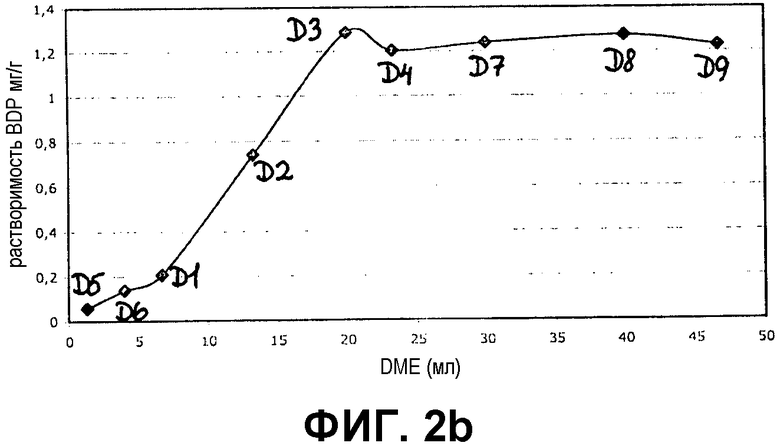
Фиг.2a и 2b представляют собой графики, демонстрирующие растворимость бетаметазона дипропионата (BDP) в 100% DME и в различных соотношениях DME и бутана в непрерывной фазе (фиг.2a) и в смеси непрерывной и дисперсной фаз (фиг.2b).
Фиг.3 представляет собой диаграмму, демонстрирующую проникновение кальципотриола (MC 903) в жизнеспособную кожу из композиции E по изобретению через 2, 6 и 21 часа после нанесения по сравнению с проникновением кальципотриола из мази Daivobet®, нанесенной сходным образом.
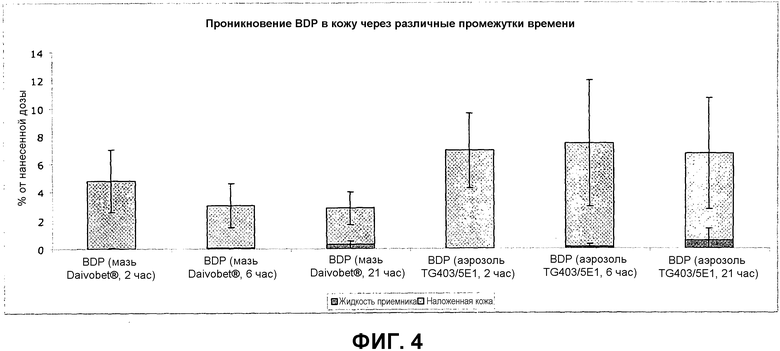
Фиг.4 представляет собой диаграмму, демонстрирующую проникновение BDP в жизнеспособную кожу из композиции E по изобретению через 2, 6 и 21 часа после нанесения по сравнению с проникновением BDP из мази Daivobet®, нанесенной сходным образом.
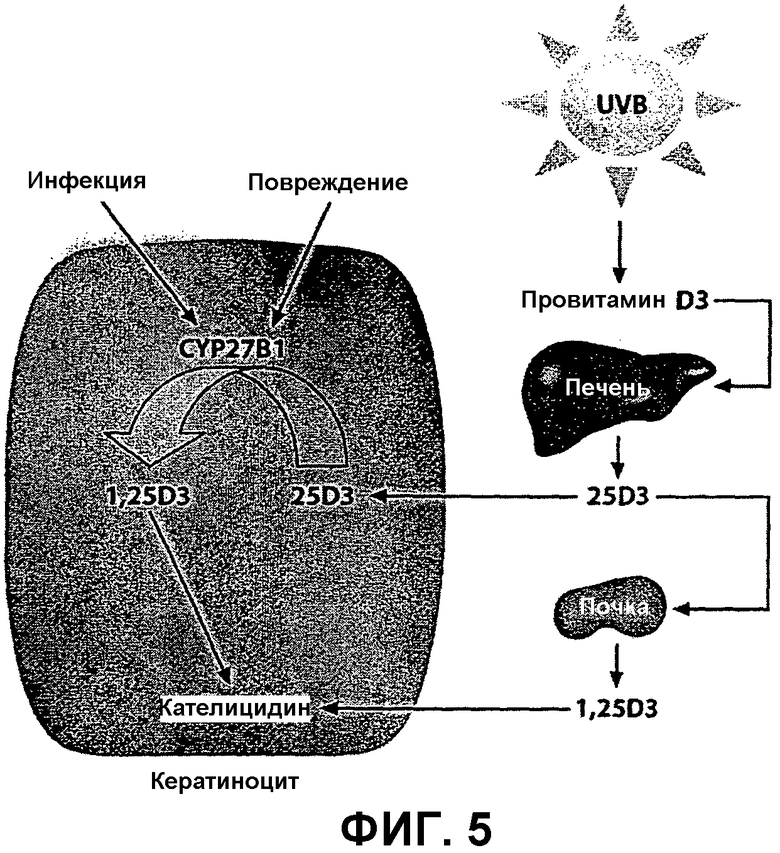
Фиг.5 представляет собой схематическое изображение активации гена, кодирующего кателицидин, витамином D3 в кератиноцитах человека. Механизм активации гена кателицидина используется в биологическом тесте с применением реконструированного эпидермиса человека (кератиноцитов человека, культивируемых так, чтобы образовывались слои эпидермиса, характерные для кожи человека), на который наносятся композиции по изобретению, содержащие кальципотриол, для активации кателицидина, как подробно описано в примере 5 ниже.
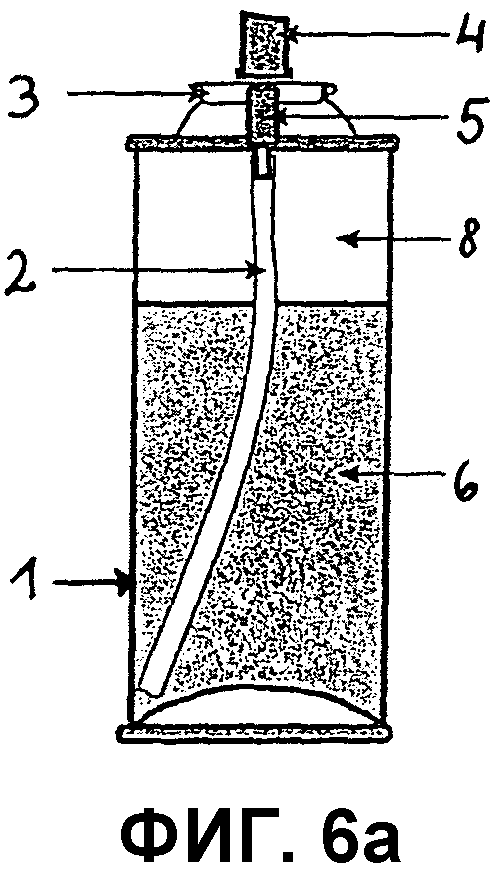
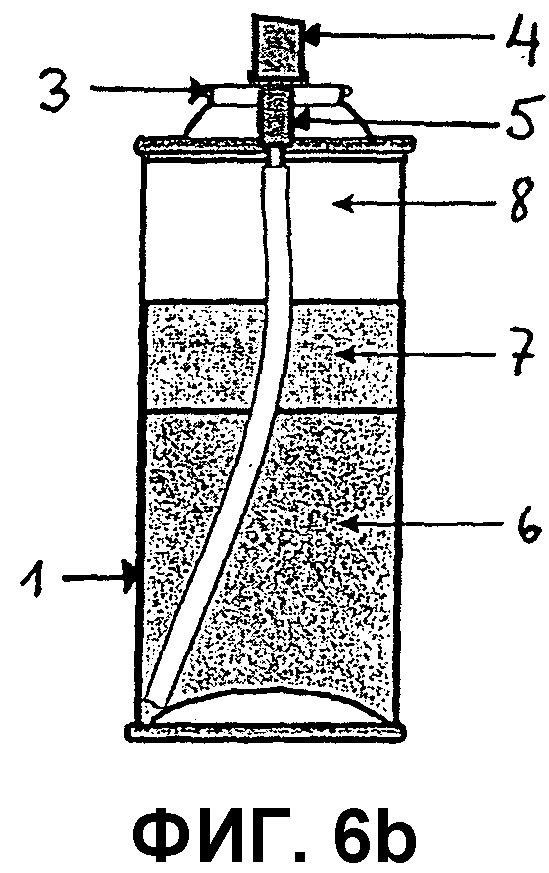
Фиг.6a представляет собой поперечный срез контейнера, предназначенного для сжатого аэрозоля композиции по изобретению, включающего корпус контейнера (1), в который вмонтирован клапанный блок, включающий клапанную чашку (3), клапанный корпус (5), исполнительный механизм (4) и трубку для погружения (2). Как показано в этом варианте осуществления, представленная композиция может являться двухфазной системой, включающей фазу композиции (6) и испаряемую фазу (8).
Фиг.6b представляет собой поперечный срез контейнера, предназначенного для сжатого аэрозоля композиции по изобретению, включающего корпус контейнера (1), в который вмонтирован клапанный блок, включающий клапанную чашку (3), клапанный корпус (5), исполнительный механизм (4) и трубку для погружения (2). Как показано в этом варианте осуществления, представленная композиция может являться трехфазной системой, включающей фазу композиции (6), фазу пропеллента (7) и испаряемую фазу (8).
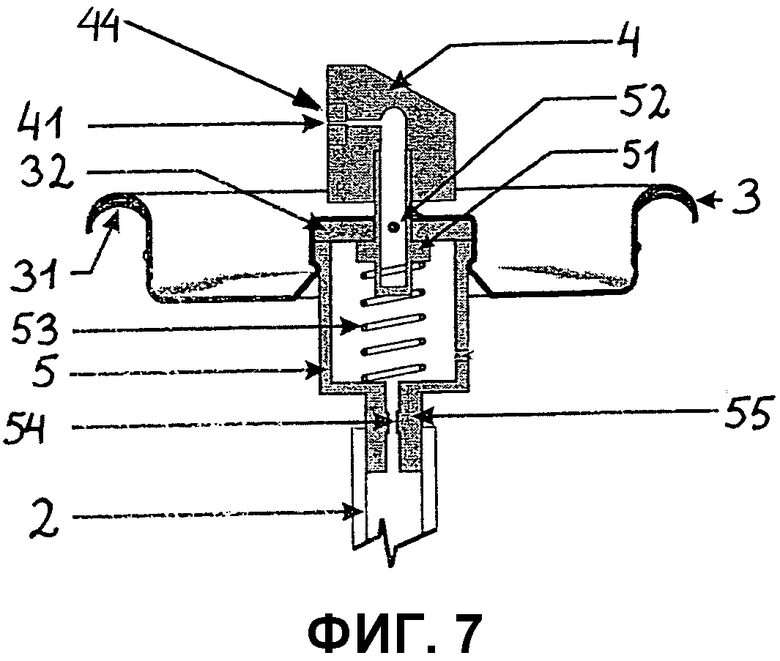
Фиг.7 представляет собой поперечный срез клапанного блока, предназначенного для закрепления на корпусе контейнера (1), включающего клапанную чашку (3), снабженную заглушкой (31) между корпусом контейнера (1) и клапанной чашкой (3), прокладку (32), клапанный корпус (5), снабженный стержнем клапана (51) и пружиной (53), соединенные с исполнительным механизмом (4), снабженным вставкой (44) с концевым соплом (41), через которое композиция, присутствующая в корпусе контейнера (1), изгоняется, когда снимается нагрузка с исполнительного механизма (4). Стержень клапана (51) содержит отверстие (52), через которое композиция, присутствующая в корпусе контейнера (1), может течь, когда снимается нагрузка с исполнительного механизма. Клапанный корпус дополнительно снабжается хвостовой частью (55), с которой соединена трубка для погружения (2). Хвостовая часть (55) снабжается отверстием (54), позволяющим композиции вытекать из трубки для погружения (2).
Подробное описание изобретения
Определения
Термин «производное витамина D» предназначено для указания на биологически активный метаболит витамина D3, такой как кальцитриол, или на предшественник такого метаболита, такой как альфакальцидол.
Термин «аналог витамина D» предназначен для указания на синтетическое соединение, включающее каркас витамина D с модификациями боковой цепи и/или с модификациями самого каркаса. Аналог проявляет биологическую активность через рецептор витамина D, сравнимую с активностью природных соединений витамина D.
«Кальципотриол» представляет собой аналог витамина D формулы
Кальципотриол, как обнаружено, существует в двух кристаллических формах, негидратированной и моногидратированной. Моногидрат кальципотриола и его получение раскрыты в патенте WO 94/15912.
Термин «стабильность при хранении» предназначен для указания на то, что композиция имеет характеристики химической и физической стабильности, которые позволяют хранить композицию в течение достаточного периода времени, такого как, по меньшей мере, 12 месяцев, в частности, по меньшей мере, 18 месяцев и предпочтительно, по меньшей мере, 2 года, в холодильнике или, предпочтительно, при комнатной температуре, чтобы сделать композицию коммерчески выгодной.
Термин «химическая стабильность» или «химически стабильный» предназначен для обозначения того, что не более 10%, предпочтительно не более 6% активных ингредиентов разрушается в течение периода полужизни продукта, обычно в течение 2 лет при комнатной температуре. Приблизительное значение химической стабильности при комнатной температуре получают с помощью исследований стабильности композиции при форсировании, подвергая ее нагреванию при 40°С, когда композицию помещают в шкаф для нагрева при 40°С и образцы забирают через 1, 2 и 3 месяца и тестируют на присутствие продуктов разрушения с помощью ВЭЖХ. Если менее приблизительно 10% вещества разрушается после 3 месяцев при 40°С, это обычно принимается за соответствующее периоду полужизни 2 года при комнатной температуре. Когда активный ингредиент, включенный в композицию, представляет собой кальципотриол, «химическая стабильность» обычно указывает на то, что кальципотриол существенно не разрушается с течением времени до 24-эпи-кальципотриола или других продуктов деградации кальципотриола в конечном фармацевтическом продукте.
Термин «физическая стабильность» или «физически стабильный» предназначен для обозначения того, что активные ингредиенты не преципитируют из фаз пропеллента или носителя в течение периода полужизни композиции.
Термин «по существу безводная» предназначен для обозначения того, что содержание свободной воды в композиции мази не превышает приблизительно 2% от массы, предпочтительно не превышает приблизительно 1% от массы композиции.
Термин «среднецепочечные триглицериды» используется для указания на сложные эфиры триглицеридов и жирных кислот с длиной цепи 6-12 углеродных атомов. В настоящее время предпочтительным примером таких среднецепочечных триглицеридов является смесь каприловых (C8) и каприновых (C10) триглицеридов, например, доступных под торговой маркой Miglyol 812.
Термин «способность к солюбилизации» предназначен для указания на способность растворителя или смеси растворителей растворять данное вещество, выражаемую как количество, требуемое для достижения полного растворения вещества.
Термин «полутвердые» используется для обозначения композиции или наполнителя, которые проявляют вязкоупругие свойства и не являются ньютоновыми по характеру, т.е. не обладают текучестью при низком напряжении сдвига, но проявляют пластическое, псевдопластическое или тиксотропное свойства режима потока при высоком напряжении сдвига при комнатной температуре. Типичными примерами полутвердых композиций являются мази и кремы.
Термин «окклюзирующий» предназначен для указания на липидный слой на поверхности кожи, который образует барьер для гидратации, достаточный для того, чтобы снизить трансэпидермальную потерю воды, приводящую к гидратации кожи.
Термин «проникновение в кожу» предназначен для обозначения диффузии активного ингредиента в различные слои кожи, т.е. в роговой слой, эпидермис и дерму.
Термин «проникновение через кожу» предназначен для обозначения потока активного ингредиента через кожу в системную циркуляцию или в случае исследований in vitro, таких как описанные в примере 4 ниже, в жидкость приемника ячейки аппарата Франца, используемого в эксперименте.
Термин «биологическая активность» предназначен для обозначения активности производного или аналога витамина D при нанесении на кожу в композиции по изобретению. Биологическая активность композиций определяется в тесте in vitro при измерении активации гена-мишени, кодирующего кателицидин, в модели реконструированного эпидермиса человека, включающей культивируемые кератиноциты человека, как подробно описано в примере 5 ниже.
Варианты осуществления изобретения
Производное или аналог витамина D, включенное в представленную композицию, может быть выбрано из кальципотриола, кальцитриола, такальцитола, максакальцитола, парикальцитола и альфакальцидола. Предпочтительный аналог витамина D, который, как было показано, является эффективным при лечении псориаза, представляет собой кальципотриол. Перед растворением в смеси растворителей кальципотриол может находиться в негидратированной или моногидратированной форме, предпочтительно в форме моногидрата.
Кортикостероид, включенный в представленную композицию, может быть выбран из группы, состоящей из амцинонида, бетаметазона, буденозида, клобетазола, клобетазона, кортизона, десонида, дезоксикортизона, дезоксиметазона, дексаметазона, дифлукотолона, дифлоразона, флукортизона, флуметазона, флунизолида, флуоцинонида, флуоцинолона, флуорометолона, флупреднизолона, флуандренолида, флутиказона, гальцинонида, галобетазола, гидрокортизона, мепреднизона, метилпреднизона, мометазона, параметазона, предникарбата, преднизона, преднизолона и триамцинолона или их фармацевтически приемлемых сложных эфиров или ацетонидов. Кортикостероид может быть предпочтительно выбран из бетаметазона, буденозида, клобетазола, клобетазона, дезоксиметазона, дифлукортолона, дифлоразона, флуоцинонида, флуоцинолона, галцинонида, галобетазола, гидрокортизона, мометазона и триамцинолона или их фармацевтически приемлемых сложных эфиров. Сложный эфир кортикостероида может, например, представлять собой бетаметазона ацетат, бетаметазона дипропионат, бетаметазона валерат, клобетазола пропионат, дексаметазона ацетат, флуметазона пивалат, флутиказона пропионат, гидрокортизона ацетат, гидрокортизона бутират или мометазона фуроат. Ацетонид может быть выбран из флуцинолона ацетонида или триамцинолона ацетонида.
Композиция по изобретению может дополнительно включать неиспаряющийся маслянистый сорастворитель, выбранный, по меньшей мере, из одного из следующих классов растворителей
(a) соединения общей формулы I
H(OCH2C(CH3)H)xOR1
где R1 представляет собой C1-20 алкил с прямой или разветвленной цепью, а x является целым числом 2-60;
(b) изопропилового эфира C10-18 алкановой или алкеновой кислоты с прямой или разветвленной цепью;
(c) пропиленгликолевого диэфира C8-14 алкановой или алкеновой кислоты;
(d) C8-24 алканола или алкенола с прямой или разветвленной цепью;
(e) высокоочищенных растительных масел, таких как среднецепочечные триглицериды или длинноцепочечные триглицериды; и
(f) N-алкилпирролидона или N-алкилпиперидона.
Маслянистый сорастворитель может служить для поддержания способности композиции к солюбилизации при испарении пропеллента или смеси пропеллентов, так что активные ингредиенты быстро не кристаллизируются на коже при испарении пропеллента, но присутствуют на коже в виде насыщенного раствора, из которого они могут проникать в кожу (подтверждено Reid et al, Pharm. Res. 25 (11), 2008, pp. 2573-2580).
В одном варианте осуществления маслянистый сорастворитель, включенный в представленную композицию, может представлять собой соединение общей формулы I, такое как простой полиоксипропилен-15-стеариловый эфир, простой полиоксипропилен-11-стеариловый эфир, простой полиоксипропилен-14-бутиловый эфир, простой полиоксипропилен-10-цетиловый эфир или простой полиоксипропилен-3-миристиловый эфир.
В другом варианте осуществления маслянистый сорастворитель может представлять собой сложный изопропиловый эфир C10-18 алкановой или алкеновой кислоты с прямой или разветвленной цепью, такой как изопропилмиристат, изопропилпальмитат, изопропилизостеарат, изопропиллинолат или изопропилмоноолеат.
В дополнительном варианте осуществления маслянистый сорастворитель может представлять собой пропиленгликолевый диэфир C8-14 алкановой кислоты, такой как пропиленгликольдипеларгонат.
В еще одном варианте осуществления маслянистый сорастворитель может представлять собой прямой C8-24 алканол, такой как каприловый, лауриловый, цетиловый, стеариловый, олеиловый, линоелиловый или миристиловый спирт, или C8-24 алканол с разветвленной цепью, предпочтительно C8-24 алканол, такой как 2-октилдодеканол.
В еще одном варианте осуществления маслянистый сорастворитель представляет собой N-алкилпирролидон, такой как N-метилпирролидон.
В исследовании, которое привело к настоящему изобретению, неожиданно было обнаружено, что использование чистого C3-5 алкана, такого как бутан, в качестве пропеллента не приводило к достаточному растворению активных ингредиентов, так что аналог витамина D со временем преципитировал из раствора, и наблюдался рост кристаллов кортикостероида, т.е. композиция не была физически стабильной в течение периода полужизни композиции. Неожиданно было обнаружено, что эта проблема не возникала, когда в качестве пропеллента использовался простой диметиловый эфир сам по себе или даже когда часть простого диметилового эфира добавляли к C3-5 алкану с образованием пропеллентной смеси. Таким образом, в предпочтительном в настоящее время варианте осуществления представленная композиция включает простой диметиловый эфир в качестве единственного пропеллента или в качестве первого пропеллента смеси пропеллентов.
В представленной композиции второй пропеллент смеси пропеллентов представляет собой предпочтительно C3-5 алкан, предпочтительно выбранный из группы, состоящей из н-пропана, изопропана, н-бутана или изобутана. Особенно предпочтительный C3-5 алкан представляет собой н-бутан и/или изобутан.
В смеси пропеллентов отношение н-бутана и/или изобутана к простому диметиловому эфиру может предпочтительно находиться в диапазоне 6:1-0:1 об./об., таком как 5:1-1:2, 4:1-1:1, 4:2-1:1, 4:2-4:3 или 4:3-1:1.
В конкретном варианте осуществления композиция включает
(a) приблизительно 0,00001-0,05% масс./масс. производного или аналога витамина D,
(b) приблизительно 0,0005-1% масс./масс. кортикостероида,
(c) приблизительно 5-55% масс./масс. липидного носителя, и
(d) приблизительно 45-95% масс./масс. пропеллента или смеси пропеллентов.
Более конкретно, представленная композиция может включать приблизительно 10-50% масс./масс., приблизительно 15-45% масс./масс. или приблизительно 20-40% масс./масс. липидного носителя.
Более конкретно, представленная композиция может включать приблизительно 50-90% масс./масс. или приблизительно 55-70% масс./масс. пропеллента или смеси пропеллентов.
В конкретном варианте осуществления представленная композиция может дополнительно включать приблизительно 0,1-10% масс./масс. маслянистого растворителя, как определено выше, например, приблизительно 0,5-3% масс./масс., приблизительно 1-2,5% масс./масс. или приблизительно 1,5-2% масс./масс. маслянистого растворителя.
Липидный носитель может представлять собой углеводород или смесь углеводородов с длинами цепей в диапазоне от C5 до C60. Часто используемым носителем мази является вазелин или мягкий бесцветный парафин, который состоит из углеводородов с различными длинами цепей с максимумом приблизительно C40-44, или смесь вазелина и жидкого парафина (состоящего из углеводородов с различными длинами цепей с максимумом приблизительно C28-40). Несмотря на то, что мягкий бесцветный парафин создает окклюзию на обрабатываемой поверхности кожи, снижая трансдермальную потерю воды и усиливая терапевтический эффект активного ингредиента в композиции, он приводит к ощущению сальности или липкости, которое полностью сохраняется в течение некоторого количества времени после нанесения. Следовательно, предпочтительным может быть применение парафинов, состоящих из углеводородов с несколько более низкой длиной цепи, таких как парафины, состоящие из углеводородов с длинами цепей с максимумом C14-16, C18-22, C20-22, C20-26, или их смесей. Было обнаружено, что такие парафины являются косметически более приемлемыми в том плане, что они дают меньше сальности или липкости при нанесении. Включение таких парафинов в представленную композицию, следовательно, как ожидается, приведет к усилению податливости больных. Подходящие парафины этого типа, обозначаемые как фармацевтический вазелин, производятся Sonneborn и продаются на рынке под торговой маркой Sonnecone, например, Sonnecone CM, Sonnecone DM1, Sonnecone DM2 и Sonnecone HV. Эти парафины дополнительно раскрыты и охарактеризованы в патенте WO 2008/141078, который включен в настоящее описание в качестве ссылки. В дополнение к своим благоприятным косметическим свойствам неожиданно было обнаружено, что композиции, содержащие эти парафины в качестве носителей, более приемлемы, чем композиции, содержащие традиционные парафины. (Углеводородный состав парафинов определен с помощью газовой хроматографии). Липидный носитель может также представлять собой изопарафин, такой как изогексадекан.
Представленная композиция может соответствующим образом включать липофильный увеличивающий вязкость ингредиент, способный придавать липидному носителю свойство образования полутвердого и окклюзирующего слоя после нанесения на кожу и испарения пропеллента. Липофильный увеличивающий вязкость ингредиент может соответствующим образом представлять собой воск, такой как минеральный воск, состоящий из смеси углеводородов высокой молекулярной массы, например, насыщенных C35-70 алканов, такой как микрокристаллический воск. Альтернативно, воск может представлять собой растительный или животный воск, например, сложные эфиры C14-32 жирных кислот и C14-32 жирных спиртов, такой как пчелиный воск, силиконовый воск или гидрогенизированное касторовое масло, или их смеси. Количество увеличивающего вязкость ингредиента может обычно находиться в диапазоне приблизительно 0,01-5% от массы композиции. Когда увеличивающий вязкость ингредиент представляет собой гидрогенизированное касторовое масло, он обычно присутствует в количестве в диапазоне приблизительно 0,05-1% от массы, например, приблизительно 0,1-0,5% от массы композиции.
Композиция может дополнительно включать смягчающее вещество, которое может действовать для смягчения утолщенного эпидермиса псориатических бляшек. Подходящее смягчающее вещество для включения в представленную композицию может представлять собой летучее силиконовое масло, так как присутствие силикона, как было дополнительно обнаружено, способствует проникновению кальципотриола в кожу. Композиции, включающие силиконовое масло, также, как было обнаружено, приводят к меньшему раздражению кожи. Подходящие силиконовые масла для включения в композицию по настоящему изобретению могут быть выбраны из циклометикона и диметикона. Количество силиконового масла, включаемого в представленную композицию, обычно находится в диапазоне приблизительно 0,3-3% масс./масс., таком как приблизительно 0,5-1,5% масс./масс.
Композиция по настоящему изобретению может также включать другие компоненты, обычно используемые в дерматологических составах, например, антиоксиданты (например, альфа-токоферол), консерванты, красящие вещества, смягчающие кожу агенты, заживляющие кожу агенты и агенты для ухода за кожей, такие как мочевина, глицерин, аллантоин или бисаболол, подтверждено CTFA Cosmetic Ingredients Handbook, 2nd Ed ., 1992. В предпочтительном варианте осуществления композиция может включать агент против раздражения кожи, такой как ментол, эвкалиптол или никотинамид. В настоящее время предпочтительным агентом против раздражения является ментол, так как он, как было обнаружено, также увеличивает проникновение кальципотриола в кожу, подтверждено на фиг.1. Ментол может быть включен в композицию в количестве приблизительно 0,001-1% масс./масс., в частности приблизительно 0,002-0,003% масс./масс. от массы композиции.
Композиция по изобретению может быть использована для лечения псориаза, себопсориаза, ладонно-подошвенного пустулезного высыпания, дерматита, ихтиоза, розовых угрей и акне, а также сходных кожных заболеваний с помощью местного введения эффективного количества композиции по изобретению больному, нуждающемуся в таком лечении. Указанный способ предпочтительно включает местное введение один или два раза в день терапевтически достаточной дозы указанной композиции. В этом случае композиция по изобретению предпочтительно содержит приблизительно 0,001-0,5 мг/г, предпочтительно приблизительно 0,002-0,25 мг/г, в частности 0,005-0,05 мг/г производного или аналога витамина D. Предусматривается, что композиция по настоящему изобретению может быть преимущественно использована для поддерживающего лечения этих кожных заболеваний, т.е. продолжающегося лечения после исчезновения видимых симптомов заболевания для того, чтобы отсрочить возвращение симптомов.
В дополнительном аспекте изобретение относится аэрозольному контейнеру, адаптированному к распылению местной композиции на участок пораженной кожи, причем контейнер включает композицию по изобретению и клапанный блок, а также исполнительный механизм для высвобождения композиции в форме аэрозоля.
Как показано на фиг.6a и 6b, пример контейнера, подходящего для аэрозольного продукта, может состоять из корпуса контейнера (1), в котором хранится представленная композиция, трубки для погружения (2) и клапанного блока, включающего клапанную чашку (3), клапанный корпус (5) и исполнительный механизм (4).
Обычно корпус контейнера (1) может быть сделан из таких материалов, как металл, стекло, керамика, полиэстер, полиэтилентерефталат (PET) или другой полимер, или тому подобное. Стеклянные контейнеры могут предлагаться с безопасным покрытием, например, из полипропилена, для вмещения осколков стекла, которые могут образоваться при ударе о твердую поверхность. Металлические корпуса контейнеров в настоящее время предпочтительны, так как они лучше способны выдерживать удар и не подлежат покрытию поверхности. Для корпусов контейнеров нержавеющая сталь, белая жесть и алюминий (т.е. алюминий или алюминиевый сплав, включая анодированный алюминий) представляют собой особенно подходящие материалы для этой цели, причем алюминий в настоящее время является предпочтительным из-за его легкости и несильной хрупкости.
Металлические контейнеры обычно выстланы или покрыты инертным веществом для защиты композиции от взаимодействий с металлом, тем самым предотвращая или существенно устраняя любое разрушение активных ингредиентов или других компонентов композиции.
Инертные вещества включают любой подходящий полимер, лак, смолу или обработку другим покрытием, которое создает барьер между контейнером и композицией для предотвращения любого химического взаимодействия между композицией и контейнером. Предпочтительно инертным веществом является неметаллическое покрытие.
Известные покрытия для металлических контейнеров включают акриловые, фенольные, полиэфирные, эпоксидные и виниловые смолы. Однако композиция, содержащая производное или аналог витамина D, является, очевидно, химически деградируемой в кислых условиях или в присутствии кислых реакционных соединений. Более того, кортикостероиды, как известно, являются химически деградируемыми в щелочных условиях или в присутствии щелочных реакционных соединений. Соответственно, покрытие контейнера для использования с композицией по настоящему изобретению должно предпочтительно быть выбрано так, чтобы оно само по себе не обладало кислой или щелочной реакционной способностью и чтобы из него не вымывались кислые или щелочные реакционноспособные загрязняющие соединения в присутствии композиции.
В исследовании, приведшем к настоящему изобретению, было обнаружено, например, что определенное внутреннее лаковое покрытие на основе эпоксифенольной смолы было несовместимо с одним из активных ингредиентов, вызывая неприемлемое химическое разрушение кальципотриола. Такое разрушение, вероятно, может быть обусловлено присутствием в лаке канифоли, которая включает кислотную группу. С другой стороны, химическая стабильность кальципотриола была удовлетворительной, когда в качестве внутреннего покрытия была использована полиимидная-полиамидная смола.
В дополнение к полиимидным-полиамидным покрытиям другие материалы, подходящие для покрытия внутренней части металлических контейнеров, включают полиамиды, полиимиды, полипропилен, полиэтилен, фторполимеры, включая сополимер перфторэтилена пропилена (FEP), фторкаучук (FPM), каучук из мономера этиленпропилендиена (EPDM), политетрафторэтилен (PTFE), сополимер этилена тетрафторэтилена (EFTE), перфторалкоксиалканы, перфторалкоксиалкилены или смеси фторполимеров с полимерами не на основе фторуглеродов. Фторполимеры могут, например, использоваться в сочетании с полиимидными-полиамидными смолами.
Покрывающий контейнер материал может быть нанесен в виде одного слоя или множественных слоев, например, позволяя каждому слою схватываться перед нанесением следующего слоя. Кроме защиты композиции от металлического контейнера, нанесение более одного покрытия может также помочь в предотвращении адгезии активных ингредиентов на стенках контейнера.
По тем же причинам клапанные компоненты контейнера, которые вступают в контакт с композицией, также предпочтительно делают или покрывают веществами, которые не вызывают разрушения композиции. Например, металлические компоненты клапанов, такие как клапанная чашка, могут быть покрыты анодированным серебром, эпоксимеламином или полипропиленом.
Кроме того, для ингибирования вытекания из контейнера, особенно вытекания пропеллента, материалы, используемые в контейнере для прокладок или заглушек, должны быть также предпочтительно химически инертными. Например, корпус контейнера и клапанная чашка могут быть обжаты вместе с использованием промежуточной прокладки, которая, по меньшей мере, частично находится в контакте с композицией, таким образом, если прокладка не сделана из инертного материала, она может со временем привести к разрушению композиции.
Всестороннее тестирование материалов, используемых для прокладок в клапанах для традиционных аэрозольных контейнеров, показало, что полимерные материалы, полученные вулканизацией с использованием содержащих серу катализаторов (например, тиазолов), не подходят для материалов прокладок для контейнеров, предназначенных для включения представленной композиции, вероятно, из-за взаимодействия содержащих серу остатков или загрязнений с одним или обоими активными ингредиентами, приводящего к химическому разрушению.
Сходно, материалы прокладок, проницаемые для пропеллентов, включенных в настоящее изобретение, не подходят в качестве материалов прокладок в целях настоящего изобретения.
Подходящие материалы для прокладок и заглушек для использования с композициями по изобретению включают фторэластомеры (например, Viton V 600), фторированный сополимер этилена-пропилена (FEP), фторкаучук (FPM, например, VI500) или каучук из мономера этиленпропилендиена (EPDM).
Подходящие материалы для трубки для погружения, как было обнаружено, представляют собой, например, полиэтилен и полипропилен. Подходящие материалы для клапанного стержня, как было обнаружено, представляют собой, например, полиамид и ацеталь (POM).
В варианте осуществления, представленном на фиг.6b, композиция включает фазу носителя (6), фазу пропеллента (7) и испаряемую фазу (8). В этом варианте осуществления аэрозольный контейнер необходимо тщательно встряхнуть перед использованием так, чтобы фаза носителя (6) была гомогенно суспендирована в фазе пропеллента (7).
Как показано на фиг.7, клапанный блок может состоять из клапанной чашки (3), которая обычно сделана из металла, такого как алюминий, присоединенной к корпусу контейнера (1) с помощью обжатия, клапанного корпуса (5), который содержит стержень клапана (51) и пружину (53), соединенные с исполнительным механизмом (4), с которого снимается нагрузка для активации изгнания композиции из контейнера. Стержень клапана (51) содержит, по меньшей мере, одно отверстие (52) с диаметром 0,05-1 мм, через которое композиция, присутствующая в корпусе контейнера (1), может течь, когда снимается нагрузка с исполнительного механизма (4). Отверстие в стержне клапана (52) может предпочтительно снабжаться шариком, который позволяет контейнеру использоваться в различных положениях, таких как вверх дном или боком.
Исполнительный механизм (4) снабжается вставкой (44), имеющей концевое сопло (41) с диаметром 0,3-1,5 мм, через которое вытесняется композиция. Исполнительный механизм (4) должен быть создан так, чтобы обеспечить аэрозольное распыление из сопла (41) с размером капель, достаточно малым, чтобы гарантировать однородное распыление продукта, но еще достаточно большим, чтобы убедиться, что капли композиции не образуют мелкого тумана при изгнании из контейнера, такого, что капли, содержащие биологически активные вещества, можно случайно вдохнуть.
Размеры вставочного сопла (41) и отверстия(й) клапанного стержня (52), а также давление в контейнере обычно определяют ширину конуса аэрозоля, образованного, когда композиция изгоняется из отверстия (4), и затем размер участка, который покрывается распыляемой композицией.
В конкретном варианте осуществления контейнер может быть снабжен устройствами для отмеривания дозы композиции.
Изобретение дополнительно иллюстрируется последующими примерами, которые нисколько не предназначены для ограничения объема изобретения, заявленного в формуле изобретения.
Примеры
Пример 1
Тестирование растворимости кальципотриола и BDP в различных смесях пропеллента
Стеклянные 100-мл флаконы 2×12, снабженные клапаном и исполнительным механизмом, наполняли композициями, содержащими 67 мг BDP, 13 мг кальципотриола, 20 г носителя (включающего жидкий парафин, белый мягкий парафин и PPG-15-стеариловый простой эфир) и различные количества DME и бутана, как показано в таблице 1. Композиция образовывала непрерывную фазу и дисперсную фазу, предположительно состоящую из длинноцепочечных алканов (содержащих ≥50 атомов углерода в цепи), присутствующих в белом мягком парафине. Дисперсная фаза оседала в нижнюю часть композиции при стоянии. Таким образом, верхняя часть композиции содержала только непрерывную фазу, а нижняя часть композиции состояла из смеси непрерывной и дисперсной фаз.
D1-9 представляют собой образцы, отобранные из смеси непрерывной и дисперсной фаз флакона
Перед отбором проб флаконы тщательно встряхивали до видимой однородности содержимого, после чего флаконы оставляли на ночь в темноте, в результате чего происходило осаждение дисперсной фазы в нижнюю часть флакона в смеси с непрерывной фазой. Образцы отбирали из верхней и нижней частей композиции с помощью погружаемой трубки, соединенной с клапаном и достигающей непрерывной фазы или смешанной непрерывной-дисперсной фазы, что обеспечивало распыление любой фазы на коричневое стекло. Была проявлена осторожность с тем, чтобы не встряхивать флаконы во время операций и дисперсная фаза оставалась в нижней части композиции. Распыленные образцы помещали в водяную баню при 40°С на 5 часов до выпаривания пропеллента. После этого образцы охлаждали в течение 1 часа при комнатной температуре.
Количество кальципотриола и BDP, находящееся в каждом образце, определяли с помощью ВЭЖХ при следующих рабочих условиях:
Колонка: Agilent Zorbas Eclipse Plus C18, 150×4,6 мм, 3,5 мкм
Подвижная фаза: ацетонитрил/метанол/0,01 М (NH4)2HPO4, pH 6,0, 25:45:30 (об./об./об.)
Скорость потока: 1,2 мл/мин
Детекция: 25-320 нм. Расчет при 264 нм для кальципотриола и 240 нм для BDP
Нагрев колонки: 30°С
Автоматический дозатор: 20°С
Время разделения: 30 мин
Впрыск: 80 мкл
Результаты показаны на фиг.1a и 1b для кальципотриола и фиг.2a и 2b для BDP. Из фигур следует, что и кальципотриол, и BDP полностью растворяются при соотношении бутана и DME 4:3 в обеих фазах пропеллента и носителя. Более того, кальципотриол и BDP, по-видимому, полностью растворяются в 100% DME в качестве пропеллента.
Физическую стабильность кальципотриола и BDP в композиции определяли с помощью микроскопии в поляризованном свете. Результаты показывают, что ни кальципотриол, ни BDP не образуют заново кристаллов при стоянии композиций в течение 4 месяцев.
Пример 2
Композиции носителя
Композиции A-E
Для получения композиций A-E белый мягкий парафин плавили при 80°С, затем охлаждали до 70°С и оставляли при этой температуре. Кальципотриола моногидрат растворяли в простом полиоксипропилен-15-стеариловом эфире с образованием раствора, который добавляли к расплавленному парафину при перемешивании. BDP диспергировали в жидком парафине, и эту дисперсию добавляли к содержащей кальципотриол парафиновой смеси при перемешивании, после чего смесь охлаждали до температуры ниже 30°С. Порции смеси по 30 г помещали в алюминиевые контейнеры для аэрозоля, снабженные внутренним полиамид-полиимидным лаковым покрытием (HOBA 8460), после чего к корпусу контейнера прикрепляли чашку клапана путем обжатия. Через трубку добавляли необходимое количество пропеллентной смеси, после чего контейнер встряхивали в течение 5 минут для полного растворения кальципотриола и BDP.
Композиция F
Для получения композиции F гидрогенизированное касторовое масло плавят вместе с жидким парафином при 85-90°С и охлаждают при гомогенизации до приблизительно 60°С. Смесь затем охлаждают до 25-30°С при перемешивании. BDP суспендируют в жидком парафине и добавляют к гомогенизированной смеси. Кальципотриола моногидрат растворяют в простом полиоксипропилен-15-стеариловом эфире и добавляют к смеси других ингредиентов, и состав гомогенизируют для обеспечения однородного распределения активных ингредиентов. Порции смеси по 30 г помещают в алюминиевые контейнеры для аэрозоля, снабженные внутренним полиамид-полиимидным лаковым покрытием (HOBA 8460), после чего к корпусу контейнера прикрепляют чашку клапана путем обжатия. Через трубку добавляют необходимое количество пропеллентной смеси, после чего контейнер встряхивают в течение 5 минут для полного растворения кальципотриола и BDP.
Композиции G и H
Для получения композиции G раствор кальципотриола моногидрата в N-метилпирролидоне смешивают со среднецепочечными триглицеридами и простым полиоксипропилен-15-стеариловым эфиром. Sonnecone DM1 и микрокристаллический воск плавят при 80-85°С и добавляют раствор α-токоферола в жидком парафине при 80°С при перемешивании до плавления. После охлаждения до 70-75°C добавляют при перемешивании смесь растворителей, содержащую кальципотриола моногидрат. После охлаждения до приблизительно 40°С добавляют ментол, и полученную смесь перемешивают при охлаждении до температуры ниже 30°С. Порции смеси по 30 г помещают в алюминиевые контейнеры для аэрозоля, снабженные внутренним полиамид-полиимидным лаковым покрытием (HOBA 8460), после чего к корпусу контейнера прикрепляют чашку клапана путем обжатия. Через трубку добавляют необходимое количество пропеллентной смеси, после чего контейнер встряхивают в течение 5 минут для полного растворения кальципотриола и BDP.
(Sonnecone DM1)
(Multiwax 180 MH)
Для получения композиции H белый мягкий парафин плавят при 80-85°С и охлаждают до 70-75°С и добавляют смесь растворителей при перемешивании. Порции смеси по 30 г помещают в алюминиевые контейнеры для аэрозоля, снабженные внутренним полиамид-полиимидным лаковым покрытием (HOBA 8460), после чего к корпусу контейнера прикрепляют чашку клапана путем обжатия. Через трубку добавляют необходимое количество пропеллентной смеси, после чего контейнер встряхивают в течение 5 минут для полного растворения кальципотриола и BDP.
Композиции I-P
Композиции I получают смешиванием среднецепочечных триглицеридов, каприловых/каприновых глицеридов и гидрогенизированного полиоксилом 40 касторового масла и перемешиванием смеси в течение 15 мин при 50°С с помощью магнитной мешалки. Кальципотриола моногидрат растворяют в смеси при 40°С с использованием магнитной мешалки в течение 15 мин. Белый мягкий парафин плавят при 80°С. Трехкомпонентную смесь поверхностно-активное вещество-растворитель, содержащую кальципотриола моногидрат, добавляют к расплавленному парафину и быстро перемешивают до получения однородной смеси мази. Гомогенизированную смесь охлаждают до 30°С при перемешивании. Композицию J получают сходным образом за исключением того, что вместо каприловых/каприновых глицеридов в качестве вспомогательного компонента поверхностно-активного вещества используют моноолеат глицерина 40. Порции смеси по 30 г помещают в алюминиевые контейнеры для аэрозоля, снабженные внутренним полиамид-полиимидным лаковым покрытием (HOBA 8460), после чего к корпусу контейнера прикрепляют чашку клапана путем обжатия. Через трубку добавляют необходимое количество пропеллентной смеси, после чего контейнер встряхивают в течение 5 минут для полного растворения кальципотриола и BDP.
I
Композиции K-P получают сходно с получением композиции I, но с соответствующей заменой поверхностно-активного вещества, вспомогательного компонента поверхностно-активного вещества и растворителя, как указано в таблице ниже.
Пример 3
Химическая стабильность кальципотриола и BDP в различных композициях
Композицию E, полученную как описано в примере 2 выше, хранили в контейнерах для аэрозоля в течение 3 месяцев при 40°С. Образцы композиции отбирали через 1, 2 и 3 месяца, соответственно, и содержание кальципотриола и BDP, а также возможных продуктов деградации (родственных загрязнений) определяли с помощью ВЭЖХ. Результаты представлены ниже в виде процента от теоретической исходной величины.
Из результатов следует, что имеется расхождение между потерей кальципотриола через 3 месяца при 40°С и измеренным количеством загрязнений. Это позволяет предполагать, что кажущаяся потеря кальципотриола не является результатом деградации кальципотриола во время хранения и может быть приписана другим причинам, таким как, например, адсорбция кальципотриола на одном или более компонентах контейнера, возможно, трубке для погружения или покрывающем внутренность лаке. Заявители поэтому заключили, что оба активных ингредиента химически стабильны при указанных условиях, что предполагает возможность хранения композиции в течение приблизительно 2 лет при 25°С.
Пример 4
Исследования проникновения
Для изучения проникновения через кожу и распространения кальципотриола из композиций по изобретению был проведен эксперимент с диффузией через кожу. В исследовании использовали кожу полной толщины из ушей свиней. Уши хранили в замороженном состоянии при -18°С до использования. Накануне эксперимента уши помещали в холодильник (5±3°C) для медленного размораживания. В день эксперимента шерсть удаляли с помощью ветеринарного триммера шерсти. Кожу очищали от подкожного жира с помощью скальпеля, из каждого уха вырезали два кусочка кожи и монтировали их на диффузионных ячейках Франца в сбалансированном порядке.
Статические диффузионные ячейки Франца с доступной площадью диффузии 3,14 см2 и объемами приемника в диапазоне от 8,6 до 11,1 мл использовали по существу также, как описано T.J. Franz, "The finite dose technique as a valid in vitro model for the study of percutaneous absorption in man", in Current Problems in Dermatology, 1978, J.W.H. Mall (Ed.), Karger, Basel, pp. 58-68. Конкретный объем каждой ячейки измеряли и фиксировали. В отделение приемника каждой ячейки помещали магнитный стержень. После монтирования кожи каждую камеру-приемник заполняли физиологическим раствором (35°С) для гидратации кожи. Ячейки помещали в водяную баню с контролируемой температурой, которую помещали на магнитную мешалку с установленной скоростью 400 об/мин. Температуру циркулирующей в водяной бане воды поддерживали на уровне 35±1°С, что обеспечивало температуру на поверхности кожи приблизительно 32°С. Через час физиологический раствор заменяли средой приемника, 0,04 М изотоническим фосфатным буфером, pH 7,4 (35°С), содержащим 4% бычий сывороточный альбумин. Условия в приемнике, т.е. концентрацию активных компонентов в среде приемника ниже 10% от растворимости соединений в среде, поддерживали на всем протяжении исследования.
Проникновение через кожу in vitro каждой тестируемой композиции проверяли в 6 повторах (т.е. n=6). Каждую тестируемую композицию распыляли на кожную мембрану в 0 часов. Для равномерного распределения композиции по поверхности кожи использовали стеклянный шпатель.
Эксперимент с проникновением через кожу продолжался в течение 21 часа. Через 2, 6 и 21 час отбирали образцы из следующих компартментов:
Роговой слой собирали путем 10-кратного сдирания с помощью клейкой ленты с использованием ленты D-Squame® (диаметр 22 мм, CuDerm Corp., Dallas, Texas, USA). Каждую полоску ленты прикладывали к тестируемой поверхности с использованием стандартного давления в течение 5 секунд и отделяли от тестируемой поверхности одним легким непрерывным движением. Для каждой следующей полоски направление отрыва меняли. После этого сходным образом из кожи отбирали образцы жизнеспособных эпидермиса и дермы.
Собирали и анализировали образцы (1 мл) жидкости приемника, остающейся в диффузионной ячейке.
Концентрацию кальципотриола в образцах определяли с помощью ЖХ масс-спектрометрии.
Результаты представлены на фиг.3 и 4 ниже, на которых показано количество кальципотриола и BDP, соответственно, обнаруженное в жизнеспособной коже (дерме и эпидермисе) и жидкости приемника в % от нанесенной дозы через 2, 6 и 21 час после нанесения. Результаты показывают, что нанесение композиции E ведет к значительному повышению проникновения через кожу кальципотриола и BDP по сравнению с мазью Daivobet®.
Пример 5
Биологическая активность композиций
Как показано на фиг.5 ниже, кателицидин представляет собой противомикробный пептид, экспрессируемый в кератиноцитах человека. Экспрессия кателицидина сильно индуцируется при инфекции кожи или повреждении кожного барьера. При псориазе уровень кателицидина повышается в поврежденной коже больных псориазом. Было обнаружено, что экспрессия гена, кодирующего кателицидин, может быть индуцирована витамином D3 или аналогами витамина D, такими как кальципотриол (подтверждено TT Wang et al, J. Immunol. 173(5), 2004, pp. 2909-2912; J Schauber et al., Immunology 118(4), 2006, pp. 509-519; Schauber and Gallo, J. Allergy Clin Immunol 122, 2008, pp. 261-266; M. Peric et al., PloS One 4(7), July 22, 2009, e6340), посредством связывания с рецептором витамина D. Это наблюдение было использовано для разработки теста, в котором захват и биологическую активность кальципотриола в кератиноцитах человека из тестируемых композиций определяли путем измерения уровня индукции гена, кодирующего кателицидин.
В тесте композицию E, полученную как описано в примере 2 выше, распыляли местно в трех повторах на реконструированный эпидермис человека, состоящий из нормальных кератиноцитов человека, культивированных в течение 12 дней на 0,5 см2 поликарбонатных фильтрах (доступных от SkinEthic® Laboratories, Nice, Франция). Ткань обрабатывали в течение двух дней с последующим отделением эпидермиса от поликарбонатного фильтра и мгновенным замораживанием в жидком азоте. Из клеток экстрагировали РНК и синтезировали кДНК традиционными методами. Затем проводили количественную ПЦР в реальном времени (qPCR) с использованием следующих тестов от Applied Biosystems: CAMP Hs0018038_m1 и GAPDH Hs99999905_m1. Уровни экспрессии кателицидина нормализовали по GAPDH и производили относительную количественную оценку по отношению к мази Daivobet®.
Результаты показывают 2,3-кратное увеличение биологической активации кателицидина по сравнению с активацией, полученной с мазью Daivobet®.
Пример 6
Химическая стабильность кальципотриола/BDP в присутствии различных внутренних лаковых покрытий
Партии композиции A, полученные как описано в примере 2 и помещенные в алюминиевые контейнеры для аэрозоля, содержащие два разных типа внутреннего лакового покрытия, лака на основе эпоксифенола (HOBA 7940/7407) и лака на основе полиимида-полиамида (HOBA 8460), соответственно, тестировали на химическую стабильность активных ингредиентов после хранения в течение 1 месяца при 40°С путем распыления образцов каждой партии на стекло и использования для ВЭЖХ с помощью метода, описанного в примере 3.
Результаты показаны в таблице ниже.
1 мес/
40°С (мкг/г)
PI-PA: лак на основе полиимида-полиамида
Из таблицы следует, что кальципотриол неприемлемо деградирует при использовании лака на основе эпоксифенола в качестве внутреннего лакового покрытия контейнера для аэрозоля, тогда как химическая стабильность является приемлемой в присутствии внутреннего лакового покрытия на основе полиимида-полиамида. Химическая стабильность бетаметазона дипропионата, по-видимому, в значительно меньшей степени зависит от состава этих внутренних лаковых покрытий. Предполагается, что деградация кальципотриола, показанная в таблице, вызывается одним или более реакционными кислотными компонентами лака HOBA 7940/7407 на основе эпоксифенола, которые могут вымываться из лака благодаря действию растворителя пропеллентной смеси. В настоящее время полагают, что таким компонентом является канифоль, поскольку она включает кислотную группу.
Пример 7
Тестирование растворимости аналогов витамина D и кортикостероидов в различных пропеллентных смесях
100-мл стеклянные флаконы, снабженные клапаном и исполнительным механизмом, наполняли композициями, содержащими API (10 мг кальцитриола, такальцитола, максакальцитола, 30 мг клобетазола пропионата, 60 мг бетаметазона 17-валерата, гидрокортизона 17-бутирата, 120 мг гидрокортизона валерата или 800 мг гидрокортизона) и различные количества DME и бутана (46,7 мл бутана, 6,7 мл DME и 40,0 мл бутана или 23,3 мл DME и 23,3 мл бутана). Перед отбором проб флаконы энергично встряхивали до достижения видимой однородности содержимого, после чего флаконы оставляли на ночь в темноте, что приводило к осаждению нерастворенных API. После этого отбирали образцы из верхней части композиции с помощью погружаемой трубки, соединенной с клапаном, путем разбрызгивания образца в сцинтилляционный стеклянный флакон. Была проявлена осторожность с тем, чтобы не встряхивать флаконы во время операций и нерастворенные API оставались осажденными в нижней части композиции. API в стеклянном флаконе растворяли в растворителе для экстракции и при необходимости разбавляли перед впрыском в ВЭЖХ.
Количество кальцитриола, такальцитола, максакальцитола, бетаметазона 17-валерата и клобетазола пропионата, находящееся в каждом образце, определяли с помощью ВЭЖХ при следующих рабочих условиях:
Расчет для бетаметазона 17-валерата и клобетазола пропионата производят при 240 нм
Расчет для аналогов витамина D производят при 260 нм
6,7 минут (бетаметазона 17-валерат)
10,5 минут (максакальцитол)
28,6 минут (кальцитриол)
32,6 минут (такакальцитол)
Количество гидрокортизона, гидрокортизона-валерата и гидрокортизона 17-бутирата, находящееся в каждом образце, определяли с помощью ВЭЖХ при следующих рабочих условиях:
Sunfire C18 3,5 мкм, 100 мм × 4,6 мм или эквивалентная
Элюент B: вода
PDA-детектор 220-320 нм
12,7 минут (гидрокортизона 17-бутират)
14,5 минут (гидрокортизона валерат)
Результаты показаны в таблице a и таблице b для аналогов витамина D и кортикостероидов, соответственно. Из таблиц следует, что растворимость аналогов витамина D и кортикостероидов возрастает с увеличением количества DME.
Растворимость аналогов витамина D при температуре окружающей среды. Величины представляют собой среднее из двух определений из одного и того же флакона.
Растворимость кортикостероидов при температуре окружающей среды. Величины представляют собой среднее из двух определений из одного и того же флакона.
Пример 8
Химическая стабильность кальципотриола/BDP в присутствии различных прокладочных материалов
Для тестирования совместимости композиции с различными прокладочными материалами образцы получали с композицией E, смотри пример 2, наполняли ими алюминиевые контейнеры для аэрозоля с полиамидным-полиимидным внутренним лаковым покрытием и закрывали клапанной чашкой, прикрепляемой к корпусу контейнера путем обжатия. В каждый контейнер для аэрозоля добавляли 10 кусочков или эквивалентное количество тестируемого прокладочного материала и оставляли их погруженными в композицию. Контейнеры хранили при 25°C или 40°C и проверяли спустя 1 и 3 месяца при 40°C и спустя 3 месяца при 25°C.
После хранения композицию распыляли в стеклянном сосуде и пропеллентам давали испариться в течение 2 дней. Нелетучую часть композиции анализировали на содержание кальципотриола, бетаметазона дипропионата и связанных с ними органических загрязнений.
Количество кальципотриола определяли с помощью ВЭЖХ после жидкостной экстракции с последующей контролируемой изомеризацией при 50°C. В качестве внутреннего стандарта использовали метилтестостерон. При анализе ВЭЖХ использовали следующие условия:
Колонка: LiChrospher RP-18, 125×4 мм, 5 мкм
Подвижная фаза: Ацетонитрил/метанол/0,01 М (NH4)2PO4 (20:50:30)
Скорость потока: 2,0 мл/мин
Обнаружение: УФ-264 нм
Впрыск: 50 мкл
Время разделения: Приблизительно 9 минут
Органические загрязнения, связанные с кальципотриолом, определяли с помощью ВЭЖХ после жидкостной экстракции при использовании следующих условий:
Колонка: YMC ODS-AM, 150×4,6 мм, 3 мкм
Подвижная фаза: Ацетонитрил/метанол/0,01 М (NH4)2PO4 (20:50:30)
Скорость потока: 1,0 мл/мин
Обнаружение: УФ-264 нм
Впрыск: 500 мкл
Время разделения: 2 × время удержания кальципотриола
Количество бетаметазона дипропионата определяли с помощью ВЭЖХ после жидкостной экстракции при использовании беклометазона дипропионата в качестве внутреннего стандарта и следующих условий ВЭЖХ:
Колонка: Superspher RP-18, 75×4 мм, 4 мкм
Подвижная фаза: Ацетонитрил/вода (50:55)
Скорость потока: 1,5 мл/мин
Обнаружение: УФ-240 нм
Впрыск: 20 мкл
Время разделения: Приблизительно 9 минут
Органические загрязнения, связанные с бетаметазона дипропионатом, экстрагировали жидкостной экстракцией и анализировали с помощью ВЭЖХ при следующих условиях:
Колонка: LiChrospher RP-18, 125×4 мм, 5 мкм
Подвижная фаза: Ацетонитрил/0,05 М (NH4)2PO4 pH 7(50:55)
Скорость потока: 2,0 мл/мин
Обнаружение: УФ-240 нм
Впрыск: 20 мкл
Время разделения: Приблизительно 20 минут
Результаты представлены в таблице ниже:
Результаты показывают, что два типа прокладки, Buna и NPR, вызывали разложение и кальципотриола, и бетаметазона дипропионата. На основании этого теста совместимости было сделано заключение, что эти два материала не пригодны для использования в контакте с тестируемой композицией. Прокладки Viton и EPDM не оказывали негативного действия на стабильность кальципотриола и бетаметазона дипропионата и, следовательно, их можно считать пригодными в качестве прокладочных материалов для тестируемой композиции.

Группа изобретений относится к медицине, а именно к дерматовенерологии, и может быть использована для лечения кожных заболеваний. Распыляемая, стабильная при хранении, по существу безводная композиция для местного применения, включает 0,00001-0,05% масс./масс. кальципотриола или кальципотриола моногидрата и 0,0005-1% сложного эфира бетаметазона, растворенных в пропеллентной смеси, составляющей 50-90% об./об. от объема композиции, 0,1-10% липидного сорастворителя и 10-50% масс./масс. фармацевтически приемлемого липидного носителя, растворенного или суспендированного в указанном пропелленте, причем липидный носитель включает один или более липидов, которые при нанесении на кожу и испарении пропеллента образуют полутвердый и окклюзирующий слой в месте нанесения. Способ лечения кожного заболевания включает введение пациенту терапевтически эффективного количества композиции. Использование изобретений позволяет повысить эффективность лечения за счет улучшения проницаемости и биологической активности ингредиентов. 2 н. и 14 з.п. ф-лы, 8 табл., 7 ил., 8 пр.
1. Распыляемая, стабильная при хранении, по существу безводная композиция для местного применения, включающая терапевтически эффективное количество 0,00001-0,05% масс./масс. кальципотриола или кальципотриола моногидрата и терапевтически эффективное количество 0,0005-1% сложного эфира бетаметазона, причем кальципотриол или кальципотриола моногидрат и сложный эфир бетаметазона растворены в пропеллентной смеси простого диметилового эфира и одного или более C3-5 алканов, при этом пропеллентная смесь присутствует в количестве 50-90% об./об. от объема композиции, композиция дополнительно включает 0,1-10% липидного сорастворителя, выбранного из группы, состоящей из простого полиоксипропилен-15-стеарилового эфира, простого полиоксипропилен-11-стеарилового эфира, простого полиоксипропилен-14-бутилового эфира, простого полиоксипропилен-10-цетилового эфира или простого полиоксипропилен-3-миристилового эфира, и 10-50% масс./масс. фармацевтически приемлемого липидного носителя, растворенного или суспендированного в указанном пропелленте, причем липидный носитель включает один или более липидов, которые при нанесении на кожу и испарении пропеллента образуют полутвердый и окклюзирующий слой в месте нанесения.
2. Композиция по п. 1, где сложный эфир бетаметазона представляет собой бетаметазона дипропионат или бетаметазона валерат.
3. Композиция по п. 1, где C3-5 алкан выбран из группы, состоящей из н-пропана, изопропана, н-бутана или изобутана.
4. Композиция по п. 3, где C3-5 алкан представляет собой н-бутан или изобутан.
5. Композиция по п. 4, где отношение н-бутана и/или изобутана к простому диметиловому эфиру находится в диапазоне 6:1-0:1 об./об.
6. Композиция по п. 5, где отношение н-бутана и/или изобутана к простому диметиловому эфиру находится в диапазоне 5:1-1:2 об./об.
7. Композиция по п. 5, где отношение н-бутана и/или изобутана к простому диметиловому эфиру находится в диапазоне 4:1-1:1 об./об.
8. Композиция по п. 5, где отношение н-бутана и/или изобутана к простому диметиловому эфиру находится в диапазоне 4:2-1:1 об./об.
9. Композиция по п. 5, где отношение н-бутана и/или изобутана к простому диметиловому эфиру находится в диапазоне 4:2-4:3 об./об.
10. Композиция по п. 1, включающая 15-45% масс./масс. или 20-40% масс./масс. липидного носителя.
11. Композиция по п. 1, включающая 55-70% масс./масс. пропеллента.
12. Композиция по п. 1, включающая 0,5-3% масс./масс. маслянистого сорастворителя.
13. Композиция по п. 12, включающая 1-2,5% масс./масс. или 1,5-2% маслянистого сорастворителя.
14. Композиция по любому из пп. 1-13, где парафин выбран из парафинов, состоящих из углеводородов с длинами цепей в диапазоне от C5 до C60, причем длины цепей имеют максимумы C14-16, C18-22, C20-22, C20-26, C28-40 и C40-44.
15. Композиция по п. 14, дополнительно включающая липофильный повышающий вязкость агент, способный придавать липидному носителю способность образовывать полутвердый и окклюзирующий слой на коже после нанесения и испарения пропеллента, причем указанный увеличивающий вязкость агент выбран из группы, состоящей из микрокристаллического воска, силиконового воска и гидрогенизированного касторового масла, или их смесей, или изопарафина.
16. Способ лечения кожного заболевания или состояния, включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества композиции по любому из пп. 1-15, где кожное заболевание или состояние выбрано из группы, состоящей из псориаза, ладонно-подошвенного пустулезного высыпания, ихтиоза, дерматита, розовых угрей и акне.
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2238734C2 |
| US 20050281749, 22.12.2005 | |||
| US 20050281754, 22.12.2005 | |||
| WO 2008152444, 18.06.2009 | |||
| MENTER a et al | |||
| Comparing clobetasol propionate 0.05% spray to calcipotriene 0.005% betamethasone dipropionate 0.064% ointment for the treatment of moderate to severe plaque psoriasis// J Drugs Dermatol | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
Авторы
Даты
2016-03-10—Публикация
2011-06-10—Подача