Настоящее изобретение относится к композиции для местного применения, содержащей по меньшей мере один витамин D или аналог витамина D и по меньшей мере один кортикостероид.
Известно, что композиции, содержащие витамин D или аналоги витамина D, применяют для лечения ряда кожных заболеваний.
Например, в европейском патенте ЕР-В-474517 описано применение композиций, содержащих одно или несколько соединений 1α-гидрокси-19-норвитамина D с тройной связью в боковой цепи, при лечении псориаза.
В патенте США № 4871723 описан способ лечения псориаза путем местного применения композиции, содержащей витамин D и восковой носитель. В частности, в патенте США № 4871723 описана композиция, содержащая а) фармацевтически эффективное количество витамина D3 активного типа, b) растворитель, выбранный из сложных эфиров жирных кислот, высших спиртов с 10 или более атомами углерода и пропиленкарбоната, и с) масляный носитель, выбранный из белого вазелина, желтого вазелина и жидкого парафина.
В заявке на патент США 2005/002546 А1 описана фармацевтическая композиция, содержащая соединение активного витамина D в предварительно концентрированных эмульсионных составах, а также в эмульсиях и субмикронных капельных эмульсиях, полученных из указанных составов. В частности, фармацевтические композиции, описанные в заявке на патент США 2005/002546 А1, содержат
(а) липофильную фазу;
(b) одно или несколько поверхностно-активных веществ и
(с) соединение активного витамина D.
Одно или несколько поверхностно-активных веществ присутствуют в количестве 1%-90% мас. в расчете на общую массу композиции, предпочтительно от около 5% до около 85% мас. в расчете на общую массу композиции.
Существующие в настоящее время композиции содержат витамин D или аналоги витамина D и поверхностно-активные вещества в относительно высоких концентрациях, что часто вызывает раздражение кожи и ухудшение псориаза. Например, в 1996 г. Американская администрация по пищевым продуктам и лекарственным средствам потребовала, чтобы в инструкции, прилагаемой к препарату Dovonex (кальципотриен) - продукт, содержащий 0,005% кальципотриола, - было указано, что примерно у 25% субъектов возникает раздражение кожи и примерно у 10% происходит ухудшение псориаза. Кроме того, в научных публикациях сообщалось, что у некоторых субъектов, принимавших Dovonex, возникла гиперкальциемия (см., например, публикацию Hardman KA, Heath DA, Nelson HM, Hypercalcaemia associated with calcipotriol (Dovonex) treatment. BMJ. 1993 Apr.3; 306 (6882); 896-896).
Кроме того, известно, что при лечении ряда кожных заболеваний возможно применение комбинации двух или более фармакологически активных соединений. Например, при лечении псориаза можно применять комбинированное лечение, включающее аналог витамина D, такой как кальципотриол, и кортикостероид, при этом все активные соединения входят в состав отдельных препаратов (как описано, например, в патенте США US-B-6753013).
Приготовление местнодействующих фармацевтических композиций, содержащих комбинацию аналога витамина D и местнодействующего кортикостероида, связано с определенными трудностями вследствие того, что указанные соединения являются устойчивыми при разных значениях рН.
Например, кальципотриол является максимально устойчивым при значении рН выше 8, в то время как кортикостероиды, такие как бетаметазон (9-фтор-11,17,21-тригидрокси-16-метилпрегна-1,4-диен-3,2-дион), являются максимально устойчивыми при значениях рН 4-6. Поэтому трудно объединить в одном препарате два активных компонента при сохранении хорошей устойчивости активных соединений, если в препарате присутствует вода.
В патенте США US-B-6753013 описана фармацевтическая композиция для нанесения на кожу, которая содержит по меньшей мере один витамин D или аналог витамина D, по меньшей мере один кортикостероид и растворитель, выбранный с учетом возможного сосуществования двух активных компонентов без значительного разложения, несмотря на разные профили устойчивости таких компонентов. Однако указанные композиции получают на основе воска и включают воск или подобные наполнители, такие как мягкий белый парафин и жидкий парафин. Недостатком указанной композиции является то, что для смешивания витамина D или аналога витамина D и кортикостероида с воском воск необходимо нагреть до температуры, равной 70°С. Такие высокие температуры могут вызывать разложение лекарственных средств в композиции. Кроме того, композиции на основе воска являются довольно масляными и после нанесения оставляют жирную пленку на коже. Такой результат является нежелательным и может стать причиной прекращения применения субъектом.
Другим недостатком композиций, описанных в патенте США US-B-6753013, является то, что для достижения благоприятных результатов при местном применении указанные композиции должны содержать большое количество витамина D или аналога витамина D для проникновения через кожу достаточного количества витамина D или аналога витамина D, так как указанные композиции характеризуются плохим проникновением через кожу. Данный фактор является неблагоприятным, поскольку известно, что витамин D и аналоги витамина D вызывают раздражение кожи.
Существует потребность в создании улучшенной композиции, пригодной для местного применения, которая позволит устранить по крайней мере некоторые проблемы, ранее существовавшие в данной области.
Авторы настоящего изобретения создали новую композицию, содержащую по меньшей мере один витамин D или аналог витамина D и по меньшей мере один кортикостероид. Было установлено, что такие композиции характеризуются лучшим проникновением через кожу и/или лучшей устойчивостью по сравнению с известными композициями. Такие композиции также обладают вязкостью, приемлемой для местного применения.
Таким образом, настоящее изобретение относится к композиции, предназначенной для местного применения, которая включает непрерывную фазу и по меньшей мере одну дисперсную фазу, при этом указанная композиция содержит по меньшей мере одну полиафроновую дисперсию, по меньшей мере один витамин D или аналог витамина D и по меньшей мере один кортикостероид.
Другим объектом настоящего изобретения является композиция, рассмотренная в настоящем описании изобретения, которая предназначена для применения при лечении псориаза.
Другим объектом настоящего изобретения является композиция, рассмотренная в настоящем описании изобретения, которая предназначена для приготовления лекарственного средства для лечения псориаза.
Другим объектом настоящего изобретения является композиция, рассмотренная в настоящем описании изобретения, которая предназначена для применения при осуществлении способа терапевтического лечения человека или животного.
Другим объектом настоящего изобретения является способ лечения или профилактики псориаза у субъекта, который включает местное нанесение субъекту эффективного количества композиции по настоящему изобретению.
В приведенном ниже описании изобретения используемые термины имеют следующие значения: гидрофильная фаза или растворитель означает жидкую фазу, включающую воду, а также воду вместе с другими смешивающимися с водой жидкостями, или неводную жидкость, смешивающуюся с водой. Гидрофобная фаза или растворитель означает фазу, включающую фармацевтически приемлемые жидкости, такие как масла, которые не смешиваются или по существу не смешиваются с гидрофильной фазой. Термин ”несмешивающиеся жидкости” означает, что при смешивании такие жидкости образуют две отдельные жидкие фазы, имеющие хорошо выраженную поверхность раздела. Термин ”по существу не смешивающиеся” означает, что две жидкости при смешивании имеют хорошо выраженную поверхность раздела между двумя фазами, и тем не менее каждая фаза может содержать небольшие количества растворенных молекул другой фазы.
Другим объектом настоящего изобретения является способ получения композиции по настоящему изобретению, включающий следующие стадии:
(i) получение гидрофильного растворителя, необязательно содержащего по меньшей мере один витамин D или аналог витамина D, по меньшей мере один кортикостероид и/или поверхностно-активное вещество;
(ii) получение гидрофобного растворителя, необязательно содержащего по меньшей мере один витамин D или аналог витамина D, по меньшей мере один кортикостероид и/или поверхностно-активное вещество;
(iii) смешивание гидрофильного растворителя с гидрофобным растворителем в приемлемых условиях с образованием композиции, содержащей по меньшей мере одну полиафроновую дисперсию, по меньшей мере один витамин D или аналог витамина D и по меньшей мере один кортикостероид.
Другим объектом настоящего изобретения является способ получения композиции по настоящему изобретению, включающий следующие стадии:
получение первой полиафроновой дисперсии, содержащей витамин D или аналог витамина D;
получение второй полиафроновой дисперсии, содержащей кортикостероид;
и смешивание первой и второй полиафроновых дисперсий с образованием композиции.
Композиции по настоящему изобретению характеризуются лучшим проникновением активного агента через кожу по сравнению с известными композциями, подобными описанным в патенте США US-B-753013. Таким образом, в композициях по настоящему изобретению могут быть использованы меньшие количества активных агентов для достижения благоприятных результатов лечения. Благодаря меньшему содержанию витамина D и/или аналогов витамина D в композициях по настоящему изобретению уменьшается вероятность возникновения раздражения кожи и/или других побочных эффектов, что может способствовать соблюдению субъектом режима лечения. В композициях по настоящему изобретению витамин D и/или аналог витамина D и кортикостероид могут сосуществовать в водной композиции, характеризуясь приемлемой и контролируемой вязкостью благодаря наличию полиафроновых дисперсий вместе с любыми гелеобразователями, входящими в состав композиции. Другим преимуществом является то, что композиции по настоящему изобретению характеризуются хорошей долговременной устойчивостью даже при повышенной темипературе (40°С). Кроме того, наличие воды в композициях может быть полезно для растворения водорастворимых добавок, таких как водорастворимые консерванты, антиоксиданты, водорастворимые усилители проникновения через кожу, и тому подобные.
Другим преимуществом является то, что композиции по настоящему изобретению обычно получают при комнатной температуре без необходимости нагревания, что делает маловероятным разрушение активных компонентов в композиции.
Другим преимуществом композиции по настоящему изобретению является то, что такая композиция является менее жирной по сравнению с композициями, описанными в патенте США US-B-6753013, благодаря чему процесс нанесения становится более приятным, и увеличивается вероятность соблюдения субъектом схемы лечения.
Композиция по настоящему изобретению обладает низким антрофогенным потенциалом (то есть нанесение данного соединения на кожу вызывает меньшее истончение кожи по сравнению с ранее известными композициями).
Другим преимуществом композиции по настоящему изобретению является низкое содержание поверхностно-активного вещества. Известно, что высокие концентрации поверхностно-активного вещества вызывают раздражение кожи. Поэтому желательно, чтобы при нанесении на кожу и, в частности, на пораженную кожу, такую как в случае псориаза, содержание поверхностно-активного вещества было минимальным. Композиции по настоящему изобретению предпочтительно содержат менее 4% мас. поверхностно-активного вещества, более предпочтительно менее 3% и еще предпочтительнее менее 2% мас. от общей массы композиции.
Термин ”полиафроновая дисперсия” в значении, использованном в настоящем описании изобретения, означает определенный тип дисперсии гидрофильной жидкости в гидрофобной жидкости или гидрофобной жидкости в гидрофильной жидкости, которая включает (а) смешивающуюся фазу гидрофильной жидкости, (b) вторую гидрофобную фазу, не смешивающуюся или по существу не смешивающуюся с первой фазой, и (с) одно или несколько поверхностно-активных веществ, при этом дисперсная фаза имеет форму мелких капель (например, с диаметром в микронном - субмикронном диапазоне, но обычно с диаметром, равным по меньшей мере 1 микрону) и обладает следующими характеристиками, отличающими полиафроновые дисперсии от стандартных или обычных эмульсий и дисперсий других типов:
1. Указанные дисперсии могут находиться в устойчивой форме, в которой объемная доля дисперсной фазы (ϕip) превышает 0,7 и может достигать 0,97. (ϕip означает объемное отношение дисперсной фазы к непрерывной фазе, выраженное в виде доли).
2. Полиафроновые дисперсии, в которых ϕip превышает 0,7, при рассмотрении под микроскопом представляют собой совокупность отдельных капель, расположенных в непосредственной близости друг от друга в виде многогранников, и напоминают аэрозоль. В такой форме указанная дисперсия обладает гелеподобными свойствами и определяется как гелевая полиафроновая дисперсия (GPD).
3. Устойчивые полиафроновые дисперсии могут быть получены при использовании поверхностно-активного вещества в количестве менее 3%, обычно менее 2% мас. от общей массы композиции.
4. Гелевые полиафроновые дисперсии (описанные выше в пункте 2) могут быть разбавлены до любой степени путем добавления дополнительного количества непрерывной фазы без добавления дополнительного количества поверхностно-активного вещества, когда гелеподобные свойства исчезают. При уменьшении значения ϕip ниже 0,7 отдельные капли дисперсной фазы отделяются друг от друга, принимая форму сферических капель, которые остаются устойчивыми и интактными, но тем не менее могут слабо ассоциировать и флотировать вверх или погружаться вниз разбавленной дисперсии (в зависимости от относительной плотности двух фаз). В указанном разбавленном виде каждая капля определяется как афрон коллоидной жидкости (CLA). Простое встряхивание разбавленной дисперсии сразу же вызывает повторное образование гомогенной устойчивой дисперсии афронов коллоидной жидкости.
Все вышеуказанные характеристики как в отдельности, так и в комбинации позволяют четко дифференцировать полиафроновые дисперсии по настоящему изобретению от стандартных эмульсий и дисперсий других типов, которые не обладают всеми указанными характеристиками. Полиафроновые дисперсии описаны в приведенных ниже публикациях Sebba: "Biliquid Foams", J. Colloid and Interface Science, 40 (1972) 468-474 and "The Behaviour of Minute Oil Droplets Encapsulated in a Water Film", Colloid Polymer Sciences, 257 (1979) 392-396, Hicks "Investigating the Generation, Characterisation, and Structure of Biliquid Foams", PhD Thesis, University of Bristol, 2005, Crutchley "The Encapsulation of Oils and Oil Soluble Substances Within Polymer Films", PhD Thesis, The University of Leeds, 2006 and Lye and Stuckey, Colloid and Surfaces, 131 (1998) 119-136. Афроны описаны также в патенте США US-A-4486333 и публикации WO 97/32559.
Полиафроновые дисперсии иногда определяются как ”вспененные бинарные жидкости”, “эмульсии с высоким содержанием дисперсной фазы (HIPE)”, “эмульсии с высоким отношением дисперсной фазы (HIPRE)” и “гелевые эмульсии”. В патенте США № 5573757 композиция, содержащая полиафроновую дисперсию, описана как ”вязкоупругий гель”. Все описания дисперсий, обладающих вышеуказанными характеристиками, относятся к полиафроновым дисперсиям в значении, использованном в настоящем изобретении.
Термин ”местное применение” означает употребление человеком или животным, предпочтительно нанесение на кожу, включая, например, лицо, голову, ступни, конечности или туловище.
Ниже приведено описание настоящего изобретения. В нижеследующих абзацах будут более подробно описаны разные объекты настоящего изобретения. Каждый указанный объект может быть объединен с любым другим объектом или объектами за исключением особо оговоренных случаев. В частности, любой признак, определяемый как предпочтительный или благоприятный, может быть объединен с любым другим признаком или признаками, определяемыми как предпочтительные или благоприятные.
Как было указано выше, полиафроновые дисперсии включают непрерывную фазу, дисперсную фазу и поверхностно-активное вещество. Дисперсная фаза предпочтительно является по существу гидрофобной дисперсной фазой, известной как масляная дисперсная фаза. Дисперсная фаза предпочтительно включает фармацевтически приемлемую масляную фазу.
Примеры масел, которые могут быть использованы в настоящем изобретении, включают миндальное масло, масло ореха пальмы, масло черной смородины, масло бурачника, масло канолы, касторовое масло, кокосовое масло, масло печени трески, кукурузное масло, хлопковое масло, масло энотеры, рыбий жир, масло виноградных зерен, горчичное масло, овсяное масло, оливковое масло, пальмоядровое масло, пальмовое масло, арахисовое масло, рапсовое масло, сафлоровое масло, кунжутное масло, масло печени акулы, сквалан, соевое масло, подсолнечное масло, ореховое масло, масло проростков пшеницы, гидрированное касторовое масло, гидрированное кокосовое масло, гидрированное хлопковое масло, гидрированное пальмовое масло, гидрированное соевое масло, частично гидрированное соевое масло, гидрированное растительное масло, изопропилмиристат, изопропилизостеарат, изопропилпальмитат, модифицированные триглицериды, глицериды каприловой/каприновой кислоты, фракционированные триглицериды, глицерилтрикапрат, глицерилтрикапроат, глицерилтрикаприлат, глицерилтрикаприлат/капрат, глицерилтрикаприлат/капрат/лаурат, глицерилтрикаприлат/капрат/линолеат, глицерилтрикаприлат/капрат/стеарат, глицерилтрилаурат, глицерилтрилинолеат, глицерилтрилиноленат, глицерилтриолеат, глицерилтриундеканоат, глицериды линолевой кислоты, насыщенные полигликозилированные глицериды, синтетические среднецепочечные триглицериды, содержащие, главным образом, цепи С8-С12 жирных кислот, среднецепочечные триглицериды, длинноцепочечные триглицериды, модифицированные триглицериды, фракционированные триглицериды и их смеси.
Дисперсная фаза включает моноглицериды, диглицериды или триглицериды.
Очевидно, что в настоящем изобретении могут быть использованы другие приемлемые масла.
В предпочтительном варианте осуществления изобретения дисперсная фаза включает триглицерид каприловой/каприновой кислоты и/или изопропилмиристат (IPM).
Дисперсная фаза, например, может оказывать смягчающее, защитное, увлажняющее, укрепляющее или другое косметическое или фармацевтическое воздействие на кожу. Дисперсная фаза может также увеличивать вязкость композиции и может сообщать растворяющую способность активным веществам. Дисперсная фаза может содержать вещества, оказывающие согревающее или охлаждающее воздействие при нанесении на кожу (например, капсаицин или ментол).
Композиция может содержать по меньшей мере 1% мас. дисперсной фазы, более предпочтительно по меньшей мере 10% мас., по меньшей мере 25% мас., по меньшей мере 50% мас., по меньшей мере 80% мас. дисперсной фазы в расчете на общую массу композиции.
Композиции по настоящему изобретению могут быть неводными, по существу неводными или водными.
Термин ”неводная композиция” в значении, использованном в настоящем описании изобретения, означает композицию, которая совершенно не содержит воды и не содержит намеренно добавляемой воды. “Неводная композиция” в используемом здесь значении предпочтительно содержит менее 0,5% мас. воды в расчете на общую массу композиции, более предпочтительно менее 0,2% мас. воды, наиболее предпочтительно менее 0,1% мас. воды в расчете на общую массу композиции.
Термин ”по существу неводная композиция” в значении, использованном в настоящем описании изобретения, означает композицию, содержащую менее 5% мас., более предпочтительно менее 4,5% мас. воды в расчете на общую массу композиции.
Термин ”водная композиция” означает композицию, содержащую по меньшей мере 5% мас. воды в расчете на общую массу композиции. Водная композиция предпочтительно содержит по меньшей мере 10% или по меньшей мере 15% мас. воды в расчете на общую массу композиции. Водная композиция может содержать по меньшей мере 35% или по меньшей мере 40% мас. воды в расчете на общую массу композиции. Процентное содержание воды для водной композиции предпочтительно составляет от 5% до 90% мас., более предпочтительно от 5% до 50% мас. и наиболее предпочтительно от 8% до 20% мас. в расчете на общую массу композиции.
Один вариант осуществления настоящего изобретения относится к водной композиции, пригодной для местного применения, которая включает непрерывную фазу и по меньшей мере одну дисперсную фазу, при этом указанная композиция содержит по меньшей мере одну полиафроновую дисперсию, по меньшей мере один витамин D или аналог витамина D и по меньшей мере один кортикостероид. В данном варианте осуществления изобретения композиция предпочтительно содержит по меньшей мере 5% мас., более предпочтительно по меньшей мере 6%, еще предпочтительнее по меньшей мере 8% мас. воды в расчете на общую массу композиции.
Водная композиция, пригодная для местного применения, предпочтительно включает 60-95% мас. дисперсной фазы и 5-40% мас. непрерывной фазы в расчете на общую массу композиции, при этом композиция предпочтительно содержит 5-40%, 5-30% или 8-20% мас. воды в расчете на общую массу композиции, дисперсная фаза и/или непрерывная фаза содержит по меньшей мере один витамин D или аналог витамина D, по меньшей мере один кортикостероид и по меньшей мере одно поверхностно-активное вещество. Более предпочтительно водная композиция, пригодная для местного применения, содержит 70-90% мас. дисперсной фазы и 10-30% мас. непрерывной фазы в расчете на общую массу композиции, при этом указанная композиция предпочтительно включает по меньшей мере 5-30% мас. или 8-20% мас. воды в расчете на общую массу композиции, дисперсная фаза и/или непрерывная фаза включают по меньшей мере один витамин D или аналог витамина D, по меньшей мере один кортикостероид и по меньшей мере одно поверхностно-активное вещество.
Композиция по настоящему изобретению предпочтительно диспергируется в воде. Композиция по настоящему изобретению предпочтительно может быть разбавлена водой. Указанное свойство расширяет возможности применения настоящего изобретения, например, позволяет улучшить нанесение композиции на голову через волосы, делая волосы влажными, смыть препарат с любой местной поверхности в случае желания или необходимости либо легко удалить препарат, случайно попавший на одежду. Указанные преимущества повышают привлекательность препарата для пользователей и улучшают соблюдение субъектом схемы лечения.
Преимуществом водной композиции, содержащей по меньшей мере один витамин D или аналог витамина D, является лучшее проникновение лекарственного средства, контроль за проникновением лекарственного средства благодаря включению определенных усилителей проникновения или замедлителей проникновения и более приятное ощущение при нанесении на кожу.
Когда непрерывная или дисперсная фаза композиции включает воду, желательно контролировать значение рН в приемлемых пределах. Такой контроль желателен для получения устойчивой композиции. Было установлено, что устойчивые композиции по настоящему изобретению можно получить при значении рН композиции от 7,0 до 8,5, более предпочтительно от 7,25 до 7,75. Очевидно, что для регулирования значения рН в указанных пределах может быть использована любая приемлемая кислота или основание. Значение рН композиции обычно можно повысить, добавляя основание, которое может быть триэтаноламином. Другие приемлемые основания включают, не ограничиваясь ими, трисгидроксиметиламинометан (трис) и гидроксид натрия. Значение рН композиции можно предпочтительно стабилизировать путем введения в водную фазу приемлемого буфера. Специалистам в данной области должны быть известны приемлемые буферные системы, имеющие значение рН в пределах указанного диапазона.
Непрерывная фаза может включать или в основном состоять из фармацевтически приемлемой жидкости, которая смешивается или по существу смешивается с водой и предпочтительно является соединением формулы R1-OH, где R1 означает С1-С10 алкил, и/или соединение формулы НО-R2-H, где R2 означает -(С2Н4)n или -(С3Н6)n, где n равно 1-100, предпочтительно 1-25. R1 и R2 могут иметь линейную или разветвленную цепь. R1 предпочтительно означает С1-С4 алкил. n предпочтительно равно 1-25. Непрерывная фаза предпочтительно включает пропиленгликоль, полиэтиленгликоль, глицерин, этанол, изопропиловый спирт или их смесь. Полиэтиленгликоль или полипропиленгликоль, образующий непрерывную фазу, предпочтительно является жидким при комнатной температуре (20°С). Полиэтиленгликоль, например, может содержать 1-12 звеньев этиленоксида или пропиленоксида и/или может иметь молекулярную массу до 600.
В одном варианте осуществления настоящего изобретения композиция и предпочтительно полиафроновая дисперсия включает 0-60% мас., предпочтительно 0-20% мас., более предпочтительно 0-15% мас. С1-С4 спирта, этиленгликоля, жидкого полиэтиленгликоля, пропиленгликоля, жидкого полипропиленгликоля, диэтиленгликоля, простого этилового моноэфира или их смесей. Одним преимуществом композиции по настоящему изобретению по сравнению с известными композициями является то, что нет необходимости использовать большое количество спирта в качестве вещества, усиливающего проникновение через кожу. Известно, что спирт вызывает раздражение при нанесении на поврежденную кожу. Преимуществом композиций по настоящему изобретению является то, что лучшее проникновение может быть обеспечено даже без использования спирта или без использования большого количества спирта. Было установлено, что для достижения благоприятного результата композиция по настоящему изобретению может включать 0-25% мас. спирта, более предпочтительно 0-15% мас. в расчете на общую массу композиции. Спирт предпочтительно является изопропанолом и/или пропиленгликолем. Такие композиции обладают улучшенными свойствами доставки лекарственного средства.
Очевидно, что в непрерывной фазе полиафронов могут быть использованы другие приемлемые гидрофильные растворители.
Поверхностно-активное вещество, используемое в настоящем изобретении, может быть введено в одну или обе фазы полиафроновой дисперсии. Приемлемые поверхностно-активные вещества включают простой алкиловый эфир полигликоля, сложный алкиловый эфир полигликоля, этоксилированный спирт, сложный эфир жирной кислоты полиоксиэтиленсорбитана, сложный эфир жирной кислоты полиэтиленоксида, ионогенное или неионогенное поверхностно-активное вещество, аддукт гидрированного касторового масла/полиоксиэтиленгликоля, содержащий 25-60 этоксильных групп, аддукт касторового масла/полиоксиэтиленгликоля, содержащий 25-45 этоксильных групп, сложный эфир жирной кислоты сорбитана (например, Спан 20 или Спан 80), блок-сополимер этиленоксида и пропиленоксида (например, Плюроник L121 или Плюроник F68) или их смесь.
Очевидно, что могут быть использованы другие приемлемые поверхностно-активные вещества.
Композиции по настоящему изобретению предпочтительно содержат менее 4% мас. поверхностно-активного вещества, более предпочтительно менее 3% мас., еще предпочтительнее менее 2% мас. от общей массы композиции.
Композиция по настоящему изобретению может включать по меньшей мере один витамин D или аналог витамина D, главным образом, в непрерывной фазе или, главным образом, в дисперсной фазе. Наиболее предпочтительно по меньшей мере один витамин D или аналог витамина D присутствует, главным образом, в дисперсной фазе.
Аналогом витамина D, используемым в композиции по настоящему изобретению, например, может быть кальципотриол, сеокальцитол, кальцитриол, моногидрат кальципотриол, такальцитол, максакальцитол, парикальцитол, фалекальцитриол, бекокальцидиол, 1α,24S-дигидрокси-витамин D2, 1(S),3(R)-дигидрокси-20(R)-[((3-(2-гидрокси-2-пропил)фенил)метокси)метил]-9,10-секопрегна-5(Z),7(E),10(19)-триен или их смесь. Более предпочтительно аналогом витамина D является кальципотриол, кальцитриол, такальцитол, максакальцитол, 1α,24S-дигидрокси-витамин D2, 1(S),3(R)-дигидрокси-20(R)-[((3-(2-гидрокси-2-пропил)фенил)метокси)метил]-9,10-секопрегна-5(Z),7(E),10(19)-триен или их смесь. Наиболее педпочтительно аналогами витамина D являются кальципотриол и моногидрат кальципотриола. Другие примеры приемлемых аналогов витамина D приведены в патенте США US-B-6753013.
Синтетические аналоги витамина D более предпочтительны в композициях по настоящему изобретению, чем природный витамин D или производные витамина D, так как терапевтическое действие указанных последними веществ может быть менее избирательным при лечении кожных заболеваний, таких как псориаз.
Композиция по настоящему изобретению может содержать 0,0001-0,05% мас. витамина D или аналога витамина D, предпочтительно 0,001-0,01% мас. и более предпочтительно 0,0025-0,005% мас. от общей массы композиции.
Кортикостероид может находиться, главным образом, в непрерывной фазе или, главным образом, в дисперсной фазе. Кортикостероид предпочтительно находится, главным образом, в дисперсной фазе. Более предпочтительно как кортикостероид, так и витамин D или аналог витамина D присутствуют, главным образом, в дисперсной фазе. Массовые отношения кортикостероида к витамину D или аналогу витамина D предпочтительно находятся в пределах от 4:1 до 50:1, более предпочтительно от 8:1 до 20:1 и наиболее предпочтительно от 9:1 до 11:1.
Кортикостероид предпочтительно выбирают из одного или нескольких веществ, включающих бетаметазон (9-фтор-11,17,21-тригидрокси-16-метилпрегна-1,4-диен-3,20-дион) или его сложные эфиры, такие как 21-ацетат, 17-адамантоат, 17-бензоат, 17-валерат и 17,21-дипропионат; алклометазон или его сложные эфиры, такие как 17,21-дипропионат; клобетазол или его сложные эфиры, такие как пропионат; клобетазон или его сложные эфиры, такие как 17-бутират; дезоксиметазон; дифлукортолон или его сложные эфиры, диафлоразон или его сложные эфиры, такие как 17,21-диацетат; флуоцинонид; флуметазон или его сложные эфиры, такие как 21-пивалат; флуоцинолон или его простые эфиры, такие как ацетонид; флутиказон или его сложные эфиры, такие как 17-пропионат; флупредниден или его сложные эфиры, такие как 21-ацетат; галцинонид; гидрокортизон или его сложные эфиры, такие как 17-бутират; мометазон или его сложные эфиры, такие как 17-(2-фуроат); и триамцинолон или его простые эфиры или сложные эфиры, такие как ацетонид. Могут быть выбраны кортикостероиды, отдающие оксид азота, такие как TPI 1020 (NicOx). Более предпочтительно кортикостероид выбирают из одного или нескольких веществ, включающих бетаметазон или его сложные эфиры, такие как 17-валерат или 17,21-дипропионат; клобетазол или его сложные эфиры, такие как пропионат; триамцинолон или его простые эфиры или сложные эфиры, такие как ацетонид или ацетонид-21-N-бензоил-2-метилаланинат или ацетонид-21-(3,3-диметилбутират); или гидрокортизон или его сложные эфиры, такие как 17-бутират. Наиболее предпочтительно кортикостероидом является 17,21-дипропионат бетаметазона.
Композиция по настоящему изобретению предпочтительно содержит 0,001-1,0% мас. кортикостероида, более предпочтительно 0,01-0,075% мас. и еще предпочтительнее 0,025-0,05% мас. от общей массы композиции.
Композиция по настоящему изобретению может далее включать гелеобразователь и/или модификатор реологии, такой как модификатор вязкости.
Гелеобразователь может быть выбран, например, из альгинатных смол или их солей, гуаровой камеди, камеди робинии, ксантановой камеди, аравийской камеди, желатина, гидроксиметилцеллюлозы, гидроксиэтилцеллюлозы, гидроксипропилцеллюлозы, карбоксиметилцеллюлозы или ее солей, бентонитов, алюмосиликатов магния, ”карбомеров” (солей сшитых полимеров акриловой кислоты) или глицерилполиметакрилатов или их дисперсий в гликолях. Очевидно, что могут быть использованы другие приемлемые гелеобразователи. Кроме того, было установлено, что некоторые гелеобразователи (например, карбомеры) могут также действовать в качестве химических буферов, препятствуя нежелательному изменению значения рН композиции во время хранения и применения.
Композиция по настоящему изобретению предпочтительно содержит 0,05-5,0% мас. гелеобразователя, более предпочтительно 0,1-2,0% мас. и еще предпочтительнее 0,2-1,0% мас. от общей массы композиции.
В одном варианте осуществления настоящего изобретения композиция имеет консистенцию геля. Гелеподобная консистенция может быть получена из одной, двух, трех или более полиафроновых дисперсий. Указанная композиция предпочтительно является водной композицией.
Композиция по настоящему изобретению может быть использована при осуществлении способа терапевтического лечения человека или животного. Кроме того, композиция по настоящему изобретению может быть использована при лечении псориаза. Композиция по настоящему изобретению может быть также использована для получения лекарственного средства для лечения псориаза.
В одном варианте осуществления настоящего изобретения композиция по настоящему изобретению может быть нанесена на кожу головы или другой участок кожи через волосы. В указанном варианте осуществления изобретения волосы предпочтительно смачивают (например, водой с шампунем или без шампуня и затем сушат полотенцем). Затем на кожу головы наносят соответствующее количество продукта и втирают в кожу головы через волосы. Волосы могут быть высушены естественным путем или с помощью фена. Диспергируемая в воде композиция позволяет равномерно распределить активные вещества в коже при выполнении данного способа. Альтернативно или дополнительно композицию можно втереть в кожу головы через сухие волосы и оставить на определенное время (которое может составлять от 8 до 12 часов), после чего избыток или оставшуюся часть композиции смывают водой с шампунем или без шампуня. Композицию по настоящему изобретению используют для лечения животного предпочтительно в виде стандартной лекарственной формы.
Композиции по настоящему изобретению могут также включать другие добавки, такие как консерванты (например, для предотвращения микробиологической порчи), буферы (для регулирования значения рН и во избежание неустойчивости и повреждения кислотной среды кожи), антиоксиданты и усилители проникновения. Указанные добавки могут быть введены в непрерывную или дисперсную фазу полиафроновой дисперсии.
Очевидно, что количество и тип вводимых добавок должны соответствовать критериям эффективности и пользы. Необходимо внимательно подходить к выбору и определению количества указанных добавок во избежание отрицательного воздействия на другие характеристики настоящего изобретения.
В одном варианте осуществления настоящего изобретения витамин D или аналог витамина D по настоящему изобретению диспергируют и/или растворяют в дисперсной фазе первой полиафроновой дисперсии. Кортикостероид диспергируют и/или растворяют в дисперсной фазе второй полиафроновой дисперсии. Затем первую и вторую полиафроновые дисперсии смешивают с образованием композиции по настоящему изобретению. В композиции по настоящему изобретению может также присутствовать третья или последующие полиафроновые дисперсии. Третья или последующие полиафроновые дисперсии могут включать, например, такие вещества, как смягчающие масла (для лучшего ощущения), защитные масла, предотвращающие дегидратацию кожи и улучшающие проникновение в кожу активных веществ, согревающие или охлаждающие кожу вещества или солнцезащитные вещества. Указанные вещества предпочтительно присутствуют в дисперсной фазе полиафроновых дисперсий.
В одном варианте осуществления настоящего изобретения аналогом витамина D является кальципотриол или моногидрат кальципотриола.
В особенно предпочтительной композиции дисперсную фазу образует триглицерид каприловой/каприновой кислоты, непрерывную фазу образует деминерализованная вода, аналогом витамина D является кальципотриол и кортикостероидом является дипропионат бетаметазона.
В одном варианте осуществления настоящего изобретения композиция включает по меньшей мере одну дисперсную фазу, которая содержит по меньшей мере одно из веществ, представляющих собой триглицериды каприновой/каприловой кислоты, сквалан, диметикон, циклометикон, и смеси двух или более вышеуказанных веществ, аналогом витамина D является кальципотриол и кортикостероидом является дипропионат бетаметазона. Предпочтительными поверхностно-активными веществами в указанном варианте осуществления изобретения являются Laureth-4 и Poloxamer 188. Непрерывная фаза предпочтительно включает воду. Такой вариант осуществления изобретения представлен в примере 1. Такая композиция остается устойчивой в течение длительного периода времени, например в течение 3 месяцев, 6 месяцев или 9 месяцев. Указанная композиция характеризуется хорошей растворимостью активных веществ и лучшим проникновением через кожу, вызывает приятное ощущение на коже во время и после нанесения.
В другом варианте осуществления изобретения композиция по настоящему изобретению включает по меньшей мере одну дисперсную фазу, которая содержит по меньшей мере одно из веществ, представляющих собой триглицериды каприновой/каприловой кислоты, сквалан, диметикон, изопропилмиристат, циклометикон, и смеси двух или более вышеуказанных веществ, аналогом витамина D является кальципотриол и кортикостероидом является дипропионат бетаметазона, предпочтительными поверхностно-активными веществами в указанном варианте осуществления изобретения являются Laureth-4 и Poloxamer 188. Непрерывная фаза предпочтительно включает воду и полиакриловую кислоту, нейтрализованную триэтаноламином, в результате чего образуется гель с контролируемой вязкостью. Такой вариант осуществления изобретения представлен в примере 3. В указанной композиции использована водно-гелевая фаза для достижения большей кремоподобной вязкости и буферной емкости с великолепным значением рН.
В другом варианте осуществления изобретения композиция по настоящему изобретению включает по меньшей мере одну дисперсную фазу, которая содержит по меньшей мере одно из веществ, представляющих собой триглицериды каприновой/каприловой кислоты, сквалан, диметикон, изопропилмиристат и циклометикон, и смеси двух или более вышеуказанных веществ, аналогом витамина D является кальципотриол и кортикостероидом является дипропионат бетаметазона, предпочтительными поверхностно-активными веществами в указанном варианте осуществления изобретения являются Laureth-4 и Poloxamer 188. Непрерывная фаза предпочтительно включает воду и ксантановую камедь, в результате чего образуется гель с контролируемой вязкостью. Такой вариант осуществления изобретения представлен в примере 5. Было установлено, что использование ксантана обеспечивает великолепную устойчивость при более низкой вязкости, что необходимо в случае применения в качестве лосьона, а не крема.
В другом варианте осуществления изобретения композиция по настоящему изобретению включает по меньшей мере одну дисперсную фазу, которая содержит по меньшей мере одно из веществ, представляющих собой триглицериды каприновой/каприловой кислоты, сквалан, диметикон, силиконовый эластомер, изопропилмиристат и циклометикон, и смеси двух или более вышеуказанных веществ, аналогом витамина D является кальципотриол и кортикостероидом является дипропионат бетаметазона, предпочтительными поверхностно-активными веществами в указанном варианте осуществления изобретения являются Laureth-4 и Poloxamer 188. Непрерывная фаза предпочтительно включает воду, изопропиловый спирт и полиакриловую кислоту, нейтрализованную триэтаноламином, в результате чего образуется гель с контролируемой вязкостью. Такой вариант осуществления изобретения представлен в примере 13. Силиконовый эластомер добавляют в дисперсную фазу для улучшения косметических свойств продукта. Продукт, полученный в соответствии с данным вариантом осуществления изобретения, характеризуется приятным ощущением после нанесения (остаточное ощущение, воспринимаемое кожей после нанесения продукта) и улучшенными защитными свойствами.
В другом варианте осуществления изобретения композиция по настоящему изобретению включает дисперсную фазу, которая содержит изопропилмиристат и по меньшей мере одно из веществ, представляющих собой сквалан, диметикон, силиконовый эластомер и циклометикон. В указанном варианте осуществления изобретения кортикостероидом является дипропионат бетаметазона, аналогом витамина D является кальципотриол, и предпочтительными поверхностно-активными веществами являются Laureth-4 и Poloxamer 188. Непрерывная фаза предпочтительно включает воду и полиакриловую кислоту, нейтрализованную триэтаноламином, в результате чего образуется гель с контролируемой вязкостью. Продукт, полученный в соответствии с таким вариантом осуществления изобретения, характеризуется значительно лучшим проникновением по сравнению с другими вариантами осуществления изобретения.
Одним объектом настоящего изобретения является способ получения композиции, рассмотренной в настоящем описании изобретения, который включает следующие стадии:
(i) получение гидрофильного растворителя, необязательно содержащего по меньшей мере один витамин D или аналог витамина D, по меньшей мере один кортикостероид и/или поверхностно-активное вещество;
(ii) получение гидрофобного растворителя, необязательно содержащего по меньшей мере один витамин D или аналог витамина D, по меньшей мере один кортикостероид и/или поверхностно-активное вещество;
(iii) смешивание гидрофильного растворителя с гидрофобным растворителем в условиям, приемлемых для образования композиции, содержащей по меньшей мере одну полиафроновую дисперсию, по меньшей мере один витамин D или аналог витамина D, и по меньшей мере один кортикостероид.
Приемлемые способы получения полиафроновых дисперсий описаны в патенте США US-A-4486333. Специалистам в данной области должно быть понятно, что там, где это возможно, могут быть использованы другие способы получения.
Другим объектом настоящего изобретения является способ получения композиции, рассмотренной в настоящем описании изобретения, который включает следующие стадии:
получение первой полиафроновой дисперсии, содержащей витамин D или аналог витамина D;
получение второй полиафроновой дисперсии, содержащей кортикостероид;
и смешивание первой и второй полиафроновых дисперсий с образованием композиции.
Данный способ может далее включать:
получение третьей или последующей полиафроновой дисперсии, содержащей один или несколько активных агентов, таких как солнцезащитное вещество, охлаждающее вещество, согревающее вещество, противозудное средство, вещество, придающее продукту эстетический вид, косметическое средство, пенообразователь, ароматизатор, краситель, антиоксидант или смягчающее масло, и смеси указанных веществ;
и смешивание третьей или последующей полиафроновой дисперсии с указанными первой и второй полиафроновыми дисперсиями с образованием композиции. Композиция, рассмотренная в настоящем описании изобретения, может быть нанесена на кожу в виде аэрозоля или распыляемого раствора. Например, в EP 1575542 описано введение вспененной бинарной жидкости в аэрозоли.
Композиция по настоящему изобретению может быть введена в аэрозоли путем добавления воды и газообразного пропеллента (например, бутана).
Композиция по настоящему изобретению может быть получена, например, в форме лосьона или крема. Указанная композиция может храниться в любом приемлемом сосуде, пробирке, флаконе, саше, аэрозоле, распылителе или герметичной емкости нагнетательного типа. Для сохранения композиции в устойчивом состоянии предпочтительно предотвращают попадание кислорода в емкость. Композиции по настоящему изобретению предпочтительно герметично закупоривают в воздухонепроницаемых емкостях для предотвращения разложения композиций до их использования.
Настоящее изобретение далее будет описано на основании примеров со ссылкой на следующие фигуры.
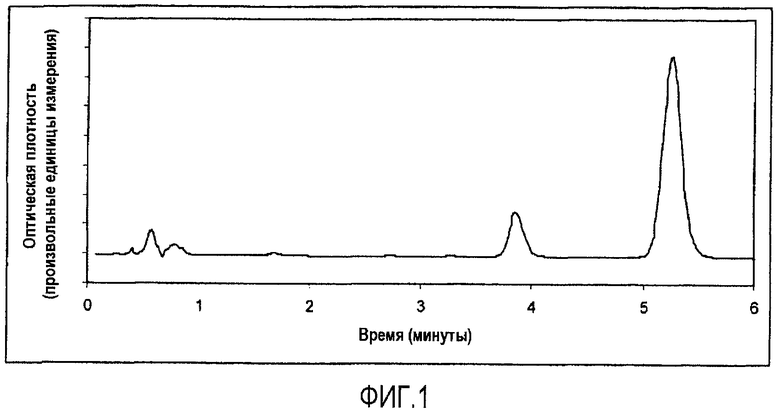
На фигуре 1 изображена хроматограмма ВЭЖХ устойчивого образца (пример 7). Показаны пики для кальципотриола (3,9 мин) и дипропионата бетаметазона (BDP) (5,3 мин). Отсутствуют какие-либо признаки разложения продукта. Условия выполнения ВЭЖХ: колонка: NovaPak C18, размер частиц 4 мк, размеры колонки 3,9×150 мм (Waters), подвижная фаза: 55% ацетонитрила в воде. Скорость потока: 1 мл/минуту. Температура колонки: 25°С.
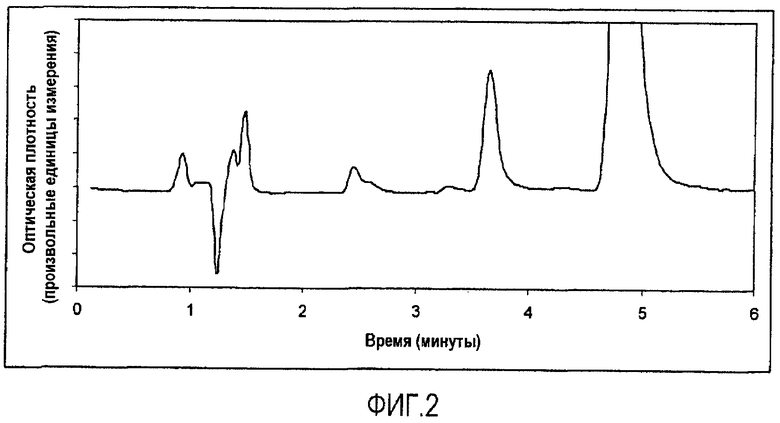
На фигуре 2 изображена хроматограмма ВЭЖХ неустойчивого образца. Показано разложение дипропионата бетаметазона (дополнительный пик и плечо пика, соответствующие 2,5 мин) и некоторые признаки разложения кальципотриола (очень незначительный пик, соответствующий 3,3 мин). Условия выполнения ВЭЖХ: колонка: NovaPak C18, размер частиц 4 мк, размеры колонки 3,9×150 мм (Waters), подвижная фаза: 55% ацетонитрила в воде. Скорость потока: 1 мл/минуту. Температура колонки: 25°С.
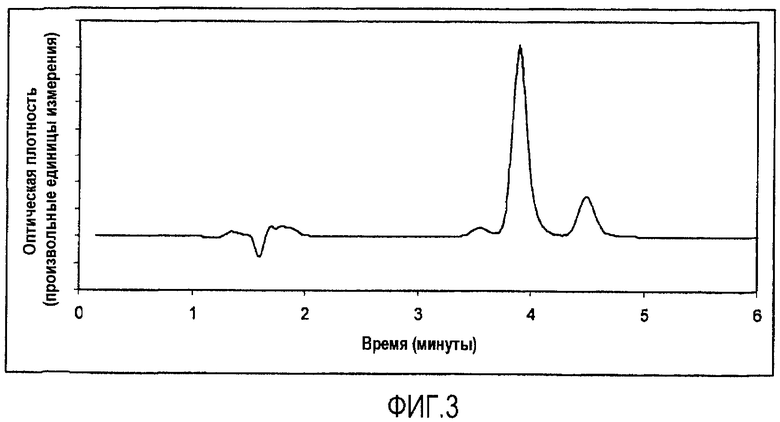
На фигуре 3 изображена хроматограмма ВЭЖХ разложения кальципотриола, о чем свидетельствует наличие посторонних пиков (4,5 мин и 3,6 мин) с обеих сторон главного пика кальципотриола (3,9 мин). В данном образце отсутствовал дипропионат бетаметазона (BDP), поэтому указанные пики не могут быть следствием разложения BDP. Условия выполнения ВЭЖХ: колонка: NovaPak C18, размер частиц 4 мк, размеры колонки 3,9×150 мм (Waters), подвижная фаза: 55% ацетонитрила в воде. Скорость потока: 1 мл/минуту. Температура колонки: 25°С.
Определение устойчивости
В настоящем изобретении продукт считается устойчивым при хранении в случае соответствия следующим критериям.
Продукт хранят в закрытых воздухонепроницаемых стеклянных емкостях, в которых свободное пространство составляет не более 5% от общего используемого объема емкости.
Продукт и вышеуказанную емкость хранят при постоянной температуре, равной 40°С, в стандартном лабораторном термостате (например, воздушный термостат 'Function Line' Heraeus модели UT6, контроль температуры в пределах ±0,3°С при 150°С).
Продукт исследуют в конце испытания. Период испытания равен по меньшей мере 3 месяцам и предпочтительно по меньшей мере 6 месяцам от даты начала хранения.
Ниже приведены критерии успешного хранения:
Все хранившиеся образцы, которые удовлетворяют вышеуказанным критериям в приведенных выше условиях испытания, считаются устойчивыми при хранении в соответствии с целями настоящего изобретения.
В руководстве Американской администрации по пищевым продуктам и лекарственным средствам ”Guidance for Industry Q1A (R2) Stability Testing of New Drug Substance and Products”, которое хотя и не является обязательным для исполнения, указаны более строгие условия хранения, которые включают хранение при конкретных температурах (например, 40°С) в течение конкретного периода времени (6 месяцев) и при контролируемой относительной влажности (относительная влажность 75%). В руководстве Европейского агентства по оценке лекарственных продуктов ICH Q1A (R2) ”Stability Testing Guidelines: Stability Testing of New Drug Substances and Products” указаны идентичные условия для более строгого испытания на сохранность. Вышеуказанный метод испытания на сохранность в соответствии с целями настоящего изобретения не включает контроль относительной влажности, так как продукт хранится в закрытых стеклянных емкостях, стенки и пробки которых являются непроницаемыми для прохождения водяного пара.
Вышеуказанное определение устойчивости при хранении специально предназначено для целей настоящего изобретения. Однако данные о хранении в некоторых примерах были получены при замене закрытых стеклянных емкостей (лабораторного стеклянного стакана) герметично закрытыми пробирками Эппердорфа. Данный метод был использован для относительно небольших количеств образца и обоснованно соответствует методу, указанному в определении, так как пробирки Эппендорфа также создают непроницаемый барьер для водяного пара и других компонентов композиции. Метод исследования для пробирок Эппендорфа (пластик) идентичен методу, указанному в определении.
Настоящее изобретение далее проиллюстрировано приведенными ниже примерами.
ПРИМЕР 1
Три гелевые полиафроновые дисперсии нижеследующих составов были получены описанным ниже способом.
** Содержание дипропионата бетаметазона в конечной композиции равно 643 мкг/г (что эквивалентно 500 мкг/г бетаметазона).
Способ получения
Три полиафроновые дисперсии были получены отдельно описанным ниже способом.
В 250-мл низкий лабораторный стакан (внутренний диаметр 6,5 см) вводили водную (непрерывной) фазу в количестве, необходимом для получения 30 г полиафронового геля. Водную фазу перемешивали со скоростью 200 оборотов/мин при помощи четырехлопастной мешалки с диаметром 6,0 см и одновременно из пастеровской пипетки по каплям добавляли масляную (дисперсную) фазу. Скорость добавления в начале процесса была медленной (примерно одна капля через каждые 7 секунд), но после добавления 10% масляной фазы скорость увеличивали, в результате чего общее время получения полиафронового геля было равно примерно 20 минутам.
До получения каждой гелевой полиафроновой дисперсии все активные вещества растворяли в соответствующей фазе, осторожно перемешивая в закрытом лабораторном стакане при помощи магнитной мешалки при комнатной температуре в течение ночи.
Для получения конечного продукта смешивали три отдельные полиафроновые дисперсии.
Измерения устойчивости - условия 1а
Измерения устойчивости производили описанным ниже способом. В приведенном примере данные устойчивости при хранении были получены при использовании пробирки Эппендорфа.
Кальципотриол и бетаметазон экстрагировали из композиции, полученной в примере 1, в изопропанол и анализировали методом ВЭЖХ в указанных ниже условиях.
Условия выполнения ВЭЖХ:
Колонка: NovaPak C18, размер частиц 4 мк, размеры колонки 3,9×150 мм (Waters).
Подвижная фаза: 47% ацетонитрила в воде.
Скорость потока: 1 мл/минуту.
Температура колонки: 25°С.
Время удерживания для кальципотриола было равно 6,8 минуты.
Время удерживания для бетаметазона было равно 9,9 минуты.
Было установлено, что после хранения в течение 2 месяцев при 40°С уровни кальципотриола и бетаметазона составляли, соответственно, 102%±3% и 99%±1% от первоначальных уровней.
Измерения устойчивости - условия 1b
Измерения устойчивости производили описанным ниже способом. Образцы хранили в (воздухонепроницаемых) лабораторных стеклянных стаканах в соответствующем термостате при 40°С в соответствии с приведенным выше описанием.
Кальципотриол и бетаметазон экстрагировали из композиции, полученной в примере 1, в изопропанол, перемешивая образец в изопропаноле, затем обрабатывали ультразвуком и центрифугировали. Аликвоты супернатанта анализировали методом ВЭЖХ в указанных ниже условиях.
Условия выполнения ВЭЖХ:
Колонка: NovaPak C18, размер частиц 4 мк, размеры колонки 3,9×150 мм (Waters).
Подвижная фаза: 55% ацетонитрила в воде.
Скорость потока: 1 мл/минуту.
Температура колонки: 25°С.
Время удерживания для кальципотриола было равно 3,9 минуты.
Время удерживания для бетаметазона было равно 5,3 минуты.
Было установлено, что после хранения в течение 2 месяцев при 40°С уровни кальципотриола и бетаметазона составляли, соответственно, 102%±3% и 99%±1% от первоначальных уровней.
ПРИМЕР 2
** Содержание BDP в конечной композиции равно 502 мкг/г.
Способ получения
Способ получения был аналогичен описанному в приведенном выше примере 1 за исключением того, что к конечной смеси трех гелевых полиафроновых дисперсий 1, 2 и 3 добавляли пропиленгликоль и нейтрализованный водный гель и смешивали путем простого перемешивания до образования гомогенной смеси полиафроновых дисперсий.
Нейтрализованный гель получали, добавляя триэтаноламин (основание) к дисперсии полиакриловой кислоты с образованием прозрачного геля, имеющего значение рН, равное 7,5±0,2. Специалистам в данной области известен способ нейтрализации гелей полиакриловой кислоты.
Измерения устойчивости
Устойчивость испытывали способом, описанным в примере 1b.
Было установлено, что после хранения в течение 3,5 месяцев при 40°С в лабораторных стеклянных стаканах уровни кальципотриола и дипропионата бетаметазона составляли, соответственно, 104±12% и 95±2% от первоначальных уровней.
В настоящее время продолжается испытание устойчивости данного образца.
В публикации Симонсена и др., Drug Development and Industrial Pharmacy, 30(10) (2004) 1095-1102, указано, что введение пропиленгликоля в продукт, содержащий кальципотриол и бетаметазон, вызывает быстрое разложение одного из двух активных веществ в зависимости от значения рН, хотя пропиленгликоль является очень хорошим усилителем скорости потока. Авторы вышеуказанной публикации пришли к выводу, что невозможно вводить пропиленгликоль в созданный ими продукт. Приведенный пример показывает, что авторы настоящего изобретения преодолели указанную проблему. В таблице 2, приведенной в примере 2 патента США US-B-6753013, проиллюстрировано разложение кальципотриола в продукте, содержащем кальципотриол, дипропионат бетаметазона и пропиленгликоль, после хранения в течение 2,5 месяца при 40°С.
ПРИМЕР 3
Три гелевые полиафроновые дисперсии и водный гель нижеследующих составов были получены описанным ниже способом.
** Содержание дипропионата бетаметазона в конечной композиции равно 690 мкг/г (что эквивалентно 537 мкг/г бетаметазона).
Способ получения
Способ получения был аналогичен описанному в приведенном выше примере 1 за исключением того, что к конечной смеси трех гелевых полиафроновых дисперсий 1, 2 и 3 добавляли нейтрализованный водный гель и смешивали путем простого перемешивания до образования гомогенной смеси полиафроновых дисперсий.
Измерения устойчивости
Устойчивость испытывали способом, описанным в примере 1b.
Было установлено, что после хранения в течение 9 месяцев при 40°С в герметично закрытом лабораторном стеклянном стакане уровни кальципотриола и дипропионата бетаметазона составляли, соответственно, 97±7% и 105±6% от первоначальных уровней.
ПРИМЕР 4
Три гелевые полиафроновые дисперсии нижеследующих составов были получены описанным ниже способом.
** Содержание дипропионата бетаметазона в конечной композиции равно 730 мкг/г (что эквивалентно 568 мкг/г бетаметазона).
Способ получения
Способ получения был аналогичен описанному в примере 1.
Измерения устойчивости
Устойчивость испытывали способом, описанным в примере 1b.
Было установлено, что после хранения в течение 4,5 месяца при 40°С в герметично закрытом лабораторном стеклянном стакане уровни кальципотриола и дипропионата бетаметазона составляли, соответственно, 100% и 119% от первоначальных уровней.
Через 6 месяцев уровни кальципотриола и дипропионата бетаметазона составляли, соответственно, 42% и 65% от первоначальных уровней.
В настоящее время продолжается испытание устойчивости данного образца при комнатной температуре.
ПРИМЕР 5
Три гелевые полиафроновые дисперсии и водный гель нижеследующих составов были получены описанным ниже способом.
** Содержание дипропионата бетаметазона в конечной композиции равно 709 мкг/г (что эквивалентно 551 мкг/г бетаметазона).
Способ получения
Способ получения был аналогичен описанному в приведенном выше примере 1 за исключением того, что к конечной смеси трех гелевых полиафроновых дисперсий 1, 2 и 3 добавляли нейтрализованный водный гель и смешивали путем простого перемешивания до образования гомогенной смеси полиафроновых дисперсий.
ПРИМЕР 6
Три гелевые полиафроновые дисперсии и водный гель нижеследующих составов были получены описанным ниже способом.
** Содержание дипропионата бетаметазона в конечной композиции равно 783 мкг/г (что эквивалентно 609 мкг/г бетаметазона).
Способ получения
Способ получения был аналогичен описанному в приведенном выше примере 1 за исключением того, что к конечной смеси трех гелевых полиафроновых дисперсий 1, 2 и 3 добавляли нейтрализованный водный гель и смешивали путем простого перемешивания до образования гомогенной смеси полиафроновых дисперсий.
Измерения устойчивости
Устойчивость испытывали способом, описанным в примере 1а, образцы хранили в герметично закрытых пробирках Эппендорфа.
Было установлено, что после хранения в течение 3 месяцев при 40°С уровни кальципотриола и бетаметазона составляли, соответственно, 101% и 106% от первоначальных уровней. В настоящее время продолжается испытание устойчивости данного образца.
После хранения в течение 6 месяцев при 40°С уровни кальципотриола и бетаметазона составляли, соответственно, 107% и 100% от первоначальных уровней.
ПРИМЕР 7
Три гелевые полиафроновые дисперсии и водный гель нижеследующих составов были получены описанным ниже способом.
** Содержание дипропионата бетаметазона в конечной композиции равно 723 мкг/г (что эквивалентно 562 мкг/г бетаметазона).
Способ получения
Способ получения был аналогичен описанному в приведенном выше примере 1 за исключением того, что к конечной смеси трех гелевых полиафроновых дисперсий 1, 2 и 3 добавляли нейтрализованный водный гель и смешивали путем простого перемешивания до образования гомогенной смеси полиафроновых дисперсий.
Измерения устойчивости
Устойчивость испытывали способом, описанным в примере 1а, образцы хранили в герметично закрытых пробирках Эппендорфа.
Было установлено, что после хранения в течение 3 месяцев при 40°С уровни кальципотриола и бетаметазона составляли, соответственно, 96% и 103% от первоначальных уровней. В настоящее время продолжается испытание устойчивости данного образца. Дальнейшее испытание устойчивости после хранения в течение 6 месяцев при 40°С показало, что уровни кальципотриола и бетаметазона составляли, соответственно, 96% и 103% от первоначальных уровней.
ПРИМЕР 8
Коммерческий продукт (Dovobet (LEO Pharma), № партии ЕА5525).
Dovobet является коммерческим продуктом, продаваемым также под названиями Daivobet и Taclonex.
2. Кальципотриол (гидрат)
3. Простой полиоксипропилен-15-стеариловый эфир
4. α-Токоферол
5. Белый мягкий парафин
2. Кальципотриол (гидрат)
3. Простой полиоксипропилен-15-стеариловый эфир
4. α-Токоферол
5. Белый мягкий парафин
Образец коммерческого продукта хранили в герметично закрытом лабораторном стеклянном стакане при 40°С аналогично вышеописанным примерам.
После хранения в течение 3 месяцев образец анализировали методом экстракции, описанным в примере 1. Анализ методом ВЭЖХ (аналогичный вышеописанному) показал, что уровни кальципотриола и BDP в лекарственном средстве составляли, соответственно, 91% и 70% по сравнению с анализами только что полученного образца.
ПРИМЕР 9
Одна гелевая полиафроновая дисперсия нижеследующего состава была получена описанным ниже способом.
** Содержание дипропионата бетаметазона в конечной композиции равно 1399 мкг/г (что эквивалентно 1088 мкг/г бетаметазона).
Способ получения
Полиафроновая дисперсия была получена способом, описанным в примере 1.
Измерения устойчивости
Измерения устойчивости выполняли способом, описанным в примере 1b.
Было установлено, что после хранения в течение 1 месяца при 40°С в герметично закрытом лабораторном стеклянном стакане происходило разделение композиции с образованием системы, содержащей значительную масляную фазу поверх полиафронового геля. В образце, хранившемся при комнатной температуре в течение 18 месяцев, уровни кальципотриола и бетаметазона составляли, соответственно, 97%±3% и 98%±3% от первоначальных уровней.
ПРИМЕР 10
** Содержание BDP в конечной композиции равно 692 мкг/г (что эквивалентно 538 мкг/г бетаметазона).
Способ получения
Способ получения был аналогичен описанному в приведенном выше примере 1 за исключением того, что к конечной смеси трех гелевых полиафроновых дисперсий 1, 2 и 3 добавляли нейтрализованный водный гель и смешивали путем простого перемешивания до образования гомогенной смеси полиафроновых дисперсий.
Измерения устойчивости
Устойчивость испытывали способом, описанным в примере 1b.
Было установлено, что после хранения в течение 2 месяцев при 40°С в герметично закрытом лабораторном стеклянном стакане уровни кальципотриола и дипропионата бетаметазона составляли, соответственно, 103±2% и 106±3% от первоначальных уровней. Далее после хранения в течение 6 месяцев при 40°С уровни кальципотриола и дипропионата бетаметазона составляли, соответственно, 106±2% и 105±3% от первоначальных уровней. В настоящее время продолжается испытание устойчивости данного образца.
ПРИМЕР 11
Три гелевые полиафроновые дисперсии и водный гель нижеследующих составов были получены описанным ниже способом.
** Содержание дипропионата бетаметазона в конечной композиции равно 656 мкг/г (что эквивалентно 510 мкг/г бетаметазона).
Способ получения
Способ получения был аналогичен описанному в приведенном выше примере 1 за исключением того, что к конечной смеси трех гелевых полиафроновых дисперсий 1, 2 и 3 добавляли буфер и смешивали путем простого перемешивания до образования гомогенной смеси полиафроновых дисперсий.
Измерения устойчивости
Устойчивостьь испытывали способом, описанным в примере 1b.
Было установлено, что после хранения в течение 6 месяцев при 40°С в герметично закрытом лабораторном стеклянном стакане уровни кальципотриола и бетаметазона составляли, соответственно, 106±2% и 105±1% от первоначальных уровней.
ПРИМЕР 12
Три гелевые полиафроновые дисперсии нижеследующих составов были получены описанным ниже способом.
** Содержание дипропионата бетаметазона в конечной композиции равно 782 мкг/г (что эквивалентно 608 мкг/г бетаметазона).
Способ получения
Способ получения был аналогичен описанному в приведенном выше примере 1 за исключением введения гелевой фазы.
Измерения устойчивости
Устойчивость испытывали способом, описанным в примере 1а.
Было установлено, что после хранения в течение 6 месяцев при 40°С в герметично закрытой пробирке Эппендорфа уровни кальципотриола и бетаметазона составляли, соответственно, 106% и 117% от первоначальных уровней. В настоящее время продолжается испытание устойчивости данного образца.
ПРИМЕР 13
Три гелевые полиафроновые дисперсии и водный гель нижеследующих составов были получены описанным ниже способом.
** Содержание дипропионата бетаметазона в конечной композиции равно 782 мкг/г (что эквивалентно 608 мкг/г бетаметазона).
Способ получения
Способ получения был аналогичен описанному в приведенном выше примере 1 за исключением того, что к конечной смеси трех гелевых полиафроновых дисперсий 1, 2 и 3 добавляли нейтрализованный водный гель и смешивали путем простого перемешивания до образования гомогенной смеси полиафроновых дисперсий.
Измерения устойчивости
Устойчивость испытывали способом, описанным в примере 1а.
Было установлено, что после хранения в течение 6 месяцев при 40°С в герметично закрытой пробирке Эппендорфа уровни кальципотриола и бетаметазона составляли, соответственно, 104% и 116% от первоначальных уровней. В настоящее время продолжается испытание устойчивости при хранении.
ПРИМЕР 14
Три гелевые полиафроновые дисперсии и водный гель нижеследующих составов были получены описанным ниже способом.
** Содержание дипропионата бетаметазона в конечной композиции равно 534 мкг/г (что эквивалентно 415 мкг/г бетаметазона).
Способ получения
Способ получения был аналогичен описанному в приведенном выше примере 1 за исключением того, что к конечной смеси трех гелевых полиафроновых дисперсий 1, 2 и 3 добавляли нейтрализованный водный гель и смешивали путем простого перемешивания до образования гомогенной смеси полиафроновых дисперсий.
Измерения устойчивости
Устойчивость испытывали способом, описанным в примере 1а.
Было установлено, что после хранения в течение 3,5 недель при 40°С в герметично закрытой пробирке Эппендорфа уровни кальципотриола и дипропионата бетаметазона составляли, соответственно, 99% и 138% от первоначальных уровней. В настоящее время продолжается испытание устойчивости при хранении.
ПРИМЕР 15
Три гелевые полиафроновые дисперсии и водный гель нижеследующих составов были получены описанным ниже способом.
** Содержание дипропионата бетаметазона в конечной композиции равно 534 мкг/г (что эквивалентно 415 мкг/г бетаметазона).
Способ получения
Способ получения был аналогичен описанному в приведенном выше примере 1 за исключением того, что к конечной смеси трех гелевых полиафроновых дисперсий 1, 2 и 3 добавляли нейтрализованный водный гель и смешивали путем простого перемешивания до образования гомогенной смеси полиафроновых дисперсий.
Измерения устойчивости
Устойчивость испытывали способом, описанным в примере 1а.
Было установлено, что после хранения в течение 3,5 недель при 40°С в герметично закрытой пробирке Эппендорфа уровни кальципотриола и бетаметазона составляли, соответственно, 95% и 136% от первоначальных уровней. В настоящее время продолжается испытание устойчивости при хранении.
ПРИМЕР 16
Три гелевые полиафроновые дисперсии и водный гель нижеследующих составов были получены описанным ниже способом.
** Содержание дипропионата бетаметазона в конечной композиции равно 536 мкг/г (что эквивалентно 417 мкг/г бетаметазона).
Способ получения
Способ получения был аналогичен описанному в приведенном выше примере 1 за исключением того, что к конечной смеси трех гелевых полиафроновых дисперсий 1, 2 и 3 добавляли нейтрализованный водный гель и смешивали путем простого перемешивания до образования гомогенной смеси полиафроновых дисперсий.
Измерения устойчивости
Устойчивость испытывали способом, описанным в примере 1а.
Было установлено, что после хранения в течение 3,5 месяцев при 40°С в герметично закрытой пробирке Эппендорфа уровни кальципотриола и бетаметазона составляли, соответственно, 101% и 137% от первоначальных уровней. В настоящее время продолжается испытание устойчивости при хранении.
ПРИМЕР 17
** Содержание BDP в конечной композиции равно 626 мкг/г (что эквивалентно 487 мкг/г бетаметазона).
Способ получения
Способ получения был аналогичен описанному в приведенном выше примере 1 за исключением того, что к конечной смеси трех гелевых полиафроновых дисперсий 1, 2 и 3 добавляли нейтрализованный водный гель и смешивали путем простого перемешивания до образования гомогенной смеси полиафроновых дисперсий.
Краткий обзор
а Уровни кальципотриола и дипропионата бетаметазона составляют 102% и 99% от первоначальных уровней.
* Уровень бетаметазона = 95% от первоначального уровня в образце, испытанном на устойчивость при хранении в течение наибольшего периода времени.
** После хранения в течение 6 месяцев уровни кальципотриола и дипропионата бетаметазона составляли, соответственно, 42% и 65% от первоначального уровня.
*** Уровень кальципотриола = 86% от первоначального уровня после хранения в течение 4 месяцев при 40°С.
**** После хранения в течение 3 месяцев уровни кальципотриола и дипропионата бетаметазона составляли, соответственно, 91% и 70% от первоначального уровня.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОФТАЛЬМИЧЕСКАЯ КОМПОЗИЦИЯ | 2012 |
|
RU2639472C2 |
| КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ | 2019 |
|
RU2806765C2 |
| НОВЫЕ КОМПОЗИЦИИ ВАКЦИН | 2006 |
|
RU2422155C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2238734C2 |
| БИОРАЗРУШАЕМЫЙ ПЛАСТЫРЬ | 2008 |
|
RU2460519C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ВИТАМИН ГРУППЫ D И КОРТИКОСТЕРОИД | 2007 |
|
RU2452488C2 |
| КОМПОЗИЦИЯ ФАРМАЦЕВТИЧЕСКОГО АЭРОЗОЛЯ, ВКЛЮЧАЮЩАЯ АНАЛОГ ВИТАМИНА D И КОРТИКОСТЕРОИД | 2011 |
|
RU2576607C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЛИПИДНЫЕ НАНОЧАСТИЦЫ И КОРТИКОСТЕРОИД ИЛИ ПРОИЗВОДНОЕ ВИТАМИНА D | 2012 |
|
RU2602171C2 |
| КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ | 2018 |
|
RU2807884C2 |
| КОМПОЗИЦИИ МЕСТНОГО ПРИМЕНЕНИЯ, СОДЕРЖАЩИЕ, ПО МЕНЬШЕЙ МЕРЕ, ОДИН ВИТАМИН D ИЛИ ОДИН АНАЛОГ ВИТАМИНА D И, ПО МЕНЬШЕЙ МЕРЕ, ОДИН КОРТИКОСТЕРОИД | 2001 |
|
RU2271810C2 |
Изобретение относится к медицине. Описана композиция, предназначенная для местного применения, которая включает непрерывную фазу и по меньшей мере одну дисперсную фазу, при этом указанная композиция содержит по меньшей мере одну полиафроновую дисперсию, по меньшей мере один витамин D или аналог витамина D и по меньшей мере один кортикостероид. Композиция характеризуется лучшим проникновением через кожу и/или лучшей устойчивостью. 4 н. и 23 з.п. ф-лы, 3 ил., 17 пр.
1. Композиция, предназначенная для местного применения, которая включает непрерывную фазу и по меньшей мере одну дисперсную фазу, при этом указанная композиция содержит по меньшей мере одну полиафроновую дисперсию, по меньшей мере один витамин D или аналог витамина D и по меньшей мере один кортикостероид, причем кортикостероид находится, главным образом, в дисперсной фазе, и витамин D или аналог витамина D находится, главным образом, в дисперсной фазе.
2. Композиция по п.1, в которой кортикостероид является бетаметазоном, клобетазолом, клобетазоном, дезоксиметазоном, дифлукортолоном, дифлуоразоном, флуоциноидом, флуметазоном, флуоцинолоном, флутиказоном, флупредниденом, гальцинонидом, гидрокортизоном, мометазоном, триамцинолоном, сложными эфирами или смесью указанных веществ.
3. Композиция по п.2, в которой кортикостероид является бетаметазоном или его сложным эфиром.
4. Композиция по п.1, в которой витамин D или аналог витамина D является витамином D, кальципотриолом, сеокальцитолом, кальцитриолом, такальцитолом, максакальцитолом, парикальцитолом, фалекальцитриолом, 1α,24S-дигидрокси-витамином D2, 1(S),3(R)-дигидрокси-20(R)-[((3-(2-гидрокси-2-пропил)фенил)метокси)метил]-9,10-секопрегна-5(Z),7(Е),10(19)-триеном или смесью указанных веществ.
5. Композиция по п.4, в которой витамин D или аналог витамина D является кальципотриолом.
6. Композиция по п.1, в которой дисперсная фаза включает масло.
7. Композиция по п.6, в которой масло включает моноглицерид, диглицерид, триглицерид, изопропилмиристат или смесь указанных веществ.
8. Композиция по п.1, которая включает менее 5 мас.% воды в расчете на общую массу композиции.
9. Композиция по п.8, в которой непрерывная фаза является неводной фазой.
10. Композиция по п.1, которая включает по меньшей мере 5 мас.% воды в расчете на общую массу композиции.
11. Композиция по п.10, которая включает по меньшей мере 10 мас.% воды в расчете на общую массу композиции.
12. Композиция по п.11, которая включает по меньшей мере 15 мас.% воды в расчете на общую массу композиции.
13. Композиция по п.1, которая включает 5-50 мас.% воды в расчете на общую массу композиции.
14. Композиция по п.1, в которой непрерывная фаза включает соединение формулы R1-OH, где R1 означает С1-С10алкил, и/или соединение формулы HO-R2-H, где R2 означает (С2Н4)n или (С3Н6)n, где n равно 1-100.
15. Композиция по п.14, в которой непрерывная фаза включает пропиленгликоль, глицерин, этанол, изопропиловый спирт или смесь указанных веществ.
16. Композиция по п.1, в которой значение рН равно 7,0-8,5.
17. Композиция по п.16, в которой значение рН водной фазы равно 7,25-7,75.
18. Композиция по п.1, которая далее включает гелеобразователь.
19. Композиция по п.1, которая далее включает усилитель проникновения.
20. Композиция по п.1, которая предназначена для применения в способе терапевтического лечения человека или животного.
21. Композиция по п.1, которая предназначена для применения при лечении псориаза.
22. Применение композиции по п.1 для приготовления лекарственного средства для лечения псориаза.
23. Способ получения композиции по п.1, который включает следующие стадии:
(i) получение гидрофильного растворителя, необязательно содержащего по меньшей мере один витамин D или аналог витамина D, и/или по меньшей мере один кортикостероид и/или поверхностно-активное вещество;
(ii) получение гидрофобного растворителя, необязательно содержащего по меньшей мере один витамин D или аналог витамина D, и/или по меньшей мере один кортикостероид и/или поверхностно-активное вещество;
(iii) смешивание гидрофильного растворителя с гидрофобным растворителем в приемлемых условиях с образованием композиции, содержащей по меньшей мере одну полиафроновую дисперсию, по меньшей мере один витамин D или аналог витамина D и по меньшей мере один кортикостероид.
24. Способ получения композиции по п.1, который включает следующие стадии:
получение первой полиафроновой дисперсии, содержащей витамин D или аналог витамина D;
получение второй полиафроновой дисперсии, содержащей кортикостероид; и
смешивание указанных первой и второй полиафроновых дисперсий с образованием композиции.
25. Способ по п.23, который дополнительно включает:
получение третьей или последующей полиафроновой дисперсии, содержащей активный агент; и
смешивание указанной третьей или последующей полиафроновой дисперсии с указанными первой и второй полиафроновыми дисперсиями.
26. Способ по п.24, в котором указанные первую и вторую полиафроновые дисперсии смешивают с другим гидрофильным растворителем, имеющим значение рН в пределах от 7,25 до 7,75.
27. Композиция по п.1, которая является устойчивой, при этом устойчивость измерена в виде не более чем 5% уменьшения количества витамина D или аналога витамина D и не более чем 5% уменьшения количества кортикостероида относительно первоначальных количеств после хранения в течение 3 месяцев в герметично закрытой стеклянной емкости при 40°С.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2238734C2 |
| TRAULSEN J, The atrophogenic potential and dermal tolerance of calcipotriol/betamethasone dipropionate ointment compared with betamethasone dipropionate ointment, Dermatology | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2012-11-20—Публикация
2008-03-14—Подача