Способ индукции противоопухолевого цитотоксического иммунного ответа in vitro с помощью дендритных клеток, трансфицированных РНК опухолевых клеток, против клеток немелкоклеточного рака легкого
Изобретение относится к иммунологии и биотехнологии, а именно к способам индукции противоопухолевого цитотоксического иммунного ответа против клеток немелкоклеточного рака легкого in vitro.
Первое место в структуре заболеваемости злокачественными новообразованиями мужского населения России на 2012 год занимают опухоли трахеи, бронхов, легкого (18,7%), при этом средний возраст заболевших составляет 64,6 лет. В структуре смертности обоих полов населения России от злокачественных новообразований наибольший удельный вес составляют опухоли трахеи, бронхов, легкого (17,3%). [Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой Злокачественные новообразования в России в 2012 году (заболеваемость и смертность) М.: ФГБУ «МНИОИ им. П.А. Герцена» Минздрава России. - 2014. илл. - 250 с. ISBN 978-5-85502-193-6]. Хотя операция рассматривается как оптимальное лечение, только в 25-30% случаев немелкоклеточного рака легкого опухоли потенциально резектабельны. Пятилетняя выживаемость после оперативного вмешательства для Ia стадии немелкоклеточного рака легкого составляет до 73% и для IIIa стадии - до 25% [Besse В., Le Chevalier Т. Developments in the treatment of early NSCLC: when to use chemotherapy // Annals of Oncology. - 2012. - 23. - V 23(10). - p. 52-59]. Согласно рекомендациям в качестве химиотерапии первой линии предпочтительнее использовать комбинации на основе производных платины, при этом частота лечебного эффекта составляет 20-40%, а медиана общей выживаемости (ОВ) - 7-12 мес [Azzoli C.G., Baker S.Jr., Temin S. et al. American Society of Clinical Oncology Clinical Practice Guideline update on chemotherapy for stage IV nonsmallcell lung cancer // J. Clin. Oncol. - 2009. - Vol. 27. - Р. 6251-6266].
В основе патогенеза злокачественных новообразований может лежать ряд причин, среди которых нарушение механизмов иммунной регуляции, низкая иммуногенность опухоли, подавление функциональной активности антиген-презентирующих клеток, таких как дендритные клетки [Pinzon-Charry A., Maxwell Т., Lopez J.A. Dendritic cell dysfunction in cancer: a mechanism for immunosuppression Review // Immunol Cell Biol. - 2005. - V. 83(5). - P. 451-61]. У дендритных клеток в процессе канцерогенеза возникает большая вероятность изменения механизмов дифференцировки в зрелые формы и кросс-презентации антигенов [Gabrilovich D. Mechanisms and functional significance of tumour-induced dendritic-cell defects Review // Nat Rev Immunol. - 2004. - V. 4(12). - Р. 941-52]. Дендритные клетки принадлежат к профессиональным антиген-презентирующим клеткам, обладают уникальной способностью к захвату антигена, его процессингу и представлению в комплексе с HLA I или II для праймирования наивных Т-клеток или активации Т-клеток, со свойствами натуральных киллеров, во вторичных лимфоидных органах [Lan Ch.-Y., Liu Ji-H., Xia J-Ch., Zheng Li-M., Biological characteristics of dendritic cells derived from peripheral blood of patients with epithelial ovarian cancer // Chinese Journal of Cancer - 2009 - V. 28(2). - P. 132-137]. В настоящее время наряду с прочими методами консервативной терапии злокачественных новообразований специфическая иммунотерапия является современным и перспективным способом лечения, основной целью которой является индукция и поддержание длительного иммунного ответа, направленного на распознавание и элиминацию опухолевых клеток [Stiff P.J., Czerlanis Ch., Drakes М.L. Dendritic cell immunotherapy in ovarian cancer // Expert Rev. Anticancer Ther. - 2013. - V. 13(1). - Р. 43-53].
Известен, например, способ получения композиции для лечения рака легких, прежде всего, немелкоклеточного рака легких (НМРЛ), содержащая по меньшей мере одну РНК, предпочтительно мРНК, кодирующую по меньшей мере два антигена, которые инициируют иммунный ответ у млекопитающего для лечения рака легких, прежде всего немелкоклеточного рака легких (НМРЛ), выбранного из основных трех его подтипов: плоскоклеточной карциномы легких, аденокарциномы и крупноклеточной карциномы легких, или нарушений, связанных с НМРЛ. Способ получения композиции включает кодирование мРНК различных антигенов in vitro. Способ включает соединение пяти компонентов участков мРНК в одну ДНК вакцину (RU 2526510, A61K 39/00, 20.11.2011.
Недостатком способа является отсутствие клеточных компонентов (ДК и эффекторных клеток, специфических к опухолевым антигенам), что необходимо для инициации противоопухолевого ответа.
Известен способ приготовления ДК в сочетании с цитокин-индуцированными клетками-килерами при лечении рака легких. При данном способе приготовление цитокин-индуцированных клеток (CIK) включает получение собственных мононуклеарных клеток пациента с раком легких в условиях культуры, содержащей интерферон-γ, а после добавления анти-CD3-антител и интерлейкина-2 (IL-2) получают CIK-килеры. В качестве антигена используется СЕА-пептид, в частности, СЕА605-613 (CN 102357101, A61K 35/00, A61K 35/12, 22.02.2012).
Недостатком способа является то, что ДК и CIK не культивируются совместно, а вводятся по отдельности, тем самым исключается обучение эффекторных клеток.
Особую роль в иммунотерапии занимает развитие новых подходов, в частности, вакцинотерапия на основе дендритных клеток. Конечная цель реализации эффекта такой ДК-вакцинотерапии заключается в достижении достаточной иммуногенности опухолевых антигенов; создании условий для их эффективной презентации; преодолении местной или системной иммуносупрессии [Zhang S., Li W.F., Zhang H.J., Wang Q. Antitumor reactivity of splenocytes primed in vivo with dendritic-cell-based vaccine and secondarily activated with a cocktail of cytokines in vitro // Exp Oncol. - 2004. - V. 26(3). - P. 243-245].
В настоящее время ведутся исследования по оптимизации подходов получения и применения дендритных клеток для формирования клеточного цитотоксического противоопухолевого иммунного ответа. Одним из способов преодоления негативных последствий, вызванных канцерогенезом, и усиления эффективности противоопухолевого иммунного ответа является получение дендритных клеток онкологического больного, нагруженных антигеном ex vivo, применяя в качестве адъювантов рекомбинантные цитокины (IL-2, IFN-α, GM-CSF) [Santini S., Lapenta С, Logozzi M., Parlato S., Spada M., Di Pucchio Т., Bellardelli F. Type I Interferon as a powerful adjuvant for monocyte derived dendritic cells development and activity in vitro and in HU-PBL-SCID mice // J. Exp. Med. - 2000. - V. 191. - P. 1777-1788].
На настоящий момент наибольшее распространение получили вакцины на основе дендритных клеток. Незрелые ДК получают из прилипающей фракции мононуклеарных клеток (МНК), при добавлении в среду рчГМ-КСФ и рчИЛ-4. Для созревания ДК применяют определенный набор цитокинов, таких как ФНО-α, ИФН-α, ИЛ-15, ИФН-γ, ПГЕ2, и т.д. Для нагрузки ДК опухолевыми антигенами могут использоваться РНК, ДНК, рекомбинантные белки, лизат опухолевых клеток. [K. Palucka et al. Recent developments in cancer vaccines. // J Immunol. - 2011. - N 186(3). - p. 1325-1331].
Решение проблем эффективной доставки антигенного материала в дендритные клетки для стимуляции противоопухолевого иммунного ответа очень важно.
Известен способ получения зрелых ДК, который включает следующие этапы: подготовку моноцитарной смеси, культивирование смеси, содержащей интерлейкин 3(IL-3) и интерлейкин 4(IL-4), получение препарата, содержащего культивированные незрелые ДК, обработку до созревания смеси препаратом, содержащим фактор некроза опухоли альфа (TNF-α), интерлейкин 1-бета (IL-1β), интерлейкин 6(IL-6), простагландин Е2 (PGE-2) и лиганд для рецептора 3 (TLR-3 лиганд), чтобы получить препарат, содержащий зрелые ДК (WO 2008098770, С07Н 21/00, C12N 5/078, 21.08.2008).
Недостатком способа является наличие простагландина, который может оказывать иммуносупрессивный эффект и в результате приводить к снижению формирования дендритными клетками Th-1 ответа [ Р1, Hilkens CM, Snijders A, Snijdewint FG, Kapsenberg ML. IL-12-deficient dendritic cells, generated in the presence of prostaglandin E2, promote type 2 cytokine production in maturing human naive T helper cells // J Immunol. 1997 Jul 1; 159(l):28-35; Lanzinger M, Jurgens B, Hainz U, Dillinger B, Raberger J, Fuchs D, Heitger A. Ambivalent effects of dendritic cells displaying prostaglandin E2-induced indoleamine 2,3-dioxygenase // Eur J Immunol. 2012 May; 42(5):1 117-28].
Р1, Hilkens CM, Snijders A, Snijdewint FG, Kapsenberg ML. IL-12-deficient dendritic cells, generated in the presence of prostaglandin E2, promote type 2 cytokine production in maturing human naive T helper cells // J Immunol. 1997 Jul 1; 159(l):28-35; Lanzinger M, Jurgens B, Hainz U, Dillinger B, Raberger J, Fuchs D, Heitger A. Ambivalent effects of dendritic cells displaying prostaglandin E2-induced indoleamine 2,3-dioxygenase // Eur J Immunol. 2012 May; 42(5):1 117-28].
Известен способ получения аутологичной вакцины для лечения онкологических заболеваний, которая содержит две части: в одну входит прикрепляющая фракция - это зрелые ДК, полученные путем инкубирования незрелых ДК с лизатом опухоли; во вторую входит не прикрепляющая фракция - это Т-лимфоциты, специфически активированные интерлейкином 2, зрелыми ДК и ЛАК-клетками (RU 2392946, A61K 35/00, 27.06.2010).
Известен способ генерации антиген-специфических цитотоксических клеток в противоопухолевой активностью, при котором из периферической крови больного выделяют прилипающую фракцию МНК и культивируют их в среде определенного состава для получения незрелых ДК. В процессе культивирования к последним добавляют опухолевый антиген (лизат аутологичных опухолевых клеток), а затем рч ФНО-α, для созревания незрелых ДК. Полученные зрелые антиген-активированные ДК культивируют с неприлипшей фракцией МНК в присутствии провоспалительных цитокинов рчИЛ-12 и рчИЛ-18 (RU 2458985, C12N 5/09, A61K 39/00, A61K 35/00, A61K 35/14, 20.08.2012).
Особенностью описанных выше патентов является использование лизата аутологичных опухолевых клеток (в качестве опухолевых антигенов). В лизате присутствуют опухолевые белки, которые могут оказывать супрессивный эффект. Кроме того, использование лизата требует больше материала опухоли, что не всегда возможно.
Указанный недостаток устраняется при использование РНК в качестве источника антигенов опухоли.
Интерес к использованию РНК (либо тотальной из опухолевой клетки либо мРНК), как к источнику антигенов опухоли и объекту для нагружения ДК при развитии противоопухолевых вакцин возник после 1990 года. В настоящее время также проводятся клинические испытания I и II фазы по применению ДК, нагруженных РНК и ДК, измененных для эндогенной экспрессии ОАА. А именно ДК, трансфицированные в результате электропорации мРНК, кодирующей полноразмерный белок WT1 при участии больных острой миелоидной лейкемией. ДК, нагруженные мРНК СЕА, используются при колоректальном раке. Также используются фьюжн клетки, состоящие из ДК и опухолевых. Такие клеточные гибриды известны как дендритомы. С июля 2012 начаты и проводятся клинические испытания по применению ДК при различных патологиях.
Использование РНК аутологичных опухолевых клеток позволяет презентировать весь возможный набор иммунных молекул, тем самым вызывая поликлональную реакцию Т-лимфоцитов против опухолевых клеток. Кроме того, так как материал забирается непосредственно от больного, отсутствует ограничение по HLA типу.
Наиболее близким к предлагаемому способу является способ индукции противоопухолевого цитотоксического иммунного ответа с помощью дендритных клеток, трансфицированных РНК опухолевых клеток, против клеток немелкоклеточного рака легкого (НМРЛ), включающий получение прилипающей и неприлипающей фракций мононуклеарных клеток (МНК), выделенных из периферической крови больного, совместное культивирование выделенных из периферической крови больного аутологичных мононуклеарных клеток неприлипающей фракции (МНК) со зрелыми дендритными клетками (ДК), полученными из прилипающей фракции МНК, трансфицированными РНК опухолевых клеток, после чего ДК подвергают стимулированному созреванию. ДК получали из прилипшей фракции мононуклеарных клеток периферической крови больного немелкоклеточным раком легкого (крупноклеточный рак легкого, плоскоклеточный рак легкого, аденокарцинома), выделенных на градиенте фиколла. Для получения незрелых ДК прилипшая фракция МНК культивировалась в культуральной среде в присутствии гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) и интерлейкина 4(ИЛ-4) в концентрации 1000 U/ml. На 6 день культивирования незрелых ДК проводили процедуру электропорации: 1×106-2×106 незрелых ДК смешивали с 20 µg опухолевой РНК в бессывороточной среде и проводили электропорацию (вольтаж 300 V, время импульса 250 мс, всего 4 импульса с интервалом 125 мс). Тотальную РНК клеток немелкоклеточного рака легких выделяли из смеси опухолевых клеток с помощью TRIzol (Gibco). Для получения зрелых ДК, после проведения электропорации, в среду добавляли цитокиновый коктейль, состоящий из: интерлейкина-2 (ИЛ-2), интерлейкина-1β (ИЛ-1β), простагландина Е2 (ПГЕ2), интерлейкина-6 (ИЛ-6) и фактора некроза опухоли-α (ФНО-α) (PeproTech, США). Трансфицированные РНК опухолевых клеток зрелые ДК получались на 9-10 день культивирования. Далее, для оценки способности ДК стимулировать пролиферативный Т-клеточный ответ in vitro, проводилось сокультивирование аутологичных МНК и ДК, трансфицированных опухолевой РНК, в соотношении 10:1 в течение 5 дней. На основе полученных данных сделан вывод, что трансфицированные тотальной РНК опухолевых клеток рака легкого дендритные клетки, на стадии незрелых, обладают стимулирующей способностью на пролиферативный ответ Т-лимфоцитов.
Описанный способ получения антиген-активированных дендритных клеток достаточно длителен (до 10 суток) из-за значительного срока сокультивирования ДК и МНК и требует использования большого количества рекомбинантных цитокинов (рчГМ-КСФ, рчИЛ-4, рчФНО-α, рчИЛ-2, рчИЛ-1β, рчИЛ-6, ПГЕ2), что ведет к значительному удорожанию технологии [Wang К., Wu Y., Zhou Q., Xu С, Lin J., Yang X., Huang S. Optimizing the methods of whole lung cancer RNA-loaded dendritic cells // Zhongguo Fei Ai Za Zhi. - 2005. - Vol. 8(6). - P. 489-94].
Кроме того, недостатком способа является также наличие простагландина, который может оказывать иммуносупрессивный эффект и в результате приводить к снижению формирования дендритными клетками Th-1 ответа [ Р, Hilkens CM, Snijders А, Snijdewint FG, Kapsenberg ML, IL-12-deficient dendritic cells, generated in the presence of prostaglandin E2, promote type 2 cytokine production in maturing human naive T helper cells // J Immunol. 1997 Jul 1;159(l):28-35; Lanzinger M, Jurgens B, Hainz U, Dillinger B, Raberger J, Fuchs D, Heitger A. Ambivalent effects of dendritic cells displaying prostaglandin E2-induced indoleamine 2,3-dioxygenase // Eur J Immunol. 2012 May;42(5):1 117-28].
Р, Hilkens CM, Snijders А, Snijdewint FG, Kapsenberg ML, IL-12-deficient dendritic cells, generated in the presence of prostaglandin E2, promote type 2 cytokine production in maturing human naive T helper cells // J Immunol. 1997 Jul 1;159(l):28-35; Lanzinger M, Jurgens B, Hainz U, Dillinger B, Raberger J, Fuchs D, Heitger A. Ambivalent effects of dendritic cells displaying prostaglandin E2-induced indoleamine 2,3-dioxygenase // Eur J Immunol. 2012 May;42(5):1 117-28].
Задачей настоящего изобретения является повышение эффективности генерации in vitro цитотоксических клеток с активностью против клеток немелкоклеточного рака легкого с помощью дендритных клеток, трансфицированных РНК опухолевых клеток, а также сокращение срока сокультивирования ДК и МНК.
Поставленная задача решается тем, что в способе индукции противоопухолевого цитотоксического иммунного ответа in vitro с помощью дендритных клеток, трансфицированных РНК опухолевых клеток, против клеток немелкоклеточного рака легкого (НМРЛ), включающем получение прилипающей и неприлипающей фракций мононуклеарных клеток (МНК), выделенных из периферической крови больного, совместное культивирование выделенных из периферической крови больного аутологичных мононуклеарных клеток неприлипающей фракции (МНК) со зрелыми дендритными клетками (ДК), полученными из прилипающей фракции МНК, трансфицированными РНК опухолевых клеток, после чего ДК подвергают стимулированному созреванию, - совместное культивирование неприлипающей фракции МНК и трансфицированных РНК аутологичных опухолевых клеток ДК проводят в течение 5-ти суток, при этом для получения зрелых ДК после трех суток культивирования прилипающей фракции МНК трансфицируют незрелые ДК опухолевой РНК, а через сутки после трансфицирования незрелые ДК подвергают еще в течение суток стимулированному созреванию путем добавления в культуру незрелых ДК фактора некроза опухоли-α (ФНО-α) и интерлейкина-1β (ИЛ-1β) при следующем соотношении компонентов: ФНО-α : ИЛ-1β=2,5:1.
Сущность предлагаемого изобретения заключается в следующем.
Мононуклеарные клетки неприлипающей фракции периферической крови больного немелкоклеточным раком легкого культивируют с антиген-активированными дендритными клетками, полученными из моноцитов прилипающей фракции МНК. Антигенную активацию ДК проводят с помощью магнитной трансфекции РНК аутологичных опухолевых клеток, а для созревания ДК используют рекомбинантные человеческие провоспалительные цитокины - фактор некроза опухоли-α (рчФНО-α) и интерлейкин-1β (ИЛ-1β). Для эффективной модуляции противоопухолевой защиты проводят совместное культивировании зрелых антиген-активированных ДК и неприлипающей фракции МНК в течение пяти суток, что позволяет повысить потенциал цитотоксической активности мононуклеарных антиген-специфических клеток.
Принципиальным отличием разработанного способа от аналогов и прототипа является применение протоколов активации и созревания ДК, включающих трансфекцию РНК, полученных из смеси аутологичных опухолевых клеток, что активирует ДК против собственных опухолевых антигенов, тем самым увеличивая цитотоксический ответ, а также сокращает стадию получения зрелых антиген-активированных ДК до 5 суток.
Изобретение осуществляется следующим образом.
Выделенная из периферической крови больного немелкоклеточным раком легкого прилипающая фракция мононуклеарных клеток культивируется в концентрации 1 млн/мл в полной среде, содержащей 10% эмбриональной телячьей сыворотки, 2 мМ L-глютамина, 10 мМ HEPES, 5×10-5 мМ 2-меркаптоэтанола, 80 мкг/мл гентамицина, 100 мкг/мл ампициллина в атмосфере 5% CO2 при 37°С с добавлением рчГМ-КСФ (50 нг/мл) и рчИЛ-4 (100 нг/мл). Через трое суток культивирования полученные незрелые ДК трансфицируют РНК аутологичных опухолевых клеток методом магнитной трансфекции, а еще через сутки для созревания незрелых дендритных клеток вносится рчФНО-α в дозе 25 нг/мл, и рчИЛ-1β в дозе 10 нг/мл в течение суток. Для генерации цитотоксической противоопухолевой реакции полученные трансфицированные дендритные клетки ссаживают с неприлипшей фракцией МНК в соотношении 1:10. Спустя 5 суток оценивают способность полученных антиген-активированных ДК стимулировать прямую цитотоксичность МНК, которые оценивали по уровню гибели аутологичных опухолевых клеток. Для этого полученные ДК совместно культивировали с неприлипшей фракцией МНК для праймирования опухолевых антигенов. Во все группы вносили аутологичные опухолевые клетки (соотношение МНК и опухолевых клеток как 10:1) и оценивали их гибель по высвобождению внутриклеточного фермента лактатдегидрогеназы. Показано достоверное повышение значения цитотоксичности, что служит показателем активации противоопухолевых цитотоксических клеток, необходимых для уничтожения опухолевых клеток (Табл. 1).
Таблица 1. Цитотоксический ответ in vitro мононуклеарных клеток больного немелкоклеточным раком легкого, сокультивированных со зрелыми дендритными клетками, трансфицированными РНК аутологичных опухолевых клеток против аутологичных опухолевых клеток (n=14).
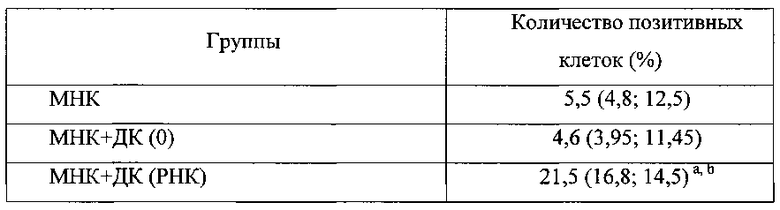
Примечание: Данные представлены в виде медианного значения и межквартильного интервала. Достоверность определена с помощью критерия Уилкоксона при уровне значимости р<0,05.
МНК - интактные клетки неприлипающей фракции мононуклеарных клеток
МНК+ДК(0) - совместная культура МНК и зрелых ДК, созревание которых происходило в отсутствие опухолевых антигенов
МНК+ДК (РНК) - совместная культура МНК и зрелых ДК, трансфицированных РНК аутологичных опухолевых клеток.
а - различия достоверны (р<0,05) по сравнению с группой МНК.
b - различия достоверны (р<0,05) по сравнению с группой МНК+ДК(0).
При оценке цитотоксической активности совместной культуры МНК и антиген -активированных зрелых ДК были получены результаты, подтверждающие эффективность применения данного протокола для получения зрелых дендритных клеток, способных стимулировать цитотоксический потенциал МНК против опухолевых клеток немелкоклеточного рака легкого.
Проведенные исследования показали, что разработанный способ стимуляции цитотоксической клеточной реакции Т-лимфоцитов против клеток немелкоклеточного рака легкого с помощью дендритных клеток, трансфицированных РНК аутологичных опухолевых клеток, является эффективным и перспективным для создания вакцин на основе дендритных клеток.
Изобретение повышает эффективность генерации цитотоксических клеток, а также позволяет сократить сроки сокультивирования ДК и МНК, что в итоге приводит к снижению стоимости способа.
Техническим результатом изобретения является индукция эффективного противоопухолевого цитотоксического иммунного ответа против клеток немелкоклеточного рака легкого, характеризующегося увеличением процента гибели аутологичных опухолевых клеток.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ГЕНЕРАЦИИ ЦИТОТОКСИЧЕСКИХ КЛЕТОК С АКТИВНОСТЬЮ ПРОТИВ КЛЕТОК НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО | 2014 |
|
RU2577992C2 |
| Способ получения антиген-специфических цитотоксических клеток, обладающих противоопухолевой цитотоксической активностью против клеток немелкоклеточного рака легкого | 2016 |
|
RU2639514C1 |
| СПОСОБ ГЕНЕРАЦИИ АНТИГЕН-СПЕЦИФИЧЕСКИХ ЦИТОТОКСИЧЕСКИХ КЛЕТОК С АКТИВНОСТЬЮ ПРОТИВ КЛЕТОК РАКА ЯИЧНИКА | 2012 |
|
RU2508298C2 |
| Способ получения зрелых антиген-активированных дендритных клеток с трансфекцией РНК опухолевых клеток рака молочной железы | 2016 |
|
RU2631792C2 |
| СПОСОБ ГЕНЕРАЦИИ АНТИГЕН-СПЕЦИФИЧЕСКИХ ЦИТОТОКСИЧЕСКИХ КЛЕТОК С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2458985C1 |
| СПОСОБ ГЕНЕРАЦИИ АНТИГЕН-СПЕЦИФИЧЕСКИХ ЦИТОТОКСИЧЕСКИХ КЛЕТОК С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2013 |
|
RU2521506C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕН-СПЕЦИФИЧЕСКИХ ЦИТОТОКСИЧЕСКИХ КЛЕТОК, ОБЛАДАЮЩИХ АКТИВНОСТЬЮ ПРОТИВ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2013 |
|
RU2596920C2 |
| Способ получения in vitro популяций активированных антигенспецифических противоопухолевых цитотоксических Т-лимфоцитов, специфичных к эпитопам опухоль-ассоциированного антигена | 2016 |
|
RU2619186C1 |
| СПОСОБ СТИМУЛЯЦИИ ЦИТОТОКСИЧЕСКОГО ИММУННОГО ОТВЕТА ПРОТИВ КЛЕТОК ОПУХОЛЕВОЙ ЛИНИИ АДЕНОКАРЦИНОМЫ МОЛОЧНОЙ ЖЕЛЕЗЫ, ЭКСПРЕССИРУЮЩИХ СПЕЦИФИЧЕСКИЕ АНТИГЕНЫ, С ПОМОЩЬЮ ДЕНДРИТНЫХ КЛЕТОК, ТРАНСФЕЦИРОВАННЫХ ПОЛИЭПИТОПНОЙ ДНК-КОНСТРУКЦИЕЙ | 2012 |
|
RU2520091C2 |
| Способ иммунотерапии рака молочной железы с помощью антиген-активированных дендритных клеток | 2016 |
|
RU2645464C1 |
Изобретение относится к области биотехнологии и может быть использовано для индукции противоопухолевого иммунного ответа in vitro. Способ включает получение прилипающей и неприлипающей фракций мононуклеарных клеток (МНК), выделенных из периферической крови больного, совместное культивирование выделенных из периферической крови больного аутологичных МНК неприлипающей фракции со зрелыми дендритными клетками (ДК), полученными из прилипающей фракции МНК, трансфицированными РНК опухолевых клеток. После чего ДК подвергают стимулированному созреванию. Совместное культивирование неприлипающей фракции МНК и трансфицированных РНК аутологичных опухолевых клеток ДК проводят в течение пяти суток. При этом для получения зрелых ДК после трех суток культивирования прилипающей фракции МНК трансфицируют незрелые ДК опухолевой РНК, а через сутки после трансфицирования незрелые ДК подвергают еще в течение суток стимулированному созреванию путем добавления в культуру незрелых ДК фактора некроза опухоли-α (ФНО-α) и интерлейкина-1β (ИЛ-1β) при следующем соотношении компонентов: ФНО-α : ИЛ-1β=2,5:1. Изобретение позволяет эффективно индуцировать противоопухолевый цитотоксический иммунный ответ против клеток немелкоклеточного рака легкого in vitro с помощью дендритных клеток, трансфицированных РНК опухолевых клеток. 1 табл.
Способ индукции противоопухолевого цитотоксического иммунного ответа in vitro с помощью дендритных клеток, трансфицированных РНК опухолевых клеток, против клеток немелкоклеточного рака легкого, включающий получение прилипающей и неприлипающей фракций мононуклеарных клеток (МНК), выделенных из периферической крови больного, совместное культивирование выделенных из периферической крови больного аутологичных мононуклеарных клеток неприлипающей фракции (МНК) со зрелыми дендритными клетками (ДК), полученными из прилипающей фракции МНК, трансфицированными РНК опухолевых клеток, после чего ДК подвергают стимулированному созреванию, отличающийся тем, что совместное культивирование неприлипающей фракции МНК и трансфицированных РНК аутологичных опухолевых клеток ДК проводят в течение пяти суток, при этом для получения зрелых ДК после трех суток культивирования прилипающей фракции МНК трансфицируют незрелые ДК опухолевой РНК, а через сутки после трансфицирования незрелые ДК подвергают еще в течение суток стимулированному созреванию путем добавления в культуру незрелых ДК фактора некроза опухоли-α (ФНО-α) и интерлейкина-1β (ИЛ-1β) при следующем соотношении компонентов: ФНО-α : ИЛ-1β=2,5:1.
Авторы
Даты
2016-03-20—Публикация
2015-04-17—Подача