Изобретение относится к области медицины, в частности к неврологии, и может быть использовано для диагностики текущего нейродегенеративного процесса при болезни Паркинсона.
Нейродегенеративный процесс при болезни Паркинсона имеет нелинейный характер: основная гибель нейронов происходит за несколько лет до манифестации клинических симптомов или в первые 2-3 года болезни. Это делает чрезвычайно актуальным поиск биомаркеров, которые позволили бы достоверно верифицировать развивающуюся патологию в ее скрытой (латентной) стадии. И только ранняя диагностика является залогом успеха превентивной нейропротективной терапии, подходы к которой интенсивно разрабатываются в ведущих лабораториях мира.
Данные многочисленных клинических и экспериментальных исследований показывают, что при большинстве нейродегенеративных заболеваний латентная фаза длится в среднем около 6-8 лет, а затем сравнительно быстро развивается манифестация явных клинических проявлений болезни. Именно эти несколько лет составляют наиболее благоприятное "терапевтическое окно", в течение которого необходимо стремиться диагностировать патологию и предотвратить или хотя бы отсрочить наступление необратимых изменений (Иллариошкин С.Н. Ранняя диагностика нейродегенеративных заболеваний. Журнал "Нервы", 2008, №1, с. 11-13).
В этой связи установление биомаркеров ранней и пресимптоматической стадии нейродегенеративного процесса играет важную роль в выявлении неблагополучия со стороны центральной нервной системы. В неврологии наиболее перспективными считаются три группы биомаркеров:
- нейрофизиологические и нейропсихологические (изменение нормальной картины биоэлектрической активности мозга при электроэнцефалографии, тонкие изменения психики и профиля личности при использовании специальных тестов и др.);
- молекулярно-биохимические (например, повышение в цереброспинальной жидкости и крови пациентов уровня некоторых белков, строго специфичных для вещества мозга);
- нейровизуализационные (выявление с помощью специальных методик рентгеновской, магнитно-резонансной или радиоизотопной компьютерной томографии тех или иных функционально-биохимических изменений в веществе мозга, либо тонких признаков нарастающего уменьшения объема отдельных ядер - скоплений нейронов в определенных отделах мозга). (Иллариошкин C.H. Ранняя диагностика нейродегенеративных заболеваний .Журнал "Нервы", 2008, №1, с. 11-13).
Однако специфичность и чувствительность большинства применяемых тестов пока недостаточна, а ряд исследовательских технологий (таких как позитронно-эмиссионная томография) в силу их сложности и высокой стоимости остаются практически недоступными для реального применения на практике. Большой интерес в последние годы вызывают новые технологии нейровизуализации, такие, как транскраниальная сонография (выявление гиперэхогенности черной субстанции) или специальные режимы магнитно-резонансной томографии (МРТ)-исследования (морфометрия, трактография и др.).
На сегодняшний день известен способ диагностики нейродегенеративного процесса при болезни Паркинсона путем волюметрической морфометрии головного мозга по данным высокопольной магнитно-резонансной томографии. Отсутствие выраженных атрофических изменений вещества головного мозга в группах с начальными и выраженными клиническими проявлениями болезни Паркинсона (БП) по сравнению с больными цереброваскулярным заболеванием (ЦВЗ), где уже имеются статистически значимые отличия как по сравнению с группой контроля, так и с группой с начальными клиническими проявлениями БП, отражают особенности нейродегенеративного процесса при БП и органические изменения при ЦВЗ (Богданов P.P., Мананникова Е.И., Абраменко А.С., Маратканова Т.В., Котов С.В. Морфометрические показатели нейродегенеративного процесса при болезни Паркинсона и хронической ишемии головного мозга. Журнал неврологии и психиатрии, 2013, №10, с. 40-44). Однако данная методика имеет ряд недостатков, в частности некорректную интерпретацию отдельных участков белого вещества полушарий и восприятие ствола мозга как однородной структуры, образованной только белым веществом. Это накладывает ряд ограничений в применении данной методики для оценки состояния дофаминергических структур и требует разработки новых технических и методологических подходов.
Техническим результатом заявленного нами способа является повышение точности диагностики нейродегенеративного процесса при болезни Паркинсона на раннем этапе его проявления.
Технический результат достигается тем, что диагностику нейродегенеративного процесса при болезни Паркинсона проводят путем исследования головного мозга с помощью функциональной магнитно-резонансной томографии в состоянии покоя (фМРТп), при этом посредством фМРТп выявляют зоны спонтанной нейрональной активности сети пассивного режима работы головного мозга (СПРР), представленные отделами предклинья, задними отделами поясных извилин, медиальными лобными отделами, нижними теменными дольками правого и левого полушарий головного мозга и при наличии снижения спонтанной нейрональной активности только в нижней теменной дольке правого полушария СПРР относительно уровня спонтанной нейрональной активности СПРР группы контроля диагностируют нейродегенеративный процесс при болезни Паркинсона.
Способ осуществляется следующим образом.
Пациенту проводят нейровизуализационное обследование на магнитно-резонансном томографе Siemens MAGNETOM Avanto с величиной магнитной индукции 1,5 Тесла, которое включает в себя определенный порядок исследования: для исключения грубых патологических изменений в головном мозге исследование проводят в стандартном режиме Т2 взвешенных изображений, затем проводят фМРТп. Функциональная магнитно-резонансная томография покоя в процессе исследовании головного мозга обеспечивает анализ низкочастотных колебаний (менее 0,1 Гц) BOLD-сигнала (blood oxygenation leveldependent contrast - контрастность, зависящая от степени насыщения крови кислородом) в получаемых при обследовании временных последовательностях (Fox MD, Greicius M. Clinical applications of resting state functional connectivity. Front Syst Neurosci 2010; 4: 19), что косвенно позволяет оценить спонтанную нейрональную активность головного мозга в покое. При этом посредством фМРТп выявляют зоны спонтанной нейрональной активности сети пассивного режима работы головного мозга (СПРР), представленные отделами предклинья, задними отделами поясных извилин, медиальными лобными отделами, нижними теменными дольками правого и левого полушарий головного мозга. При проведении фМРТп пациентам предлагают лежать как можно более неподвижно, с закрытыми глазами (с целью исключения стимуляции зрительного анализатора), в наушниках (для уменьшения стимуляции слухового анализатора), стараться не засыпать и не думать ни о чем конкретном. При этом продолжительность исследования составляет 6 минут 20 секунд (регистрировали 36 срезов головного мозга); в результате для каждого обследуемого получают 100 измерений всего объема головного мозга. Для обработки данных фМРТп используют пакет программ SPM и анализируют методом анализа независимых компонент в приложении GIFT на базе MATLAB. Предпроцессинг проводят в программе SPM. При предварительном статистическом анализе данных фМРТп для каждого обследуемого получают данные о зонах спонтанной нейрональной активности в виде цветных карт. Те же данные также представляют в числовом отображении с указанием их объема-кластера в вокселах, уровня статистической значимости зон активности (PFWEcorr), Т-критерия и координат в стереотаксическом пространстве MNI (Montreal Neurological Institute anatomical template). Данный анализ проводят для каждого обследованного субъекта отдельно (порог статистической значимости - p<0,05, FWE corrected). На основании полученных данных была определена СПРР, где выявились зоны спонтанной нейрональной активности с высоким уровнем статистической значимости, где при наличии снижения спонтанной нейрональной активности только в нижней теменной дольке правого полушария СПРР относительно уровня спонтанной нейрональной активности СПРР группы контроля диагностируют нейродегенеративный процесс при болезни Паркинсона.
Необходимо отметить, что большинство работ, обследующих сети покоя, направлены на изучение моторных зон коры и изменений функциональной коннективности (ФК) в них.
С целью определения зон сети пассивного режима работы головного мозга (СПРР), в которую входят участки серого вещества предклиньев, задних отделов поясных извилин, медиальных лобных отделов, нижних теменных областей, участвующие в когнитивных процессах и зрительно-пространственном восприятии, нами был использован анализ независимых компонент (программа GIFT - Group ICA fMRI Toolbox, - групповой анализ независимых компонент для данных фМРТ).
Были обследованы пациенты с впервые выявленной болезнью Паркинсона до начала терапии и для сравнения пациенты с БП, находящиеся на дофаминергической терапии, и группа здоровых добровольцев - 3 независимых группы:
1. Группа здоровых добровольцев. В нее вошли 18 здоровых добровольцев без заболеваний центральной нервной системы, из них 9 женщин, средний возраст (медиана, 1 и 3 квартили) составил 43,0 года [27;71].
2. Группа пациентов, находящихся на дофаминергической терапии. 16 пациентов с болезнью Паркинсона, из них 10 женщин. Все пациенты находились на лечении агонистами дофаминовых рецепторов и/или препаратами леводопы. Средний возраст пациентов составил 62,5 [50;76] года. Средняя продолжительность заболевания составляла 33 [18;60] месяца или 2 года 9 месяцев.
3. Группа пациентов на ранних стадиях заболевания. В группу вошло 9 пациентов, из них 4 женщины, с впервые выявленной болезнью Паркинсона без фармакологического лечения. Средний возраст составил 56,44 [39;66] года. Средняя продолжительность заболевания составляла 20 [10;36] месяцев.
Проведение исследования было одобрено локальным этическим комитетом; пациенты и здоровые добровольцы подписали информированное согласие на проведение обследования. Все исследуемые были правши.
Всем пациентам был проведен неврологический осмотр с использованием шкал UPDRS, МоСа, Hoehn-Yahr, батареи лобных тестов, госпитальной шкале тревоги и депрессии (HADS). Исследование проводили на магнитно-резонансном томографе Siemens MAGNETOM Avanto с величиной магнитной индукции 1,5 Тесла, которое включало в себя порядок исследования: последовательность для получения стандартного режима Т2 ВИ - для исключения грубых патологических изменений в головном мозге, данных функциональной МРТп и анатомических данных в режиме MPR. При проведении фМРТп пациентам предлагалось лежать как можно более неподвижно, с закрытыми глазами (с целью исключения стимуляции зрительного анализатора), в наушниках (для уменьшения стимуляции слухового анализатора), стараться не засыпать и не думать ни о чем конкретном. Проведение фМРТп и получение результатов осуществляли, как описано выше.
При сравнении трех независимых групп были получены следующие данные.
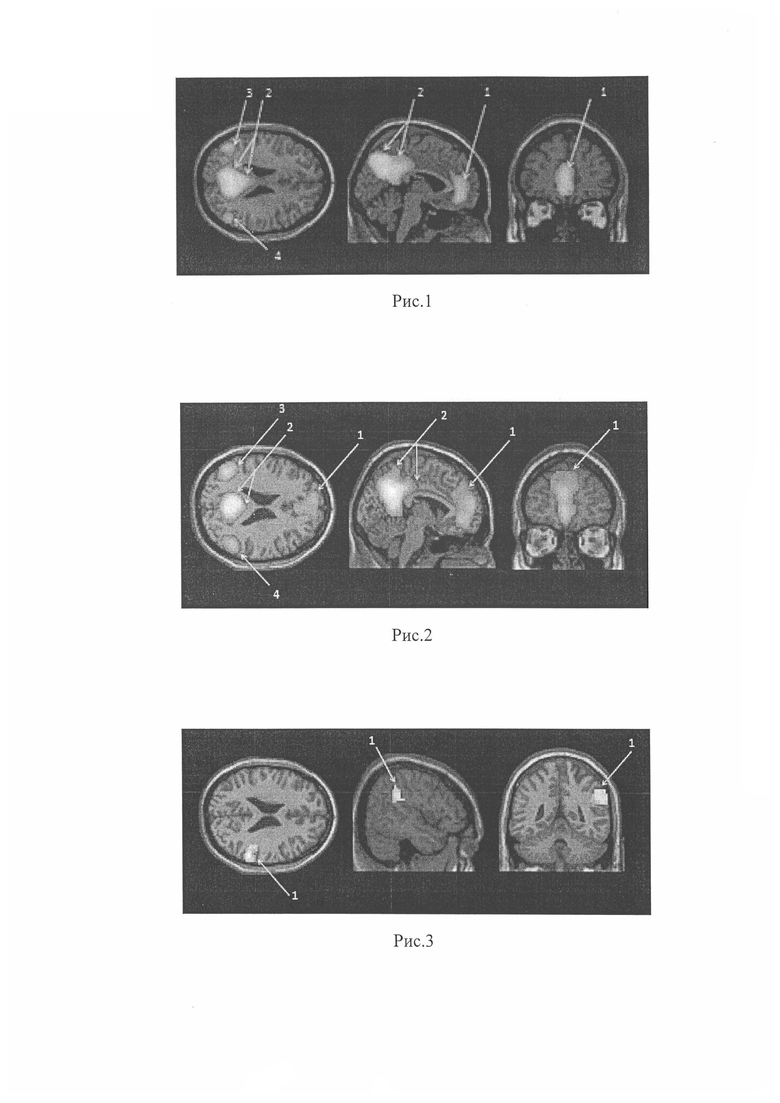
Во всех группах был определен уровень спонтанной нейрональной активности СПРР, представленной отделами предклинья, задними отделами поясных извилин, медиальными лобными отделами, нижними теменными дольками правого и левого полушарий головного мозга, из которых были выбраны зоны активности с высоким уровнем статистической значимости (pFWEcorr<0,05). Зоны СПРР на примере данных группы контроля представлены на рис. 1 «Общий вид СПРР по данным фМРТп головного мозга здорового добровольца»: представлена локализация зон данной сети, где 1 - медиальные отделы лобных долей. 2 - задние отделы поясных извилин и отделы предклинья. 3 - нижние отделы теменных долей левого полушария головного мозга. 4 - нижние отделы теменных долей правого полушария головного мозга.
В отличие от здоровых добровольцев и по сравнению с другими зонами у пациентов 2-й группы определилось уменьшение спонтанной нейрональной активности в нижней теменной дольке правого полушария - в зоне, участвующей в зрительно-пространственном восприятии (см. рис. 2).
На рис. 2 представлен общий вид СПРР по данным фМРТп головного мозга пациента с БП, находящегося на дофаминергической терапии (а именно снижение интенсивности активации в зоне 4 (нижние отделы теменных долей правого полушария головного мозга) по сравнению с зоной 3 (левое полушарие) и другими зонами (1 и 2).
У пациентов 3-й группы в сравнении с группами 1 и 2 также определялось уменьшение спонтанной нейрональной активности в нижней теменной дольке правого полушария СПРР. Причем оно было более выражено по сравнению со 2-й группой, что отражено на рис. 3. На рис. 3 показано сравнение двух групп (2-й и 3-й), где было определено статистически значимое снижение спонтанной нейрональной активности только в нижней теменной дольке правого полушария СПРР, а именно более выраженное снижение интенсивности активации в зоне 4 правого полушария группы 3 по сравнению с той же зоной пациентов 2-й группы).
Кроме того, нами было выявлено, что изменение спонтанной нейрональной активности в нижней теменной дольке правого полушария коррелирует с данными по шкале МоСа и UPDRS (МоСа - Монреальская шкала когнитивной оценки разработана для быстрого скрининга мягких когнитивных нарушений; унифицированная шкала UPDRS используется для оценки когнитивных нарушений при длительном течении БП). Чем выше оценка по шкале МоСа, т.е. чем сохраннее когнитивная функция, тем выше спонтанная нейрональная активность в данной зоне. Чем выше оценка по шкале UPDRS, тем более выражено снижение когнитивной функции и тем меньше спонтанная нейрональная активность в данной зоне у всех пациентов с БП (табл. 1).

Данные были подтверждены результатами проведенного множественного регрессионного анализа со шкалами МоСа и UPDRS и данной зоной. Наряду с уменьшением спонтанной нейрональной активности в вышеуказанной зоне, у пациентов третьей группы также было выявлено увеличение спонтанной нейрональной активности в других зонах, входящих в состав СПРР - медиальных отделах левой лобной доли, угловых извилинах правого и левого полушарий большого мозга, что отражает явление нейропластичности.
Таким образом, полученные с помощью методики фМРТп данные с выявлением сети пассивного режима работы головного мозга у нелеченых больных БП говорят о снижении спонтанной нейрональной активности в нижней теменной дольке правого полушария и входящей в ее состав надкраевой извилине, участвующей в когнитивных процессах, и могут рассматриваться как биомаркеры текущего нейродегенеративного процесса у пациентов с БП, не принимавших терапию. Выявление снижения спонтанной нейрональной активности в нижней теменной дольке доказывает наличие нейродегенеративного процесса при болезни Паркинсона, что крайне важно для ранней диагностики БП, а также в оценке эффективности проводимого лечения, что благоприятно отражается на прогнозе заболевания и повышает качество жизни пациента.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования развития когнитивных нарушений у пациентов с болезнью Паркинсона | 2024 |
|
RU2828959C1 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ВОЗДЕЙСТВИЯ, ОТНОСЯЩЕГОСЯ К КОМПЛЕМЕНТАРНОЙ МЕДИЦИНЕ, ПУТЕМ ФУНКЦИОНАЛЬНОЙ МАГНИТНО-РЕЗОНАНСНОЙ ТОМОГРАФИИ ПРИ ЛЕЧЕНИИ БОЛЬНЫХ С АТЕРОСКЛЕРОТИЧЕСКИМИ СТЕНОЗАМИ СОННЫХ АРТЕРИЙ, С ПАНИЧЕСКИМИ РАССТРОЙСТВАМИ | 2019 |
|
RU2723607C1 |
| Способ интраоперационного нейрофизиологического мониторинга моторных и речевой зон головного мозга | 2019 |
|
RU2716507C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ЗАБОЛЕВАНИЙ НЕРВНОЙ СИСТЕМЫ | 2006 |
|
RU2326596C1 |
| СПОСОБ ДИАГНОСТИКИ НЕЙРОДЕГЕНЕРАТИВНОГО ЗАБОЛЕВАНИЯ ХОРЕИ ГЕНТИНГТОНА | 2007 |
|
RU2356498C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОТВЕТА ПАЦИЕНТА НА НЕЙРОФАРМАКОЛОГИЧЕСКОЕ ВМЕШАТЕЛЬСТВО, СИСТЕМА И МАШИНОЧИТАЕМЫЙ НОСИТЕЛЬ ДЛЯ ЕГО РЕАЛИЗАЦИИ | 2018 |
|
RU2794185C2 |
| Способ выявления зон активации для оценки управляющих функций мозга | 2018 |
|
RU2688993C1 |
| СПОСОБ НЕЙРОВИЗУАЛИЗАЦИИ ЗОН АКТИВАЦИИ ГОЛОВНОГО МОЗГА, ОТВЕТСТВЕННЫХ ЗА ХОДЬБУ | 2010 |
|
RU2428931C1 |
| ПРИМЕНЕНИЕ ГЕПТАПЕПТИДА ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА И СПОСОБ ЛЕЧЕНИЯ ТАКОЙ БОЛЕЗНИ | 2011 |
|
RU2450822C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ТИПА ДЕМЕНЦИИ | 2002 |
|
RU2228708C1 |
Изобретение относится к медицине, неврологии, оценке когнитивных процессов и зрительно-пространственного восприятия в головном мозге у пациентов с болезнью Паркинсона (БП). Может быть использовано в качестве биомаркера текущего нейродегенеративного процесса, а также оценки эффективности проводимого лечения. Проводят исследование головного мозга с помощью функциональной МРТ (фМРТ) в покое, выявляя зоны нейрональной активности сети пассивного режима работы головного мозга (СПРР). Данные зоны представлены отделами предклинья, задними отделами поясных извилин, медиальными лобными отделами, нижними теменными дольками правого и левого полушарий головного мозга. При наличии статистически значимого снижения спонтанной нейрональной активности только в нижней теменной дольке правого полушария СПРР относительно уровня нейрональной активности СПРР остальных ее зон диагностируют начальные нейродегенеративные проявления при БП. Способ обеспечивает высокую точность диагностики нейродегенеративного процесса при БП на раннем этапе его проявления. 3 ил., 1 табл.
Способ диагностики ранних нейродегенеративных проявлений при болезни Паркинсона (БП), включающий исследование головного мозга с помощью функциональной МРТ (фМРТ), отличающийся тем, что фМРТ проводят в покое, выявляя зоны нейрональной активности сети пассивного режима работы головного мозга (СПРР), представленные отделами предклинья, задними отделами поясных извилин, медиальными лобными отделами, нижними теменными дольками правого и левого полушарий головного мозга, и при наличии статистически значимого снижения спонтанной нейрональной активности только в нижней теменной дольке правого полушария СПРР относительно уровня нейрональной активности СПРР остальных ее зон диагностируют начальные нейродегенеративные проявления при БП.
| СЕЛИВЕРСТОВ Ю.А | |||
| и др | |||
| Функциональная магнитно-резонансная томография покоя и ее роль в изучении экстрапирамидных заболеваний// Сб | |||
| тр | |||
| конф | |||
| Болезнь Паркинсона и расстройства движений, М., 21-24 сентября 2014, с.138-142 | |||
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ТИПА ДЕМЕНЦИИ | 2002 |
|
RU2228708C1 |
| ФУНКЦИОНАЛЬНАЯ ВИЗУАЛИЗАЦИЯ ГОЛОВНОГО МОЗГА ДЛЯ ОБНАРУЖЕНИЯ И ОЦЕНКИ ОБМАНА И СКРЫТОГО ПРИЗНАНИЯ, И КОГНИТИВНОЙ/ЭМОЦИОНАЛЬНОЙ РЕАКЦИИ НА ИНФОРМАЦИЮ | 2002 |
|
RU2296508C2 |
| US 2008292557 A1, 27.11.2008 | |||
| EIDELBERG D.et al.Inferior parietal lobule. | |||
Авторы
Даты
2016-04-20—Публикация
2015-04-23—Подача