Область техники, к которой относится изобретение
Настоящее изобретение относится к соединению, которое представляет собой соль производного тетразолилгидроксиимина, способу очистки конкретного геометрического изомера указанного выше соединения и способу получения производного тетразолилоксима с использованием указанного выше соединения.
Уровень техники
Многочисленные агенты контроля были предложены для использования против заболеваний сельскохозяйственных и садовых культур. Например, Патентный документ 1 раскрывает производное тетразолилоксима (общая формула (Р)), который обладает превосходной фармакологической эффективностью для полезных растений, и предлагает применение этого производного в качестве агента контроля болезней растений.
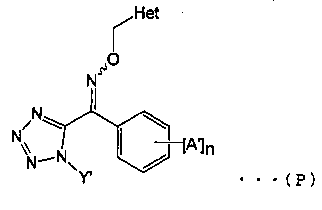
В общей формуле (Р), А′ представляет собой атом галогена, алкильную группу, алкоксигруппу, метансульфонильную группу, трифторметильную группу, арильную группу, цианогруппу или нитрогруппу, η представляет собой целое число от 0 до 5, Y′ представляет собой алкильную группу и Het представляет собой замещенную пиридильную группу или замещенную тиазолильную группу. Кроме того, в общей формуле (Ρ), "Ν~О" означает, что вышеупомянутая группа оксима может быть (Е) формы или (Z) формы.
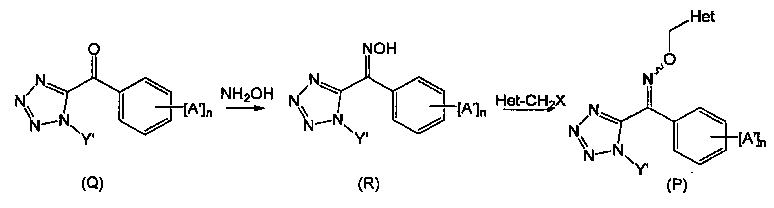
Производное тетразолилоксима, представленное указанной общей формулой (Р), может быть получено путем получения производного тетразолилгидроксиимина, представленного общей формулой (R), путем взаимодействия гидроксиламина с производным 1-алкил-5-бензоил-1Н-тетразола, представленного общей формулой (Q), и затем взаимодействием его с Het-CH2X (где X представляет собой атом хлора, атом брома или атом иода) в присутствии основания (такого как гидрид натрия, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, карбонат цезия, триэтиламин, пиридин или Ν,Ν-диметиламинопиридин). Кроме того, производное 1-алкил-5-бензоил-1Н-тетразола, представленное общей формулой (Q), может быть синтезировано, например, способом, раскрытым в патентном документе 2. Кроме того, галогенированное производное пиколина, описанное в патентном документе 3, например, может быть использовано для Het-CH2X.
Производное тетразолилоксима, представленное общей формулой (Р), имеет (Е) форму и (Z) форму стереоизомеров на основе двойной связи углерод-азота оксимной группы. Хотя, как (Z) форма, так и (Е) форма обладают активностью, (Z), форма является предпочтительной.
Документы предшествующего уровня техники
Патентные документы
Патентный документ 1: международная публикация WO 2003/016303
Патентный документ 2: международная публикация WO 2010/001597
Патентный документ 3: международная публикация WO 2011/111831
Раскрытие изобретения
Проблемы, решаемые с помощью изобретения
Производные тетразолилоксима, представленные общей формулой (Р), как правило, получают в виде смеси (Е) формы и (Z) формы. Следовательно, для того чтобы получить только (Z) форму, смесь (Е) формы и (Z) формы должна быть подвергнута стадии очистки, такой как разделение и очистка с помощью колоночной хроматографии на силикагеле.
С другой стороны, для того, чтобы синтезировать только (Z) форму в синтезе производного тетразолилоксима, представленного общей формулой (Р), предпочтительно использовать только (Z) форму вышеуказанного производного тетразолилгидроксиимина, представленного общей формулой (R), в качестве исходного материала. Однако, поскольку производное тетразолилгидроксиимина, представленное общей формулой (R), также обычно получают в виде смеси (Е) формы и (Z) формы, требуется аналогичная стадия очистки для того, чтобы получить только (Z) форму.
Задачей настоящего изобретения является получение соединения, которое является предпочтительным в качестве промежуточного соединения синтеза для получения (Z) формы производного тетразолилоксима, представленного общей формулой (Р), с высокой чистотой путем ингибирования количества (Е) формы, присутствующей в нем и способ получения, указанного выше соединения.
Средства для решения проблем
В результате проведения обширных исследований для решения вышеуказанных проблем, авторы настоящего изобретения обнаружили, что эффективность кристаллизации (Z) формы, извлекаемой в виде кристалла, может быть значительно повышена путем кристаллизации спиртом за счет преобразования указанного выше производного тетразолилгидроксиимина, представленного общей формулой (Р), в соль щелочного металла или соль щелочноземельного металла, и что скорости реакции реакций фотоизомеризации таких солей быстрее, чем скорость вышеуказанного производного тетразолилгидроксиимина, позволяя достигать равновесия в течение короткого периода времени, и приводя таким образом к выполнению настоящего изобретения.
А именно, соединение по настоящему изобретению, способ получения этого соединения, способ очистки (Z) формы этого соединения, и способ получения (Z) формы этого соединения являются такими, как описано в [1] до [11] ниже.
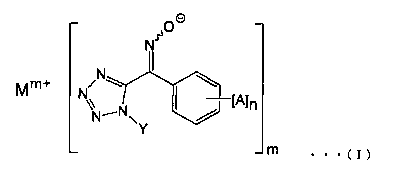
[1] Соединение, представленное общей формулой (I):
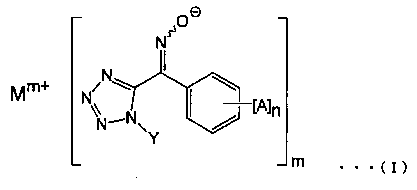
(где А представляет собой атом галогена, алкильную группу, галогеналкильную группу, алкоксигруппу, галогеналкоксигруппу, алкилсульфонильную группу, незамещенную или замещенную арильную группу, цианогруппу или нитрогруппу, n представляет собой целое число от 0 до 5 (и А могут быть одновременно одинаковыми или различными, когда n равно 2 или более), Υ представляет собой алкильную группу, Μ представляет собой щелочной металл или щелочноземельный металл, а m представляет собой целое число 1 или 2).
[2] Соединение по [1] выше, которое является (Z) формой.
[3] Соединение по [1] или [2] выше, которое содержит 2 молекулы воды на каждую его молекулу.
[4] Соединение по любому из [1] до [3] выше, где Μ представляет собой щелочной металл.
[5] Способ получения соединения, представленного общей формулой (I), который включает стадию (А), приводящую соединение щелочного металла или щелочноземельного металла во взаимодействие с производным тетразолилоксима, представленного общей формулой (II):
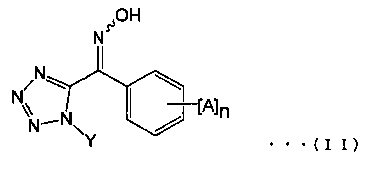
(где А представляет собой атом галогена, алкильную группу, галогеналкильную группу, алкоксигруппу, галогеналкоксигруппу, алкилсульфонильную группу, незамещенную или замещенную арильную группу, цианогруппу или нитрогруппу, n представляет собой целое число от 0 до 5 (и А могут быть одновременно одинаковыми или различными, когда n равно 2 или более), и Υ представляет собой алкильную группу).
[6] Способ очистки (Ζ) формы соединения, представленного общей формулой (I), который включает стадию (В) кристаллизации кристаллов (Ζ) формы соединения, представленного общей формулой (I), путем добавления спирта к водному раствору соединения, представленного общей формулой (I).
[7] Способ очистки по [6] выше, где спирт представляет собой низший спирт.
[8] Способ получения (Ζ) формы соединения, представленного общей формулой (I), который включает стадию (С) облучения светом раствора, содержащего (Е) форму соединения, представленного общей формулой (I), и изомеризацию в (Ζ) форму.
[9] Способ получения (Ζ) формы соединения, представленного общей формулой (I), по [8] выше, который включает:
стадию (С), в которой раствор, содержащий (Е) форму соединения, представленного общей формулой (I), представляет собой водный раствор, а
стадию (Β′) осаждения кристаллов (Ζ) формы соединения, представленного общей формулой (I), путем добавления спирта к водному раствору, после стадии (С′).
[10] Способ получения производного тетразолилоксима, представленного общей формулой (IV), который включает стадию (D1) получения производного тетразолилоксима, представленного общей формулой (IV), путем взаимодействия соединения, представленного общей формулой (I), с галогенидом, представленным общей формулой (III):
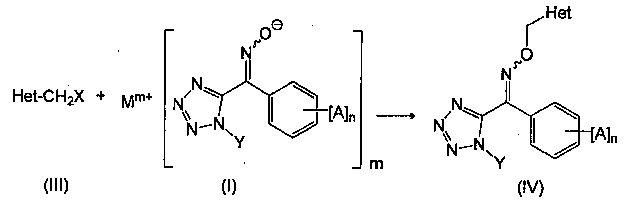
(где, в общей формуле (III), Het представляет собой замещенную пиридильную группу или замещенную тиазолильную группу, и
X представляет собой атом галогена, и
в общей формуле (IV), Het, Χ, Α, n и Υ являются соответственно такими же, как определено выше в общей формуле (III) и общей формуле (I)).
[11] Способ получения производного тетразолилоксима, представленного общей формулой (IV), по [10] выше, где соединение галогенида, представленное общей формулой (III), представляет собой производное галогенированного пиколина, представленного общей формулой (VI):
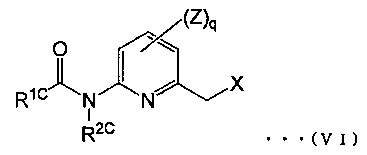
(где,
R1C представляет собой незамещенную или замещенную алкильную группу, или незамещенную или замещенную алкоксигруппу,
R2C представляет атом водорода, незамещенную или замещенную алкоксикарбонильную группу или незамещенную или замещенную ацильную группу,
X представляет собой атом галогена,
Ζ представляет собой атом галогена, цианогруппу, нитрогруппу, гидроксильную группу, тиольную группу, формильную группу, карбоксильную группу, незамещенную или замещенную аминогруппу, незамещенную или замещенную алкильную группу, незамещенную или замещенную алкенильную группу, незамещенную или замещенную алкинильную группу, незамещенную или замещенную арильную группу, незамещенную или замещенную гетероциклическую группу, OR3, S(O)pR3, COR3 или CO2R3 (где R3 представляет собой незамещенную или замещенную аминогруппу, незамещенную или замещенную алкильную группу, незамещенную или замещенную алкенильную группу, незамещенную или замещенную алкинильную группу, незамещенную или замещенную арильную группу или незамещенную или замещенную гетероциклическую группу, и p обозначает число атомов кислорода, показанное в скобках, и представляет собой целое число от 0 до 2), и
q обозначает количество заместителей Ζ и является целым числом от 0 до 3, и несколько Ζ могут быть одновременно одинаковыми или различными, когда q равно 2 или более).
Эффекты изобретения
(Z) форма среди геометрических изомеров соединения по настоящему изобретению может быть легко отделена и очищена от (Е) формы. Кроме того, (Z) форма соединения по настоящему изобретению может быть получена из (Е) формы, как легко, так и за короткий период времени за счет реакции фотоизомеризации. Следовательно, соединение по настоящему изобретению является особенно полезным в качестве промежуточного соединения синтеза для получения производных тетразолилоксима, которые являются полезными в качестве активных ингредиентов агрохимикатов и т.п., а также использование вышеуказанного соединения дает возможность производить (Z) форму производного тетразолилоксима как легко, так и с высокой степенью чистоты.
Лучший вариант осуществления изобретения
Хотя ниже приводится разъяснение предпочтительных примеров осуществления настоящего изобретения, настоящее изобретение не ограничивается этими примерами. Составляющие настоящего изобретения могут быть добавлены, удалены, замещены или модифицированы другими способами в пределах, которые не отклоняются от сущности настоящего изобретения.
<Соединение, представленное общей формулой (I)>
Соединение по настоящему изобретению характеризуется тем, что оно, представлено общей формулой (I):
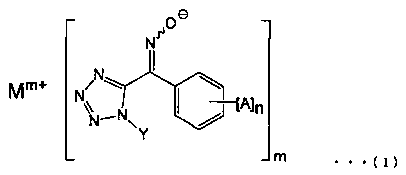
(где А представляет собой атом галогена, алкильную группу, галогеналкильную группу, алкоксигруппу, галогеналкокси группу, алкилсульфонильную группу, незамещенную или замещенную арильную группу, цианогруппу или нитрогруппу, n представляет собой целое число от 0 до 5 (и А могут быть одновременно одинаковыми или различными, когда n равно 2 или более), Υ представляет собой алкильную группу, Μ представляет собой щелочной металл или щелочноземельный металл, и m представляет собой целое число 1 или 2).
В общей формуле (I), А представляет собой атом галогена, алкильную группу, галогеналкильную группу, алкоксигруппу, галогеналкоксигруппу, алкилсульфонильную группу, незамещенную или замещенную арильную группу, цианогруппу или нитрогруппу.
Примеры атомов галогена включают атом фтора, атом хлора, атом брома и атом йода.
Примеры алкильных групп включают метальную группу, этильную группу, н-пропильную группу, изо-пропильную группу, н-бутильную группу, изо-бутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу и н-гексильную группу. Число атомов углерода, составляющих алкильную группу, предпочтительно равно от 1 до 8.
Примеры галогеналкильных групп включают фторметильную группу, хлорметильную группу, бромметильную группу, дифторметильную группу, дихлорметильную группу, трифторметильную группу, трихлорметильную группу, трифторэтильную группу, пентафторэтильную группу, 3,3,3,2,2-пентафторпропильную группу и 2,2,2-трифтор-1-трифторметилэтильную группу. Число атомов углерода, составляющих галогеналкильную группу, предпочтительно равно от 1 до 8.
Примеры алкоксигрупп включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изо-пропоксигруппу, н-бутоксигруппу, изо-бутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу и н-гексилоксигруппу. Число атомов углерода, составляющих алкоксигруппу, предпочтительно равно от 1 до 8.
Примеры галогеналкоксигрупп включают 2-хлор-н-пропоксигруппу, 2,3-дихлорбутоксигруппу и трифторметоксигруппу. Число атомов углерода, составляющих галогеналкоксигруппу, предпочтительно равно от 1 до 8.
Примеры алкилсульфонильных групп включают метилсульфонильную группу, этилсульфонильную группу, н-пропилсульфонильную группу, изо-пропилсульфонильную группу и трет-бутилсульфонильную группу. Число атомов углерода, составляющих алкилсульфонильную группу, предпочтительно равно от 1 до 8.
Арильная группа относится к моноциклической или полициклической арильной группе. Кроме того, полициклические арильные группы являются такими, что, при условии, по крайней мере, одно из колец является ароматическим кольцом, а остальные кольца могут быть насыщенными кольцами, ненасыщенными кольцами или ароматическими кольцами. Арильные группы, имеющие от 6 до 10 атомов углерода, являются предпочтительными.
Конкретные примеры незамещенных арильных групп включают фенильную группу, 1-нафтильную группу, 2-нафтильную группу, азуленильную группу, инданильную группу и тетранильную группу.
Нет особых ограничений в отношении заместителя в замещенной арильной группе при условии, что это химически приемлемая группа. Более конкретно, примеры заместителей включают такие, которые указаны ниже.
(1) атомы галогена, такие как атом фтора, атом хлора, атом брома или атом йода; (2) алкильные группы, такие как метальная группа, этильная группа, н-пропильная группа, изо-пропильная группа, н-бутильная группа, втор-бутильная группа, изо-бутильная группа, трет-бутильная группа, н-пентильная группа или н-гексильная группа; (3) циклоалкильные группы, такие как циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа или циклогептильная группа; (4) алкоксигруппы, такие как метоксигруппа, этоксигруппа, н-пропоксигруппа, изо-пропоксигруппа, н-бутоксигруппа, изо-бутоксигруппа, втор-бутоксигруппа или трет-бутоксигруппа; (5) алкенильные группы, такие как винильная группа, 1-пропенильная группа, 2-пропенильная группа, 1-бутенильная группа, 2-бутенильная группа, 3-бутенильная группа, 1-метил-2-пропенильная группа, 2-метил-2-пропенильная группа, 1-пентенильная группа, 2-пентенильная группа, 3-пентенильная группа, 4-пентенильная группа, 1-метил-2-бутенильная группа, 2-метил-2-бутенильная группа, 1-гексенильная группа, 2-гексенильная группа, 3-гексенильная группа, 4-гексенильная группа или 5-гексенильная группа;
(6) циклоалкенильные группы, такие как 2-циклопропенильная группа, 2-циклопентенильная группа, 3-циклогексенильная группа или 4-циклооктенильная группа; (7) алкенилоксигруппы, такие как винилоксигруппа, аллилоксигруппа, 1-пропенилоксигруппа или 2-бутенилоксигруппа; (8) алкинильные группы, такие как этинильная группа, 1-пропинильная группа, 2-пропинилъная группа, 1-бутинильная группа, 2-бутинильная группа, 3-бутинильная группа, 1-метил-2-пропинильная группа, 2-метил-3-бутинильная группа, 1-пентинильная группа, 2-пентинильная группа, 3-пентинильная группа, 4-пентинильная группа, 1-метил-2-бутинильная группа, 2-метил-3-пентинильная группа, 1-гексинильная группа или 1,1-диметил-2-бутинильная группа; (9) алкинилоксигруппы, такие как этинилоксигруппа или пропаргилокси группа; (10) арильные группы, такие как фенильная группа, 1-нафтильная группа или 2-нафтильная группа;
(11) арилоксигруппы, такие как феноксигруппа или 1-нафтоксигруппа; (12) аралкильные группы, такие как бензильная группа или фенетильная группа; (13) аралкилоксигруппы, такие как бензилоксигруппа или фенетилоксигруппа; (14) ацильные группы, такие как формильная группа, ацетильная группа, пропионильная группа, бензоильная группа, циклогексилкарбонильная группа или фталоильная группа; (15) алкоксикарбонильные группы, такие как метоксикарбонильная группа, этоксикарбонильная группа, н-пропоксикарбонильная группа, изо-пропоксикарбонильная группа, н-бутоксикарбонильная группа или трет-бутоксикарбонильная группа; (16) карбоксильные группы; (17) гидроксильные группы; (18) галогеналкильные группы, такие как хлорметильная группа, хлорэтильная группа, 1,2-дихлор-н-пропильная группа, 1-фтор-н-бутильная группа или перфтор-н-пентильная группа; (19) галогеналкоксигруппы, такие как 2-хлор-н-пропоксигруппа, 2,3-дихлорбутоксигруппа или трифторметоксигруппа; (20) галогеналкенильные группы, такие как 2-хлор-1-пропенильная группа или 2-фтор-1-бутенильная группа; (21) галогеналкинильные группы, такие как 4,4-дихлор-1-бутинильная группа, 4-фтор-1-пентинильная группа или 5-бром-2-пентинильная группа;
(22) галогеналкенилоксигруппы, такие как 2-хлор-1-пропенилоксигруппа или 3-бром-2-бутенилоксигруппа; (23) галогеналкинильные группы, такие как 3-хлор-пропаргильная группа или 3-иод-пропаргильная группа; (24) галогеналкинилоксигруппы, такие как 3-хлор-пропаргилоксигруппа или 3-иод-пропаргилоксигруппа; (25) галогенарильные группы, такие как 4-хлорфенильная группа, 4-фторфенильная группа или 2,4-дихлорфенильная группа; (26) галогенарилоксигруппы, такие как 4-фторфеноксигруппа или 4-хлор-1-нафтоксигруппа; (27) замещенные галогеном ацильные группы, такие как хлорацетильная группа, трифторацетильная группа, трихлорацетильная группа или 4-хлорбензоильная группа; (28) алкоксиалкильные группы, такие как метоксиметильная группа, этоксиметильная группа, 1-этоксиэтильная группа или 2-этоксиэтильная группа; (29) алкоксиалкоксигруппы, такие как метоксиметоксигруппа, этоксиметоксигруппа, 1-этоксиэтоксигруппа или 2-этоксиэтоксигруппа: (30) цианогруппы;
(31) изоцианогруппы; (32) нитрогруппы; (33) изоцианатогруппы; (34) цианатогруппы; (35) аминогруппы (группы NH2); (36) алкиламиногруппы, такие как метиламиногруппа, диметиламиногруппа или диэтиламиногруппа; (37) ариламиногруппы, такие как анилиногруппа, нафтиламиногруппа или антранил аминогруппа; (38) аралкиламиногруппы, такие как бензиламиногруппа или фенэтиламиногруппа; (39) алкилсульфониламиногруппы, такие как метилсульфониламиногруппа, этилсульфониламиногруппа, н-пропилсульфониламиногруппа, изо-пропилсульфониламиногруппа или н-бутилсульфониламиногруппа; (40) арилсульфониламиногруппы, такие как фенилсульфониламиногруппа;
(41) гетероарилсульфониламиногруппы, такие как группы пиразинилсульфониламиногруппа; (42) ациламиногруппы, такие как формиламиногруппа, ацетиламиногруппа, пропаноиламиногруппа, бутириламиногруппа, изо-пропилкарбониламиногруппа или бензоиламиногруппа; (43) алкоксикарбониламиногруппы, такие как метоксикарбониламиногруппа или этоксикарбониламиногруппа; (44) галогеналкилсульфониламиногруппы, такие как фторметилсульфониламиногруппа, хлорметилсульфониламиногруппа, бромметилсульфониламиногруппа, дифторметилсульфониламиногруппа, дихлорметилсульфониламиногруппа, 1,1-дифторэтилсульфониламиногруппа, трифторметилсульфониламиногруппа, 2,2,2-трифторэтилсульфониламиногруппа или пентафторэтилсульфониламиногруппа; (45) бис(алкилсульфонил)аминогруппы, такие как бис(метилсульфонил)аминогруппа, бис(этилсульфонил)аминогруппа, (этилсульфонил)(метилсульфонил)аминогруппа, бис(н-пропилсульфонил)аминогруппа, бис(изо-пропилсульфонил)аминогруппа, бис(н-бутилсульфонил)аминогруппа или бис(трет-бутилсульфонил)аминогруппа;
(46) бис(галогеналкилсульфонил)аминогруппы, такие как бис(фторметилсульфонил)аминогруппа, бис(хлорметилсульфонил)аминогруппа, бис(бромметилсульфонил)аминогруппа, бис(дихлорметилсульфонил)аминогруппа, бис(1,1-дифторэтилсульфонил)аминогруппа, бис(трифторметилсульфонил)аминогруппа, бис(2,2,2-трифторэтилсульфонил)аминогруппа или бис(пентафторэтилсульфонил)аминогруппа; (47) незамещенные или замещенные гидразиногруппы, такие как гидразиногруппа, N′-фенилгидразиногруппа, N`-метоксикарбонилгидразиногруппа, N`-ацетилгидразиногруппа или Ν′-метилгидразиногруппа; (48) незамещенные или замещенные аминокарбонильные группы, такие как аминокарбонильная группа, диметиламинокарбонильная группа, фениламинокарбонильная группа или N-фенил-N-метиламинокарбонильная группа; (49) незамещенные или замещенные гидразинокарбонильные группы, такие как гидразинокарбонильная группа, N′-метилгидразинокарбонильная группа или Ν′-фенилгидразинокарбонильная группа; (50) незамещенные или замещенные иминоалкильные группы, такие как N-метилиминометильная группа, 1-Ν-фенилиминоэтильная группа, N-гидроксииминометильная группа или Ν-метоксииминометильная группа;
(51) тиольные группы; (52) изотиоцианатные группы; (53) тиоцианатные группы; (54) алкилтиогруппы, такие как метилтиогруппа, этилтиогруппа, н-пропилтиогруппа, изо-пропилтиогруппа, н-бутилтиогруппа, изо- бутилтиогруппа, втор-бутилтиогруппа или трет-бутилтиогруппа; (55) алкенилтиогруппы, такие как винилтиогруппа или аллилтиогруппа; (56)алкинилтиогруппы, такие как этилтиогруппа или пропаргилтиогруппа; (57) арилтиогруппы, такие как фенилтиогруппа или нафтилтиогруппа; (58) гетероарилтиогруппы, такие как 2-пиридилтиогруппа или 3-пиридазилтиогруппа; (59) аралкилтиогруппы, такие как бензилтиогруппа или фенэтилтиогруппа; (60) гетероарилалкилтиогруппы, такие как 2-пиридилметилтиогруппа или 2-фурилметилтиогруппа; (61) алкилтиокарбонильные группы, такие как метилтиокарбонильная группа, этилтиокарбонильная группа, н-пропилтиокарбонильная группа, изо-пропилтиокарбонильная группа, н-бутилтиокарбонильная группа, изо-бутилтиокарбонильная группа, втор-бутилтиокарбонильная группа или трет-бутилтиокарбонильная группа;
(62) алкилтиоалкильные группы, такие как метилтиометильная группа или 1-метилтиоэтильная группа; (63) арилтиоалкильные группы, такие как фенилтиометильная группа или 1-фенилтиоэтильная группа; (64) алкилтиоалкокси группы, такие как метилтиометоксигруппа или 1-метилтиоэтоксигруппа; (65) арилтиоалкоксигруппы, такие как фенилтиометоксигруппа или 1-фенилтиоэтоксигруппа; (66) алкилсульфинильные группы, такие как метилсульфинильная группа, этилсульфинильная группа или трет-бутилсульфинильная группа; (67) алкенилсульфинильные группы, такие как аллилсульфинильная группа; (68) алкинилсульфинильные группы, такие как пропаргилсульфинильная группа; (69) арилсульфинильные группы, такие как фенилсульфинильная группа; (70) гетероарилсульфинильные группы, такие как 2-пиридилсульфинильная группа или 3-пиридилсульфинильная группа; (71) аралкилсульфинильные группы, такие как бензилсульфинильная группа или фенэтилсульфинильная группа; (72) гетероарилалкилсульфинильные группы, такие как 2-пиридилметилсульфинильная группа или 3-пиридилметилсульфинильная группа;
(73) алкилсульфонильные группы, такие как метилсульфонильная группа, этилсульфонильная группа или трет-бутилсульфонильная группа; (74) алкенилсульфонильные группы, такие как аллилсульфонильная группа; (75) алкинилсульфонильные группы, такие как пропаргилсульфонильная группа; (76) арилсульфонильные группы, такие как фенилсульфонильная группа; (77) гетероарилсульфонильные группы, такие как 2-пиридилсульфонильная группа или 3-пиридилсульфонильная группа; (78) аралкилсульфонильные группы, такие как бензилсульфонильная группа или фенэтилсульфонильная группа; (79) гетероарилалкилсульфонильные группы, такие как 2-пиридилметилсульфонильная группа или 3-пиридилметилсульфонильная группа; (80) ненасыщенные пятичленные гетероциклические группы, такие как фуран-2-ильная группа, фуран-3-ильная группа, тиофен-2-ильная группа, тиофен-3-ильная группа, пиррол-2-ильная группа, пиррол-3 -ильная группа, оксазол-2-ильная группа, оксазол-4-ильная группа, оксазол-5-ильная группа, тиазол-2-ильная группа, тиазол-4-ильная группа, тиазол-5-ильная группа, изоксазол-3-ильная группа, изоксазол-4-ильная группа, изоксазол-5-ильная группа, изотиазол-3-ильная группа, изотиазол-4-ильная группа, изотиазол-5-ильная группа, имидазол^2-ильная группа, имидазол-4-ильная группа, имидазол-5-ильная группа, пиразол-3-ильная группа, пиразол-4-ильная группа, пиразол-5-ильная группа, 1,3,4-оксадиазол-2-ильная группа, 1,3,4-тиадиазол-2-ильная группа, 1,2,3-триазол-4-ильная группа, 1,2,4-триазол-3-ильная группа или 1,2,4-триазол-5-ильная группа;
(81) ненасыщенные 6-членные гетероциклические группы, такие как пиридин-2-ильная группа, пиридин-3-ильная группа, пиридин-4-ильная группа, 5-хлор-3-пиридильная группа, 3-трифторметил-2-пиридильная группа, пиридазин-3-ильная группа, пиридазин-4-ильная группа, пиразин-2-ильная группа, пиримидин-5-ильная группа, 1,3,5-триазин-2-ильная группа или 1,2,4-триазин-3-ильная группа; (82) насыщенные или частично ненасыщенные гетероциклические группы, такие как тетрагидрофуран-2-ильная группа, тетрагидропиран-4-ильная группа, пиперидин-3-ильная группа, пирролидин-2-ильная группа, морфолино группа, пиперидино группа, N-метилпиперазиногруппа или оксазолин-2-ильная группа; (83) гетероциклооксигруппы, такие как 2-пиридилоксигруппа или 3-изоксазолилоксигруппа; (84) гетероарилалкильные группы, такие как 2-пиридилметильная группа или 3-пиридилметильная группа; и (85) гетероарилалкокси группы, такие как 2-пиридилметоксигруппа или 3-пиридилметоксигруппа.
Указанные заместители, приведенные в качестве примеров в (1) до (85) могут дополнительно иметь заместители, примеры которых приведены в (1) по (85) в пределах химически приемлемого диапазона.
Конкретные примеры замещенных арильных групп включают 4-фторфенильную группу, 4-хлорфенильную группу, 2,4-дихлорфенильную группу, 3,4-дихлорфенильную группу, 3,5-дихлорфенильную группу, 2,6-дифторфенильную группу, 4-трифторметилфенильную группу, 4-метоксифенильную группу, 3,4-диметоксифенильную группу, 3,4-метилендиоксифенильную группу, 4-трифторметоксифенильную группу и 4-метокси-1-нафтильную группу.
Среди них, А предпочтительно представляет собой атом галогена.
В общей формуле (I), n представляет собой целое число от 0 до 5, предпочтительно представляет собой целое число от 0 до 3, и более предпочтительно представляет собой 0. Кроме того, А могут быть одновременно одинаковыми или различными, когда n равно 2 или более.
В общей формуле (I), Y представляет собой алкильную группу. Примеры алкильных групп включают метальную группу, этильную группу, н-пропильную группу, изо-пропильную группу, н-бутильную группу, изо-бутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу и н-гексильную группу. Среди них, Y предпочтительно представляет собой алкильную группу, имеющую от 1 до 6 атомов углерода, более предпочтительно представляет собой алкильную группу, имеющую от 1 до 3 атомов углерода, и особенно предпочтительно представляет собой метальную группу.
В общей формуле (I), M представляет собой щелочной металл или щелочноземельный металл. Примеры щелочных металлов включают натрий, калий и литий, а примеры щелочноземельных металлов включают магний и кальций. Среди них, М, предпочтительно, представляет собой натрий или калий, и более предпочтительно, натрий.
В общей формуле (I), m представляет собой целое число, равное 1 или 2. m равно 1, в случае, когда M означает щелочной металл, в то время как m равно 2, в том случае, когда M представляет собой щелочноземельный металл.
Соединение, представленное общей формулой (I) по настоящему изобретению, предпочтительно представляет собой соединение, в котором А представляет собой атом галогена, n представляет собой целое число от 0 до 3, Y представляет собой алкильную группу, имеющую от 1 до 6 атомов углерода, M представляет собой натрий, калий, литий, магний или кальций, и m представляет собой целое число 1 или 2, более предпочтительно соединение, в котором n равно 0, Y представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода, M представляет собой натрий, калий, литий, магний или кальций и m представляет собой целое число 1 или 2, еще более предпочтительно, соединение, в котором n равно 0, Y представляет собой алкильную группу, имеющую от 1 до 6 атомов углерода, M обозначает натрий или калий, и m представляет собой 1, еще более предпочтительно, соединение, в котором n равно 0, Y представляет собой алкильную группу, содержащую от 1 до 3 атомов углерода, M представляет натрий или калий, и m представляет собой 1, и, особенно предпочтительно соединение, в котором n равно 0, Y представляет собой алкильную группу, содержащую от 1 до 3 атомов углерода, M представляет натрий и m равно 1.
Соединение, представленное общей формулой (I), имеет геометрические изомеры, состоящие из (Е) формы (представленной следующей общей формулой (1-Е)) и (Z) формы (представленной следующей общей формулой (I-Z)). В изобретении настоящей заявки и описании настоящей заявки, как (Е) форма, так и (Z) форма включены в соединения, представленные общей формулой (I), если не указано иное. В частности, соединение, представленное общей формулой (I), может быть (Е) формой или (Z) формой.
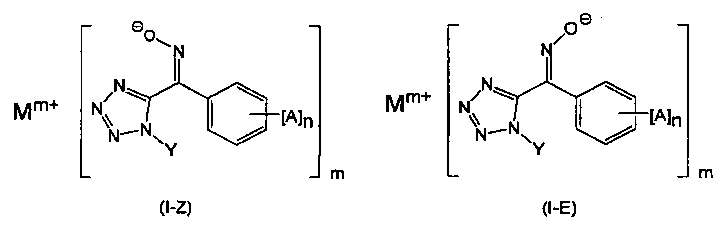
Кроме того, гидраты, различные типы сольватов, кристаллические полиморфы и т.п., также включены в соединения, представленные общей формулой (I). Соединение, представленное общей формулой (I) по настоящему изобретению, предпочтительно, содержит молекулы воды в виде гидрата и тому подобное, и более предпочтительно содержит две молекулы молекул воды. Например, кристалл соединения, представленного общей формулой (I) по настоящему изобретению, содержит две молекулы кристаллической воды на молекулу соединения. Кристаллы, содержащие указанные две молекулы молекул воды имеют большую термическую стабильность, чем кристаллы производного тетразолилоксима, представленного общей формулой (II), которые будут впоследствии описаны.
<Способ получения соединения, представленного общей Формулой (I)>
Соединение, представленное общей формулой (I), может быть синтезировано из известного соединения с использованием известной химической реакции.
Например, соединение, представленное формулой (I), могут быть получены с помощью стадии (А) приводя соединение щелочного металла или соединение щелочноземельного металла во взаимодействие с производным тетразолилоксима, представленного общей формулой (II):
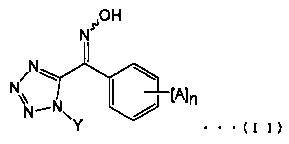
(где Α, n и Υ представляют собой алкильные группы).
Производное тетразолилоксима, представленное общей формулой (II), может быть синтезировано из известного соединения с использованием известной химической реакции. Более конкретно, пример способа синтеза производного тетразолилоксима, представленного общей формулой (II), состоит в реакции гидроксиламина с производным 1-алкил-5-бензоил-1Н-тетразола (смотри, например, патентный документ 2).
Конкретные примеры соединений щелочных металлов и соединений щелочноземельных металлов, используемых на стадии (А), включают гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия или гидроксид лития, гидроксиды щелочноземельных металлов, такие как гидроксид магния или гидроксид кальция, карбонаты, такие как карбонат натрия, карбонат калия, карбонат лития, карбонат магния, карбонат кальция, бикарбонат натрия или бикарбонат калия, гидриды, такие как гидрид натрия, гидрид лития или гидрид кальция, и алкоксиды металлов, такие как метоксид натрия, этоксид натрия или метоксид магния. Среди них, предпочтительны гидроксиды щелочных металлов.
Нет особых ограничений в отношении растворителя, используемого в реакции на стадии (А) при условии, что растворитель, способен растворить любое производное тетразолилоксима, представленное общей формулой (II), соединение щелочного металла или соединение щелочноземельного металла, и соединение, представленное общей формулой (I). Растворитель на стадии (А) предпочтительно является водой или низшим спиртом.
Температура реакции на стадии (А) может быть соответствующим образом установлена с учетом таких факторов, как тип используемого растворителя. Например, температура реакции в случае использования воды в качестве растворителя, составляет 0°С до 100°С, предпочтительно, 20°С до 80°С и более предпочтительно, 40°С до 80°С. Несмотря на различия в зависимости от таких факторов, как масштабы реакции, время реакции составляет обычно от 15 минут до 24 часов.
<Способ очистки (Z) формы соединения, представленного общей формулой (I)>
(Z) форма соединения, представленного общей формулой (I) по настоящему изобретению, может быть преимущественно кристаллизована в отношении (Е) формы, в случае кристаллизации с использованием спирта в качестве слабого растворителя. Это может быть использовано для очистки соединения, представленного общей формулой (I), путем отделения (Z) формы от (Е) формы. Выход после кристаллизации (Z) формы является выше для соединения, представленного общей формулой (I), чем производного тетразолилоксима, представленного общей формулой (II). Следовательно, получение соединения, представленного общей формулой (I), с последующей его кристаллизацией позволяет получить (Z) форму, с более высокой чистотой (а именно, содержащую более низкий уровень примеси (Е) формы), чем прямая кристаллизация производного тетразолилоксима, представленного общей формулой (II).
Более конкретно, (Z) форма может быть очищена с помощью стадии (В) для кристаллизации (Z) формы соединения, представленного общей формулой (I), путем добавления спирта к водному раствору соединения, представленного общей формулой (I).
На стадии (В), несмотря на то, что водный раствор, к которому добавляют спирт требует только присутствия соединение, представленного общей формулой (I), которое по меньшей мере содержит (Z) форму, предпочтительно раствор содержит как (Z) форму, так и форму (Е) соединения, представленного общей формулой (I). В этом случае, кристаллизуют большую часть (Z) формы (например, 95% или более и предпочтительно 98% или более), в то время как почти вся (Е) форма остается растворенной в маточном растворе. В настоящем изобретении, поскольку эффективность кристаллизации (Z) формы чрезвычайно высока, (Z) форма может быть эффективно отделена от (Е) формы и извлечена.
Спирт, используемый на стадии (В), может быть линейным спиртом или разветвленным спиртом. Вышеупомянутый спирт предпочтительно представляет собой низший спирт, имеющий от 1 до 6 атомов углерода и более предпочтительно низший спирт, имеющий от 1 до 4 атомов углерода. Конкретные примеры спиртов включают метанол, этанол, н-пропанол, изопропанол (2-пропанол), н-бутанол, 2-бутанол, 2-метил-1-пропанол и 2-метил-2-пропанол. Среди них, метанол, этанол, н-пропанол и изопропанол, являются предпочтительными, и изопропанол является более предпочтительным.
Хотя нет особых ограничений в отношении количества спирта, добавляемого к водному раствору соединения, представленного общей формулой (I), предусмотрено, что это количество, которое обеспечивает кристаллизацию (Z) формы, предпочтительно, примерное количество, равное от 1 до 100 раз больше количества водного раствора и более предпочтительно примерное количество равное от 2 до 30 раз больше количества водного раствора. Спирт может быть добавлен к водному раствору, указанному выше, весь сразу или может быть добавлен путем разделения на множество добавок.
Температура кристаллизации на стадии (В) требуется только такая, чтобы быть равной или ниже, чем температура кипения спирта, и реакция кристаллизации может быть осуществлена с температурой, например, в 20°С до 80°С, предпочтительно 30°С до 70°С и более предпочтительно 40°С до 65°С. Кроме того, может быть осуществлено перемешивание в процессе кристаллизации. Затем водный раствор может быть охлажден до примерно 0°С до 10°С по мере необходимости и выдержан в течение примерно 30 минут до 2 часов.
Выпавшие в осадок кристаллы (Z) формы содержат две молекулы воды на одну молекулу вещества в виде кристаллической воды. Эти кристаллы могут быть выделены путем обработки разделением на твердую и жидкую фазы. Выделенные кристаллы могут быть промыты водным спиртом и т.п. с последующей сушкой при необходимости.
<Способ получения (Z) формы соединения, представленного общей формулой (I)>
Соединение, представленное общей формулой (I), подвергают реакции изомеризации при облучении светом таким же образом, что и производное тетразолилоксима, представленное общей формулой (II), и, в конечном счете, количественное соотношение между (Е) формой и (Z) формой (соотношение, при котором каждый изомер присутствует в расчете на общее количество (Е) формы и (Z) формы) достигает состояния равновесия. Следовательно, в случае, когда количественное соотношение (Z) формы меньше, чем количественное соотношение при равновесии в растворе, в котором соединение, представленное общей формулой (I), было растворено в подходящем растворителе, содержание (Z) формы может быть дополнительно увеличено за счет проведения реакции фотоизомеризации в вышеуказанном растворе. В частности, соединение, представленное общей формулой (I), демонстрирует более высокую скорость фотоизомеризации, чем производное тетразолилоксима, представленное общей формулой (II), и равновесие будет достигнуто за более короткий промежуток времени. Следовательно, соединение, представленное общей формулой (I), дает возможность увеличить количество (Z) формы за счет реакции фотоизомеризации в более короткий промежуток времени, чем производное тетразолилоксима, представленное общей формулой (II).
Более конкретно, (Z), форма может быть получена на стадии (С) для изомеризации (Е) формы в (Z) форму путем облучения раствора, содержащего (Е) форму соединения, представленного общей формулой (I), светом.
Хотя нет никаких конкретных ограничений на содержание (Z) формы соединения, представленного общей формулой (I), в растворе, облученном светом на стадии (С), предпочтительно, оно ниже, чем количественно соотношение формы (Z) в конечном состоянии равновесия, достигнутого в результате реакции фотоизомеризации. А именно, количественное соотношение (Z) формы соединения, представленного общей формулой (I), в растворе, облученном светом на стадии (С), предпочтительно составляет 10% или менее, более предпочтительно 5% или менее и еще более предпочтительно 1% или менее.
Особых ограничений в отношении растворителя для раствора, облучаемого светом на стадии (С) нет при условии, что он способен растворить соединение, представленное общей формулой (I), и не легко поглощает излучаемый свет, и может быть водой или органическим растворителем. На стадии (С), растворителем предпочтительно является вода, так как она обладает благоприятной растворимостью по отношению к соединению, представленному общей формулой (I), а также обладает высоким пропускания света. Водный раствор соединения, представленного общей формулой (I), может также содержать другие компоненты в дополнение к воде, и соединению, представленному общей формулой (I), при условии, что они не ухудшают реакцию фотоизомеризации.
Особых ограничений в отношении света, излучаемого на стадии (С) нет при условии, что он способен передавать световую энергию достаточную для изомеризации соединения, представленного общей формулой (I), от (Е) формы к (Z) форме. Свет, излучаемый на стадии (С), предпочтительно представляет собой ультрафиолетовое излучение, более предпочтительно является излучением, имеющим длину волны от 185 нм до 400 нм, а еще более предпочтительно излучением, имеющим длину волны от 300 нм до 400 нм.
Время, в течение которого требуется облучение светом на стадии (С), должно быть количеством времени, которое приводит к дозе облучения, что позволяет реакции изомеризации соединения, представленного общей формулой (I), перейти в раствор, и, хотя облучение светом может быть прекращено до того, как вышеуказанный раствор достигнет равновесия, количество времени, предпочтительно является таким, которое приводит к дозе облучения, которая является достаточной для достижения равновесия. Как правило, количественное соотношение (Z) формы больше, чем количество (Е) формы при равновесии. Другими словами, в результате достижения равновесия, содержание (Z) формы в растворе может быть увеличено до максимального количества, которое может быть, как ожидается, будет достигнуто путем реакции фотоизомеризации. Так как скорость реакции изомеризации соединения, представленного общей формулой (I), является высокой, например, равновесие может быть достигнуто путем облучения светом с длиной волны от 365 нм в течение 15 минут до 60 минут.
Кроме того, (Z) форма соединения, представленного общей формулой (I), может быть получена в большом количестве даже более эффективно при комбинировании указанных выше стадий (В) и (С).
Например, раствор, облученный светом на вышеуказанной стадии (С) приводят к водному раствору, содержащему (Е) форму соединения, представленного общей формулой (I), и (Е) форму подвергают изомеризации в (Z) форму путем облучения вышеуказанного раствора светом (стадия (С′)), с последующим осаждением кристаллов (Z) формы соединения, представленного общей формулой (I), путем добавления спирта к вышеуказанному раствору (стадии (В′)). В соответствии с вышеуказанным способом, (Z) форма, на которого ее количество было увеличено путем реакции фотоизомеризации, может быть отделена от (Е) формы и осаждена в виде кристаллов путем кристаллизации из спирта.
Кроме того, после вышеупомянутой стадии (В), следовые количества (Z) формы и большее количество (Е) формы содержатся в оставшемся маточном растворе, из которого кристаллы (Z) формы были извлечены с помощью обработки разделением на твердую и жидкую фазы. Таким образом, вышеупомянутый маточный раствор приводят к раствору, который облучают светом на вышеуказанной стадии (С) с последующим облучением светом для изомеризации (Е) формы в вышеупомянутом маточном растворе в (Z) форму. После реакции фотоизомеризации, только что полученная (Z) форма может быть осаждена в виде кристаллов путем концентрирования вышеуказанного маточного раствора или повторения добавления спирта.
В результате проведения приведенного ряда стадий, с высокой степенью чистоты (Z) форма, в которой количество загрязняющей (Е) формы является крайне низким, может быть извлечено быстро и в больших количествах из смеси (Z) формы и (Е) формы, полученной в результате реакции синтеза, такой как синтез на стадии (А).
<Способ получения производного тетразолилоксима, представленного общей формулой (IV)>
Соединение, представленное общей формулой (I), используют в качестве промежуточного соединения для получения агента для контроля болезней растений и тому подобного.
Например, производное тетразолилоксима, представленное общей формулой (IV), может быть получено взаимодействием соединения, представленного общей формулой (I), с галогенидом, представленным общей формулой (III) (стадия (D1)).
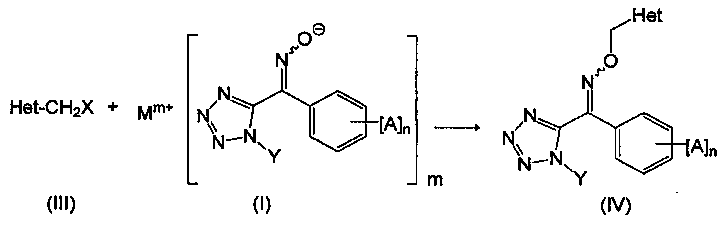
В общей формуле (III), Het представляет собой замещенную пиридильную группу или замещенную тиазолильную группу. Заместители в замещенной пиридильной группе или замещенной тиазолильной группе, представленные за счет Het могут быть замещены химически приемлемыми группами с помощью известной химической реакции.
В общей формуле (III), X представляет собой атом галогена. Примеры атомов галогена включают атом фтора, атом хлора, атом брома и атом йода.
В общей формуле (IV), Het, Χ, Α, n и Υ являются соответственно такими же, как в общей формуле (III) и общей формуле (I).
Примеры галогенида, представленного общей формулой (III), включают галогенированные производные пиколина, представленные общей формулой (VI) (смотри, например, патентный документ 3):
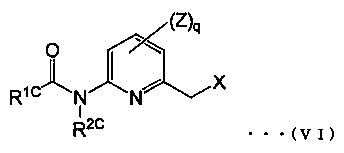
(где,
R1C представляет собой незамещенную или замещенную алкильную группу, или незамещенную или замещенную алкокси группу,
R2C представляет атом водорода, незамещенную или замещенную алкоксикарбонильную группу или незамещенную или замещенную ацильную группу,
X представляет собой атом галогена,
Ζ представляет собой атом галогена, цианогруппу, нитрогруппу, гидроксильную группу, тиольную группу, формильную группу, карбоксильную группу, незамещенную или замещенную аминогруппу, незамещенную или замещенную алкильную группу, незамещенную или замещенную алкенильную группу, незамещенную или замещенную алкинильную группу, незамещенную или замещенную арильную группу, незамещенную или замещенную гетероциклическую группу, OR3, S(O)pR3, COR3 или CO2R3 (где R3 представляет собой незамещенную или замещенную аминогруппу, незамещенную или замещенную алкильную группу, незамещенную или замещенную алкенильную группу, незамещенную или замещенную алкинильную группу, незамещенную или замещенную арильную группу или незамещенную или замещенную гетероциклическую группу, и p обозначает число атомов кислорода, приведенное в скобках, и представляет собой целое число от 0 до 2), и
q обозначает количество заместителей Ζ и является целым числом от 0 до 3, и множество Ζ могут быть одновременно одинаковым или различным, когда q равно 2 или более).
В общей формулы (VI), R1C представляет собой незамещенную или замещенную алкильную группу, или незамещенную или замещенную алкоксигруппу. Особых ограничений в отношении заместителей в R1C нет при условии, что они инертны в реакции с соединением, представленным общей формулой (I).
Алкильная группа, в R1C может быть линейной, разветвленной или циклической. Кроме того, число атомов углерода в вышеуказанной алкильной группе, предпочтительно, составляет от 1 до 6.
Примеры незамещенных алкильных групп включают метальную группу, этильную группу, н-пропильную группу, изо-пропильную группу, н-бутильную группу, изо-бутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу, н-октильную группу, циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу, циклогептильную группу, 2,2-диметилциклопропильную группу и ментальную группу.
Примеры замещенных алкильных групп включают хлорметильную группу, фторметильную группу, трифторметильную группу, метоксиметильную группу, этоксиметильную группу, метоксиэтильную группу, метоксипропильную группу, этоксибутильную группу, метоксибутильную группу, метоксигексильную группу, пропоксиоктильную группу, 2-метокси-1,1-диметилэтильную группу, 1-этокси-1-метилэтильную группу, карбометоксиметальную группу, 1-карбоэтокси-2,2-диметил-3-циклопропильную группу, гидроксиметильную группу, гидроксиэтильную группу и 1-гидроксипропильную группу. Замещенная алкильная группа, предпочтительно представляет собой галогеналкильную группу.
Алкоксигруппа в R1C может быть линейной, разветвленной или циклической. Вышеупомянутая алкоксигруппа предпочтительно содержит от 1 до 6 атомов углерода.
Примеры незамещенных алкоксигрупп включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изо-пропоксигруппу, н-бутоксигруппу, изо-бутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу, н-пентилоксигруппу, н-гексилоксигруппу, н-децилоксигруппу, циклопропилоксигруппу, циклобутилоксигруппу, циклопентилоксигруппу, циклогексилоксигруппу и ментилоксигруппу.
Примеры замещенных алкоксигрупп включают хлорметоксигруппу, фторметоксигруппу, трифторметоксигруппу, метоксиметоксигруппу, этоксиметоксигруппу, метоксиэтоксигруппу, 3-этоксипропоксигруппу, 2-этоксибутоксигруппу, 4-бутоксибутоксигруппу, 1-бутоксипентоксигруппу, форметоксиметоксигруппу, дихлорметоксиметоксигруппу, 1,2-дибром-3-метоксипропоксигруппу и 3-изопропокси-2-метилпропоксигруппу.
В общей формулы (VI), R2C представляет атом водорода, незамещенную или замещенную алкоксикарбонильную группу, или незамещенную или замещенную ацильную группу.
Примеры незамещенных алкоксикарбонильных групп в R2C включают метоксикарбонильную группу, этоксикарбонильную группу, изо-пропоксикарбонильную группу, н-пропоксикарбонильную группу, н-бутоксикарбонильную группу, изо-бутоксикарбонильную группу, втор-бутоксикарбонильную группу и трет-бутоксикарбонильную группу.
Примеры замещенных алкоксикарбонильных групп в R2C включают цианометоксикарбонильную группу, 1-цианоэтоксикарбонильную группу, 2-цианоэтоксикарбонильную группу, нитрометоксикарбонильную группу, хлорметоксикарбонильную группу, фторметоксикарбонильную группу, дифторметоксикарбонильную группу, трифторметоксикарбонильную группу, 2-фторэтоксикарбонильную группу, 2,2,2-трифторэтоксикарбонильную группу, метоксиметоксикарбонильную группу, этоксиметоксикарбонильную группу, 1-метоксиэтоксикарбонильную группу, 2-метоксиэтоксикарбонильную группу и 2-хлорэтоксиметоксикарбонильную группу.
Ацильная группа в R2C представляет собой группу, в которой атом водорода, алкильная группа, алкенильная группа, алкинильная группа, арильная группа или гетероциклическая группа связаны с карбонильной группой.
Примеры незамещенных арильных групп включают алкилкарбонильные группы, такие как формильная группа, ацетильная группа, пропионильная группа, н-пропилкарбонильная группа, н-бутилкарбонильная группа, октаноильная группа, изо-пропилкарбонильная группа, изо-бутилкарбонильная группа, пивалоильная группа или изовалерильная группа, алкенилкарбонильные группы, такие как акрилоильная группа или метакрилоильная группа, алкинилкарбонильные группы, такие как пропиолоильная группа, арилкарбонильные группы, такие как бензоильная группа, и гетероциклические карбонильные группы, такие как 2-пиридилкарбонильная группа или тиенилкарбонильная группа.
Примеры замещенных арильных групп в R2C включают фторацетильную группу, хлорацетильную группу, нитроацетильную группу, цианоацетильную группу, метоксиацетильную группу, дибромацетильную группу, трифторацетильную группу, трихлорацетильную группу, трибромацетильную группу, 3,3,3-трифторпропионильную группу, 3,3,3-трихлорпропионильную группу, 2,2,3,3,3-пентафторпропионильную группу и 4-хлорбензоильную группу.
Среди указанных значений, R2C в общей формуле (VI), предпочтительно представляет собой атом водорода, незамещенную бензоильную группу или замещенную бензоильную группу. Примеры замещенных бензоильных групп включают 2,6-диметоксибензоильную группу, 3,5-нитробензоильную группу, 2,4,6-трихлорбензоильную группу и 4-хлорбензоильную группу.
В общей формуле (VI), X представляет собой атом галогена. Примеры атомов галогена включают атом фтора, атом хлора, атом брома и атом йода. Среди них атом хлора или брома является предпочтительным.
В общей формуле (VI), Ζ представляет собой атом галогена, цианогруппу, нитрогруппу, гидроксильную группу, тиольную группу, формильную группу, карбоксильную группу, незамещенную или замещенную аминогруппу, незамещенную или замещенную алкильную группу, незамещенную или замещенную алкенильную группу, незамещенную или замещенную алкинильную группу, незамещенную или замещенную арильную группу, незамещенную или замещенную гетероциклическую группу, OR3, S(O)pR3, COR3 или CO2R3.
Примеры атомов галогена в Ζ являются такими же, как примеры атомов галогена в X.
Незамещенная аминогруппа в Ζ представляет собой группу, имеющую ΝΗ2-структуру. Примеры замещенных аминогрупп включают метиламиногруппу, диметиламиногруппу, метилэтиламиногруппу, диэтиламиногруппу, трет-бутоксикарбонилметиламиногруппу, трет-бутоксикарбониламиногруппу, ацетилметиламиногруппу, ацетилэтиламиногруппу и бензоилметиламиногруппу.
Примеры незамещенных или замещенных алкильных групп в Ζ являются такими же, как примеры незамещенных или замещенных алкильных групп в вышеуказанном R1C.
Незамещенная или замещенная алкенильная группа в Ζ предпочтительно является группой, содержащей от 2 до 8 атомов углерода.
Примеры незамещенных алкенильных групп включают винильную группу, 1-пропенильную группу, 2-пропенильную группу, 1-бутенильную группу, 2-бутенильную группу, 3-бутенильную группу, 1-метил-2-пропенильную группу, 2-метил-2-пропенильную группу, 1-пентенильную группу, 2-пентенильную группу, 3-пентенильную группу, 4-пентенильную группу, 1-метил-2-бутенильную группу, 2-метил-2-бутенильную группу, 1-гексенильную группу, 2-гексенильную группу, 3-гексенильную группу, 4-гексенильную группу и 5-гексенильную группу.
Примеры замещенных алкенильных групп включают 2-хлорэтинильную группу, 2-фторэтенильную группу, 3,3,3-трифтор-1-пентенильную группу, 1,2,2-трифторэтенильную группу, 2,3,3-трифтор-2-пропенильную группу, 2,3,3-трииодо-2-пропенильную группу и 2-метоксиэтенильную группу.
Незамещенная или замещенная алкинильная группа в Ζ предпочтительно является группой, содержащей от 2 до 8 атомов углерода.
Примеры незамещенных алкинильных групп включают этинильную группу, 1-пропинильную группу, 2-пропинильную группу, 1-бутинильную группу, 2-бутинильную группу, 3-бутинильную группу, 1-метил-2-пропинильную группу, 2-метил-3 бутинильную группу, 1-пентинильную группу, 2-пентинильную группу, 3-пентинильную группу, 4-пентинильную группу, 1-метил-2-бутинильную группу, 2-метил-3-пентинильную группу, 1-гексинильную группу и 1,1 диметил-2-бутинильную группу.
Примеры замещенных алкинильных групп включают 2-хлорэтинильную группу, 2-фторэтинильную группу, 3-фтор-1-пропинильную группу, 3,3,3-трифтор-1-пропинильную группу, 3-фтор-2-пропинильную группу и 3-иод-2-пропинильную группу.
Незамещенная или замещенная арильная группа в Ζ представляет собой моноциклическую или полициклическую арильную группу. Полициклическая арильная группа является такой группой, обеспечивающей, что по крайней мере, одно из колец является ароматическим кольцом, а остальные кольца могут быть насыщенными алифатическими кольцами, ненасыщенными алифатическими кольцами или ароматическими кольцами.
Примеры незамещенных арильных групп включают фенильную группу, 1-нафтильную группу, 2-нафтильную группу, азуленильную группу, инденильную группу, инданильную группу или тетралинильную группу.
Примеры замещенных арильных групп включают 6-метилфенильную группу, 4-метилфенильную группу, 4-фторфенильную группу, 4-хлорфенильную группу, 2,4-дихлорфенильную группу, 3,4-дихлорфенильную группу, 3,5-дихлорфенильную группу, 2,6-дифторфенильную группу, 4-трифторметилфенильную группу, 4-метоксифенильную группу, 3,4-диметоксифенильную группу, 3,4-метилендиоксифенильную группу, 3-феноксифенильную группу, 4-трифторметоксифенильную группу и 4-метокси-1-нафтильную группу.
Примеры незамещенных гетероциклических групп в Ζ включают ненасыщенные пятичленные гетероциклические группы, такие как фуран-2-ильная группа, фуран-3-ильная группа, тиофен-2-ильная группа, тиофен-3-ильная группа, пиррол-2-ильная группа, пиррол-3-ильная группа, оксазол-2-ильная группа, оксазол-4-ильная группа, оксазол-5-ильная группа, тиазол-2-ильная группа, тиазол-4-ильная группа, тиазол-5-ильная группа, изоксазол-3-ильная группа, изоксазол-4-ильная группа, изоксазол-5-ильная группа, изотиазол-3-ильная группа, изотиазол-4-ильная группа, изотиазол-5-ильная группа, имидазол-2-ильная группа, имидазол-4-ильная группа, имидазол-5-ильная группа, пиразол-3-ильная группа, пиразол-4-ильная группа, пиразол-5-ильная группа, 1,3,4-оксадиазол-2-ильная группа, 1,3,4-тиадиазол-2-ильная группа, 1,2,3-триазол-4-ильная группа, 1,2,4-триазол-3-ильная группа или 1,2,4-триазол-5-ильная группа; ненасыщенные шестичленные гетероциклические группы, такие как пиридин-2-ильная группа, пиридин-3-ильная группа, пиридин-4-ильная группа, 5-хлор-3-пиридильная группа, 3-трифторметил-2-пиридильная группа, пиридазин-3-ильная группа, пиридазин-4-ильная группа, пиразин-2-ильная группа, пиримидин-5-ильная группа, 1,3,5-триазин-2-ильная группа или 1,2,4-триазин-3-ильная группа; и, насыщенные или частично ненасыщенные гетероциклические группы, такие как тетрагидрофуран-2-ильная группа, тетрагидропиран-4-ильная группа, пиперидин-3-ильная группа, пирролидин-2-ильная группа, морфолино группа, пиперидино групп, пиперазино группа, N-метилпиперазино группа, азилидино группа, азетидино группа, пирролидино группу или оксазолин-2-ильная группа.
Примеры замещенных гетероциклических групп включают 3-трифторметилпиридин-2-ильную группу, 4-трифторметокси-2-пиридильную группу, 3-метил-1-пиразолильную группу, 4-трифторметил-1-имидазолильную группу и 3,4-дифторпирролидиногруппу.
R3 в OR3, S(O)pR3, COR3 или CO2R3, представляющий Ζ, представляет собой незамещенную или замещенную аминогруппу, незамещенную или замещенную алкильную группу, незамещенную или замещенную алкенильную группу, незамещенную или замещенную алкинильную группу, незамещенную или замещенную арильную группу или незамещенную или замещенную гетероциклическую группу. p обозначает количество атомов кислорода, приведенное в скобках, и представляет собой целое число от 0 до 2.
Примеры незамещенной или замещенной аминогруппы, незамещенной или замещенной алкильной группы, незамещенной или замещенной алкенильной группы, незамещенной или замещенной алкинильной группы, незамещенной или замещенной арильной группы и незамещенной или замещенной гетероциклической группы в R3 такие же, как примеры, приведенные в вышеуказанных объяснениях R1C и Ζ.
Конкретные примеры OR3 включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изо-пропоксигруппу, н-бутоксигруппу, втор-бутоксигруппу, изо-бутоксигруппу, трет-бутоксигруппу, метоксиметоксигруппу, этоксиметоксигруппу, метоксиэтоксигруппу, этоксиэтоксигруппу, винилоксигруппу, 1-пропенилоксигруппу, 2-пропенилоксигруппу, этинилоксигруппу, 1-пропинилоксигруппу, 2-пропинилоксигруппу, аминооксигруппу, метиламинооксигруппу, диэтиламинооксигруппу, метоксикарбониламинооксигруппу, феноксигруппу, трихлорметоксигруппу, трифторметоксигруппу, дифторметоксигруппу, 2,2,2-трифторэтоксигруппу, пентафторэтоксигруппу и 2-фторэтоксигруппу.
Конкретные примеры S(O)pR3 включают диметиламинотиогруппу, хлорметилтиогруппу, 3-бутенилтиогруппу, этинилтиогруппу, 3-метилфенилтиогруппу, метилсульфинильную группу, этилсульфинильную группу, 1-бутенсульфинильную группу, 1-гексинилсульфинильную группу, 2,3-диметилфенилсульфинильную группу, метилсульфонильную группу, диметиламиносульфонильную группу, N-этил-N-метиламиносульфонильную группу, н-гексилсульфонильную группу, 2-метил-2-бутенилсульфонильную группу, 2-пропинилсульфонильную группу, 2-нафтилсульфонильную группу, фенилсульфонильную группу, 2-нитрофенилсульфонильную группу и p-толилсульфонильную группу.
Конкретные примеры COR3 включают ацетильную группу, бензоильную группу, пропаноильную группу, изо-пропилкарбонильную группу, трет-бутилкарбонильную группу, циклопропилкарбонильную группу, циклобутилкарбонильную группу, циклопентилкарбонильную группу, винилкарбонильную группу, 1-пропенилкарбонильную группу, 2-пропенилкарбонильную группу, изо-пропенилкарбонильную группу, 1-пропинилкарбонильную группу, 2-пропинилкарбонильную группу, 3-бутенилкарбонильную группу, метиламинокарбонильную группу, диметиламинокарбонильную группу, N-метил-N-этиламинокарбонильную группу, азиридинокарбонильную группу, азетидинокарбонильную группу, пирролидинокарбонильную группу, пиперидинокарбонильную группу, морфолинокарбонильную группу, пиперазинокарбонильную группу и N-метилпиперазинокарбонильную группу.
Конкретные примеры CO2R3 включают метоксикарбонильную группу, трифторметоксикарбонильную группу, 1-пентенилоксикарбонильную группу, 2-пропинилоксикарбонильную группу и феноксикарбонильную группу.
Среди приведенных значений, Ζ в общей формуле (VI) предпочтительно представляет собой атом галогена, незамещенную или замещенную аминогруппу, незамещенную алкильную группу, OR3 или SR3, а более предпочтительно незамещенную или замещенную аминогруппу, незамещенную алкильную группу, OR3 или SR3. Незамещенная или замещенная аминогруппа в Ζ предпочтительно представляет собой незамещенную аминогруппу или диалкиламиногруппу, незамещенная алкильная группа, предпочтительно, представляет собой группу, имеющую от 1 до 4 атомов углерода, OR3 предпочтительно представляет алкоксигруппу, имеющую от 1 до 4 атомов углерода, и SR3 предпочтительно представляет алкилтиогруппу, имеющую от 1 до 4 атомов углерода.
В общей формулы (VI), q обозначает количество заместителей Ζ и является целым числом от 0 до 3. Множество Ζ могут быть одновременно одинаковым или различным, когда q равно 2 или более, и q особенно предпочтительно равен 0.
Галогенированное производное пиколина, представленное общей формулой (VI) может быть получено взаимодействием галогенирующего агента с производным 2-амино-6-метилпиридина, имеющим соответствующую структуру.
Реакция на стадии (D1), может быть также проведена в присутствии основания. Примеры оснований, используемых в данной реакции, включают неорганические основания, такие как гидроксид натрия, гидроксид калия, гидрид натрия, карбонат натрия или карбонат калия, и органических оснований, таких как триэтиламин, 4-(диметиламино)пиридин, пиридин, 1,8-диазабицикло[5.4.0]ундецен-7 или 1,5-диазабицикло[4.3.0]нонен-5. Один тип этих оснований может быть использован по отдельности или два или больше типов могут использоваться в комбинации. Среди них, предпочтительно используют гидроксиды щелочных металлов, такие как гидроксид натрия или гидроксид калия.
Количество используемого основания, как правило, составляет от 0,01 моль до 100 моль, и предпочтительно от 0,1 моль до 5 моль, в расчете на 1 моль соединения, представленного общей формулой (I).
Эта реакция может быть проведена в присутствии или в отсутствие растворителя.
Никаких особых ограничений в отношении используемого растворителя нет, при условии, что растворитель является инертным в настоящей реакции. Примеры растворителей включают растворители на основе углеводородов, такие как пентан, гексан, гептан, бензол, толуол или ксилол, растворители на основе галогенов, такие как дихлорметан, хлороформ или четыреххлористый углерод, растворителей на основе нитрилов, таких как ацетонитрил или пропионитрил, растворители на основе простых нитрилов, таких как диэтиловый эфир, диоксан или тетрагидрофуран, растворители на основе амидов, такие как Ν,Ν-диметилформамид, Ν,Ν-диметилацетамид или N-метилпирролидон, растворители на основе сульфоксидов, такие как диметилсульфоксид, вода и смеси этих растворителей.
Нет особых ограничений в отношении процедуры и т.д. реакции между галогенированным производным пиколина, представленного общей формулой (VI), и соединения, представленного общей формулой (I). Например, соединение, представленное общей формулой (I), может быть добавлено в раствор органического растворителя, содержащего галогенированное производное пиколина, представленного общей формулой (VI), и дают возможность реагировать.
Хотя температура от начала до конца реакции на стадии (D1) может быть постоянной или может изменяться, как правило, при температуре держится в пределах от -70°С до +200°С и, предпочтительно, в пределах от -20°С до +100°С. Несмотря на различия в зависимости от таких факторов, как масштаб реакции, время реакции составляет обычно от 30 минут до 24 часов.
В случае использования соединения, в котором R2C не является атомом водорода для галогенированного производного пиколина, представленного общей формулой (VI), производное тетразолилоксима, в котором R2C в общей формуле (IV), представляет собой атом водорода могут быть получены взаимодействием основания на производное тетразолилоксима, представленного общей формулой (IV), полученного после стадии (D1) (стадии (D2)).
Кроме того, основание может быть подвергнуто взаимодействию с продуктом реакции, а именно производным тетразолилоксима, представленного общей формулой (IV), без выполнения процедуры очистки от реакционной жидкости, полученной путем прохождения через указанной выше стадию (D1), или процедура очистки может быть проведена на реакционной жидкости, полученной, проходя через стадию (D1) с последующим выделением указанного выше продукта реакции и взаимодействием на него основания. Примеры способов очистки включают дистилляцию, перекристаллизацию и колоночную хроматографию.
Конкретных ограничений в отношении основания, используемого на стадии (D2) нет при условии, что оно способно вызвать исключение R2C в производном тетразолилоксима, представленного общей формулой (IV). Примеры основания включают гидроксиды щелочных металлов, такие как гидроксид натрия или гидроксид калия, гидроксиды щелочноземельных металлов, такие как гидроксид магния или гидроксид кальция, карбонаты, такие как карбонат натрия, карбонат калия, карбонат магния или карбонат кальция, гидридов, таких как гидрид натрия или гидрид кальция, алкоксиды металлов, такие как метоксид натрия, этоксид натрия или метоксид магния и органические основания, такие как триэтиламин, триизопропилэтиламин, пиридин, Ν,Ν-диметиламинопиридин, 1,4-диазабицикло [2.2.2] октан, 4-(диметиламино)пиридин, 1,8-диазабицикло[5.4.0]ундец-7-ен или 1,5-диазабицикло[4.3.0]нон-5-ен. Один тип этих оснований может быть использован по отдельности или два или больше типов могут использоваться в комбинации.
Количество основания, используемого на стадии (D2), как правило, составляет от 0,01 моль до 100 моль, и предпочтительно от 0,1 моль до 5 моль, в расчете на 1 моль производного тетразолилоксима, представленного общей формулой (IV).
Кроме того, в случае проведения реакции стадии (D1) в присутствии основания и использовании данной реакционной жидкости, полученной на стадии (D1), непосредственно на стадии (D2), без удаления основания из реакционной жидкости, полученной на стадии (D1), количество добавленного основания на стадии (D2) можно регулировать с учетом количества основания, используемого на стадии (D1).
Реакция стадии (D2) может быть осуществлена в присутствии или в отсутствие растворителя. Особых ограничений нет при условии, используемый растворитель является инертным в данной реакции. Его конкретными примерами являются такие же растворители, которые перечислены в качестве примеров растворителей в объяснении стадии (D1). Если растворитель, используемый на стадии (D2) является таким же, как растворитель, используемый на стадии (D1), нет необходимости для замены растворителя, когда переходят из стадии (D1) на стадию (D2), что является выгодным с точки зрения стоимости производства.
Нет особых ограничений в отношении процедуры и т.п., используемых, чтобы привести во взаимодействие основание с продуктом реакции на стадии (D1). Например, реакция может быть осуществлена путем добавления основания к продукту реакции стадии (D1), а именно, к раствор органического растворителя, содержащего производное тетразолилоксима, представленного общей формулой (IV).
Хотя температуру от начала до конца реакции на стадии (D2) можно поддерживать постоянной или можно изменять, как правило, температура находится в пределах от -0°С до температуры кипения растворителя, и предпочтительно в диапазоне 10°С до 60°С. Несмотря на различия в зависимости от таких факторов, как концентрация основания или масштаб реакции, время реакции составляет обычно от 5 минут до 24 часов.
Кроме того, соль производного тетразолилоксима, представленного общей формулой (IV), может быть получена взаимодействием кислоты с вышеуказанным производным тетразолилоксима в соответствии с обычными методами. Нет особых ограничений в отношении соли производного тетразолилоксима, представленного общей формулой (IV), при условии, что это сельско- и садово-хозяйственно-приемлемая соль. Их примеры включают соли неорганических кислот, такие как гидрохлориды, нитраты, сульфаты или фосфаты, и соли органических кислот, такие как ацетаты, лактаты, пропионаты или бензоаты.
Целевое производное тетразолилоксима, представленное общей формулой (IV), и его соль могут быть выделены путем проведения обычной процедуры последующей обработки после завершения любой из реакций. Кроме того, если требуется очистка продукта, известны широко используемые средства очистки, такие как дистилляция, перекристаллизации или колоночная хроматография. Структура целевого продукта может быть идентифицирована и подтверждена измерением спектра 1Н-ЯМР, ИК-спектра и масс-спектра, или путем элементарного анализа и тому подобное.
Производное тетразолилоксима, представленное общей формулой (IV), или его соль, полученные указанным способом, является предпочтительным для использования в качестве активного ингредиента бактерицида и тому подобного. Вышеуказанный бактерицид может быть использован в качестве сельскохозяйственного химического препарата для оказания помощи роста сельскохозяйственных и садовых культур, в качестве агента для предотвращения прилипания ракообразных и моллюсков, или в качестве антибактериального агента или агента против плесени для стен, ванны, обувь или одежды.
Примеры
Хотя ниже приводится более подробное описание настоящего изобретения за счет его примеров, настоящее изобретение не ограничивается этими примерами.
Пример 1
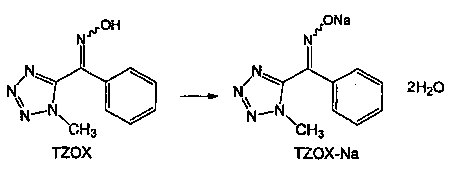
5 г чистой воды (0,1 л/моль по отношению к TZ) и 90 мл метанола (0,9 л/моль) добавляли к 300 мл в четырехгорлую колбу. (1-Метил)-1Н-тетразол-5-ил) (фенил) метанон (TZ) (0,05 моль) и 6,2 г HAS (сульфат гидроксиламина) (1,50 моль%/ΤΖ) добавляли в колбу с последующей реакцией в течение 20 часов при 55°С до 60°С.
После подтверждения с помощью ВЭЖХ, что реакция закончилась, метанол и воду концентрировали при пониженном давлении с получением суспензии с последующим добавлением 50 мл (1 л/моль) чистой воды к ней и проведением кристаллизации при 5°С. Выпавшие в осадок кристаллы отфильтровывали и дважды промывали 25 мл чистой воды с последующей сушкой, чтобы получить 9,14 г (1-метил-1Н-тетразол-5-ил)(фенил) метаноноксим (TZOX) (выход: 90% мол/TZ). Количественное соотношение между (Е) формой и (Z) формой полученного TZOX была такой, что (Е) форма: (Z) форме=8:92.
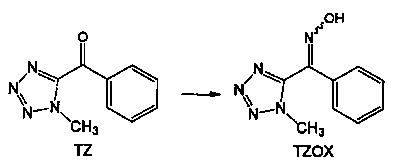
3,3 г чистой воды (65 г/моль по отношению к TZOX) и 8,57 г 28% по массе водного раствора гидроксида натрия (120 моль% по отношению к TZOX) добавляли в 300 мл четырехгорлую колбу. 10,16 г (0,05 моль, E:Z=8:92) ранее синтезированного TZOX добавляли при нагревании этой жидкости при 55°С до 60°С. После реакции в течение 0,5 часов, пока в данном состоянии, добавляли 100 мл (2 л/моль) изопропилового спирта (IPA). Затем, после реакции в течение 1 часа при 50±5°С, жидкость охлаждают до 5°С или ниже и оставляют кристаллизоваться в течение 1 часа.
После фильтрации осажденной соли TZOX-Na, кристаллы промывали 50 мл раствора IPA/H2O=90:10 при охлаждении с последующим высушиванием.
Когда высушенные кристаллы TZOX-Na взвесили, обнаружили, что их вес 11,8 г (чистота: 77% по массе, как TZOX). Кроме того, количественное соотношение (Е) формы к (Z) форме составило 0,5:99,5, а скорость восстановление (Z) формы составляла 95% или выше. Кроме того, вышеуказанная соль TZOX-Na представляла собой соединение, которое имеет две молекулы кристаллизованной воды.
Пример 2
20 г (200 г/моль по отношению к TZOX) чистой воды и 7,6 г (120 моль% по отношению к TZOX) кристаллического гидроксида калия добавляли в 300 мл четырехгорлую колбу и растворяли. 20,3 г (0,10 моль, Ε:Ζ=6:94) ранее синтезированного TZOX добавляли при нагревании этой жидкости при 55°С до 60°С. После реакции в течение 0,5 часов, пока в этом состоянии, добавляли 200 мл (2 л/моль) IPA. Затем, после реакции в течение 1 часа при 50±5°С, жидкость охлаждали до 5°С или ниже и оставляли кристаллизоваться в течение 1 часа.
После фильтрации осажденной соли TZOX-K, кристаллы промывали 50 мл раствора IPA/H20=90:10 при охлаждении с последующим высушиванием.
Когда высушенные кристаллы TZOX-K взвесили, обнаружили, что их вес равен 20,1 г (чистота: 74% по массе, как TZOX). Кроме того, количественное соотношение (Е) формы и (Z) формы составляло 99,5:0,5, и степень извлечения (Z) формы составила 77%. Кроме того, вышеуказанная соль TZOX-K представляла собой соединение, которое имеет две молекулы кристаллизованной воды.
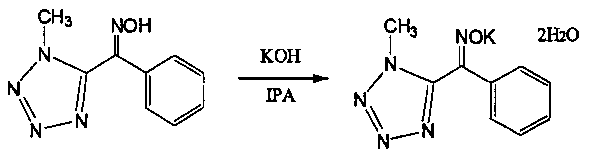
Поскольку полученная TZOX-K·2H2O представляет собой соль, которая содержит две молекулы воды, соединение может быть обработано более безопасно по сравнению с обычной свободной формой TZOX, которая связана с риском взрыва пыли.
Пример 3
25 г (250 г/моль по отношению к TZOX) чистой воды и 5,0 г (120 моль% по отношению к TZOX) кристаллического гидроксида лития добавляли в 300 мл четырехгорлую колбу и растворяли. 20,3 г (0,10 моль, Ε:Ζ=6:94) ранее синтезированного TZOX добавляли при нагревании этой жидкости при 55°С до 60°С. После реакции в течение 0,5 часов, пока в этом состоянии, добавляли 200 мл (2 л/моль) IPA. Затем, после реакции в течение 1 часа при 50±5°С, жидкость охлаждали до 5°С или ниже и оставляли кристаллизоваться в течение от 3 часов до 5 часов.
После фильтрации осажденной соли TZOX-Li, кристаллы промывали 50 мл раствора IPA/H20=90:10 при охлаждении с последующим высушиванием.
Когда высушенные кристаллы TZOX-Li взвесили, обнаружили, что их вес равен 20,1 г (чистота: 83% по массе, как TZOX). Кроме того, количественное соотношение (Е) формы и (Z) формы составляло 99,5:0,5, и степень извлечения (Z) формы составила 90%. Кроме того, вышеуказанная соль TZOX-Li представляла собой соединение, которое имеет две молекулы кристаллизованной воды.
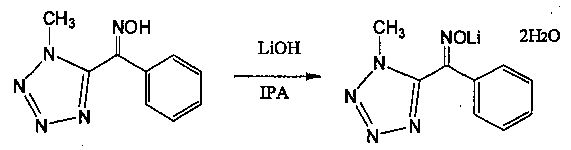
Поскольку полученная TZOX-Li·2H2O представляет собой соль, которая содержит две молекулы воды, соединение может быть обработано более безопасно по сравнению с обычной свободной формой TZOX, которая связана с риском взрыва пыли. Кроме того, результаты были получены также с указанием, что вода высвобождается при более низкой температуре и в случае указанной только Li соли по сравнению с К солью или Na солью.
Пример 4
В фильтрате, полученном после кристаллизации в примере 1, (Е) форма и (Z) форма содержались при количественном соотношении (Е) форма : (Z) форма=8:2, и концентрация соли TZOX-Na 1% масс.
Вышеуказанный фильтрат облучали светом (длина волны : 365 нм) в течение 15 минут до 30 минут с использованием ртутной лампы высокого давления. Когда было исследовано количественное соотношение (Е) формы и (Z) формы в фильтрате после облучения светом, было обнаружено, что (Е) форма : (Z) форма = 35:65. Другими словами, TZOX-Na соль была определена будучи подверженной изомеризации путем облучения светом в очень короткий период времени, а именно, что скорость реакции изомеризации является высокой. Кроме того, фильтрат (вода/IPA) концентрировали при облучении светом, и выпавшую в осадок TZOX-Na соль выделяли фильтрованием. Извлеченная TZOX-Na соль содержала (Z) форму примерно 50% от общего количества (моль%) (Е) формы и (Z) формы в фильтрате после кристаллизации (фильтрата до начала облучения светом). Более того, примерно 70% (Z) формы, в конечном счете, может быть выделено в результате аналогичного повторения концентрирования и фильтрации на полученном повторно отфильтрованном фильтрате.
Пример 5
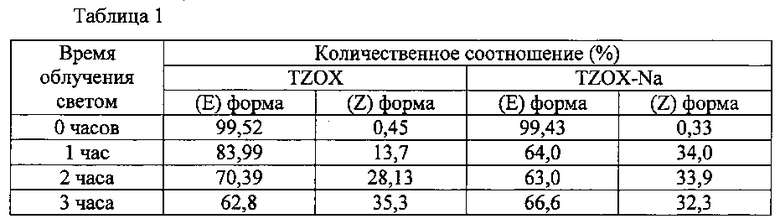
Реакционные скорости реакции изомеризации сравнивали для TZOX и TZOX-Na соли, синтезированных в примере 1.
Более конкретно, 1% по массе водные растворы каждого были подготовлены с последующим облучением этих водных растворов светом (длина волны:365 нм) в течение 3 часов с использованием ртутной лампы высокого давления. Часть водных растворов отбирали до начала облучения светом (время облучения: 0 часов) и через 1, 2 и 3 часа после начала облучения светом с последующим исследованием на количественное соотношение (Е) формы и (Z) формы. Полученные результаты приведены в табл. 1. Хотя количественное соотношение (Z) формы и в случае TZOX-Na до облучения светом составляло только 0,33%, оно увеличилось до 34% через 1 час с момента начала облучения и существенно не изменилось после этой точки. Другими словами, было определено, что TZOX-Na соль достигает равновесия в результате облучения светом в течение 1 часа, и что ее изомеризации скорость является очень высокой. В противоположность этому, в случае TZOX, количественное соотношение (Z) формы только в конце достигает 35% после 3 часов, после момента начала облучения, и было установлено, что по крайней мере 2 часа необходимы для достижения равновесия.
Промышленная применимость
Соединение по настоящему изобретению применяют в качестве промежуточного продукта в синтезе производного тетразолилоксима, который используют в качестве активного ингредиента сельскохозяйственных химикатов и тому подобного. Следовательно, применение соединения по настоящему изобретению делает возможным получать производное тетразолилоксима и, в частности, его (Z) форму, которая является стереоизомером, имеющим более высокую фармакологическую эффективность, как с высокой селективностью, так и с высоким выходом.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЕ, СОДЕРЖАЩИЕ КОЛЬЦО ПИРИДИНА, И СПОСОБ ПОЛУЧЕНИЯ ГАЛОГЕНИРОВАННОГО ПРОИЗВОДНОГО ПИКОЛИНА И ПРОИЗВОДНОГО ТЕТРАЗОЛИЛОКСИМА | 2011 |
|
RU2512344C1 |
| ЦИКЛОАЛКИЛЬНЫЕ ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1997 |
|
RU2197458C2 |
| ФУНГИЦИДНАЯ ВОДНАЯ СУСПЕНЗИОННАЯ КОМПОЗИЦИЯ ДЛЯ СЕЛЬСКОГО ХОЗЯЙСТВА И РАСТЕНИЕВОДСТВА, А ТАКЖЕ СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2012 |
|
RU2549931C2 |
| АЗОТСОДЕРЖАЩЕЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2533708C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО ЭНДО-9-АЗАБИЦИКЛО[3.3.1]НОНАН-3-ОЛА | 2014 |
|
RU2639150C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТИОФЕНОВОГО ПРОИЗВОДНОГО И ЕГО ПРОМЕЖУТОЧНОГО ПРОДУКТА | 2009 |
|
RU2495877C2 |
| ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ, ОБЛАДАЮЩИХ АНТИДИАБЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 1995 |
|
RU2151145C1 |
| СПОСОБ РАЦЕМИЗАЦИИ ОПТИЧЕСКИ АКТИВНЫХ АЛЬФА-АМИНОАЦЕТАЛЕЙ | 2008 |
|
RU2470912C2 |
| ЦИКЛИЧЕСКИЕ АМИНОПРОИЗВОДНЫЕ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ И ПРЕДУПРЕЖДЕНИЯ ЗАБОЛЕВАНИЙ | 1997 |
|
RU2163596C2 |
| АЗОТСОДЕРЖАЩИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2009 |
|
RU2477281C2 |
Изобретение относится к соединению, представленному общей формулой (I)
где n представляет собой 0, Y представляет собой алкильную группу, имеющую от 1 до 6 атомов углерода, М представляет собой щелочной металл или щелочноземельный металл, a m представляет собой целое число от 1 или 2. Также изобретение относится к способу получения соединения общей формулы (I), к способу очистки (Z) формы соединения общей формулы (I) и к способу получения (Z) формы соединения общей формулы (I). Технический результат: получены новые соединения общей формулы (I), которые могут использоваться в качестве промежуточного продукта в синтезе производного тетразолилоксима. 4 н. и 5 з.п. ф-лы, 1 табл., 5 пр.
1. Соединение, представленное общей формулой (I):

(где n представляет собой 0, Y представляет собой алкильную группу, имеющую от 1 до 6 атомов углерода, М представляет собой щелочной металл или щелочноземельный металл, a m представляет собой целое число от 1 или 2).
2. Соединение по п.1, которое представляет собой (Z) форму.
3. Соединение по п.1, которое содержит 2 молекулы воды на молекулу соединения.
4. Соединение по любому из пп.1-3, где М представляет собой щелочной металл.
5. Способ получения соединения, представленного общей формулой (I):
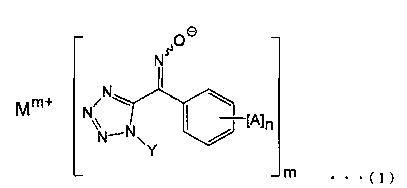
(где n представляет собой 0, Y представляет собой алкильную группу, имеющую от 1 до 6 атомов углерода, М представляет собой щелочной металл или щелочноземельный металл, и m представляет собой целое число от 1 или 2), включающий: стадию (А), приводящую соединение щелочного металла или соединение щелочноземельного металла, выбранное из группы, состоящей из гидроксида щелочного или щелочноземельного металла, карбоната щелочного или щелочноземельного металла, гидрида щелочного или щелочноземельного металла, и алкоксида щелочного или щелочноземельного металла, во взаимодействие с производным тетразолилоксима, представленного общей формулой (II):
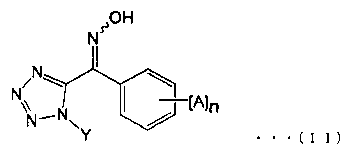
(где А, n и Y являются такими же, как в общей формуле (I)).
6. Способ очистки (Z) формы соединения, представленного общей формулой (I), включающий: стадию (В) кристаллизации кристаллов (Z) формы соединения, представленного общей формулой (I), путем добавления спирта к водному раствору соединения, представленного общей формулой (I):
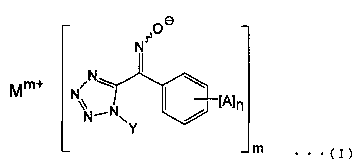
(где n представляет собой 0, Y представляет собой алкильную группу, имеющую от 1 до 6 атомов углерода, М представляет собой щелочной металл или щелочноземельный металл, и m представляет собой целое число от 1 или 2).
7. Способ очистки по п.6, в котором спирт представляет собой низший спирт.
8. Способ получения (Z) формы соединения, представленного общей формулой (I), включающий: стадию (С) облучения светом раствора, содержащего (Е) форму соединения, представленного общей формулой (I):
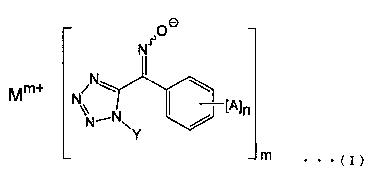
(где n представляет собой 0, Y представляет собой алкильную группу, имеющую от 1 до 6 атомов углерода, М представляет собой щелочной металл или щелочноземельный металл, и m представляет собой целое число от 1 или 2) и изомеризацию (Z) формы.
9. Способ получения (Z) формы соединения, представленного общей формулой (I), по п.8, включающий:
стадию (С′), на которой раствор, содержащий (Е) форму соединения, представленного общей формулой (I), представляет собой водный раствор, и
стадию (В′) осаждения кристаллов (Z) формы соединения, представленного общей формулой (I), путем добавления спирта к водному раствору, после стадии (С′).
| СВЧ-ФАЗОВРАЩАТЕЛЬ | 1985 |
|
RU1426371C |
| RU 2009104939 A, 20.08.2010 | |||
| СТИРАЛЬНАЯ МАШИНА | 2000 |
|
RU2177519C2 |
| WO 2009115557 A2, 24.09.2009. | |||
Авторы
Даты
2016-04-20—Публикация
2013-03-06—Подача