[Область техники]
Настоящее изобретение касается новых соединений, которые обладают антагонистической активностью в отношении EP1 и которые используют в качестве эффективного компонента фармацевтического средства.
[Описание смежного уровня техники]
Гиперактивный мочевой пузырь, согласно определению Международного общества по проблемам, связанным с недержанием мочи, представляет собой "расстройство, которое включает сильную потребность в мочеиспускании с или без неудержания мочи (непроизвольного мочеотделения), учащенное мочеиспускание и никтурию" (Непатентный документ 1). Кроме того, недержание мочи обычно определяют как "непроизвольное мочевыделение, которое объективно может проявляться и представляет социальную или гигиеническую проблему" и под термином "сильная потребность в мочеиспускании, сопровождающаяся опасением непроизвольного мочеотделения", обычно подразумевают "состояние, при котором возникает сильное и внезапное желание мочиться, и этот неудержимый позыв к мочеиспусканию невозможно контролировать" (Непатентный документ 2).
Причина гиперактивного мочевого пузыря может включать изменение функции мочевого пузыря, обусловленное старением, внутримозговым кровоизлиянием, инфарктом головного мозга, болезнью Паркинсона, нейронным расстройством, таким как повреждение спинного мозга, и т.д., закупорку нижних мочевых путей вследствие гипертрофии предстательной железы, и т.д. и чувствительный мочевой пузырь вследствие проявления симптома раздражающего болезненного опорожнения мочевого пузыря, вызванного гиперчувствительным мочевым пузырем, являющимся следствием хронического цистита, интерстициального цистита и т.д. Однако для большинства случаев причина этой патологии остается невыясненной.
Простагландин E2 (ниже в настоящем описании может быть иногда представлен в сокращении как PGE2) представляет собой продукт метаболизма каскада арахидоновой кислоты, и, как известно, он вовлечен в активность защиты клеток, родостимулирующую активность, больгенерирующую активность, активность в стимулировании перистальтического движения желудочно-кишечного тракта, аналептическую активность, активность в ингибировании секреции кислоты желудочного сока, гипотензивную активность, диуретическую активность и т.д.
Известно, что эпителий мочевых путей или гладкая мышца мочевого пузыря продуцирует PGE2 и такое продуцирование увеличивается при нарушении функционирования мочевого пузыря, вызванном различным физиологическим раздражением или воспалением, и т.д. (Непатентные документы 3 и 4). Считают, что PGE2 может не только вызывать сокращение гладкой мышцы мочевого пузыря, но также может усилить рефлекс опорожнения мочевого пузыря путем увеличения афферентного импульса, так как он действует на чувствительный нерв мочевого пузыря (Непатентные документы 5 и 6). Согласно последним исследованиям было обнаружено, что существует несколько подтипов рецептора PGE2, которые имеют функции, отличающиеся друг от друга. В настоящее время известны четыре подтипа, включая EP1, EP2, EP3 и EP4 (Непатентные документы 7 и 8). Среди них рецептор EP1, в основном, присутствует в волокне С чувствительных нервов мочевого пузыря. Было обнаружено также, что, вызывая антагонизм к этому рецептору, можно ингибировать рефлекс к опорожнению мочевого пузыря (Непатентный документ 9). Также уже известно, что при наличии мочевого пузыря с гиперактивностью, которая обусловлена закупоркой нижних мочевых путей вследствие травмы спинного мозга, гипертрофии предстательной железы и т.д., потверждается гиперактивность афферентного волокна С и что эту гиперактивность детрузора можно подавить, ингибируя этот афферентный путь (Непатентный документ 10).
В качестве соединения, которое обладает антагонистической активностью в отношении рецептора EP1, в настоящее время уже известны соединения, которые описаны, например, в нижеприведенных литературных источниках (Патенные документы 1-5).
[Непатентный документ 1] Abrams, P. et al., Neurourol. Urodyn. 21, p. 167-178 (2002)
[Непатентный документ 2] Yamaguchi Osamu, Clinics and Drug Therapy, 21, p.2-7 (2002)
[Непатентный документ 3] Andersson, KE, Pharmacol. Rev. 45, 253-308 (1993)
[Непатентный документ 4] Khan, MA. et al., Prostag1andins Leukot. Essent. Fatty Acids, 59, 415-422 (1998)
[Непатентный документ 5] Palea, S. et al., Br. J. Pharmacol., 124 p. 865-872 (1998)
[Непатентный документ 6] Maggi, CA., Pharmacol. Res. 25, p.13-20 (1992)
[Непатентный документ 7] Negishi, M. et al., J. Lipid Mediators Cell Signaling 12, 379-391 (1995)
[Непатентный документ 8] Narumiya, S. et al., Pharmacol. Rev. 79, p.1193-1226 (1999)
[Непатентный документ 9] Ikeda, M. et al., Biomed. Res. 27, p.49-54 (2006)
[Непатентный документ 10] Yamaguchi Osamu, Folia Pharmacologica Japonica, 121, p.331-338 (2003)
[Патентный документ 1] WO 00/69465
[Патентный документ 2] WO 02/15902
[Патентный документ 3] WO 2004/039753
[Патентный документ 4] WO 2004/083185
[Патентный документ 5] WO 2005/010534
[Раскрытие изобретения]
[Задачи, подлежащие решению данным изобретением]
Задачей изобретения является разработка соединений, которые обладают антагонистической активностью по отношению к рецептору EP1 и которые можно использовать в качестве эффективного компонента фармацевтического средства для профилактики и/или лечения гиперактивного мочевого пузыря, и соединений, которые можно использовать в качестве эффективного компонента фармацевтического средства для профилактики и/или лечения симптомов, включая учащенное мочеиспускание, сильную потребность в мочеиспускании, сопровождающуюся опасением непроизвольного мочеотделения, недержание мочи и т.д.
[Способ решения поставленных задач]
В результате интенсивного исследования, направленного на разрешение поставленных выше задач, авторами было обнаружено, что соединения, представленные нижеследующей формулой (1), обладают значимым антагонистическим действием в отношении рецептора EP1 и могут быть использованы в качестве эффективного компонента фармацевтического средства для профилактики и/или лечения гиперактивного мочевого пузыря. Помимо этого, было также обнаружено, что эти соединения могут быть полезными в качестве эффективного компонента фармацевтического средства для профилактики и/или лечения симптомов, включая учащенное мочеиспускание, сильную потребность в мочеиспускании, сопровождающуюся опасением непроизвольного мочеотделения, недержание мочи и т.д. Настоящее изобретение было выполнено, основываясь на этих полученных данных.
В частности, настоящее изобретение включает нижеследующее.
[1] Соединение, представленное формулой (1), или его соль
[Химическая формула 1]
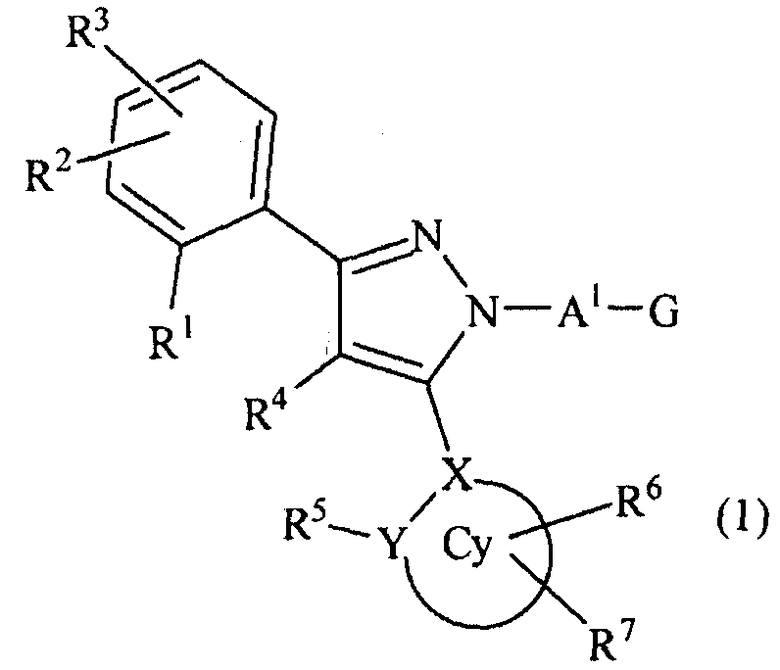
[в формуле (1), Cy представляет собой арильную группу, насыщенную циклическую углеводородную группу или насыщенную гетероциклическую группу,
X представляет собой атом углерода или атом азота,
Y представляет собой атом углерода, атом азота, атом кислорода или атом серы,
R1, R2, R3 могут быть одинаковыми или отличными друг от друга, и каждый из них независимо представляет собой атом водорода, атом галогена, алкильную группу, которая может быть замещенной, алкенильную группу, которая может быть замещенной, алкинильную группу, которая может быть замещенной, арильную группу, которая может быть замещенной, аралкильную группу, которая может быть замещенной, гидроксигруппу, алкоксигруппу, которая может быть замещенной, арилоксигруппу, которая может быть замещенной, алкилтиогруппу, ацильную группу, ацилоксигруппу, алкилсульфинильную группу, алкилсульфонильную группу, алкилкарбамильную группу, -N(RP1)(RP2) (RP1 и RP2 могут быть одинаковыми или отличными друг от друга, и каждый независимо представляет собой атом водорода, алкильную группу, которая может быть замещенной, или арильную группу, которая может быть замещенной, или RP1 и RP2 вместе образуют 3-7-членный цикл, который представляет собой циклический амин N(RP1)(RP2).), ациламиногруппу, ацил(алкил)аминогруппу, алкилсульфониламиногруппу, алкилсульфонил(алкил)аминогруппу, карбоксигруппу, -CON(RP3)(RP4) (RP3 и RP4 могут быть одинаковыми или отличными друг от друга, и каждый независимо представляет собой атом водорода, алкильную группу, которая может быть замещенной, или арильную группу, которая может быть замещенной, или RP3 и RP4 вместе образуют 3-7-членный цикл, который представляет собой циклический амин N(RP3)(RP4).) или -COORP5 (RP5 представляет собой алкильную группу, которая может быть замещенной),
R4 представляет собой атом водорода, атом галогена, алкильную группу, которая может быть замещенной, алкенильную группу, которая может быть замещенной, алкинильную группу, которая может быть замещенной, гидроксигруппу, алкоксигруппу, которая может быть замещенной, или -N(R41)(R42) (R41 и R42 могут быть одинаковыми или отличными друг от друга, и каждый независимо представляет собой атом водорода, алкильную группу, которая может быть замещенной, или арильную группу, которая может быть замещенной, или R41 и R42 вместе образуют 3-7-членный цикл, который представляет собой циклический амин N(R41)(R42).),
R5, R6 и R7 могут быть одинаковыми или отличными друг от друга, и все или часть из них могут присутствовать, или ни один из них не присутствует (при условии, что когда Y представляет собой атом кислорода или атом серы, R5 отсутствует), и когда R5, R6 и R7 присутствуют, то каждый из них независимо представляет собой атом водорода, атом галогена, алкильную группу, которая может быть замещенной, алкенильную группу, которая может быть замещенной, алкинильную группу, которая может быть замещенной, арильную группу, которая может быть замещенной, аралкильную группу, которая может быть замещенной, гидроксигруппу, алкоксигруппу, которая может быть замещенной, арилоксигруппу, которая может быть замещенной, алкилтиогруппу, ацильную группу, ацилоксигруппу, алкилсульфинильную группу, алкилсульфонильную группу, алкилкарбамильную группу, -N(RY1)(RY2) (RY1 и RY2 могут быть одинаковыми или отличными друг от друга, и каждый из них независимо представляет собой атом водорода, алкильную группу, которая может быть замещенной, или арильную группу, которая может быть замещенной, или RY1 и RY2 вместе образуют 3-7-членный цикл, который представляет собой циклический амин N(RY1)(RY2).), ациламиногруппу, ацил(алкил)аминогруппу, алкилсульфониламиногруппу, алкилсульфонил(алкил)аминогруппу, карбоксигруппу, -CON(RY3)(RY4) (RY3 и RY4 могут быть одинаковыми или отличными друг от друга, и каждый из них независимо представляет собой атом водорода, алкильную группу, которая может быть замещенной, или арильную группу, которая может быть замещенной, или RY3 и RY4 вместе образуют 3-7-членный цикл, который представляет собой циклический амин N(RY3)(RY4).) или -COORY5 (RY5 представляет собой алкильную группу, которая может быть замещенной.), или
R1 и R4 могут вместе представлять цикл, который выбран из группы, состоящей из частично ненасыщенного углеводородного цикла, который может быть замещенным, и ненасыщенного углеводородного цикла, который может быть замещенным, или цикл, в котором один из составляющих цикл углеродных атомов в цикле замещен атомом кислорода, атомом серы или атомом азота, или
R4 и R5 могут вместе представлять цикл, который выбран из группы, состоящей из частично ненасыщенного углеводородного цикла, который может быть замещенным, и ненасыщенного углеводородного цикла, который может быть замещенным, или цикл, в котором один из составляющих цикл углеродных атомов в цикле замещен атомом кислорода, атомом серы или атомом азота,
A1 представляет собой простую связь, алкиленовую группу, которая может быть замещенной, или алкениленовую группу, которая может быть замещенной,
G представляет собой любую из нижеследующих формул (G1)-(G4):
[Химическая формула 2]
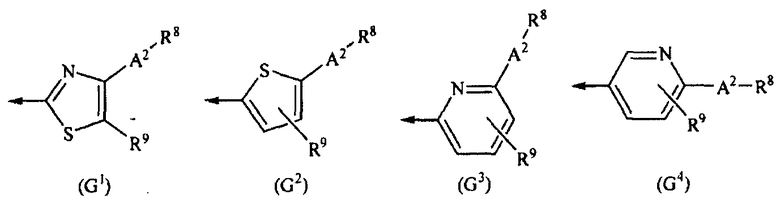
{в формулах (G1)-(G4) A2 представляет собой простую связь, алкиленовую группу или алкениленовую группу, которая может быть замещенной, R8 представляет собой карбоксигруппу, -CON(R81)(R82) (R81 и R82 могут быть одинаковыми или отличными друг от друга, и каждый независимо представляет собой атом водорода, алкильную группу, которая может быть замещенной, или арильную группу, которая может быть замещенной, или R81 и R82 вместе образуют 3-7-членный цикл, который представляет собой циклический амин N(R81)(R82).), -COOR83 (R83 представляет собой алкильную группу, которая может быть замещенной.) или тетразол-5-ильную группу, и R9 представляет собой атом водорода или алкильную группу, которая может быть замещенной}].
[2] Соединение, описанное в вышеупомянутом [1], или его соль, в котором G представляет собой формулу (G1).
[2-2] Соединение, описанное в вышеупомянутом [1], или его соль, в котором G представляет собой формулу (G2).
[2-3] Соединение, описанное в вышеупомянутом [1], или его соль, в котором G представляет собой формулу (G3).
[2-4] Соединение, описанное в вышеупомянутом [1], или его соль, в котором G представляет собой формулу (G4).
[3] Соединение, описанное в любом из вышеупомянутых [1]-[2-4], или его соль, в котором R8 представляет собой карбоксигруппу.
Кроме того, когда номера пунктов, обозначенные подобно [1] до [2-4] в вышеупомянутом контексте, описываются данным рядом и имеется дополнительный пункт, имеющий номер с ответвлением, подобный [2-2], и т.д., то пункт, имеющий номер с ответвлением, подобный [2-2], и т.д., также относится к этому же ряду, и эта связь имеет такой же смысл для нижеследующих описаний.
[4] Соединение, описанное в любом из вышеупомянутых [1]-[3], или его соль, в котором A2 представляет собой простую связь, алкиленовую группу, имеющую два или меньшее число атомов углерода, которая может быть замещена низшей алкильной группой, или этениленовую группу, которая может быть замещена низшей алкильной группой.
[4-2] Соединение, описанное в любом из вышеупомянутых [1]-[3], или его соль, в котором A2 представляет собой простую связь.
[4-3] Соединение, описанное в любом из вышеупомянутых [1]-[3], или его соль, в котором A2 представляет собой этениленовую группу, которая может быть замещена низшей алкильной группой.
[5] Соединение, описанное в любом из вышеупомянутых [1]-[4-3], или его соль, в котором A1 представляет собой простую связь, алкиленовую группу или алкениленовую группу.
[5-2] Соединение, описанное в любом из вышеупомянутых [1]-[4-3], или его соль, в котором A1 представляет собой простую связь, метиленовую группу, которая может быть замещена низшей алкильной группой, или этениленовую группу, которая может быть замещена низшей алкильной группой.
[6] Соединение, описанное в любом из вышеупомянутых [1]-[4-3], или его соль, в котором A1 представляет собой простую связь.
[7] Соединение, описанное в любом из вышеупомянутых [1]-[4-3], или его соль, в котором A1 представляет собой метиленовую группу, которая может быть замещена низшей алкильной группой.
[7-2] Соединение, описанное в любом из вышеупомянутых [1]-[4-3], или его соль, в котором A1 представляет собой этениленовую группу, которая может быть замещена низшей алкильной группой.
[8] Соединение, описанное в любом из вышеупомянутых [1]-[7-2], или его соль, в котором Cy представляет собой арильную группу.
[9] Соединение, описанное в любом из вышеупомянутых [1]-[7-2], или его соль, в котором Cy представляет собой фенильную группу.
[10] Соединение, описанное в любом из вышеупомянутых [1]-[7-2], или его соль, в котором Cy представляет собой насыщенную гетероциклическую группу.
[10-2] Соединение, описанное в любом из вышеупомянутых [1]-[7-2], или его соль, в котором Cy представляет собой насыщенную циклическую углеводородную группу.
[10-3] Соединение, описанное в любом из вышеупомянутых [1]-[7-2], или его соль, в котором Cy представляет собой частично ненасыщенную циклическую углеродную группу или гетероциклическую группу.
[10-4] Соединение, описанное в любом из вышеупомянутых [1]-[7-2], или его соль, в котором Cy представляет собой частично ненасыщенную циклическую углеродную группу.
[10-5] Соединение, описанное в любом из вышеупомянутых [1]-[7-2], или его соль, в котором Cy представляет собой частично ненасыщенную гетероциклическую группу.
[10-6] Соединение, описанное в любом из вышеупомянутых [1]-[7-2], или его соль, в котором Cy представляет собой тиенильную группу или фурильную группу.
[11] Соединение, описанное в любом из вышеупомянутых [1]-[10-6], или его соль, в котором R4 представляет собой атом галогена, алкильную группу, которая может быть замещенной, гидроксигруппу или аминогруппу.
[11-2] Соединение, описанное в любом из вышеупомянутых [1]-[10-6], или его соль, в котором R4 представляет собой алкильную группу, которая может быть замещенной.
[11-3] Соединение, описанное в любом из вышеупомянутых [1]-[10-6], или его соль, в котором R4 представляет собой аминогруппу.
[12] Соединение, описанное в любом из вышеупомянутых [1]-[11-3], или его соль, в котором R1, R2 и R3 представляют собой группу, которая независимо выбрана из группы, состоящей из атома водорода, атома галогена, алкильной группы, которая может быть замещенной, гидроксигруппы и алкоксигруппы, которая может быть замещенной.
[12-2] Соединение, описанное в любом из вышеупомянутых [1]-[11-3], или его соль, в котором R1, R2 и R3 представляют собой группу, которая независимо выбрана из группы, состоящей из атома водорода и гидроксигруппы.
[12-3] Соединение, описанное в любом из вышеупомянутых [1]-[11-3], или его соль, в котором R1, R2 и R3 представляют собой атом водорода.
[13] Соединение, описанное в любом из вышеупомянутых [1]-[12-3], или его соль, в котором R5, R6 и R7 представляют собой группу, которая независимо выбрана из группы, состоящей из атома водорода, атома галогена, алкильной группы, которая может быть замещенной, гидроксигруппы и алкоксигруппы, которая может быть замещенной.
[14] Соединение, описанное в любом из вышеупомянутых [1]-[12-3], или его соль, в котором R5, R6 и R7 представляют собой группу, которая независимо выбрана из группы, состоящей из атома водорода, атома галогена, алкильной группы, которая может быть замещенной, и алкоксигруппы, которая может быть замещенной.
[15] Соединение, описанное в любом из вышеупомянутых [1]-[10-6], [13] или [14], или его соль, в котором R1 и R4 вместе представляют цикл, который выбран из группы, состоящей из частично ненасыщенного углеводородного цикла, который может быть замещенным, или цикл, в котором один из составляющих цикл атомов углерода в цикле замещен атомом кислорода, атомом серы или атомом азота.
[15-2] Соединение, описанное в любом из вышеупомянутых [1]-[10-6], [13] или [14], или его соль, в котором R1 и R4 вместе представляют 5- или 6-членный цикл, который выбран из группы, состоящей из частично ненасыщенного углеводородного цикла, который может быть замещенным, и ненасыщенного углеводородного цикла, который может быть замещенным, или цикл, в котором один из составляющих цикл атомов углерода в цикле замещен атомом кислорода, атомом серы или атомом азота.
[15-3] Соединение, описанное в любом из вышеупомянутых [1]-[10-6], [13] или [14], или его соль, в котором R1 и R4 вместе представляют 6-членный цикл, который выбран из группы, состоящей из частично ненасыщенного углеводородного цикла, который может быть замещенным, и ненасыщенного углеводородного цикла, который может быть замещенным, или цикл, в котором один из составляющих цикл атомов углерода в цикле замещен атомом кислорода, атомом серы или атомом азота.
[15-4] Соединение, описанное в любом из вышеупомянутых [1]-[10-6], [13] или [14], или его соль, в котором R1 и R4 вместе представляют 6-членный цикл, который выбран из группы, состоящей из частично ненасыщенного углеводородного цикла, который может быть замещенным, и ненасыщенного углеводородного цикла, который может быть замещенным.
[16] Соединение, описанное в любом из вышеупомянутых [1]-[10-6] или [12]-[12-3], или его соль, в котором R4 и R5 вместе представляют цикл, который выбран из группы, состоящей из частично ненасыщенного углеводородного цикла, который может быть замещенным, и ненасыщенного углеводородного цикла, который может быть замещенным, или цикл, в котором один из составляющих цикл атомов углерода в цикле замещен атомом кислорода, атомом серы или атомом азота.
[16-2] Соединение, описанное в любом из вышеупомянутых [1]-[10-6] или [12]-[12-3], или его соль, в котором R4 и R5 вместе представляют 5- или 6-членный цикл, который выбран из группы, состоящей из частично ненасыщенного углеводородного цикла, который может быть замещенным, и ненасыщенного углеводородного цикла, который может быть замещенным, или цикл, в котором один из составляющих цикл атомов углерода в цикле замещен атомом кислорода, атомом серы или атомом азота.
[16-3] Соединение, описанное в любом из вышеупомянутых [1]-[10-6] или [12]-[12-3], или его соль, в котором R4 и R5 вместе представляют 5-членный цикл, который выбран из группы, состоящей из частично ненасыщенного углеводородного цикла, который может быть замещенным, и ненасыщенного углеводородного цикла, который может быть замещенным, или цикл, в котором один из составляющих цикл атомов углерода в цикле замещен атомом кислорода, атомом серы или атомом азота.
[16-4] Соединение, описанное в любом из вышеупомянутых [1]-[10-6] или [12]-[12-3], или его соль, в котором R4 и R5 вместе представляют 5-членный цикл, который выбран из группы, состоящей из частично ненасыщенного углеводородного цикла, который может быть замещенным, и ненасыщенного углеводородного цикла, который может быть замещенным.
[16-5] Соединение, описанное в вышеупомянутом [1], или его соль, в котором
G представляет собой формулу (G1),
A1 и A2 представляют собой простую связь,
R1 представляет собой атом водорода или частично ненасыщенный цикл вместе с R4,
R4 представляет собой метильную группу, аминогруппу, гидроксигруппу, атом фтора, атом хлора или атом брома, когда R1 представляет собой атом водорода,
R2, R3 и R5 представляют собой атом водорода,
Cy представляет собой бензол, тиофен, фуран, циклогексен или 3,4-дигидро-2H-пиран,
X и Y представляют собой атом углерода,
R6 и R7, каждый, независимо представляет собой атом водорода или атом фтора,
R8 представляет собой карбоксигруппу и
R9 представляет собой атом водорода.
[16-6] Соединение, описанное в вышеупомянутом [1], или его соль, в котором
G представляет собой формулу (G1),
A1 и A2 представляют собой простую связь,
R1, R2, R3 и R5 представляют собой атом водорода,
R4 представляет собой метильную группу, аминогруппу, гидроксигруппу, атом фтора, атом хлора или атом брома,
Cy представляет собой бензол, тиофен, фуран, циклогексен или 3,4-дигидро-2H-пиран,
X и Y представляют собой атом углерода, R6 и R7, каждый, независимо представляет собой атом водорода или атом фтора,
R8 представляет собой карбоксигруппу и
R9 представляет собой атом водорода.
[16-7] Соединение, описанное в вышеупомянутом [1], или его соль, в котором
G представляет собой формулу (G1),
A1 и A2 представляют собой простую связь,
R1 представляет частично ненасыщенный цикл вместе с R4,
R2, R3 и R5 представляют собой атом водорода,
Cy представляет собой бензол, тиофен, фуран, циклогексен или 3,4-дигидро-2H-пиран,
X и Y представляют собой атом углерода,
R6 и R7, каждый, независимо представляет собой атом водорода или атом фтора,
R8 представляет собой карбоксигруппу, и
R9 представляет собой атом водорода.
[17] Фармацевтическое средство, которое содержит в качестве эффективного компонента соединение, описанное в любом из вышеупомянутых [1]-[16-7], или его фармацевтически приемлемую соль.
[17-2] Пролекарство соединения, описанного в любом из вышеупомянутых [1]-[16-7], или его фармацевтически приемлемой соли.
[18] Фармацевтическое средство, которое является вышеописанным [17], которое используют для профилактики и/или лечения гиперактивного мочевого пузыря.
[18-2] Фармацевтическое средство, которое является вышеописанным [17], которое используют для профилактики и/или лечения симптомов, включая учащенное мочеиспускание, сильную потребность в мочеиспускании, сопровождающуюся опасением непроизвольного мочеотделения, и недержание мочи.
[19] Антагонист EP1, который содержит в качестве эффективного компонента соединение, описанное в любом из [1]-[16-7], или его фармацевтически приемлемую соль.
[20] Применение соединения, описанного в любом из вышеупомянутых [1]-[16-7], или его фармацевтически приемлемой соли для получения фармацевтического средства, которое используют для профилактики и/или лечения гиперактивного мочевого пузыря, или его пролекарства.
[20-2] Применение соединения, описанного в любом из вышеупомянутых [1]-[16-7], или его фармацевтически приемлемой соли для получения фармацевтического средства, которое используют для профилактики и/или лечения симптомов, включая учащенное мочеиспускание, сильную потребность в мочеиспускании, сопровождающуюся опасением непроизвольного мочеотделения, и недержание мочи.
[21] Способ профилактики и/или лечения гиперактивного мочевого пузыря у млекопитающего, включающий введение млекопитающему соединения, описанного в любом из вышеупомянутых [1]-[16-7], или его фармацевтически приемлемой соли в количестве, эффективном для профилактики и/или лечения гиперактивного мочевого пузыря.
[21-2] Способ профилактики и/или лечения учащенного мочеиспускания, сильной потребности в мочеиспускании, сопровождающейся опасением непроизвольного мочеотделения, или недержания мочи, включающий введение млекопитающему соединения, описанного в любом из вышеупомянутых [1]-[16-7], или его фармацевтически приемлемой соли в количестве, эффективном для профилактики и/или лечения вышеуказанных симптомов.
[Положительный эффект изобретения]
"Соединения, представленные формулой (1), или их соль" (которые ниже в настоящем описании могут быть иногда представлены в сокращенном виде как "соединения по данному изобретению") проявляют сильную антагонистическую активность в отношении рецептора EP1, когда их вводят человеку или животному, и их используют в качестве эффективного компонента фармацевтического средства для профилактики и/или лечения, например, гиперактивного мочевого пузыря. Кроме того, их используют в качестве эффективного компонента фармацевтического средства для профилактики и/или лечения симптомов, включая учащенное мочеиспускание, сильную потребность в мочеиспускании, сопровождающуюся опасением непроизвольного мочеотделения, или недержание мочи.
[Лучший способ осуществления изобретения]
В дальнейшем, настоящее изобретение разъясняется более детально.
В настоящем описании атом фтора, атом хлора, атом брома или атом йода служат примером атома галогена.
Что касается "низшего" заместителя, описанного в настоящем описании, то может быть упомянут заместитель, содержащий самое большее десять атомов углерода, которые и составляют этот заместитель. В частности, могут быть упомянуты заместители, содержащие от 1 до 6 углеродных атомов. В качестве предпочтительного примера могут быть упомянуты заместители, содержащие от 1 до 3 углеродных атомов.
Примеры алкильной группы, описанной в настоящем описании, включают прямую, разветвленную или циклическую насыщенную углеводородную группу или их комбинацию. Предпочтительной является низшая алкильная группа. Предпочтительные примеры низшей алкильной группы включают алкильную группу, содержащую от 1 до 6 углеродных атомов, и более предпочтительные примеры такой группы включают алкильную группу, содержащую от 1 до 3 углеродных атомов. Предпочтительные примеры алкильной группы, содержащей от 1 до 3 углеродных атомов, включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, циклопропильную группу и т.п. Помимо этого, предпочтительные примеры алкильной группы, содержащей от 4 до 6 углеродных атомов, включают н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, циклобутильную группу, циклопропилметильную группу, н-пентильную группу, циклопентильную группу, циклопропилэтильную группу, циклобутилметильную группу, н-гексильную группу, циклогексильную группу, циклопропилпропильную группу, циклобутилэтильную группу, циклопентилметильную группу и т.п. В качестве алкильной группы более предпочтительны метильная группа, этильная группа, п-пропильная группа или изопропильная группа.
Примеры алкенильной группы, описанной в настоящем описании, включают низшую алкенильную группу, которая содержит одну или по меньшей мере две двойных связи. Предпочтительной является низшая алкенильная группа, содержащая одну двойную связь. В качестве низшей алкенильной группы предпочтительна алкенильная группа, содержащая от 2 до 5 углеродных атомов. Более предпочтительной является алкенильная группа, содержащая от 2 до 4 углеродных атомов. Предпочтительные примеры алкенильной группы, содержащей от 2 до 4 углеродных атомов, включают винильную группу, аллильную группу, пропенильную группу, бутилиденовую группу, бут-1-енильную группу, бут-2-енильную группу, бут-3-енильную группу и т.п. Кроме того, предпочтительные примеры алкенильной группы, содержащей 5 углеродных атомов, включают пентилиденовую группу, пент-1-енильную группу, пент-2-енильную группу, пент-3-енильную группу, пент-4-енильную группу и т.п. Более предпочтительные примеры алкенильной группы включают винильную группу, аллильную группу или пропенильную группу.
Примеры алкинильной группы, описанной в настоящем описании, включают низшую алкинильную группу, которая содержит одну или по меньшей мере две тройных связи. Предпочтительной является низшая алкинильная группа, содержащая одну тройную связь. В качестве низшей алкинильной группы предпочтительна алкинильная группа, содержащая от 2 до 5 углеродных атомов. В частности, предпочтительные примеры включают этинильную группу, проп-1-инильную группу, проп-2-инильную группу, бут-1-инильную группу, бут-2-инильную группу, бут-3-инильную группу, пент-1-инильную группу, пент-2-инильную группу, пент-3-инильную группу, пент-4-инильную группу и т.п. Более предпочтительны этинильная группа, проп-2-инильная группа или бут-3-инильная группа.
Что касается алкиленовой группы, описанной в настоящем описании, то примером ее может служить двухвалентный остаток, который образован путем удаления любого одного атома водорода из алкильной группы, описанной выше, и она включает линейную, разветвленную или циклическую насыщенную двухвалентную углеводородную группу или их комбинацию. Предпочтительной является низшая алкиленовая группа. Что касается низшей алкиленовой группы, то предпочтительна алкиленовая группа, содержащая от 1 до 6 углеродных атомов. Более предпочтительной является алкиленовая группа, содержащая от 1 до 3 углеродных атомов. Предпочтительные примеры алкиленовой группы, содержащей от 1 до 3 углеродных атомов, включают метиленовую группу, этиленовую группу, н-пропиленовую группу, изопропиленовую группу или циклопропиленовую группу. Кроме того, предпочтительные примеры алкиленовой группы, содержащей от 4 до 6 углеродных атомов, включают двухвалентный остаток, который образован путем удаления любого одного водородного атома из группы, которая описана выше в качестве предпочтительного примера алкильной группы, содержащей от 4 до 6 углеродных атомов. В качестве алкиленовой группы более предпочтительны метиленовая группа, этиленовая группа, н-пропиленовая группа или изопропиленовая группа. В качестве еще более предпочтительного примера алкиленовой группы может быть упомянута метиленовая группа. Существует другой вариант, в котором еще более предпочтительным примером алкиленовой группы является этиленовая группа.
Что касается алкениленовой группы, описанной в настоящем описании, то примером ее может служить двухвалентный остаток, который образован путем удаления любого одного атома водорода из алкенильной группы, описанной выше, и она включает низшую алкениленовую группу, содержащую одну или по меньшей мере две двойных связей. Предпочтительна низшая алкениленовая группа, содержащая одну двойную связь. В качестве низшей алкениленовой группы предпочтительной является алкениленовая группа, содержащая от 2 до 5 углеродных атомов. Алкениленовая группа, содержащая от 2 до 4 углеродных атомов, является более предпочтительной. Предпочтительные примеры алкениленовой группы, содержащей от 2 до 4 углеродных атомов, включают виниленовую группу, пропениленовую группу, бут-1-ениленовую группу, бут-2-ениленовую группу, бут-3-ениленовую группу и т.п. Что касается алкениленовой группы, содержащей 5 углеродных атомов, то можно упомянуть двухвалентный остаток, который образован путем удаления любого одного атома водорода из группы, которая описана выше в качестве предпочтительного примера алкенильной группы, содержащей 5 углеродных атомов. В качестве алкениленовой группы более предпочтительна виниленовая группа или пропениленовая группа. Еще более предпочтительна виниленовая группа.
Что касается стереохимии, имеющей отношение к двойной связи, то приемлемым является любой из цис- и транс-изомеров. Предпочтительная стереохимия включает транс-изомер.
Что касается алкоксигруппы, используемой в контексте настоящего описания, то может быть упомянута линейная, разветвленная, циклическая насыщенная алкилэфирная группа или насыщенная алкилэфирная группа, содержащая их комбинацию. Предпочтительной является низшая алкоксигруппа. В качестве низшей алкоксигруппы предпочтительна алкоксигруппа, содержащая от 1 до 6 углеродных атомов. Более предпочтительной является алкоксигруппа, содержащая от 1 до 4 углеродных атомов. Предпочтительные примеры алкоксигруппы, содержащей от 1 до 4 углеродных атомов, включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, циклопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу, циклобутоксигруппу, циклопропилметоксигруппу и т.п. Кроме того, предпочтительные примеры алкоксигруппы, содержащей 5 или 6 углеродных атомов, включают н-пентилоксигруппу, циклопентилоксигруппу, циклопропилэтилоксигруппу, циклобутилметилоксигруппу, н-гексилоксигруппу, циклогексилоксигруппу, циклопропилпропилоксигруппу, циклобутилэтилоксигруппу, циклопентилметилоксигруппу и т.п.
Что касается арильной циклической структуры, используемой в контексте настоящего описания, то могут быть упомянуты моноциклическая ароматическая структура, конденсированная полициклическая ароматическая структура и т.п. Моноциклическая ароматическая структура или конденсированная полициклическая ароматическая структура, определенная в данном контексте, включает частично ненасыщенную моноциклическую структуру или конденсированную бициклическую углеродную структуру или гетероциклическую структуру. Арильная циклическая структура может представлять собой углеводородную циклическую структуру, или в качестве составляющего цикл атома, помимо атома углерода, она может включать по меньшей мере один атом, например, 1-3, одного или по меньшей мере двух типов гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода.
Примеры моноциклической ароматической структуры включают моноциклическую ароматическую углеводородную структуру или моноциклическую ароматическую гетероциклическую структуру, которая включает один или по меньшей мере два гетероатома. В качестве предпочтительного примера моноциклической ароматической углеводородной структуры могут быть упомянуты бензол, циклопентен или циклогексен. В качестве моноциклической ароматической гетероциклической структуры могут быть упомянуты 5- или 6-членный ароматический гетероцикл, который включает один или по меньшей мере два гетероатома. Конкретные примеры предпочтительного 5- или 6-членного ароматического гетероцикла включают тиофен, пиридин, фуран, тиазол, оксазол, пиразол, пиразин, пиримидин, пиррол, имидазол, пиридазин, изотиазол, изоксазол, 1,2,4-оксадиазол, 1,3,4-оксадиазол, 1,2,4-тиадиазол, 1,3,4-тиадиазол, фуразан, 2,3-дигидрофуран, 3,4-дигидро-2H-пиран и т.п.
Далее в качестве частично ненасыщенного моноцикла, который входит в термин 'моноциклическая ароматическая структура', может быть упомянута частично ненасыщенная моноциклическая углеродсодержащая структура или моноциклическая гетероструктура. Конкретные примеры частично ненасыщенной моноциклической углеродсодержащей структуры включают циклопентен, циклопента-1,3-диен, циклогексен и циклогекса-1,3-диен.
Далее в качестве частично ненасыщенной моноциклической гетероструктуры конкретные примеры включают 2,3-дигидрофуран, 2,5-дигидрофуран, 2,3-дигидротиофен, 3,4-дигидро-2H-пиран, 3,6-дигидро-2H-пиран и 3,4-дигидро-2H-тиопиран.
Примеры конденсированной полициклической ароматической структуры включают конденсированную полициклическую ароматическую углеводородную структуру или конденсированную полициклическую ароматическую гетероциклическую структуру, которая включает один или по меньшей мере два гетероатома. В качестве конденсированной полициклической ароматической углеводородной структуры может быть упомянута конденсированная полициклическая ароматическая углеводородная структура, содержащая от 9 до 14 углеродных атомов, т.е. би- или трициклический ароматический углеводород. В частности, предпочтительные примеры включают нафталин, инден, флуорен, антрацен и т.п. В качестве конденсированной полициклической ароматической гетероциклической структуры может быть упомянут 9-14-членный, предпочтительно 9- или 10-членный конденсированный полициклический ароматический гетероцикл, содержащий по меньшей мере один гетероатом, например, от одного до четырех гетероатомов. В частности, предпочтительные примеры включают бензофуран, бензотиофен, бензимидазол, бензоксазол, бензотиазол, бензизотиазол, нафто[2,3-b]тиофен, хинолин, изохинолин, индол, хиноксалин, фенантридин, фенотиазин, феноксазин, фталазин, нафтиридин, хиназолин, циннолин, карбазол, β-карболин, акридин, феназин, фталимид, тиоксатен и т.п.
В настоящем описании в качестве арильной группы могут быть упомянуты, например, моноциклическая ароматическая группа, конденсированная полициклическая ароматическая группа и т.п. Кроме того, примером может служить моновалентный остаток, который получают путем удаления любого одного атома водорода из вышеупомянутой арильной структуры. Кроме того, моноциклическая ароматическая группа включает частично ненасыщенную моноциклическую группу, конденсированную бициклическую углеводородную группу или гетероциклическую группу.
Что касается моноциклической ароматической группы, то примером может служить моновалентный остаток, который получают удалением любого одного атома водорода из моноциклической ароматической структуры. Более конкретные и предпочтительные примеры моноциклической ароматической группы включают фенильную группу, циклопентенильную группу (1-, 3- или 4-циклопентенильную группу), циклогексенильную группу (1-, 3- или 4-циклогексенильную группу), тиенильную группу (2- или 3-тиенильную группу), пиридильную группу (2-, 3- или 4-пиридильную группу), фурильную группу (2- или 3-фурильную группу), тиазолильную группу (2-, 4- или 5-тиазолильную группу), оксазолильную группу (2-, 4- или 5-оксазолильную группу), пиразолильную группу (1-, 3- или 4-пиразолильную группу), 2-пиразинильную группу, пиримидинильную группу (2-, 4- или 5-пиримидинильную группу), пирролильную группу (1-, 2- или 3-пирролильную группу), имидазолильную группу (1-, 2- или 4-имидазолильную группу), пиридазинильную группу (3- или 4-пиридазинильную группу), 3-изотиазолильную группу, 3-изоксазолильную группу, 1,2,4-оксадиазол-5-ильную группу, 1,2,4-оксадиазол-3-ильную группу, 2,3-дигидрофуран-2-ильную группу, 2,3-дигидрофуран-3-ильную группу, 2,3-дигидрофуран-4-ильную группу, 2,3-дигидрофуран-5-ильную группу, 2,5-дигидрофуран-2-ильную группу, 2,5-дигидрофуран-3-ильную группу, 2,3-дигидротиофен-5-ильную группу, 3,4-дигидро-2H-пиран-2-ильную группу, 3,4-дигидро-2H-пиран-3-ильную группу, 3,4-дигидро-2H-пиран-4-ильную группу, 3,4-дигидро-2H-пиран-5-ильную группу, 3,4-дигидро-2H-пиран-6-ильную группу, 3,6-дигидро-2H-пиран-2-ильную группу, 3,6-дигидро-2H-пиран-3-ильную группу, 3,6-дигидро-2H-пиран-4-ильную группу, 3,6-дигидро-2H-пиран-5-ильную группу, 3,6-дигидро-2H-пиран-6-ильную группу, 3,4-дигидро-2H-тиопиран-6-ильную группу и т.п.
Что касается конденсированной полициклической ароматической группы, то примером может служить моновалентный остаток, который получают удалением любого одного атома водорода из конденсированной полициклической ароматической группы, содержащей 2-4, предпочтительно 2 или 3 цикла.
В частности, предпочтительные примеры конденсированной полициклической ароматической группы включают 1-нафтильную группу, 2-нафтильную группу, 2-инденильную группу, 2-антрильную группу, хинолильную группу (2-, 3-, 4-, 5-, 6-, 7- или 8-хинолильную группу), изохинолильную группу (1-, 3-, 4-, 5-, 6-, 7- или 8-изохинолильную группу), индолильную группу (1-, 2-, 3-, 4-, 5-, 6- или 7-индолильную группу), изоиндолильную группу (1-, 2-, 4- или 5-изоиндолильную группу), фталазинильную группу (1-, 5- или 6-фталазинильную группу), хиноксалинильную группу (2-, 3- или 5-хиноксалинильную группу), бензофуранильную группу (2-, 3-, 4-, 5- или 6-бензофуранильную группу), бензотиазолильную группу (2-, 4-, 5- или 6-бензотиазолильную группу), бензимидазолильную группу (1-, 2-, 4-, 5- или 6-бензимидазолильную группу), 2,1,3-бензоксадиазол-4-ильную группу, 2,1,3-бензоксадиазол-5-ильную группу, 2,1,3-бензоксадиазол-6-ильную группу, флуоренильную группу (1-, 2-, 3- или 4-флуоренильную группу), тиоксантенильную группу и т.п.
Что касается частично ненасыщенной моноциклической группы, то примером может служить моновалентный остаток, который получен путем удаления любого одного атома водорода из частично ненасыщенного моноцикла, и она включает частично ненасыщенную моноциклическую углеродсодержащую группу или моноциклическую гетероциклическую группу. Конкретные примеры частично ненасыщенной моноциклической углеродсодержащей группы включают циклопентенильную группу (1-, 3- или 4-циклопентенильную группу), циклопента-1,3-диенильную группу (1-циклопента-1,3-диенильную группу, 2-циклопента-1,3-диенильную группу или 5-циклопента-1,3-диенильную группу), циклогексенильную группу (1-, 3- или 4-циклогексенильную группу) или циклогекса-1,3-диенильную группу (1-циклогекса-1,3-диенильную группу, 2-циклогекса-1,3-диенильную группу и 5-циклогекса-1,3-диенильную группу). Предпочтительной является 1-циклопентенильная группа или 1-циклогексенильная группа. Более предпочтительна 1-циклогексенильная группа.
Далее, конкретные примеры частично ненасыщенной моноциклической гетероциклической группы включают 2,3-дигидрофуран-2-ильную группу, 2,3-дигидрофуран-3-ильную группу, 2,3-дигидрофуран-4-ильную группу, 2,3-дигидрофуран-5-ильную группу, 2,5-дигидрофуран-2-ильную группу, 2,5-дигидрофуран-3-ильную группу, 2,3-дигидротиофен-5-ильную группу, 3,4-дигидро-2H-пиран-2-ильную группу, 3,4-дигидро-2H-пиран-3-ильную группу, 3,4-дигидро-2H-пиран-4-ильную группу, 3,4-дигидро-2H-пиран-5-ильную группу, 3,4-дигидро-2H-пиран-6-ильную группу, 3,6-дигидро-2H-пиран-2-ильную группу, 3,6-дигидро-2H-пиран-3-ильную группу, 3,6-дигидро-2H-пиран-4-ильную группу, 3,6-дигидро-2H-пиран-5-ильную группу, 3,6-дигидро-2H-пиран-6-ильную группу и 3,4-дигидро-2H-тиопиран-6-ильную группу. Предпочтительной является 2,3-дигидрофуран-5-ильная группа или 3,4-дигидро-2H-пиран-6-ильная группа. 3,4-дигидро-2H-пиран-6-ильная группа является более предпочтительной.
Что касается насыщенного циклического углеводорода, термина, используемого в настоящем описании, то может быть упомянута, например, полностью насыщенная моноциклическая структура. Циклическая структура состоит только из атомов углерода и более предпочтительным является 5- или 6-членный цикл. Конкретные примеры включают циклопентан и циклогексан.
Что касается насыщенной циклической углеводородной группы, термина, используемого в настоящем описании, то может быть упомянут, например, моновалентный остаток, который получают путем удаления любого одного атома водорода из насыщенной циклической углеводородной группы, описанной выше.
В настоящем описании примеры насыщенного гетероцикла включают, например, полностью насыщенную моноциклическую структуру. Циклическая структура может представлять собой 3-7-членный цикл, который содержит в качестве составляющего цикл атома, помимо атома углерода по меньшей мере один, например от 1 до 3, предпочтительно 1 атом, одного или по меньшей мере двух типов гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода. Более предпочтительным является 5- или 6-членный цикл. В частности, предпочтительные примеры включают тетрагидропиран, тетрагидрофуран, пиперидин, пирролидин, тетрагидротиопиран, тетрагидротиофен, морфолин, пиперазин и т.п. Более предпочтительным примером является пиперидин, пирролидин или тетрагидропиран.
Что касается насыщенной гетероциклической группы, термина, используемого в настоящем описании, то может быть упомянут, например, моновалентный остаток, полученный путем удаления любого одного атома водорода из насыщенной гетероциклической группы, описанной выше. Конкретные предпочтительные примеры моноциклической ароматической группы включают тетрагидропиранильную группу (2-, 3- или 4-тетрагидропиранильная группа), тетрагидрофурильную группу (2- или 3-тетрагидрофурильная группа), пиперидинильную группу (1-, 2-, 3-или 4-пиперидинильная группа), пирролидинильную группу (1-, 2- или 3-пирролидинильная группа), тетрагидротиопиранильную группу (2-, 3- или 4-тетрагидротиопиранильная группа), тетрагидротиофенильную группу (2- или 4-тетрагидротиофенильная группа), морфолинильную группу (2-, 3- или 4-морфолинильная группа), пиперидинильную группу (1-, 2- или 3-пиперидинильная группа) и т.п. В качестве более предпочтительного примера может быть упомянута пиперидинильная группа, пирролидинильная группа или тетрагидропиранильная группа.
Что касается частично ненасыщенной углеводородной группы, термина, используемого в настоящем изобретении, то примером может служить циклическая структура, подобная частично ненасыщенной моноциклической углеродсодержащей структуре, описанной выше. Предпочтительные примеры включают циклопента-1,3-диен, циклогекса-1,3-диен и циклогепта-1,3-диен. Более предпочтительным является циклопента-1,3-диен или циклогекса-1,3-диен. Структура циклогекса-1,3-диена является еще более предпочтительной, однако этими структурами не ограничиваются.
Что касается ненасыщенной углеводородной циклической структуры, термина, используемого в настоящем описании, то примером могут служить циклические структуры, описанные выше для ненасыщенной циклической структуры моноциклического ароматического углеводорода. Структура бензола является предпочтительной.
Что касается арилоксигруппы, термина, используемого в настоящем описании, то он означает арильную группу, которая связана с атомом кислорода. Арильная часть арилоксигруппы является такой же, как вышеописанная арильная группа. Арильная часть арилоксигруппы представляет собой предпочтительно моноциклическую ароматическую группу, и примеры арилоксигруппы включают феноксигруппу, 2-тиенилоксигруппу, 3-тиенилоксигруппу, 2-пиридилоксигруппу, 3-пиридилоксигруппу, 4-пиридилоксигруппу, 2-фурилоксигруппу, 3-фурилоксигруппу, 2-тиазолилоксигруппу, 4-тиазолилоксигруппу, 5-тиазолилоксигруппу, 2-оксазолилоксигруппу, 4-оксазолилоксигруппу, 5-оксазолилоксигруппу, 3-пиразолилоксигруппу, 4-пиразолилоксигруппу, 2-пиразинилоксигруппу, 2-пиримидинилоксигруппу, 4-пиримидинилоксигруппу, 5-пиримидинилоксигруппу, 2-пирролилоксигруппу, 3-пирролилоксигруппу, 2-имидазолилоксигруппу, 4-имидазолилоксигруппу, 3-пиридазинилоксигруппу, 4-пиридазинилоксигруппу, 3-изотиазолилоксигруппу, 3-изоксазолилоксигруппу, 1,2,4-оксадиазол-5-илоксигруппу, 1,2,4-оксадиазол-3-илоксигруппу или 3,4-дигидро-2H-пиран-6-илоксигруппу и т.п. Предпочтительными являются феноксигруппа, 2-тиенилоксигруппа, 3-тиенилоксигруппа, 2-фурилоксигруппа, 3-фурилоксигруппа, 2-пирролилоксигруппа, 3-пирролилоксигруппа и т.п. Более предпочтительна феноксигруппа.
Что касается аралкильной группы, термина, используемого в настоящем описании, то примером может служить вышеописанная алкильная группа, один атом водорода которой замещен арильной группой, определенной в настоящем описании. Конкретные примеры включают бензильную группу, фенетильную группу, 1-(фенил)этильную группу, фенилпропильную группу, 1-нафтилметильную группу, 2-нафтилметильную группу, 2-пиридилметильную группу, 3-пиридилметильную группу, 4-пиридилметильную группу, 2-фурилметильную группу, 3-фурилметильную группу, 2-тиенилметильную группу, 3-тиенилметильную группу и т.п., и предпочтительными являются бензильная группа и фенетильная группа.
Что касается алкилтиогруппы, термина, используемого в настоящем описании, то может быть упомянута насыщенная алкилтиоэфирная группа, содержащая от 1 до 6 углеродных атомов, и может быть упомянута, например, вышеописанная алкильная группа, к которой добавлен атом серы. Конкретные примеры включают метилтиогруппу, этилтиогруппу, н-пропилтиогруппу, изопропилтиогруппу, циклопропилтиогруппу, н-бутилтиогруппу, изобутилтиогруппу, втор-бутилтиогруппу, трет-бутилтиогруппу, циклобутилтиогруппу, циклопропилметилтиогруппу и т.п.
Что касается ацильной группы, термина, используемого в настоящем описании, то может быть упомянута алканоильная группа или арилкарбонильная группа. Относительно алканоильной группы, может быть упомянута насыщенная алкилкарбонильная группа, содержащая от 2 до 6 углеродных атомов. Конкретные примеры включают ацетильную группу, пропаноильную группу, бутаноильную группу, 2-метилпропаноильную группу, циклопропилкарбонильную группу, пентаноильную группу, 3-метилбутаноильную группу, 2,2-диметилпропаноильную группу, циклобутилкарбонильную группу и т.п.
Что касается ацилоксигруппы, термина, используемого в настоящем описании, то может быть упомянута, например, алканоилоксигруппа (алкилкарбонилоксигруппа) или арилкарбонилоксигруппа. Относительно алканоилоксигруппы, может быть упомянута насыщенная алкилкарбонилоксигруппа, содержащая от 2 до 6 углеродных атомов. Конкретные примеры включают ацетоксигруппу, пропаноилоксигруппу, бутаноилоксигруппу, 2-метилпропаноилоксигруппу, циклопропилкарбонилоксигруппу, пентаноилоксигруппу, 3-метилбутаноилоксигруппу, 2,2-диметилпропаноилоксигруппу, циклобутилкарбонилоксигруппу и т.п.
Что касается алкилсульфинильной группы, термина, используемого в настоящем описании, то может быть упомянута насыщенная алкилсульфинильная группа, содержащая от 1 до 6 углеродных атомов. Конкретные примеры включают метилсульфинильную группу, этилсульфинильную группу, н-пропилсульфинильную группу, изопропилсульфинильную группу, циклопропилсульфинильную группу, н-бутилсульфинильную группу, изобутилсульфинильную группу, втор-бутилсульфинильную группу, трет-бутилсульфинильную группу, циклобутилсульфинильную группу, циклопропилметилсульфинильную группу и т.п.
Что касается алкилсульфонильной группы, термина, используемого в настоящем описании, то может быть упомянута насыщенная алкилсульфонильная группа, содержащая от 1 до 6 углеродных атомов. Конкретные примеры включают метилсульфонильную группу, этилсульфонильную группу, н-пропилсульфонильную группу, изопропилсульфонильную группу, циклопропилсульфонильную группу, н-бутилсульфонильную группу, изобутилсульфонильную группу, втор-бутилсульфонильную группу, трет-бутилсульфонильную группу, циклобутилсульфонильную группу, циклопропилметилсульфонильную группу и т.п.
Что касается алкилкарбамильной группы, термина, используемого в настоящем описании, то может быть упомянута насыщенная алкилкарбамильная группа, содержащая от 2 до 6 углеродных атомов. Конкретные примеры включают метилкарбамильную группу, этилкарбамильную группу, н-пропилкарбамильную группу, изопропилкарбамильную группу, циклопропилкарбамильную группу, н-бутилкарбамильную группу, изобутилкарбамильную группу, втор-бутилкарбамильную группу, трет-бутилкарбамильную группу, циклобутилкарбамильную группу, циклопропилметилкарбамильную группу и т.п.
Что касается алкиламиногруппы, термина, используемого в настоящем описании, то может быть упомянута насыщенная алкиламиногруппа, содержащая от 1 до 6 углеродных атомов. Конкретные примеры включают метиламиногруппу, этиламиногруппу, н-пропиламиногруппу, изопропиламиногруппу, циклопропиламиногруппу, н-бутиламиногруппу, изобутиламиногруппу, втор-бутиламиногруппу, трет-бутиламиногруппу, циклобутиламиногруппу, циклопропилметиламиногруппу и т.п.
Что касается диалкиламиногруппы, термина, используемого в настоящем описании, то может быть упомянута аминогруппа, замещенная 1-6 одинаковыми или отличными друг от друга алкильными группами. Конкретные примеры включают диметиламиногруппу, этил(метил)аминогруппу, диэтиламиногруппу, метил(н-пропил)аминогруппу, изопропил(метил)аминогруппу, циклопропил(метил)аминогруппу, н-бутил(метил)аминогруппу, изобутил(метил)аминогруппу, втор-бутил(метил)аминогруппу, трет-бутил(метил)аминогруппу, циклобутил(метил)аминогруппу, циклопропилметил(метил)аминогруппу и т.п. Кроме того, два заместителя на атоме азота могут вместе образовать 3-7-членный цикл с получением циклического амина, и в таком случае, при наличии диалкиламиногруппы, может быть образован 3-7-членный циклический амин. Конкретные примеры включают пирролидиногруппу, пиперидиновую группу и т.п.
Что касается ациламиногруппы, термина, используемого в настоящем описании, то может быть упомянута аминогруппа, которая замещена ацильной группой, описанной выше. Конкретные примеры включают ацетиламиногруппу, пропаноиламиногруппу, бутаноиламиногруппу, 2-метилпропаноиламиногруппу, циклопропилкарбониламиногруппу, пентаноиламиногруппу, 3-метилбутаноиламиногруппу, 2,2-диметилпропаноиламиногруппу, циклобутилкарбониламиногруппу и т.п.
Что касается ацил(алкил)аминогруппы, термина, используемого в настоящем описании, то можно упомянуть аминогруппу, которая замещена одновременно одной вышеописанной ацильной группой и одной вышеописанной алкильной группой. Конкретные примеры включают ацетил(метил)аминогруппу, метил(пропаноил)аминогруппу, бутаноил(метил)аминогруппу, метил(2-метилпропаноил)аминогруппу, циклопропилкарбонил(метил)аминогруппу, метил(пентаноил)аминогруппу, метил(3-метилбутаноил)аминогруппу, 2,2-диметилпропаноил(метил)аминогруппу, циклобутилкарбонил(метил)аминогруппу и т.п.
Что касается алкилсульфониламиногруппы, термина, используемого в настоящем описании, то может быть упомянута аминогруппа, которая замещена алкилсульфонильной группой, описанной выше. Конкретные примеры включают метилсульфониламиногруппу, этилсульфониламиногруппу, н-пропилсульфониламиногруппу, изопропилсульфониламиногруппу, циклопропилсульфониламиногруппу, н-бутилсульфониламиногруппу, изобутилсульфониламиногруппу, втор-бутилсульфониламиногруппу, трет-бутилсульфониламиногруппу, циклобутилсульфониламиногруппу, циклопропилметилсульфониламиногруппу и т.п.
Что касается алкилсульфонил(алкил)аминогруппы, термина, используемого в настоящем описании, то может быть упомянута аминогруппа, которая замещена одновременно одной алкилсульфонильной группой, описанной выше, и одной алкильной группой, описанной выше. Конкретные примеры включают метил(метилсульфонил)аминогруппу, этилсульфонил(метил)аминогруппу, метил(н-пропилсульфонил)аминогруппу, изопропилсульфонил(метил)аминогруппу, циклопропилсульфонил(метил)аминогруппу, н-бутилсульфонил(метил)аминогруппу, изобутилсульфонил(метил)аминогруппу, втор-бутилсульфонил(метил)аминогруппу, трет-бутилсульфонил(метил)аминогруппу, циклобутилсульфонил(метил)аминогруппу, циклопропилметилсульфонил(метил)аминогруппу и т.п.
Что касается группы, которая может быть замещенной, термина, используемого в настоящем описании (т.е. алкильная группа, алкенильная группа, алкинильная группа, арильная группа, аралкильная группа, алкоксигруппа, арилоксигруппа, алкиленовая группа, метиленовая группа, алкениленовая группа и т.п.), то может быть упомянута незамещенная группа или группа, которая замещена, как правило, от одного до нескольких заместителями в пределах верхнего предела, то есть максимального числа допустимого замещения.
Что касается заместителя для алкильной группы, которая может быть замещенной, термина, используемого в настоящем описании, то может быть упомянут заместитель, такой как гидроксигруппа, цианогруппа, атом галогена, арильная группа, арилоксигруппа, алкоксигруппа, алкилтиогруппа, ацильная группа, ацилоксигруппа, алкилсульфинильная группа, алкилсульфонильная группа, алкилкарбамильная группа, аминогруппа, алкиламиногруппа, диалкиламиногруппа, ациламиногруппа, ацил(алкил)аминогруппа, алкилсульфониламиногруппа, алкилсульфонил(алкил)аминогруппа и т.п.
Что касается заместителя для алкиленовой группы, которая может быть замещенной, термина, используемого в настоящем описании, то может быть также упомянут заместитель, описанный для алкильной группы, которая может быть замещенной, как описано выше.
Что касается заместителя для метиленовой группы, которая может быть замещена низшей алкильной группой, термина, используемого в настоящем описании, то предпочтительным заместителем является алкильная группа, содержащая от 1 до 6 углеродных атомов. Более предпочтительна алкильная группа, содержащая от 1 до 3 углеродных атомов. Примеры алкильной группы, содержащей от 1 до 3 углеродных атомов, включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, циклопропильную группу и т.п. Примеры алкильной группы, содержащей от 4 до 6 углеродных атомов, включают н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, циклобутильную группу, циклопропилметильную группу, н-пентильную группу, циклопентильную группу, циклопропилэтильную группу, циклобутилметильную группу, н-гексильную группу, циклогексильную группу, циклопропилпропильную группу, циклобутилэтильную группу, циклопентилметильную группу и т.п.
Что касается заместителя для алкенильной группы, которая может быть замещенной, термина, используемого в настоящем описании, то может быть также упомянут заместитель, описанный для алкильной группы, которая может быть замещенной, как описано выше.
Что касается заместителя для алкениленовой группы, которая может быть замещенной, термина, используемого в настоящем описании, то может быть также упомянут заместитель, описанный для алкильной группы, которая может быть замещенной, как описано выше.
Что касается заместителя для алкинильной группы, которая может быть замещенной, термина, используемого в настоящем описании, то может быть также упомянут заместитель, описанный для алкильной группы, которая может быть замещенной, описанной выше.
Что касается заместителя для арильного цикла, который может быть замещенным, и заместителя для арильной группы, которая может быть замещенной, описанных в настоящем описании, то им может быть гидроксигруппа, атом галогена, алкильная группа, которая может быть замещенной, алкенильная группа, которая может быть замещенной, алкинильная группа, которая может быть замещенной, арильная группа, алкоксигруппа, которая может быть замещенной, алкилтиогруппа, ацильная группа, ацилоксигруппа, алкилсульфинильная группа, алкилсульфонильная группа, алкилкарбамильная группа, -N(RA11)(RA12) (RA11 и RA12 могут быть одинаковыми или отличными друг от друга, и каждый независимо представляет собой атом водорода, алкильную группу, которая может быть замещенной, или арильную группу, которая может быть замещенной, или RA11 и RA12 вместе образуют 3-7-членный цикл, который представляет собой циклический амин N(RA11)(RA12).), ациламиногруппа, ацил(алкил)аминогруппа, алкилсульфониламиногруппа, алкилсульфонил(алкил)аминогруппа, карбоксигруппа, -CON(RA13)(RA14) (RA13 и RA14 могут быть одинаковыми иили отличными друг от друга, и каждый независимо представляет собой атом водорода, алкильную группу, которая может быть замещенной, или арильную группу, которая может быть замещенной, или RA13 и RA14 вместе образуют 3-7-членный цикл, который представляет собой циклический амин N(RA13)(RA14).) или -COORA15 (RA15 представляет собой алкильную группу, которая может быть замещенной.), и при этом число заместителей особенно не ограничено при условии, что оно представляет собой допустимое число замещения, Предпочтительно, когда число заместителей находится между 1 и 3. В тех случаях, когда присутствуют два или большее число заместителей, указанные заместители могут быть одинаковыми или отличными друг от друга.
Что касается аралкильной группы, которая может быть замещенной, термина, используемого в настоящем описании, то может быть упомянута вышеописанная алкильная группа, которая может быть замещенной, один атом водорода которой замещен арильной группой, которая может быть замещенной, описанной в настоящем описании.
Что касается заместителя для алкоксигруппы, которая может быть замещенной, термина, используемого в настоящем описании, то здесь также может быть упомянут заместитель, описанный для вышеопределенной алкильной группы, которая может быть замещенной.
Что касается заместителя для арилоксигруппы, которая может быть замещенной, термина, используемого в настоящем описании, то здесь также может быть упомянут заместитель, описанный для вышеопределенной алкильной группы, которая может быть замещенной.
Затем каждый заместитель для соединений по данному изобретению будет описан более конкретно.
Cy представляет собой арильную группу, насыщенную циклическую углеводородную группу или насыщенную гетероциклическую группу. В качестве Cy предпочтительна арильная группа. Кроме того, существует другой вариант, в котором предпочтительна насыщенная гетероциклическая группа.
Когда Cy представляет собой арильную группу, предпочтительные примеры арильной группы включают фенильную группу, циклопентенильную группу (1-, 3- или 4-циклопентенильная группа), циклогексенильную группу (1-, 3- или 4-циклогексенильная группа), тиенильную группу (2- или 3-тиенильная группа), пиридильную группу (2-, 3- или 4-пиридильная группа), фурильную группу (2- или 3-фурильная группа), тиазолильную группу (2-, 4- или 5-тиазолильная группа), оксазолильную группу (2-, 4- или 5-оксазолильная группа), пиразолильную группу (1-, 3- или 4-пиразолильная группа), 2-пиразинильную группу, пиримидинильную группу (2-, 4- или 5-пиримидинильная группа), пирролильную группу (1-, 2- или 3-пирролильная группа), имидазолильную группу (1-, 2- или 4-имидазолильная группа), пиридазинильную группу (3- или 4-пиридазинильная группа), 3-изотиазолильную группу, 3-изоксазолильную группу, 1,2,4-оксадиазол-5-ильную группу, 1,2,4-оксадиазол-3-ильную группу, 2,3-дигидрофуран-2-ильную группу, 2,3-дигидрофуран-3-ильную группу, 2,3-дигидрофуран-4-ильную группу, 2,3-дигидрофуран-5-ильную группу, 2,5-дигидрофуран-2-ильную группу, 2,5-дигидрофуран-3-ильную группу, 2,3-дигидротиофен-5-ильную группу, 3,4-дигидро-2H-пиран-2-ильную группу, 3,4-дигидро-2H-пиран-3-ильную группу, 3,4-дигидро-2H-пиран-4-ильную группу, 3,4-дигидро-2H-пиран-5-ильную группу, 3,4-дигидро-2H-пиран-6-ильную группу, 3,6-дигидро-2H-пиран-2-ильную группу, 3,6-дигидро-2H-пиран-3-ильную группу, 3,6-дигидро-2H-пиран-4-ильную группу, 3,6-дигидро-2H-пиран-5-ильную группу, 3,6-дигидро-2H-пиран-6-ильную группу, 3,4-дигидро-2H-тиопиран-6-ильную группу, 1-нафтильную группу, 2-нафтильную группу, 2-инденильную группу, 2-антрильную группу, хинолильную группу (2-, 3-, 4-, 5-, 6-, 7- или 8-хинолильная группа), изохинолильную группу (1-, 3-, 4-, 5-, 6-, 7- или 8-изохинолильная группа), индолильную (1-, 2-, 3-, 4-, 5-, 6- или 7-индолильная группа), изоиндолильную группу (1-, 2- или 5-изоиндолильная группа), фталазинильную группу (1-, 5- или 6-фталазинильная группа), хиноксалинильную группу (2-, 3- или 5-хиноксалинильная группа), бензофуранильную группу (2-, 3-, 4-, 5- или 6-бензофуранильная группа), бензотиазолильную группу (2-, 4-, 5- или 6-бензотиазолильная группа), бензимидазолильную группу (1-, 2-, 4-, 5- или 6-бензимидазолильная группа), 2,1,3-бензоксадиазол-4-ильную группу, 2,1,3-бензоксадиазол-5-ильную группу, 2,1,3-бензоксадиазол-6-ильную группу, флуоренильную группу (1-, 2-, 3- или 4-флуоренильная группа) и тиоксантенильную группу. Более предпочтительными являются фенильная группа, 1-циклопентенильная группа, 1-циклогексенильная группа, 2-тиенильная группа, 3-тиенильная группа, 3-пиридильная группа, 2-фурильная группа, 3-фурильная группа, 3-пиразолильная группа, 4-пиразолильная группа, 5-пиримидинильная группа, 2-пирролильная группа, 3-пирролильная группа, 3,4-дигидро-2H-пиран-6-ильная группа, 2-нафтильная группа, 3-хинолильная группа, 8-хинолильная группа, 6-индолильная группа или 2,1,3-бензоксадиазол-5-ильная группа. Еще более предпочтительными являются фенильная группа, 1-циклопентенильная группа, 1-циклогексенильная группа, 2-тиенильная группа, 3-тиенильная группа, 3-пиридильная группа, 2-фурильная группа, 3-фурильная группа, 3,4-дигидро-2H-пиран-6-ильная группа или 8-хинолильная группа. В еще более высокой степени предпочтительными являются фенильная группа, 2-тиенильная группа или 3-тиенильная группа. И в высшей степени предпочтительной является фенильная группа.
Кроме того, когда Cy представляет собой арильную группу, существует другой вариант, в котором Cy представляет собой предпочтительно частично ненасыщенную моноциклическую углеродсодержащую группу или моноциклическую гетероциклическую группу. В частности, в качестве частично ненасыщенной моноциклической углеродсодержащей группы, примером служит циклопентенильная группа (1-, 3- или 4-циклопентенильная группа) или циклогексенильная группа (1-, 3- или 4-циклогексенильная группа) и предпочтительной является 1-циклопентенильная группа или 1-циклогексенильная группа. Более предпочтительна 1-циклогексенильная группа.
Далее, в качестве частично ненасыщенной моноциклической гетероциклической группы конкретные примеры включают 2,3-дигидрофуран-2-ильную группу, 2,3-дигидрофуран-3-ильную группу, 2,3-дигидрофуран-4-ильную группу, 2,3-дигидрофуран-5-ильную группу, 2,5-дигидрофуран-2-ильную группу, 2,5-дигидрофуран-3-ильную группу, 2,3-дигидротиофен-5-ильную группу, 3,4-дигидро-2H-пиран-2-ильную группу, 3,4-дигидро-2H-пиран-3-ильную группу, 3,4-дигидро-2H-пиран-4-ильную группу, 3,4-дигидро-2H-пиран-5-ильную группу, 3,4-дигидро-2H-пиран-6-ильную группу, 3,6-дигидро-2H-пиран-2-ильную группу, 3,6-дигидро-2H-пиран-3-ильную группу, 3,6-дигидро-2H-пиран-4-ильную группу, 3,6-дигидро-2H-пиран-5-ильную группу, 3,6-дигидро-2H-пиран-6-ильную группу и 3,4-дигидро-2H-тиопиран-6-ильную группу. Предпочтительными являются 2,3-дигидрофуран-5-ильная группа и 3,4-дигидро-2H-пиран-6-ильная группа. Более предпочтительна 3,4-дигидро-2H-пиран-6-ильная группа.
Когда Cy представляет собой насыщенную циклическую углеводородную группу, предпочтительной является циклопентильная группа или циклогексильная группа.
Когда Cy представляет собой насыщенную гетероциклическую группу, предпочтительными являются тетрагидропиранильная группа (2,3- или 4-тетрагидропиранильная группа), тетрагидрофурильная группа (2- или 3-тетрагидрофурильная группа), пиперидинильная группа (1-, 2-, 3- или 4-пиперидинильная группа), пирролидинильная группа (1-, 2- или 3-пирролидинильная группа), тетрагидротиопиранильная группа (2-, 3- или 4-тетрагидротиопиранильная группа), тетрагидротиофенильная группа (2- или 4-тетрагидротиофенильная группа), морфолинильная группа (2-, 3- или 4-морфолинильная группа) или пиперидинильная группа (1-, 2- или 3-пиперидинильная группа). Более предпочтительна 1-пирролидинильная группа.
X представляет собой атом углерода или атом азота. В качестве Х предпочтителен атом углерода.
Y представляет собой атом углерода, атом азота, атом кислорода или атом серы. В качестве Y предпочтителен атом углерода.
R1, R2 и R3 могут быть одинаковыми или отличными друг от друга, и каждый независимо представляет собой атом водорода, атом галогена, алкильную группу, которая может быть замещенной, алкенильную группу, которая может быть замещенной, алкинильную группу, которая может быть замещенной, арильную группу, которая может быть замещенной, аралкильную группу, которая может быть замещенной, гидроксигруппу, алкоксигруппу, которая может быть замещенной, арилоксигруппу, которая может быть замещенной, алкилтиогруппу, ацильную группу, ацилоксигруппу, алкилсульфинильную группу, алкилсульфонильную группу, алкилкарбамильную группу, -N(RP1)(RP2) (RP1 и RP2 могут быть одинаковыми или отличными друг от друга, и каждый независимо представляет собой атом водорода, алкильную группу, которая может быть замещенной, или арильную группу, которая может быть замещенной, или RP1 и RP2 вместе образуют 3-7-членный цикл, который представляет собой циклический амин N(RP1)(RP2).), ациламиногруппу, ацил(алкил)аминогруппу, алкилсульфониламиногруппу, алкилсульфонил(алкил)аминогруппу, карбоксигруппу, -CON(RP3)(RP4) (RP3 и RP4 могут быть одинаковыми или отличными друг от друга, и каждый независимо представляет собой атом водорода, алкильную группу, которая может быть замещенной, или арильную группу, которая может быть замещенной, или RP3 и RP4 вместе образуют 3-7-членный цикл, который представляет собой циклический амин N(RP3)(RP4).) или -COORP5 (RP5 представляет собой алкильную группу, которая может быть замещенной.). В качестве R1, R2 и R3 предпочтительны атом водорода, атом галогена, алкильная группа, которая может быть замещенной, гидроксигруппа или алкоксигруппа, которая может быть замещенной. Атом водорода, атом галогена или гидроксигруппа являются более предпочтительными. Еще более предпочтителен атом водорода или гидроксигруппа. В высшей степени предпочтителен атом водорода.
Что касается атома галогена, который представлен R1, R2 и R3, то предпочтительные примеры атома галогена включают атом фтора или атом хлора. Более предпочтителен атом фтора. Что касается алкильной группы, которая может быть замещенной и представлена R1, R2 и R3, то предпочтительные примеры такой группы включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу или трифторметильную группу. Более предпочтительна метильная группа. Кроме того, существует другой вариант, в котором предпочтительна трифторметильная группа. Что касается алкоксигруппы, которая может быть замещенной и представлена R1, R2 и R3, то предпочтительные примеры такой группы включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу или трифторметилоксигруппу. Более предпочтительна метоксигруппа. Кроме того, существует другой вариант, в котором более предпочтительна трифторметилоксигруппа.
Предпочтительно, чтобы любой из R1, R2 и R3 представлял собой атом водорода. Более предпочтительно, чтобы любые два из них представляли собой атом водорода. Также возможно, чтобы R1, R2 и R3, все, одновременно представляли собой атом водорода. R1 принадлежит атому углерода, который является близлежащим к атому углерода на бензольном кольце, связанному с циклом пиразола. В тех случаях, когда по меньшей мере один из R2 и R3 представляет собой заместитель, отличный от атома водорода, его (или их) положение замещения особенно не ограничивается и заместитель может присутствовать в любом положении на бензольном кольце.
R4 представляет собой атом водорода, атом галогена, алкильную группу, которая может быть замещенной, алкенильную группу, которая может быть замещенной, алкинильную группу, которая может быть замещенной, гидроксигруппу, алкоксигруппу, которая может быть замещенной, -N(R41)(R42) (R41 и R42 могут быть одинаковыми или отличными друг от друга, и каждый независимо представляет собой атом водорода, алкильную группу, которая может быть замещенной, или арильную группу, которая может быть замещенной, или R41 и R42 вместе образуют 3-7-членный цикл, который представляет собой циклический амин N(R41)(R42).). Предпочтительно R4 представляет собой атом водорода, атом галогена, алкильную группу, которая может быть замещенной, гидроксигруппу или аминогруппу. Более предпочтительно R4 представляет собой атом галогена, алкильную группу, которая может быть замещенной, или аминогруппу. Еще более предпочтительно, он представляет собой алкильную группу, которая может быть замещенной. Существует другой вариант, в котором в качестве R4 более предпочтительна аминогруппа.
Что касается атома галогена, представленного R4, то предпочтителен, например, атом фтора, атом хлора или атом брома. Более предпочтителен атом фтора или атом хлора. Существует другой вариант, в котором в качестве атома галогена, который представлен R4, более предпочтителен атом брома. Что касается алкильной группы, которая может быть замещенной, представленной R1, R2 или R3, то предпочтительной является, например, метильная группа, этильная группа, н-пропильная группа, изопропильная группа или трифторметильная группа. Более предпочтительна метильная группа.
Кроме того, R1 и R4 могут вместе представлять цикл, который выбран из группы, состоящей из частично ненасыщенного углеводородного цикла, который может быть замещенным, и ненасыщенного углеводородного цикла, который может быть замещенным, или цикл, в котором один из составляющих цикл углеродных атомов в цикле замещен атомом кислорода, атомом серы или атомом азота, и предпочтительно, когда R1 и R4 вместе представляют частично ненасыщенный углеводородный цикл или цикл, в котором один из составляющих цикл атомов углерода в цикле замещен атомом кислорода или атомом серы.
Что касается частично ненасыщенного углеводородного цикла, то могут быть упомянуты циклопента-1,3-диен, циклогекса-1,3-диен или циклогепта-1,3-диен. Предпочтительны циклопента-1,3-диен или циклогекса-1,3-диен. Более предпочтительной является структура циклогекса-1,3-диена.
В отношении ненасыщенного углеводородного цикла может быть упомянут цикл бензола.
Что касается цикла, в котором один из составляющих цикл углеродных атомов в частично ненасыщенном углеводородном цикле или ненасыщенном углеводородном цикле замещен атомом кислорода, атомом серы или атомом азота, то могут быть упомянуты циклические структуры тиофена, фурана, пиррола, 2H-пирана, 2H-тиопирана, 1,2-дигидропиридина или пиридина. Предпочтительны циклические структуры тиофена, фурана, 2H-пирана или 2H-тиопирана. Более предпочтительна циклическая структура фурана.
В тех случаях, когда R1 и R4 вместе представляют цикл, в качестве соединения формулы (1) предпочтительным является соединение, имеющее любую из нижеследующих формул (1-1)-(1-5):
[Химическая формула 3]
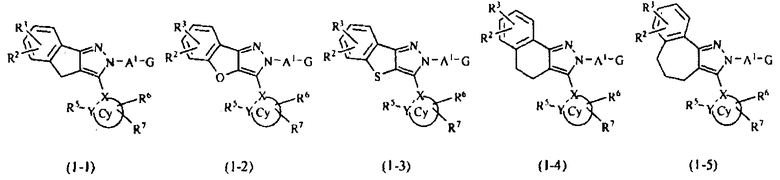
[в формулах (1-1)-(1-5) Cy, X, Y, R2, R3, R5, R6, R7, A1 и G такие, как определены выше, при условии, что R5 не объединяется с R4 с образованием цикла] и более предпочтительным является соединение формулы (1-4).
Далее, в тех случаях, когда R1 и R4 вместе представляют, например, циклическую структуру циклопента-1,3-диена, это указывает на то, что соединение формулы (1) соответствует формуле (1-1). Кроме того, когда R1 и R4 вместе представляют, например, структуру фурана, это указывает на то, что соединение формулы (1) соответствует формуле (1-2).
Что касается R5, R6 и R7, то могут присутствовать они, все, либо часть из них, или не присутствует ни один из них. Если присутствует R5, Y в структуре Cy представляет собой атом углерода или атом азота, то это означает, что R5 присутствует на атоме углерода или на атоме азота. Если по меньшей мере один из R6 и R7 присутствует, то его (или их) положение замещения особенно не ограничивается и указанный заместитель может присутствовать в любом замещаемом положении Cy.
R5, R6 и R7 могут быть одинаковыми или отличными друг от друга, и когда они присутствуют, то каждый из них независимо представляет собой атом водорода, атом галогена, алкильную группу, которая может быть замещенной, алкенильную группу, которая может быть замещенной, алкинильную группу, которая может быть замещенной, арильную группу, которая может быть замещенной, аралкильную группу, которая может быть замещенной, гидроксигруппу, алкоксигруппу, которая может быть замещенной, арилоксигруппу, которая может быть замещенной, алкилтиогруппу, ацильную группу, ацилоксигруппу, алкилсульфинильную группу, алкилсульфонильную группу, алкилкарбамильную группу, -N(RY1)(RY2) (RY1 и RY2 могут быть одинаковыми или отличными друг от друга, и каждый независимо представляет собой атом водорода, алкильную группу, которая может быть замещенной, или арильную группу, которая может быть замещенной, или RY1 и RY2 вместе образуют 3-7-членный цикл, который представляет собой циклический амин N(RY1)(RY2).), ациламиногруппу, ацил(алкил)аминогруппу, алкилсульфониламиногруппу, алкилсульфонил(алкил)аминогруппу, карбоксигруппу, -CON(RY3)(RY4) (RY3 и RY4 могут быть одинаковыми или отличными друг от друга, и каждый независимо представляет собой атом водорода, алкильную группу, которая может быть замещенной, или арильную группу, которая может быть замещенной, или RY3 и RY4 вместе образуют 3-7-членный цикл, который представляет собой циклический амин N(RY3)(RY4).) или -COORY5 (RY5 представляет собой алкильную группу, которая может быть замещенной). Что касается R5, R6 и R7, то предпочтительно, когда они представляют собой атом водорода, атом галогена, алкильную группу, которая может быть замещенной, гидроксигруппу или алкоксигруппу, которая может быть замещенной. Более предпочтителен атом водорода или атом галогена. Существует другой вариант, в котором более предпочтительна гидроксигруппа.
Что касается атома галогена, который представлен R5, R6 или R7, то предпочтительным является атом фтора или атом хлора. Более предпочтителен атом фтора. Что касается алкильной группы, которая может быть замещенной, представленной R5, R6 или R7, то предпочтительными являются, например, метильная группа, этильная группа, н-пропильная группа, изопропильная группа или трифторметильная группа. Более предпочтительна метильная группа. Существует другой вариант, в котором более предпочтительна трифторметильная группа. Что касается алкоксигруппы, которая может быть замещенной и представленной R5, R6 или R7, то предпочтительными являются, например, метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа или трифторметилоксигруппа. Более предпочтительна метоксигруппа. Существует другой вариант, в котором более предпочтительна трифторметилоксигруппа.
Далее, в тех случаях, когда R4 и R5 вместе представляют цикл, который выбран из группы, состоящей из частично ненасыщенного углеводородного цикла, который может быть замещенным, и ненасыщенного углеводородного цикла, который может быть замещенным, или цикл, в котором один из составляющих цикл атомов углерода в цикле замещен атомом кислорода, атомом серы или атомом азота, и предпочтительно, чтобы Cy представлял собой бензольное кольцо и R4 и R5 вместе образовали частично ненасыщенный углеводородный цикл или цикл, в котором один из составляющих цикл атомов углерода в цикле был замещен атомом кислорода или атомом серы.
Что касается частично ненасыщенного углеводородного цикла, то может быть упомянута структура циклопента-1,3-диена, циклогекса-1,3-диена или циклогепта-1,3-диена. Предпочтительной является структура циклопента-1,3-диена или циклогекса-1,3-диена. Более предпочтительна структура циклогекса-1,3-диена.
Что касается ненасыщенного углеводородного цикла, то можно указать на бензольное кольцо.
Что касается цикла, в котором один из составляющих цикл атомов углерода в частично ненасыщенном углеводородном цикле или ненасыщенном углеводородном цикле замещен атомом кислорода, атомом серы или атомом азота, то можно упомянуть цикличекие структуры тиофена, фурана, пиррола, 2H-пирана, 2H-тиопирана, 1,2-дигидропиридина или пиридина. Предпочтительной является структура тиофена, фурана, 2H-пирана или 2H-тиопирана. Более предпочтительна структура тиофена или фурана.
В тех случаях, когда R4 и R5 вместе представляют циклическую структуру, в качестве соединения формулы (1), предпочтительным является соединение, имеющее любую из нижеследующих формул (1-6)-(1-10):
[Химическая формула 4]
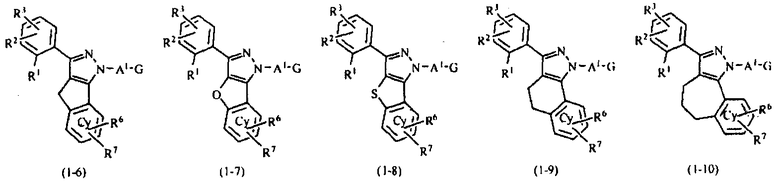
[в формулах (1-6)-(1-10) Cy, R1, R2, R3, R6, R7, A1 и G такие, как определены выше, при условии, что R1 не объединяется с R4 с образованием цикла] и более предпочтительным является соединение формулы (1-6) или формулы (1-7). Соединение формулы (1-6) является еще более предпочтительным. Кроме того, существует другой вариант, в котором еще более предпочтительным является соединение формулы (1-7).
Кроме того, если R4 и R5 вместе представляют структуру циклопента-1,3-диена, например, то это указывает на то, что соединение формулы (1) соответствует формуле (1-6). Кроме того, если R4 и R5 вместе представляют структуру фурана, например, то это указывает на то, что соединение формулы (1) соответствует формуле (1-7).
Однако невозможен случай, когда R1 и R4 вместе представляют цикл, который выбран из группы, состоящей из частично ненасыщенного углеводородного цикла, который может быть замещенным, и ненасыщенного углеводородного цикла, который может быть замещенным, или цикл, в котором один из составляющих цикл углеродных атомов в цикле замещен атомом кислорода, атомом серы или атомом азота, и одновременно с этим R4 и R5 вместе представляют цикл, который выбран из группы, состоящей из частично ненасыщенного углеводородного цикла, который может быть замещенным, и ненасыщенного углеводородного цикла, который может быть замещенным, или цикл, в котором один из составляющих цикл атомов углерода в цикле замещен атомом кислорода, атомом серы или атомом азота.
A1 представляет собой простую связь, алкиленовую группу, которая может быть замещенной, или алкениленовую группу, которая может быть замещенной. Предпочтительно, A1 представляет собой простую связь, алкиленовую группу или алкениленовую группу. Более предпочтительно, A1 представляет собой простую связь, метиленовую группу, которая может быть замещена низшей алкильной группой, или этениленовую группу, которая может быть замещена низшей алкильной группой. Еще более предпочтительно, когда A1 представляет собой простую связь. Существует другой вариант, в котором более предпочтительна метиленовая группа. Кроме того, существует другой вариант, в котором более предпочтительна этениленовая группа. Что касается стереохимии, имеющей отношение к двойной связи, содержащейся в этениленовой группе, которая представлена A1, то приемлем любой из цис- и транс-изомеров. Предпочтительной является цис-форма изомера.
G представляет собой любую одну из нижеследующих формул (G1)-(G4):
[Химическая формула 5]
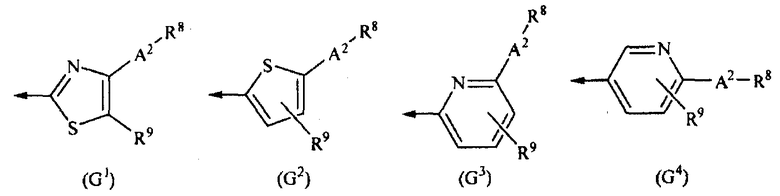
[в формулах (G1)-(G4) A2 представляет собой простую связь, алкиленовую группу, или алкениленовую группу, которая может быть замещенной, R8 представляет собой карбоксигруппу, -CON(R81)(R82) (R81 и R82 могут быть одинаковыми или отличными друг от друга, и каждый независимо представляет собой атом водорода, алкильную группу, которая может быть замещенной, или арильную группу, которая может быть замещенной, или R81 и R82 вместе образуют 3-7-членный цикл, который представляет собой циклический амин N(R81)(R82).), -COOR83 (R83 представляет собой алкильную группу, которая может быть замещенной.) или тетразол-5-ильную группу, и R9 представляет собой атом водорода или алкильную группу, которая может быть замещенной]. Кроме того, стрелка, обозначенная в формулах (G1)-(G4), указывает на положение для связи с A1.
G представляет собой предпочтительно заместители, представленные формулой (G1). Существует другой вариант, в котором G представляет собой предпочтительно заместители, представленные формулой (G2). Далее, существует другой вариант, в котором G представляет собой предпочтительно заместители, представленные формулой (G3). Еще дальше, существует другой вариант, в котором G представляет собой предпочтительно заместители, представленные формулой (G4).
A2 представляет собой простую связь, алкиленовую группу или алкениленовую группу, которая может быть замещенной. Предпочтительно A2 представляет собой простую связь, алкиленовую группу, содержащую два или меньшее число углеродных атомов, которая может быть замещена низшей алкильной группой, или этениленовую группу, которая может быть замещена низшей алкильной группой. Более предпочтительно A2 представляет собой простую связь. Существует другой вариант, в котором A2 более предпочтительно представляет собой этениленовую группу. Что касается стереохимии, имеющей отношение к двойной связи, содержащейся в этениленовой группе, представленной A2, то приемлем любой из цис- и транс-изомеров. Предпочтительным является транс-изомер.
R8 представляет собой карбоксигруппу, -CON(R81)(R82) (R81 и R82 могут быть одинаковыми или отличными друг от друга, и каждый независимо представляет собой атом водорода, алкильную группу, которая может быть замещенной, или арильную группу, которая может быть замещенной, или R81 и R82 вместе образуют 3-7-членный цикл, который представляет собой циклический амин N(R81)(R82).), -COOR83 (R83 представляет собой алкильную группу, которая может быть замещенной.) или тетразол-5-ильную группу. В качестве R8 предпочтительна карбоксигруппа или -COOR83 (R83 такой, как определен выше). Более предпочтительна карбоксигруппа. R83 особенно не ограничен при условии, что R83 представляет собой вышеописанную алкильную группу, которая может быть замещенной. Более предпочтительна низшая алкильная группа. Еще более предпочтительна метильная группа или этильная группа.
R9 представляет собой атом водорода или алкильную группу, которая может быть замещенной. R9 представляет собой предпочтительно атом водорода. R9 присутствует в положении 5 цикла тиазола формулы (G1). R9 может присутствовать при любом атоме углерода цикла формул (G2)-(G4), исключая место связи с A1 и A2. Что касается алкильной группы, которая может быть замещенной, представленной R9, то предпочтительна низшая алкильная группа. Более предпочтительна метильная группа или этильная группа. Еще более предпочтительна метильная группа.
Комбинация заместителей для соединений по данному изобретению особенно не ограничена, и предпочтительные примеры возможной их комбинации включают нижеследующие:
<A1> Соединение, в котором G представляет собой формулу (G1);
<A2> Соединение, в котором G представляет собой формулу (G2);
<A3> Соединение, в котором G представляет собой формулу (G3);
<A4> Соединение, в котором G представляет собой формулу (G4);
<B1> Соединение, в котором R8 представляет собой карбоксигруппу;
<B2> Соединение, в котором R8 представляет собой -COOR83;
<B3> Соединение, в котором R8 представляет собой тетразол-5-ильную группу;
<C1> Соединение, соответствующее <B1> из числа любого из вышеуказанных <A1>-<A4>;
<C2> Соединение, соответствующее <B2> из числа любого из вышеуказанных <A1>-<A4>;
<C3> Соединение, соответствующее <B3> из числа любого из вышеуказанных <A1>-<A4>;
<D1> Соединение, в котором A2 представляет собой простую связь;
<D2> Соединение, в котором A2 представляет собой алкиленовую группу;
<D3> Соединение, в котором A2 представляет собой алкиленовую группу, содержащую два или меньшее число углеродных атомов, которая может быть замещена низшей алкильной группой;
<D4> Соединение, в котором A2 представляет собой этиленовую группу;
<D5> Соединение, в котором A2 представляет собой метиленовую группу;
<D6> Соединение, в котором A2 представляет собой алкениленовую группу;
<D7> Соединение, в котором A2 представляет собой этениленовую группу, которая может быть замещена низшей алкильной группой;
<D8> Соединение, в котором A2 представляет собой этениленовую группу;
<E1> Соединение, соответствующее <D1> из числа любого из вышеуказанных <A1>-<C3>;
<E2> Соединение, соответствующее <D2> из числа любого из вышеуказанных <A1>-<C3>;
<E3> Соединение, соответствующее <D3> из числа любого из вышеуказанных <A1>-<C3>;
<E4> Соединение, соответствующее <D4> из числа любого из вышеуказанных <A1>-<C3>;
<E5> Соединение, соответствующее <D5> из числа любого из вышеуказанных <A1>-<C3>;
<E6> Соединение, соответствующее <D6> из числа любого из вышеуказанных <A1>-<C3>;
<E7> Соединение, соответствующее <D7> из числа любого из вышеуказанных <A1>-<C3>;
<E8> Соединение, соответствующее <D8> из числа любого из вышеуказанных <A1>-<C3>;
<F1> Соединение, в котором A1 представляет собой простую связь;
<F2> Соединение, в котором A1 представляет собой алкиленовую группу;
<F3> Соединение, в котором A1 представляет собой алкиленовую группу, содержащую два или меньшее число углеродных атомов, которая может быть замещена низшей алкильной группой;
<F4> Соединение, в котором A1 представляет собой этиленовую группу;
<F5> Соединение, в котором A1 представляет собой метиленовую группу;
<F6> Соединение, в котором A1 представляет собой алкениленовую группу;
<F7> Соединение, в котором A1 представляет собой этениленовую группу, которая может быть замещена низшей алкильной группой;
<F8> Соединение, в котором A1 представляет собой этениленовую группу;
<G1> Соединение, соответствующее <F1> из числа любого из вышеуказанных <A1>-<E8>;
<G2> Соединение, соответствующее <F2> из числа любого из вышеуказанных <A1>-<E8>;
<G3> Соединение, соответствующее <F3> из числа любого из вышеуказанных <A1>-<E8>;
<G4> Соединение, соответствующее <F4> из числа любого из вышеуказанных <A1>-<E8>;
<G5> Соединение, соответствующее <F5> из числа любого из вышеуказанных <A1>-<E8>;
<G6> Соединение, соответствующее <F6> из числа любого из вышеуказанных <A1>-<E8>;
<G7> Соединение, соответствующее <F7> из числа любого из вышеуказанных <A1>-<E8>;
<G8> Соединение, соответствующее <F8> из числа любого из вышеуказанных <A1>-<E8>;
<H1> Соединение, в котором Cy представляет собой фенильную группу;
<H2> Соединение, в котором Cy представляет собой 1-циклопентенильную группу;
<H3> Соединение, в котором Cy представляет 1-циклогексенильную группу;
<H4> Соединение, в котором Cy представляет 2-тиенильную группу;
<H5> Соединение, в котором Cy представляет собой 3-тиенильную группу;
<H6> Соединение, в котором Cy представляет собой 3-пиридильную группу;
<H7> Соединение, в котором Cy представляет собой 2-фурильную группу;
<H8> Соединение, в котором Cy представляет собой 3-фурильную группу;
<H9> Соединение, в котором Cy представляет собой 3,4-дигидро-2H-пиран-6-ильную группу;
<H10> Соединение, в котором Cy представляет собой 8-хинолильную группу;
<H11> Соединение, в котором Cy представляет собой циклопентильную группу;
<H12> Соединение, в котором Cy представляет собой циклогексильную группу;
<H13> Соединение, в котором Cy представляет собой 1-пирролидинильную группу;
<I1> Соединение, соответствующее <H1> из числа любого из вышеуказанных <A1>-<G8>;
<I2> Соединение, соответствующее <H2> из числа любого из вышеуказанных <A1>-<G8>;
<I3> Соединение, соответствующее <H3> из числа любого из вышеуказанных <A1>-<G8>;
<I4> Соединение, соответствующее <H4> из числа любого из вышеуказанных <A1>-<G8>;
<I5> Соединение, соответствующее <H5> из числа любого из вышеуказанных <A1>-<G8>;
<I6> Соединение, соответствующее <H6> из числа любого из вышеуказанных <A1>-<G8>;
<I7> Соединение, соответствующее <H7> из числа любого из вышеуказанных <A1>-<G8>;
<I8> Соединение, соответствующее <H8> из числа любого из вышеуказанных <A1>-<G8>;
<I9> Соединение, соответствующее <H9> из числа любого из вышеуказанных <A1>-<G8>;
<I10> Соединение, соответствующее <H10> из числа любого из вышеуказанных <A1>-<G8>;
<I11> Соединение, соответствующее <H11> из числа любого из вышеуказанных <A1>-<G8>;
<I12> Соединение, соответствующее <H12> из числа любого из вышеуказанных <A1>-<G8>;
<I13> Соединение, соответствующее <H13> из числа любого из вышеуказанных <A1>-<G8>;
<J1> Соединение, в котором R2 представляет собой атом водорода;
<J2> Соединение, в котором R2 представляет собой гидроксигруппу;
<J3> Соединение, в котором R2 представляет собой атом фтора;
<J4> Соединение, в котором R2 представляет собой атом хлора;
<J5> Соединение, в котором R2 представляет собой атом брома;
<J6> соединение, в котором R2 представляет собой метильную группу;
<J7> Соединение, в котором R2 представляет собой этильную группу;
<J8> Соединение, в котором R2 представляет собой н-пропильную группу;
<J9> Соединение, в котором R2 представляет собой изопропильную группу;
<J10> Соединение, в котором R2 представляет собой трифторметильную группу;
<J11> Соединение, в котором R2 представляет собой метоксигруппу;
<J12> Соединение, в котором R2 представляет собой этоксигруппу;
<J13> Соединение, в котором R2 представляет собой н-пропоксигруппу;
<J14> Соединение, в котором R2 представляет собой изопропоксигруппу;
<J15> Соединение, в котором R2 представляет собой трифторметилоксигруппу;
<K1> Соединение, соответствующее <J1> из числа любого из вышеуказанных <A1>-<I13>;
<K2> Соединение, соответствующее <J2> из числа любого из вышеуказанных <A1>-<I13>;
<K3> Соединение, соответствующее <J3> из числа любого из вышеуказанных <A1>-<I13>;
<K4> Соединение, соответствующее <J4> из числа любого из вышеуказанных <A1>-<I13>;
<K5> Соединение, соответствующее <J5> из числа любого из вышеуказанных <A1>-<I13>;
<K6> Соединение, соответствующее <J6> из числа любого из вышеуказанных <A1>-<I13>;
<K7> Соединение, соответствующее <J7> из числа любого из вышеуказанных <A1>-<I13>;
<K8> Соединение, соответствующее <J8> из числа любого из вышеуказанных <A1>-<I13>;
<K9> Соединение, соответствующее <J9> из числа любого из вышеуказанных <A1>-<I13>;
<K10> Соединение, соответствующее <J10> из числа любого из вышеуказанных <A1>-<I13>;
<K11> Соединение, соответствующее <J11> из числа любого из вышеуказанных <A1>-<I13>;
<K12> Соединение, соответствующее <J12> из числа любого из вышеуказанных <A1>-<I13>;
<K13> Соединение, соответствующее <J13> из числа любого из вышеуказанных <A1>-<I13>;
<K14> Соединение, соответствующее <J14> из числа любого из вышеуказанных <A1>-<I13>;
<K15> Соединение, соответствующее <J15> из числа любого из вышеуказанных <A1>-<I13>;
<L1> Соединение, в котором R3 представляет собой атом водорода;
<L2> Соединение, в котором R3 представляет собой гидроксигруппу;
<L3> Соединение, в котором R3 представляет собой атом фтора;
<L4> Соединение, в котором R3 представляет собой атом хлора;
<L5> Соединение, в котором R3 представляет собой атом брома;
<L6> Соединение, в котором R3 представляет собой метильную группу;
<L7> Соединение, в котором R3 представляет собой этильную группу;
<L8> Соединение, в котором R3 представляет собой н-пропильную группу;
<L9> Соединение, в котором R3 представляет собой изопропильную группу;
<L10> Соединение, в котором R3 представляет собой трифторметильную группу;
<L11> Соединение, в котором R3 представляет собой метоксигруппу;
<L12> Соединение, в котором R3 представляет собой этоксигруппу;
<L13> Соединение, в котором R3 представляет собой н-пропоксигруппу;
<L14> Соединение, в котором R3 представляет собой изопропоксигруппу;
<L15> Соединение, в котором R3 представляет собой трифторметилоксигруппу;
<M1> Соединение, соответствующее <L1> из числа любого из вышеуказанных <A1>-<K15>;
<M2> Соединение, соответствующее <L2> из числа любого из вышеуказанных <A1>-<K15>;
<M3> Соединение, соответствующее <L3> из числа любого из вышеуказанных <A1>-<K15>;
<M4> Соединение, соответствующее <L4> из числа любого из вышеуказанных <A1>-<K15>;
<M5> Соединение, соответствующее <L5> из числа любого из вышеуказанных <A1>-<K15>;
<M6> Соединение, соответствующее <L6> из числа любого из вышеуказанных <A1>-<K15>;
<M7> Соединение, соответствующее <L7> из числа любого из вышеуказанных <A1>-<K15>;
<M8> Соединение, соответствующее <L8> из числа любого из вышеуказанных <A1>-<K15>;
<M9> Соединение, соответствующее <L9> из числа любого из вышеуказанных <A1>-<K15>;
<M10> Соединение, соответствующее <L10> из числа любого из вышеуказанных <A1>-<K15>;
<M11> Соединение, соответствующее <L11> из числа любого из вышеуказанных <A1>-<K15>;
<M12> Соединение, соответствующее <L12> из числа любого из вышеуказанных <A1>-<K15>;
<M13> Соединение, соответствующее <L13> из числа любого из вышеуказанных <A1>-<K15>;
<M14> Соединение, соответствующее <L14> из числа любого из вышеуказанных <A1>-<K15>;
<M15> Соединение, соответствующее <L15> из числа любого из вышеуказанных <A1>-<K15>;
<N1> Соединение, в котором R1 представляет собой атом водорода;
<N2> Соединение, в котором R1 представляет собой гидроксигруппу;
<N3> Соединение, в котором R1 представляет собой атом фтора;
<N4> Соединение, в котором R1 представляет собой атом хлора;
<N5> Соединение, в котором R1 представляет собой атом брома;
<N6> Соединение, в котором R1 представляет собой метильную группу;
<N7> Соединение, в котором R1 представляет собой этильную группу;
<N8> Соединение, в котором R1 представляет собой н-пропильную группу;
<N9> Соединение, в котором R1 представляет собой изопропильную группу;
<N10> Соединение, в котором R1 представляет собой трифторметильную группу;
<N11> Соединение, в котором R1 представляет собой метоксигруппу;
<N12> Соединение, в котором R1 представляет собой этоксигруппу;
<N13> Соединение, в котором R1 представляет собой н-пропоксигруппу;
<N14> Соединение, в котором R1 представляет собой изопропоксигруппу;
<N15> Соединение, в котором R1 представляет собой трифторметилоксигруппу
<N16> Соединение, в котором R4 представляет собой гидроксигруппу;
<N17> Соединение, в котором R4 представляет собой аминогруппу;
<N18> Соединение, в котором R4 представляет собой атом фтора;
<N19> Соединение, в котором R4 представляет собой атом хлора;
<N20> Соединение, в котором R4 представляет собой атом брома;
<N21> Соединение, в котором R4 представляет собой метильную группу;
<N22> Соединение, в котором R4 представляет собой этильную группу;
<N23> Соединение, в котором R4 представляет собой н-пропильную группу;
<N24> Соединение, в котором R4 представляет собой изопропильную группу;
<N25> Соединение, в котором R4 представляет собой трифторметильную группу;
<N26> Соединение, в котором R5 представляет собой атом водорода;
<N27> Соединение, в котором R5 представляет собой гидроксигруппу;
<N28> Соединение, в котором R5 представляет собой атом фтора;
<N29> Соединение, в котором R5 представляет собой атом хлора;
<N30> Соединение, в котором R5 представляет собой атом брома;
<N31> Соединение, в котором R5 представляет собой метильную группу;
<N32> Соединение, в котором R5 представляет собой этильную группу;
<N33> Соединение, в котором R5 представляет собой н-пропильную группу;
<N34> Соединение, в котором R5 представляет собой изопропильную группу;
<N35> Соединение, в котором R5 представляет собой трифторметильную группу;
<N36> Соединение, в котором R5 представляет собой метоксигруппу;
<N37> Соединение, в котором R5 представляет собой этоксигруппу;
<N38> Соединение, в котором R5 представляет собой н-пропоксигруппу;
<N39> Соединение, в котором R5 представляет собой изопропоксигруппу;
<N40> Соединение, в котором R5 представляет собой трифторметилоксигруппу;
<N41> Соединение, в котором R1 и R4 вместе образуют структуру циклопента-1,3-диена;
<N42> Соединение, в котором R1 и R4 вместе образуют структуру циклогекса-1,3-диена;
<N43> Соединение, в котором R1 и R4 вместе образуют структуру тиофена;
<N44> Соединение, в котором R1 и R4 вместе образуют структуру фурана;
<N45> Соединение, в котором R4 и R5 вместе образуют структуру циклопента-1,3-диена;
<N46> Соединение, в котором R4 и R5 вместе образуют структуру циклогекса-1,3-диена;
<N47> Соединение, в котором R4 и R5 вместе образуют структуру тиофена;
<N48> Соединение, в котором R4 и R5 вместе образуют структуру фурана;
<О1> Соединение, соответствующее <N1> из числа любого из вышеуказанных <A1>-<M15>;
<О2> Соединение, соответствующее <N2> из числа любого из вышеуказанных <A1>-<M15>;
<О3> Соединение, соответствующее <N3> из числа любого из вышеуказанных <A1>-<M15>;
<О4> Соединение, соответствующее <N4> из числа любого из вышеуказанных <A1>-<M15>;
<О5> Соединение, соответствующее <N5> из числа любого из вышеуказанных <A1>-<M15>;
<О6> Соединение, соответствующее <N6> из числа любого из вышеуказанных <A1>-<M15>;
<О7> Соединение, соответствующее <N7> из числа любого из вышеуказанных <A1>-<M15>;
<О8> Соединение, соответствующее <N8> из числа любого из вышеуказанных <A1>-<M15>;
<О9> Соединение, соответствующее <N9> из числа любого из вышеуказанных <A1>-<M15>;
<O10> Соединение, соответствующее <N10> из числа любого из вышеуказанных <A1>-<M15>;
<О11> Соединение, соответствующее <N11> из числа любого из вышеуказанных <A1>-<M15>;
<О12> Соединение, соответствующее <N12> из числа любого из вышеуказанных <A1>-<M15>;
<О13> Соединение, соответствующее <N13> из числа любого из вышеуказанных <A1>-<M15>;
<О14> Соединение, соответствующее <N14> из числа любого из вышеуказанных <A1>-<M15>;
<О15> Соединение, соответствующее <N15> из числа любого из вышеуказанных <A1>-<M15>;
<О16> Соединение, соответствующее <N16> из числа любого из вышеуказанных <A1>-<M15>;
<О17> Соединение, соответствующее <N17> из числа любого из вышеуказанных <A1>-<M15>;
<О18> Соединение, соответствующее <N18> из числа любого из вышеуказанных <A1>-<M15>;
<О19> Соединение, соответствующее <N19> из числа любого из вышеуказанных <A1>-<M15>;
<O20> Соединение, соответствующее <N20> из числа любого из вышеуказанных <A1>-<M15>;
<О21> Соединение, соответствующее <N21> из числа любого из вышеуказанных <A1>-<M15>;
<O22> Соединение, соответствующее <N22> из числа любого из вышеуказанных <A1>-<M15>;
<O23> Соединение, соответствующее <N23> из числа любого из вышеуказанных <A1>-<M15>;
<O24> Соединение, соответствующее <N24> из числа любого из вышеуказанных <A1>-<M15>;
<O25> Соединение, соответствующее <N25> из числа любого из вышеуказанных <A1>-<M15>;
<O26> Соединение, соответствующее <N26> из числа любого из вышеуказанных <A1>-<M15>;
<O27> Соединение, соответствующее <N27> из числа любого из вышеуказанных <A1>-<M15>;
<O28> Соединение, соответствующее <N28> из числа любого из вышеуказанных <A1>-<M15>;
<O29> Соединение, соответствующее <N29> из числа любого из вышеуказанных <A1>-<M15>;
<O30> Соединение, соответствующее <N30> из числа любого из вышеуказанных <A1>-<M15>;
<О31> Соединение, соответствующее <N31> из числа любого из вышеуказанных <A1>-<M15>;
<O32> Соединение, соответствующее <N32> из числа любого из вышеуказанных <A1>-<M15>;
<O33> Соединение, соответствующее <N33> из числа любого из вышеуказанных <A1>-<M15>;
<O34> Соединение, соответствующее <N34> из числа любого из вышеуказанных <A1>-<M15>;
<O35> Соединение, соответствующее <N35> из числа любого из вышеуказанных <A1>-<M15>;
<O36> Соединение, соответствующее <N36> из числа любого из вышеуказанных <A1>-<M15>;
<O37> Соединение, соответствующее <N37> из числа любого из вышеуказанных <A1>-<M15>;
<O38> Соединение, соответствующее <N38> из числа любого из вышеуказанных <A1>-<M15>;
<O39> Соединение, соответствующее <N39> из числа любого из вышеуказанных <A1>-<M15>;
<O40> Соединение, соответствующее <N40> из числа любого из вышеуказанных <A1>-<M15>;
<041> Соединение, соответствующее <N41> из числа любого из вышеуказанных <A1>-<M15>;
<O42> Соединение, соответствующее <N42> из числа любого из вышеуказанных <A1>-<M15>;
<O43> Соединение, соответствующее <N43> из числа любого из вышеуказанных <A1>-<M15>;
<O44> Соединение, соответствующее <N44> из числа любого из вышеуказанных <A1>-<M15>;
<O45> Соединение, соответствующее <N45> из числа любого из вышеуказанных <A1>-<M15>;
<O46> Соединение, соответствующее <N46> из числа любого из вышеуказанных <A1>-<M15>;
<O47> Соединение, соответствующее <N47> из числа любого из вышеуказанных <A1>-<M15>;
<О48> Соединение, соответствующее <N48> из числа любого из вышеуказанных <A1>-<M15>;
<P1> Соединение, в котором R6 представляет собой атом водорода;
<P2> Соединение, в котором R6 представляет собой гидроксигруппу;
<P3> Соединение, в котором R6 представляет собой атом фтора;
<P4> Соединение, в котором R6 представляет собой атом хлора;
<P5> Соединение, в котором R6 представляет собой атом брома;
<P6> Соединение, в котором R6 представляет собой метильную группу;
<P7> Соединение, в котором R6 представляет собой этильную группу;
<P8> Соединение, в котором R6 представляет собой н-пропильную группу;
<P9> Соединение, в котором R6 представляет собой изопропильную группу;
<P10> Соединение, в котором R6 представляет собой трифторметильную группу;
<P11> Соединение, в котором R6 представляет собой метоксигруппу;
<P12> Соединение, в котором R6 представляет собой этоксигруппу;
<P13> Соединение, в котором R6 представляет собой н-пропоксигруппу;
<P14> Соединение, в котором R6 представляет собой изопропоксигруппу;
<P15> Соединение, в котором R6 представляет собой трифторметилоксигруппу;
<Q1> Соединение, соответствующее <P1> из числа любого из вышеуказанных <A1>-<O48>;
<Q2> Соединение, соответствующее <P2> из числа любого из вышеуказанных <A1>-<O48>;
<Q3> Соединение, соответствующее <P3> из числа любого из вышеуказанных <A1>-<O48>;
<Q4> Соединение, соответствующее <P4> из числа любого из вышеуказанных <A1>-<O48>;
<Q5> Соединение, соответствующее <P5> из числа любого из вышеуказанных <A1>-<O48>;
<Q6> Соединение, соответствующее <P6> из числа любого из вышеуказанных <A1>-<O48>;
<Q7> Соединение, соответствующее <P7> из числа любого из вышеуказанных <A1>-<O48>;
<Q8> Соединение, соответствующее <P8> из числа любого из вышеуказанных <A1>-<O4 8>;
<Q9> Соединение, соответствующее <P9> из числа любого из вышеуказанных <A1>-<O48>;
<Q10> Соединение, соответствующее <P10> из числа любого из вышеуказанных <A1>-<O48>;
<Q11> Соединение, соответствующее <P11> из числа любого из вышеуказанных <A1>-<O48>;
<Q12> Соединение, соответствующее <P12> из числа любого из вышеуказанных <A1>-<O48>;
<Q13> Соединение, соответствующее <P13> из числа любого из вышеуказанных <A1>-<O4 8>;
<Q14> Соединение, соответствующее <P14> из числа любого из вышеуказанных <A1>-<O48>;
<Q15> Соединение, соответствующее <P15> из числа любого из вышеуказанных <A1>-<O48>;
<R1> Соединение, в котором R7 представляет собой атом водорода;
<R2> Соединение, в котором R7 представляет собой гидроксигруппу;
<R3> Соединение, в котором R7 представляет собой атом фтора;
<R4> Соединение, в котором R7 представляет собой атом хлора;
<R5> Соединение, в котором R7 представляет собой атом брома;
<R6> Соединение, в котором R7 представляет собой метильную группу;
<R7> Соединение, в котором R7 представляет собой этильную группу;
<R8> Соединение, в котором R7 представляет собой н-пропильную группу;
<R9> Соединение, в котором R7 представляет собой изопропильную группу;
<R10> Соединение, в котором R7 представляет собой трифторметильную группу;
<R11> Соединение, в котором R7 представляет собой метоксигруппу;
<R12> Соединение, в котором R7 представляет собой этоксигруппу;
<R13> Солединение, в котором R7 представляет собой н-пропоксигруппу;
<R14> Соединение, в котором R7 представляет собой изопропоксигруппу;
<R15> Соединение, в котором R7 представляет собой трифторметилоксигруппу;
<S1> Соединение, соответствующее <R1> из числа любого из вышеуказанных <A1>-<Q15>;
<S2> Соединение, соответствующее <R2> из числа любого из вышеуказанных <A1>-<Q15>;
<S3> Соединенипе, соответствующее <R3> из числа любого из вышеуказанных <A1>-<Q15>;
<S4> Соединение, соответствующее <R4> из числа любого из вышеуказанных <A1>-<Q15>;
<S5> Соединение, соответствующее <R5> из числа любого из вышеуказанных <A1>-<Q15>;
<S6> Соединение, соответствующее <R6> из числа любого из вышеуказанных <A1>-<Q15>;
<S7> Соединение, соответствующее <R7> из числа любого из вышеуказанных <A1>-<Q15>;
<S8> Соединение, соответствующее <R8> из числа любого из вышеуказанных <A1>-<Q15>;
<S9> Соединение, соответствующее <R9> из числа любого из вышеуказанных <A1>-<Q15>;
<S10> Соединение, соответствующее <R10> из числа любого из вышеуказанных <A1>-<Q15>;
<S11> Соединение, соответствующее <R11> из числа любого из вышеуказанных <A1>-<Q15>;
<S12> Соединение, соответствующее <R12> из числа любого из вышеуказанных <A1>-<Q15>;
<S13> Соединение, соответствующее <R13> из числа любого из вышеуказанных <A1>-<Q15>;
<S14> Соединение, соответствующее <R14> из числа любого из вышеуказанных <A1>-<Q15>;
<S15> Соединение, соответствующее <R15> из числа любого из вышеуказанных <A1>-<Q15>;
<T1> Соединение, в котором R9 представляет собой атом водорода;
<T2> Соединение, в котором R9 представляет собой метильную группу;
<T3> Соединение, в котором R9 представляет собой этильную группу;
<U1> Соединение, соответствующее <T1> из числа любого из вышеуказанных <A1>-<S15>;
<U2> Соединение, соответствующее <T2> из числа любого из вышеуказанных <A1>-<S15>;
<U3> Соединение, соответствующее <T3> из числа любого из вышеуказанных <A1>-<S15>.
Соединения по данному изобретению являются новыми соединениями, которые никогда не раскрывались в какой-либо литературе. Несмотря на то, что соединения по данному изобретению можно получить, например, согласно способу, описанному ниже, способ получения соединений по данному изобретению этим способом не ограничивается.
Для каждой реакции время реакции особенно не ограничено. Поскольку протекание реакции может легко контролироваться, используя нижеописанный аналитический метод, то каждая реакция может быть прекращена, когда количество получаемого целевого соединения будет максимальным. Кроме того, в случае необходимости, каждая реакция может осуществляться в атмосфере инертного газа, как например, в потоке азота или в потоке аргона. Далее, для каждой реакции, когда требуется защита с использованием защитной группы или последующая реакция, связанная с ее удалением, эта реакция может быть осуществлена надлежащим образом, используя нижеописанные способы.
Примеры защитной группы, которые могут быть использованы в случае данного изобретения, включают защитную группу для карбоксильной группы (-COOH), защитную группу для гидроксигруппы (-OH), защитную группу для формильной группы (-CHO-), защитную группу для аминогруппы (-NH2) и т.п.
Что касается защитной группы для карбоксильной группы, то могут быть упомянуты, например, алкильная группа, содержащая от 1 до 4 углеродных атомов, алкенильная группа, содержащая от 2 до 4 углеродных атомов, алкильная группа, содержащая от 1 до 4 углеродных атомов, замещенная алкоксигруппой, содержащей от 1 до 4 углеродных атомов, алкильная группа, содержащая от 1 до 4 углеродных атомов, замещенная 1-3 атомами галогена, и т.д. Конкретные примеры включают метильную группу, этильную группу, трет-бутильную группу, аллильную группу, метоксиэтильную группу, трихлорэтильную группу и т.п.
Что касается защитной группы для гидроксигруппы, то могут быть упомянуты, например, алкильная группа, содержащая от 1 до 4 углеродных атомов, алкенильная группа, содержащая от 2 до 4 углеродных атомов, алкильная группа, содержащая от 1 до 4 углеродных атомов, замещенная алкоксигруппой, содержащей от 1 до 4 углеродных атомов, алкильная группа, содержащая от 1 до 4 углеродных атомов, замещенная 1-3 атомами галогена, силильная группа, которая замещена тремя различными или одинаковыми фенильными группами или алкильными группами, содержащими от 1 до 4 углеродных атомов, тетрагидропиранильная группа, тетрагидрофурильная группа, пропаргильная группа, триметилсилилэтильная группа и т.п. Конкретные примеры включают метильную группу, этильную группу, трет-бутильную группу, аллильную группу, метоксиметильную (MOM) группу, метоксиэтильную (MEM) группу, трихлорэтильную группу, фенильную группу, метилфенильную группу, хлорфенильную группу, бензильную группу, метилбензильную группу, хлорбензильную группу, дихлорбензильную группу, фторбензильную группу, трифторметилбензильную группу, нитробензильную группу, метоксифенильную группу, N-метиламинобензильную группу, N,N-диметиламинобензильную группу, фенацильную группу, тритильную группу, 1-этоксиэтильную (EE) группу, тетрагидропиранильную (THP) группу, тетрагидрофурильную группу, пропаргильную группу, триметилсилильную (TMS) группу, триэтилсилильную (TES) группу, трет-бутилдиметилсилильную (TBDMS) группу, трет-бутилдифенилсилильную (TBDPS) группу, ацетильную (Ac) группу, пивалоильную группу, бензоильную группу, арилоксикарбонильную (Alloc) группу, 2,2,2-трихлорэтоксикарбонильную (Troc) группу и т.п.
Что касается защитной группы для формильной группы, то может быть упомянута, например, ацетальная группа и т.п. В частности, можно указать на диметилацеталь и т.п.
Что касается защитной группы для аминогруппы, то могут быть упомянуты бензильная группа, метилбензильная группа, хлорбензильная группа, дихлорбензильная группа, фторбензильная группа, трифторметилбензильная группа, нитробензильная группа, метоксифенильная группа, N-метиламинобензильная группа, N,N-диметиламинобензильная группа, фенацильная группа, ацетильная группа, трифторацетильная группа, пивалоильная группа, бензоильная группа, аллилоксикарбонильная группа, 2,2,2-трихлорэтоксикарбонильная группа, бензилоксикарбонильная группа, трет-бутоксикарбонильная (Boc) группа, 1-метил-1-(4-бифенил)этоксикарбонильная (Bpoc) группа, 9-флуоренилметоксикарбоонильная группа, бензилоксиметильная (BOM) группа и 2-(триметилсилил)этоксиметильная (SEM) группа и т.д.
Защитная группа может быть удалена одновременно или последовательно во время промежуточной стадии или на конечной стадии способа получения, и она может быть соответственно превращена в желаемый продукт. Способ защиты и снятия защиты может быть осуществлен в соответствии с известным способом, например, способом, описанным в "Protective Groups in Organic Synthesis, Fourth Edition, 2007, John Wiley & Sons, Inc." Способ защиты и соответственно ее снятия может быть осуществлен, например, способами (1)-(6), изложенными ниже.
(1) Реакцию снятия защиты, основанную на щелочном гидролизе, осуществляют, например, посредством реакции в присутствии основания в полярном растворителе. Примеры основания включают, например, основание щелочных металлов, такое как гидроксид натрия, гидроксид калия, гидроксид лития, гидроксид бария, гидроксид кальция, карбонат натрия, карбонат калия, метоксид натрия, трет-бутоксид калия, и органическое основание, такое как триэтиламин. В случае основания щелочных металлов, количество используемого основания обычно в 1-20 раз, предпочтительно в 1-10 раз, превышает молярное количество реакционного соединения, и в случае использования органического основания его количество составляет 1 моль и выше. Растворителем для реакции обычно является инертная среда, которая не оказывает никакого влияния на ход реакции. Предпочтительно реакцию проводят в полярном растворителе. Примеры полярного растворителя включают воду, метанол, этанол, тетрагидрофуран, диоксан и т.п. При необходимости может быть также использована смесь этих растворителей. Температуру реакции выбирают подходящим образом, как правило, в диапазоне от -10°C до температуры кипения выбранного растворителя. Например, когда используют основание щелочного металла, время реакции обычно находится в диапазоне от 0,5 до 72 часов, предпочтительно от 1 до 48 часов. В случае использования органического основания, например, время реакции обычно находится в диапазоне от 5 часов до 14 дней. Поскольку ход реакции может быть контролирован посредством тонкослойной хроматографии (ТСХ, TLC), высокоэффективной жидкостной хроматографии (ВЭЖХ, HPLC) и т.д., то реакцию можно оборвать, когда количество целевого соединения будет наибольшим.
(2) Реакцию снятия защиты в кислых условиях осуществляют, например, в органическом растворителе, таком как дихлорметан, хлороформ, диоксан, этилацетат, или анизол, в присутствии органической кислоты, такой как уксусная кислота, трифторуксусная кислота, метансульфокислота, п-толуолсульфокислота, кислота Льюиса, как, например, трибромид бора, трифторид бора, бромид алюминия или хлорид алюминия, или неорганической кислоты, такой как хлористоводородная кислота или серная кислота, или их смеси, как, например, гидробромид и уксусная кислота, при температуре от -10 до 100°C. Кроме того, существует другой способ, в котором этантиол, 1,2-этандитиол и т.д. добавляют в качестве добавки.
(3) Реакция снятия защиты, основанную на гидрировании, может быть осуществлена в органическом растворителе, например, типа простого эфира, таком как тетрагидрофуран, диоксан, диметоксиэтан или диэтиловый эфир, спирте, таком как метанол или этанол, растворителе типа бензола, таком как бензол или толуол, кетоне, таком как ацетон или метилэтилкетон, нитриле, таком как ацетонитрил, амидном растворителе, таком как диметилформамид, типа сложного эфира, таком как этилацетат, воде, уксусной кислоте или смешанном растворителе, включая два или большее число из них, в присутствии катализатора, таком как порошок палладия-на-углероде, оксид платины (PtO2) или активированный никель, и источника водорода, как например, газ-водород в условиях атмосферного давления или при повышенном давлении, соли аммония муравьиной кислоты или гидрата гидразина, при температуре в диапазоне от -10 до 60°C.
(4) Реакцию снятия защиты, связанной с удалением силильной группы, осуществляют, например, используя тетра-н-бутиламмонийфторид и т.п., в органическом растворителе, который смешивается с водой (например, тетрагидрофуран, ацетонитрил и т.п.), при температуре в диапазоне от -10 до 60°C.
(5) Реакцию снятия защиты с использованием металла, осуществляют в кислотном растворителе, например, в уксусной кислоте, буферном растворе, имеющем pH в диапазоне от 4,2 до 7,2, или смешанном растворителе, включая вышеуказанные растворители и органический растворитель, такой как тетрагидрофуран и т.п., в присутствии порошка цинка с или без обработки ультразвуком, при температуре в диапазоне от -10 до 60°C.
(6) Реакцию снятия защиты с использованием комплекса металла осуществляют, например, в органическом растворителе, таком как дихлорметан, диметилформамид, тетрагидрофуран, этилацетат, ацетонитрил, диоксан или этанол, воде или смеси из вышеуказанных растворителей, в присутствии улавливающего агента, такого как трибутилоловогидрид, триэтилсилан, димедон, морфолин, диэтиламин или пирролидон, органической кислоты, такой как уксусная кислота, муравьиная кислота или 2-этилгексановая кислота, и/или соли органической кислоты, такой как 2-этилгексаноат натрия или 2-этилгексаноат калия, с или без фосфинового реагента, такого как трифенилфосфин, при использовании комплекса металла, как например, тетракистрифенилфосфинпалладий(0), дихлорбис(трифенилфосфин)палладий(II), ацетат палладия(II) или хлортрис(трифенилфосфин)родий(I), при температуре в диапазоне от -10 до 60°C.
Соединения, представленные формулой (1), по данному изобретению можно получить ретросинтетическим путем, например, согласно нижеследующей реакции.
[Химическая формула 6]
Например, соединения, представленные формулой (1), могут быть получены путем удаления одновременно или последовательно всех защитных групп с соединений, представленных формулой (2) [в формуле (2) R1a, R2a, R3a, R4a, R5a, R6a, R7a, Cya, A1a и Ga имеют такие же значения, как вышеописанные R1, R2, R3, R4, R5, R6, R7, Cy, A1 и G соответственно (при условии, что формула, которая соответствует общим формулам (G1)-(G4), отражающих G, т.е. общая формула Ga представляется как (G1a)-(G4a), и символы, которые соответствуют A2, R8 и R9 формул (G1)-(G4), представляют собой A2a, R8a и R9a соответственно в формулах (G1a)-(G4a)), или по меньшей мере одна из этих групп может быть защищенной. X и Y такие, как определены выше.]. Реакция снятия защиты может быть осуществлена известным способом, например, способом, описанным в "Protective Groups in Organic Synthesis, 2007, John Wiley & Sons, Inc." Далее, если R1a, R2a, R3a, R4a, R5a, R6a, R7a, Cya, A1a и Ga в формуле (2) имеют такие же значения, как вышеописанные R1, R2, R3, R4, R5, R6, R7, Cy, A1 и G, то соединения, представленные формулой (2), соответствуют соединениям, представленным формулой (1), не требуя какой-либо реакции снятия защиты.
Соединения, представленные формулой (2A) [в формуле (2A), R1a, R2a, R3a, R4a, R5a, R6a, R7a, A1a, Ga, X и Y такие, как определены выше.], т.е. соединения формулы (2), в которой Cya представляет собой арильную группу, могут быть получены ретросинтетическим путем согласно нижеследующей реакции, например.
[Химическая формула 7]
Среди соединений, представленных формулой (2А), соединения, в которых A1a представляет собой простую связь или алкениленовую группу, которая может быть замещенной, можно получить взаимодействием соединений, представленных формулой (3A) [в формуле (3A), R1a, R2a, R3a, R4a, R5a, R6a, R7a, Cya, X и Y такие, как определены выше.], с соединениями, представленными формулой (4A) [в формуле (4A), A1a и Ga такие, как определены выше, и L1 представляет собой атом хлора, атом брома или атом иода.], используя коммерчески доступный катализатор меди или катализатор, полученный из порошка меди или соли меди и соединения-лиганда, в присутствии основания. Для взаимодействия соединений, представленных формулой (3A), и соединений, представленных формулой (4A), соединения, представленные формулой (4A), могут быть использованы в количестве 1/5-20 эквивалентов по сравнению с соединениями, представленными формулой (3A). Возможно также использование соединений, представленных формулой (4A), в количестве от 1/2 до 10 эквивалентов и предпочтительно от 1 до 5 эквивалентов. Однако это количество может быть надлежащим образом выбрано в зависимости от чистоты, выхода и эффективности очистки соединений, представленных формулой (2A). В качестве медного катализатора коммерчески доступный катализатор, такой как бис(ацетилацетонат)медь(II), может быть добавлен непосредственно в реакционную систему или может быть использован катализатор, полученный смешением медного порошка, хлорида меди(I), бромида меди(I), иодида меди(I), цианида меди(I), оксида меди(I), хлорида меди(II), бромида меди(II), ацетата меди(II), сульфата меди(II) или оксида меди(II) и соединения-лиганда. Примеры лиганда включают (1S, 2S)-(+)-N,N-диметилциклогексан-1,2-диамин, (1R, 2R)-(-)-N,N-диметилциклогексан-1,2-диамин, (1S, 2S)-(+)-1,2-циклогександиамин, (1R, 2R)-(-)-1,2-циклогександиамин, 1,10-фенантролин, 2,9-диметил-1,10-фенантролин, 4,7-диметил-1,10-фенантролин, 3,4,7,8-тетраметил-1,10-фенантролин, 2,2,6,6-тетраметил-3,5-гептандион, 2-ацетилциклогексанон, 2-пропионилциклогексанон, N,N-диэтилсалициламид, N-метилэтилендиамин, N,N-диметилэтилендиамин, N,N'-диметилэтилендиамин, N,N,N',N'-тетраметилэтилендиамин, 8-хинолинол, 1,1'-бинафтил-2,2'-диол, 2,2'-дигидроксибифенил, катехин, этиленгликоль, 9,10-фенантренхинон, L-(-)-пролин, D-(+)-пролин, глицин и т.п. Предпочтительно иодид меди(I) используют с (1S, 2S)-(+)-N,N-диметилциклогексан-1,2-диамином в качестве лиганда. Медный катализатор используют в количестве от 1/1000 до 1 эквивалента по сравнению с соединениями формулы (2A). Это количество может составлять от 1/500 до 1/2 эквивалентов и предпочтительно от 1/100 до 1/5 эквивалентов. Примеры основания включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, карбонат цезия, фторид цезия, фторид калия, фосфат калия, ацетат калия и т.п. Предпочтительно основание представляет собой фосфат калия или карбонат цезия. Основание может быть использовано в количестве от 1/20 до 20 эквивалентов по сравнению с соединениями формулы (2A). Это количество может составлять от 1/10 до 10 эквивалентов и предпочтительно от 1/2 до 5 эквивалентов. Примеры растворителя, который может быть использован для данной реакции, включают N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, толуол, ксилол, мезитилен, 1,4-диоксан, тетрагидрофуран или диметилсульфоксид. Предпочтительно растворителем является N,N-диметилацетамид или мезитилен. Кроме того, эти растворители могут быть использованы в виде смеси, включая два или большее число из вышеприведенных растворителей. Более того, эти растворители могут быть смешаны с водой и затем использованы. В общем, реакция может осуществляться в диапазоне температур от 20°C до 250°C. Предпочтительно реакцию проводят в диапазоне температур от 80°C до 200°C. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 4 часов до 72 часов, предпочтительно в диапазоне от 8 до 48 часов.
Из числа соединений, представленных формулой (2A), соединения, в которых A1a представляет собой алкиленовую группу, которая может быть замещенной, можно получить взаимодействием соединений, представленных формулой (3A) [в формуле (3A), R1a, R2a, R3a, R4a, R5a, R6a, R7a, Cya, Ga, X и Y такие, как определены выше], с соединениями, представленными формулой (4A) [в формуле (4A), A1a, Ga и L1 такие, как определены выше], в присутствии основания. Для реакции соединений, представленных формулой (3A), и соединений, представленных формулой (4A), соединения, представленные формулой (4A), могут быть использованы в количестве от 1/5 до 20 эквивалентов по сравнению с соединениями, представленными формулой (3A). Это количество может также составлять от 1/2 до 10 эквивалентов и предпочтительно составляет от 1 до 5 эквивалентов. Однако в зависимости от чистоты, выхода и эффективности очистки соединений, представленных формулой (2A), это количество может быть надлежащим образом подобрано. Примеры основания включают гидрид натрия, гидрид калия, этоксид натрия, трет-бутоксид калия, карбонат натрия, карбонат калия и т.п. Предпочтительно основание представляет собой гидрид натрия. Основание может быть использовано в количестве от одного эквивалента до его избыточного количества в отношении соединений формулы (3A) в качестве взаимодействующего продукта. Это количество может составлять от 1 до 10 эквивалентов и предпочтительно составляет от 1 до 5 эквивалентов. Примеры растворителя, который может быть использован для реакции, включают N,N-диметилформамид, N,N-диметилацетамид, ксилол, толуол, 1,4-диоксан, тетрагидрофуран и т.п. Предпочтительным растворителем является N,N-диметилформамид или N,N-диметилацетамид. Далее, эти растворители могут быть использованы в виде смеси, содержащей два или большее число из перечисленных выше растворителей. В общем, реакцию можно проводить в диапазоне температур от -40°C до 100°C. Предпочтительно реакцию проводят в диапазоне температур от -20°C до 60°C. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 0,5 часа до 48 часов, предпочтительно в диапазоне от 1 до 24 часов.
Из числа соединений, представленных формулой (2A), соединения, в которых R4a представляет собой алкоксигруппу, которая может быть замещенной, или алоксигруппу, которая замещена заместителем, имеющим по меньшей мере одну защитную группу, можно получить взаимодействием, при необходимости в присутствии основания, соединений, представленных формулой (2A), в которой R4a представляет собой гидроксигруппу, с алкилирующим агентом, имеющим алкильную группу, которая может быть замещенной, или алкильную группу, которая замещена заместителем, содержащим по меньшей мере одну защитную группу. Примеры алкилирующего агента включают галогенид алкильной группы, которая может быть замещенной, или галогенид алкильной группы, которая может быть замещена заместителем, содержащим, по меньшей мере, одну защитную группу, и т.д. Конкретные примеры алкилирующего агента включают алкилиодид, алкилбромид, алкилхлорид и т.п. Кроме того, также используют алкилирующий агент, который содержит удаляемые группы, отличные от галогена, такие как мезилат или тозилат, трифлат. Алкилирующий агент может быть использован в количестве от одного эквивалента до его избыточного количества по сравнению с соединениями формулы (2A). Это количество может составлять от 1 до 10 эквивалентов и предпочтительно составляет от 1 до 5 эквивалентов. Если это необходимо, то для реакции может быть использовано основание. Можно использовать любое из органических или неорганических оснований. Примеры основания включают гидрид натрия, гидрид калия, гидроксид натрия, гидроксид калия, карбонат калия, карбонат натрия, триэтиламин, диизопропилэтиламин, N-метилморфолин, пиридин и т.п. Основание может быть использовано в эквивалентном количестве или избыточном количестве по сравнению с соединениями формулы (2A). Это количество может составлять от 1 до 10 эквивалентов и предпочтительно составляет от 1 до 30 эквивалентов. Что касается растворителя, который используют для реакции, то может быть использован инертный растворитель. Примеры инертного растворителя включают дихлорметан, хлороформ, 1,2-дихлорэтан, тетрагидрофуран, 1,4-диоксан, диметоксиэтан, N,N-диметилформамид, N,N-диметилацетамид и т.п. Предпочтительно, растворитель представляет собой тетрагидрофуран или N,N-диметилформамид. Кроме того, эти растворители могут быть использованы в виде смеси, содержащей два или большее число из них. В общем, реакция может быть осуществлена в диапазоне температур от -20°C до 100°C. Предпочтительно, реакцию проводят в диапазоне температур от -10°C до 50°C. Время реакции особенно не ограничено. В общем, время проведения реакции находится в диапазоне от 0,2 часа до 24 часов, предпочтительно в диапазоне от 1 до 5 часов. Далее, согласно другому варианту, из числа соединений, представленных формулой (2A), соединения, в которых R4a представляет собой гидроксигруппу, могут быть подвергнуты взаимодействию с алкиловым спиртом в присутствии фосфорсодержащего реагента и азосоединения в инертном растворителе (см., Chem. Lett., 539-542 (1994) или Synthesis, 1 (1981), и т.д.). Примеры инертного растворителя включают тетрагидрофуран, диоксан, толуол, дихлорметан и т.п. Предпочтительным является тетрагидрофуран или дихлорметан. Кроме того, эти растворители могут быть использованы в виде смеси, содержащей два или большее число из них. Примеры фосфорсодержащего реагента включают трифенилфосфин, трибутилфосфин и т.п. Примеры азосоединения включают диэтилазодикарбоксилат, диизопропилазодикарбоксилат, N,N,N',N'-тетраметилазодикарбонамид и т.п.
Из числа соединений, представленных формулой (2A), соединения, в которых R4a формулы (2A) представляет собой атом хлора, атом брома или атом йода, можно получить взаимодействием соединений, представленных формулой (2A), в которой R4a представляет собой аминогруппу, с солями и сложным эфиром азотистой кислоты с последующей реакцией с галогенидом металла или молекулой галогена. Эту реакцию осуществляют известным способом. Предпочтительный пример включает способ, когда соединения, в которых R4a формулы (2A) представляет собой аминогруппу, подвергают взаимодействию со сложным эфиром азотистой кислоты в органическом растворителе с последующей реакцией с галогенидом металла для галогенирования. Примеры эфира азотистой кислоты включают трет-бутиловый эфир азотистой кислоты или изоамиловый эфир азотистой кислоты и т.п. Эфир азотистой кислоты может быть использован в количестве от 1/5 до 20 эквивалентов по сравнению с соединениями формулы (2A), в которых R4a представляет собой аминогруппу. Предпочтительно количество используемого вышеуказанного сложного эфира составляет от 1/2 до 10 эквивалентов и более предпочтительно от 1 до 5 эквивалентов. В тех случаях, когда используют галогенид металла, его выбор предпочтительно зависит от типа атома галогена, представленного R4a в соединениях формулы (2A). В частности, когда R4a представляет собой атом хлора, то предпочтительно используют хлорид меди или хлорид калия. Если R4a представляет собой атом брома, то предпочтительно используют бромид меди или бромид калия. Если R4a представляет собой атом йода, то предпочтительно используют иодид меди или иодид калия. Галогенид металла может быть использован в количестве от 1/5 до 50 эквивалентов по сравнению с соединениями формулы (2A), в которых R4a представляет собой аминогруппу. Предпочтительно количество используемого галогенида металла составляет от 1/2 до 20 эквивалентов и более предпочтительно от 1 до 10 эквивалентов. Что касается растворителя, который используют в данной реакции, то может быть использован 1,4-диоксан, тетрагидрофуран или ацетонитрил. Предпочтительным растворителем является ацетонитрил. Кроме того, эти растворители могут быть использованы в виде смеси, содержащей два или большее число из них. В общем, реакцию можно проводить в диапазоне температур от 0°C до температуры кипения растворителя. Предпочтительно, реакцию проводят в диапазоне температур от 20°C до 80°C. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 0,5 часа до 24 часов, предпочтительно в диапазоне от 1 до 12 часов. Далее, согласно другому варианту, существует другой предпочтительный способ, в котором соль азотистой кислоты подвергают взаимодействию в водном растворе кислоты с последующей реакцией галогенидом металла для галогенирования. Примеры водного раствора кислоты включают водные растворы серной кислоты, хлористоводородной кислоты, бромистоводородной кислоты и т.п. Примеры солей азотистой кислоты включают нитрит натрия и т.п. Когда используют галогенид металла, то может быть использован галогенид металла, который содержит атом галогена, включенный в R4a желательной формулы (2A).
Кроме того, из числа соединений формулы (2A) соединения, в которых R4a формулы (2A) представляет собой -CF3, могут быть получены по способу, описанному в обычной химической литературе, например, способом, описанным на страницах 292-300 Organo Fluorine Chemistry (Kenji Uneyama, published by B1ackwell), или способом, описанным в ссылках, цитированных в литературе. В качестве подходящего примера соединения, в которых R4a формулы (2A) представляет собой -CF3, можно получить путем взаимодействия соединения формулы (2A), в которой R4a представляет собой атом хлора, атом брома или атом йода, с реагентом для трифторметилирования в присутствии катализатора в инертном растворителе. В качестве инертного растворителя можно упомянуть апротонный растворитель, такой как N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид или N-метилпирролидон. Предпочтительным является N-метилпирролидон. В качестве реагента для трифторметилирования может быть упомянут трифторметилиодид, трифторацетат натрия, метил 2,2-дифтор-2-(фторсульфонил)ацетат, трифторметил-триметилсилан, трифторметил-триэтилсилан или метил хлордифторацетат-фторид калия и т.п. Предпочтительным является метил 2,2-дифтор-2-(фторсульфонил)ацетат. В качестве катализатора может быть упомянут комплекс меди, соль меди, такая как иодид меди или бромид меди и т.д., или медный порошок. Предпочтительным является иодид меди.
Реагент для трифторметилирования может быть использован в 1-10-кратном количестве, по молям, предпочтительно 1-5-кратном количестве, по молям, относительно соединения формулы (2A), в которой R4a представляет собой атом хлора, атом брома или атом йода. Катализатор используют в 0,001-10-кратном количестве, по молям, предпочтительно 0,1-5-кратном количестве, по молям, относительно соединения формулы (2A), в которой R4a представляет собой атом хлора, атом брома или атом йода. Температура реакции находится в диапазоне от 0°C до температуры образования флегмы, при нагревании. Предпочтительно температура реакции находится в диапазоне от 60°C до температуры образования флегмы, при нагревании. Время реакции составляет от 0,1 до 48 часов и предпочтительно от 1 до 24 часов.
Кроме того, из числа соединений, представленных формулой (2A), соединения, в которых R4a в формуле (2A) представляет собой -N(RP1)(RP2) (RP1 и RP2 могут быть одинаковыми или отличными друг от друга, и каждый независимо представляет собой атом водорода, алкильную группу, которая может быть замещенной, или арильную группу, которая может быть замещенной, или RPl и RP2 вместе образуют 3-7-членный цикл, который представляет собой циклический амин N(RP1)(RP2).), можно получить, подвергая соединения, представленные формулой (2A), в которой R4a представляет собой аминогруппу, реакции гидроаминирования для связывания с альдегидом или кетоном. Что касается гидроаминирования, то можно сослаться на способ, описанный в литературе, т.е. "Reductive Amination Reaction" in Lectures on Experimental Science, edited by The Chemical Society of Japan, Vol. 20, page 300, 1992, published by Maruzen, или способ, описанный в ссылках, цитированных в литературе. Подходящий альдегид или кетон используют в количестве от 1/5 эквивалента до 20 эквивалентов, предпочтительно от 1/2 до 10 эквивалентов, относительно соединений формулы (2), в которой R3a и/или R4a представляет собой -N(RQ1)(RQ2) (RQ1 и RQ2 такие, как определены выше, или могут быть защищены заместителем, содержащим по меньшей мере одну защитную группу, при условии, что по меньшей мере одна группа из RQ1 и RQ2 представляет собой атом водорода.). Более предпочтительно вышеуказанный альдегид или кетон используют в количестве от 1 до 5 эквивалентов. В качестве восстановителя может быть упомянут металлгидридный восстановитель, такой как натрийборгидрид, натрийцианоборгидрид, натрийборгидридтриацетат, комплекс боран-диметилсульфид, комплекс боран-пиридин, комплекс боран-триэтиламин, комплекс боран-тетрагидрофуран, литийтриэтилбор и т.п. Предпочтительно можно указать на натрийцианоборгидрид или натрийборгидридтриацетат. Восстановитель используют в количестве по меньшей мере 1/10 эквивалента, предпочтительно от 1 до 20 эквивалентов, относительно соединений формулы (2A), в которой R4a представляет собой аминогруппу. В качестве кислоты, подлежащей добавлению, можно упомянуть уксусную кислоту и трифторуксусную кислоту. Предпочтительна уксусная кислота. Кислоту используют в количестве от 1/10 эквивалента до 20 эквивалентов, предпочтительно от 1/5 до 10 эквивалентов, относительно соединений формулы (2A), в которой R4a представляет собой аминогруппу. Примеры растворителя включают метанол, этанол, изопропанол, тетрагидрофуран, 1,2-диметоксиэтан, 1,4-диоксан, дихлорметан, хлороформ, 1,2-дихлорэтан, N,N-диметилформамид и т.п. Предпочтительно растворитель представляет собой метанол, тетрагидрофуран или дихлорметан. Температура реакции составляет по меньшей мере 0°C. Предпочтительно температура реакции находится в диапазоне от 10°C до температуры кипения растворителя. Время реакции составляет по меньшей мере 0,1 часа и предпочтительно в диапазоне от 0,5 до 30 часов.
Соединения, представленные формулой (3A), можно получить путем взаимодействия соединений, представленных формулой (5A) [в формуле (5A) R1a, R2a, R3a, R4a, R5a, R6a, R7a, Cya, X и Y такие, как определены выше.], с гидразином. Реакция может быть осуществлена по способу, описанному в литературе (например, J. Heterocycl. Chem., 18, 803-805 (1981)). Гидразин может быть либо гидратом гидразина, либо безводным гидразином. Предпочтительно гидразин представляет собой гидрат гидразина. Гидразин может быть использован в количестве от 1/5 до 20 эквивалентов по сравнению с соединениями, представленными формулой (5A). Он может быть также использован в количестве от 1/2 до 10 эквивалентов и предпочтительно в количестве от 1 до 5 эквивалентов. Однако в зависимости от чистоты, выхода и степени очистки и т.д. соединений, представленных формулой (3A), это количество может быть надлежащим образом подобрано. Что касается растворителя, который используют для данной реакции, то можно использовать метанол, этанол, изопропиловый спирт, 2-метил-2-пропанол, N,N-диметилформамид, толуол, 1,4-диоксан, тетрагидрофуран или уксусную кислоту. Предпочтительно растворителем является этанол, изопропиловый спирт или уксусная кислота. Далее, эти растворители могут использоваться в виде смеси, содержащей два или большее число из них. В общем, реакцию можно осуществлять при подходящей температуре в диапазоне от 0°C до температуры кипения растворителя. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 0,2 часа до 24 часов, предпочттельно в диапазоне от 0,5 до 12 часов.
Что касается соединения формулы (4A), в которой A1a представляет собой простую связь, то можно использовать коммерчески доступный этиловый эфир 2-бромтиазол-4-карбоновой кислоты (производимый компанией Combi-Block), метиловый эфир 2-бромтиазол-4-карбоновой кислоты (производимый Combi-Block), этиловый эфир 2-бромтиофенкарбоновой кислоты (производимый Alfa Aesar Co.), метиловый эфир 6-бром-2-пиридинкарбоновой кислоты (производимый Aldrich Company), метиловый эфир 5-бром-2-пиридинкарбоновой кислоты (производимый Combi-Block) и т.п. Альтернативно соединение, в котором L1 представляет собой аминогруппу, подвергают взаимодействию с эфиром азотистой кислоты в органическом растворителе согласно известному способу (см., J. Org. Chem., 61, 4623-4633 (1996) или Tetrahedron: Asymmetry, 9, 1395-1408 (1998)) с последующей реакцией с галогенидом металла, и затем полученное соединение может быть использовано.
Из числа соединений, представленных формулой (4A) соединения, в которой A1a представляет собой простую связь, L1 представляет собой аминогруппу и R9a представляет собой алкильную группу, которая может быть замещенной, можно получить взаимодействием соединений, представленных формулой (4A), в которой A1a представляет собой простую связь, L1 представляет собой аминогруппу и R9a представляет собой атом брома или атом йода, с коммерчески доступным оловосодержащим реагентом, который представлен формулой (8A): (R9a)4Sn [в формуле (8A) R9a представляет собой алкильную группу, которая может быть замещенной], используя коммерчески доступный палладиевый катализатор или катализатор, который получают из комплекса палладия и лиганда. Среди соединений, представленных формулой (4A), в тех случаях, когда соединения, в которых A1a представляет собой простую связь, L1 представляет собой аминогруппу и R9a представляет собой атом брома или атом йода, подвергают взаимодействию с соединениями, представленными формулой (8A), соединения формулы (8A) можно использовать в количестве от 1/5 до 20 эквивалентов по сравнению с соединениями, представленными формулой (4A), в которой A1a представляет собой простую связь, L1 представляет собой аминогруппу и R9a представляет собой атом брома или атом йода. Предпочтительно количество соединения формулы (8A) составляет от 1/2 до 10 эквивалентов и более предпочтительно от 1 до 5 эквивалентов. Однако, в зависимости от чистоты, выхода и эффективности очистки и т.д. соединений, представленных формулой (4A), в которой A1a представляет собой простую связь, L1 представляет собой аминогруппу и R9a представляет собой алкильную группу, которая может быть замещенной, это количество может быть подобрано надлежащим образом. Что касается палладиевого катализатора, то в реакционную систему может быть непосредственно добавлен коммерчески доступный катализатор, такой как трис(дибензилиденацетон)дипалладий, дибензилиденацетонпалладий, тетракистрифенилфосфинпалладий или ацетат палладия, либо можно использовать катализатор, который получают путем смешения ацетата палладия или дибензилиденацетонпалладия с лигандом. Примеры лиганда включают трифенилфосфин, три-трет-бутилфосфин, трициклогексилфосфин или 2-(ди-трет-бутилфосфино)бифенил и т.п. Предпочтительно используют тетракистрифенилфосфинпалладий без его смешения с лигандом. Катализатор предпочтительно используют в количестве от 1/1000 до 1 эквивалента по сравнению с соединениями, представленными формулой (4A), в которой A1a представляет собой простую связь, L1 представляет собой аминогруппу и R9a представляет собой атом брома или атом йода. Предпочтительно катализатор может быть использован в количестве от 1/100 до 1/2 эквивалента и более предпочтительно от 1/100 до 1/5 эквивалента. Примеры растворителя, который может быть использован для реакции, включают N,N-диметилформамид, N,N-диметилацетамид, ксилол, толуол, 1,4-диоксан, тетрагидрофуран, этанол или метанол, и предпочтительным является N,N-диметилформамид или 1,4-диоксан. Более того, эти растворители могут быть использованы в виде смеси, содержащей два или большее число из них. В общем, реакцию можно проводить при подходящей температуре в диапазоне температур от 0°C до 150°C. Предпочтительно температура реакции находится в диапазоне от 40°C до 120°C. Время реакции особенно не ограничено. В общем, время реакции лежит в диапазоне от 1 часа до 72 часов, предпочтительно в диапазоне от 2 до 24 часов.
Что касается соединения формулы (4A), в котором A1a представляет собой простую связь, L1 представляет собой аминогруппу и R9a представляет собой атом брома или атом йода, то можно использовать коммерчески доступный метиловый эфир 2-амино-5-бромтиазол-4-карбоновой кислоты (производимый компанией Combi-Block) или метиловый эфир 6-амино-3-бром-2-пиколиновой кислоты (производимый компанией Combi-Block) и т.п.
Что касаеся соединений формулы (4A), в которой A1a представляет собой метиленовую группу, которая может быть замещенной, то можно использовать соединение, полученное известным способом, например, Liebigs. Ann. Chem., 4, 623-632 (1981) и т.д.
Из числа соединений, представленных формулой (4A), соединения формулы (4AA), в которой A1a представляет собой этениленовую группу [в формуле (4AA) Ga такой, как определен выше, L1 представляет собой атом хлора, атом брома или атом йода, и стереохимия, связанная с наличием двойной связи в этениленовой группе, которая представлена A1, может быть представлена любым из цис- и транс-изомеров.], можно получить ретросинтетическим путем согласно нижеследующей реакции, например.
[Химическая формула 8]
Соединения, представленные формулой (4AA), можно получить взаимодействием соединений, представленных формулой (9AA) [в формуле (9AA) Ga такой, как определен выше], с разновидностью гидрида металла с последующей реакцией с соответствующим источником атома галогена. Типы разновидности галогенида металла включают, например, комплекс боран-тетрагидрофуран, 9-борабицикло[3.3.1]нонан, комплекс дибромборан-диметилсульфид, катехинборан, диизобутилалюминий, трибутилолово, бис(циклопентадиенил)цирконий(IV)хлоридгидрид и т.п. Разновидность галогенида металла может быть использована в количестве от 1/5 до 20 эквивалентов по сравнению с соединениями, представленными формулой (9AA). Количество галогенида металла может составлять от 1/2 до 10 эквивалентов и предпочтительно от 1 до 5 эквивалентов. Что касается источника атома галогена, используемого для реакции, то можно использовать молекулу галогена или N-галогенированный сукцинимид, который включает атом галогена, представляемый L1 в желательной формуле (4AA). В частности, в тех случаях, когда L1 представляет собой атом хлора, предпочтительно используют N-хлорсукцинимид. В тех случаях, когда L1 представляет собой атом брома, предпочтительно используют молекулу брома или N-бромсукцинимид. В тех же случаях, когда L1 представляет собой атом йода, предпочтительно используют молекулу йода или N-йодсукцинимид. Источник атома галогена может использоваться в количестве от 1/5 до 20 эквивалентов по сравнению с соединениями, представленными формулой (9AA). Это количество может составлять, например, от 1/2 до 10 эквивалентов и предпочтительно от 1 до 5 эквивалентов. Примеры растворителя, который может быть использован для реакции, включают N,N-диметилформамид, толуол, 1,4-диоксан, тетрагидрофуран и т.п., и предпочтительным является тетрагидрофуран. Более того, эти растворители могут использоваться в виде смеси, содержащей два или большее число из них. В общем, реакцию можно проводить при подходящей температуре, лежащей в диапазоне от -60°C до 60°C. Предпочтительно температура реакции лежит в диапазоне от -20°C до 40°C. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 0,2 часа до 24 часов, предпочтительно в диапазоне от 0,5 до 12 часов.
Соединения, представленные формулой (9AA), можно получить из соединений, представленных формулой (10AA) [в формуле (10AA) Ga такой, как определен выше] в известных условиях для защиты силильной групппы. Например, можно упомянуть реакцию, в которой используют тетрабутиламмонийфторид в растворимом в воде эфирном растворителе, таком как тетрагидрофуран. Тетрабутиламмонийфторид может быть использован в количестве от 1/2 до 20 эквивалентов по сравнению с соединениями, представленными формулой (10AA), и предпочтительно это количество составляет от 1 до 10 эквивалентов. Примеры растворителя, который может быть использован для данной реакции, включают N,N-диметилформамид, толуол, 1,4-диоксан, тетрагидрофуран, дихлорметан, хлороформ и т.п., и предпочтительным является тетрагидрофуран или дихлорметан. Более того, эти растворители могут быть использованы в виде смеси, содержащей два или большее число из них. В общем, реакция может быть осуществлена при подходящей температуре в диапазоне от -20°C до 100°C. Предпочтительно температура реакции находится в диапазоне от 0°C до 60°C. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 0,2 часа до 24 часов, предпочтительно в диапазоне от 0,5 до 12 часов.
Соединения, представленные формулой (10AA), можно получить взаимодействием соединений, представленных формулой (4AB) [в формуле (4AB) Ga и L1 такие, как определены выше], т.е. соединений, представленных формулой (4A), в которой A1a представляет собой простую связь, с триметилсилилацетиленом, используя коммерчески доступный палладиевый катализатор или катализатор, который получают из палладиевого комплекса и лиганда, в присутствии основания. Для реакции между соединениями, представленными формулой (10AA), и триметилсилилацетиленом, триметилсилилацетилен может быть использован в количестве от 1/2 до 10 эквивалентов по сравнению с соединениями, представленными формулой (4AB), и предпочтительно это количество составляет от 1 до 5 эквивалентов. Что касается палладиевого катализатора, то в реакционную систему может быть непосредственно добавлен коммерчески доступный катализатор, такой как трис(дибензилиденацетон)дипалладий, дибензилиденацетонпалладий, тетракистрифенилфосфинпалладий, дихлорбис(трифенилфосфин)палладий, ацетат палладия, хлорид палладия и т.п., или можно использовать катализатор, который получают путем смешения ацетата палладия, дибензилиденацетонпалладия или дихлорбис(трифенилфосфин)палладия с любым лигандом. Примеры лиганда включают трифенилфосфин, три-трет-бутилфосфин, трициклогексилфосфин или 2-(ди-трет-бутилфосфино)бифенил и т.п. Предпочтительно используют дихлорбис(трифенилфосфин)палладия с трифенилфосфином в качестве лиганда. Палладиевый катализатор предпочтительно используют в количестве от 1/1000 до 1 эквивалента по сравнению с соединениями, представленными формулой (4AB). Палладиевый катализатор может быть использован в количестве от 1/100 до 1/2 эквивалента и более предпочтительно от 1/100 до 1/5 эквивалента. Примеры основания включают триэтиламин, диэтиламин, диизопропиламин, ацетат натрия, гидроксид натрия, гидроксид лития, фторид калия, карбонат калия, карбонат цезия, фторид цезия, трет-бутоксид натрия и т.п. Предпочтительно, основание представляет собой триэтиламин или диэтиламин. Основание может быть использовано в количестве от 1/10 до 10 эквивалентов по сравнению с соединениями формулы (4AB). Предпочтительно, количество основания составляет от 1/5 до 5 эквивалентов. Растворители, которые используют для данной реакции, включают N,N-диметилформамид, N,N-диметилацетамид, ксилол, толуол, 1,4-диоксан, тетрагидрофуран, этанол, метанол и т.п. Предпочтительно растворитель представляет собой N,N-диметилформамид или 1,4-диоксан. Более того, эти растворители могут быть использованы в виде смеси, содержащей два или большее число из них. В общем, реакцию можно проводить при подходящей температуре в диапазоне от 0°C до 150°C. Предпочтительно температура реакции находится в диапазоне от 40°C до 120°C. Время реакции особенно не ограничено, В общем, время реакции находится в диапазоне от 1 часа до 72 часов, предпочтительно в диапазоне от 2 до 24 часов.
Что касается соединений, представленных формулой (5A), то можно использовать коммерчески доступный 1,3-дифенил-1,3-пропандион (производимый компанией Aldrich) или 1-(2-гидроксифенил)-3-фенил-1,3-пропандион (производимый компанией Aldrich) и т.д., или продукт, полученный реакцией между соединениями формулы (6A-1) [в формуле (6A-1) R1a, R2a, R3a и R4a такие, как определены выше] и соединениями формулы (7A-1) [в формуле (7A-1) R5a, R6a, R7a, Cya, X и Y такие, как определены выше, и Z1 представляет собой атом фтора, атом хлора, атом брома или алкоксигруппу] в присутствии основания согласно известному способу (Tetrahedron Lett., 43, 2945-2948(2002)), или продукт, полученный реакцией между соединениями формулы (6A-2) [в формуле (6A-2) R1a, R2a и R3a такие, как определены выше, и Z2 представляет собой атом фтора, атом хлора, атом брома или алкоксигруппу] и соединениями формулы (7A-2) [в формуле (7A-2) R4a, R5a, R6a, R7a, Cya, X и Y такие, как определены выше] в присутствии основания. Что касается реакции между соединениями формулы (6A-1) и соединениями формулы (7A-1), то соединения формулы (7A-1) могут быть использованы в количестве от 1/5 до 20 эквивалентов по сравнению с соединениями формулы (6A-1). Это количество также может составлять от 1/2 до 10 эквивалентов и предпочтительно составляет от 1 до 5 эквивалентов. Однако в зависимости от чистоты, выхода и степени очистки и т.д. соединений, представленных формулой (5A), количество соединения формулы (7A-1) может быть подобрано надлежащим образом. Что касается основания, которое используют для данной реакции, то можно использовать гидрид натрия, гидрид калия, этоксид натрия, трет-бутоксид калия или гексаметилдисилазан лития и т.п. Предпочтительным основанием является гексаметилдисилазан лития. Основание может быть использовано в количестве от одного эквивалента до его избыточного количества по сравнению с соединениями формулы (6A-1). Это количество может составлять от 1 до 10 эквивалентов и предпочтительно составляет от 1 до 5 эквивалентов. Что касается растворителя, который используют для данной реакции, то его примеры включают N,N-диметилформамид, N,N-диметилацетамид, ксилол, толуол, 1,4-диоксан, тетрагидрофуран и т.п. Кроме того, эти растворители могут быть использованы в виде смеси, содержащей два или большее число из них. В общем, реакцию можно проводить при подходящей температуре в диапазоне от -40°C до 80°C. Предпочтительно температура реакции находится в диапазоне от -20°C до 40°C. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 0,5 часа до 48 часов, предпочтительно в диапазоне от 1 до 24 часов. Реакция между соединениями формулы (6A-2) и соединениями формулы (7A-2) может быть проведена, ссылаясь на реакцию между соединениями формулы (6A-1) и соединениями формулы (7A-1).
Что касается соединений, представленных формулой (6A-1), то можно использовать н-бутирофенон (производимый Wako Pure Chemical Industries, Ltd.), валерофенон (производимый Wako Pure Chemical Industries, Ltd.) и т.п.
Из числа соединений, представленных формулой (6A-1), соединения формулы (6A-1A), в которой R4a представляет собой алкильную группу, которая может быть замещенной [в формуле (6A-1A) R1a, R2a и R3a такие, как определены выше.], можно получить ретросинтетическим путем согласно нижеследующей реакции, например.
[Химическая формула 9]
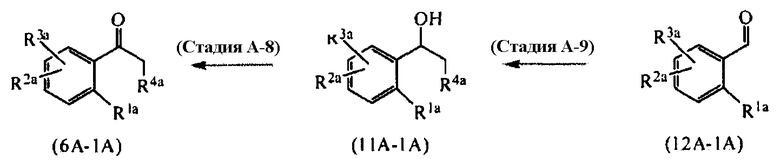
Соединения, представленные формулой (6A-1A), могут быть получены, подвергая соединения, представленные формулой (11A-1A) [в формуле (11A-1A) R1a, R2a и R3a такие, как определены выше.], реакции окисления. Что касается реакции окисления, то можно упомянуть способ с использованием реагента Десса-Мартина, окисление по Сверну или способ окисления с использованием хромовой кислоты и т.п. Данную реакцию осуществляют согласно известному способу и предпочтительно ее осуществляют согласно способу, в котором хлорхромат пиридиния в качестве соли хромовой кислоты в органическом растворителе применяют в отношении соединений, представленных формулой (11A-1A), получая соединения, представленные формулой (6A-1A). Хлорохромат пиридиния может быть использован в количестве от 1/5 до 10 эквивалентов, и предпочтительно это количество составляет от 1/2 до 3 эквивалентов по сравнению с соединениями, представленными формулой (11A-1A). Что касается растворителя, который используют для данной реакции, то его примеры включают N,N-диметилформамид, толуол, дихлорметан, хлороформ и т.п. Предпочтительным растворителепм является дихлорметан. Кроме того, эти растворители могут быть использованы в виде смеси, содержащей два или большее число из них. В общем, реакцию можно осуществлять при подходящей температуре в диапазоне от -20°C до 60°C. Предпочтительно температура реакции находится в диапазоне от 0°C до 40°C. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 1 часа 48 часов, предпочтительно в диапазоне от 2 до 24 часов.
Соединения, представленные формулой (11A-1A), могут быть получены путем взаимодействия соединений, представленных формулой (12A-1A) [в формуле (12A-1A) R1a, R2a и R3a такие, как определены выше], с коммерчески доступным реактивом Гриньяра, который представлен формулой (13A-1A): R4a-CH2MgL2 [в формуле (13A-1A) R4a такой, как определен выше, и L2 представляет собой атом хлора, атом брома или атом йода.], с последующим добавлением источника протонов для прекращения реакции. Примеры реактива Гриньяра формулы (13A-1A) включают этилмагнийбромид (производимый компанией Aldrich) или изобутилмагнийбромид (производимый компанией Aldrich) и т.п. Соединения, представленные формулой (13A-1A), могут быть использованы в количестве от 1/2 до 10 эквивалентов и предпочтительно в количестве от 1 до 5 эквивалентов по сравнению с соединениями, представленными формулой (12A-1A). Что касается растворителя, который используют для данной реакции, то его примеры включают N,N-диметилформамид, толуол, 1,4-диоксан, тетрагидрофуран, диэтиловый эфир и т.п. Предпочтительным явлется тетрагидрофуран. Более того, эти растворители могут быть использованы в виде смеси, включающей два и большее число из них. В общем, реакция может быть осуществлена при подходящей температуре в диапазоне от -80°C до 60°C. Предпочтительно температура реакции находится в диапазоне от -20°C до 40°C. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 0,2 часа до 24 часов, предпочтительно в диапазоне от 0,5 до 12 часов. В качестве источника протонов, который используют для прекращения реакции, можно использовать воду, неорганическую кислоту или органическую кислоту и т.д. Предпочтительной является вода. Источник протонов для обрыва реакции может быть использован в количестве от 1 эквивалента до его избыточного количества относительно соединений, представленных формулой (13A-1A). Температура для прекращения реакции может в большинстве случаев находиться в диапазоне от -80°C до 60°C.
Что касается соединений, представленных формулой (12A-1A), то можно использовать коммерчески доступный бензальдегид (производимый Tokyo Chemical Industry Co., Ltd.), п-метоксибензальдегид (производимый Wako Pure Chemical Industries, Ltd.) и т.п.
Что касается соединений, представленных формулой (7A-1), то можно использовать коммерчески доступный бензоилхлорид (производимый Tokyo Chemical Industry Co., Ltd.), п-метоксибензоилхлорид (производимый Wako Pure Chemical Industries, Ltd.) и т.п.
Что касается соединений, представленных формулой (6A-2), то можно использовать коммерчески доступный бензоилхлорид (производимый Tokyo Chemical Industry Co., Ltd.), п-метоксибензоилхлорид (производимый Wako Pure Chemical Industries, Ltd.) и т.п.
Что касается соединений, представленных формулой (7A-2), то можно использовать н-бутирофенон (производимый Wako Pure Chemical Industries, Ltd.), валерофенон (производимый Wako Pure Chemical Industries, Ltd.) и т.п.
Кроме того, что касается соединений формулы (7A-2), в которой R4a представляет собой алкильную группу, которая может быть замещенной, то можно использовать соединение, которое получают, ссылаясь на способ синтезирования соединений формулы (6A-1A), описанный выше.
Из числа соединений, представленных формулой (2), соединения формулы (2B), в которой A1a представляет собой простую связь и Ga представляет формулу (G1a) [в формуле (2B) R1a, R2a, R3a, R4a, R5a, R6a, R7a, R8a, R9a, A2a, Cya, X и Y такие, как определены выше, при условии, что R4a и R5a вместе не представляют цикл, который выбран из группы, состоящей из частично ненасыщенного углеводородного цикла, который может быть замещенным, и ненасыщенного углеводородного цикла, который может быть замещенным, или цикл, в котором один из составляющих цикл атомов углерода в цикле замещен атомом кислорода, атомом серы или атомом азота], можно получить, следуя ретросинтетическому пути согласно нижеследующей реакции, например.
[Химическая формула 10]
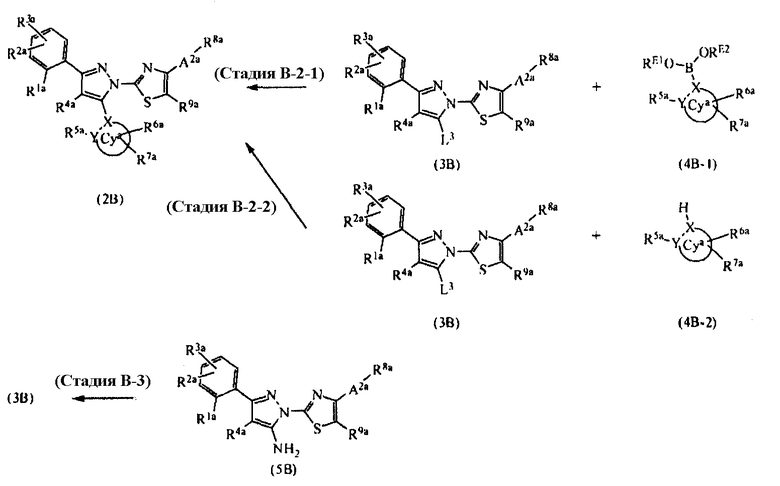
Из числа соединений, представленных формулой (2B), соединения, в которых X представляет собой атом углерода, можно получить взаимодействием соединений, представленных формулой (3B) [в формуле (3B) R1a, R2a, R3a, R4a, R8a, R9a и A2a такие, как определены выше, и L3 представляет собой атом хлора, атом брома или атом йода], с соединениями, представленными формулой (4B-1) [в формуле (4B-1) R5a, R6a, R7a, Cya и Y такие, как определены выше, и RE1 и RE2 могут быть одинаковыми или отличными друг от друга и каждый независимо представляет собой атом водорода или низшую алкильную группу, или RE1 и RE2 вместе образуют 5-6-членную циклическую структуру эфира бороновой кислоты B(ORE1)(ORE2)], используя коммерчески доступный палладиевый катализатор или катализатор, который получают из палладиевого комплекса и лиганда, в присутствии основания. Для реакции между соединениями, представленными формулой (3B) и соединениями, представленными формулой (4B-1), соединения, представленные формулой (4B-1), могут быть использованы в количестве от 1/5 до 20 эквивалентов по сравнению с соединениями, представленными формулой (3B), и предпочтительно их количество составляет от 1/2 до 10 эквивалентов и более предпочтительно от 1 до 5 эквивалентов. Однако в зависимости от чистоты, выхода и степени очистки и т.д. соединений, представленных формулой (2B), это количество можно подобрать надлежащим образом. Что касается палладиевого катализатора, то в реакционную систему может быть непосредственно добавлен коммерчески доступный катализатор, такой как трис(дибензилиденацетон)дипалладий, дибензилиденацетонпалладий, тетракистрифенилфосфинпалладий, дихлорбис(трифенилфосфин)палладий, ацетат палладия, хлорид палладия и т.п., или может быть использован катализатор, который получают путем смешения ацетата палладия или дибензилиденацетонпалладия с лигандом. Примеры лиганда включают трифенилфосфин, три-о-толилфосфин, три-трет-бутилфосфин, трициклогексилфосфин или 2-(ди-трет-бутилфосфино)бифенил и т.п. Предпочтительно используют дибензилиденацетонпалладий с три-о-толилфосфином в качестве лиганда или используют тетракистрифенилфосфинпалладий без какого-либо лиганда. Палладиевый катализатор предпочтительно используют в количестве от 1/1000 до 1 эквивалента по сравнению с соединениями, представленными формулой (3В). Указанный катализатор может быть использован в количестве от 1/100 до 1/2 эквивалента и более предпочтительно в количестве от 1/100 до 1/5 эквивалента. Примеры основания включают карбонат натрия, карбонат калия, карбонат цезия, фторид цезия, фторид калия, фосфат калия, ацетат калия и т.п. Предпочтительно основание представляет собой карбонат натрия или карбонат калия. Основание может быть использовано в количестве от 1/10 до 10 эквивалентов по сравнению с соединениями формулы (3B). Предпочтительно количество основания составляет от 1/5 до 5 эквивалентов. Примеры растворителя, который может быть использован для данной реакции, включают N,N-диметилформамид, N,N-диметилацетамид, ксилол, толуол, 1,4-диоксан, тетрагидрофуран, этанол, метанол и т.п. Предпочтительно растворителем является N,N-диметилформамид или 1,4-диоксан. Более того, эти растворители могут быть использованы в виде смеси, включающей два или большее число из них. Еще дальше, эти растворители могут быть смешаны с водой и затем использованы. В общем, реакцию можно проводить в диапазоне температур от 0°C до 150°C. Предпочтительно температура реакции находится в диапазоне от 40°C до 120°C. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 1 часа до 72 часов, предпочтительно в диапазоне от 2 до 24 часов.
Среди соединений, представленных формулой (2B), соединения, в которых X представляет собой атом азота, можно получить взаимодействием соединений, представленных формулой (3B) [в формуле (3B) R1a, R2a, R3a, R4a, R8a, R9a и A2a такие, как определены выше, и L3 представляет собой атом хлора, атом брома или атом йода], с соединениями, представленными формулой (4B-2) [в формуле (4B-2) R5a, R6a, R7a, Cya и Y такие, как определены выше], используя коммерчески доступный катализатор меди или катализатор, который получают из медного порошка или медной соли с соединением-лигандом, в присутствии основания. Для реакции соединений, представленных формулой (3B), и соединений, представленных формулой (4B-2), соединения, представленные формулой (4B-2), могут быть использованы в количестве от 1/5 до 20 эквивалентов по сравнению с соединениями, представленными формулой (3B). Это количество может также составлять от 1/2 до 10 эквивалентов, и предпочтительно составляет от 1 до 5 эквивалентов. Однако в зависимости от чистоты, выхода и степени очистки и т.д. соединений, представленных формулой (2B), это количество может быть подобрано надлежащим образом. В качестве медного катализатора в реакционную среду может быть непосредственно добавлен коммерчески доступный катализатор, такой как бис(ацетилацетонат)медь(II) и т.п., или может быть использован катализатор, полученный смешением порошка меди, хлорида меди(I), бромида меди(I), иодида меди(I), цианида меди(I), оксида меди(I), хлорида меди(II), бромида меди(II), ацетата меди(II), сульфата меди(II) или оксида меди(II) и лиганда. Примеры лиганда включают (1S, 2S)-(+)-N,N-диметилциклогексан-1,2-диамин, (1R, 2R)-(-)-N,N-диметилциклогексан-1,2-диамин, (1S, 2S)-(+)-1,2-циклогександиамин, (1R, 2R)-(-)-1,2-циклогександиамин, 1,10-фенантролин, 2,9-диметил-1,10-фенантролин, 4,7-диметил-1,10-фенантролин, 3,4,7,8-тетраметил-1,10-фенантролин, 2,2,6,6-тетраметил-3,5-гептандион, 2-ацетилциклогексанон, 2-пропионилциклогексанон, N,N-диэтилсалициламид, N-метилэтилендиамин, N,N-диметилэтилендиамин, N,N'-диметилэтилендиамин, N,N,N',N'-тетраметилэтилендиамин, 8-хинолинол, 1,1'-бинафтил-2,2'-диол, 2,2'-дигидроксибифенил, катехин, этиленгликоль, 9,10-фенантренхинон, L-(-)-пролин, D-(+)-пролин, глицин и т.п. Предпочтительно используют иодид меди(I) с 2-ацетилциклогексаноном в качестве лиганда. Медный катализатор используют в количестве от 1/1000 до 1 эквивалента по сравнению с соединениями формулы (3B). Количество катализатора может составлять от 1/100 до 1/2 эквивалента и предпочтительно от 1/100 до 1/5 эквивалента. Примеры основания включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, карбонат цезия, фторид цезия, фторид калия, фосфат калия, ацетат калия и т.п. Предпочтительно основание представляет собой фосфат калия или карбонат цезия. Основание может быть использовано в количестве от 1/20 до 20 эквивалентов по сравнению с соединениями формулы (3B). Количество основания может составлять от 1/10 до 10 эквивалентов и предпочтительно от 1/2 до 5 эквивалентов. Примеры растворителя, который может быть использован для данной реакции, включают N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, толуол, ксилол, мезитилен, 1,4-диоксан, тетрагидрфуран или диметилсульфоксид и т.п. Предпочтительно растворителем является N,N-диметилацетамид или мезитилен. Более того, эти растворители могут быть использованы в виде смеси, включающей два или большее число из них. Еще дальше, эти растворители можно смешать с водой и затем эту смесь использовать. В общем, реакцию можно проводить в диапазоне температур от 20°C до 250°C. Предпочтительно, температура реакции находится в диапазоне от 60°C до 200°C. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 4 часов до 72 часов, предпочтительно в диапазоне от 8 до 48 часов.
Соединения, представленные формулой (3B), можно получить взаимодействием соединений, представленных формулой (5B) [в формуле (5B) R1a, R2a, R3a, R4a, R8a, R9a и A2a такие, как определены выше], с солями и эфиром азотистой кислоты с последующей реакцией с соединением галогенида металла или молекулой галогена. Эту реакцию осуществляют согласно известному способу. Предпочтительный пример включает способ, в котором соединения формулы (5B) подвергают взаимодействию с эфиром азотистой кислоты в органическом растворителе с последующей реакцией с галогенидом металла для галогенирования. Примеры эфира азотистой кислоты включают трет-бутиловый эфир азотистой кислоты или изоамиловый эфир азотистой кислоты и т.п. Эфир азотистой кислоты может быть использован в количестве от 1/5 до 20 эквивалентов по сравнению с соединениями формулы (5B). Предпочтительно это количество составляет от 1/2 до 10 эквивалентов и более предпочтительно от 1 до 5 эквивалентов. В тех случаях, когда используют молекулу галогена, молекулу галогенида предпочтительно выбирают в зависимости от того, каким является атом галогена, представляющий L3 в соединениях формулы (3B). В частности, если L3 представляет собой атом брома, то предпочтительно используют молекулу брома. Если L3 представляет собой атом йода, то предпочтительно используют молекулу йода. Молекулу галогенида можно использовать в количестве от 1/5 до 50 эквивалентов в сравнении с соединениями формулы (5B). Предпочтительно это количество составляет от 1/2 до 20 эквивалентов, и более предпочтительно от 1 до 10 эквивалентов. Что касается растворителя, который используют для данной реакции, то можно использовать 1,4-диоксан, тетрагидрофуран или ацетонитрил. Предпочтительным растворителем является ацетонитрил. Кроме того, эти растворители могут быть использованы в виде смеси, содержащей два или большее число из них. В общем, реакция может быть осуществлена в диапазоне температур от 0°C до 200°C. Предпочтительно температура реакции находится в диапазоне от 20°C до 100°C. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 0,5 часа до 24 часов, предпочтительно в диапазоне от 1 до 12 часов. Кроме того, согласно другому варианту, существует предпочтительный способ, в котором соль азотистой кислоты подвергают взаимодействию в водном растворе кислоты с последующей реакцией с галогенидом металла для галогенирования. Примеры водного раствора кислоты включают водные растворы серной кислоты, хлористоводородной кислоты, бромистоводородной кислоты и т.п. Примеры солей азотистой кислоты включают нитрит натрия и т.п. Когда используют галогенид металла, то можно использовать галогениды металла, включающие атом галогена, который аналогичен атому галогена, включенному в L3 желательной формулы (3B). В частности, если L3 представляет собой атом брома, то предпочтительно используют бромид меди или бромид калия. Если L3 представляет собой атом йода, то предпочтительно используют иодид меди или иодид калия.
Что касается соединений, представленных формулой (4B-1), то можно использовать коммерчески доступную бензолбороновую кислоту (производмую Tokyo Chemical Industry Co., Ltd.), тиофен-2-бороновую кислоту (производимую Aldrich Company), тиофен-3-бороновую кислоту (производимую Aldrich Company) или 3-пиридинбороновую кислоту (производимую Wako Pure Chemical Industries, Ltd.) и т.п. Кроме того, можно использовать соединение, которое получают согласно известному способу (см., Chem. Rev., 95, 2457-2483 (1995) или J. Organomet. Chem., 576, 147-168 (1999), и т.д.).
Что касается соединений, представленных формулой (4B-2), то могут быть использованы коммерчески доступный пирролидин (производимый Tokyo Chemical Industry Co., Ltd.), пиперидин (производимый Tokyo Chemical Industry Co., Ltd.), морфолин (производимый Tokyo Chemical Industry Co., Ltd.), 1-метилпиперазин (производимый Tokyo Chemical Industry Co., Ltd.), пиррол (производимый Tokyo Chemical Industry Co., Ltd.), имидазол (производимый Tokyo Chemical Industry Co., Ltd.), или пиразол (производимый Tokyo Chemical Industry Co., Ltd.) и т.д.
Из числа соединений, представленных формулой (5B), соединения формулы (5BA), в которых A2a представляет собой простую связь, R4a представляет собой алкильную группу, которая может быть замещенной, и R8a представляет собой -COORE3 [в формуле (5BA) R1a, R2a, R3a и R9a такие, как определены выше, и RE3 представляет собой алкильную группу, которая может быть замещенной], можно получить ретросинтетическим путем согласно нижеследующей реакции, например.
[Химическая формула 11]
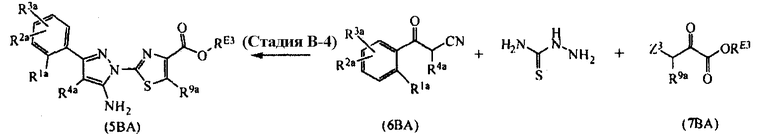
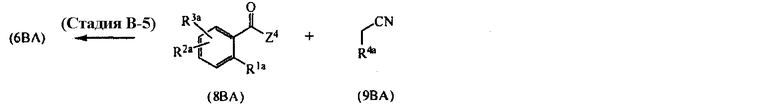
Соединения, представленные формулой (5BA), можно получить взаимодействием соединений, представленных формулой (6BA) [в формуле (6BA) R1a, R2a, R3a и R4a такие, как определены выше], с тиосемикарбазидом с последующей реакцией с соединениями, представленными формулой (7BA) [в формуле (7BA) R9a и RE3 такие, как определены выше, и Z3 представляет собой атом хлора, атом брома или атом йода]. Тиосемикарбазид может быть использован в количестве от 1/10 до 10 эквивалентов по сравнению с соединениями формулы (6BA). Предпочтительно количество тиосемикарбазида составляет от 1/5 до 5 эквивалентов и более предпочтительно от 1/2 до 2 эквивалентов. Соединения, представленные формулой (7BA), могут быть использованы в количестве от 1/10 до 10 эквивалентов по сравнению с соединениями формулы (6BA). Предпочтительно это количество составляет от 1/5 до 5 эквивалентов и более предпочтительно от 1 до 3 эквивалентов. Однако в зависимости от чистоты, выхода и степени очистки и т.д. соединений, представленных формулой (5BA), это количество можно подобрать надлежащим образом. Что касается растворителя, который используют для данной реакции, то могут быть использованы метанол, этанол, изопропиловый спирт, 2-метил-2-пропанол, N,N-диметилформамид, толуол, 1,4-диоксан или тетрагидрофуран. Предпочтительно растворителем является этанол или изопропиловый спирт. Более того, эти растворители могут быть использованы в виде смеси, включающей два или большее число из них. В общем, реакцию можно проводить в диапазоне температур от 0°C до 150°C. Предпочтительно температура реакции находится в диапазоне от 40°C до 120°C. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 0,5 часа до 48 часов, предпочтительно в диапазоне от 2 до 12 часов.
Соединения, представленные формулой (6BA), могут быть получены взаимодействием соединений, представленных формулой (8BA) [в формуле (8BA) R1a, R2a и R3a такие, как определены выше, и Z4 представляет собой атом фтора, атом хлора, атом брома или алкоксигруппу], с соединениями, представленными формулой (9BA) [в формуле (9BA), R4a такой, как определен выше.], в присутствии основания. В случае реакции между соединениями, представленными формулой (8BA), и соединениями, представленными формулой (9BA), соединения, представленные формулой (9BA), могут быть использованы в количестве от 1/10 до 10 эквивалентов по сравнению с соединениями, представленными формулой (8BA). Предпочтительно количество вышеуказанных соединений составляет от 1/5 до 5 эквивалентов и более предпочтительно от 1/2 до 2 эквивалентов. Однако в зависимости от чистоты, выхода, степени очистки и т.д. соединений, представленных (6BA), это количество может быть подобрано надлежащим образом. Примеры основания включают гидрид натрия, этоксид натрия, карбонат натрия, карбонат калия и т.п. Предпочтительно основание представляет собой этоксид натрия. Основание может быть использовано в количестве от одного эквивалента до его избыточного количества по сравнению с соединениями, представленными формулой (8BA). Количество основания может составлять 1-10 эквивалентов, и предпочтительно оно составляет от 1 до 5 эквивалентов. Примеры растворителя, который может быть использован для данной реакции, включают N,N-диметилформамид, N,N-диметилацетамид, ксилол, толуол, 1,4-диоксан, тетрагидрофуран и т.п. Тетрагидрофуран является предпочтительным. Более того, эти растворители могут быть использованы в виде смеси, включающей два или большее число из них. В общем, реакция может быть осуществлена в диапазоне температур от 0°C до 150°C. Предпочтительно температура реакции лежит в диапазоне от 40°C до 120°C. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 1 часа до 48 часов, предпочтительно в диапазоне от 2 до 24 часов.
Что касается соединений, представленных формулой (7BA), то можно использовать коммерчески доступный этиловый эфир бромпировиноградной кислоты, производимый Wako Pure Chemical Industries, Ltd.), или метиловый эфир бромпировиноградной кислоты (производимый Fluka) и т.п. Кроме того, может быть использовано соединение, которое получают согласно известному способу (J. Org. Chem., 67, 1102-1108 (2002), и т.д.).
Что касается соединений, представленных формулой (8BA), то можно использовать коммерчески доступный этиловый эфир бензойной кислоты (производимый Wako Pure Chemical Industries, Ltd.), этиловый эфир п-анисовой кислоты (производимый Wako Pure Chemical Industries, Ltd.), этиловый эфир п-толуиловой кислоты (производимый Wako Pure Chemical Industries, Ltd.), этиловый эфир о-толуиловой кислоты (производимый Tokyo Chemical Industry Co., Ltd.), этиловый эфир п-хлорбензойной кислоты (производимый Tokyo Chemical Industry Co., Ltd.), п-метоксибензоилхлорид (производимый Tokyo Chemical Industry Co., Ltd.) и т.п.
Что касается соединений, представленных формулой (9BA), то можно использовать коммерчески доступный пропионитрил (производимый Wako Pure Chemical Industries, Ltd.), н-бутиронитрил (производимый Wako Pure Chemical Industries, Ltd.) и т.п. Кроме того, может быть использовано соединение, которое получают согласно известному способу (см., J. Org. Chem., 25, 877-879 (1960) или J. Org. Chem., 39, 3416-3418 (1974) и т.д.).
Из числа соединений, представленных формулой (2), соединения формулы (2C), в которой A1a представляет собой простую связь, Ga представляет собой формулу (G1a) A2a представляет собой простую связь, R8a представляет собой -COORE3, Cya представляет собой арильную группу и R4a представляет собой аминогруппу [в формуле (2C) R1a, R2a, R3a, R5a, R6a, R7a, R9a, RE3, Cya, X и Y такие, как определены выше], можно получить ретросинтетическим путем согласно нижеследующей реакции, например.
[Химическая формула 12]
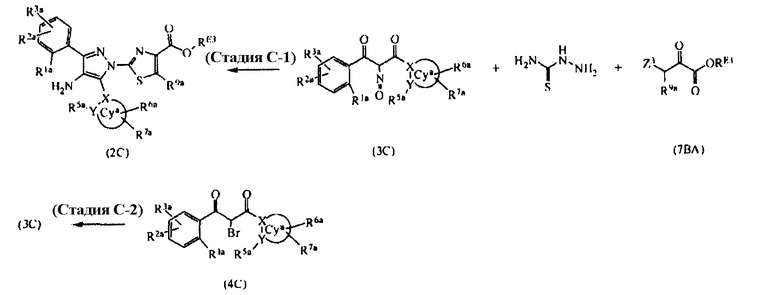
Соединения, представленные формулой (2C), можно получить взаимодействием соединений, представленных формулой (3C) [в формуле (3C) R1a, R2a, R3a, R5a, R6a, R7a, Cya, X и Y такие, как определены выше], с тиосемикарбазидом с последующей реакцией с соединениями, представленными формулой (7BA) [в формуле (7BA) R9a и RE3 или Z3 такие, как определены выше]. Получение соединений формулы (7BA) может быть осуществлено, ссылаясь на способ синтезирования соединений формулы (5BA), детально опианный выше.
Соединения, представленные формулой (3C), можно получить взаимодействием соединений, представленных формулой (4C) [в формуле (4C) R1a, R2a, R3a, R5a, R6a, R7a, Cya, X и Y такие, как определены выше], одновременно с солью азотистой кислоты и мочевиной. Примеры соли азотистой кислоты включают нитрит натрия и т.п. Соль азотистой кислоты может быть использована в количестве от 1/5 до 20 эквивалентов по сравнению с соединениями формулы (4C). Предпочтительно количество соли азотистой кислоты составляет от 1/2 до 10 эквивалентов и более предпочтительно от 1 до 5 эквивалентов. Мочевину можно использовать в количестве от 1/5 до 50 эквивалентов по сравнению с соединениями формулы (4C). Предпочтительно это количество составляет от 1/2 до 20 эквивалентов и более предпочтительно от 2 до 10 эквивалентов. Что касается растворителя, который используют для данной реакции, то можно использовать метанол, этанол, изопропиловый спирт, 2-метил-2-пропанол, N,N-диметилформамид, диметилсульфоксид, толуол, 1,4-диоксан или тетрагидрофуран. Предпочтительно, растворителем является диметилсульфоксид. Кроме того, эти растворители могут быть использованы в виде смеси, включающей два или большее число из них. В общем, реакция может быть осуществлена в диапазоне температур от -20°C до 100°C. Предпочтительно температура реакции находится в диапазоне от 0°C до 40°C. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 0,5 часа до 48 часов, предпочтительно в диапазоне от 2 до 24 часов.
Что касается соединений, представленных формулой (4C), то можно использовать соединение, которое получают согласно известному способу (см., J. Org. Chem., 71, 8961-8963 (2006) и т.п.).
Среди соединений, представленных формулой (2), соединения формулы (2DA), в которой A1a представляет собой этиленовую группу и R8a представляет собой -COORE4 [в формуле (2DA) R1a, R2a, R3a, R4a, R5a, R6a, R7a, R9a, Cya, X и Y такие, как определены выше, и RE4 представляет собой алкильную группу], можно получить, следуя ретросинтетическому пути согласно нижеследующей реакции, например.
[Химическая формула 13]
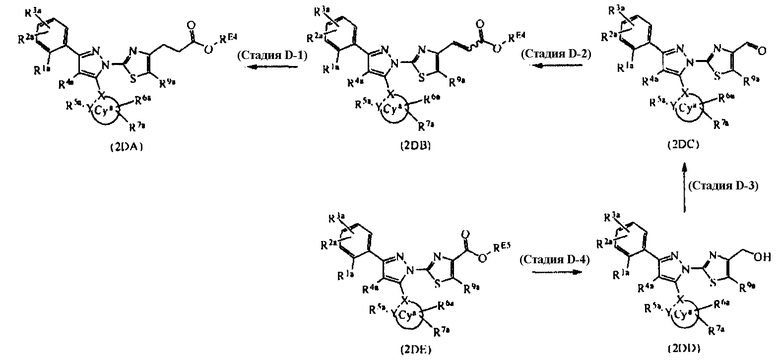
Из числа соединений, представленных формулой (2DA), соединения формулы (2), в которой A1a представляет собой простую связь, Ga представляет собой формулу (G1a), A2a представляет собой этениленовую группу и R8a представляет собой -COORE4 [в формуле (2DB) R1a, R2a, R3a, R4a, R5a, R6a, R7a, R9a, RE4, Cya, X и Y такие, как определены выше, и стереохимия, имеющая отношение к двойной связи этениленовой группы A2a, может быть любой из цис- и транс-конфигураций], можно получить, подвергая соединения, представленные формулой (2DA), реакции восстановления. Что касается реакции восстановления, то можно упомянуть восстановление, основанное на контакте с водородом. Восстановление, основанное на контакте с водородом, может быть осуществлено, используя катализатор, в растворителе в атмосфере водорода. Примеры катализатора включают палладий-на-углероде, оксид платины, платина-углерод или гидроксид палладия и т.п. Примеры растворителя, который может быть использован для данной реакции, включают этилацетат, диэтиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, метанол, этанол и т.п. Предпочтительно растворитель представляет собой тетрагидрофуран или метанол. Более того, эти растворители могут быть использованы в виде смеси, содержащей два или большее число из них. В общем, реакция может быть осуществлена в диапазоне температур от -20°C до 100°C. Предпочтительно температура реакции находится в диапазоне от 0°C до 50°C. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 1 часа до 96 часов, предпочтительно в диапазоне от 3 до 48 часов.
Соединения, представленные формулой (2DB), можно получить взаимодействием соединений, представленных формулой (2DC), в которой A1a представляет собой простую связь, Ga представляет собой формулу (G1a), A2a представляет собой простую связь и R8a представляет собой формильную группу [в формуле (2DC) R1a, R2a, R3a, R4a, R5a, R6a, R7a, R9a, Cya, X и Y такие, как определены выше], с коммерчески доступным диалкилфосфоноацетатом в присутствии основания. Примеры диалкилфосфоноацетата включают диэтиловый эфир этилфосфоновой кислоты, бис(2,2,2-трифторэтил)(метоксикарбонилметил)фосфоновой кислоты и т.п. Диалкилфосфоноацетат может быть использован в количестве от 1/5 до 10 эквивалентов по сравнению с соединениями, представленными формулой (2DC). Количество диалкилфосфоноацетата составляет предпочтительно от 1/2 до 3 эквивалентов. Примеры основания включают гидроксид натрия, гидроксид калия, карбонат калия, гидрид натрия, калий-трет-бутоксид, гексаметилдисилазан калия и т.п. Предпочтительно основание представляет собой гидрид натрия или гексаметилдисилазан калия. Основание может быть использовано в количестве от 1/2 до 20 эквивалентов по сравнению с соединениями формулы (2DC) в качестве взаимодействующего вещества. Предпочтительно количество основания составляет от 1/2 до 5 эквивалентов. Что касается растворителя, который используют для данной реакции, то можно упомянуть N,N-диметилформамид, N,N-диметилацетамид, толуол, 1,4-диоксан или тетрагидрофуран. Предпочтительным растворителем является 1,4-диоксан или тетрагидрофуран. Более того, эти растворители могут быть использованы в виде смеси, включающей два или большее число из них. В общем, реакция может проводиться в диапазоне температур от -20°C до 100°C. Предпочтительно температура реакции находится в диапазоне от 0°C до 40°C. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 1 часа до 24 часов, предпочтительно в диапазоне от 2 до 12 часов.
Соединения, представленные формулой (2DC), можно получить, подвергая соединения, представленные формулой (2DD) [в формуле (2DD) R1a, R2a, R3a, R4a, R5a, R6a, R7a, R9a, Cya, X и Y такие, как определены выше], т.е. соединения формулы (2), в которых A1a представляет собой простую связь, Ga представляет собой формулу (G1a), A2a представляет собой простую связь и R8a представляет собой гидроксиметильную группу, реакции окисления. Что касается реакции окисления, то можно упомянуть способ, использующий периодинан Десса-Мартина, окисление по Swern или способ окисления, использующий хромовую кислоту, и т.п. Данную реакцию осуществляют согласно известному способу, и предпочтительно ее проводят согласно способу, в котором соединения, представленные формулой (2DD), подвергают взаимодействию с периодинаном Десса-Мартина в органическом растворителе, получая соединения, представленные формулой (2DC). Периодинан Десса-Мартина можно использовать в количестве от 1/5 до 10 эквивалентов по сравнению с соединениями формулы (2DD). Количество этого реагента может составлять от 1/5 до 10 эквивалентов и предпочтительно от 1/2 до 3 эквивалентов. Что касается растворителя, который используют для данной реакции, то можно использовать N,N-диметилформамид, толуол, дихлорметан и хлороформ и т.п. Предпочтительно растворитель представляет собой дихлорметан. Более того, эти растворители могут быть использованы в виде смеси, включающей два или большее число из них. В общем, реакцию можно проводить в диапазоне температур от -20°C до 60°C. Предпочтительно температура реакции находится в диапазоне от 0°C до 40°C. Время реакции особенно не ограничено. В общем, время реакции находится в диапазоне от 1 часа до 48 часов, предпочтительно в диапазоне от 2 до 24 часов.
Соединения, представленные формулой (2DD), можно получить взаимодействием соединений формулы (2DE) [в формуле (2DE) R1a, R2a, R3a, R4a, R5a, R6a, R7a, R9a, Cya, X и Y такие, как определены выше, и RE5 представляет собой алкильную группу], т.е. соединений, представленных формулой (2), в которой A1a представляет собой простую связь, Ga представляет собой формулу (G1a), A2a представляет собой простую связь и R8a представляет собой -COORE5, с коммерчески доступным соединением гидрида металла. Типы соединения гидрида металла включают, например, литийалюминийгидрид, комплекс боран-тетрагидрофуран и т.п. Предпочтительно используют литийалюминийгидрид. Соединение гидрида металла может быть использовано в количестве от 1/4 до 5 эквивалентов по сравнению с соединениями формулы (2DE). Это количество может предпочтительно составлять от 1/2 до 3 эквивалентов. Что касается растворителя, который используют для данной реакции, то можно использовать диэтиловый эфир, тетрагидрофуран, 1,4-диоксан и т.п. Предпочтительно растворитель представляет собой тетрагидрофуран. Более того, эти растворители могут быть использованы в виде смеси, включающей два или большее число из них. В общем, реакцию можно осуществлять в диапазоне температур от -20°C до 80°C. Предпочтительно температура реакции находится в диапазоне от 0°C до 60°C. Время реакции особенно не ограничено. В общем, время реакции лежит в диапазоне от 1 часа до 48 часов, предпочтительно в диапазоне от 2 до 24 часов.
Из вышеприведенных соединений, представленных формулой (1), можно получить соли. Способ получения солей особенно не ограничен. Например, в качестве способа получения аддитивной соли кислоты соединения, представленные формулой (1), растворяют в спиртах, таких как метанол и этанол, и к полученному раствору добавляют от одного до нескольких эквивалентов кислотного компонента, получая в результате этого кислотно-аддитивные соли. Что касается кислотного компонента, то можно использовать любой кислотный компонент, который соответствует кислотно-аддитивным солям, описанным ниже. Примеры кислотного компонента включают фармацевтически приемлемую минеральную или органическую кислоту, такую как хлористоводородная кислота, бромистоводородная кислота, серная кислота, гидросерная кислота, дигидрофосфат, гидрофосфат, лимонная кислота, малеиновая кислота, винная кислота, фумаровая кислота, глюконовая кислота, метансульфокислота и т.п. Кроме того, что касается способа получения основно-аддитивной соли, то он может быть осуществлен таким же образом, как и вышеописанный способ получения кислотно-аддитивной соли, за исключением того, что вместо кислотного компонента используют компонент основания. Что касается основного компонента, то можно использовать любой основный компонент, который соответствует основно-аддитивным солям, описанным ниже. Примеры основного компонента включают фармацевтически приемлемое основание, такое как гидроксид натрия, гидроксид калия, N-метил-D-глюкамин, N,N'-дибензилэтилендиамин, 2-аминоэтанол, трис(гидроксиметил)аминометан, аргинин, лизин и т.п.
Согласно данному изобретению под термином "соединения, представленные формулой (1)" понимают соединения, имеющие формулу (1), находящиеся в свободной форме. Далее, что касается их солей, то могут быть упомянуты соли, описанные ниже.
Что касается солей соединений по данному изобретению, то их тип особенно не ограничен. Это может быть любая из кислотно-аддитивных солей и основно-аддитивных солей. Кроме того, она может присутствовать в форме противоиона в молекуле. В частности, при использовании в качестве эффективного компонента фармацевтического средства, особенно предпочтительны фармацевтически приемлемые соли. Согласно данному описанию при описании в связи с использованием в качестве фармацевтического средства, под солями соединений по данному изобретению обычно подразумевают фармацевтически приемлемые соли. Примеры кислотно-аддитивной соли включают соль хлористоводородной кислоты, соль бромистоводородной кислоты, соль серной кислоты, соль гидросерной кислоты, соль дигидрофосфорной кислоты, соль лимонной кислоты, соль малеиновой кислоты, соль винной кислоты, соль фумаровой кислоты, соль глюконовой кислоты, соль метансульфокислоты или аддитивную соль с оптически активной кислотой, такой как камфорсульфоновая кислота, миндальная кислота или замещенная миндальная кислота. Примеры основно-аддитивной соли включают соль металла, такую как натриевая соль, калиевая соль и т.п., и аддитивную соль с органическим основанием, таким как N-метил-D-глюкамин, N,N'-дибензилэтилендиамин, 2-аминоэтанол, трис(гидроксиметил)аминометан, аргинин или лизин и т.д. Однако типы солей не ограничиваются вышеперечисленными, и совершенно очевидно, что специалист в данной области может выбрать их надлежащим образом. Среди них фармацевтически приемлемая соль является предпочтительной.
Соединения по данному изобретению могут находиться в безводной форме. Кроме того, гидраты соединений по данному изобретению также являются предпочтительными.
Далее, предпочтительными являются сольваты соединений по данному изобретению, а также соединения по данному изобретению, находящиеся в несольватированной форме.
Кроме того, соединения по данному изобретению могут быть либо кристаллическими, либо некристаллическими. Кристаллы могут быть в виде монокристалла или смеси, включающей множественные типы кристаллической формы. Более того, соединение по данному изобретению может находиться в виде смеси, включающей как кристаллическую форму, так и аморфную форму.
Более конретно, предпочтительные примеры включают безводную и несольватированную форму “соединений, представленных формулой (1)", или гидрат и/или сольват их, или их кристаллы.
Еще дальше, приемлемыми также являются безводная и несольватированная форма "солей соединений, представленных формулой (1)" или гидрат и/или сольват их, и также безводная и несольватированная форма солей или гидрат и/или сольват солей.
Когда необходимо получить пролекарство из соединений по данному изобретению, то в соответствии с общим способом группу, которая может образовать пролекарство, вводят соответствующим образом в по меньшей мере одну группу, выбранную из гидроксигруппы и аминогруппы, содержащуюся в соединениях по данному изобретению, используя реагент для получения пролекарства, например, соответствующее галогенидсодержащее соединение, и т.д., и далее пролекарство может быть соответствующим образом получено, используя обычный способ разделения и очистки. Кроме того, реагент для получения пролекарства, подобный спирту или амину, может быть использован для введения группы, которая может соответственно образовать пролекарство с карбоксигруппой соединений по данному изобретению. Еще дальше, для получения пролекарства, во время процесса получения может быть использована защитная группа, присутствующая на соединениях формулы (2).
Пролекарства соединений по данному изобретению особенно не ограничены, и примеры их включают соединение, в котором функциональная группа, которая может образовать пролекарство, введена в по меньшей мере одну группу, выбранную из гидроксигруппы, аминогруппы и карбоксигруппы, содержащуюся в соединениях по данному изобретению. Что касается функциональной группы, которая может образовать пролекарство с гидроксигруппой или аминогруппой, то примером ее может служить ацильная группа и алкоксикарбонильная группа. Предпочтительные примеры функциональной группы включают ацетильную группу, пропионильную группу, метоксикарбонильную группу, этоксикарбонильную группу и т.п. Более предпочтительной является этоксикарбонильная группа. Кроме того, существует другой вариант, в котором более предпочтительной является ацетильная группа. Помимо этого, существует другой вариант, в котором более предпочтительна пропионильная группа. Кроме того, сущестует также другой вариант, в котором метоксикарбонильная группа более предпочтительна. Что касается функциональной группы, которая может образовать пролекарство с карбоксигруппой, то примером может служить метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, аминогруппа, метиламиногруппа, этиламиногруппа, диметиламиногруппа или диэтиламиногруппа. Предпочтительные примеры такой группы включают этильную группу, н-пропильную группу, изопропильную группу и т.п. Более предпочтительной является этильная группа. Кроме того, существует другой вариант, в котором более предпочтительной является н-пропильная группа. Помимо этого, существует также другой вариант, в котором более предпочтительна изопропильная группа.
Соединения по данному изобретению могут иногда иметь асимметрический углерод. Стереоконфигурация такого асимметрического углерода особенно не ограничена и может быть любой из R-конфигурации и S-конфигурации или представлять смесь, содержащую обе из указанных конфигураций. Любые стереоизомеры, включая оптические изомеры в чистой форме или диастереомер, как следствие наличия такого асимметрического углерода, любая смесь стереоизомеров, рацемат и т.п., все вышеперечисленные, входят в объем данного изобретения.
Соединения по данному изобретению обладают сильным ингибирующим действием в отношении рецептора EP1, как показано в Тест-примере 1, описанном ниже, и поэтому их используют в качестве эффективного компонента для фармацевтического средства.
Соединения по данному изобретению являются антагонистами в отношении рецептора EP1, и они могут найти применение для лечения различных заболеваний, в патологию которых вовлечен рецептор EP1. Кроме того, их используют в качестве аналгезирующего средства, жаропонижающего средства, болеутоляющего средства или средства для профилактики и/или лечения симптомов нижних мочевых путей. В частности, из числа симптомов нижних мочевых путей, соединения по данному изобретению оказываются эффективными для нарушения, связанного с накоплением мочи в мочевом пузыре, и особенно полезными в качестве средства для профилактики и/или лечения гиперактивного мочевого пузыря. Симптомы гиперактивного мочевого пузыря включают учащенное мочеиспускание, сильную потребность в мочеиспускании, сопровождающуюся опасением непроизвольного мочеотделения, и недержание мочи. В качестве предпочтительного примера может служить сильная потребность в мочеиспускании, сопровождающаяся опасением непроизвольного мочеотделения. Кроме того, существует другой вариант, в котором предпочтительным примером является учащенное мочеиспускание или недержание мочи. Что касается недержания мочи, то в качестве предпочтительного примера можно упомянуть неудержание мочи (непроизвольное мочеотделение). Соединения по данному изобретению являются также эффективными и для этих симптомов.
Было известно, что PGE2 продуцируется в гладкой мышце мочевого музыря или эндотелии мочевых путей (Brown, WW. et al., Am. J. Physiol., 239, p. F452-F458 (1980), Mitchell JA & Warner TD, Br. J. Pharmacol., 128, p. 1121-1132 (1999)). Было известно также, что PGE2 может индуцировать сокращение изолированного фрагмента мочевого пузыря человека (Palea, S., et al., Br. J. Pharmacol. 124 (1998) 865-872) или может регулировать мочеиспускательный рефлекс, воздействуя на капсаицин-чувствительный сенсорный нерв (Maggi, CA., Pharmacol. Res. 25, p.13-20 (1992)). Более того, было показано, что PGE2 вовлечен в патологию происхождения гиперактивного мочевого пузыря, поскольку было получено потвержение того, что вливание PGE2 в мочевой пузырь вызывает снижение давления замыкания сфинктера уретры, сокращение мочевого пузыря и ощущение сильного позыва к мочеиспусканию (Schussler, B. Urol. Res., 18, p349-352 (1990)).
Между тем уже известно, что антагонист EP1 может увеличить емкость мочевого пузыря у обычной крысы (Maggi, CA., et al., Eur. J. Pharmacol. 152, p. 273-279 (1988)), может ингибировать гиперактивность детрузора (Yoshida M. et al., J. Urol. 163, suppl. 44, abstract 191, (2000) и может ингибировать активность афферентного нерва во время воспаления мочевого пузыря (Ikeda M., et al., Biomed Res. 27, p. 49-54, (2006)). Также имеются сообщения о том, что нормальное мочеиспускание не страдает, пока интервал между актами мочеиспускания не сокращается в результате внутрипузырного введения PGE2 или закупорки нижних мочевых путей у мыши с направленно пораженным рецептором EP1 (Schroder, A., et al., J. Urol., 172, p. 1166-1170 (2004)). Ожидается, что соединения по данному изобретению будут обладать действием, направленным на улучшение аномального мочеиспускания в патологическом состоянии и будут полезными для улучшения симптомов, проявляющихся в нижних мочевых путях, и других симптомов, включая гиперактивность мочевого пузыря или учащенное мочеиспускание, сильную потребность в мочеиспускании, сопровождающуюся опасением непроизвольного мочеотделения (т.е. неудержанием); недержание мочи и т.п.
Применимость соединений по данному изобретению в качестве эффективного компонента фармацевтического средства для улучшения симптомов, включая учащенное мочеиспускание, сильную потребность в мочеиспускании, сопровождающуюся опасением непроизвольного мочеотделения, недержание мочи и т.п., и профилактики и/или лечения симптомов в нижних мочевых путях может быть подтвержена способом, описанным в любом из нижеприведенных Тест-примера 4, Тест-примера 5, Тест-примера 6, Тест-примера 7, Тест-примера 8 или Тест-примера 9 или их комбинацией.
Известно, что мышь с направленно пораженным рецептором EP1 обладает меньшей чувствительностью к боли (индуцированная ацетатом активность в растяжении снижается; Stock, JL., et al., J. Clin. Invest. 107, p. 325-331 (2000)), и антагонист EP1 является эффективным в модели CCI у крысы (Kawahara, H., et al., Anesth Analg., 93, p1012-1017 (2001)), имея аналгетическую активность в модели полного адъюванта Фрейнда у крысы (Giblin, GMP. et al., Bioorg. Med. Chem. Lett. 17, p. 385-389 (2007)) и аналгетическую активность в модели постоперационной боли у крысы (Omote, K. et al., Anesth Analg. 92, p. 233-238 (2001)). Кроме того, уже известно, что антагонист EP1 используют для облегчения боли и/или нейрогенной алгезичной (algesic) боли. Применимость соединений по данному изобретению в качестве эффективного компонента фармацевтического средства для облегчения боли может быть проверена способом, который включает введение мыши предлагаемых соединений пероральным, внутривенным или интраперитонеальным путем и обследование числа растяжений после интраперитонеального введения уксусной кислоты (т.е. метод введения уксусной кислоты с возрастающей концентрацией). Альтернативно, кожу и фасцию срезают с области пятки до верхушки лапы задней конечности крысы, затем кожу и фасцию сшивают вместе и животное помещают в клетку для восстановления с последующим введением соединения пероральным, внутривенным или интраперитонеальным путем и подтверждением порогового значения для различных типов стимуляции. Альтернативно, крысе, которой в подошву ее левой задней лапы сначала был введен раствор (адъювант), содержащий инактивированные туберкулезные бактерии (M. TUBERCULOSIS DES. H37 RA, DIFCO Laboratories), вводят перорально, внутривенно или интраперитонеально заявляемые соединения и после этого получают пороговое значение для проявления животным поведения, связанного с уходом от опасности, используя устройство по типу фон Фрейя для измерения боли. Еще один альтернативный вариант, крысе с удаленным седалищным нервом вводят перорально, внутривенно или интраперитонеально заявляемые соединения, и затем можно проанализировать пороговые значения для различных видов стимуляции, и, следовательно, таким путем, может быть подтверждена применимость соединений для нейрогенной боли.
Имеются сообщения о том, что антагонист EP1 является эффективным для почечной недостаточности у крысы, страдающей диабетом, который индуцирован стрептозоцином (STZ) (Makino, H., et al., J. Am, Soc, Nephrol. 13, 1757-1765 (2002)), почечного нарушения функции почек у SHRSP крысы, что представляет собой модель спонтанной гипертензии у крысы (Suganami, T., et al., Hypertension 42, 1183-1190 (2003)) и также для улучшения симптомов почечной недостаточности. Пригодность соединений по данному изобретению в качестве эффективного компонента для фармацевтического средства для профилактики и/или лечения нарушения функции почек может быть подтверждена, анализируя количество белка, содержащегося в моче, или исследуя гистологические изменения в почке и т.д. после перорального, внутривенного или интраперитонеального введения соединений SHRSP крысе или STZ крысе.
Имеются сообщения о том, что антагонист EP1 является эффективным в модели рака кожи у мыши (Tober, KL., et al., J. Invest. Dermatol., 126, p205-211 (2006), модели рака ободочной кишки у крысы (Kawamori, T., et al., Anticancer Res., 21, p3865-3869 (2001), Niho, N., et al., Cancer Sci., 96, p260-264 (2005)), модели рака легкого у крысы (Kawamori, T., et al., Carcinogenesis, 22, p2001-2004 (2001)) и что антагонист EP1 может ингибировать пролиферацию глиоматозных (gliomaous) клеток и рост опухолевых клеток мыши (Matsuo, M., et al., J. Neurooncol., 66, 285-292 (2004)). Кроме того, известно, что антагонист EP1, возможно, может быть использован в области лечения рака. Применимость соединений по данному изобретению в качестве эффективного компонента фармацевтического средства для лечения рака кожи может быть подтверждена, например, анализируя воспаление кожи или кожные опухоли, которые индуцированы УФ-облучением, после подкожного введения мыши соединений по данному изобретению. Более того, применимость соединений по данному изобретению в качестве эффективного компонента фармацевтического средства для лечения рака ободочной кишки может быть подтверждена, например, анализируя количество очагов аберрантной крипты в ободочной кишке и т.д., которые индуцируют азоксиметаном после перорального введения крысе соединений по данному изобретению. Еще дальше, пригодность соединений по данному изобретению в качестве эффективного компонента фармацевтического средства для лечения рака легкого может быть подтверждена, например, путем проведения гистологического анализа опухолей легкого, которые индуцируют 2-амино-1-метил-6-фенилимидазо[4,5-b]пиридином (PhIP), после перорального введения крысе соединений по данному изобретению.
Имеются сообщения о том, что антагонист EP1 является эффективным для модели закупорки средней мозговой артерии у мыши (Kawano, T., et al., Nat. Med., 12, p.225-22 (2006), Ahmad, AS. et al., Toxicol. Sci., 89, p.265-270 (2006)) и также для профилактики и/или лечения инфаркта головного мозга. Применимость соединений по данному изобретению в качестве эффективного компонента фармацевтического средства для профилактики и/или лечения инфаркта головного мозга можно подтвердить, например, путем проведения гистологического анализа головного мозга мыши (т.е. для определения процента поверхности головного мозга, пораженного некрозом), которая была подвергнута оперативному вмешательству по поводу закупорки средней мозговой артерии после перорального, внутривенного или интраперитонеального введения соединений по данному изобретению.
Имеются также сообщения о том, что антагонист EP1 является эффективным для ингибирования образования остеокласта у мыши (Inoue H., et al., J. Endocrinol., 161, p231-236 (1999), Tsujisawa, T. et al., J. Bone Miner. Res., 20, p.l5-22 (2006)) и также является полезным для улучшения симптомов костного заболевания. Применимость соединений по данному изобретению в качестве эффективного компонента фармацевтического средства для профилактики и/или лечения костного заболевания может быть подтверждена, например, путем проведения испытания на их ингибирующее действие в отношении образования остеокласта после добавления соединений по данному изобретению к культивируемым клеткам костного мозга, которые стимулируют 1,25(OH)2 витамином D3 или IL-1, и т.д. и подсчитывания числа клеток, которые являются TRAP(тартрат-резистентная кислая фосфатаза, фермент, секретируемый остеокластами)-положительными.
Исходя из обнаружения того, что антагонист EP1 является эффективным в модели повреждения слизистой оболочки желудка у крысы (Hase S. et al., Life Sci., 74, p.629-641 (2003)), стало известно, что антагонист EP1 может найти применение для пищеварительных систем. Применимость соединений по данному изобретению в качестве эффективного компонента фармацевтического средства для пищеварительных систем можно подтвердить путем введения крысе пероральным, внутривенным или интраперитонеальным путем соединений по данному изобретению и затем анализа их защитного действия в отношении повреждения слизистой оболочки желудка, вызванного введением гистамина и PGE2, наблюдая за гистологическим изменением в слизистой оболочке или определяя проницаемость мембраны, и т.д.
Фармацевтическое средство по данному изобретению может быть получено в виде фармацевтического средства, которое содержит соединения по данному изобретению в качестве эффективного компонента. Например, когда соединение, вводимое в виде пролекарства или его соли, подвергается химическому изменению при обмене веществ в живом организме с генерированием соединений формулы (1) или их фармацевтически приемлемых солей, то и такое производное соединений по данному изобретению, как пролекарство, также входит в объем фармацевтического средства по данному изобретению.
Такие производные, которые используют в качестве соединений по данному изобретению, имеют надежную безопасность (т.е. имеют благоприятную фармакологию относительно токсичности разного типа и безопасности) и фармакокинетические показатели, приемлемые для фармацевтического препарата и т.д., и применимость их в качестве эффективного компонента для фармацевтического средства подтверждается.
Примеры теста на безопасность включают нижеперечисленные, однако ими не ограничиваются. Тест на клеточную токсичность (тест, использующий клетки HL60 или клетки печени и т.д.), тест на генетическую токсичность (Ames test, тест с использованием ТК лимфомы мыши, тест на хромосомные аберрации, тест на наличие малого ядра и т.д.), тест на кожную сенсибилизацию (Buehler метод, GPMT метод, APT метод, LLNA тест и т.д.), тест на кожную фотосенсибилизацию (метод с нанесением адъюванта и полоски и т.д.), тест на безопасность воздействия медикамента относительно сердечно-сосудистой системы (телеметрический метод, APD метод, испытание по оценке торможения электроретинограммы у человека (hERG), тест на безопасность воздействия медикамента относительно центральной нервной системы (FOB метод, модифицированный метод Ирвина, и т.д.), тест на безопасность воздействия медикамента относительно органов дыхания (измерение, используя аппарат для измерения функции внешнего дыхания; измерение, используя аппаратуру для проведения анализа газов крови, и т.д.), тест на общую токсичность, тест на токсичность в отношении полового размножения и т.д.
Кроме того, что касается испытания, связанного с определением фармакокинетических показателей фармацевтического средства, то в данное описание включены нижеописанные тесты, однако они не являются ограничением. Тест на ингибирование или индуцирование, рассматриваемый в связи с ферментом - цитохром P450, тест на проницаемость клеток (т.е. тест, использующий клетки CaCO-2 или клетки MDCK, и т.д.), анализ на аденозинтрифосфатазу (ATPase) транспортера лекарственного средства, тест на пероральную абсорбирующую активность, тест на профиль-зависимость “концентрации соединения в крови - время”, тест на метаболизм (тест на стабильность, определение разновидности молекулярного метаболита, тест на реактивность и т.д.), тест на растворимость (т.е. тест на растворимость, основанный на определении мутности, и т.д.) и т.п.
Применимость производных, которые используют в качестве соединений по данному изобретению, в качестве эффективного компонента для фармацевтического средства может быть определена, исходя, например, из испытания на клеточную токсичность. Что касается теста на клеточную токсичность, то можно упомянуть метод, использующий различные культивируемые клетки, как, например, клетки HL-60 предлейкоза человека; первоначально изолированные культивируемые клетки печени, фракция нейтрофилов, полученная из периферической крови человека, и т.д. Испытание может быть осуществлено согласно способу, описанному ниже, но он не является ограничением. Клетки получают в виде взвеси, содержащей от 105 до 107 клеток/мл. Аликвотную пробу от 0,01 мл до 1 мл взвеси переносят в микропробирку или микропланшет и т.д. Затем туда добавляют раствор, содержащий растворенные в нем соединения, в количестве от 1/100 до 1, исходя из используемого количества взвеси клеток, с последующим культивированием в среде клеточной культуры, имеющей конечную концентрацию соединений в диапазоне от 0,001 мкМ до 1000 мкМ, в условиях 37°C, 5% CO2 в течение периода времени от 30 минут до нескольких дней. Сразу после завершения культивирования определяют степень жизнеспособности клеток, используя метод MTT или метод WST-1 (Ishiyama, M., et al., In Vitro Toxicology, 8, p.187, 1995), и т.д. Измеряя клеточную токсичность, проявляемую соединениями по данному изобретению, можно проанализировать их пригодность в качестве эффективного компонента фармацевтического средства.
Применимость производных, которые используют в качестве соединений по данному изобретению, в качестве эффективного компонента фармацевтического средства может быть определена, используя, например, тест на генетическую токсичность. Примеры испытания на генетическую токсичность включают Ames тест, тест с использованием TK лимфомы мыши, тест на хромосомные аберрации, тест на наличие малого ядра и т.д. Ames тест представляет собой способ определения обратной [реверсирующей] мутации при культивировании указанных клеток, таких как Сальмонелла или E. coli, на культуральном планшете (чашке), содержащем химическое соединение (см., II-l. Genetic Toxicity Test under "Guidelines for Genetic Toxicity Test", Pharmaceuticals Examination, Vol. 1604, 1999). Кроме того, тест с использованием TK лимфомы мыши представляет собой испытание, заключающееся в определении мутационного свойства гена, в котором в качестве мишени используют тимидинкиназный ген клеток L5178Y лимфомы у мыши (см., II-3. Mouse Lymphoma TK Test under "Guidelines for Genetic Toxicity Test", Pharmaceuticals Examination, Vol. 1604, 1999; Clive, D. et al., Mutat. Res., 31, pp. 17-29, 1975; Cole, J., et al., Mutat. Res., 111, pp. 371-386, 1983, etc.). Кроме того, тест на хромосомные аберрации представляет собой способ, в котором клетки, относящиеся к млекопитающему, культивируют в присутствии соединения и клетки фиксируют, и хромосому окрашивают и наблюдают с целью определения какой-либо активности, которая может вызвать хромосомные аберрации (см., II-2. Chromosome Abnormality Test Using Cultured Mammalian Cells under "Guidelines for Genetic Toxicity Test", Pharmaceuticals Examination, Vol. 1604, 1999). Далее, тест на наличие маленького ядра представляет собой способ выявления способности к образованию маленького ядра (клетки), которая вызвана хромосомными аберрациями, и этот тест включает способ, в котором используют грызунов (т.е. in vivo тест, II-4. Small Nucleus Test Using Rodents, under "Guidelines for Genetic Toxicity Test", Pharmaceuticals Examination, Vol. 1604, 1999; Hayashi, M. et al., Mutat. Res., 312, pp. 293-304, 1994; Hayashi, M. et al., Environ. Mol. Mutagen., 35, pp. 234-252, 2000), или используют культивируемые клетки (т.е. in vitro тест, Fenech, M. et al., Mutat. Res., 147, pp. 27-36, 1985; Miller, B., et al., Mutat. Res., 392, pp. 45-59, 1997), и т.д. Выполняя один, два или три теста, основанные на вышеуказанных методах, можно безусловно распознать генетическую токсичность соединений по данному изобретению и тем самым оценить возможность их применения в качестве эффективного компонента фармацевтического средства.
Пригодность производных, которые используют в качестве соединений по данному изобретению, в качестве эффективного компонента для фармацевтического средства можно оценить, например, опираясь на результаты теста на кожную сенсибилизацию. Примеры теста на кожную сенсибилизацию включают Buehler метод (Buehler, E.V. Arch. Dermatol., 91, pp. 171-177, 1965), GPMT метод (т.е. Maximization method, Magnusson, B. et al., J. Invest. Dermatol., 52, pp. 268-276, 1969), APT метод (т.е. метод с нанесением адъюванта и пятна-полоски, Sato, Y. et al., Contact Dermatitis, 7, pp. 225-237, 1981), в котором для испытания на кожную сенсибилизацию в качестве подопытного животного используют кошку - mormot. Кроме того, в качестве метода выявления кожной сенсибилизации существует LLNA метод, в котором в качестве подопытного животного используют мышь (Local Lymph Node Assay method, OECD Guideline for the testing of chemicals 429, skin sensitization 2002; Takeyoshi, M. et al., Toxicol. Lett., 119(3), pp. 203-8, 2001; Takeyoshi, M. et al., J. Appl. Toxicol., 25(2), pp. 129-34, 2005) и т.п. Выполняя один, два или большее число испытаний, опираясь на вышеизложенные методы, сенсибилизирующее действие соединений по данному изобретению на кожу может быть конкретно идентифицировано с тем, чтобы можно было оценить возможность их применения в качестве эффективного компонента фармацевтического средства.
Применимость производных, которые используют в качестве соединений по данному изобретению, в качестве эффективного компонента для фармацевтического средства может быть установлена, например, исходя из результатов испытания на кожную фотосенсибилизацию. Примеры теста на кожную фотосенсибилизацию включают испытание с использованием в качестве подопытного животного кошки - mormot (см. Guidelines for Non-clinical test of Pharmaceuticals - Exp1anation, 2002, YAKUJI NIPPO LIMITED 2002, 1-9: Skin Photosensitization Test, etc.). Кроме того, конкретные способы включают метод с нанесением адъюванта и полоски (Ichikawa, H. et al., J. Invest. Dermatol., 76, pp. 498-501, 1981), Harber метод (Harber, L.C., Arch. Dermatol., 96, pp. 646-653, 1967), Horio метод (Horio, T., J. Invest. Dermatol., 67, pp. 591-593, 1976), Jordan метод (Jordan, W.P., Contact Dermatitis, 8, pp. 109-116, 1982), Kochever метод (Kochever, I.E. et al., J. Invest. Dermatol., 73, pp. 144-146, 1979), Maurer метод (Maurer, T. et al., Br. J. Dermatol., 63, pp. 593-605, 1980), Morikawa метод (Morikawa, F. et al., "Sunlight and man", Tokyo Univ. Press, Tokyo, pp. 529-557, 1974), Vinson метод (Vinson, L.J., J. Soc. Cosm. Chem., 17, pp. 123-130, 1966) и т.п. Выполняя один, два или большее число тестов, основанных на вышеизложенных методах, фотосенсибилизирующее действие соединений по данному изобретению на кожу может быть несомненно выявлено с тем результатом, чтобы оценить возможность их применения в качестве эффективного компонента фармацевтического средства.
Пригодность производных, которые используют в качестве соединений по данному изобретению, в качестве эффективного компонента для фармацевтического средства можно установить, осуществляя тест на безопасность воздействия медикамента в отношении сердечно-сосудистой системы. Примеры испытания на безопасность воздействия медикамента относительно сердечно-сосудистой системы включают телеметрический способ (т.е. способ, согласно которому устанавливают влияние соединения на электрокардиограмму, частоту сердечных сокращений, кровяное давление, величину кровотока и т.п., не в условиях анестезии (Shigeru Kanno, Hirokazu Tsubone, Yoshitaka Nakata eds., Electrocardiography, Echocardiography, Blood Pressure, and Pathology test of an Animal for Basic and Clinical Medicine, 2003, published by Maruzen)), APD метод (т.е. способ измерения длительности потенциала действия кардиомиоцита (Muraki, K. et al., AM. J. Physiol., 269, H524-532, 1995; Ducic, I. et al., J. Cardiovasc. Pharmacol., 30(1), pp. 42-54, 1997)), измерение торможения электроретинограммы у человека (hERG) (метод пэтч-кламп (Chachin, M. et al., Nippon Yakurigaku Zasshi, 119, pp. 345-351, 2002), метод анализа с использованием реакции связывания (Gilbert, J.D. et al., J. Pharm. Tox. Methods, 50, pp. 187-199, 2004), метод анализа оттока Rb+ (Cheng, C.S. et al., Drug Develop. Indust. Pharm., 28, pp. 177-191, 2002), метод анализа трансмембранного потенциала (Dorn, A. et al., J. Biomol. Screen., 10, pp. 339-347, 2005) и т.д.) и т.д. Выполняя один, два или большее число тестов, основанных на вышеизложенных методах, действие соединений по данному изобретению на сердечно-сосудистую систему может быть конкретно идентифицировано с тем, чтобы можно было подтвердить их применимость в качестве эффективного компонента фармацевтического средства.
Применимость производных, которые используют в качестве соединений по данному изобретению, в качестве эффективного компонента для фармацевтического средства можно установить, осуществляя тест на безопасность воздействия медикамента относительно центральной нервной системы. Примеры испытания на безопасность воздействия медикамента в отношении центральной нервной системы включают FOB способ (т.е. способ оценки общей функции, Mattson, J. L. et al., J. American College of Technology 15 (3), pp. 239-254, 1996), модифицированный способ Ирвина (т.е. способ оценки общих симптомов и поведенческих характеристик (Irwin, S. Comprehensive Observational Assessment (Berl.) 13, pp. 222-257, 1968)) и т.д. Выполняя один, два или большее чсло тестов, основанных на вышеупомянутых способах, действие соединений по данному изобретению на центральную нервную систему может быть безусловно идентифицировано с тем результатом, чтобы подтвердить возможность их применения в качестве эффективного компонента фармацевтического средства.
Пригодность производных, которые используют в качестве соединений по данному изобретению, в качестве эффективного компонента для фармацевтического средства может быть установлена, осуществляя тест на безопасность воздействия медикамента в отношении органов дыхания, например. Примеры теста на безопасность воздействия медикамента в отношении органов дыхания включают измерение, используя прибор для измерения функции внешнего дыхания (т.е. способ, который измеряет число дыхательных циклов (вдох и выдох), количество воздуха на одно дыхание, количество вдыхаемого воздуха в минуту или час, (Drorbaugh, J.E. et al., Pediatrics, 16, pp. 81-87, 1955; Epstein, M.A. et al., Respir. Physiol., 32, pp. 105-120, 1978), или измерение, используя анализатор кислотно-основного баланса крови (т.е. способ, который измеряет состав газов крови, насыщение кислородом гемоглобина и т.д., Matsuo, S. Medicina, 40, pp. 188, 2003) и т.д. Выполняя один, два или большее число испытаний, основанных на вышеизложенных способах, действие соединений по данному изобретению на органы дыхания может быть четко идентифицирвано с тем результатом, чтобы можно было подтвердить их пригодность в качестве эффективного компонента фармацевтического средства.
Применимость производных, которые используют в качестве соединений по данному изобретению, в качестве эффективного компонента для фармацевтического средства может быть установлена, осуществляя испытание на общую токсичность. В частности, в соответствии с испытанием на общую токсичность, соединение, которое либо растворяют, либо суспендируют в подходящем растворителе, вводят перорально или вводят внутривенно один раз или неоднократно (на протяжении нескольких дней) грызунам, таким как крыса, мышь и т.п., или животным, не относящимся к грызунам, таким как обезьяна, собака и т.п. в качестве подопытного животного, и затем анализируют общее состояние животного или любое изменение в клинической биохимии или ткани с точки зрения патологии и т.д. Идентифицируя общую токсичность, проявляемую соединением, на основе вышеизложенного способа, применимость соединений по данному изобретению в качестве эффективного компонента для фармацевтического средства может быть подтверждена.
Пригодность производных, которые используют в качестве соединений по данному изобретению, в качестве эффективного соединения для фармацевтического средства может быть установлена, осуществляя тест на токсичность в отношении полового размножения. Данное испытание заключается в выявлении какого-либо побочного действия, вызываемого соединением, на процесс полового размножения, используя грызунов, таких как крыса, мышь и т.п. или животное, не относящееся к грызунам, такое как обезьяна, собака и т.п. (Guidelines for Non-clinical test of pharmaceuticals - Exp1anation, 2002, YAKUJI NIPPO LIMITED 2002, 1-6: Sexual Reproduction Toxicity Test, etc.). Что касается испытания на токсичность в отношении полового размножения, то можно упомянуть тест, касающийся (внутриутробного) развития эмбриона от оплодотворения до имплантации, тест, касающийся развития до и после рождения и активности матери, тест, касающийся развития эмбриона и плода (см., [3] Sexual Reproduction Toxicity Test under "Guidelines for Toxicity Test for Pharmaceuticals", Pharmaceuticals Examination, Vol. 1834, 2000), и т.д. Идентифицируя токсичность соединений по данному изобретению в отношении полового размножения, исходя из этого способа, применимость соединения в качестве эффективного компонента для фармацевтического средства может быть подтверждена.
Пригодность производных, которые используют в качестве соединений по данному изобретению, в качестве эффективного компонента для фармацевтического средства может быть установлена, осуществляя тест по ингибированию или индуцированию фермента цитохрома P450 (Gomez-Lechon, M.J. et al., Curr. Drug Metab. 5(5), pp. 443-462, 2004). Примеры такого испытания включают способ выявления in vitro ингибирующего действия соединения на активность фермента, этот способ использует фермент, цитохром P450, каждой молекулярной разновидности, который либо очищен от клетки, либо получен, используя генетический рекомбинант, или микросому в качестве системы, экспрессирующей человеческий P450 (Miller, V.P. et al., Ann. N.Y. Acad. Sci., 919, pp. 26-32, 2000), способ определения экспрессии фермента, цитохрома P450, для каждой молекулярной разновидности или вариации в ферментативной активности, использующий микросому клеточный гомогенат печени человека (Hengstler, J.G. et al., Drug Metab. Rev., 32, pp. 81-118, 2000), способ выявления активности соединения в индуцировании фермента путем экстрагирования РНК из клеток печени человека, которые были подвергнуты воздействию соединения, и сравнения величины экспрессии мРНК с величиной экспрессии мРНК контроля (Kato, M. et al., Drug Metab. Pharmacokinet., 20(4), pp. 236-243, 2005), и т.д. Выполняя один, два или большее число тестов, основанных на этих способах, действие соединений по данному изобретению на индуцирование или ингибирование фермента цитохрома P450 может быть несомненно идентифицировано, и соответственно полученному результату подтвердить возможность их применения в качестве эффективного компонента фармацевтического средства.
Применимость производных, которые используют в качестве соединений по данному изобретению, в качестве эффективного компонента для фармацевтического средства может быть установлена, например, осуществляя испытание на проницаемость клеток. Примеры данного испытания включают способ определения способности соединения проникать внутрь клеточной мембраны в условиях in vitro системы клеточной культуры, используя клетки CaCO-2, например (Delie, F. et al., Crit. Rev. Ther. Drug Carrier Syst., 14, pp. 221-286, 1997; Yamashita, S. et al., Eur. J. Pham. Sci., 10, pp. 195-204, 2000; Ingels, F.M. et al., J. Pham. Sci., 92, pp. 1545-1558, 2003), или способ определения способности соединения проникать внутрь клеточной мембраны в условиях in vitro системы клеточной культуры, используя клетки MDCK (Irvine, J.D. et al., J. Pham. Sci., 88, pp. 28-33, 1999) etc. Выполняя один, два или большее число тестов, основанных на этих способах, можно несомненно идентифицировать способность соединений проникать внутрь клеточной мембраны, тем самым подтвердить возможность их применения в качестве эффективного компонента фармацевтического средства.
Применимость производных, которые используют в качестве соединений по данному изобретению, в качестве эффективного компонента для фармацевтического средства можно установить, осуществляя, например, анализ на аденозинтрифосфатазу (ATPase), транспортера лекарственного средства, с использованием транспортера, АТФ-связывающей кассеты (ABC). Примеры такого анализа включают способ определения того, является ли испытуемое соединение субстратом или нет для P-gp, при использовании системы экспрессии бакуловируса Р-гликопротеина (P-gp) (Germann, U.A., Methods Enzymol., 292, pp. 427-41, 1998), и т.д. Кроме того, определение может быть также осуществлено, основываясь на анализе переноса, использующем ооциты, полученные от Xenopus 1aevis, в качестве транспортера, растворенного носителя (SLC). Что касается анализа переноса, ооциты, которые экспрессируют OATP2, могут быть использованы для подтверждения того, является ли испытуемое соединение субстратом для OATP2 или нет (Tamai I. et al., Pharm Res. 2001 Sep; 18(9): 1262-1269). Идентифицируя активность соединений относительно транспортера ABC или транспортера SLC, основываясь на этом способе, применимость соединений по данному изобретению в качестве эффективного компонента для фармацевтического средства может быть подтверждена.
Пригодность производных, которые используют в качестве соединений по данному изобретению, в качестве эффективного компонента для фармацевтического средства можно установить, осуществляя, например, тест на пероральную абсорбирующую активность. Примеры анализа включают способ определения способности соединения к переносу кровью после его перорального введения с использованием комбинированного метода анализа ЖХ-МС/МС (LC-MS/MS), посредством получения некоторого количества соединения, растворенного или суспендированного в растворителе, перорального введения его грызуну, обезьяне или собаке и измерения концентрации соедиения в крови на протяжении некоторого времени (Harada Kenichi et al., eds. "Newest aspects in mass spectrometry for biological sciences", 2002, Kodansha Scientific, etc.). Идентифицируя пероральную абсорбирующую способность соединения, исходя из этого способа, можно подтвердить применимость соединений по данному изобретению в качестве эффективного компонента для фармацевтического средства.
Пригодность производных, которые используют в качестве соединений по данному изобретению, в качестве эффективного компонента для фармацевтического средства может быть установлена, осуществляя, например, испытание с целью оценки кривой зависимости концентрация испытуемого соединения в крови-время. Примеры такого теста включают способ определения концентрационного профиля соединения в крови с использованием комбинированного метода анализа ЖХ-МС/МС путем перорального или парентерального (например, внутривенного, внутримышечного, интраперитонеального, подкожного или трансдермального введения или введения в глаз или через нос и т.д.) введения соединения грызуну, обезьяне или собаке и измерения концентрации в крови соединения на протяжении заданного периода времени (Harada Kenichi et al., eds. "Newest aspects in mass spectrometry for biological sciences", 2002, Kodansha Scientific и т.д.). Идентифицируя профиль-зависимость “концентрация соединения в крови-время”, исходя из этого способа, можно подтвердить применимость соединений по данному изобретению в качестве эффективного компонента для фармацевтического средства.
Пригодность производных, которые используют в качестве соединений по данному изобретению, в качестве эффективного компонента для фармацевтического средства можно установить, осуществляя, например, тест на метаболизм. Примеры такого теста включают способ определения стабильности в крови (т.е. способ, посредством которого вычисляют in vivo метаболический клиренс соединения, измеряя уровень его метаболизма в микросоме печени вытяжки другого животного; Shou, W.Z. et al., J. Mass Spectrom., 40(10), pp. 1347-1356, 2005; Li, C. et al., Drug Metab. Dispos., 34(6), 901-905, 2006), тест на молекулярную разновидность метаболитов, способ тестирования реакционноспособных метаболитов и т.д. Выполняя один, два или большее число тестов, основанных на вышеуказанных способах, можно идентифицировать метаболический профиль соединений и тем самым подтвердить возможность их применения в качестве эффективного компонента фармацевтического средства.
Пригодность производных, которые используют в качестве соединений по данному изобретению, в качестве эффективного компонента для фармацевтического средства можно установить, например, осуществляя испытание на растворимость. Примеры такого испытания включают способ определения растворимости, основанный на мутности (Lipinski, C.A. et al., Adv. Drug Deliv. Rev., 23, pp. 3-26, 1997; Bevan, CD. et al., Anal. Chem., 72, pp. 1781-1787, 2000), и т.д. Идентифицируя способность соединения к растворению, исходя из вышеуказанного способа, можно подтвердить применимость соединений по данному изобретению в качестве эффективного компонента для фармацевтического средства.
Пригодность производных, которые используют в качестве соединений по данному изобретению, в качестве эффективного компонента для фармацевтического средства можно оценить, исследуя, например, проблемы, связанные с верхним отделом желудочно-кишечного тракта или почкой, и т.д. Что касается фармакологического испытания относительно верхнего отдела желудочно-кишечного тракта, то можно упомянуть влияние соединения на состояние слизистой оболочки желудка, используя модель голодной крысы, имеющей поврежденную слизистую оболочку желудка. Что касается фармакологического испытания касательно функции почек, то можно упомянуть способ измерения величины почечного кровотока и уровня клубочковой фильтрации в почках [Physiology, 18th ed. Bunkoto, 1986, Chapter 17]. Выполняя один, два или большее число тестов, основанных на этих способах, можно несомненно идентифицировать действие соединений на верхний отдел желудочно-кишечного тракта или функцию почек и тем самым оценить возможность их применения в качестве эффективного компонента фармацевтического средства.
Что касается фармацевтического средства по данному изобретению, то могут быть использованы соединения по данному изобретению, как таковые, или смесь, содержащая два или большее число их видов. Однако для получения фармацевтической композиции для введения предпочтительно, чтобы к соединениям по данному изобретению или к смеси, содержащей два или большее число из них, были добавлены один или по меньшей мере два типа фармакологически приемлемых носителей. Типы фармакологически приемлемых носителей особенно не ограничены, тем не менее, они включают наполнитель, связующее, дезинтегрирующее средство, смазку или добавку и т.д. Примеры наполнителя включают D-маннит и т.п. Примеры связующего средства включают карбоксиметилцеллюлозу и т.п. Примеры дезинтегрирующего средства включают кукурузный крахмал и т.п. Примеры смазки включают глицерин и т.п. Примеры добавки включают эфир пара-оксибензойной кислоты и т.п. Кроме того, примеры добавки включают поверхностно-активное вещество, подобное полиоксиэтиленсорбитанмоноолеату (Tween 80), HC60 и т.п.
В тех случаях, когда фармацевтическое средство по данному изобретению вводят человеку, его можно вводить пероральным путем в форме таблетки, порошка, гранулы, капсулы, таблетки с сахарным покрытием, жидкости или сиропа и т.д. Кроме того, его можно также вводить парентеральным путем в форме, включающей раствор для инъекции, раствор Лингера, суппозиторий, трансдермальное или абсорбирующее средство и т.д.
Период времени введения фармацевтического средства по данному изобретению особенно не ограничен. Однако если фармацевтическое средство применяют с целью лечения, то период времени, на протяжении которого все еще проявляется клинический признак заболевания, можно считать периодом времени, необходимым для введения медикамента. В общем, введение продолжают на протяжении периода времени от нескольких недель до одного года. Однако в зависимости от симптомов заболевания, фармацевтическое средство может применяться и в дальнейшем, или его можно вводить постоянно даже после излечения от имевших место клинических симптомов. Кроме того, даже когда клинические признаки не наблюдаются, предлагаемое фармацевтическое средство может вводиться с профилактической целью, с учетом решения, принятого практикующим врачом. Доза фармацевтического средства по данному изобретению особенно не ограничена. Например, как правило, эффективная доза может составлять для взрослого человека от 0,01 до 2000 мг в день, при однократном приеме или в виде разделенной на несколько частей, повторяемой через определенные интервалы времени дозы. Частота введения может быть от одного раза в месяц до ежедневного приема. Предпочтительно частота введения - от одного раза в неделю до трех раз в неделю или пять раз в неделю, или фармацевтическое средство можно принимать ежедневно. Разовая доза, период введения и частота введения и т.д. могут либо увеличиваться, либо уменьшаться в зависимости от возраста, массы тела, общего состояния здоровья субъекта или заболевания, подлежащего лечению, и серьезности заболевания.
Комбинирование соединений по данному изобретению с другими фармацевтическыми средствами и использование такой комбинации в пределах достижения благоприятного эффекта, такого как получение желательного лечебного действия при максимальном уровне его проявления и/или снижение побочного действия, также находятся в пределах объема настоящего изобретения. Примеры фармацевтического средства, которое может быть использовано в комбинации с соединениями по данному изобретению для дополнения или повышения профилактической и/или терапевтической активности соединений по данному изобретению в отношении гиперактивного мочевого пузыря, включают антихолинергическое средство, ингибитор αl, агонист в отношении рецептора β3, антагонист в отношении рецептора нейрокинина, открыватель [активатор] кальциевых каналов, антагонист в отношении рецептора P2X3, блокатор для рецептора 1А серотонина, блокатор для рецептора NMDA, средство для ингибирования синтеза простагландина, гидрохлорид имипрамина, гидрохлорид флавоксата, капсаицин, резинифератоксин, ботулинический токсин, антидиуретическое средство и т.п.
Антихолинергическое средство, используемое для настоящего изобретения, является антагонистом мускаринового рецептора, и, например, предпочтительным является антагонистическое средство в отношении мускаринового рецептора, которое описано в литературе (Yakurigaku Zasshi, 126, p.199-206 (2006)). В частности, в качестве предпочтительного примера могут быть упомянуты оксибутинин, пропиверин, толтеродин, солифенацин и имидафенацин. Среди них особенно предпочительны пропиверин, толтеродин или солифенацин.
Ингибитор α1, используемый для настоящего изобретения, представляет собой ингибитор рецептора α1 адреналина, и примеры включают ингибитор рецептора α1 адреналина, который описан в литературе (Yakurigaku Zasshi, 126, pl99-206 (2006)). Конкретные примеры включают празозин, теразозин, тамсулозин, нафтопидил, альфузозин, доксазозин или силодозин. Среди них особенно предпочтительны тамсулозин, нафтопидил или силодозин.
Время введения для вышеописанных средств в случае комбинированного использования особенно не ограничено. Фармацевтическое средство по данному изобретению и средства для комбинированного использования можно вводить субъекту либо одновременно, либо с интервалом по времени. Доза средств для комбинированного использования может быть аналогична дозам, которые используют в клинической практике. Эта доза может быть соответствующим образом подобрана в зависимости от субъекта, подлежащего лечению, пути введения, заболевания, подлежащего лечению, и типа комбинации фармацевтического средства по данному изобретению и средств для комбинированного использования.
Форма введения средств для комбинированного использования особенно не ограничена при условии, что фармацевтическое средство по данному изобретению и средства для комбинированного использования присутствуют в виде комбинации на момент времени введения. Такая форма введения включает, например, 1) введение одного препарата, который получают путем объединения в общем составе соединений по данному изобретению в качестве эффективного компонента фармацевтического средства по данному изобретению и средств для комбинированного использования, 2) введение одним и тем же путем, одновременно, двух типов препаратов, каждый из которых получают раздельно, используя фармацевтическое средство по данному изобретению и средства для комбинированного использования соответственно, 3) введение одним и тем же путем, с интервалом по времени, двух типов препаратов, каждый из которых получают раздельно, используя фармацевтическое средство по данному изобретению и средства для комбинированного использования соответственно, 4) введение одновременно, различными путями введения, двух типов препаратов, каждый из которых получают раздельно, используя фармацевтическое средство по данному изобретению и средства для комбинированного использования соответственно, и 5) введение различными путями введения, с интервалом по времени, двух типов препаратов, каждый из которых получают раздельно, используя фармацевтическое средство по данному изобретению и средства для комбинированного использования соответственно (например, фармацевтическое средство по данному изобретению вводят первым, за которым следует введение средств для комбинированного использования, и наоборот) и т.п.
Отношение смеси фармацевтическое средство по данному изобретению/средства для комбинированного использования может быть подобрано надлежащим образом в зависимости от ряда факторов, таких как субъект, нуждающийся в лечении таким комбинированным фармацевтическым средством, путь введения, заболевание, подлежащее лечению; и т.п.
[Пример]
Ниже в настоящем описании настоящее изобретение более детально разъясняется при рассмотрении нижеприведенных примеров. Однако объем данного изобретения никоим образом не ограничивается этими примерами.
Что касается Примеров, изложенных ниже, в них приводятся данные различных используемых методов анализа, которые осуществляют в соответствии с нижеприведенными описаниями, если они не оговорены особо.
Для тонкослойной хроматографии (ТСХ) используют пластину для ТСХ, поставляемую компанией Merck Co., Germany (предварительно покрытую силикагелем 60 F254). После проявления, используя смесь хлороформ:метанол (1:0 до 1:1) или смесь гексан:этилацеткат (1:0 до 0:1), осуществляют облучение УФ-лучами (254 нм или 365 нм), за которым следует проведение хромогенной реакции, используя пары йода, раствор п-анисового альдегида, фосформолибденовую кислоту (раствор в этаноле), нингидрин или раствор гидрохлорида динитрофенилгидразина, для идентификации. Для сушки органического растворителя используют безводный сульфат магния или безводный сульфат натрия. Для колоночной хроматографии используют многофункциональный гидравлический клапан YFLC (производимый Yamazen) и в качестве колонки используют либо серию колонок типа Hi-F1ash (40 мкм; производимую Yamazen), либо серию колонок типа Purif Pack-Si (производимую MORITE). Для колоночной флэш-хроматографии используют силикагель 60N (в форме шариков, нейтральный, размером от 40 до 100 мкм, производимый Kanto Chemical Formu1a Company, Japan). Для препаративной тонкослойной хроматографии (ниже в данном контексте аббревиатура "ПТСХ") используют, в зависимости от количества образца, одну пластину или множество пластин для ТСХ, покрытых силикагелем 60 F254 (20×20 см, толщина слоя 2 мм, производитель Merck Co.). Для очистки с помощью ВЭЖХ используют систему LC-10A (производитель Shimadzu Corporation) в сочетании с колонкой Develosil C-30-UG-5 (производитель NOMURA CHEMICAL CO., LTD). В качестве раствора для элюирования используют раствор смеси вода-ацетонитрил, содержащий 0,1% уксусной кислоты. В случае очистки с помощью ВЭЖХ целевое соединение получают путем удаления растворителя посредством лиофилизации, если не оговорено иначе. Для получения спектра ядерного магнитного резонанса (ЯМР) используют прибор AL-300 (FT-NMR, производитель JEOL Co.). В качестве растворителя используют дейтерированный хлороформ, если не оговорено особо. Для измерения химического сдвига в качестве внутреннего стандарта используют тетраметилсилан (TMS). Величина химического сдвига выражается в δ (м.д.). Кроме того, константа спин-спинового взаимодействия выражается в J (Гц).
Что касается "ЖХМС", то для получения масс-спектра используют комбинированный метод анализа, сочетающий жидкостную хроматографию с масс-спектрометрией (ЖХ-МС). Для анализа используют, в отдельности, три типа инструментальных систем (A), (B) и (C), описанные ниже.
(A) В качестве масс-спектрометра используют масс-спектрометр типа ZMD (производимый Micromass, Eng1and) и для измерения проводят ионизацию, используя метод электрораспыления (ESI). Используют жидкостной хроматограф системы Waters 600 LC, производимый Waters Company. В качестве разделительной колонки используют колонку Develosil C30-UG-5 (50×4,6 мм, производимую NOMURA CHEMICAL CO., LTD).
(B) В качестве масс-спектрометра используют масс-спектрометр типа P1atform-LC (производимый Micromass, Eng1and) и для измерения проводят ионизацию, используя метод электрораспыления (ESI). Используют жидкостной хроматограф, производимый компанией GILSON, France. В качестве разделительной колонки используют колонку Develosil C30-UG-5 (50×4,6 мм, производимую NOMURA CHEMICAL CO., LTD).
(C) В качестве масс-спектрометра используют масс-спектрометр квадрупольного типа, т.е. систему UPLC/SQD (производимую Waters Company) и для измерения проводят ионизацию, используя метод электрораспыления (ESI). Используют жидкостной хроматограф с разделительной системой Ultra Performance LC, производимый Waters Company. В качестве разделительной колонки используют колонку ACQUITY UPLC BEH (C18, 2,1×50 мм 1,7 мкм, производимую Waters Company).
Что касается Примеров и Ссылочных примеров, в которых представлены конкретные описания относительно условия проведения ЖХ-разделения, то в них представлены результаты измерений, осуществляемых, используя любую из вышеописанных инструментальных систем и в соответствии с нижеприведенным состоянием растворителя. Кроме того, "m/z" означает данные масс-спектра (указаны молекулярные ионы как M + H, так и M - H).
Условие проведения ЖХ-разделения 1: (A-1)
Используемая инструментальная система: (A)
Скорость потока: 2 мл/мин
Растворитель: Раствор A = вода, содержащая 0,1% (об./об.) уксусной кислоты, Раствор B = ацетонитрил, содержащий 0,1% (об./об.) уксусной кислоты
Начиная с 0 минуты до 5 минут: Линейный градиент от [Раствор A 95% + Раствор B 5% (об./об.)] до [Раствор A 2% + Раствор B 98% ((об./об.)]
Начиная с 5 минуты до 6 минут: Поддерживать состав растворителя при [Раствор A 2% + Раствор B 98% (об./об.)]
Начиная с 6 минуты до 7,5 минуты: Поддерживать состав растворителя при [Раствор A 95% + Раствор B 5% (об./об.)]
Условие проведения ЖХ-разделения 2: (B-1)
Используемая инструментальная система: (B)
Растворитель: Раствор A = вода, содержащая 0,1% (об./об.) уксусной кислоты, Раствор B = ацетонитрил, содержащий 0,1% (об./об.) уксусной кислоты
Начиная с 0 минуты до 5 минут: Линейный градиент от [Раствор A 95% + Раствор B 5% (об./об.)] до [Раствор A 0% + Раствор B 100% (об./об.)]
Начиная с 5 минуты до 9 минут: Поддерживать состав растворителя при [Раствор A 0% + Раствор B 100% (об./об.)]
Начиная с 9 минуты до 10 минут: Поддерживать состав растворителя при [Раствор A 95% + Раствор B 5% (об./об.)]
Условие проведения ЖХ-разделения: (C-1)
Используемая инструментальная система: (C)
Скорость потока: 0,6 мл/мин
Растворитель: Раствор A = вода, содержащая 0,1% (об./об.) уксусной кислоты, Раствор B = ацетонитрил, содержащий 0,1% (об./об.) уксусной кислоты
Начиная с 0 минуты до 2 минут: Линейный градиент от [Раствор A 95% + Раствор B 5% (об./об.)] до [Раствор A 10% + Раствор B 90% (об./об.)]
Начиная с 2 минут до 2,5 минуты: Линейный градиент от [Раствор A 10% + Раствор B 90% (об./об.)] до [Раствор A 2% + Раствор B 98% (об./об.)]
Начиная с 2,5 минуты до 2,6 минуты: Линейный градиент от [Раствор A 2% + Раствор B 98% (об./об.)] до [Раствор A 95% + Раствор B 5% (об./об.)]
Начиная с 2,6 минуты до 3,2 минуты: Поддерживать состав растворителя при [Раствор A 95% + Раствор B 5% (об./об.)]
Условие проведения ЖХ-разделения: (A-2)
Используемая инструментальная система: (A)
Скорость потока: 2 мл/мин
Растворитель: Раствор A = вода, содержащая 0,1% (об./об.) уксусной кислоты, Раствор B = ацетонитрил, содержащий 0,1% (об./об.)] уксусной кислоты
Начиная с 0 минуты до 5 минут: Линейный градиент от [Раствор A 50% + Раствор B 50% (об./об.)] до [Раствор A 2% + Раствор B 98% (об./об.)]
Начиная с 5 минут до 6 минут: Поддерживать состав растворителя при [Раствор A 2% + Раствор B 98% (об./об.)]
Начиная с 6 минут до 7,5 минуты: Поддерживать состав растворителя при [Раствор A 50% + Раствор B 50% (об./об.)]
<Ссылочный пример 1>
3,5-Дифенил-1H-пиразол
К этанольному (22 мл, производимый Wako Pure Chemical Industries, Ltd.) раствору 1,3-дифенил-1,3-пропандиона (500 мг, производимому Tokyo Chemical Industry Co., Ltd.) добавляют гидрат гидразина (228 мг, производимому Tokyo Chemical Industry Co., Ltd.) и перемешивают в течение одного часа при комнатной температуре. К полученному реакционному раствору добавляют воду (20 мл) с последующей экстракцией этилацетатом (3×20 мл), промыванием насыщенным раствором соли (20 мл) и сушкой над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 8:1), получая указанное в заголовке соединение (480 мг). ЖХ-МС: время удерживания согласно ВЭЖХ 4,63 минуты, m/z 221(M+H), Условие A-1.
<Ссылочный пример 2>
1-{3-(Метоксиметокси)фенил}пропан-1-ол
К раствору 3-(метоксиметокси)бензальдегида (2,0 г), который был синтезирован способом, описанным в литературе (B. Michael et al., Org. Lett. 2006, 8, 3745-3748), в тетрагидрофуране (80 мл, производимом Wako Pure Chemical Industries, Ltd.) добавляют при 0°C этилмагнийбромид (24 мл, 0,91M раствор в тетрагидрофуране, полученный Kanto Chemical Formu1a Company) с последующим перемешиванием при комнатной температуре в течение 1 часа. К полученному реакционному раствору добавляют воду (50 мл) с последующей экстракцией этилацетатом (3×50 мл), промыванием насыщенным раствором соли (100 мл) и сушкой над MgSO4. Растворитель выпаривают, получая указанное в заголовке соединение (1,65 г).
<Ссылочный пример 3>
1-{3-(Метоксиметокси)фенил}пропан-1-он
К раствору соединения Ссылочного примера 2 (1,65 г) в дихлорметане (80 мл, производимом Wako Pure Chemical Industries, Ltd.) добавляют хлорохромат пиридиния (3,62 г, производимый Acros Organics) с последующим перемешиванием при комнатной температуре в течение 3 часов. После завершения реакции непрореагировавший хлорхромат пиридиния удаляют фильтрацией, к фильтрату добавляют воду (50 мл), за которым следует экстракция этилацетатом (3×50 мл), промывание насыщенным раствором соли (100 мл) и сушка над MgSO4. Растворитель выпаривают, получая указанное в заголовке соединение (251 мг).
<Ссылочный пример 4>
1-{3-(Метоксиметокси)фенил}-2-метил-3-фенилпропан-1,3-дион
К раствору в толуоле (13 мл, производимом Kanto Chemical Formu1a Company) соединения Ссылочного примера 3 (251 мг) добавляют при охлаждении льдом гексаметилдисилазан лития (850 мкл, 1,6M раствор в тетрагидрофуране, производимый Aldrich Company). После перемешивания в течение 1 минуты при такой же температуре добавляют бензоилхлорид (90 мкл, производимый Wako Pure Chemical Industries, Ltd.) и перемешивают в течение 30 минут. К реакционному раствору добавляют 1M хлористоводородную кислоту (10 мл, производимую Kanto Chemical Formu1a Company), за которым следует экстракция диэтиловым эфиром (3×20 мл), промывание насыщенным раствором соли (40 мл) и сушка над MgSO4. Растворитель выпаривают, получая указанное в заголовке соединение (384 мг). ЖХ-МС: время удерживания согласно ВЭЖХ 4,46 минуты, m/z 299 (M+H), Условие B-1.
<Ссылочный пример 5>
2-Нитрозо-1,3-дифенилпропандион
К раствору 2-бром-1,3-дифенилпропан-1,3-диона (9,55 г), который был синтезирован способом, описанным в литературе (T. H. L. Quyen et al., J. Chem. Soc. Dalton Trans., 1997, 643-648), в диметилсульфоксиде (158 мл, производимом Kanto Chemical Formu1a Company) добавляют нитрит натрия (10,9 г, производимый Aldrich Company) и мочевину (15,2 г, производимую Kanto Chemical Formu1a Company) с последующим перемешиванием на протяжении ночи при комнатной температуре. К реакционному раствору добавляют воду (200 мл), за этим следует экстракция этилацетатом (3×200 мл), промывание насыщенным раствором соли (400 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 70:30), получая указанное в заголовке соединение (4,25 г). ЖХ-МС: время удерживания согласно ВЭЖХ 1,52 минуты, m/z 252 (M + Н), Условие C-1.
<Ссылочный пример 6>
2-Метил-3-йод-3-фенилпропионитрил
К раствору пропионитрила (770 мг, производимого Wako Pure Chemical Industries, Ltd.) в тетрагидрофуране (27 мл, производимом Kanto Chemical Formu1a Company) добавляют этоксид натрия (1,24 г, производимый Kanto Chemical Formu1a Company) при комнатной температуре с последующим перемешиванием в течение 5 минут при комнатной температуре. К реакционному раствору добавляют этилбензоат (2,32 г, производимый Tokyo Chemical Industry Co., Ltd.) и кипятят с обратным холодильником в течение 12 часов. Реакционный раствор охлаждают до комнатной температуры и в него добавляют 1M хлористоводородную кислоту (20 мл, производимую Kanto Chemical Formu1a Company). Смесь перемешивают при той же температуре в течение 1 часа. Раствор смеси экстрагируют этилацетатом (3×20 мл), промывают насыщенным раствором соли (20 мл) и сушат над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 6:1), получая указанное в заголовке соединение (2,06 г). ЖХ-МС:время удерживания согласно ВЭЖХ 4,11 минут, m/z 158 (M-H). Условие A-1.
<Ссылочный пример 7>
Этиловый эфир 2-(5-амино-4-метил-3-фенил-1H-пиразол-1-ил)тиазол-4-карбоновой кислоты
К раствору соединения Ссылочного примера 6 (2,06 г) в этаноле (47 мл, производимом Wako Pure Chemical Industries, Ltd.) добавляют тиосемикарбазид (1,20 г, производимый Tokyo Chemical Industry Co., Ltd.) при комнатной температуре с последующим кипячением с обратным холодильником в течение 1 часа. Затем добавляют этиловый эфир бромпировиноградной кислоты (2,16 мл, производимый Wako Pure Chemical Industries, Ltd.) и кипятят с обратным холодильником в течение 4 часов. Реакционный раствор охлаждают до комнатной температуры и концентрируют при пониженном давлении. К полученному остатку добавляют воду (20 мл), за которым следует экстракция этилацетом (3×20 мл), промывание насыщенным раствором соли (20 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 4:1), получая указанное в заголовке соединение (679 мг). ЖХ-МС:время удерживания ВЭЖХ 5,44 минут, m/z 329 (M+H), Условие A-1
<Ссылочный пример 8>
Этиловый эфир 2-(5-йод-4-метил-3-фенил-1H-пиразол-1-ил)тиазол-4-карбоновой кислоты
К раствору соединения Ссылочного примера 7 (572 мг) в ацетонитриле (17 мл, производимом Wako Pure Chemical Industries, Ltd.) добавляют трет-бутиловый эфир азотистой кислоты (554 мкл, производимый Acros Organics) и йод (1,17 г, производимый Kanto Chemical Formu1a Company) с последующим кипячением с обратным холодильником в течение 2 часов. Реакционный раствор охлаждают до комнатной температуры и концентрируют при пониженном давлении. К полученному остатку добавляют насыщенный водный раствор тиосульфата натрия (20 мл), за которым следует экстракция этилацетатом (3×20 мл), промывание насыщенным раствором соли (20 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 9:1), получая указанное в заголовке соединение (495 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 6,05 минут, m/z 440 (M+H), Условие B-1.
<Ссылочный пример 9>
Метиловый эфир 2-амино-5-метилтиазол-4-карбоновой кислоты
К раствору метилового эфира 2-амино-5-бромтиазол-4-карбоновой кислоты (240 мг, производимый Combi-Block Company) в N,N-диметилформамиде (10 мл, производимом Kanto Chemical Formu1a Company) добавляют тетраметилолово (693 мкг, производимое Tokyo Chemical Industry Co., Ltd.) и тетракистрифенилфосфинпалладий (118 мг, производимый Kanto Chemical Formu1a Company) и перемешивают на протяжении ночи при 120°C. К реакционному раствору добавляют воду (20 мл), за которым следует экстракция этилацетатом (2×30 мл), промывание насыщенным раствором соли (20 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь хлороформ:метанол = 20:1), получая указанное в заголовке соединение (43,3 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 1,76 минуты, m/z 173 (M + H), Условие B-1.
<Ссылочный пример 10>
Метиловый эфир 2-бром-5-метилтиазол-4-карбоновой кислоты
К раствору соединения Ссылочного примера 9 (267 мг) в ацетонитриле (15 мл, производимом Kanto Chemical Formu1a Company) добавляют трет-бутиловый эфир азотистой кислоты (493 мкл, производимый Acros Organics) и бромид меди(II) (915 мг, производимый Kanto Chemical Formu1a Company) при комнатной температуре и кипятят с обратным холодильником в течение 6 часов. Реакционный раствор охлаждают до комнатной температуры и добавляют воду (20 мл), за которым следует экстракция этилацетатом (2×30 мл), промывание насыщенным раствором соли (20 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 4:1), получая указанное в заголовке соединение (277 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 3,30 минуты, m/z 236 (M+H), Условие B-1.
<Ссылочный пример 11>
Метиловый эфир 2-бром-5-этилтиазол-4-карбоновой кислоты
К раствору метилового эфира 2-амино-5-этилтиазол-4-карбоновой кислоты (373 мг, производимого Bionet) в ацетонитриле (20 мл, производимом Kanto Chemical Formu1a Company) добавляют при комнатной температуре трет-бутиловый эфир азотистой кислоты (636 мкл, производимый Acros Organics) и бромид меди(II) (1,19 г, производимый Kanto Chemical Formu1a Company) и кипятят с обратным холодильником в течение 2,5 часов. Реакционный раствор охлаждают до комнатной температуры, добавляют воду (10 мл), за которым следует экстракция этилацетатом (2×30 мл), промывание насыщенным раствором соли (20 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 4:1), получая указанное в заголовке соединение (389 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 3,87 минуты, m/z 250 (M+H), Условие B-1.
<Ссылочный пример 12>
Этиловый эфир 2-{(триметилсилил)этинил}тиазол-4-карбоновой кислоты
К раствору в тетрагидрофуране (500 мкл, производимом Kanto Chemical Formu1a Company) этилового эфира 2-бром-4-тиазолкарбоновой кислоты (213 мг), который был синтезирован способом, описанным в литературе (T.R. Kelly et al., J. Org. Chem. 1996, 61, 4623-4633), добавляют триметилсилилацетилен (147 мг, производимый Tokyo Chemical Industry Co., Ltd.), дихлорбис(трифенилфосфин)палладий (35 мг, производимый Kanto Chemical Formu1a Company), трифенилфосфин (7 мг, производимый Wako Pure Chemical Industries, Ltd.) и триэтиламин (210 мкл, производимый Wako Pure Chemical Industries, Ltd.) и перемешивают при той же температуре в течение 20 минут. К реакционному раствору добавляют иодид меди (8 мг, производимый Kanto Chemical Formu1a Company) и затем перемешивают при 60°C в течение двух часов. Реакционный раствор охлаждают до комнатной температуры, добавляют воду (10 мл), за которым следует экстракция этилацетатом (3×10 мл), промывание насыщенным раствором соли (20 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 4:1), получая указанное в заголовке соединение (77,7 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 4,91 минуты, m/z 254 (M+H), Условие B-1.
<Ссылочный пример 13>
Этиловый эфир 2-этинилтиазол-4-карбоновой кислоты
К раствору соединения Ссылочного примера 12 (78 мг) в тетрагидрофуране (1,8 мл, производимом Kanto Chemical Formu1a Company) добавляют фторид тетрабутиламмония (401 мг, производимый Tokyo Chemical Industry Co., Ltd.) и перемешивают при комнатной температуре в течение 1 часа. К реакционному раствору добавляют насыщенный водный раствор хлорида аммония (10 мл), за которым следует экстракция этилацетатом (3×10 мл), промывание насыщенным раствором соли (20 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 4:1), получая указанное в заголовке соединение (30,5 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 3,06 минуты, m/z 182 (M+H), Условие B-1.
<Ссылочный пример 14>
Этиловый эфир (Z)-2-(2-бромвинил)тиазол-4-карбоновой кислоты
<Ссылочный пример 15>
Этиловый эфир (E)-2-(2-бромвинил)тиазол-4-карбоновой кислоты
К раствору соединения Ссылочного примера 13 (40 мг) в тетрагидрофуране (883 мкл, производимом Kanto Chemical Formu1a Company) добавляют цирконоценхлоридгидрид (85 мг, производимый Tokyo Chemical Industry Co., Ltd.) и перемешивают при такой же температуре в течение 3 часов. Затем добавляют бром (17 мг, производимый Wako Pure Chemical Industries, Ltd.) и смесь дополнительно перемешивают в течение 2 часов при 0°C. К реакционному раствору добавляют насыщенный водный раствор тиосульфата натрия (10 мл), за которым следует экстракция этилацетатом (3×10 мл), промывание насыщенным раствором соли (20 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают ПТСХ (препаративная тонкослойная хроматография, смесь гексан:этилацетат = 2:1), получая целевое соединене (т.е. 30 мг (Z)-формы и 15 мг (E)-формы).
(Z)-форма; ЖХ-МС:время удерживания согласно ВЭЖХ 3,74 минуты, m/z 262 (M + H), Условие B-1. (E)-форма; ЖХ-МС:время удерживания согласно ВЭЖХ 3,91 минуты, m/z 262 (M+H), Условие B-1.
<Пример 1>
Этиловый эфир 2-(3,5-дифенил-1H-пиразол-1-ил)тиазол-4-карбоновой кислоты
К раствору соединения Ссылочного примера 11 (200 мг) в N,N-диметилформамиде (9 мл, производимом Kanto Chemical Formu1a Company) добавляют при охлаждении льдом гидрид натрия (добавляют вместе с 40% минерального масла, 80 мг, производимый Kanto Chemical Formu1a Company) и перемешивают при такой же температуре в течение 15 минут. Затем к реакционному раствору добавляют этиловый эфир 2-бром-4-тиазолкарбоновой кислоты (648 мг, который был синтезирован способом, описанным в литературе (T. R. Kelly et al., J. Org. Chem. 1996, 61, 4623-4633) и перемешивают при 150°C в течение 14 часов. Реакционный раствор охлаждают до комнатной температуры. Затем добавляют воду (10 мл), за которым следует экстракция этилацетатом (3×10 мл), промывание насыщенным раствором соли (10 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 6:1), получая указанное в заголовке соединение (149 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 5,67 минуты, m/z 376 (M+H), Условие A-1.
<Пример 2>
2-(3,5-Дифенил-1H-пиразол-1-ил)тиазол-4-карбоновая кислота
К раствору соединения Примера 1 (53 мг) в этаноле (9 мл, производимом Wako Pure Chemical Industries, Ltd.) добавляют 5M водный раствор гидроксида натрия (1 мл, производимого Kanto Chemical Formu1a Company) и перемешивают при комнатной температуре в течение 12 часов. После добавления 5M хлористоводородной кислоты (1 мл, производимой Kanto Chemical Formu1a Company) к реакционному раствору осуществляют экстракцию этилацетатом (3×10 мл), за которой следует промывание насыщенным раствором соли (10 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 1:3), получая указанное в заголовке соединение (32,0 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 5,05 минуты, m/z 348 (M+H), Условие A-1.
<Пример 3>
Этиловый эфир 2-(4-гидрокси-3,5-дифенил-1H-пиразол-1-ил)тиазол-4-карбоновой кислоты
К раствору 2-гидрокси-1,3-дифенилпропан-1,3-диона (3,36 г), который был синтезирован способом, описанным в литературе (A. H. B1att et al., J. Am. Chem. Soc. 1936, 58, 81-84.) в этаноле (50 мл, производимом Wako Pure Chemical Industries, Ltd.) добавляют тиосемикарбазид (1,30 г, производимый Tokyo Chemical Industry Co., Ltd.) с последующим перемешиванием при нагревании 80°C в течение 2 часов. Далее к реакционному раствору добавляют этиловый эфир бромпировиноградной кислоты (2,33 мл, производимый Wako Pure Chemical Industries, Ltd.) и содержимое затем перемешивают при 80°C в течение 12 часов. Реакционный раствор охлаждают до комнатной температуры. Добавляют воду (20 мл), за которым следует экстракция этилацетатом (3×30 мл), промывание насыщенным раствором соли (30 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 5:1), получая указанное в заголовке соединение (1,68 г). ЖХ-МС:время удерживания согласно ВЭЖХ 5,37 минуты, m/z 392 (M+H), Условие B-1.
<Пример 4>
Этиловый эфир 2-[4-метокси-3,5-дифенил-1H-пиразол-1-ил]тиазол-4-карбоновой кислоты
К раствору соединения Примера 3 (20 мг) в N,N-диметилформамиде (4 мл, производимом Kanto Chemical Formu1a Company) добавляют при охлаждении льдом гидрид натрия (добавляют вместе с 40% минерального масла, 50 мг, производимый Kanto Chemical Formu1a Company) и перемешивают при такой же температуре в течение 15 минут. Затем к реакционному раствору добавляют йодметан (22 мг, производимый Tokyo Chemical Industry Co., Ltd.) и перемешивают при той же температуре в течение 4 часов. Затем добавляют воду (10 мл), за которым следует экстракция диэтиловым эфиром (3×10 мл), промывание насыщенным раствором соли (10 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 9:1), получая указанное в заголовке соединение (12,8 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 5,64 минуты, m/z 406 (M+H), Условие A-1.
<Пример 5>
Этиловый эфир 2-(4-метил-3,5-дифенил-1H-пиразол-1-ил)тиазол-4-карбоновой кислоты
К раствору в мезитилене (5 мл, производимом Kanto Chemical Formu1a Company) 4-метил-3,5-дифенил-1H-пиразола (1,17 г), который был синтезирован описанным в литературе способом (C. Francesca et al., J. Chem. Soc. Perkin Trans. 1 1994, 18, 2533-2536.), фосфат калия (2,23 г, производимый Wako Pure Chemical Industries, Ltd.), (1S, 2S)-(+)-N,N-диметилциклогексан-1,2-диамин (71 мг, производимый Tokyo Chemical Industry Co., Ltd.), иодид меди (48 мг, производимый Kanto Chemical Formu1a Company) и этиловый эфир 2-бром-4-тиазолкарбоновой кислоты (1,19 г), который был синтезирован способом, описанным в литературе (T.R. Kelly et al., J. Org. Chem. 1996, 61, 4623-4633), добавляют и перемешивают при 180°C в течение 12 часов. Реакционный раствор охлаждают до комнатной температуры. Затем добавляют воду (20 мл), за которым следует экстракция этилацетатом (3×20 мл), промывание насыщенным раствором соли (20 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 9:1), получая указанное в заголовке соединение (313 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 6,06 минуты, m/z 390 (M+H), Условие B-1.
<Пример 6>
2-{3-(3-Гидроксифенил)-4-метил-5-фенил-1H-пиразол-1-ил}тиазол-4-карбоновая кислота
К раствору в этаноле (500 мкл, производимом Wako Pure Chemical Industries, Ltd.) этилового эфира 2-[3-{3-(метоксиметокси)фенил}-4-метил-5-фенил-1H-пиразол-1-ил]тиазол-4-карбоновой кислоты (40 мг), который был получен из соединения Ссылочного примера 4 по способу Ссылочного примера 1 и затем по способу Примера 5, добавляют 5M хлористоводородную кислоту (0,5 мл, производимую Kanto Chemical Formu1a Company) и перемешивают при комнатной температуре в течение трех часов. К реакционному раствору добавляют 5M водный раствор гидроксида натрия (1 мл, производимого Kanto Chemical Formu1a Company) и смесь далее перемешивают при комнатной температуре в течение 3 часов. Затем добавляют 5M хлористоводородную кислоту (0,5 мл, производимую Kanto Chemical Formu1a Company) для нейтрализации, за которым следует экстракция этилацетатом (3×10 мл), промывание насыщенным раствором соли (10 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают ПТСХ (смесь гексан:этилацетат = 1:3), получая указанное в заголовке соединение (7,0 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 4,52 минуты, m/z 378 (M + H), Условие A-1.
<Пример 7>
Этиловый эфир 2-(4-амино-3,5-дифенил-1H-пиразол-1-ил)тиазол-4-карбоновой кислоты
К раствору соединения Ссылочного примера 5 (500 мг) в этаноле (20 мл, производимом Wako Pure Chemical Industries, Ltd.) добавляют тиосемикарбазид (734 мг, производимый Tokyo Chemica Industry Co., Ltd.) с последующим перемешиванием при нагревании 80°С в течение 2 часов. Затем добавляют этиловый эфир бромпировиноградной кислоты (328 мкл, производимый Wako Pure Chemical Industries, Ltd.) и перемешивают при 80°C в течение 12 часов. Реакционный раствор охлаждают до комнатной температуры. Добавляют воду (20 мл), за этим следует экстракция этилацетатом (3×30 мл), промывание насыщенным раствором соли и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 7:3), получая указанное в заголовке соединение (215 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 5,34 минут, m/z 391 (M+H), Условие B-1.
<Пример 8>
Этиловый эфир 2-(4-хлор-3,5-дифенил-1H-пиразол-1-ил)тиазол-4-карбоновой кислоты
К раствору соединения Примера 7 (26,8 мг) в ацетонитриле (800 мкл, производимом Wako Pure Chemical Industries, Ltd.) при комнатной температуре добавляют трет-бутиловый эфир азотистой кислоты (26 мкл, производимый Acros Organics) и бромид меди(II) (36 мг, производимый Kanto Chemical Formu1a Company) и кипятят с обратным холодильником в течение 2 часов. Реакционный раствор охлаждают до комнатной температуры и затем добавляют насыщенный водный раствор тиосульфата натрия (20 мл), за этим следует экстракция этилацетатом (3×20 мл), промывание насыщенным раствором соли (20 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 4:1), получая указанное в заголовке соединение (12,8 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 6,23 минуты, m/z 410 (M+H), Условие B-1.
<Пример 9>
Этиловый эфир 2-(4-метил-3-фенил-5-тиофен-2-ил)тиазол-4-карбоновой кислоты
К раствору в 1,4-диоксане (455 мкл, производимом Kanto Chemical Formu1a Company) соединения Ссылочного примера 8 (20 мг), 2M водного раствора карбоната натрия (10 мкл, производимого Kanto Chemical Formu1a Company) и бис(дибензилиденацетон)палладия (4,2 мг, производимый Aldrich Company) добавляют три-о-толилфосфин (5,6 мг, производимый Kanto Chemical Formu1a Company), 2-тиофенбороновую кислоту (29 мг, производимую Maybridge) и перемешивают при 80°C в течение 4 часов. Реакционный раствор охлаждают до комнатной температуры и затем добавляют насыщенный водный раствор гидрокарбоната натрия (1 мл), за этим следует экстракция этилацетатом (3×5 мл), промывание насыщенным раствором соли (5 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 5:1), получая указанное в заголовке соединение (6,9 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 5,92 минуты, m/z 396 (M + H), Условие A-1.
<Пример 10>
Этиловый эфир 2-(1',4-диметил-5-фенил-1'H,2H-3,4'-бипиразол-2-ил)тиазол-4-карбоновой кислоты
К раствору смеси N,N-диметилформамида (910 мкл, производимого Kanto Chemical Formu1a Company) и воды (смесь 10:1), содержащей соединение Ссылочного примера 8 (100 мг), фосфат калия (145 мг, производимый Wako Pure Chemical Industries, Ltd.), три-о-толилфосфин (20,8 мг, производимый Kanto Chemical Formu1a Company), бис(дибензилиденацетон)палладий (21 мг, производимый Aldrich Company) и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол (142 мг, производимый Boron Molecu1ar) добавляют и перемешивают при 80°C в течение 12 часов. Полученный раствор охлаждают до комнатной температуры и добавляют воду (20 мл). После перемешивания при комнатной температуре в течение одного часа осуществляют экстракцию этилацетатом (3×20 мл) с последующим промыванием насыщенным раствором соли (20 мл) и сушкой над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 6:1), получая указанное в заголовке соединение (43,3 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 5,27 минуты, m/z 394 (M+H), Условие B-1.
<Пример 11>
Этиловый эфир 2-(4-метил-3-фенил-5-(пирролидин-1-ил)-1H-пиразол-1-ил)тиазол-4-карбоновой кислоты
К раствору в N,N-диметилформамиде (170 мкл, производимом Kanto Chemical Formu1a Company), содержащем соединение Ссылочного примера 8 (30 мг), карбонат цезия (47 мг, производимый Wako Pure Chemical Industries, Ltd.), иодид меди(I) (1 мг, производимый Kanto Chemical Formu1a Company), пирролидин (10 мг, производимый Wako Pure Chemical Industries, Ltd.) и 2-ацетилциклогексанон (2 мг, производимый Aldrich Company) добавляют и перемешивают при 80°C на протяжении ночи. Реакционный раствор охлаждают до комнатной температуры и добавляют воду (1 мл), за этим следует экстракция этилацетатом (3×5 мл), промывание насыщенным раствором соли (5 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 5:1), получая указанное в заголовке соединение (3,4 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 6,34 минуты, m/z 383 (M+H), Условие B-1.
<Пример 12>
5-(4-Метил-3,5-дифенил-1H-пиразол-1-ил)пиколиновая кислота
К раствору в N,N-диметилацетамиде (500 мкл, производимом Kanto Chemical Formu1a Company) 4-метил-3,5-дифенил-1H-пиразола, который был синтезирован способом, описанным в литературе (C. Francesca et al., J. Chem. Soc. Perkin Trans. 1 1994, 18, 2533-2536.), фосфат калия (87,5 мг, производимый Wako Pure Chemical Industries, Ltd.), (1S, 2S)-(+)-N,N-диметилциклогексан-1,2-диамин (11,7 мг, производимый Tokyo Chemical Industry Co., Ltd.), иодид меди (7,8 мг, производимый Kanto Chemical Formu1a Company) и метиловый эфир 5-бромпиколиновой кислоты (44,5 мг, производимый Combi-Block Company) добавляют и смесь подвергают облучению микроволнами при 185°C в течение 45 минут. Раствор охлаждают до комнатной температуры и добавляют воду (1 мл) с последующей экстракцией этилацетатом (3×2 мл), промывкой насыщенным раствором соли (5 мл) и сушкой над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 85:15), получая указанное в заголовке соединение (21,5 мг) . ЖХ-МС:время удерживания согласно ВЭЖХ 1,91 минуты, m/z 370 (M+H), Условие C-1.
<Пример 13>
Этиловый эфир 2-{2-(4-метил-3,5-дифенил-1H-пиразол-1-ил)тиазол-4-ил}уксусной кислоты
К раствору в мезитилене (500 мкл, производимом Kanto Chemical Formu1a Company) этилового эфира (2-хлор-4-тиазолил)уксусной кислоты (206 мг), который был синтезирован способом, описанным в литературе (EP 2002-705433), фосфат калия (446 мг, производимый Wako Pure Chemical Industries, Ltd.), MO-PHOS (35 мг, производимый Takasago International Corporation), ацетат палладия (11 мг, производимый Kanto Chemical Formu1a Company) и 4-метил-3,5-дифенил-1H-пиразол (234 мг), который был синтезирован способом, описанным в литературе (C. Francesca et al., J. Chem. Soc. Perkin Trans. 1 1994, 18, 2533-2536.) добавляют и смесь перемешивают при 180°C на протяжении ночи. Реакционный раствор охлаждают до комнатной температуры и добавляют воду (1 мл) с последующей экстракцией этилацетатом (3×2 мл), промыванием насыщенным раствором соли (10 мл) и сушкой над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 2:1), получая указанное в заголовке соединение (73 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 5,83 минуты, m/z 404 (M+H), Условие B-1.
<Пример 14>
2-{(4-Метил-3,5-дифенил-1H-пиразол-1-ил)метил}тиазол-4-карбоновая кислота
К раствору в N,N-диметилформамиде (1 мл, производимом Kanto Chemical Formu1a Company) 4-метил-3,5-дифенил-1H-пиразола (40 мг), который был синтезирован способом, описанным в литературе (C. Francesca et al., J. Chem. Soc. Perkin Trans. 1 1994, 18, 2533-2536.), добавляют при охлаждении льдом гидрид натрия (добавленный вместе с 40% минерального масла, 7,5 мг, производимый Kanto Chemical Formu1a Company) и перемешивают при той же температуре в течение 5 минут. Затем к реакционному раствору добавляют этиловый эфир 2-бромметилтиазол-4-карбоновой кислоты (43 мг), который был синтезирован способом, описанным в литературе (K. Benno et al., Liebigs. Ann. Chem. 1981, 4, 623-632.) и перемешивают при комнатной температуре на протяжении ночи. Затем к реакционному раствору добавляют воду (1 мл), за этим следует экстракция этилацетатом (3×2 мл), промывание насыщенным раствором соли (10 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают ПТСХ (смесь гексан:этилацетат = 2:1), получая указанное в заголовке соединение (5,5 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 4,62 минуты, m/z 376 (M+H), Условие B-1.
<Ссылочный пример 16>
{2-(4-Метил-3,5-дифенил-1H-пиразол-1-ил)тиазол-4-ил}метанол
К раствору в тетрагидрофуране (5 мл, производимом Wako Pure Chemical Industries, Ltd.) соединения Примера 5 (182 мг) добавляют литийалюминийгидрид (36 мг, производимый Kanto Chemical Formu1a Company) при охлаждении льдом и перемешивают при такой же температуре в течение одного часа. К реакционному раствору по каплям добавляют насыщенный водный раствор хлорида аммония (1 мл), затем добавляют сульфат магния и затем смесь перемешивают при комнатной температуре в течение 1 часа с последующей фильтрацией через целит. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 9:1), получая указанное в заголовке соединение (158 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 4,98 минуты, m/z 348 (M+H), Условие B-1.
<Ссылочный пример 17>
2-(4-Метил-3,5-дифенил-1H-пиразол-1-ил)тиазол-4-карбальдегид
К раствору в дихлорметане (7 мл, производимом Kanto Chemical Formu1a Company) соединения Ссылочного примера 16 (158 мг) добавляют периодинан Десса-Мартина (594 мг, производимый LANCASTER) и затем смесь перемешивают при комнатной температуре в течение 1 часа. К реакционному раствору добавляют воду (10 мл), за этим следует экстракция дихлорметаном (3×10 мл), промывание насыщенным раствором соли (20 мл) и сушка над MgSO4. Растворитель выпаривают, получая указанное в заголовке соединение (91 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 5,66 минуты, m/z 346 (M + H), Условие B-1.
<Пример 15>
Этиловый эфир (E)-3-{2-(4-метил-3,5-дифенил-1H-пиразол-1-ил)тиазол-4-ил}акриловой кислоты
К раствору в тетрагидрофуране (2,6 мл, производимом Kanto Chemical Formu1a Company) соединения Ссылочного примера 17 (91 мг) добавляют при 0°С гексаметилдисилазан калия (278 мкл, 1,9M раствор в тетрагидрофуране, производимый Tokyo Chemical Industry Co., Ltd.) и диэтиловый эфир этилфосфоновой кислоты (105 мкл, производимый Tokyo Chemical Industry Co., Ltd.) при 0°C и затем смесь перемешивают при той же температуре на протяжении ночи. К реакционному раствору добавляют 1M хлористоводородную кислоту (10 мл), за этим следует экстракция этилацетатом (3×10 мл), промывание насыщенным раствором соли (20 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 6:1), получая указанное в заголовке соединение (57 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 7,14 минуты, m/z 416 (M+H), Условие B-1.
<Пример 16>
Этиловый эфир 3-{2-(4-метил-3,5-дифенил-1H-пиразол-1-ил)тиазол-4-ил}пропионовой кислоты
К раствору в смеси тетрагидрофурана (200 мкл, производимом Wako Pure Chemical Industries, Ltd.) и метанола (200 мкл, производимого Wako Pure Chemical Industries, Ltd.) соединения Примера 15 (17 мг) добавляют 10% палладий-на-углероде (18 мг, производимый Merck) и затем смесь перемешивают на протяжении ночи в атмосфере водорода. После завершения реакции 10% палладий-на-углероде удаляют фильтрацией и растворитель выпаривают, получая указанное в заголовке соединение (13,7 мг) ЖХ-МС:время удерживания согласно ВЭЖХ 6,23 минуты, m/z 418 (M+H), Условие B-1.
<Пример 17>
Этиловый эфир 2-{5-(4-аминофенил)-4-метил-3-фенил-1H-пиразол-1-ил}тиазол-4-карбоновой кислоты
К раствору в дихлорметане (500 мкл, производимом Wako Pure Chemical Industries, Ltd.) этилового эфира 2-[5-{4-(трет-бутоксикарбониламино)фенил}-4-метил-3-фенил-1H-пиразол-1-ил]тиазол-4-карбоновой кислоты (18,4 мг), который был синтезирован по способу Примера 10, добавляют трифторуксусную кислоту (42 мкл, производимую Wako Pure Chemical Industries, Ltd.) и затем смесь перемешивают при комнатной температуре в течение 3 часов. Затем растворитель выпаривают и полученный остаток очищают ПТСХ (смесь гексан:этилацетат = 2:1), получая указанное в заголовке соединение (5,6 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 4,77 минуты, m/z 405 (M+H), Условие A-1.
<Пример 18>
2-{4-Метил-3-фенил-5-(1H-пирроло-2-ил)-1H-пиразол-1-ил}-1,3-тиазол-4-карбоновая кислота
К раствору в этаноле (500 мкл, производимом Wako Pure Chemical Industries, Ltd.) этилового эфира 2-[5-{1-(трет-бутоксикарбонил)-1H-пиррол-2-ил}-4-метил-3-фенил-1H-пиразол-1-ил]тиазол-4-карбоновой кислоты (20 мг), который был синтезирован по способу Примера 10, добавляют 5M хлористоводородную кислоту (0,5 мл, производимую Kanto Chemical Formu1a Company) и затем смесь перемешивают при комнатной температуре в течение трех часов. Затем к реакционному раствору добавляют 5M водный раствор гидроксида натрия (1 мл производимого Kanto Chemical Formu1a Company) и затем смесь снова перемешивают в течение еще трех часов при той же температуре. Для нейтрализации добавляют 5N хлористоводородную кислоту (0,5 мл, производимую Kanto Chemical Formu1a Company), за этим следует экстракция этилацетатом (3×10 мл), промывание насыщенным раствором соли (1 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают ПТСХ (смесь гексан:этилацетат = 2:1), получая указанное в заголовке соединение (1,1 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 4,46 минуты, m/z 378 (M + H), Условие A-1.
<Пример 19>
2-{4-Метил-3-фенил-5-(1H-пиррол-3-ил)-1H-пиразол-1-ил}-1,3-тиазол-4-карбоновая кислота
К раствору в этаноле (500 мкл, производимом Wako Pure Chemical Industries, Ltd.) этилового эфира 2-[4-метил-3-фенил-5-{1-(триизопропилсилил)-1H-пиррол-3-ил}-1H-пиразол-1-ил]тиазол-4-карбоновой кислоты (5,2 мг), который был синтезирован по способу Примера 10, добавляют 5M водный раствор гидроксида натрия (0,5 мл, производимого Kanto Chemical Formu1a Company) и затем смесь перемешивают при комнатной температуре в течение трех часов. Затем для нейтрализации к реакционному раствору добавляют 5M водную хлористоводородную кислоту (0,5 мл, производимую Kanto Chemical Formu1a Company), за которым следует экстракция этилацетатом (3×10 мл), промывание насыщенным раствором соли (10 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 1:3), получая указанное в заголовке соединение (1,8 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 5,28 минуты, m/z 351 (M+H), Условие A-1.
<Ссылочные примеры № 18-27>
Ниже излагается получение соединений Ссылочных примеров № 18-27. Детальная информация относительно Ссылочных примеров № 18-27 приводится в Таблице 1. Значение символов, включенных в Таблицу 1, представлено ниже.
"Ref."; номер Ссылочного примера, "Str.": структура соединения Ссылочного примера, "S. M. 1": исходный продукт для получения соответствующего соединения Ссылочного примера. Символы, включенные в колонку "S. M. 1", указывают на исходные продукты, перечисленные ниже. "IM.1": 2-метил-1,3-дифенилпропан-1,3-дион (полученный по способу, описанному в Tetrahedron Lett. 43, 2945-2948 (2002)), "IM. 2": 1-(2-метоксиметоксифенил)-3-фенилпропан-1,3-дион (полученный по способу, описанному в Synthesis 3, 178-183 (1988)). Кроме того, что касается коммерчески доступных реагентов, используемых в качестве исходных продуктов, то они представляют собой реагенты, которые соответствуют символу, описанному в колонке “Реагент” Таблицы 2.
"ЖХ-МС" означает данные, полученные благодаря применению комбинированного метода анализа, сочетающего жидкостную хроматографию с масс-спектрометрией. В частности, к ним относятся "method", "R. T." и "MS", описанные ниже.
"Method"; тип оборудования ЖХМС. Условие "B-1" соответствует используемой инструментальной системе "ЖХМС" и Условию проведения ЖХ-разделения (B-1), описанным выше. Аналогично условие "C-1" соответствует используемой инструментальной системе "ЖХМС" и Условию проведения ЖХ-разделения (C-1), описанным выше.
"R. T."; время удерживания согласно ЖХМС (единица; мин);
"MS"; данные масс-спектра (указаны молекулярные ионы как M+H, так и M-H), при условии, что "N.D" указывает на невозможность обнаружения пиков молекулярных ионов.
"Synth. Method"; способ получения соответствующего соединения Ссылочного примера. Символы, включенные в колонку "Synth. Method", указывают на способы получения, описанные ниже. "A" означает способ получения, представленный в Ссылочном примере 1, и "D" означает способ получения, представленный в Ссылочном примере 4.
Символы, которые представлены в Таблице 2, имеют нижеуказанные значения.
"Reagent"; символы, которые соответствуют реагенту, который используют в колонке "S. M. 1" Таблицы 1, "Structure"; структура реагента, "Supl."; поставщик используемого реагента: что касается производителей используемых реагентов, то они иногда указываются нижеследующими аббревиатурами: производимый Tokyo Chemical Industry Co., Ltd.; "TCI", производимый Aldrich Company; "Ald", производимый Wako Pure Chemical Industries, Ltd.; "WAKO", производимый Alfa Aesar Co.; "AAesar".
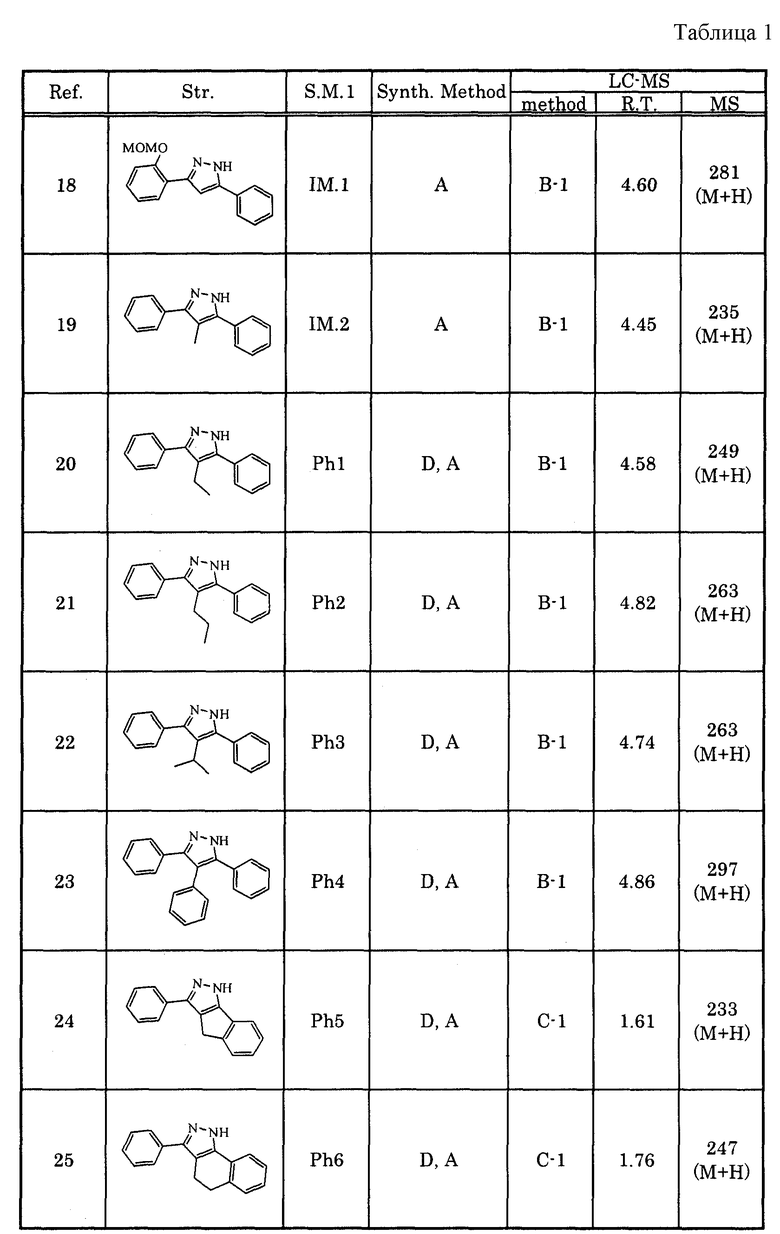
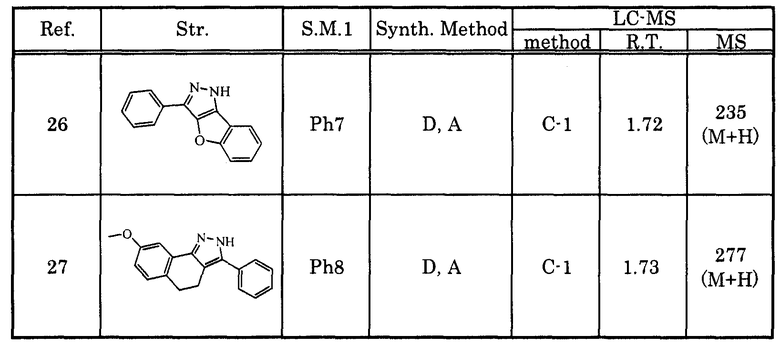
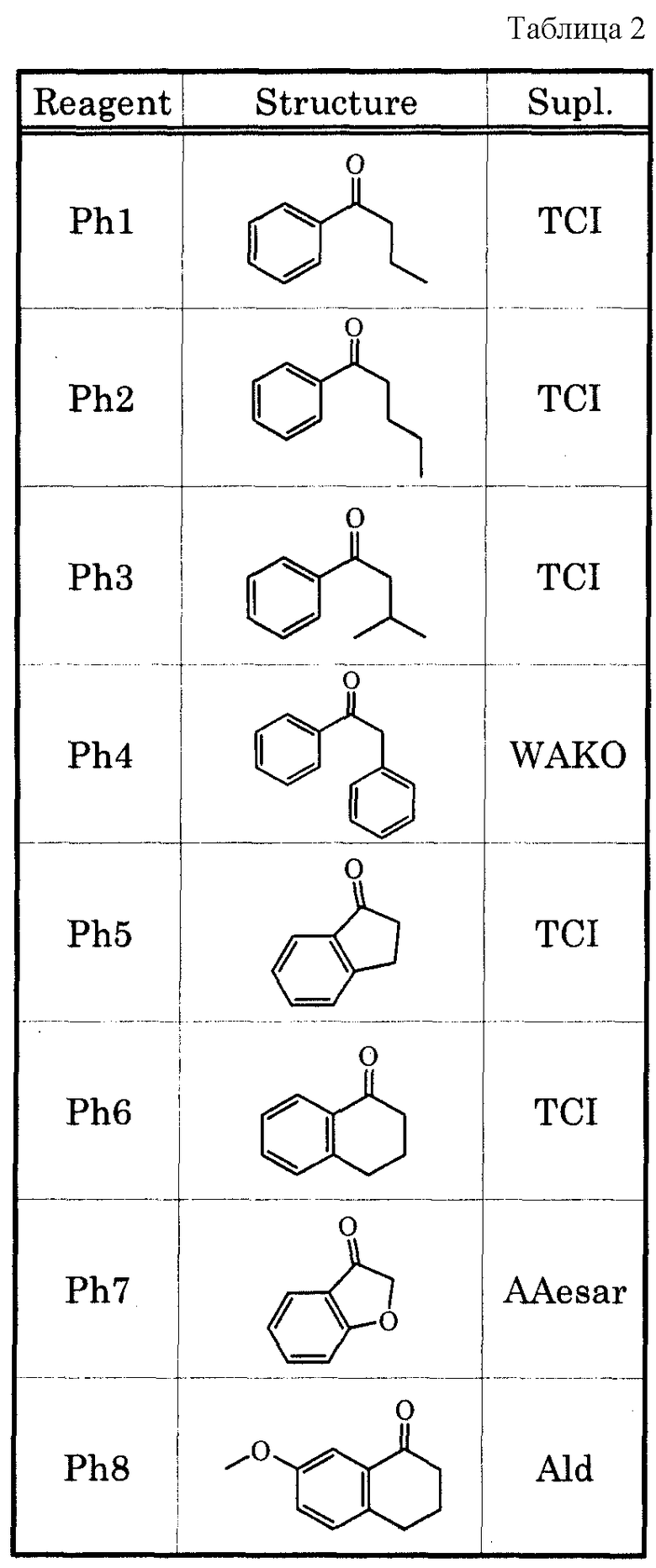
<Примеры № 20-128>
Ниже описывается получение соединений Примеров № 20-128. Детальная информация относительно Примеров № 20-128 приводится в Таблице 3. Значение символов, включенных в Таблицу 3, представлено ниже.
"Exp."; номер примера, "Str."; структура соединения Примера; "S. M. 1" и "S. M. 2"; исходные продукты для получения соответствующих соединений Примеров. Символы, описанные в колонках "S. M. 1" и "S. M. 2", обозначают нижеприведенные исходные продукты. "IM. 3"; 2-фтор-1,3-дифенилпропан-1,3-дион (полученный по способу, описанному в Tetrahedron 45, 6003-6010 (1989)), "IM. 4"; этиловый эфир 2-бром-4-тиазолкарбоновой кислоты (полученный по способу, описанному в J. Org. Chem. 61, 4623-4633 (1996)). Кроме того, когда исходные продукты представляют собой соединения, описанные в Примерах или Ссылочных примерах данного изобретения, то их обозначают номером такого Примера или номером Ссылочного примера (т.е. "Exp. номер Примера" для номера Примера и "Ref. номер Ссылочного примера" для номера Ссылочного примера; например, "Ref. 2" обозначает соединение Ссылочного примера 2.). Кроме того, что касается коммерчески доступных реагентов, используемых в качестве исходных продуктов, то они представляют собой реагенты, которые соответствуют символам, описанным в колонке “Реагент” Таблицы 4. Если имеется только один исходный продукт, то приводится только этот соответствующий исходный продукт.
"ЖХ-МС" означает данные, полученные благодаря применению комбинированного метода анализа, сочетающего жидкостную хроматографию с масс-спектрометрией. В частности, к ним относятся "method", "R. T." и "MS", описанные ниже.
"Method"; тип оборудования ЖХМС. Условие "А-1" соответствует используемой инструментальной системе "ЖХМС" и Условию проведения ЖХ-разделения (А-1), описанным выше. Аналогично условие "В-1" соответствует используемой инструментальной системе "ЖХМС" и Условию проведения ЖХ-разделения (В-1), описанным выше. Аналогично условие "C-1" соответствует используемой инструментальной системе "ЖХМС" и Условию проведения ЖХ-разделения (C-1), описанным выше. Кроме того, условие "A-2" соответствует используемой инструментальной системе "ЖХМС" и Условию проведения ЖХ-разделения (A-2), описанным выше;
"R. T."; время удерживания согласно ЖХМС (единица; мин);
"MS"; данные масс-спектра (m/z) (указаны молекулярные ионы как M+H, так и M-H), при условии, что "N.D" указывает на невозможность обнаружения пиков молекулярных ионов.
"Synth. Method"; способ получения соответствующего соединения Примера. Символы, включенные в колонку "Synth. Method", указывают на способы получения, описанные ниже. "A" обозначает способ получения, представленный в Ссылочном примере 1, "B" означает способ получения, представленный в Ссылочном примере 2, "C" обозначает способ получения, представленный в Ссылочном примере 3, "D" обозначает способ получения, представленный в Ссылочном примере 4, "a" обозначает способ получения, представленный в Примере 1, "b" означает способ получения, представленный в Примере 2, "c" обозначает способ получения, представленный в Примере 3, "d" обозначает способ получения, представленный в Примере 4, "e" обозначает способ получения, представленный в Примере 5, "f" обозначает способ получения, представленный в Примере 6, "g" означает способ получения, представленный в Примере 8, "h" означает способ получения, представленный в Примере 9, "i" означает способ получения, представленный в Примере 10, "j" означает способ получения, представленный в Примере 12, и "k" означает способ получения, представленный в Примере 14, и соединения могут быть синтезированы, ссылаясь на соответствующие примеры.
Символы, включенные в Таблицу 4, имеют нижеприведенные значения.
"Reagent" (реагент); символы, которые соответствуют реагентам, используемым в колонках "S. M. 1" и "S. M. 2" Таблицы 1, "Structure"; структура реагента, "Supl."; производитель используемого реагента: что касается производителей используемых реагентов, то их иногда указывают, используя нижеследующие аббревиатуры - производимый Tokyo Chemical Industry Co., Ltd.; "TCI", производимый Aldrich Company; "Ald", производимый Kanto Chemical Formu1a Company; "KANTO", производимый Wako Pure Chemical Industries, Ltd.; "WAKO", производимый Lancaster, Co.; "LANC", производимый Acros Organics; "Acros", производимый Alfa Aesar Co.; "AAesar", производимый Boron Molecule; "B Mol", производимый Combi-Block; "Comb", производимый Fluoro Chem; "Fchem", производимый Frontier; "Front", производимый Ryscor; "Rysc".
Далее, аббревиатуры, упоминаемые в абзацах текста и таблицах, имеют нижеследующие значения. Me: метил, Et: этил, CHO: формил, COOH: карбокси, NH2: амино, CF3: трифторметил, F: фтор, Cl: хлор, Br: бром, I: йод, OMe: метокси, OH: гидрокси, MOM: метоксиметокси.
Цифры, стоящие перед каждым заместителем, обозначают положение замещения. Цифры, представленные с "-" (дефисом) перед ароматическим циклом, обозначают положение замещения на ароматическом цикле. Термин "(Z)", представленный в химических названиях или структурах, указывает на то, что заместители при двойной связи находятся в Z-конфигурации. Термин "(E)" указывает на то, что заместители при двойной связи находятся в E-конфигурации.
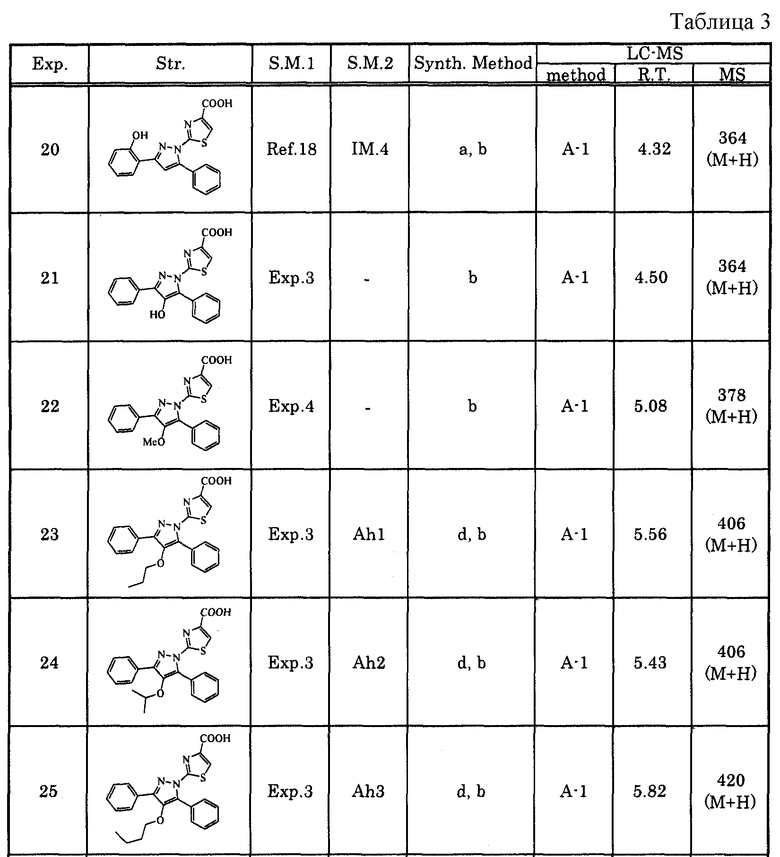

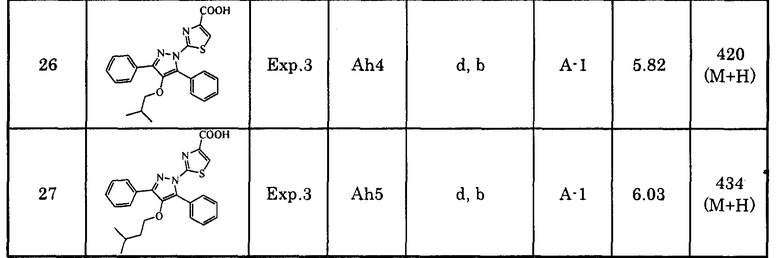
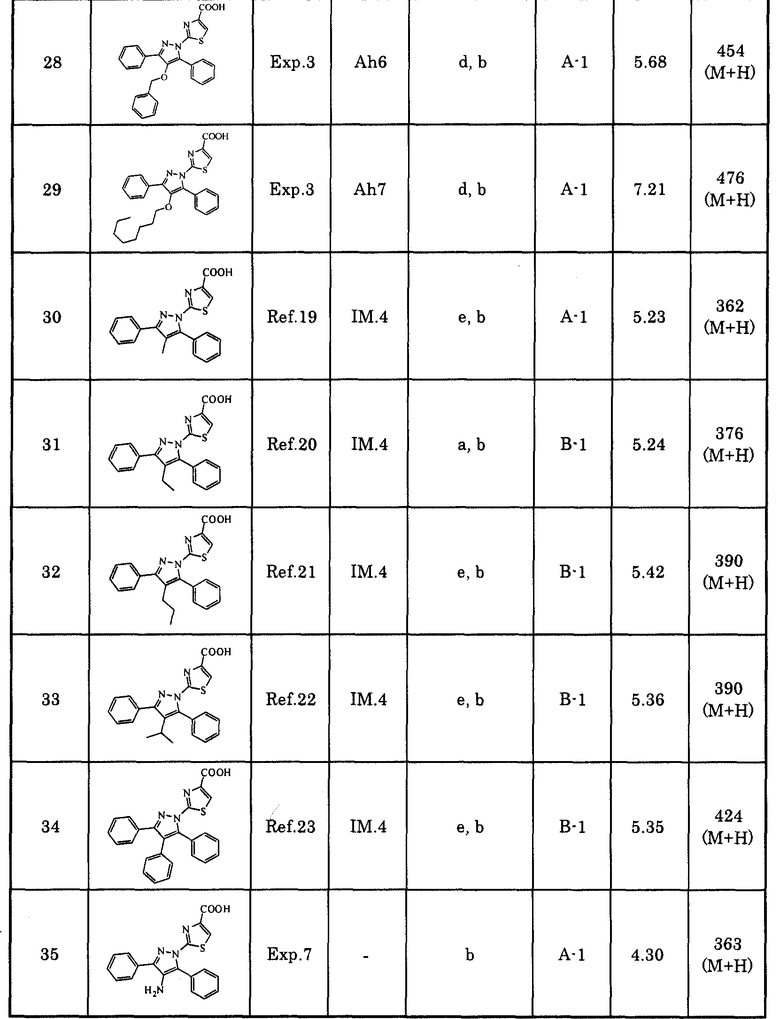
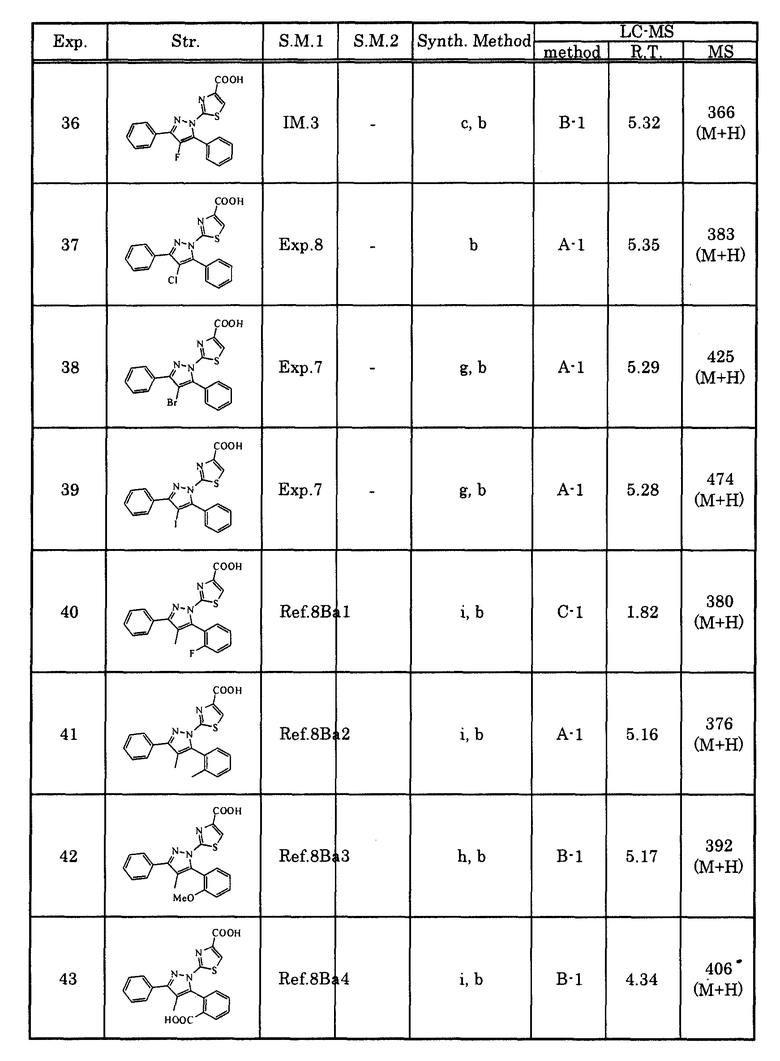
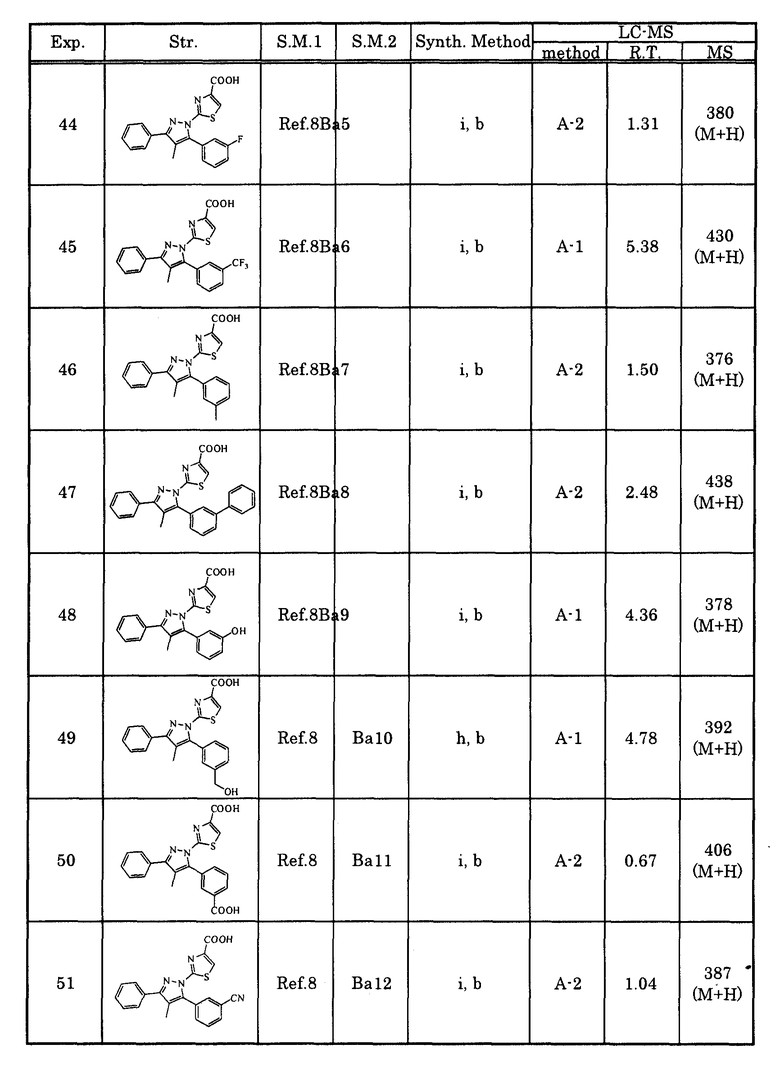
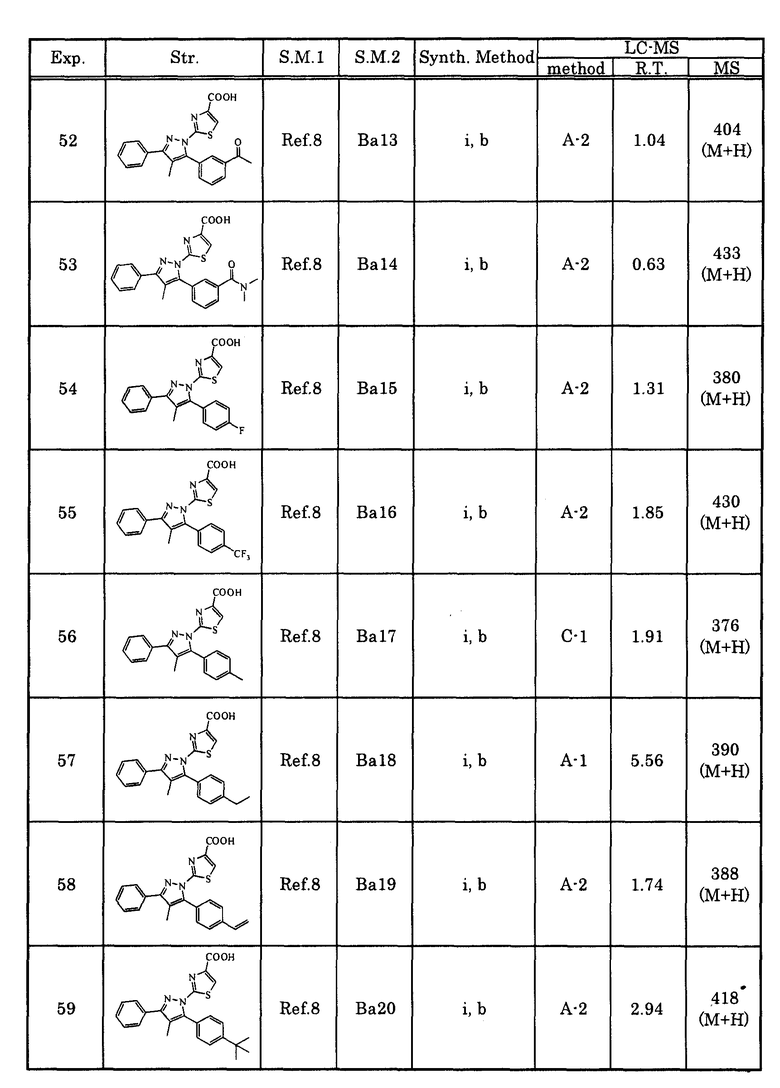
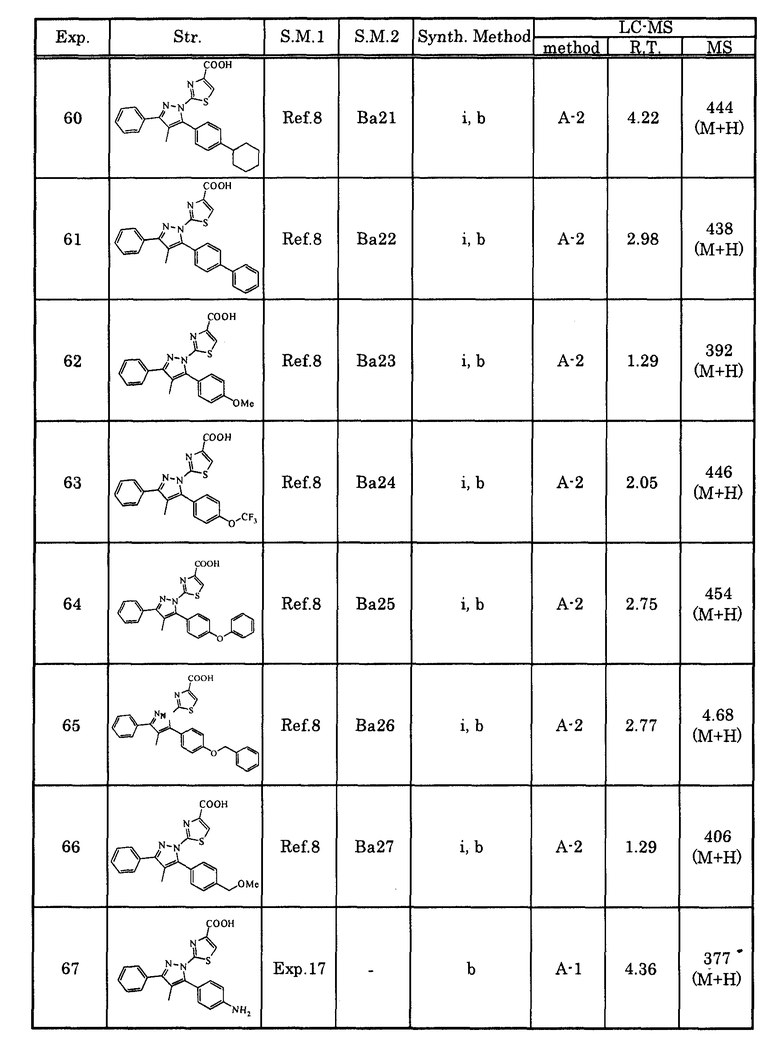
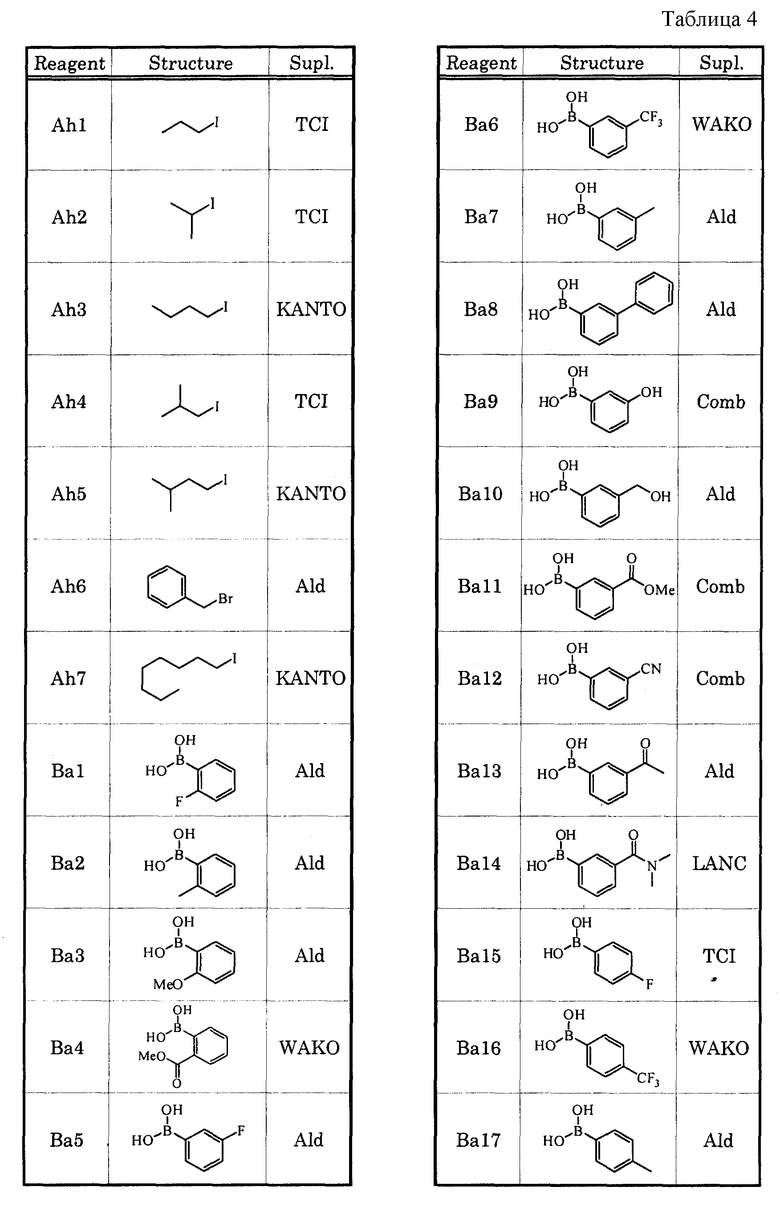
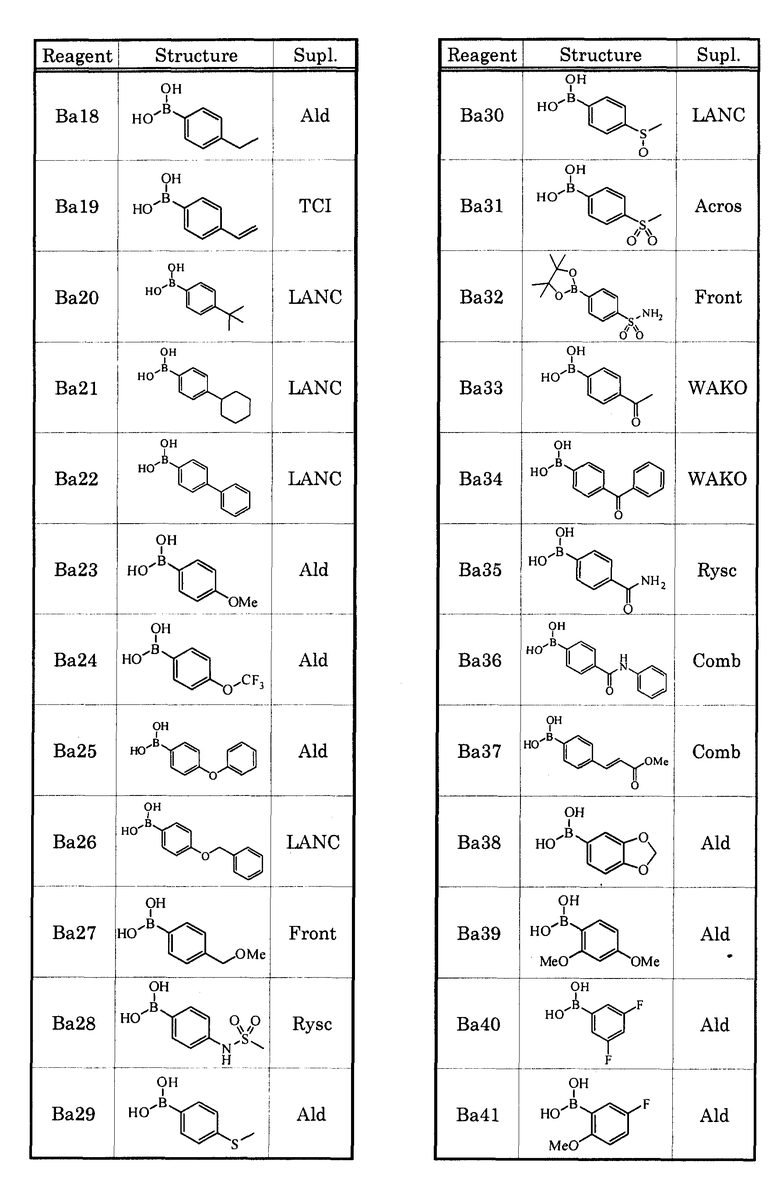
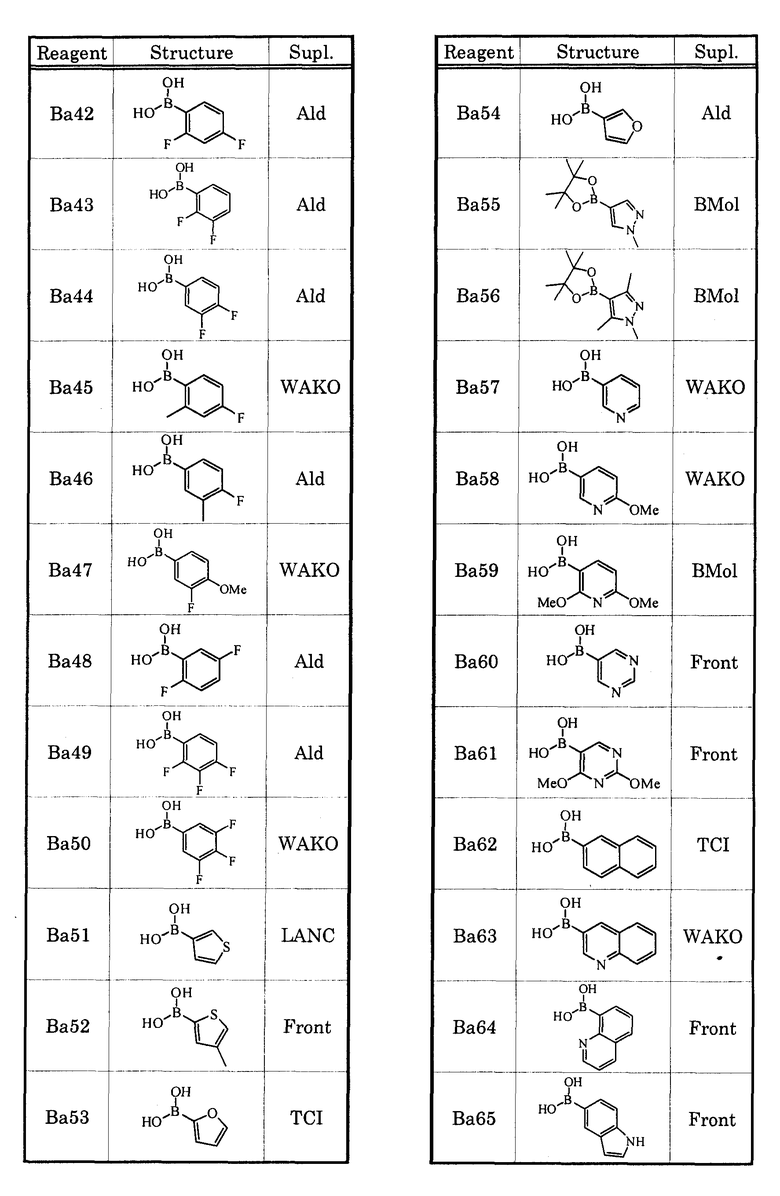
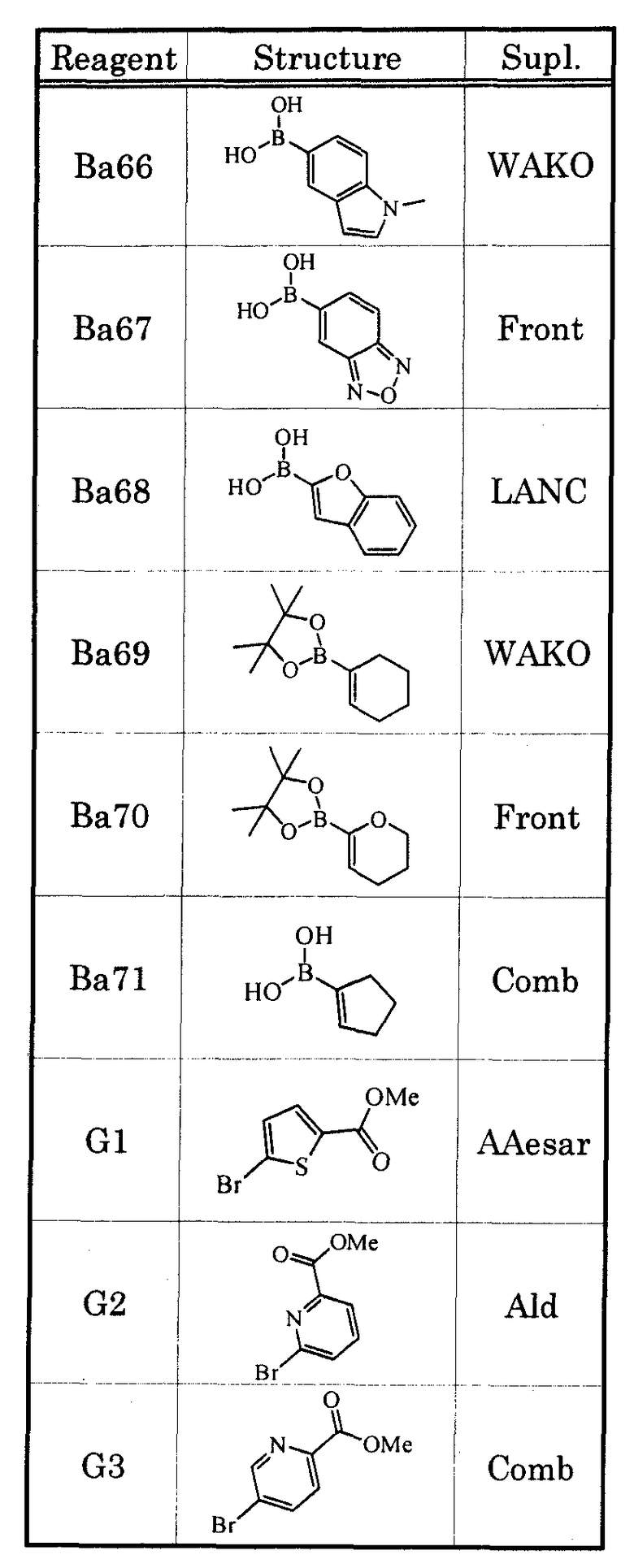
<Пример 129>
Метиловый эфир 2-(4-амино-3,5-дифенил-1H-пиразол-1-ил)тиазол-4-карбоновой кислоты
К раствору в метаноле (10 мл, производимом Wako Pure Chemical Industries, Ltd.) соединения Примера 30 (250 мг) добавляют гидрат п-толуолсульфокислоты (12 мг, производимый Tokyo Chemical Industry Co., Ltd.). После перемешивания при комнатной температуре в течение 1 часа добавляют гидрат гидразина (73 мкл, производимый Tokyo Chemical Industry Co., Ltd.) и кипятят с обратным холодильником на протяжении ночи. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 70:30), получая указанное в заголовке соединение (259 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 1,43 минуты, m/z (M+H) 377, Условие C-1.
<Пример 130>
Метиловый эфир 2-{4-(метиламино)-3,5-дифенил-1H-пиразол-1-ил}тиазол-4-карбоновой кислоты
<Пример 131>
Метиловый эфир 2-{4-(диметиламино)-3,5-дифенил-1H-пиразол-1-ил}тиазол-4-карбоновой кислоты
К раствору в дихлорэтане (350 мкл, производимом Kanto Kagaku Company) соедиения Примера 4 (50 мг) добавляют 36% водный раствор формальдегида (33 мг, производимого Kanto Kagaku Company). После перемешивания при комнатной температуре в течение 1 часа выпаривают растворитель из реакционного раствора. Затем добавляют дихлорэтан (350 мкл, производимый Kanto Kagaku Company), уксусную кислоту (100 мкл, производимую Wako Pure Chemical Industries, Ltd.) и натрийтриацетоксиборгидрид (89 мг, производимый Aldrich Company) и смесь перемешивают при комнатной температуре на протяжении ночи. К реакционному раствору добавляют воду (10 мл), за этим следует экстракция этилацетатом (3×10 мл), промывание насыщенным раствором соли (10 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 9:1). В результате этого получают монометиловую форму и диметиловую форму, в качестве высокополярного или слабополярного соединения, в количестве 4,5 мг и 11,7 мг соответственно. Монометиловая форма (Пример 130): ЖХ-МС:время удерживания согласно ВЭЖХ 1,70 минуты, m/z (M+H) 391, Условие C-1. Диметиловая форма (Пример 131): ЖХ-МС:время удерживания согласно ВЭЖХ 2,03 минуты, m/z (M+H) 405, Условие C-1.
<Пример 132>
Метиловый эфир 2-(4-йод-3,5-дифенил-1H-пиразол-1-ил)тиазол-4-карбоновой кислоты
К раствору в ацетонитриле (5,0 мл, производимом Wako Pure Chemical Industries, Ltd.) соединения Примера 4 (200 мг) добавляют трет-бутиловый эфир азотистой кислоты (191 мкл, производимый Acros Organics) и йод (405 мг, производимый Kanto Kagaku Company), затем кипятят с обратным холодильником в течение 1 часа. Реакционный раствор охлаждают до комнатной температуры. Затем к смеси добавляют воду (15 мл), за этим следует экстракция этилацетатом (3×20 мл), промывание насыщенным раствором соли (20 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 80:20), получая указанное в заголовке соединение (130 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 1,90 минуты, m/z (M+H) 488, Условие C-1.
<Пример 133>
Метиловый эфир 2-{3,5-дифенил-4-(трифторметил)-1H-пиразол-1-ил}тиазол-4-карбоновой кислоты
К раствору в N,N-диметилформамиде (1,5 мл, производимом Kanto Kagaku Company) соединения Примера 132 (130 мг) добавляют иодид меди(I) (15 мг, производимый Kanto Kagaku Company) и метиловый эфир 2,2-дифтор-2-(фторсульфонил)уксусной кислоты (86 мкл, производимый Wako Pure Chemical Industries, Ltd.) и перемешивают при 100°C на протяжении ночи. К реакционному раствору добавляют воду (5 мл), за этим следует экстракция этилацетатом (3×10 мл), промывание насыщенным раствором соли (10 мл) и сушка над MgSO4. Растворитель выпаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (смесь гексан:этилацетат = 80:20), получая указанное в заголовке соединение (49,5 мг). ЖХ-МС:время удерживания согласно ВЭЖХ 1,85 минуты, m/z (M+H) 430, Условие C-1.
<Примеры 134-136>
Ниже описывается получение соединений Примеров № 134-136. Детальная информация относительно Примеров № 134-136 приводится в Таблице 5. Значение символов, представленных в Таблице 5, приводится ниже.
"Exp."; Номер примера, "Str."; структура соединения примера, "S.M."; Исходный продукт для получения соответствующего соединения.
Кроме того, когда исходные продукты представляют собой соединения, описанные в Примерах или Ссылочных примерах данного изобретения, то они обозначены номером такого Примера или номером Ссылочного примера (т.е. "Exp. номер Примера" для номера Примера).
"ЖХ-МС" означает данные, полученные благодаря применению комбинированного метода анализа, сочетающего жидкостную хроматографию с масс-спектрометрией. В частности, к ним относятся "method", "R. T." и " MS", описанные ниже.
"Method"; тип оборудования ЖХМС. Условие "A-1" соответствует используемой инструментальной системе “ЖХМС” и Условию проведения ЖХ-разделения (А-1), описанным выше.
"R. T."; время удерживания согласно ЖХМС (единица; мин);
"MS"; данные масс-спектра (m/z) (указаны молекулярные ионы как (M+H), так и (M-H), при условии, что "N.D" указывает на невозможность обнаружения пиков молекулярных ионов.
"Synth. Method"; способ получения соответствующего соединения Примера. Символы, включенные в колонку "Synth. Method", указывают на способы получения, описанные ниже. "b" означает способ получения, представленный в Примере 2, и соединения могут быть синтезированы, ссылаясь на соответствующие примеры.
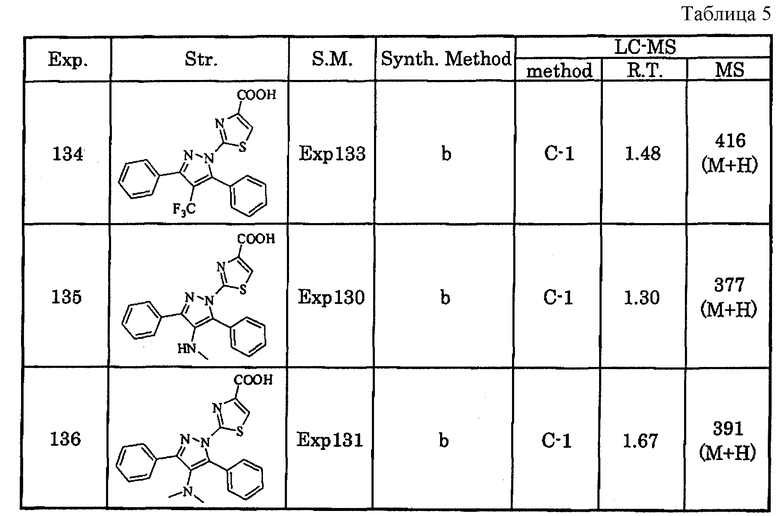
<Тест-пример 1>
Измерение антагонистической активности, используя клетки, экспрессирующие человеческий рецептор EP1
Для исследования антагонистической активности соединений по данному изобретению в отношении рецептора EP1 измеряют активность репортера, используя клетки HEK293, в которых стабильно экспрессируется человеческий рецептор EP1.
(1) Способ измерения
В результате изучения базы данных по справочным последовательностям для рецептора Е простагландина получают генетическую информацию относительно человеческого рецептора EP1 (NM_000955). Исходя из информации по этой последовательности, ген рецептора EP1 человека клонируют с помощью ПЦР, используя человеческую кДНК в качестве матрицы, и другим общим способом, с получением человеческого рецептора EP1. Затем создают клетки HEK293, в которых стабильно экспрессируется рецептор, вместе с репортерным геном (SRE-Люцифераза), в который введен сывороточный ответственный элемент (SRE) в область, расположенную в обратном направлении по ходу транскрипции гена фермента люциферазы светляков. Полученные клетки добавляют в 96-луночный планшет (5×104 клеток/лунка) и культивируют в течение одного дня. В планшет для инициирования реакции добавляют PGE2 (200 нМ, конечная концентрация 10 нМ) и испытуемое соединение (в количестве 1/20, 20× конечной концентрации). После предоставления возможности реакции протекать при 37°C в течение 6 часов среду аспирируют, добавляют люминесцирующее вещество и измеряют активность репортера.
(2) Результат измерения
Соединения, которые были подвергнуты испытанию, выражают как "Exp. номер примера", используя номер примера. Такая система выражения используется и ниже.
Репрезентативные соединения по данному изобретению демонстрируют высокую антагонистическую активность во время испытания с целью выявления их антагонистической активности, использующего клетки, экспрессирующие человеческий рецептор EP1.
Согласно проведенному испытанию с целью выявления антагонистической активности, использующему клетки, экспрессирующие человеческий рецептор EP1 соединения, которые были подвергнуты испытанию (№ испытуемых соединений: Exp. 30, Exp. 35, Exp. 36, Exp. 37, Exp. 38, Exp. 44, Exp. 54, Exp. 80, Exp. 92, Exp. 94, Exp. 95, Exp. 105, Exp. 110, Exp. 111, Exp. 114, Exp. 116, Exp. 117), демонстрируют значение IC50 такое же или меньше чем 0,1 мкМ. Далее, другие соединения, которые также были подвергнуты испытанию (№ испытуемых соединений: Exp. 20, Exp. 39, Exp. 48, Exp. 88, Exp. 90, Exp. 91, Exp. 128), демонстрируют значение IC50 от 0,3 до 0,1 мкМ в соответствии с проведенным испытанием с целью выявления антагонистической активности, использующим клетки, экспрессирующие человеческий рецептор EP1. Еще дальше, другие соединения, которые также были подвергнуты испытанию (№ испытуемых соединений: Exp. 14, Exp. 42, Exp. 127), показывают значение IC50 от 1,0 до 0,3 мкМ в соответствии с проведенным испытанием с целью выявления антагонистической активности, использующим клетки, экспрессирующие человеческий рецептор EP1.
<Тест-пример 2>
Измерение антагонистической активности, используя клетки, экспрессирующие человеческий рецептор EP1
Для исследования антагонистической активности соединений по данному изобретению в отношении рецептора EP1 измеряют внутриклеточный Ca2+, используя клетки HEK293, в которых стабильно экспрессируется человеческий рецептор EP1.
(1) Способ измерения
Клетки, экспрессирующие человеческий рецептор EP1, суспендируют в буфере для анализа до концентрации 5×106 клеток/мл, добавляют Puronic F-127 (конечная концентрация 0,2%) и Fura 2-AM (конечная концентрация 5 мкМ), с последующей инкубацией при 37°C в течение 30 минут. После промывания дважды буфером для анализа клетки снова суспендируют в буфере для анализа до концентрации 1×106 клеток/60 мкл и затем переносят в 96-луночный, предназначенный для работы в условиях УФ-облучения, планшет (1×106 клеток/60 мкл/лунка). После этого, используя скрининговую систему с флуоресцирующим химическим веществом (FDSS4000, Hamamatsu Photonics K.K.), измеряют концентрацию внутриклеточного Ca2+ после добавления 20 мкл каждого из испытуемых соединений и PGE2 (5× конечной концентрации для обоих). Концентрацию Ca2+ измеряют, определяя интенсивность флуоресценции после облучения при двух длинах волн возбуждения, т.е. 340 и 380 нм.
Кроме того, антагонистическую активность по отношению к EP1 вычисляют в виде отношения (%) увеличения ингибирования концентрации внутриклеточного Ca2+ к PGE2 (10 нМ).
Буфер для анализа: 20 мМ HEPES/KOH (pH 7,4), 115 мМ NaCl, 5,4 мМ KC1, 0,8 мМ MgCl2, 0,8 мМ CaCl2, 13,8 мМ D-глюкозы, 0,1% BSA (бычий сывороточный альбумин)
(2) Результат измерения
Репрезентативные соединения по данному изобретению демонстрируют превосходную антагонистичесую активность во время анализа на внутриклеточный Ca2+.
Согласно анализу на внутриклеточный Ca2+ соединения, которые были подвергнуты испытанию (№ испытуемых соединений: Exp. 35, Exp. 38, Exp. 111, Exp. 114, Exp. 116), демонстрируют значение IC50, такое же или меньше чем 0,3 мкМ. Далее, другие соединения, которые также были подвергнуты испытанию (№ испытуемых соединений: Exp. 30, Exp. 36, Exp. 37, Exp. 94, Exp. 95), демонстрируют значение IC50 от 1,0 до 0,3 мкМ в соответствии с анализом на внутриклеточный Ca2+. Еще дальше, другие соединения, которые также были подвергнуты испытанию (№ испытуемых соединений: Exp. 20, Exp. 39), демонстрируют значение IC50 от 3,0 до 1,0 мкМ согласно анализу на внутриклеточный Ca2+
<Тест-пример 3>
Тест на связывание с рецептором, использующий клетки, экспрессирующие человеческий рецептор EP1
Измеряют ингибирующую активность испытуемых соединений в отношении связывания [3H]PGE2 в клетках HEK293, стабильно экспрессирующих человеческий рецептор EP1.
(1) Способ измерения
Создают клетки HEK293, которые стабильно экспрессируют человеческий рецептор EP1, используя ген человеческого рецептора EP1, и затем из них получают фракцию мембран. Полученную таким образом фракцию мембран инкубируют при 30°C в течение 90 минут с реакционным раствором (200 мкл/лунка), который содержит испытуемое соединение и [3H]PGE2. После завершения реакции реакционный раствор аспирируют при пониженном давлении и улавливают [3H]PGE2, связанный с мембранной фракцией, используя кассетный фильтр P1ateg F/C (производимый Packard) и считывают связанную радиоактивность с помощью жидкого сцинтиллятора.
Значение Kd получают из кривой Scatchard. Неспецифическое связывание получают из связывания в присутствии избыточного количества (10 мкМ) PGE2, немеченного радиоактивным изотопом. Для измерения ингибирующей активности испытуемого соединения в отношении связывания с [3H]PGE2 добавляют [3H]PGE2 (1 нМ) и различные концентрации испытуемого соединения. При этом для всех реакций используют буфер, описанный ниже.
Буфер; 10 мМ MES/NaOH (pH 6,0), 10 мМ MgCl2, 1 мМ EDTA (этилендиаминтетрауксусная кислота), 0,1% BSA (бычий сывороточный альбумин)
Константу диссоциации соединений, т.е. Ki, получают согласно нижеследующему уравнению. В этом отношении [C] означает концентрацию [3H]PGE2, которую используют для теста на ингибирование связывания (1 нМ для данного испытания):
Ki=IC50/(1+[C]/Kd).
(2) Результат измерения
Репрезентативные соединения по данному изобретению демонстрируют превосходную активность во время проведения испытания на ингибирование связывания [3H]PGE2.
Согласно испытанию на ингибирование связывания [3H]PGE2 соединения, которые были подвергнуты испытанию (№ испытуемых соединений: Exp. 30, Exp. 35), показывают значение Ki, такое же или меньше чем 0,3 мкМ.
<Тест-пример 4>
Активность в расслаблении гладкой мышцы мочевого пузыря у крысы
Активность в расслаблении гладкой мышцы мочевого пузыря у крысы может быть определена, ссылаясь на способ, разработанный Maggi, и др. (Eur. J. Pharmacol. 152, p. 273-279 (1988)). В частности, образец гладкой мышцы получают из мочевого пузыря, выделенного у крысы, самца линии SD, и измеряют способность к изометрическому сокращению в ванне для органов. После сокращения в присутствии 3×10-7M PGE2 соединение, подлежащее испытанию, растворяют в ДМСО и добавляют в ванну для органов при конечной концентрации в диапазоне от 10-8M до 10-5M. В результате этого можно определить активность соединения в расслаблении мышцы.
<Тест-пример 5>
Пролонгирование интервала мочеиспускания у крысы, находящейся в состоянии наркоза - I
Активность в пролонгировании интервала между мочеиспусканиями у крысы, находящейся под наркозом, можно определить, ссылаясь на способ, разработанный Maggi, и др. (Eur. J. Pharmacol. 145, p. 105-112 (1988)). В частности, крысу, женскую особь линии SD, подвергают наркозу уретаном, фиксируют в плоском положении и вводят катетер через наружное отверстие мочеиспускательного канала. Используя трехходовой запорный кран, катетер соединяют с датчиком давления и шприцевым насосом. При проведении вливания физиологического раствора, содержащего 100 мкМ PGE2, в мочевой пузырь с постоянной скоростью производят запись цистометрограммы. После подтверждения устоявшегося интервала мочеиспускания, порогового давления мочеиспускания и максимального давления опорожнения мочевого пузыря растворитель или соединение, подлежащее испытанию, вводят в левую бедренную вену для того, чтобы можно было определить активность в пролонгировании интервала мочеиспускания как эффективность соединения, действующего как лекарственное средство.
<Тест-пример 6>
Пролонгирование интервала мочеиспускания у крысы, находящейся под наркозом - II
Активность в пролонгировании интервала между мочеиспусканиями у крысы, находящейся под наркозом, определяют, ссылаясь на способ, разработанный Maggi, и др. (Eur. J. Pharmacol. 145, p. 105-112 (1988)). В частности, крысу, женскую особь линии SD, подвергают наркозу уретаном, фиксируют в плоском положении и вводят катетер через наружное отверстие мочеиспускательного канала. Используя трехходовой запорный кран, катетер соединяют с датчиком давления и шприцем-насосом. При проведении вливания физиологического раствора, содержащего 0,2% уксусной кислоты, в мочевой пузырь с постоянной скоростью производят запись цистометрограммы. После подтверждения достижения устоявшегося интервала мочеиспускания, порогового давления мочеиспускания и максимального давления опорожнения мочевого пузыря растворитель или соединение, подлежащее испытанию, вводят в левую бедренную вену и определяют активность в пролонгировании интервала мочеиспускания как эффективность соединения, действующего как фармацевтическое средство. Каждая группа включает пять животных. В результате этого было обнаружено, что репрезентативные соединения по данному изобретению имеют превосходную эффективность в пролонгировании интервала мчеиспускания. Результаты суммированы в Таблице 6.
<Тест-пример 7>
Активность в пролонгировании интервала мочеиспускания у бодствующей крысы разпознать
Активность в пролонгировании интервала мочеиспускания у бодрствующей крысы можно определить, ссылаясь на способ, разработанный Shinozaki и др. (Biomed. Res. 26(1), p. 29-33 (2005)). В частности, мочевой пузырь крысы подвергают действию анестезии, используя галотан. В область дна мочевого пузыря вводят катетер, в то время как другой конец выводят из брюшной полости и соединяют с датчиком давления и инфузионным насосом. Помимо этого, катетер вводят в яремную вену животного. Крысу помещают в клетку для фиксации экспериментальных животных и после выхода из анестезированного состояния в мочевой пузырь через катетер мочевого пузыря вливают физиологический раствор и и производят запись цисторетрограммы (ниже в данном контесте, аббревиатура "CMG"). Через два-три часа инфузионный раствор мочевого пузыря заменяют на физиологический раствор, содержащий 0,2% уксусной кислоты, и затем вновь осуществляют запись CMG. Через один-два часа после замещения инфузионного раствора растворитель или соединение, подлежащее испытанию, вводят в яремную вену и определяют активность в пролонгировании интервала мочеиспускания при введении уксусной кислоты как эффективность соединения, действующего как лекарственное средство.
<Тест-пример 8>
Измерение частоты мочеиспускания у крысы (в состоянии бодрствования)
Частоту мочеиспускания у крысы можно измерить, ссылаясь на метод Oka и др. (Jpn. J. Pharmacol. 87, p. 27-33 (2001)). В частности, крысу помещают в обменную клетку для исследования метаболизма и выделяемую мочу постоянно собирают и взвешивают. Каждую другую (порцию) массу мочи можно считать частотой мочеиспускания и также разницу в общей массе можно считать общей массой выделившейся мочи. В этом отношении известно, например, что учащенное мочеиспускание может быть вызвано интраперитонеальным введением циклофосфамида (Lecci et al., Br. J. Pharmacol. 130, p. 331-338 (2000)), травмой спинного мозга (Kamo et al., Am. J. Physiol. Renal Physiol. 287, p. F434-F441 (2004)) или инфарктом головного мозга вследствие лигирования средней мозговой артерии (Yokoyama et al., J. Urol., 174, p. 2032-2036 (2005)). В модель учащенного мочеиспускания, созданную таким образом, вводят перорально растворитель или соединение, подлежащее испытанию, и терапевтическое действие соединения можно определить, принимая во внимание снижение частоты мочеиспускания.
<Тест-пример 9>
Терапевтическое действие на симптомы раздражения мочевого пузыря и гиперактивного мочевого пузыря, вызванного синдромом инфравезикальной обструкции
Модель синдрома инфравезикальной обструкции (BOO) можно создать, ссылаясь на способ Malmgren и др. (J. Urol. 137, p. 1291-1294 (1987)). Через шесть недель мочевой пузырь модели BOO крысы подвергают воздействию анестезии. В область дна мочевого пузыря вводят катетер, в то время как другой конец выводят с тыльной стороны цервикальной области. Помимо этого, катетер вводят в яремную вену. Через два дня крысу помещают в клетку для фиксации экспериментальных животных и физиологический раствор вливают через катетер мочевого пузыря и производят запись цистометрограммы. Растворитель или испытуемое соединение вливают внутривенно и определяют снижение числа сокращений, не приводящих к опорожнению мочевого пузыря (NVC), почти не сопровождающихся мочеиспусканием, как эффективность действия соединения, действующего как фармацевтическое средство.
<Тест-пример 10>
Используя модель поллакиурии у крысы, у которой учащенное мочеиспускание вызвано инфузией простагландина E2 в мочевой пузырь (Takeda et al., Neurourol. Urodyn. 21, p. 558-565 (2002)) или инфузией АТФ в мочевой пузырь (Atiemo et al. Urology 65, p. 622-626 (2005)), можно оценить терапевтическое действие соединения как лекарственного средства, следя за увеличением частоты мочеиспускания или увеличением инфузионного количества (объем мочевого пузыря) в соответствии с внутривенным введением испытуемого соединения во время цистометрического измерения. Помимо этого, терапевтическое действие соединения как лекарственного средства можно оценить, следя за снижением частоты мочеиспускания после введения испытуемого соединения во время проведения испытания по измерению частоты мочеиспускания.
<Тест-пример 11>
Оценка аналгетической активности в модели лигирования седалищного нерва (Bennett модель).
Аналгетическую активность в модели лигирования седалищного нерва у крысы (Bennett модель) можно определить, ссылаясь на способ Kawahara и др. (Anesth. Analg. 93, p. 1012-1017 (2001)).
[Создание модели]
Крысу, самца линии SD (с массой тела 200-250 г, Charles River Corporation, Japan), анестезируют пентобарбиталом натрия (50 мг/кг, внутрибрюшинно) и, положив ее на живот, делают разрез непосредственно над правым бедром. С центральной области бедра отрезают двухглавую мышцу бедра и обнажают седалищный нерв (приблизительно 5 мм), стараясь не повредить его. Используя 4-0 плетеную шелковую нить (Nescosuture), в центральной области бедра накладывают лигатуру в четырех положениях с интервалом 1 мм с периферической стороны. Для лигирования не делают перевязку с использованием техник хирургичекого шва или квадратного шва. Завязывают только один узел и этот узел постепенно затягивают до уровня, при котором задняя конечность может слегка двигаться. Затем мышечную плеву и кожу сшивают. Для группы с фиктивным оперативным вмешательством используют те же манипуляции до обнажения седалищного нерва и затем мышечную плеву и кожу сшивают.
[Способ измерения для теста на раздражение, вызываемого нагревом]
Измерение осуществляют, используя BASILE P1anter Тест (UGO BASILE 7370). К правой задней конечности незакрепленной крысы применяют инвазивное раздражение, вызываемое нагревом, и измеряют период времени, предшествующий проявлению у животного поведения, связанного с бегством от опасности (латентный период реакции). В частности, крысу помещают в бокс для измерения и крысе предоставляют возможность адаптироваться на протяжении приблизительно 5 минут. Затем переносной генератор инфракрасного излучения помещают под стеклянной пластиной и облучение инфракрасными лучами регулируют так, чтобы сфокусировать его в пределах шести баллов около подошвы правой стопы крысы. Важно убедиться в том, что достигнут близкий контакт между стеклянной пластиной и задним отделом стопы. Позже, после запуска раздражения, вызванного нагревом, измеряют латентный период реакции, необходимый для проявления животным поведения, связанного с уходом от опасности, т.е. отдергивание лапки. После проявления поведения, связанного с бегством от опасности, выключатель автоматически срабатывает и время отклика считывают.
[Способ измерения для испытания на раздражение, вызванное воздействием давления]
Измерение осуществляют, используя прибор для измерения аналгезивного эффекта для тестирования раздражения, вызываемого давлением (UGO BASILE 7200). В частности, правую лапу крысы помещают между подставкой и иглой, выдерживающей высокое давление, и прикладывают давление с постоянной скоростью 16 г/сек. Когда крыса почувствует боль и отдернет свою лапу, реагируя на боль, педальный выключатель срабатывает и величину измерения регистрируют.
[План оценки]
Сначала, до операционного вмешательства, проводят тест на раздражение, вызванное нагревом, и тест на раздражение, вызванное воздействием давления. Через семь дней после операционного вмешательства растворитель или испытуемое соединение вводят один раз пероральным, внутривенным, интраперитонеальным или подкожным путем. Через 1, 2 и 24 часа после введения осуществляют такую же процедуру. Что касается группы с непрерывным пероральным введением, то в этом случае растворитель или испытуемое соединение вводят один день после операции, один раз в день в течение семи дней. Через 1, 2 и 24 часа после 7-го дня введения проводят испытание на проявление раздражения под действием нагрева и тест на проявление раздражения под воздействием давления.
<Тест-пример 12>
Оценка аналгетической активности на модели полного адъюванта Фрейнда у крысы
Аналгетическую активность в модели полного адъюванта Фрейнда у крысы можно исследовать, ссылаясь на способ Giblin и др. (Bioorg. Med. Chem. Lett. 17, p. 385-389 (2007)).
[Создание модели]
Крысу, мужскую особь линии SD (массой тела 150-200 г, Charles River Corporation, Japan), подвергают наркозу, используя пентобарбитал натрия (50 мг/кг, интраперитонеально). Инактивированные туберкулезные бактерии (M. TUBERCULOSIS DES. H37 RA, DIFCO Laboratories), которые суспендируют в вазелиновом масле (концентрация 10,0 мг/мл), инъецируют в подошву левой задней стопы крысы (объем 0,05 мл).
[Способ измерения для теста по стимулированию боли]
Измерение осуществляют, используя устройство по типу фон Фрейя для тестирования боли (UGO BASILE 37400). Крысу помещают в пластиковую клетку с проволочным дном и содержат в незакрепленном состоянии. Для адаптации крысу помещают в клетку по меньшей мере за 20 минут до начала испытания. Филамент, который обеспечивает раздражение давлением, устанавливают таким образом, чтобы сфокусировать его в пределах шести баллов около подошвы левой стопы крысы. Постоянную величину раздражения давлением прикладывают вертикально. Определяют, проявит ли крыса поведение, связанное с уходом от опасности, или нет, реагируя на раздражение давлением. После этого получают пороговое значение для проявления животным поведения, связанного с уходом от опасности.
[План оценки]
Сначала, за день до создания модели, проводят испытание по стимулированию боли. Помимо этого, принимая день создания модели за 0-й, осуществляют тест по стимулированию боли на 1, 3, 7, 9, 11 и 13 дни. На 13 день после создания модели растворитель или испытуемое соединение вводят один раз пероральным, внутривенным, интраперитонеальным или подкожным путем и затем проводят испытание по стимулированию боли только после двух часов после введения. В случае непрерывного введения, начиная с 13 дня после создания модели, растворитель или испытуемое соединение вводят перорально, внутривенно, интраперитонеально или подкожно дважды в день на протяжении пяти дней (частота введения и временной период введения не ограничены вышеуказанными величинами). Начиная с 14 дня после создания модели, тест по стимулированию боли проводят каждый день до введения растворителя или испытуемого соединения и так продолжают 24 часа после дня прекращения введения.
<Тест-пример 13>
Оценка аналгетической активности в модели постоперационной боли у крысы
Аналгетическую активность в модели постоперационной боли у крысы можно определить, принимая во внимание способ, представленный Omote и др. (Anesth Analg. 92, p. 233-8 (2001)).
[Создание модели]
Крысу, мужскую особь линии SD (с массой тела 250-300 г, SLC Corporation, Japan), подвергают анестезии, используя 3% изофлуран. Для предотвращения какой-либо инфекции подошву правой задней стопы стерилизуют повидонйодом и в трехглавую мышцу инъецируют внутримышечно пенициллин-G (30000Е, Бензилпенициллин; компании Sigma-Aldrich). Кожу и фасцию срезают с области, которая расположена на расстоянии 0,5 см от пятки до верхушки лапы правой задней конечности крысы (т.е. длина 1 см). После рассечения кожу и фасцию сшивают вместе, используя 5-0 нейлоновую нить, и крысу помещают в клетку для восстановления.
[Способ измерения для испытания по стимуляции боли]
Измерение осуществляют, используя приспособление по типу фон Фрейя (Von Frey) для тестирования боли (UGO BASILE 37400). Крысу помещают в пластиковую клетку с проволочным дном и содержат в незакрепленном состоянии. Для адаптации крысу помещают в клетку по меньшей мере за 20 минут до начала испытания. Филамент, который обеспечивает раздражение давлением, устанавливают таким образом, чтобы сфокусировать его в пределах шести баллов около подошвы левой стопы крысы. Постоянную величину раздражения давлением прикладывают вертикально. Затем определяют, проявит ли крыса поведение, связанное с уходом от опасности, или нет, реагируя на раздражение давлением. После этого получают пороговое значение для проявления животным поведения, связанного с уходом от опасности.
[Введение растворителя и испытуемого соединения]
Крысу подвергают анестезии, используя 1,5% изофлуран. В подошву животного, которое было подвергнуто операционному вмешательству, инъецируют растворитель или испытуемое соединение, заботясь о том, чтобы избежать какого-либо подтекания. Через два и двадцать четыре часа после операционного вмешательства растворитель или испытуемое соединение вводят дважды соответственно.
[План оценки]
Сначала, до операционного вмешательства, осуществляют испытание по стимуляции боли, получая контрольное значение. Через два и двадцать четыре часа после операционного вмешательства, но до введения проводят испытание по стимулированию боли и подтверждают значимое снижение в пороговом значении по сравнению с контрольным значением как базового (исходного) уровня. Затем, через 15, 30, 45, 60, 90 или 120 минут после каждого введения, проводят испытание по стимуляции боли и получают аналгезирующее действие испытуемого соединения по сравнению с базовым (исходным) уровнем.
<Тест-пример 14>
Пролонгирование интервала мочеиспускания у бодрствующей крысы - II
В качестве испытуемого животного используют крысу, мужскую особь линии SD (Charles River Corporation, Japan). Крысу подвергают анестезии, используя ингаляцию изофлурана (смесь закись азота:кислород = 7:3) и положив ее на живот, оставляют анестезироваться вдыханием 2% изофлурана. Затем делают разрез в центральной области живота и обнажают мочевой пузырь. Делают небольшой надрез в области дна мочевого пузыря и вводят полиэтиленовую трубочку (PE-50: Becton Dickinson) в мочевой пузырь и фиксируют ее. Один конец канюли подкожно направляют к задней стороне животного и после фиксирования канюли к брюшной стенке разрез герметизируют. Канюлю, направленную к задней стороне животного, соединяют с seibel и среднюю область защищают пружинкой из нержавеющей стали. В то же самое время канюлю, которую используют для введения через яремную вену, вставляют, направляют подкожно к задней стороне животного и также защищают пружинкой. Через два дня после операционного вмешательства через канюлю, размещенную внутри мочевого пузыря, в мочевой пузырь инъецируют 0,3% уксусную кислоту со скоростью 4,0 мл/час, вызывая цистит. Затем через один конец трубки, которая была вставлена в мочевой пузырь, инъецируют физиологический раствор, нагретый до 37°C, со скоростью 3,0 мл/час, используя трехходовой запорный кран, тогда как другой конец соединяют с датчиком давления и цистометрограмму регистрируют непрерывно при усилении давления. Выделяемую мочу собирают в сосуд, помещенный на электронные весы, и одновременно измеряют изменение в массе мочи. После подтверждения установившегося характера мочеиспускания осуществляют внутривенное введение через канюлю, размещенную в яремной вене. Измерение проводят в течение 60 минут. Среднюю величину измерения на протяжении 30 минут до осуществления введения считают значением до введения, в то время как среднюю величину измерений на протяжении 60 минут сразу после введения принимают за значение после введения. Испытанию подвергают трех животных. В результате этого было обнаружено, что репрезентативное соединение по данному изобретению, например Пример 35, демонстрирует по меньшей мере 30% пролонгирование в интервале мочеиспускания и увеличение в объеме мочеиспускания.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ ФЕНИЛПРОПИОНОВОЙ КИСЛОТЫ И ЕГО ПРИМЕНЕНИЕ | 2009 |
|
RU2479579C2 |
| ИНГИБИТОР СВЯЗЫВАНИЯ СФИНГОЗИН-1-ФОСФАТА | 2007 |
|
RU2395499C2 |
| СПОСОБ СИНТЕЗА ГИДРАЗИНА, КОТОРЫЙ МОЖНО ПРИМЕНЯТЬ ПРИ ЛЕЧЕНИИ ВИРУСА ПАПИЛЛОМЫ | 2013 |
|
RU2649006C2 |
| ПРОИЗВОДНОЕ ТЕТРАЗОЛИЛГИДРОКСИИМИНА, СПОСОБ ЕГО ОЧИСТКИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2581828C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБ ЛЕЧЕНИЯ ПОВЫШЕННОГО ГЛАЗНОГО ДАВЛЕНИЯ И/ИЛИ ГЛАУКОМЫ | 1995 |
|
RU2123847C1 |
| ТЕРАПЕВТИЧЕСКОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ИЛИ ПРОФИЛАКТИЧЕСКОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ОТ ДИАБЕТИЧЕСКОЙ НЕФРОПАТИИ | 2017 |
|
RU2735538C1 |
| ЦИКЛОАЛКИЛЬНЫЕ ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1997 |
|
RU2197458C2 |
| ЦИКЛИЧЕСКИЕ АМИНОПРОИЗВОДНЫЕ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ И ПРЕДУПРЕЖДЕНИЯ ЗАБОЛЕВАНИЙ | 1997 |
|
RU2163596C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ТЕТРАЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2011 |
|
RU2573392C2 |
| СУЛЬФОНАМИДНОЕ СОЕДИНЕНИЕ | 2006 |
|
RU2376300C1 |
Предлагаются азотсодержащие гетероциклические соединения, представленные нижеследующей формулой (1), где значения радикалов указаны в описании. Эти соединения или их фармацевтически приемлемые соли обладают сильной антагонистической активностью по отношению к ЕР1, когда их вводят человеку или животному, и их используют в качестве эффективного компонента фармацевтического средства, например, для профилактики и/или лечения гиперактивного мочевого пузыря. Кроме того, вышеуказанные соединения используют в качестве эффективного компонента фармацевтического средства для профилактики и/или лечения симптомов, включая учащенное мочеиспускание, сильную потребность в мочеиспускании, сопровождающуюся опасением непроизвольного мочеотделения, и недержание мочи. 7 н. и 17 з.п. ф-лы, 145 пр., 5 табл.
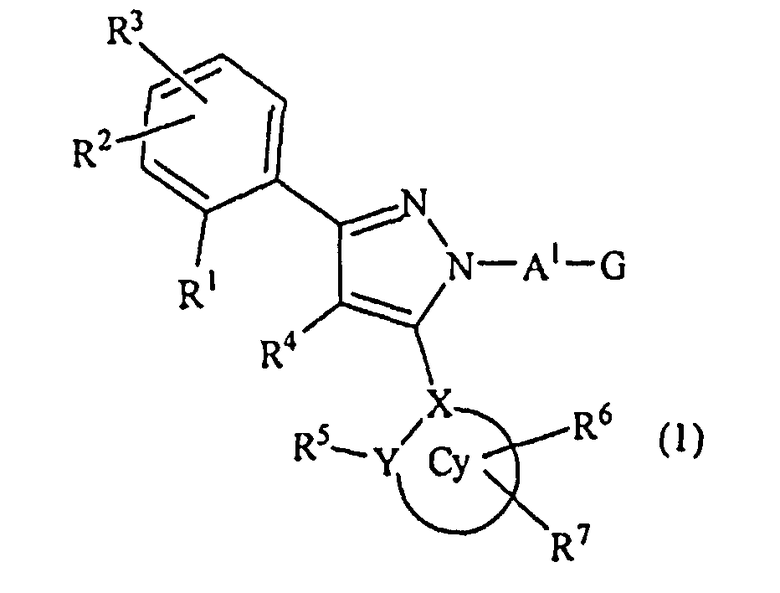
1. Соединение, представленное формулой (1), или его фармацевтически приемлемая соль:
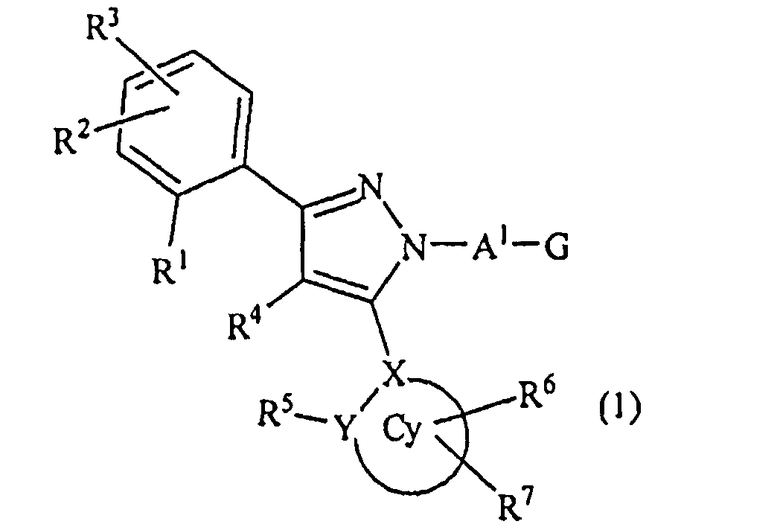
в формуле (1) Су представляет собой фенильную группу, 5- или 6-членную ароматическую гетероциклическую группу, включающую 1-2 гетероатома, выбранных из О, S или N, нафтильную группу, 9- или 10-членную конденсированную полициклическую ароматическую гетероциклическую группу, включающую 1-2 гетероатома, выбранных из О или N, частично ненасыщенное 5- или 6-членное моноциклическое углеводородное кольцо, частично ненасыщенное 5-или 6-членное гетероциклическое кольцо, содержащее 1-2 атома кислорода, или 3-7-членную гетероциклическую группу, включающую 1-2 атома азота, Х представляет собой атом углерода или атом азота, Y представляет собой атом углерода, атом азота, атом кислорода или атом серы,
R1, R2 R3 могут быть одинаковыми или отличными друг от друга и каждый из них независимо представляет собой атом водорода, гидроксигруппу или алкоксигруппу, включающую 1-6 атомов углерода,
R4 представляет собой атом водорода, атом галогена, алкильную группу, включающую 1-6 атомов углерода, которая может быть замещенной 1-3 атомами галогена, гидроксигруппу, алкоксигруппу, включающую 1-10 атомов углерода, которая может быть замещена фенильной группой, алкиламиногруппу, включающую 1-6 атомов углерода или -N(RP1)(RP2) (RP1 и RP2 могут быть одинаковыми или отличными друг от друга и каждый независимо представляет собой атом водорода, алкильную группу, включающую 1-6 атомов углерода),
R5, R6 и R7 могут быть одинаковыми или отличными друг от друга и все или часть из них могут присутствовать или ни один из них не присутствует (при условии, что, когда Y представляет собой атом кислорода или атом серы, R5 отсутствует), и когда R5, R6 и R7 присутствуют, то каждый из них независимо представляет собой атом водорода, атом галогена, алкильную группу, включающую 1-6 атомов углерода, которая может быть замещенной 1-3 атомами галогена, гидроксигруппой или алкоксигруппой, включающей 1-6 атомов углерода, алкенильную группу, включающую 1-6 атомов углерода, которая может быть замещена карбоксигруппой, цианогруппу, фенильную группу, алкоксигруппу, включающую 1-6 атомов углерода, которая может быть замещена 1-3 атомами галогена или фенильной группой, феноксигруппу, алкилтиогруппу, включающую 1-6 атомов углерода, ацильную группу, включающую 2-6 атомов углерода, бензоильную группу, алкилсульфинильную группу, включающую 1-6 атомов углерода, алкилсульфонильную группу, включающую 1-6 атомов углерода, карбамильную группу, сульфамоильную группу, -NH2, метилсульфониламиногруппу, карбоксигруппу, -CON(RY3)(RY4)(RY3 и RY4 могут быть одинаковыми или отличными друг от друга и каждый из них независимо представляет собой атом водорода, алкильную группу, включающую 1-6 атомов углерода или фенильную группу, или
R1 и R4 могут вместе представлять цикл, который выбран из группы, состоящей из частично ненасыщенного 5- или 6-членнного углеводородного цикла, или
R4 и R5 могут вместе представлять цикл, который выбран из группы, состоящей из частично ненасыщенного 5- или 6-членного углеводородного цикла и 5- или 6-членного ненасыщенного углеводородного цикла, или 5- или 6-членный цикл, в котором один из составляющих цикл углеродных атомов в цикле замещен атомом кислорода,
А1 представляет собой простую связь, алкиленовую группу, включающую 1-2 атома углерода, или алкениленовую группу, включающую 1-2 атома углерода,
G представляет собой любую из нижеследующих формул (G1)-(G4):
[Химическая формула 15]
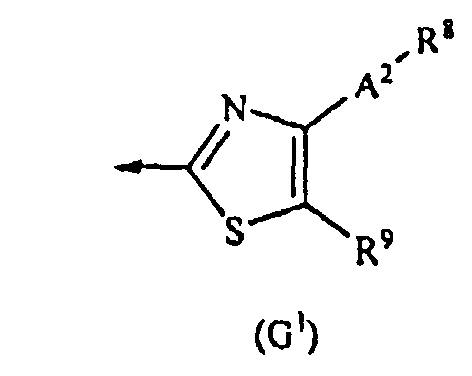
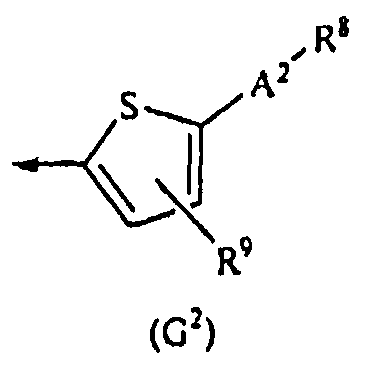
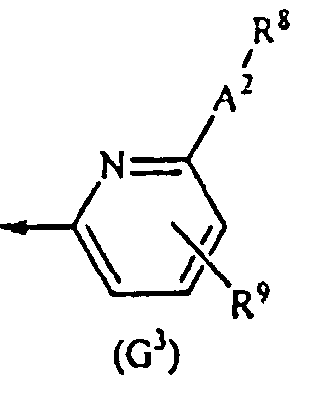
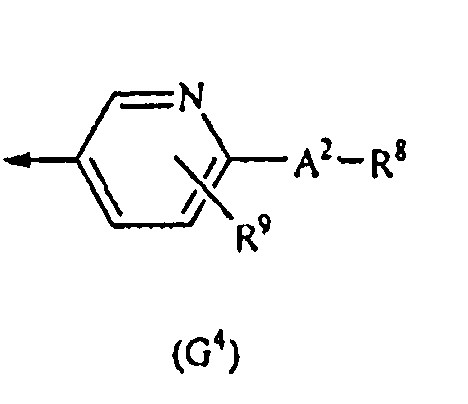
в формулах (G1)-(G4) А2 представляет собой простую связь, алкиленовую группу, включающую 1-6 атомов углерода, или алкениленовую группу, включающую 1-6 атомов углерода, R8 представляет собой карбоксигруппу или -COOR83 (R83 представляет собой алкильную группу, включающую 1-6 атомов углерода, и R9 представляет собой атом водорода или алкильную группу, включающую 1-6 атомов углерода.
2. Соединение по п.1 или его фармацевтически приемлемая соль, в котором G представляет собой формулу (G1).
3. Соединение по п.1 или его фармацевтически приемлемая соль, в котором R8 представляет собой карбоксигруппу.
4. Соединение по п.1 или его фармацевтически приемлемая соль, в котором А2 представляет собой простую связь.
5. Соединение по п.1 или его фармацевтически приемлемая соль, в котором А1 представляет собой простую связь, алкиленовую группу, включающую 1-6 атомов углерода, или алкениленовую группу, включающую 1-6 атомов углерода.
6. Соединение по п.1 или его фармацевтически приемлемая соль, в котором А1 представляет собой простую связь.
7. Соединение по п.1 или его фармацевтически приемлемая соль, в котором А1 представляет собой метиленовую группу, которая может быть замещена алкильной группой, включающую 1-6 атомов углерода.
8. Соединение по п.1 или его фармацевтически приемлемая соль, в котором Су представляет собой фенильную группу, 5- или 6-членную ароматическую гетероциклическую группу, включающую 1-2 гетероатома, выбранных из О, S или N, нафтильную группу, 9- или 10-членную конденсированную полициклическую ароматическую гетероциклическую группу, включающую 1-2 гетероатома, выбранных из О или N, частично ненасыщенное 5- или 6-членное моноциклическое углеводородное кольцо, частично ненасыщенное 5- или 6-членное гетероциклическое кольцо, содержащее 1-2 атома кислорода.
9. Соединение по п.1 или его фармацевтически приемлемая соль, в котором Су представляет собой фенильную группу.
10. Соединение по п.1 или его фармацевтически приемлемая соль, в котором Су представляет собой насыщенную 3-7-членную насыщенную гетероциклическую группу, включающую 1 -2 атома азота.
11. Соединение по п.1 или его фармацевтически приемлемая соль, в котором R4 представляет собой атом галогена, алкильную группу, включающую 1-6 атомов углерода, которая может быть замещенной 1-3 атомами галогена, гидроксигруппу или аминогруппу.
12. Соединение по п.1 или его фармацевтически приемлемая соль, в котором R1, R2 и R3 представляют собой группу, которая независимо выбрана из группы, состоящей из атома водорода, гидроксигруппы и алкоксигруппы, включающую 1-6 атомов углерода.
13. Соединение по п.1 или его фармацевтически приемлемая соль, в котором R5, R6 и R7 представляют собой группу, которая независимо выбрана из группы, состоящей из атома водорода, атома галогена, алкильной группы, включающую 1-6 атомов углерода, которая может быть замещенной 1-3 атомами галогена, гидроксигруппы или алкоксигруппы, включающей 1-6 атомов углерода, и алкоксигруппы, включающую 1-6 атомов углерода, которая может быть замещенной 1-3 атомами галогена или фенилом.
14. Соединение по п.1 или его фармацевтически приемлемая соль, в котором R1 и R4 вместе представляют цикл, который выбран из группы, состоящей из частично ненасыщенного 5- или 6-членного углеводородного цикла.
15. Соединение по п.14 или его фармацевтически приемлемая соль, представленное любой из формул (1-1) или (1-4):
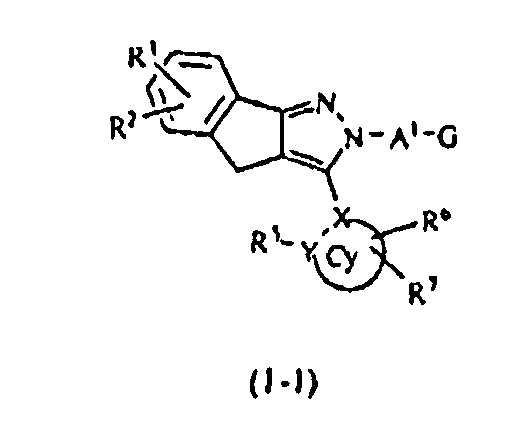
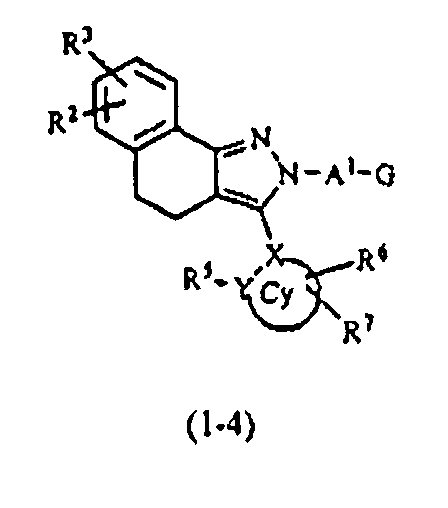
где Су, X, У, R2, R3, R5, R6, R7, А1 и G определены в п.1.
16. Соединение по п.1 или его фармацевтически приемлемая соль, в котором R4 и R5 вместе представляют цикл, который выбран из группы, состоящей из частично ненасыщенного 5- или 6-членного углеводородного цикла, и 5- или 6-членного ненасыщенного углеводородного цикла, или 5- или 6-членный цикл, в котором один из составляющих цикл атомов углерода в цикле замещен атомом кислорода.
17. Соединение по п. 16 или его фармацевтически приемлемая соль, представленное любой из формул (1-6) , (1-7) или (1-9):
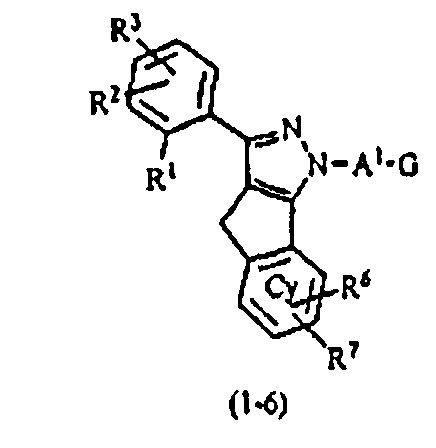
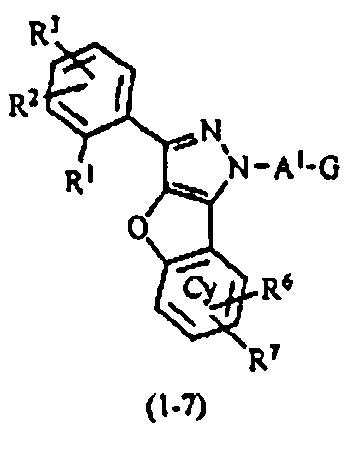
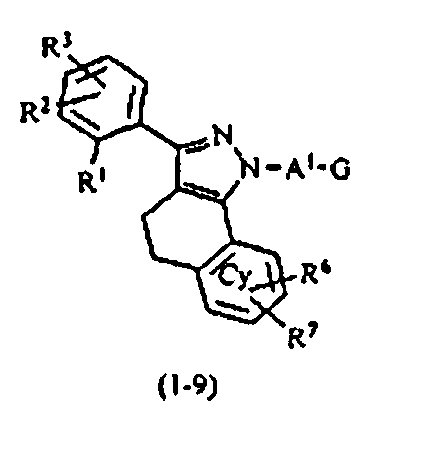
где Су, R1, R2, R3, R6, R7, А1 и G определены в п.1.
18. Соединение, выбранное из группы
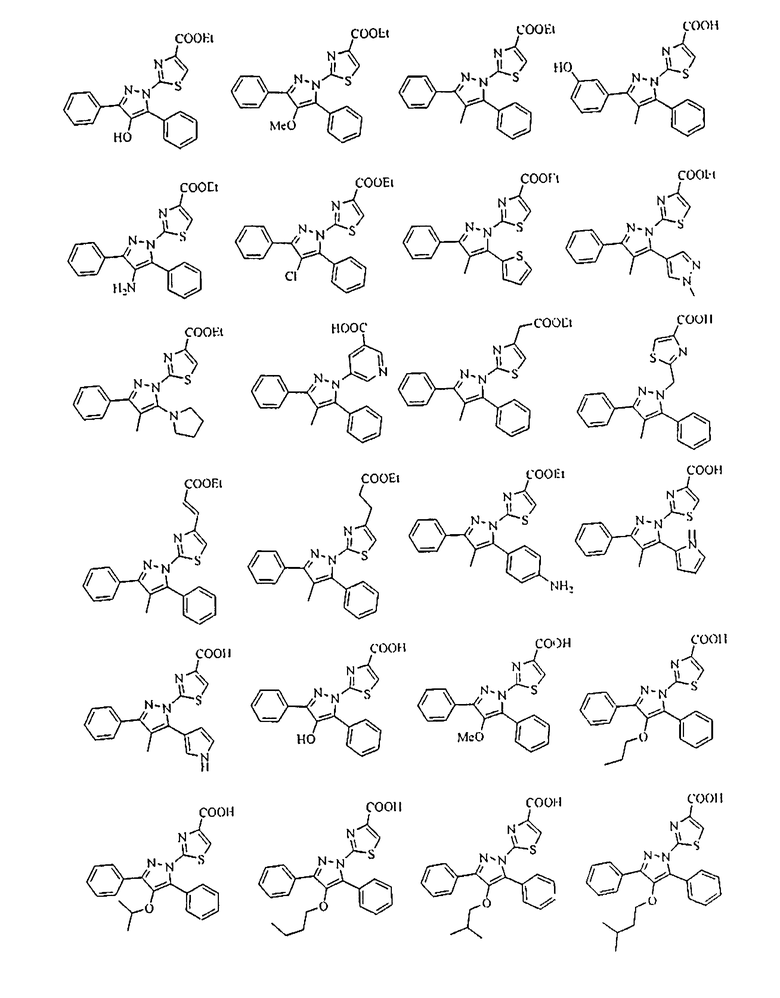
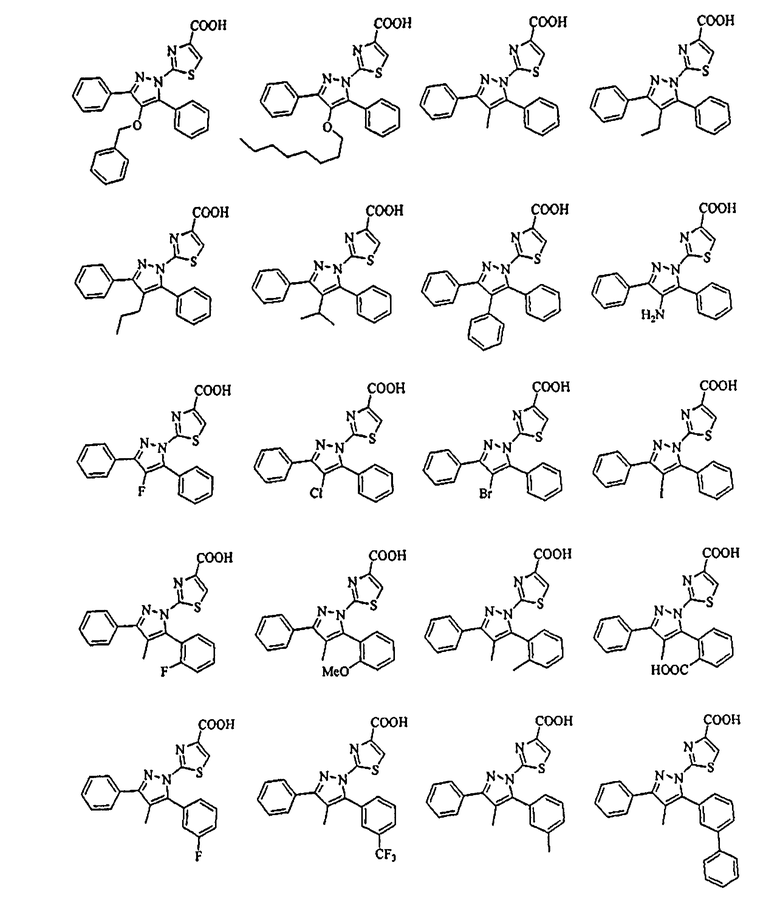
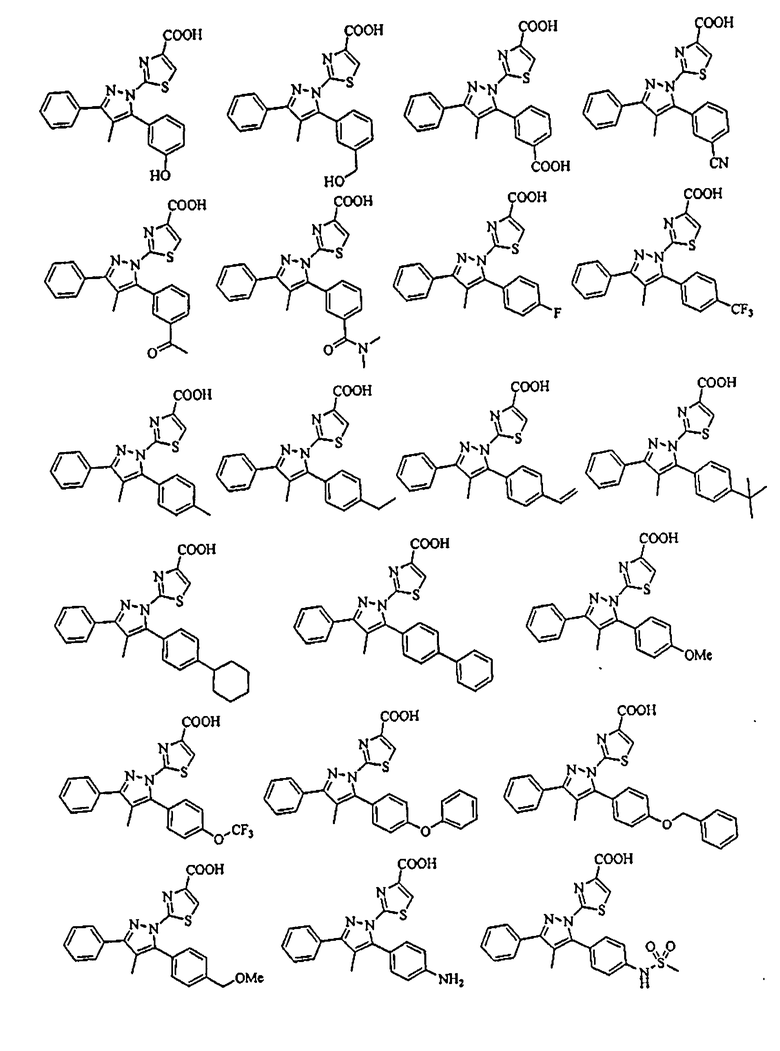
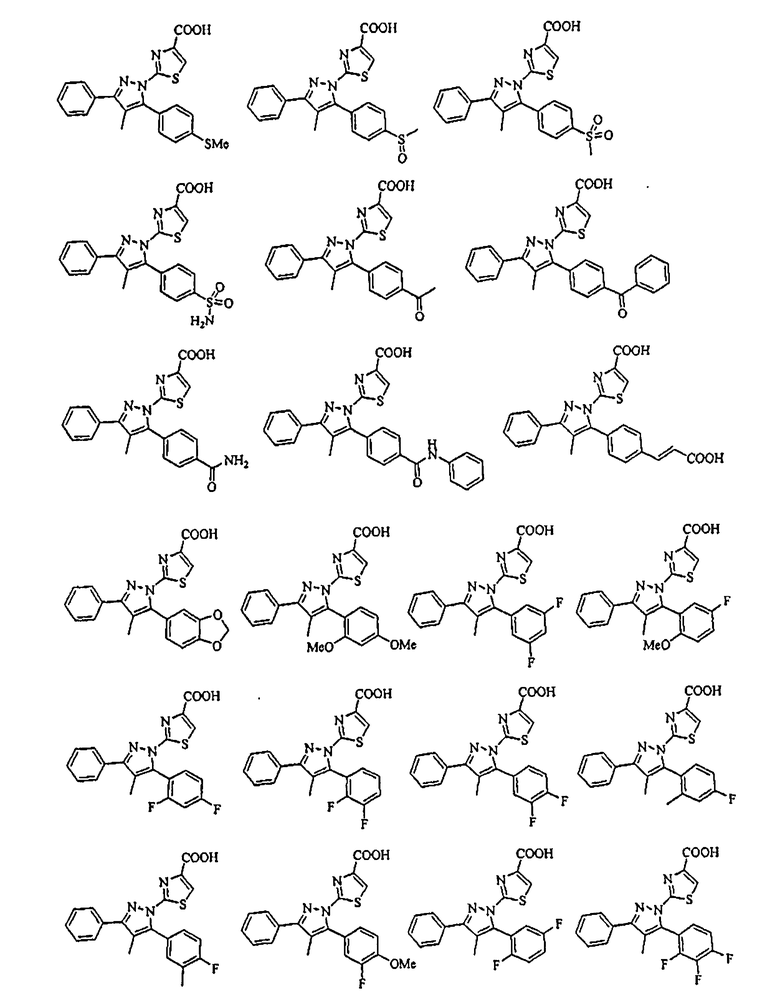
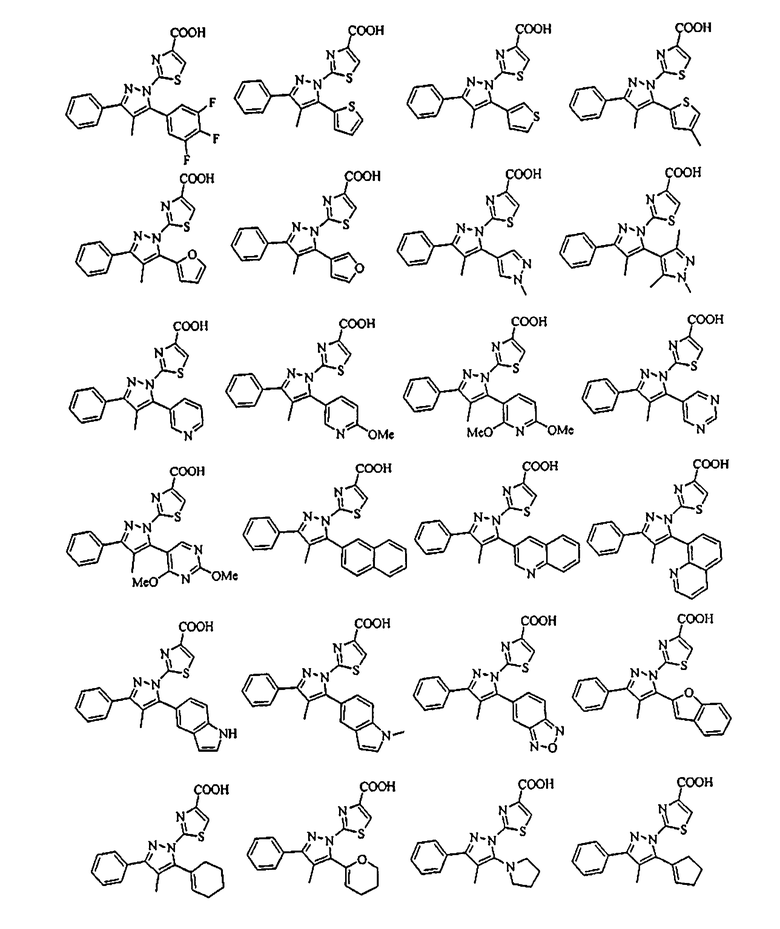
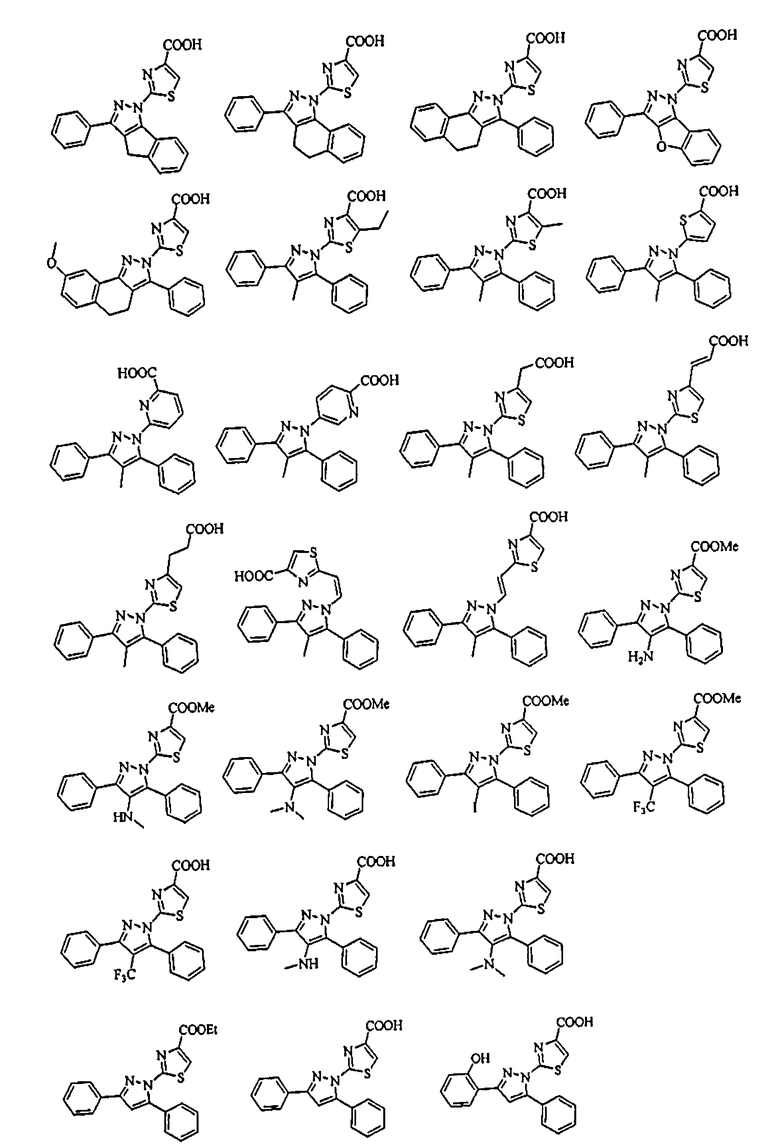
или его фармацевтически приемлемая соль.
19. Соединение, выбранное из группы:
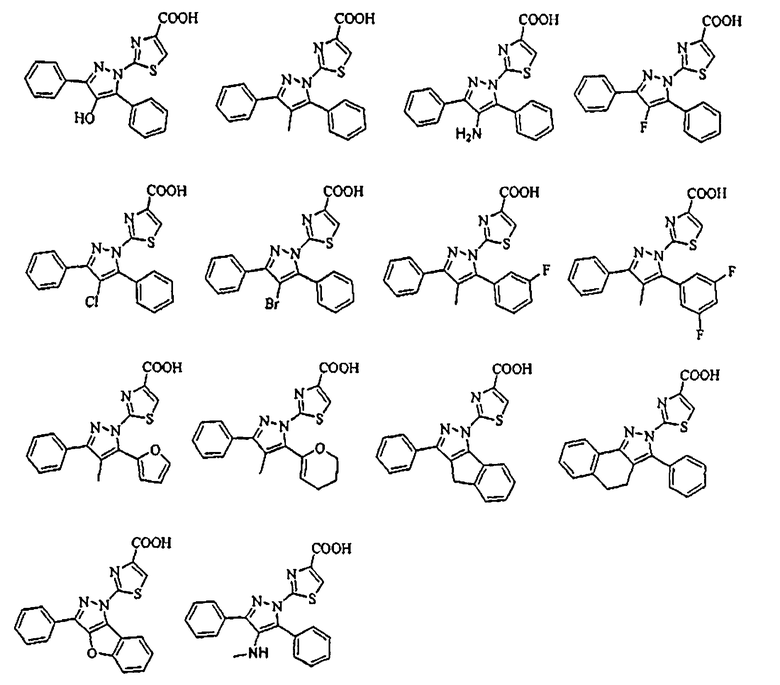
или его фармацевтически приемлемая соль.
20. Соединение, выбранное из группы
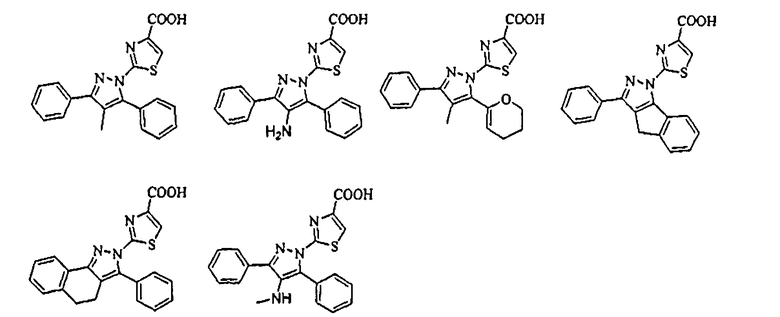
или его фармацевтически приемлемая соль.
21. Фармацевтическое средство, обладающее антагонистической активностью в отношении ЕР1, которое содержит в качестве эффективного компонента соединение по любому из пп.1-20 или его фармацевтически приемлемую соль.
22. Фармацевтическое средство по п.21, которое используют для профилактики и/или лечения гиперактивного мочевого пузыря.
23. Антагонист ЕР1, который содержит в качестве эффективного компонента соединение по любому из пп.1-20 или его фармацевтически приемлемую соль.
24. Применение соединения по любому из пп.1-20 или его фармацевтически приемлемой соли для получения фармацевтического средства, которое используют для профилактики и/или лечения гиперактивного мочевого пузыря.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| EP 1104759 A1, 06.06.2001 | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| СПОСОБ ПРИМЕНЕНИЯ ИНГИБИТОРОВ ЦИКЛООКСИГЕНАЗЫ-2 ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ НЕОПЛАЗИИ | 1997 |
|
RU2239429C2 |
Авторы
Даты
2013-03-10—Публикация
2009-07-10—Подача