Изобретение относится к области медицины, конкретно к кардиологии, и касается способа оценки вегетативной регуляции сердечного ритма для выявления кардиальной автономной нейропатии до появления клинических симптомов у пациентов с артериальной гипертензией и метаболическими нарушениями.
Кардиальная автономная нейропатия (КАН) - осложнение сахарного диабета (СД) 2 типа, которое ухудшает качество жизни пациентов и повышает риск внезапной смерти [1]. Считается, что основные механизмы КАН запускаются уже при состоянии, предшествующем развитию СД 2 типа, а именно метаболическом синдроме, основным признаком которого является абдоминальное ожирение [2]. Диагностика КАН представляет определенные трудности. Бессимптомное течение указанного осложнения не позволяет диагностировать его на ранних стадиях. Появление таких признаков, как ортостатическая гипотензия, безболевой инфаркт миокарда и тахикардия покоя, на которых базируется диагностика КАН, свидетельствует о далеко зашедшем процессе. Современными исследованиями доказано, что КАН до определенной степени обратима при условии своевременного лечения [3].
Известен способ определения КАН на основании исследования кардиоваскулярных рефлексов, так называемых 5 стандартных тестов по Ewing, принятых за стандарт для диагностики автономной нейропатии на конференции в Сан-Антонио (1998) [4]. Каждый из пяти тестов повторяют трижды с вычислением среднего значения результата и последующей оценкой результата по 2-балльной шкале: 0 - нормальный результат, 1 - пограничный результат, 2 - патологический результат. Критерием КАН считают патологические результаты двух и более тестов или балл автономной нейропатии >4.
Данный способ является наиболее близким к заявленному и выбран в качестве прототипа.
Недостатками данного способа являются длительность тестирования пациентов - около 90-120 минут, трудность в оценке и интерпретации результатов, возможность получения неоднозначного, пограничного результата.
Задачей изобретения является создание способа ранней кардиальной автономной нейропатии у пациентов с артериальной гипертензией и метаболическими нарушениями, основанного на оценке вегетативной регуляции сердечного ритма.
Поставленная задача решается проведением пациентам с АГ и метаболическими нарушениями 5-минутного фонового исследования вариабельности ритма сердца (ВРС) в положении лежа и при выполнении активной ортостатической пробы в течение 5 мин с последующим спектральным анализом и расчетом относительных спектральных показателей, представляющих вклад очень низкочастотного (VLF) и низкочастотного (LF) компонентов в общую мощность спектра колебаний ритма сердца; с последующим расчетом отношения каждого относительного показателя при проведении ортостатической пробы к таковому при фоновой записи.
Новым в предлагаемом изобретении является использование отношения каждого относительного показателя ВРС при проведении ортостатической пробы к таковому при фоновой записи. Рассчитывают отношение %LFортопроба/%LFфон и %VLFортопроба/%VLFфон. У пациентов с АГ и метаболическими нарушениями отношение %LFортопроба/%LFфон менее 1,0 в сочетании с коэффициентом %VLFортопроба/%VLFфон более 1,0 свидетельствуют о формировании КАН еще до появления клинических симптомов.
Авторами в проанализированной литературе использования отношения каждого относительного показателя ВРС при проведении ортостатической пробы к таковому при фоновой записи для диагностики КАН не найдено, и предлагаемый способ соответствует критерию ″Новизна″.
Известно, что в патогенезе метаболического синдрома и СД 2 типа ведущую роль играет инсулинорезистентность/гиперинсулинемия, которой также отводится главное место в развитии автономной дисфункции. Кроме того, поражение сердца при метаболическом синдроме и СД обусловлено рядом нарушений метаболических процессов в миокарде и проводящей системе, что происходит вследствие повышенной утилизации свободных жирных кислот, тканевой гипоксии, нарушений кровоснабжения, микроангиопатии и других факторов. КАН может проявляться ортостатической гипотензией, снижением вариабельности сердечного ритма, повышением частоты сердечных сокращений (ЧСС) в покое; неадекватной реакцией ЧСС и артериального давления (АД) на физическую нагрузку; дисфункцией левого желудочка. Поражение сердца значительно снижает качество и прогноз жизни пациента за счет высокой частоты развития безболевых форм инфаркта миокарда и угрожающих жизни аритмий [5], в связи с чем очевидна необходимость раннего диагностирования КАН у пациентов с метаболическими нарушениями еще до появления клинических проявлений для назначения патогенетически обосноснованного своевременного лечения. В настоящее время стандартом диагностики КАН является тестирование по Ewing [4], а как дополнение к стандартному тестированию используется исследование ВРС.
Вариабельность ритма сердца - это колебания ЧСС около некоторого среднего значения на исследуемом промежутке времени и, являясь одним из механизмов адаптации организма к меняющимся внешним и внутренним факторам, отражает степень напряжения регуляторных систем на любое воздействие. ВРС можно оценить с использованием временного и частотного анализа. Временной анализ применяется для исследования длительной записи ЭКГ, в частности, во время суточного мониторирования ЭКГ. К его недостаткам относится сложность стандартизации условий исследования за столь продолжительный период. Частотный анализ с использованием быстрого преобразования Фурье рекомендуется проводить в течение 5 минут в стандартных условиях, что позволяет максимально исключить влияние внешних раздражителей на результаты исследования.
При спектральном анализе ВРС определяют общую мощность спектра (TP), с вычислением спектра мощности колебаний в трех частотных диапазонах: 0,004-0,08 Гц (очень низкие частоты - VLF); 0,09-0,16 Гц (низкие частоты - LF); 0,17-0,5 Гц (высокие частоты - HF). Выделение трех частотных диапазонов обусловлено различием их формирования: диапазон очень низких частот отражает функциональное состояние надсегментарных структур; диапазон низких частот - симпатическую и диапазон высоких частот - парасимпатическую нервную систему на сегментарном уровне. Оценку показателей проводят с учетом абсолютных и относительных значений мощности спектра каждого частотного диапазона (VLF, LF, HF) в исходном состоянии, направленности их реагирования в ответ на функциональные пробы. На настоящее время ВРС используют как метод дополнительной диагностики КАН для измерения корригированного интервала QT и дисперсии интервала QT [5].
Известно, что ранним признаком КАН является угнетение активности симпатического отдела вегетативной нервной системы, она в этом случае не появляется даже в ответ на проводимые тесты по оценке функционального состояния сердца. При этом фиксированный сердечный ритм у данных пациентов - отсутствие четкой зависимости частоты сердечного ритма от физической активности и фазы дыхания - свидетельствуют о преобладании влияния надсегментарных структур на сердечный ритм [5]. При проведении ВРС возможна оценка влияния симпатического отдела вегетативной нервной системы и надсегментарных структур на ритм сердца как в покое, так и на фоне физической активности (ортостатической пробы), однако использование отношения каждого относительного показателя ВРС при проведении ортостатической пробы к таковому при фоновой записи для диагностики кардиальной автономной нейропатии еще до появления клинических симптомов у пациентов с АГ и метаболическими нарушениями для специалиста не является очевидным.
Совокупность отличительных признаков не является очевидной для специалиста и не вытекает явным образом из уровня техники данной области, что позволяет считать предлагаемое изобретение соответствующим критерию ″Изобретательский уровень″. Предлагаемое изобретение может быть использовано в практическом здравоохранении для ранней диагностики кардиальной автономной нейропатии и соответствует критерию ″Промышленная применимость″.
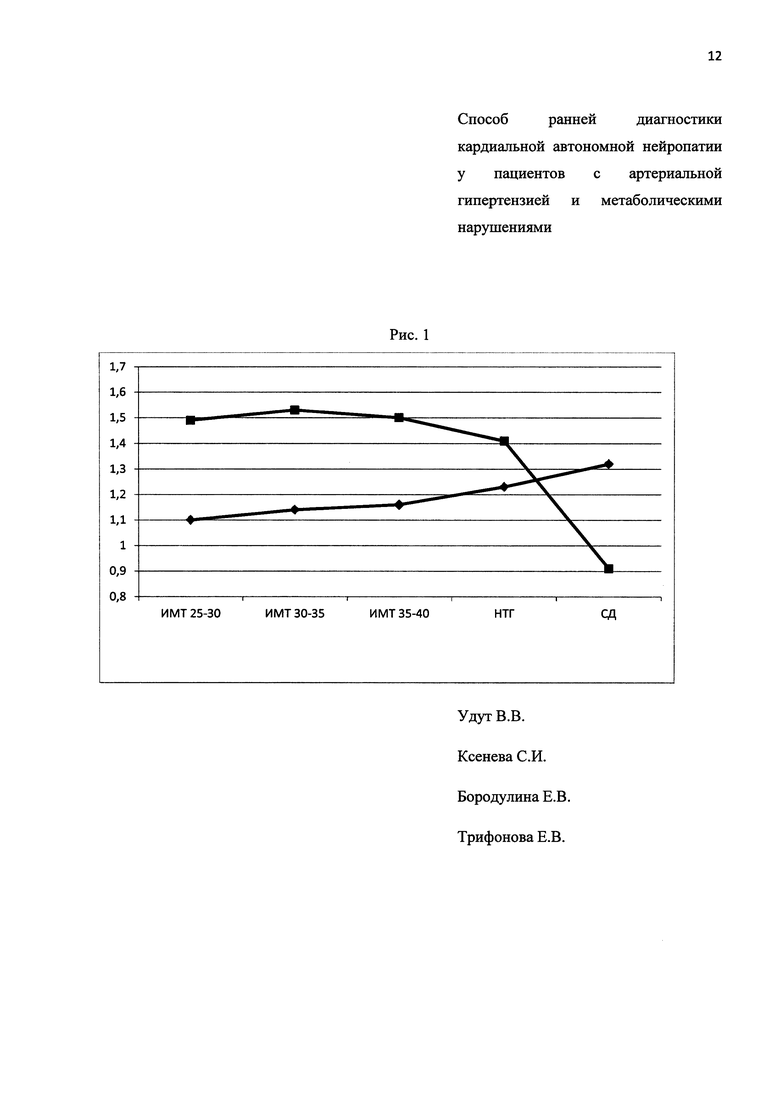
Изобретение будет понятно из следующего описания и приложенных к нему рисунков. На рис. 1 показана динамика коэффициентов %LFортопроба/%LFфон и у пациентов с артериальной гипертензией в зависимости от выраженности метаболических нарушений.
Способ осуществляют следующим образом.
Раннюю диагностику кардиальной автономной нейропатии у пациентов с артериальной гипертензией и метаболическими нарушениями осуществляют на основании спектрального анализа вариабельности ритма сердца с расчетом отношения каждого относительного показателя при проведении ортостатической пробы к таковому при фоновой записи (%LFортопроба/%LFфон, %VLFортопроба/%VLFфон). Коэффициент %LFортопроба/%LFфон менее 1,0 в сочетании с коэффициентом %VLFортопроба/%VLFфон более 1,0 свидетельствуют о формировании кардиальной автономной нейропатии.
На базе клиники федерального государственного бюджетного научного учреждения ″Научно-исследовательского института фармакологии и регенеративной медицины имени Е.Д. Гольдберга″ проведено одномоментное поперечное исследование, в рамках которого обследована сплошная выборка из 141 пациента в возрасте от 27 до 60 лет (средний возраст 50,43±0,52 лет, среди них 31 мужчина и 110 женщин). Критерием включения являлось соответствие рекомендациям Европейского общества гипертонии (ESH) и Европейского общества кардиологов (ESC) (2013 г.) по верификации артериальной гипертонии - уровень систолического АД, равный 140 мм рт. ст. или более, и (или) уровень диастолического АД, равный 90 мм рт. ст. или более, у людей, которые не получают антигипертензивных препаратов. Критериями исключения из исследования служили: ишемическая болезнь сердца, нарушения ритма и проводимости, пороки сердца, острое нарушение мозгового кровообращения в анамнезе, фракция выброса левого желудочка менее 50%, локальные нарушения сократимости миокарда, выявленные при эхокардиографии, почечная недостаточность.
Всем пациентам проводили спектральный анализ вариабельности ритма сердца с помощью аппаратно-программного комплекса ″Поли-спектр″ (ООО ″Нейро-Софт″, Россия). Функциональные резервы регуляторных систем организма оценивали по пульсовой реакции на активную ортостатическую пробу (смена положения тела - ″лежа″-″стоя″). Длительность регистрации ЭКГ для анализа данных составляла 5-минут в положении ″лежа″, анализ ВРС в ортостазе проводился в течение 5 минут после периода адаптации. Соблюдались следующие требования к условиям исследования ВРС: к исследованию приступали не ранее чем через 1,5 часа после еды, в тихой комнате, в которой поддерживается постоянная температура 20-22°С. Перед исследованием отменялись физиотерапевтические процедуры и медикаменты. Перед началом исследования пациент проходил период адаптации к окружающим условиям в течение 5 минут. В период исследования ВРС предлагалось дышать равномерно и спокойно, не делая глубоких вдохов, не кашлять.
При автоматизированном спектральном анализе ВРС рассчитывались следующие показатели: LF, мс2 - мощность в диапазоне низких частот (0,04-0,15 Гц) - маркер симпатических механизмов регуляции; HF, мс2 - мощность в диапазоне высоких частот (0,15-0,4 Гц) - маркер парасимпатических влияний, VLF, мс2 - мощность в диапазоне очень низких частот (0,00-0,04 Гц) - маркер церебральной симпатико-адреналовой активности; TP, мс2 - общая мощность колебаний длительности интервалов R-R - интегральный показатель, характеризующий ВРС в целом, отражает воздействие как симпатического, так и парасимпатического отдела вегетативной нервной системы. Рассчитывались относительные показатели, отражающие вклад каждого компонента спектра в процентах в общий спектр нейрогормонального регулирования (%VLF, %LF, %HF). При этом показатель общей мощности спектра TP принимался за 100%. Помимо общепризнанных показателей, каждому пациенту рассчитывались коэффициенты %LFортопроба/%LFфон и %VLFортопроба/%VLFфон. Проведение анализа ВРС с расчетом всех указанных показателей занимало около 15 минут. КАН диагностировали при значениях %LFортопроба/%LFфон менее 1,0 и %VLFортопроба/%VLFфон более 1,0. Пограничных значений получено не было, что свидетельствует о высокой чувствительности метода.
У всех пациентов проводилось тестирование по Ewing, тесты выполнялись по стандартному протоколу в следующем порядке: тест глубокого дыхания, маневр Вальсальвы, ортостатическая проба с оценкой ответа частоты сердечных сокращений (ЧСС) и АД на вставание, тест 30:15, проба с изометрической нагрузкой. Каждый тест повторяли трижды с вычислением среднего значения результата и последующей оценкой результата по 2-балльной шкале: 0 - нормальный результат, 1 - пограничный результат, 2 - патологический результат. Критерием КАН считали патологические результаты двух и более тестов или балл автономной нейропатии >4. Тестирование по Ewing с обработкой полученных результатов занимало около 120 минут, такая длительность тестирования тяжело переносилась некоторыми пациентами. У 8 пациентов (5,7%) были получены пограничные значения, которые не позволяли точно диагностировать или опровергнуть наличие КАН.
Для обработки результатов использовали методы вариационной статистики. Количественные показатели выражали в виде ″среднее±стандартная ошибка среднего″. Для всех статистических тестов различия считали достоверными при р<0,05. Для порядковых признаков внутри- и межгрупповые различия оценивали непараметрическими тестами: ранговый тест Уилкоксона для парных случаев и U-тест Манна-Уитни.
Все пациенты, принимавшие участие в исследовании, были разделены на группы в зависимости от наличия у них нарушений углеводного обмена. В 1 группу вошли пациенты с верифицированным диагнозом сахарный диабет 2 типа (19 пациентов, средний возраст 58,60±0,75 лет), вторую группу составили пациенты с выявленным нарушением толерантности к глюкозе (НТГ) - 40 пациентов, средний возраст 53,04±1,32 лет. Пациенты без СД 2 типа и НТГ были разделены на 3 группы в зависимости от индекса массы тела (ИМТ): с избыточной массой тела, ИМТ от 25 до 30 кг/м2 - 33 пациента (средний возраст 48,74±2,09 лет), с ожирением 1 степени, ИМТ 30-35 кг/м2 - 33 пациента (средний возраст 52,06±1,52 года), с ожирением 2 степени, ИМТ 35-40 кг/м2 - 16 пациентов (средний возраст 48,38±4,45 года). Группы не различались (р>0,05) по возрасту, полу, нозологическим единицам. При оценке вклада симпатического звена вегетативной нервной системы в сердечный ритм обращает на себя внимание, что у пациентов с СД 2 не только не отмечалось прироста показателя %LF при проведении ортостатической пробы (в таком случае отношение %LFортопроба/%LFфон было бы равно единице), но и фиксировалось его угнетение, что можно объяснить прогрессирующим снижением чувствительности барорефлекса, развивающемся на фоне выраженных метаболических нарушений у пациентов с АГ.
При изучении вклада вегетативных влияний на регуляцию ВРС по показателю %VLF не отмечалось существенного межгруппового различия при фоновой записи. При ортостатической пробе во всех группах выявлено повышение этого показателя относительно данных в покое, отношение %VLFортопроба/%VLFфон более 1,0 свидетельствуют о преобладании центрального контура регуляции сердечным ритмом над автономным. Повышение отношения %VLFортопроба/%VLFфон происходит параллельно увеличению выраженности метаболических проявлений, проявляющихся в нарастании массы тела и формировании углеводных нарушений, и достигает наибольшей выраженности у больных с СД 2 типа.
Рассчитывают отношение каждого относительного показателя ВРС при проведении ортостатической пробы к таковому при фоновой записи у каждого пациента, принимавшего участие в исследовании. Установлено, что у пациентов отмечалось снижение коэффициента %LFортопроба/%LFфон и увеличение %VLFортопроба/%VLFфон параллельно нарастанию метаболических нарушений, достигая максимума у пациентов с СД 2 типа.
При детальном рассмотрении указанных коэффициентов выявлено, что показатель %VLFортопроба/%VLFфон больше значения 1,0, а %LFортопроба/%LFфон менее 1,0 выявлялся у 22,7% в группе с избыточным весом, в группе с ожирением 1 степени - 25%, у лиц с ожирением 2 степени - 27%, у пациентов с нарушением толерантности к углеводам - 29,8% и у пациентов с СД 2 типа - 40%. Динамика коэффициентов %HFортопроба/%HFфон, %VLFортопроба/%VLFфон и %LFортопроба/%LFфон представлены на рис. 1.
Пример 1.
Пациентка К., 37 лет, ИМТ 35,4 кг/м2, диагноз Гипертоническая болезнь I стадии, 2 степени. Нарушение толерантности к глюкозе. Ожирение 2 ст. Риск 2. Проведена оценка ВРС с помощью аппаратно-программного комплекса ″Поли-спектр″ (ООО ″Нейро-Софт″, Россия). Автоматически рассчитаны стандартные показатели ВРС, они приведены в табл. 1.
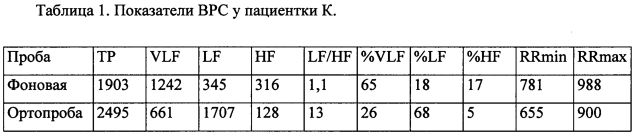
У пациентки в положении лежа в спектре колебаний ритма сердца преобладала очень низкочастотная составляющая VLF как в абсолютных, так и в относительных показателях. При переходе в положение стоя увеличилась общая мощность спектра. Анализ относительных показателей показывает, что при вставании произошло изменение соотношения этих отдельных составляющих: значительно снизилась очень низкочастотная составляющая VLF (с 65 до 26%), также значительно снизилась высокочастотная составляющая HF (с 17 до 5%), при этом значительно возросла низкочастотная составляющая LF (с 18 до 68%). Такая реакция на ортостатическую пробу считается нормальной, так как увеличение общей мощности спектра произошло за счет всплеска симпатической нейрорефлекторной активности, которая выражается в виде возрастания LF. Подсчитаны предлагаемые коэффициенты: %LFортопроба/%LFфон равен 3,78, а коэффициент %VLFортопроба/%VLFфон равен 0,4. Таким образом, полученные коэффициенты позволяют сделать заключение о нормальной вегетативной реакции пациентки при проведении ортостатической пробы. При тестировании по Ewing суммарное количество баллов равнялось 2, что свидетельствует об отсутствии у пациентки К. кардиальной автономной нейропатии.
Пример 2.
Пациентка Ф., 49 лет, ИМТ 30,8 кг/м2, диагноз: Гипертоническая болезнь I стадии, 2 степени. Ожирение I степени. Риск 2. Проведена оценка ВРС с помощью аппаратно-программного комплекса ″Поли-спектр″ (ООО ″Нейро-Софт″, Россия). Автоматически рассчитаны стандартные показатели ВРС, они приведены в табл.2.
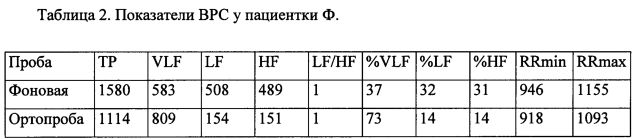
У пациентки в положении лежа в спектре колебаний ритма сердца преобладала очень низкочастотная составляющая VLF как в абсолютных, так и в относительных показателях. При переходе в положение стоя общая мощность спектра несколько уменьшилась. Анализ относительных показателей показывает, что при вставании произошло изменение соотношения этих отдельных составляющих. Значительно повысилась очень низкочастотная составляющая VLF (с 37 до 73%) на фоне выраженного снижения высокочастотной составляющей HF (с 31 до 14%) и низкочастотной составляющей LF (с 32 до 14%). Такая реакция на ортостатическую пробу не может считаться нормальной, так как не произошло увеличения как общей мощности спектра, так и симпатической нейрорефлекторной активности. Подсчитаны коэффициенты: %LFортопроба/%LFфон равен 0,44, а коэффициент %VLFортопроба/%VLFфон равен 1,98. Таким образом, полученные коэффициенты позволяют сделать заключение не столько об отсутствии активации симпатического отдела вегетативной нервной системы в ответ на ортостатическую пробы (в этом случае коэффициент %LFортопроба/%LFфон был бы равен 1), сколько об ее угнетении на фоне возрастающего влияния нейрогуморальных систем (%VLFортопроба/%VLFфон превышает единицу), прежде всего - ренин-ангиотензин-альдостероновой, увеличивающей энергоемкость процессов реагирования и управления и свидетельствует о наличии у пациентки автономной кардиальной нейропатии. При тестировании по Ewing суммарное количество равнялось 8, что подтверждает развитие кардиальной автономной нейропатии баллов у пациентки Ф.
Таким образом, исследование вегетативной регуляции ритма у пациентов с артериальной гипертензией и метаболическими нарушениями показало, что применение именно отношения относительных спектральных показателей вариабельности ритма сердца при проведении активной ортостатической пробы к таковым в покое позволяет выявить характерные признаки кардиальной автономной нейропатии. На основании проведенных авторами исследований ранними признаками кардиальной автономной нейропатии можно назвать коэффициент %VLFортопроба/%VLFфон больше значения 1,0, а %LFортопроба/%LFфон менее 1,0.
Предлагаемый способ позволяет выявить кардиальную автономную нейропатию до появления клинических симптомов у пациентов с артериальной гипертензией и метаболическими нарушениями.
Представленные данные свидетельствуют о том, что при оценке вариабельности ритма сердца у пациентов с артериальной гипертензией и метаболическими нарушениями расчет отношения %VLFортопроба/%VLFфон и %LFортопроба/%LFфон позволяет диагностировать кардиальную автономную нейропатию до появления клинических симптомов; сократить время, затрачиваемое на диагностирование КАН, что способствует приверженности врачей к диагностике этого осложнения у всех пациентов с метаболическими нарушениями и позволит своевременно назначить адекватную патогенетическую терапию.
Список литературы
1. Vinik A.I., Ziegler D. Diabetic cardiovascular autonomic neuropathy // Circulation. -2007. - Vol. 115. - P. 387-397.
2. Минаков Э.В., Кудаева Л.А. Изучение особенностей формирования кардиальной нейропатии у лиц с метаболическим синдромом и нарушением углеводного обмена (по данным анализа вариабельности сердечного ритма) // Саратовский научно-медицинский журнал. - 2010. - Т. 6. - Вып. 3. - С. 582-585.
3. Pop-Busui R. Cardiac Autonomic Neuropathy in Diabetes. A clinical perspective // Diabetes Care. - 2010. - Vol. 33 (2). - P. 434-441.
4. Ewing D.J., Martyn C.N., Young R.J., et al. The value of cardiovascular autonomic function tests: 10 years experience in diabetes // Diabetes Care. - 1985. - 8. - P. 491-498.
5. Черникова H.A. Сердечно-сосудистая форма диабетической автономной нейропатии // Эффективная эндокринология. - 2013. - Спецвыпуск. - С. 44-50.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения стадии кардиальной автономной нейропатии вне зависимости от наличия ее клинических проявлений у пациентов с метаболическим синдромом | 2023 |
|
RU2817843C1 |
| Способ лечения кардиальной автономной нейропатии у пациентов с использованием комбинации препаратов антиоксидантного и ангиопротективного действия | 2024 |
|
RU2836078C1 |
| СПОСОБ ДИАГНОСТИКИ АВТОНОМНОЙ КАРДИАЛЬНОЙ НЕЙРОПАТИИ У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ ТИПА 2 | 2011 |
|
RU2475183C1 |
| СПОСОБ ДИАГНОСТИКИ ВЕГЕТАТИВНОЙ НЕДОСТАТОЧНОСТИ | 2014 |
|
RU2559578C1 |
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ ДИАБЕТИЧЕСКОЙ АВТОНОМНОЙ КАРДИАЛЬНОЙ НЕЙРОПАТИИ У ДЕТЕЙ И ПОДРОСТКОВ | 2009 |
|
RU2391905C1 |
| СПОСОБ ДИАГНОСТИКИ ВЕГЕТАТИВНЫХ НАРУШЕНИЙ У БОЛЬНЫХ С НЕЙРОГЕННЫМИ ОБМОРОКАМИ | 2013 |
|
RU2517472C1 |
| СПОСОБ ЛЕЧЕНИЯ ВЕГЕТАТИВНОЙ ДИСФУНКЦИИ ПРИ ФИБРОЗНО-КИСТОЗНОЙ БОЛЕЗНИ МОЛОЧНЫХ ЖЕЛЕЗ У ЖЕНЩИН РЕПРОДУКТИВНОГО ВОЗРАСТА | 2011 |
|
RU2471494C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ФИЗИЧЕСКОЙ РЕАБИЛИТАЦИИ У БОЛЬНЫХ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ | 2015 |
|
RU2592249C1 |
| СПОСОБ КОРРЕКЦИИ ВЕГЕТАТИВНОГО БАЛАНСА ОРГАНИЗМА СПОРТСМЕНОВ | 2008 |
|
RU2373975C1 |
| СПОСОБ ДИАГНОСТИКИ СИНДРОМА ВЕГЕТАТИВНОЙ ДИСТОНИИ ПО ГИПОТОНИЧЕСКОМУ ТИПУ | 2015 |
|
RU2587036C1 |
Изобретение относится к медицине, а именно к кардиологии. Проводят фоновое исследование вариабельности ритма сердца в положении лежа 5 мин и при выполнении активной ортостатической пробы в течение 5 мин с последующим спектральным анализом и расчетом относительных спектральных показателей. Рассчитывается отношение показателей %LFopтoпробa/%LFфон и %VLFopтопроба/%VLFфон при проведении ортостатической пробы к таковому при фоновой записи. При выявлении отношения %LFopтoпробa/%LFфон менее 1,0 в сочетании с отношением %VLFopтопроба/%VLFфон более 1,0 диагностируют кардиальную автономную нейропатию до появления клинических симптомов. Способ позволяет на ранних стадиях до клинических проявлений выявить кардиальную автономную нейропатию, что позволит назначить адекватную патогенетическую терапию. 2 табл., 1 ил., 2 пр.
Способ ранней диагностики кардиальной автономной нейропатии у пациентов с артериальной гипертензией и метаболическими нарушениями, включающий оценку вегетативной регуляции сердечного ритма при фоновой записи в течение 5 минут и при активной ортостатической пробе в течение 5 минут с последующим спектральным анализом, отличающийся тем, что определяют отношение относительных значений LF и VLF, полученных при проведении активной ортостатической пробы, к таковым при фоновой записи и при одновременном отношении %LFортопроба/%LFфон менее 1,0 и %VLFортопроба/%VLFфон более 1,0 диагностируют кардиальную автономную нейропатию до появления клинических симптомов.
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ АВТОНОМНОЙ КАРДИАЛЬНОЙ НЕЙРОПАТИИ У ДЕТЕЙ, БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ I ТИПА | 2002 |
|
RU2218864C1 |
| СПОСОБ ДОКЛИНИЧЕСКОЙ ДИАГНОСТИКИ ДИАБЕТИЧЕСКОЙ АВТОНОМНОЙ КАРДИОВАСКУЛЯРНОЙ НЕЙРОПАТИИ У ДЕТЕЙ И ПОДРОСТКОВ | 2004 |
|
RU2261654C1 |
| КУЗНЕЦОВА И.Г | |||
| и др | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| КАЗАКОВА Л.В | |||
| и др | |||
| Диагностическое значение кардиоваскулярных тестов в оценке вегетативной нейропатии при сахарном диабете первого | |||
Авторы
Даты
2016-06-10—Публикация
2015-06-24—Подача