Изобретение относится к нефтедобывающей промышленности, в частности к способам термохимической обработки добывающих и нагнетательных скважин. Техническим результатом является прогрев призабойной зоны пласта, удаление асфальтосмолистых и парафиновых отложений (АСПО) со стенок скважины и внутрискважинного оборудования, улучшение фильтрационных характеристик призабойной зоны за счет выделения большого количества тепла в ходе химической реакции. Химическая реакция протекает без образования труднорастворимых соединений и продуктов реакции, вызывающих коррозию нефтепромыслового оборудования, а используемые компоненты вступают в реакцию при стандартных условиях (Т=20°C, Р=101 кПа).
Известен способ термохимической обработки ПЗП, в основе которого лежит химическая реакция, протекающая между нитритом натрия NaNO2 и хлоридом аммония NH4Cl (1) (патент US №5183581 А, опубл. 02.02.1993). Реагенты закачивают в скважину в виде двух эмульсий обратного типа, дисперсионная среда которых представлена органическим растворителем. Дисперсная фаза первой эмульсии состоит из насыщенного раствора хлорида аммония NH4Cl (концентрация 2,0-6,0 М) с добавлением 96% уксусной кислоты СН3СООН. Дисперсная фаза второй эмульсии состоит из насыщенного раствора нитрита натрия NaNO2 (концентрация 5,0-9,0 М).

Способ термохимической обработки ПЗП заключается в одновременной закачке обеих эмульсий в скважину.
Недостатком данного способа является то, что при использовании концентрированной уксусной кислоты СН3СООН окислительно-восстановительная реакция между нитритом натрия и хлоридом аммония идет с выделением диоксида азота NO2 (бурого газа), под действием которого происходит коррозия внутрискважинного оборудования и эксплуатационной колонны. Выделение диоксида азота в скважине может привести к отравлению рабочего персонала при реализации технологии освоения скважин.
Известен термохимический состав (патент РФ №2165011, кл. Е21В 43/24, Е21В 43/27, опубл. 10.04.2001), содержащий нитрит натрия NaNO2, карбамид (NH2)2CO и соляную кислоту HCl. Экзотермическая реакции между нитритом натрия, карбамидом и соляной кислотой протекает по уравнению (2).

Способ термохимической обработки ПЗП заключается в закачке насыщенных водных растворов карбамида CO(NH2)2, нитрита натрия NaNO2 и концентрированной соляной кислоты HCl. Реагенты закачивают в скважину в виде двух концентрированных, 65-70% кинетически и агрегативно устойчивых эмульсий обратного типа, где дисперсная фаза одной эмульсии состоит из смеси насыщенных водных растворов карбамида и нитрита натрия плотностью 1250 кг/м3, а другая в качестве дисперсной фазы содержит концентрированную 31% соляную кислоту плотностью 1190 кг/м3.
Недостатком данного способа является то, что концентрированная соляная кислота вызывает коррозию оборудования, а при взаимодействии соляной кислоты с нитритом натрия будет выделяться диоксид азота NO2, который также вызывает коррозию металлов. Кроме того, температурный эффект реакции в сильной степени зависит от концентрации кислоты. При использовании разбавленной соляной кислоты HCl (С≤20%), температурный эффект заметно снижается.
Известен способ обработки призабойной зоны добывающих скважин (патент РФ №2373385, кл. Е21В 43/25, опубл. 20.11.2009 г.), по компонентному составу газогенерирующей системы аналогичный патенту РФ №2165011. Отличие заключается в том, что в скважину закачиваются концентрированные водные растворы нитрита натрия NaNO2, карбамида (NH2)2CO и сульфаминовой кислоты NH2SO3H (3) совместно с ПАВ и декольматирующими реагентами (ПАВ, кислота или органический растворитель).

Обработку скважины осуществляют путем закачки и последующей продавки в пласт водных растворов указанных реагентов.
Преимуществом этого способа является большой тепловой эффект реакции - 1474 кДж/моль. Недостатком является то, что взаимодействие концентрированной сульфаминовой кислоты NH2SO3H с нитритом натрия NaNO2 сопровождается выделением диоксида азота NO2.
Известен термохимический состав (авторское свидетельство СССР №1739014 А1, кл. Е21В 43/24, Е21В 43/27, опубл. Бюл. N21, 07.06.1992 г.), основанный на протекании экзотермической реакции непосредственно в призабойной зоне скважины между комплексным соединением азотной кислоты [CO(NH2)2·HNO3] и нитритом натрия NaNO2 (4). Комплексное соединение азотной кислоты и карбамида (азотнокислый карбамид) получают смешением на поверхности концентрированной азотной кислоты (60%) и насыщенного раствора карбамида (5).
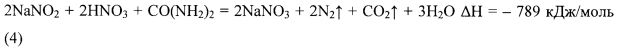

В зависимости от геологических условий предлагаемый способ термохимической обработки ПЗП реализуется по двум технологическим схемам. В скважинах с низкой приемистостью (ориентировочно до 50 м3/ч) способ осуществляется параллельной закачкой суспензии азотнокислого карбамида и раствора нитрита натрия через затрубное пространство и НКТ. В скважинах с высокой приемистостью способ реализуют последовательной закачкой сначала суспензии азотнокислого карбамида, затем раствора нитрита натрия.
Недостатками данного способа является следующее.
1) Применение концентрированной азотной кислоты, что требует применения специального оборудования и средств защиты.
2) При взаимодействии комплексного соединения азотной кислоты [CO(NH2)2·HNO3] с нитритом натрия NaNO2 выделяется диоксид азота NO2.
Известен способ термохимической обработки пласта (авторское свидетельство SU №1816854 А1, кл. Е21В 43/27, опубл. Бюл. №19, 23.05.1993 г.), основанный на взаимодействии минеральных солей гидразина или гидроксиламина (хлориды, нитраты, сульфаты) с нитритом натрия NaNO2 (6, 7) или калия KNO2.

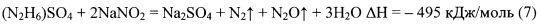
Указанные реагенты закачивают совместно в виде суспензии в углеводородной жидкости. При контакте суспензии реагентов на забое скважины или в пласте с водой происходит переход реагентов из углеводородной фазы в водную фазу, где они растворяются и вступают в экзотермическую реакцию.
Недостатками данного способа является следующее.
1) Взрывоопасность и токсичность солей гидразина и гидроксиламина, а также их высокая стоимость.
2) Термохимическая реакция минеральных солей гидразина или гидроксиламина с нитритом натрия или калия не поддается регулированию, поскольку процессы перехода и растворения кристаллических солей данных веществ из углеводородной фазы в воду растянуты во времени и зависят от наличия на забое скважины и в пласте воды и эффективности смешения углеводородной дисперсии реагентов с водной фазой.
Известен состав для удаления асфальтеносмолопарафиновых отложений (АСПО) из нефтепромыслового оборудования, трубопроводов и резервуаров (патент РФ №2215866, кл. Е21В 37/06, опубл. 10.11.2003 г.). Водные растворы состава имеют следующее соотношение компонентов, мас. %:
Раствор А - сульфаминовая кислота NH2SO3H (3-30 мас.%), технический водный аммиак NH4OH (18-70 мас.%), остальное - Н2О.
Раствор Б - гипохлорит натрия NaOCl (7-20 мас. %), остальное - Н2О.
В заявляемом составе избыток аммиака нейтрализует сульфаминовую кислоту (8) и переводит рН раствора из кислой в щелочную среду. Гипохлорит натрия взаимодействует с сульфаминовой кислотой, нейтрализованной аммиаком (сульфамат аммония NH2SO3NH4) (9), а также с избытком аммиака (10), в результате чего выделяется большое количество тепла.


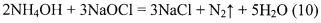
Преимуществом способа является большой тепловой эффект реакции - 1700 кДж/моль.
Наиболее близким по технической сущности и достигаемому эффекту является способ термохимического воздействия на призабойную зону пласта (патент РФ №2224884, кл. Е21В 43/25, Е21В 37/06, опубл. 27.02.2004 г.). Технология заключается в последовательном закачивании на забой скважины двух составов, представляющих собой горюче-окислительную систему, в которой первый состав содержит: аммиачную селитру NH4NO3 (15-65%), карбамид CO(NH2)2 (2-18%), азотнокислый никель Ni(NO3)2 (0,0005-0,05%), остальное - вода. Второй состав содержит нитрит натрия NaNO2 (15-65%), остальное - вода.
Недостатком способа-прототипа является то, что интенсивное протекание реакции между нитритом натрия, карбамидом и нитратом аммония, сопровождающееся выделением тепла, начинается при разогреве реакционной порядка 60°С, поэтому использование такой технологии для скважин с пластовой температурой ниже 60°С не представляется возможным.
Решаемая задача и ожидаемый технический результат заключаются в создании способа термохимической обработки призабойной зоны пласта, позволяющего эффективно удалять АСПО за счет выделения большого количества тепла, без образования в ходе химических превращений труднорастворимых соединений и продуктов реакции, вызывающих коррозию нефтепромыслового оборудования, причем используемые компоненты должны вступать между собой в химическую реакцию при стандартных условиях (Т=20°C, Р=101 кПа).
Поставленная задача решается тем, что предлагаемый способ термохимической обработки призабойной зоны пласта, включающий закачку на забой скважины двух водных растворов, первый из которых содержит нитрат аммония, а второй - нитрит натрия, отличается тем, что первый раствор содержит дополнительно кислоту лимонную и карбонат натрия при соотношении компонентов, мас.%:
а второй раствор содержит, мас.%:
причем закачку указанных растворов осуществляют параллельно или последовательно в объемах, обеспечивающих стехиометрическое взаимодействие нитрита натрия с нитратом аммония и лимонной кислотой.
Целесообразно использование насыщенных растворов NaNO2 и NH4NO3, так как в более разбавленных растворах с увеличением доли воды в растворе, уменьшается температурный эффект (т.е. уменьшается прирост температуры за счет снижения концентрации реагирующих веществ).
Реакция между NaNO2 и NH4NO3, стехиометрическое взаимодействие которых упомянуто выше, протекает по уравнению (11):

Температурный барьер начала протекания реакции (11) имеет величину порядка 73°C. Для достижения этой температуры авторы использовали тепловой эффект параллельно протекающей реакции взаимодействия нитрита натрия с кислотой (12). В качестве кислоты было предложено использовать лимонную кислоту C6H8O7.

Реакция между NaNO2 и лимонной кислотой C6H8O7, стехиометрическое взаимодействие которых также упомянуто выше, обеспечивает температуру начала протекания реакции (11).
Выделение диоксида азота NO2, образующегося при взаимодействии кислоты и нитрита натрия NaNO2 (при рН раствора ≤4,0) удалось избежать путем дополнительного введения карбоната натрия Na2CO3 в раствор NH4NO3. Дополнительно введенный в состав карбонат натрия Na2CO3 образует с лимонной кислотой C6H8O7 цитратный буферный раствор. Изменением концентрации лимонной кислоты и количества цитрата натрия Na3C6H5O7 можно получить растворы с различным рН.
В результате экспериментов удалось найти оптимальное соотношение реагентов, при котором наблюдается максимальный температурный эффект реакционной массы, все продукты реакции хорошо растворимы в воде, отсутствует выделение вызывающих коррозию газов.
Способ термохимической обработки призабойной зоны пласта заключается в последовательной или параллельной закачке в призабойную зону пласта нитрата аммония (NH4NO3), лимонной кислоты (C6H8O7), нитрита натрия (NaNO2) и карбоната натрия (Na2CO3) в виде двух концентрированных, насыщенных водных растворов, один из которых содержит нитрат аммония, лимонную кислоту и карбонат натрия (раствор №1 или Компонент А), другой содержит нитрит натрия (раствор №2 или Компонент Б), при следующем соотношении: 
При смешивании на забое скважины данных растворов они реагируют с выделением большого количества теплоты и газообразных продуктов реакции.
ОПИСАНИЕ ЛАБОРАТОРНЫХ ЭКСПЕРИМЕНОВ
Для проведения эксперимента были взяты следующие реактивы: нитрит натрия (NaNO2) технический, нитрат аммония (NH4NO3) технический, лимонная кислота (C6H8O7) квалификации "ч" (чистая), карбонат натрия (сода кальцинированная, Na2CO3), вода дистиллированная.
В основе технического решения, как указано выше, лежит реакция, протекающая между насыщенными растворами NaNO2 и NH4NO3 (11).
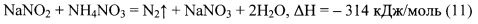
Реакция (11) начинается при температуре выше 70°C и протекает с выделением газообразного азота, выделяющегося при разложении неустойчивого промежуточного продукта реакции - нитрита аммония ((NH4)NO2), разлагающегося в воде при 60-70°C (13) [1].

Температурный барьер начала протекания реакции (11) определен экспериментальным методом путем смешивания насыщенных растворов NaNO2 и NH4NO3, термостатированных при различных температурах.
Исходя из растворимости нитрита натрия (NaNO2) - 83 г при 20°C в 100 г воды [2], нитрата аммония (NH4NO3) - 192 г при 20°C в 100 г воды [3], были приготовлены растворы, насыщенные этими солями. В 30 мл воды растворили 40,5 г NH4NO3, в 42 мл воды растворили 35 г NaNO2. Получилось 54 мл раствора NaNO2 (плотность ρ=1,345 г/мл) и 58 мл раствора NH4NO3 (плотность ρ=1,265 г/мл). Авторы использовали именно насыщенные растворы NaNO2 и NH4NO3, так как в более разбавленных растворах с увеличением доли воды в растворе, уменьшается температурный эффект (т.е. уменьшается прирост температуры за счет снижения концентрации реагирующих веществ). Результаты, представляющие практический интерес, получаются при общем содержании в реагирующих растворах воды 48,4-54,4% (таблица 1 ниже в разделе «Лабораторные эксперименты», фиг. 1 - зависимость максимальной температуры (Tmax, °C) реагирующих растворов №1 и №2 от общего содержания воды (Н2О, %)).
Чтобы инициировать протекание реакции (11), необходимо разогреть реакционную массу до Т=73°C. Для достижения этой температуры авторы использовали тепловой эффект указанной выше параллельно протекающей реакции взаимодействия нитрита натрия с кислотой (12). В качестве кислоты использовали лимонную кислоту C6H8O7.
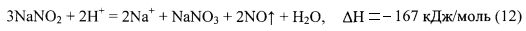
Количество лимонной кислоты подбиралось экспериментальным путем, таким образом, чтобы в результате взаимодействия ее с нитритом натрия выделилось достаточное количество тепла для поднятия температуры в объеме реагирующих растворов выше 70°C.
Выделение диоксида азота NO2, образующегося при взаимодействии кислоты и NaNO2 (при рН раствора ≤4,0), удалось избежать путем дополнительного введения карбоната натрия Na2CO3 в раствор нитрата аммония.
Экспериментально было установлено, что при рН>4 диоксид азота NO2 не образуется.
Дополнительно введенный в состав карбонат натрия Na2CO3 образует с лимонной кислотой C6H8O7 цитратный буферный раствор (регулятор рН*). (*Коцентрация ионов водорода (рН) в растворе лимонной кислоты зависит от ее концентрации и степени диссоциации. Степень диссоциации C6H8O7 в растворе понизится, если добавить к раствору соль этой кислоты - цитрат натрия Na3C6H5O7. Чем выше концентрация соли, тем меньше рН. Таким образом, изменением концентрации лимонной кислоты и количества цитрата натрия Na3C6H5O7 (образуется при добавлении к раствору лимонной кислоты карбоната натрия) можно получить растворы с различным рН). Результаты, представляющие практический интерес, получаются при значении рН=4,1-4,5 (таблица 2 ниже в разделе «Лабораторные эксперименты»).
ЛАБОРАТОРНЫЕ ЭКСПЕРИМЕНТЫ
Лабораторный эксперимент №1.
Приготовлены растворы:
Раствор №1 (47 мл) - (32 г NH4NO3 + 2,0 г C6H8O7 + 0,4 г Na2CO3 + 24,8 мл H2O)
Раствор №2 (46 мл) - (28,4 г NaNO2 + 34 мл H2O)
Растворы смешивались в соотношении: 9,4 мл раствора №1 + 9,2 мл раствора №2 + N мл H2O, максимальное значение температуры фиксировалось ртутным лабораторным термометром. Результаты, представляющие практический интерес, получаются при общем содержании в реагирующих растворах воды от 48,4% до 54,4% (опыты №№1-5, таблица 1), причем максимальная температура разогрева реакционной смеси составляет от 93°C в опыте с содержанием воды 54,4% до 104°C в опыте с содержанием воды 48,4%. Соответственно максимальная температура разогрева реакционной массы от 93°C обеспечивается содержанием NH4NO3 в первом растворе от 48 мас.% до 54 мас.% и NaNO2 во втором растворе от 40 мас.% до 45 мас.% (округлено до целых единиц процентов).
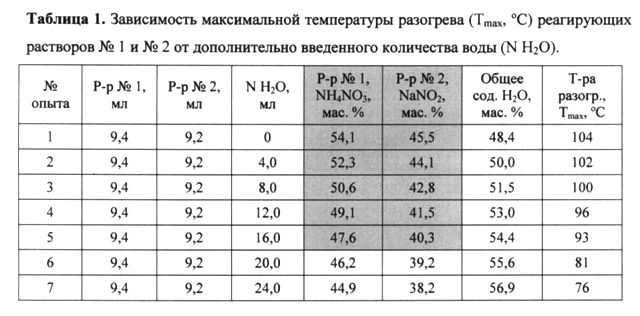
Лабораторный эксперимент №2.
Приготовлены растворы:
Раствор №1′ - (32 г NH4NO3 + 2 г C6H8O7 + 25 мл H2O)
Раствор №1″ - (2,0 г Na2CO3 + 10 мл H2O)
Раствор №2 - (28 г NaNO2 + 34 мл H2O)
В раствор №1′ при непрерывном перемешивании магнитной мешалкой, из бюретки добавлялся раствор №1″. Значения рН раствора №1′ измерялись стеклянным электродом. При значении рН=1,9-3,9 в растворе №1′ взаимодействие его с раствором №2 сопровождалось выделением NO2 (таблица 2, опыты №№1-7). Результаты, представляющие практический интерес, получаются при значении рН=4,1-4,5 (таблица 2, опыты №№8-9); в этом диапазоне рН наблюдается интенсивное протекание реакции без выделения NO2. При дальнейшем повышении рН скорость реакции значительно уменьшается и при рН>5 наблюдается лишь слабое газовыделение без существенного разогрева реакционной массы (таблица 2, опыты №№10-11).
Таким образом, с учетом установленного в лабораторном эксперименте №1 диапазона разбавления реагирующих растворов (таблица 1), оптимальное содержание лимонной кислоты лежит в диапазоне от 2,9 мас.% (в растворе с содержанием H2O 48 мас.%) до 3,4 мас.% (в растворе с содержанием H2O 41 мас.%), оптимальное содержание карбоната натрия лежит в диапазоне от 2,3 мас.% (минимальное его содержание в растворе NH4NO3 с содержанием H2O 48 мас.%) до 3,0 мас.% (максимальное его содержание в растворе NH4NO3 с содержанием H2O 41 мас.%).
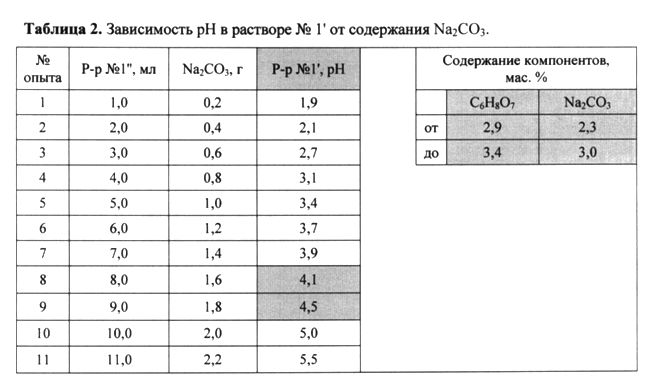
Лабораторный эксперимент №3.
Для определения эффективности состава на поверхность стальной пластины площадью 10 см2 равномерным слоем нанесли 2 г АСПО с температурой плавления 50-70°С поместили ее в стеклянный цилиндр. Затем в него внесли раствор №1 (NH4NO3 47,6%, C6H8O7 2,9%, Na2CO3 2,3%, H2O 47,2%) и №2 (NaNO2 40,3%, H2O 59,7%) в объемах, обеспечивающих стехиометрическое взаимодействие реагентов. В ходе реакции (в течение 5-10 мин) происходила очистка стальной пластины от АСПО. После завершения реакции взвешивали пластину для определения массы оставшегося АСПО. Результаты эффективности удаления АСПО представлены в таблице 3.

Из таблицы 3 можно сделать вывод: для эффективного удаления АСПО на 1 м2 загрязненной поверхности требуется 0,8 л термохимического состава, получаемого при смешении растворов №1 и №2 (опыты №№1-3 проведены при атмосферных условиях).
Лабораторный эксперимент №4 - по прототипу.
Приготовлены растворы:
Раствор №1 - в мас.%: NH4NO3 48,7%, CO(NH2)2 13,3%, Ni(NO3)2 0,03%, H2O 38%.
Раствор №2 - в мас.%: NaNO2 45,5%, H2O 54,5%.
Массы реагентов рассчитаны исходя из стехиометрических соотношений уравнений реакций взаимодействия нитрита натрия NaNO2 с нитратом аммония NH4NO3 и карбамидом CO(NH2)2. Растворы приготовлены с учетом растворимости компонентов в 100 г воды при 20°C.
Раствор №1, взятый в объеме 1,3 мл, и раствор №2, взятый в объеме 2 мл, термостатировались при различных температурах, затем смешивались. Визуально наблюдалось протекание реакции между растворами (газовыделение), максимальное значение температуры в ходе реакции фиксировалось ртутным лабораторным термометром (таблица 4).


Таким образом, из экспериментальных данных можно сделать заключение, что при указанном в патенте-прототипе соотношении реагентов в смешиваемых растворах, даже после термостатирования до 80°C, реакция между ними протекает без существенного разогрева реакционной массы, а дополнительное введение нитрата никеля Ni(NO3)2 (таблица 4, опыт №5 - прототип), действительно, увеличивает скорость реакции и температурный эффект; но и при введении нитрата никеля необходимо предварительное термостатирование смешиваемых растворов.
В отличие от прототипа, предлагаемый способ обеспечивает вступление реагентов в химическую реакцию при стандартных условиях (Т=20°C, Р=101 кПа - лабораторные эксперименты №№1, 2, 3); соответственно, обеспечивается термохимическая обработка призабойных зон скважин с более низкой пластовой температурой, в том числе, ниже 60°C. Эффективное удаление АСПО происходит за счет выделения большого количества тепла, без образования в ходе химических превращений труднорастворимых соединений и продуктов реакции, вызывающих коррозию нефтепромыслового оборудования.
ЛИТЕРАТУРА
1. Лидин Р.А., Андреева Л.Л., Молочко В.А. Реакции неорганических веществ: справочник / 2-е изд., перераб. и доп. - М.: Дрофа, 2007.
2. Рабинович В.А., Хавин В.Я. Краткий химический справочник / 3-е изд. перераб. и доп. - Л.: Химия, 1991.
3. Лидин Р.А., Андреева Л.Л., Молочко В.А. Константы неорганических веществ: справочник / 3-е изд., стереотип. - М.: Дрофа, 2008.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЭНЕРГОГАЗООБРАЗУЮЩИЙ СОСТАВ И ТЕХНОЛОГИЯ ОБРАБОТКИ ПРИЗАБОЙНОЙ ЗОНЫ ПРОДУКТИВНОГО ПЛАСТА | 2014 |
|
RU2615543C2 |
| Способ обработки нефтяного пласта | 2021 |
|
RU2766283C1 |
| Способ термохимической обработки нефтяного пласта | 2019 |
|
RU2721200C1 |
| СПОСОБ ТЕРМОХИМИЧЕСКОЙ ОБРАБОТКИ ПЛАСТА | 2018 |
|
RU2675394C1 |
| Термогазохимический состав и способ его применения при обработке призабойной и удаленной зоны продуктивного пласта (варианты) | 2022 |
|
RU2803463C1 |
| Термогазохимический бинарный состав и способ применения для обработки призабойной и удаленной зон нефтегазоносного пласта | 2015 |
|
RU2637259C2 |
| ТЕРМОХИМИЧЕСКИЙ СОСТАВ ДЛЯ УДАЛЕНИЯ АСФАЛЬТЕНОСМОЛОПАРАФИНОВЫХ ОТЛОЖЕНИЙ | 2002 |
|
RU2203411C1 |
| СПОСОБ ТЕРМОХИМИЧЕСКОЙ ОБРАБОТКИ ПРИСКВАЖИННОЙ ЧАСТИ НЕФТЯНОГО ПЛАСТА | 1990 |
|
RU2070283C1 |
| СПОСОБ ТЕРМОХИМИЧЕСКОЙ ОБРАБОТКИ ПРИЗАБОЙНОЙ ЗОНЫ ПЛАСТА | 2000 |
|
RU2165011C1 |
| ТЕРМОХИМИЧЕСКИЙ СОСТАВ ДЛЯ УДАЛЕНИЯ АСФАЛЬТЕНОСМОЛОПАРАФИНОВЫХ ОТЛОЖЕНИЙ | 2003 |
|
RU2215866C1 |

Изобретение относится к нефтедобывающей промышленности. Технический результат - эффективное удаление асфальтосмолистых и парафиновых отложений за счет выделения большого количества тепла без образования в ходе химических превращений труднорастворимых соединений и продуктов реакции, вызывающих коррозию нефтепромыслового оборудования, используемые компоненты вступают между собой в химическую реакцию при стандартных условиях (Т=20°C, Р=101 кПа). Способ термохимической обработки призабойной зоны пласта включает закачку на забой скважины двух водных растворов. Первый раствор содержит, мас.%: нитрат аммония NH4NO3 48-54; кислота лимонная C6H8O7 2,9-3,4; карбонат натрия Na2CO3 2,3-3,0; вода пресная - остальное. Второй раствор содержит, мас.%: нитрит натрия NaNO2 40-45; вода пресная - остальное. Закачку указанных растворов осуществляют параллельно или последовательно в объемах, обеспечивающих стехиометрическое взаимодействие нитрита натрия с нитратом аммония и лимонной кислотой. 4 табл., 1 ил.
Способ термохимической обработки призабойной зоны пласта, включающий закачку на забой скважины двух водных растворов, первый из которых содержит нитрат аммония, а второй - нитрит натрия, отличающийся тем, что первый раствор содержит дополнительно кислоту лимонную и карбонат натрия при соотношении компонентов, мас.%:
а второй раствор содержит, мас.%:
причем закачку указанных растворов осуществляют параллельно или последовательно в объемах, обеспечивающих стехиометрическое взаимодействие нитрита натрия с нитратом аммония и лимонной кислотой.
| СПОСОБ ТЕРМОХИМИЧЕСКОЙ ОБРАБОТКИ ПРИЗАБОЙНОЙ ЗОНЫ ПЛАСТА И СТВОЛА СКВАЖИНЫ | 1996 |
|
RU2102589C1 |
| Способ термохимического воздействия на призабойную зону пласта | 2002 |
|
RU2224884C2 |
| СПОСОБ ТЕРМОХИМИЧЕСКОЙ ОБРАБОТКИ ПРИЗАБОЙНОЙ ЗОНЫ ПЛАСТА | 2000 |
|
RU2165011C1 |
| СПОСОБ ОБРАБОТКИ ПРИЗАБОЙНЫХ ЗОН ДОБЫВАЮЩИХ СКВАЖИН | 2008 |
|
RU2373385C1 |
| US 4482018 A, 13.11.1984 | |||
| US 4219083 A, 26.08.1980 | |||
| US 4330037 A, 18.05.1982. | |||
Авторы
Даты
2016-06-20—Публикация
2015-04-07—Подача