Изобретение относится к области медицины, в частности к фармацевтической промышленности, и описывает фармацевтическую композицию, включающую ламивудин.
Профилактика инфицирования вирусами иммунодефицита человека (ВИЧ) и гепатита В, а также лечение синдрома приобретенного иммунодефицита (СПИД) и гепатита Б являются одними из наиболее актуальных медико-социологических проблем.
ВИЧ/СПИД является основной инфекционной причиной смерти в мире. Ежегодно от ВИЧ/СПИД умирает 2 млн человек и на сегодня эта болезнь унесла жизни более 27 млн человек. Ежедневно ВИЧ-инфицированными становятся 7000 человек.
Вирусный гепатит В - широко распространенное во всем мире заболевание, которое является причиной острых и хронических гепатитов.
Несмотря на доступность высокоэффективной вакцины, в настоящее время во всем мире насчитывается 350 миллионов человек с хронической HBV-инфекцией.
Согласно результатам исследований, у 6-13% ВИЧ-инфицированных имеет место соинфекция HBV. Соинфекция ВИЧ наиболее распространена у лиц, проживающих в регионах, где оба вируса являются эндемичными, например в Южной Африке. У лиц с соинфекцией HBV/ВИЧ, как правило, отмечается более высокий уровень HBV ДНК, более низкая частота спонтанной сероконверсии HBeAg, более тяжелое поражение печени и более высокая частота летальных исходов, связанных с заболеванием печени [Care of patients with chronic hepatitis В and HIV co-infection: recommendations from an HIV-HBV International Panel / Soriano V., Puoti M., Bonacini M., Brook G., Cargnel Α., Rockstroh J., et al. // AIDS. - 2005. - №19. P. 221-240].
Ламивудин, эмтрицитабин и тенофовир являются АН с активностью в отношении как ВИЧ, так и HBV. Однако у пациентов с соинфекцией HBV/ВИЧ наблюдается высокая частота формирования резистентности HBV к ламивудину, которая достигает 90% за 4 года [Long-term incidence of hepatitis В virus resistance to lamivudine in human immunodeficiency virus-infected patitents / Benhamou Y., Bochet M., Thibault V. et al. // HEPATOLOGY. - 2000. - №31. - P. 1030-1031]. Тенофовир в комбинации с ламивудином или эмтрицитабином широко назначаются в качестве компонента ВААРТ у пациентов с соинфекцией HBV/ВИЧ. Кроме того, тенофовир обладает активностью против ламивудин-резистентных штаммов HBV и снижает частоту резистентности к ламивудину при применении его в комбинации.
Ламивудин является нуклеозидным ингибитором обратной транскриптазы (НИОТ). В ноябре 1995 г. впервые одобрен Управлением США по контролю качества пищевых продуктов и лекарственных веществ (FDA).
Согласно рекомендациям ВОЗ по терапии у взрослых, подростков и детей, ламивудин широко используется в схемах лечения первой и второй линии. Это лекарственное вещество является важным компонентом комбинированных препаратов.
Руководство ВОЗ 2010 г. рекомендует для терапии первой линии у взрослых и подростков ламивудин или эмтрицитабин вместе с тенофовиром или зидовудином и эфиваренцем или невирапином [World Health Organization. Antiretroviral therapy for HIV infection in adults and adolescents: Recommendations for a public health approach. 2010 Revision. [Online] Health (San Francisco), 2010. [Cited 2012 June 25]].
Из уровня техники известны следующие зарегистрированные в РФ лекарственные препараты ламивудина (таблица 1).
Из данных, представленных в таблице 1, видно, что на рынке РФ имеется всего один препарат в форме раствора с ламивудином - Эпивир®, раствор для приема внутрь (ГлаксоСмитКляйн Инк., Канада).
Препарат Эпивир - раствор для приема внутрь 10 мг/мл, имеет следующий состав, мг:
Таким образом, препарат приготовлен на гидрофильной основе, в которой вспомогательные вещества выполняют следующее функциональное назначение: метилпарагидроксибензоат и пропилпарагидроксибензоат - антимикробные консерванты; сахароза - корригент вкуса; пропиленгликоль - гидрофильный неводный растворитель; искусственный клубничный ароматизатор и искусственный банановый ароматизатор - ароматизаторы; кислота лимонная безводная и натрия цитрат - буферные вещества; кислота хлористоводородная разведенная и натрия гидроксид - регуляторы рН; вода очищенная - растворитель. Все вспомогательные вещества, входящие в состав препарата, кроме ароматизаторов, соответствуют требованиям Европейской Фармакопеи.
Из уровня техники известно о существовании Евразийского патента (ЕА 001990, публ. 22.10.2001) на вышеуказанный состав, который является наиболее близким аналогом к заявляемому изобретению. Указанный патент описывает фармацевтическую композицию, по существу свободную от этанола и содержащую менее 0,005% этилендиаминтетрауксусной кислоты, включающую в себя ламивудин или его фармацевтически приемлемое производное, носитель и систему консервантов, которая включает в себя парабены, причем указанная композиция имеет рН выше 5,5.
Также из уровня техники известно, что рН раствора является важным для стабильности ламивудина, а рН 5,5 является критическим параметром, при понижении которого ламивудин разлагается.
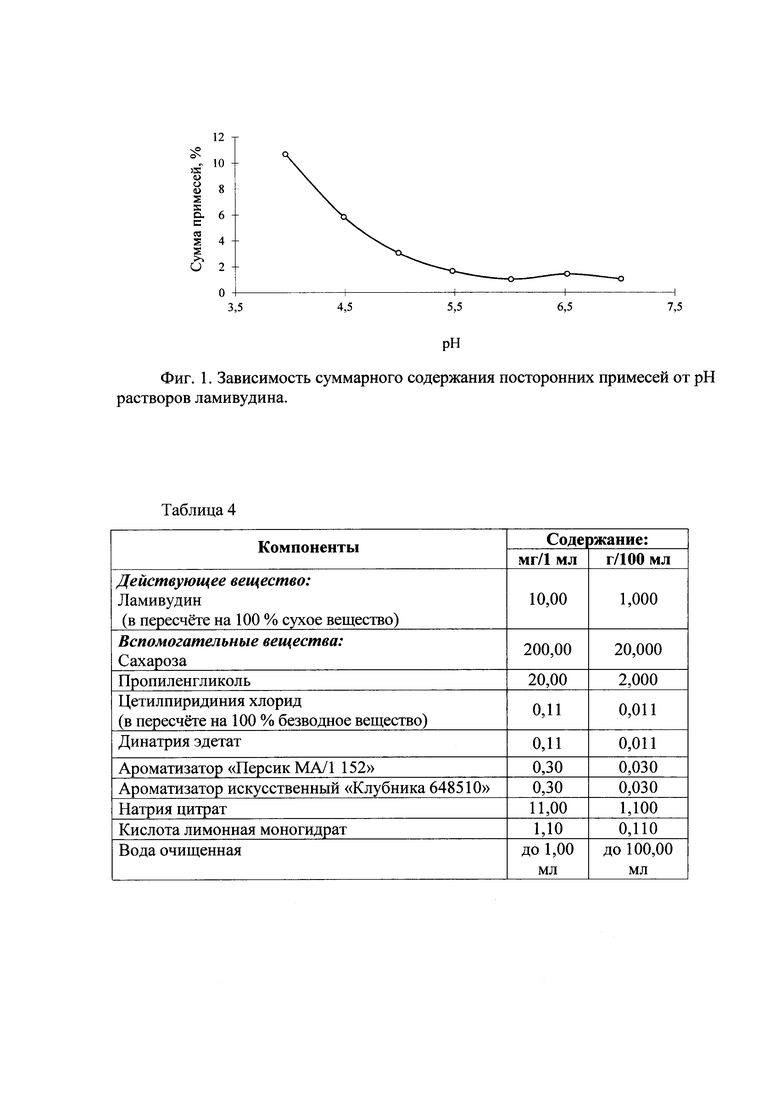
Поэтому представляло интерес исследовать влияние рН на стабильность ламивудина в его гидрофильных основах. В связи с этим исследовали зависимость образования примесей ламивудина от рН его растворов. Образцы растворов доводили до определенного рН при помощи 10% раствора натрия гидроксида или 0,1 M раствора хлористоводородной кислоты и хранили в течение двух недель при температуре 60°С.
В таблице 2 приведены составы исследованных растворов, а в таблице 3 - суммарное содержание примесей, которое определяли по методике, включенной в проект ФСП. На фиг. 1 представлена зависимость суммарного содержания продуктов разложения (посторонних примесей) от рН растворов ламивудина.
Как видно из данных, представленных в таблице 3 и на фиг. 1, с увеличением рН от 4,0 до 5,5 сумма образующихся примесей уменьшается и практически выходит на плато при рН 5,5. Нет достоверных отличий в суммарном содержании примесей, которые образуются в диапазоне рН растворов от 5,5 до 7,0 в процессе их хранения при температуре 60°С.
В патенте №001990 В1 авторы решают проблему замещения этанола увеличением концентрации парабенов на 20-25%, что обеспечивает необходимый уровень консервантной эффективности с рН>5,5 в растворе ламивудина. В частности в составе данной фармацевтической композиции, указанные парабены присутствуют в концентрации от 0,96 до 2 мг/мл метилпарабена и в концентрации от 0,1 до 0,2 мг/мл пропилпарабена соответственно.
Вместе с тем, до настоящего времени научное сообщество не может дать однозначного ответа о безвредности парабенов для человека. Существуют различные точки зрения о безопасности применения парабенов в пищевой промышленности, фармацевтике и косметологии. Мнения ученых в этом вопросе расходятся.
Так, несколько экспертных исследований показали, что существует косвенно-подтвержденная корреляция между наличием парабенов и раком груди. Высокий уровень парабенов был обнаружен в раковой опухоли, точнее в британском исследовании была получена высокая концентрация парабенов в 18 из 20 случаев рака груди [Harvey PW, Everett DJ (2004). «Significance of the detection of esters of p-hydroxybenzoic acid (parabens) in human breast tumours». Journal of Applied Toxicology 24 (1): 1-4. DOI:10.1002/jat.957. PMID 14745840.,Darbre PD, Aljarrah A, Miller WR, Coldham NG, Sauer MJ, Pope GS (2004 Jan-Feb). «Concentrations of parabens in human breast tumours». J Appl Toxicol 24 (1): 5-13. DOI:10.1002/jat.958. PMID 14745841].
Прямых доказательств причинно-следственной связи между парабенами и раком, однако, не было представлено. В 2005 после дополнительных исследований доступных данных [Golden R, Gandy J, Vollmer G (2005). «A review of the endocrine activity of parabens and implications for potential risks to human health». Critical Reviews in Toxicology 35 (5): 435-58. DOI:10.1080/10408440490920104. PMID 16097138], Американское онкологическое общество пришло к выводам о недостаточности научных доказательств для утверждения, что использование косметики, например антиперспирантов, увеличивает индивидуальный риск развития рака груди и о необходимости дальнейших исследований возможного влияния парабенов на рак груди [The American Cancer Society Antiperspirants and Breast Cancer Risk].
Вместе с тем, Европейская научная комиссия по потребительским продуктам (ЕНКПП, англ. SCCP) установила в 2006 году, что доступные данные по парабенам не позволяют дать решающий ответ на вопрос, могут ли пропил, бутил и изобутил парабены безопасно использоваться в косметических товарах при индивидуальной концентрации до 0,4%, разрешенном лимите в ЕС.[SCCP: Opinion on Parabens. Colipa No P82 10 Oct 200]
С 2014 года Франция запретила использование таких парабенов, как изопропил-, изобутил-, пентил- и бензилпарабен. Комиссия по безопасности косметических продуктов посчитала, что несмотря на многочисленные подтверждения безопасности использования парабенов в установленных концентрациях, требуются дополнительные исследования [Яна Зубцова, Тийна Орасмяэ-Медер Бьюти-мифы: Вся правда о ботоксе, стволовых клетках, органической косметике и многом другом. - М.: Альпина Паблишер, 2015. - 296 с. - ISBN 978-5-9614-4887-0.].
В России в 2005 году Постановлением Главного Санитарного Врача РФ был введен запрет на ввоз на территорию Российской Федерации пищевых продуктов, изготовленных с использованием добавок Ε 216 (пара-оксибензойной кислоты пропиловый эфир) и Ε 217 (пара-Оксибензойной кислоты пропиловый эфир, натриевая соль), а также использование указанных добавок при производстве пищевых продуктов.
Поскольку вопрос о безопасности применения парабенов в настоящее время остается дискуссионным, при разработке фармацевтической композиции ламивудина авторами настоящего изобретения была поставлена задача исключения из состава препарата этанола и парабенов, при сохранении необходимой консервирующей эффективности и уровня рН.
Технической задачей настоящего изобретения является расширение перечня лекарственных средств и разработка отечественного препарата, фармацевтически эквивалентного препарату Эпивир, раствор для приема внутрь, 10 мг/мл, при этом исключающего применение нежелательных (небезопасных) агентов в составе для достижения консервирующей эффективности.
Техническим результатом изобретения является получение стабильного препарата в форме раствора для приема внутрь, содержащего безопасное терапевтически эффективное количество ламивудина, свободного от этанола и не содержащего парабены, с составом обеспечивающим создание и поддержание консервирующей эффективности при рН от 5,5 до 7,0.
Авторами настоящего изобретения опытным путем был подобран состав препарата Ламивудин, раствор для приема внутрь, с возможной концентрацией ламивудина 1-50 мг/мл в соответствии с заявленным техническим результатом.
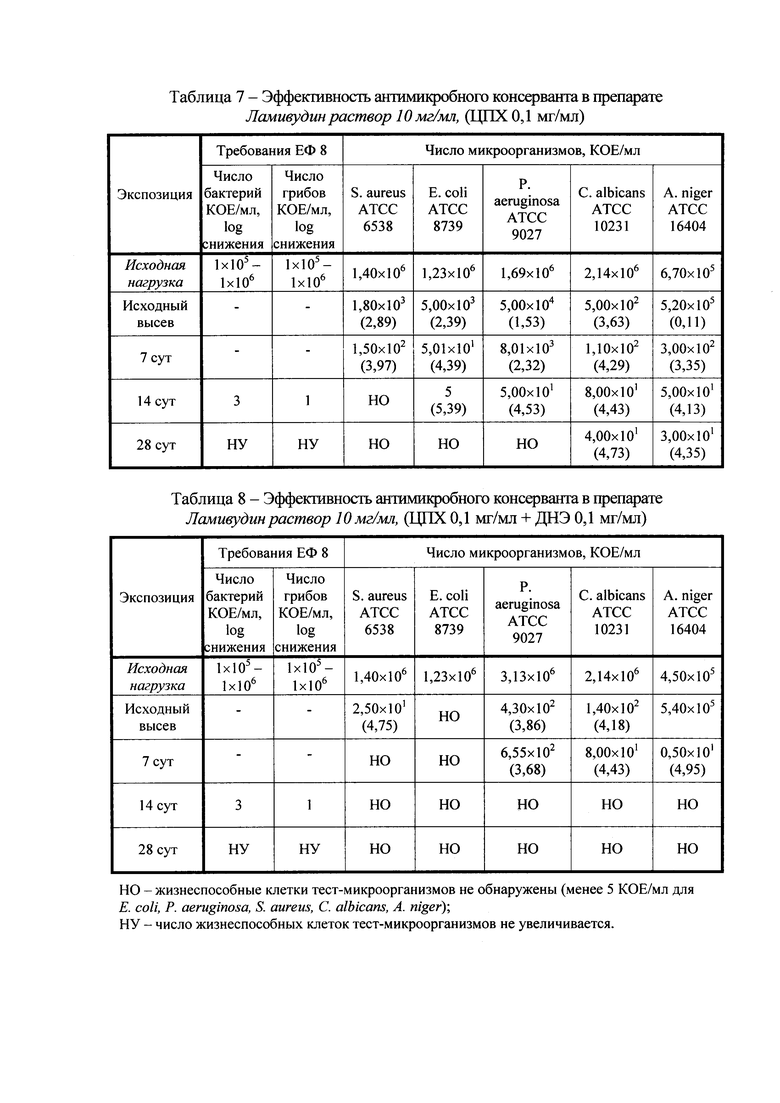
В составе разработанного препарата отсутствуют такие регуляторы рН, как кислота хлористоводородная и натрия гидроксид; вместо них в качестве регуляторов рН выступают натрия цитрат и кислота лимонная моногидрат, содержание которых при необходимости можно варьировать. В качестве регуляторов рН могут быть использованы и другие вещества, образующие буферные растворы с рН более 5,5.
Также в составе разработанного препарата не содержатся парабены. Вместо метилпарагидроксибензоата и пропилпарагидроксибензоата в качестве антимикробного консерванта использовали цетилпиридиния хлорид (ЦПХ). Для усиления эффективности антимикробного действия цетилпиридиния хлорида в состав препарата может быть введен комплексообразователь динатрия эдетат (ДНЭ) в концентрации до 0,2%.
В качестве подходящего антимикробного консерванта был выбран цетилпиридиния хлорид, который является катионным антисептиком и применяется в фармации в качестве лекарственного вещества антимикробного действия и антимикробного консерванта. Цетилпиридиния хлорид применяется в препаратах для лечения кожных заболеваний, инфекций полости рта и горла, в препаратах для орального и ингаляционного применения. В препаратах для орального и ингаляционного применения применяется в концентрациях 0,02-1,5 мг/мл. Суточная доза цетилпиридиния хлорида для взрослых и детей в возрасте старше 12 лет составляет 8 мг, а для детей от 6 до 12 лет - 4 мг.
В результате указанных исследований, авторами была получена фармацевтическая композиция ламивудина, соответствующая заявляемому техническому результату (свободная от этанола и парабенов, при рН от 5,5 до 7,0). Данная композиция содержит гидрофильный носитель, консервирующий агент в виде цетилпиридиния хлорида в количестве 0,1 мг/мл до 0,2 мг/мл и технологические добавки, в качестве которых могут использоваться корригенты вкуса, цвета, запаха и регуляторы рН. Также возможно включение в состав композиции комплексообразователя в виде динатрия эдетата в количестве до 0,2 мг/мл.
Пример 1: Конкретный пример состава разработанного препарата Ламивудин раствор для приема внутрь 10 мг/мл представлен в таблице 4.
Способ производства указанного состава предпочтительно, но не обязательно осуществляют следующим образом:
- последовательно растворяют пропиленгликоль, буферные вещества, цетилпиридиния хлорид и динатрия эдетат, сахарозу, ароматизаторы и ламивудин в воде очищенной;
- фильтруют раствор;
- дозируют раствор во флаконы, укупоривают и этикетируют.
Авторами настоящего изобретения были проведены скрининговые исследования по выбору состава консервирующей системы с использованием цетилпиридиния хлорида и динатрия эдетата. При выборе концентрации цетилпиридиния хлорида учитывали также тот факт, что разовая и суточная доза препарата может составлять для детей и взрослых до 30 мл.
Методика испытания эффективности антимикробных консервантов приведена в общей статье 34 (ОФС 42-0069-07) «Определение эффективности антимикробных консервантов лекарственных средств» ГФ РФ XII изд., а также в Европейской фармакопее (ЕФ) Методы исследования эффективности антимикробного консервирующего действия, приведенные в ГФ РФ XII изд. и ЕФ, существенно не отличаются.
По требованиям общей статьи 34 ГФ РФ XII в лекарственных средствах для приема внутрь десятичный логарифм снижения числа жизнеспособных клеток бактерий через 14 суток должен составлять не менее 1, с 14 до 28 суток число жизнеспособных клеток бактерий не должно увеличиваться. Число жизнеспособных клеток грибов не должно увеличиваться через 14 и 28 суток по сравнению с исходным уровнем. Этот критерий является менее жестким, чем критерий, приведенный в Европейской фармакопее (5.1.3).
В соответствии с требованиями Европейской фармакопеи (5.1.3) в лекарственных средствах для приема внутрь десятичный логарифм снижения числа жизнеспособных клеток бактерий через 14 суток должен составлять не менее 3, через 28 суток число жизнеспособных клеток бактерий не должно увеличиваться. Логарифм снижения числа жизнеспособных клеток грибов через 14 суток должен составлять не менее 1, в дальнейшем число жизнеспособных клеток грибов не должно увеличиваться.
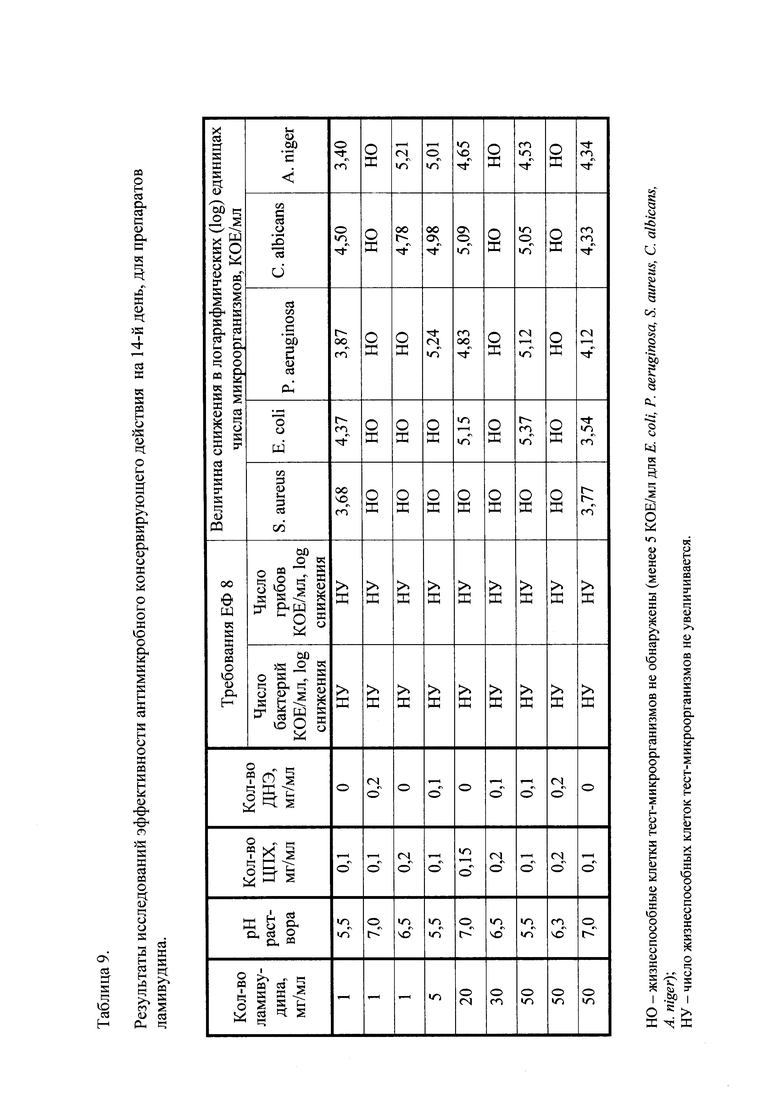
Результаты исследований для примера 1 приведены в таблицах 5-8.
При концентрации цетилпиридиния хлорида (ЦПХ) 0,2 мг/мл эффективность антимикробного консервирующего действия оказывается очень высокой как с динатрия эдетатом (ДНЭ) 0,2 мг/мл, так и без него (табл. 5 и 6).
При снижении в 2 раза концентрации цетилпиридиния хлорида (ЦПХ) до 0,1 мг/мл и динатрия эдетата до 0,1 мг/мл эффективность антимикробного консервирующего действия несколько снижается в отношении P. aeruginosa, S. aureus и A. niger, но остается достаточно высокой. Из данных, представленных в таблице 8, видно, что в лекарственном препарате наблюдается быстрая гибель бактерий. В исходном высеве логарифм снижения числа тест-микроорганизма S. aureus АТСС 6538 составил 4,75, через 7 суток и при последующих высевах жизнеспособные клетки этого тест-микроорганизма не были обнаружены.
В исходном высеве жизнеспособные клетки тест-микроорганизма Е. coli АТСС 8739 не были обнаружены и при последующих высевах жизнеспособные клетки этого тест-микроорганизма также не были обнаружены.
В исходном высеве логарифм снижения числа тест-микроорганизма P. aeruginosa АТСС 9027 составил 3,86, через 7 суток - 3,68, через 14 суток и при последующих высевах жизнеспособные клетки этого тест-микроорганизма не были обнаружены.
В отношении грибов исследуемый препарат также проявил высокую эффективность антимикробного консервирующего действия. В исходном высеве логарифм снижения числа тест-микроорганизма С.albicans АТСС 10231 составил 4,18, через 7 суток - 4,43, через 14 суток и 28 суток жизнеспособные клетки этого тест-микроорганизма не были обнаружены.
В исходном высеве число жизнеспособных клеток тест-микроорганизма A. niger АТСС 16404 существенно не изменялось, через 7 суток логарифм снижения числа тест-микроорганизма A. niger АТСС 16404 составил 4,95, через 14 суток и при последующих высевах жизнеспособные клетки этого тест-микроорганизма не были обнаружены.
Такая эффективность антимикробного консерванта соответствует требованиям ЕФ 8 (5.1.3) к лекарственным средствам для приема внутрь [European Pharmacopoeia 8.0. - 5. General Texts. - 5.1.3. Efficacy of Antimicrobial Preservation] и существенно превосходит требования статьи 34 (ОФС 42-0069-07) «Определение эффективности антимикробных консервантов лекарственных средств» ГФ РФ XII издания к лекарственным средствам категории 3 [Государственная фармакопея Российской Федерации. - М.: Издательство «Научный центр экспертизы средств медицинского применения», 2008. - 704 с.].
Далее исследование растворов ламивудина с различным составом проводили по аналогичной методике. Для исследований было приготовлено несколько вариантов раствора с разным рН и с содержанием ламивудина от 1 мг/мл до 50 мг/мл. Нижний предел содержания 1 мг/мл обусловлен тем, что при меньшем содержании даже для обеспечения эффективной детской суточной дозы ламивудина 30 мг потребуется 30 мл раствора, что неприемлемо много. Верхний же предел 50 мг/мл обусловлен растворимостью ламивудина в гидрофильных растворителях.
В таблице 9 приведены результаты исследований эффективности антимикробного консервирующего действия на 14-й день для препаратов ламивудина с разным рН и содержанием активного вещества.
Полученные данные свидетельствуют о соответствии для всех приведенных вариантов состава эффективности антимикробного консервирующего действия требованиям ЕФ 8 (5.1.3) к лекарственным средствам для приема внутрь
| название | год | авторы | номер документа |
|---|---|---|---|
| Стабильная мягкая лекарственная форма диоксидина | 2020 |
|
RU2741787C1 |
| Фармацевтическая композиция в виде назального спрея на основе кеторолака и способ ее получения | 2015 |
|
RU2611659C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ДЕРМАТОЗОВ (ВАРИАНТЫ) | 2013 |
|
RU2548764C2 |
| Флеботропная комбинированная фармацевтическая композиция | 2017 |
|
RU2704976C2 |
| ЖИДКАЯ ЛЕКАРСТВЕННАЯ ФОРМА РИСПЕРИДОНА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2016 |
|
RU2646812C1 |
| КОМПОЗИЦИЯ АЛЬФА-ИНТЕРФЕРОНА В ФОРМЕ ВОДНОГО РАСТВОРА | 2000 |
|
RU2232595C2 |
| ЭМУЛЬСИОННАЯ КОМПОЗИЦИЯ ДИФЛЮПРЕДНАТА, СОДЕРЖАЩАЯ АНТИМИКРОБНЫЙ МЕТАЛЛ | 2014 |
|
RU2666961C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ПРОТИВОВОСПАЛИТЕЛЬНОГО И АНТИМИКРОБНОГО ДЕЙСТВИЯ В ФОРМЕ МАЗИ НА ГИДРОФОБНОЙ ОСНОВЕ ДЛЯ ЛЕЧЕНИЯ КОЖНЫХ ЗАБОЛЕВАНИЙ (ВАРИАНТЫ) | 2006 |
|
RU2325912C1 |
| ЭМУЛЬСИОННАЯ КОМПОЗИЦИЯ ДИФЛУПРЕДНАТА, СОДЕРЖАЩАЯ ЦИНК | 2014 |
|
RU2675813C2 |
| Комбинированная мягкая лекарственная форма диосмина и троксерутина | 2018 |
|
RU2689409C1 |



Изобретение относится к фармацевтике. Описана стабильная фармацевтическая композиция для перорального употребления, содержащая ламивудин в количестве 10 мг/мл, свободная от этанола и парабенов. Композиция включает гидрофильный носитель, представляющий собой воду, консервирующий агент, комплексообразователь и технологические добавки. Консервирующим агентом является цетилпиридиния хлорид в количестве 0,1 мг/мл до 0,2 мг/мл. Комплексообразователем является динатрия эдетат в количестве от 0,11 мг/мл до 0,2 мг/мл. В качестве технологических добавок используют корригенты вкуса, цвета, запаха и регуляторы рН, причем данная композиция имеет уровень рН от 5,5 до 7,0. Изобретение обеспечивает реализацию указанного назначения, а также расширение арсенала лекарственных средств. 1 ил., 9 табл., 1 пр.
Стабильная фармацевтическая композиция для перорального употребления, содержащая ламивудин в количестве 10 мг/мл, свободная от этанола и парабенов, включающая гидрофильный носитель, представляющий собой воду, консервирующий агент, комплексообразователь и технологические добавки, где консервирующим агентом является цетилпиридиния хлорид в количестве 0,1 мг/мл до 0,2 мг/мл, комплексообразователем - динатрия эдетат в количестве от 0,11 мг/мл до 0,2 мг/мл, а в качестве технологических добавок содержит корригенты вкуса, цвета, запаха и регуляторы рН, причем данная композиция имеет уровень рН от 5,5 до 7,0.
| WO 1998042321 А2, 01.10.1998 | |||
| CN 103520094 А, 22.01.2014 | |||
| WO 2009129470 А2, 22.10.2009 | |||
| WO 1997033565 А1, 18.09.1997 | |||
| ЧУЕШОВ В.И | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Харьков- Издательство НФАУ, МТК-Книга, 2002г. | |||
Авторы
Даты
2016-06-20—Публикация
2015-01-19—Подача