Область техники
Изобретение относится к области медицины, в частности к фармацевтической промышленности, и описывает жидкую пероральную лекарственную форму, содержащую рисперидон и способ ее изготовления.
Уровень техники
В настоящее время в мире наблюдается рост психических заболеваний и расстройств поведения личности. Согласно прогноза Всемирной Организации Здравоохранения (ВОЗ), к 2020 году психические расстройства войдут в первую пятерку болезней, ведущих к потере трудоспособности. Общая заболеваемость психическими расстройствами в мире в среднем составляет 15% от общего числа населения, в то время как в России данный показатель равен 25%. Рост психических заболеваний напрямую связан с увеличением числа инвалидов и людей, не способных заниматься трудовой деятельностью. Согласно расчетам ЕС, потери производительности труда, связанные с данными заболеваниями, оцениваются в 3-4% от ВВП.
В то же время, несмотря на серьезность и масштаб проблемы, в мире наблюдается большой разрыв между потребностями в лечении и помощью, оказываемой больным психическими заболеваниями. В странах с низким и средним уровнем дохода от 76% до 85% пациентов с психическими расстройствами не получают никакого лечения. В странах с высоким уровнем дохода в таком положении находятся от 35% до 50% лиц с такими расстройствами [Информационный бюллетень ВОЗ №396 Апрель 2016 г., http://www.who.int/mediacentre/factsheets/fs396/ru/].
В настоящее время в терапии психических расстройств широкое применение находят препараты, относящиеся к группе атипичных нейролептиков (антипсихотиков). Также как и их предшественники - нейролептики - атипичные антипсихотики эффективно устраняют бредовые расстройства, галлюцинации, дезорганизацию мышления и другие клинические проявления психозов. Однако по сравнению с предыдущими поколениями препаратов, атипичные нейролептики в меньшей степени способны вызывать экстрапирамидные симптомы и обладают большей клинической эффективностью [Meltzer HY. Outcome in schizophrenia: Beyond symptom reduction. J Clin Psychiatry 1999; 60(Suppl 3): 3-8].
Традиционные антипсихотические средства эффективны в отношении острой ажитации и в контролировании позитивных симптомов, и вместе с тем мало эффективны в отношении когнитивных расстройств и негативных симптомов при шизофрении [Jibson MD, Tandon R. New atypical antipsychotic medica-tions. J Psychiatr Res 1998; 32: 215-28]. Атипичные антипсихотики, напротив, обладают весьма широким спектром эффективности, позволяя лечить как позитивные, так и негативные симптомы, а также когнитивные расстройства [Bilder RM, Goldman RS, Volavka J, et al. Neurocognitive effects of clozapine, olanzapine, risperidone, and haloperidol in patients with chronic schizophrenia or schizoaffective disorder. Am J Psychiatry 2002; 159: 1018-28].
В связи с их высокой эффективностью атипичные антипсихотики быстро внедряются в широкую клиническую практику. Такие препараты, как рисперидон, оланзапин, кветиапин, зипразидон, арипипразол - рекомендованы в качестве терапии первой линии при лечении пациентов с резистентной шизофренией [Marder SR, Essock SM, Miller AL, Buchanan RW, Davis JM, Kane JM, Lieberman J, Schooler NR. The Mount Sinai Conference on the Pharmacotherapy of schizophrenia. Schizophr Bull 2002; 28: 5-16].
Одними из наиболее широко применяемых лекарственных средств в практике лечения психических заболеваний являются препараты рисперидона. Рисперидон обладает уникальной активностью, воздействуя как на Д2-дофаминовые, так и 5НТ2А-серотониновые рецепторы. В настоящее время рисперидон с успехом применяется в лечении острых и хронических форм шизофрении у взрослых больных. Вместе с тем зарубежные психиатры используют данный препарат у детей с целью лечения гиперактивности, импульсивности, агрессии, стереотипного поведения, обсессивно-компульсивных расстройств. Ряд зарубежных психиатров предполагает, что атипичные нейролептики, в частности рисперидон, могут сыграть важную роль в лечении тяжелых аутистических расстройств [Шинаев Н.Н., Акжигинов Р.Г., Волкова Н.П. Применение атипичного нейролептика рисполепт в клинике пограничных психических расстройств // Психиатрия и психофармакотерапия. - 2000. - Прил. №2. - С. 8-10; Posey DJ, Walsh КН, Wilson GA, et al. Risperidon in the treatment of two very young children with autism // J Child Adolesc Psychopharmacol, 1999, 9, 273-276].
Относительная безопасность рисперидона (отсутствие токсического и мутагенного воздействия в эксперименте, отсутствие осложнений при приеме средних суточных доз лицами среднего возраста), а также отмеченные факты преодоления терапевтической резистентности в лечении тяжелых форм эндогенных заболеваний у взрослых [Козловская Г.В., Калинина М.А., Горюнова А.В., Проселкова М.Е. Опыт применения рисполепта при лечении раннего детского аутизма и шизофрении у детей // Психиатрия и психофармакотерапия. - 2000. - Прил. №2 - С. 10-12] делают рисперидон привлекательным для его применения в детской практике.
Учитывая детский возраст пациентов, а также симптоматику психических заболеваний (поведенческие расстройства на фоне деменции, бред, галлюцинации, агрессивность), проблема затрудненного глотания лекарственных препаратов является актуальной. Кроме того, такое явление как дисфагия (затруднение глотания) широко распространена, особенно среди детей и пожилых людей, и по разным оценкам наблюдается примерно у 35% населения. В этой связи выпуск лекарственных препаратов рисперидона в жидкой форме представляется наиболее удобным и безопасным.
Препараты рисперидона представлены на рынке в виде таблеток, покрытых пленочной оболочкой, таблеток для рассасывания, таблеток, диспергируемых в полости рта, порошков для приготовления суспензии для внутимышечного введения пролонгированного действия, а также растворов для приема внутрь.
Из предшествующего уровня техники известен и представлен на отечественном рынке единственный препарат рисперидона в жидкой лекарственной форме, который принят за прототип предлагаемого технического решения:
- «Рисполепт®» в форме раствора для приема внутрь в дозировке 1 мг/мл производства фирмы Янссен Фармацевтика Н.В., (Бельгия), регистрационное удостоверение П N012226/01 от 14.07.2011 г.
Также из уровня техники известен способ приготовления водных композиций рисперидона по патенту RU 2161965 (опубликован 20.01.2001), при котором, согласно описанию и п. 11 формулы, изготовлению растворов для перорального введения сопутствует этап растворения консерванта в некотором количестве подогретой воды, что, по мнению авторов настоящего изобретения, является излишним и затрудняет процесс производства.
В этой связи существует потребность в разработке качественных и доступных атипичных антипсихотических средств отечественного производства, содержащих рисперидон в виде жидких лекарственных форм, предпочтительно в виде раствора для приема внутрь, удобных для применения и стабильных при хранении, а также, отличающихся более технологичным способом производства.
Технической задачей настоящего изобретения является расширение перечня лекарственных средств отечественного производства.
Техническим результатом (целью) изобретения является создание жидкой лекарственной формы рисперидона, предпочтительно в виде раствора для приема внутрь, стабильной при получении и длительном хранении, фармацевтически эквивалентной прототипу, но при этом отличающейся более технологичным способом производства, заключающимся в отсутствии необходимости нагревания водного раствора при растворении антимикробного консерванта для введения его в состав жидкой лекарственной формы.
Для достижения указанной цели авторами настоящего изобретения была предпринята попытка разработки препарата-аналога - Рисперидон раствор для приема внутрь 1 мг/мл (разрабатываемый препарат), который по эффективности, безвредности и показателям качества не уступал бы препарату «Рисполепт®» раствор для приема внутрь 1 мг/мл («Янссен Фармацевтика Н.В.», Бельгия) (референтный препарат, препарат сравнения, прототип).
Раскрытие изобретения
Исходя из задачи исследования, авторы настоящего изобретения попытались разработать препарат, фармацевтически эквивалентный препарату «Рисполепт®» раствор для приема внутрь 1 мг/мл, имеющий сопоставимые с ним показатели качества и свойства.
Лекарственный препарат является по существу аналогичным оригинальному препарату (препаратом-генериком), если он удовлетворяет критериям одного и того же количественного и качественного состава относительно действующих веществ, одной и той же лекарственной формы и является биоэквивалентным. Лекарственные препараты фармацевтически эквивалентны, если они содержат одно и то же количество одного и того же действующего вещества в одних и тех же лекарственных формах, которые соответствуют требованиям одних и тех же или сопоставимых стандартов (Фармацевтический сектор: Директива 2001/83/ЕС Европейского Парламента и Совета ЕС. - К.: МОРИОН, 2013. - 120 с; CPMP/EWG/QWP/1401/98. Note for guidance on the investigation of bioavailability and bioequivalence. - London: CPMP/EMEA, 26 July 2001). Лекарственный препарат является терапевтически эквивалентным другому препарату, если он содержит то же действующее вещество или его терапевтически активную часть и клинически проявляет такую же эффективность и безопасность, как и препарат, эффективность и безопасность которого установлена (CPMP/EWG/QWP/1401/98. Note for guidance on the investigation of bioavailability and bioequivalence. - London: CPMP/EMEA, 26 July 2001).
Референтный препарат «Рисполепт®» раствор для приема внутрь 1 мг/мл, содержит следующие компоненты (мг/мл):

Целью исследований стала разработка препарата-генерика Рисперидон раствор для приема внутрь 1 мг/мл, который представляет собой истинный раствор со вспомогательными веществами, имеющими аналогичные характеристики, что позволяет рассматривать изменение состава вспомогательных веществ по отношению к референтному препарату как изменение I типа и отнести разрабатываемый препарат к препаратам-генерикам (Надлежащая производственная практика лекарственных средств / Под ред. Н.А. Ляпунова, В.А. Загория, В.П. Георгиевского, Е.П. Безуглой. - К.: МОРИОН, 1999. - 896 с.).
Учитывая физико-химические свойства действующего и вспомогательных веществ, входящих в состав препарата, необходимо было выбрать их качественный и количественный состав по результатам физико-химических, микробиологических, технологических и аналитических исследований.
Действующим веществом в референтном препарате является рисперидон, который содержится в концентрации 1 мг/мл. Поскольку регистрируемый препарат является препаратом-генериком, то для него также выбрана концентрация рисперидона 1 мг/мл, и установлены пределы содержания рисперидона от 0,9 г до 1,1 мг в мл раствора (от 95% до 105% от номинального количества действующего вещества).
Рисперидон практически нерастворим в воде и растворим в разбавленных растворах кислот, поэтому авторами настоящего изобретения было подтверждено, что растворимость рисперидона, а также его устойчивость (физическая стабильность раствора) увеличивается при понижении рН. Наилучшая стабильность раствора наблюдается при значениях рН от 2,0 до 4,0, оптимально при значении рН=3,0±0,2.
При разработке состава вспомогательных веществ, авторы настоящего изобретения столкнулись с проблемой включения консерванта в состав разрабатываемого препарата. В составе оригинального препарата таким консервантом служит бензойная кислота. В фармакопейной статье на данное вещество указано, что бензойная кислота «мало растворима в воде» [European Pharmacopoeia 7.0 Benzoic acid - p. 1467], что соответствует растворимости 1 г вещества в 100-1000 мл воды очищенной при температуре от 15°С до 25°С и «растворима в кипящей воде», что соответствует растворимости 1 г вещества в 10-30 мл воды кипящей.
Бензойная кислота в референтном препарате находится в виде истинного раствора. Соотношение между бензойной кислотой и водой очищенной в препарате составляет 1 г / 19,8 мл, что в 5 раз меньше 100 мл и 50 раз меньше 1000 мл. То есть растворимость бензойной кислоты может повлиять на качество и физическую стабильность раствора. Однако при нагревании раствора до температуры 90°С (состояние закипания воды) растворимость бензойной кислоты в воде очищенной увеличивается, но требует значительных энергозатрат (нагрев и охлаждение раствора), что усложняет технологический процесс и делает его более длительным.
С целью решения данной задачи, авторам удалось разработать рациональный состав препарата-генерика «Рисперидон» раствор для приема внутрь 1 мг/мл, с учетом состава и свойств референтного препарата «Рисполепт®» раствор для приема внутрь 1 мг/мл, а также свойств рисперидона и вспомогательных веществ. При этом выбрать состав препарата таким образом, чтобы изменения в нем по отношению к референтному препарату можно было классифицировать как несущественные изменения I типа [The rules governing medicinal products in the European Union. - V. 2. - Notice to Applicants. - V. 2C. - Regulatory Guidelines. - Guideline on Dossier Requirements for Type IA and IB Notifications. - EC. - July 2003.; Надлежащая производственная практика лекарственных средств / Под ред. Н.А. Ляпунова, В.А. Загория, В.П. Георгиевского, Е.П. Безуглой. - К.: МОРИОН, 1999. - 896 с.; The rules governing medicinal products in the European Union. - V. 2. - Notice to Applicants. - V. 2C. - Regulatory Guidelines. - Guideline on the Categorisation of new Applications (NA) versus Variations Applications (V). - European Comission. - January 2002. - 11 p.].
Разработку состава необходимо осуществлять так, чтобы разрабатываемый препарат можно было квалифицировать как фармацевтически эквивалентный относительно референтного препарата, а также с учетом медико-биологических требований, предъявляемых к препаратам для системного лечения органов верхних дыхательных путей, для чего:
- препарат должен содержать рисперидон в концентрации, соответствующей его содержанию в референтном препарате - 1 мг/мл;
- препарат должен иметь лекарственную форму «раствор для приема внутрь» и обеспечивать терапевтическую эквивалентность относительно референтного препарата.
В этой связи, критическими характеристиками для разрабатываемого препарата являются:
- рисперидон и вспомогательные вещества должны находиться в препарате в виде истинного раствора в установленном для хранения диапазоне температур, для чего должен быть подобран подходящий состав растворителей;
- физико-химические свойства препарата (рН) должны быть сопоставимы с таковыми у референтного препарата;
- микробиологическая чистота, которая должна соответствовать требованиям Государственной Фармакопеи РФ изд. XII, статьи 34 (ОФС 42-0069-07) «Определение эффективности антимикробных консервантов лекарственных средств».
С целью достижения вышеуказанного технического результата, авторами настоящего изобретения были проведены исследования по выбору корригентов рН (буферных веществ) и антимикробных консервантов разрабатываемого состава.
Совместимость рисперидона с вспомогательными веществами доказана стабильностью препарата в процессе хранения (см. ниже результаты исследований стабильности в процессе хранения).
В состав препарата в целом включены вспомогательные вещества, которые по функциональному назначению аналогичны вспомогательным веществам, включенным в состав референтного препарата. Однако с целью сокращения энергозатрат и времени технологического процесса, необходимых для производства препарата-генерика, авторами настоящего изобретения было принято решение по замене бензойной кислоты в качестве антимикробного консерванта и вкючении в состав лекарственной формы бензоата натрия. Данное вещество широко используются в фармацевтической промышленности в концентрациях 0,2-0,3%, допустимая концентрация до 0,5%. Бензойная кислота малорастворима в воде (0,34% в холодной воде, 6,8% в кипящей воде), в то время как бензоат натрия легко растворим в воде (55,4% в холодной воде.) и его применение вместо бензойной кислоты позволяет исключить этап нагревания растворителя для растворения консерванта и последующего охлаждения полученного раствора. В оригинальном препарате бензойная кислота используется в концентрации 0,2%, но известно, что микробиологической эффективностью обладает недиссоциированная бензойная кислота, существующая в растворе в достаточных количествах только при кислых значениях при рН≤4. Бензоат натрия превращается в растворе в недиссоциированную бензойную кислоту при значениях рН менее 4,0. Исходя из вышеизложенного в разработанный препарат введен бензоат натрия в концентрации 0,236%, что соответствует содержанию в растворе 0,2% недиссоциированной бензойной кислоты.
Таким образом, авторами настоящего изобретения, был получен состав препарата-генерика «Рисперидон» раствор для приема внутрь 1 мг/мл, содержащий следующие компоненты:

С целью подтверждения фармацевтической эквивалентности разработанного препарата была исследована эффективность
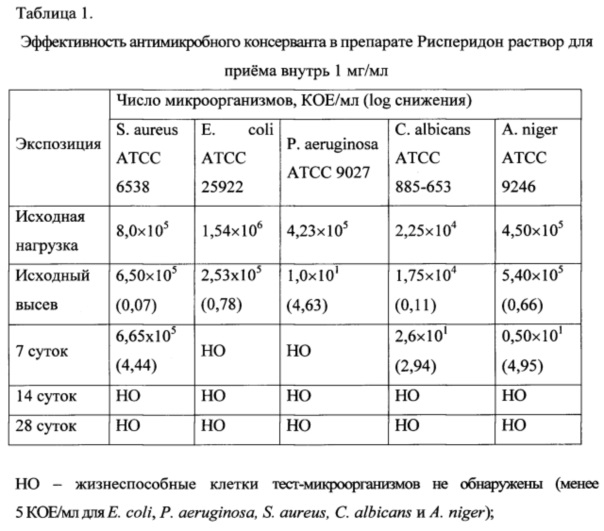
антимикробного консервирующего действия образцов лабораторной серии препарата «Рисперидон» раствор для приема внутрь 1 мг/мл, содержащей 0,095% рисперидона и 0,212% бензоата натрия (нижние пределы количественного содержания по проекту ФСП). По требованиям общей статьи 34 ГФ РФ XII изд. в лекарственных средствах для приема внутрь логарифм снижения числа жизнеспособных клеток бактерий через 14 суток должен составлять не менее 1, с 14 до 28 суток число жизнеспособных клеток бактерий не должно увеличиваться. Число жизнеспособных клеток грибов не должно увеличиваться через 14 и 28 суток по сравнению с исходным уровнем. Результаты исследований представлены в таблице 1.
Из данных, представленных в таблице 1, видно, что в лекарственном препарате наблюдается быстрая гибель бактерий. В исходном высеве логарифм снижения числа тест-микроорганизма S. aureus АТСС 6538 составил 0,07, через 7 суток 4,44, а через 14 суток и при последующих высевах жизнеспособные клетки этого тест-микроорганизма не были обнаружены.
В исходном высеве логарифм снижения числа тест-микроорганизма Е. coli АТСС 25922 составил 0,78, через 7 суток и при последующих высевах жизнеспособные клетки этого тест-микроорганизма не были обнаружены.
В исходном высеве логарифм снижения числа тест-микроорганизма P. aeruginosa АТСС 9027 составил 4,63, через 7 суток и при последующих высевах жизнеспособные клетки этого тест-микроорганизма не были обнаружены.
В отношении грибов исследуемый препарат также проявил эффективность антимикробного консервирующего действия. В исходном высеве логарифм снижения числа тест-микроорганизма С. albicans NCTC 885-653 составил 0,11, через 7 суток - 2,94, через 14 суток и 28 суток жизнеспособные клетки этого тест-микроорганизма не были обнаружены.
В исходном высеве число жизнеспособных клеток тест-микроорганизма A. niger АТСС 9246 существенно не изменялось, через 7 суток логарифм снижения числа тест-микроорганизма A. niger АТСС 9246 составил 3,22, через 14 суток и при последующих высевах жизнеспособные клетки этого тест-микроорганизма не были обнаружены.
Такая эффективность антимикробного консерванта соответствует требованиям статьи 34 (ОФС 42-0069-07) «Определение эффективности антимикробных консервантов лекарственных средств» ГФ РФ XII издания к лекарственным средствам категории 3.
Таким образом, проведенные исследования показали, что эффективность антимикробного консерванта в препарате «Рисперидон» раствор для приема внутрь 1 мг/мл соответствует требованиям ГФ РФ XII издания (статья 34) к лекарственным средствам категории 3.
Как следует из результатов исследований, по эффективности антимикробного консервирующего действия разработанный препарат превосходит требования статьи 34 (ОФС 42-0069-07) «Определение эффективности антимикробных консервантов лекарственных средств» ГФ РФ XII издания.
Для приготовления буферного раствора в референтном препарате используют винную кислоту в концентрации 0,75% и гидроксид натрия для доведения полученного раствора до значения рН 3,0±0,1. В патенте №2161965 «Водные композиции респиридона» указано, что рН раствора является важным для физико-химической стабильности рисперидона, также указано, что при значениях рН от 2 до 6 в представленном составе концентрация рисперидона остается без изменений даже при более жестких условиях, в частности при более продолжительном хранении при повышенной температуре.
В разделе 2.2 было указано, что оптимальная растворимость респиридона достигается при значениях рН 3,0±0,2, а также в фармакопейных статьях производителя субстанции определено, что получение прозрачного, бесцветного раствора с содержанием респиридона в концентрации 0,1% достигается в 0,75% растворе винной кислоты.
Из всего выше указанного следует, что оптимальной для введения в состав препарата является винная кислота в концентрации 0,75% и гидроксид натрия для доведения значения рН 3,0±0,2.
Таким образом, указанные исследования подтверждают, что замена консерванта не влияет на качество и стабильность препарата в течение всего срока годности.
Настоящее изобретение также относится к способу получения жидкой лекарственной формы рисперидона.
Согласно пп. 11-13 формулы патента RU №2161965 известен следующий способ получения водной композиции рисперидона: «а) добавление кислотного компонента буфера и активного ингредиента рисперидона к воде; б) перемешивание смеси до полного растворения и охлаждение раствора до комнатной температуры; в) доверение рН с помощью основного компонента буфера и г) дальнейшее разбавление раствора водой до требуемого конечного объема». Причем на стадии «a)» проводят растворение консерванта в некотором количестве подогретой воды и разбавление раствора равным количеством воды.
Данный способ требует использования специального оборудования и дополнительных трудозатрат для введения в смесь вспомогательных веществ, что является экономически нецелесообразным.
В результате исследований, авторам настоящего изобретения удалось разработать оптимальный способ изготовления препарата-генерика «Рисперидон» раствор для приема внутрь 1 мг/мл, который, учитывая свойства компонентов, входящих в его состав, включает следующие основные технологические процессы:
- приготовление 0,1 М раствора щелочи;
- растворение бензоата натрия, винной кислоты, рисперидона в воде очищенной;
- доведение рН раствора до значения 3,0±0,2;
- дозирование раствора во флаконы.
Ниже представлено краткое описание процесса производства препарата:
Стадия 1. Приготовление 0,1 М раствора щелочи
В технологическую емкость отвешивают на весах и последовательно загружают воду очищенную для приготовления 0,1 М раствора щелочи и гидроксид натрия. Раствор готовят согласно ГФ XIII. Перемешивают при помощи мешалки до полного растворения.
Стадия 2. Приготовление раствора
В реактор загружают предварительно отвешенные воду очищенную и бензоат натрия. Перемешивают полученный раствор мешалкой до полного растворения порошка, затем загружают предварительно отвешенную винную кислоту и перемешивают мешалкой до полного растворения, после чего загружают предварительно отвешенный рисперидон и перемешивают мешалкой до полного растворения, а в завершение добавляют приготовленный 0,1 М раствор щелочи до получения рН раствора 3,0±0,2, перемешивают и выгружают полученный раствор из реактора-гомогенизатора в промежуточные емкости.
Стадия 3. Дозирование раствора во флаконы
Из промежуточных емкостей раствор выгружают и дозируют во флаконы.
Таким образом, указанный способ получения жидкой лекарственной формы рисперидона значительно отличается от предшествующего известного уровня техники и характеризуется отсутствием необходимости в нагревании водного раствора для введения в состав жидкой лекарственной формы антимикробных консервантов и соответственно более высокой технологичностью производственного процесса.
Указанная жидкая лекарственная форма рисперидона стабильна при получении и длительном хранении, а также фармацевтически эквивалентна прототипу.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КОМБИНИРОВАННОГО КУПИРОВАНИЯ ШИЗОАФФЕКТИВНЫХ СИНДРОМОВ ПСИХОТИЧЕСКОГО И СУБПСИХОТИЧЕСКОГО УРОВНЯ В УСЛОВИЯХ ДНЕВНОГО СТАЦИОНАРА | 2003 |
|
RU2249456C1 |
| ЖИДКАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ, ОБЛАДАЮЩАЯ НООТРОПНОЙ АКТИВНОСТЬЮ | 2018 |
|
RU2703293C1 |
| СТАБИЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ЛАМИВУДИНА | 2015 |
|
RU2587782C1 |
| ПРОИЗВОДНЫЕ 7-ФТОРО-8-ХЛОРО-5Н-ДИБЕНЗО[b, е][1, 4]ДИАЗЕПИНА И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2610169C2 |
| ВОДНЫЕ КОМПОЗИЦИИ РИСПЕРИДОНА | 1995 |
|
RU2161965C2 |
| СМЕСЬ, СОДЕРЖАЩАЯ КАРБАМАТНОЕ СОЕДИНЕНИЕ ДЛЯ ПРЕДОТВРАЩЕНИЯ, ОБЛЕГЧЕНИЯ ИЛИ ЛЕЧЕНИЯ ШИЗОФРЕНИИ | 2018 |
|
RU2772465C2 |
| ЖИДКАЯ ЛЕКАРСТВЕННАЯ ФОРМА ФЕНСПИРИДА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2015 |
|
RU2607965C1 |
| ТЕРАПЕВТИЧЕСКИЕ АГЕНТЫ | 2008 |
|
RU2468025C2 |
| СОДЕРЖАЩИЕ ОНДАНСЕТРОН СОСТАВЫ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ | 1995 |
|
RU2145853C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ФУНКЦИОНАЛЬНЫХ ПСИХИЧЕСКИХ РАССТРОЙСТВ | 2016 |
|
RU2667954C2 |
Изобретение относится к области фармацевтики и описывает жидкую лекарственную форму рисперидона, выполненную в виде раствора для приема внутрь, включающую активное вещество и комбинацию вспомогательных веществ, имеющую следующий состав в мг/мл:
Изобретение обеспечивает создание жидкой лекарственной формы, которая стабильна при получении и длительном хранении, а также предполагает более технологичный способ производства, заключающийся в отсутствии необходимости нагревания водного раствора при растворении антимикробного консерванта для введения его в состав жидкой лекарственной формы. 1 з.п. ф-лы, 1 табл.
1. Жидкая лекарственная форма рисперидона, выполненная в виде раствора для приема внутрь, включающая активное вещество и комбинацию вспомогательных веществ, имеющая следующий состав в мг/мл:
2. Жидкая лекарственная форма рисперидона по п. 1, полученная способом, при котором отвешивают на весах и последовательно загружают воду очищенную, для приготовления 0,1 М раствора щелочи, и гидроксид натрия и перемешивают их при помощи мешалки до полного растворения, затем в реактор загружают предварительно отвешенные воду очищенную и бензоат натрия и перемешивают полученный раствор до полного растворения, после чего загружают предварительно отвешенную винную кислоту и перемешивают до полного растворения, затем загружают предварительно отвешенный рисперидон и перемешивают его до полного растворения, после чего добавляют приготовленный 0,1 М раствор щелочи до получения рН раствора 3,0±0,2, перемешивают, выгружают полученный раствор из реактора-гомогенизатора в промежуточные емкости и из промежуточных емкостей раствор выгружают и дозируют во флаконы.
| ВОДНЫЕ КОМПОЗИЦИИ РИСПЕРИДОНА | 1995 |
|
RU2161965C2 |
| US 2014045864 A1, 13.02.2014 | |||
| CN 104557918 A, 29.04.2015. | |||
Авторы
Даты
2018-03-07—Публикация
2016-10-24—Подача