Настоящее изобретение относится к стабильным водным композициям, содержащим по меньшей мере 5 мг/мл белка CD-RAP и заряженную аминокислоту, предпочтительно имеющую суммарный заряд при рН приблизительно от 6 до 8. Предпочтительно, ингредиенты композиции обеспечивают стабильность при повторных циклах замораживания-оттаивания. В предпочтительном аспекте композиция предназначена для применения в лечении, предпочтительно для применения в лечении воспалительных расстройств, предпочтительно остеоартрита. Кроме того, предложен набор, содержащий композицию по изобретению.
Белки используют для многих прикладных задач в области фармацевтики, продуктов для ветеринарии, косметики и других потребительских продуктов, продуктов питания, кормов, диагностики, промышленной химии и деконтаминации. Иногда такое применение ограничено факторами, обусловленными самими белками или связанными с условиями или средой, в которых их используют. Такие факторы могут приводить к недостаточной стабильности белков, изменению их свойств или высокой стоимости. Благодаря прогрессу в области биотехнологии возможно получение широкого спектра белков для терапевтического применения. После изготовления белковых фармацевтических продуктов обычно их хранят до их использования. В виду того факта, что белки обычно крупнее и сложнее «традиционных» фармацевтических продуктов, изготовление и обработка пригодных для хранения белковых фармацевтических продуктов могут быть особенно затруднительными. Обзор по разработке и изготовлении белковых фармацевтических композиций приведен в Carpenter et al. (1997), Pharm. Res. 14:969-975; Wang (2000), Int. J. Pharmaceutics 203:1-60; and Tang and Pikal (2004), Pharm. Res. 21:191-200.
При разработке композиций и способов получения белков для фармацевтического применения следует принимать во внимание несколько факторов. Первостепенное значение имеет стабильность белка на всех стадиях его получения, транспортировки и на стадиях применения, которые могут включать изготовление композиции, замораживание, сушку, хранение, транспортировку, восстановление, циклы замораживания-оттаивания и хранение после восстановления конечным пользователем. Другие возможные факторы включают простоту и экономичность изготовления, применения и распределения; состав конечного продукта для введения пациенту; и простоту применения конечным пользователем, включая растворимость лиофилизированной композиции после восстановления.
Жидкие композиции могут обеспечивать выполнение определенных задач. Потенциальные преимущества жидких композиций включают простоту и экономичность изготовления и удобство для конечного пользователя. Часто полипептиды в растворе нестабильны при их хранении на протяжении длительных периодов времени (Manning et al (1989), Pham. Res. 6: 903-918). Соответственно, были разработаны дополнительные стадии обработки, позволяющие увеличить срок хранения, включающие сушку, например лиофилизацию. Лиофилизированные композиции могут также обеспечивать определенные преимущества. Потенциальные преимущества лиофилизации включают большую стабильность белка, а также простоту и экономичность транспортировки и хранения. Тем не менее, лиофилизированные фармацевтические композиции могут быть менее удобными для конечного пользователя.
Помимо выбора основной формы композиции (например, лиофилизированной, жидкой, замороженной и так далее) оптимизация белковой композиции обычно включает вариабельность компонентов композиции и их соответствующих концентраций для обеспечения максимальной стабильности белка. На стабильность белка могут влиять множество факторов, включая ионную силу, рН, температуру, циклы замораживания-оттаивания, силы сдвига, замораживание, сушку, перемешивание и восстановление. Нестабильность белка может быть обусловлена физической деградацией (например, денатурацией, агрегацией или преципитацией) или химической деградацией (например, дезаминированием, окислением или гидролизом). Оптимизация компонентов композиции и их концентраций основана исключительно на эмпирических исследованиях и/или разумных способах устранения причин нестабильности.
Иногда при длительном хранении фармацевтических композиций, содержащих полипептиды, включая водные и лиофилизированные композиции, возможна утрата активных полипептидов из-за агрегации и/или деградации.
Соответственно, типичные способы повышения стабильности полипептидов могут включать изменение концентрации элементов композиции или добавление эксципиентов для модификации композиции (патенты США 5580856 и 6171586 и заявки на патенты США 2003/0202972, US 2003/0180287). US 5580856 является прототипной заявкой, где для стабилизации высушенного белка могут быть добавлены во время или после регидратации такие агенты, как природные полимеры, поверхностно-активные вещества, сульфатированные полисахариды, белки и буферы. Тем не менее, среди множества возможных вариантов в патенте США 5580856 не указано, какие именно регидратационные стабилизаторы следует добавлять к конкретным белкам. Соответственно, несмотря на то что специалисту в данной области техники, читающему указанный патент США, будет сообщено о таком множестве возможных вариантов, ему придется выявлять наилучшие для его белка условия из множества этих возможных вариантов, описанных в US 5580856. В заявке на патент США 2003/0202972 описана стабильная лиофилизированная композиция антитела против Her-2, где стабилизатор представляет собой сахар, трегалозу или буфер. Тем не менее, полезность этих стабилизаторов для антител нельзя экстраполировать на другие белки. Заявка на патент США 2003/0180287 сходна с US 2003/0202972, поскольку в ней также описан стабильный раствор иммуноглобулиноподобного белка, то есть белка, содержащего Fc-домен. Стабилизатор может представлять собой фосфат натрия, фосфат калия, цитрат натрия или калия, яблочную кислоту, ацетат аммония, трис-буфер (буфер с трис(гидроксиметил)аминометаном), ацетат, диэтаноламин, гистидин, лизин или цистеин. Из этих химически различных стабилизаторов, которые могут быть выбраны специалистом в данной области техники, наиболее подходящим оказался лизин. Однако, подобно US 2003/0202972, данный конкретный стабилизатор подходит лишь для конкретного белка, в данном случае белка, содержащего Fc-домен, что само по себе нельзя экстраполировать на другой белок. Таким образом, применение добавок нельзя экстраполировать с одного конкретного белка на другой неродственный белок. Действительно, несмотря на то что применение добавок способствует хранению, оно может также приводить к инактивации полипептидов. Кроме того, в случае лиофилизации, условия, обусловленные стадией регидратации, могут приводить к инактивации полипептида, например, посредством агрегации или денатурации (Hora et al. (1992), Pharm. Res., 9: 33-36; Liu et al. (1991), Biotechnol. Bioeng., 37: 177-184). Действительно, агрегация полипептидов нежелательна, поскольку она может приводить к иммуногенности (Cleland et al. (1993), Crit. Rev. Therapeutic Drug Carrier Systems, 10: 307-377; and Robbins et al. (1987), Diabetes, 36: 838-845).
Сохранение биологической активности при разработке и изготовлении фармацевтических продуктов зависит от естественной стабильности макромолекулы, а также от применяемых методик стабилизации. Существует множество методик стабилизации белка, включая добавление химических «стабилизаторов» к водному раствору или суспензии белка. Например, в патенте США 4297344 раскрыта стабилизация II и VIII факторов свертывания, антитромбина III и плазминогена к нагреванию путем добавления выбранных аминокислот. В патенте США 4783441 раскрыт способ стабилизации белков путем добавления поверхностно-активных веществ. В патенте США 4812557 раскрыт способ стабилизации интерлейкина-2 с использованием человеческого сывороточного альбумина. Другими возможными способами стабилизации белка являются способы замораживания-оттаивания, в которых препарат смешивают с криопротектором и хранят при очень низких температурах. Тем не менее, не все белки переносят цикл замораживания-оттаивания. Еще один возможный вариант представляет собой хранение при низкой температуре с добавлением криопротектора, обычно глицерина. Также возможно хранение в стеклообразной форме, как описано в патенте США 5098893. В таком случае белки растворяют в водорастворимых или набухаемых в воде веществах, представленных в аморфном или стеклообразном состоянии. Наиболее широко применяемым способом стабилизации белков является сублимация или лиофилизация. В случаях, когда не удается достигнуть достаточной стабильности белка в водном растворе, лиофилизация является наиболее реальной альтернативой. Недостатки лиофилизации заключаются в необходимости сложной обработки, больших затратах времени и высокой стоимости. Кроме того, при ненадлежащем проведении лиофилизации происходит по меньшей мере частичная денатурация большинства препаратов, обусловленная стадиями замораживания и обезвоживания, входящими в данную методику. Это часто приводит к необратимой агрегации части белковых молекул, что делает композицию неприемлемой для парентерального введения.
В целом, деградация белков хорошо описана в литературе, но хранение и растворимость, в частности, белка CD-RAP/MIA (называемого далее CD-RAP) описаны не были. CD-RAP представляет собой небольшой растворимый белок, секретируемый клетками злокачественной меланомы и хондроцитами. Согласно полученным недавно данным было установлено, что CD-RAP является прототипом небольшого семейства внеклеточных белков, содержащих структуру, подобную домену SH3. Предполагают, что взаимодействие CD-RAP с определенными эпитопами белков внеклеточного матрикса регулирует адгезию опухолевых клеток и хондроцитов (Moser et al (2002), Mol Cell Biol. 5:1438-45). В то же время белки, родственные CD-RAP, известны из US 2002/0103360 и WO 2004/015078. Тем не менее, в этих заявках не описаны стабильные композиции белков, родственных CD-RAP.
В настоящее время известна липосомная композиция CD-RAP, описанная в WO 2008/040556. Конкретно, раскрыта сухая фармацевтическая композиция, содержащая многослойные везикулы, содержащие CD-RAP, после восстановления, где белок CD-RAP инкапсулирован и/или захвачен в липосомы для длительной доставки CD-RAP, так что он может оставаться в желаемом месте действия на протяжении более длительного периода времени.
Одна функция CD-RAP состоит в том, что он действует как хемотаксический фактор на мезенхимальные стволовые клетки. В то время как CD-RAP не способен индуцировать дифференцировку мышиных или человеческих мезенхимальных стволовых клеток (HMSC), он влияет на действие морфогенетического белка кости 2 (BMP-2) и трансформирующего фактора роста бета-3 (TGF-бета-З) при дифференцировке мезенхимальных стволовых клеток, поддерживая хондрогенный фенотип и ингибируя остеогенную дифференцировку. Кроме того, CD-RAP приводит к понижающей регуляции экспрессии генов остеопонтина и остеокальцина в обработанных ВМР-2 культурах HMSC, снижая остеогенный потенциал ВМР-2. В случае человеческих первичных хондроцитов CD-RAP стимулирует образование внеклеточного матрикса, повышая содержание гликозаминогликанов. По этой причине полагают, что CD-RAP является важным регулятором при хондрогенной дифференцировке и поддержании хряща. Соответственно, полагают, что CD-RAP является перспективным агентом для восстановления хряща. Таким образом, желательно обеспечить доступные фармацевтические композиции, содержащие достаточно высокое количество CD-RAP, стабильные на протяжении длительного времени при хранении. Действительно, стабильные композиции с высокими концентрациями CD-RAP позволят уменьшить объем инъекций, проводимых пациентам, что уменьшит побочные эффекты, такие как боль, связанная с большим объемом инъекции, и, конечно, позволит увеличить каждую дозу.
Кроме того, в то время как в данной области техники было известно о доступности множества вариантов агентов, стабилизирующих белки, а также агентов, позволяющих сохранять стабильность белков при их высокой концентрации, до настоящего изобретения в данной области техники не было представления о том, что композиция, содержащая белок CD-RAP в высоких концентрациях, может быть нестабильной и, следовательно, требует улучшения.
Таким образом, техническая проблема, рассмотренная в настоящем изобретении, состоит в удовлетворении описанных выше потребностей.
В настоящем изобретении рассмотрены эти потребности и, соответственно, в качестве решения указанной технической проблемы согласно настоящему изобретению предложены воплощения, касающиеся композиций, а также способов и применений этих композиций в лечении страдающих от заболеваний субъектов, которым будет полезно введение CD-RAP. Эти воплощения охарактеризованы и описаны здесь, проиллюстрированы в Примерах и отражены в формуле изобретения.
Необходимо отметить, что при использовании здесь формы единственного числа включают множественное число, если в контексте явно не указано иное. Таким образом, например, ссылка на «антитело» включает одно или несколько таких различных антител, и ссылка на «способ» включает ссылку на эквивалентные стадии и способы, известные специалистам в данной области техники, которые могут быть модифицированы или заменены способами, описанными здесь.
Все публикации и патенты, упомянутые в данном описании, полностью включены посредством ссылки. В той степени, в которой материал, включенный посредством ссылки, противоречит или не соответствует данному описанию, описание будет заменять любой такой материал.
Если не указано иное, подразумевают, что термин «по меньшей мере», расположенный перед группой элементов, относится к каждому элементу данной группы. Специалистам в данной области техники будут ясны многие эквиваленты конкретных воплощений изобретения, описанных здесь, или специалисты в данной области техники смогут установить такие эквиваленты с использованием не более чем рутинных экспериментов. Предполагают, что такие эквиваленты входят в объем настоящего изобретения.
Подразумевают, что в данном описании и последующей формуле изобретения, если контекст не требует иного, слово «содержать» и такие варианты, как «содержит» и «содержащий», означают включение указанного целого, или стадии, или группы целых или стадий, но не исключение любого другого целого, или стадии, или группы целых или стадий. При использовании здесь термин «содержащий» может быть заменен термином «включающий» или иногда, при использовании здесь, термином «имеющий».
При использовании здесь термин «состоящий из» исключает любые элемент, стадию или ингредиент, не указанные в заявленном элементе. При использовании здесь термин «состоящий по существу из» не исключает вещества или стадии, по существу не влияющие на основные и новые признаки заявленного элемента/пункта формулы изобретения. В каждом случае в настоящей заявке любой из терминов «содержащий», «состоящий по существу из» и «состоящий из» может быть заменен любым из двух других терминов.
Подразумевают, что при использовании здесь союзный термин «и/или» между несколькими перечисленными элементами включает как отдельные, так и комбинированные варианты. Например, когда два элемента соединены посредством «и/или», первый вариант относится к возможности использования первого элемента без второго. Второй вариант относится к возможности использования второго элемента без первого. Третий вариант относится к возможности использования первого и второго элемента совместно. Подразумевают, что любой из этих вариантов входит в объем значения данного термина и, следовательно, соответствует требованию термина «и/или», как он использован здесь. Подразумевают, что возможность одновременного использования нескольких вариантов также входит в объем значения данного термина и, следовательно, соответствует требованию термина «и/или», как он использован здесь.
В тексте данного описания упомянуты несколько документов. Каждый из упомянутых здесь документов (включая все патенты, заявки на патенты, научные публикации, описания изготовителей, инструкции и так далее), приведенные выше или ниже, полностью включены сюда посредством ссылки. Ни один элемент настоящей заявки не следует толковать как признание того, что настоящее изобретение не предвосхищает такое описание, приведенное в предшествующем изобретении.
С целью обеспечения композиции, содержащей большое количество CD-RAP, что позволит уменьшить объем инъекций, проводимых субъектам, нуждающимся в этом, и уменьшить побочные эффекты, такие как боль, связанная с большим объемом инъекции, авторы настоящего изобретения обнаружили, что белок CD-RAP может быть нестабильным в высоких концентрациях и может также быть нестабильным на протяжении длительного периода хранения.
Таким образом, во время своих исследований, направленных на получение высококонцентрированной стабильной композиции, авторы изобретения наблюдали определенную нестабильность белков CD-RAP и, следовательно, поставили задачу исправить это нежелательное свойство. Соответственно, они поставили задачу концентрирования CD-RAP, сохраняя его в растворе, то есть в растворенном состоянии. Для этого им было доступно множество вариантов и альтернатив, однако без каких-либо данных о том, что какой-либо вариант или альтернатива будут подходящими для решения данной объективной задачи.
«Растворенное состояние» означает, что белок CD-RAP, предпочтительно в концентрации по меньшей мере 5 мг/мл CD-RAP, находится в растворе, то есть растворен и/или диспергирован непосредственно в водном растворе (то есть в водной фазе) композиции. Предпочтительно, белок CD-RAP растворен и/или диспергирован равномерно. «Равномерно» означает, что количество белка CD-RAP, растворенного и/или диспергированного в стабильной водной композиции, почти равномерно, предпочтительно равномерно распределено в водной композиции, так что концентрация («с») количества белка CD-RAP («n» в случае молярной массы или «m» в случае массы) почти одинакова, предпочтительно одинакова в (или во всем) объеме («v») водного раствора, то есть c=n/v или c=m/v, соответственно, почти постоянны, предпочтительно постоянны. Предпочтительно, в композиции нет градиента концентрации.
Соответственно, стабильную водную композицию по настоящему изобретению, содержащую белок CD-RAP, можно предпочтительно рассматривать как водный раствор, в котором непосредственно растворен и/или диспергирован CD-RAP.
Более предпочтительно, стабильную водную композицию по настоящему изобретению можно рассматривать как водный раствор, содержащий по меньшей мере 5 мг/мл белка CD-RAP и заряженную аминокислоту. Это означает, что основой композиции является водный раствор, где по меньшей мере 5 мг/мл белка CD-RAP растворены и/или диспергированы совместно с по меньшей мере заряженной аминокислотой.
Альтернативно, стабильную водную композицию по настоящему изобретению можно более предпочтительно рассматривать как стабильную композицию на основе водного раствора, содержащую белок CD-RAP в концентрации по меньшей мере 5 мг/мл (масса/объем) и заряженную аминокислоту.
«Раствор» представляет собой гомогенную смесь одного, или двух, или более веществ/компонентов. В такой смеси растворенное вещество (в настоящем изобретении белок CD-RAP, предпочтительно по меньшей мере 5 мг/мл белка CD-RAP) растворено (как описано выше) в другом веществе (в настоящем изобретении предпочтительно в водной композиции), также известном как растворитель.
С учетом сказанного выше, белок CD-RAP предпочтительно не гетерогенно растворен и/или диспергирован в водном растворе. Термин «растворенное состояние» также включает то, что белок CD-RAP в водном растворе предпочтительно по существу не эмульгирован или, более предпочтительно, не эмульгирован вовсе.
Кроме того, термин «растворенное состояние» включает то, что белок CD-RAP предпочтительно по существу не инкапсулирован и/или не захвачен, например, в липосомы, многослойные липосомы или тому подобное (предпочтительно, менее 2%, 1% или 0,5% белка CD-RAP может быть инкапсулировано и/или захвачено), или, более предпочтительно, не инкапсулирован и/или не захвачен вовсе.
Соответственно, в предпочтительном аспекте настоящее изобретение включает стабильную водную композицию, по существу свободную от липосом (предпочтительно, менее 2%, 1% или 0,5% липосом), предпочтительно, свободную от липосом, содержащую по меньшей мере 5 мг/мл белка CD-RAP и заряженную аминокислоту.
В альтернативном более предпочтительном аспекте настоящее изобретение включает стабильную водную композицию, содержащую по меньшей мере 5 мг/мл белка CD-RAP и заряженную аминокислоту, где белок CD-RAP по существу не включен (предпочтительно, менее 2, 1 или 0,5%), предпочтительно не включен (не инкапсулирован и/или не захвачен) в липосомы.
Действительно, существует множество возможных механизмов нестабильности белка. Например, нестабильность белка может быть обусловлена агрегацией белка, а также химической нестабильностью, связанной с дезаминированием, окислением, разрывом и образованием дисульфидных связей, гидролизом, сукцинимидированием, образованием поперечных сшивок без дисульфидных связей, дегликозилированием, или «ферментативным потемнением» (реакцией Майяра), или любой комбинацией этих явлений; см., например, Wang et al. (1999), Int. J. Pharm. 185: 129-188) и Фиг.1. Кроме того, на стабильность белка могут влиять физико-химические условия, такие как температура, значение рН, поверхностная адсорбция, соли, ионы металлов, хелатирующие агенты, физические силы, такие как силы сдвига, агенты, денатурирующие белки, неводные растворители, концентрация белка, источник и степень очистки белка, морфизм белка или давление.
Однако, при множестве факторов, способных влиять на стабильность белка, существует множество способов, которые могут быть использованы для стабилизации белка. Например, возможна внутренняя (посредством замены аминокислот) или внешняя стабилизация белка. Внешняя стабилизация может быть осуществлена хелатирующими агентами, ионами металлов, восстанавливающими агентами, полимерами, полиэтиленгликолями/полиолами, сывороточным альбумином, поверхностно-активными веществами, сахарами и полиолами, жирными кислотами и фосфолипидами, аминокислотами, буферами и так далее; см., например, Wang, Y and Hanson M (1988), J. Parental Sci. & Technology, 42, Supplement: 4-26; Wang et al. (1999), Int. J. Pharm. 185: 129-188, и Фиг.2. В целом, для стабилизации белка CD-RAP в композиции специалисту в данной области техники доступно множество вариантов.
В данном случае авторы изобретения наблюдали, что белок CD-RAP проявляет агрегацию. К агрегации белка в белковой композиции может приводить множество различных факторов. Обычные способы очистки и хранения могут приводить к воздействию на белковые композиции условий и компонентов, приводящих к агрегации белка. Например, агрегация белков в белковой композиции может быть результатом одного или более из следующего: хранения, воздействия повышенных температур, рН композиции, ионной силы композиции и присутствия некоторых поверхностно-активных веществ (например, полисорбата-20 и полисорбата-80) и эмульгаторов. Сходным образом, агрегация белков возможна при воздействии сил сдвига, как, например, при восстановлении лиофилизированного сухого белка в растворе, очистке образца белка фильтрацией, замораживании-оттаивании, встряхивании или переносе раствора белка шприцом. Агрегация может также происходить в результате взаимодействий полипептидных молекул в растворе и на границах раздела «жидкость-воздух» в флаконах для хранения. При уменьшении или увеличении поверхности границ раздела «жидкость-воздух» и «твердое тело-жидкость», связанном со взбалтыванием при транспортировке, возможны изменения конформации полипептидов, адсорбированных на этих границах раздела. Такое взбалтывание может приводить к образованию в композиции белковых агрегатов и, в итоге, их преципитации с другими адсорбированными белками.
Кроме того, к агрегации белка может приводить воздействие света на белковую композицию. Таким образом, согласно настоящему изобретению предложены композиции, позволяющие повысить концентрации CD-RAP и уменьшающие агрегацию белков. Безотносительно теории, уменьшения агрегации белков достигают контролем одного или нескольких указанных выше механизмов агрегации. Это может приводить, например, к большей стабильности продукта и большей гибкости производственных процессов и условий хранения.
Конкретно, авторы настоящего изобретения обнаружили, что из множества исследованных агентов аминокислоты с суммарным зарядом при рН приблизительно от 6 до 8 полезны для стабилизации белка CD-RAP в высокой концентрации, благодаря, среди прочего, опосредованию растворимости белка и/или ингибированию агрегации белка. Подразумевают, что при упоминании здесь аминокислота предпочтительно представляет собой L-аминокислоту. D-аминокислота менее предпочтительна. Предпочтительно, аминокислота представляет собой L-гистидин, L-аргинин, L-глутаминовую кислоту или их соль; предпочтительно, соль представляет собой хлорид, фосфат, ацетат или сульфат.
Соответственно, изобретение основано, по меньшей мере частично, на обнаружении того, что композиции, содержащие по меньшей мере 5 мг/мл CD-RAP и заряженную аминокислоту или ее соль, предпочтительно хлорид, фосфат, ацетат или сульфат, более предпочтительно, вместе с буфером, дисахаридом, наполнителем и, возможно, поверхностно-активным веществом, обладают достаточной стабильностью при длительном хранении и/или при одном или нескольких циклах замораживания-оттаивания. Композиция по изобретению имеет множество преимуществ по сравнению со стандартными забуференными композициями. В одном аспекте композиция содержит белок CD-RAP в высоких концентрациях, например 30 мг/мл или более. Неожиданным образом, несмотря на высокую концентрацию белка, агрегация в композиции минимальна, и такую композицию можно хранить с использованием множества различных способов и форм, например замораживания, без проявления неблагоприятных эффектов, которые можно ожидать при использовании композиций с высокой концентрацией белка.
В некоторых менее предпочтительных воплощениях в композициях по изобретению нет необходимости использовать эксципиенты, такие как, например, поверхностно-активные вещества и буферные системы, используемые в обычных композициях для стабилизации белков в растворе. Кроме того, композиции, описанные здесь, более предпочтительны по сравнению со стандартными композициями, поскольку они обладают сниженной иммуногенностью, в виду отсутствия дополнительных агентов, необходимых для стабилизации белка.
Таким образом, настоящее изобретение направлено на жидкую композицию, предпочтительно стабильную жидкую композицию, которая неожиданно обеспечивает возможность длительного сохранения полипептида CD-RAP или его биологически активного аналога, аминокислотная последовательность которого по меньшей мере на 63% гомологична четырехцистеиновому каркасу CD-RAP, аминокислотам 12-107 SEQ ID NO: 1, как описано ниже, в концентрации по меньшей мере 5 мг/мл, предпочтительно по меньшей мере 7,5 мг/мл, более предпочтительно по меньшей мере 10 мг/мл, еще более предпочтительно по меньшей мере 15 мг/мл, особенно предпочтительно по меньшей мере 20 мг/мл, более предпочтительно по меньшей мере 25 мг/мл, еще более предпочтительно по меньшей мере 30 мг/мл, и заряженную аминокислоту или ее соль, предпочтительно хлорид, фосфат, ацетат или сульфат. Эта композиция полезна, в частности, в виду ее большего удобства в использовании для пациента, поскольку полипептид CD-RAP в данной композиции является высококонцентрированным, что позволяет уменьшить побочные эффекты, такие как боль, связанная с большим объемом инъекции. Кроме того, применение композиции посредством внутрисуставной инъекции пациенту при низком уровне динамического давления жидкости усиливает хондрогенез.
Композиция по изобретению (иногда также называемая здесь «композиция веществ» или «композиция») может предпочтительно быть представлена в разных физических состояниях, таких как жидкие, замороженные, лиофилизированные, сублимированные, высушенные распылением и восстановленные композиции, при этом предпочтительны жидкие и лиофилизированные композиции. Предпочтительно, рН композиции составляет 6,0 и более, более предпочтительно от 5,5 до 9,0, более предпочтительно рН композиции составляет от 6,0 до 8,0, еще более предпочтительно от 6,5 до 7,6, наиболее предпочтительно от 7,0 до 7,5.
При использовании здесь «жидкая композиция» относится к композиции веществ, представленной в жидкой форме, для которой характерно свободное перемещение составляющих ее молекул друг относительно друга, но без тенденции к разделению при комнатной температуре. Жидкие композиции включают водные и неводные жидкости, при этом водные композиции являются предпочтительными. Водная композиция представляет собой композицию, в которой растворителем является вода. Полипептид CD-RAP может быть растворен в композиции равномерно или неравномерно, при этом равномерное растворение является предпочтительным, как описано выше.
Может быть использована любая подходящая неводная жидкость, при условии, что она обеспечивает стабильность композиции по изобретению, Предпочтительно, неводная жидкость является гидрофильной жидкостью. Типичные примеры подходящих неводных жидкостей включают: глицерин; диметилсульфоксид (DMSO); полидиметилсилоксан (PMS); этиленгликоли, такие как этиленгликоль, диэтиленгликоль, триэтиленгликоль, полиэтиленгликоль («PEG») 200, PEG 300 и PEG 400; и пропиленгликоли, такие как дипропиленгликоль, трипропиленгликоль, полипропиленгликоль («PPG») 425 и PPG 725.
При использовании здесь «смешанная водная/неводная жидкая композиция» относится к жидкой композиции, содержащей смесь воды и дополнительной жидкой композиции.
При использовании здесь «композиция» представляет собой смесь полипептида CD-RAP (то есть активного лекарственного средства/вещества) и других химических веществ и/или добавок, необходимых для лекарственного продукта, представленного предпочтительно в жидком состоянии. Композиция по изобретению включает фармацевтическую композицию. Термин «фармацевтическая композиция» относится к композициям, представленным в такой форме, которая позволяет активным ингредиентам эффективно проявлять свою биологическую активность, и которые, таким образом, могут быть введены субъекту для терапевтического применения, как описано здесь.
Изготовление композиции включает способ, при котором различные химические вещества, включая активное лекарственное средство, объединяют с получением конечного лекарственного продукта, такого как фармацевтическая композиция. Активным лекарственным средством композиции по изобретению является полипептид CD-RAP. Термин «полипептид» может быть использован здесь взаимозаменяемо с термином «белок» и при использовании здесь включает пептид, полипептид, белок и слитый белок. Белки могут быть получены рекомбинантными или синтетическими способами.
В определенных воплощениях белок CD-RAP для включения в композицию является по существу чистым и/или по существу гомогенным (то есть по существу свободен от контаминирующих белков и так далее). Термин «по существу чистый» белок обозначает композицию, в которой белковая фракция составляет по меньшей мере приблизительно 80%, предпочтительно 90% по массе, предпочтительно по меньшей мере приблизительно 95% по массе, более предпочтительно 97% по массе и наиболее предпочтительно 98% по массе. Термин «по существу гомогенный» белок обозначает композицию, в которой белковая фракция составляет по меньшей мере приблизительно 99% по массе, исключая массу различных стабилизаторов и воды в растворе.
Полипептид CD-RAP композиции по изобретению известен в данной области техники (см. ЕР-В1 710248 или ЕР-В1 1146897) и/или описан здесь. Полипептид CD-RAP (хрящевой белок, чувствительный к ретиноевой кислоте), используемый в композициях по изобретению, представляет собой полипептид CD-RAP, также называемый MIA (активность, ингибирующая меланому), OTOR (фиброцитарный белок, FDP, MIA-подобный белок, MIAL) и TANGO 130, являющийся представителем класса секретируемых белков, как описано в Bosserhoff et al. (2004), Gene Expr. Patterns. 4: 473-479; Bosserhoff and Buettner (2003), Biomaterials 24: 3229-3234; Bosserhoff et al. (1997), Dev. Dyn. 208: 516-525; WO 00/12762; WO 2004/015078; EP-B1 710248; US 2002/0103360; или ЕР-В1 1146897. Белок CD-RAP, используемый в композиции по изобретению, предпочтительно представляет собой рекомбинантный человеческий белок CD-RAP (rhCD-RAP).
Также предпочтительно, чтобы полипептид CD-RAP композиции по изобретению представлял собой: (а) полипептид, содержащий или имеющий зрелую последовательность CD-RAP (SEQ ID NO: 1) и ее функциональные фрагменты или варианты; (б) полипептид, аминокислотная последовательность которого по меньшей мере на 63%, более предпочтительно на 70%, еще более предпочтительно на 80%, более предпочтительно на 90%, наиболее предпочтительно на 95% гомологична четырехцистеиновому каркасу CD-RAP, аминокислотам 12-107 SEQ ID NO: 1; или (в) полипептид, имеющий любую из общих последовательностей 1-3, определенных здесь (SEQ ID NO: 2, 3 и 4). Вариантом CD-RAP является белок, имеющий последовательность SEQ ID NO: 4 или ее зрелый вариант, как описано в WO 2004/015078, или белок, имеющий последовательность SEQ ID NO: 14 или ее зрелый вариант, как описано в US 2002/0103360.
«Процент (%) гомологии аминокислотных последовательностей» применительно к последовательностям CD-RAP, указанным здесь, определяют как процент аминокислотных остатков в рассматриваемой последовательности, идентичным аминокислотным остаткам в последовательности CD-RAP после выравнивания последовательностей и, при необходимости, введения разрывов для достижения максимального процента идентичности последовательностей, при этом любые консервативные замены не рассматривают как часть процента идентичности. Выравнивание в целях определения процента идентичности аминокислотных последовательностей может быть проведено различными способами, известными специалистам в данной области техники, например с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут определить подходящие параметры оценки выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей.
Длина функциональных фрагментов, имеющих одинаковую с CD-RAP биологическую функцию, предпочтительно составляет по меньшей мере 20, в частности по меньшей мере 40, и более предпочтительно по меньшей мере 50, наиболее предпочтительно 80 смежных аминокислот последовательности, показанной в SEQ ID NO: 1. Предпочтительно, функциональные фрагменты содержат аминокислоты, локализованные в положениях 1-50, 1-70, 1-80, 20-80, 20-107 SEQ ID NO: 1.
Зрелая последовательность CD-RAP (SEQ ID NO: 1)
GPMPKLADRKLCADQECSHPISMAVALQDYMAPDCRFLTIHRGQVVYVFSKLKGRGRLFWGGSVQGDYYGDLAARLGYFPSSIVREDQTLKPGKVDVKTDKWDFYCQ
Общая последовательность 1 (SEQ ID NO; 2)
С Х4 С X17 С X12 V X11-13 W X7-18 F X4 V X21 С X
Общая последовательность 2 (SEQ ID NO: 3)
K X C X D X E C X11 D X3 P D C X12 V X2 K L X7-9 W X G S X5-13 G Y F P Х3 V X18 D F X C X
Общая последовательность 3 (SEQ ID NO: 4)
K X C X D X2 C X8 A X2 D X3 P D C R F X5 G X V X5 K L X7 W X G S V X12 G Y F P X22 D F X С Q
В каждом случае «X» независимо представляет собой аминокислоту, и номер, указанный подстрочным индексом, означает число любых аминокислот. Предпочтительно, «X» независимо представляет собой встречающуюся в природе аминокислоту и, в частности, A, R, N, D, С, Q, Е, G, H, I, L, К, М, F, P, S, Т, W, Y или V. «X» может также представлять собой нестандартные аминокислоты, такие как лантионин, 2-аминоизомасляная кислота, дегидроаланин, орнитин, цитруллин, бета-аланин или норлейцин. Разумеется, также предусмотрены посттрансляционные модификации, хорошо известные в данной области техники. Таким образом, возможна посттрансляционная модификация полипептида CD-RAP по изобретению.
Белок CD-RAP, используемый в композиции по изобретению, может быть экспрессирован с интактной или процессированной геномной ДНК либо комплементарной ДНК (кДНК), или с синтетической ДНК в прокариотических или эукариотических клетках-хозяевах. Белки могут быть выделены из культуральной среды или телец включений и/или подвергнуты рефолдингу с получением биологически активных композиций. Типичные протоколы очистки рекомбинантного белка CD-RAP см., например, в ЕР-В1 710248 и Lougheed et al. (2001), Proc. Natl. Acad. Sci. U.S.A 98; 5515-5520. Подробное описание исследования активности (например, хондрогенеза) таких выделенных белков приведено в Tscheudschilsuren et al. (2005), Exp.Cell Res. 1-10; or Stoll et al. (2003), Protein Sci. 12: 510-519). Биологический анализ индукции хондрогенеза описан в Примерах 2-5 ЕР-В1 1 146897. Дополнительные биологические анализы описаны ниже и в Примерах 7 и 8.
Клеточные генно-инженерные способы получения полипептидов хорошо известны в данной области техники. См., например, Ausubel et al., eds. (1990), Current Protocols in Molecular Biology (Wiley, New York). Такие способы включают введение нуклеиновых кислот, кодирующих полипептид и обеспечивающих его экспрессию, в живые клетки-хозяева. Эти клетки-хозяева могут представлять собой бактериальные клетки, клетки грибов или, предпочтительно, клетки животных, выращенные в культуре. Бактериальные клетки-хозяева включают, без ограничения, клетки Escherichia coli. Примеры подходящих штаммов Е.coli включают штаммы НВ101, DH5a, GM2929, JM109, KW251, NM538, NM539 и любой штамм Е.coli, не способный расщеплять чужеродную ДНК. Грибковые клетки-хозяева, которые могут быть использованы, включают, без ограничения, клетки Saccharomyces cerevisiae, Pichia pastoris и Aspergillus. Немногочисленными примерами животных клеточных линий, которые могут быть использованы, являются клетки СНО, VERO, BHK, HeLa, Cos, MDCK, 293, 3Т3 и WI38. С использованием способов, хорошо известных специалистам в данной области техники (например, трансформацией, вирусным инфицированием и/или селекцией), могут быть разработаны новые животные клеточные линии. Возможно, клетки-хозяева могут секретировать полипептид в среду.
При необходимости могут быть использованы методики очистки полипептидов, такие как фракционирование с использованием ионообменной колонки, осаждение этанолом, высокоэффективная жидкостная хроматография (HPLC) с обращенной фазой, хроматография на диоксиде кремния, хроматография на гепарине SEPHAROSET, хроматография на анионообменной или катионообменной смоле (как, например, колонка с полиаспарагиновой кислотой), хроматофокусировка, электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и осаждение сульфатом аммония. Белок CD-RAP, используемый в композиции по изобретению, может быть экспрессирован и очищен, как описано в Примерах ЕР-В1 1697523.
В некоторых воплощениях концентрация белка CD-RAP в композиции по изобретению составляет по меньшей мере 5 мг/мл, предпочтительно по меньшей мере 7,5 мг/мл, более предпочтительно по меньшей мере 10 мг/мл, еще более предпочтительно по меньшей мере 15 мг/мл, особенно предпочтительно по меньшей мере 20 мг/мл, более предпочтительно по меньшей мере 25 мг/мл, еще более предпочтительно по меньшей мере 30 мг/мл.
В некоторых воплощениях концентрация полипептида CD-RAP в композиции по изобретению выбрана из следующих диапазонов: от приблизительно 5 мг/мл до приблизительно 10 мг/мл, от приблизительно 10 мг/мл до приблизительно 20 мг/мл, от приблизительно 15 мг/мл до приблизительно 25 мг/мл, от приблизительно 20 мг/мл до приблизительно 30 мг/мл или от приблизительно 5 мг/мл до приблизительно 30 мг/мл.
В предпочтительном аспекте композиция CD-RAP, в частности, стабильная водная композиция по изобретению, не содержит липосомы и/или матриксный материал. Предпочтительно, композиция CD-RAP по изобретению не содержит липосомы и/или матриксный материал, выбранный из группы, включающей гиалуроновую кислоту, альгинат, коллаген, гепарин, фибрин, фибриноген, деминерализованную кость, сополимер молочной и гликолевой кислот и/или производные сополимера молочной и гликолевой кислот, или их комбинации. Более предпочтительно, композиция CD-RAP не содержит билипидный слой.
В другом предпочтительном аспекте белок CD-RAP не содержится в концентрации 1-4 мг/мл, включая 1,0 мг/мл, 1,5 мг/мл, 2,0 мг/мл, 2,5 мг/мл, 3,0 мг/мл, 3,5 мг/мл, 4,0 мг/мл, в аргинине/H3PO4, предпочтительно в концентрации 350-420 мМ. Более предпочтительно, белок CD-RAP не содержится в концентрации 1,15 мг/мл или 3 мг/мл в 350 мМ или 420 мМ аргинине/H3PO4 с рН 7,5.
При использовании здесь подразумевают, что термин «приблизительно» означает, что концентрация белка CD-RAP в описанной композиции может варьировать в пределах 5%, 10%, 15% или до 20% заданного значения, включительно. Например, если композиция содержит приблизительно 5 мг/мл полипептида CD-RAP, подразумевают, что это означает, что композиция содержит от 3 до 7 мг/мл, более предпочтительно от 4 до 6 мг/мл. Соответственно, при использовании здесь интервал концентраций, определенный как «от Х до Y» равен интервалу, определенному как «между Х и Y». В обоих случаях интервалы включают указанные верхние и нижние пределы. Это означает, что, например, интервал «от 5 мг/мл до 10 мг/мл» или «между 5 мг/мл и 10 мг/мл» включает концентрацию 5, 6, 7, 8, 9 и/или 10 мг/мл.
«Стабильная композиция» представляет собой композицию, где включенный в нее белок по существу сохраняет его физическую стабильность, и/или химическую стабильность, и/или биологическую активность при хранении и/или не демонстрирует признаков агрегации, преципитации и/или денатурации при сравнении с контрольным образом, предпочтительно при визуальной оценке цвета и/или прозрачности, или как измерено рассеиванием ультрафиолетовых лучей (УФ-светорассеянием) или гель-фильтрацией. В данной области техники доступны различные дополнительные аналитические методики оценки стабильности белков, и их обзор приведен, например, в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991) and Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993).
Предпочтительно, подразумевают, что термин «стабильный» применительно к композиции по изобретению означает, что полипептид CD-RAP данной композиции теряет при хранении не более 15%, или более предпочтительно 10%, или еще более предпочтительно 5%, и наиболее предпочтительно 3% его биологической активности относительно активности полипептида CD-RAP в начале хранения и/или во время или после замораживания-оттаивания. Биологическая активность CD-RAP может, например, быть определена биологическим анализом индукции хондрогенеза, как описано в Примерах 2-5 ЕР-В1 1146897. Другим биологическим анализом является анализ инвазии, описанный Stoll et al., (2006), Biol. Chem., Vol.387, pp.1601-1606 или в Примерах 7 и 8.
При использовании здесь термин «при хранении» означает, что композицию не используют сразу после изготовления; наоборот, после ее изготовления проводят ее упаковку для хранения в жидкой форме, в замороженном состоянии или в высушенной форме для последующего восстановления с получением жидкой формы или другой формы.
«Повторные циклы замораживания-оттаивания» включают один или несколько циклов замораживания-оттаивания композиции по изобретению, например, один, два, три, четыре, пять или более циклов замораживания-оттаивания. Тем не менее, как описано здесь и продемонстрировано в Примерах, композиция по изобретению сохраняет стабильность при повторных циклах замораживания-оттаивания. Соответственно, полипептид CD-RAP предпочтительно стабилен при повторных (одном, двух, трех, предпочтительно четырех, пяти или более) циклах замораживания-оттаивания. Предпочтительно, цикл замораживания-оттаивания представляет собой следующее: от 5°С до -25°С, скорость охлаждения и нагревания 1,0°С/мин с изотермической стадией продолжительностью 15 минут между циклами. Безотносительно теории, цикл замораживания-оттаивания, предпочтительно применяемый в контексте данного изобретения, имитирует стрессовые воздействия при замораживании, которые могут возникать при замораживании больших количеств растворенного белка. Соответственно, поскольку композиция по изобретению оказалась способной сохранять стабильность CD-RAP в растворе при цикле замораживания-оттаивания, композиция по изобретению более совершенна и обладает полезными свойствами.
При хранении возможно образование агрегатов, например, из-за воздействия повышенных температур. Под «повышенной температурой» понимают любую температуру выше той, при которой обычно хранят композицию по изобретению, содержащую полипептид CD-RAP. Нормальная температура хранения составляет приблизительно от 4°С до 10°С, предпочтительно приблизительно от 4°С до 8°С, более предпочтительно приблизительно от 4°С до 6°С, еще более предпочтительно приблизительно 4°С. Другими причинами образования агрегатов могут быть рН композиции, ионная сила композиции, присутствие некоторых поверхностно-активных веществ (например, полисорбата-20 и полисорбата-80), эмульгаторов и/или естественная склонность полипептида к образованию таких агрегатов. Безотносительно теории, допускают, что образование агрегатов полипептидов CD-RAP может быть обусловлено одной или несколькими из указанных выше причин и может приводить к потере активности.
Соответственно, предполагают, что полипептид CD-RAP предпочтительно стабилен в той мере, что он по существу не образует агрегаты (например, в силу одной или нескольких из указанных выше причин) при хранении и/или во время или после замораживания-оттаивания. Соответственно, предпочтительно предполагают, что агрегаты образуют не более 10% полипептида CD-RAP, более предпочтительно не более 8%, еще более предпочтительно не более 5%, еще более предпочтительно не более 3%, особенно предпочтительно не более 1% относительно количества полипептида CD-RAP в начале хранения.
Альтернативно, предполагают, что полипептид CD-RAP предпочтительно стабилен в той мере, что он не образует димеры и олигомеры. Иными словами, стабильность белка CD-RAP можно определить по проценту мономерного белка в растворе при небольшом проценте деградированного (например, фрагментированного) и/или агрегированного белка. Например, композиция по изобретению, содержащая белок CD-RAP, может содержать по меньшей мере 90%, более предпочтительно по меньшей мере 92%, еще более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 97%, особенно предпочтительно по меньшей мере 98%, наиболее предпочтительно 99% мономерного белка CD-RAP.
Под «агрегатом» понимают физическое взаимодействие белковых молекул, приводящее к образованию ковалентных или нековалентных димеров или олигомеров (то есть структур с большой молекулярной массой), которые могут оставаться в растворе или образовывать нерастворимые агрегаты, выпадающие из раствора в осадок. «Агрегат» также включает деградированный и/или фрагментированный белок CD-RAP. Степень агрегации белка в композиции можно измерить до, по существу во время или после добавления в композицию заряженной аминокислоты, как описано здесь. В некоторых воплощениях степень агрегации измеряют по меньшей мере один раз в период от приблизительно 1 суток до приблизительно 12 недель после добавления в композицию заряженной аминокислоты, как описано здесь. В других воплощениях степень агрегации измеряют по меньшей мере один раз в период от приблизительно 1 суток до приблизительно 36 месяцев после добавления в композицию заряженной аминокислоты, как описано здесь.
Как упомянуто в настоящей заявке выше, для выявления присутствия агрегатов в композиции, содержащей белок, и определения их уровней может быть использовано несколько разных аналитических способов. Эти способы включают, без ограничения, например, простой электрофорез в полиакриламидном геле (PAGE), электрофорез в полиакриламидном геле с додецил сульфатом натрия (SDS-PAGE), капиллярный гель-электрофорез (CGE), гель-фильтрацию (SEC), аналитическое ультрацентрифугирование (AUC), проточное фракционирование в поле (FFF, field flow fractionation), детекцию светорассеянием, скорость осаждения, УФ-спектроскопию, дифференциальную сканирующую калориметрию, турбидиметрию, нефелометрию, микроскопию, гель-фильтрацию/высокоэффективную жидкостную хроматографию (SEC-HPLC), высокоэффективную жидкостную хроматографию с обращенной фазой (RP-HPLC), тандемную масс-спектрометрию с ионизацией электрораспылением (ESI-MS) и тандемную RP-HPLC/ESI-MS, методику проточного фракционирования в поле и статическое и/или динамическое светорассеяние. Эти способы могут быть использованы сами по себе или в комбинации. Предпочтительными аналитическими способами выявления присутствия агрегатов в композиции, содержащей белок, предпочтительно CD-RAP, и определения уровней этих агрегатов являются гель-фильтрация/высокоэффективная жидкостная хроматография (SEC-HPLC) и методика проточного фракционирования в поле со статическим и/или динамическим светорассеянием.
Частой проблемой композиции, содержащей белок, является необратимое накопление агрегатов с течением времени, при стрессовых воздействиях, обусловленных температурой или силами сдвига. Обычно при осаждении агрегатов они образуют крупные частицы, которые легко обнаружимы. Однако, обнаружение и количественная оценка более мелких нековалентных растворимых агрегатов, часто являющихся предшественниками осаждения крупных частиц, более сложно. Таким образом, способы обнаружения и количественной оценки агрегации белков в белковой композиции должны быть основаны на типе оцениваемых агрегатов.
Из указанных выше способов предполагаемыми способами определения присутствия и/или количества растворимых ковалентных агрегатов в белковой композиции являются SEC/светорассеяние, SDS-PAGE, CGE, RP-HPLC/ESI-MS, FFF и AUC. Предполагаемыми способами определения присутствия и/или количества растворимых нековалентных агрегатов в белковой композиции являются SEC, PAGE, SDS-PAGE, CGE, FFF, AUC и динамическое светорассеяние. Предполагаемыми способами определения присутствия и/или количества нерастворимых нековалентных агрегатов в белковой композиции являются УФ-спектроскопия, турбидиметрия, нефелометрия, микроскопия, AUC и динамическое светорассеяние.
С учетом описанного выше, согласно другому воплощению изобретения предложен способ быстрой оценки стабильности полипептида CD-RAP в композиции по изобретению, включающий стадии определения активности включенного в композицию полипептида перед хранением, то есть в момент времени «ноль», хранение композиции при температуре приблизительно от 37°С до 42°С, предпочтительно при приблизительно 37°С, в течение по меньшей мере одного месяца, оценки стабильности полипептида и сравнения стабильности в момент времени «ноль» с моментом времени «один месяц». Эта информация полезна для раннего исключения партий или серий, имеющих хорошую стабильность в начале, но не подходящих для хранения на протяжении более длительных периодов времени.
Более того, композиция по изобретению предпочтительно обеспечивает лучшее длительное хранение, так что белок CD-RAP стабилен при хранении в жидком или замороженном состоянии, предпочтительно в жидкой форме. Подразумевают, что при использовании здесь фраза «длительное хранение» означает, что композицию можно хранить в течение по меньшей мере одного месяца, двух или трех месяцев или более, в течение шести месяцев или более и предпочтительно в течение одного года или более. Также подразумевают, что длительное хранение означает, что фармацевтическую композицию хранят в жидком состоянии при 2-8°С или в замороженном состоянии, например, при -20°С или при более низкой температуре, посредством чего композиция предпочтительно не теряет свою биологическую активность в степени, описанной здесь, и/или не образует агрегаты в степени, описанной здесь, и/или содержит мономеры в степени, описанной здесь. Исследование этих свойств описано в других частях настоящей заявки. Также предусмотрено и продемонстрировано в Примерах, что композиция может быть заморожена и разморожена более одного раза.
В одном аспекте изобретения включенный в композиции белок CD-RAP стабилен в жидкой форме в течение по меньшей мере 1 месяца, 2 месяцев, 3 месяцев, по меньшей мере 4 месяцев, по меньшей мере 5 месяцев, по меньшей мере 6 месяцев, по меньшей мере 12 месяцев. Предполагают, что данное изобретение также включает периоды, являющиеся промежуточными относительно указанных выше периодов времени, например 9 месяцев и так далее. Кроме того, предполагают, что изобретение также включает диапазоны значений, заданные комбинацией любых приведенных выше значений в качестве верхних и/или нижних пределов. Предпочтительно, композиция стабильна при комнатной температуре (приблизительно 20°С) или при 30°С в течение по меньшей мере 1 месяца и/или стабильна при приблизительно 2-8°С в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев, или, более предпочтительно, стабильна при приблизительно 2-8°С в течение по меньшей мере 2 лет. Кроме того, композиция предпочтительно стабильна после замораживания (например, охлаждения до -80°С) и оттаивания композиции, также называемых здесь «цикл замораживания-оттаивания».
Неожиданно, авторы настоящего изобретения, в попытке стабилизации белка CD-RAP при высокой концентрации, обнаружили, что аминокислота с суммарным зарядом при рН приблизительно от 6 до 8 обеспечивает возможность изготавливать высококонцентрированные композиции CD-RAP и способствует снижению агрегации полипептидов CD-RAP в такой композиции на протяжении длительных периодов времени, обеспечивая тем самым стабильную композицию, как описано здесь.
Соответственно, в предпочтительном аспекте заряженная аминокислота, включенная в стабильную композицию по изобретению, имеет суммарный заряд при рН приблизительно от 6 до 8.
Термин «суммарный заряд» означает, что положительные и отрицательные заряды на поверхности аминокислоты или белка, зависящие от природы аминокислоты или аминокислот белка, не равны нулю. Суммарный заряд зависит от числа и свойств заряженных аминокислот, рН, а также от положения аминокислоты в первичной последовательности полипептида. При определенном рН положительные и отрицательные заряды будут сбалансированы, и суммарный заряд будет равен нулю. Такой рН называют изоэлектрической точкой, в которой белок наименее растворим.
Более предпочтительно, аминокислота или заряженная аминокислота выбрана из группы, состоящей из глицина, аргинина, гистидина, лизина, аспарагиновой кислоты, глутаминовой кислоты и их солей. Наиболее предпочтительны гистидин, глутамат, аргинин или их соли. В некоторых воплощениях в композициях по изобретению используют комбинации указанных выше аминокислот или их солей.
В других воплощениях аминокислота представляет собой аналог аргинина, лизина или гистидина, сохраняющий способность повышать растворимость CD-RAP, предпочтительно при рН 6,0 или более. Такие аналоги включают, без ограничения, дипептиды и трипептиды, содержащие аргинин, лизин или гистидин.
В других предпочтительных воплощениях соль аминокислоты представляет собой хлорид аргинина (предпочтительно в растворе с рН от 6,0 до 8,0, более предпочтительно с рН от 6,5 до 7,5, наиболее предпочтительно с рН 6,0 или 7,4), фосфат аргинина (предпочтительно в растворе с рН от 6,0 до 8,0, более предпочтительно с рН от 6,5 до 7,5, наиболее предпочтительно с рН 6,0 или 7,4), фосфат гистидина (предпочтительно в растворе с рН от 6,0 до 8,0, более предпочтительно с рН от 6,5 до 7,5, наиболее предпочтительно с рН 6,0 или 7,4), хлорид гистидина (предпочтительно в растворе с рН от 6,0 to 8,0, более предпочтительно с рН от 6,5 до 7,5, наиболее предпочтительно с рН 6,0 или 7,4), глутамат калия и натрия (предпочтительно в растворе с рН от 6,0 до 8,0, более предпочтительно с рН от 6,5 до 7,5, наиболее предпочтительно с рН 6,0 или рН 7,4). Аминокислоты и их соли, используемые в изобретении, хорошо известны в данной области техники, их получают известными способами, и они доступны от коммерческих поставщиков.
Концентрация заряженной аминокислоты, ее соли или любой указанной аминокислоты, такой как глицин, аргинин, лизин, гистидин, аспарагиновая кислота, глутаминовая кислота и их соли, в композиции предпочтительно составляет от приблизительно 0,5% (масс./об.) до приблизительно 8% (масс./об.), от 1% (масс./об.) до приблизительно 8% (масс./об.), от 1% (масс./об.) до приблизительно 5% (масс./об.), от 1,5% (масс./об.) до приблизительно 5% (масс./об.), от 2% (масс./об.) до приблизительно 5% (масс./об.), от 0,5% (масс./об.) до приблизительно 3% (масс./об.), более предпочтительно от приблизительно 1,0% (масс./об.) до приблизительно 3% (масс./об.), еще более предпочтительно от приблизительно 1,5% (масс./об.) до приблизительно 3% (масс./об.), еще более предпочтительно от приблизительно 2,0% (масс./об.) до приблизительно 3% (масс./об.) и особенно предпочтительно приблизительно 2,5% (масс./об.). Заряженные аминокислоты доступны от коммерческих поставщиков.
Композицию по изобретению изготавливают, смешивая полипептид CD-RAP, как описано здесь, и аминокислоту с суммарным зарядом при рН приблизительно от 6 до 8, например, в водном растворе.
Кроме того, при необходимости могут быть добавлены буфер, модификатор тоничности, и/или стабилизатор, и, возможно, дополнительный эксципиент. Специалистам в данной области техники будет ясно, что смешивание различных компонентов для включения в композицию можно проводить в любом подходящем порядке. Например, буфер может быть добавлен в начале, в середине или в конце, и модификатор тоничности может также быть добавлен в начале, в середине или в конце. Специалисту в данной области техники также будет ясно, что некоторые из этих химических веществ могут быть несовместимы в определенных комбинациях и, соответственно, могут быть легко заменены другими химическими веществами, имеющими сходные свойства, но совместимыми в данной конкретной смеси.
В предпочтительном воплощении изобретения аминокислота, включенная в композицию по изобретению, и любые другие ингредиенты, такие как буфер, модификатор тоничности, стабилизатор, эксципиент, которые могут быть включены в композицию, выбраны таким образом, что они обеспечивают стабильность белка CD-RAP при повторных циклах замораживания-оттаивания (предпочтительно при 5 циклах замораживания-оттаивания (от 5°С до -25°С, скорость охлаждения и нагревания 1,0°С/мин с изотермической стадией продолжительностью 15 минут между циклами)).
В предпочтительном аспекте изобретения композиция содержит буфер.
При использовании здесь термин «буфер» включает агенты, поддерживающие рН в желаемом диапазоне. Буфер представляет собой водный раствор, состоящий из смеси слабой кислоты и сопряженного с ней основания или слабого основания и сопряженной с ним кислоты. Он обладает тем свойством, что при добавлении небольшого количества сильной кислоты или основания рН раствора меняется крайне незначительно. Буферные растворы используют как средство поддержания почти постоянного значения рН в широком спектре химических применений. Буферные растворы используют для поддержания определенного уровня по шкале рН. В целом, при добавлении буфера в композицию по изобретению он предпочтительно стабилизирует белок CD-RAP.
При использовании здесь «аминокислотные буферы» включают, например, аминокислотную основу, например аргинин, и сопряженную с ней соль. Примерами аминокислотных буферов являются аргинин/хлорид аргинина, аргинин/фосфат аргинина, гистидин/хлорид гистидина, гистидин/фосфат гистидина, глутаминовая кислота/глутамат калия или натрия. Предпочтительно, в изобретении используют эти примеры.
Предпочтительный рН композиции, как описано здесь, может быть выбран из следующих диапазонов; от приблизительно 4 до приблизительно 10, от приблизительно 5 до приблизительно 9, предпочтительно от приблизительно 6 до приблизительно 8. Соответственно, предпочтительно используют буфер, поддерживающий рН раствора от 6,0 до 8,0. При использовании в контексте значения/диапазона рН термин «приблизительно» предпочтительно означает численное значение в диапазоне +/-25% от указанного значения. Когда значение рН фармацевтической композиции установлено на физиологическом уровне или вблизи него, комфорт при введении для пациента является максимальным.
Обычно свойства буфера и/или аминокислоты и их концентрация являются такими, что осмоляльность композиции составляет 280-320 миллиосмоль/кг. В частности, предпочтительно, чтобы рН был в диапазоне приблизительно от 5,8 до 8,4, предпочтительно от 6,2 до 7,4, более предпочтительно, рН составляет от 5,8 до 8,4, наиболее предпочтительно от 6,2 до 7,4, тем не менее, следует понимать, что при необходимости рН можно корректировать для обеспечения максимальной стабильности и растворимости полипептида в конкретной композиции, и как таковой рН вне физиологических диапазонов, но все еще переносимый пациентом, входит в объем изобретения.
Неограничивающие примеры буферов, которые можно использовать в композиции, описанной здесь, включают гистидин, сукцинат, глюконат, цитрат, трис (трометамол), бис-трис, MOPS, ACES, TES, HEPES, EPPS, этилендиамин, фосфорную кислоту, яблочную кислоту/фосфат, цитрат, 2-морфолиноэтансульфоновую кислоту (MES), фосфат натрия, ацетат натрия и диэтаноламин.
Предпочтительными буферами являются фосфатные буферы, трис-буферы, аминокислотные буферы, такие как, без ограничения, аргининовый, гистидиновый и глутаматный буфер. Более предпочтительно, в композиции по изобретению используют следующие буферы: фосфат аргинина (предпочтительно с рН от 6,0 до 8,0, более предпочтительно с рН от 6,5 до 7,5, наиболее предпочтительно с рН 6,0 или 7,4), фосфат гистидина (предпочтительно с рН от 6,0 до 8,0, более предпочтительно с рН от 6,5 до 7,5, наиболее предпочтительно с рН 6,0 или 7,4), хлорид гистидина (предпочтительно с рН от 6,0 до 8,0, более предпочтительно с рН от 6,5 до 7,5, наиболее предпочтительно с рН 6,0 или 7,4). Буферы, используемые в изобретении, хорошо известны в данной области техники, их получают известными способами, и они доступны от коммерческих поставщиков.
Концентрация аминокислоты, ее соли, глицина, аргинина, лизина, гистидина, аспарагиновой кислоты, глутаминовой кислоты и их солей, буфера, такого как, без ограничения, трис-буфер, гистидиновый буфер, аргининовый фосфатный буфер и фосфатный буфер, в композициях по изобретению может быть выбрана из следующих диапазонов: от приблизительно 1 до приблизительно 500 мМ, от приблизительно 1 до приблизительно 450 мМ, от приблизительно 1 до приблизительно 400 мМ, от приблизительно 1 до приблизительно 350 мМ, от приблизительно 1 до приблизительно 300 мМ, от приблизительно 1 до приблизительно 250 мМ, от приблизительно 1 до приблизительно 200 мМ, от приблизительно 1 до приблизительно 150 мМ, от приблизительно 1 до приблизительно 100 мМ, от приблизительно 1 до приблизительно 50 мМ, от приблизительно 1 до приблизительно 40 мМ, от приблизительно 1 до приблизительно 30 мМ, от приблизительно 1 до приблизительно 20 мМ, от приблизительно 1 до приблизительно 10 мМ, от приблизительно 10 до приблизительно 500 мМ, от 10 до приблизительно 450 мМ, от 10 до приблизительно 400 мМ, от 10 до приблизительно 350 мМ, от 10 до приблизительно 300 мМ, от 10 до приблизительно 250 мМ, от 10 до приблизительно 200 мМ, от 10 до приблизительно 150 мМ, от приблизительно 30 до приблизительно 500 мМ, от 30 до приблизительно 450 мМ, от 30 до приблизительно 400 мМ, от 30 до приблизительно 350 мМ, от 30 до приблизительно 300 мМ, от 30 до приблизительно 250 мМ, от 30 до приблизительно 200 мМ или от 30 до приблизительно 150 мМ.
Для трис-буфера наиболее предпочтительная концентрация составляет от 30 до 100 мМ, для гистидинового буфера предпочтительная концентрация составляет от 45 до 60 мМ или от 250 до 350 мМ, наиболее предпочтительно от 50 мМ до 300 мМ, для фосфатного буфера предпочтительная концентрация составляет от 45 до 60 мМ, для аргининового буфера предпочтительная концентрация составляет от 250 до 380 мМ, и для глутаматного буфера предпочтительная концентрация составляет от 250 до 360 мМ, наиболее предпочтительно от 280 до 360 мМ.
В предпочтительном аспекте изобретения композиция содержит модификатор тоничности. Подразумевают, что при использовании здесь термин «модификатор тоничности» обозначает соединение или соединения, которые могут быть использованы для коррекции тоничности жидкой композиции. Подходящие модификаторы тоничности включают глицерин, лактозу, маннит, декстрозу, хлорид натрия, сульфат магния, хлорид магния, хлорид калия, сульфат натрия, сорбит, трегалозу, сахарозу, раффинозу, мальтозу и другие модификаторы тоничности, известные специалистам в данной области техники. В одном воплощении тоничность жидкой композиции приблизительно соответствует тоничности крови или плазмы. Модификатор тоничности влияет на осмоляльность композиции. Осмоляльность человеческой сыворотки составляет приблизительно 250-350 мОсм/кг. Для поддержания стабильности белка и минимизации дискомфорта пациента обычно предпочтительно, чтобы композиция была изотоничной, то есть чтобы ее осмоляльность была приблизительно равна осмоляльности человеческой сыворотки или синовиальной жидкости. Соответственно, осмоляльность композиции предпочтительно составляет от 180 до 420 мОсм/кг, более предпочтительно от 280 до 320 мОсм/кг. В этот диапазон входит наиболее желательная осмоляльность, то есть изотоничность. Термин «изотоничный» означает, что рассматриваемая композиция имеет по существу такое же осмотическое давление, что и человеческая кровь. Изотоничные композиции будут обычно иметь осмотическое давление приблизительно 270-328 мОсм. Несколько сниженное осмотическое давление составляет 250-269 мОсм, и несколько повышенное осмотическое давление составляет 328-350 мОсм. Осмотическое давление может быть измерено, например, с использованием парового осмометра или осмометра замораживающего типа (ice-freezing type osmometer).
Тем не менее, специалисту в данной области техники будет ясно, что в зависимости от конкретных условий осмоляльность композиции может быть выше или ниже. В данной области техники известно множество модификаторов тоничности (см., например, абзац [0047] заявки на патент США 2003/0180287). На осмоляльность композиции могут влиять другие компоненты композиции, включая, без ограничения, соли (например, хлорид натрия, хлорид калия и цитрат натрия), буферы, дисахариды (например, сахароза, глюкоза и маннит), наполнители и поверхностно-активные вещества. Концентрация модификатора тоничности в композиции предпочтительно составляет от 1 мМ до 1000 мМ, более предпочтительно от 10 мМ до приблизительно 200 мМ. Предпочтительным модификатором тоничности, используемым в композиции по изобретению, является хлорид калия или хлорид натрия, предпочтительно в концентрации менее 150 мМ, менее 100 мМ, менее 80 мМ, менее 50 мМ, в концентрации от 10 до 50 мМ, от 40 до 90 мМ, от 40 до 120 мМ, от 50 до 120 мМ, от 50 до 150 мМ, от 80 до 150 мМ, от 80 до 120 мМ, от 40 до 45 мМ, от 80 до 90 мМ, от 100 до 150 мМ, от 100 до 120 мМ, 42,5 мМ, 89,5 мМ, 116,5 мМ или 150 мМ.
В некоторых воплощениях композиция дополнительно содержит хлорид натрия (NaCl). В определенных воплощениях композиция содержит 1-200 мМ, или менее 50 мМ, менее 40 мМ, менее 35 мМ, менее 30 мМ, менее 25 мМ, менее 20 мМ, менее 15 мМ, менее 10 мМ или менее 5 мМ NaCl. В определенных условиях NaCl может затруднять лиофилизацию или приводить к появлению опалесценции восстановленной лиофилизированной композиции. Соответственно, в менее предпочтительном воплощении композиция не содержит NaCl.
Помимо белка CD-RAP композиция, как описано здесь, может также содержать другие вещества. Эти вещества включают, без ограничения, стабилизирующие агенты (стабилизаторы).
Соответственно, в предпочтительном аспекте композиция содержит стабилизатор. Термин «стабилизирующий агент» относится к агенту, улучшающему или иным образом повышающему стабильность композиции, особенно белка CD-RAP. Стабилизирующий агент может представлять собой дисахарид, сахарный спирт, хелатор металлов или комбинацию хелаторов металлов, акцептор радикалов или их комбинации.
Предпочтительно, при использовании дисахарида в качестве стабилизирующего агента он может представлять собой невосстанавливающий сахар, например сахарозу, трегалозу или маннозу. В некоторых воплощениях концентрация дисахарида в композиции выбрана из следующих диапазонов: от 0,5 до 5%, от 0,5 до 4%, от 0,5 до 3%, от 0,5 до 2,5%, от 0,5 до 2%, от 0,5 до 1,5%, от 0,5 до 1%, от 1 до 1,5%, от 1,5 до 2%, от 2 до 2,5%, от 2,5 до 3%, от 3 до 4%, от 4 до 5% или более 5% (масс./об.). В определенных воплощениях концентрация дисахарида в композиции составляет приблизительно от 0,5 до 5%, например приблизительно от 0,5 до 2,0% (масс./об.). Предпочтительным стабилизатором, используемым в композиции по изобретению, является сахароза, предпочтительно в концентрации 5,0%, или маннит, предпочтительно в концентрации 5,0% (масс./об.).
Стабилизирующий агент может также представлять собой сахарный спирт, такой как гликоль, глицерин, эритрит, треит, арабит, ксилит, рибит, маннит, сорбит, дульцит, идит, изомальт, мальтит, лактит или полиглицит.
Другим стабилизатором может быть хелатор металлов или комбинация хелаторов металлов. В определенных воплощениях хелаторы металлов представляют собой диэтилентриаминпентауксусную кислоту (DTPA), этиленгликольтетрауксусную кислоту (EGTA) и DEF. В некоторых воплощениях концентрация DTPA или EGTA в белковой композиции составляет от приблизительно 1 мкМ до приблизительно 10 мМ, от приблизительно 1 мкМ до приблизительно 5 мМ, от приблизительно 10 мкМ до приблизительно 10 мМ, от 50 мкМ до приблизительно 5 мМ или от приблизительно 75 мкМ до приблизительно 2,5 мМ. В некоторых воплощениях концентрация DEF в белковой композиции составляет от приблизительно 1 мкМ до приблизительно 10 мМ, от приблизительно 1 мкМ до приблизительно 5 мМ, от приблизительно 10 мкМ до приблизительно 1 мМ или от приблизительно 20 мкМ до приблизительно 250 мкМ.
Стабилизатор может также представлять собой акцептор свободных радикалов, в частности, акцептор кислородных радикалов. В некоторых воплощениях акцептор свободных радикалов представляет собой маннит или гистидин. В некоторых воплощениях концентрация маннита в белковой композиции составляет от приблизительно 0,01% до приблизительно 5%, от приблизительно 0,1% до приблизительно 5%, от приблизительно 0,5% до приблизительно 5% или от приблизительно 1% до приблизительно 5%.
В других воплощениях агент, уменьшающий агрегацию белка, входящего в композицию, представляет собой комбинацию хелатора металлов и акцептора свободных радикалов. В некоторых воплощениях агент, уменьшающий агрегацию белка или белков, входящих в композицию, представляет собой цитрат. В определенных воплощениях концентрация цитрата в белковой композиции составляет от приблизительно 0,5 мМ до приблизительно 50 мМ, от приблизительно 0,5 мМ до приблизительно 25 мМ, от приблизительно 1 мМ до приблизительно 35 мМ, от приблизительно 5 мМ до приблизительно 25 мМ или от приблизительно 5 мМ до приблизительно 10 мМ.
В предпочтительном воплощении композиция, описанная здесь, содержит эксципиент. Предпочтительно, эксципиент выбран из группы, состоящей из криопротектора, лиопротектора, поверхностно-активного вещества, наполнителя, антиоксиданта и их комбинаций.
В композицию по изобретению могут также быть добавлены эксципиенты, также называемые химическими добавками, сорастворенными веществами, сорастворителями, предпочтительно стабилизирующими полипептид CD-RAP в растворе (также в высушенной или замороженной форме). Предпочтительно, эксципиенты вносят вклад в повышение стабильности белка CD-RAP, но следует понимать, что эксципиенты могут иным образом влиять на физические, химические и биологические свойства композиции. Эксципиенты хорошо известны в данной области техники, их получают известными способами, и они доступны от коммерческих поставщиков.
Примеры эксципиентов включают, без ограничения: сахара/полиолы, такие как сахароза, лактоза, глицерин, ксилит, сорбит, маннит, мальтоза, инозит, трегалоза, глюкоза; полимеры, такие как сывороточный альбумин (бычий сывороточный альбумин (BSA), человеческий сывороточный альбумин (человеческий SA) или рекомбинантный человеческий альбумин (НА)), декстран, поливиниловый спирт (PVA), гидроксипропилметилцеллюлоза (НРМС), полиэтиленимин, желатин, поливинилпирролидон (PVP), гидроксиэтилцеллюлоза (НЕС), гидроксиэтилкрахмал (HES); неводные растворители, такие как многоатомные спирты (например, PEG, этиленгликоль и глицерин), диметилсульфоксид (DMSO) и диметилформамид (DMF); аминокислоты, такие как пролин, L-серин, глутамат натрия, аланин, глицин, гидрохлорид лизина, саркозин и гамма-аминомасляная кислота; поверхностно-активные вещества, такие как Tween-80, Tween-20, SDS, полисорбат, сополимер полиоксиэтилена; и различные эксципиенты, такие как фосфат калия, ацетат натрия, сульфат аммония, сульфат магния, сульфат натрия, триметиламин-N-оксид, бетаин, ионы металлов (например, цинка, меди, кальция, марганца и магния), CHAPS, монолаурат, 2-O-бета-манноглицерат или любую комбинацию указанного выше. В определенных воплощениях концентрация поверхностно-активного вещества в композиции составляет от 0,001 до 5,0%, от 0,001 до 2,5%, от 0,001 до 1%, от 0,001 до 0,5%, от 0,001 до 0,2%, от 0,001 до 0,1%, от 0,001 до 0,05%, от 0,001 до 0,01% или от 0,001 до 0,005% по массе.
«Криопротекторы» включают вещества, обеспечивающие стабильность замороженного белка при изготовлении, заморозке, хранении, транспортировке, распределении, восстановлении или применении. В определенном аспекте «Криопротекторы» включают вещества, защищающие белок от стрессовых воздействий, обусловленных процессом замораживания. Криопротекторы могут действовать как лиопротекторы. Неограничивающие примеры криопротекторов включают: сахара, такие как сахароза, глюкоза, трегалоза, маннит, манноза и лактоза; полимеры, такие как декстран, гидроксиэтилкрахмал и полиэтиленгликоль; поверхностно-активные вещества, такие как полисорбаты (например, полисорбат-20 (PS-20) или полисорбат-80 (PS-80)); и аминокислоты, такие как глицин, аргинин, лейцин и серин. Обычно используют криопротектор, обладающий низкой токсичностью в биологических системах. При его включении в композицию криопротектор добавляют до конечной концентрации от приблизительно 1% до приблизительно 10% (масс./об.), предпочтительно до конечной концентрации от 0,5 до 8% (масс./об.), от 0,5 до 6% (масс./об.), от 0,5 до 8% (масс./об.), от 0,5 до 5% (масс./об.), от 1 до 8% (масс./об.), от 1 до 6% (масс./об.), от 1 до 8% (масс./об.), от 1 до 5% (масс./об.), от 1,5 до 8% (масс./об,), от 1,5 до 6% (масс./об.), от 1,5 до 8% (масс./об.), от 1,5 до 5% (масс./об.), от 2 до 8% (масс./об.), от 2 до 6% (масс./об.), от 2 до 8% (масс./об.), от 2 до 5,5% (масс./об.).
Дисахарид, описанный здесь, может действовать как лиопротектор или криопротектор. «Лиопротекторы» включают вещества, предотвращающие или снижающие химическую или физическую нестабильность белка при лиофилизации и последующем хранении. В одном аспекте лиопротектор включает вещества, предотвращающие или снижающие химическую или физическую нестабильность белка при удалении воды из композиции в процессе сушки. В другом аспекте лиопротектор стабилизирует белок, способствуя поддержанию правильной конформации белка, благодаря образованию водородных связей.
Соответственно, в одном аспекте дисахарид, как описано здесь, может способствовать стабилизации белка CD-RAP при замораживании. Поскольку защитный эффект при замораживании может зависеть от абсолютной концентрации дисахарида (Carpenter et al., Pharm. Res. (1997), 14:969-975), для максимизации стабильности могут быть необходимы концентрации более 5%.
В одном аспекте дисахарид стабилизирует белок CD-RAP при сушке. Защитный эффект при сушке может зависеть от конечного массового соотношения дисахарида и белка. Carpenter et al., Pharmaceutical Research 14:969-975 (1997). Соответственно, в некоторых воплощениях концентрация дисахарида выбрана для достижения желаемого массового соотношения дисахарида и белка, обычно по меньшей мере 1:1. В некоторых воплощениях стабильность оптимальна при массовом соотношении дисахарид: белок 5:1. В других воплощениях массовое соотношение дисахарид: белок составляет 10:1, 20:1, 30:1, 40:1, 50:1, 100:1, 200:1, 300:1, 400:1, 500:1, 600:1, 700:1, 800:1, 900:1, 1000:1 или более 1000:1.
В одном воплощении к композиции, описанной здесь, добавлен лиопротектор. При использовании здесь термин «лиопротектор» включает агенты, обеспечивающие стабильность белка в процессе сублимации или дегидратации (первичных и вторичных циклах сублимации), обеспечивая аморфный стеклообразный матрикс и связываясь с белком водородными связями, замещая молекулы воды, удаляемые в процессе сушки. Это способствует поддержанию конформации белка, минимизации деградации белка во время цикла лиофилизации и повышению стабильности продукта при длительном хранении. Лиопротектор добавляют к композиции перед лиофилизацией в «количестве, обеспечивающем лиопротективный эффект», которое означает, что после лиофилизации белка CD-RAP в присутствии лиопротектора в количестве, обеспечивающем лиопротективный эффект, белок по существу сохраняет свою физическую и химическую стабильность и целостность при лиофилизации и хранении.
Неограничивающие примеры лиопротекторов включают: сахара, такие как сахароза или трегалоза; аминокислоты, такие как одноосновный глутамат натрия, глицин или гистидин; метиламин, такой как бетаин; лиотропные соли, такие как сульфат магния; полиолы, такие как триатомные спирты или спирты с большим числом гидроксильных групп, например, арабит, ксилит, сорбит и маннит; полиэтиленгликоль; плюроники; и их комбинации. Количество лиопротектора, добавляемое в композицию, обычно представляет собой количество, не приводящее к неприемлемой степени деградации/агрегации белка при лиофилизации белковой композиции. Когда лиопротектор представляет собой сахар (такой как сахароза или трегалоза) и белок представляет собой антитело, неограничивающие примеры концентраций лиопротектора в белковой композиции составляют от приблизительно 10 мМ до приблизительно 400 мМ, предпочтительно от приблизительно 30 мМ до приблизительно 300 мМ и наиболее предпочтительно от приблизительно 50 мМ до приблизительно 100 мМ. В некоторых воплощениях в композицию может быть включено поверхностно-активное вещество.
Другим предпочтительным эксципиентом является поверхностно-активное вещество. Термин «поверхностно-активное вещество» обычно включает агенты, защищающие белок CD-RAP от стрессовых воздействий на границе раздела «воздух-раствор» и стрессовых воздействий на границе раздела «раствор-поверхность». Например, поверхностно-активные вещества могут защищать белок от агрегации.
Примеры поверхностно-активных веществ включают, без ограничения: неионные поверхностно-активные вещества, такие как полисорбаты (полисорбат-80 или полисорбат-20); полоксамеры (например, полоксамер-188); Triton, додецилсульфат натрия (SDS); лаурилсульфат натрия; октилгликозид натрия; лаурилсульфобетаин, миристилсульфобетаин, линолеилсульфобетаин, стеарилсульфобетаин; лаурилсаркозин; миристилсаркозин; линолеилсаркозин, стеарилсаркозин; линолеилбетаин, миристилбетаин, цетилбетаин; лауроамидопропилбетаин, кокамидопропилбетаин, линоламидопропилбетаин, миристамидопропилбетаин, пальмидопропилбетаин, изостеарамидопропилбетаин (например, лауроамидопропил); миристамидопропил-, пальмидопропил- или изостеарамидопропилдиметиламин; метилкокоилтаурат натрия или двунатриевую соль метилолеилтаурата; и серию Monaquat (Mona Industries, Inc., Paterson, NJ.), полиэтиленгликоль, полипропиленгликоль и сополимеры этиленгликоля и пропиленгликоля (например, плюроники, PF68). Добавляемое количество поверхностно-активного вещества является таким, что оно удерживает агрегацию восстановленного белка на приемлемом уровне согласно применяемому анализу, например SEC-HPLC с определением процента высокомолекулярных (HMW) частиц или низкомолекулярных (LMW) частиц, и минимизирует образование частиц после восстановления лиофилизированной белковой композиции, как описано здесь. Например, поверхностно-активное вещество может присутствовать в композиции (жидкой или перед восстановлением лиофилизированной композиции) в количестве от приблизительно 0,001 до приблизительно 0,5%, например от приблизительно 0,05 до приблизительно 0,3%. Предпочтительным поверхностно-активным веществом, используемым в композиции по изобретению, является полисорбат-20 или полисорбат-80.
Еще одним предпочтительным эксципиентом может быть наполнитель. Конкретно, в одном аспекте изобретения предполагают, что композицию по изобретению изготавливают в форме нерасфасованной композиции, и сами по себе компоненты фармацевтической композиции присутствуют в количестве, превышающем необходимое для введения, и такую композицию разводят соответствующим образом перед применением.
При использовании здесь термин «наполнитель» включает агенты, обеспечивающие структуру сублимированного продукта без непосредственного взаимодействия с фармацевтическим продуктом. Помимо обеспечения фармацевтически приемлемой сухой композиции наполнители могут также обладать полезными свойствами относительно модификации температуры коллапса, оказывая защитный эффект при замораживании-оттаивании и повышая стабильность белка при длительном хранении. Неограничивающие примеры наполнителей включают маннит, глицин, лактозу и сахарозу. Наполнители могут быть кристаллическими (такими как глицин, маннит или хлорид натрия) или аморфными (такими как декстран, гидроксиэтилкрахмал), и их обычно используют в белковых композициях в количестве от 0,5% до 10%.
Предпочтительно, наполнитель, используемый в композиции по изобретению, способствует получению эстетически приемлемой, однородной сухой композиции с хорошими механическими свойствами. Предпочтительно, наполнители также способствуют получению открытой пористой структуры, облегчая и ускоряя восстановление. Предпочтительно, наполнители также ослабляют или предотвращают коллапс сухой композиции, эвтектическое плавление или задержку остаточной влаги. В другом аспекте наполнители предпочтительно способствуют защите белка CD-RAP от стрессовых воздействий (например, физических и химических стрессовых воздействий) и способствуют сохранению активности белка.
В определенных воплощениях концентрация наполнителя в композиции выбрана из следующих диапазонов: от 1 до 10%, от 1 до 8%, от 1 до 5%, от 2 до 8%, от 2 до 6%, от 2,5 до 6%, от 0,5 до 1%, от 1 до 1,5%, от 1,5 до 2%, от 2 до 2,5%, от 2,5 до 3%, от 3 до 3,5%, от 3,5 до 4%, от 4 до 4,5%, от 4,5 до 5%, более 5%, от 0,5 до 5%, от 0,5 до 4%, от 0,5 до 3%, от 0,5 до 2,5%, от 0,5 до 2%, от 0,5 до 1,5%, или от 0,5 до 1%. В некоторых воплощениях концентрация наполнителя в композиции составляет от 0,5 до 5%, например от 0,5 до 3%, точнее от 1,8 до 2%,
Другим предпочтительным эксципиентом может быть антиоксидант. При использовании здесь «антиоксидант» представляет собой молекулу, способную замедлять или предотвращать окисление других молекул. Окисление представляет собой химическую реакцию переноса электронов от вещества к окислителю. Для использования в способах по изобретению предпочтительны фармацевтически приемлемые антиоксиданты. Такие антиоксиданты включают, без ограничения, восстановители, аскорбиновую кислоту (витамин С), липоевую кислоту, мелатонин, мочевую кислоту, каротины, ретинолы, токоферолы и токотриенолы, например α-токоферол (витамин Е), убихинон (коэнзим Q) и тому подобное.
Возможно, в некоторых воплощениях композиция может содержать консервант.«Консервант» представляет собой соединение, которое может быть добавлено в композиции, описанные здесь, для снижения бактериальной активности. Добавление консерванта может, например, способствовать изготовлению композиции для многоразового использования (многодозовые композиции). Примеры возможных консервантов включают хлорид октадецилдиметилбензиламмония, хлорид гексаметония, хлорид бензалкония (смесь хлоридов алкилдиметилбензиламмония с длинноцепочечными алкильными группами) и хлорид бензетония. Другие типы консервантов включают ароматические спирты, такие как фенол, бутиловый и бензиловый спирт, алкилпарабены, такие как метил- или пропилпарабен, катехол, резорцин, циклогексанол, 3-пентанол и м-крезол. В данном изобретении наиболее предпочтительным консервантом является бензиловый спирт.
В прилагаемых Примерах (см. Примеры 3 и 4) продемонстрировано (см. также Фиг.6, 7, 10 и 11), что в исследованных композициях (за исключением CD-RAP в 50 мМ фосфате калия/5% сахарозе и 150 мМ глицине, рН 6,0) циклы замораживания-оттаивания не оказали влияния на стабильность белка. В последнем случае наблюдали значительное снижение концентрации CD-RAP после третьего цикла замораживания-оттаивания. Тем не менее, при всех других композициях раствор был прозрачным после каждого цикла замораживания. В сочетании с результатами количественного определения rhCD-RAP в ультрафиолетовой и видимой областях спектра (UV/Vis-анализ) это позволяет решить задачу настоящего изобретения и обеспечивает подходящие условия для rhCD-RAP в высоких концентрациях.
Соответственно, в более предпочтительных воплощениях композиция по изобретению представляет собой жидкую, предпочтительно водную композицию, содержащую по меньшей мере 5, 10, 15, 20, 25 или 30 мг/мл CD-RAP, буфер, выбранный из группы, состоящей из фосфата калия или натрия, трис, гистидинового, аргининового и глутаматного буфера, и аминокислоту, выбранную из группы, состоящей из аспартата, глутамата (предпочтительно фосфата глутамата), аргинина (предпочтительно фосфата аргинина или хлорида аргинина), гистидина (предпочтительно хлорида гистидина или фосфата гистидина), лизина и глицина.
Глутамат, аспартат, аргинин, гистидин, лизин и глицин предпочтительно присутствуют в композиции в количестве 2,5% (масс./об.). Предпочтительно, буфер и аминокислота выбраны таким образом, что они обеспечивают стабильность белка CD-RAP при 5 циклах замораживания-оттаивания (от 5°С до -25°С, скорость охлаждения и нагревания 1,0°С/мин с изотермической стадией продолжительностью 15 минут между циклами).
Соответственно, в определенных предпочтительных воплощениях изобретения предложена жидкая, предпочтительно водная композиция, содержащая по меньшей мере 30 мг/мл CD-RAP и 50 мМ трис-хлорида (хлорида трис(гидроксиметил)аминометана) и 2,5% глутамата; 50 мМ гистидина и 2,5% (масс./об.) глицина, 2,5% (масс./об.) глутамата или 2,5% (масс./об.) лизина; 300 мМ хлорида гистидина, рН 6,0; 50, 100, 200 или 300 мМ фосфата гистидина, рН 6,0; 350 мМ хлорида аргинина, рН 6,0; 350 мМ фосфата аргинина, рН 6,0; 350 мМ фосфата аргинина, рН 7,4; или 300 мМ глутамата калия, рН 6,0. Возможно, композиции могут содержать стабилизатор, модификатор тоничности и/или эксципиент, как описано здесь.
Следует понимать, что определенные компоненты композиции могут быть заменены альтернативными, известными в данной области техники. Тем не менее, специалисту в данной области техники также будет ясно, что включение определенных компонентов будет препятствовать применению других компонентов, концентраций или способов изготовления композиции по причинам, включающим, без ограничения, химическую совместимость, рН, тоничность и стабильность.
Как указано здесь, данная заявка относится в целом к обнаружению того, что добавление заряженной аминокислоты в композицию может уменьшать агрегацию белка CD-RAP в высоких концентрациях в композиции. Независимо от причин, приводящих к агрегации белка CD-RAP в высокой концентрации в композиции добавление заряженной аминокислоты или комбинации заряженных аминокислот, как описано здесь, уменьшает агрегацию белка CD-RAP в композиции. В определенных воплощениях добавление заряженной аминокислоты уменьшает агрегацию в композиции, обусловленную, например, хранением, воздействием повышенных температур, воздействием света, воздействием сил сдвига, присутствием поверхностно-активных веществ, рН и ионными условиями и любыми их комбинациями.
Авторы настоящего изобретения обнаружили, что такая мера может быть использована для уменьшения агрегации белков CD-RAP, включенных, в частности, в жидкую композицию. Таким образом, в жидкой композиции предпочтительно наблюдают уменьшение агрегации. Предполагают, что уменьшенную агрегацию можно также наблюдать при хранении непосредственно в жидкой форме для дальнейшего применения, хранении в замороженном состоянии и размораживании перед применением или изготовлении в высушенной форме, такой как лиофилизированная, высушенная на воздухе или высушенная распылением форма, для восстановления с получением жидкой или другой формы перед применением.
Таким образом, предполагают, что композицию, описанную здесь, можно хранить любым способом, известным специалисту в данной области техники. Неограничивающие примеры включают замораживание, лиофилизацию и распылительную сушку композиции.
В некоторых случаях белковые композиции замораживают для хранения. Соответственно, желательно, чтобы композиция была относительно стабильна в таких условиях, включающих циклы замораживания-оттаивания. Один способ определения того, является ли композиция подходящей, состоит в проведении по меньшей мере двух, например от трех до десяти, циклов замораживания и оттаивания образца композиции (например, с быстрым оттаиванием при комнатной температуре или медленным оттаиванием на льду), определении количества низкомолекулярных частиц (LMW-частиц) и/или высокомолекулярных частиц (HMW-частиц), накапливающихся после циклов замораживания-оттаивания, и его сравнении с количеством LMW-частиц или HMW-частиц, присутствующих в образце перед замораживанием-оттаиванием. Увеличение количества LMW- или HMW-частиц указывает на сниженную стабильность белка, хранящегося как часть композиции. Для определения присутствия LMW- или HMW-частиц может быть использована гель-фильтрация/высокоэффективная жидкостная хроматография (SEC-HPLC).
В некоторых случаях белковые композиции можно хранить в жидкой форме. Соответственно, как описано здесь, желательно, чтобы жидкая композиция была стабильна в таких условиях, включающих различные температуры. Например, один способ определения того, является ли композиция подходящей, состоит в хранении образцов композиции при нескольких температурах (таких как 2-8, 15, 20, 25, 30, 35, 40 и 50°С) и мониторинге количества HMW- и/или LMW-частиц, накапливающихся с течением времени. Чем меньше количество HMW- и/или LMW-частиц, накапливающихся с течением времени, тем лучше условия хранения композиции. Кроме того, можно проводить мониторинг заряда белка катионообменной-высокоэффективной жидкостной хроматографией (СЕХ-HPLC). Альтернативно, композиции можно хранить после лиофилизации.
Термин «лиофилизированный» или «сублимированный» относится к состоянию вещества после его сушки, такой как лиофилизация, с удалением по меньшей мере 90%, предпочтительно 95%, наиболее предпочтительно 98% воды. Соответственно, при использовании здесь термин «лиофилизация» относится к процессу, при котором вещество, подлежащее сушке, сначала замораживают с последующим удалением льда или замороженного растворителя сублимацией в вакууме. В композиции, подлежащие лиофилизации, может быть включен эксципиент (например, лиопротектор) для повышения стабильности лиофилизированного продукта при хранении. При использовании здесь термин «восстановленная композиция» относится к композиции, которая была получена растворением лиофилизированной белковой композиции в разбавителе, так что белок диспергирован в разбавителе.
При использовании здесь термин «разбавитель» представляет собой фармацевтически приемлемое вещество (безопасное и нетоксичное при введении человеку), полезное для изготовления жидкой композиции, такой как композиция, восстановленная после лиофилизации. Неограничивающие примеры разбавителей включают стерильную воду, бактериостатическую воду для инъекций (BWFI), рН-забуференный раствор (например, забуференный фосфатом физиологический раствор), стерильный физиологический раствор, раствор Рингера, раствор декстрозы или водные растворы солей и/или буферов.
Для определения того, является композиция подходящей, может быть полезно исследование композиции на стабильность белкового компонента композиции после лиофилизации. Этот способ подобен способу, описанному выше для замораживания, за исключением того, что вместо замораживания образец композиции лиофилизируют, восстанавливают разбавителем и исследуют присутствие LMW-частиц и/или HMW-частиц в восстановленной композиции. Увеличение количества LMW- или HMW-частиц в лиофилизированном образце по сравнению с соответствующим образцом нелиофилизированной композиции указывает на сниженную стабильность в лиофилизированном образце.
В некоторых случаях перед хранением композиции проводят ее сушку. Для сушки распылением проводят распыление жидкой композиции в потоке сухого газа. Происходит удаление воды из капель композиции в поток газа, что приводит к получению высушенных частиц лекарственной композиции. В композицию могут быть включены эксципиенты для (1) защиты белка во время обезвоживания при распылительной сушке, (2) защиты белка при хранении после распылительной сушки и/или (3) придания раствору свойств, делающих его подходящим для распыления. Этот способ подобен способу, описанному выше для замораживания, за исключением того, что вместо замораживания проводят распылительную сушку образца композиции, восстанавливают его разбавителем и исследуют присутствие LMW-частиц и/или HMW-частиц в восстановленной композиции. Увеличение количества LMW- или HMW-частиц в образце, высушенном распылением, по сравнению с соответствующим образцом нелиофилизированной композиции указывает на сниженную стабильность в образце, высушенном распылением.
Лиофилизированные композиции обычно восстанавливают для использования посредством добавления водного раствора для растворения лиофилизированной композиции. Для восстановления лиофилизированной композиции может быть использован широкий спектр водных растворов. Предпочтительно, лиофилизированные композиции восстанавливают водой. Предпочтительно, лиофилизированные композиции восстанавливают раствором, состоящим по существу из воды (например, WFI согласно Фармакопее США (USP WFI) или воды для инъекций (WFI)) или бактериостатической воды (например, USP WFI с 0,9% бензиловым спиртом). Тем не менее, могут также быть использованы растворы, содержащие буферы, и/или эксципиенты, и/или один или несколько фармацевтически приемлемых носителей.
Сублимированные или лиофилизированные композиции обычно изготавливают из жидкостей, то есть из растворов, суспензий, эмульсий и тому подобного. По этой причине, жидкость, подлежащая сублимации или лиофилизации, предпочтительно содержит все компоненты, присутствие которых желательно в конечной восстановленной жидкой композиции. В результате, при восстановлении сублимированная или лиофилизированная композиция обеспечивает получение желаемой восстановленной жидкой композиции.
В другом аспекте изобретения композиция предназначена для применения в лечении. Соответственно, согласно изобретению предложена фармацевтическая композиция (или лекарственное средство), содержащая композицию, описанную здесь.
В еще одном воплощении согласно изобретению предложен способ лечения субъекта, имеющего заболевание или расстройство, которое можно полезным образом лечить полипептидом CD-RAP, включающий введение терапевтически эффективного количества композиции, описанной здесь.
Предпочтительно, композицию, описанную здесь, применяют в профилактике и/или лечении заболевания, которое можно предотвращать и/или лечить с использованием CD-RAP.
Подразумевают, что термин «субъект» включает живые организмы. Примеры субъектов включают млекопитающих, например людей, собак, коров, лошадей, свиней, овец, коз, кошек, мышей, кроликов, крыс и трансгенных животных, не являющихся людьми. В предпочтительных воплощениях изобретения субъект представляет собой человека.
Термин «эффективная доза» определяют как количество, достаточное для достижения или по меньшей мере частичного достижения желаемого эффекта. Термин «терапевтически эффективная доза» определяют как количество, достаточное для лечения или по меньшей мере частичной остановки развития заболевания и его осложнений у пациента, уже страдающего от заболевания. Количества, эффективные для данного применения, будут зависеть от тяжести инфекции и общего состояния собственной иммунной системы субъекта. Термин «пациент» включает человека и других субъектов-млекопитающих, получающих профилактическое или терапевтическое лечение.
Подходящая доза или терапевтически эффективное количество композиции будут зависеть от состояния, подлежащего лечению, тяжести состояния, предшествующего лечения, истории болезни пациента и ответа на терапевтический агент. Возможна коррекция подходящей дозы по усмотрению лечащего врача, таким образом, что она может быть введена пациенту однократно или несколькими введениями. Фармацевтическую композицию можно вводить в качестве единственного терапевтического агента или, по необходимости, в комбинации с дополнительными терапевтическими агентами.
Фармацевтические композиции по данному изобретению особенно полезны при парентеральном введении, то есть подкожном, внутримышечном, внутривенном, внутрисуставном и/или интрасиновиальном введении. Парентеральное введение может представлять собой болюсную инъекцию или продолжительную инфузию.
В предпочтительном воплощении инъекция представляет собой местное или несистемное введение, предпочтительно в синовиальную оболочку, синовиальное пространство, синовиальную жидкость или синовиальное соединение, подхрящевую область, костно-хрящевой дефект, внутрисуставное пространство коленного, плечевого, тазобедренного сустава, сустава большого пальца руки, височно-нижнечелюстного сустава или фасеточного сустава, фиброзное кольцо, студенистое ядро, область студенистого ядра, внутрь межпозвоночного диска или через межпозвоночный диск. Более предпочтительно, инъекция представляет собой внутрисуставную инъекцию в коленный, плечевой, тазобедренный сустав, сустав большого пальца руки, височно-нижнечелюстной сустав или фасеточный сустав. Более предпочтительно, внутрисуставная инъекция представляет собой внутрисуставную инъекцию в синовиальную жидкость фасеточного сустава или височно-нижнечелюстного сустава. Более предпочтительная инъекция представляет собой инъекцию в подсиновиальное пространство или область или инъекцию в хрящевой или костно-хрящевой дефект. Изобретение также включает инъекцию в хрящевой или костно-хрящевой дефект до или после закрытия дефекта мембраной. Мембрана может представлять собой, без ограничения, периост или коллагеновую мембрану. В другом воплощении мембрана представляет собой мембрану, содержащую коллаген I типа, коллаген III типа, свиной или крысиный коллаген I типа или III типа, гиалуроновую кислоту или ее производные. Преимущество закрытия дефекта до инъекции композиции состоит в уменьшении разведения композиции или повышении местной концентрации активного ингредиента композиции. Мембрана также действует как биоадгезивный агент для прикрепления клеток.
Если белковая композиция была лиофилизирована, перед введением лиофилизированное вещество сначала разводят в подходящей жидкости. Например, лиофилизированное вещество может быть восстановлено в бактериостатической воде для инъекций (BWFI), физиологическом растворе, забуференном фосфатом физиологическом растворе (PBS), водном растворе или в той же композиции, в которой белок был растворен до лиофилизации.
Фармацевтические композиции для инъекций могут быть представлены в стандартной лекарственной форме, например в ампулах или многодозовых контейнерах с добавленным консервантом. Кроме того, недавно был разработан ряд новых способов доставки лекарственных средств, и фармацевтические композиции по настоящему изобретению являются подходящими для введения с использованием этих новых способов, например Inject-ease, Genject, шприцев-ручек, таких как Genen, и безыгольных устройств, таких как MediJector и BioJector. Композиция по настоящему изобретению может также быть адаптирована для способов введения, которые будут открыты в будущем. См. также Langer, 1990, Science, 249: 1527-1533.
Фармацевтическая композиция может также быть изготовлена в форме депо-препарата. Такие длительно действующие композиции могут быть введены имплантацией (например, подкожно, в связку или сухожилие, субсиновиально или внутримышечно), субсиновиальной инъекцией или внутримышечной инъекцией. Таким образом, например, композиции могут быть модифицированы подходящими полимерными или гидрофобными веществами (например, в форме эмульсии в приемлемом масле) или ионообменными смолами, или могут быть представлены в форме малорастворимых производных, например в форме малорастворимой соли.
Фармацевтические композиции могут также быть представлены во множестве обычных депо-форм, используемых для введения и обеспечения активных композиций. Эти формы включают, например, твердые, полутвердые и жидкие лекарственные формы, такие как жидкие растворы или суспензии, суспензии, гели, кремы, бальзамы, эмульсии, лосьоны, порошки, спреи, кремы, пасты, мази, целебные мази, бальзамы и капли.
Если желательно, фармацевтические композиции могут быть представлены во флаконе, упаковке или дозирующем устройстве, которые могут содержать одну или несколько стандартных лекарственных форм, содержащих активный ингредиент. В одном воплощении дозирующее устройство может включать шприц с одной дозой жидкой композиции, готовой к инъекции. К шприцу могут быть приложены инструкции по применению.
Фармацевтические композиции могут также содержать дополнительные фармацевтически приемлемые компоненты. В белковую композицию, описанную здесь, могут быть включены другие фармацевтически приемлемые носители, эксципиенты или стабилизаторы, такие как носители, эксципиенты или стабилизаторы, описанные в Remington's Pharmaceutical Sciences 16 th edition, Osol, A. Ed. (1980), при условии, что они не оказывают отрицательного влияния на желаемые свойства композиции. При использовании здесь «фармацевтически приемлемый носитель» обозначает любые растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты и агенты, замедляющие всасывание, совместимые с фармацевтическим введением. Применение таких сред и агентов для фармацевтически активных агентов хорошо известно в данной области техники. Приемлемые носители, эксципиенты или стабилизаторы нетоксичны для реципиентов в используемых дозах и концентрациях и включают: дополнительные буферные агенты; консерванты; сорастворители; антиоксиданты, включая аскорбиновую кислоту и метионин; хелатирующие агенты, такие как EDTA; металлосодержащие комплексы (например, комплексы Zn-белок); биоразлагаемые полимеры, такие как полиэфиры; солеобразующие противоионы, такие как натрий; многоатомные сахарные спирты; аминокислоты, такие как аланин, глицин, аспарагин, 2-фенилаланин и треонин; сахара или сахарные спирты, такие как лактит, стахиоза, манноза, сорбоза, ксилоза, рибоза, рибит, миоинозитоза, миоинозит, галактоза, галактит, глицерин, циклиты (например, инозит), полиэтиленгликоль; серосодержащие восстанавливающие агенты, такие как глутатион, липоевая кислота, тиогликолят натрия, тиоглицерин, альфа-монотиоглицерин и тиосульфат натрия; низкомолекулярные белки, такие как человеческий сывороточный альбумин, бычий сывороточный альбумин, желатин или другие иммуноглобулины; и гидрофильные полимеры, такие как поливинилпирролидон.
Композиции, описанные здесь, полезны в качестве фармацевтических композиций при лечении и/или предотвращении заболевания или расстройства у пациента, нуждающегося в этом. Термин «лечение» относится как к терапевтическому лечению, так и к профилактическим или превентивным мероприятиям. Данный термин включает применение или введение композиции в организм, в выделенную ткань или клетку пациента, имеющего заболевание/расстройство, симптом заболевания/расстройства или предрасположенного к заболеванию/расстройству, с целью лечения, исцеления, уменьшения интенсивности, облегчения, изменения, излечения, уменьшения степени тяжести, улучшения состояния или воздействия на заболевание, симптом заболевания или предрасположенность к заболеванию.
«Нуждающиеся в лечении» включают уже имеющих расстройство, а также тех, у кого необходимо предотвратить расстройство. Термин «расстройство» представляет собой любое состояние, при котором полезно лечение белковой композицией, описанной здесь. Он включает хронические или острые расстройства или заболевания, включая патологические состояния, приводящие к предрасположенности млекопитающего к рассматриваемому расстройству. В настоящем изобретении неограничивающие примеры расстройств, подлежащих лечению, включают дегенеративные заболевания, костные и/или хрящевые дефекты и/или дефекты суставного хряща, иммунологическое заболевание, предпочтительно хроническое воспаление сустава, костной или хрящевой ткани, такое как артрит (включая, без ограничения, остеоартрит, ревматоидный артрит), и заболевание позвоночника, такое как дегенеративное заболевание межпозвоночных дисков. В предпочтительном воплощении заболевание позвоночника представляет собой идиопатическую боль в пояснице, грыжу межпозвоночного диска, внутренний разрыв межпозвоночного диска или трещину межпозвоночного диска, радикулопатию, стеноз позвоночного канала, ишиас, обусловленный грыжей межпозвоночного диска, ишиас, идиопатический сколиоз или миелопатию.
Термин «дегенеративные заболевания» обозначает заболевания или дефекты с нарушением структуры хряща, например дегенерацией или деструкцией хряща, с или без вовлечения костных структур. Предпочтительно, дегенеративные заболевания представляют собой дегенеративные заболевания хрящей. Они включают расстройство височно-нижнечелюстного сустава (TMDs), расстройства губы вертлужной впадины, артрит, остеоартрит, ревматоидный артрит, псориатический артрит, ювенильный хронический артрит, псевдоартрит тазобедренного или плечевого сустава, ревматоидный полиартрит, дегенеративное заболевание межпозвоночных дисков, хрящевые или костно-хрящевые дефекты, фокальный хрящевой дефект, фокальный костно-хрящевой дефект, поверхностные хрящевые дефекты, рассекающий остеохондрит, хрящевые дефекты, проникающие на всю глубину хряща, хрящевые дефекты, проникающие не на всю глубину хряща, хондромаляцию, травмы внутрисуставных и внесуставных связок и сухожилий коленного сустава, травму латерального или медиального мениска, разрывы менисков, повреждение передней крестообразной связки, синовиальный остеохондроматоз, спондилит, анкилозирующий спондилит, синовит, ворсинчато-узловой синовит.
Термин «хрящевой дефект» относится к любой патологии хряща, включая заболевания хряща, повреждение хряща, обусловленное, например, травмой или дегенеративными процессами.
Термин «суставной хрящ» обозначает хрящ, покрывающий поверхность части костей в суставах и функционирующий как прокладка между двумя костями, обеспечивая подвижность суставов. Нормальный здоровый суставной хрящ описывают как гиалиновый хрящ. Суставной хрящ состоит из специализированных клеток (хондроцитов), заключенных в матрикс из внеклеточного вещества, богатого протеогликанами, преимущественно агреканом, фибриллами коллагена II типа, другими белками и водой. Образование и поддержание матрикса осуществляют заключенные в него хондроциты. В хрящевой ткани нет нервов и сосудов, и ее питание обеспечивает подлежащая ткань.
Помимо белка CD-RAP фармацевтическая композиция по изобретению может содержать дополнительные терапевтически или биологически активные агенты. Например, возможно присутствие терапевтических факторов, полезных в лечении определенного состояния, например остеоартрита, таких как один или несколько ингибиторов, вовлеченных в деструкцию составного хряща или компонентов синовиальной оболочки, включая, без ограничения, антиметаллопротеиназы, циклиновые соединения, антагонисты цитокинов, кортикостероиды, ингибиторы фактора некроза опухоли (TNF), ингибиторы интерлейкинов (IL), антиангиогенные вещества, ингибиторы агриканазы, ингибиторы киназы р38, ингибиторы апоптоза, ингибиторы гиалуронидазы и ингибиторы протеолитических ферментов. Факторы, контролирующие воспаление, включая инфликсимаб, этанерцепт, адалимумаб, нерелимонмаб, ленерцепт и тому подобное или их комбинации, могут также быть частью композиции. Кроме того, предполагают, что липосомальная фармацевтическая композиция может включать компоненты внеклеточного матрикса, такие как гиалуроновая кислота или ее производные, включая соли, эфиры, внутренние эфиры и сульфатированные производные, предпочтительно неполный эфир гиалуроновой кислоты.
В другом воплощении настоящее изобретение направлено на набор (или продукт) или контейнер, содержащий композицию по изобретению. Предпочтительно, композиция может уже быть представлена в жидком состоянии. Тем не менее, альтернативно, она может предпочтительно быть представлена в лиофилизированном состоянии. Она может также быть представлена в замороженном, лиофилизированном, сублимированном состоянии или состоянии после распылительной сушки. Соответственно, если композиция представлена в состоянии, отличном от жидкого, специалист в данной области техники может приготовить из нее (жидкую) водную фармацевтическую композицию. Например, композиция может быть лиофилизирована, и затем будет необходимо ее восстановить. Соответственно, набор может дополнительно включать средство восстановления замороженной, лиофилизированной, сублимированной или высушенной распылением композиции, и/или средство разведения композиции, и/или средство введения композиции или фармацевтической композиции соответственно. Набор может также включать инструкции по применению.
Таким образом, предложен продукт, включающий композицию, описанную здесь, и, предпочтительно, инструкции по ее применению. Продукт включает контейнер, подходящий для размещения композиции. Подходящие контейнеры включают, без ограничения, бутыли, флаконы (например, двухкамерные флаконы), шприцы (например, однокамерные или двухкамерные шприцы), пробирки, небулайзеры, ингаляторы (например, дозирующие ингаляторы или ингаляторы сухого порошка) или депо. Контейнер может быть изготовлен из множества материалов, таких как стекло, металл или пластик (например, поликарбонат, полистирол, полипропилен, полиолефин). Контейнер содержит композицию, и этикетка на контейнере, или связанная с ним, может содержать указания по восстановлению и/или применению. В этикетке может также быть указано, что композиция полезна при подкожном введении или предназначена для подкожного введения. Контейнер, содержащий композицию, может представлять собой флакон для многоразового использования, что позволяет вводить композицию повторно (например, от 1 до 6 раз и более). Продукт может дополнительно включать второй контейнер, содержащий подходящий разбавитель (например, WFI, 0,9% NaCl, BWFI, забуференный фосфатом физиологический раствор). Когда продукт содержит лиофилизированный вариант белковой композиции, смешивание разбавителя с лиофилизированной композицией будет обычно обеспечивать конечную концентрацию в восстановленной композиции по меньшей мере 20 мг/мл. Продукт может дополнительно включать другие вещества, желательные с коммерческой точки зрения или с точки зрения пользователя, включая другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши с инструкциями по применению.
В другом воплощении изобретения предложен продукт, содержащий водную композицию по настоящему изобретению и инструкции по ее применению. Продукт включает контейнер. Подходящие контейнеры включают, например, бутыли, флаконы (например, двухкамерные флаконы), шприцы (такие как двухкамерные шприцы), шприцы-ручки и пробирки. Контейнер может быть изготовлен из множества материалов, таких как стекло, пластик или поликарбонат. Контейнер содержит водную композицию, и этикетка на контейнере или связанная с ним, может содержать указания по применению. Например, в этикетке может быть указано, что композиция полезна при подкожном введении или предназначена для подкожного введения. Контейнер, содержащий композицию, может представлять собой флакон для многоразового использования, что позволяет вводить водную композицию повторно (например, от 2 до 6 раз и более). Продукт может дополнительно включать второй контейнер. Продукт может дополнительно включать другие вещества, желательные с коммерческой точки зрения или с точки зрения пользователя, включая другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши с инструкциями по применению.
Кроме того, изобретение включает устройства, которые могут быть использованы для доставки композиции по изобретению. Примеры таких устройств включают, без ограничения, шприц, шприц-ручку, имплантат, безыгольное устройство для инъекций, ингалятор и пластырь.
Далее изобретение проиллюстрировано графическими материалами и Примерами, приведенными исключительно в пояснительных целях, и которые не следует трактовать как ограничение объема настоящего изобретения.
Краткое описание графических материалов
Фиг.1: Факторы, влияющие на стабильность белка.
Фиг.2: Типичные способы, которые могут быть использованы для стабилизации белка.
Фиг.3: Последовательное концентрирование rhCD-RAP в фосфате калия; К-PO4 означает фосфат калия.
Фиг.4: Последовательное концентрирование rhCD-RAP в трис-хлориде.
Фиг.5: Последовательное концентрирование rhCD-RAP в хлориде гистидина.
Фиг.6: Стабильность rhCD-RAP в высокой концентрации в различных буферных системах.
Фиг.7: Стабильность rhCD-RAP в высокой концентрации в различных буферных системах.
Фиг.8: Суммарный заряд глицина и rhCD-RAP при различных значениях РН.
Фиг.9: Влияние рН на растворимость rhCD-RAP в 150 мМ глицине.
Фиг.10: Влияние молярности фосфата гистидина на растворимость rhCD-RAP.
Фиг.11: Влияние фосфата гистидина (в концентрации, скорректированной до изотоничной осмоляльности хлоридом калия) на растворимость rhCD-RAP.
Следует отметить, что на Фиг.3-11 нумерация, добавленная к подписям гистограммы, относится к столбцам каждого «блока», показанного на диаграмме (слева направо). Например, «0» относится к крайнему левому столбцу, «1» относится к столбцу, расположенному рядом со столбцом, обозначенным «0», и так далее.
Изобретение проиллюстрировано следующими Примерами.
По усмотрению авторов изобретения, цель которых заключалась в обеспечении стабильных композиций с высокими концентрациями CD-RAP, так чтобы уменьшить объем инъекций, проводимых пациентам, и уменьшить посредством этого побочные эффекты, такие как боль, связанная с большим объемом инъекции, было проведено исследование влияния различных композиций на стабилизацию белка CD-RAP. Некоторые из этих композиций проиллюстрированы в следующих ниже Примерах. Тем не менее, как указано здесь, начиная с цели авторов изобретения, для определения подходящих ингредиентов композиции, позволяющих достичь этой цели, необходима эмпирическая работа, поскольку каждый белок обладает индивидуальными свойствами, и, по этой причине, определить подходящие ингредиенты на основании одного примера невозможно.
Пример 1. Анализ различных буферных систем для rhCD-RAP
Проводили диализ rhCD-RAP против 36 буферных систем (50 хлорид калия, 50 мМ хлорид гистидина или 50 мМ трис-хлорид, рН каждого 6,0, каждый буфер с или без добавления одного из следующих стабилизаторов, выбранных из сахарозы, маннита, глицина, лизина и глутаминовой кислоты с или без 0,1% Tween® 20). В процессе последующего концентрирования диализом до 30 мг/мл rhCD-RAP и фильтрации проводили UV/Vis-анализ образцов.
Стабильные композиции подвергали стрессовому воздействию циклами замораживания-оттаивания. После каждого цикла образцы центрифугировали и количество rhCD-RAP определяли UV/Vis-анализом.
Диализ
Проводили диализ 2,0 мл исходного вещества rhCD-RAP (в 350 мМ аргинине/фосфате, рН 7,4) против 500 мл желаемого буфера при 4°С в течение 24 часов с умеренным перемешиванием и с использованием пробирки с отсевом по молекулярной массе 6-8 кДа. Через 16 часов диализный буфер заменяли 500 мл свежего буфера. Полученные растворы белка хранили для последующего анализа при 2-8°С.
UV/Vis-анализ
Количество белка в образцах определяли UV/Vis-анализом после центрифугирования прошедшего диализ rhCD-RAP в течение 5 минут при 13000 д. В качестве отрицательного контроля использовали соответствующие буферы для образцов. Для вычисления концентрации белка [мг/мл] использовали оптическую плотность при 280 нм и специфическую абсорбционную способность rhCD-RAP при 280 нм [1,649 мл/(мг*см)].
Повышение концентрации rhCD-RAP
2 мл прошедшего диализ rhCD-RAP переносили в концентрирующую центрифугу.
После дальнейших стадий центрифугирования (4000 g, 4°С) происходило уменьшение объема раствора rhCD-RAP. Определяли объем оставшегося раствора rhCD-RAP и концентрацию rhCD-RAP измеряли UV/Vis-анализом.
Термостабильность (циклы замораживания-оттаивания)
Термостабильность rhCD-RAP оценивали с использованием циклов замораживания-оттаивания при температуре от 5°С до -25°С с использованием морозильника. Скорость охлаждения и нагревания составляла 1,0°С/мин с изотермической стадией продолжительностью 15 минут между циклами. До анализа растворы белков хранили при 4°С-8°С.
300 мкл rhCD-RAP в концентрации 30 мг/мл переносили в полипропиленовые пробирки объемом 1,5 мл и подвергали стрессовому воздействию с использованием указанных стадий замораживания-оттаивания, как описано выше.
Пример 2: Стабильность rhCD-RAP в различных буферных системах
Определяли стабилизирующие эффекты всех буферных систем, описанных в Примере 1.
Буферные системы с фосфатом калия
Следующие вещества растворяли в WFI до конечной массы 1 кг с получением концентрации буфера 50 мМ. рН корректировали до рН 6,0 добавлением КОН и HCl соответственно:
а) 6,8 г фосфата калия, 12,4 г KCl с и без 1,0 г Tween® 80;
б) 6,8 г фосфата калия, 50 г сахарозы, 4,9 г KCl с и без 1,0 г Tween® 80;
в) 6,8 г фосфата калия, 50 г маннита с и без 1,0 г Tween® 80;
г) 6,8 г фосфата калия, 25 г глицина с и без 1,0 г Tween® 80;
д) 6,8 г фосфата калия, 25 г глутаминовой кислоты с и без 1,0 г Tween® 80;
е) 6,8 г фосфата калия, 25 г лизина с и без 1,0 г Tween® 80;
ж) 61,0 г аргинина, рН 7,4, доведенный с помощью фосфорной кислоты (контроль).
При необходимости изотоничность корректировали с использованием хлорида калия до 300-400 мОсм/кг. Осмоляльность каждого буфера показана в
Таблице 1.
Затем проводили диализ rhCD-RAP против буферных систем на основе фосфата калия, как показано в Таблице 1, и концентрировали его фильтрацией. После определенного последовательного уменьшения количества буфера определяли объем оставшегося раствора белка и концентрацию rhCD-RAP измеряли UV/Vis-анализом. На Фиг.3 показана полученная концентрация CD-RAP до и после диализа 5 мг/мл раствора CD-RAP, а также после концентрирования до 10, 20 и 30 мг/мл. В качестве контроля использовали аргининовый/фосфатный буфер.
Как показано на Фиг.3, композиция в аргининовой/фосфатной буферной системе продемонстрировала оптимальную растворимость на всех стадиях концентрирования. Даже на последней стадии концентрирования измеренное содержание белка достигало теоретического содержания rhCD-RAP. Таким образом, поскольку при использовании аргинина/фосфата не было потери белка rhCD-RAP, этот буфер является одним из наиболее предпочтительных солюбилизирующих растворов.
В отличие от аргинина/фосфата, при использовании фосфата калия в качестве буфера для композиции для достижения достаточной растворимости было необходимо использовать некоторые дополнительные добавки. Поскольку 50 мМ фосфат калия (содержащий хлорид натрия в качестве ионной добавки для достижения изотонического состояния) продемонстрировал хорошую растворимость только до концентрации 10 мг/мл rhCD-RAP, для достижения растворимости при степени концентрирования до 30 мг/мл rhCD-RAP и выше было необходимо использовать дополнительные добавки. Из широкого спектра стабилизаторов только сахароза приводит к хорошей растворимости rhCD-RAP, даже при концентрации 30 мг/мл. Другие продемонстрировали эффекты агрегации с частично видимой преципитацией белка на различных стадиях концентрирования.
Трис-буферные системы
Трис-хлорид в сочетании с такими стабилизаторами, как сахароза, маннит, глицин, глутаминовая кислота и лизин, с и без Tween80® в качестве солюбилизатора растворяли в WFI до конечной массы 1 кг, с получением концентрации буфера 50 мМ. Значение рН доводили до рН 6,0 с использованием дополнительной HCI соответственно:
а) 6,05 г трис-основания, 9,7 г NaCl с и без 1,0 г Tween® 80;
б) 6,05 г трис-основания, 50 г сахарозы, 3,9 г NaCl с и без 1,0 г Tween® 80;
в) 6,05 г трис-основания, 50 г маннита с и без 1,0 г Tween® 80;
г) 6,05 г трис-основания, 25 г глицина с и без 1,0 г Tween® 80;
д) 6,05 г трис-основания, 25 г глутаминовой кислоты с и без 1,0 г Tween® 80;
е) 6,05 г трис-основания, 25 г лизина с и без 1,0 г Tween® 80.
При необходимости изотоничность корректировали хлоридом калия до 300-400 мОсм/кг. Осмоляльность каждого буфера показана в Таблице 2.
Проводили диализ rhCD-RAP и концентрировали его до 30 мг/мл, как описано для буфера с фосфатом калия выше. Буфер с 350 мМ фосфата аргинина использовали в качестве контроля с оптимальной растворимостью.
По сравнению с буферными композициями на основе фосфата калия все буферы с трис-хлоридом, за исключением 50 мМ трис-хлорида с 2,5% глутаминовой кислотой, продемонстрировали слабую растворимость CD-RAP при его концентрации более 5 мг/мл.
Буферные системы с гистидином
Хлорид гистидина (50 мМ, рН 6,0) в сочетании с такими стабилизаторами, как сахароза, маннит, глицин, глутаминовая кислота и лизин, с и без Tween80® в качестве солюбилизатора, анализировали следующим образом с использованием того же способа, что описан выше для двух других буферных систем:
а) 7,76 г хлорида L-гистидина, 12,4 г KCl с и без 1,0 г Tween® 80;
б) 7,76 г хлорида L-гистидина, 50 г сахарозы, 4,9 г KCl с и без 1,0 г Tween® 80;
в) 7,76 г хлорида L-гистидина, 50 г маннита с и без 1,0 г Tween® 80;
г) 7,76 г хлорида L-гистидина, 25 г глицина с и без 1,0 г Tween® 80;
д) 7,76 г хлорида L-гистидина, 25 г глутаминовой кислоты с и без 1,0 г Tween® 80;
е) 7,76 г хлорида L-гистидина, 25 г лизина с и без 1,0 г Tween® 80.
При необходимости корректировали Осмоляльность. Конечная Осмоляльность показана в Таблице 3.
Проводили диализ rhCD-RAP в этих буферных системах и концентрировали его до 30 мг/мл (аналогично 4.1.1)
По сравнению с буферными композициями на основе фосфата калия и Трис, буферы на основе хлорида гистидина обеспечивали наилучшие результаты растворимости rhCD-RAP, за исключением настоящего буфера с фосфатом аргинина.
За исключением того, что 50 мМ гистидин с или без TweenSO® приводил к агрегации rhCD-RAP при концентрации 5 мг/мл, все остальные буферы продемонстрировали очень хорошую растворимость вплоть до 30 мг/мл в изотоничном буфере при рН 6,0 и при приблизительно нейтральном рН. Снова, использование Tween80® не влияло на растворимость rhCD-RAP в проанализированных буферных системах.
Заключение
Наилучшие результаты обеспечения высокой концентрации белка CD-RAP до 30 мг/мл без агрегации были получены с использованием следующих буферов: (а) 50 мМ фосфат калия с 5% сахарозой; (б) 50 мМ трис-хлорид, 2,5% глутаминовая кислота; (в) 50 мМ гистидин, 2,5% глицин; (г) 50 мМ гистидин, 2,5% глутаминовая кислота; (д) 50 мМ гистидин, 2,5% лизин; (е) гистидин с 5% маннитом; и (ж) 350 мМ фосфат аргинина.
Снижение желаемой концентрации до 5 мг/мл приводило к стабильности белка почти во всех исследованных композициях, однако повышение концентрации до 30 мг/мл позволило преодолеть этот барьер.
Пример 3: Оценка термостабильности rhCD-RAP в разных буферных системах с использованием циклов замораживания-оттаивания
В Примере 1 была проведена оценка способности 7 буферных композиций обеспечивать концентрирование rhCD-RAP вплоть до 30 мг/мл при рН 6,0. Проводили исследование способности этих композиций поддерживать стабильность rhCD-RAP при стрессовых воздействиях, то есть при циклах замораживания-оттаивания.
Проводили диализ rhCD-RAP в следующих буферных системах: (а) 50 мМ фосфате калия с 5% сахарозой; (б) 50 мМ трис-хлориде, 2,5% глутаминовой кислоте; (в) 50 мМ гистидине, 2,5% глицине; (г) 50 мМ гистидине, 2,5% глутаминовой кислоте; (д) 50 мМ гистидине, 2,5% лизине; (е) гистидине с 5% маннитом; и (ж) 350 мМ фосфате аргинина, с последующим концентрированием rhCD-RAP путем центрифугирования и фильтрации до концентрации примерно 30 мг/мл. 300 мкл переносили в полипропиленовые пробирки объемом 1,5 мл. Композиции подвергали стрессовому воздействию с использованием 5 циклов замораживания-оттаивания, после чего агрегированный rhCD-RAP удаляли центрифугированием и определяли количество оставшегося растворимого rhCD-RAP посредством UV/Vis-анализа.
Во всех исследованных буферных системах удавалось успешно концентрировать rhCD-RAP до примерно 30 мг/мл.
На Фиг.6 показано отсутствие отрицательного влияния циклов замораживания-оттаивания на концентрацию белка во всех композициях, кроме rhCD-RAP в 50 мМ фосфате калия/5% сахарозе. Только в 50 мМ фосфате калия/5% сахарозе можно было наблюдать значимое снижение концентрации rhCD-RAP после третьего цикла замораживания-оттаивания, и иногда можно было наблюдать мутную молочно-белую дисперсию. Во всех других композициях раствор был прозрачным после каждого цикла замораживания-оттаивания, что в сочетании с результатами определения количества rhCD-RAP посредством UV/Vis-анализа позволило решить проблему растворимости и стабильности rhCD-RAP в высоких концентрациях.
Неожиданным образом, только буферные системы, содержащие по меньшей мере одну аминокислоту, обеспечивали термостабильность rhCD-RAP после циклов замораживания-оттаивания.
Пример 4: Стабилизирующий эффект различных аминокислот в отношении rhCD-RAP (30 мг/мл)
Поскольку в Примерах 2 и 3 была показана очень хорошая растворимость rhCD-RAP в концентрации 30 мг/мл в буферных растворах, содержащих аминокислоты, этот особый эффект аминокислот исследовали в следующем Примере.
Исследовали стабилизирующий эффект, оказываемый на rhCD-RAP основными аминокислотами, такими как гистидин и аргинин, а также нейтральными аминокислотами, такими как глицин, и кислыми аминокислотами, такими как глутаминовая кислота.
Все исходные растворы изотоничны при рН 6,0 без добавления каких-либо солей или других эксципиентов; рН корректировали соляной и фосфорной кислотами. Кроме того, исследовали 350 мМ фосфат аргинина при рН 6,0 и рН 7,4.
Проводили диализ rhCD-RAP в буферных системах (приведенных в Таблице 4) и затем концентрировали его путем центрифугирования и фильтрации до концентрации приблизительно 30 мг/мл. 300 мкл переносили в полипропиленовые пробирки объемом 1,5 мл.
Композиции, приведенные в Таблице 4, подвергали стрессовому воздействию с использованием 5 циклов замораживания-оттаивания согласно описанным выше Примерам. После этого агрегированный rhCD-RAP удаляли центрифугированием и определяли количество оставшегося растворимого rhCD-RAP посредством UV/Vis-анализа.
На Фиг.7 показан превосходный стабилизирующий эффект всех буферных систем, а также растворимость rhCD-RAP при циклах замораживания-оттаивания, за исключением одного: во время стадии диализа rhCD-RAP в 150 мМ глицине была количественно отмечена агрегация. Таким образом, поскольку глицин при рН 6,0 был единственной незаряженной аминокислотой, включенной в анализ, это наблюдение показывает, что заряд аминокислоты является важным техническим свойством при использовании аминокислот для приготовления буферов для высококонцентрированных растворов rhCD-RAP. Тем не менее, результаты использования фосфатного и хлоридного буфера были сходными.
Пример 5: Эффект различных рН в отношении стабильности rhCD-RAP в глицине
В Примере 4 была показана слабая растворимость rhCD-RAP в изотоничных растворах глицина при рН 6,0 из-за его нейтральных свойств. Затем авторы изобретения определили последствия для растворимости CD-RAP, если глицин все еще не заряжен, но rhCD-RAP имеет больший суммарный заряд, благодаря изменению рН и большему суммарному заряду CD-RAP соответственно.
На Фиг.8 показан суммарный заряд глицина и rhCD-RAP при различных значениях рН, обусловленный их значениями рК. В этом эксперименте проводили диализ rhCD-RAP против 150 мМ глицина при рН 4,0, рН 6,0 и рН 8,0. Значения рН корректировали фосфорной кислотой и гидроксидом натрия соответственно. rhCD-RAP, прошедший диализ в буфер с рН 6 и рН 8, продемонстрировал сильную тенденцию к агрегации. Эти растворы были непрозрачны и имели молочно-белый цвет, в отличие от глицина (рН 4), где раствор все еще был прозрачным без мелочно-белого оттенка.
rhCD-RAP концентрировали до 30 мг/мл (рН 4,0) и затем подвергали стрессовому воздействию с использованием 5 циклов замораживания-оттаивания соответственно. После этого агрегированный rhCD-RAP удаляли центрифугированием и определяли количество оставшегося растворимого rhCD-RAP посредством UV/Vis-анализа. Растворы rhCD-RAP с рН 6,0 и рН 8,0 подвергали стрессовому воздействию в более низких концентрациях из-за блокирования фильтра в процессе концентрирования.
На Фиг.9 показан эффект самостабилизации rhCD-RAP в кислых условиях, например при рН 4,0, благодаря увеличению общего заряда белка. Несмотря на то что глицин не имеет заряда при рН 4,0, удалось достичь достаточной растворимости rhCD-RAP.
В то время как при рН в диапазоне от 6 до 8 композиции, содержащие CD-RAP, должны содержать заряженные аминокислоты в качестве стабилизирующего эксципиента, при более низком рН, например рН 4,0, rhCD-RAP способен к самостабилизации без добавления заряженных аминокислот.
Пример 6: Эффект гистидина в отношении стабилизации rhCD-RAP
В предыдущих экспериментах было продемонстрировано, что заряженные аминокислоты являются эффективным средством стабилизации rhCD-RAP в высоких концентрациях вплоть до 30 мг/мл при приблизительно нейтральном рН, таком как рН 6,0. Для определения диапазона концентраций указанных буферов в данном Примере показано, что зависимость от концентрации буферного компонента для CD-RAP наиболее типична в случае гистидина. Поэтому проводили диализ rhCD-RAP в фосфат гистидина с диапазоном концентраций от 0 мМ до 300 мМ, как показано в Таблице 5 ниже. Кроме того, эти композиции корректировали до физиологической осмоляльности путем добавления достаточного количества хлорида калия.
rhCD-RAP концентрировали до 30 мг/мл (рН 6,0) и затем подвергали стрессовому воздействию с использованием 5 циклов замораживания-оттаивания. После этого агрегированный rhCD-RAP удаляли центрифугированием и определяли количество оставшегося растворимого rhCD-RAP посредством UV/Vis-анализа.
На Фиг.10 показано, что растворимость rhCD-RAP в фосфате гистидина при рН 6,0 сильно зависела от концентрации гистидина. В то время как 0 мМ гистидин при рН 6,0 не стабилизировал rhCD-RAP, более высокие концентрации приводили к существенному повышению стабильности, коррелируя с увеличением молярности гистидина. Эти эксперименты с повторным замораживанием-оттаиванием показали, что буферы, содержащие L-гистидин в концентрации 200 ммоль/мл и более, обеспечивали стабильные растворы rhCD-RAP с концентрацией 30 мг/мл.
Как видно на Фиг.11, добавление хлорида калия не влияло на растворимость rhCD-RAP в фосфате гистидина. Таким образом, доведение фармацевтической композиции CD-RAP хлоридом калия до изотоничной осмоляльности может быть использовано без негативного влияния на растворимость и стабильность rhCD-RAP в высоких концентрациях.
Пример 7: Ингибирование активности ALP, индуцированной GDF-5
Клетки МСНТ высевали на 96-луночные планшеты с плотностью 30000 клеток на лунку и выращивали в течение ночи в культуральной среде (альфа-МЕМ), содержащей глутамин и дополненной 10% фетальной телячьей сывороткой (FCS)). На следующий день начинали стимуляцию rhGDF-5 и rhCD-RAP, заменяя культуральную среду в каждой лунке на 160 мкл соответствующей стимулирующей среды. Анализ всех стандартов и образцов повторяли четыре раза. Для построения калибровочной кривой получали серийные разведения rhGDF-5 со следующими концентрациями rhGDF-5 (1200 нг/мл, 400 нг/мл, 133,2 нг/мл, 44,5 нг/мл, 14,8 нг/мл rhGDF-5 в полной культуральной среде). Для анализа опосредованного rhCD-RAP ингибирования активности ALP проводили одновременную стимуляцию клеток 400 нг/мл rhGDF-5 и 1-10 мкМ rhCD RAP. Клетки культивировали в стимулирующей среде в течение трех суток, после чего их лизировали добавлением 0,2 г MgCl2×6H2O в 2 мл Nonidet P40 и инкубировали в инкубаторе в течение 16 часов. 50 мкл лизата переносили в новый 96-луночный планшет, добавляли 50 мкл субстратного буфера (0,222 г PNPP в диэтаноламиновом буфере, Pierce) и проводили инкубацию в течение 45 минут при 37°С. После этого реакцию останавливали, добавляя 0,5 М NaOH. Оптическую плотность измеряли при 405 нм в планшет-ридере. Измеряли фоновую активность ALP в необработанных клетках и вычитали ее из всех стандартов и образцов. Для вычисления активности ALP во всех образцах использовали калибровочную кривую.
Пример 8: Стимуляция хондроцитов CD-RAP и анализ с использованием количественной полимеразной цепной реакции с обратной транскрипцией (qRT-PCR)
Хондроциты выделяли из человеческого суставного хряща, полученного от пациентов, прошедших полное протезирование коленного сустава. Хрящ отрезали от кости и измельчали. Частички хряща обрабатывали 1% проназой в DMEM/F12, содержащей 1% пенициллин/стрептомицин при 37°С в течение 1 часа. После центрифугирования при 200 g в течение 5 минут при комнатной температуре проводили однократную отмывку частичек хряща PBS. Их обрабатывали 0,07% коллагеназой А в культуральной среде (DMEM/F12, дополненной 10% FCS и 1% пенициллином/стрептомицином) при 37°С в течение ночи. На следующий день проводили последовательную фильтрацию суспензии клеток через 100, 70 и 40 мкм клеточные фильтры. Клетки осаждали центрифугированием, ресуспендировали в культуральной среде и высевали на 6-луночные планшеты в плотности 250000 клеток на лунку. Клетки культивировали при 37°С, 5% CO2 и относительной влажности 90% до смыкания монослоя (приблизительно 1 неделя). На каждые вторые сутки проводили замену среды.
Для стимуляции CD-RAP клетки держали в свободной от сыворотки среде в течение ночи. CD-RAP (0,5-5 мкМ) добавляли в свободную от сыворотки DMEM/F12 и клетки культивировали в течение 24 часов. Затем клетки лизировали и выделяли РНК с использованием набора RNeasy Mini Kit, следуя инструкциям изготовителя. Для получения кДНК использовали 1 мкг РНК и набор QuantiTect Reverse Transcription Kit (Qiagen). Полимеразную цепную реакцию с обратной транскрипцией (RT-PCR) проводили с использованием 4 мкл разведенной кДНК (разведение 1:5), 10 мкл смеси QuantiFast SYBR Green PCR Mix (Qiagen), 4 мкл свободной от нуклеаз воды и 2 мкл смеси праймеров, проводя 50 циклов в термоциклере LightCycler® в стандартных условиях. Использовали следующие праймеры: 18S рибосомальная РНК (рРНК) (Qiagen, QuantiTect Primer Assay QT00199367, MMP13 прямой GGGTTCCTGATGTGGGTGAATA (SEQ ID NO: 5), MMP13 обратный GCCATCGTGAAGTCTGGTA (SEQ ID NO: 6)). Результаты нормализовали относительно конститутивного гена 18S рРНК.
| название | год | авторы | номер документа |
|---|---|---|---|
| Стабильные водные композиции белка MIA/CD-RAP | 2011 |
|
RU2739078C2 |
| ВЫСУШЕННЫЕ ВОССТАНОВЛЕННЫЕ ВЕЗИКУЛЫ ДЛЯ ФАРМАЦЕВТИЧЕСКОГО ПРИМЕНЕНИЯ | 2007 |
|
RU2443412C2 |
| АЛЬТЕРНАТИВНЫЕ СОСТАВЫ ДЛЯ ХИМЕРНЫХ ПОЛИПЕПТИДОВ TNFR:FC | 2014 |
|
RU2663727C2 |
| СТАБИЛЬНАЯ ЖИДКАЯ КОМПОЗИЦИЯ ЭТАНЕРЦЕПТА | 2012 |
|
RU2575619C2 |
| Препараты однодоменных антигенсвязывающих молекул | 2013 |
|
RU2683861C2 |
| Жидкая композиция антитела против TNF альфа | 2018 |
|
RU2756619C2 |
| КОНЦЕНТРИРОВАННЫЕ БЕЛКОВЫЕ ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2626512C2 |
| СПОСОБ КОНТРОЛЯ РЕАКЦИИ МОДИФИКАЦИИ ПОЛИПЕПТИДА | 2009 |
|
RU2532850C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПЛАЗМИНОГЕН, И ЕЕ ПРИМЕНЕНИЕ | 2015 |
|
RU2711989C2 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, ВКЛЮЧАЮЩИЙ АНТИТЕЛО ПРОТИВ РЕЦЕПТОРА EGF | 2004 |
|
RU2381036C2 |
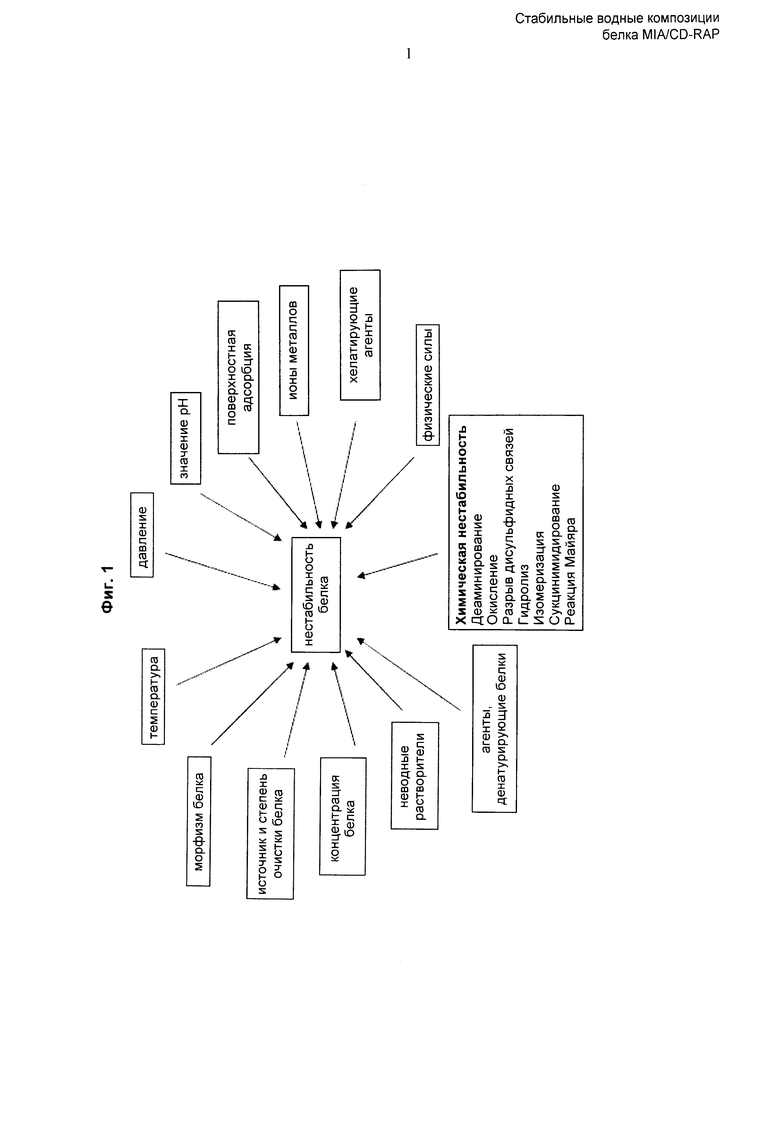
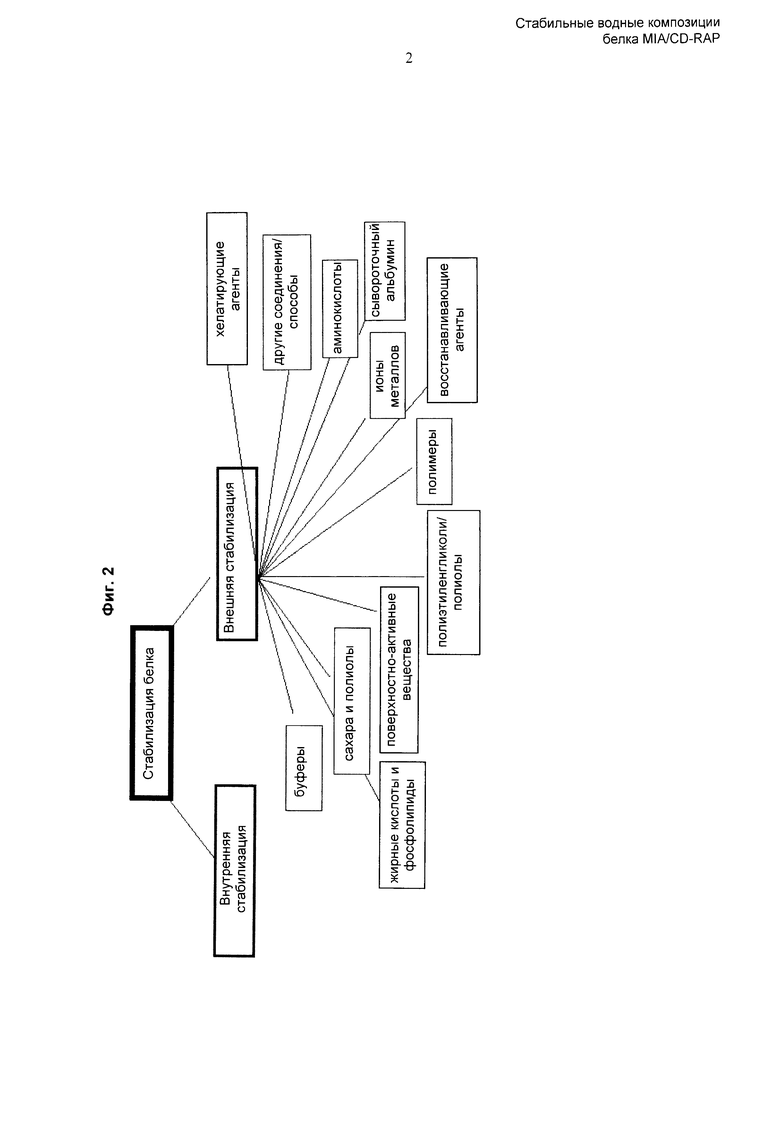
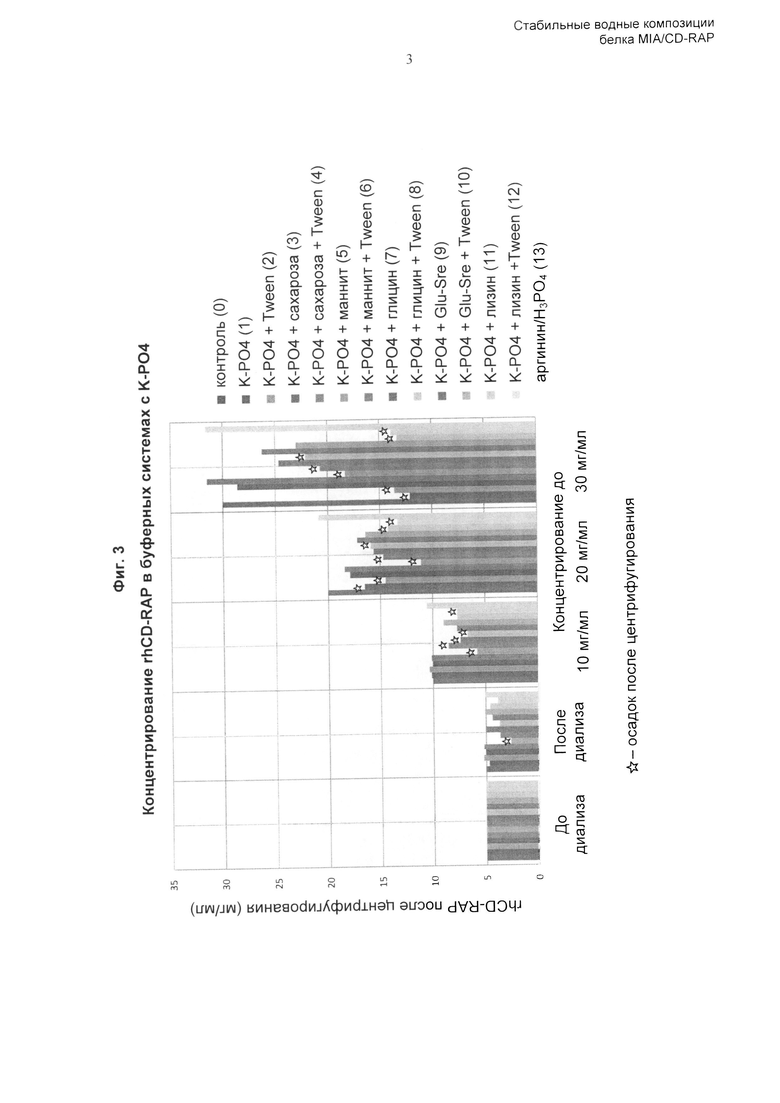
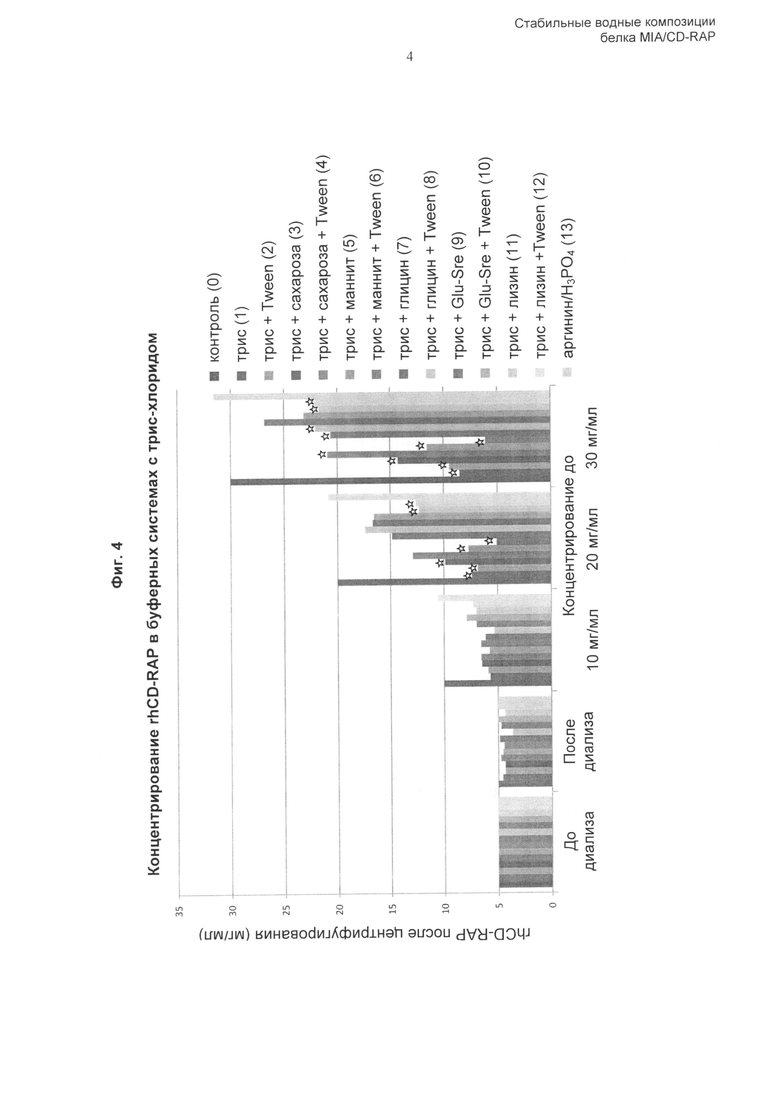
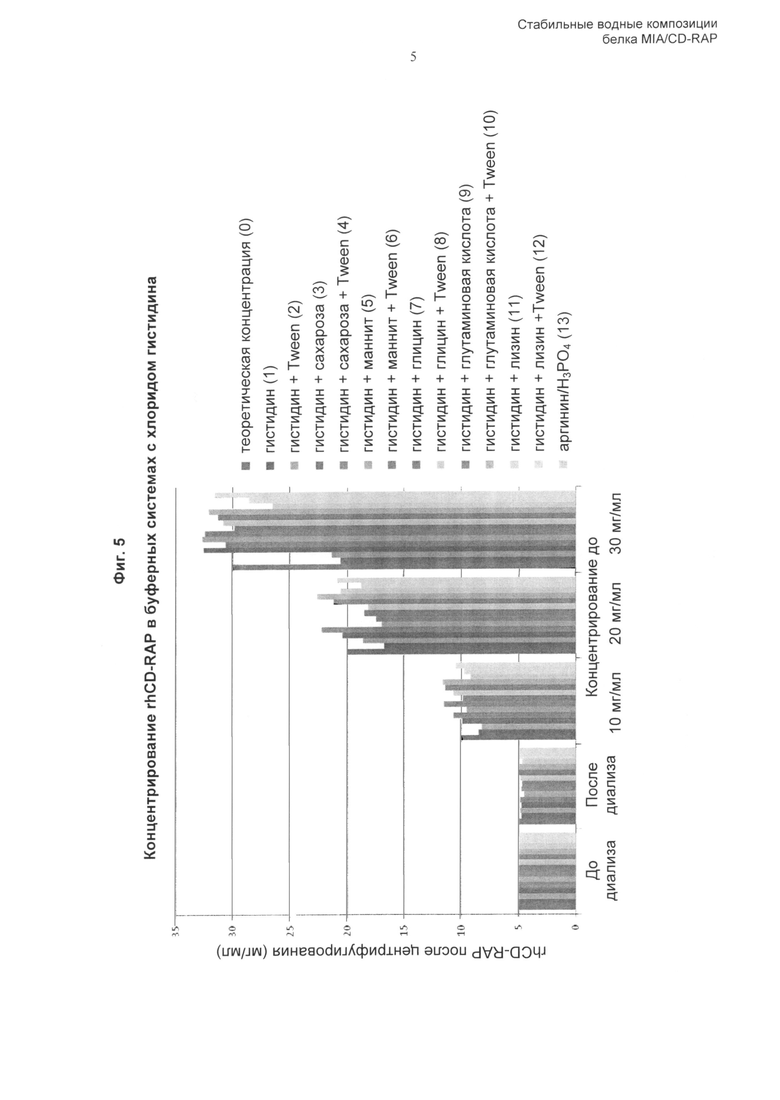
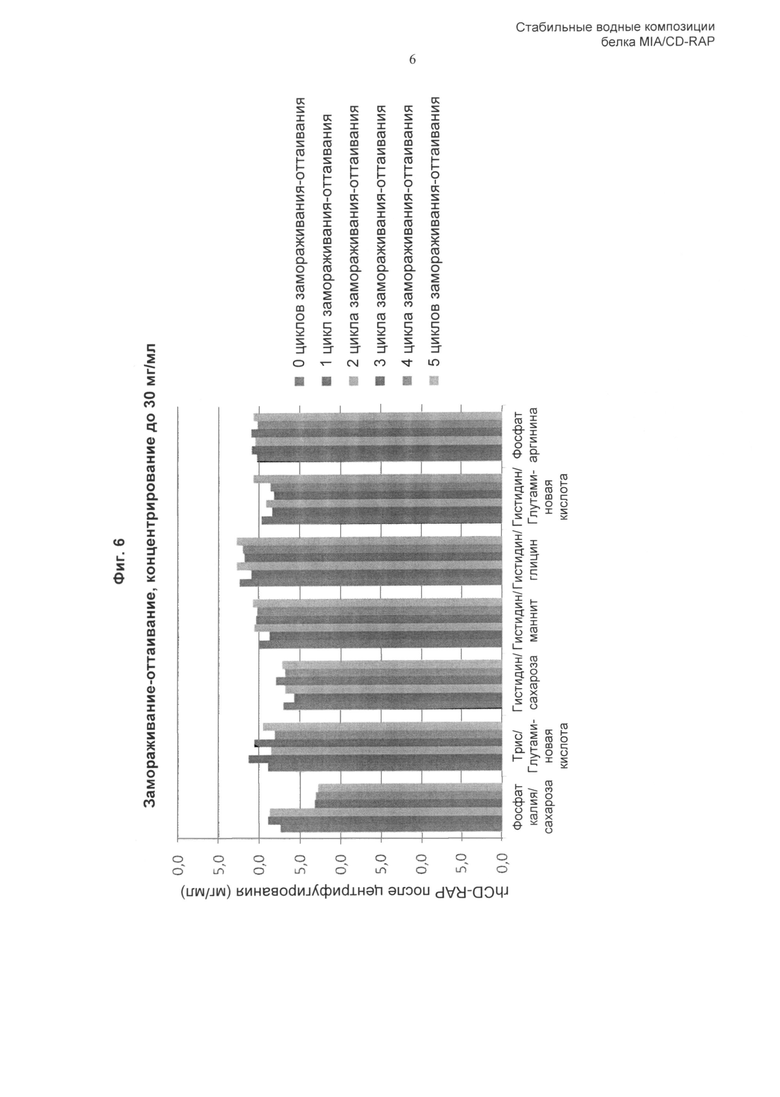
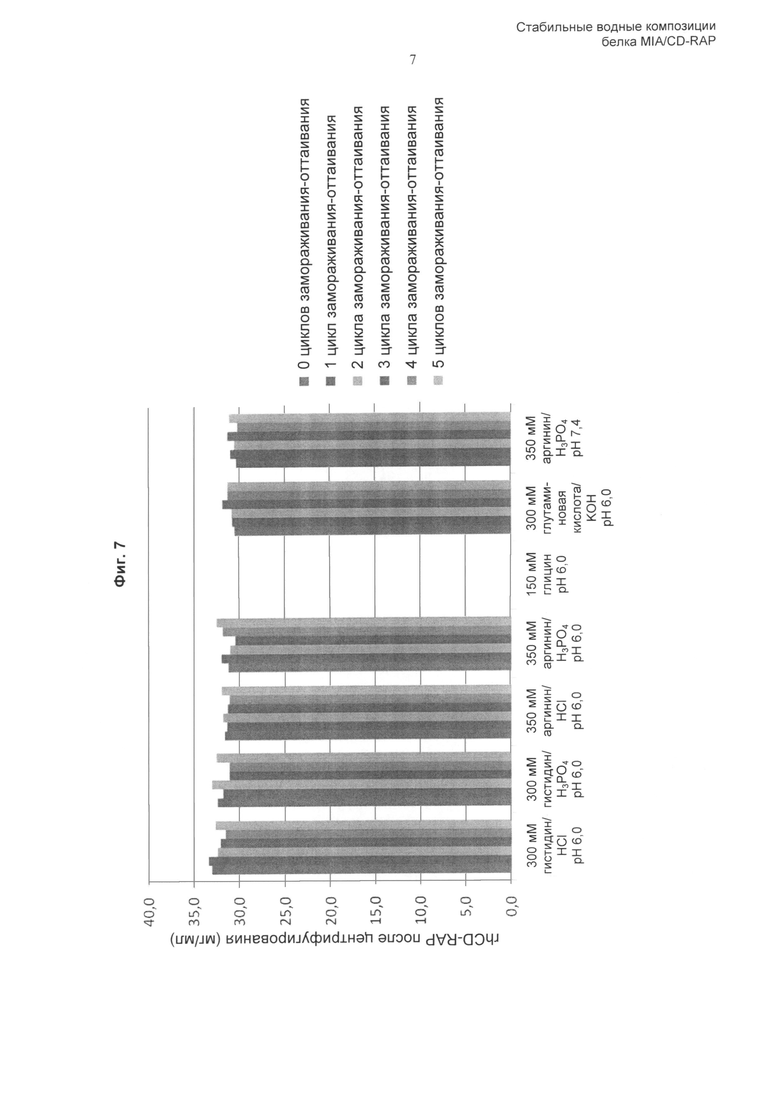
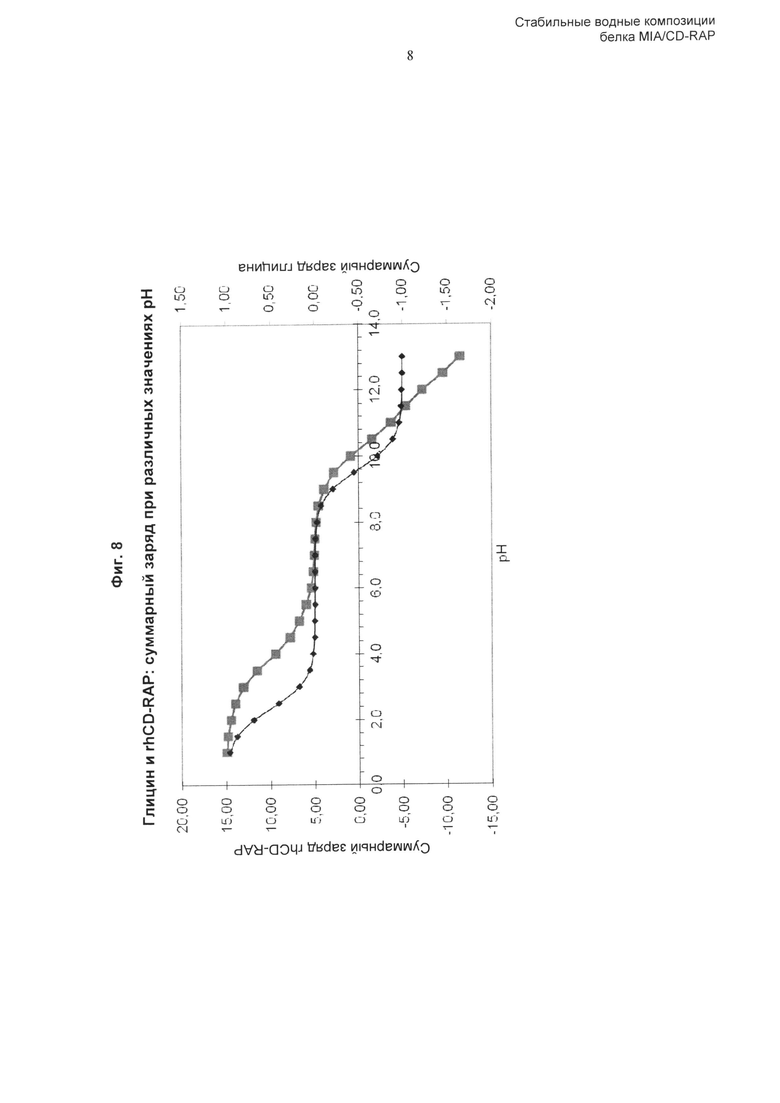
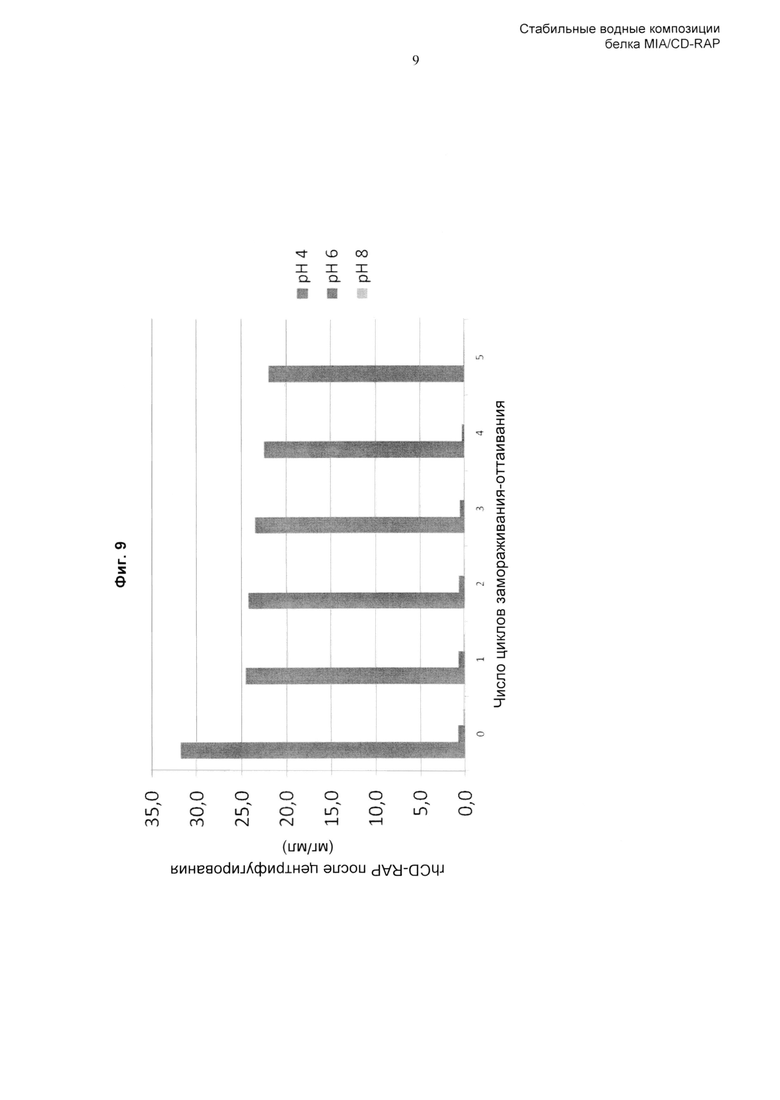
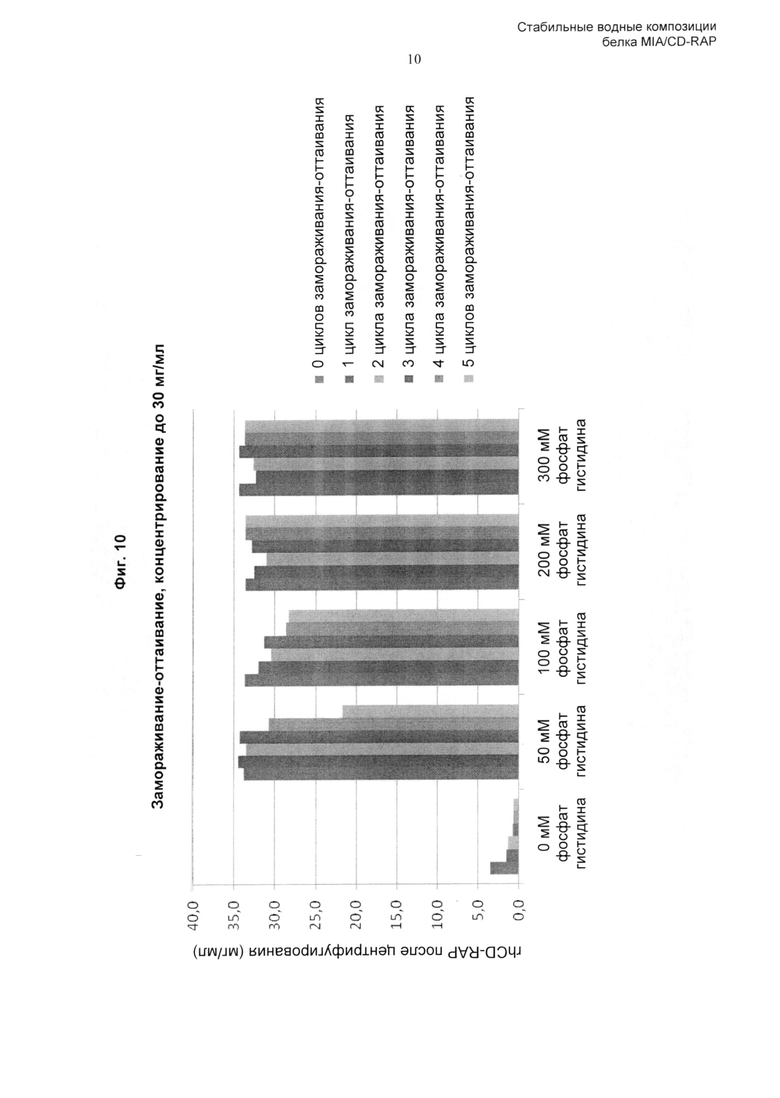
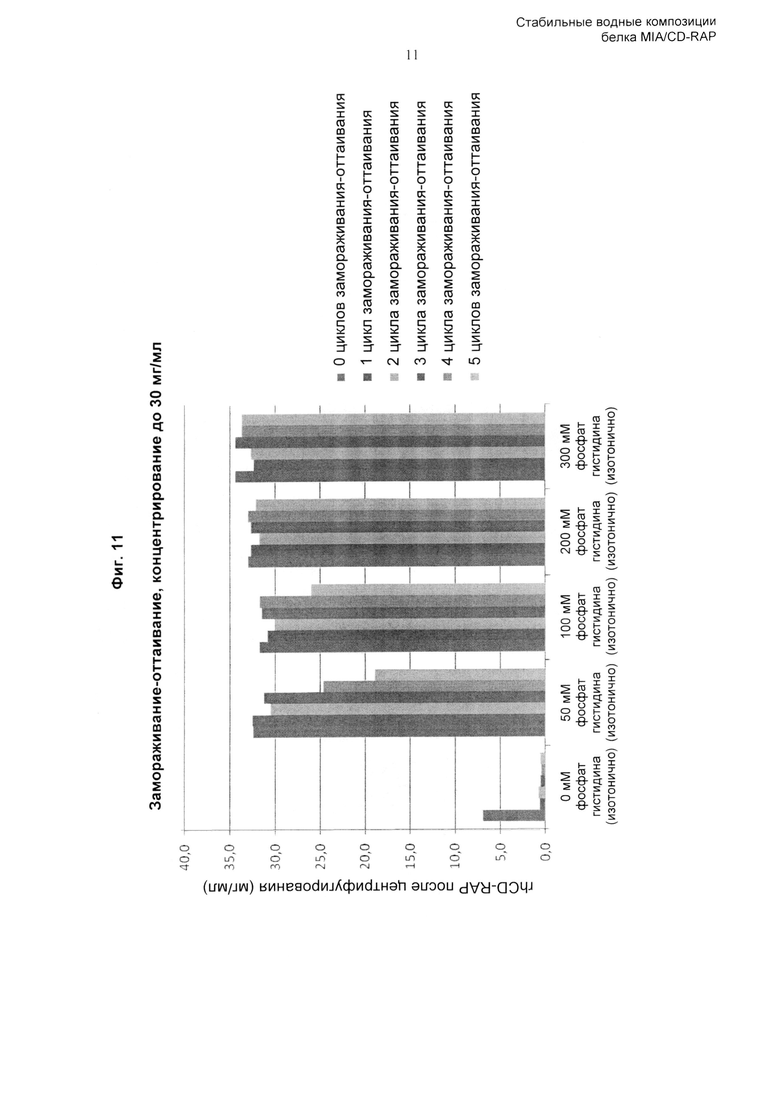






Настоящее изобретение относится к биохимии, в частности к стабильной водной композиции, содержащей примерно от 5 до 30 мг/мл белка CD-RAP и заряженную аминокислоту, имеющую суммарный заряд при рН приблизительно от 6 до 8, и набору для восстановления хряща, содержащему указанную композицию и инструкции для применения. Настоящее изобретение позволяет получать стабильные водные композиции белка CD-RAP, содержащие указанный белок в высокой концентрации, в которых при этом снижена агрегация полипептидов CD-RAP на протяжении длительного периода времени и при повторных циклах замораживания-оттаивания. Композиция по настоящему изобретению предназначена для применения в лечении воспалительных расстройств, предпочтительно остеоартрита. 2 н. и 8 з.п. ф-лы, 11 ил., 5 табл., 8 пр.
1. Стабильная водная композиция для восстановления хряща, содержащая от примерно 5 мг/мл до примерно 30 мг/мл белка CD-RAP и заряженную аминокислоту, где указанный белок CD-RAP непосредственно растворен в композиции, при этом указанная композиция имеет значение рН приблизительно от 6 до 8, и указанная аминокислота имеет суммарный заряд при рН приблизительно от 6 до 8.
2. Композиция по п. 1, дополнительно содержащая буфер.
3. Композиция по п. 1, дополнительно содержащая модификатор тоничности.
4. Композиция по п. 1, дополнительно содержащая стабилизатор.
5. Композиция по п. 1, дополнительно содержащая эксципиент.
6. Композиция по п. 1, где заряженная аминокислота выбрана из группы, состоящей из аргинина, гистидина, лизина и глутаминовой кислоты.
7. Композиция по п. 1, ингредиенты которой обеспечивают стабильность при повторных циклах замораживания-оттаивания.
8. Композиция по п. 2, где буфер выбран из группы, состоящей из фосфата калия, трис-хлорида (хлорида трис(гидроксиметил)аминометана), гистидина, аргинина и глутамата, и аминокислота выбрана из группы, состоящей из аспартата, глутамата (предпочтительно фосфата глутамата), аргинина (предпочтительно фосфата аргинина или хлорида аргинина), гистидина (предпочтительно хлорида гистидина или фосфата гистидина), лизина и глицина.
9. Композиция по п. 1, содержащая от примерно 5 мг/мл до примерно 30 мг/мл CD-RAP и:
1) 50 мМ трис-хлорида и 2,5% глутамата;
2) 50 мМ гистидина и 2,5% (масс/об.) глицина, 2,5% (масс/об.) глутамата или 2,5% (масс/об.) лизина;
3) 300 мМ хлорида гистидина, рН 6,0;
4) 50, 100, 200 или 300 мМ фосфата гистидина, рН 6,0;
5) 350 мМ хлорида аргинина, рН 6,0;
6) 350 мМ фосфата аргинина, рН 6,0;
7) 350 мМ фосфата аргинина, рН 7,4; или
8) 300 мМ глутамата калия, рН 6,0.
10. Набор для восстановления хряща, включающий композицию по любому из пп. 1-9 и инструкции для применения.
| WO 2008040556 A1, 10.04.2008 | |||
| US 5580856 А, 03.12.1996 | |||
| BOSSERHOFF AK, Mouse CD-RAP/MIA gene: structure, chromosomal localization, and expression in cartilage and chondrosarcoma, Dev Dyn, 1997, Vol.208, No.4, pp.516-525 | |||
| СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ОСТЕОАРТРОЗА, СРЕДСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ И СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ОСТЕОАРТРОЗА | 1999 |
|
RU2197238C2 |
Авторы
Даты
2016-07-10—Публикация
2011-04-27—Подача