Область изобретения
Настоящее изобретение относится к жидкой композиции антитела против TNF-α, и конкретно к жидкой композиции адалимумаба.
Предшествующий уровень техники
Фактор некроза опухоли альфа (TNF-α) представляет собой цитокин, продуцируемый различными типами клеток, такими как моноциты, макрофаги и т.п., путем стимулирования эндотоксина и т.п. TNF-α представляет собой основной медиатор основных воспалительных, иммунологических и патофизиологических реакций, которые активируют рецепторы TNF и вызывают ответы, такие как активация Т-клеток, пролиферация тимоцитов и т.п. (Grell, М., et al. (1995) Cell, 83: 793-802).
Адалимумаб представляет собой моноклональное антитело - рекомбинантный человеческий иммуноглобулин G1, который ингибирует иммунные ответы, индуцируемые TNF-α, путем избирательного связывания с TNF-α in vivo. Адалимумаб разработан В ASP Bioresearch Corporation в 1993 и одобрен Abbott Laboratories для продажи в качестве средства для лечения ревматоидного артрита. Адалимумаб в настоящее время представлен на рынке под товарным знаком HUMIRA®, и после получения одобрения для продажи в качестве терапевтического агента для лечения ревматоидного артрита HUMIRA® используют для лечения болезни Крона, анкилозирующего спондилита, псориатического артрита, неспецифического язвенного колита и т.п.
Адалимумаб представляет собой первое полностью человеческое антитело, разработанное в качестве лекарственного средства. Адалимумаб разработан путем применения технологии фагового дисплея и обладает увеличенной аффинностью путем индукции мутации в CDR (гипервариабельных участках). Адалимумаб, также называемый D2E7, состоит из 1330 аминокислот и имеет молекулярную массу приблизительно 148 кДа (патент США №6090382). Адалимумаб представляет собой ингибитор TNF-α, который связывается с TNF и блокирует реакции, вызываемые TNF, за счет того, что предупреждает взаимодействие TNF с рецепторами TNF на клеточной поверхности (т.е. р55 и р75).
Кроме того, лекарственные средства в виде антитела представляют собой вид белкового лекарственного средства, и физическая и химическая денатурация может возникать ввиду различных факторов. Помимо белковой денатурации может возникать химическая денатурация, такая как окисление, деамидирование и изомеризация, или может возникать структурная денатурация, такая как фрагментация или агрегация. Когда белок денатурирует, тогда возможно, что белок может утратить свою собственную фармакологическую активность и таким образом вызывать неблагоприятные иммунные ответы in vivo в качестве побочного действия. Когда антитело фрагментировано, тогда его связывающая аффинность или время удерживания в организме изменяется, и, таким образом, фармакологическая активность антитела изменяется. Дополнительно, представлены исследования того, что фрагментированные антитела могут вызывать агрегирование антител. Дополнительно, фармакологическая активность может быть уменьшена путем агрегации. В соответствии с исследованиями в качестве результата сравнения имеющихся в продаже продуктов бета интерферона, подтверждено, что продукты, имеющие высокое содержание агрегатов и частиц с высокой степенью вероятности имеют высокую процентную долю нейтрализующих антител в организме (Barnard et ah, 2013, J. Pharm. Sci. 102: 915). Если нейтрализующие антитела продуцируются in vivo, тогда нейтрализующие антитела связываются с белковым лекарственным средством, когда лекарственное средство инъецируется в организм, таким образом, нарушая безопасность, фармакологическое действие и фармакокинетику белкового лекарственного средства. Дополнительно, также представлено, что денатурация и агрегация эпоэтина альфа представляют собой причины увеличенной иммуногенности лекарственных средств на основе эпоэтина альфа. Соответственно, в случае белковых лекарственных средств весьма важно получать белковые лекарственные средства в подходящих композициях таким образом, чтобы не утратить свою физиологическую активность во время периода хранения, и также чтобы белки не фрагментировались, не агрегировались или не образовывали частицы. Соответственно, проводятся активные исследования на композициях различных белковых лекарственных средств.
Задача исследования белковых композиций заключается в том, чтобы найти оптимальную комбинацию путем соответствующего смешивания нескольких добавок с учетом свойства каждого продукта, таким образом, что продукт может стабильно храниться до его введения пациенту. Основная задача добавок заключается в стабилизации белков и контроля за физическими свойствами смешанных материалов. Добавки могут быть разделены на поверхностно-активные вещества, стабилизаторы, консерванты, буферы, изотонические агенты и т.п. в зависимости от их задач и характеристик. В случае лекарственных средств на основе антитела вводят большее количество белка по сравнению с другими белковыми лекарственными средствами для достижения эффективных терапевтических действий. В случае подкожной инъекции важно разработать высококонцентрированную композицию вследствие сложностей, связанных с доставкой большого объема одномоментно, таких как боли у пациента, продукция и т.п. По мере увеличения концентрации белка увеличивается межмолекулярное взаимодействие, таким образом вызывая проблемы, такие как увеличенная агрегация, увеличенная вязкость, желатинизация, осаждение и т.п. Среди них чрезмерное увеличение вязкости затрудняет продукцию, и также усложняет введение пациенту вследствие увеличения давления при инъекции. Таким образом, исследуются различные способы предупреждения и уменьшения вязкости высококонцентрированного раствора антитела.
Описание изобретения
Техническая задача
Задача настоящего изобретения заключается в том, чтобы предложить жидкую композицию антитела против TNF-α.
Также задача настоящего изобретения заключается в том, чтобы предложить способ получения жидкой композиции.
Также задача настоящего изобретения заключается в том, чтобы предложить способ улучшения стабильности антитела против TNF-α, с использованием композиции, содержащей стабилизатор, поверхностно-активное вещество и аргинин.
Также задача настоящего изобретения заключается в том, чтобы предложить способ улучшения стабильности антитела против TNF-α, с использованием композиции, содержащей стабилизатор, поверхностно-активное вещество и аргинин без буфера.
Техническое решение
Далее настоящее изобретение будет описано более подробно.
Кроме того, каждое из раскрытых здесь объяснений и примеров воплощений может быть применено в отношении других объяснений и примеров воплощений. То есть все из комбинаций раскрытых здесь различных факторов относятся к объему настоящего изобретения. Кроме того, объем настоящего изобретения не должен ограничиваться конкретным описанием, приведенным ниже.
Дополнительно, специалист в данной области техники способен осознать или подтвердить с использованием не более чем стандартных экспериментов количество эквивалентов конкретных воплощений изобретения, описанных в настоящем изобретении. Дополнительно, предполагается, что такие эквиваленты включены в настоящее изобретение.
Для достижения вышеприведенных задач в аспекте настоящего изобретения предложена жидкая композиция антитела против TNF-α.
Использованный здесь термин "антитело против TNF-α" относится к антителу, которое связывается с TNF-α и регулирует его биологическую активность. Более конкретно, антитело может связываться с TNF-α и ингибировать связывание между TNF-α и его рецепторами, таким образом, ингибируя передачу сигнала с TNF-α. Дополнительно, антитело против TNF-α может представлять собой моноклональное антитело.
Антитело против TNF-α может находиться в форме полноразмерного антитела или фрагмента антитела, содержащего его антигенсвязывающую область, но антитело против TNF-α не ограничивается конкретно ими.
Более конкретно, антитело против TNF-α может представлять собой моноклональное антитело - рекомбинантный человеческий иммуноглобулин G1, и еще более конкретно, может представлять собой адалимумаб. Информация о адалимумабе легко может быть получена специалистом в данной области техники из известных баз данных.
Это антитело может быть получено с помощью технологии рекомбинантных ДНК с использованием системы экспрессии на основе клеток млекопитающих, но способ получения не ограничивается этим.
Это антитело может содержаться в жидкой композиции по настоящему изобретению в терапевтически эффективном количестве. В конкретном воплощении антитело может быть представлено в концентрации от 1 мг/мл до 250 мг/мл, конкретно от 20 мг/мл до 200 мг/мл, более конкретно от 50 мг/мл до 200 мг/мл и еще более конкретно в концентрации 50 мг/мл, 100 мг/мл или 130 мг/мл, но концентрация антитела не ограничивается конкретно ими.
Жидкая композиция по настоящему изобретению может содержать стабилизатор, поверхностно-активное вещество и аргинин дополнительно к антителу против TNF-α. Жидкая композиция может представлять собой композицию в виде раствора, способную стабильно сохранять антитело против TNF-α.
Конкретно, стабильность антитела против TNF-α может быть измерена с использованием любого анализа измерения стабильности белка, хорошо известного в области техники. Стабильность может быть измерена при выбранной температуре в течение выбранного промежутка времени. Для быстрого теста композицию можно хранить при более высокой или "повышенной температуре" (например, при 40°С в течение от 2 недель до 1 месяца или больше), при этом измеряют стабильность в зависимости от времени.
В настоящем изобретении "обеспечение стабильности антитела против TNF-α" означает, что утрата активного ингредиента в определенных условиях хранения (конкретно при определенной температуре) в течение определенного периода времени меньше определенного количества (например меньше чем 10%). Обычно, когда остаточный уровень антитела против TNF-α в композиции составляет 90% или более, тогда конкретно приблизительно 92% более при 5±3°С в течение 2 лет, при 25±2°С в течение 6 месяцев или 40±2°С в течение от 1 до 2 месяцев, эти композиции могут быть интерпретированы как стабильные.
Стабилизатор, содержащийся в жидкой композиции по настоящему изобретению, может представлять собой полиол, аминокислоту или их комбинацию. Аминокислота может представлять собой аминокислоту, отличающуюся от аргинина.
Конкретно, стабилизатор может представлять собой 1) один из видов пол иола; 2) комбинацию одного из видов полиола и одного из видов аминокислоты; 3) комбинацию одного из видов полиола, первой аминокислоты и второй аминокислоты; 4) комбинацию первого полиола и второго полиола; 5) комбинацию первого полиола, второго полиола и одного из видов аминокислоты; 6) комбинацию первого полиола, второго полиола, первой аминокислоты и второй аминокислоты; или 7) одного из видов аминокислоты.
Более конкретно, этот полиол может представлять собой маннит, сахарозу, трегалозу, PEG (полиэтиленгликоль) или их комбинацию, и более конкретно, сахарозу, трегалозу, PEG или их комбинацию. PEG может конкретно представлять собой PEG400 или PEG4000, но конкретно не ограничивается ими. В вышеприведенной композиции полиол может быть представлен в концентрации от 0,1 мг/мл до 100 мг/мл.
Более конкретно, аминокислота, отличающаяся от аргинина, может представлять собой глицин лейцин, изолейцин, фенилаланин или пролин. В вышеприведенной композиции аминокислота может быть представлена в концентрации от 1 мМ до 300 мМ.
Дополнительно, используемый здесь термин "аминокислота" также включает все из них в форме аналогов, сольватов, гидратов, стереоизомеров и фармацевтически приемлемых солей соответствующей аминокислоты, которые демонстрируют по существу то же самое действие.
Используемый здесь термин "фармацевтически приемлемая соль" включает фармацевтически приемлемые неорганические кислоты, органические кислоты или соли, полученные из оснований. Примеры подходящих кислот могут включать соляную кислоту, бромноватую кислоту, серную кислоту, азотную кислоту, перхлорную кислоту, фумаровую кислоту, малеиновую кислоту, ортофосфорную кислоту, гликолевую кислоту, молочную кислоту, салициловую кислоту, янтарную кислоту, толуол-пара-сульфоновую кислоту, винную кислоту, уксусную кислоту, лимонную кислоту, метансульфоновую кислоту, муравьиную кислоту, бензойную кислоту, малоновую кислоту, нафталин-2-сульфоновую кислоту, бензолсульфоновую кислоту и т.п. Примеры солей, полученных из подходящих оснований, могут включать соль щелочного металла, такого как натрий, калий и т.п.; щелочно-земельного металла, такого как магний и т.п.; аммиака и т.п.
Дополнительно, используемый здесь термин "сольват" означает, что аминокислота или ее соль образует комплекс с молекулой растворителя.
Более конкретно, стабилизатор может представлять собой стабилизатор, выбранный из группы, состоящей из (1) сахарозы или трегалозы, (2) PEG, имеющего среднечисловую молекулярную массу от 200 до 600 или PEG, имеющего среднечисловую молекулярную массу от 1000 до 8000; (3) глицина или лейцина; и (4) комбинации по меньшей мере двух из (1)-(3), но стабилизатор не ограничивается конкретно ими.
В более конкретном воплощении стабилизатор может представлять собой стабилизатор, выбранный из группы, состоящей из 1) любого из сахарозы, трегалозы и PEG400; 2) комбинации сахарозы или трегалозы с глицином или лейцином; 3) комбинации сахарозы или трегалозы с глицином и лейцином; 4) комбинации сахарозы или трегалозы с PEG4000; 5) комбинации сахарозы или трегалозы с PEG4000 и глицином; 6) комбинации сахарозы или трегалозы с PEG4000 и лейцином; 7) комбинации сахарозы или трегалозы с PEG4000, глицином и лейцином; и 8) глицина, но стабилизатор не ограничивается конкретно ими.
Поверхностно-активное вещество, которое должно быть в жидкой композиции по настоящему изобретению, может представлять собой не ионное поверхностно-активное вещество. Более конкретно, поверхностно-активное вещество может представлять собой полисорбат или полоксамер.
Конкретно, поверхностно-активное вещество может представлять собой полисорбат 80, полисорбат 20 или полоксамер 188, но поверхностно-активное вещество не ограничивается конкретно ими.
В вышеприведенной композиции поверхностно-активное вещество может быть представлено в концентрации от 0,1 мг/мл до 5 мг/мл.
Аргинин, который должен быть в жидкой композиции по настоящему изобретению, может быть представлен в форме соли, и, более конкретно, в форме фармацевтически приемлемой соли.
Более конкретно, аргинин может находиться в форме аргинина гидрохлорид, но аргинин не ограничивается конкретно им.
В вышеприведенной композиции аргинин может быть представлен в концентрации от 0,1 мМ до 200 мМ. Более конкретно, аргинин может быть представлен в концентрации от 0,1 мМ до 140 мМ, когда антитело представлено в композиции в концентрации 100 мг/мл, тогда как аргинин может быть представлен в концентрации от 0,1 мМ до 100 мМ, когда антитело представлено в композиции в концентрации 50 мг/мл, но концентрация аргинина не ограничивается конкретно ими.
Аргинин может быть в жидкой композиции по настоящему изобретению в виде агента, уменьшающего вязкость.
За счет содержания аргинина жидкая композиция по настоящему изобретению может иметь вязкость от приблизительно 1 сП до 6 сП, но вязкость не ограничивается конкретно ими. Вязкость может быть измерена с использованием различных способов, известных в области техники, например тем же самым образом, как описано в примере 1, но способ измерения не ограничивается конкретно ими.
Жидкая композиция по настоящему изобретению может дополнительно содержать антиоксидант.
Используемый здесь "антиоксидант" может действовать таким образом, что ингибирует образование примесей, которое может происходить вследствие реакции окисления белков в растворенном состоянии.
Примеры антиоксиданта могут включать гидросульфат натрия, аскорбиновую кислоту, аскорбилпальмитат, лимонную кислоту, бутилгидроксианизол (ВНА), бутилгидрокситолуол (ВНТ), тиоглицерин, пропилгаллат, метионин, аскорбат натрия, цитрат натрия, сульфид натрия, сульфит натрия, EDTA (этилендиаминтетрауксусная кислота) и другие антиоксиданты, но антиоксидант не ограничивается ими.
В вышеприведенной композиции антиоксидант (конкретно метионин) может быть представлен в концентрации от 1 мМ до 50 мМ, но антиоксидант не ограничивается конкретно ими.
Дополнительно, жидкая композиция по настоящему изобретению может иметь рН от 4 до 6, но рН не ограничивается конкретно ими.
Кроме того, жидкая композиция может не содержать дополнительно соль и/или буфер, но жидкая композиция не ограничивается конкретно ими.
В неограничивающем воплощении композиция, содержащая антитело против TNF-α в концентрации 50 мг/мл или выше, может не содержать дополнительно соль и/или буфер.
Как подтверждено в одном воплощении настоящего изобретения, композиция по настоящему изобретению, не содержащая соль и буфер, может обеспечивать большую стабильность антитела против TNF-α к нагреванию по сравнению с композициями, не содержащими соль, буфер, или оба из них, но композиция по настоящему изобретению не ограничивается конкретно ими.
Кроме того, если дополнительный буфер не добавляют в композицию лекарственного средства на основе антитела в высокой концентрации (например, лекарственное средство, в котором антитела представлены в концентрации 50 мг/мл или более высокой), или дополнительную добавку не добавляют в композицию в таком количестве, которое приводит к тому, что осмотическое давление в растворе выходит за пределы диапазона осмотического давления, близкого к осмотическому давлению жидкостей организма, боль в момент введения может быть уменьшена, тем самым повышая удобство пациенту.
Кроме того, жидкая композиция по настоящему изобретению может оказывать следующие действия, но эти действия не ограничиваются конкретно ими.
Жидкая композиция, содержащая аргинин, по настоящему изобретению может демонстрировать относительно низкое содержание высокомолекулярных (HMW) продуктов за счет подавления агрегации белков антитела против TNF-α по сравнению с композицией, не содержащей аргинин; и/или может включать относительно низкое количество кислотных вариантов антитела за счет подавления продукции кислотных вариантов антитела по сравнению с композицией, не содержащей аргинин. В частности, жидкая композиция, содержащая аргинин, по настоящим изобретению, может обладать действием, уменьшающим денатурацию антитела, и/или действиями, уменьшающими агрегацию и образование частиц в ответ на определенные физические стрессы.
Композиция раствора, содержащая аргинин, по настоящему изобретению, может дополнительно содержать консервант. Консервант относится к соединению, добавляемому в фармацевтическую композицию, действующему в качестве антимикробного агента. Примеры консервантов могут включать хлорид бензалкония, бензэтоний, хлоргексидин, фенол, м-крезол, бензиловый спирт, метилпарабен, пропилпарабен, хлорбутанол, о-крезол, n-крезол, хлоркрезол, нитрат фенилртути, тимеросал, бензойную кислоту и т.п., но консервант не ограничен ими. Эти консерванты могут быть использованы сами по себе или в любой комбинации по меньшей мере двух из них.
Жидкая композиция по настоящему изобретению может быть в форме фармацевтической композиции.
Дополнительно, жидкая композиция по настоящему изобретению может содержать различные фармацевтически приемлемые носители дополнительно к описанным выше ингредиентам.
Композиции по настоящему изобретению могут быть использованы для предупреждения или лечения ревматоидного артрита, псориаза, псориатического артрита, аксиального спондилоартрита (например анкилозирующего спондилита, тяжелого аксиального спондилоартрита без ретгенографического доказательства анкилозирующего спондилита), васкулита, болезни Альцгеймера, неспецифического язвенного колита, синдрома Бехчета, гнойного гидраденита, увеита, ювенильного идиопатического артрита, бляшковидного псориаза у детей или болезни Крона (включающей болезнь Крона у детей и болезнь Крона у взрослых), но заболевания, которые предупреждаются или лечатся, не ограничиваются ими.
Композиции по настоящему изобретению могут быть введены в организм путем перорального введения или парентерального введения, включающего подкожные, внутримышечные, внутриперитонеальные, внутригрудинные, чрескожные и внутривенные инъекции и инфузии, но введения не ограничиваются ими.
В еще одном аспекте настоящего изобретения предложен способ получения жидкой композиции антитела против TNF-α, включающий смешивание антитела против TNF-α, стабилизатора, поверхностно-активного вещества и аргинина друг с другом.
Вышеприведенные термины являются такими же как разъяснено выше. Дополнительно, очевидно, что все конкретные воплощения этих терминов также применяются в настоящем аспекте.
В еще одном аспекте настоящего изобретения предложен способ улучшения стабильности антитела против TNF-α с использованием композиции, которая содержит стабилизатор, поверхностно-активное вещество и аргинин.
Вышеприведенные термины являются такими же как разъяснено выше. Дополнительно, очевидно, что все конкретные воплощения этих терминов также применяются в настоящем аспекте.
Также задача настоящего изобретения заключается в том, чтобы предложить способ улучшения стабильности антитела против TNF-α с использованием композиции, которая содержит стабилизатор, поверхностно-активное вещество и аргинин без буфера.
Вышеприведенные термины являются такими же как разъяснено выше. Дополнительно, очевидно, что все конкретные воплощения этих терминов также применяются в настоящем аспекте.
Полезные свойства изобретения
Жидкая композиция антитела против TNF-α по настоящему изобретению, конкретно жидкая композиция адалимумаба, может уменьшать образование побочных продуктов хранения адалимумаба, таким образом, обеспечивая длительное хранение. Дополнительно, фармакологическое действие адалимумаба может стабильно сохраняться в течение длительного периода времени путем предупреждения денатурации и агрегации, вызываемых в ответ на физические стрессы во время процессов производства и транспортировки. Соответственно, жидкая композиция по настоящему изобретению может эффективно использоваться в терапевтической области, ассоциирующейся с фармакологической эффективностью адалимумаба.
Краткое описание графических материалов
Фиг. 1 демонстрирует вязкость каждого образца в примере 1 в соответствии с дополнительными композициями.
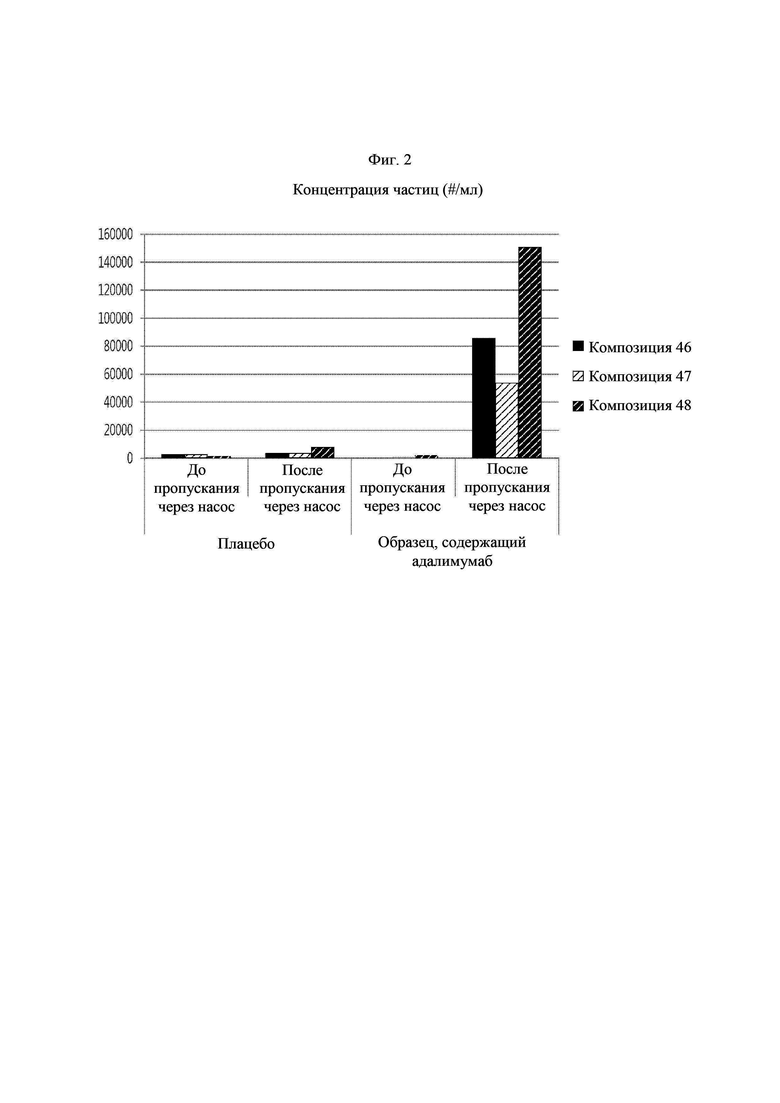
Фиг. 2 демонстрирует количество частиц в каждом из образцов и соответствующих им холостых образцов в примере 7 до и после пропускания через насос.
Подробное описание изобретения
Далее настоящее изобретение будет описано более подробно со ссылкой на следующие примеры. Тем не менее, эти примеры приведены исключительно для иллюстративных задач, и изобретение не ограничивается этими примерами.
Пример 1
Эффект уменьшения вязкости раствора адалимумаба в зависимости от добавок и подтверждение стабильности
Для проверки добавок, используемых для получения жидкой композиции адалимумаба, получали композицию 1, содержащую комбинацию сахарозы (55 мг/мл), метионина (5 мМ), полисорбата 80 (1 мг/мл) и адалимумаба (100 мг/мл) при рН 5,2.
Дополнительно получали композиции 2-13 путем дополнительного добавления каждого из гидрохлорида аргинина, гидрохлорида лизина, лейцина, изолейцина, фенилаланина, глутаминовой кислоты, глицина, пролина, аланина, хлорида натрия, хлорида кальция и хлорида магния в состав композиции 1, и вязкость каждой композиции измеряли с использованием аппарата mVROC (Rheosense Inc.). Типы и концентрации добавок, добавляемых в композиции, и вязкость каждой композиции представлены в таблице 1 ниже и фиг. 1.

В отношении вязкости для каждой из композиции, представленной в таблице 1, вязкость для композиции 1, состоящей из сахарозы, метионина, полисорбата 80 и адалимумаба, составила 3,23. Для сравнения вязкость композиций, содержащих аминокислоты, такие как лейцин, изолейцин, фенилаланин, глицин и пролин, находилась в диапазоне от 3,20 до 3,28, таким образом, не демонстрируя какого-либо существенного различия относительно композиции 1. Наоборот, в случаях, когда добавляли гидрохлорид аргинина, гидрохлорид лизина, глутаминовую кислоту, хлорид натрия, хлорид кальция, хлорид магния и т.п., подтвердили то, что вязкости находились в диапазоне от 2,94 до 3,14, таким образом, демонстрируя уменьшение по сравнению с композицией 1.
Для сравнения стабильности каждой из композиций, каждую из них стерилизовали путем фильтрования через фильтр (размер пор: 0,2 мкм), распределяли в стеклянные шприцы (объем: приблизительно 1,0 мл) в количестве 0,4 мл в каждый, запечатывали и хранили при 40°С в течение 2 месяцев. После хранения каждый образец анализировали при помощи SE-HPLC (эксклюзионная высокоэффективная жидкостная хроматография) для определения содержания высокомолекулярных примесей (HMW) (например олигомеров, агрегатов и т.п.) и низкомолекулярных примесей (LMW) (т.е. фрагментов молекул адалимумаба). Сначала в таблице 2, представленной ниже, приведены результаты SE-HPLC для композиций, обладающих уменьшенной вязкостью, (композиции 2, 3, 7, 11, 12 и 13) и для композиции 1 в качестве контрольной группы. Дополнительно, в таблице 3, представленной ниже, приведены результаты SE-HPLC для композиций, не обладающих значительным изменением вязкости, (композиции 4, 5, 6, 8, 9 и 10) и для композиции 1 в качестве контрольной группы.
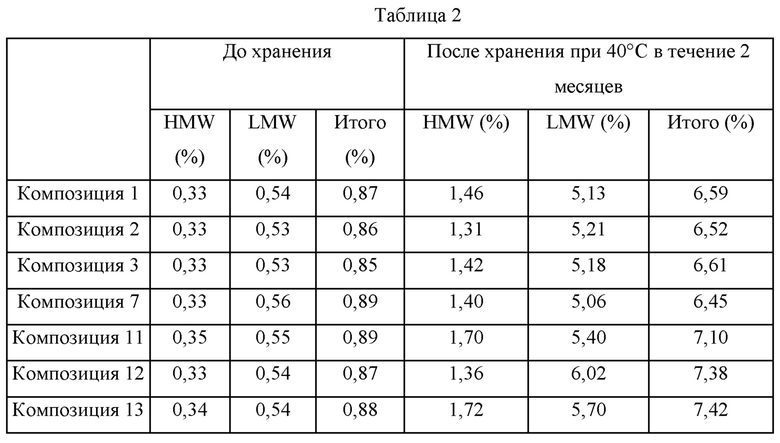
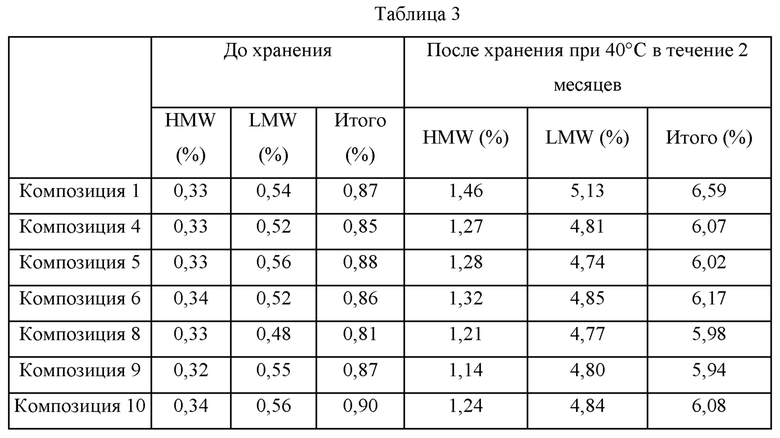
В отношении таблицы 2 выше представленные HMW, LMW и общие количества примесей до хранения похожи между композициями. Однако общее количество примесей после хранения при 40°С в течение 2 месяцев составило соответственно 7,10% в композиции 11, содержащей хлорид натрия, 7,38% в композиции 12, содержащей хлорид кальция, и 7,42% в композиции 13, содержащей хлорид магния, таким образом, демонстрируя значительное увеличение по сравнению с 6,59% для композиции 1 (т.е. контрольная группа). Наоборот, в случаях композиций 2, 3 и 7, в которых соответственно содержится гидрохлорид аргинина, гидрохлорид лизина и глутаминовая кислота, представленные общие количества примесей после хранения при 40°С в течение 2 месяцев находятся в диапазоне от 6,45% до 6,61%, таким образом, поддерживая уровни общего количества примесей около 6,59%, как в композиции 1 (т.е. контрольная группа).
В отношении таблицы 3 выше, в случае композиций, в которые добавлены аминокислоты, такие как лейцин, изолейцин, фенилаланин, глицин, пролин и т.п., представленные общие количества примесей после хранения при 40°С в течение 2 месяцев находятся в диапазоне от 5,94% до 6,17%, таким образом, демонстрируя значительное уменьшение по сравнению с 6,59% для композиции 1 (т.е. контрольная группа). В соответствии с этими результатами подтвердили, что аминокислоты, такие как лейцин, изолейцин, фенилаланин, глицин, пролин и т.п. могут вносить вклад в стабильность адалимумаба.
Пример 2
Оценка стабильности 1 в зависимости от содержания гидрохлорида аргинина
Для оценки стабильности композиций адалимумаба в зависимости от содержания гидрохлорида аргинина, композиции получали следующим образом.
Композицию 14 получали таким образом, что она содержит сахарозу (55 мг/мл), метионин (5 мМ), полисорбат 80 (1 мг/мл) и адалимумаб (100 мг/мл). Композиции 15 и 16 получали путем добавления соответственно гидрохлорида аргинина (20 мМ) и гидрохлорида аргинина (40 мМ) в состав композиции 14 и заполнения в стеклянные шприцы объемом 1 мл в количестве 0,4 мл. Каждый шприц хранили при 40°С в течение 2 месяцев и затем подвергали анализу при помощи SE-HPLC для определения стабильности. Состав каждой композиции и содержащиеся в ней HMW до и после хранения представлены в таблице 4 ниже.
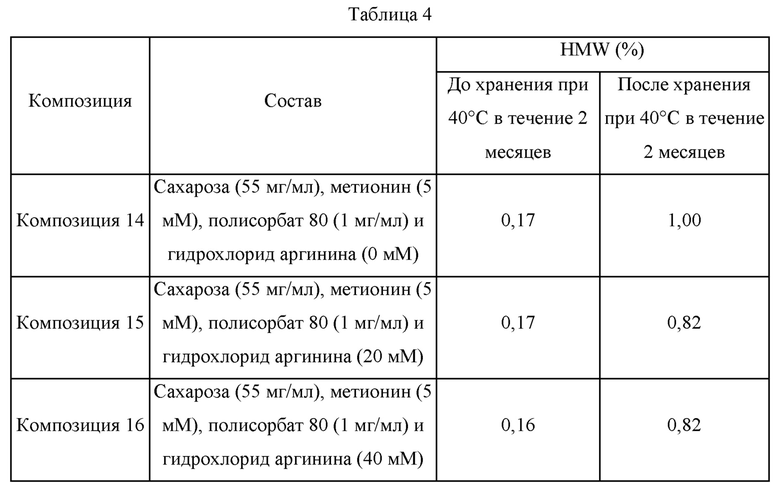
В отношении результатов SE-HPLC в таблице 4, когда содержание гидрохлорида аргинина увеличивали с 0 мМ (композиция 14) до 20 мМ (композиция 15) и 40 мМ (композиция 16), тогда количество HMW в образцах до хранения было похожим, находясь в диапазоне от 0,16% до 0,17%. Однако содержание HMW после хранения при 40°С в течение 2 месяцев составляло 1,00% в композиции 14 (не содержащей гидрохлорид аргинина) и 0,82% в композициях 15 и 16 (содержащих соответственно 20 мМ гидрохлорида аргинина и 40 мМ гидрохлорида аргинина), таким образом, демонстрируя то, что композиции, содержащие 20 мМ гидрохлорида аргинина и 40 мМ гидрохлорида аргинина обладали уменьшенными уровнями HMW по сравнению с композицией, не содержащей гидрохлорид аргинина. Соответственно, подтвердили, что гидрохлорид аргинина обладает действием, предотвращающим агрегацию адалимумаба.
Пример 3
Сравнение образования вариантов антитела, отличающихся зарядом, в зависимости от содержания аргинина
Для сравнения уровней образования вариантов антитела, отличающихся зарядом, в зависимости от содержания аргинина, получали композицию, содержащую аргинин, и композицию, не содержащую аргинин; хранили при 40°С в течение 1 месяца и сравнивали свойства продуцировать варианты, отличающиеся зарядом, при помощи CEX-HPLC (катионообменная высокоэффективная жидкостная хроматография). Каждая из композиций и содержания вариантов, отличающихся зарядом, до и после хранения представлены в таблице 5 ниже.
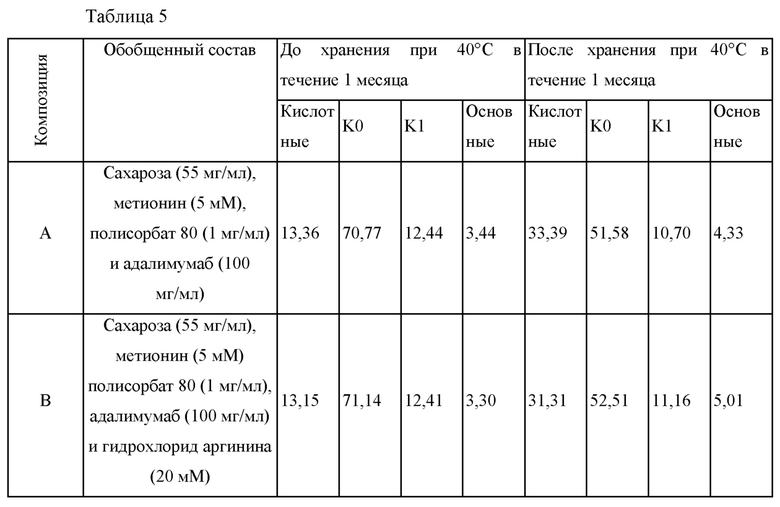
Получали композицию А, содержащую сахарозу (55 мг/мл), метионин (5 мМ), полисорбат 80 (PS80: 1 мг/мл) и адалимумаб (100 мг/мл), и получали композицию В, дополнительно содержащую гидрохлорид аргинина (20 мМ) в составе композиции А. Содержание кислотных вариантов в этих двух композициях до хранения при 40°С в течение 1 месяца было похожим. При сравнении этих двух композиций после хранения подтвердили, что композиция В, содержащая гидрохлорид аргинина, имела меньшее содержание кислотных вариантов антитела и более высокое содержание КО по сравнению с композицией А.
Соответственно, подтвердили, что гидрохлорид аргинина уменьшает образование кислотных вариантов адалимумаба.
Пример 4
Композиции в зависимости от типов поверхностно-активных веществ и сравнение стабильности этих композиций
Для сравнения стабильности жидких композиций адалимумаба в зависимости от типов поверхностно-активных веществ получали композиции, имеющие следующие составы.
Как композицию 14 в примере 2, получали композицию 17, содержащую сахарозу (55 мг/мл), метионин (5 мМ), полисорбат 80 (1 мг/мл) и адалимумаб (100 мг/мл). Дополнительно, получали композиции 18 и 19 путем изменения типа поверхностно-активного вещества на полисорбат 20 и полоксамер 188, при этом фиксируя количество поверхностно-активного вещества на том же самом уровне.
Каждую из композиций стерилизовали путем фильтрования, заполняли каждую в стеклянный шприц объемом 1 мл в количестве 0,4 мл и хранили при 40°С в течение 1 месяца. Количества примесей в виде HMW и LMW в образцах до и после хранения анализировали при помощи SE-HPLC. Составы композиций 17-19 и содержания в этих композициях в соответствии с SE-HPLC до и после хранения при 40°С в течение 1 месяца анализировали, и результаты представлены в таблице 6 ниже.

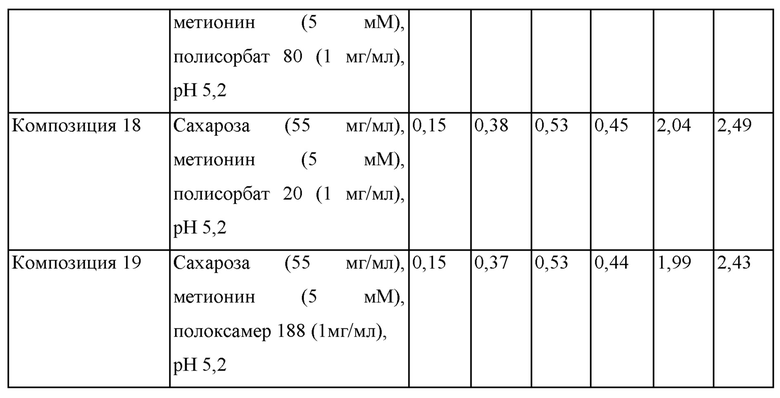
В отношении результатов, представленных в таблице 6, содержания HMW и LMW до и после хранения при 40°С в течение 1 месяца не изменяются существенным образом в зависимости от типов поверхностно-активных веществ.
То есть, показатели стабильности композиции, содержащей полисорбат 80, композиции, содержащей полисорбат 20, и композиции, содержащей полоксамер 188, были сопоставимы.
Соответственно, подтвердили, что действия полисорбата 80, полисорбата 20 и полоксамера 188 на стабильность адалимумаба были сопоставимы.
Пример 5
Композиции в зависимости от типов полиолов и сравнение стабильностей этих композиций
Для сравнения стабильности жидких композиций адалимумаба в зависимости от типов полиолов получали композиции, имеющие следующие составы.
Как композицию 14 в примере 2, композицию 20 получали таким образом, что она содержит сахарозу (55 мг/мл), метионин (5 мМ), полисорбат 80 (1 мг/мл) и адалимумаб (100 мг/мл) (так же как в композиции 17 в примере 4). Дополнительно, композиции 21-23 получали путем изменения типа полиола на трегалозу, PEG400 и PEG4000, при этом фиксируя общее количество полиола на том же самом уровне.
Каждую композицию стерилизовали путем фильтрования, заполняли в стеклянные шприцы объемом 1 мл в количестве 0,4 мл и хранили при 40°С в течение 1 месяца. Количества примесей в виде HMW и LMW в образцах до и после хранения анализировали при помощи SE-HPLC.
Составы композиций 20-23 и содержания в этих композициях в соответствии с SE-HPLC до и после хранения при 40°С в течение 1 месяца анализировали, и результаты представлены в таблице 7 ниже.
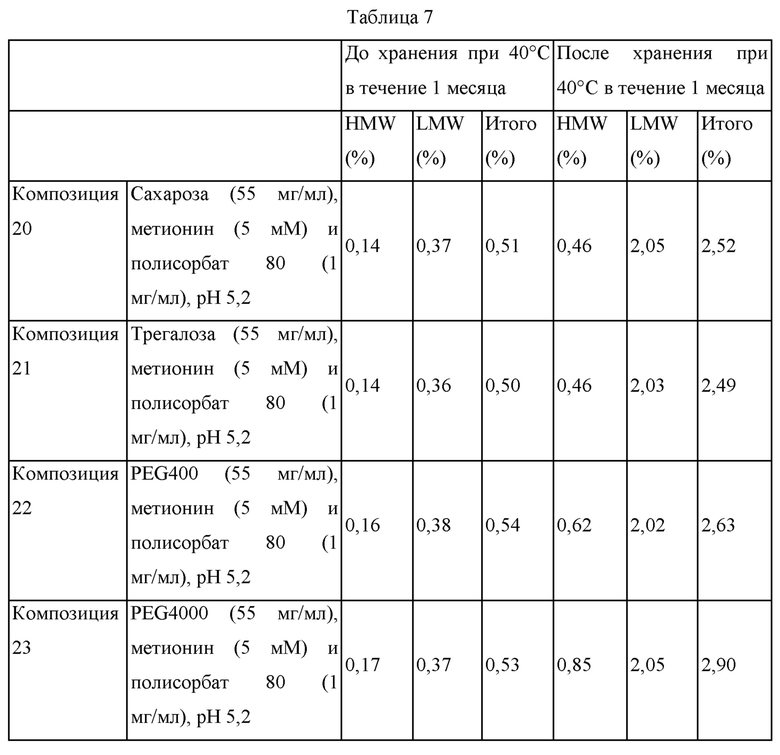
В отношении результатов, представленных в таблице 7 выше, можно видеть, что содержания HMW и LMW значительно варьируют в зависимости от типов полиола до и после хранения при 40°С в течение 1 месяца. Содержание примесей в виде HMW и LMW во всех композициях было близким друг другу до хранения при 40°С в течение 1 месяца. Тем не менее, после хранения при 40°С в течение 1 месяца композиции 20-22, которые содержали соответственно сахарозу, трегалозу и PEG400, демонстрировали относительно низкое содержание HMW по сравнению с композицией 23, которая содержала PEG4000. Представленное содержание LMW близко среди этих композиций. Соответственно, подтвердили, что существует различие в стабильности среди композиций в зависимости от используемых типов полиолов, и показали, что среди них сахароза и трегалоза являются более эффективными в отношении улучшения стабильности, чем другие типы полиолов.
Пример 6
Сравнение стабильности композиций, состоящих из полиола, аргинина, метионина, поверхностно-активного вещества и дополнительного стабилизатора, и композиции HUMIRA®
Образцы получали с различными композициями путем изменения типов поверхностно-активных веществ и полиолов, присутствия/отсутствия дополнительного стабилизатора, содержания гидрохлорида аргинина и т.п. в композиции, где в качестве стабилизатора использовали 5 мМ метионин, и получали композицию в имеющейся в продаже композиции Humira®. Эти образцы хранили при 40°С и затем подвергали анализу при помощи SE-HPLC для сравнения стабильности этих композиций. Составы каждой из этих композиций представлены в таблице 8, и содержания примесей до и после хранения при 40°С в течение 2 месяцев представлены в таблице 9.
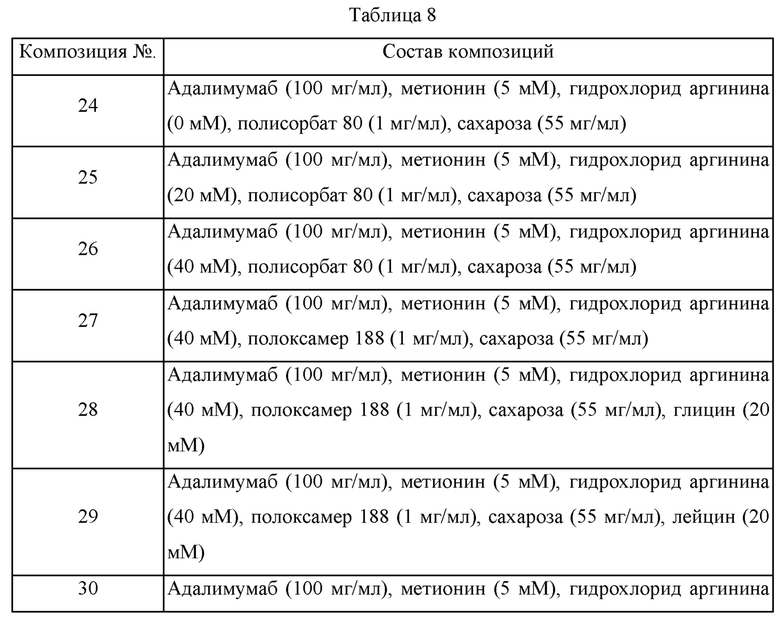
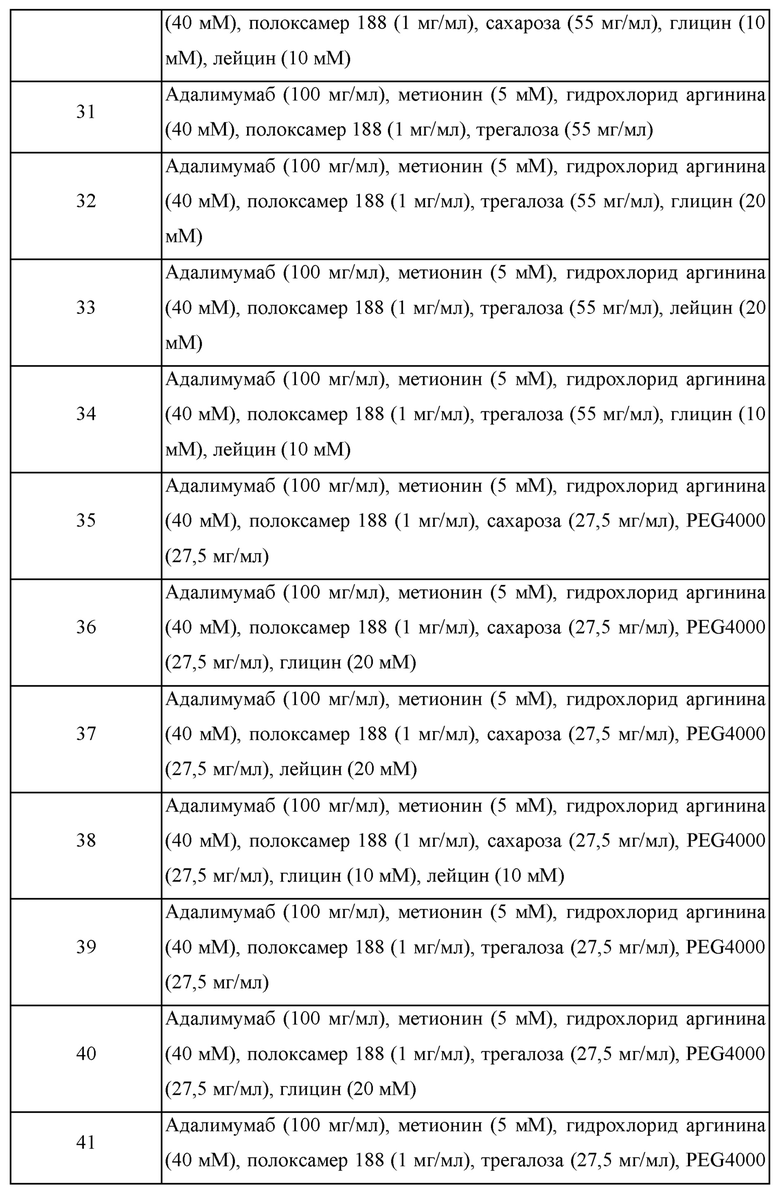

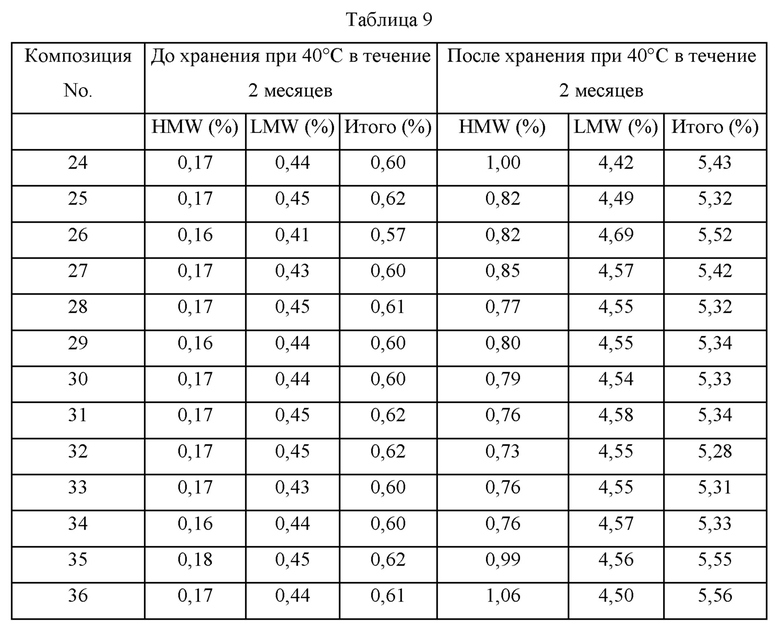
В отношении таблицы 8 сахарозу, трегалозу, комбинацию сахарозы и PEG4000, и коминацию трегалозы и PEG4000 использовали в качестве полиолов, тогда как полисорбат 80 и полоксамер 188 использовали в качестве поверхностно-активных веществ.
Аргинин использовали в концентрации 0 мМ, 20 мМ или 40 мМ, и для подтверждения ролей дополнительных добавок разрабатывали композиции с использованием глицина (Gly), лейцина (Leu) или комбинации глицина и лейцина, и стабильность получающихся в результате композиций адалимумаба (100 мг/мл) сравнивали со стабильностью имеющейся в продаже композиции HUMIRA®. Дополнительно, в отношении стабильности адалимумаба (50 мг/мл) имеющуюся в продаже композицию HUMIRA® сравнивали с составом композиции 44, который был тем же самым, что и композиция 26, за исключением содержания адалимумаба.
В качестве результата сравнения стабильности композиций в таблице 9 подтвердили, что все композиции обладают превосходной стабильностью по сравнению с имеющейся в продаже композицией HUMIRA®. Общее содержание примесей до хранения находилось в диапазоне от 0,57 до 0,74, и было близко друг другу. Однако в отношении стабильности этих композиций после хранения при 40°С в течение 2 месяцев подтвердили, что другие композиции адалимумаба имеют меньшее содержание примесей по сравнению с имеющейся в продаже композицией HUMIRA®, имеющей содержание адалимумаба 100 мг/мл (композиция 43) и имеющейся в продаже композицией HUMIRA®, имеющей содержание адалимумаба 50 мг/мл (композиция 45).
Соответственно, подтвердили, что композиции по настоящему изобретению, состоящие из различных полиолов и поверхностно-активных веществ, гидрохлорида аргинина и дополнительного стабилизатора, более стабильны, чем имеющиеся в продаже композиции HUMIRA® в отношении увеличения содержания примесей.
Дополнительно, хотя общее содержание примесей было приблизительно на 0,4% выше в композициях примера 5 после хранения при 40°С в течение 1 месяца, когда в качестве полиола в примере 5 использовали PEG 4000, по сравнению с композициями, в которых в качестве полиола использовали сахарозу или трегалозу, было показано, что в композициях указанного примера общее содержание примесей в адалимумабе при использовании сахарозы или трегалозы вместе с PEG4000, являются близкими с теми композициями, где сахарозу или трегалозу использовали по отдельности, хотя период хранения составил 2 месяца. Соответственно, подтвердили, что когда дополнительную добавку добавляют для достижения дополнительного эффекта, такого как антиокисление и т.п., замена части сахарозы или трегалозы на PEG, который обладает более высокой молекулярной массой, может быть использована в качестве способа поддержания осмотического давления и стабильности.
Пример 7
Оценка сравнительной стабильности имеющейся в продаже композиции HUMIRA® и композиций, содержащих гидрохлорид аргинина, в ответ на механический стресс
Для сравнения стабильности имеющейся в продаже композиции HUMIRA® и композиций, содержащих гидрохлорид аргинина, в ответ на механический стресс получали композиции, имеющие следующие составы, и давали возможность для пропускания через ротационно-поршневой насос, и, таким образом, оценивали количество частиц до и после пропускания через насос.
Дополнительно, для подтверждения того, имеют ли измеряемые частицы происхождение из адалимумаба, получали плацебо путем исключения только адалимумаба в композиции каждого образца, давали им возможность для пропускания через ротационно-поршневой насос в тех же самых условиях, и, таким образом, оценивали количество частиц до и после пропускания через насос. Для оценки количества частиц использовали устройство для визуализации с микропотоком от Protein Simple. Композиция каждого образца представлена в таблице 10, и количество частиц в каждом образце и соответствующих им плацебо до и после пропускания через насос представлены в таблице 11 и фиг. 2.
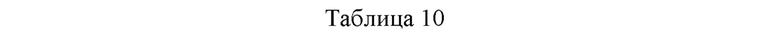

В соответствии с представленным в таблице 10 композиция 46 и композиция 47 имеют один и тот же дополнительный состав, и содержание адалимумаба в композиции 46 составляет 100 мг/мл, а его содержание в композиции 47 составляет 50 мг/мл. В случае композиции 48 состав и содержание адалимумаба скорректировали таким образом, чтобы оно было таким же, как в имеющейся в продаже HUMIRA®. Каждую композицию пропускали через ротационно-поршневой насос и анализировали количество частиц до и после пропускания. В результате, как представлено в таблице 11 и на фиг. 2, подтвердили, что композиция 46 содержала 85743 частиц/мл, композиция 47 содержала 53734 частиц/мл, и композиция 46 с высоким содержанием адалимумаба содержала более высокое количество частиц по сравнению с композицией 47, имеющей низкое содержание адалимумаба.
Наоборот, в случае композиции 48, т.е. имеющейся в продаже композиции HUMIRA®, количество частиц, которые пропускали через насос, составляло 150617 частиц/мл, таким образом, демонстрируя более высокое количество частиц по сравнению с количеством частиц в композициях 46 и 47. Дополнительно, концентрации частиц в плацебо всех композиций после прохождения через насос составляли 3618 частиц/мл и 7938 частиц/мл, и, таким образом, подтвердили, что частицы, измеряемые в образцах, содержащих адалимумаб, после прохождения через насос, имели происхождение из адалимумаба. Соответственно, подтвердили, что композиции, содержащие гидрохлорид аргинина, могут эффективно защищать адалимумаб от механического стресса по сравнению с имеющейся в продаже композицией HUMIRA®.
Пример 8
Эксперимент по уменьшающему вязкость действию в зависимости от концентрации гидрохлорида аргинина
Для исследования диапазона концентраций аргинина, при которых вязкость раствора адалимумаба может быть уменьшена при добавлении к нему аргинина, были проведены следующие эксперименты. В качестве контрольной группы, не содержащей гидрохлорид аргинина (ArgHCl), получали образцы, содержащие адалимумаб (100 мг/мл) и полисорбат 80 (1 мг/мл) или адалимумаб (50 мг/мл) и полисорбат 80 (1 мг/мл). В качестве экспериментальной группы получали образцы, содержащие гидрохлорид аргинина, путем постепенного увеличения концентрации гидрохлорида аргинина, добавляемого в каждый состав контрольной группы от 20 мМ до 180 мМ (конечная концентрация). рН всех образцов составлял приблизительно 5,2. Вязкости приготовленных образцов измеряли с использованием прибора mVROC от Rheosense. Результаты измерения вязкости представлены в таблице 12.
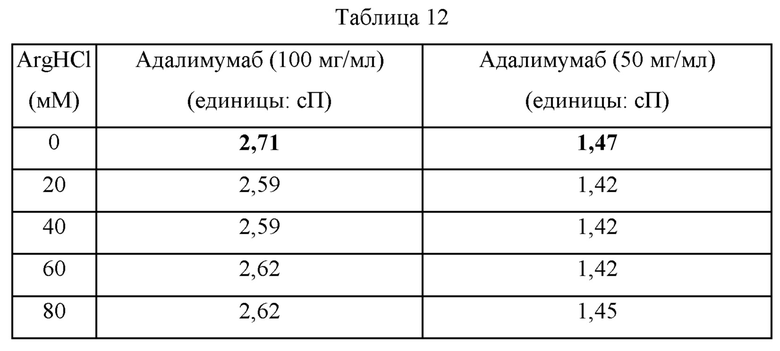
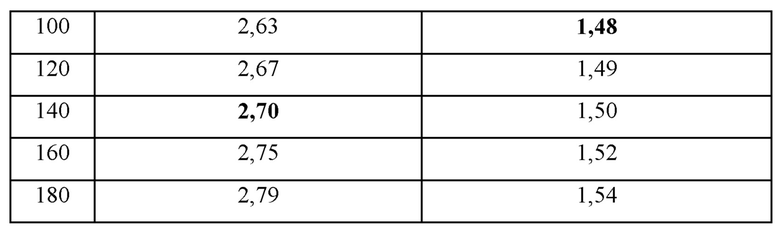
В вышеприведенной таблице 12, отражающей вязкости композиций, в которые добавляли адалимумаб (100 мг/мл), полисорбат 80 (1 мг/мл) и гидрохлорид аргинина (ArgHCl) в различных концентрациях, вязкость раствора, содержащего адалимумаб (100 мг/мл) и полисорбат 80 (1 мг/мл) без ArgHCl составляла 2,71 сП. Когда ArgHCl добавляли в раствор до конечной концентрации от 20 мМ до 120 мМ, тогда подтверждали, что вязкости этих композиций уменьшались по сравнению с вязкостью композиции, в которую ArgHCl не добавляли. В случае, где ArgHCl добавляли до конечной концентрации 140 мМ, вязкость композиции была близка вязкости в том случае, где ArgHCl не добавляли. В случаях, где ArgHCl добавляли до конечной концентрации 160 мМ или выше, действие, уменьшающее вязкость, не обнаруживали и вязкости были увеличены по сравнению с композицией, в которую ArgHCl не добавляли.
В случае композиций, содержащих адалимумаб (50 мг/мл) и полисорбат 80 (1 мг/мл), вязкость раствора, не содержащего ArgHCl, составляла 1,47 сП, и в случаях, где ArgHCl добавляли до концентрации от 20 мМ до 80 мМ, тогда вязкости находились в диапазоне от 1,42 до 1,45, таким образом, оказываясь меньше по сравнению с композицией, в которую ArgHCl не добавляли. В случаях, где ArgHCl добавляли до конечной концентрации 100 мМ, тогда вязкость была близка вязкости, где ArgHCl не добавляли, и в тех случаях, где ArgHCl добавляли до конечной концентрации 120 мМ или выше, тогда вязкости увеличивались по сравнению с тем случаем, где ArgHCl не добавляли.
Соответственно, подтвердили, что в случае раствора адалимумаба (100 мг/мл) вязкость может быть уменьшена путем добавления в него ArgHCl в концентрации 140 мМ или меньше, и в случае раствора адалимумаба (50 мг/мл) вязкость может быть уменьшена путем добавления в него ArgHCl в концентрации 100 мМ или меньше.
Пример 9
Эксперимент 1, подтверждающий действие буферов и солей в композициях адалимумаба
Для определения действий буферов и солей на стабильность адалимумаба получали образцы композиций без буферов и солей, и получали образцы композиций, в которых буфер или соль добавляли в вышеприведенные композиции, и эти композиции хранили при 40°С в течение 2 недель и 1 месяца. Стабильность этих образцов сравнивали при помощи SE-HPLC и измеряли рН каждого образца.
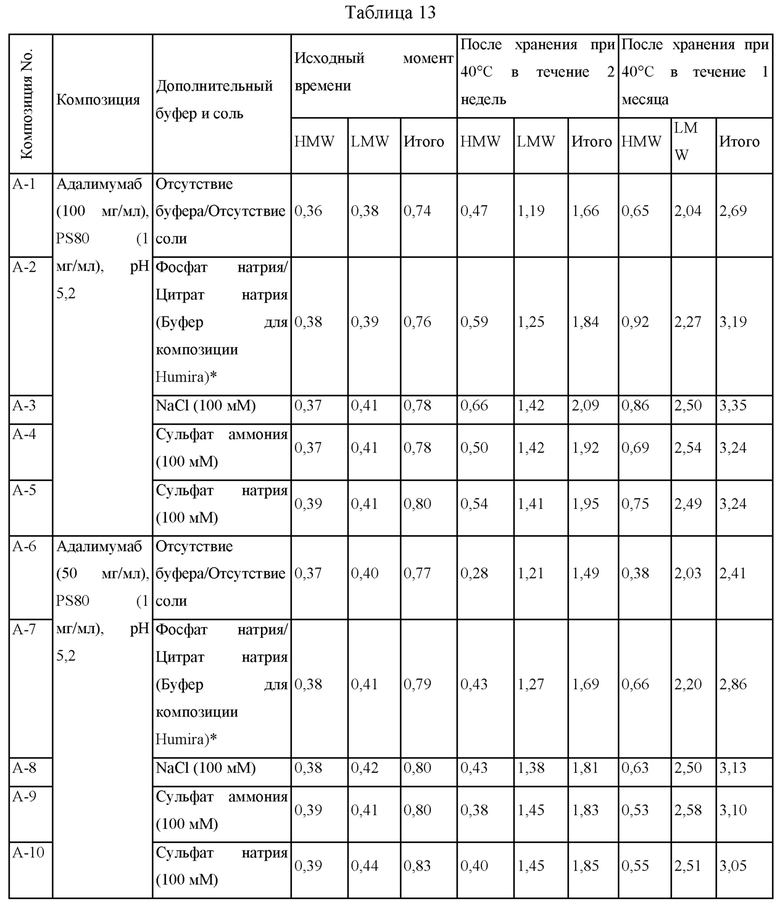

В таблице 13 представлены результаты анализа при помощи SE-HPLC композиций образцов в исходный для каждого образца момент времени, после хранения при 40°С в течение 2 недель и после хранения при 40°С в течение 1 месяца. Композицию А-1 получали таким образом, что она содержит адалимумаб (100 мг/мл) и PS80 (1 мг/мл), и композиции А-2 - А-5 получали таким образом, что они содержат буфер или соль в композиции А-1. Дополнительно, композиции А-6 - А-10 получали путем корректирования концентрации адалимумаба в композиции А-1 - А-5 до 50 мг/мл. Рассматривая результаты анализа при помощи SE-HPLC каждого из образцов, когда сравнивали композицию А-1 без буфера и композицию А-2 с буфером (или сравнивали композиции А-6 и А-7 с различными концентрациями адалимумаба), тогда обнаружили, что композиции без буфера демонстрировали меньшее увеличение HMW и LMW, таким образом, подтверждая, что эти композиции являются более стабильными.
Дополнительно, когда сравнивали композиции А-1 и А-6 и композиции, содержащие соль, включающую NaCl, сульфат аммония, сульфат натрия и т.п., тогда обнаружили, что композиции без соли демонстрировали меньшее увеличение HMW и LMW по сравнению с композициями с солью. Соответственно, подтвердили, что предпочтительно, чтобы композиции адалимумаба не содержали соль, исходя из аспекта стабильности.
Дополнительно, все из образцов поддерживали таким образом, чтобы они имели постоянный рН 5,2 до хранения, через 2 недели после хранения и 1 месяц после хранения. Соответственно, подтвердили, что адалимумаб в концентрации 50 мг/мл или более высокой, обладает достаточным собственным буферным действием, таким образом, не требуя применения буфера, и могут быть составлены композиции, обладающие улучшенной стабильностью, без использования буфера.
Пример 10
Эксперимент 2, подтверждающий влияние буферов и солей в композициях адалимумаба
Для определения действий буферов и солей на стабильность адалимумаба получали образцы композиций, состоящих из адалимумаба (100 мг/мл или 50 мг/мл), стабилизатора (сахароза (55 мг/мл) или глицин (160 мМ)), гидрохлорида аргинина (ArgHCl: 50 мМ), метионина (5 мМ) и полисорбата 80 (1 мг/мл), и получали образцы композиций, в которых буфер или соль добавлены в вышеприведенные композиции. Для сравнения получали образцы с композицией Humira®, содержащие адалимумаб (100 мг/мл) или адалимумаб (50 мг/мл), и каждую композицию заполняли в стеклянные шприцы в количестве 0,4 мл на шприц, хранили при 55°С в течение одной недели, и стабильность сравнивали при помощи SE-HPLC и измеряли рН. Подробная информация о каждой композиции и содержании мономеров до и после хранения при 55°С в течение 1 недели представлена в таблице 14 ниже.
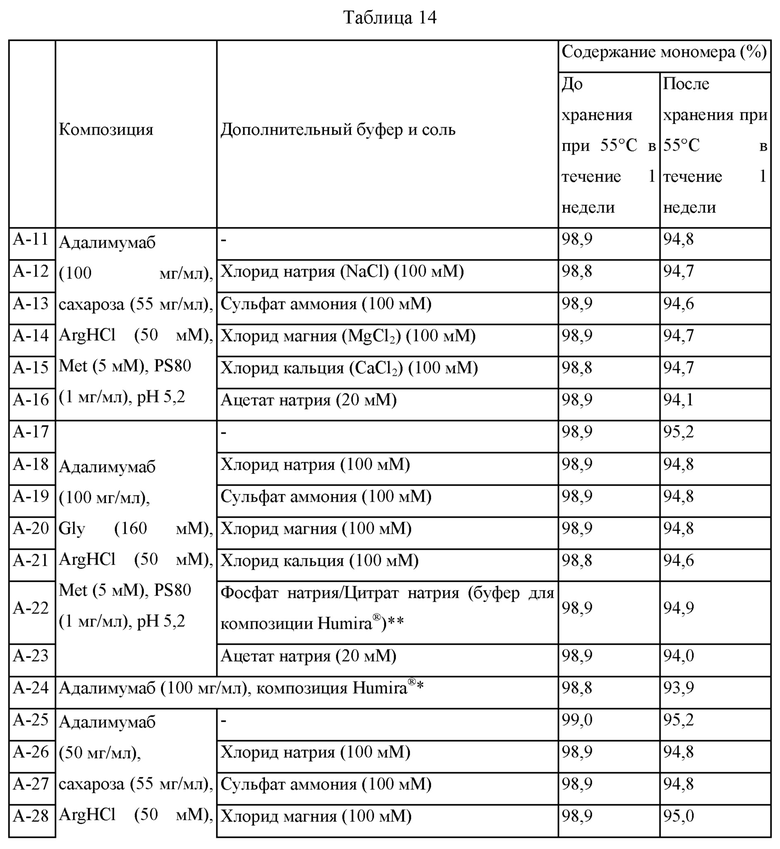

Во-первых, все из образцов поддерживали таким образом, чтобы они имели постоянный рН 5,2 до и после хранения при 55°С в течение 1 недели. Соответственно, подтвердили, что адалимумаб в концентрации 50 мг/мл или выше обладает достаточным собственным буферным действием в композициях и подобных им композициях, представленных в таблице 14 выше.
Как представлено в таблице 14 выше, содержание мономера в образцах было близким друг к другу, находясь в диапазоне от 98,8% до 99,0%. После хранения при 55°С в течение 1 недели было продемонстрировано, что содержание мономеров отличается между композициями. Содержание мономера в образце А-11 для композиции адалимумаба (100 мг/мл), сахарозы (55 мг/мл), ArgHCl (50 мМ), метионина (5 мМ) и полисорбата 80 (1 мг/мл) составило 94,8% после хранения. Однако в случае образцов А-12 - А-16, где использовали соли хлорида натрия, сульфата аммония, хлорида магния и хлорида кальция, или цитрата натрия в качестве буфера, содержания мономеров после хранения находились в диапазоне от 94,1% до 94,7%, будучи меньшей величиной по сравнению с содержанием в образце, имеющем состав, в котором соль и буфер не использовали. В случае образца А-17, когда Gly (160 мМ) использовали в качестве стабилизатора вместо сахарозы, тогда содержание мономера после хранения составило 95,2%; однако в случае образцов А-18 - А-23, когда использовали соли и буферы, тогда содержания мономера после хранения находились в диапазоне от 94,0% до 94,9%, таким образом, будучи меньше по сравнению с содержанием в образце, имеющем состав, в котором соль и буфер не использовали. Даже в том случае, когда композицию получали путем уменьшения содержания адалимумаба до 50 мг/мл, когда сахарозу использовали в качестве стабилизатора без использования соли и буфера (т.е. образец А-25), тогда содержание мономера после хранения составляло 95,2%, и когда глицин (Gly) использовали в качестве стабилизатора без использования соли и буфера (т.е. образец А-32), тогда содержание мономера после хранения составляло 95,6%. Тем не менее, когда дополнительные соль/буфер использовали в каждой из композиций, в случае композиций (образцы А-26 - А-31), в которых содержалась сахароза, тогда содержание мономеров после хранения находилось в диапазоне от 93,5% до 95,0%, и в случаях композиций (образцы А-33 - А-38), в которых содержался Gly, содержание мономеров после хранения находилось в диапазоне от 93,6% до 95,4%, таким образом, демонстрируя то, что содержание мономеров в композициях, в которых использовали дополнительную соль/буфер, было меньше по сравнению с содержанием в композициях, в которых соль и буфер не использовали. Соответственно, подтвердили, что, когда дополнительная соль и буфер не используются в композициях, в которых содержатся адалимумаб, аргинин, стабилизатор и поверхностно-активные вещества, тогда стабильность адалимумаба может быть улучшена, и что возможно получить композицию, обладающую улучшенной стабильностью, с использованием самого адалимумаба, обладающего собственным буферным действием, без использования дополнительного буфера.
Однако по сравнению с образцами А-24 и А-39, имеющими композицию Humira®, в котором содержание адалимумаба было тем же самым, содержание мономеров в композициях, в которых содержались соль и буфер, после хранения при 55°С в течение 1 недели было большим по сравнению с содержанием мономеров в образцах, имеющих композицию Humira®, после хранения при 55°С в течение 1 недели.
Соответственно, исходя из аспекта стабильности предпочтительно, чтобы дополнительную соль и буфер не использовали в композициях адалимумаба, в которых содержатся аргинин, поверхностно-активные вещества и стабилизаторы; тем не менее, подтвердили, что композиции, содержащие аргинин, поверхностно-активные вещества и стабилизаторы более стабильны по сравнению с имеющимися в продаже композициями Humira® независимо от того, содержат ли композиции дополнительную соль и буфер.
Пример 11
Эксперимент, подтверждающий стабилизирующее действие полиолов в композициях адалимумаба
Для сравнения стабилизирующего действия полиолов, которые используют для улучшения стабильности адалимумаба в растворе, раствор адалимумаба (112 мг/мл адалимумаба) и композицию, содержащую адалимумаб в концентрации 112 мг/мл и каждый из полиолов в концентрации 42 мг/мл, получали следующим образом. Содержание HMW, LMW и мономеров анализировали с использованием SE-HPLC после повторения процесса замораживания/оттаивания (FT) в течение 5 циклов и 10 циклов при -70°С и 5°С, соответственно.
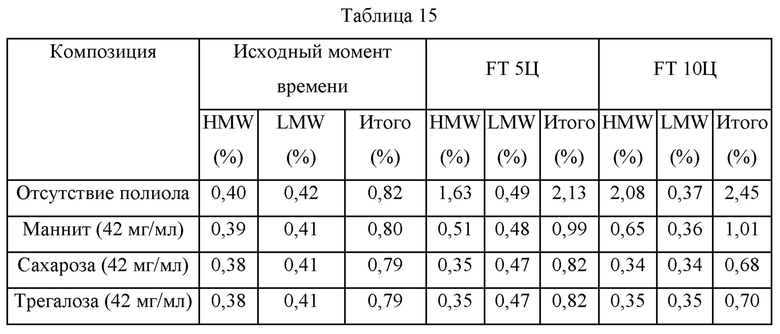
В таблице 15 представлены композиции образцов и результаты анализа при помощи SE-HPLC образцов в соответствии с моментами отбора образцов в тесте стабильности. В вышеприведенных результатах, когда каждый образец подвергали процессу повторного замерзания/оттаивания, увеличение HMW и LMW в композициях, в которые добавляли маннит, сахарозу или трегалозу, демонстрировало тенденцию к уменьшению по сравнению с композицией, в которую полиол не добавляли, таким образом, подтверждая присутствие стабилизирующего действия со стороны полиолов. Сравнивая стабилизирующее действие каждого полиола в зависимости от его типа, когда добавляли сахарозу или трегалозу, тогда содержание HMW и LMW было близко содержанию в образцах до того, как они претерпят процесс замораживания/оттаивания, и, дополнительно, представленная чистота близка чистоте до процесса замораживания/оттаивания даже после того, как они претерпят 10 циклов процесса замораживания/оттаивания, таким образом, подтверждая значительное стабилизирующее действие со стороны полиолов. Наоборот, в случае образца, содержащего маннит, когда образец подвергают процессу повторного замораживания/оттаивания, подтвердили, что содержание HMW демонстрирует тенденцию к увеличению, и чистота образца уменьшалась во время процесса замораживания/оттаивания. Соответственно, подтвердили, что сахароза и трегалоза обладают большим стабилизирующим действием по сравнению с маннитом.
Пример 12
Эксперимент по замораживанию/оттаиванию композиций адалимумаба для подтверждения и сравнения стабилизирующих действий аргинина, метионина, глицина и сахарозы
Для подтверждения действия аргинина, метионина, глицина и сахарозы на стабилизацию во время процесса замораживания/оттаивания концентрированных растворов, образцы получали в соответствии с представленным ниже. Каждый образец в количестве 1 мл добавляли во флакон из поликарбоната (5 мл), подвергали 5 циклам процесса замораживания/оттаивания во время приготовления и при -70°С и 5°С, соответственно, и анализировали с использованием SE-HPLC. Состав каждого образца и результаты SE-HPLC для каждого образца до и после процесса замораживания/оттаивания представлены ниже.
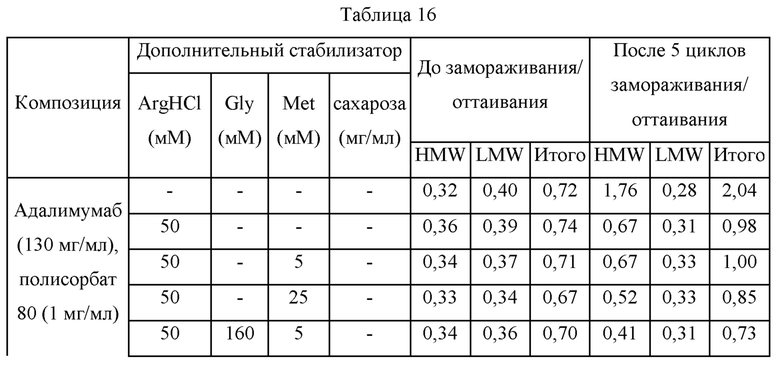
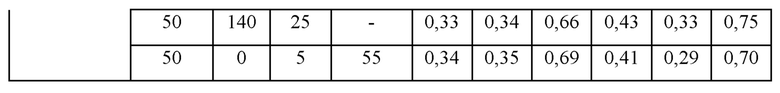
Получали образцы, содержащие адалимумаб (130 мг/мл) и полисорбат 80 (1 мг/мл) и содержащие дополнительный стабилизатор. Представленные содержания примесей в каждом из образцов до процесса замораживания/оттаивания близки друг другу в отношении как HMW, так и LMW. После процесса замораживания/оттаивания представленное содержание LMW было близким во всех из образцов; тем не менее, представленное содержание HMW варьировало в зависимости от типа и содержания дополнительного стабилизатора. В случае образца, в который дополнительный стабилизатор не добавляли, содержание HMW после 5 циклов процесса замораживания/оттаивания увеличивалось до 1,76%, тогда как в случае образца, содержащего гидрохлорид аргинина (50 мМ), содержание HMW после 5 циклов процесса замораживания/оттаивания значительно уменьшалось до 0,67%. В случае композиции, где метионин добавляли дополнительно к гидрохлориду аргинина (50 мМ), дополнительное уменьшение содержания HMW не подтверждалось тогда, когда композиция содержала метионин в концентрации 5 мМ, тогда как содержание HMW дополнительно уменьшалось на приблизительно 0,52% тогда, когда композиция содержала метионин в концентрации 25 мМ. В случаях, когда глицин или сахарозу добавляли дополнительно к гидрохлориду аргинина и метионину, подтвердили, что содержание HMW после 5 циклов процесса замораживания/оттаивания дополнительно уменьшалось, находясь в диапазоне от 0,41% до 0,43%, и как композиция, содержавшая глицин, так и композиция, содержавшая сахарозу, демонстрировали подобную стабильность. Соответственно, подтвердили, что все из метионина, аргинина, глицина и сахарозы вносят вклад в стабильность адалимумаба. Дополнительно, подтвердили, что похожие уровни стабильности могут быть достигнуты тогда, когда композиции получали при помощи подходящих комбинаций с использованием полиола или аминокислоты в качестве стабилизатора.
Пример 13
Сравнительные эксперименты по стабильности между композициями, содержащими глицин, композициями, содержащими сахарозу, и имеющимися в продаже композициями Humira®
Для сравнения стабильности композиций, содержащих глицин, композиций, содержащих сахарозу, и имеющихся в продаже композиций Humira®, получали образцы, содержащие адалимумаб в концентрации 100 мг/мл или 50 мг/мл, гидрохлорид аргинина (ArgHCl) в концентрации 50 мМ, полисорбат 80 (PS80) в концентрации 1 мг/мл и метионин в концентрации 5 мМ, и затем дополнительные образцы получали путем добавления глицина, комбинаций глицина и метионина или сахарозы в качестве дополнительного стабилизатора в вышеприведенные композиции. Дополнительно, получали образцы, содержащие имеющиеся в продаже композиции Humira® и содержащие адалимумаб в концентрации 100 мг/мл или 50 мг/мл. Каждый из вышеприведенных образцов заполняли в стеклянные шприцы объемом 1 мл в количестве 0,4 мл на шприц. После хранения каждого шприца при 40°С в течение 4 недель содержания HMW и LMW в каждом образце анализировали при помощи SE-HPLC. Состав каждой композиции и результаты SE-HPLC представлены в таблице 17 ниже.
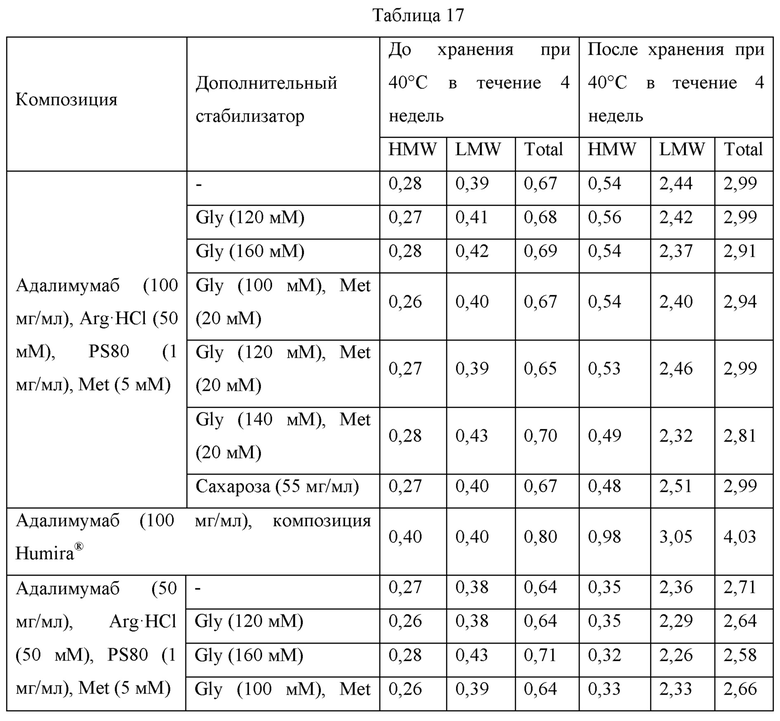
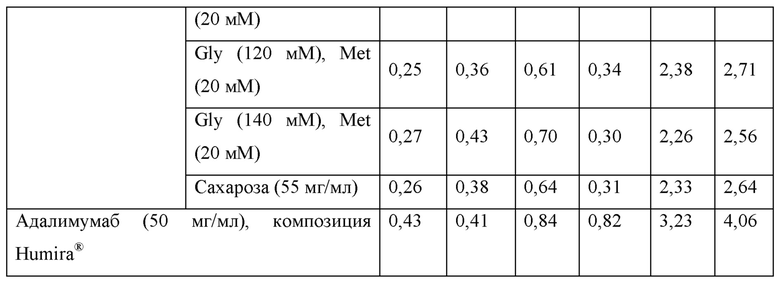
Образцы, имеющие композиции, содержащие гидрохлорид аргинина, полисорбат 80, метионин и адалимумаб, демонстрировали похожие уровни стабильности до хранения при 40°С в течение 4 недель. В то же время, образцы, содержащие имеющиеся в продаже композиции Humira®, демонстрировали более высокое содержание HMW приблизительно на 0,1% после получения и сравнения с другими образцами. В отношении суммы содержаний HMW и LMW после хранения все из образцов, содержащие гидрохлорид аргинина, демонстрировали относительно низкие значения: то есть от 2,81% до 2,99%, когда адалимумаб содержался в концентрации 100 мг/мл; и от 2,56% до 2,71%, когда адалимумаб содержался в концентрации 50 мг/мл. Тем не менее, в случае имеющихся в продаже композиций Humira®, сумма содержаний HMW и LMW после хранения составляла 4,03%, когда адалимумаб содержался в концентрации 100 мг/мл; и 4,06%, когда адалимумаб содержался в концентрации 50 мг/мл, таким образом, демонстрируя более высокие уровни содержаний HMW и LMW по сравнению с образцами, имеющими композиции, содержащие аргинин. Соответственно, подтвердили, что композиции, содержащие комбинации добавок, описанных в примерах настоящего изобретения; то есть композиции, содержащие аргинин, и композиции, содержащие полиол или аминокислоту в качестве дополнительного стабилизатора, обладают превосходством над имеющимися в продаже композициями Humira® в отношении стабильности.
Пример 14
Сравнительные эксперименты по стабильности композиций адалимумаба в зависимости от концентрации адалимумаба, сахарозы, глицина, лейцина, метионина, хлорида натрия (NaCl) и аргинина
Для сравнения стабильности композиций адалимумаба образцы различных композиций получали путем комбинирования адалимумаба, гидрохлорида аргинина (ArgHCl), хлорида натрия (NaCl), полисорбата 80 (PS80), метионина (Met), сахарозы, глицина (Gly) и лейцина (Leu). Дополнительно, получали образцы, содержащие имеющиеся в продаже композиции Humira®, и содержащие адалимумаб в концентрации 100 мг/мл или 50 мг/мл для задач сравнения. Каждую композицию заполняли в стеклянный шприц объемом 1 мл в количестве 0,4 мл, хранили при 40°С в течение 4 недель, и содержание мономеров до и после хранения анализировали при помощи SE-HPLC. Композиции и результаты SE-HPLC представлены ниже.
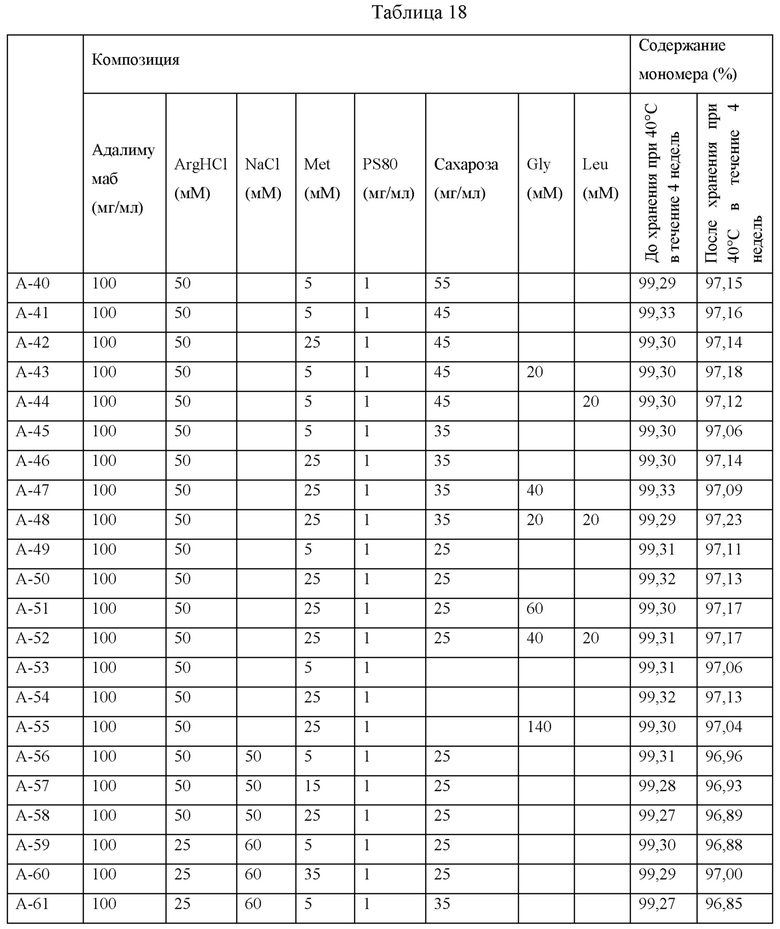
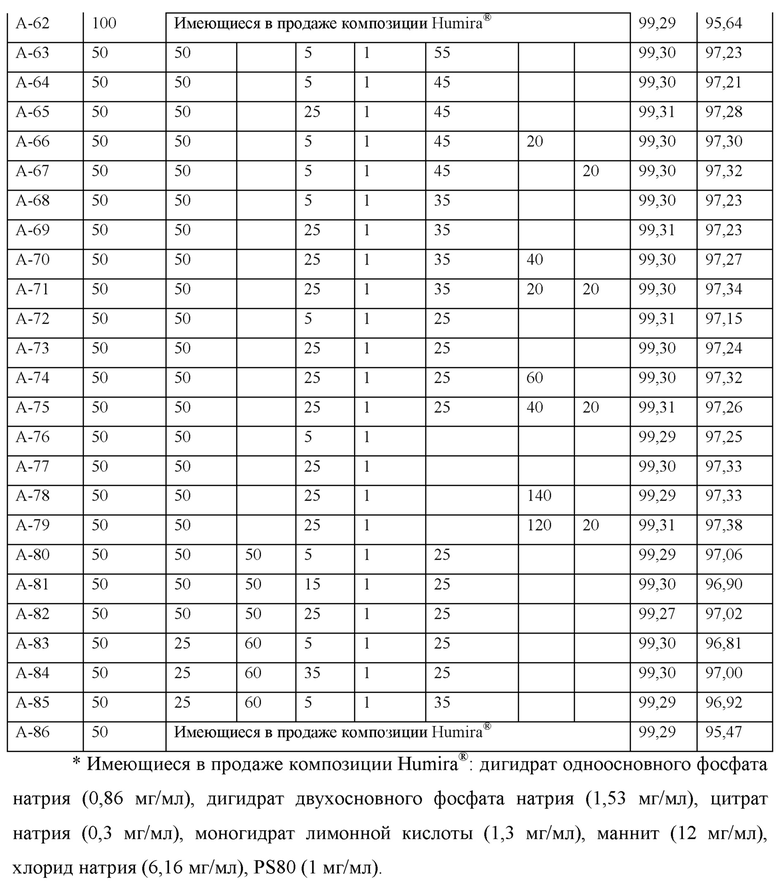
Содержание мономеров во всех образцах до хранения при 40°С было близко друг другу, находясь в диапазоне от 99,27% до 99,33% независимо от композиции. В отношении содержания мономеров в образцах (А-40 - А-61), содержащих адалимумаб (100 мг/мл), после хранения при 40°С в течение 4 недель в случае образцов (А-40 - А-55), в которых хлорид натрия не содержался, содержание мономеров находилось в диапазоне от 97,04% до 97,23%, тогда как в случае образцов, содержащих хлорид натрия (А-56 - А-61, за исключением А-62, которая представляла собой композицию Humira®), содержание мономеров находилось в диапазоне от 96,85% до 97,00%, таким образом, демонстрируя слегка меньшее содержание мономеров по сравнению с композициями, в которых хлорид натрия не содержался. Однако отличие в содержании мономеров между этими образцами в зависимости от содержания хлорида натрия, сахарозы, метионина, глицина и лейцина после хранения при 40°С в течение 4 недель является относительно незначительным, и представленное содержание мономеров в композициях (А-40 - А-61) было выше, чем 95,64%, содержание мономера в А-62, которая представляет собой композицию Humira®, содержащую адалимумаб в той же самой концентрации, по меньшей мере на 1%.
В том случае, когда адалимумаб содержался в концентрации 50 мг/мл, тогда результаты анализа были теми же самыми как в композициях, в которых адалимумаб содержался в концентрации 100 мг/мл. В отношении содержания мономеров в образцах, содержащих адалимумаб (50 мг/мл) (А-63 - А-85) после хранения при 40°С в течение 4 недель, в случае образцов А-63 - А-79, в которых хлорид натрия не содержался, содержание мономеров находилось в диапазоне от 97,15% до 97,38%, тогда как в случае образцов, содержащих хлорид натрия (А-80 - А-85, за исключением А-86, которая представляет собой композицию Humira®), содержание мономеров находилось в диапазоне от 96,81% до 97,06%, таким образом, демонстрируя слегка меньшее содержание мономеров по сравнению с теми композициями, в которых хлорид натрия не содержался. Тем не менее, представленное отличие в содержании мономеров между этими образцами в зависимости от содержания хлорида натрия, сахарозы, метионина, глицина и лейцина после хранения при 40°С в течение 4 недель является относительно незначительным, и представленное содержание мономеров в композициях (А-63 - А-85) было выше, чем 95,47%, содержание мономера в А-86, которая представляет собой композицию Humira®, содержащую адалимумаб в той же самой концентрации, по меньшей мере на 1%.
Соответственно, подтвердили, что комбинации добавок и их композиций, описанные в примерах в соответствии с настоящим изобретением, то есть, композиции, содержащие аргинин, превосходят имеющиеся в продаже композиции Humira® в отношении стабильности.
Исходя из вышеизложенного, специалист в данной области техники, к которой относится настоящее изобретение, сможет понять, что настоящее изобретение может быть воплощено в других конкретных формах без модификации технических концепций или существенных характеристик настоящего изобретения. В этой связи раскрытые здесь примеры воплощений приведены исключительно для иллюстративных задач и их не следует рассматривать как ограничивающие объем настоящего изобретения. Наоборот, предполагается, что настоящее изобретение охватывает не только примеры воплощений, но также различные альтернативы, модификации, эквиваленты и другие воплощения, которые могут быть включены в пределы сущности и объема настоящего изобретения, как определено приложенной формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Препараты однодоменных антигенсвязывающих молекул | 2013 |
|
RU2683861C2 |
| УСТОЙЧИВАЯ ЖИДКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2018 |
|
RU2773747C2 |
| СТАБИЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2017 |
|
RU2736830C2 |
| СОВМЕСТНЫЕ СОСТАВЫ АНТИ-LAG3 АНТИТЕЛА И АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2822192C2 |
| ЖИДКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2015 |
|
RU2719431C2 |
| Водная фармацевтическая композиция рекомбинантного моноклонального антитела к ФНОα | 2016 |
|
RU2665966C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АДАЛИМУМАБ | 2014 |
|
RU2664736C2 |
| Водная фармацевтическая композиция рекомбинантного моноклонального антитела к ФНОа | 2017 |
|
RU2764521C2 |
| НОВЫЕ СТАБИЛЬНЫЕ КОМПОЗИЦИИ ДЛЯ FXIA АНТИТЕЛ | 2018 |
|
RU2775692C2 |
| СОСТАВЫ АНТИТЕЛ К RSV И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2807524C2 |
Группа изобретений относится к области фармацевтики, а именно к жидкой композиции антитела против TNF-α и способу ее получения. Жидкая композиция содержит антитело против TNF-α, стабилизатор, представляющий собой полиол, аминокислоту, отличающуюся от аргинина, или их комбинацию, поверхностно-активное вещество, метионин и аргинин в определенных концентрациях, причем жидкая композиция не содержит дополнительный буфер. Способ получения жидкой композиции включает смешивание антитела против TNF-α, стабилизатора, поверхностно-активного вещества, метионина и аргинина. Группа изобретений обеспечивает улучшенную стабильность антитела против TNF-α в жидкой композиции, содержащей стабилизатор, поверхностно-активное вещество и аргинин, без дополнительного буфера, за счет добавления антиоксиданта – метионина. 2 н. и 11 з.п. ф-лы, 18 табл., 2 ил., 14 пр.
1. Жидкая композиция антитела против TNF-α, содержащая антитело против TNF-α в концентрации от 50 мг/мл до 130 мг/мл, стабилизатор, поверхностно-активное вещество в концентрации от 0,5 мг/мл до 1,5 мг/мл, метионин в концентрации от 2,5 мМ до 35 мМ и аргинин в концентрации от 20 мМ до 120 мМ,
где стабилизатор представляет собой полиол, аминокислоту, отличающуюся от аргинина, или их комбинацию,
где полиол представлен в концентрации от 25 мг/мл до 82,5 мг/мл, и где аминокислота, отличающаяся от аргинина, представлена в концентрации от 10 мМ до 160 мМ,
причем жидкая композиция не содержит дополнительный буфер.
2. Жидкая композиция по п. 1, где полиол выбран из сахарозы, трегалозы, полиэтиленгликоля (PEG) и их комбинации.
3. Жидкая композиция по п. 1, где аминокислота выбрана из глицина, лейцина, изолейцина, фенилаланина, пролина и их комбинации.
4. Жидкая композиция по п. 1, где стабилизатор выбран из группы, состоящей из:
(1) сахарозы или трегалозы;
(2) PEG, имеющего среднечисловую молекулярную массу от 200 до 600, или PEG, имеющего среднечисловую молекулярную массу от 1000 до 8000;
(3) глицина или лейцина; и
(4) комбинации по меньшей мере двух из (1) - (3).
5. Жидкая композиция по п. 1, где поверхностно-активное вещество представляет собой неионное поверхностно-активное вещество.
6. Жидкая композиция по п. 1, где поверхностно-активное вещество представляет собой полисорбат или полоксамер.
7. Жидкая композиция по п. 6, где поверхностно-активное вещество представляет собой полисорбат 80, полисорбат 20 или полоксамер 188.
8. Жидкая композиция по п. 1, где аргинин представлен в форме соли.
9. Жидкая композиция по п. 8, где аргинин представлен в форме гидрохлорида аргинина.
10. Жидкая композиция по п. 1, где антитело против TNF-α представляет собой адалимумаб.
11. Жидкая композиция по п. 1, где антитело против TNF-α представлено в концентрации от 75 мг/мл до 130 мг/мл.
12. Жидкая композиция по любому из пп. 1-11, имеющая pH от 4 до 6.
13. Способ получения жидкой композиции по п. 1, включающий смешивание антитела против TNF-α, стабилизатора, поверхностно-активного вещества, метионина и аргинина.
| WO 2015151115 A1, 08.10.2015 | |||
| US 2016304599 A1, 20.10.2016 | |||
| WO 2016162819 A, 13.10.2016 | |||
| WO 2016066688 A1, 06.05.2016 | |||
| WO 2015177057 A1, 26.11.2015 | |||
| WO 2016120413 A1, 04.08.2016 | |||
| WO 2012065072 A2, 18.05.2012. |
Авторы
Даты
2021-10-04—Публикация
2018-03-16—Подача