Изобретение относится к области генной инженерии и биотехнологии растений, и может быть использовано в лесном хозяйстве, строительстве, целлюлозно-бумажной промышленности и других отраслях народного хозяйства, использующих осину в качестве сырья.
Леса играют большую роль в экономике России как источник древесины и многих видов сырья. Большую площадь занимают хвойные леса - 77%, мягколиственные леса занимают 21%, твердолиственные - всего 2%. Однако по данным состояния использования лесов РФ за 2011-2012 гг. объем использования мягколиственных пород (береза, осина, липа, тополь, ива и ольха) оставил 33% от общего, что говорит об их активном использовании (Ежегодный доклад о состоянии и использовании лесов Российской Федерации за 2012 г. Министерство природных ресурсов и экологии Российской Федерации. Опубликовано 28 октября 2013, с. 123). Такой высокий процент использования связан с гораздо более широким спектром применения древесины мягколиственных по сравнению с древесиной хвойных пород. Такое использование объясняется обессмоленностью и более низким содержанием лигнинов в древесине мягколиственных, что делает ее удобным сырьем для целлюлозно-бумажной, химической промышленностей и других отраслей индустрии. Однако при таком высоком уровне заготовки древесины мягколиственных пород возможно образование проблемы нехватки первичного сырья, необходимо повышение эффективности и рациональности использования древесины. Поэтому восстановление лесов должно производиться с использованием плантационного способа ведения лесного хозяйства, используя для этих целей высокопродуктивные формы лесных пород с новыми ценными признаками.
Осина - мягколиственная древесная порода, которая является ценной лесной породой благодаря хорошей скорости роста и нетребовательности к условиям произрастания.
Целью предлагаемого изобретения является внедрение в дикий генотип осины Pt (Populus tremula L.) трансгена, изменяющего содержание целлюлозы в древесине, что позволит быстрее получить необходимый для использования растительный материал. Экономия достигается за счет снижения трудозатрат на выращивания растений с необходимыми качествами древесины.
Поставленная цель достигается за счет изменения структуры клеточной стенки растений. Ксилоглюкан является полисахаридом гемицеллюлозы растительной клеточной стенки, который поперечно сшивает прилегающие микрофибриллы целлюлозы, обеспечивая формирование прочного каркаса (Bauman M.J., Eklo G., Michel M., Kallas T.T., Teeri M., Czjzek, H. Brumer. Structural Evidence for the Evolution of Xyloglucanase Activity from Xyloglucan Endo-Transglycosylases // Biological Implications for Cell Wall Metabolism. The Plant Cell. - 2007. - V. 19. - P. 1947-1963). Разделение микрофибрилл при росте клетки растения обеспечивают ферменты, расщепляющие ксилоглюканы и ослабляющие связывание между микрофибриллами (Takeda Т., Furuta Y., Awano Т, Mizuno K., Mitsuishi Y., Hayashi Т.. Suppression and Acceleration of Cell Elongation by Integration of Xyloglucans in Pea Stem Segments // PNAS. - 2002. - V. 99 (13). - P. 9055-9060). Ксилоглюканаза - один из таких ферментов, относящийся к группе карбогидраз, который, гидролизуя ксилоглюканы, разрушает поперечную «сшивку» целлюлозных микрофибрилл. В настоящее время суперэкспрессия карбогидраз, расщепляющих ксилоглюкан, рассматривается как перспективный способ изменения содержания целлюлозы. В работе Park с соавторами (Park Y.W., Baba K., Furutab Y., Iidab I., Sameshimac K., Araid M., Hayashi T. Enhancement of growth and cellulose accumulation by overexpression of xyloglucanase in poplar // FEBS Letters. - 2004. - V.564. - P. 183-187) показано, что у тополя белого (Populus alba), трансформированного геном ксилоглюканазы AaXEG2 из Aspergillus aculeatus, наблюдалось увеличение содержания целлюлозы во вторичной ксилеме трансгенных растениях на 11% по сравнению с контролем. Значительное увеличение целлюлозы по сравнению с нетрансгенным контролем для растений осины с гиперэкспрессией эндо-1,4-β-глюканазы (cell) из Arabidopsis thaliana отмечено Shani с соавторами (Shani Z., Dekel М., Tsabary G., Goren R., Shoseyov O. Growth enhancement of transgenic poplar plants by overexpression of Arabidopsis thaliana endo-1,4-в-glucanase (cell) // Molecular Breeding. - 2004. - V. 14. - P. 321-330). Описанные ими растения имели увеличение содержания целлюлозы на 10,8%.
Суть изобретения состоит в том, что в геном осины был интегрирован химерный ген XegA из гриба Penicillium canescens с сигнальным пептидом целлюлазы тополя белого (SEQ ID NO: 1, SEQ ID NO: 2). Для трансформации осины использовали штамм Agrobacterium tumefaciens СВЕ21 с Ti-плазмидой рСВЕ21. Агробактериальный штамм содержал бинарный вектор pBI-Xeg, содержащий ген XegA под контролем 35S промотора.
Анализ известных биоинженерных продуктов, проведенный по научно-технической и патентной документации, показал, что совокупность существенных признаков заявляемого продукта неизвестна из уровня техники, следовательно, продукт соответствует условию патентоспособности изобретения как «новизна».
Предлагаемый продукт получают следующим образом.
Агробактериальная трансформация осины:
1. В 50 мл жидкой среды Luria-Bertoni (LB) (10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl), дополнительно содержащую 50 мг/л канамицина, добавляли 100 мкл суспензии агробактериальных клеток и инкубировали при 27-28°С в течение суток. Суспензию наросших клеток осаждали центрифугированием, промывали и ресуспендировали в 50 мл жидкой среды MS (Murashige Т. & Skoog F., A revised medium for rapid growth and bioassays with tobacco tissue culture // Physiol. Plant, 15 (1962) 473-497).
2. В чашки Петри заливали по 25 мл агаризованной модифицированной среды MS (соли MS+20 мМ KNO3+10 мМ NH4NO3) с добавлением 0,5 мг/л 2,4-дихлорфеноксиуксусной кислоты (2,4-Д).
3. Нарезали экспланты из междоузлий микрорастений осины длиной 5-10 мм.
4. Экспланты заливали агробактериальной суспензией в среде MS и инкубировали 20 минут при комнатной температуре.
5. Затем экспланты подсушивали их на фильтровальной бумаге и помещали на модифицированную среду MS.
6. Экспланты инкубировали на свету в течение 48 часов, после чего промывали их в дистиллированной воде с добавлением цефотаксима (1 г/л) в течение 20-30 минут.
7. Отмытые экспланты подсушивали на фильтрах и раскладывали на модифицированную среду MS, содержащую 0,5 мг/л зеатина, 30 мг/л канамицина и 500 мг/л цефотаксима. На данной среде производилась регенерация и селекция трансформантов.
Регенерировавшие растения, которые демонстрировали нормальный рост в присутствии селективного агента канамицина, проверяли на наличие вставки renaXegA, используя метод полимеразной цепной реакции (ПЦР), также регенераты оценивали на наличие агробактериальной контаминации. Для этого из микрорастений выделяли тотальную растительную ДНК по стандартной методике Rogers и Benedich (Rogers S.O., Bendich A.J. (1994). Extraction of DNA from plant, fungal and algal tissues. In:, Gelvin SB, Schilperoort RA (eds) Plant Molecular Biology Manual. Boston, MA: Kluwer Academic Publishers, D 1: 1-8).
ПЦР анализ ДНК отдельных регенерантов проводили в следующих условиях: реакционная смесь содержала 16 мМ (NH4)2SO4, 0,01% бычий сывороточный альбумин, 200 мкМ каждого дНТФ, 0,4 мкМ каждого праймера, 0,05 ед./мкл Taq-полимеразы, 1-5 нг/мкл растительной ДНК. Реакции проводили на амплификаторе MJ MiniTM Gradient Thermal Cycler (BIO-RAD). Режим амплификации: 3 мин денатурация при 96°С, 45 сек денатурация при 94°С, 45 сек отжиг при 58°С, элонгация 1 мин при 72°С, 5 мин достройка при 72°С, 31 цикл амплификации. Все линии осины в первую очередь анализировались на наличие агробактериальной контаминации. Геномная ДНК анализировалась на присутствие агробактериального гена VirB. Для этого бралась пара праймеров Vir-Bl (SEQ ID NO: 3) и VirB2 (SEQ ID NO: 4). Размер амплифицируемого фрагмента 670 п.н. Результаты анализа показали, что все двадцать пять анализируемых линий не были контаминированы агробактериями (фиг. 1).
После этого все двадцать пять линий, проверенные на агробактериальную контаминацию ранее, были проанализированы на наличие вставки гена XegA с использованием пары праймеров xeg-up (SEQ ID NO: 5) и xeg-low (SEQ ID NO: 6). Размер амплифицируемого фрагмента 762 п.н. Анализ препаратов геномной ДНК регенерировавших растений показал, что во всех линиях содержалась вставка теш XegA (фиг.2).
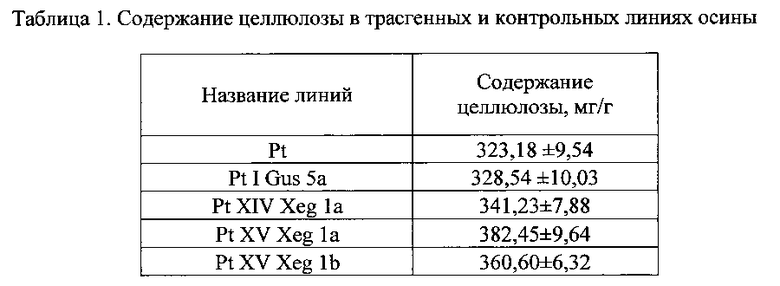
Трансформанты с подтвержденной вставкой тепа. XegA были размножены в условиях in vitro и после укоренения адаптированы к естественным условиям окружающей среды. Через 8 месяцев после адаптации, трансгенные линии осины, а также контрольная нетрансформированная линия (Pt) и трансформированный контроль с репортерным геном gus (PtIGus5a) были проанализированы на содержание целлюлозы. Используя азотно-спиртовой метод (Оболенская А.В., Ельницкая З.П., Леонович А.А. Лабораторные работы по химии древесины // М.: Экология. - 1991. - С.320), было определено содержание целлюлозы в трансгенных линиях PtXIVXeg1a, PtXVXeg1a и PtXVXeg1b. Содержание целлюлозы во всех линиях было выше, чем в контрольных, на 6%, 15% и 10% соответственно (таблица 1).
Таким образом, были получены трансгенные линии осины, обладающие повышенным содержанием целлюлозы в древесине.
Перечень последовательностей:
Целевой ген - химерный ген из сигнального пептида целлюлазы тополя белого (фрагмент 1) и кодирующей последовательности ксилюглюканазы Penicillium canescens (фрагмент 2).
SEQ ID No: 1. Фрагмент 1
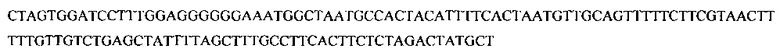 SEQ ID No: 2. Фрагмент 2
SEQ ID No: 2. Фрагмент 2
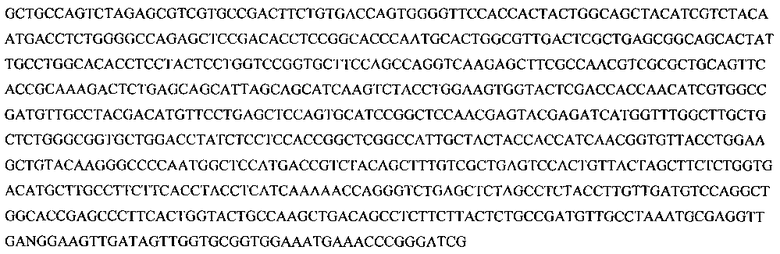
SEQ ID No: 3. Нуклеотидная последовательность праймера Vir-B1:
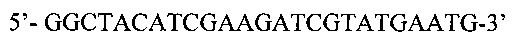
SEQ ID No: 4. Нуклеотидная последовательность праймера Vir-B2:
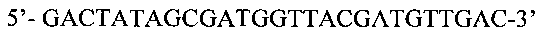
SEQ ID No: 5. Нуклеотидная последовательность праймера Xeg-up:
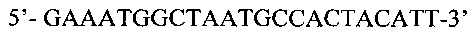
SEQ ID No: 6. Нуклеотидная последовательность праймера Xeg-low:
Краткое описание чертежей
Фиг. 1. Результаты ПЦР-анализа двадцати пяти трансгенных линий осины на присутствие агробактериального гена VirB
Размер ожидаемого амплифицируемого фрагмента 670 п.о. М - молекулярный маркер, total СВЕ21К - геномная ДНК агробактерий (положительный контроль), Pt - нетрансформированное растение (отрицательный контроль), Н2О - вода, Gus5a - трансформированное растение (отрицательный контроль),141а-168b - трансгенные линии осины.
Фиг. 2. Результаты ПЦР-анализа двадцати пяти трансгенных линий осины на присутствие тепа XegA
Размер ожидаемого амплифицируемого фрагмента 762 п.о. М - молекулярный маркер, pBI-Xeg - плазмидная ДНК (положительный контроль), Pt - нетрансформированное растение (отрицательный контроль), Н2О - вода, Gus5a - трансформированное растение (отрицательный контроль), 141а-168b - трансгенные линии осины.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРАНСГЕННОЕ РАСТЕНИЕ ОСИНЫ С ПОНИЖЕННОЙ СКОРОСТЬЮ РАЗЛОЖЕНИЯ ДРЕВЕСИНЫ | 2015 |
|
RU2603081C2 |
| ТРАНСГЕННОЕ РАСТЕНИЕ ОСИНЫ, УСТОЙЧИВОЕ К ГЕРБИЦИДАМ | 2013 |
|
RU2627189C2 |
| ТРАНСГЕННОЕ РАСТЕНИЕ ОСИНЫ С ПОВЫШЕННОЙ ПРОДУКТИВНОСТЬЮ И МОДИФИЦИРОВАННОЙ ДРЕВЕСИНОЙ | 2013 |
|
RU2593722C2 |
| ТРАНСГЕННОЕ РАСТЕНИЕ БЕРЕЗЫ С ПОВЫШЕННОЙ ПРОДУКТИВНОСТЬЮ | 2013 |
|
RU2593721C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫХ ДРЕВЕСНЫХ РАСТЕНИЙ | 2013 |
|
RU2582263C2 |
| Триплоидная трансгенная линия березы с повышенной скоростью роста | 2013 |
|
RU2616288C2 |
| Трансгенное растение березы с ранним цветением | 2015 |
|
RU2619173C1 |
| ТРАНСГЕННОЕ РАСТЕНИЕ БЕРЕЗЫ С УСТОЙЧИВОСТЬЮ К ГЕРБИЦИДАМ | 2013 |
|
RU2587623C2 |
| Способ получения генетически модифицированных древесных растений | 2015 |
|
RU2619175C1 |
| МУТАНТНАЯ ФОРМА КСИЛОГЛЮКАНАЗЫ ИЗ ASPERGILLUS CERVINUS С ПОВЫШЕННОЙ ПО СРАВНЕНИЮ С ФЕРМЕНТОМ ДИКОГО ТИПА ТЕРМОСТАБИЛЬНОСТЬЮ, РЕКОМБИНАНТНЫЙ ШТАММ ESCHERICHIA COLI, ПРОДУЦИРУЮЩИЙ ЭТУ КСИЛОГЛЮКАНАЗУ, И СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА МУТАНТНОЙ КСИЛОГЛЮКАНАЗЫ ИЗ ASPERGILLUS CERVINUS НА ОСНОВЕ ЭТОГО ШТАММА | 2022 |
|
RU2815837C1 |

Изобретение относится к области биохимии, в частности к трансгенному растению осины с повышенным содержанием целлюлозы по сравнению с нетрансформированным растением, содержащему XegA трансген, который кодирует фермент ксилоглюканазу гриба Penicillium canescens с сигнальным пептидом целлюлазы тополя белого. Изобретение позволяет эффективно получать трансгенное растение осины с повышенным содержанием целлюлозы. 2 ил., 1 табл.
Трансгенное растение осины с повышенным содержанием целлюлозы по сравнению с нетрансформированным растением, содержащее XegA трансген, который кодирует фермент ксилоглюканазу гриба Penicillium canescens (SEQ ID No: 2. 5′-GCTGCCAGTCTA
GAGCGTCGTGCCGACTTCTGTGACCAGTGGGGTTCCACCACTACTGGCAGCTACATCGTCTACAATGACCTCTGGGGCCAGAGCTCCGACACCTCCGGCACCCAATGCACTGGCGTTGACTCGCTGAGCGGCAGCACTATTGCCTGGCACACCTCCTACTCCTGGTCCGGTGCTTCCAGCCAGGTCAAGAGCTTCGCCAACGTCGCGCTGCAGTTCACCGCAAAGACTCTGAGCAGCATTAGCAGCATCAAGTCTACCTGGAAGTGGTACTCGACCACCAACATCGTGGCCGATGTTGCCTACGACATGTTCCTGAGCTCCAGTGCATCCGGCTCCAACGAGTACGAGATCATGGTTTGGCTTGCTGCTCTGGGCGGTGCTGGACCTATCTCCTCCACCGGCTCGGCCATTGCTACTACCACCATCAACGGTGTTACCTGGAAGCTGTACAAGGGCCCCAATGGCTCCATGACCGTCTACAGCTTTGTCGCTGAGTCCACTGTTACTAGCTTCTCTGGTGACATGCTTGCCTTCTTCACCTACCTCATCAAAAACCAGGGTCTGAGCTCTAGCCTCTACCTTGTTGATGTCCAGGCTGGCACCGAGCCCTTCACTGGTACTGCCAAGCTGACAGCCTCTTCTTACTCTGCCGATGTTGCCTAAATGCGAGGTTGANGG AAGTTGATAGTTGGTGCGGTGGAAATGAAACCCGGGATCG-3′) с сигнальным пептидом целлюлазы тополя белого (SEQ ID No: 1.5′-CTAGTGGATCCTTTGGAGGGGGGAAAT GGCTAATGCCACTACATTTTCACTAATGTT GCAGTTTTTCTTCGTAACTTTTTGTTGTCTGAGCTATTT TAGCTTTGCCTTC ACTTCTCT AG ACTATGCT-3′).
| VIDYAGINA E | |||
| et al., Overexpression of the recombinant xyloglucanase sp-Xeg from Penicillium canescens accelerates growth and rooting of transgenic aspen plants, Natural Science, 2013, Vol.5, No.6A, 36-43;ШЕСТИБРАТОВ К.А | |||
| и др., ФЕНОТИПИЧЕСКОЕ ПРОЯВЛЕНИЕ ЭКСПРЕССИИ ГЕНА КСИЛОГЛЮКАНАЗЫ ИЗ Penicillium canescens В ТРАНСГЕННЫХ РАСТЕНИЯХ ОСИНЫ, Журнал |
Авторы
Даты
2016-10-10—Публикация
2014-12-10—Подача