Область техники, к которой относится изобретение
Настоящее изобретение в общем относится к области терапевтических средств и способов, в частности к области лечения рака предстательной железы (простаты).
Уровень техники
Упоминание и обсуждение в настоящей заявке документов, которые по-видимому опубликованы ранее, не обязательно означает признание того, что данный документ является частью предшествующего уровня техники или относится к общеизвестным познаниям.
Рак предстательной железы (простаты) в настоящее время является наиболее распространенной формой рака среди мужчин. Предстательная железа размером с грецкий орех вырабатывает жидкость, которая является компонентом спермы. Предстательная железа имеет две или больше долей или сегментов, окруженных наружным слоем ткани. Предстательная железа располагается перед прямой кишкой и чуть ниже мочевого пузыря и окружает мочеиспускательный канал.
Встречаемость рака простаты наиболее высока в северо-западной части Европы и в США. Процесс роста опухоли обычно происходит в течение длительного времени. В норме рак простаты является мягкой формой рака. Так, большинство мужчин с диагнозом рака простаты выживают, и только у меньшей части мужчин встречается более агрессивная форма рака простаты, которая дает метастазы на ранней стадии. Эта форма рака простаты поддается лечению только, если диагноз поставлен на ранней стадии, еще до того, как рак распространится на внекапсулярные ткани.
Современная диагностика и мониторинг рака простаты могут осуществляться путем измерения концентрации специфического антигена простаты (PSA) в крови у пациента. Если концентрация PSA заметно повышена при нескольких последовательных измерениях, выполненных в различные моменты времени, то существует вероятность наличия рака простаты. В этот момент может проводиться биопсия для проверки на наличие рака простаты.
Белок PSA (также известный как калликреин III) состоит из одной цепи в 237 аминокислот и вырабатывается в секреторных клетках предстательной железы. Эти секреторные клетки встречаются по всей предстательной железе. PSA является признанным и тщательно изученным маркером в отношении рака простаты. По сравнению со здоровыми клетками, уровень PSA понижен в злокачественных клетках и повышен в гиперплазированных клетках. Следовательно, это противоречит тому, что концентрация PSA повышена в крови у мужчин, страдающих раком простаты. Однако одним из объяснений может быть то, что у злокачественных клеток нарушена структура клеток, поэтому они более проницаемы для PSA.
Другой важной сериновой протеазой, которая может подойти для будущей терапии рака простаты, является железистый (или гландуллярный) калликреин 2 (hK2) человека. Кодирующий hK2 ген располагается на хромосоме 19, вместе с геном, кодирующим PSA. В основном hK2 экспрессируется в ткани предстательной железы, так же, как и PSA. В предстательной железе PSA присутствует в виде неактивной проформы и активируется под действием пептидазы hK2. Иммуногистохимические исследования в отношении hK2 показали, что hK2 экспрессируется в зависимости от уровня дифференцировки. Это означает, что hK2 экспрессируется в большей степени в слабодифференцированной ткани типа ткани, пораженной раком простаты, и в меньшей степени в сильнодифференцированной ткани типа ткани, пораженной доброкачественной гиперплазией простаты (BPH), которая является еще одним распространенным заболеванием предстательной железы.
Современные способы лечения рака простаты представлены хирургией (например, радикальная простатэктомия), лучевой терапией (включая брахитерапию и наружную лучевую терапию), сфокусированным ультразвуком высокой интенсивности (HIFU), химиотерапией и пероральными химиотерапевтическими препаратами, криохирургией (замораживание опухоли), гормональной терапией (типа антиандрогенной терапии), кастрацией или комбинацией вышеперечисленного.
Однако большая часть этих способов лечения (хирургия и наружная лучевая терапия) применима только (или преимущественно) для лечения первичных опухолей и крупных метастазов. Химиотерапия применяется при диссеминировании рака, но у большинства таких пациентов она дает лишь паллиативный эффект и/или продлевает выживание. Следовательно, необходимы другие или дополнительные способы лечения, чтобы добиться значительного улучшения при диссеминированных злокачественных заболеваниях, особенно в случае микрометастазов.
Терапия типа иммунотерапии или радиоиммунотерапии с использованием наводящих молекул типа антител и фрагментов могла бы дать возможность лечения диссеминированных заболеваний.
Таким образом, существует потребность в новых терапевтических средствах и методах для лечения рака простаты, особенно в случаях диссеминированного заболевания, метастазов и микрометастазов.
Сущность изобретения
Соответственно, настоящее изобретение направлено на смягчение, ослабление или устранение одного или нескольких из вышеприведенных недостатков в данной области поодиночке или в любой комбинации и решает по крайней мере указанные выше проблемы, предусматривая способ лечения в соответствии с прилагаемой формулой изобретения.
Первый аспект настоящего изобретения предусматривает средство, содержащее или состоящее из связывающей молекулы со специфичностью к белку калликреина, для применения при лечении рака простаты.
Иными словами, первый аспект настоящего изобретения касается применения средства, содержащего или состоящего из связывающей молекулы со специфичностью к белку калликреина, для применения при изготовлении лекарственных препаратов для лечения рака простаты.
Соответственно, первый аспект также предусматривает способ лечения рака простаты у пациентов, который включает стадию введения терапевтически эффективного количества средства, содержащего или состоящего из связывающей молекулы со специфичностью к белку калликреина.
Под "связывающей молекулой" подразумеваются все типы химических соединений (например, олигонуклеотиды, полинуклеотиды, полипептиды, пептидомиметики и небольшие соединения), которые способны специфически связываться с белком калликреина. Предпочтительно связывающая молекула способна избирательно (т.е. предпочтительно) связываться с белком калликреина в физиологических условиях.
Как указано выше, средства по изобретению могут содержать или состоять из любого подходящего химического соединения, представляющего собой связывающую молекулу со специфичностью к белку калликреина.
Методы, которые подходят для выявления взаимодействия между исследуемым химическим соединением и белком калликреина, хорошо известны в данной области. Например, можно использовать методы ультрафильтрации с масс-спектрометрией с ионизацией распылением / HPLC или другие физические и аналитические методы. Кроме того, можно использовать методы резонансного переноса энергии флуоресценции (FRET), в которых можно измерить связывание двух флуоресцентно меченых соединений по измерению взаимодействия флуоресцентных меток, когда они находятся в непосредственной близости друг от друга.
Альтернативные методы выявления связывания белка калликреина с такими макромолекулами, как ДНК, РНК, белки и фосфолипиды, включают метод поверхностного плазмонного резонанса, к примеру, как описано в Plant et al., 1995, Analyt Biochem. 226(2), 342-348. В таких методах могут использоваться полипептиды, помеченные, к примеру, радиоактивной или флуоресцентной меткой.
Еще один способ идентификации химических соединений, способных связываться с белком калликреина, состоит в том, что белок калликреина подвергается обработке соединением и выявляется и/или измеряется любое связывание соединения с данным белком калликреина. Можно определить константу связывания соединения с белком калликреина. Подходящие методы выявления и/или (количественного) измерения связывания соединения с белком калликреина хорошо известны специалистам и могут выполняться, к примеру, с помощью метода, подходящего для высокопроизводительной обработки, к примеру, метода на основе чипа. Новая технология, называемая VLSIPS™, позволяет производить чрезвычайно маленькие чипы, содержащие сотни тысяч и больше различных молекулярных зондов. В таких биологических чипах зонды располагаются в массивах, и каждому зонду присваивается определенное место. Уже получены такие биологические чипы, в которых каждое положение имеет размеры, к примеру, в десять микрон. Такие чипы можно использовать для определения того, что данные молекулы взаимодействуют с каким-либо зондом на чипе. После проведения взаимодействия массива с молекулами-мишениями при выбранных условиях сканирующее устройство может проверить каждое положение в массиве и определить, происходило ли взаимодействие данной молекулы с зондом в этом положении.
Другой способ идентификации соединений со сродством связывания к белку калликреина представлен дрожжевой двухгибридной системой, в которой полипептиды по изобретению могут использоваться для "захвата" тех белков, которые связываются с белком калликреина. Дрожжевая двухгибридная система описана в Fields & Song, Nature 340: 245-246 (1989).
В одном воплощении связывающая молекула может содержать или состоять из полипептида.
Например, связывающая молекула может содержать или состоять из антитела или его антиген-связывающего фрагмента со специфичностью связывания с белком калликреина, либо варианта, слитого белка или производного данного антитела или антиген-связывающего фрагмента, либо слитого белка данного варианта или производного, сохраняющего специфичность связывания с белком калликреина.
Таким образом, в одном воплощении первого аспекта настоящего изобретения, связывающей молекулой может быть антитело или его антиген-связывающий фрагмент.
Под "антителом" подразумеваются практически интактные молекулы антител, а также химерные антитела, гуманизированные антитела, человеческие антитела (при этом по меньшей мере одна аминокислота подверглась мутации по сравнению с природными антителами человека), одноцепочечные антитела, диатела, биспецифичные антитела, тяжелые цепи антител, легкие цепи антител, гомодимеры и гетеродимеры тяжелых и/или легких цепей антител и их антиген-связывающие фрагменты и производные.
Под "антиген-связывающим фрагментом" подразумеваются функциональные фрагменты антител, которые способны связываться с белком калликреина. Сродство связывания различных производных антител, приведенных выше, можно определить по методу Скетчарда при фиксированной концентрации иммобилизованного фрагмента антитела и различных концентрациях индикатора Eu-PSA. С другой стороны, сродство связывания можно определить по технологии поверхностного плазмонного резонанса (SPR) на приборе Biacore. Методы анализа дополнительно описаны в примере 8.
В частности, антиген-связывающий фрагмент выбирается из группы, состоящей из Fv-фрагментов (например, одноцепочечных Fv и связанных дисульфидной связью Fv), Fab-подобных фрагментов (например, Fab-фрагментов, Fab'-фрагментов и F(ab)2-фрагментов), одиночных вариабельных доменов (например, доменов VH и VL) и доменных антител (dAbs, включая одиночные и двойные форматы [т.е. dAb-линкер-dAb]).
Есть несколько преимуществ в использовании фрагментов антител, а не целых антител. Меньшие размеры фрагментов могут приводить к улучшению фармакологических свойств типа лучшего проникновения в твердые ткани и/или более быстрого клиренса в крови, что позволит повысить терапевтическое соотношение. Кроме того, такие антиген-связывающие фрагменты антител, как Fab, Fv, scFv и dAb, могут экспрессироваться и секретироваться из микроорганизмов типа Е. coli, что позволяет легко получать большие количества таких фрагментов.
Также в рамки изобретения входят модифицированные варианты антител и их антиген-связывающих фрагментов, например, модифицированные путем ковалентного присоединения полиэтиленгликоля или другого подходящего полимера (см. ниже).
Способы получения антител и фрагментов антител хорошо известны в данной области. Например, антитела могут быть получены любым из нескольких способов, в которых применяется индукция вырабатывания молекул антител in vivo, скрининг библиотек иммуноглобулинов (Orlandi et al., 1989, Proc. Natl. Acad. Sci. USA. 86: 3833-3837; Winter et al., 1991, Nature 349: 293-299) или получение молекул моноклональных антител в культуре клеточных линий. Они включают, без ограничения, метод гибридомы, метод гибридомы с В-клетками человека и метод гибридомы с вирусом Эпштейна-Барра (EBV) (Kohler et al., 1975, Nature 256: 495-497; Kozbor et al., 1985, J. Immunol. Methods 81: 31-42; Cote et al., 1983, Proc. Natl. Acad. Sci. USA 80: 2026-2030; Cole et al., 1984, Mol. Cell. Biol. 62: 109-120).
Подходящие моноклональные антитела к выбранным антигенам могут быть получены по известным методикам, к примеру, изложенным в "Monoclonal Antibodies: А Manual of Techniques", H. Zola (CRC Press, 1988) и в "Monoclonal Hybridoma Antibodies: Techniques and Applications", J.G.R Hurrell (CRC Press, 1982).
Точно так же фрагменты антител могут быть получены хорошо известными в данной области методами (к примеру, см. Harlow & Lane, 1988, "Antibodies: A Laboratory Manual", Cold Spring Harbor Laboratory, New York). Например, фрагменты антител по настоящему изобретению могут быть получены путем протеолитического гидролиза антител или путем экспрессии в Е. coli или клетках млекопитающих (например, в культуре клеток яичников китайского хомячка или в других системах экспрессии белков) ДНК, кодирующей данный фрагмент. С другой стороны, фрагменты антител могут быть получены путем расщепления пепсином или папаином целых антител стандартными методами.
Специалистам в данной области известно, что для терапии или диагностики людей могут использоваться человеческие или гуманизированные антитела. Гуманизированные формы антител не человека, а других (например, мыши) представляют собой генетически сконструированные химерные антитела или фрагменты антител, содержащие минимальные участки, происходящие не из антител человека. Гуманизированные антитела включают такие антитела, у которых определяющие комплементарность участки антитела человека (реципиентного антитела) заменены остатками из определяющей комплементарность области от другого вида, чем человек (донорского антитела), как-то мыши, крысы или кролика, обладающими требуемой функциональностью. В некоторых случаях каркасные участки Fv антител человека заменяются соответствующими остатками не от человека. Гуманизированные антитела также могут содержать остатки, которые не встречаются ни в реципиентом антителе, ни в импортируемой определяющей комплементарность области или каркасных последовательностях. В общем, гуманизированные антитела обычно содержат практически все из по меньшей мере одного, а чаще двух вариабельных доменов, у которых все или практически все определяющие комплементарность участки соответствуют таковым у антитела не от человека, а все или практически все каркасные участки соответствуют таковым у соответствующей консенсусной последовательности человека. Гуманизированные антитела оптимально также содержат по меньшей мере часть константной области антител типа области Fc, которая обычно происходит из антител человека (к примеру, см. Jones et al, 1986, Nature 321: 522-525; Riechmann et al., 1988, Nature 332: 323-329; Presta, 1992, Curr. Op. Struct. Biol. 2: 593-596).
Методы гуманизирования чужих антител хорошо известны в данной области. Обычно гуманизированные антитела содержат один или несколько аминокислотных остатков, введенных в них из других источников, чем человек. Эти чужие аминокислотные остатки, которые часто называют импортированными остатками, как правило, берут из импортируемого вариабельного домена. Гуманизация в основном может проводиться так, как описано (к примеру, см. Jones et al., 1986, Nature 321: 522-525; Reichmann et al., 1988, Nature 332: 323-327; Verhoeyen et al., 1988, Science 239: 1534-15361; US 4,816,567) путем замены определяющих комплементарность участков на соответствующие определяющие комплементарность участки грызунов. Соответственно, такие гуманизированные антитела являются химерными антителами, у которых существенно меньшая часть чем интактный вариабельный домен человека заменена на соответствующую последовательность из другого вида, чем человек. На практике гуманизированные антитела, как правило, являются такими антителами человека, у которых некоторые остатки из определяющих комплементарность участков и возможно некоторые остатки из каркасных участков заменены остатками из аналогичных участков у антител грызунов.
Антитела человека также можно идентифицировать различными известными методами, в том числе библиотеки фагового дисплея (к примеру, см. Hoogenboom & Winter, 1991, J. Mol. Biol. 227: 381; Marks et al., 1991, J. Mol. Biol. 222: 581; Cole et al., 1985, In: Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, pp. 77; Boerner et al., 1991, J. Immunol. 147: 86-95).
После того, как получены подходящие антитела, их можно протестировать на активность, к примеру, методом ELISA.
В альтернативном воплощении первого аспекта изобретения, связывающая молекула содержит или состоит из неиммуноглобулиновой связывающей молекулы, например, как описано в Skerra, Curr Opin Biotechnol. 2007, 18(4): 295-304.
В другом альтернативном воплощении связывающая молекула содержит или состоит из аптамера. Например, она может содержать или состоять из пептидного аптамера или из нуклеинового аптамера (см. Hoppe-Seyler & Butz, 2000, J Mol Med. 78(8): 426-30; Bunka DH & Stockley PG, 2006, Nat Rev Microbiol. 4(8): 588-96; и Drabovich et al., 2006, Anal Chem. 78(9): 3171-8).
В еще одном альтернативном воплощении связывающая молекула содержит или состоит из небольшой химической молекулы. Такие молекулы со свойствами связывания калликреина могут быть идентифицированы путем скрининга коммерческих библиотек небольших соединений (к примеру, фирмы ChemBridge Corporation, San Diego, USA).
Соответственно, связывающая молекула, которая присутствует в средстве согласно первому аспекту настоящего изобретения, специфически связывается с белком калликреина. При этом выражение "специфически связывается" означает, что связывающая молекула избирательно связывается с намеченным белком калликреина в предпочтении к другим белкам, необязательно включая другие белки калликреина. Специалистам должны быть хорошо известны разнообразные способы оценки специфичности связывания связывающей молекулы с мишенью. Например, если связывающая молекула является антителом или на основе антитела, то ее способность к специфическому связыванию с белком калликреина можно определить методом иммуноанализа типа ELISA, радиоиммуноанализа и др.
В одном воплощении принимается, что связывающая молекула специфически связывается с белком калликреина, если она связывается с белком калликреина при иммуноанализе и/или в физиологических условиях (типа условий в предстательной железе или других участках для лечения, как изложено здесь) со сродством связывания больше чем 1×105, 1×106, 1×107, 2×107, 1×108, 2×108, 1×109, 2×109, 1×1010, 2×1010, 3×1010, 1×1011 или больше, как-то в пределах от 1×105 до 3×1010 или больше.
Связывающая молекула, используемая в первом аспекте настоящего изобретения, может обладать специфичностью к белку калликреина человека. Белок калликреина человека представляет собой сериновую протеазу, принадлежащую к семейству генов тканевых калликреинов человека, которое состоит из по меньшей мере 15 представителей (Hsieh ML, Cancer Res. 1997, 57: 2651-6). Калликреины являются термоустойчивыми гликопротеинами, состоящими из одной полипептидной цепи с м.в. в пределах 27-40 кДа.
Связывающая молекула, используемая в первом аспекте настоящего изобретения, может обладать специфичностью к белку калликреина, выбранному из группы, состоящей из специфического антигена простаты (PSA; hK3, калликреин-3 человека) и гландулярного калликреина человека (hK2).
В одном воплощении связывающая молекула обладает специфичностью к PSA. Термин PSA служит для обозначения всех известных форм PSA, к примеру, свободного PSA, предшественников PSA, форм PSA с внутренними разрывами, низкомолекулярного свободного PSA, свободного PSA со стандартной молекулярной массой, неактивного зрелого PSA, усеченных форм PSA, гликозилированных вариантов PSA, BPSA, неактивного про-PSA и всяческих комплексов PSA типа PSA, связанного с α1-антихимотрипсином (ACT), ингибитором α1-протеазы (API) и α2-макроглобулином (AMG). Типичная первичная аминокислотная структура PSA представлена на фиг. 14 (см. SEQ ID NO: 16).
Секретируемый из раковых клеток PSA находится в более активном состоянии, чем PSA, секретируемый из пораженной ВРН ткани. Во внеклеточной жидкости PSA может подвергаться протеолитическому расщеплению, что приводит к потере активности и образованию комплексов. Таким образом, в объем настоящего изобретения также входит введение метки в такие соединения или молекулы, как ACT, API и AMG, связанные или комплексированные с PSA.
В одном предпочтительном воплощении связывающая молекула обладает специфичностью к свободной (то есть некомплексированной) форме PSA по сравнению с комплексированной формой PSA. Связывающие молекулы со специфичностью к свободной форме PSA могут обладать специфичностью связывания к эпитопу, который экспонирован у свободной формы PSA, но не экспонирован у комплексированной формы PSA, типа конформационного (т.е. нелинейного) эпитопа. К примеру, такой конформационный эпитоп образуется из аминокислотных остатков, входящих в состав калликреиновой петли, окружающей каталитическую расщелину PSA, и может включать в себя триаду активного сайта из His41, Asn96 и Ser189. Насчет дальнейшего обсуждения и раскрытия многочисленных подходящих эпитопов на PSA см. Leinonen et al., Clinical Chemistry 48: 12, 2208-2216 (2002), которая включена сюда путем ссылки.
Если связывающая молекула, используемая в первом аспекте настоящего изобретения, обладает специфичностью к PSA, то она может конкурировать за связывание с PSA (типа свободной формы PSA) или пептидом, содержащим активный эпитоп PSA при связывании со связывающей молекулой, с антителом, выбранным из группы, состоящей из PSA30, 4D4, 5C3 и 5A10 и их антиген-связывающих фрагментов. Дальнейшее обсуждение таких антител можно найти в Pettersson et al., Clin. Chem., 41: 10, 1480-1488 (1995); Nilsson et al., Brit. J. Cancer, 75: 6, 789-797 (1997); Leinonen et al., Clinical Chemistry 48:12, 2208-2216 (2002); Väisänen et al., Anal. Chem., 78: 7809-7815 (2006); Evans-Axelsson et al., Cancer Biother. Radiopharm. 27:4, 243-51; EP 1320756 B1; и US 2004/101914, содержание которых включено сюда путем ссылки.
Аминокислотные последовательности тяжелой и легкой цепи, входящих в состав типичного антитела 5A10 против PSA, приведены ниже (при этом последовательности CDR подчеркнуты).
Тяжелая цепь 5А10
EVQLVESGPGILQPSQTLSLTCSFSGFSLSTTGMGVSWIRQPSGKGLEWLAHLYWDEDKRYNPSLKSRLTISEDSSRNQVFLKITSVGPADSATYYCARKGYYGYFDYWGQGTALTVSS [SEQ ID NO: 1]
Легкая цепь 5А10
DIVMTQSQKFMSTSVGDRVSVTCKASQNVNTDVAWYQQKPGQSPKALIFSTSYRSSGVPDRFTGSGSGTDFTLTITNVQSEDLAEYFCQQYSNYPLTFGAGTKVDLN [SEQ ID NO: 2]
В этом контексте термин "конкурирует" означает то, что присутствие средства, содержащего связывающую молекулу, при конкурентном анализе вместе с контрольным антителом, выбранным из числа PSA30, 4D4, 5С3 и 5А10, может понизить уровень детектируемого связывания контрольного антитела с PSA (типа свободного PSA) на 1%, 2%, 3%, 4%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или 100% (например, если средство и контрольное антитело присутствуют при тестировании в эквимолярном количестве, при этом необязательно тестирование проводится в физиологических условиях). Такой анализ может проводиться методом иммунорадиометрического анализа (IRMA), как описано в примере 9.
Если связывающая молекула, используемая в первом аспекте настоящего изобретения, обладает специфичностью к PSA, то она может содержать один или несколько определяющих комплементарность участков (CDRs) антитела, выбранного из группы, состоящей из PSA30, 4D4, 5С3 и 5А10 (которые выделены подчеркиванием выше).
Как хорошо известно в данной области, полные антитела содержат шесть CDRs, три из которых присутствуют в вариабельной области легкой (VL) цепи, а другие три присутствуют в вариабельной области тяжелой цепи (VH).
Связывающие молекулы не обязательно должны содержать все шесть CDRs какого-либо из этих антител для того, чтобы сохранить антиген-связывающую активность, хотя в одном воплощении связывающая молекула может содержать все шесть CDRs из антитела, выбранного из группы, состоящей из PSA30, 4D4, 5С3 и 5А10.
В качестве альтернативы связывающая молекула может содержать менее шести CDRs, как-то:
- пять CDRs (т.е. 3 CDRs из области VH или VL, 2 CDRs из другой вариабельной области);
- четыре CDRs (т.е. 3 CDRs из области VH или VL, 1 CDR из другой вариабельной области; либо по 2 CDRs из каждой из областей VH и VL);
- три CDRs (т.е. все 3 CDRs из одной области VH или VL и ни одного из другой; либо 2 CDRs из области VH или VL, 1 CDR из другой вариабельной области);
- два CDRs (т.е. два CDRs из одной области VH или VL и ни одного из другой; либо по 1 CDR из каждой из областей VH и VL); или
- один CDR из любой из областей VH и VL,
из антитела, выбранного из группы, состоящей из PSA30, 4D4, 5C3 и 5A10.
Хорошо известно, что три или меньше участков CDR (в некоторых случаях всего лишь один CDR или его часть) способны сохранять антиген-связывающую активность того антитела, из которого они происходят:
Laune et al. (1997), JBC, 272: 30937-44 - показано, что целый ряд гексапептидов, полученных из CDR, проявляют антиген-связывающую активность (см. реферат), и отмечено, что синтетические пептиды из полного одиночного CDR проявляют сильную связывающую активность (см. стр. 30942, правая колонка);
Monnet et al. (1999) JBC, 274: 3789-96 - показано, что целый ряд 12-мерных пептидов и связанных с ними каркасных участков обладают антиген-связывающей активностью (см. реферат), и отмечено, что CDR3-подобный пептид сам по себе способен связывать антиген (см. стр. 3785, левая колонка);
Qiu et al. (2007) Nature Biotechnology, 25: 921-9 - показано, что молекула, состоящая из двух связанных CDRs, способна связывать антиген (см. реферат и стр. 926, правая колонка);
Ladner et al. (2007) Nature Biotechnology, 25: 875-7 - это обзорная статья, в которой изложена работа Qiu et al. (выше) с комментарием, что молекулы, содержащие два CDRs, способны сохранять антиген-связывающую активность (см. стр. 875, правая колонка);
Heap et al. (2005) J. Gen. Virol., 86: 1791-1800 - сообщается, что "микроантитело" (молекула, содержащая один CDR) способно связывать антиген (см. реферат и стр. 1791, левая колонка), и показано, что циклический пептид из антитела против HIV обладает антиген-связывающей активностью и функцией;
Nicaise et al. (2004) Protein Science, 13: 1882-91 - показано, что одиночный CDR может придавать антиген-связьшающую активность и сродство к своему антигену лизоциму;
Vaughan and Sollazzo (2001) Combinatorial Chemistry & High Throughput Screening, 4: 417-430 - это обзорная статья, в которой описаны минитела, содержащие менее трех участков CDR. Например, на стр. 418 (правая колонка - 3 Our Strategy for Design) описано минитело, содержащее только гипервариабельные участки H1 и Н2 CDR, встроенные в каркасные участки. Минитело описано, как способное связываться с мишенью;
Quiocho (1993) Nature, 362: 293-4 - еще одна статья обзорного типа, в которой представлена сводка по технологии минител (т.е. миниатюрных антител - в данном случае менее трех CDRs);
Pessi et al. (1993) Nature, 362: 367-9 и Bianchi et al. (1994), J. Mol. Biol., 236: 649-59 - эти работы приведены в обзоре Vaughan и Sollazzo и в них более подробно описаны минитела H1 и H2 и их свойства;
Gao et al. (1994) J. Biol. Chem., 269: 32389-93 - отмечается, что полная цепь VL (включая все три CDRs) обладает высоким сродством к своему субстрату, вазоактивному кишечному пептиду, как свидетельство того, что не обязательно иметь обе цепи VH и VL.
Эти документы были опубликованы еще до даты приоритета настоящей заявки и поэтому должны были быть доступны специалистам тогда, когда осуществлялось настоящее изобретение. В них представлены четкие данные о том, что молекулы, содержащие не все шесть CDRs, могут сохранять антиген-связывающие свойства тех антител, из которых они происходят.
В одном предпочтительном воплощении, если связывающая молекула, используемая в первом аспекте настоящего изобретения, обладает специфичностью к PSA, то связывающая молекула представляет собой антитело либо его антиген-связывающий фрагмент или производное, содержащее все 6 CDRs типичного антитела 5A10 против PSA.
В альтернативном воплощении, если связывающая молекула, используемая в первом аспекте настоящего изобретения, обладает специфичностью к PSA, то связывающая молекула может содержать или состоять из антитела, выбранного из группы, состоящей из PSA30, 4D4, 5C3 и 5A10 и их антиген-связывающих фрагментов.
В другом воплощении первого аспекта настоящего изобретения связывающая молекула обладает специфичностью к гландулярному калликреину человека (hK2).
Термин hK2 служит для обозначения всех изомерных форм hK2 и любых молекул или белков в комплексе с hK2. Типичная последовательность hK2 описана как Transcript: KLK2-201 (ENST00000325321), продукт гена ENSG00000167751, и приведена в сводной базе данных, которая находится по следующему адресу во всемирной паутине: ensembl.org/Homo_sapiens/Transcript/Sequence_Protein?g=ENSG00000167751; r=19:51376689-51383822; t=ENST00000325321 и имеет следующую последовательность:

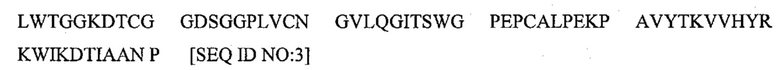
Большая часть hK2 в семенной жидкости неактивна и находится в комплексе с ингибиторным белком С (PCI). Возможно, что hK2 образует комплексы и с другими ингибиторами внеклеточных протеаз. Опыты in vitro показали, что hK2 может связываться с α2-антиплазмином (α2-АР), ACT, AMG, антитромбином III (ATIII), инактиватором C1 и ингибитором-1 активатора плазминогена (PAI-1).
Таким образом, в объем настоящего изобретения также входит введение метки в такие соединения, молекулы, белки или вещества, как PCI, α2-антиплазмин (α2-АР), ACT, AMG, антитромбин III (ATIII), инактиватор C1 и ингибитор-1 активатора плазминогена (PAI-1), связанные или комплексированные с PSA.
В одном воплощении связывающая молекула может обладать специфичностью к свободной (то есть некомплексированной) форме hK2 по сравнению с комплексированной формой hK2. Связывающие молекулы со специфичностью к свободной форме hK2 могут обладать специфичностью связывания к эпитопу, который экспонирован у свободной формы hK2, но не экспонирован у комплексированной формы hK2, который может быть линейным или же конформационным (т.е. нелинейным) эпитопом. К примеру, связывающая молекула может обладать специфичностью к такому эпитопу, который включает один или несколько аминокислотных остатков, входящих в состав каталитической расщелины hK2, которая выходит на поверхность у свободного hK2, но не выходит у комплексированной формы типа той формы, которая присутствует в семенной жидкости при комплексировании hK2 с PCI. Картирование эпитопов у hK2 описано в Väisänen et al., Clinical Chemistry 50: 9, 1607-1617 (2004), содержание которой включено сюда путем ссылки.
Если связывающая молекула, используемая в первом аспекте настоящего изобретения, обладает специфичностью к hK2, то она может конкурировать за связывание с hK2 или пептидом, содержащим активный эпитоп hK2 при связывании со связывающей молекулой, с антителом, выбранным из группы, состоящей из 11B6 и 7G1. Дальнейшее обсуждение таких антител можно найти в Väisänen et al., Clinical Chemistry, 50:9, 1607-1617 (2004); и Väisänen et al., Anal. Chem., 78: 7809-7815 (2006), содержание которых включено сюда путем ссылки.
Аминокислотные последовательности тяжелой и легкой цепи, входящих в состав типичного антитела 11B6 против hK2, приведены ниже (при этом последовательности CDR подчеркнуты).
Тяжелая цепь 11В6
DVQLQESGPGLVKPSQSLSLTCTVTGNSITSDYAWNWIRQFPGNRLEWMGYISYSGSTTYSPSLKSRFSITRDTSKNQFFLQLNSVTPEDTATYFCATGYYYGSGFWGQGTLVTVSS
[SEQ ID NO: 4]
Легкая цепь 11B6
DIVLTQSPASLAVSLGQRATISCRASESVEYFGTSLMHWYRQKPGQPPKLLIYAASNVESGVPARFSGSGSGTDFSLNIQPVEEDDFSMYFCQQTRKVPYTFGGGTKLEIK [SEQ ID NO: 5]
В этом контексте термин "конкурирует" означает, что присутствие средства, содержащего связывающую молекулу, при конкурентном анализе вместе с контрольным антителом, выбранным из числа 11B6 и 7G1, может снижать уровень детектируемого связывания контрольного антитела с hK2 на 1%, 2%, 3%, 4%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или 100% (например, если средство и контрольное антитело присутствуют при тестировании в эквимолярном количестве, при этом тестирование необязательно проводится в физиологических условиях). Такой анализ может проводиться методом иммунорадиометрического анализа (IRMA), как описано в примере 9.
Если связывающая молекула, используемая в первом аспекте настоящего изобретения, обладает специфичностью к hK2, то она может содержать один или несколько определяющих комплементарность участков (CDRs) антитела, выбранного из группы, состоящей из 11B6 и 7G1 (которые выделены подчеркиванием выше).
Связывающие молекулы не обязательно должны содержать все шесть CDRs какого-либо из этих антител для того, чтобы сохранить антиген-связывающую активность, хотя в одном воплощении связывающая молекула может содержать все шесть CDRs из антитела, выбранного из группы, состоящей из 11B6 и 7G1.
В качестве альтернативы связывающая молекула может содержать менее шести CDRs, как-то:
- пять CDRs (т.е. 3 CDRs из области VH или VL, 2 CDRs из другой вариабельной области);
- четыре CDRs (т.е. 3 CDRs из области VH или VL, 1 CDR из другой вариабельной области; либо по 2 CDRs из каждой из областей VH и VL);
- три CDRs (т.е. все 3 CDRs из одной области VH или VL и ни одного из другой; либо 2 CDRs из области VH или VL, 1 CDR из другой вариабельной области);
- два CDRs (т.е. два CDRs из одной области VH или VL и ни одного из другой; либо по 1 CDR из каждой из областей VH и VL); или
- один CDR из любой из областей VH и VL,
из антитела, выбранного из группы, состоящей из 11B6 и 7G1.
В одном предпочтительном воплощении, если связывающая молекула, используемая в первом аспекте настоящего изобретения, обладает специфичностью к hK2, то связывающая молекула представляет собой антитело либо его антиген-связывающий фрагмент или производное, содержащее все 6 CDRs типичного антитела 11B6 против hK2 (см. подчеркнутые последовательности в SEQ ID NOs: 4 и 5).
В альтернативном воплощении, если связывающая молекула, используемая в первом аспекте настоящего изобретения, обладает специфичностью к hK2, то связывающая молекула может содержать или состоять из антитела, выбранного из группы, состоящей из 11B6 и 7G1 и их антиген-связывающих фрагментов.
Необязательно средство, используемое в первом аспекте настоящего изобретения, может дополнительно содержать терапевтическую молекулу. Соответственно, средство может содержать или состоять из связывающей молекулы, описанной выше, и терапевтической молекулы. Связывающая молекула может соединяться с терапевтической молекулой непосредственно или опосредованно.
В том случае, когда средство содержит или состоит из связывающей молекулы, описанной выше, и терапевтической молекулы, оно может проявлять характеристики поглощения опухолью, к примеру, при тестировании в условиях, используемых в приведенных ниже примерах, которые практически эквивалентны характеристикам поглощения опухолью у средства, состоящего только из связывающей молекулы. При этом практически эквивалентные включают значения более чем 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или практически 100%.
Можно использовать любые подходящие терапевтические молекулы. Подходящими терапевтическими молекулами являются такие, которые способны уменьшать или подавлять рост или же в особенности уничтожать клетки рака простаты. Например, терапевтическим средством может быть цитотоксическая молекула. Цитотоксическая молекула может содержать или состоять из одного или нескольких радиоизотопов. К примеру, один или несколько радиоизотопов могут быть независимо выбраны из группы, состоящей из бета-излучателей, излучателей Оже, излучателей конверсионных электронов, альфа-излучателей и излучателей низкоэнергетических фотонов. Может быть желательно, чтобы один или несколько радиоизотопов каждый независимо имел такой профиль излучения локально поглощаемой энергии, который дает большую поглощенную дозу в непосредственной близости от средства. Типичными радиоизотопами являются длиннопробежные бета-излучатели, такие как 90Y, 32P, 186Re/188Re, 166Ho, 76As/77As, 89Sr, 153Sm; среднепробежные бета-излучатели, такие как 131I, 177Lu, 67Cu, 161Tb, 105Rh; низкоэнергетические бета-излучатели, такие как 45Са или 35S; конверсионные или излучатели Оже, такие как 51Cr, 67Ga, 99Tcm, 111In, 114mIn, 123I, 125I, 201Tl; и альфа-излучатели, такие как 212Bi, 213Bi, 223Ac, 225Ac, 212Pb, 255Fm, 223Ra, 149Tb и 221At. Другие примеры терапевтических радионуклидов приведены на фиг. 9. Доступны и другие радионуклиды, которые могут применяться для лечения. В другом воплощении может потребоваться, чтобы терапевтическая молекула или цитотоксическая молекула не была представлена молекулой, которая представлена как "радиометка" в WO 2006/087374 A1, в частности на стр. 11, строки 7-15.
В одном предпочтительном воплощении терапевтическая молекула представлена 177Lu. К примеру, средство может представлять собой помеченное 177Lu антитело 11B6 против hK2 либо его антиген-связывающий фрагмент или производное.
С другой стороны, терапевтическая молекула может содержать или состоять из одного или нескольких терапевтических (как-то цитотоксических) препаратов, например, цитостатического препарата; антиандрогенного препарата; кортизона и его производных; фосфоната; ингибитора тестостерон-5-α-редуктазы; адденда бора; цитокина; тапсигаргина и его метаболитов; токсина (типа сапонина или калихеамицина); химиотерапевтического средства (типа антиметаболита); или любого другого терапевтического или цитотоксического препарата, применимого при лечении рака простаты.
Примеры терапевтических/цитотоксических препаратов, к примеру, включают:
- цитостатики, в частности, с ограничивающими дозировку побочными эффектами, включая, без ограничения, циклофосфамид, хлорамбуцил, ифосфамид, бусульфан, ломустин, таксаны, эстрамустин фосфат и другие азотные производные иприта, антибиотики (в том числе доксорубицин, калихеамицины и эсперамицин), алкалоиды барвинка, азаридины, содержащие платину соединения, эндостатин, алкилсульфонаты, нитрозокарбаматы, триазены, аналоги фолиевой кислоты, аналоги пиримидина, аналоги пурина, ферменты, замещенную мочевину, производные метилгидразина, даунорубицин, амфипатические амины;
- антиандрогены, такие как флутамид и бикалутамид и их метаболиты;
- кортизон и его производные;
- фосфонаты типа дифосфоната и буфосфоната;
- ингибиторы тестостерон-5-α-редуктазы;
- адденды бора;
- цитокины;
- тапсигаргин и его метаболиты;
- другие средства, используемые при лечении рака простаты.
С другой стороны, цитотоксическая молекула может содержать или состоять из одной или нескольких молекул, пригодных для применения при активационной терапии, как-то фотонной активационной терапии, нейтронной активационной терапии, терапии нейтрон-индуцированными электронами Оже, синхротронной радиационной терапии или низкоэнергетической рентгеновской фотонной активационной терапии.
Например, существует возможность использования синхротронного излучения (или низкоэнергетического рентгеновского излучения) вместе с противоопухолевыми средствами по настоящему изобретению для реализации радиотерапии, сосредоточенной, в первую очередь, на так называемой фотоактивационной радиотерапии (PAT), при которой локальное внесение энергии от внешнего рентгеновского облучения будет усиливаться в раковой ткани за счет взаимодействия с предварительно введенным противоопухолевым средством с высоким значением Z, см. фиг. 10.
При лечении по методике PAT используется монохроматическое рентгеновское излучение из синхротронного источника типа биомедицинской установки ID 17 beamline при European Synchrotron Radiation Facility (ESRF) в Гренобле, которые в будущем должны быть доступны и на других объектах типа новой синхротронной установки Мах-IV в Швеции.
В качестве другого потенциального метода лечения предусмотрены исследования по "лечению опухолей индуцированными электронами Оже" на будущем European Spallation Source (ESS) в Лунде с медицинской экспериментальной станцией. Вырабатываемые реакторами тепловые и полутепловые нейтроны уже давно использовались для терапии методом захвата нейтронов бором (BNCT) как для доклинических экспериментов, так и для лечения опухолей мозга индуцированными альфа-частицами и ядрами отдачи (7L), дающими большой выход локально поглощаемой энергии. Аналогичный подход заключается в использовании нейтронов и подходящих противоопухолевых молекул, помеченных стабильными ядрами с большим поперечным сечением для нейтронов. Так, антитела или пептиды могут быть помечены стабильным гадолинием (157Gd) и будут действовать в качестве молекул мишени для нейтронов, захватываемых ядрами Gd, что именуется терапией методом захвата нейтронов гадолинием (GdNCT). По методу Monte Carlo рассчитывается распределение дозы в опухоли и в окружающей ткани, поступающей от γ-фотонов, нейтронов, ядер отдачи, а также характерных рентгеновских лучей, конверсионных электронов и электронов Оже из гадолиния или других возможных элементов.
Как обсуждалось выше, терапевтическая молекула (как-то радиоизотоп, цитотоксическая молекула и т.п.) может быть связана непосредственно или опосредованно со связывающей молекулой (как-то антителом или его фрагментом). Подходящие линкеры известны и включают, к примеру, простетические группы, нефенольные линкеры (производные N-сукцимидилбензоатов; додекабораты), хелатные молекулы макроциклических и ациклических хелаторов, как-то производные 1,4,7,10-тетраазацикло до декан-1,4,7,10-тетрауксусной кислоты (DOTA), производные диэтилентриаминпентауксусной кислоты (DTPA), производные S-2-(4-изотиоцианатобензил)-1,4,7-триазациклононан-1,4,7-триуксусной кислоты (NOTA) и производные 1,4,8,11-тетраазациклододекан-1,4,8,11-тетрауксусной кислоты (TETA) и другие хелатные молекулы. Использование таких линкеров может быть особенно целесообразно в тех случаях, когда средство содержит или состоит из антитела или его фрагмента в качестве связывающей молекулы, связанной через линкер с радиоизотопом в качестве терапевтической молекулы.
Одним из предпочтительных линкеров является DTPA, к примеру, в виде 177Lu-DTPA-11B6.
Необязательно средство, используемое в первом аспекте настоящего изобретения, может (или нет) дополнительно содержать детектируемую молекулу. Например, детектируемая молекула может содержать или состоять из радиоизотопа типа радиоизотопа, выбранного из группы, состоящей из: технеция-99m; индия-111; галлия-67; галлия-68; мышьяка-72; циркония-89; йода-123, йода-124, йода-125; таллия-201. Необязательно средство может содержать пару из детектируемого и цитотоксического радионуклидов, таких как 86Y/90Y или 124I/211At. С другой стороны, средство может содержать и радиоизотоп, способный одновременно действовать мультимодальным образом, и в качестве детектируемой молекулы, и цитотоксической молекулы, обеспечивая так называемую "комплексную терагностику". При этом связывающие молекулы могут соединяться с наночастицами, способными давать несколько различных изображений (например, SPECT, PET, MRI, оптические или ультразвуковые) вместе с терапевтической способностью с использованием цитотоксических препаратов, таких как радионуклиды или средства химиотерапии. Также в настоящее изобретение входит возможность лечения методом гипертермии с помощью высокочастотных переменных магнитных полей в сочетании с ультразвуковой интраскопией. Например, см. фиг. 11.
С другой стороны, детектируемая молекула может содержать или состоять из парамагнитного изотопа типа парамагнитного изотопа, выбранного из группы, состоящей из: гадолиния-157; марганца-55, диспрозия-162, хрома-52; железа-56.
В том случае, когда средство, используемое в первом аспекте настоящего изобретения, содержит детектируемую молекулу, то детектируемая молекула может выявляться таким методом визуализации, как SPECT, PET, MRI, оптическая или ультразвуковая интраскопия.
Терапевтические и детектируемые молекулы могут быть конъюгированы или иным образом комбинированы со связывающей молекулой известными в данной области способами (например, существующее иммуноконъюгатное средство терапии - гемтузумаб озогамицин [торговая марка: Mylotarg®] содержит моноклональное антитело, соединенное с цитотоксином - калихеамицином).
В следующем воплощении средство, используемое согласно первому аспекту настоящего изобретения, применяется для лечения рака простаты в виде лекарственной формы, содержащей популяцию молекул средства. В одном варианте все (или практически все, как-то более 90%, 95%, 99%, 99.9% или больше по весу) молекулы средства в популяции, используемой для лечения, включают одну и ту же терапевтическую молекулу. В другом варианте популяция включает смесь других средств с другими терапевтическими молекулами. В этом случае возникает возможность усиления эффектов прицельной радионуклидной терапии с помощью различных средств типа средств химиотерапии, средств гормональной терапии или других комбинаций способов лечения, при которых прицельное средство не только доставляет терапевтически активные радионуклиды к связанным с опухолью антигенам, но и одновременно вызывает радиосенситизацию опухолевых клеток-мишеней, запуская каскад внутриклеточных сигналов. Этот вариант также применим при лечении рака простаты с помощью смеси цитотоксических средств, например, с помощью коктейля из альфа-излучателей и бета-излучателей с различным пробегом или коктейля из радионуклидов с различным пробегом, LET (линейной передачей энергии) и RBE (относительным биологическим эффектом), для комбинированного лечения больших опухолей, микрометастазов и одиночных опухолевых клеток. В одном воплощении для лечения больших опухолей могут использоваться длиннопробежные излучатели, а для лечения небольших опухолей типа микрометастазов и одиночных опухолевых клеток могут использоваться короткопробежные излучатели.
Необязательно средство, используемое в первом аспекте настоящего изобретения, может (или нет) дополнительно содержать молекулу для увеличения времени полужизни средства in vivo. Примеры молекул для увеличения времени полужизни средства in vivo могут включать полиэтиленгликоль (PEG), сывороточный альбумин человека, гликозилирующие группы, жирные кислоты и декстран. Особенно предпочтителен PEG.
В одном воплощении настоящего изобретения средства, включающие связывающее средство (например, антитело или его фрагмент), специфичное для белка калликреина типа PSA или hK2, и терапевтическое средство, затем вводят/вливают в организм. После этого средство связывается с тканями, вырабатывающими соответствующие антигены, как-то PSA или hK2. Биологические структуры, с которыми будет связываться средство, впоследствии можно обработать соответствующим реагентом и/или использовать методы дозиметрии и/или интраскопии для оценки терапии, включая PET/SPECT/CT/MR/ оптические/ультразвуковые методы.
В некоторых случаях различия в степени ослабления клеток рака простаты под действием средства могут прямо соответствовать показателям продукции и концентрации калликреина-мишени (как-то PSA или hK2) в клетках рака простаты у пациента. Эти вариации могут быть определены, к примеру, методами из WO 2006/08734, которые включены сюда путем ссылки, и использованы для получения терапевтической информации.
Например, предварительная визуализация связывания антител с PSA и hK2, полученная с помощью вышеприведенных методов визуализации, может сочетаться с методами и применениями настоящего изобретения. Из измерения ослабления можно прямо определить, вырабатывает ли исследуемая ткань PSA, hK2 или то и другое. В свете этого определения можно будет адаптировать лечение так, чтобы оно было наиболее эффективным. Тем самым достигается индивидуальная терапия для пациента путем планирования дозы перед лечением. В качестве руководства по индивидуальной терапии для пациентов можно взять уже известные способы лечения типа тех, что приведены в (1) Garkavij et al. (2010) Cancer, 116: 1084-1092; (2) Linden et al. (1999) Clin. Cancer Res., 5: 3287s-3291s; (3) Ljungberg et al. (2003) Cancer Biother. Radiopharm., 18: 99-107; (4) Minarik et al. (2010) J. Nucl. Med., 51: 1974-1978; (5) Sjogreen-Gleisner et al. (2011) Q.J. Nucl. Med. Mol. Imaging, 55: 126-154; и (6) Sjogreen et al. (2005) Cancer Biother. Radiopharm., 20: 92-97, содержание которых включено сюда путем ссылки.
Соответственно в одном воплощении первый аспект изобретения включает лечение пациентов, у которых установлено наличие вырабатывающих PSA клеток рака простаты, с помощью средства согласно первому аспекту настоящего изобретения, обладающего специфичностью к PSA.
В другом воплощении первый аспект изобретения включает лечение пациентов, у которых установлено наличие вырабатывающих hK2 клеток рака простаты, с помощью средства согласно первому аспекту настоящего изобретения, обладающего специфичностью к гландулярному калликреину человека (hK2).
В другом воплощении первый аспект изобретения включает лечение пациентов, у которых установлено наличие клеток рака простаты, вырабатывающих и PSA, и hK2, с помощью средства согласно первому аспекту настоящего изобретения, обладающего специфичностью и к PSA, и к гландулярному калликреину человека (hK2), или комбинации средств, одно из которых обладает специфичностью к PSA, а другое обладает специфичностью к hK2. При комбинированной терапии средства могут вводиться пациентам по отдельности, последовательно, одновременно или готовиться в виде смеси в одной и той же фармацевтической композиции.
Таким образом, введение средства согласно первому аспекту настоящего изобретения пациентам с раком простаты может приводить к связыванию белка калликреина, как-то специфичного антигена простаты (PSA; hk3, гена 3 калликреина человека) и/или гландулярного калликреина человека (hK2), присутствующего на или в клетках рака простаты, и приводить к ингибированию роста и/или гибели клеток рака простаты у пациента. Например, средство может уменьшить скорость роста и/или наличие клеток рака простаты у пациента по меньшей мере на 10%, в частности, по меньшей мере на 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% и наиболее предпочтительно на 100% по сравнению с наблюдавшейся скоростью роста и/или наличием клеток рака простаты у пациента до лечения. Способы измерения скорости роста и/или наличия клеток рака простаты у субъекта известны в данной области.
Таким образом, изобретением предусмотрены способы лечения рака простаты.
Под "лечением" понимается и терапевтическое, и профилактическое лечение пациента. Термин "профилактический" охватывает такое применение средства или его состава, как описано здесь, которое либо предупреждает, либо уменьшает вероятность рака простаты или распространение, диссеминирование или метастазирование локализованного рака простаты у пациента или субъекта. Термин "профилактический" также охватывает такое применение средства или его состава, как описано здесь, которое предотвращает рецидив рака простаты у пациента, который раньше проходил лечение от рака простаты.
Рак простаты, подлежащий лечению по первому аспекту настоящего изобретения, может быть локализован в предстательной железе или может не быть локализованным раком простаты (то есть он диссеминирован). Рак простаты, локализованный в предстательной железе, к примеру, может быть классифицирован как клинический рак T1 или T2 по системе TNM (сокращенно от Tumor/Nodes/Metastases, т.е. опухоль/узлы/метастазы), тогда как нелокализованный/ диссеминированный рак простаты, к примеру, может быть классифицирован как клинический рак T3 или T4.
Рак простаты, подлежащий лечению по первому аспекту настоящего изобретения, может быть метастазирующим раком простаты. Метастазирование означает распространение рака из его исходного местоположения в другие места организма. Например, метастазирующий рак простаты, подлежащий лечению, может представлять собой метастазы, присутствующие в лимфатической системе; в костях (в том числе позвоночнике, позвонках, тазовых костях, ребрах); метастазы в позвонках, прямой кишке, мочевом пузыре или мочеиспускательном канале. Метастазы, присутствующие в других менее распространенных местах, также можно лечить по настоящему изобретению. Метастазы могут представлять собой микрометастазы. Микрометастазы являются такой формой метастазов, при которой вновь образовавшиеся опухоли в общем слишком малы, чтобы их можно было обнаружить, или же обнаруживаются с трудом. Например, настоящее изобретение предоставляет специалистам средство для лечения одиночных раковых клеток или клеточных кластеров, даже если присутствие таких клеток или кластеров невозможно диагностировать, но они существуют, к примеру, в виде скрытого диссеминированного заболевания.
Соответственно, предполагается, что особенно важным техническим преимуществом лечения по настоящему изобретению в сравнении с предшествующими способами лечения рака простаты является повышение эффективности при лечении диссеминированного и/или метастазирующего (включая микрометастазы) рака простаты.
Таким образом, в одном воплощении изобретения предусмотрены средства и способы профилактики или лечения метастазов первичной опухоли предстательной железы.
Рак простаты обычно возникает у мужчин в возрасте старше пятидесяти лет, чаще всего у мужчин старше 60, 65 или 70 лет, и хотя он является одним из наиболее распространенных видов рака у мужчин, у многих никогда не проявляются симптомы, они не проходят лечение и в конечном счете умирают от других причин. Все это потому, что рак простаты в большинстве случаев развивается медленно и без симптомов, а поскольку мужчины с этим заболеванием пожилого возраста, то они часто умирают от причин, не связанных с раком простаты, как-то сердечно-сосудистых заболеваний, пневмонии, других видов рака или от старости. Примерно две трети случаев рака простаты развиваются медленно, а другая треть является более агрессивной и развивается быстро.
Соответственно, разработка эффективных способов лечения рака простаты имеет особое значение при более агрессивных и быстро развивающихся формах рака, особенно у более молодых пациентов. Соответственно, в одном воплощении, первый аспект настоящего изобретения касается лечения рака простаты у пациентов в возрасте менее 70, 65, 60, 55, 50, 45, 40 лет или еще меньше на момент диагноза рака простаты и/или во время лечения.
У мужчин, имеющих близких родственников первой степени (отец или брат) с раком простаты, в два раза повышается риск возникновения рака простаты, а у тех, кто имеет двух заболевших родственников первой степени, риск повышается в пять раз по сравнению с мужчинами без такой семейной истории. Соответственно, первый аспект изобретения касается лечения рака простаты у пациентов, отличающихся тем, что у них у одного, двух или большего количества членов семьи, в частности членов семьи первой степени (таких, как отец или брат), уже был диагностирован рак простаты.
Первый аспект изобретения также касается лечения рака простаты у пациентов, у которых подлежащий лечению рак простаты представлен устойчивым к кастрации раком простаты (CRPC). CRPC обычно характеризуется тем, что он становится невосприимчивым к гормональной терапии через один-три года и возобновляет рост, несмотря на гормональную терапию.
Настоящим изобретением также предусмотрены фармацевтические композиции, содержащие терапевтически эффективное количество средства, как определено выше в отношении первого аспекта настоящего изобретения, и фармацевтически приемлемый разбавитель, носитель или наполнитель.
В фармацевтические композиции могут входить и другие соединения, в том числе такие хелаторы, как EDTA, цитрат, EGTA или глутатион.
Фармацевтические композиции могут быть получены способом, известным в данной области, которые будут достаточно стабильными при хранении и пригодными для введения человеку и животным. Например, фармацевтические композиции могут быть лиофилизированы, например, методом сублимационной сушки, сушки распылением, охлаждения с распылением или путем образования частиц из сверхкритической жидкости.
Под "фармацевтически приемлемыми" понимаются такие нетоксичные материалы, которые не снижают эффективность связывания с белком калликреина у средства по изобретению. Такие фармацевтически приемлемые буферы, носители или наполнители хорошо известны в данной области (см. Remington's Pharmaceutical Sciences, 18th edition, A.R. Gennaro, Ed., Mack Publishing Company (1990); и учебник Pharmaceutical Excipients, 3rd edition, A. Kibbe, Ed., Pharmaceutical Press (2000), содержание которых включено сюда путем ссылки).
Термин "буфер" служит для обозначения водных растворов, содержащих кислотно-щелочную смесь с целью стабилизации pH. Примерами буферов являются Trizma, Bicine, Tricine, MOPS, MOPSO, MOBS, трис, Hepes, HEPBS, MES, фосфат, карбонат, ацетат, цитрат, гликолат, лактат, борат, ACES, ADA, тартрат, AVP, AMPD, AMPSO, BES, CABS, какодилат, CHES, DIPSO, EPPS, этаноламин, глицин, HEPPSO, имидазол, имидазолмолочная кислота, PIPES, SSC, SSPE, POPSO, TAPS, TABS, TAPSO и TES.
Термин "разбавитель" служит для обозначения водных или неводных растворов, предназначенных для разбавления средства в фармацевтическом препарате. Разбавителем может быть одно или несколько из числа солевого раствора, воды, полиэтиленгликоля, пропиленгликоля, этанола или масел (таких, как сафлоровое масло, кукурузное масло, арахисовое масло, хлопковое масло или кунжутное масло).
Термин "адъювант" служит для обозначения любых соединений, добавляемых в композицию для усиления биологических эффектов средства по изобретению. Адъювантом может быть одно или несколько из числа солей цинка, меди или серебра с различными анионами, к примеру, без ограничения, фторидом, хлоридом, бромидом, йодидом, тиоцианатом, сульфитом, гидроксидом, фосфатом, карбонатом, лактатом, гликолатом, цитратом, боратом, тартратом и ацетатом с различным составом ацилов. Адъювантами также могут быть катионные полимеры, такие как катионные эфиры целлюлозы, катионные сложные эфиры целлюлозы, деацетилированная гиалуроновая кислота, хитозан, катионные дендримеры, катионные синтетические полимеры типа поли(винилимидазола), катионные полипептиды типа полигистидина, полилизина, полиаргинина и пептиды, содержащие эти аминокислоты.
Наполнителем может быть одно или несколько из числа углеводов, полимеров, липидов и минералов. Примеры углеводов включают лактозу, глюкозу, сахарозу, маннитол и циклодекстрины, которые добавляют в композицию, например, для облегчения лиофилизации. Примерами полимеров служат крахмал, эфиры целлюлозы, карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, этилгидроксиэтилцеллюлоза, альгинаты, карагенаны, гиалуроновая кислота и ее производные, полиакриловая кислота, полисульфонаты, сополимеры полиэтиленгликоля/полиэтиленоксида, сополимеры полиэтиленоксида/полипропиленоксида, поливиниловый спирт/ поливинилацетат различной степени гидролиза и поливинилпирролидон, все разной молекулярной массы, которые добавляются в композицию, например, для контроля вязкости, для достижения биоадгезии или для защиты липидов от химического и протеолитического разрушения. Примерами липидов являются жирные кислоты, фосфолипиды, моно-, ди- и триглицериды, церамиды, сфинголипиды и гликолипиды, все с ацильными цепями разной длины и насыщения, яичный лецитин, соевый лецитин, гидрированный яичный и соевый лецитин, которые добавляются в композиции по тем же причинам, что и полимеры. Примерами минералов являются тальк, оксид магния, оксид цинка и оксид титана, которые добавляются в композиции для получения таких преимуществ, как уменьшение поступления жидкости или улучшение пигментных свойств.
Средства по изобретению могут быть составлены в фармацевтические композиции любого типа, известные в данной области как пригодные для их доставки.
В одном воплощении фармацевтические композиции по изобретению могут иметь вид липосом, в которых средство сочетается, наряду с другими фармацевтически приемлемыми носителями, с такими амфипатическими веществами, как липиды, которые существуют в агрегированном виде типа мицелл, нерастворимых монослоев и жидких кристаллов. Подходящими липидами для липосомных препаратов являются, без ограничения, моноглицериды, диглицериды, сульфатиды, лизолецитин, фосфолипиды, сапонин, желчные кислоты и др. Подходящими липидами также являются вышеприведенные липиды, модифицированные поли(этиленгликолем) по полярным головкам для увеличения времени циркуляции в кровяном русле. Получение таких липосомных составов изложено, к примеру, в US 4,235,871, содержание которого включено сюда путем ссылки.
Фармацевтические композиции по изобретению также могут иметь вид биоразлагаемых микросфер. В качестве биоразлагаемых полимеров при получении микросфер широко применяются алифатические полиэфиры, такие как поли(молочная кислота) (PLA), поли(гликолевая кислота) (PGA), сополимеры PLA и PGA (PLGA) или поли(капролактон) (PCL), а также полиангидриды. Получение таких микросфер приведено в US 5,851,451 и EP 0213303, содержание которых включено сюда путем ссылки.
В следующем воплощении фармацевтические композиции по изобретению представлены в виде полимерных гелей, в которых для загущения раствора, содержащего средство, применяются такие полимеры, как крахмал, эфиры целлюлозы, карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, этилгидроксиэтилцеллюлоза, альгинаты, каррагинаны, гиалуроновая кислота и ее производные, полиакриловая кислота, поливинилимидазол, полисульфонаты, сополимеры полиэтиленгликоля/полиэтиленоксида, сополимеры полиэтиленоксида/полипропиленоксида, поливиниловый спирт/поливинилацетат различной степени гидролиза и поливинилпирролидон. Полимеры также могут включать желатин или коллаген.
С другой стороны, средства можно просто растворять в воде, полиэтиленгликоле, пропиленгликоле, этаноле или масле (как-то сафлоровом масле, кукурузном масле, арахисовом масле, хлопковом масле или кунжутном масле), трагакантовой камеди и/или в различных буферах.
Следует иметь в виду, что фармацевтические композиции по изобретению могут включать ионы и определенное значение pH для усиления действия активного средства. Кроме того, композиции могут подвергаться стандартным фармацевтическим операциям типа стерилизации и/или могут содержать стандартные адъюванты типа консервантов, стабилизаторов, смачивающих веществ, эмульгаторов, буферов, заполнителей и др.
Фармацевтические композиции по изобретению могут вводиться любым подходящим способом, известным специалистам в данной области. Так, возможные способы введения включают парентеральное (внутривенное, подкожное и внутримышечное), местное, внутриглазное, интраназальное, внутрилегочное, буккальное, пероральное, парентеральное и ректальное. Также возможно введение из имплантов. Желательным способом может оказаться вливание, поскольку вводимое средство может обладать высокой токсичностью.
В одном воплощении фармацевтические композиции вводятся парентерально, к примеру, внутривенно, в желудочки мозга, внутрисуставно, внутриартериально, внутрибрюшинно, интратекально, интравентрикулярно, внутригрудинно, интракраниально, внутримышечно или подкожно, или же они вводятся методом вливания. Их удобно использовать в виде стерильного водного раствора, который может содержать другие вещества, к примеру, достаточное количество солей или глюкозы, чтобы раствор стал изотоничен крови. Водные растворы должны быть соответствующим образом забуферены (к примеру, до значения pH от 3 до 9), при необходимости. Приготовление подходящих парентеральных форм в стерильных условиях легко осуществимо с помощью стандартных фармацевтических методов, хорошо известных специалистам.
Лекарственные формы, подходящие для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буфера, бактериостатики и растворенные вещества, делающие препарат изотоничным крови реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие вещества и загустители. Лекарственные формы могут быть представлены в контейнерах для однократных доз или множественных доз, к примеру, в герметичных ампулах или флаконах, и могут храниться в высушенном (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, к примеру, воды для инъекций, непосредственно перед использованием. Растворы и суспензии для инъекций ex tempore могут быть приготовлены из стерильных порошков, гранул и таблеток описанного ранее типа.
Таким образом, фармацевтические композиции по изобретению особенно подходят для парентерального, например, внутривенного введения.
С другой стороны, фармацевтические композиции можно вводить интраназально или путем ингаляции (к примеру, в виде аэрозоля, распыляемого из контейнера под давлением, насоса, спрея или распылителя с помощью подходящего вытеснителя (сжатого газа), такого как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, гидрофторалкана типа 1,1,1,2-тетрафторэтана (HFA 134A3 или 1,1,1,2,3,3,3-гептафторпропана (HFA 227EA3), двуокиси углерода или другого подходящего газа. В случае аэрозоля под давлением дозировка устанавливается с помощью клапана для выделения отмеренного количества. Контейнер под давлением, насос, спрей или распылитель может содержать раствор или суспензию активного полипептида, например, в смеси из этанола и вытеснителя в качестве растворителя, который может дополнительно содержать смазку, например, сорбитан триолеат. Капсулы и картриджи (к примеру, из желатина) для ингалятора или порошковдувателя могут содержать порошкообразную смесь из соединения по изобретению и подходящей основы порошка типа лактозы или крахмала.
Фармацевтические композиции должны вводиться пациентам в фармацевтически эффективной дозе. "Терапевтически эффективное количество" или "эффективное количество" или "терапевтически эффективное" в настоящем изобретении означает такое количество, которое обеспечивает терапевтический эффект при данном состоянии и режиме введения. Это заранее установленное количество активного материала, которое рассчитано на получение требуемого терапевтического эффекта в сочетании с требуемой добавкой и разбавителем, т.е. носителем или растворителем. Кроме того, оно служит для обозначения количества, достаточного для снижения и/или предотвращения клинически значимой недостаточности в активности, функции и реакции организма. С другой стороны, терапевтически эффективное количество достаточно для того, чтобы вызвать улучшение клинически значимого состояния организма. Как известно специалистам, количество соединения может варьироваться в зависимости от его удельной активности. Подходящие дозовые количества могут содержать заданное количество активной композиции, рассчитанное на получение требуемого терапевтического эффекта в сочетании с требуемым разбавителем. В способах и применении для изготовления композиций по изобретению предусматривается терапевтически эффективное количество активного компонента. Терапевтически эффективное количество может быть определено рядовым квалифицированным медицинским работником, исходя из таких характеристик пациента, как возраст, вес, пол, состояние, осложнения, другие заболевания и т.д., как это хорошо известно в данной области. Введение фармацевтически эффективной дозы может осуществляться как путем однократного введения в виде индивидуальной дозы или же нескольких меньших доз, так и множественного введения дробных доз через определенные интервалы. В качестве альтернативы доза может вводиться в виде непрерывного вливания на протяжении длительного времени.
Вышеприведенное средство по первому аспекту настоящего изобретения может быть составлено в различных концентрациях, в зависимости от эффективности/токсичности используемого соединения. Лекарственная форма может содержать активное вещество в концентрации от 0.1 мкМ до 1 мМ, от 1 мкМ до 500 мкМ, от 500 мкМ до 1 мМ, от 300 мкМ до 700 мкМ, от 1 мкМ до 100 мкМ, от 100 мкМ до 200 мкМ, от 200 мкМ до 300 мкМ, от 300 мкМ до 400 мкМ, от 400 мкМ до 500 мкМ и около 500 мкМ.
Специалистам должно быть известно, что фармацевтические композиции по изобретению могут вводиться сами по себе или в комбинации с другими терапевтическими средствами, используемыми при лечении рака простаты, или же до, после или в то же самое время, что и лечение пациента другими способами лечения рака простаты, такими как хирургия (например, радикальная простатэктомия), лучевая терапия, брахитерапия, наружная лучевая терапия, сфокусированный ультразвук высокой интенсивности (HIFU), химиотерапия, пероральные химиотерапевтические препараты, криохирургия (замораживание опухоли), гормональная терапия (типа антиандрогенной терапии), кастрация или комбинации из вышеперечисленного.
Настоящим изобретением также предусмотрены наборы, включающие средство, определенное выше по первому аспекту настоящего изобретения, или фармацевтическую композицию, определенную выше.
Настоящим изобретением также предусмотрены средства для применения в медицине, практически как описано здесь.
Настоящим изобретением также предусмотрены фармацевтические композиции, практически как описано здесь.
Настоящим изобретением также предусмотрено применение средств, практически как описано здесь.
Настоящим изобретением также предусмотрены способы лечения, практически как описано здесь.
Настоящим изобретением также предусмотрены наборы, практически как описано здесь.
В соответствии с одним аспектом изобретения предусмотрен способ лечения, которым лечат первичный и диссеминированный рак простаты с помощью средства, определенного выше.
В соответствии с другим аспектом изобретения предусмотрен способ лечения, который может применяться для лечения метастазов типа метастазов в лимфатических узлах и/или костях, включая микрометастазы.
В соответствии с еще одним аспектом изобретения предусмотрен способ лечения, который может применяться вместе с или после наружной радиотерапии, лечения цитостатиками и андрогенами или другими способами лечения, не связанными с воздействием на опухоль терапевтическими антителами/фрагментами.
В соответствии с определенными аспектами изобретения предусмотрены меченые для терапии антитела, специфичные к PSA и/или hK2, которые применяются для лечения рака простаты, т.е. ткани, вырабатывающей PSA и/или hK2.
В соответствии со следующим аспектом изобретения предусмотрено применение данных способов.
Способ лечения по настоящему изобретению обладает преимуществом перед предшествующим уровнем техники в том, что он позволяет лечить рак простаты, причем данный способ также может применяться для лечения метастазов, включая микрометастазы, как-то метастазов лимфатических узлов или любых других форм метастазирования, как описано выше, и может применяться вместе с постоперационными процедурами или после них и во время или после лучевой терапии, лечения цитостатиками и андрогенами.
Вышеприведенное описание сосредоточено на воплощениях настоящего изобретения, применимых к способам лечения рака простаты. Однако следует иметь в виду, что изобретение не ограничивается этим применением, а может применяться ко многим другим комбинациям лечения, включая, к примеру, метастазы, послеоперационное обследование и обследование во время или после лучевой терапии, лечения цитостатиками и андрогенами. В отношении лечения метастазов они подлежат лечению в лимфатических узлах.
В другом воплощении для идентификации меченых изотопами специфичных к калликреину связывающих молекул (типа антител к PSA и/или hK2), описанных выше, во время и/или перед хирургической операцией может применяться радиохирургия (RadioGuided Surgery, RGS) или видеохирургия (Image-Guided Surgery, IGS). Так, во время и/или перед хирургической операцией может вводиться средство, включающее связывающую молекулу и детектируемую молекулу, как изложено выше. В этом воплощении сначала может вводиться средство типа меченых изотопами антител против PSA и/или против hK2. После этого может применяться RGS/IGS для идентификации вырабатывающей PSA/hK2 ткани с помощью прибора, чувствительного к детектируемой молекуле, во время и/или перед хирургией. Детектируемой молекулой, к примеру, может служить излучающая радиацию или магниточувствительная детектируемая молекула; к примеру, ею может служить излучатель черенковского излучения и/или тормозного излучения; ею может служить флуоресцентная метка и/или магнитная или намагничивающаяся метка. Соответственно, RGS/IGS по настоящему изобретению, к примеру, может представлять собой метод, основанный на детектировании оптического, Черенковского, тормозного или бета-излучения; детектировании радионуклидной метки; и/или он может включать магнитометрию. RGS хорошо известен специалистам как хирургический метод, который позволяет хирургам идентифицировать ткань, "помеченную" детектируемой молекулой.
Методы визуализации в соответствии с вышесказанным могут комбинироваться с другими радиологическими методами визуализации, такими как SPECT/PET, компьютерная томография (СТ), ультразвуковая (US) и магнитно-резонансная томография (MRT).
Соответственно, во втором аспекте настоящего изобретения также предусмотрено средство, содержащее или состоящее из связывающей молекулы со специфичностью к белку калликреина (типа описанных выше в отношении первого аспекта настоящего изобретения) и детектируемой молекулы, как обсуждалось выше в отношении первого аспекта настоящего изобретения, для применения в медицине путем введения пациентам с раком простаты перед хирургической операцией или во время нее типа радиохирургии или видеохирургии.
Таким образом, второй аспект также предусматривает применение средства, содержащего или состоящего из связывающей молекулы со специфичностью к белку калликреина и детектируемой молекулы, при изготовлении медикаментов для введения пациентам с раком простаты перед хирургической операцией или во время нее типа радиохирургии или видеохирургии.
Второй аспект настоящего изобретения также предусматривает способ хирургии типа радиохирургии или видеохирургии, которая проводится на пациентах с раком простаты, причем способ включает стадию введения пациентам перед хирургической операцией или во время нее эффективного количества средства, содержащего или состоящего из связывающей молекулы со специфичностью к белку калликреина и детектируемой молекулы.
Предусматривается, что любые способы, вещества или композиции, описанные здесь, могут быть реализованы в отношении любого другого способа, вещества или композиции, описанных здесь.
Использование единственного числа в сочетании с термином "содержащий" в формуле изобретения и/или описании может означать "один", но оно также согласуется со значением "один или несколько", "по меньшей мере один" и "один или более одного".
Эти и другие воплощения изобретения станут более понятными при рассмотрении их в сочетании с вышеприведенным описанием и сопровождающими рисунками. Однако следует иметь в виду, что вышеприведенное описание, хотя в нем и приведены различные воплощения изобретения и многочисленные конкретные подробности, приводится в качестве иллюстрации, а не ограничения. В рамках настоящего изобретения могут проводиться разнообразные замены, модификации, дополнения и/или перестановки, не отходящие от его сути, а само изобретение включает все такие замены, модификации, дополнения и/или перестановки.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Нижеследующие рисунки составляют часть настоящего описания и включены для дополнительного раскрытия определенных аспектов настоящего изобретения. Изобретение может быть лучше понято с привлечением одного или нескольких из этих рисунков в сочетании с подробным описанием конкретных воплощений, представленных в нем.
На фиг. 1 представлена кинетика меченного 125I антитела PSA30 в различных тканях после внутривенного введения у нормальных мышей.
На фиг. 2 представлена кинетика меченного 125I антитела PSA30 в различных тканях после внутривенного введения мышам с привитыми ксенотрансплантатами метастатических раковых клеток простаты, которая показывает, что метастатические раковые клетки простаты проявляют сильное поглощение антитела PSA30.
На фиг. 3 представлены соотношения опухоль-орган по 125I-PSA30 после внутривенного введения у мышей nude, несущих подкожные опухоли на основе LNCaP, в различные моменты времени после инъекции (n=34). Более высокие соотношения указывают на большую специфичность поглощения тканью опухоли, чем данной тканью.
На фиг. 4A-H представлены результаты цифровой ауторадиографии: индивидуально нормализованный захват 125I-PSA30 (фиг. 4А) и 18F-холина (фиг. 4B) через 48 ч после инъекции 125I-PSA30 плюс 1 ч после инъекции меченого холина на одном и том же срезе опухоли по отдельным изотопам. Гистологический анализ с помощью H&E (фиг. 4C, фиг. 4E-F) и экспрессия PSA с помощью общего антитела 2E9 к PSA (фиг. 4D, фиг. 4G-H) сопоставлены на смежных срезах. Не отмечено прямой связи между зонами с высоким захватом mAb PSA30 и высоким захватом холина. Примечание: эта мышь могла свободно двигаться после инъекции 18F-холина. 209×297 мм (300×300 DPI).
На фиг. 5 представлена кинетика меченного 125I антитела 5A10 в различных тканях после внутривенного введения у нормальных мышей.
На фиг. 6 представлена кинетика меченного 125I антитела 11B6 в различных тканях после внутривенного введения у нормальных мышей.
На фиг. 7 представлена кинетика меченного 125I антитела 11B6 в различных тканях после внутривенного введения у мышей с привитыми ксенотрансплантатами метастатических раковых клеток простаты. Поглощение органами выражено в %IA/г от времени.
На фиг. 8 представлено биораспределение 111In-11B6 в ксенотрансплантатах LnCAP. Накопление радиоактивности достигало пика через 48 ч после введения при 16.4±1.92% IA/г (процент введенной радиоактивности на 1 г). Поглощение нормальными органами (печень, селезенка, почки, кости, простата, семенники) находится на весьма низком уровне. Несколько повышенное поглощение наблюдалось в слюнных железах, вероятно, в связи с определенным уровнем нормальной экспрессии hK2.
На фиг. 9 представлены примеры некоторых терапевтических радионуклидов.
На фиг. 10 представлена иллюстрация принципа PAT. При низкой дозе наружного облучения наводящее на опухоль средство с высоким значением Z производит большое усиление локально поглощенной дозы в опухолевых клетках-мишенях.
На фиг. 11 представлен пример того, как можно использовать наночастицы для комплексной интраскопии и терапии при прикреплении к наводящим на опухоли средствам в виде антител.
На фиг. 12 представлены соотношения опухоль/кровь. Соотношения возрастают с течением времени, свидетельствуя об активном наведении 111In-11B6 на hK2 в опухолях LnCAP.
На фиг. 13 представлено сравнительное биораспределение 111In-11B6 в экспрессирующих hK2 ксенотрансплантатах (LnCAP) и в отрицательных по hK2 ксенотрансплантатах (DU145) через 48 ч после введения. Результаты показали статистически значимое отличие (p<0.005) между двумя ксенотрансплантатами по накоплению в опухоли, тогда как накопление радиоактивности у большинства нормальных тканей остается на том же уровне. Поглощение опухолью был более чем в 3 раза выше у LnCAP, чем у DU145. Это свидетельствует о специфичности 111In-11B6 к hK2.
На фиг. 14 представлена аминокислотная последовательность и структура эпитопа у PSA согласно Leinonen J. et al., Clin Chem. 2002, 48: 2208-2216.
На фиг. 15 представлен график Скэтчарда у типичного 5A10-Fab.
На фиг. 16 представлена кинетика мечения 177Lu-11B6.
На фиг. 17 представлена стабильность 177Lu-11B6 в PBS и EDTA in vitro.
На фиг. 18 представлены репрезентативные SPECT-снимки 177Lu-11B6 в ксенотрансплантатах LnCAP.
На фиг. 19 представлено биораспределение 177Lu-11B6 в ксенотрансплантатах LnCAP.
На фиг. 20 представлено детальное биораспределение 177Lu-11B6 через 72 ч после введения в ксенотрансплантатах LnCAP.
На фиг. 21 представлена биокинетика 177Lu-11B6 in vivo в ксенотрансплантатах LnCAP.
На фиг. 22 представлены репрезентативные фотографии размера опухоли до (слева) и после (справа) обработки 177Lu-11B6.
На фиг. 23 представлены эффекты (А) однократной дозы 177Lu-11B6, (В) двукратной дозы 177Lu-11B6 и (с) контрольной обработки на размеры опухоли у ксенотрансплантатов LnCAP.
На фиг. 24 представлены (А) данные о росте опухоли и (В) SPECT-снимок одного ксенотрансплантата LnCAP у мыши, получившей однократную дозу 177Lu-11B6.
Примеры
Нижеследующие примеры включены для демонстрации отдельных воплощений изобретения. Специалистам следует иметь в виду, что приведенные в данных примерах методы представляют собой методы, которые, как открыли авторы изобретения, хорошо работают при применении изобретения на практике, поэтому можно считать, что они составляют конкретные способы его осуществления. Однако специалистам в данной области должно быть понятно, в свете настоящего изложения, что можно производить разнообразные изменения в конкретных приведенных воплощениях и тем не менее получать сходные или близкие результаты, не отходя от сути и не выходя за рамки настоящего изобретения.
Пример 1. Биораспределение 125I-PSA30 и 125I-11B6
Материалы и методы. Антитела PSA30 и 11B6 метили 125I (PerkinElmer, USA) с помощью Iodogen. Вкратце, для мечения 200 мкг PSA30 использовали пробирку, покрытую 150 мкг 1,3,4,6-тетрахлор-3α,6α-дифенилгликолурила. После инкубации смеси в течение 15 мин при комнатной температуре удаляли низкомолекулярные компоненты при помощи гель-фильтрации (колонка PD-10, GE Healthcare, UK). После гель фильтрации радиохимическая чистота составляла 95%.
Результаты и обсуждение. См. фиг. 2 и 3. Опухоли LNCaP проявляли более сильное поглощение по сравнению с другими исследованными органами в большинстве временных точек с пиком (4.32% IA/г) через 24 ч после внутривенной инъекции состава с 125I-PSA30. В отличие от всех других органов, проявлявших снижение активности, опухоли LNCaP проявляли заметное повышение радиоактивности (на 32%) в течение первых 24 ч после введения. По сравнению с мышами без опухолей, сильно повышалось накопление в щитовидной железе. Поглощение mAb 125I-PSA30 в опухолях LNCaP достигал пика через 24 ч после введения, с последующим резким падением поглощения в опухоли, отмеченным через 72 ч после введения. Следует отметить, что в тот же момент времени отмечалось резкое возрастание поглощения в щитовидной железе. Такая обратная корреляция может означать то, что происходил эффект дегалогенирования. Таким образом, 125I-PSA30 может эффективно доставать fPSA у мышей с ксенотрансплантатами на основе LNCaP.
Пример 2. Биораспределение 111In-DTPA-11B6
Материалы и методы. Эксперименты на животных проводились в соответствии с национальным законодательством по защите лабораторных животных. Исследования на животных были одобрены местным комитетом по этике исследований на животных. В данном исследовании использовали самцов иммунодефицитных мышей nude (в возрасте 6-8 недель), приобретенных у Taconic Europe (Bomholt, Дания). Ксенотрансплантаты экспрессирующих hK2 клеток карциномы простаты LnCAP имплантировали подкожно в правый бок. Для ксенотрансплантации использовали клетки LNCaP по 5.2×106 клеток на мышь в 100 мкл клеточной среды и 100 мкл Matrigel (BD Sciences, Bedford, USA). Клетки DU145 (hK2-отрицательная линия клеток) по 1-2×106 имплантировали подкожно в правый бок в качестве отрицательного контроля. Через 3-6 недель после введения клеток LNCaP, мышам из 5 групп (4-5 животных на группу), несущих ксенотрансплантаты LNCaP, и 1 группы (3 животных на группу), несущих ксенотрансплантаты DU145, вводили внутривенно по 100 мкл 111In-DTPA-11B6 (~200 кБк в 100 мкл и 22,5 мкг белка). Животных забивали через различные промежутки времени: 4 ч, 24 ч, 48 ч, 72 ч или 168 ч после введения, а контрольную группу - через 48 ч после введения. Нужные органы (см. таблицу) помещали во флаконы на 20 мл для сцинтилляционного счетчика (Zinsser Analytic, Frankfurt, Германия), взвешивали и измеряли на автоматизированном гамма-счетчике с 3-дюймовым NaI(Tl)-детектором (1480 Wizard OY, Wallac, Turku, Финляндия). Все органы измерялись дважды: сразу после вскрытия и после последней временной точки. Измерение радиоактивности проводили по нижеследующей стандартной методике.
Измерение радиоактивности. Использовали стандартную методику для измерения радионуклидов. Для определения использовали импульсы в минуту с коррекцией на уровень фона. Величину поглощения в ткани, выраженную в процентах от введенной дозы на 1 г ткани (% введенная доза/грамм), рассчитывали следующим образом:
% введенная доза /грамм = (радиоактивность в ткани/введенная радиоактивность)/вес органа × 100,
где при внутривенном введении:
введенная радиоактивность = средняя радиоактивность в контрольном шприце - радиоактивность в использованном шприце - радиоактивность в хвосте.
Результаты и обсуждение. См. фиг. 8, 12 и 13. Предварительные результаты показали, что 111In-11B6 эффективно накапливается в опухоли с течением времени, достигая пика через 48 ч после введения при 16.4±1.92%IA/г (процент от введенной радиоактивности на 1 г). Поглощение радиоактивности в нормальных органах (печень, селезенка, почки, кости, простата, семенники) было на более низком уровне. Небольшое повышение поглощения наблюдалось в слюнных железах, вероятно, в связи с определенной нормальным уровнем экспрессии hK2 (фиг. 8). Это будет дополнительно исследовано в будущих работах. Кроме того, поглощение 111In-DTPA-11B6 был hK2-специфичным, так как в ксенотрансплантатах отрицательного контроля DU145 наблюдалось значительно меньшее поглощение (фиг. 13). Соотношение опухоль/кровь возрастало со временем, указывая на то, что все больше и больше 111In-DTPA-11B6 накапливается в опухоли (фиг. 12). Таким образом, данные по биораспределению 111In11B6 свидетельствуют о многообещающих свойствах наводки на опухоль при раке простаты, указывая на потенциал для лечения рака простаты с помощью других радионуклидов.
Пример 3. Ауторадиография с цифровым изображением
Материалы и методы. DAR проводили на животных, которым вводили 125I-PSA и 18F-холин. Животных забивали через 1 час после введения метаболических зондов и сразу же извлекали опухоли, заделывали в Cryomount (HistoLab Products AB, Швеция), быстро замораживали в жидком азоте и нарезали на срезы в 100 мкм для DAR или срезы в 20 мкм для гистопатологического и иммуногистохимического (IHC) анализа. Для визуализации распределения радиоактивности в более толстых срезах использовали систему с полосковым кремниевым детектором (Biomolex 700 Imager; Bimolex AS, Oslo). Для получения отдельных изображений по каждому радионуклиду у животных, которым вводили более одного радионуклида, в данном случае 125I и 18F, использовали различия в спектрах излучения и скорости распада.
Результаты и обсуждение. См. результаты на фиг. 4A-H. Исходя из этих данных, мы показали, что поглощение mAb PSA30 в извлеченных опухолях достигало пика через 24 ч после внутривенной инъекции и сохранялось в опухоли по сравнению с нормальными тканями. Относительно низкие соотношения Опухоль/Ткань (см. таблицу на фиг. 3) можно отнести к таким факторам, как экранирование сайта связывания, которое наблюдается при насыщении низкой дозы антитела антигенами fPSA в периваскулярном пространстве, что предотвращает более глубокое проникновение в твердую опухоль; недостаточная проницаемость сосудов внутри опухоли; или дейодирование антитела (о чем свидетельствует сильное накопление йода в щитовидной железе). Два способа улучшения соотношения Опухоль/Ткань состоят в увеличении дозы антитела и тестировании других радиоактивных меток. Несмотря на этот недостаток, мы обнаружили накопление радиоактивности 125I-PSA30 в опухолевой ткани.
Иммуногистохимия и гистопатология (см. результаты на фиг. 4A-H). Для исследования на PSA криосрезы опухолей в 20 мкм (замороженные и залитые, как описано выше) изучали при помощи IHC. Иммунореактивность против PSA или hK2 визуализировали с помощью набора DAKO EnVision Flex/HRP System kit (Dako Corporation). Смежные срезы опухолей также окрашивали гематоксилином (окрашивание на ядра) и эозином (окрашивание на цитоплазму (H&E) и анализировали общую морфологию под стандартным просвечивающим микроскопом. При окрашивании H&E окрашивались жизнеспособные участки на срезах опухолей и некротические зоны. В качестве положительного контроля срезы опухолей LNCaP инкубировали с mAb 2E9 к PSA при разведении 1: 1000 и визуализировали, как описано выше. В качестве отрицательного контроля визуализировали срезы опухоли мыши, получившей внутривенную инъекцию PSA30, без инкубации со вторичным антителом, но включая все остальные стадии IHC. Окрашенные срезы сканировали с помощью микроскопа-сканнера Carl Zeiss MIRAX Scan и анализировали с помощью программы MIRAX Viewer (Carl Zeiss Imaging Solutions GmbH, Германия).
Пример 4. Введение радиоактивных меток
Прямое йодирование (125I/124I/131I). Белки (10 мкл, 1 мг/мл в PBS) смешивали с 125I в виде раствора NaI (4 МБк) с помощью хлорамина-T (CAT, Sigma St. Louis, MO, USA). Реакцию запускали добавлением CAT в PBS (10 мкл, 2 мг/мл) и инкубировали в течение 1 мин при интенсивном встряхивании, а затем останавливали добавлением метабисульфита натрия (20 мкл, 2 мг/мл). Меченые белки отделяли от непрореагировавшего 125I и низкомолекулярных компонентов реакции методом эксклюзионной хроматографии на колонке NAP-5 (Sephadex G-25, GE Healthcare), предварительно уравновешенной с PBS.
Непрямое йодирование (125I/124I/131I/211At). Предшественник метки, N-сукцинимидил-n-(триметилстаннил)бензоат (SPMB), получали согласно Orlova et al. in Nucl Med Biol 27: 827-835 (2000) и добавляли 5 мкг SPMB к 5 МБк 125I или 211At в 5% растворе уксусной кислоты. Для запуска реакции добавляли 40 мкг хлорамина-T (Sigma, St. Louis, Mo.) в водном растворе. Реакционную смесь встряхивали в течение 5 мин, а затем добавляли 80 мкг метабисульфита натрия (Aldrich, Steinheim, Germany) в водном растворе для остановки реакции. Радиоактивно меченый предшественник добавляли в раствор 40 мкг белка в 0,07 М боратном буфере, pH 9,2. Реакцию конденсации проводили при комнатной температуре в течение 45 мин с непрерывным встряхиванием. Меченые варианты белков отделяли от низкомолекулярных продуктов на колонке NAP™-5 для эксклюзионной хроматографии (GE, Healthcare), уравновешенной в PBS. Затем варианты белков с радиоактивной меткой анализировали по методу IRMA (согласно Evans et al., submitted to CBR) для проверки того, что включение метки не повлияло на сродство связывания со своей мишенью.
Введение радиоактивной метки 177Lu. Конъюгирование изотиоцианат-бензил-CHX-Aʺ-DTPA (130 нМ) с белком (60 нМ) проводили в 220 мкл 0,7 М боратного буфера, рН 9,2 в течение ночи на водяной бане при 37°C. Конъюгированный с CHX белок очищали на колонке NAP-5 для эксклюзионной хроматографии (GE Healthcare, Uppsala, Sweden), используя в качестве элюента 0,2 М Na-ацетатный буфер pH 5,5, а затем разделяли на 10 порций, которые позже использовали для хелатирования. Продолжительность хелатирования оптимизировали путем отбора проб в процессе хелатирования и проверки чистоты хелатного комплекса на пластинках SG (Biodex) для мгновенной тонкослойной хроматографии (ITLC) с 0,2 М цитратным рабочим буфером. Пластинки анализировали на Cyclone Phosphorimager (Perkin Elmer, Wellesley, MA, USA). Как оказалось, комплексообразование завершалось через 30 мин при комнатной температуре. Количество радиоактивного лютеция варьировалось в зависимости от потребностей отдельных экспериментов.
Для проверки на присутствие слабо хелатированного 177Lu проводилась обработка EDTA. Тройные пробы хелатированного продукта обрабатывали EDTA при молярном избытке 200:1 или 1000:1 относительно хелатора с инкубацией при 37°C в течение ночи. Концентрацию EDTA рассчитывали в предположении, что конъюгирование было количественным, что давало в среднем две молекулы CHX-A-DTPA на 1 антитело. Затем образцы растворов анализировали методом ITLC, как указано выше. В качестве контроля тройные пробы [177Lu]-белка тоже держали в PBS при 37°C или 4°C в течение ночи.
Пример 5. Стабильность in vivo
Для анализа на стабильность радиоактивно меченых конъюгатов in vivo нормальным мышам внутривенно вводили радиоактивные метки и подвергали их эвтаназии через различные промежутки времени. Затем брали кровь и центрифугировали при 5000×g. Пробы крови затем разделяли на колонках NAP-5 (с отсечкой в 5 кДа), уравновешенных в PBS, и определяли относительную радиоактивность в высокомолекулярной фракции.
Пример 6. Выживаемость клеток для мониторинга эффектов терапии
Клетки высеивали в чашки Петри (диаметром 6 см, примерно 2×105 клеток на чашку. Через 48 ч к клеткам добавляли радиоактивно меченые белки (57 нг на чашку или 287 нг на чашку, что соответствует отношению антитело/антиген примерно 1:1 и 5:1). Для того, чтобы определить влияние 125/131I/177Lu в среде, некоторые чашки предварительно инкубировали с избыточным количеством немеченого белка (29 мкг на чашку). Для оценки числа распадов на 1 клетку (DPC) использовали дополнительные чашки. В этих чашках измеряли захват клетками белка с радиоактивной меткой в шести временных точках за время 24-часовой инкубации. Клетки затем промывали шесть раз холодной бессывороточной средой и продолжали инкубацию в свежей культуральной среде. Клетки подсчитывали примерно раз в неделю и пересеивали через каждые две недели. DPC определяли путем расчета площади под кривой захвата при двух концентрациях антител, а также для блокированных чашек. При самой низкой концентрации белка с радиоактивной меткой клетки получали примерно 56 DPC, а при самой высокой - примерно 150 DPC, тогда как блокированные клетки получали около 2 DPC. Полученные результаты анализировали методом нелинейной регрессии (экспоненциальный рост), используя в качестве весового коэффициента 1/Y2.
Пример 7. Исследования in vivo
Использовали следующие модели привитых опухолей: ксенотрансплантаты клеток LnCAP, DU145, PC-3. PSA экспрессируется во всех трех линиях клеток, тогда как hK2 экспрессируется в LnCAP и не экспрессируется в DU145 или PC-3.
Для ксенотрансплантации клетки LNCaP, DU145 или PC-3 (2-10 миллионов клеток), собранные в PBS с 0,02% трипсина, ресуспендировали в среде и вводили подкожно в правый бок в виде 200 мкл клеточной суспензии, содержащей равное количество матригеля (BD Biosciences, Bedford, MA). Формирование опухоли контролировали визуально или при помощи пальпации.
Эксперимент по блокированию. Эксперимент по блокированию в Эксперименте I по Биораспределению проводили с целью установить, что захват радиоактивно меченых белков в опухолях был специфичным к hK2 или нет. В блокированной группе мышей перед основным внутривенным введением белка с радиоактивной меткой внутривенно вводили 0,8-3,0 мг немеченого белка. Сравнивали включение радиоактивности через 24-72 ч после введения между блокированной и неблокированной группами.
Оптимизация удельной активности. Этот эксперимент проводится для определения влияния удельной активности (т.е. введенной дозы белка с радиоактивной меткой) на поглощение опухолью. Готовили серийные разведения меченного 177Lu белка с различной заданной удельной активностью. Порцию меченного 177Lu белка разводили исходным раствором немеченого белка, получая дозы для введения от 10 мкг до 500 мкг на 1 мышь с LnCAP. Через 2-3 дня после введения животных подвергали эвтаназии. Извлекали органы и опухоли и измеряли захват радиоактивности. Удельную активность, обеспечивающую наиболее оптимальное поглощение в опухоли, также учитывали для дозиметрии.
Пример дозиметрического определения. Мышам с LnCAP (4 мыши на группу) вводили Lu-меченый белок. Животных подвергали эвтаназии через 4 ч - 2 недели после введения. Рассчитывали поглощенную дозу в различных органах по схеме MIRD. Для всех тканей представляющих интерес органов в организме (животного) получали кривые время-активность. Исследования основываются на количественной интраскопии методом SPECT и/или PET. Интегрирование кривых дает совокупную активность. По системе MIRD исходили из наших собственных расчетных значений S (на основе конкретной геометрии по методу Monte Carlo для поглощенных доз) для преобразования совокупной активности в поглощенные дозы. Во многих случаях нужно тщательно рассчитывать перекрестные дозы, а это значит, что нужно делать дозиметрические расчеты по методу Monte Carlo (Hindorf et al. (2004) J. Nuc. Med., 45: 1960-1965; Larsson et al. (2007) Cancer Biotherapy & Radiopharmaceuticals, 22: 438-442; Larsson et al. (2011) Acta Oncol., 50: 973-980).
Примеры интраскопии SPECT и PET. Интраскопия методом PET-CT и SPECT-CT является неотъемлемой частью радионуклидной терапии. Она дает представление о том, в какой степени накапливается радиоактивный материал в тканях, и помогает получить оценку требуемой терапевтической дозы и ее эффектов. Для хороших результатов лечения необходимо ввести опухоль достаточную дозу облучения. Это проверяется при помощи интраскопии, как изложено в ссылках, приведенных выше в отношении планирования дозы, содержание которых включено сюда путем ссылки.
Радиобиология. Для надлежащей дозиметрии применяются специфические методы дозиметрии на основе индивидуальной геометрии пациента/лабораторного животного, которые можно связать с биологическими эффектами и провести корреляцию с радиобиологическими эффектами для оптимизации терапии индивидуальных пациентов.
Пример 8. Определение сродства связывания
Метод Скэтчарда
Сродство связывания (Kd) у полученных вариантов антител определяли по методу Скэтчарда согласно Scatchard, Ann N Y Acad Sci. 51: 660-72 (1949).
Вкратце, использовали фиксированные концентрации антител (или же, в данном случае, Fab-фрагментов антител) при варьирующей концентрации Eu3+-меченого PSA.
Поверхностный плазмонный резонанс
Кинетику связывания и сродство у вариантов антител также можно определить путем анализа в реальном времени биоспецифического взаимодействия на приборе Biacore. Вкратце, на сенсорном чипе СМ5 иммобилизируют PSA или hK2 посредством конъюгации по аминогруппе, при этом степень иммобилизации достигает 1000-2000 единиц. Различные производные антител (mAb или Fab) против PSA или против hK2 разводят до концентраций в пределах 0,1-10 нМ в буфере HBS-EP. Кинетику связывания изучают в течение 5-минутной фазы ассоциации и 30-минутной фазы диссоциации при скорости протока 50 мкл/мин с последующей регенерацией. Кинетические константы рассчитывают, используя модель связывания Лэнгмюра 1:1 с поправкой на массообмен.
Пример 9. Иммунорадиометрический анализ (IRMA)
Иммунорадиометрический анализ (IRMA) на основе моноклональных антител на качество связывания радиоактивно меченых mAb или Fab's проводили в трех повторах в виде 4-стадийного определения со стадиями отмывки между инкубациями (отмывочный буфер: 10 мМ трис-HCl pH 8,0, 0,15 М NaCl, 0,05% Tween 20). Метод разрабатывали и оптимизировали в соответствии с общепринятыми рекомендациями. Микропланшеты покрывали моноклональным антителом H117 (0.2 мкг на лунку), распознающим свободный или общий PSA и калликреин-2 человека (hK2) с одинаковым сродством, разбавляли покрывающим буфером (75 мМ карбоната натрия, pH 9,6) и инкубировали в течение ночи при 4°C. Затем лунки инкубировали с гасящим буфером (3% рыбьего желатина в отмывочном буфере) при 0.2 мкг на лунку в течение 2 часов при комнатной температуре. Далее в лунки вносили по 200 мкл плазмы (самки), содержащей 3 нг/мкл fPSA, и инкубировали 2 часа при комнатной температуре. Затем смешивали вместе радиоактивно меченое и немеченое антитело PSA30 в буфере для определения (50 мМ трис-HCl pH 7,5, 0,1 М NaCl, 5 мМ EDTA, 0,25% BSA и 0,05% Tween 20) при убывающих концентрациях и вносили в лунки (общий объем: 50 мкл на лунку). Содержание меченого антитела на лунку составляло: 100, 92, 84, 68, 50, 30 и 0 процентов. Планшеты инкубировали 2 часа при комнатной температуре, промывали и просчитывали на счетчике с NaI(Tl)-колодцем (1282 Compugamma CS; LKB Wallac, Turku, Финляндия). Для дальнейшей работы была принята разность в детектирующей способности <25% относительно теоретического разброса. Оценки по детектированию после введения метки показали, что антитело с радиоактивной меткой сохраняло 70-90% сродства/емкости связывания немеченого антитела.
Пример 10. Радиоиммунотерапия с помощью 177Lu-m11B6 на мышиной модели рака простаты
Рак простаты является наиболее распространенным диагнозом рака среди мужчин в Западном мире, составляя 25% от всех новых случаев рака и 14% смертей от рака (22700443). Текущие стратегии лечения (хирургия и облучение) успешны только тогда, когда злокачественные новообразования локализуются в предстательной железе. Стратегия лечения в случае диссеминированного заболевания ограничивается кастрацией, которая зачастую подавляет рост только на 12-18 месяцев, а затем уже не поддается лечению, несмотря на лишенную гормонов среду (Scher HI et al., Cancer of the prostate. In: DeVita VT Jr, Hellman S, Rosenberg SA, eds. 7th ed. Philadelphia, PA: Lippincott, Williams & Wilkins, 2005). Из-за отсутствия способов лечения, которые бы давали эффект посильнее кратковременной реакции, настоятельно требуются новые прицельные молекулярные терапии. Поскольку рак простаты является радиочувствительным, то он представляет идеальную мишень для радиоиммунотерапии. К тому же радиоиммунотерапия обычно приносит высокий уровень циркулирующих антител в костный мозг и лимфатические узлы, куда обычно распространяется рак. Кроме того, при радиоиммунотерапии используется "эффект перекрестного огня", который, в зависимости от спектра излучаемых частиц данного радиоизотопа, может уничтожать окружающие антиген-отрицательные неканонические раковые клетки без прямого связывания антитела (16029058).
Калликреин-2 (hK2) человека является андроген-зависимым ферментом, который экспрессируется при очень высоких концентрациях только в здоровой или злокачественной ткани предстательной железы. Поскольку было показано, что hK2 расщепляет зимогенную форму специфического антигена простаты (PSA), то считается, что его физиологические функции состоят в том, чтобы действовать в качестве регулятора этого фермента. В целом эти биологические особенности делают hK2 оптимальной мишенью в системе терагностики (терапии и диагностики).
Целью данного исследования было подтверждение полезности mAb 11B6, которое специфично нацелено на эпитоп внутри каталитической расщелины hK2, в качестве средства для доставки высокотоксичных радионуклидов специально в зоны роста рака простаты. В этом исследовании для проверки концепции в качестве метки для mAb мы выбрали 177Lu, дающий бета-частицы с низкой энергией, а также гамма-излучение, что позволяет получать SPECT-изображения.
Материалы и методы
Материалы
177Lu приобретали у Mallinkrodt Medical BV, Petten, Голландия. Для измерения радиоактивности на полосках для ITLC (мгновенная тонкослойная хроматография) (Biodex, US) использовали установку Cyclone™ Storage Phosphor System и программное обеспечение для анализа изображений OptiQuant™ (Perkin Elmer, Wellesley, MA, USA) для определения кинетики включения метки и радиохимической чистоты. Все химические реактивы получали от Sigma Alchrich, а буферы готовили на месте с использованием воды аналитической степени чистоты, если не указано иначе. Антитело mAb 11B6 специфично к калликреину-2 человека со сродством к этому антигену порядка 1,2 нМ; см. SEQ ID NOs: 4 и 5 выше (получали из University of Turku, Финляндия). Для исследований in vivo использовали линию клеток рака простаты LNCaP, экспрессирующих hK2 (АТСС, Manassas, VA, USA). Клетки культивировали в среде RPMI 1640 с добавлением 10% эмбриональной телячьей сыворотки и PEST (пенициллин 100 IU/мл и стрептомицин 100 мкг/мл). Клетки содержали при 37°C в увлажненном инкубаторе с 5% CO2 и отделяли при помощи раствора трипсин-EDTA (0.25% трипсина, 0.02% EDTA в буфере фирмы Thermo Scientific).
Конъюгирование и введение радиоактивной метки
Конъюгирование CHX-A"-РТРА с 11B6. Раствор mAb 11B6 в PBS доводили до pH 9.2 с помощью 0,07 М Na-боратного буфера. Образец концентрировали на центрифужном фильтре Amicon Ultra-2 (2 мл, 100 K). Раствор белка подвергали конъюгации с хелатором CHX-Aʺ-DTPA (Macrocyclics, USA) при молярном соотношении хелатора к антителу 3:1 при 40°C. Через 4 часа реакцию останавливали и отделяли CHX-Aʺ-DTPA-11B6, который в дальнейшем именуется DTPA-11B6, от свободного хелата методом эксклюзионной хроматографии на колонке NAP-5 (GE Healthcare), уравновешенной с 20 мл 0,2 М NH4-ацетатного буфера, pH 5,5. Конъюгированные 11B6 и 5A10 элюировали с помощью 1 мл NH4-ацетатного буфера.
Введение радиоактивной метки в DTPA-11B6. DTPA-11B6 в NHf-ацетатном буфере pH 5.5 смешивали с заданным количеством 177LuCl3. После инкубации при комнатной температуре в течение 2 ч мечение останавливали и подвергали очистке на колонке NAP-5, уравновешенной с PBS. Эффективность и кинетику включения метки контролировали с помощью полосок для ITLC, которые элюировали 0,2 М лимонной кислотой. В этой системе радиоактивно меченый конъюгат остается на стартовой линии, тогда как свободный Lu-177 мигрирует с фронтом растворителя. Распределение радиоактивности определяли на установке Phosphorlmager (Perkin Elmer, Wellesley, MA, USA), используя для количественной обработки программу Optiquant (Perkin Elmer, Wellesley, MA, USA).
Поверхностный плазмонный резонанс
Белок hk2 (Department of Biotechnology, Turku, Finland) в 10 мМ NaAc-буфере, pH 4,0 иммобилизировали на чипе CM4 для исследований, приобретенном у Biacore, путем конденсации по аминогруппе с помощью N-гидроксисукцинимида (NHS), 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида (EDC) и 1М этаноламин гидрохлорид-NaOH pH 8,5 в системе Biacore 2000. Антитело mAb 11B6, его конъюгат DTPA-11B6 и Herceptin в качестве неспецифического контрольного mAb, все в буфере Biacore, пропускали через две проточные ячейки в пяти различных концентрациях (0,5 нМ, 5 нМ, 10 нМ, 50 нМ и 100 нМ) для выявления возможного связывания. Одна из двух проточных ячеек содержала иммобилизованный hK2, а другая служила холостой пробой. Чип регенерировали с помощью 25 мМ глицинового буфера, pH 2,7.
Исследования стабильности in vitro
Стабильность меченых конъюгатов проверяли в PBS при 500-кратном избытке EDTA относительно DTPA, конъюгированного на m11B6, путем инкубации при 4°C в течение 1 недели и 2 недель и анализа на полосках для ITLC, см. выше.
Исследования на животных
Все эксперименты на животных проводились в соответствии с национальным законодательством по защите лабораторных животных. Исследования на животных были одобрены местным комитетом по этике исследований на животных. В данном исследовании использовали самцов иммунодефицитных мышей nude линии NMRI (в возрасте 6-8 недель), приобретенных у Taconic Europe (Bomholt, Дания).
Ксенотрансплантаты экспрессирующих hK2 клеток карциномы простаты LnCAP имплантировали подкожно в правый бок и/или левый бок, примерно по 10×106 клеток на инъекцию.
Животных, у которых возникали опухоли LNCaP, разбивали на группы и вводили им терапевтическое средство 177Lu-DTP-11B6 либо контроль, см. ниже таблицу 1.
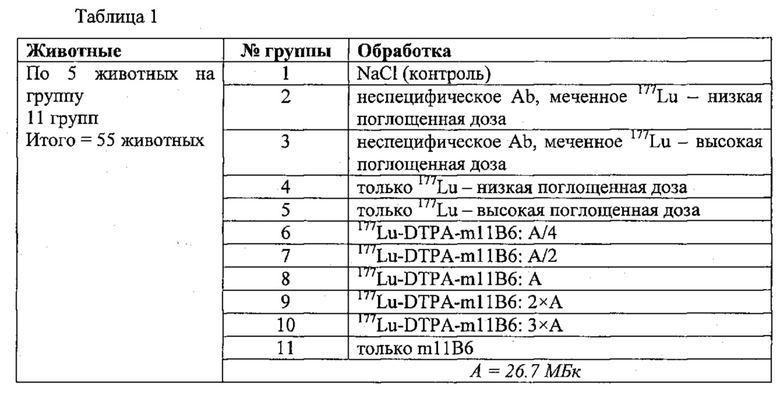
Всех включенных животных постоянно измеряли и взвешивали с интервалом в 3-4 дня.
Сначала некоторые животные получали более низкую радиоактивность (8 МБк) из 177Lu-DTPA-11B6 для исследования локализации терапевтического средства методом SPECT. Одну мышь из группы 8 также изучали методом SPECT. У этих животных извлекали органы, а для количественной оценки радиоактивности в образцах ткани этих органов использовали автоматизированный счетчик с NaI(Tl)-колодцем и 3-дюймовым NaI(Tl)-детектором (1480 WIZARD, Wallac Оу, Turku, Финляндия).
Для изучения влияния на костный мозг регулярно брали пробы крови (10 мкл). Пробы крови брали два раза в неделю на протяжении 8 недель после введения и делали анализ на лейкоциты, эритроциты и тромбоциты на анализаторе Medonic Cell Analyzer-Vet CA530 Vet (Boule Medical, Stockholm, Швеция). Во время взятия проб крови отмечали вес и физическое состояние животных. Токсичность оценивали путем мониторинга животных на потерю массы тела, ухудшение общего состояния и гематологическую токсичность.
Объем опухолей измеряли с помощью штангенциркуля. Измеряли длину 1, ширину w и толщину t и рассчитывали объем.
Фармакокинетика
Для исследования биокинетики 111In-m11B6 мышам в хвостовую вену вводили 25 мкг меченного радионуклидом антитела m11B6. Через регулярные промежутки времени животных забивали.
Вкратце, мышиное mAb 11B6 конъюгировали с CHX-Aʺ-DTPA и метили 111In, получая 111In-CHX-A"-DTPA-11B6 (111In-DTPA-11B6). Опыты по биораспределению проводили на модели hK2- и AR-положительных (LNCaP) ксенотрансплантатов PCa. В качестве контроля использовали ксенотрансплантаты DU-145 (hK2- и AR-отрицательные). Животных линии NMRI nude подвергали эвтаназии через заданные промежутки времени, вскрывали и извлекали органы для измерения радиоактивности. Проводили микро-интраскопию методом SPECT. Делали срезы опухолей, проводили их окрашивание и авторадиографию. Некоторым животным перед введением 111In-DTPA-11B6 вводили нерадиоактивное мышиное mAb 11B6, чтобы блокировать захват радиоактивно меченого 11B6.
Биокинетику 177Lu-m11B6 изучали таким же образом, как и при изучении 111In-m11B6.
Сбор данных и дозиметрия
Для определения поглощенной дозы в различных органах-мишенях применяли схему MIRD (1) вместе со специфичными для мыши S-факторами. Количество распадов (накопленную радиоактивность) выводили из кинетических данных по 111In-m11B6. По точкам строили биэкспоненциальные графики по методу наименьших квадратов, а число распадов рассчитывали в виде интеграла этих выражений, умноженного на коэффициент распада. Накопленную радиоактивность для костного мозга определяли, исходя из крови (2), при этом предполагается, что радиоактивность в костном мозге пропорциональна радиоактивности в крови. Считается, что соотношение костный мозг/кровь (RMBLR) составляет 0,36 (2), которое также использовали в данном исследовании.
Для определения специфичных для мыши S-факторов использовали вариант фантома MOBY (3), в котором можно задавать размеры органов. Средний вес извлеченных органов определяли из кинетического исследования вместе со средним общим весом. Затем при рендеринге гибких поверхностей NURBS создавали специфичный для данной линии фантом. Фантом подвергали вокселизации на 160×160×400 вокселей. Добавляли подкожную опухоль на левом боку в виде сферы вне нормального контура кожи, но в виде эллипсоида с короткой осью в половину радиуса сферы перпендикулярно контуру кожи и длинной осью в качестве радиуса сферы. Вручную добавляли к фантому слюнные железы и предстательную железу в виде сфер с радиусом, коррелирующим со средним весом органов.
Затем фантом служил в качестве входного для симуляции методом Monte Carlo S-факторов для 177Lu и 111In с кодом MCNPX 2.6, как описано в более ранней работе (4).
Планирование лечения
Исходя из соотношения между поглощенной дозой и биологическим эффектом на костный мозг у крыс, подвергавшихся радиоиммунотерапии с помощью 90Y и 177Lu (Larsson et al., 2012, Med. Phys. 39(7): 4434-43), можно полагать, что LD50 для костного мозга будет составлять порядка 12 Гр. В литературе значения LD50 при остром облучении у крыс и мышей одинаковы, примерно 9 Гр (к примеру, см. Radiobiology for the radiologist, Hall & Giacca (Eds), 2006, 6th edition).
Затем разрабатывали лечение в предположении о переносимой костным мозгом поглощенной дозе в 12 Гр. Затем по данным дозиметрии рассчитывали активность, соответствующую этой поглощенной дозе. Затем составляли лечебные группы, получающие A/4, A/2, A, 2×A и 3×A. Соответствующие активности использовали и для контролей.
Результаты
Радиоактивное мечение 177Lu-DTPA-m11B6
Результаты по кинетике мечения на фиг. 16 свидетельствуют, что эффективность включения метки очень высока, достигая 90% после 2 ч инкубации. Это обеспечивает вероятность отличной эффективности терапии с незначительным влиянием неконъюгированного 177Lu.
Результаты по стабильности in vitro в PBS и EDTA свидетельствуют о хорошей стабильности по времени почти без изменений на протяжении двух недель (см. фиг. 17). Кроме того, не наблюдается никакой разницы между инкубацией в PBS и EDTA, что указывает на очень хороший химизм конъюгирования, обеспечивающий стабильность in vivo с длительным временем удержания и циркуляции.
Интраскопия
Снимки методом SPECT на фиг. 18 показывают распределение 177Lu-DTPA-m11B6 у мышей nude с ксенотрансплантатами (которым вводили 8 МБк). Пояснения к снимкам на фиг. 18 приведены в таблице 2.

В первом столбце для мыши S1 представлено отличное поглощение в опухоль у мыши S1 с возрастанием поглощения через 48, 72 и 168 ч после введения. Во втором столбце представлена мышь S2 через 72 и 168 ч с таким же высоким поглощением опухолью. В столбце 3, строка 2, представлена мышь S3 через 72 ч после введения с таким же высоким поглощением опухолью. В строке 3, столбец 3, представлена мышь S8 через 168 ч после введения с отсутствием поглощения в опухоль после блокировки нерадиоактивными антителами, что свидетельствует о специфичности m11B6 при таргетировании опухоли. Близкие результаты для мыши S9 в столбце 4, строка 3. Наконец, у мыши S11 в столбце 4, строка 2, наблюдается отсутствие поглощения в опухоль из клеток линии DU145, которая не является специфичной для антитела m11B6.
Эти результаты свидетельствуют о высокой специфичности m11B6, что приводит к высокому накоплению в опухолях.
Биораспределение
Результаты биокинетического исследования 111In-m11B6 изложены в примере 2 выше. Отмечается накопление в опухолевой ткани с максимумом в 16% IA/г через 48 ч; все другие органы проявляют снижение активности, за исключением слюнных желез (см. фиг. 8). Таким образом, получено высокое соотношение опухоли к нормальным органам, что является необходимым условием для высокой эффективности терапии.
Данные по биораспределению для 177Lu-m11B6 (через 72 ч и 168 ч) представлены на фиг. 19. При этом отмечается гораздо большее накопление радиоактивности по сравнению с 111In-m11B6, почти 30% IA/г через 168 ч. Это еще больше подчеркивает возможность высокой терапевтической эффективности с радиоактивно меченым антителом 11B6.
Подробные результаты через 72 ч после введения при блокировании вместе с использованием линии опухолевых клеток DU-145 представлены на фиг. 20. Здесь представлено распределение 177Lu-DTPA-m11B6 из приведенного выше исследования SPECT на мышах с LnCaP или DU-145 и блокирования Ag hK2 с предварительным введением неконъюгированного 11B6. Как видно в деталях, блокирование и линия опухолевых клеток DU-145 приводят к отсутствию поглощения в опухолях, что свидетельствует о высокой специфичности m11B6.
Дозиметрия
На фиг. 21 представлены результаты исследования по биокинетике 111In-m11B6, использовавшиеся для расчетов по дозиметрии. На каждом графике в составном рисунке верхняя пунктирная линия представляет результаты кинетического исследования с одним стандартным отклонением, сплошная кривая - аппроксимация биэкспоненциальной функцией, а нижняя пунктирная кривая - с учетом распада 111In. Площадь под нижней пунктирной кривой представляет накопленную активность, используемую при расчетах по дозиметрии.
На основе биокинетики, приведенной на фиг. 21, рассчитывали накопленные активности. Затем, используя значения S для 111In, рассчитывали поглощенную дозу на единицу активности (Гр/МБк). Ниже в таблице 3 приводятся результаты для 111In.
Исходя из предположения о том, что та же самая биокинетика может использоваться и для 177Lu-m11B6, рассчитывали соответствующие накопленные активности вместе с их физическим временем полужизни. Используя значения S для 177Lu, рассчитывали поглощенную дозу на единицу активности. Предположение о сходной биокинетике подтверждается результатами по захвату 177Lu-m11B6, которые дают такие же значения поглощения, как и для 111In-m11B6 (см. фиг. 8 и 19).
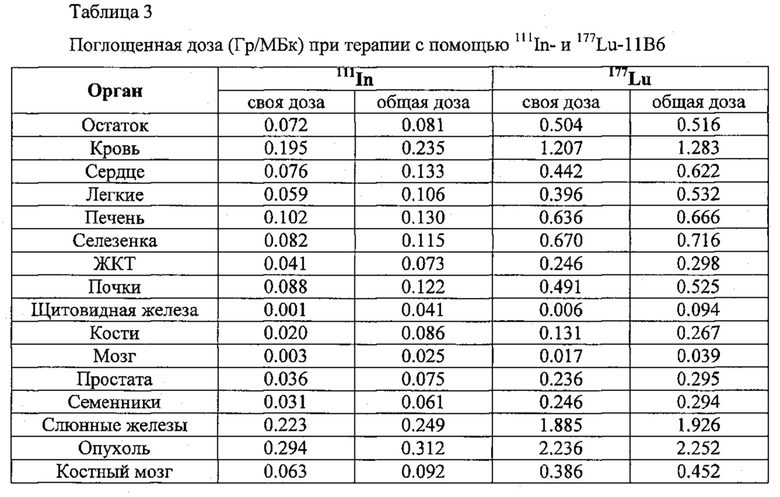
Исходя из значения LD50 для костного мозга в 12 Гр, может вводиться доза в 26,7 МБк. Это означает, что поглощенная доза для опухоли составляет 60 Гр.
Пересчет поглощенной дозы для опухоли (в предположении о том, что кинетика 111-In-m11B6 будет такой же, как у 177Lu-m11B6) и замена значений поглощения через 72 ч после введения (с 16% IA/г на 20% IA/г) и через 168 ч после введения (с 15% IA/г на 28% IA/г) дает поглощенные дозы, приведенные ниже в таблице 4. Видно, что тогда поглощенная доза для опухоли возрастает с 60 Гр до 120 Гр.
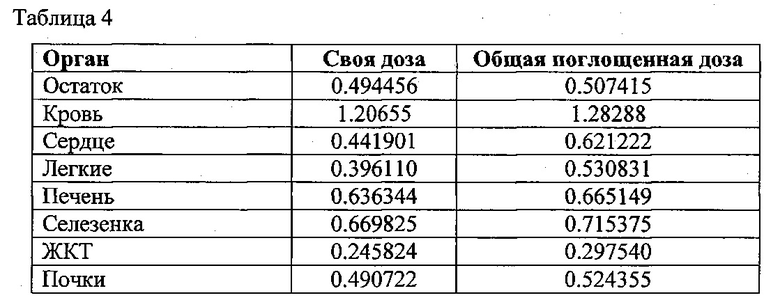
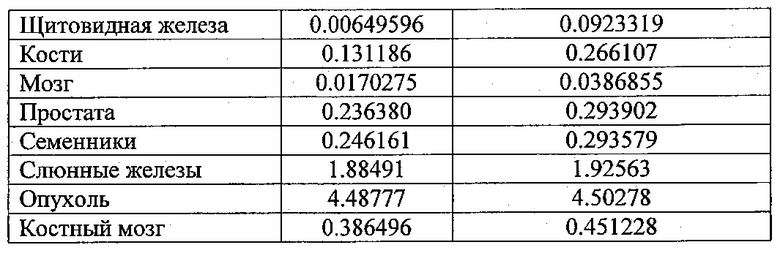
Вышеприведенные расчеты по дозиметрии основываются на надлежащей модели дозиметрии; биокинетика свидетельствует, что терапевтическая поглощенная доза может вводиться в опухоли в безопасных пределах токсичности для костного мозга.
Уменьшение опухолей у животных
На фиг. 22 видно, как у одной из мышей опухоль (видна на боку у животного, под кожей) уменьшается в объеме после лечения.
Результаты радиоиммунотерапии
На фиг. 23 представлены результаты по опытным группам при введении радиоактивности: (А) D, (В) 2×D и (С) контрольная группа (при этом D=26.7 МБк).
Существует четкая тенденция к уменьшению объема опухолей в обеих опытных группах. Начало уменьшения опухолей наблюдается уже через несколько дней после введения 177Lu-m11B6. В контрольной группе отмечается увеличение объема опухолей после инъекции раствора NaI.
На фиг. 24(А) представлены результаты для одной из мышей в группе с введением активности A. При этом опухоль неуклонно растет с первого по шестой день, когда вводится активность A 177Lu-m11B6. После обработки наблюдается быстрое падение объема опухоли.
В исследовании SPECT (8 дней после введения) представлен объем опухоли, в которой еще присутствует активность; см. фиг. 24(В).
Заключение
В настоящем исследовании с типичным антителом 177Lu-m11B6 четко продемонстрирована терапевтическая эффективность против опухолей рака простаты in vivo.
И теоретические расчеты на основе специальной модели дозиметрии, и измерение биокинетики in vivo свидетельствуют о благоприятной дозиметрии, дающей высокое терапевтическое соотношение. Затем это проверяли в исследовании на животных с хорошими результатами терапии, показывающими быстрое уменьшение объема опухолей.
БИБЛИОГРАФИЯ
1. Bolch WE, Eckerman KF, Sgouros G, Thomas SR. MIRD pamphlet No. 21: a generalized schema for radiopharmaceutical dosimetry - standardization of nomenclature. J Nucl Med. 2009, 50: 477-484.
2. Sgouros G. Bone marrow dosimetry for radioimmunotherapy: theoretical considerations. J Nucl Med. 1993, 34: 689-694.
3. Segars WP, Tsui BM, Frey EC, Johnson GA, Berr SS. Development of a 4-D digital mouse phantom for molecular imaging research. Mol Imaging Biol. 2004, 6: 149-159.
4. Larsson E, Strand SE, Ljungberg M, Jönsson BA. Mouse S-factors based on Monte Carlo simulations in the anatomical realistic Moby phantom for internal dosimetry. Cancer Biother Radiopharm. 2007, 22: 438-442.
5. Erik Larsson, Michael Ljungberg, Linda Mårtensson, Rune Nilsson, Jan Tennvall, Sven-Erik Strand and Bo-Anders Jönsson. Use of Monte Carlo simulations with a realistic rat phantom for examining the correlation between hematopoietic system response and red marrow absorbed dose in Brown Norway rats undergoing radionuclide therapy with 177Lu- and 90Y-BR96 mAbs. Medical.
6. Linda Mårtensson, Zhongmin Wang, Rune Nilsson, Tomas Ohlsson, Peter Senter, Hans-Olov Sjögren, Sven-Erik Strand, Jan Tennvall. Determining maximal tolerable dose of the monoclonal antibody BR96 labeled with 90Y or 177Lu in Rats: Establishment of a syngeneic tumor model to evaluate means to improve radioimmunotherapy. Clin Cancer Res 2005, 11: 7104s-7108s. 2005.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИПЕПТИДЫ АНТИТЕЛ И ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2687163C1 |
| ПОЛИПЕПТИДЫ АНТИТЕЛ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2753677C2 |
| НОВЫЕ РАДИОИММУНОКОНЪЮГАТЫ И ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2560587C9 |
| Новые радиоиммуноконъюгаты и их применения | 2011 |
|
RU2664475C1 |
| СРЕДСТВО И СПОСОБ ЛЕЧЕНИЯ ПЛОСКОКЛЕТОЧНОГО РАКА | 1996 |
|
RU2193779C2 |
| МЕЧЕННОЕ РАДИОАКТИВНЫМ МЕТАЛЛОМ АНТИТЕЛО ПРОТИВ КАДГЕРИНА | 2011 |
|
RU2577125C2 |
| ПАРААМИНОГИППУРОВАЯ КИСЛОТА (ПАГ) КАК ВЕЩЕСТВО ДЛЯ ЗАЩИТЫ ПОЧЕК | 2020 |
|
RU2804349C2 |
| АНТИТЕЛА ПРОТИВ ВСПОМОГАТЕЛЬНОГО БЕЛКА РЕЦЕПТОРА ЧЕЛОВЕЧЕСКОГО ИНТЕРЛЕЙКИНА-1 (IL1RAP) И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2710787C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА К CD151 ДЛЯ ЛЕЧЕНИЯ РАКА | 2007 |
|
RU2464041C2 |
| ЛЕЧЕНИЕ В-КЛЕТОЧНЫХ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛ ПРОТИВ CD40L В КОМБИНАЦИИ С АНТИТЕЛАМИ ПРОТИВ CD20 И/ИЛИ ХИМИОТЕРАПИЕЙ И ЛУЧЕВОЙ ТЕРАПИЕЙ | 2000 |
|
RU2305561C2 |






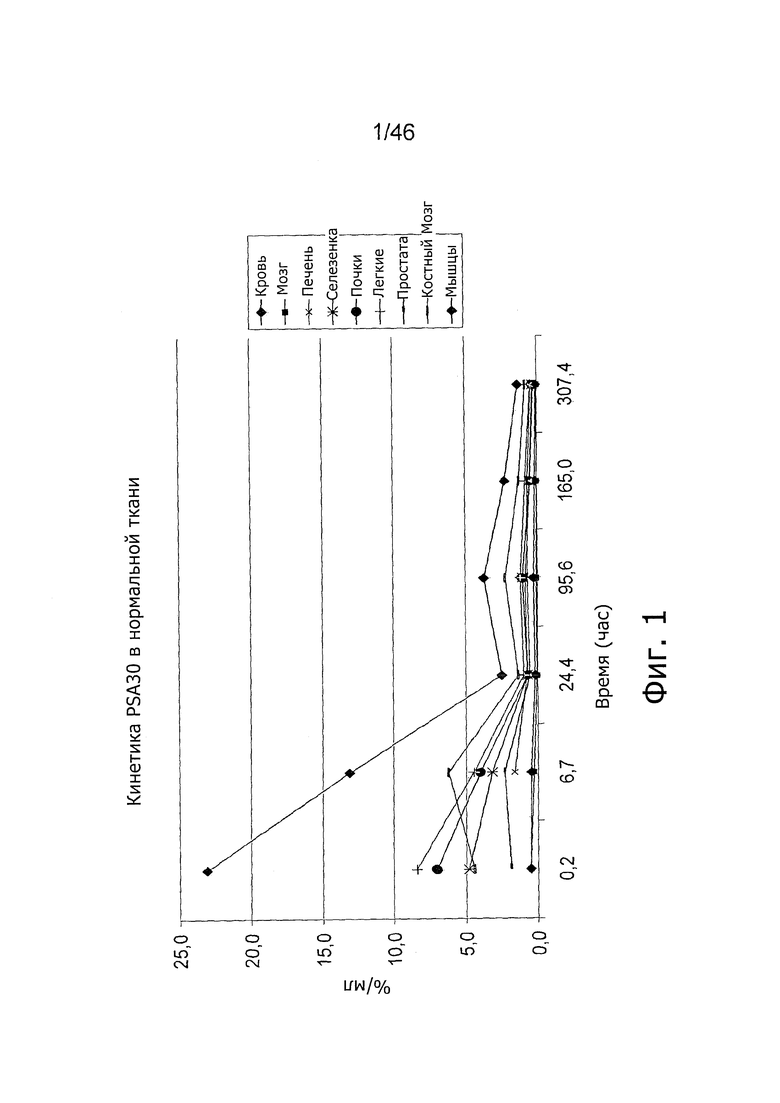
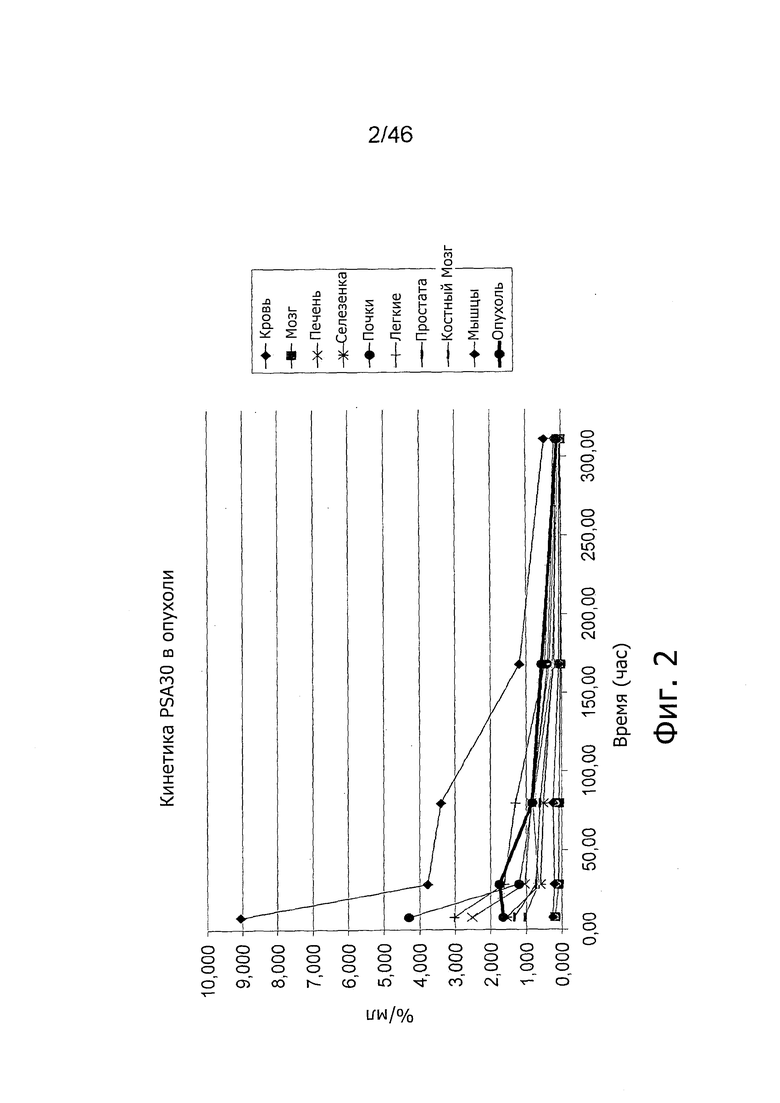
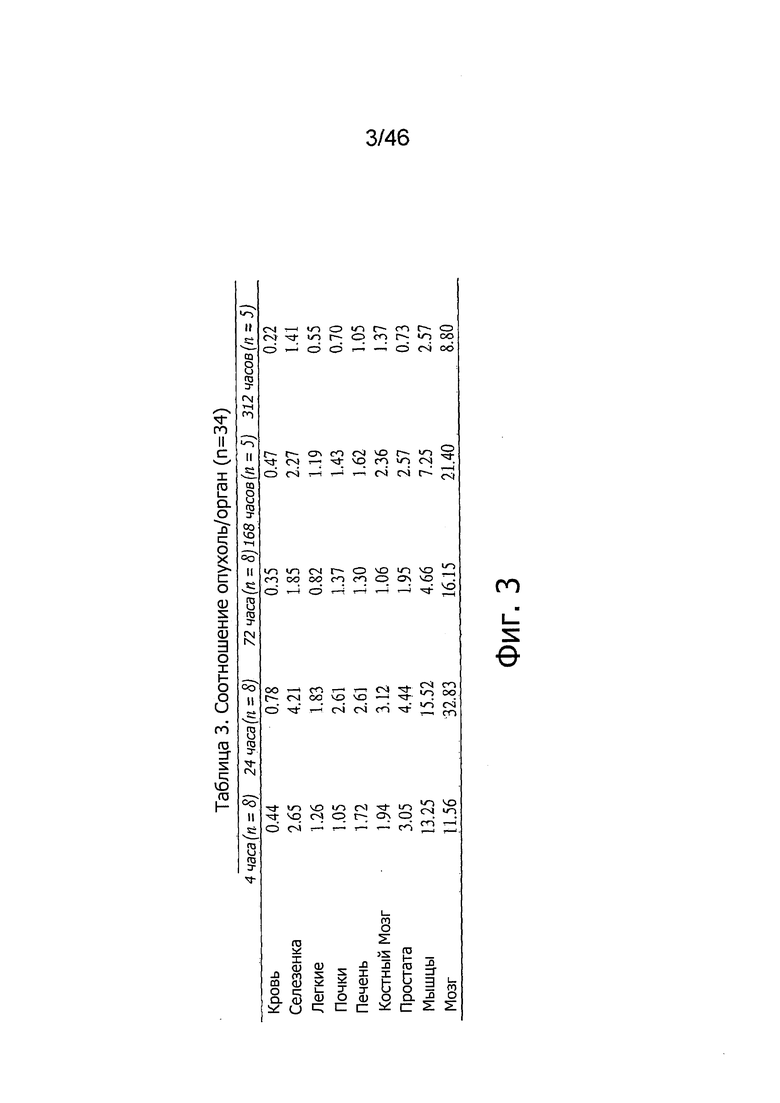
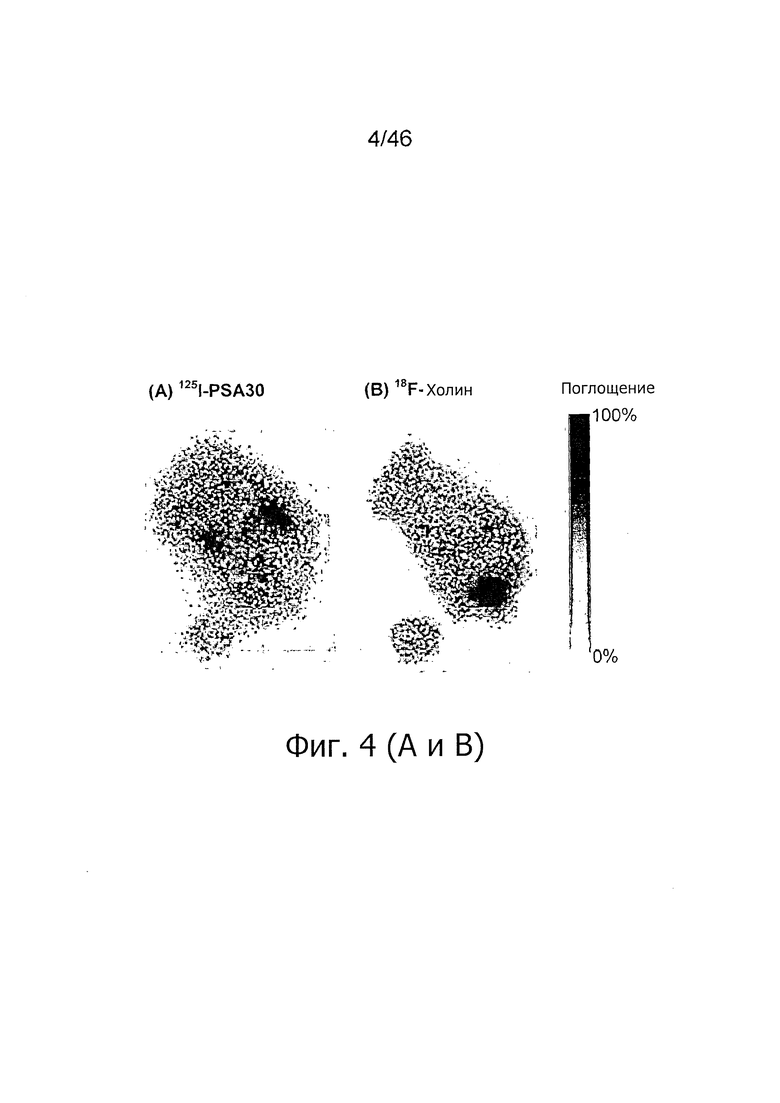
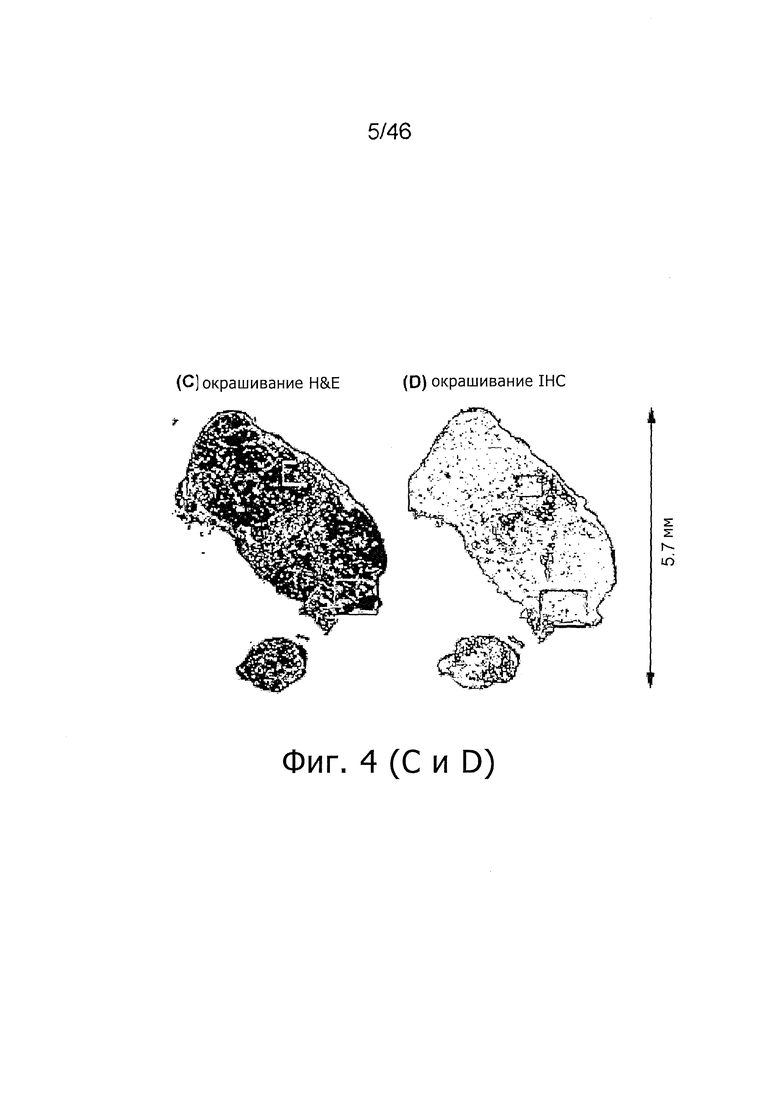

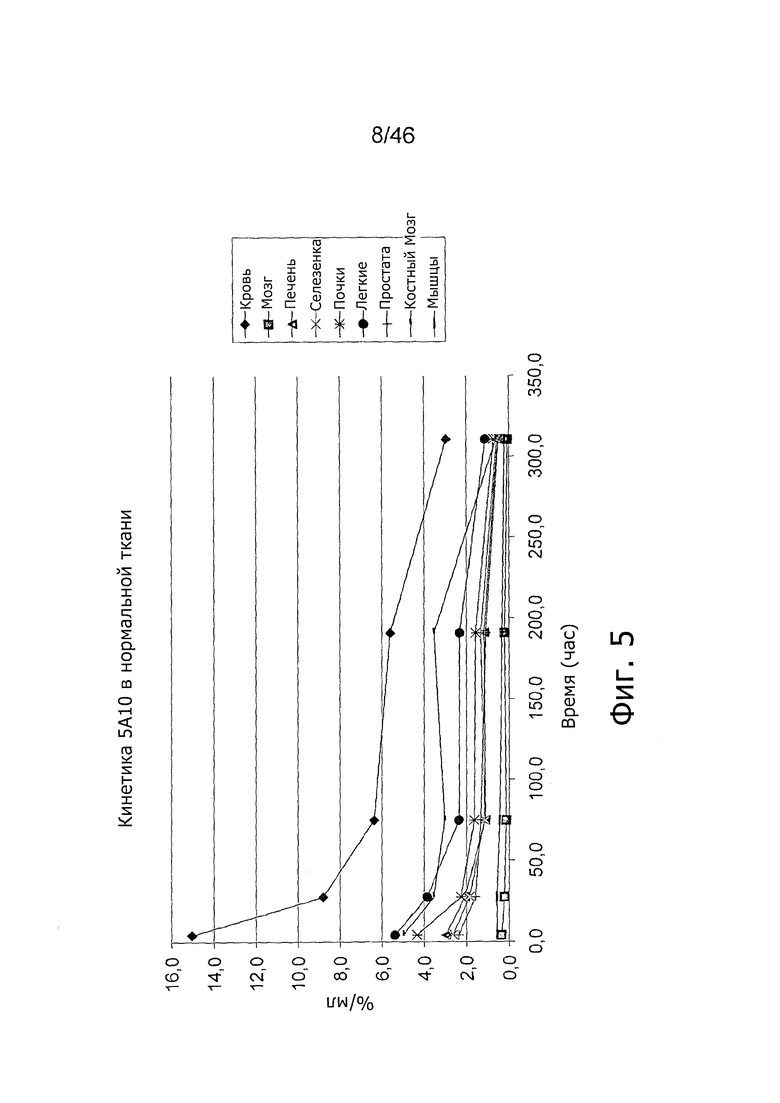
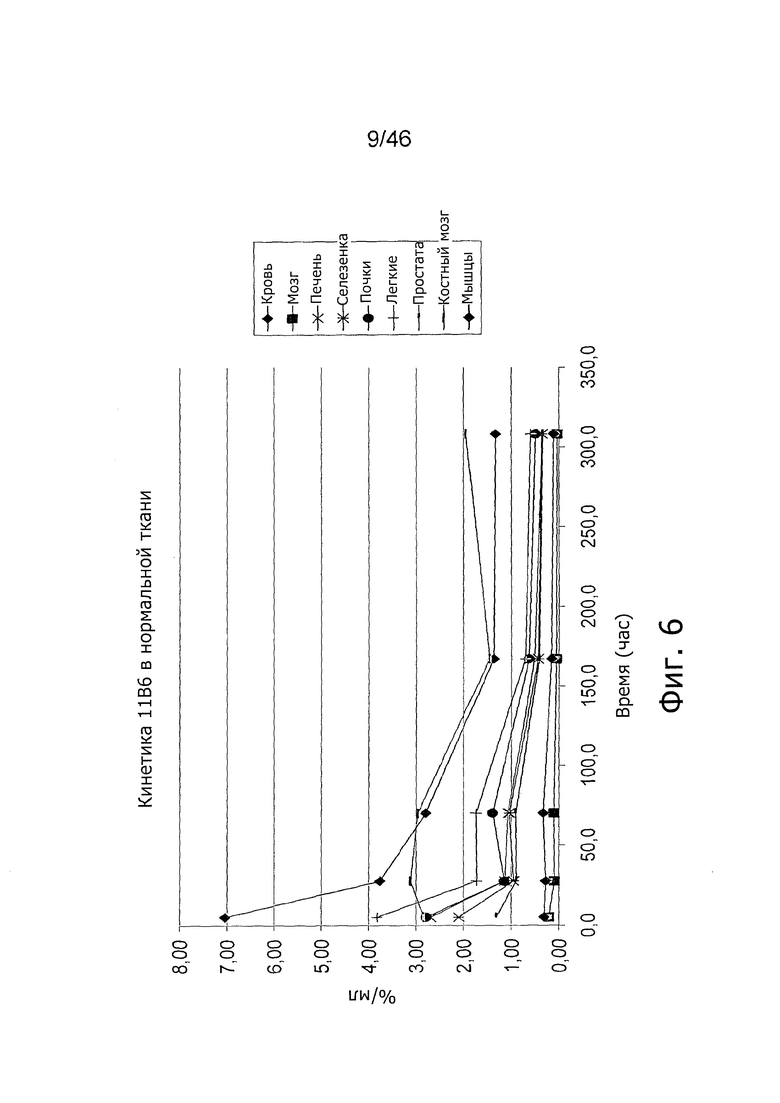
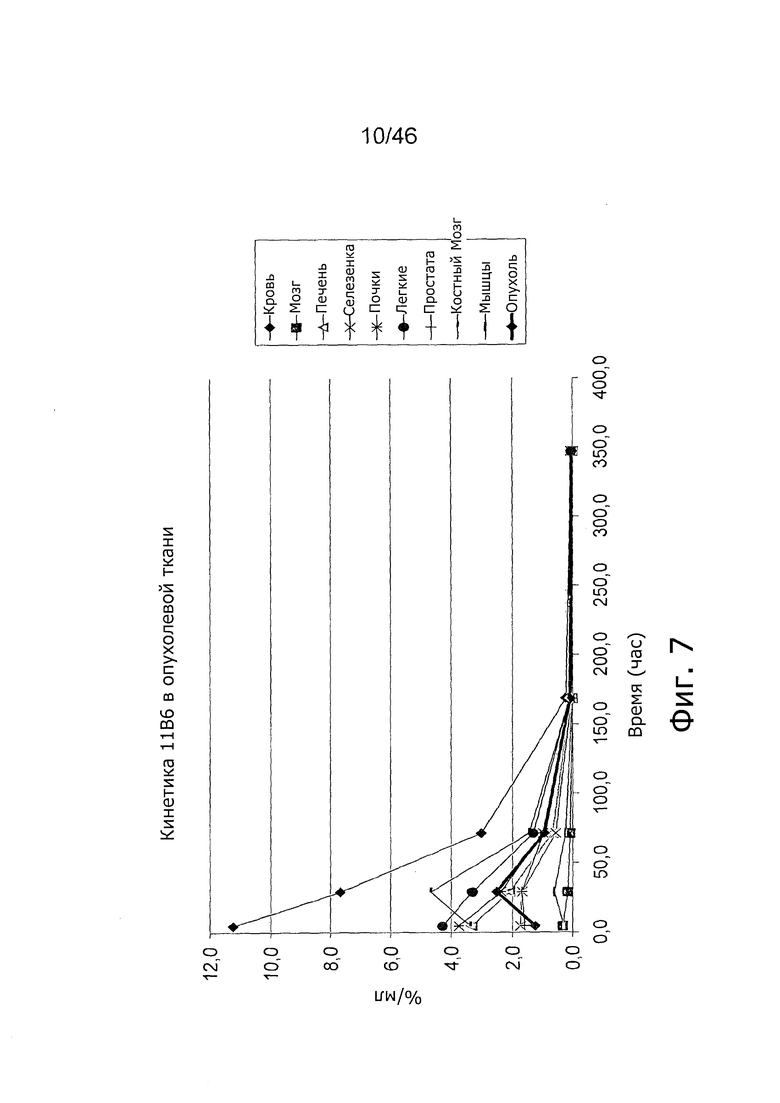
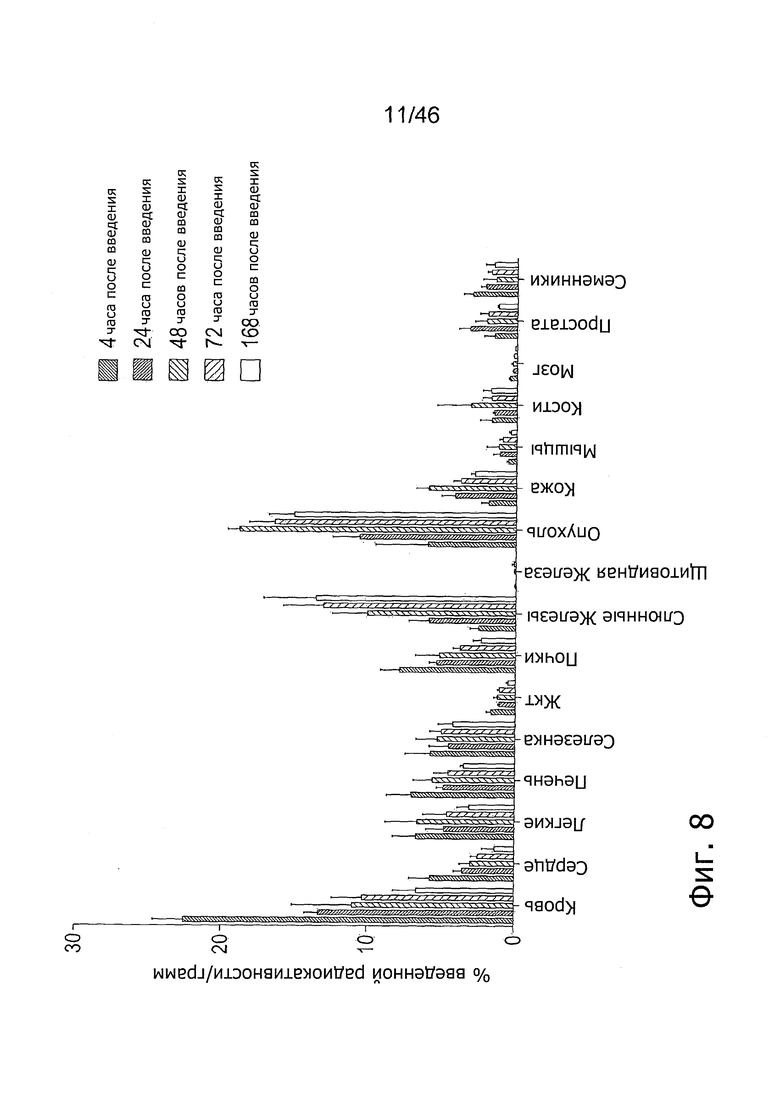

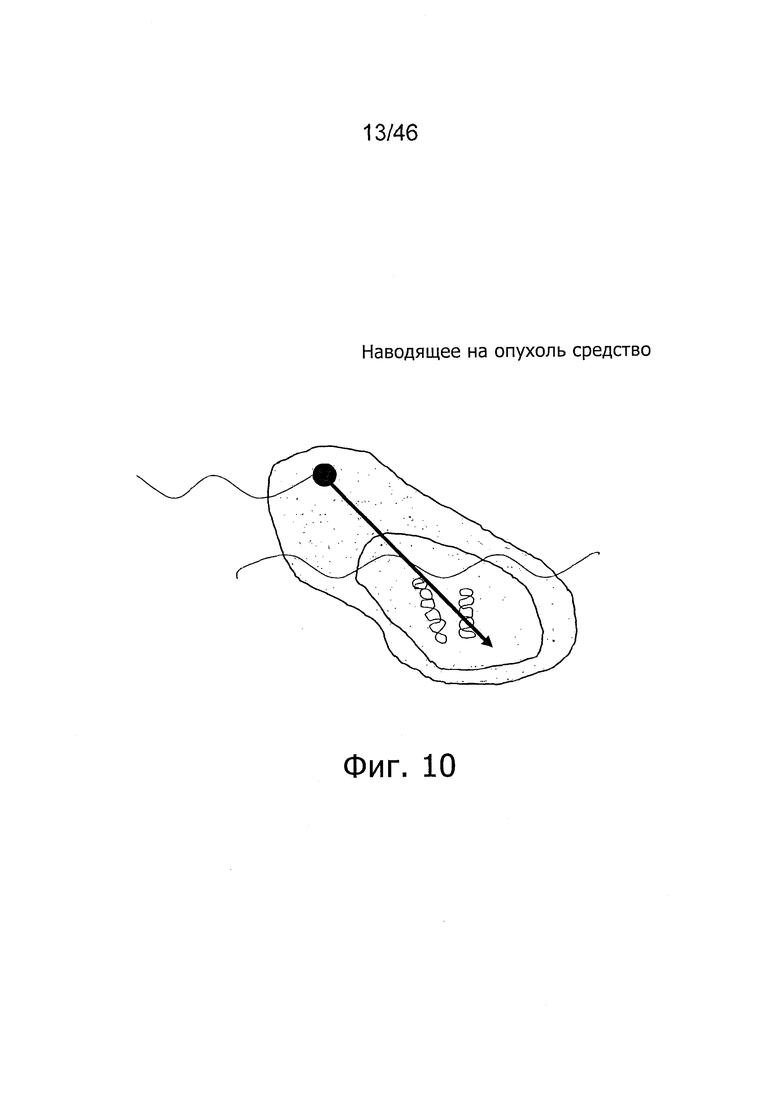

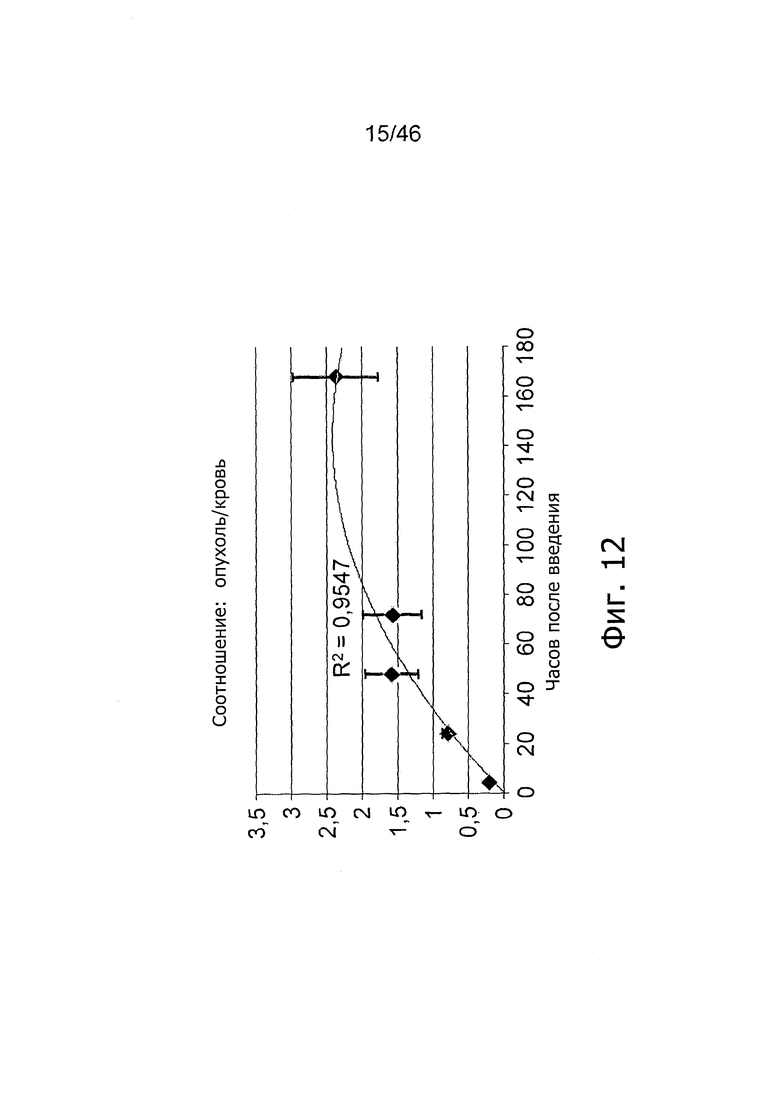
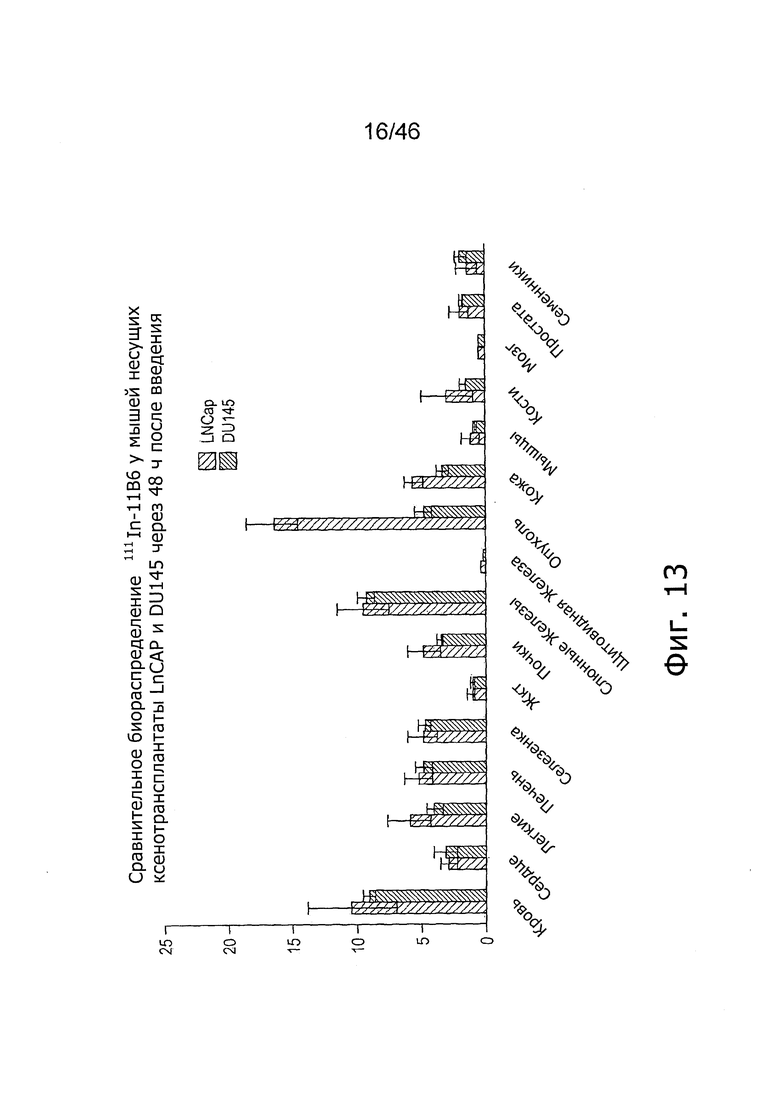

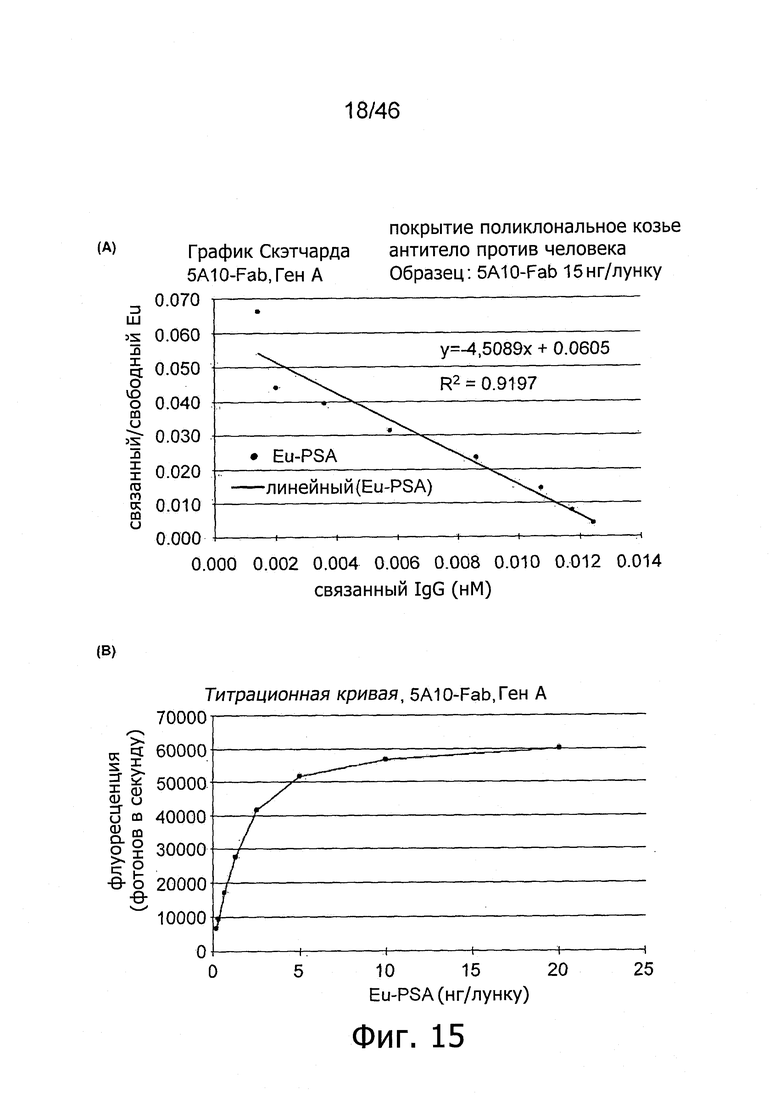
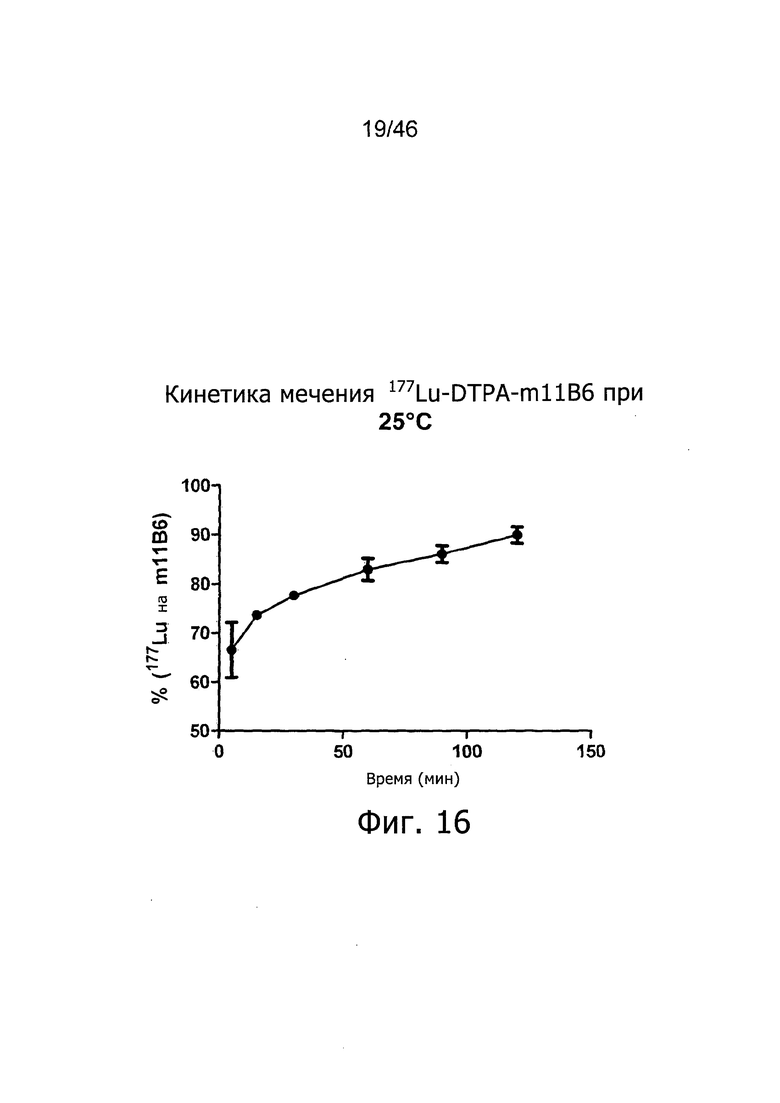
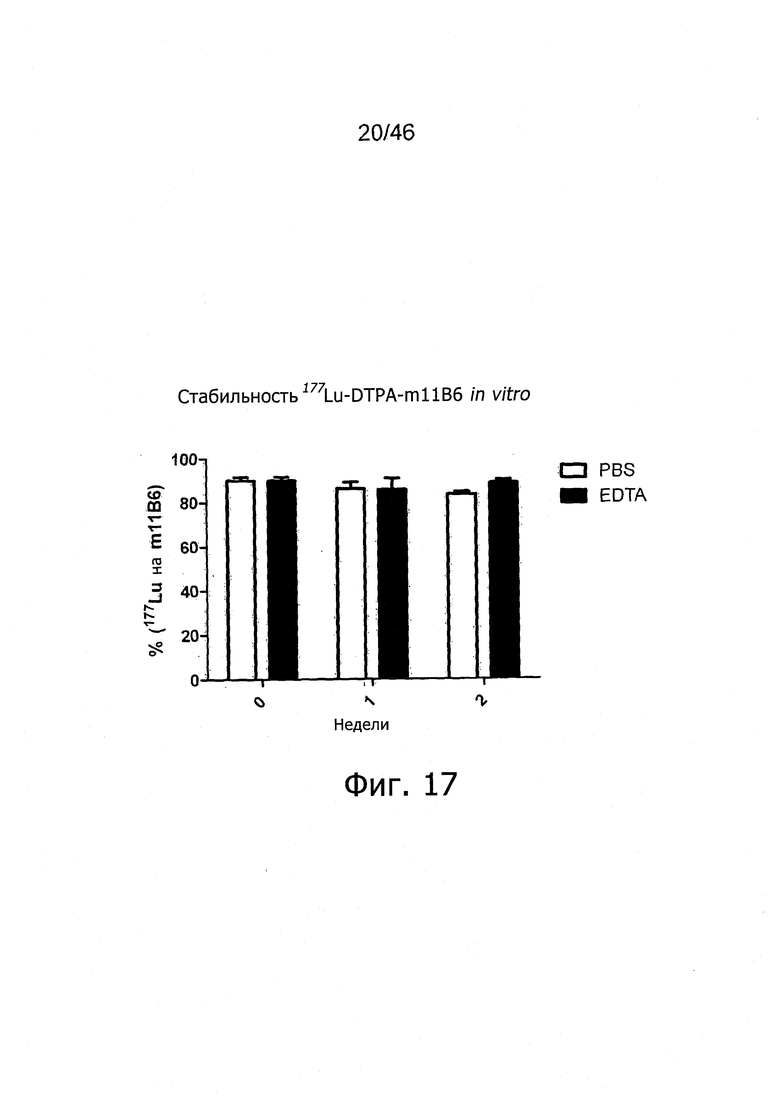

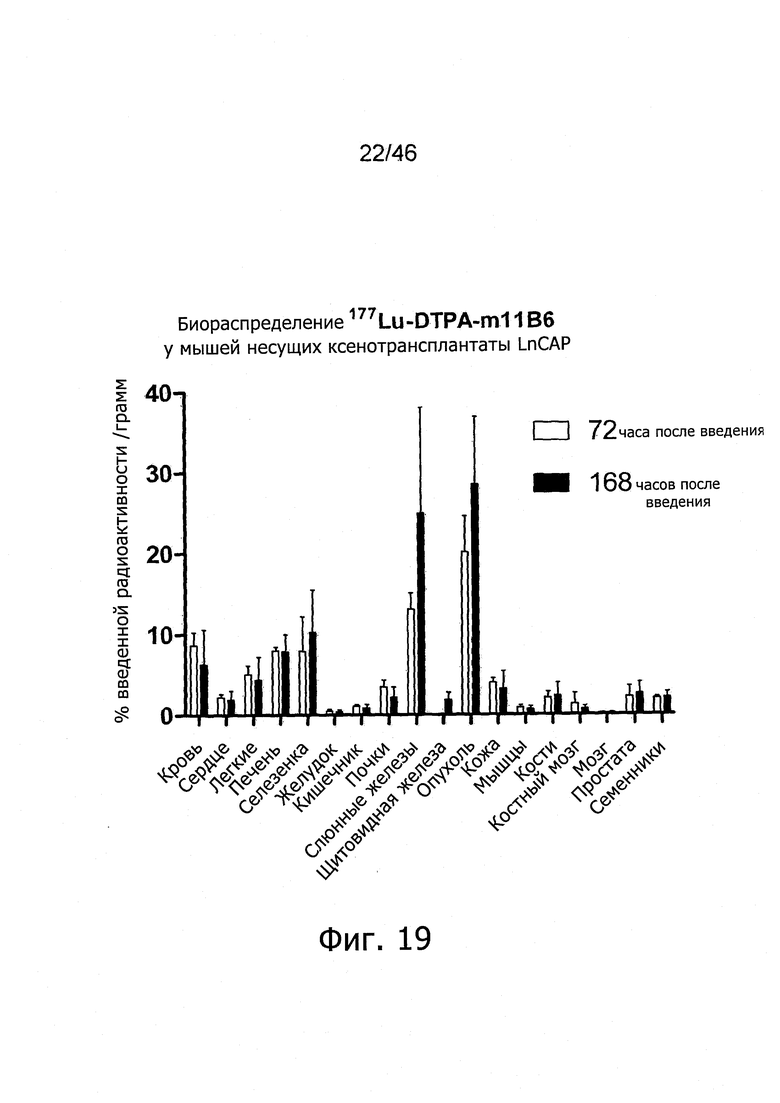
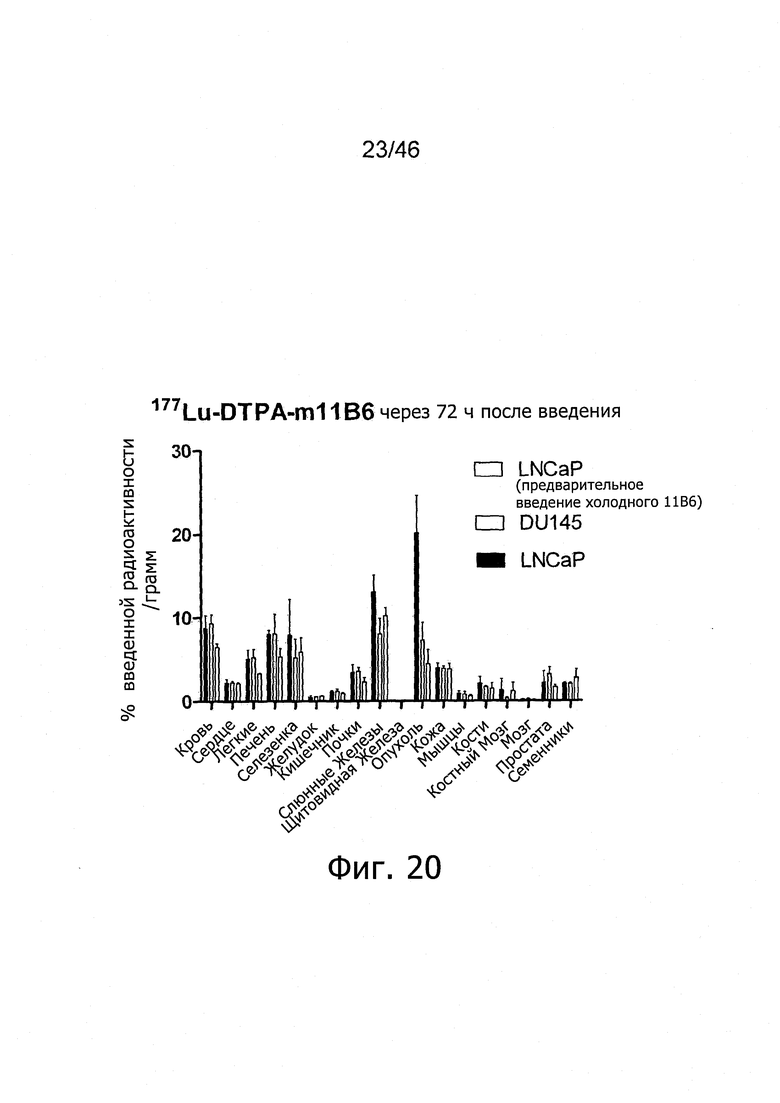
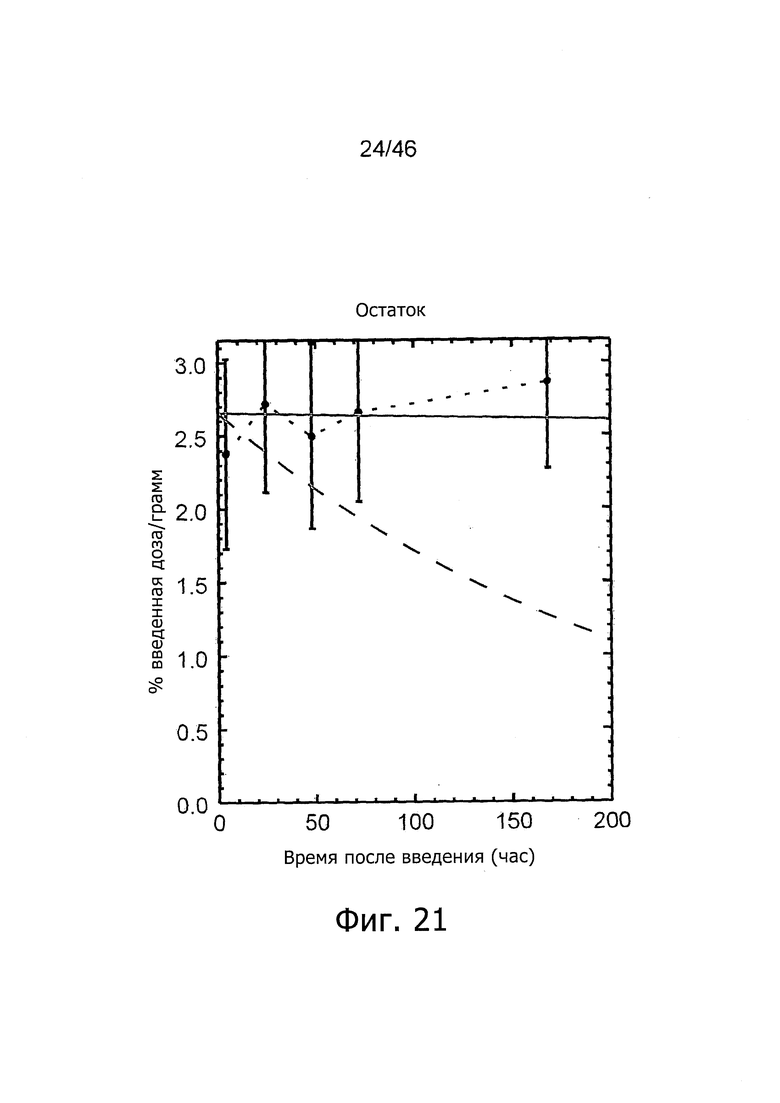
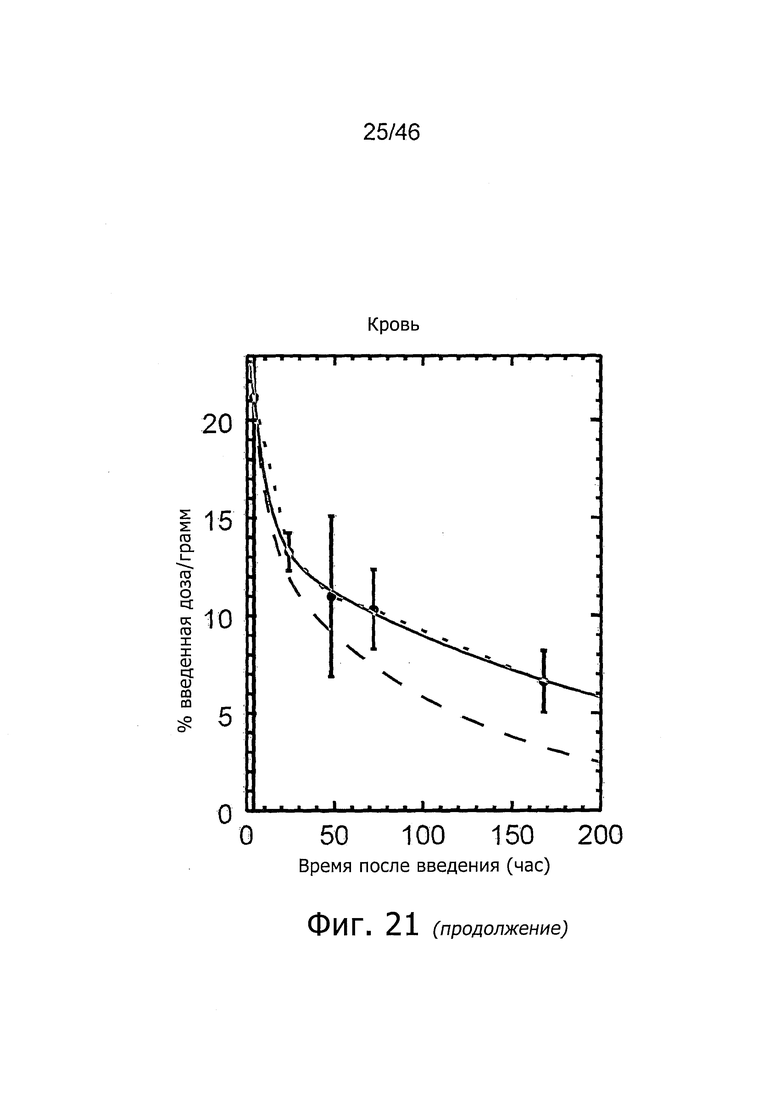

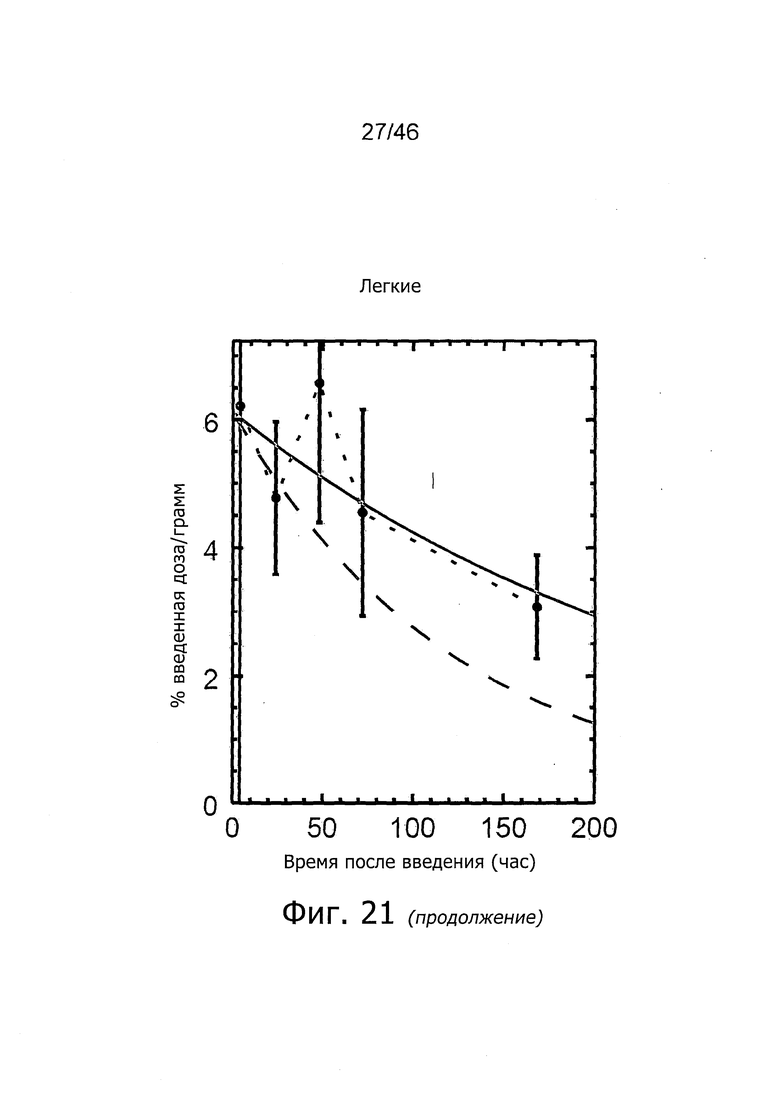
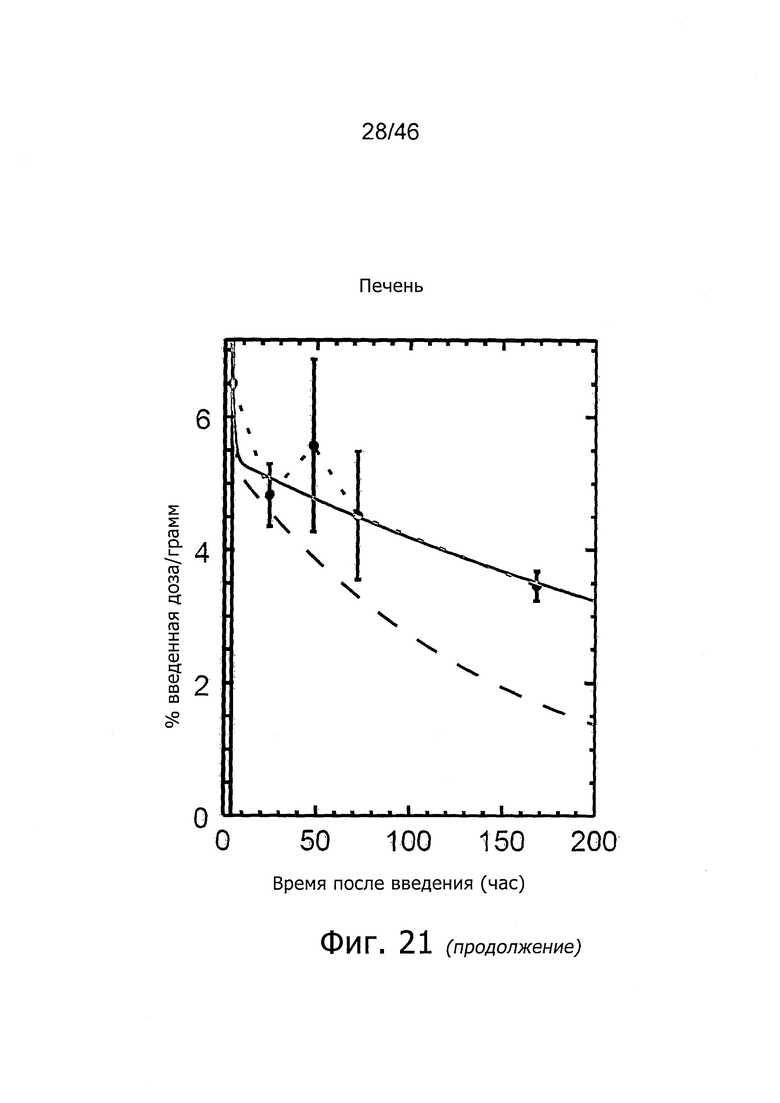
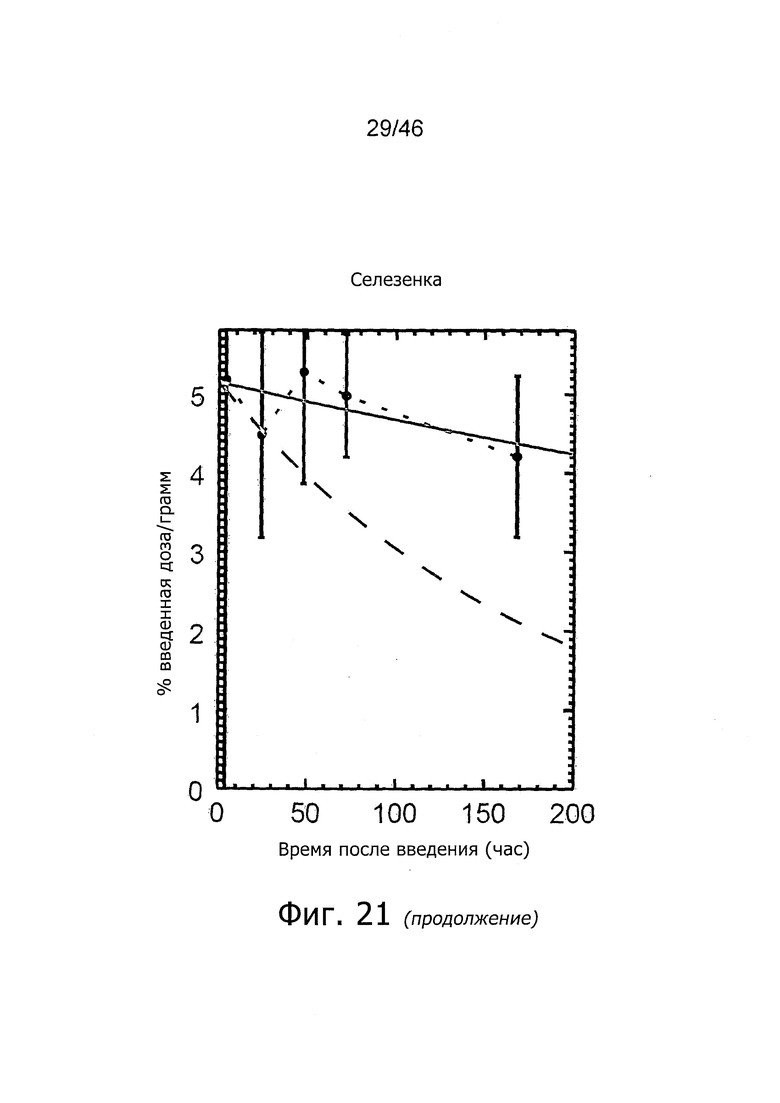
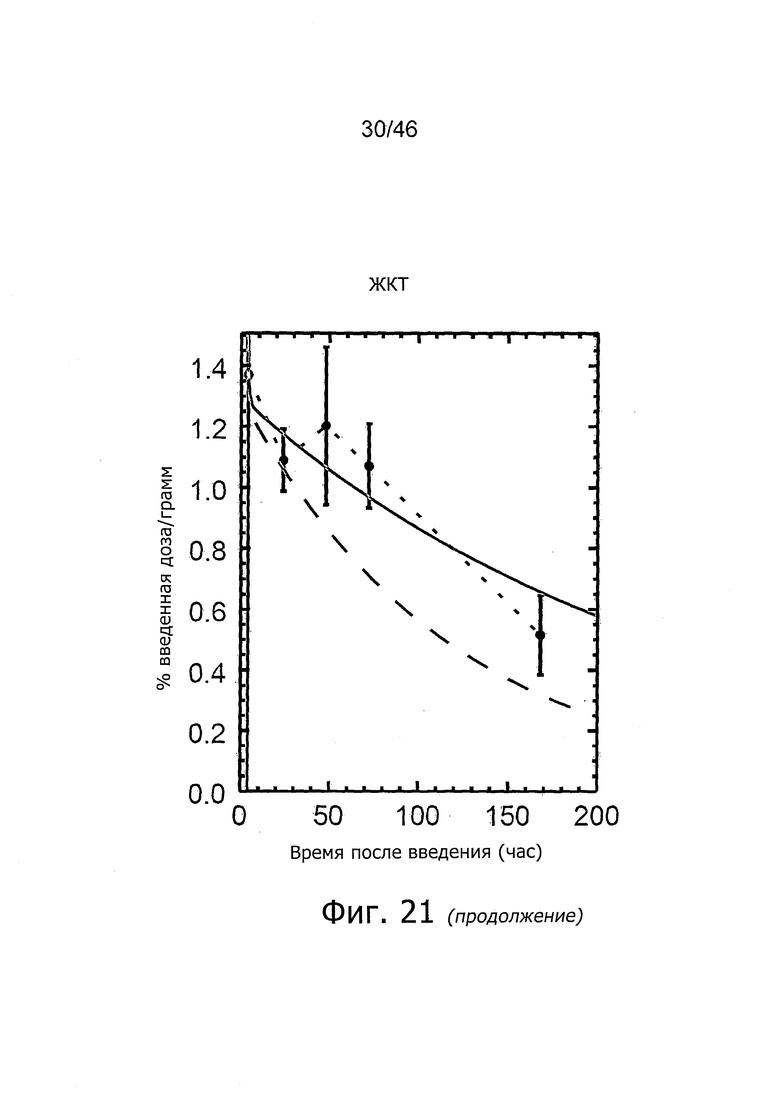
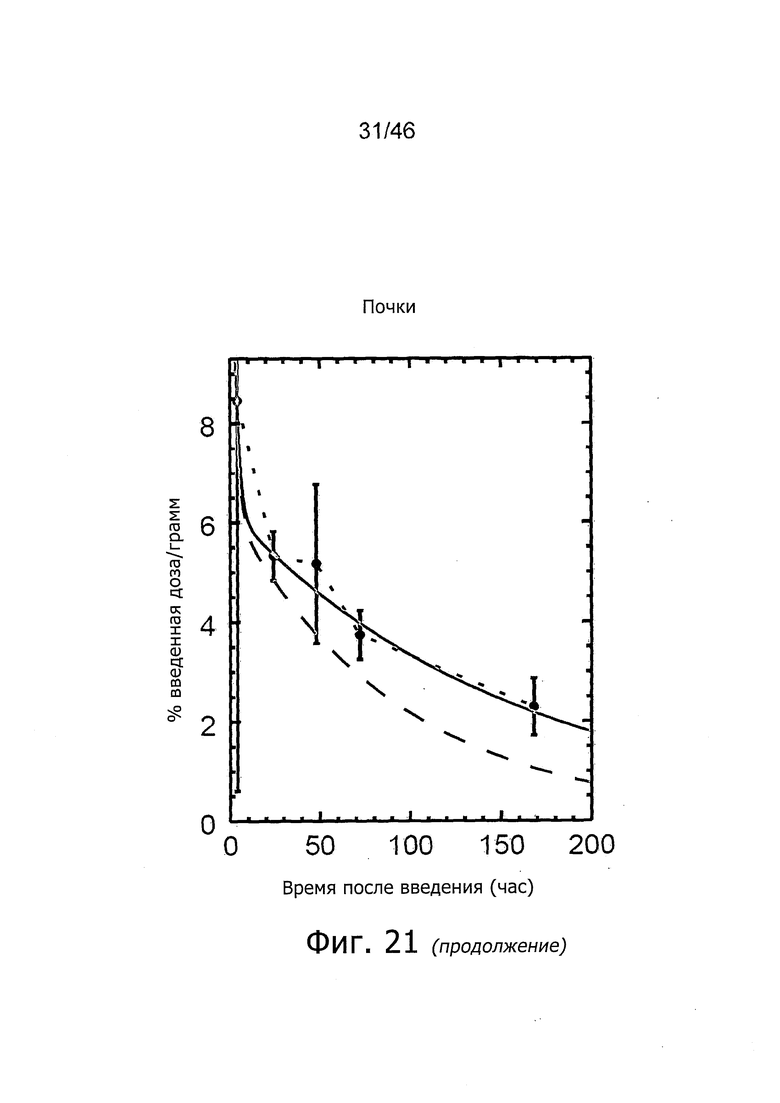
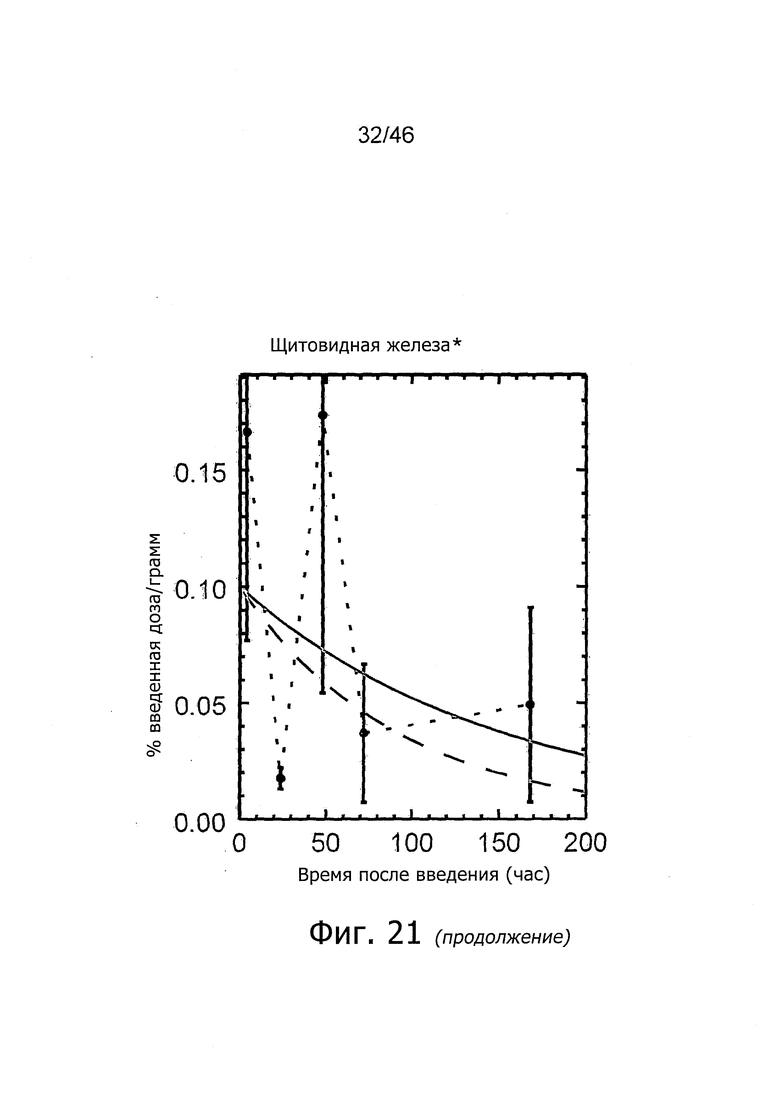

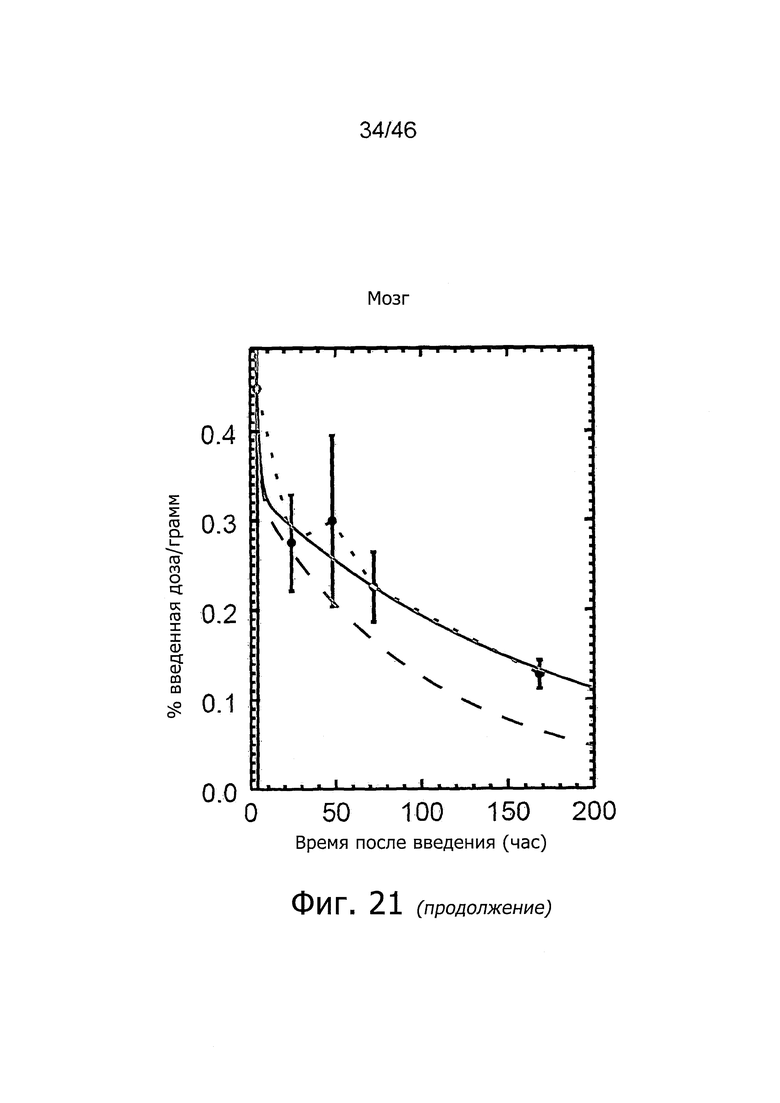
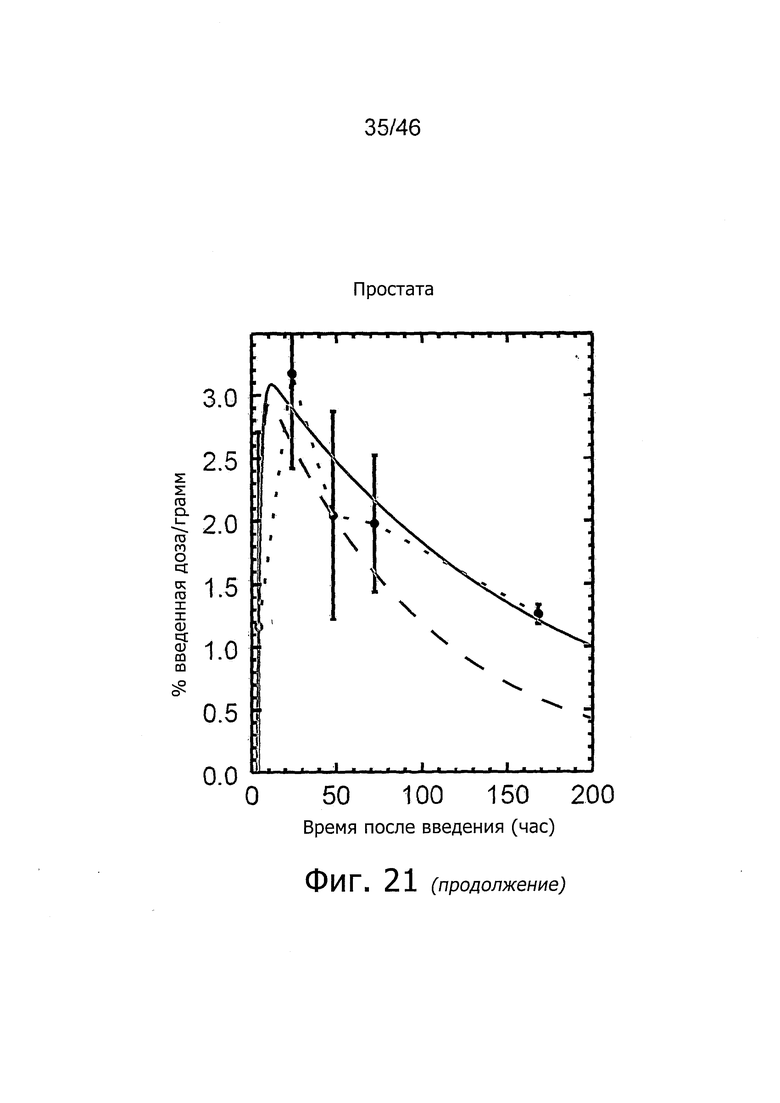
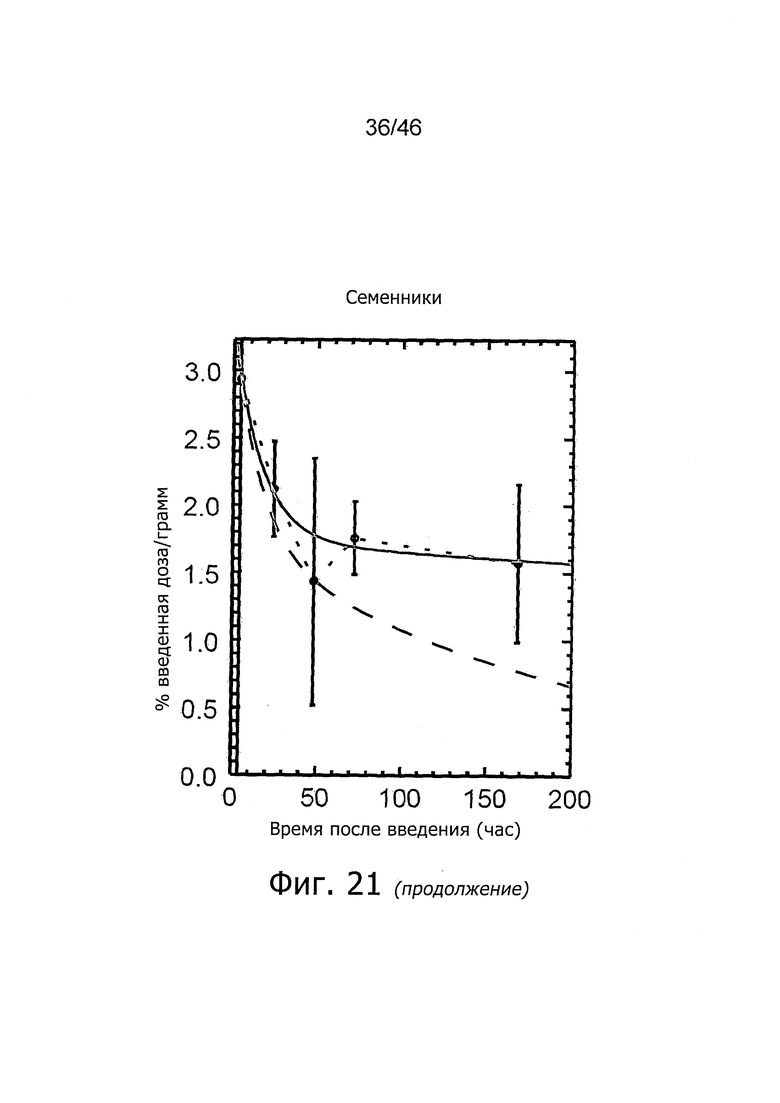
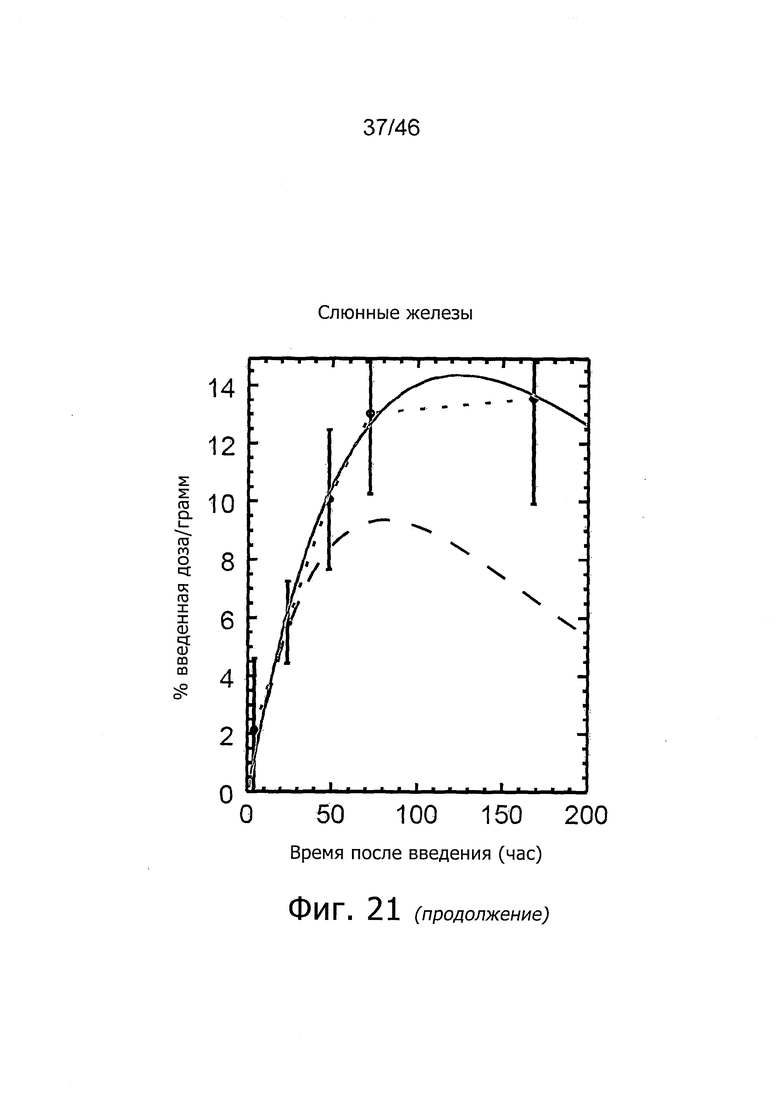
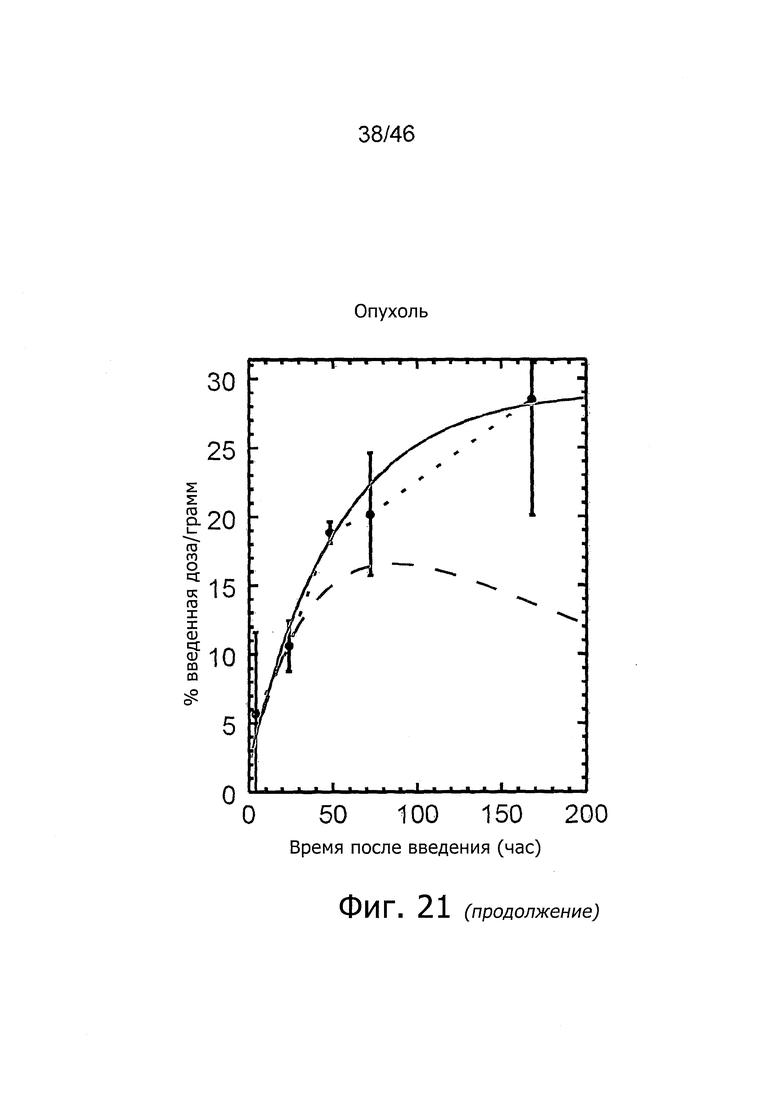
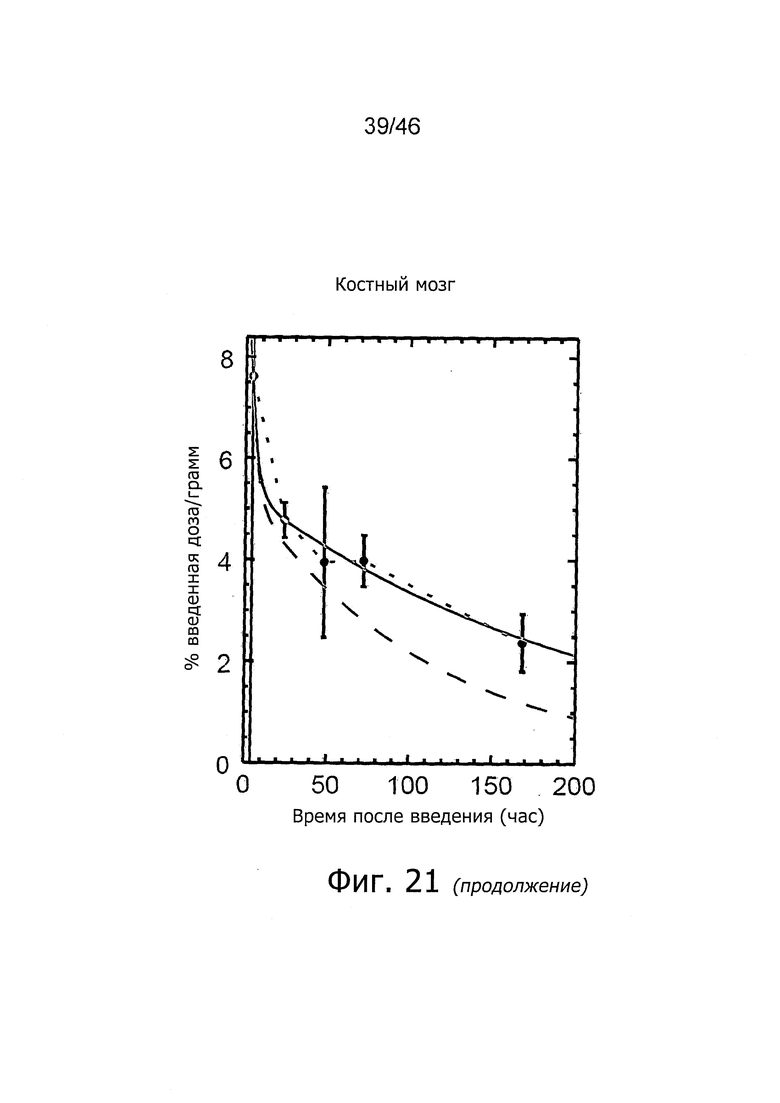
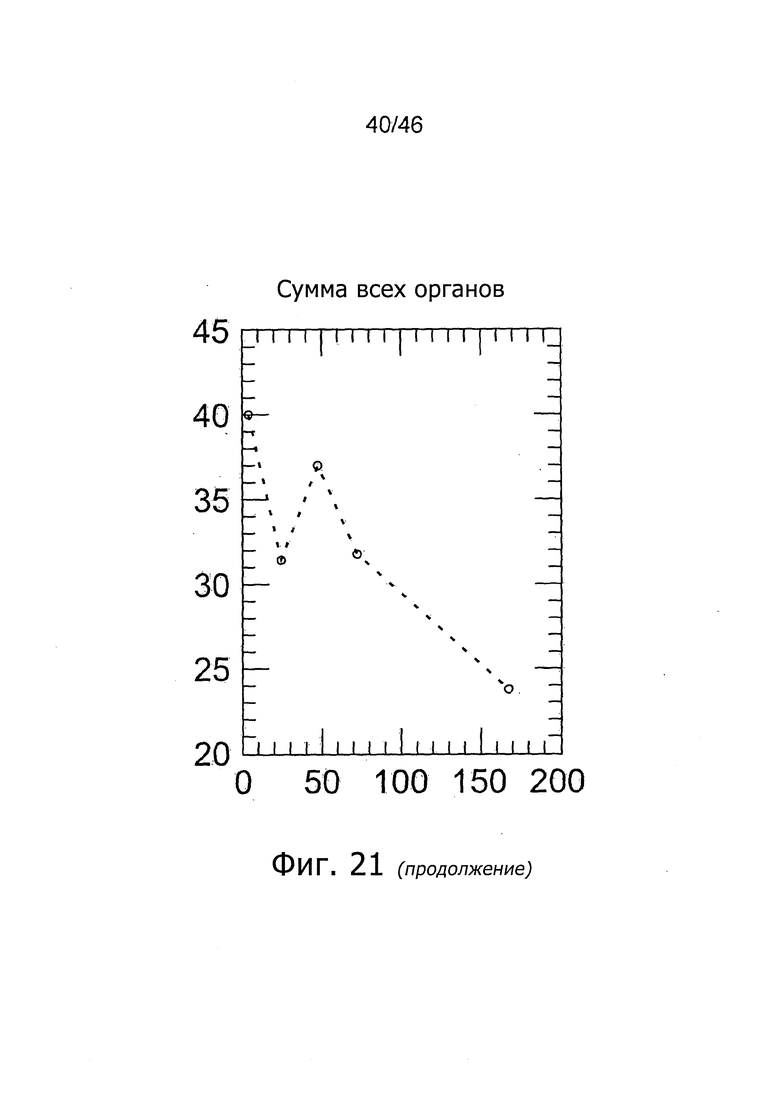


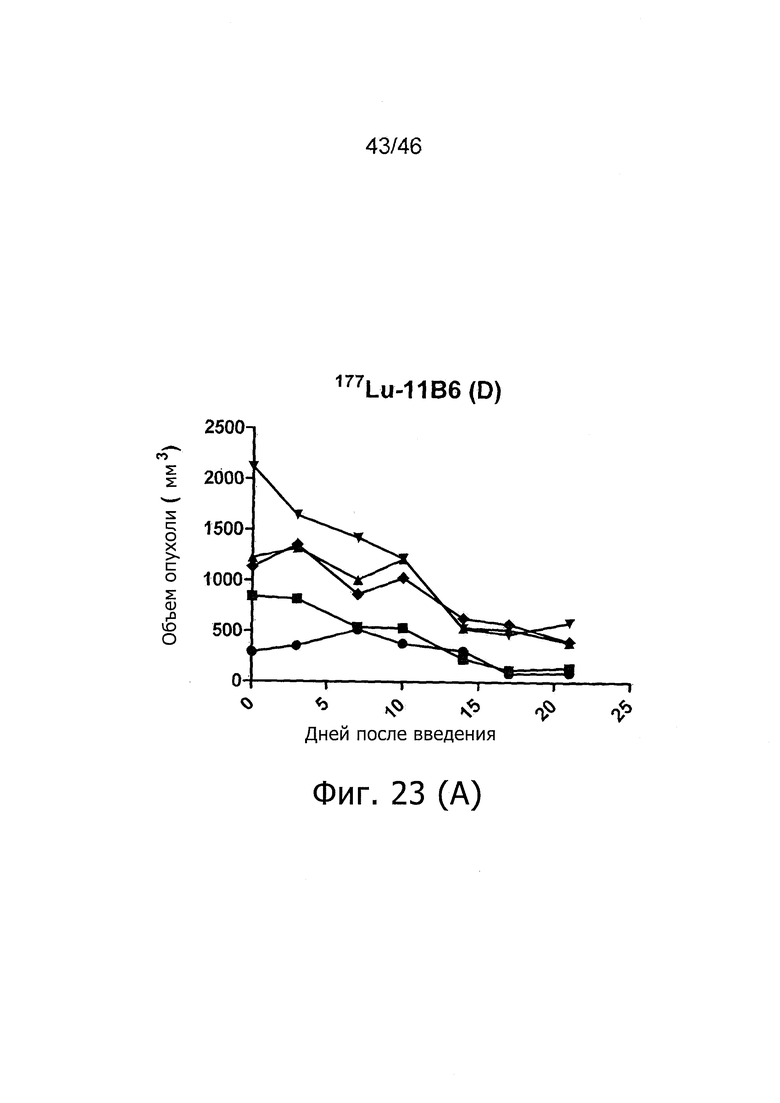
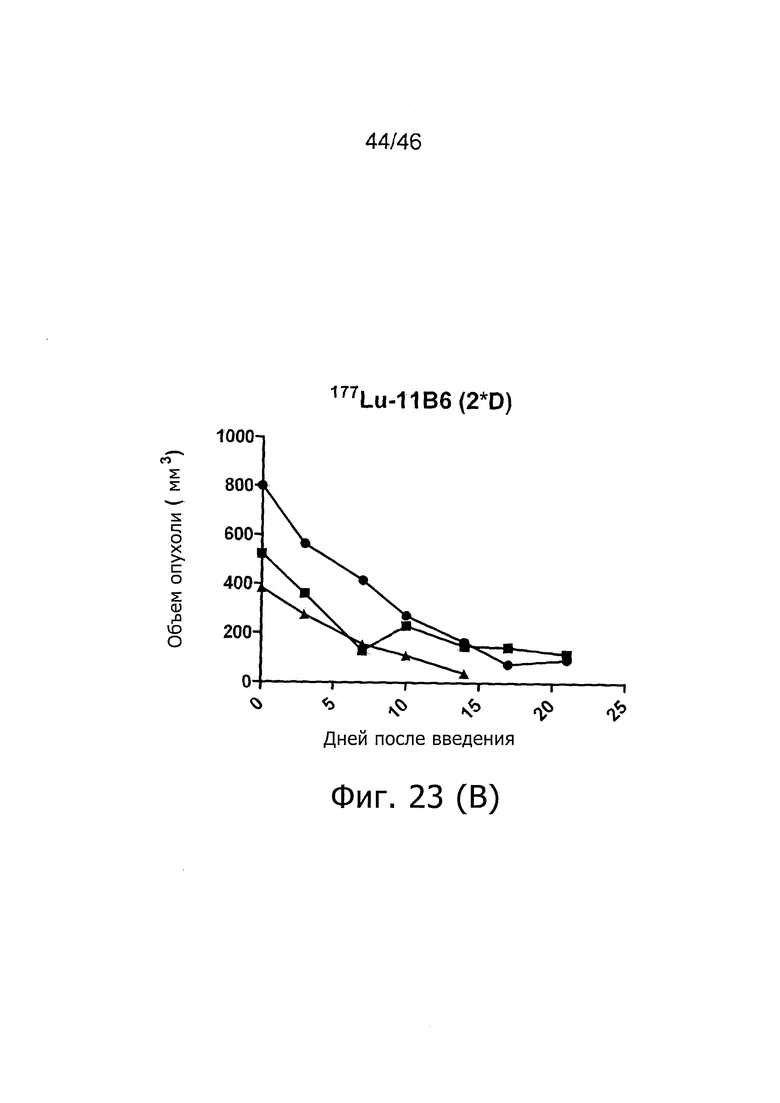
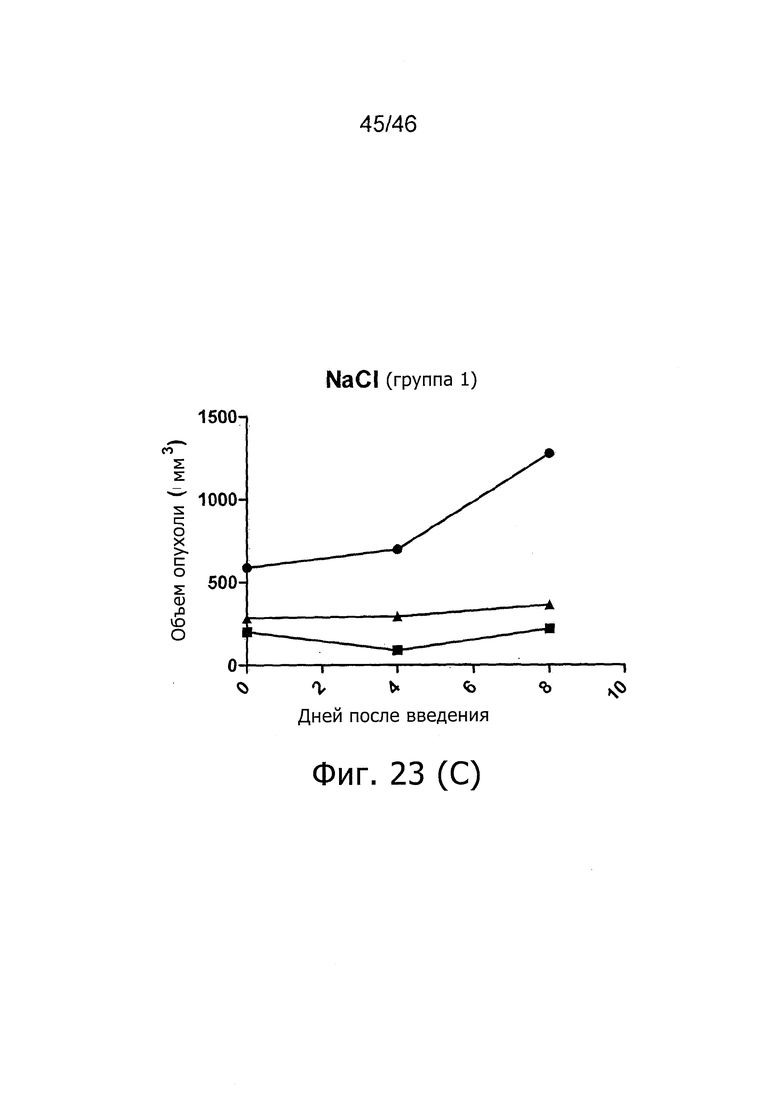
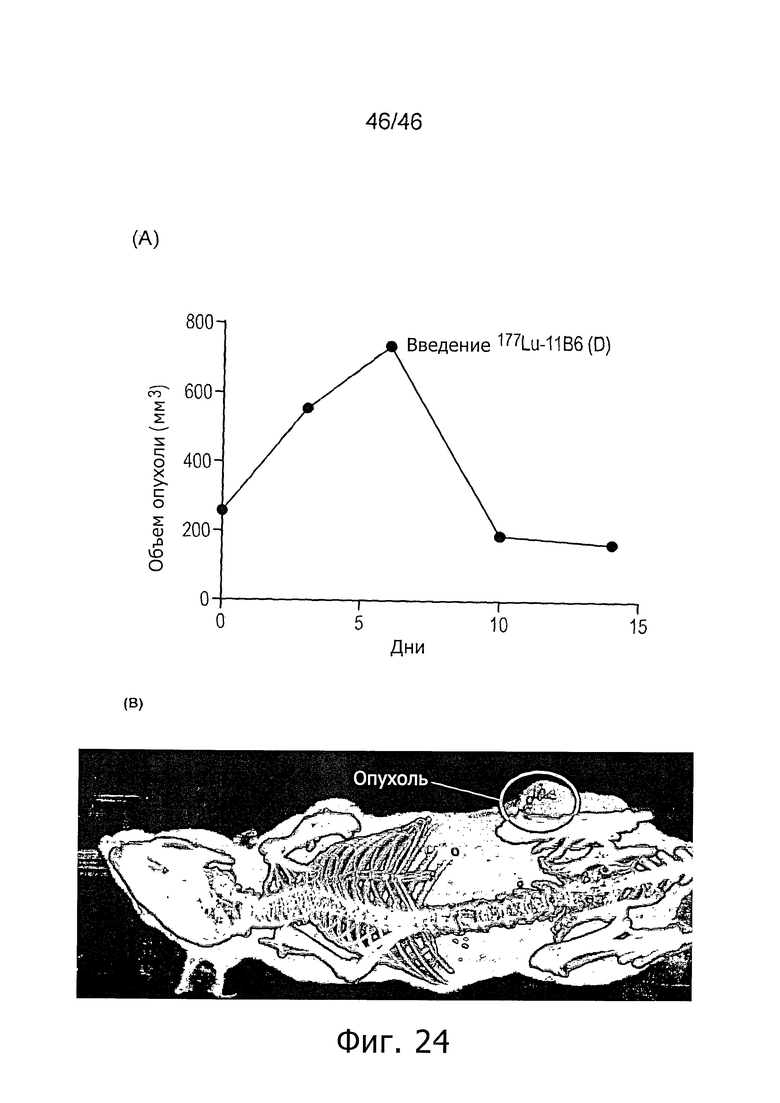
Группа изобретений относится к средству, содержащему или состоящему из (а) антитела или его антигенсвязывающего фрагмента со специфичностью к гландулярному калликреину человека (hK2) и (b) цитотоксической молекулы, для применения при лечении рака простаты, способу лечения рака простаты, который включает стадию введения пациенту терапевтически эффективного количества средства, содержащего или состоящего из (а) антитела или его антигенсвязывающего фрагмента со специфичностью к гландулярному калликреину человека (hK2) и (b) цитотоксической молекулы, а также композиции и набору для лечения рака простаты. Группа изобретений направлена на смягчение, ослабление или устранение недостатков, возникающих при лечении рака простаты. 5 н. и 73 з.п. ф-лы, 50 ил., 4 табл., 10 пр.
1. Средство, содержащее или состоящее из (а) антитела или его антигенсвязывающего фрагмента со специфичностью к гландулярному калликреину человека (hK2) и (b) цитотоксической молекулы, для применения при лечении рака простаты.
2. Средство по п. 1, где антитело или его антигенсвязывающий фрагмент со специфичностью к hK2 конкурирует за связывание с hK2 с антителом, выбранным из группы, состоящей из 11B6 и 7G1.
3. Средство по п. 1, где антитело или его антигенсвязывающий фрагмент со специфичностью к hK2 содержит один или несколько определяющих комплементарность участков (CDRs) антитела, выбранного из группы, состоящей из 11B6 и 7G1.
4. Средство по п. 1, где антитело или его антигенсвязывающий фрагмент со специфичностью к hK2 содержит или состоит из антитела, выбранного из группы, состоящей из 11B6 и 7G1 и их антигенсвязывающих фрагментов.
5. Средство по п. 1, где антитело или его антигенсвязывающий фрагмент со специфичностью к hK2 соединяется с цитотоксической молекулой опосредованно.
6. Средство по п. 1, где антитело или его антигенсвязывающий фрагмент со специфичностью к hK2 соединяется с цитотоксической молекулой непосредственно.
7. Средство по п. 5, где средство проявляет характеристики поглощения опухолью, практически эквивалентные характеристикам поглощения опухолью самого антитела или его антигенсвязывающего фрагмента со специфичностью к hK2.
8. Средство по п. 6, где средство проявляет характеристики поглощения опухолью, практически эквивалентные характеристикам поглощения опухолью самого антитела или его антигенсвязывающего фрагмента со специфичностью к hK2.
9. Средство по п. 5, где цитотоксическая молекула содержит или состоит из одного или нескольких радиоизотопов.
10. Средство по п. 6, где цитотоксическая молекула содержит или состоит из одного или нескольких радиоизотопов.
11. Средство по любому из пп. 9-10, где один или несколько радиоизотопов, каждый независимо, выбраны из группы, состоящей из бета-излучателей, излучателей Оже, излучателей конверсионных электронов, альфа-излучателей и излучателей низкоэнергетических фотонов.
12. Средство по любому из пп. 9-10, где один или несколько радиоизотопов, каждый независимо, имеют такой профиль излучения локально поглощаемой энергии, который дает большую поглощенную дозу в непосредственной близости от средства.
13. Средство по любому из пп. 9-10, где один или несколько радиоизотопов, каждый независимо, выбраны из группы, состоящей из длиннопробежных бета-излучателей, таких как 90Y, 32P, 186Re, I66Ho, 76As/77As, 89Sr, 153Sm; среднепробежных бета-излучателей, таких как 131I, 177Lu, 67Cu, 161Tb, 105Rh; низкоэнергетических бета-излучателей, таких как 45Ca или 35S; конверсионных или излучателей Оже, таких как 51Cr, 67Ga, 99Tcm, 111In, 114mIn, 123I, 125I, 201Tl; и альфа-излучателей, таких как 212Bi, 213Bi, 223Ac, 225Ac, 212Pb, 255Fm, 223Ra, 149Tb и 221At.
14. Средство по п. 1, где цитотоксическая молекула включает или состоит из одного или нескольких цитотоксических препаратов.
15. Средство по п. 14, где один или несколько цитотоксических препаратов представляют собой, или каждый независимо выбран из группы, состоящей из цитостатических препаратов; антиандрогенных препаратов; кортизона и его производных; фосфонатов; ингибиторов тестостерон-5-α-редуктазы; аддендов бора; цитокинов; тапсигаргина и его метаболитов; токсинов (типа сапонина или калихеамицина); химиотерапевтических средств (типа антиметаболитов); или любых других цитотоксических препаратов, применимых при лечении рака простаты.
16. Средство по п. 1, где цитотоксическая молекула содержит или состоит из одной или нескольких молекул, пригодных для применения при активационной терапии, как-то фотонной активационной терапии, нейтронной активационной терапии, терапии нейтрон-индуцированными электронами Оже, синхротронной радиационной терапии или низкоэнергетической рентгеновской фотонной активационной терапии.
17. Средство по любому из пп. 9-10, где радиоизотоп способен одновременно действовать мультимодальным образом как в качестве детектируемой молекулы, так и цитотоксической молекулы.
18. Средство по п. 1, где средство дополнительно содержит молекулу для увеличения времени полужизни средства in vivo.
19. Средство по п. 18, где молекула для увеличения времени полужизни in vivo выбрана из группы, состоящей из полиэтиленгликоля (PEG), сывороточного альбумина человека, гликозилирующих групп, жирных кислот и декстрана.
20. Средство по п. 1, где подлежащий лечению рак простаты представляет собой нелокализованный (т.е. диссеминированный) рак простаты.
21. Средство по п. 1, где подлежащий лечению рак простаты представляет собой метастатический рак простаты, необязательно микрометастатический рак простаты.
22. Средство по п. 21, где подлежащий лечению метастатический рак простаты представляет собой метастазы в лимфатической системе; метастазы в костях (в том числе позвоночнике, позвонках, тазовых костях, ребрах); метастазирование в тазовых костях, прямой кишке, мочевом пузыре, мочеиспускательном канале.
23. Средство по п. 1, где пациент болеет раком простаты и его возраст составляет менее 70, 65, 60, 55, 50, 45, 40 лет или еще меньше на момент диагноза рака простаты и/или во время лечения.
24. Средство по п. 1, где пациент отличается тем, что у его члена семьи, как-то отца или брата, ранее был поставлен диагноз рака простаты.
25. Средство по п. 1, где подлежащий лечению рак простаты представляет собой устойчивый к кастрации рак простаты (CRPC).
26. Применение средства, содержащего или состоящего из (а) антитела или его антигенсвязывающего фрагмента со специфичностью к гландулярному калликреину человека (hK2) и (b) цитотоксической молекулы, при изготовлении лекарства для лечения рака простаты.
27. Применение по п. 26, где антитело или его антигенсвязывающий фрагмент со специфичностью к hK2 конкурирует за связывание с hK2 с антителом, выбранным из группы, состоящей из 11B6 и 7G1.
28. Применение по п. 26, где антитело или его антигенсвязывающий фрагмент со специфичностью к hK2 содержит один или несколько определяющих комплементарность участков (CDRs) антитела, выбранного из группы, состоящей из 11B6 и 7G1.
29. Применение по п. 26, где антитело или его антигенсвязывающий фрагмент со специфичностью к hK2 содержит или состоит из антитела, выбранного из группы, состоящей из 11B6 и 7G1 и их антигенсвязывающих фрагментов.
30. Применение по п. 26, где антитело или его антигенсвязывающий фрагмент со специфичностью к hK2 соединяется с цитотоксической молекулой опосредованно.
31. Применение по п. 26, где антитело или его антигенсвязывающий фрагмент со специфичностью к hK2 соединяется с цитотоксической молекулой непосредственно.
32. Применение по п. 30, где средство проявляет характеристики поглощения опухолью, практически эквивалентные характеристикам поглощения опухолью самого антитела или его антигенсвязывающего фрагмента со специфичностью к hK2.
33. Применение по п. 31, где средство проявляет характеристики поглощения опухолью, практически эквивалентные характеристикам поглощения опухолью самого антитела или его антигенсвязывающего фрагмента со специфичностью к hK2.
34. Применение по п. 30, где цитотоксическая молекула содержит или состоит из одного или нескольких радиоизотопов.
35. Применение по п. 31, где цитотоксическая молекула содержит или состоит из одного или нескольких радиоизотопов.
36. Применение по любому из пп. 34, 35, где один или несколько радиоизотопов, каждый независимо, выбраны из группы, состоящей из бета-излучателей, излучателей Оже, излучателей конверсионных электронов, альфа-излучателей и излучателей низкоэнергетических фотонов.
37. Применение по любому из пп. 34, 35, где один или несколько радиоизотопов, каждый независимо, имеют такой профиль излучения локально поглощаемой энергии, который дает большую поглощенную дозу в непосредственной близости от средства.
38. Применение по любому из пп. 34, 35, где один или несколько радиоизотопов, каждый независимо, выбраны из группы, состоящей из длиннопробежных бета-излучателей, таких как 90Y, 32P, 186Re, 166Ho, 76As/77As, 89Sr, 153Sm; среднепробежных бета-излучателей, таких как 131I, 177Lu, 67Cu, 161Tb, 105Rh; низкоэнергетических бета-излучателей, таких как 45Ca или 35S; конверсионных или излучателей Оже, таких как 51Cr, 67Ga, 99Tcm, 111In, 114mIn, 123I, 125I, 201Tl; и альфа-излучателей, таких как 212Bi, 213Bi, 223Ac, 225Ac, 212Pb, 255Fm, 223Ra, 149Tb и 221At.
39. Применение по п. 26, где цитотоксическая молекула включает или состоит из одного или нескольких цитотоксических препаратов.
40. Применение по п. 39, где один или несколько цитотоксических препаратов представляют собой, или каждый независимо выбран из группы, состоящей из цитостатических препаратов; антиандрогенных препаратов; кортизона и его производных; фосфонатов; ингибиторов тестостерон-5-α-редуктазы; аддендов бора; цитокинов; тапсигаргина и его метаболитов; токсинов (типа сапонина или калихеамицина); химиотерапевтических средств (типа антиметаболитов); или любых других цитотоксических препаратов, применимых при лечении рака простаты.
41. Применение по п. 26, где цитотоксическая молекула содержит или состоит из одной или нескольких молекул, пригодных для применения при активационной терапии, как-то фотонной активационной терапии, нейтронной активационной терапии, терапии нейтрон-индуцированными электронами Оже, синхротронной радиационной терапии или низкоэнергетической рентгеновской фотонной активационной терапии.
42. Применение по любому из пп. 34, 35, где радиоизотоп способен одновременно действовать мультимодальным образом как в качестве детектируемой молекулы, так и цитотоксической молекулы.
43. Применение по п. 26, где средство дополнительно содержит молекулу для увеличения времени полужизни средства in vivo.
44. Применение по п. 43, где молекула для увеличения времени полужизни in vivo выбрана из группы, состоящей из полиэтиленгликоля (PEG), сывороточного альбумина человека, гликозилирующих групп, жирных кислот и декстрана.
45. Применение по п. 26, где подлежащий лечению рак простаты представляет собой нелокализованный (т.е. диссеминированный) рак простаты.
46. Применение по п. 26, где подлежащий лечению рак простаты представляет собой метастатический рак простаты, необязательно микрометастатический рак простаты.
47. Применение по п. 46, где подлежащий лечению метастатический рак простаты представляет собой: метастазы в лимфатической системе; метастазы в костях (в том числе позвоночнике, позвонках, тазовых костях, ребрах); метастазирование в тазовых костях, прямой кишке, мочевом пузыре, мочеиспускательном канале.
48. Применение по п. 26, где пациент болеет раком простаты и его возраст составляет менее 70, 65, 60, 55, 50, 45, 40 лет или еще меньше на момент диагноза рака простаты и/или во время лечения.
49. Применение по п. 26, где пациент отличается тем, что у его члена семьи, как-то отца или брата, ранее был поставлен диагноз рака простаты.
50. Применение по п. 26, где подлежащий лечению рак простаты представляет собой устойчивый к кастрации рак простаты (CRPC).
51. Способ лечения рака простаты у пациента, который включает стадию введения терапевтически эффективного количества средства, содержащего или состоящего из (а) антитела или его антигенсвязывающего фрагмента со специфичностью к гландулярному калликреину человека (hK2) и (b) цитотоксической молекулы.
52. Способ по п. 51, где антитело или его антигенсвязывающий фрагмент со специфичностью к hK2 конкурирует за связывание с hK2 с антителом, выбранным из группы, состоящей из 11B6 и 7G1.
53. Способ по п. 51, где антитело или его антигенсвязывающий фрагмент со специфичностью к hK2 содержит один или несколько определяющих комплементарность участков (CDRs) антитела, выбранного из группы, состоящей из 11B6 и 7G1.
54. Способ по п. 51, где антитело или его антигенсвязывающий фрагмент со специфичностью к hK2 содержит или состоит из антитела, выбранного из группы, состоящей из 11B6 и 7G1 и их антигенсвязывающих фрагментов.
55. Способ по п. 51, где антитело или его антигенсвязывающий фрагмент со специфичностью к hK2 соединяется с цитотоксической молекулой опосредованно.
56. Способ по п. 51, где антитело или его антигенсвязывающий фрагмент со специфичностью к hK2 соединяется с цитотоксической молекулой непосредственно.
57. Способ по п. 55, где средство проявляет характеристики поглощения опухолью, практически эквивалентные характеристикам поглощения опухолью самого антитела или его антигенсвязывающего фрагмента со специфичностью к hK2.
58. Способ по п. 56, где средство проявляет характеристики поглощения опухолью, практически эквивалентные характеристикам поглощения опухолью самого антитела или его антигенсвязывающего фрагмента со специфичностью к hK2.
59. Способ по п. 55, где цитотоксическая молекула содержит или состоит из одного или нескольких радиоизотопов.
60. Способ по п. 56, где цитотоксическая молекула содержит или состоит из одного или нескольких радиоизотопов.
61. Способ по любому из пп. 59, 60, где один или несколько радиоизотопов, каждый независимо, выбраны из группы, состоящей из бета-излучателей, излучателей Оже, излучателей конверсионных электронов, альфа-излучателей и излучателей низкоэнергетических фотонов.
62. Способ по любому из пп. 59, 60, где один или несколько радиоизотопов, каждый независимо, имеют такой профиль излучения локально поглощаемой энергии, который дает большую поглощенную дозу в непосредственной близости от средства.
63. Способ по любому из пп. 59, 60, где один или несколько радиоизотопов, каждый независимо, выбраны из группы, состоящей из: длиннопробежных бета-излучателей, таких как 90Y, 32P, 186Re, 166Ho, 76As/77As, 89Sr, 153Sm; среднепробежных бета-излучателей, таких как 131I, 177Lu, 67Cu, 161Tb, 105Rh; низкоэнергетических бета-излучателей, таких как 45Ca или 35S; конверсионных или излучателей Оже, таких как 51Cr, 67Ga, 99Tcm, 111In, 114mIn, 123I, 125I, 201Tl; и альфа-излучателей, таких как 212Bi, 213Bi, 223Ac, 225Ac, 212Pb, 255Fm, 223Ra, 149Tb и 221At.
64. Способ по п. 51, где цитотоксическая молекула включает или состоит из одного или нескольких цитотоксических препаратов.
65. Способ по п. 64, где один или несколько цитотоксических препаратов представляют собой, или каждый независимо выбран из группы, состоящей из цитостатических препаратов; антиандрогенных препаратов; кортизона и его производных; фосфонатов; ингибиторов тестостерон-5-α-редуктазы; аддендов бора; цитокинов; тапсигаргина и его метаболитов; токсинов (типа сапонина или калихеамицина); химиотерапевтических средств (типа антиметаболитов); или любых других цитотоксических препаратов, применимых при лечении рака простаты.
66. Способ по п. 51, где цитотоксическая молекула содержит или состоит из одной или нескольких молекул, пригодных для применения при активационной терапии, как-то фотонной активационной терапии, нейтронной активационной терапии, терапии нейтрон-индуцированными электронами Оже, синхротронной радиационной терапии или низкоэнергетической рентгеновской фотонной активационной терапии.
67. Способ по любому из пп. 59, 60, где радиоизотоп способен одновременно действовать мультимодальным образом как в качестве детектируемой молекулы, так и цитотоксической молекулы.
68. Способ по п. 51, где средство дополнительно содержит молекулу для увеличения времени полужизни средства in vivo.
69. Способ по п. 68, где молекула для увеличения времени полужизни in vivo выбрана из группы, состоящей из полиэтиленгликоля (PEG), сывороточного альбумина человека, гликозилирующих групп, жирных кислот и декстрана.
70. Способ по п. 51, где подлежащий лечению рак простаты представляет собой нелокализованный (т.е. диссеминированный) рак простаты.
71. Способ по п. 51, где подлежащий лечению рак простаты представляет собой метастатический рак простаты, необязательно микрометастатический рак простаты.
72. Способ по п. 71, где подлежащий лечению метастатический рак простаты представляет собой: метастазы в лимфатической системе; метастазы в костях (в том числе позвоночнике, позвонках, тазовых костях, ребрах); метастазирование в тазовых костях, прямой кишке, мочевом пузыре, мочеиспускательном канале.
73. Способ по п. 51, где пациент болеет раком простаты и его возраст составляет менее 70, 65, 60, 55, 50, 45, 40 лет или еще меньше на момент диагноза рака простаты и/или во время лечения.
74. Способ по п. 51, где пациент отличается тем, что у его члена семьи, как-то отца или брата, ранее был поставлен диагноз рака простаты.
75. Способ по п. 51, где подлежащий лечению рак простаты представляет собой устойчивый к кастрации рак простаты (CRPC).
76. Фармацевтическая композиция, включающая терапевтически эффективное количество средства, согласно любому из пп. 1-25, и фармацевтически приемлемый разбавитель, носитель или наполнитель, для применения в лечении рака простаты.
77. Фармацевтическая композиция по п. 76, приспособленная для парентерального, внутривенного, подкожного, внутримышечного введения или введения посредством инъекции.
78. Набор, включающий средство, определенное в любом из пп. 1-5, или фармацевтическую композицию, определенную в п. 76 или 77, для применения при лечении рака простаты.
| "Doktorandplats i Medicinsk str not alningsfysik", 05.10.2010, Найдено в Интернет, 05.08.2016, найдено на http://vakanser.se/jobb/doktorandplats+i+ medicinsk+stralningsfysik/ | |||
| Затворное устройство для водопроводов, подающих воду из верхнею бьефа в нижний | 1929 |
|
SU14295A1 |
| US 2002001588 A1, 03.01.2002 | |||
| US 2002001588 A1, 03.01.2002 | |||
| WO 2006087374 A1, 24.08.2006 | |||
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| Москва, Медицина, 2001, ч.1, стр | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
Авторы
Даты
2017-01-10—Публикация
2012-10-26—Подача