Изобретение относится к области исследования биоматериалов и тканевой инженерии и может быть использовано в регенеративной медицине для замещения органов и тканей, утративших свою функцию в результате болезни или травмы.
Известен способ получения альгинатных микросфер, модифицированных децеллюляризованной жировой тканью [1]. Указанный способ выбран в качестве прототипа предложенного решения.
Недостаток этого способа заключается в том, что предлагаемый способ получения альгинатных микросфер не позволяет получить альгинатные микросферы с высокой плотностью микрочастиц децеллюляризованной ткани на их поверхности и прочной ковалентной связью между поверхностью альгинатной микросферы и микрочастицами децеллюляризованной ткани. Это сужает функциональные возможности способа.
Технический результат изобретения заключается в том, что предлагаемые модифицированные альгинатные микроносители имеют высокую плотность микрочастиц децеллюляризованной ткани печени на их поверхности и прочную ковалентную связь между поверхностью альгинатной микросферы и микрочастицами децеллюляризованной ткани печени и могут выступать в качестве биодеградируемого контейнера для биологически активных веществ и/или клеток, а также защищать клетки, инкапсулированные внутрь альгинатных микроносителей от действия иммунной системы реципиента при имплантации. Это расширяет функциональные возможности способа.
Указанный технический результат достигается тем, что способ получения модифицированных альгинатных микросфер включает децеллюляризацию печени, механическое фрагментирование и дальнейшее механическое измельчение с получением микрочастиц децеллюляризированной печени, которые закрепляют путем ковалентного связывания на предварительно полученных альгинатных микросферах, модифицированных с использованием модифицирующих агентов, таких как гидроксисукцинимид (NHS) и гидрохлорид N-(3-диметиламинопропил)-N-этилкарбодиимида (EDC).
Существует вариант, в котором на поверхность альгинатных микросфер, модифицированных микрочастицами децеллюляризированной печени, наносят клетки гепатокарциономы человека Hep-G2.
Существует вариант, в котором внутрь альгинатных микросфер, модифицированных микрочастицами децеллюляризированной печени, включают фактор роста гепатоцитов.
Существует вариант, в котором внутрь альгинатных микросфер, модифицированных микрочастицами децеллюляризированной печени, включают клетки гепатокарциономы человека Hep-G2.
Существует вариант, в котором внутрь альгинатных микросфер, модифицированных микрочастицами децеллюляризированной печени, включают микрочастицы децеллюляризированной печени.
Существует вариант, в котором внутрь альгинатных микросфер дополнительно включают клетки гепатокарциономы человека Hep-G2.
Существует вариант, в котором внутрь альгинатных микросфер дополнительно включают фактор роста гепатоцитов.
На фиг. 1 приведена микрофотография микрочастиц децеллюляризованной ткани печени крысы.
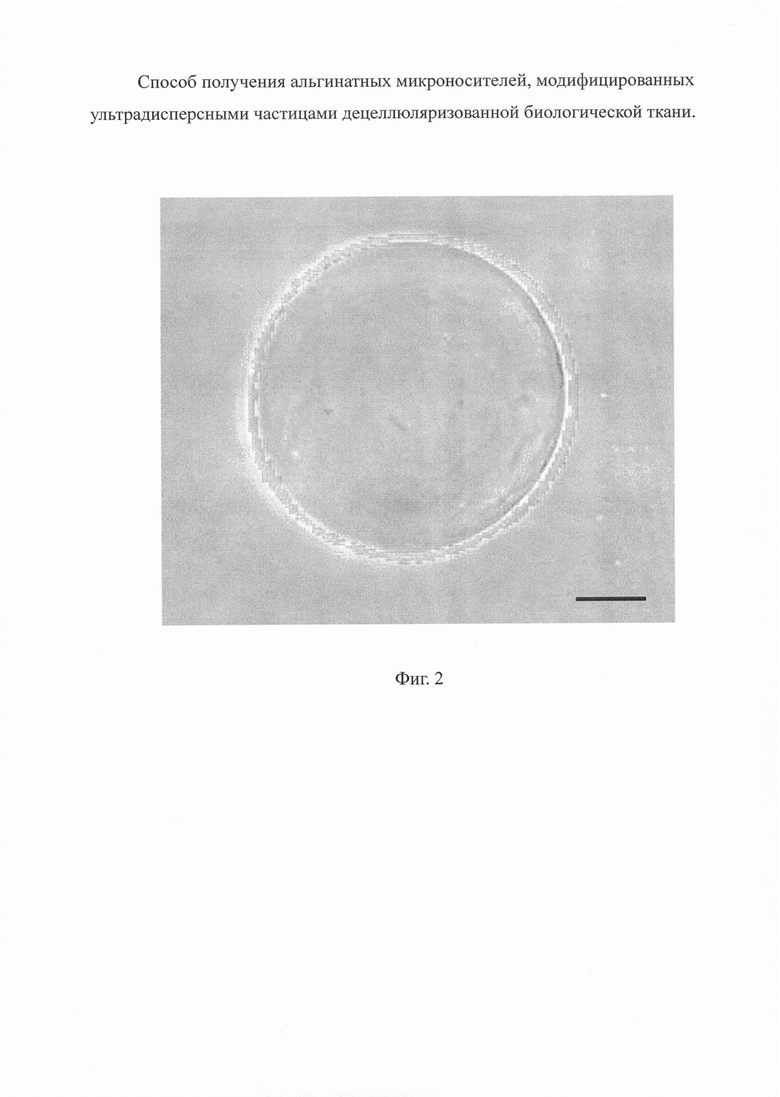
На фиг. 2 приведена микрофотография альгинатного микроносителя.
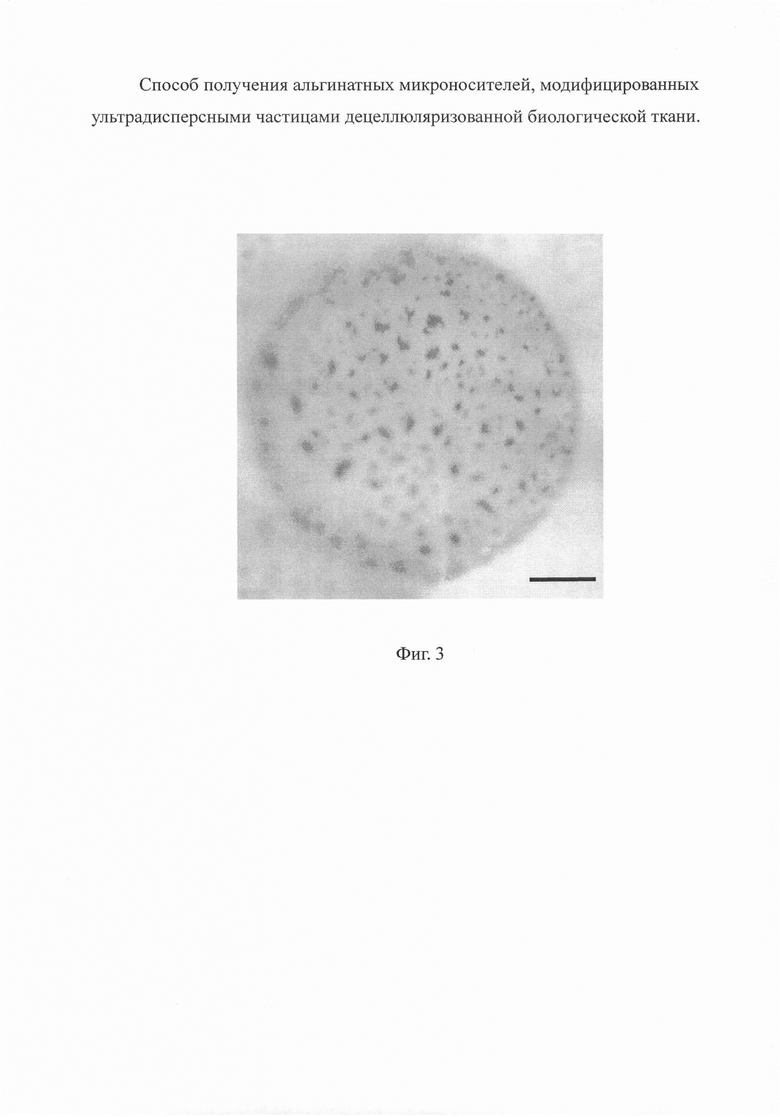
На фиг. 3 приведена микрофотография альгинатного микроносителя, на поверхности которого закреплены ультрадисперсные частицы децеллюляризованной ткани печени крысы.
Предложенный способ реализуется следующим образом. На первом этапе осуществляют децеллюляризацию биологической ткани, например печени крысы. Этот процесс проводят, например, следующим образом.
Крысам породы Wistar за 20 минут до проведения процедуры забора печени вводят 250 мкл гепарина внутрибрюшинно для снижения тромбообразования. Через 30 минут вводят 200 мкл трентала в качестве ангиопротекторного препарата. Для общего парентерального наркоза через 30 минут вводят 0,20 мл препарата Zoletil. Далее вскрывают брюшную полость, производя продольный разрез по средней линии, после чего мышечные лоскуты отворачиваются в стороны. Затем портальную вену канюлируют и промывают от крови 200 мл натрий-фосфатного буфера (рН 7,4) со скоростью 150 мл/ч. Печень децеллюляризируют со скоростью 150 мл/ч последовательно 1) 500 мл натрий-фосфатного буфера, содержащего 0,1% додецилсульфата натрия и 1% Triton Х-100, 2) 500 мл натрий-фосфатного буфера с 0,1% додецилсульфата натрия и 2% Triton Х-100, 3) 500 мл натрий-фосфатного буфера с 0,1% додецилсульфата натрия и 3% Triton Х-100. После децеллюляризации печень отмывают от детергентов 200 мл натрий-фосфатного буфера со скоростью 150 мл/ч, извлекают из крысы, помещают в чашку Петри и измельчают с помощью хирургических ножниц. Размеры фрагментов децеллюляризированной биологической ткани могут составлять 1-3 мм. Измельченную печень перемещают в пробирку, доводят объем до 15 мл 15% раствором глицерина в натрий-фосфатном буфере, инкубируют 20 минут и центрифугируют 10 минут при 500 об/мин. Процесс подробно описан в [2]. На втором этапе производят механическое измельчение полученной децеллюляризированной биологической ткани с получением из нее ультрадисперсных частиц децеллюляризированной биологической ткани. Этот процесс может происходить в жидком азоте с помощью предварительно охлажденных пестика и ступки в течение 5 минут. При этом размеры ультрадисперсных частиц децеллюляризированной биологической ткани могут быть в диапазоне от 1 до 5 мкм. Оптическая микрофотография ультрадисперсных частиц децеллюляризированной биологической ткани печени крысы породы Wistar, полученных вышеописанным способом, представлена на Фиг. 1 (увеличение × 100, размерный отрезок - 5 мкм). Полученные частицы перемещают в чистую предварительно охлажденную пробирку и доводят объем до 25 мл 70% этанолом, после чего тщательно перемешивают. Далее центрифугируют 10 минут при 500 об/мин. После центрифугирования супернатант отбирают в пробирки типа «Эппендорф» (Eppendorf, Германия), герметично закрывают и хранят при +40C в 70% этаноле.
Далее формируют альгинатные микроносители, например, методом осаждения альгинатных гидрогелевых микрочастиц в растворе хлорида кальция с использованием инкапсулятора с вибрирующей форсункой (например, Buchi В-390 [3]). Данный метод и оборудование являются наиболее эффективным методом получения микроносителей с заданными параметрами и хорошей повторяемостью. Методика получения гидрогелевых микроносителей вибрирующей форсунки основана на разбиении ламинарного потока жидкости на капли одинакового размера за счет вибрации. Скорость образования микроносителей напрямую зависит от выбранной частоты вибрации форсунки, к примеру, вибрация с частотой 1000 Гц генерирует 1000 капель в секунду. Подробно этот процесс описан в [4]. Формирование альгинатных микроносителей при помощи данного метода осуществляют, например, следующим образом.
В стеклянный стакан на 400 мл вносят навеску 3,3 г альгината натрия и 200 мл бидистилированной воды. Навеска растворяется при перемешивании на магнитной мешалке в течение 1 часа. Из раствора удаляются крупные комки альгината. Затем раствор инкубируется при перемешивании в течение 1 часа и отстаивается при комнатной температуре до выхода из него пузырей воздуха. В результате получают 1,6% раствор альгината натрия. Раствор альгината разводят бидистилированной водой в 4 раза до концентрации 0,4% в стеклянном стакане при тщательном перемешивании и дегазируют в эксикаторе в течение 3-х часов до выхода всех пузырьков воздуха. В стеклянном стакане подготавливают раствор хлорида кальция с концентрацией 100 мМ. Для осаждения микрочастиц альгината в растворе хлорида кальция можно использовать, например, инкапсулятор Buchi В-390 [3] с форсункой диаметром 120 мкм и шприцевой насос, например, KD Scientific Legato 100 [5].
В шприц шприцевого насоса набирают 2,5 мл раствора альгината натрия и производят распыление раствора альгината натрия через форсунку диаметром 120 мкм в принимающую жидкость - 100 мМ раствор хлорида кальция, где происходит осаждение микрочастиц. Использование следующих параметров инкапсуляции: частота - 1000 Гц, напряжение - 2500 В, скорость подачи раствора из шприца - 5 мл/мин, обеспечивает получение микроносителей диаметром от 200 до 300 мкм. Оптическая микрофотография полученного таким образом альгинатного микроносителя (увеличение × 100, размерный отрезок - 50 мкм) представлена на Фиг. 2.
Полученные микроносители переносят в суспензии в полипропиленовую пробирку типа «Эппендорф» емкостью 1,5 мл для хранения в 100 мМ растворе хлорида кальция с добавлением 30% этанола.
После этого на микроносителях закрепляют ультрадисперсные частицы децеллюляризированной биологической ткани. Этот процесс может осуществляться, например, путем ковалентной пришивки микрочастиц децеллюляризованной биологической ткани следующим образом.
Предварительно альгинатные микроносители и микрочастицы децеллюляризованного матрикса печени переводят в фосфатно-солевой буфер следующего состава: 50 мМ однозамещенного фосфата натрия, 100 мМ хлорида натрия, рН 6,15 - путем центрифугирования в течение 5 минут при 900 g. Суспензию альгинатных микроносителей готовят из расчета 300 мкл густого осадка альгинатных микроносителей на 1 мл суспензии. В качестве модифицирующих агентов используют N-гидроксисукцинимид (NHS) и гидрохлорид N-(3-диметиламинопропил)-N-этилкарбодиимида (EDC), так как эти вещества делают возможным образование ковалентной связи между карбоксильными группами, которые в большом количестве присутствуют в структуре альгината, и аминогруппами в составе компонентов межклеточного матрикса. EDC и NHS добавляют к суспензии альгинатных микроносителей до конечной концентрации 3 мМ и 10 мМ соответственно. Суспензию инкубируют с EDC при перемешивании в течение 1 часа при комнатной температуре, затем добавляют NHS и инкубируют в течение 1 часа в аналогичных условиях.
Отмывку от модифицирующих агентов проводят путем центрифугирования в течение 5 минут при 900 g. Осадок альгинатных микроносителей ресуспендируют в фосфатно-солевом буфере с рН 6,15 и добавляют суспензию ультрадисперсных частиц децеллюляризованного матрикса печени до конечной концентрации 12 мг/мл. Полученную смесь инкубируют при перемешивании в течение 12-ти часов при комнатной температуре. Далее микроносители инкубируют в 100 мМ растворе глицина в течение 1 часа при комнатной температуре, после чего центрифугируют в течение 5 минут при 900 g. Осадок альгинатных микроносителей с закрепленными ультрадисперсными частицами децеллюляризованного матрикса печени ресуспендируют в фосфатно-солевом буфере с рН 7,4 с добавлением 100 мМ хлорида кальция и 30% этанола.
На Фиг. 3 представлена оптическая микрофотография альгинатного микроносителя с закрепленными ультрадисперсными частицами децеллюляризованной ткани печени крысы породы Wistar, полученного вышеописанным способом (увеличение × 100, размерный отрезок - 50 мкм). Для визуализации микрочастиц межклеточного матрикса был использован краситель Кумасси бриллиантовый синий R-250, который связывается с белковыми компонентами в составе матрикса и не связывается с альгинатом. На поверхности модифицированных альгинатных микроносителей идентифицируются оптически плотные гранулы размером 1-5 мкм, окрашенные в темно-синий цвет, соответствующие ультрадисперсным частицам децеллюляризованного матрикса печени.
В одном из вариантов на поверхность альгинатных микроносителей, модифицированных ультрадисперсными частицами децеллюляризированной биологической ткани, наносят биологические клетки. В качестве биологических клеток могут быть использованы клетки гепатокарциномы человека Hep-G2. Этот процесс может осуществляться следующим образом. Суспензию альгинатных микроносителей по 100 мкл переносят, например, в лунки 96-луночного планшета, после чего вносят суспензию клеток гепатокарциномы человека Hep-G2 в среде инкубации из расчета 13500 клеток на 1 см поверхности микроносителей. Планшет закрывают и помещают в термостат при 37°C и 5% CO2. Аналогично, в качестве биологических клеток могут быть использованы, например, мезенхимальные стволовые клетки.
В одном из вариантов формируют альгинатные микроносители, внутрь которых помещают ультрадисперсные частицы децеллюляризированной биологической ткани. В качестве ультрадисперсных частиц децеллюляризированной биологической ткани могут быть использованы микрочастицы децеллюляризованной печени. Этот процесс может осуществляться следующим образом. Микрочастицы децеллюляризованной печени предварительно переводят в раствор фосфатно-солевого буфера путем многократного центрифугирования с последующим ресуспендированием в растворе фосфатно-солевого буфера. Для изготовления микроносителей используют раствор альгината натрия с концентрацией 1,6%, подготовленный по методике, аналогичной методике получения раствора альгината для формирования альгинатных микроносителей. Суспензию микрочастиц децеллюляризованной печени смешивают с 1,6% раствором альгината натрия из расчета, чтобы конечная концентрация микрочастиц децеллюляризованной печени составляла не менее 20 мг/мл. В пробирке готовят раствор хлорида кальция с концентрацией 100 мМ на фосфатно-солевом буфере. Изготовление микрочастиц производят методом осаждения в растворе хлорида кальция. Для этого можно использовать, например, инкапсулятор Buchi В-390 [3] с форсункой диаметром 120 мкм и шприцевой насос, например, KD Scientific Legato 100 [5]. В шприц шприцевого насоса набирают 2,5 мл смеси раствора альгината натрия с суспензией микрочастиц децеллюляризованной печени. Распыление смеси производят через форсунку диаметром 120 мкм в принимающую жидкость - 100 мМ раствор хлорида кальция на фосфатно-солевом буфере. Использование следующих параметров инкапсуляции: частота - 1000 Гц, напряжение - 2500 В, скорость подачи раствора из шприца - 5 мл/мин, обеспечивает получение микроносителей диаметром от 200 до 300 мкм.
В одном из вариантов формируют альгинатные микроносители, внутрь которых помещают биологически активные вещества. В качестве биологически активного вещества может быть использован фактор роста гепатоцитов, описанный, например, в [6]. Этот процесс может осуществляться следующим образом. На первом этапе получают раствор фактора роста гепатоцитов в растворе ХЕПЕС с концентрацией 10 мМ. Для изготовления микроносителей используют раствор альгината натрия с концентрацией 1,6%, подготовленный по методике, аналогичной методике получения раствора альгината для формирования альгинатных микроносителей. Раствор фактора роста гепатоцитов смешивают с 1,6% раствором альгината натрия из расчета, чтобы конечная концентрация фактора роста гепатоцитов в суспензии была в диапазоне от 20 нг/мл до 1 мкг/мл. В пробирке готовят раствор хлорида кальция с концентрацией 3 00 мМ на 10 мМ растворе ХЕПЕС. Изготовление микрочастиц производят методом осаждения в растворе хлорида кальция. Для этого можно использовать, например, инкапсулятор Buchi В-390 [3] с форсункой диаметром 120 мкм и шприцевой насос, например, KD Scientific Legato 100 [5]. В шприц шприцевого насоса набирают 2,5 мл смеси раствора альгината натрия с фактором роста гепатоцитов. Распыление смеси производят через форсунку диаметром 120 мкм в принимающую жидкость - 100 мМ раствор хлорида кальция на 10 мМ растворе ХЕПЕС. Использование следующих параметров инкапсуляции: частота - 1000 Гц, напряжение - 2500 В, скорость подачи раствора из шприца - 5 мл/мин, обеспечивает получение микроносителей диаметром от 200 до 300 мкм.
В одном из вариантов формируют альгинатные микроносители, внутрь которых помещают биологические клетки. В качестве биологических клеток могут быть использованы клетки гепатокарциномы человека Hep-G2. Этот процесс может осуществляться следующим образом. На первом этапе получают суспензию клеток гепатокарциномы человека Hep-G2 в растворе ХЕПЕС с концентрацией 10 мМ. Для этого клетки снимают с поверхности культурального пластика раствором трипсина-ЭДТА, затем осаждают в центрифуге и ресуспендируют в 10 мМ растворе ХЕПЕС. Для изготовления микроносителей используют раствор альгината натрия с концентрацией 1,6%, подготовленный по методике, аналогичной методике получения раствора альгината для формирования альгинатных микроносителей. Суспензию клеток смешивают с 1,6% раствором альгината натрия из расчета, чтобы конечная концентрация клеток в суспензии была не менее 106 клеток в 1 мл. В пробирке готовят раствор хлорида кальция с концентрацией 100 мМ на 10 мМ растворе ХЕПЕС. Изготовление микрочастиц производят методом осаждения в растворе хлорида кальция. Для этого можно использовать, например, инкапсулятор Buchi В-390 [3] с форсункой диаметром 120 мкм и шприцевой насос, например, KD Scientific Legato 100 [5]. В шприц шприцевого насоса набирают 2,5 мл смеси раствора альгината натрия с суспензией клеток гепатокарциномы человека Hep-G2. Распыление смеси производят через форсунку диаметром 120 мкм в принимающую жидкость - 100 мМ раствор хлорида кальция на 10 мМ растворе ХЕПЕС. Использование следующих параметров инкапсуляции: частота - 1000 Гц, напряжение - 2500 В, скорость подачи раствора из шприца - 5 мл/мин, обеспечивает получение микроносителей диаметром от 200 до 300 мкм. Аналогично, в качестве биологических клеток могут быть использованы, например, мезенхимальные стволовые клетки.
В одном из вариантов внутрь альгинатных микроносителей помещают ультрадисперсные частицы децеллюляризированной биологической ткани и биологические клетки. В качестве ультрадисперсных частиц децеллюляризированной биологической ткани могут быть использованы микрочастицы децеллюляризованной печени, а в качестве биологических клеток могут быть использованы клетки гепатокарциномы человека Hep-G2. Этот процесс может осуществляться следующим образом. На первом этапе получают суспензию клеток гепатокарциномы человека Hep-G2 в растворе ХЕПЕС с концентрацией 10 мМ. Для этого клетки снимают с поверхности культурального пластика раствором трипсина-ЭДТА, затем осаждают в центрифуге и ресуспендируют в 10 мМ растворе ХЕПЕС. Затем получают суспензию микрочастиц децеллюляризованной печени путем многократного центрифугирования с последующим ресуспендированием в 10 мМ растворе ХЕПЕС. После этого получают суспензию клеток и микрочастиц в 10 мМ растворе ХЕПЕС путем смешивания полученных суспензий. Для изготовления микроносителей используют раствор альгината натрия с концентрацией 1,6%, подготовленный по методике, аналогичной методике получения раствора альгината для формирования альгинатных микроносителей. Получают смесь раствора альгината с суспензией микрочастиц децеллюляризованной печени и клеток гепатокарциномы человека Hep-G2 из расчета, чтобы конечная концентрация клеток в суспензии была равной не менее 8×105 клеток в 1 мл при концентрации микрочастиц децеллюляризованной печени 10 мг/мл. В пробирке готовят раствор хлорида кальция с концентрацией 100 мМ на 10 мМ растворе ХЕПЕС. Изготовление микрочастиц производят методом осаждения в растворе хлорида кальция. Для этого можно использовать, например, инкапсулятор Buchi В-390 [3] с форсункой диаметром 120 мкм и шприцевой насос, например, KD Scientific Legato 100 [5]. В шприц шприцевого насоса набирают 2,5 мл полученной смеси. Распыление смеси производят через форсунку диаметром 120 мкм в принимающую жидкость - 100 мМ раствор хлорида кальция на 10 мМ растворе ХЕПЕС. Использование следующих параметров инкапсуляции: частота - 1000 Гц, напряжение - 2500 В, скорость подачи раствора из шприца - 5 мл/мин, обеспечивает получение микроносителей диаметром от 200 до 300 мкм.
В одном из вариантов внутрь альгинатных микроносителей помещают ультрадисперсные частицы децеллюляризированной биологической ткани, биологические клетки и биологически активные вещества. В качестве ультрадисперсных частиц децеллюляризированной биологической ткани могут быть использованы микрочастицы децеллюляризованной печени, в качестве биологических клеток могут быть использованы клетки гепатокарциномы человека Hep-G2, а в качестве биологически активного вещества может быть использован фактор роста гепатоцитов. Этот процесс может осуществляться следующим образом. На первом этапе получают суспензию клеток гепатокарциномы человека Hep-G2 в растворе ХЕПЕС с концентрацией 10 мМ. Для этого клетки снимают с поверхности культурального пластика раствором трипсина-ЭДТА, затем осаждают в центрифуге и ресуспендируют в 10 мМ растворе ХЕПЕС. Затем получают суспензию микрочастиц децеллюляризованной печени путем многократного центрифугирования с последующим ресуспендированием в 10 мМ растворе ХЕПЕС. Далее получают раствор фактора роста гепатоцитов в растворе ХЕПЕС с концентрацией 10 мМ. После этого получают суспензию клеток, микрочастиц и фактора роста гепатоцитов в 10 мМ растворе ХЕПЕС путем смешивания полученных суспензий. Для изготовления микроносителей используют раствор альгината натрия с концентрацией 1,6%, подготовленный по методике, аналогичной методике получения раствора альгината для формирования альгинатных микроносителей. Получают смесь раствора альгината с суспензией микрочастиц децеллюляризованной печени, клеток гепатокарциномы человека Hep-G2 и раствора фактора роста гепатоцитов из расчета, чтобы конечная концентрация клеток в суспензии была равной не менее 8×105 клеток в 1 мл при концентрации микрочастиц децеллюляризованной печени 10 мг/мл и конечная концентрация фактора роста гепатоцитов в суспензии была в диапазоне от 20 нг/мл до 1 мкг/мл. В пробирке готовят раствор хлорида кальция с концентрацией 100 мМ на 10 мМ растворе ХЕПЕС. Изготовление микроносителей производят методом осаждения в растворе хлорида кальция. Для этого можно использовать, например, инкапсулятор Buchi В-390 [3] с форсункой диаметром 120 мкм и шприцевой насос, например, KD Scientific Legato 100 [5]. В шприц шприцевого насоса набирают 2,5 мл полученной смеси. Распыление смеси производят через форсунку диаметром 120 мкм в принимающую жидкость - 100 мМ раствор хлорида кальция на 10 мМ растворе ХЕПЕС. Использование следующих параметров инкапсуляции: частота - 1000 Гц, напряжение - 2500 В, скорость подачи раствора из шприца - 5 мл/мин, обеспечивает получение микроносителей диаметром от 200 до 300 мкм
То, что способ получения модифицированных альгинатных микросфер включает децеллюляризацию печени механическое фрагментирование и дальнейшее механическое измельчение с получением микрочастиц децеллюляризированной печени, которые закрепляют путем ковалентного связывания на предварительно полученных альгинатных микросферах, модифицированных с использованием модифицирующих агентов, таких как гидроксисукцинимид (NHS) и гидрохлорид N-(3-диметиламинопропил)-N-этилкарбодиимида (EDC), расширяет функциональные возможности способа.
То, что на поверхность альгинатных микросфер, модифицированных микрочастицами децеллюляризированной печени наносят клетки гепатокарциономы человека Hep-G2, расширяет функциональные возможности способа.
То, что внутрь альгинатных микросфер, модифицированных микрочастицами децеллюляризированной печени, включают фактор роста гепатоцитов, расширяет функциональные возможности способа.
То, что внутрь альгинатных микросфер, модифицированных микрочастицами децеллюляризированной печени, включают клетки гепатокарциономы человека Hep-G2, расширяет функциональные возможности способа.
То, что внутрь альгинатных микросфер, модифицированных микрочастицами децеллюляризированной печени, включают микрочастицы децеллюляризированной печени, расширяет функциональные возможности способа.
То, что внутрь альгинатных микросфер дополнительно включают клетки гепатокарциономы человека Hep-G2, расширяет функциональные возможности способа.
То, что внутрь альгинатных микросфер дополнительно включают фактор роста гепатоцитов, расширяет функциональные возможности способа.
Список литературы
1. Shin-Yi et. al. The Influence of Alginate Microspheres Modified with DAT on the Proliferation and Adipogenic Differentiation of ASCs / International Journal of Biomedical and Biological Engineering: 18 International Conference on Bimedical Engineering, 2014, Vol. 1, N. 11.
2. M.M. Боброва, Л.А. Сафонова, О.И. Агапова, М.Е. Крашенинников, М.Ю. Шагидулин, И.И. Агапов. "Децеллюляризация ткани печени как перспективная технология получения пористого матрикса для тканевой инженерии и регенеративной медицины". Современные технологии в медицине, 2015, том 7, №4, с. 6-13.
3. http://www.buchi.com/ru-ru/products/spray-drying-and-encapsulation/encapsulator-b-390.
4. "Инкапсулятор Buchi B-390. Руководство пользователя."  Labortechnik AG, CH-9230 Flawil 1/Switzerland, 2012.
Labortechnik AG, CH-9230 Flawil 1/Switzerland, 2012.
5. http://www.kdscientific.com/technicol-resources/flow-rates.asp#legato100Series.
6. Soto-Gutierrez A., Zhang L., Medberry C., Fukumitsu K., Faulk D., Jiang H., Reing J., Gramignoli R., Komori J., Ross M., Nagaya M., Lagasse E., Stolz D., Strom S.C., Fox I.J., Badylak S.F., 2011. A whole-Organ regenerative medicine approach for liver replacement // Tissue Engineering. V. 17. R677-686.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БИОДЕГРАДИРУЕМЫХ СКАФФОЛДОВ ИЗ ФИБРОИНА ШЕЛКА С УЛУЧШЕННЫМИ БИОЛОГИЧЕСКИМИ СВОЙСТВАМИ | 2017 |
|
RU2683557C1 |
| Композиция для изготовления биодеградируемых скаффолдов и способ ее получения | 2017 |
|
RU2684769C1 |
| БИОРЕЗОРБИРУЕМЫЙ МИКРОНОСИТЕЛЬ ДЛЯ ДОСТАВКИ КЛЕТОК В ОБЛАСТЬ ЗАЖИВЛЕНИЯ И РЕГЕНЕРАЦИИ РАН | 2015 |
|
RU2616866C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТКАНЕСПЕЦИФИЧЕСКОГО МАТРИКСА ДЛЯ ТКАНЕВОЙ ИНЖЕНЕРИИ ПАРЕНХИМАТОЗНОГО ОРГАНА | 2013 |
|
RU2539918C1 |
| Способ получения тканеспецифического матрикса для тканевой инженерии хряща | 2019 |
|
RU2716577C1 |
| Тканеспецифический матрикс для тканевой инженерии паренхиматозного органа и способ его получения | 2016 |
|
RU2693432C2 |
| СИСТЕМА ИНКАПСУЛЯЦИИ | 2006 |
|
RU2429864C2 |
| КОМПОЗИЦИЯ ИНКАПСУЛИРОВАННЫХ КЛЕТОК ПЕЧЕНИ | 2010 |
|
RU2564924C2 |
| КОМПОЗИЦИЯ ИНКАПСУЛИРОВАННЫХ КЛЕТОК ПЕЧЕНИ | 2010 |
|
RU2500390C2 |
| Способ лечения печеночной недостаточности | 2016 |
|
RU2618989C1 |

Изобретение относится к области исследования биоматериалов и тканевой инженерии, а именно к способу получения модифицированных альгинатных микросфер, включающему децеллюляризацию печени, ее механическое фрагментирование и дальнейшее механическое измельчение с получением микрочастиц децеллюляризированной печени, которые закрепляют путем ковалентного связывания на предварительно полученных альгинатных микросферах, модифицированных с использованием модифицирующих агентов, таких как гидроксисукцинимид (NHS) и гидрохлорид N-(3-диметиламинопропил)-N-этилкарбодиимида (EDC). Изобретение обеспечивает высокую плотность микрочастиц децеллюляризированной ткани печени на поверхности модифицированных альгинатных микроносителей и прочную ковалентную связь между ними. Предлагаемые модифицированные альгинатные микросферы могут выступать в качестве биодеградируемого контейнера для биологически активных веществ и/или клеток, а также защищать клетки, инкапсулированные внутрь альгинатных микроносителей от действия иммунной системы реципиента при имплантации. 6 з.п. ф-лы, 3 ил.
1. Способ получения модифицированных альгинатных микросфер, отличающийся тем, что включает децеллюляризацию печени, ее механическое фрагментирование и дальнейшее механическое измельчение с получением микрочастиц децеллюляризированной печени, которые закрепляют путем ковалентного связывания на предварительно полученных альгинатных микросферах, модифицированных с использованием модифицирующих агентов, таких как гидроксисукцинимид (NHS) и гидрохлорид N-(3-диметиламинопропил)-N-этилкарбодиимида (EDC).
2. Способ по п. 1, отличающийся тем, что на поверхность альгинатных микросфер, модифицированных микрочастицами децеллюляризированной печени, наносят клетки гепатокарциономы человека Hep-G2.
3. Способ по п. 1, отличающийся тем, что внутрь альгинатных микросфер, модифицированных микрочастицами децеллюляризированной печени, включают фактор роста гепатоцитов.
4. Способ по п. 1, отличающийся тем, что внутрь альгинатных микросфер, модифицированных микрочастицами децеллюляризированной печени, включают клетки гепатокарциономы человека Hep-G2.
5. Способ по п. 1, отличающийся тем, что внутрь альгинатных микросфер, модифицированных микрочастицами децеллюляризированной печени, включают микрочастицы децеллюляризированной печени
6. Способ по п. 5, отличающийся тем, что внутрь альгинатных микросфер дополнительно включают клетки гепатокарциономы человека Hep-G2.
7. Способ по п. 6, отличающийся тем, что внутрь альгинатных микросфер дополнительно включают фактор роста гепатоцитов.
| Shin-Yi et al | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| WO 2015048317 A1, 02.04.2015 | |||
| СПОСОБ ПОЛУЧЕНИЯ ТКАНЕСПЕЦИФИЧЕСКОГО МАТРИКСА ДЛЯ ТКАНЕВОЙ ИНЖЕНЕРИИ ПАРЕНХИМАТОЗНОГО ОРГАНА | 2013 |
|
RU2539918C1 |
| Archana Bhat et al | |||
| Alginate hydrogels containing cell-interactive beads for bone formation / The FASEB Journal, 2013, Vol.27, pages 1-9. | |||
Авторы
Даты
2017-01-10—Публикация
2015-10-22—Подача