СВЯЗАННЫЕ ЗАЯВКИ
По этой заявке испрашивается приоритет согласно предварительной заявке US 61/510,832, поданной 22 июля 2011 года, описание которой включено здесь в виде ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Для создания формы твердого орально-доставляемого фармацевтического соединения требуется получить множество определенных характеристик. Хотя может быть создана аморфная форма фармацевтического соединения, в целом предпочтительны соединения, имеющие высокую степень кристалличности. Часто такие высоко кристаллические соединения - это соли.
Международная Публикация WO 2004/046092 описывает ряд соединений, которые указаны как антагонисты CCR9 рецептора, и которые, как указано, используются при лечении CCR9-обусловленных заболеваний. В частности, в этой заявке раскрыто соединение 4-трет-бутил-N-[4-хлор-2-(1-окси-пиридин-4-карбонил)-фенил]-бензолсульфонамид (в дальнейшем, "соединение А"). Идентификация устойчивой кристаллической формы такого соединения с подходящими свойствами для орального введения была бы очень желательна для лечения CCR9-обусловленных заболеваний.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новой кристаллической форме натриевой соли 4-трет-бутил-N-[4-хлор-2-(1-окси-пиридин-4-карбонил)-фенил]-бензолсульфонамиду (в дальнейшем, "Соединение В"). Соединение по изобретению представлено Структурой (I):
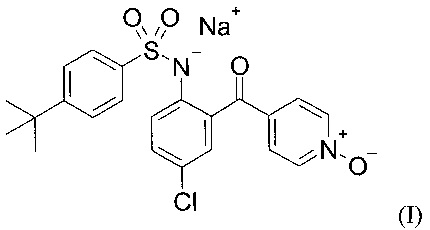
Соединение этого изобретения используется для противодействия рецептору CCR9 и для лечения заболеваний, таких как воспалительные заболевания внутренних органов человека, включая болезнь Крона и язвенный колит.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фиг. 1 показывает рентгеновскую порошковую дифракционную структуру Соединения А.
Фиг. 2 показывает рентгеновскую порошковую дифракционную структуру Соединения В - аморфная форма.
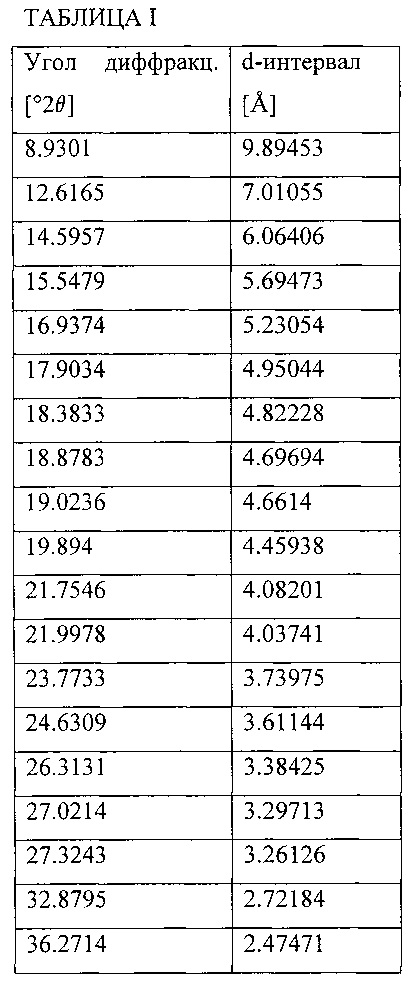
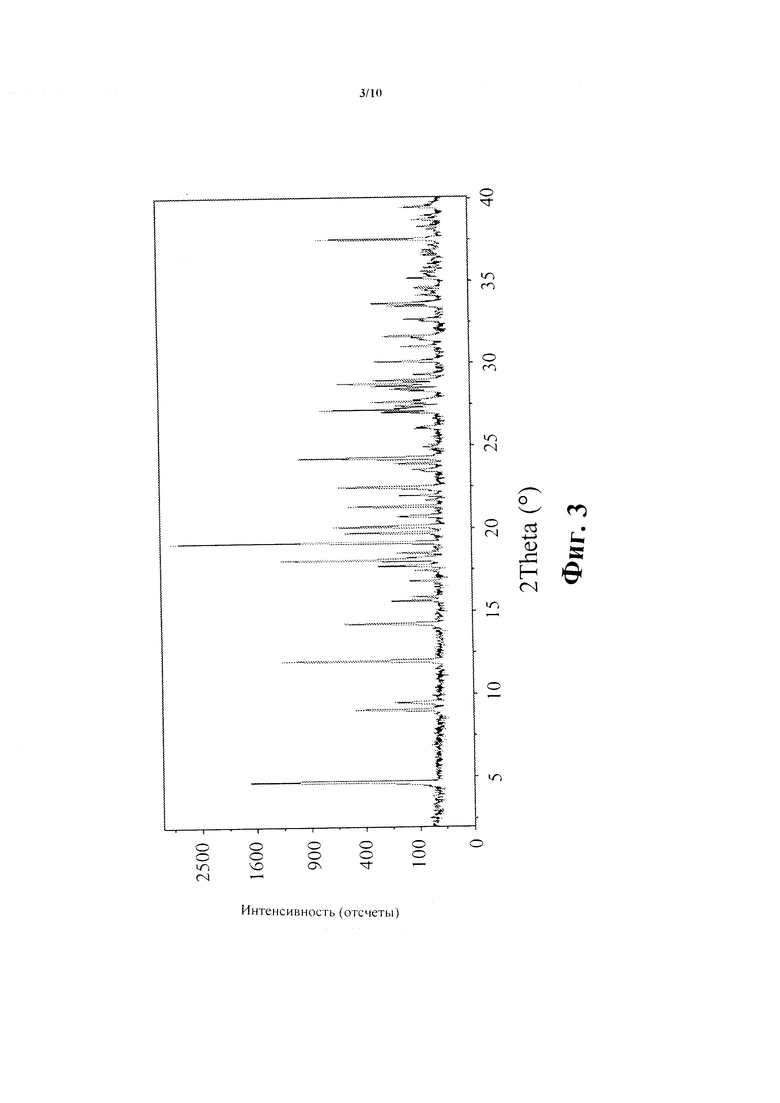
Фиг. 3 показывает рентгеновскую порошковую дифракционную структуру Соединения В - безводная кристаллическая форма.
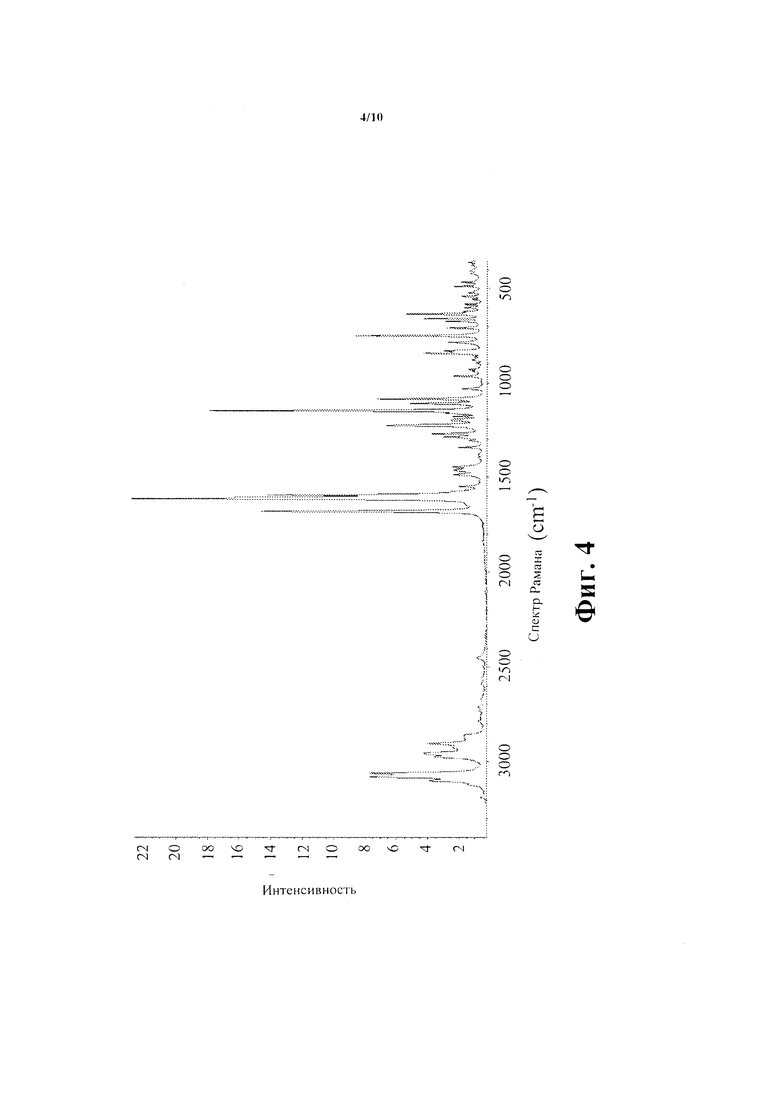
Фиг. 4 показывает Рамановский Спектр Соединения А.
Фиг. 5 показывает преобразование Фурье инфракрасного спектра Соединения В - аморфная форма.
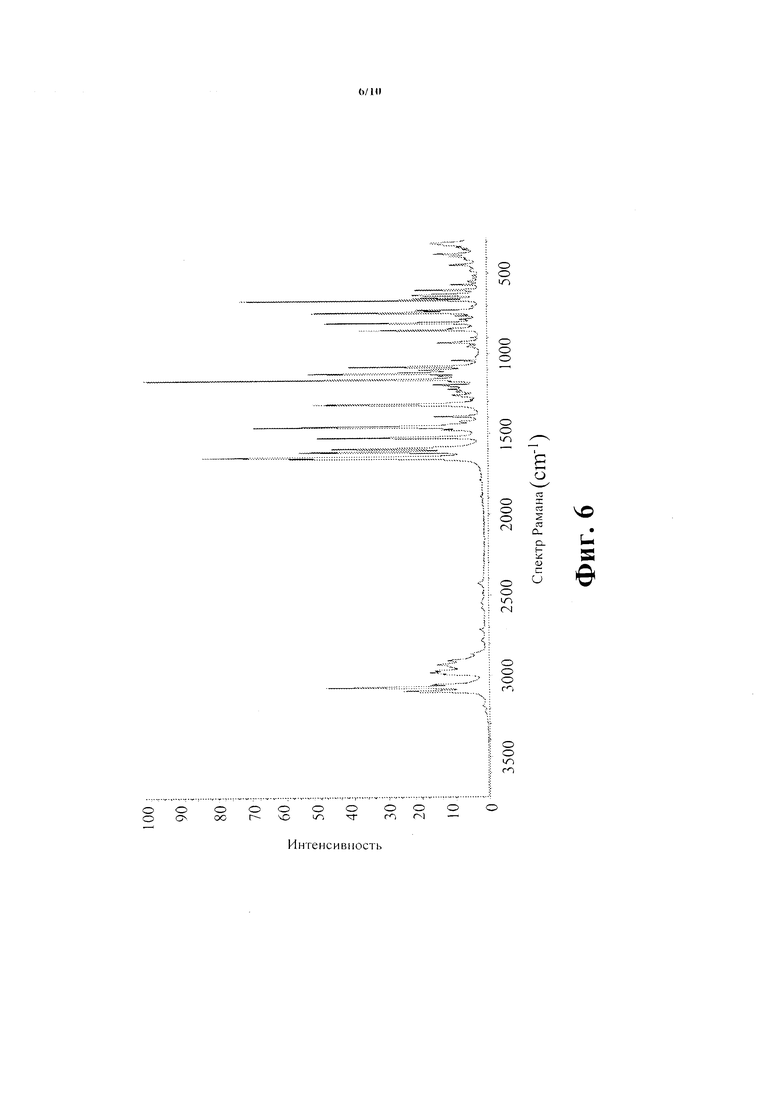
Фиг. 6 показывает Рамановский Спектр Соединения В - безводная кристаллическая форма.
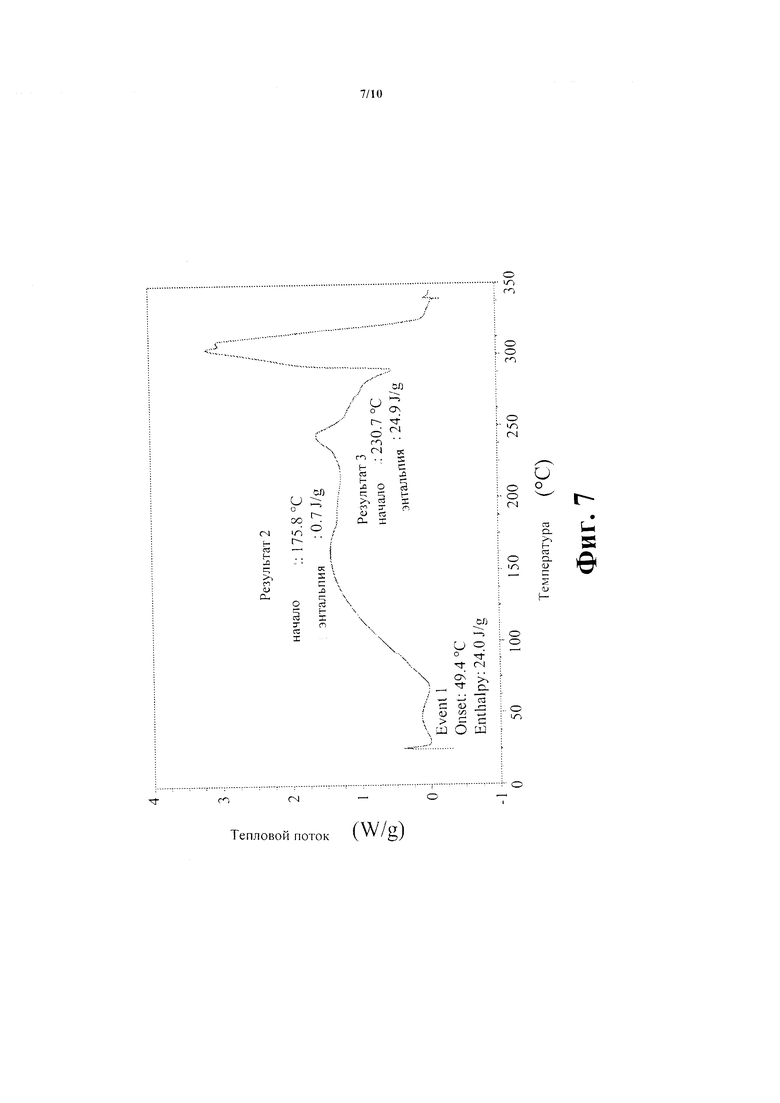
Фиг. 7 показывает след Соединения В - аморфная форма - дифференциальной сканирующей калориметрии.
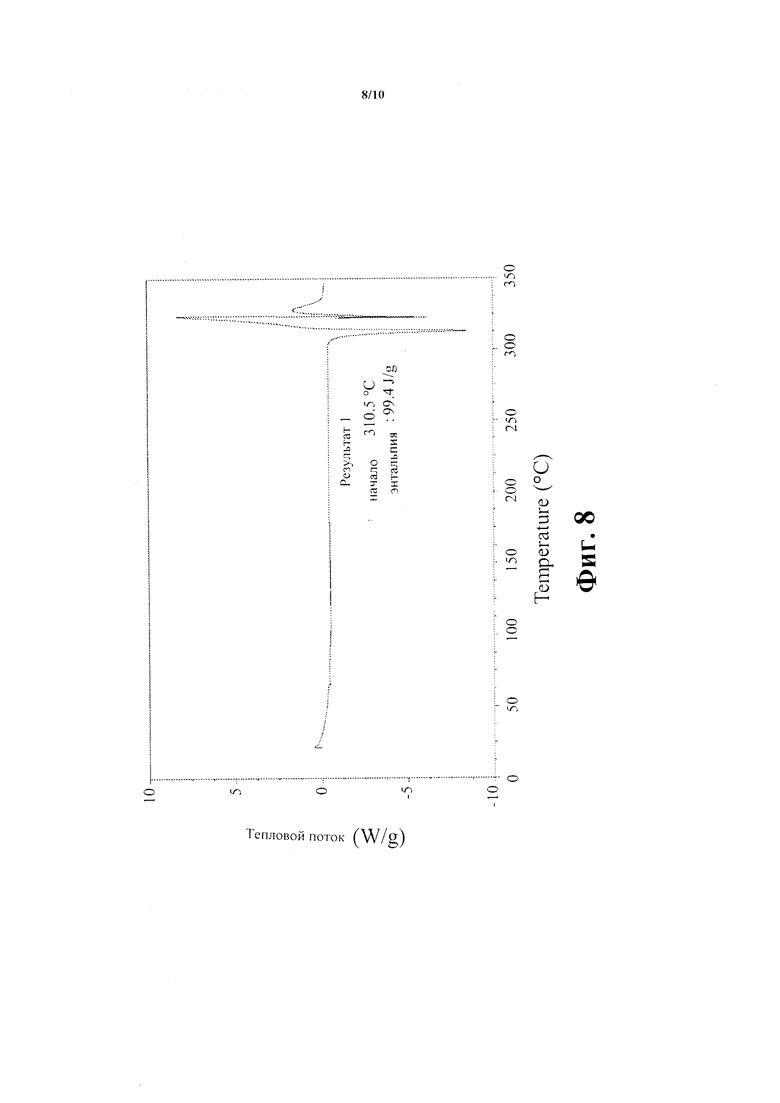
Фиг. 8 показывает след Соединения В - безводная кристаллическая форма -дифференциальной сканирующей калориметрии.
Фиг. 9 показывает след Соединения В - аморфная форма термогравиметрического анализа.
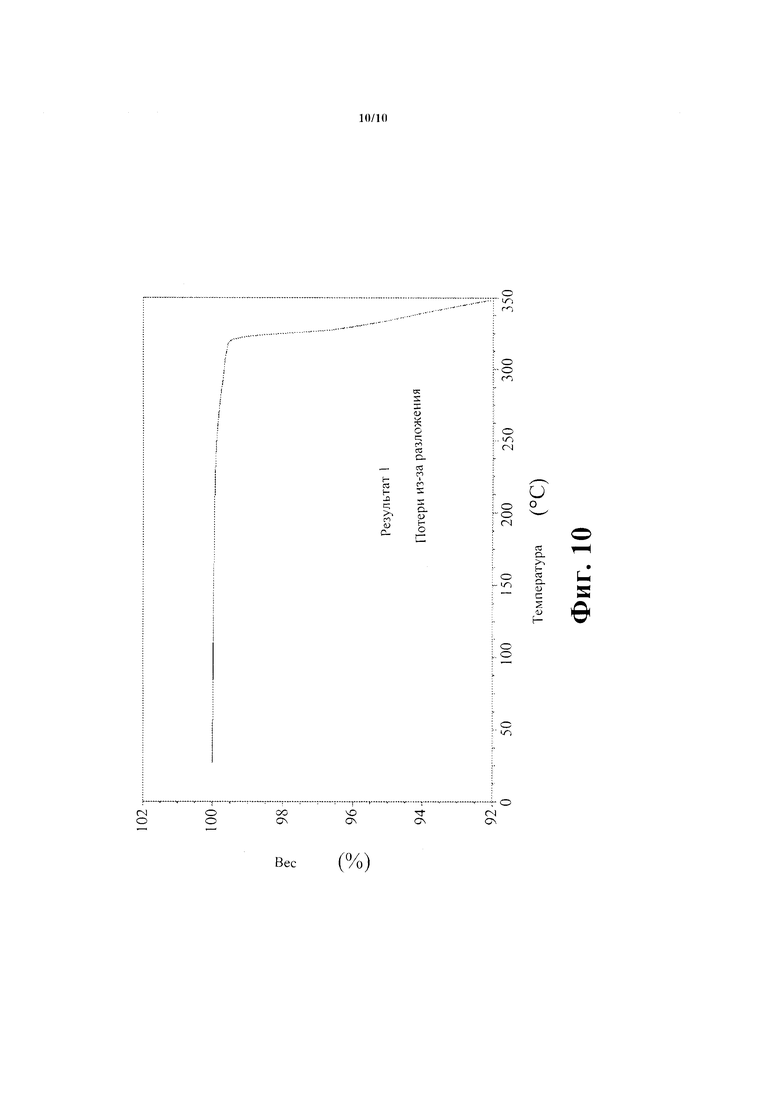
Фиг. 10 показывает след Соединения В - безводная кристаллическая форма -термогравиметрического анализа.
ДЕТАЛИЗИРОВАННОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на кристаллическую форму натриевой соли 4-трет-бутил-N-[4-хлор-2-(1-окси-пиридин-4-карбонил)-фенил]-бензолсульфонамида (в дальнейшем "Соединение В - кристаллическая форма ").
В некоторых воплощениях Соединение В - кристаллическая форма является безводной (в дальнейшем, "Соединение В - безводная кристаллическая форма").
В некоторых воплощениях Соединение В - безводная кристаллическая форма - характеризуется рентгеновской порошковой дифракционной структурой (XRPD), включающей, по крайней мере, три дифракционных угла, при измерении с использованием Cu Kα радиации, выбранные из группы, включающей приблизительно 4.7, 9.1, 12.0, 14.2, 17.7, 18.1, 19.2, 19.8, 20.1, 21.3, 22.5, 24.3, 27.0, 27.2, 27.7, 28.6, 28.8, 29.0, 30.1, 31.6, 33.5, 33.6 и 37.6 градусов 2θ.
В одном воплощении Соединение В - безводная кристаллическая форма - характеризуется рентгеновской порошковой дифракционной (XRPD), структурой, включающей, по крайней мере, три угла дифракции, при измерении с использованием Cu Kα радиации, выбранные из группы, включающей приблизительно 4.7, 9.1, 12.0, 14.2, 18.1, 19.2, 19.8, 20.1, 21.3, 22.5, 24.3, 27.2, 28.8 и 37.6 градусов 2θ.
В другом воплощении соединение В - безводная кристаллическая форма - характеризуется рентгеновской порошковой дифракционной (XRPD) структурой, включающей, по крайней мере, три угла дифракции при измерении с использованием Cu Kα радиации, выбранные из группы, включающей приблизительно 4.7, 12.0, 14.2, 18.1, 19.2 и 24.3 градусов 2θ.
В еще одном воплощении Соединение В - безводная кристаллическая форма -характеризуется рентгеновской порошковой дифракционной (XRPD) структурой, включающей углы дифракции при измерении с использованием Cu Kα радиации, приблизительно 4.7, 12.0, 14.2, 18.1, 19.2 и 24.3 градусов 2θ.
В еще одном воплощении Соединение В - безводная кристаллическая форма - характеризуется рентгеновской порошковой дифракционной (XRPD) структурой, включающей углы дифракции при измерении с использованием Cu Kα радиации, приблизительно 4.7, 12.0 и 19.2 градусов 2θ.
В еще одном воплощении Соединение В - безводная кристаллическая форма - характеризуется рентгеновской порошковой дифракционной (XRPD) структурой, включающей углы дифракции при измерении с использованием Cu Kα радиации, приблизительно 4.7, 12.0, 18.1 и 19.2 градусов 2θ.
В еще одном воплощении Соединение В - безводная кристаллическая форма - характеризуется рентгеновской порошковой дифракционной (XRPD) структурой, включающей углы дифракции при измерении с использованием Cu Kα радиации, приблизительно 4.7, 12.0, 14.2, 18.1 и 19.2 градусов 20.
В еще одном воплощении Соединение В - безводная кристаллическая форма - характеризуется рентгеновской порошковой дифракционной (XRPD) структурой, включающей углы дифракции при измерении с использованием Cu Kα радиации, приблизительно 4.7, 12.0, 19.2 и 24.3 градусов 2θ.
В еще одном воплощении Соединение В - безводная кристаллическая форма - характеризуется рентгеновской порошковой дифракционной (XRPD) структурой, включающей углы дифракции при измерении с использованием Cu Kα радиации, приблизительно 4.7, 12.0, 18.1, 19.2 и 24.3 градусов 2θ.
В еще одном воплощении Соединение В - безводная кристаллическая форма - характеризуется рентгеновской порошковой дифракционной (XRPD) структурой, включающей углы дифракции при измерении с использованием Cu Kα радиации, приблизительно 4.7, 19.2 и 24.3 градусов 2θ.
В еще одном воплощении Соединение В - безводная кристаллическая форма - характеризуется рентгеновской порошковой дифракционной (XRPD) структурой, включающей углы дифракции при измерении с использованием Cu Kα радиации, приблизительно 12.0, 19.2 и 24.3 градусов 2θ.
В еще одном воплощении Соединение В - безводная кристаллическая форма - характеризуется рентгеновской порошковой дифракционной (XRPD)) структурой в основном в соответствии с Фиг. 3.
В других воплощениях Соединение В - безводная кристаллическая форма - характеризуется Рамановским Спектром, включающим, по крайней мере, три пика в положениях, выбранных из группы, состоящей из пиков на приблизительно 601, 632, 651, 664, 726, 740, 803, 853, 931, 1080, 1123, 1138, 1162, 1318, 1395, 1458, 1526, 1595, 1614 и 1647 см-1.
В одном воплощении Соединение В - безводная кристаллическая форма - характеризуется Спектром Рамана, включающим, по крайней мере, три пика в положениях, выбранных из группы, состоящей из пиков на приблизительно 664, 740, 803, 853, 1080, 1123, 1162, 1318, 1458, 1526, 1595, 1614 и 1647 см-1.
В другом воплощении Соединение В - безводная кристаллическая форма - характеризуется Спектром Рамана, включающим, по крайней мере, три пика в положениях, выбранных из группы, состоящей из пиков на приблизительно 664, 1162, 1458, 1614 и 1647 см-1.
В еще одном воплощении Соединение В - безводная кристаллическая форма - характеризуется Спектром Рамана, включающим пики на приблизительно 664, 740, 803, 853, 1080, 1123, 1162, 1318, 1458, 1526, 1595, 1614 и 1647 см-1.
В еще одном воплощении Соединение В - безводная кристаллическая форма - характеризуется Спектром Рамана в основном в соответствии с Фиг. 6.
В дальнейших воплощениях Соединение В - безводная кристаллическая форма - характеризуется следом дифференциальной сканирующей калориметрии в основном в соответствии с Фиг. 8 и/или следом термогравиметрического анализа в основном в соответствии с Фиг. 10.
В дальнейших воплощениях, как понятно специалисту в отрасли, Соединение В - безводная кристаллическая форма - характеризуется любой комбинацией аналитических данных, характеризующих вышеупомянутые воплощения.
Структура XRPD, как будет понятно, включает дифракционный угол (выраженный в градусах 2θ), составляющий приблизительно величину, определенную здесь, когда структура XRPD включает угол дифракции в пределах ±0.2 градуса 2θ указанной величины. Далее, как известно и понятно специалистам области, применяемая аппаратура, влажность, температура, ориентация кристаллов порошка и другие параметры, включаемые в получение рентгеновской порошковой дифракционной (XRPD) структуры, могут вызвать некоторую вариабельность во внешнем виде, интенсивностях и положениях линий в дифракционной структуре. Рентгеновская порошковая дифракционная структура, которая находится "по существу в соответствии" со структурой по Фиг. 1, 2 или 3, обеспеченным здесь, - это структура XRPD, которая, как очевидно специалисту отрасли, представляет соединение, обладающее той же самой кристаллической формой, что и соединение, которое обеспечено XRPD структурой Фиг. 1, 2 или 3. Таким образом, структура XRPD может быть идентичной структуре Фиг. 1, 2 или 3, или более вероятно она может несколько отличаться. Такая XRPD структура не обязательно может показывать каждую из линий любой из дифракционной структур, представленных здесь, и/или может показывать небольшое изменение во внешнем виде, интенсивности или сдвиге в положении упомянутых линий, следующее из различий в условиях, включаемых при получении данных. Специалист в области способен определить, имеет ли структура кристаллического соединения ту же самую форму или отлична от формы, раскрытой здесь, путем сравнения их XRPD структур. Например, специалист в области может сравнить XRPD структуру образца натриевой соли 4-трет-бутил-1N-[4-хлор-2-(1-окси-пиридин-4-карбонил)-фенил]-бензолсульфонамида с Фиг. 3 и, используя экспертизу и знания в области, легко определить, соответствует ли XRPD структура образца по существу XRPD структуре Соединения В безводной кристаллической формы. Если XRPD структура по существу соответствует Фиг. 3, форма образца может быть легко и точно идентифицирована как имеющая ту же самую форму, что и Соединение В - безводная кристаллическая форма.
Спектр Рамана, как станет понятно, включает пик, (выраженный в см-1), составляющий приблизительно значение, определенное здесь, когда Спектр Рамана включает пик в пределах ±4.0 см-1 указанной величины. Далее, также известно и понятно специалисту в области, что применяемая аппаратура, влажность, температура, ориентация кристаллов порошка и другие параметры, включаемые при получении Спектра Рамана, могут вызвать некоторую вариабельность во внешнем виде, интенсивности и положениях пиков в спектре. Спектр Рамана, который "по существу соответствует" спектру, обеспеченному здесь Фиг. 4 или 6, это Спектр Рамана, который, как понятно специалисту области, представляет соединение, обладающее той же самой кристаллической формой, что и соединение, которое обеспечивает Спектр Рамана Фиг. 4 или 6.
Таким образом, Спектр Рамана может быть идентичным спектру на Фиг. 4 или 6, или более вероятно он может несколько отличаться. Такой Спектр Рамана не обязательно может показывать каждый из пиков любого из спектров, представленных здесь, и/или может показывать небольшое изменение во внешнем виде, интенсивности или сдвиге в положении упомянутых пиков, следующих из различий в условиях, имеющих место при получении данных. Специалист отрасли способен определить, имеет ли структура кристаллического соединения ту же самую форму или отличную от формы, раскрытой здесь путем сравнения их Спектров Рамана. Например, специалист в области может сравнить Спектр Рамана образца натриевой соли 4-трет-бутил-N-[-[4-хлор-2-(1-окси-пиридин-4-карбонил)-фенил]-бензолсульфонамида с Фиг. 6 и, используя экспертизу и знания в области, легко определить, соответствует ли в основном Спектр Рамана образца Спектру Рамана Соединения В безводной кристаллической формы. Если Спектр Рамана в основном соответствует Фиг. 6, форма образца может быть легко и точно идентифицирована как имеющая ту же самую форму, что и Соединение В - безводная кристаллическая форма.
"Соединение изобретения" означает натриевую соль 4-трет-бутил-N-[4-хлор-2-(1-окси-пиридин-4-карбонил)-фенил]-бензолсульфонамида, по существу кристаллической формы, определенное здесь как Соединение В - кристаллическая форма или в некоторых воплощениях Соединение В - безводная кристаллическая форма.
Изобретение включает терапевтический способ лечения или улучшения CCR9-обусловленного нарушения в нуждающемся в этом субъекте, включающий введение нуждающемуся субъекту эффективного количества соединения изобретения или композиции, включающей эффективное количество соединения изобретения и дополнительно фармацевтически приемлемый носитель. Изобретение далее включает соединение изобретения для использования в терапии, соединение изобретения для использования в лечении CCR9-обусловленных нарушений и соединение изобретения для использования в лечении воспалительного заболевания кишечника.
Используемая здесь фраза "CCR9-обусловленное нарушение" и связанные фразы относятся к состоянию или заболеванию, характеризующемуся несоответствующей, то есть, меньше чем или больше чем нормальная CCR9 функциональная активность. Несоответствующая функциональная активность CCR9 могла бы возникнуть как результат CCR9 экспрессии в клетках, которые обычно не имеют CCR9 экспрессии, увеличения CCR9 экспрессии (приводящие, например, к воспалительному и иммунорегуляторному нарушению и заболеванию) или уменьшению CCR9 экспрессии. Несоответствующая функциональная активность CCR9 могла бы также возникнуть как результат ТЕСК секреции клетками, которые обычно не имеют ТЕСК секреции, увеличения ТЕСК экспрессии (приводящее, например, к воспалительному и иммунорегуляторному нарушению и заболеванию) или уменьшения ТЕСК экспрессии. CCR9-обусловленное нарушение может быть полностью или частично обусловлено несоответствующей функциональной активностью CCR9.
CCR9-обусловленное нарушение - это то, в котором модуляция CCR9 приводит к некоторому влиянию на основное состояние или заболевание (например, CCR9 антагонист приводит к некоторому улучшению у пациента, по крайней мере, у некоторых пациентов).
Используемая здесь фраза "эффективное количество" означает количество вещества препарата (то есть соединения настоящего изобретения), которое проявляет желательный биологический ответ в субъекте. Такой ответ включает облегчение симптомов заболевания или нарушения, которое лечат. Эффективное количество соединения изобретения в таком терапевтическом способе приблизительно от 0.001 до 100 мг на кг массы тела пациента в сутки, которое можно вводить в единственной или многократных дозах. Предпочтительно, уровень дозировки будет от приблизительно 0.01 до приблизительно 25 мг/кг в сутки; более предпочтительно от приблизительно 0.05 до приблизительно 10 мг/кг в сутки. Подходящий уровень дозировки может составлять от приблизительно 0.01 до 25 мг/кг в сутки, приблизительно 0.05-10 мг/кг в сутки или приблизительно 0.1-5 мг/кг в сутки. В пределах этого диапазона дозировка может быть 0.005-0.05, 0.05-0.5, 0.5-5.0 или 5.0-50 мг/кг в сутки. Для орального введения соединения предпочтительно предоставляют в форме таблеток, содержащих 1.0-1000 миллиграмм активного ингредиента, в частности 1.0, 5.0, 10.0, 15.0, 20.0, 25.0, 50.0, 75.0, 100.0, 150.0, 200.0, 250.0, 300.0, 400.0, 500.0, 600.0, 750.0, 800.0, 900.0 и 1000.0 миллиграмм активного ингредиента для симптоматического регулирования дозировки пациенту, которого лечат. Соединение можно вводить при режиме 1-4 раза в сутки, предпочтительно несколько раз в сутки.
Следует понимать, однако, что определенный уровень дозы и частота дозировки для любого конкретного пациента могут быть различны и будут зависеть от разновидности факторов, включая возраст, массу тела, наследственные особенности, общее здоровье, род, диету, способ и время введения, скорость выделения, комбинации препаратов и характер и серьезность специфического состояния, которое подвергается лечению.
Способы введения включают введение эффективного количества соединения или композиции изобретения в разное время в течение курса терапии или одновременно в комбинированной форме. Способы изобретения включают все известные терапевтические режимы лечения.
Заболевания и состояния, связанные с воспалением, иммунными нарушениями, инфекцией и опухолью, можно лечить или предотвращать настоящим соединением, композициями и способами. В одной группе воплощений заболевания или состояния, включая хронические заболевания людей или других разновидностей, можно лечить ингибитором CCR9 функции. Эти заболевания или состояния включают: (1) аллергические заболевания, такие как системная анафилаксия или ответы гиперчувствительности, аллергии на препараты, аллергии на ужаливание насекомого и пищевые аллергии, (2) воспалительные заболевания кишечника, такие как заболевания Крона, язвенный колит, илеит и энтерит, (3) вагиниты, (4) псориаз и воспалительные дерматозы, такие как дерматит, экземы, атопический дерматит, аллергический контактный дерматит, крапивница и зуд, (5) васкулиты, (6) спондилоартропатии, (7) склеродерма, (8) астма и дыхательные аллергические заболевания, такие как аллергическая астма, аллергический ринит, заболевания гиперчувствительности легких и т.п., (9) аутоиммунные заболевания, такие как фибромиалгия, склеродермы, алкилозные спондилиты, ювенильный РА, заболевание Стилла, полиартрикулярный ювенильный РА, пауциартикулярный ювенильный РА, полимиалгия ревматическая, ревматический артрит, псориатический артрит, остеоартрит, полисуставной артрит, рассеянный склероз, системная красная волчанка, диабет типа I, диабет типа II, гломерулонефрит и т.п., (10) отторжение трансплантата (включая отторжение аллотрансплантата), (11) заболевание трансплантат-против-хозяина (включая и острое, и хроническое), (12) другие заболевания, в которых нежелательные воспалительные ответы должны замедляться, такие как атеросклероз, миозиты, нейродегенеративные заболевания (например, Заболевание Альцгеймера), энцефалит, менингит, гепатит, нефрит, сепсис, саркоидоз, аллергический конъюнктивит, отит, хроническое обсруктивное легочное заболевание, синусит, синдром Бехсета и подагра, (13) легочный фиброз и другие фиброзные заболевания и (14) синдром раздраженного кишечника.
Предпочтительно настоящие способы направлены на лечение заболеваний или состояний, выбранных из воспалительного заболевания кишечника, включая заболевание Крона и язвенный колит; аллергических заболеваний, таких как псориаз, атопический дерматит и астма; и аутоиммунных заболеваний, таких как ревматоидный артрит.
Более предпочтительно настоящие способы направлены на лечение воспалительного заболевания кишечника, включая заболевание Крона и язвенный колит.
Соединение и композиции настоящего изобретения могут быть объединены с другими соединениями и композициями, назначение которых - предотвращение и лечение интересующих состояния или заболевания, таких как воспалительные состояния и заболевания, включая воспалительное заболевание кишечника, аллергические заболевания, псориаз, атопический дерматит и астму, и патологии, отмеченные выше. Выбор соответствующих агентов для использования в комбинированных терапиях может быть сделан специалистом. Комбинация терапевтических агентов может действовать синергетически на эффект терапии или предотвращение различных нарушений. Используя этот подход, можно достигнуть терапевтическую эффективность с более низкими дозировками каждого агента, таким образом уменьшая возможность неблагоприятных побочных эффектов.
Весовое соотношение соединения настоящего изобретения со вторым активным ингредиентом может быть различно и будет зависеть от эффективной дозы каждого ингредиента. В целом, будет использоваться эффективная доза каждого.
Таким образом, например, когда соединение настоящего изобретения объединяется с NSAID, весовое соотношение соединения настоящего изобретения к NSAID будет вообще составлять от приблизительно 1000:1 до приблизительно 1:1000, предпочтительно от около 200:1 до приблизительно 1:200. Комбинации соединения настоящего изобретения и других активных ингредиентов, в целом, также будут в пределах вышеупомянутого диапазона, но в каждом случае должна использоваться эффективная доза каждого активного ингредиента.
Комбинированная терапия включает совместное введение соединения изобретения и упомянутого другого агента, последовательное введение соединения изобретения и другого агента, введение композиции, содержащей соединение изобретения и другого агента или одновременное введение отдельных композиций, содержащих соединение изобретения и другого агента.
Изобретение далее включает использование соединения изобретения в качестве активного терапевтического вещества, в частности, при лечении CCR9-обусловленных нарушений. В частности, изобретение включает использование соединения изобретения при лечении воспалительного заболевания кишечника, включая заболевание Крона и язвенный колит.
В другом аспекте изобретение включает использование соединений изобретения в производстве лекарства для использования при лечении вышеупомянутых нарушений.
Настоящее изобретение также направлено на фармацевтическую композицию, включающую соединение изобретения и фармацевтически приемлемый носитель.
Настоящее изобретение далее направлено на способ получения фармацевтической композиции, включающей смешивание соединения изобретения и фармацевтически приемлемого носителя.
Как здесь используется, фраза "фармацевтически приемлемый носитель" означает одно или более соединений и/или композиций, которые имеют достаточную чистоту и качество для использования в составе соединения изобретения, которые при введении человеку не производят неблагоприятную реакцию, и они используются как связующее для вещества препарата (то есть соединения настоящего изобретения).
Изобретение далее включает процесс получения композиции, включающий смешивание соединения изобретения и дополнительного фармацевтически приемлемого носителя, и включает такие композиции, которые следуют из такого процесса, который включает обычные фармацевтические технологии.
Например, соединение изобретения может быть измельчено до наноразмеров перед составлением. Соединение изобретения также может быть получено путем размалывания, микронизации или другими способами уменьшения величины частиц, известными в технологии. Такие способы включают, но без ограничения, описанные в патентах US №№4826689, 5145684, 5298262, 5302401, 5336507, 5340564, 5346702, 5352459, 5354560, 5384124, 5429824, 5503723, 5510118, 5518187, 5518738, 5534270, 5536508, 5552160, 5560931, 5560932, 5565188, 5569448, 5571536, 5573783, 5580579, 5585108, 5587143, 5591456, 5622938, 5662883, 5665331, 5718919, 5747001, заявках WO 96/24336 и WO 98/35666, каждые из которых включены здесь в виде ссылки.
Фармацевтические композиции изобретения могут быть получены с использованием технологий и способов, известных специалистам области. Некоторые из способов, обычно используемых в технологии, описаны в Remington's Pharmaceutical Sciences (Mack Publishing Company), все содержание которого включено здесь ссылкой.
Композиции изобретения включают глазные, оральные, назальные, трансдермальные, местные с или без окклюзии, внутривенные (и болюсные, и инфузионные) и инъекционные (интраперитонеально, подкожно, внутримышечно, внутрь опухоли или парентерально). Композиция может быть представлена в единицах дозировки, таких как таблетки, пилюли, капсулы, порошки, гранулы, липосомы, ионнообменные смолы, стерильный глазной раствор или глазное устройство доставки (такое как контактная линза и т.п., облегчающая непосредственное высвобождение, спланированное по времени высвобождение или непрерывное длительное высвобождение), парентеральный раствор или суспензия, дозированный аэрозоль или жидкий спрей, капля, ампула, автоинъекционное устройство или свеча; для введения окулярно, орально, интраназально, сублингвально, парентерально или ректально, или ингаляцией или вдуванием.
Композиции изобретения, подходящие для орального введения, включают твердые формы, такие как пилюли, таблетки, каплеты, капсулы (каждая включает немедленное высвобождение, отложенное во времени высвобождение и продолжительное высвобождение составов), гранулы и порошки.
Оральная композиция предпочтительно сформулирована как гомогенная композиция, в которой вещество препарата (т.е. соединения настоящего изобретения) диспергировано равномерно по смеси, которая может легко подразделяться на единицы дозировки, содержащие равные количества соединения изобретения. Предпочтительно композиции получают путем смешивания соединения изобретения с одним или более произвольно представленных фармацевтических носителей (таких как крахмал, сахар, растворитель, гранулирующий агент, смазка, скользящее вещество, связующее вещество и дезинтегрирующий агент), одного или более произвольно представленных фармацевтически инертных наполнителей (таких как вода, гликоли, масла, спирты, ароматизаторы, консерванты, пигменты и сироп), одного или более произвольно представленных обычных таблетирующих ингредиентов (таких как кукурузный крахмал, лактоза, сахароза, сорбит, тальк, стеариновая кислота, стеарат магния, дикальций фосфат и любая разновидность смол) и дополнительного растворителя (такого как вода).
Связующие вещества включают крахмал, желатин, натуральный сахар (например, глюкозу и бета-лактозу), зерновой подсластитель и естественные и синтетические смолы (например, акацию и трагакант). Дезинтегрирующие агенты включают крахмал, метилцеллюлозу, агар-агар и бентонит.
Соединение изобретения можно также вводить посредством композиции отсроченного высвобождения, в которой композиция включает соединение изобретения и разлагаемый медленного высвобождения носитель (например, полимерный носитель) или фармацевтически приемлемый небиоразлагаемый медленного высвобождения носитель (например, ионнообменный носитель).
Биоразлагаемые и небиоразлагаемые носители отсроченного высвобождения известны в технологии. Биоразлагаемые носители используются, чтобы сформировать частицы или матрицы, которые сохраняют вещество (а) препарата (т.е. соединение настоящего изобретения) и которые медленно разлагаются / растворяются в подходящей окружающей среде (например, водной, кислой, основной и т.п.), чтобы высвободить вещество (а) препарата. Такие частицы разлагаются / растворяются в жидкостях тела, чтобы выпустить вещество (а) препарата (т.е. соединения настоящего изобретения) в них. Частицы предпочтительно являются наночастицами (например, в диапазоне приблизительно 1-500 нм в диаметре, предпочтительно приблизительно 50-200 нм в диаметре и наиболее предпочтительно приблизительно 100 нм в диаметре).
В процессе получения композиции медленного высвобождения носитель медленного высвобождения и соединение изобретения сначала растворяют или диспергируют в органическом растворителе. Получающуюся смесь добавляют в водный раствор, содержащий дополнительный поверхностно-активный агент(ы), чтобы получить эмульсию. Органический растворитель затем испаряют из эмульсии, чтобы обеспечить коллоидную суспензию частиц, содержащую носитель медленного высвобождения и соединение изобретения.
Таблетки и капсулы предоставляют преимущество единиц дозировки оральной формы. Таблетки могут быть засахаренными или покрытыми пленкой с использованием стандартных технологий. Таблетки могут также быть покрыты или иначе составлены, чтобы обеспечить пролонгированный терапевтический эффект контролируемого высвобождения. Форма дозировки может включать внутренний компонент дозировки и внешний компонент дозировки, в котором внешний компонент находится в форме снимающегося защитного покрытия над внутренним компонентом. Эти два компонента могут далее быть отделены слоем, который сопротивляется разложению в желудке (таким как энтеральный слой) и позволяет внутреннему компоненту проходить неповрежденным в двенадцатиперстную кишку, или слоем, который задерживает или поддерживает высвобождение. Разнообразные энтерические и неэнтерические слои или покрывающие материалы (такие как полимерные кислоты, шеллаки, ацетиловый спирт и ацетилцеллюлоза или их комбинации) могут использоваться.
Очевидно, что специалист в технологии без дальнейшей разработки, используя предыдущее описание, может использовать настоящее изобретение в его самой полной степени. Следующие Примеры поэтому в любом случае должны рассматриваться просто как иллюстративные, а никак не ограничивающие объем настоящего изобретения.
ПРИМЕР 1
Получение:
4-трет-бутил-N-[4-хлор-2-(1-окси-пиридин-4-карбонил)-фенил]-бензолсульфонамида (Соединение А),
В колбу с круглым основанием с 3 горловинами на 2000 мл, оборудованную термопарой, теплозащитной оболочкой, холодильником и N2 барботером, загружают 60.0 г 4-трет-бутил-N-[4-хлор-2-(пиридин-4-карбонил)-фенил]-бензолсульфонамида (процедуру получения этого материала см. WO 2004/046092) и 900 мл ацетонитрила. Добавляют 31.9 г трифторуксусной кислоты и реакционную смесь размешивают при температуре окружающей среды до получения раствора.
Затем добавляют 39.5 г водород пероксид мочевины, и реакционную смесь нагревают до 70±5°С в течение 23 часов.
Добавляют 63.8 г трифторуксусной кислоты, и реакционную смесь нагревают до 80±5°С, чтобы получить прозрачный раствор.
Медленно добавляют 900 мл воды при поддержании температуры реакционной смеси 70±5°С во время добавления. Реакционную смесь охлаждают до 20±5°С и перемешивают в течение 30 минут. Твердый осадок отфильтровывают, и отжатый осадок промывают 240 мл раствором ацетонитрил: вода 1:1. Собранное твердое вещество сушат под вакуумом при 40±5°С, чтобы обеспечить 54 г названного соединения как кристаллического твердого (см., WO 2004/046092 в отношении данных 1H ЯМР исследования).
Рентгеновская порошковая дифракционная (XRPD) структура этого материала показана на Фиг. 1 и сумма углов дифракции и d-интервалов приведена в Таблице I. XRPD анализ проведен на PANanalytical X'Pert Pro Дифрактометре, модель PW 3040/60, серийный номер DY2407, с использованием детектора X'Celerator. Полученные условия включали: CuKα радиация (λ=1.54059 Е), напряжение генератора: 45 kV, ток генератора: 40 mA, начальный угол: 2.0° 2θ, конечный угол: 50.0° 2θ, размер шага: 0.0167° 2θ, время на шаг: 40.005 секунды.
Образец получен с использованием техники нулевого фона (фронтального наполнения).
Спектр Рамана названного соединения зарегистрирован на Nicolet NXR 9650 FT-Raman Спектрометре при разрешении 4 см-1 с возбуждением от Nd:YVO4 лазера (λ=1064 нм). Спектр Рамана этого материала показан на Фиг. 4 с главными пиками, наблюдаемыми на 657, 671, 749, 784, 964, 1086, 1110, 1149, 1180, 1229, 1270, 1487, 1594, 1609, и 1676-1.
ПРИМЕР 2
Получение:
Безводная кристаллическая натриевая соль 4-трет-бутил-N-[4-хлор-2-(1-окси-пиридин-4-карбонил)-фенил]-бензолсульфонамид (Соединение В - безводная прозрачная форма).
В реакционный сосуд загружают 300 г 4-трет-бутил-N-[4-хлор-2-(1-окси-пиридин-4-карбонил)-фенил]-бензолсульфонамида, 4,737 мл промышленных метилированных спиртов (IMS) и 302.4 мл воды. 27.245 г гранул гидроокиси натрия добавляют к жидкому раствору при 25°С. Реакционную смесь перемешивают при температуре окружающей среды в течение 50 минут с последующим нагреванием до ~78°С, чтобы растворить все твердые частицы. Прозрачный раствор затем фильтруют, поддерживая температуру выше 55°С во время процесса фильтрации. После фильтрации отфильтрованный раствор повторно нагревают до 75°С и затем охлаждают до 55°С и добавляют затравку 3.0 г Соединения В - безводной кристаллической формы - (полученного в соответствии с аналогичной процедурой меньшего масштаба за исключением затравливания) в виде суспензии в 15 мл IMS при температуре окружающей среды. Суспензию выдерживают при 55°С и затем охлаждают до 45°С. Используют перегонку в вакууме путем нагрева реакторной рубашки до 65°С и не позволяя температуре суспензии превысить 55°С, в реакторе оставляют приблизительно 1500 мл суспензии. Суспензию охлаждают до -10°С, выдерживают при этой температуре в течение ночи, и затем переводят в фильтрационную сушилку и оставляют на 10 минут. Температуру рубашки фильтра предварительно охлаждают до -10°С. Маточные растворы удаляют через прокол с использованием азота под давлением 0.5-1 бар. Кристаллизатор загружают первым предохлажденным промывом 1 200 мл IMS, охлажденным до -10°С. Промыв перемещают в отжатый осадок в фильтре, перемешивают в течение 10 минут, оставляют на 10 минут и удаляют под 0.5-1 бар давления азота. Промывание отжатого осадка фильтра повторяют еще два раза при тех же самых условиях. Температуру рубашки фильтра повышают до 20°С, и отжатый осадок удаляют под 0.5-1 бар давления азота, пока удаляемый растворитель не уменьшился до струйки. Влажный отжатый осадок высушивают при 70°C с перемешиванием под вакуумом, чтобы обеспечить 258.3 г названного соединения в виде желтого кристаллического твердого.
Рентгеновская порошковая дифракционная (XRPD) структура этого материала показана на Фиг. 3, и итог углов дифракции и d-интервалов приведен в Таблице II. XRPD анализ проведен на PANanalytical X'Pert Pro Дифрактометре, модель PW 3040/60, серийный номер DY2407, с использованием детектора X'Celerator.
Полученные условия включали: CuKα радиация (λ=1.54059 Е), напряжение генератора: 45 kV, ток генератора: 40 mA, начальный угол: 2.0° 2θ, конечный угол: 50.0° 2θ, размер шага: 0.0167° 2θ, время на шаг: 40.005 секунд. Образец получен с использованием техники нулевого фона (фронтальное заполнение).

Спектр Рамана названного соединения зарегистрирован на Nicolet NXR 9650 FT-Raman Спектрометре, при 4 см-1 разрешении с возбуждением от Nd:YVO4 лазера (λ=1064 нм). Спектр Рамана этого материала показан на Фиг. 6 с главными пиками, наблюдаемыми на 601, 632, 651, 664, 726, 740, 803, 853, 931, 1080, 1123, 1138, 1162, 1318,1395, 1458, 1526, 1595, 1614 и 1647 см-1.
Термограмма дифференциальной сканирующей калориметрии (DSC) названного соединения зарегистрирована на Приборах ТА Q1000 дифференциальном сканирующем калориметре и показана на Фиг. 8. Образец взвешен в алюминиевой чашке весов, крышка чашки помещена сверху и слегка сдвинута, не герметизируя чашку. Эксперименты проведены с использованием скорости нагревания 15°С/мин. DSC термограмма Соединения В - безводная кристаллическая форма - показывает эндотерм с начальной температурой приблизительно 310°С. Специалист должен понимать, что начальная температура эндотерма может изменяться в зависимости от условий эксперимента.
Термогравиметрический анализ (TGA) термограммы названного соединения проведен на Приборе ТА Q5000 Термогравиметрический анализатор показан на Фиг. 10. Эксперименты проведены с использованием скорости нагревания 15°С/мин. TGA Термограмма Соединения В - безводная кристаллическая форма показывает незначительные потери веса до 300°С.
ПРИМЕР 3
Получение:
Аморфная натриевая соль 4-трет-бутил-N-[4-хлор-2-(1-окси-пиридин-4-карбонил)-фенил]-бензолсульфонамида (Соединение В - аморфная форма)
Безводная кристаллическая натриевая соль 4-трет-бутил-N-[4-хлор-2-(1-окси-пиридин-4-карбонил)-фенил]-бензолсульфонамида (500 мг) помещена в сосуд из нержавеющей стали на 10 мл, содержащий два мелющих шарика 7 мм в диаметре. Образец измельчали при температуре окружающей среды в течение 30 минут на частоте 30 гц, используя Retsch Mill ММ301 прибор.
Рентгеновская порошковая дифракционная (XRPD) структура этого материала показана на Фиг. 2. XRPD анализ проведен на PANanalytical X'Pert Pro Дифрактометре, модель PW 3040/60, серийный номер DY2407 с использованием детектора X'Celerator. Принятые условия включали: CuKα радиация (λ=1.54059 Ε), напряжение генератора: 45 kV, ток генератора: 40 mA, начальный угол: 2.0° 2θ, конечный угол: 50.0° 2θ, размер шага: 0.0167° 2θ, время на шаг: 40.005 секунд. Образец получен с использованием техники нулевого фона (фронтальное заполнение).
Инфракрасный спектр преобразования Фурье (FT-IR) названного соединения показан на Фиг. 5 с главными пиками, наблюдаемыми на 718, 159, 775, 803, 833, 975, 1078, 1102, 1134, 1154, 1172, 1219, 1261, 1283, 1394, 1460, 1608 и 1654 см-1.
Дифференциальная сканирующая калориметрическая (DSC) термограмма названного соединения зарегистрирована на Приборах ТА Q1000 Дифференциальный сканирующий Калориметр и показана на Фиг. 7. Образец взвешен в алюминиевой чаше весов, крышка чашки помещена сверху и слегка отодвинута, не герметизируя кастрюлю. Эксперименты проведены с использованием скорости нагревания 15°С/мин.
Термогравиметрический анализ (TGA) термограммы названного соединения проведен на Приборе ТА Q5000 Термогравиметрический Анализатор и показан на Фиг. 9. Эксперименты проведены с использованием скорости нагревания 15°С/мин.




Изобретение относится к новым кристаллическим формам натриевой соли 4-трет-бутил-N-[4-хлор-2-(1-окси-пиридин-4-карбонил)-фенил]-бензолсульфонамида. Указанные кристаллические формы могут быть использованы при лечении воспалительного заболевания кишечника. 6 н. и 13 з.п. ф-лы, 10 ил., 2 табл., 3 пр.
.
1. Кристаллическая форма натриевой соли 4-трет-бутил-N-[4-хлор-2-(1-окси-пиридин-4-карбонил)-фенил]-бензолсульфонамида, в которой кристаллическая форма характеризуется рентгеновской порошковой дифракционной структурой, включающей, по крайней мере, три угла дифракции при измерении с использованием CuKα радиации, выбранные из группы, состоящей из: приблизительно 4.7, 9.1, 12.0, 14.2, 17.7, 18.1, 19.2, 19.8, 20.1, 21.3, 22.5, 24.3, 27.0, 27.2, 27.7, 28.6, 28.8, 29.0, 30.1, 31.6, 33.5, 33.6 и 37.6 градусов 2θ.
2. Кристаллическая форма по п. 1, в которой кристаллическая форма характеризуется рентгеновской порошковой дифракционной структурой, включающей, по крайней мере, три угла дифракции, выбранные из группы, состоящей из: приблизительно 4.7, 9.1, 12.0, 14.2, 18.1, 19.2, 19.8, 20.1, 21.3, 22.5, 24.3, 27.2, 28.8 и 37.6 градусов 2θ.
3. Кристаллическая форма по п. 1, в которой кристаллическая форма характеризуется рентгеновской порошковой, дифракционной структурой, включающей, по крайней мере, три угла дифракции, выбранные из группы, состоящей из: приблизительно 4.7, 12.0, 14.2, 18.1, 19.2 и 24.3 градуса 2θ.
4. Кристаллическая форма по п. 1, в которой кристаллическая форма характеризуется рентгеновской порошковой дифракционной структурой, включающей углы дифракции, выбранные из группы, состоящей из: приблизительно 4.7, 12.0, 14.2, 18.1, 19.2 и 24.3 градуса 2θ.
5. Кристаллическая форма по любому из пп. 1-4, в которой кристаллическая форма характеризуется рентгеновской порошковой дифракционной структурой в основном в соответствии с Фиг. 3.
6. Кристаллическая форма по п. 1, в которой кристаллическая форма характеризуется Спектром Рамана, включающим, по крайней мере, три пика в положениях, выбранных из группы, состоящей из: приблизительно 601, 632, 651, 664, 726, 740, 803, 853, 931, 1080, 1123, 1138, 1162, 1318, 1395, 1458, 1526, 1595, 1614 и 1647 см-1.
7. Кристаллическая форма по п. 1, в которой кристаллическая форма характеризуется Спектром Рамана, включающим, по крайней мере, три пика в положениях, выбранных из группы, состоящей из: приблизительно 664, 740, 803, 853, 1080, 1123, 1162, 1318, 1458, 1526, 1595, 1614 и 1647 см-1.
8. Кристаллическая форма по п. 1, в которой кристаллическая форма характеризуется Спектром Рамана, включающим, по крайней мере, три пика в положениях, выбранных из группы, состоящей из: приблизительно 664, 1162, 1458, 1614 и 1647 см-1.
9. Кристаллическая форма по п. 1, в которой кристаллическая форма характеризуется Спектром Рамана, включающим пики в положениях, выбранных из группы, состоящей из: приблизительно 664, 740, 803, 853, 1080, 1123, 1162, 1318, 1458, 1526, 1595, 1614 и 1647 см-1.
10. Кристаллическая форма по одному из пп. 1-4 или 6-9, в которой кристаллическая форма характеризуется Спектром Рамана в основном в соответствии с Фиг. 6.
11. Способ получения фармацевтической композиции для использования в лечении воспалительного заболевания кишечника, включающий смешивание кристаллической формы по одному из пп. 1-4 или 6-9 и фармацевтически приемлемого носителя.
12. Фармацевтическая композиция для использования в лечении воспалительного заболевания кишечника, включающая кристаллическую форму по одному из пп. 1-4 или 6-9 и фармацевтически приемлемый носитель.
13. Композиция по п. 12, в котором композиция адаптирована для орального введения.
14. Композиция по п. 12, в которой композиция находится в форме таблетки или капсулы.
15. Применение кристаллической формы по одному из пп. 1-4 или 6-9 в производстве агентов для лечения воспалительного заболевания кишечника или для лечения CCR-9-обусловленного нарушения.
16. Применение по п. 15, в котором воспалительное заболевание кишечника выбрано из заболевания Крона или язвенного колита.
17. Кристаллическая форма по одному из пп. 1-4 или 6-9 для использования в лечении воспалительного заболевания кишечника
18. Способ лечения воспалительного заболевания кишечника у субъекта, нуждающегося в этом, включающий введение субъекту кристаллической формы по одному из пп. 1-4 или 6-9.
19. Способ по п. 18, в котором воспалительное заболевание кишечника - это заболевание Крона или язвенный колит.
| WO 2005113513,A2,01.12.2005 | |||
| Способ парообразования в котлах непрерывной циркуляцией | 1928 |
|
SU15710A1 |
Авторы
Даты
2017-01-10—Публикация
2012-07-20—Подача