Изобретение относится к области органической химии, в частности к способу получения производных хинолина, а именно 2,2,4-триметил-1,2-дигидрохинолина.
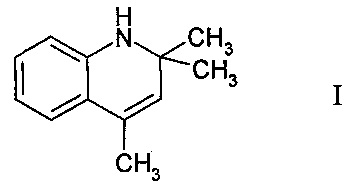
Дигидрохинолиновый фрагмент присутствует во многих природных соединениях, большинство из которых обладают биологической активностью [1. Balayer A., Sévenet Т., Schaller Н., Hamid A., Hadi A., Chiaroni A., Riche С. & Païs М. Dihydroquinoline-type Alkaloids from Bhesa Paniculata, Celastraceae // Natural Product Lellers. - 1993. - V. - 2(1). - P. 61-67; 2. Abe F.; Yamauchi, Т.; Shibuya, H.; Kitagawa, I.; Yamashita. Indole Alkaloids from the Leaves of Alstonia villosa in Sunbawa // M. Chem. Pharm. Bull. - 1998. - 46. - P. 1235-1238]. Например, 2,2,4 замещенные 1,2-дигидрохинолины были использованы как сильнодействующие вещества, обладающие антибактериальным, антидиабетическим и противовоспалительным действием [3. Jay V. Johnson, Barbara S. Rauckman, David P. Baccanari, and Barbara Roth. 2,4-Diamino-5-benzylpyrimidines and Analogues as Antibacterial Agents, 1,2-Dihydroquinolylmethyl Analogues with High Activity and Specificity for Bacterial Dihydrofolate Reductase // Med. Chem. - 1989. - 32. - P. 1942-1949; 4. Пат. JP №042823701992; 5. Dillard R.D., Pravey D.E., Benslay D.N. Synthesis and anti-inflammatory activity of some 2,2-dimethyl-1,2-dihydroquinolines // J. Med. Chem. - 1973. - V. 16. - P. 251-253; 6. Maria-Elena Theoclitou* and Leslie A. Robinson. Novel facile synthesis of 2,2,4 substituted 1,2-dihydroquinolines via a modified Skraup reaction // Tetrahedron Letters. - 2002. - 43. - P. 3907-3910].
Производные дигидрохинолинов могут быть использованы в качестве ингибиторов перекисного окисления липидов [7. Пат. США №5411969], HMG-CoA-редуктазы [8. Пат. США №5688808], ингибитора транспортера желчной кислоты [9. Пат. WO №0134570 А1], агонистов и антагонистов прогестерона [10. Пат.WO №9619458; 11. Пат. WO №9941256].
Полимер 2,2,4-триметил-1,2-дигидрохинолина [12. Y. Liu, Q. Gao, L. Liu and S. Li. Investigated on the Rubber Antioxidant 2,2,4-Trimethyl-1,2-dihydroquinoline Polymer // Asian Journal of Chemistry. - 2013. - V. 25. - No. 6. - P. 2956-2958] используют в качестве антиоксиданта при производстве резины.
Дигидрохинолины могут быть синтезированы циклизацией Скраупа, которая заключается во взаимодействии анилина и карбонильного соединения в присутствии йода (или брома) при 145°С в течение 2-3 дней [13. Vaughan, W.R. 2,4-Dimethylquinoline // Org. Synth. - 1955. - 3. - P. 329-334; 14. Пат. JP №55,040,661; 15. Lugovik B.A., Yudin L.G., Kost A.N., Technology of the reaction of acetone with aniline // Zh. Prikl. Khim. - 1965. - 38. - P. 216].
Ряд работ посвящены упрощению этого метода [16. Durgadas S., Chatare V.K., Mukkanti K., Pal S. Ceric Ammonium Nitrate: An Efficient Catalyst for One-Pot Synthesis of 2,2,4-Trimethyl-1,2-dihydroquinolines // Letters in Organic Chemistry. - 2010. - V. 7. - P. 306-310; 17. Kundu D., Kundu S.K., Majee A., Hajra A. A Facile Synthesis of 2,2,4-Trisubstituted-1,2-dihydroquinolines Catalyzed by Zinc Triflate under Solvent-free Conditions // J. Chin. Chem. Soc. - 2008. - V. 55. - P. 1186-1190; 18. Kiss A., Potor A., Hell Z. Heterogeneous Catalytic Solvent-free Synthesis of Quinoline. Derivatives via the Friedlander Reaction // Catal Lett. - 2008. - 125. - P. 250-253; 19. A. Hegedüs, Z. Hell, T. Vargadi, A. Potor and I. Gresitsb. A new synthesis of 1,2-dihydroquinolines via cyclocondensation using zeolite catalyst // Catalysis Letters. - 2007.- V. 117, - 3-4].
В работах [12; 20. Liu Yu, Gao qinyu, Liu Lianxin, and Shi guangxia. Study on the Industrial Process of Rubber Anti-oxidant RD // Journal of the Korean Chemical Society. - 201. - V. 55. - No. 5] исследован механизм реакции анилина с ацетоном с образованием 2,2,4-триметил-1,2-дигидрохинолина и его последующей полимеризацией. В синтезе дигидрохинолина и его олигомеров предлагается использовать в качестве катализатора BF3⋅O(C2H5)2 [12], AlBr3 или HCl [20]. Реакция экзотермична, поэтому необходимо контролировать, чтобы температура не превышала 50°С.
Механизм реакции в присутствии BF3⋅О(С2Н5)2 можно представить в виде следующей схемы:
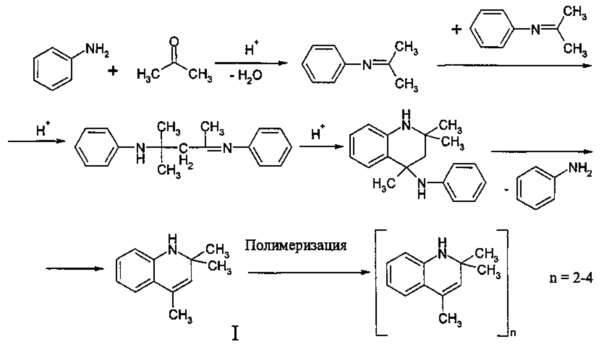
В присутствии HCl анилин с ацетоном реагируют согласно схеме:

Недостатки:
1. Многостадийность;
2. Коррозионная среда;
3. Образование сточных вод;
4. Эфират трехфтористого бора ядовит;
5. Образование фторсодержащих отходов.
Кроме того, в качестве катализатора синтеза дигидрохинолина взаимодействием анилина с ацетоном можно использовать п-аминобензолсульфокислоту [15], бензолсульфоновую кислоту [21. Пат. JP №56,014,516; 22. Пат. GB №764,957], п-толуолсульфокислоту [23. R.W. Layer, Synthesis of 1,3,5-trialkylbenzenes from anils of methyl alkyl ketones // J. Org. Chem. - 1981. - 46. - P. 4552-4555; 24. Пат. JP №57,011,968]. При этом образуются ди-, три- и тетрамеры 2,2,4-триметил-1,2-дигидрохинолина.
Недостатки:
1. Сложное отделение катализатора от реакционной массы;
2. Невозможность повторного использования катализатора;
3. Необходимо удалять образующуюся воду.
Предложен способ синтеза дигидрохинолина под действием кремневольфрамовой кислоты (H4[SiW12O40]) [25. R. Kamakshi, B.S.R. Reddy. Synthesis of 2,2,4-dihydroquinolines using heteropolyacid as a catalyst. // Catalysis Communications. - 2007. - 8. P. 825-828]. Синтез осуществляют взаимодействием ароматических аминов с кетонами при мольном соотношении реагентов 1:2,7 (моль), температуре кипения растворителя (ацетон, ацетонитрил, дихлорметан, хлороформ или толуол) в течение 4-10 ч, концентрации катализатора - 2 моль %. Затем реакционную смесь охлаждают, упаривают растворитель. Концентрированную реакционную смесь разбавляют с помощью хлороформа и промывают водой (3*20 мл). Органический слой отделяют и сушат над безводным сульфатом натрия. Затем его концентрируют и очищают с помощью колоночной хроматографии. Выход 1,2-дигидрохинолинов составляет 77-94%. Наиболее высокие выходы получены при использовании ацетонитрила в качестве растворителя.
Недостатки:
1. Использование нескольких растворителей в больших объемах;
2. Многостадийность способа;
3. Образование сточных вод;
4. Невозможность использования катализатора повторно.
В работе [6] авторы предлагают синтезировать 2,2,4-триметил-1,2-дигидрохинолин в присутствии трифлата скандия Sc(OTf)3 (0,05 ммоль) в среде растворителя CH3CN при комнатной температуре в течение 2-6 ч под действием микроволнового излучения. Реакционную смесь экстрагируют диметилсульфоксидом. При вовлечении в реакцию анилина и ацетона в мольном соотношении 1:600, выход 2,2,4-триметил-1,2-дигидрохинолина составляет 65%. В случае использования замещенных анилинов выход дигидрохинолинов составляет 78-98%.
Недостатки:
1. Высокая стоимость катализатора на основе Sc;
2. Реакция протекает в среде растворителя, применяемого в большом количестве;
3. Многостадийность способа.
Реакцию анилина с ацетоном можно осуществить в присутствии Zn(OTf)3 в количестве 5-10 мол. % [17] при комнатной температуре, без растворителя в течение 22 ч. Выход дигидрохинолина составляет 70-80%. Повышение температуры реакции до 70% позволяет сократить время реакции вдвое. Реакционную массу экстрагируют диэтиловым эфиром.
Недостатки:
1. Сложность удаления катализатора из реакционной массы;
2. Необходимость удаления растворителя после экстракции;
3. Многостадийность.
Авторами [26. Satoshi Kamiguchi, Ikuko Takahashi, Hideki Kurokawa, Hiroshi Miura, Teiji Chihara. Vapor-phase synthesis of 1,2-dihydro-2,2,4-trimethylquinolines from anilines and acetone over group 5-7 metal halide clusters as catalysts // Applied Catalysis A. - 2006. - 309. - P. 70-75] предложен способ получения 2,2,4-триметил-1,2-дигидрохинолина взаимодействием анилина (скорость подачи 0,091 мл/ч) с ацетоном (0,147 мл/ч) под действием кластеров на основе галидов ниобия. Синтез проводят в реакторе с неподвижным слоем катализатора (30 мг), в токе водорода, при 300°С в течение 1 ч. Самым активным оказался [(Nb6Cl12)Cl2(Н2О)4]⋅4H2O, на котором селективность образования дигидрохинолина составила 71,7%. В качестве побочного соединения образуется N-изопропилиденанилин (16%) при конверсии анилина 34%.
Недостатки:
1. Использование сложных, дорогих и малодоступных каталитических систем;
2. Низкая активность катализатора.
В качестве катализатора синтеза дигидрохинолинов используют полиэдральные олигомерные силсесквиоксаны (ПОСС) [27. Ganapati D. Yadav, Rahul P. Kumbhar, Saumydeep Helder. A Facile Solvent-Free Skraup Cyclization Reaction for Synthesis of 2,2,4-trimethyl-1,2-dihydroquinoline // I.RE.CH.E. - 2012. - V. 4. - N.6], представляющие собой класс трехмерных органо-неорганических гибридов с общей формулой (RSiO1,5)n, где R=Н, алкил-, арил-, галоген; n - целое число ≥4. Реакцию проводят при 140-170°С в автоклаве, мольное соотношение анилин : ацетон = 1:3-9, количество катализатора - 0,01-0,03 г/см3. Конверсия анилина достигает 94%. Выход целевых продуктов авторами не указан.
Недостатки:
1. Синтез катализатора является сложным и многостадийным.
С начала XXI века активно проводятся работы по использованию цеолитов в качестве катализаторов газофазной конденсации карбонильных соединений с анилином [28. Aguilar J., Corma A., Melo F.V. and Sastre E. Alkylation of biphenyl with propylene using acid catalysts // Catal. Today. - 2000. - V. 55. - P. 225; 29. Jin D.F., Hou Z.Y., Zhang L.W., Zheng X.M., Selective synthesis of para-para-dimethyldiphenylmethane over H-Beta zeolite // Catal. Today. - 2008. - V. 131. - P. 378-384; 30. Пат. США №5,700,942].
Авторами [19] предложен способ получения 2,2,4-триметил-1,2-дигидрохинолина реакцией анилина с ацетоном в среде растворителя - толуола под действием катализатора Е4а (250% катализатора в расчете на анилин) в течение 6 ч. Катализатор Е4а получен на основе природного цеолита клиноптилонита (состав в пересчете на оксиды: SiO2 - 73.0%, Al2O3 - 11.2%, Fe2O3 1.17%, K2O - 5.12%, Na2O - 0.38%, CaO - 2.20%, MgO - 0.44%) путем ионного обмена катионов Ca, Mg, K на ионы аммония и последующей прокалки с целью получения декатионированной формы цеолита. Катионы Fe и Al в процессе ионного обмена практически не удаляются. Условия реакции: 110°С, массовое содержание катализатора в расчете на анилин составляет 250%, мольное соотношение анилин : ацетон : толуол равно 1:5:45. Реакцию проводят в стеклянном обогреваемом реакторе с мешалкой, обратным холодильником и термометром. В присутствии катализатора Е4а выход 2,2,4-триметил-1,2-дигидрохинолина составляет 96%.
К недостаткам этого способа можно отнести:
1. Использование катализатора в больших количествах (250% катализатора в расчете на анилин), что значительно ухудшает показатели эффективности способа.
2. Большое количество растворителя (мольное соотношение анилин : толуол = 1:45) приводит к увеличению объемов используемого оборудования и создает проблемы при отделении и регенерации растворителя.
3. Катализатор приготовлен на основе природного цеолита. Последние, как правило, отличаются нестабильностью минералогического и химического состава, пористой структуры, показателей прочности, термостабильности, способности к ионному обмену и др. важных характеристик. Природные цеолиты, кроме основного минерала, содержат еще сопутствующие, такие как песок, глина, кварц. Состав и количество катионов металлов, присутствующих в них, могут существенно отличаться.
Задачей настоящего изобретения является разработка более эффективного способа синтеза 2,2,4-триметил-1,2-дигидрохинолина под действием цеолитных катализаторов.
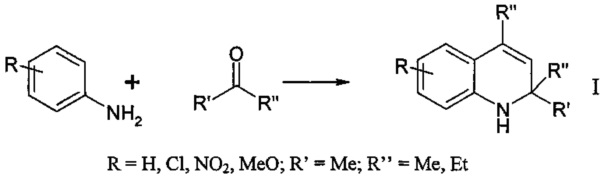
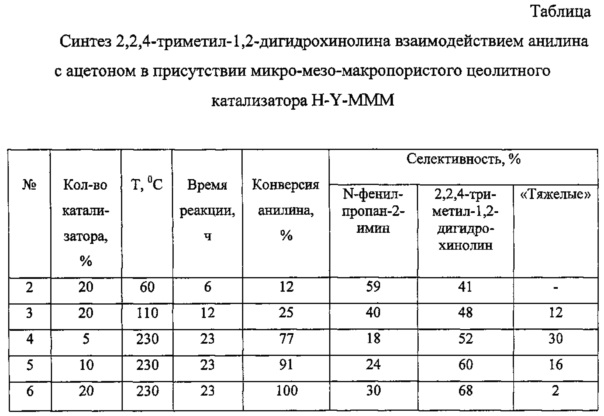
Указанная цель достигается тем, что способ получения 2,2,4-триметил-1,2-дигидрохинолина путем конденсации анилина с ацетоном осуществляют согласно изобретению в присутствии гранулированного без связующих веществ цеолитного катализатора H-Y-MMM, обладающего микро-мезо-макропористой структурой при температуре 60-230°С, концентрации катализатора 5-20% и времени реакции 6-23 ч. Мольное соотношение анилин : ацетон составляет 1:5.
Образование 2,2,4-триметил-1,2-дигидрохинолина из анилина и ацетона можно представить в виде схемы [31. Liu Y., Gao Q., Liu L. and Li S. Investigated on the Rubber Antioxidant 2,2,4-Trimethyl-1,2-dihydroquinoline Polymer // Asian Journal of Chemistry. - 2013. - V. 25. - No. 6. - P. 2956-2958]:

Цеолит Y-MMM синтезирован в виде гранул без связующих веществ [32. Патент РФ №2412903]. Его гранулы представляют собой единые сростки цеолитных кристаллов и обладают близкой к 100% степенью кристалличности. Пористая структура гранул состоит из микропористой структуры самого цеолита и мезо-макропористой структуры, сформировавшейся между сростками кристаллов. Применение микро-мезопористых цеолитов в синтезе хинолинов неизвестно.
Сравнительный анализ заявляемого решения с прототипом показывает, что заявляемый способ отличается от прототипа тем, что в процессе синтеза 2,2,4-триметил-1,2-дигидрохинолина реакцией анилина с ацетоном в качестве катализатора используют гранулированный без связующих веществ цеолитный катализатор H-Y-MMM. Синтез осуществляют при 60-230°С. Конверсия анилина достигает 100%, селективность образования 2,2,4-триметил-1,2-дигидрохинолина составляет 60-68%. Побочным продуктом реакции является N-фенилпропан-2-имин [N-(1-метилиден)анилин], который является ценным химическим соединением.
Известно, что имины - важные промежуточные вещества в синтезе биологически активных N-содержащих соединений, таких как β-лактамы, красители, душистые вещества, фармацевтические препараты, фунгициды и сельскохозяйственные химикаты [33. Martin S.F. Recent applications of imines as key intermediates in the synthesis of alkaloids and novel nitrogen heterocycles // Pure Appl. Chem. - 2009. - V. 81. - No. 2. - P. 195-204].
Использование предлагаемого способа позволяет:
1. Осуществлять реакцию анилина с ацетоном при значительно более низкой концентрации катализатора (5-20%);
2. Не использовать растворители;
3. Применение синтетического цеолитного катализатора, имеющего стабильный химический и фазовый состав, физико-химические характеристики, позволит получать стабильные и воспроизводимые результаты, в том числе высокую конверсию анилина и достаточно высокий выход 2,2,4-триметил-1,2-дигидрохинолина;
4. В процессе образуется ценное химическое соединение - N-фенилпропан-2-имин, выход которого можно регулировать, изменяя условия реакции.
Предлагаемый способ осуществляют следующим образом.
В ампулу загружали анилин, ацетон и 5-20% цеолитного катализатора H-Y-MMM (в расчете на смесь анилин : ацетон, взятых в мольном соотношении 1:2). Запаянную ампулу помещали в автоклав, который герметично закрывали и нагревали до заданной температуры в течение необходимого времени. После окончания реакции автоклав охлаждали до комнатной температуры, ампулу вскрывали. Реакционную массу отфильтровывали от катализатора.
Продукты реакции анализировали с помощью газо-жидкостной хроматографии на хроматографе с пламенно-ионизационным детектором (стальная насадочная колонка длиной 3 м, фаза 15% полиэтиленгликоля на хроматоне HMDS, температура анализа 50-180°С с программированным нагревом 8°С/мин, температура детектора 200°С, температура испарителя 200°С, газ-носитель - гелий - 30 мл/мин).
Масс-спектры получены на хромато-масс-спектрометре SHIMADZU GCMS-QP2010Plus (фаза SPB-5, капиллярная колонка 30 м × 0.25 мм, газ-носитель - гелий, температура программирования от 40 до 300°С со скоростью 8°С/мин, температура испарения 280°С, температура ионного источника 200°С, энергия ионизации 70 эВ).
Идентификацию продуктов осуществляли сравнением хромато-масс-спектров и хроматографического поведения выделенных и эталонных соединений хинолина и его производных. Спектральные характеристики 2,2,4-триметил-1,2-дигидрохинолина соответствуют литературным данным, приведенным в [19].
Предлагаемый способ иллюстрируется следующими примерами.
ПРИМЕР 1.
В ампулу загружали 0,2 г (0,002 моль) анилина, 0,58 г (0,01 моль) ацетона и 0,06 г цеолитного катализатора H-Y-MMM (15% мас. в расчете на смесь анилин : ацетон, взятые в мольном соотношении 1:2). Запаянную ампулу помещали в автоклав, который нагревали при 230°С в течение 23 ч. После окончания реакции автоклав охлаждали до комнатной температуры, ампулу вскрывали. Реакционную массу отфильтровывали от катализатора и анализировали с помощью газо-жидкостной хроматографии. Конверсия анилина составляла 97%, селективность образования 2,2,4-триметил-1,2-дигидрохинолина - 66%.
ПРИМЕРЫ 2-6. Аналогично примеру 1. Условия и результаты примеров представлены в таблице.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 2,2,4-триалкил-2,3-дигидро-1Н-1,5-бензодиазепинов | 2019 |
|
RU2702358C1 |
| Способ получения 2,2,4-триалкил-2,3-дигидро-1Н-1,5-бензодиазепинов | 2019 |
|
RU2702359C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-ЭТИЛ-3,5-ДИМЕТИЛПИРИДИНА | 2016 |
|
RU2644164C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-МЕТИЛ-2-ЭТИЛХИНОЛИНА | 2023 |
|
RU2803740C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-МЕТИЛ-2-ЭТИЛ-N-ФЕНИЛ-1,2,3,4-ТЕТРАГИДРОХИНОЛИН-4-АМИНА | 2023 |
|
RU2808560C1 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ N-ПРОПИЛАНИЛИНА И 2-ЭТИЛ-3-МЕТИЛХИНОЛИНА | 2022 |
|
RU2797946C1 |
| Способ получения хинолинов в присутствии иерархического цеолита H-ZSM-5mmm | 2021 |
|
RU2789409C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПИРИДИНА И МЕТИЛПИРИДИНОВ | 2013 |
|
RU2555843C1 |
| Способ получения хинолинов | 2022 |
|
RU2786740C1 |
| Способ получения хинолинов в присутствии иерархического цеолита H-Ymmm | 2021 |
|
RU2789408C1 |
Изобретение относится к способу получения 2,2,4-триметил-1,2-дигидрохинолина путем конденсации анилина с ацетоном в присутствии гетерогенного катализатора, отличающийся тем, что в качестве катализатора используют микро-мезо-макропористый цеолит H-Y-MMM и реакцию проводят при температуре 60-230°С, концентрации катализатора 5-20% и времени реакции 6-23 ч. Технический результат: разработан новый способ получения 2,2,4-триметил-1,2-дигидрохинолина, который широко применяется для получения высокоэффективных лекарственных препаратов, комплексонов, сорбентов, циановых красителей, находит широкое применение в синтезе фунгицидов, пестицидов, алкалоидов и др. 1 табл., 6 пр.
Способ получения 2,2,4-триметил-1,2-дигидрохинолина путем конденсации анилина с ацетоном в присутствии гетерогенного катализатора, отличающийся тем, что в качестве катализатора используют микро-мезо-макропористый цеолит H-Y-MMM и реакцию проводят при температуре 60-230°С, концентрации катализатора 5-20% и времени реакции 6-23 ч.
| Hegedues, Adrienn и др.: "A new, simple synthesis of 1,2-dihydroquinolines via cyclocondensation using zeolite catalyst", Catalysis Letters, 117(3-4), стр.99-101, 2007 | |||
| Ручная граната | 1927 |
|
SU18157A1 |
Авторы
Даты
2017-01-30—Публикация
2015-07-29—Подача