Предлагаемое изобретение относится к области органической химии, в частности, к способу получения 1,5-бензодиазепинов общей формулы:
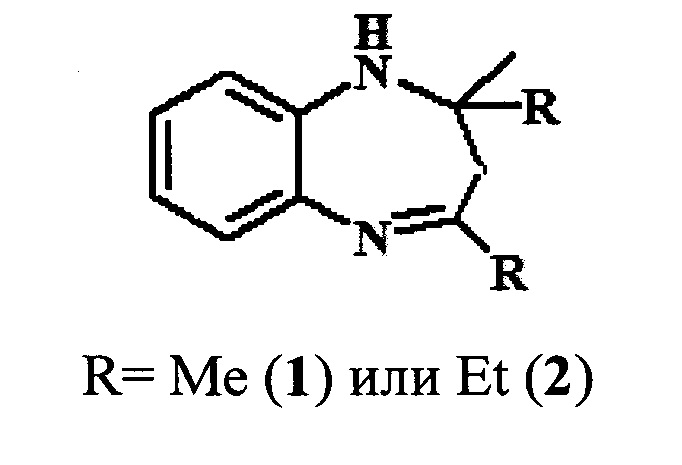
Производные 1,5-бензодиазепина (БДА) относятся к классу важных азотсодержащих гетероциклов с широким спектром биологической активности. Они нашли применение в качестве психотропных [Aastha Р, Navneet K, Anushu A, Pratima S, Dharma K. 1,5-Benzodiazepines: Overview of properties and synthetic aspects. Res J Chem Sci. 2013; 3:90-103], противосудорожных [Salve PS, Mali DS. 1,5-benzodiazepine: A versatile pharmacophore. Int J Pharma Bio Sci. 2013; 43(11):345-370], противоэпилептических [Bariwal JB, Upadhyay KD, Manvar AT, Trivedi JC, Singh JS, Jain KS et al. Eur J Med Chem. 2008; 43(11):2279-2290], противораковых [Chen Y, Le V, Xu X, Shao X, Liu J, Li Z. Bioorg Med Chem Lett 2014; 24(16):3948-3951], противовирусных [Ilango SS, Remya PU, Ponnuswamy S.. Indian J Chem. 2013; 52B:136-140], противогрибковых, антибактериальных [Kumaraswamy MN, Vaidya VP, Chandrashekhar C, Parthima-Mathias DA, Shivakumar H, Mahadevan KM. International Journal of pharmaceutical, chemical and biological Sciences. 2013; 3(2):281-287], обезболивающих, противовоспалительных, жаропонижающих и противоязвенных средств [Nikas Р, Gatta Е, Cupello A, Di Braccio М, Grossi G, Pellistri F et al. Neuroscience. 2013; 243:158-164]. Кроме того, производные 1H-1,5-бензодиазепинов используются в качестве красителей для акриловых волокон [Harris, R.С; Straley, J.М. U.S. Pat. 1,537,757, 1968].
Одним из основных методов синтеза производных БДА является конденсация 1,2-фенилендиамина с α,β-ненасыщенными карбонильными соединениями, кетонами, β-галокетонами. Реакция катализируется различными гомогенными катализаторами, например BF3⋅OEt2 [Herbert, J.A.L.; Suschitzky, H. J Chem. Soc, Perkin Trans 1 1974, 2657], NaBH4 [Morales, H.R.; Bulbarela, A.; Contreras, R. Heterocycles 1986, 24, 135], Ga(OTf)3 [Pan, X.-Q.; Zou, J.-P.; Hauang, Z.-H.; Zhang, W. Tetrahedron Lett 2008, 49, 5302], L-пролином [Sivamurugan, V.; Deepa, K.; Palanichamy, M.; Muragesan, V. Synth Commun. 2004, 34, 3833], молекулярным йодом [Chen, W.Y.; Lu, J. Synlett.2005, 1337], уксусной кислотой в условиях микроволнового излучения [Minothora, P.; Julia, S.S.; Constantinos, А. Т. Tetrahedron Lett 2002, 43, 1755], ионных жидкостей [Jarikote, D. V.; Siddiqui, S. A.; Rajagopal, R.; Thomas, D.; Lahotiands, R. J.; Srinivasan, K.V. Tetrahedron Lett. 2003, 44, 1835]. Многие из этих способов характеризуются длительным временем реакции, образованием побочных продуктов, жесткими условиями реакции, низким выходом и многостадийной процедурой отделения катализатора и выделения продукта.
Для разработки новых эффективных способов синтеза бензодиазепинов более перспективно использовать гетерогенные катализаторы.
Один из примеров гетерогенно-каталитического осуществления циклоконденсации 1,2-фенилендиамина с карбонильными соединениями описан в [Raquel G. Jacob, Catia' S. Radatz, Mariele B. Rodrigues, Diego Alves, Gelson Perin,1 Eder J. Lenardao, and Lucielli Savegnago//Heteroatom Chem. V. 22, N 2, p. 180-185, 2011]. Авторы синтезировали производные БДА реакцией 1,2-фенилендиамина с алкил-, арил- и циклическими кетонами в присутствии катализатора SiO2/ZnCl2 (схема 1), без растворителя при комнатной температуре или при микроволновом облучении (мощность облучения - 200 Вт) и 50°С. Мольное соотношение кетон : фенилендиамин = 2,5:1, количество катализатора - 30%. Выход бензодиазепинов составлял 79-95%.
Схема 1
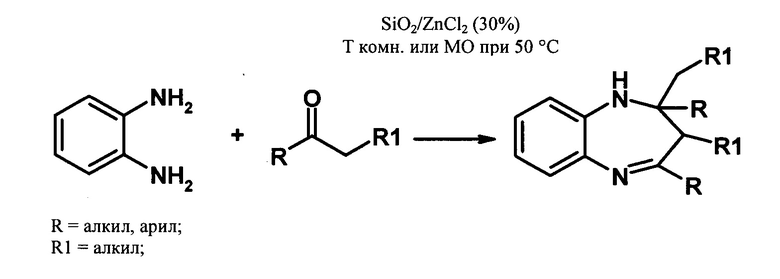
К основным недостаткам данного метода можно отнести использование специального оборудования для микроволнового облучения и большой избыток катализатора.
В работе [ Hell, Z., & Potor, A. A simple environmentally-friendly method for the selective synthesis of 1,5-benzodiazepine derivatives using zeolite catalyst. Catalysis Letters, 2005, V. 105. N 3-4, 229-232.] 1,5-бензодиазепин 1 получали реакцией фенилендиамина с ацетоном в присутствии природного алюмосиликата Е4а с выходом до 97%. Алюмосиликат Е4а представляет собой обработанный кислотой природный цеолит Е4 с узкими порами. Реакцию проводили при кипении реакционной массы в растворе этанола или ксилола в течение 2-6 ч. Катализатор использовали в большом количестве (380% в расчете на о-фенилендиамин), что значительно ухудшает показатели эффективности способа. Кроме того, природные алюмосиликаты отличаются нестабильностью минералогического и химического состава, пористой структуры, показателей прочности, термостойкости и др. важных характеристик. Природные цеолиты, кроме основного минерала, содержат еще сопутствующие материалы, такие, как песок, глина, кварц. Состав и количество катионов металлов, присутствующих в них, могут существенно отличаться.
Hell, Z., & Potor, A. A simple environmentally-friendly method for the selective synthesis of 1,5-benzodiazepine derivatives using zeolite catalyst. Catalysis Letters, 2005, V. 105. N 3-4, 229-232.] 1,5-бензодиазепин 1 получали реакцией фенилендиамина с ацетоном в присутствии природного алюмосиликата Е4а с выходом до 97%. Алюмосиликат Е4а представляет собой обработанный кислотой природный цеолит Е4 с узкими порами. Реакцию проводили при кипении реакционной массы в растворе этанола или ксилола в течение 2-6 ч. Катализатор использовали в большом количестве (380% в расчете на о-фенилендиамин), что значительно ухудшает показатели эффективности способа. Кроме того, природные алюмосиликаты отличаются нестабильностью минералогического и химического состава, пористой структуры, показателей прочности, термостойкости и др. важных характеристик. Природные цеолиты, кроме основного минерала, содержат еще сопутствующие материалы, такие, как песок, глина, кварц. Состав и количество катионов металлов, присутствующих в них, могут существенно отличаться.
Циклоконденсация о-фенилендиамина и ацетона в присутствии природного цеолита TNZ описана в [Maulidan Firdaus, Meyta Dyah Prameswari. Synthesis of 2,2,4-Trimethyl-2,3-dihydro-1H-1,5-benzodiazepine using Treated Natural Zeolite Catalyst // Bulletin of Chemical Reaction Engineering & Catalysis. 2019. 14 (1), p. 9-16]. Цеолит предварительно обрабатывали раствором соляной кислоты при 50°С в течение 1 ч с последующим выдерживанием в растворе хлорида аммония в течение 5 дней. Количество катализатора в опытах изменяли от 15% до 60% мас, мольное соотношение фенилендиамин : ацетон составляло 1;4, температура реакции 50°С. Бензодиазепин 1 получали с выходом 73%.
Недостатками данного метода являются недостаточно высокий выход бензодиазепина, сложная многостадийная обработка катализатора, нестабильность состава природных цеолитов.
Предложен способ [Sheikh Abdul Majid, Waheed Ahmad Khanday, and Radha Tomar / Journal of Biomedicine and Biotechnology. 2012. Volume 2012, P. 1-5] синтеза бензодиазепинов реакцией о-фенилендиамина и циклических или ациклических кетонов в присутствии цеолита Н-МСМ-22. Реакцию проводили при комнатной температуре в растворе ацетонитрила в течение 1-3 ч. Выход 1.5-бензодиазепина 1, образующегося при взаимодействии о-фенилендиамина с ацетоном - 30-88%. Максимальные выходы получены при использовании катализатора в количестве 80% мас. в расчете на реакционную массу.
Недостатками данного метода являются недостаточно высокий выход бензодиазепина, большой избыток катализатора.
В работе [K. Sucheta, В. Vittal Rao. Microwave induced solvent-free synthesis of substituted 1,5-benzodiazepine derivates. // Indian J. of Chem. 2005. Vol. 44B, p, 2152-2154] описано применение мезопористого катализатора для синтеза 1.5-бензодиазепинов. Авторы синтезировали бензодиазепины взаимодействием о-фенилендиамина с производными хинолинонов в присутствии мезопористого материала МСМ-41 как под действием микроволнового излучения, так и без него. В первом случае использовали порошкообразную смесь мезопористого материала МСМ-41 с силикагелем, время реакции составляло 5-10 мин. Выход продуктов реакции достигает 90-98%. Во втором случае реакцию осуществляли в растворе этанола при кипении в течение 8 ч. Выход бензодиазепинов составляет 50-63%.
К недостаткам способа можно отнести высокую стоимость мезопористого материала МСМ-41, при синтезе которого используют большие количества дорогих темплатов.
Авторами [Mahmood Tajbakhsh, Majid М. Heravi, Bagher Mohajerani, Amir N. Ahmadi/ Journal of Molecular Catalysis A: Chemical. 2006 V. 247. N1-2. P. 213-215] разработан метод циклоконденсации о-фенилендиамина и ацетона с образованием БДА 1 в присутствии природного цеолита гейландита HEU (Si/Al=5) и синтетических цеолитов H-ZSM-5 (Si/Al=28) и H-Y (Si/Al=2,5). Мольное соотношение реагентов - фенилендиамин : кетон = 1:4, реакцию проводили в течение 3-7 ч при кипячении при 50-55°С. Выход БДА 1 на цеолите HEU составляет 81%, на цеолите H-Y- 82%, на цеолите Н-ZSM-5 - 52%. При взаимодействии о-фенилендиамина с 2-бутаноном получали БДА 2 с выходом 79% (цеолит H-Y) и 77% (цеолит HEU).
К недостаткам данного метода можно отнести небольшой выход целевого продукта.
Авторы [Mariappan Jeganathan and Kasi Pitchumani. Solvent-Free Syntheses of 1,5-Benzodiazepines Using HY Zeolite as a Green Solid Acid Catalyst. ACS Sustainable Chem. Eng., 2014, 2 (5), pp 1169-1176] синтезировали 1.5-бензодиазепины реакцией фенилендиамина и его производных с кетонами в присутствии цеолита H-Y при 50-75°С в течение 4-10 ч без растворителя с выходами 75-93%). Показано, что выход 1.5-бензодиазепинов в значительной степени зависит от количества катализатора, температуры и времени реакции. Максимальные выходы 1.5-бензодиазепинов получены при 50°С и выше (75°С), количестве катализатора 100-200 мг и времени реакции 4-10 ч. Указанное количество катализатора (100-200 мг) в расчете на смесь исходных соединений (фенилендиамина и ацетона в мольном соотношении 1:2) составляет 50-100 мас. %.
Недостатками данного метода является большое количество используемого катализатора, что затрудняет перемешивание реакционной массы, осложняет отделение катализатора, приводит к потерям продукта.
Задачей настоящего изобретения является разработка более простого селективного гетерогенно-каталитического способа синтеза 2,2,4-триалкил-2,3-дигидро-1H-1,5-бензодиазепинов 1,2.
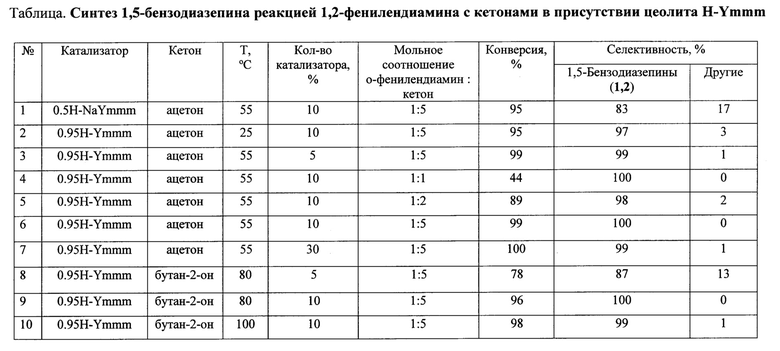
Решение этой задачи достигается тем, что синтез 2,2,4-триалкил-2,3-дигидро-1H-1,5-бензодиазепинов (1,2) осуществляют реакцией о-фенилендиамина с кетонами (например, ацетоном или бутан-2-оном) в присутствии гранулированного цеолита Y в Н-форме (H-Ymmm) высокой степени кристалличности, имеющего иерархическую (микро-мезо-макропористую) структуру.
Степень декатионирования (обмена катионов Na+ на Н+) цеолита Н-Ymmm составляет 50-95%. Реакцию проводят в присутствии 5-30% мае. катализатора H-Ymmm при 25-100°С в растворе метанола в течение 5 ч при мольном соотношении о-фенилендиамин : кетон = 1:1-5.
Конверсия о-фенилендиамина составляет 44-100%). Основным продуктом реакции являются 1,5-бензодиазепины 1,2, образующиеся с селективностью 83-100%) (схема 2).
Схема 2
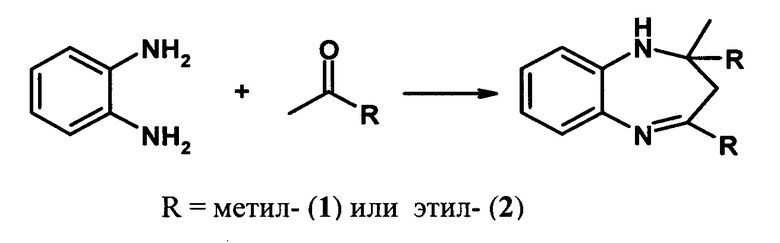
Применение цеолита H-Ymmm в реакциях синтеза производных бензодиазепина из 1,2-фенилендиамина и кетонов неизвестно.
Цеолит H-Ymmm синтезирован в виде гранул без связующих веществ; его гранулы представляют собой единые сростки цеолитных кристаллов и обладают степенью кристалличности, близкой к 100%. Пористая структура гранул состоит из микропористой структуры самого цеолита Y и мезопористой структуры, сформировавшейся между сростками кристаллов. Существенным преимуществом цеолита H-Ymmm перед высокодисперсными цеолитами является то, что он синтезируется в гранулах. Гранулированный катализатор обладает лучшими физическими свойствами: не пылит, не слеживается, легко рассеивается и легко отделяется от реакционной массы фильтрованием (в отличие от высокодисперсного, который быстро забивает фильтр или проходит через полотно фильтра).
Обычно гранулированные цеолиты синтезируют следующим образом: смешивают высокодисперсный цеолит со связующим материалом, а затем полученную смесь формуют в гранулы. Введение связующего материала в состав гранул снижает адсорбционную емкость и каталитическую активность цеолитов по сравнению с высокодисперсными цеолитами, а в ряде случаев не удается обеспечить механическую прочность получаемых таким образом гранулированных материалов. Гранулы катализатора H-Ymmm на 100% состоят из цеолита Y, в них отсутствует связующее вещество.
Кроме того, известно, что при глубоком декатионировании микропористых цеолитов Y (до степени ионного обмена катионов Na+ на Н+ выше 90-95%о) происходит их частичная аморфизация и степень кристалличности уменьшается. Цеолит H-Ymmm имеет комбинированную микро-мезопористую кристаллическую структуру, которая высокостабильна и не разрушается в процессе декатионирования.
Использование предлагаемого способа имеет следующие преимущества перед известными:
1. Катализатор цеолит H-Ymmm используется в виде гранул, в то время как в известных способах используют высокодисперсный (порошкообразный) цеолит H-Y.
2. Применение гранулированного катализатора гораздо технологичнее, чем высоко дисперсного.
3. Иерархическая пористая структура цеолита H-Ymmm позволяет преодолеть характерные для микропористых цеолитных катализаторов диффузионные ограничения и создает более благоприятные возможности для синтеза объемных молекул 1,5-бензодиазепинов.
4. Катализатор H-Ymmm позволяет эффективно, с высокой конверсией фенилендиамина селективно синтезировать 1,5-бензодиазепины.
Предлагаемый способ синтеза 1,5-бензодиазепинов 1,2 осуществляют следующим образом.
Используют о-фенилендиамин и карбонильные соединения: ацетон, бутан-2-он.
В качестве катализатора используют гранулированный без связующих веществ цеолит H-Ymmm, синтезированный в Na-форме по методу, приведенному в [O.S. Travkina, M.R. Agliullin, N.A. Filippova, A.N. Khazipova, I.G. Danilova, N.G. Grigor'eva, N. Narender, M.L. Pavlov, B.I. Kutepov // RSC Advances. 7 (2017) 32581-32590. M.Л. Павлов, О.С.Травкина, А.Н. Хазипова, Р.А. Басимова, Н.Н. Шавалеева, Б.И. Кутепов. // Нефтехимия, 2015, т. 55, №5, С. 406. Патент РФ №2540086. Павлов М.Л., Травкина О.С., Кутепов Б.И. Басимова Р.А., Эрштейн А.С., Шавалеева Н.Н. Бюл. №3, 2015. Патент РФ №2553876. Шавалеев Д.А., Павлов М.Л., Кутепов Б.И., Травкина О.С., Шавалеева Н.Н., Басимова Р.А., Эрштейн А.С. Бюл. №17, 2015]. Путем ионного обмена из раствора NH4NO3 цеолит Na-Ymmm переводят в NH4-форму; последующей прокалкой при 540°С в течение 4 ч полученные образцы переводят в Н-форму с различной степенью ионного обмена - 0,5H-Na-Ymmm, 0,95H-Ymmm (цифры перед обозначением цеолита показывают степень обмена ионов Na+ на H+). В процессе ионного обмена с промежуточными термообработками аморфизации кристаллического каркаса цеолита не происходит. Удельная поверхность образцов, определяемая методом ртутной порометрии, составляет 12.1 м2/г, а объемы микро-, мезо- и макропор составляют 0.27; 0.15 и 0.15 см3/г, соответственно. Транспортные поры, в основном, представлены порами с радиусом 50-100 нм и 100-1000 нм.
Синтез 1,5-бензодиазепинов проводят в металлическом автоклаве. В автоклав загружают 1,2-фенилендиамин, кетон (ацетон, бутан-2-он), катализатор и растворитель, герметично закрывают и помещают в термостатируемый шкаф, где автоклав непрерывно вращается при выбранной температуре. По окончании реакции реакционную массу охлаждают, отфильтровывают от нее катализатор. Состав продукта анализируют методом высокоэффективной жидкостной хроматографии. Условия ВЭЖХ-анализа: хроматограф Shimadzu LC-20AT, пламенно-ионизационный детектор, Колонка-Agilent С18 (4,6*250 мм), элюент - СН3CN:Н2О/80:20, скорость подачи элюента - 1 мл/мин.
Идентификацию продуктов реакции осуществляли с помощью 1D и 2D методик ЯМР 1Н и 13С спектроскопии, их брутто-состав подтверждали регистрацией пика молекулярного иона в ГХ-МС спектре.
Изобретение иллюстрируется следующим примером:
Пример 1. В автоклав загружают 0.1 мг (0,93 ммоль) 1,2-фенилендиамина, затем 0,35 мл (4,8 ммоль) ацетона, 1 мл метанола и 0,04 г (10% маc. в расчете на исходную смесь) цеолитного катализатора 0,95Н-Ymmm, автоклав герметично закрывают и помещают в термостатируемый шкаф. Реакцию проводят при температуре 55°С, 5 ч при непрерывном вращении автоклава. После окончания реакции реакционную массу охлаждают до комнатной температуры, отфильтровывают катализатор и хроматографируют на колонке (SiO2, элюент гексан → смесь гексан-этилацетат). Конверсия 1,2-фенилендиамина 99%, селективность образования 1,5-бензодиазепина 1 100%.
Пример 2. В автоклав загружают 0,1 мг (0,93 ммоль) 1,2-фенилендиамина, затем 0,4 мл (4,5 ммоль) бутан-2-она, 1 мл метанола и 0,04 г (10% маc. в расчете на исходную смесь) цеолитного катализатора 0,95Н-Ymmm, автоклав герметично закрывают и помещают в термостатируемый шкаф. Реакцию проводят при температуре 80°С, 5 ч при непрерывном вращении автоклава. После окончания реакции реакционную массу охлаждают до комнатной температуры, отфильтровывают катализатор и хроматографируют на колонке (SiO2, элюент гексан → смесь гексан-этилацетат). Конверсия 1,2-фенилендиамина 96%, селективность образования 1,5-бензодиазепина 2 100%.
Другие примеры осуществления способа приведены в таблице.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 2,2,4-триалкил-2,3-дигидро-1Н-1,5-бензодиазепинов | 2019 |
|
RU2702359C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛХИНОЛИНОВ | 2018 |
|
RU2688228C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛХИНОЛИНОВ | 2018 |
|
RU2690535C1 |
| Способ получения 2,3-диалкил-N-фенил-1,2,3,4-тетрагидрохинолин-4-аминов | 2018 |
|
RU2697876C1 |
| Способ получения хинолинов реакцией Скраупа в присутствии иерархического цеолита Н-Ymmm | 2019 |
|
RU2738603C1 |
| Способ получения 2,4,6-триметилпиридина в присутствии иерархического цеолитного катализатора H-Ymmm | 2020 |
|
RU2767452C2 |
| Способ получения 2,4,6-триметилпиридина в присутствии иерархического цеолитного катализатора H-Ymmm | 2020 |
|
RU2759567C1 |
| Способ получения олигомеров пентена | 2022 |
|
RU2783661C1 |
| Способ получения олигомеров изопентенов | 2022 |
|
RU2783680C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2, 2, 4-ТРИМЕТИЛ-1, 2-ДИГИДРОХИНОЛИНА | 2015 |
|
RU2609028C1 |
Изобретение относится области органической химии, а именно к способу получения 1,5-бензодиазепинов, указанной ниже формулы, в которой R=Me или Et, путем каталитической гетероциклизации 1,2-фенилендиамина с кетонами (ацетон, бутан-2-он), характеризующемуся тем, что в качестве катализатора используют гранулированный цеолит Y в Н-форме (H-Ymmm) высокой степени кристалличности, имеющий иерархическую (микро-мезо-макропористую) структуру в количестве 5-30% мас. по отношению к исходной смеси реагентов и реакцию проводят при 20-100°С в течение 5 ч в растворе метанола, мольное соотношение 1,2-фенилендиамин : кетон = 1:1-5. Технический результат: разработан новый способ получения 1,5-бензодиазепинов, позволяющий упростить синтез производных и снизить энерго- и материалоемкость процесса гетероциклизации. 2 з.п. ф-лы, 1 табл., 2 пр.
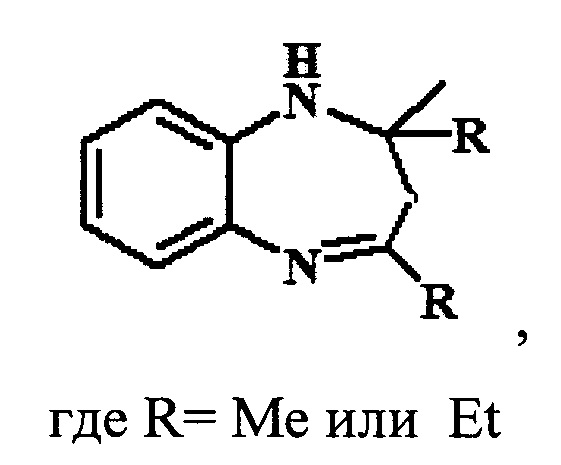
1. Способ получения 2,2,4-триалкил-2,3-дигидро-1H-1,5-бензодиазепинов общей формулы
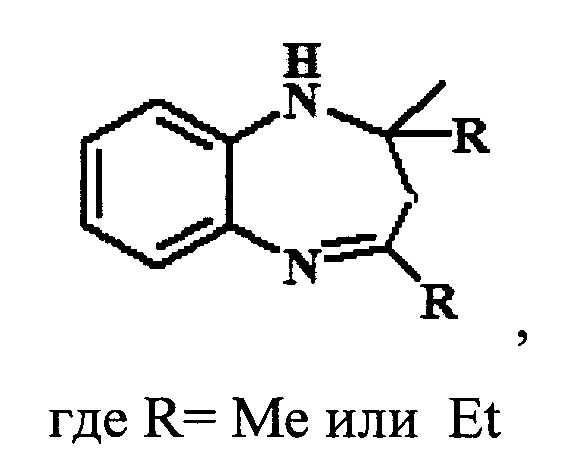
взаимодействием о-фенилендиамина с кетонами в присутствии катализатора на основе цеолита Y, отличающийся тем, что в качестве катализатора используют гранулированный цеолит Y в Н-форме (H-Ymmm) высокой степени кристалличности, имеющий иерархическую (микро-мезо-макропористую) структуру в количестве 5-30% маc. по отношению к исходной смеси реагентов и реакцию проводят в автоклаве при 25-100°С, мольном соотношении 1,2-фенилендиамин : кетон = 1:1-5 в течение 5 ч в растворе метанола.
2. Способ по п. 1, в котором в качестве кетона используют ацетон или бутан-2-он.
3. Способ по п. 1, в котором степень ионного обмена катионов Na+ на Н+ в цеолите H-Ymmm составляет от 0,5 до 0,95.
| US 2015376224 A1, 31.12.2015 | |||
| US 2014073633 A1, 13.03.2014 | |||
| ПРОИЗВОДНЫЕ БЕНЗОДИАЗЕПИНА И ЛЕКАРСТВЕННОЕ СРЕДСТВО, ИХ СОДЕРЖАЩЕЕ | 2000 |
|
RU2259360C2 |
Авторы
Даты
2019-10-08—Публикация
2019-06-04—Подача