Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения композиции иммуноглобулинов с вирусной безопасностью, и к препаратам антител и фармацевтическим композициям, которые можно получать с применением этого способа.
Предпосылки создания изобретения
Композиции иммуноглобулинов, полученные из плазмы человека и пригодные для внутривенного введения, известны в данной области и в течение нескольких десятилетий играют важную роль в лечении широкого ряда заболеваний. Иммуноглобулины применяют, например, для лечения инфекций у человека, и их можно отнести к различным классам с различными биохимическими и физиологическими свойствами. Иммуноглобулин G участвует в защите против вирусных антигенов, в то время как IgM является преимущественно активным в иммунных ответах против бактерий и токсинов.
Растворы иммуноглобулинов содержат IgG, IgA и IgM в разных процентных соотношениях, где различные препараты имеют различные применения в лечении, например, препараты с более высоким процентным содержанием IgM применяют для профилактики или лечения бактериальных инфекций. В отличие от препаратов IgG антитела IgM легко агрегируют в растворе. Препараты IgM сложно стабилизировать, особенно если их обогащают в сравнении с концентрациями в плазме и сохраняют в жидком растворе.
Растворы иммуноглобулинов обычно получают из фракций плазмы или сыворотки крови, например, фракций Коэна. Затем эти фракции подвергают ряду стадий очистки для удаления загрязнений, таких как вирусы, денатурированные белки, протеазы и липиды. Плазму человека для фракционирования собирают от тысяч доноров, и она может содержать патогенные вирусы, несмотря на тестирование источника плазмы. Таким образом, стадии способа инактивации или удаления вирусов являются необходимыми для получения безопасных продуктов для применения в медицине. В данной области известно несколько способов инактивации/удаления вирусов, например, химическая обработка, облучение УФС-светом или фильтрация через нанометровые фильтры, которые осуществляют для обеспечения полной вирусной безопасности. Однако такие стадии могут оказывать негативное влияние на активность иммуноглобулинов; например, увеличенные периоды времени облучения УФС могут снижать выход нативного и активного IgM, полученного в конечном растворе иммуноглобулина.
Способность стадий способа удалять или инактивировать вирус подтверждают с применением моделей способа получения в лабораторном масштабе, и для каждой стадии определяют степень удаления или инактивации. Увеличение степени инактивации/удаления добавляет фармацевтическому продукту дополнительную вирусную безопасность. Современные руководства регулирующих органов требуют, по меньшей мере, двух эффективных стадий для оболочечных и безоболочечных вирусов в производстве происходящих из плазмы лекарственных средств.
В дополнение к вирусам, которые потенциально присутствуют, является также необходимым удаление других загрязнений, подобно липидам, протеазам, агрегатам белка и денатурированным иммуноглобулинам, для поучения продукта с хорошей переносимостью. Денатурированные иммуноглобулины особенно представляют потенциальный риск для пациентов, поскольку они обладают высокой способностью неспецифически активировать комплемент, приводя к тяжелым побочным эффектам у пациентов, которым вводят эти денатурированные иммуноглобулины. Эту антикомплементарную активность (ACA) измеряют посредством стандартизированного теста, описанного в Европейской фармакопее.
Удаление всех этих загрязнений является необходимым для того, (1) чтобы продукт являлся переносимым пациентом после внутривенного введения, (2) чтобы обеспечить соответствие продукта инструкциям по биологической безопасности, относящимся к загрязнению вирусами, (3) чтобы дать возможность продукту оставаться стабильным во время долгосрочного хранения и (4) чтобы получить желаемую смесь соединений/фармацевтическую композицию.
Начальную очистку растворов IgM человека проводят классическими способами фракционирования плазмы Коэна или их хорошо известными модификациями (например, Коэна/Онкли, Кистлера/Нитшманна). С применением способа осаждения холодным этанолом фракцию IgM выделяют во фракции III или фракции I/III (также называемые B или B+I). Описаны способы очистки растворов белка, обогащенных IgM, начиная с фракции III или I/III. В EP0013901 описан способ очистки, начиная с фракции III, включающий стадии с применением обработки октановой кислотой, β-пропиолактоном и стадию адсорбции с применением анионообменной смолы. Этот способ применяют для получения Pentaglobin® (пентаглобин®)- до настоящего времени единственного коммерчески доступного внутривенного продукта IgM. В EP0352500 описано получение концентрата IgM для внутривенного введения с уменьшенной антикомплементарной активностью при использовании анионообменной хроматографии, β-пропиолактона, облучения УФС-светом и стадии инкубации при повышенной температуре (40°C-60°C). Поскольку β-пропиолактон является очень реакционноспособным веществом, вызывающим химическую модификацию белков, существует также значительная потеря противовирусной и антибактериальной активности иммуноглобулинов. Препарат, полученный таким способом, являлся стабильным в жидком растворе в течение ограниченного времени из-за химической модификации. Концентрация IgM составляла более 50% общего содержания иммуноглобулинов.
Получение растворов белка, обогащенных IgM без химической модификации β-пропиолактоном, описано в EP0413187 (Biotest) и EP0413188 (Biotest). Эти способы включают подвергание подходящего раствора белка обработке октановой кислотой и анионообменной хроматографии, начиная с фракции Коэна III или II/III. В патенте EP0413187 (Biotest) обработку октановой кислотой проводят путем перемешивания в течение 15 мин для удаления липидов, присутствующих во фракции Коэна III.
Поскольку большие количества иммуноглобулинов внутривенно вводят пациентам, необходимо получение переносимого фармацевтического препарата. Препараты IgM описаны как трудно получаемые для внутривенного введения. IgM по природе является сильным активатором комплемента после связывания антигенов. Таким образом, неспецифическая антикомплементарная активность денатурированных молекул IgM является намного более опасной для пациентов, чем у денатурированных молекул IgG. Препарат по EP0413187 обладал низкой антикомплементарной активностью, от 0,6 до 0,8 CH50/мг белка, но нуждался в стабилизации и инактивации вируса β-пропиолактоном. Считается, что низкая антикомплементарная активность составляет ≤1 CH50/мг белка согласно монографии EP для иммуноглобулинов.
В EP0413188B1 (Biotest) описано получение обогащенного IgM препарата для внутривенного введения при использовании анионообменной хроматографии для снижения антикомплементарной активности. Кроме того, описана термическая обработка при pH 4-4,5 при 40-60°C, предпочтительно, от 50 до 54°C, для снижения антикомплементарной активности. Этот препарат необходимо было лиофилизировать для обеспечения стабильности препарата в течение нескольких месяцев. Не смогли показать долгосрочной стабильности в форме жидкого раствора.
По другому способу описано применение мягкой термической обработки препаратов IgM при 40-62°C, предпочтительно, 45-55°C, при pH 4,0-5,0 (EP 0450412, Miles) для уменьшения неспецифической активации комплемента. В этой патентной заявке октановую кислоту добавляют к суспензии фракции Коэна III для удаления активатора прекалликреина и липопротеинов центрифугированием. Тем не менее, эта мягкая термическая обработка приводит к частичной потере антигенных детерминант IgM. Это может увеличивать риск образования неоантигенов, приводя к увеличенной иммуногенности для человека или потере активности.
Получение содержащего IgM раствора белка для внутривенного введения с использованием обработки протеазой (например, пепсином) после стадии осаждения октановой кислотой описано в EP0835880 (US 6136312, ZLB). Обработка протеазой приводит к частичной фрагментации молекулы иммуноглобулина, уменьшающей полную функциональную активность частей Fab и Fc. Таким образом, обработанные протеазой иммуноглобулины нельзя рассматривать как немодифицированные. Этот способ получения приводит также приблизительно к 5% фрагментов с молекулярной массой <100 кДа.
Описанные способы проведения обработки октановой кислотой (EP0413187 и EP0835880) обладают таким недостатком, при котором обработка октановой кислотой не является эффективной в отношении удаления и инактивации безоболочечных вирусов, и по существу не удаляет всю протеолитическую активность.
В EP 0345543 (Bayer, Miles) описан высококонцентрированный препарат IgM, по меньшей мере, с 33% IgM для терапевтического применения, где препарат является по существу свободным от титров изоагглютинина. В этой патентной заявке осаждение октановой кислотой проводят путем добавления октановой кислоты, и изоагглютинины удаляют аффинной хроматографией на Synsorb. Конечный препарат необходимо лиофилизировать.
В целом, получение содержащего IgM препарата с низкой антикомплементарной активностью является возможным, если иммуноглобулины химически или ферментативно модифицируют и/или дополнительно очищают хроматографией и/или подвергают мягкой термической обработке.
Тем не менее, способами предшествующего уровня техники, приводящими к препарату немодифицированного иммуноглобулина, невозможно достигать возможности инактивации вирусов для всех потенциально присутствующих вирусов. Хотя несколько способов, таких как обработка растворителем/детергентом, обработка октановой кислотой, фильтрация через нанометровые фильтры и термическая обработка, являются эффективными для инактивации или удаления оболочечных вирусов, существует только немного способов для инактивации или удаления безоболочечных вирусов, например, парвовирусов. Эти безоболочечные вирусы по большей части являются чрезвычайно малыми, обычно проходя через нанометровые фильтры с размерами пор более 20 нм. Этот размер пор является слишком малым для молекул IgM, имеющих диаметр вплоть до 30 нм. Безоболочечные вирусы эффективно инактивируют химическими веществами, подобными β-пропиолактону, которые, однако, также приводят к модифицированному иммуноглобулину с нарушенными функциями. Другой эффективной обработкой является облучение УФС (EP 1842561, CAF-DCF). Однако известные обработки растворителем/детергентом, обработка октановой кислотой и слабая термическая обработка не оказывают существенного эффекта на безоболочечные вирусы.
Таким образом, все препараты, содержащие химически немодифицированные IgM, которые получены способами предшествующего уровня техники, и которые обладают низкой антикомплементарной активностью, не являются безопасными для применения человеку по отношению к безоболочечным вирусам, например, парвовирусам.
Таким образом, способы предшествующего уровня техники, которыми выделяют содержащие IgM препараты с переносимостью при внутривенном введении, обладают определенными недостатками, такими как неспособность эффективно инактивировать или удалять безоболочечные вирусы, и ограниченная способность удалять протеолитическую активность при сохранении в то же время IgM в растворе с высоким выходом. (Протеолитическая активность относится к сумме протеаз, присутствующих в препарате). Поскольку жидкий препарат белка должен поддаваться хранению в течение длительных периодов времени (например, 2 года), остаточную активность протеаз необходимо исключать, поскольку эта активность может приводить к деградации фармацевтического препарата.
Таким образом, цель настоящего изобретения направлена на эти недостатки.
Краткое описание сущности изобретения
В первом аспекте настоящее изобретение относится к способу получения композиции иммуноглобулинов IgM из фракции плазмы, содержащей иммуноглобулины, включающему:
(a) обеспечение фракции плазмы в виде раствора, содержащего иммуноглобулины;
(b) смешивание C7-C9 карбоновой кислоты с раствором и обработку смешанного раствора вибросмесителем для осаждения загрязняющих белков; и
(c) отделение осажденных белков от раствора для получения содержащей IgM композиции иммуноглобулинов.
Авторы настоящего изобретения неожиданно обнаружили, что применение вибросмесителя на стадии, когда раствор иммуноглобулина смешивают с карбоновой кислотой, обладает необычайными преимуществами. Эта стадия способа обеспечивает более эффективное удаление нежелательных белков (включая протеазы) и образует промежуточный продукт, лучше подходящий для стадий дальнейшей переработки, используемых для получения иммуноглобулинового лекарственного средства; промежуточный продукт дает возможность стадиям дальнейшей переработки быть более эффективными. В частности, содержащую иммуноглобулин IgM композицию, полученную на стадии (c), можно комбинировать с дополнительными стадиями обработки, такими как обработка в слабокислых условиях и обработка облучением УФС, для получения содержащего IgM иммуноглобулинового продукта или препарата антитела, который является пригодным для внутривенного введения и который обладает следующими преимущественными свойствами: (i) является химически немодифицированным; (ii) обладает вирусной безопасностью, (iii) обладает низкой протеолитической активностью (и таким образом является стабильным в ходе долгосрочного хранения); (iv) обладает низкой антикомплементарной активностью; и (v) сохраняет высокий уровень нативного и активного IgM. Уровень вирусной безопасности, достигаемый способами, описанными в данном описании, ранее не мог быть получен. Кроме того, с применением способа по настоящему изобретению получают содержащий IgM иммуноглобулиновый продукт или препарат антитела с комбинацией этих свойств, которая ранее не могла быть получена.
В частности, стадии способа по настоящему изобретению приводят к более высокой инактивации и удалению вирусных частиц, особенно очень устойчивых, безоболочечных вирусов, таких как парвовирусы, которые обычно являются не очень чувствительными к обработке октановой кислотой. Более того, достигают улучшенного удаления протеолитической активности по сравнению с общепринятым перемешиванием. Этих свойств достигают, сохраняя в то же время высокий уровень IgM, который является химически немодифицированным. Эти открытия противоречат общепринятой точке зрения, что обработка октановой кислотой не является эффективной стадией против безоболочечных вирусов, и улучшенной вирусной безопасности необходимо достигать посредством инактивации вируса более жесткими способами, такими как обработка β-пропиолактоном. Также было хорошо известно, что, например, повышение концентрации октановой кислоты для полного удаления протеолитической активности приводит к массовой потере IgM.
Результатов по настоящему изобретению достигают путем использования смешивающих устройств с применением режима вибрации в сочетании с обработкой октановой кислотой. Это является особенно неожиданным, поскольку известно, что IgM является очень чувствительным к напряжению сдвига, которое может приводить к нежелательной высокой антикомплементарной активности. Соответственно, невозможно было предусмотреть использования вибросмесителя для получения композиции IgM и невозможно было ожидать настолько благоприятного вклада применения вибросмешивания в ходе получения содержащего IgM раствора.
Более того, способом по настоящему изобретению, разделение, осуществляемое на стадии (c), такой как осветление фильтрацией обработанного октановой кислотой раствора, полученного на стадии (b), улучшается при использовании вибросмесителя. Разделения достигают более просто, с уменьшением времени обработки и производственной себестоимости, и стадия (c) приводит к прозрачному раствору, что создает преимущества для дальнейшей переработки. Общепринятые растворы, получаемые фильтрацией продуктов обработанных октановой кислотой содержащих IgM растворов, подвергнутых перемешиванию, являются опалесцирующими или мутными.
Содержащую IgM композицию, полученную на стадии (c), предпочтительно подвергают обработке в слабокислых условиях (например, pH 4) и стадии облучения УФС для дополнительного улучшения вирусной безопасности и стабилизации конечного продукта. Благодаря улучшенному осветлению содержащей IgM композиции иммуноглобулинов, полученной на стадии (c), становится возможным уменьшить необходимое время облучения УФС для достижения вирусной инактивации безоболочечных вирусов более 3 или 4 log10. Это приводит к более высокому выходу нативного и активного IgM в ходе обработки УФС.
Неожиданно, эти стадии приводят к содержащему химически и ферментативно немодифицированный IgM раствору, обладающему более высокими выходами нативного и активного IgM, обладающему низкой антикомплементарной активностью и низкой протеолитической активностью, и обладающему высокой антибактериальной и противовирусной активностью, выдающейся вирусной безопасностью по отношению к оболочечным и безоболочечным вирусам; ключевой характеристикой для лекарственных средств, предназначенных для внутривенного введения. Более того, обработанный содержащий IgM раствор обладает улучшенной долгосрочной стабильностью, являясь очень стабильным в жидком растворе в течение более 12 месяцев при 2-8°C.
Соответственно, в следующем аспекте настоящее изобретение относится к препарату антитела, получаемому с применением способа по настоящему изобретению, указанного выше, и к препарату антитела, содержащему IgM и обладающему протеолитической активностью менее 8 Ед./л. В частности, препарат антитела является пригодным для внутривенного введения человеку и содержит IgG, IgA и IgM, где, по меньшей мере, 5% от общего количества иммуноглобулинов составляют IgM.
Кроме того, настоящее изобретение относится к препарату антитела по настоящему изобретению для применения в медицине. В одном варианте осуществления препарат антитела предназначен для применения в лечении иммунологических нарушений и бактериальных инфекций.
Следующий аспект настоящего изобретения относится к способу лечения, включающему введение препарата антитела по настоящему изобретению пациенту.
Настоящее изобретение в настоящее время описано более подробно только посредством примера, со ссылкой на сопутствующие фигуры.
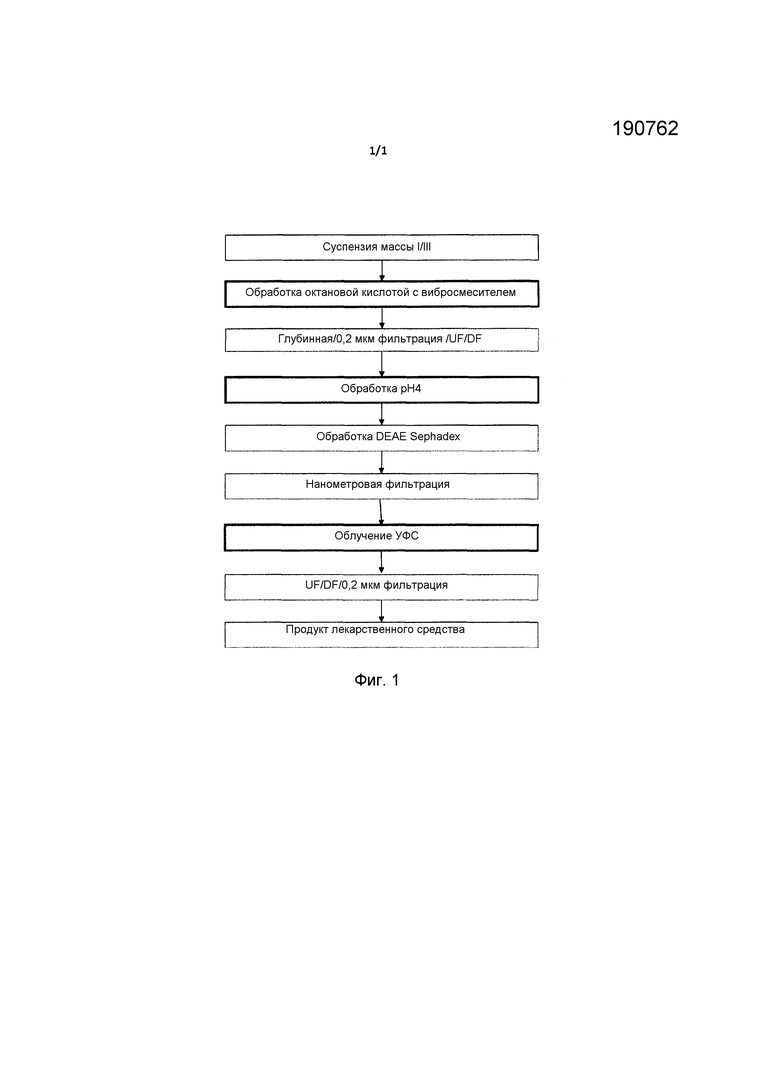
На фиг.1 предоставлен обзор варианта осуществления настоящего изобретения, в котором показаны стадии, которые можно применять для получения препарата антитела, пригодного для внутривенного введения. На стадии обработки октановой кислотой с использованием устройства вибросмесителя большое значение придается обработке pH4 и обработке УФС. Исходный материал получают общепринятым способом осаждения плазмы человека холодным этанолом.
Подробное описание изобретения
Как описано выше, настоящее изобретение относится к способу получения содержащей IgM композиции иммуноглобулинов из фракции плазмы, содержащей иммуноглобулины. Фракции плазмы, пригодные для получения фармацевтических композиций иммуноглобулинов, и способы их получения хорошо известны в данной области. В частности, когда фармацевтические композиции иммуноглобулинов предназначены для введения человеку, фракцию плазмы получают из плазмы человека. Фракция плазмы предпочтительно представляет собой осажденную фракцию плазмы и наиболее предпочтительно, осажденную фракцию плазмы, полученную способом фракционирования по Коэну или с помощью его хорошо известных модификаций (например, Кистлера-Нитшманна). Наиболее предпочтительно, фракция представляет собой фракцию I/III или фракцию III (известные также как фракция B+I или фракция B) после фракционирования холодным этанолом. Предпочтительным является, чтобы иммуноглобулины фракции плазмы содержали, по меньшей мере, 5% IgM.
Стадия (a) включает предоставление фракции плазмы в виде раствора, содержащего иммуноглобулины. Во многих случаях фракция плазмы, содержащая иммуноглобулины, находится в твердой или полутвердой форме. Таким образом, задачей этой стадии является обеспечение перехода или перевод белка из фракции плазмы в раствор, так чтобы он находился в состоянии, подходящем для смешивания с карбоновой кислотой на стадии (b). Эта стадия может включать смешивание фракции плазмы с подходящим буфером. Предпочтительно, буфер имеет низкую молярность (т.е. менее 1M) и имеет pH от 4,5 до 5,5, например, 0,1M буфер ацетата натрия pH 5,05±0,1. Смешивание можно выполнять с использованием лопастной мешалки или вибросмесителя.
На стадии (b) раствор, образованный на стадии (a), смешивают с использованием вибросмесителя с C7-C9 карбоновой кислотой для осаждения загрязняющих белков (например, протеаз, вирусов и т.д.). Карбоновая кислота может быть разветвленной и/или может включать заместители, которые по существу не изменяют эффект стадии (b). Карбоновая кислота предпочтительно представляет собой октановую кислоту. Кислоту предпочтительно добавляют в концентрации, по меньшей мере, 0,075 кг/кг фракции плазмы, вплоть до концентрации 0,2 кг/кг. Более предпочтительно, кислоту добавляют при 0,8-0,15 кг/кг фракции плазмы, и наиболее предпочтительно, от 0,09 кг/кг до 0,13 кг/кг. Кислоту любой подходящей молярности можно применять для обеспечения правильной концентрации.
Можно использовать любой тип коммерчески доступного вибросмесителя, пригодного для применения в химической/фармацевтической промышленности. Примеры пригодных вибросмесителей доступны от Graber+Pfenninger GmbH. В частности, вибросмеситель «Labormodell Typ 1» можно использовать для экспериментов в лабораторном масштабе, и «Industriemixer Typ 4» можно использовать для препаратов в промышленном масштабе. Вибросмесители можно использовать согласно инструкциям производителя, и в частности, при установках, описанных производителями как подходящие для перемешивания растворов, содержащих белки. Например, вибросмесители обычно можно эксплуатировать при менее 100 Гц с амплитудой менее 10 мм, например, авторы настоящего изобретения проводили вибросмешивание в лабораторном масштабе с использованием «Labormodell Typ 1» при 50 Гц, с применением источника электропитания 230 В. Амплитуду вибрации процесса смешивания меняли от 0 до 3 мм, и для препарата IgM предпочтительно применяли 3 мм. Смесители с диаметром от 23 мм до 65 мм использовали для экспериментов в лабораторном масштабе. Для промышленного масштаба применяли диаметр смесителя 395 мм (диаметры отверстий 13,5 мм и 16 мм).
На стадии (b) pH смешанного раствора предпочтительно составляет 4,5-5,5, и более предпочтительно, от pH 4,8 до pH 5,3. Стадию можно проводить в буфере ацетата натрия, и, например, в буфере приблизительно 0,1M ацетата натрия. Температура, при которой проводят стадию (b), предпочтительно составляет от 10°C до 35°C, и более предпочтительно, 14-30°C.
Время смешивания с использованием вибросмесителя не является конкретно ограниченным, но оно предпочтительно составляет, по меньшей мере, 30 минут и не более 3 часов, и более предпочтительно, 40-110 минут. Периоды времени инкубации менее 30 минут могут снижать уровень инактивации вируса.
В одном варианте осуществления стадии (b) трифосфат кальция смешивают с раствором на стадии (b). Предпочтительно, его добавляют при 0,01-0,02 кг/кг фракции плазмы (как таковой в твердой или полутвердой форме). Трифосфат кальция можно добавлять одновременно, отдельно или последовательно с карбоновой кислотой. В предпочтительном варианте осуществления трифосфат кальция добавляют, по меньшей мере, через 20 минут после карбоновой кислоты.
На стадии (c) загрязняющие белки, осажденные на стадии (b), отделяют от раствора для получения содержащей IgM композиции иммуноглобулина (т.е. содержащего иммуноглобулин раствора). Эта стадия разделения не является конкретно ограниченной, но ее можно проводить любым пригодным способом, известным в данной области. Однако стадию разделения предпочтительно проводят с применением фильтрации, и более предпочтительно, ультрафильтрации, и результатом стадии (c), таким образом, является фильтрованный раствор.
Как описано выше, способ по настоящему изобретению является преимущественным в отношении производства, поскольку он, по-видимому, обеспечивает более эффективное осаждение загрязняющих белков, и, в результате, стадию (c) проще проводить. Когда разделяют смесь, полученную в результате стадии (b), достигают прозрачного очищенного раствора, т.е. содержащей IgM композиции иммуноглобулина. Фильтрация, таким образом, является более быстрой и простой.
Дополнительные стадии способа необходимы для перевода содержащей IgM композиции иммуноглобулина, полученной на стадии (c), в препарат антитела, пригодный для внутривенного введения.
Соответственно, в предпочтительном варианте осуществления способ по настоящему изобретению включает дополнительные стадии обработки содержащей IgM композиции иммуноглобулинов, полученной на стадии (c), в слабокислых условиях и, кроме того, подвергания обработанной кислотой композиции облучению УФС.
Для обработки в слабокислых условиях содержащую IgM композицию иммуноглобулинов, полученную на стадии (c), инкубируют от pH 3,5 до pH 4,5, и предпочтительно, от pH 3,8 до pH 4,2, для получения инкубированного раствора. Слабокислые условия можно создавать добавлением пригодной кислоты к содержащей IgM композиции иммуноглобулинов, например, pH можно доводить добавлением 0,2M HCl.
Стадию инкубации предпочтительно проводят от 32 до 42°C, и более предпочтительно, от 35 до 39°C. Время инкубации составляет предпочтительно, по меньшей мере, 2 часа и не более 24 часов, и более предпочтительно, по меньшей мере, 9 часов, но не более 16 часов.
На стадии облучения инкубированный раствор, полученный после обработки слабой кислотой, описанной выше, обрабатывают УФС-светом для получения облученного УФС раствора. Эту стадию можно проводить с использованием устройств, которые являются коммерчески доступными, таких как устройство UVivatec® (Bayer Technology Services). Предпочтительным является, чтобы инкубированный раствор обрабатывали при 254±10 нм от 200 до 500 Дж/м2, более конкретно, от 200 до 300 Дж/м2, для дополнительной инактивации вирусов и протеаз, которые потенциально присутствуют. Отмечено, что обработка УФС в мягких условиях, которая в норме является необходимой, возможна только для осветленного прозрачного фильтрата, который получают по настоящему изобретению после обработки октановой кислотой с вибросмешиванием. Более опалесцирующие или мутные растворы, в норме получаемые общепринятыми способами смешивания, могут нуждаться в более длительных периодах времени облучения, которые могут приводить к большей денатурации активного IgM и меньшим степеням инактивации вируса.
В дополнение к обработке слабой кислотой и облучению УФС, дополнительные стадии получения препарата иммуноглобулина для внутривенного введения могут также необязательно включать одну или более дополнительных стадий фильтрации. В одном варианте осуществления раствор белка можно адсорбировать на DEAE-Sephadex и затем отделить от Sephadex глубинной фильтрацией. Например, его можно дополнительно подвергать периодической адсорбции с помощью 75 мг на кг белка DEAE Sephadex при pH 5,8 для удаления нежелательного сопутствующего белка церулоплазмина.
В особенно предпочтительном варианте осуществления инкубированный раствор, полученный после обработки слабой кислотой, подвергают адсорбции на DEAE-Sephadex и затем отделяют от Sephadex глубинной фильтрацией, перед обработкой облучением УФС.
В другом варианте осуществления обрабатываемый раствор иммуноглобулина можно фильтровать через нанометровый фильтр. Фильтры с размером пор 75±5 нм-35±5 нм, или фильтры с номинальным размером пор 75-35 нм (например, Pall Ultipor DV50), можно использовать на различных стадиях в ходе процесса. (Номинальный размер пор, например, 50 нм, означает степень удержания ≥4 log10 для вируса размером 50 нм или более). В предпочтительном варианте осуществления раствор, полученный на стадии DEAE-Sephadex, описанной в вышестоящем разделе, фильтруют через фильтр 0,2 мкм перед облучением УФС. В дополнительном предпочтительном варианте осуществления раствор иммуноглобулина, полученный после облучения УФС, подвергают нанофильтрации, предпочтительно, через фильтр, имеющий размер пор 40-50 нм. Предпочтительно, эту стадию следует проводить в стерильных условиях.
Конечным препаратом антитела (т.е. обработанным содержащим IgM раствором иммуноглобулина), полученным способом, определенным выше, можно непосредственно заполнять контейнер в стерильных условиях. Альтернативно, препарат антитела можно составлять со стабилизирующим средством, таким как глицин. В частности, препарат можно составлять в глицинсодержащем буфере при pH от 4 до 5,5 и, предпочтительно, от 4,1 до 4,5. Препарат антитела можно также разводить до концентрации белка от 40 до 80 г/л и, предпочтительно, от 55 до 70 г/л.
Предпочтительно, способ по настоящему изобретению не включает стадию, состоящую из одной или более химических модификаций антител в препарате, ферментативной модификации антител или термической обработки антител (например, обработку антител при температуре 40°C или выше в течение 10 минут или более). Более конкретно, способ по настоящему изобретению не включает стадию контакта антител с β-пропиолактоном и/или пепсином.
Кроме того, настоящее изобретение относится к препарату иммуноглобулинов или препарату антитела, которые могут быть получены способом, описанным выше. Препарат иммуноглобулинов является поликлональным и может включать, по меньшей мере, 5% IgM, предпочтительно, по меньшей мере, 15% IgM и наиболее предпочтительно, по меньшей мере, 20% IgM. Другие иммуноглобулины представляют собой IgG и IgA. Предпочтительно, препарат иммуноглобулинов содержит от 5 до 30% IgM (наиболее предпочтительно, приблизительно от 15 до 30%), от 5 до 30% IgA (наиболее предпочтительно, от 15 до 30%) и от 40 до 70% IgG (наиболее предпочтительно, от 45 до 70%). В наиболее предпочтительном продукте содержание IgG составляет приблизительно 50%, и содержание каждого из IgM и IgA составляет приблизительно 25%. Значения обозначают процентное содержание, например, IgM от суммы IgG+IgA+IgM. Тем не менее, также возможно дополнительное обогащение IgM хорошо известными способами, подобно, например, анионообменной хроматографии. Значения могут быть определены нефелометрией или иммунопреципитацией согласно Ph. Eur. (current edition (2010) 2.9.17).
В частности, иммуноглобулины в препарате иммуноглобулинов не являются химически модифицированными. Препарат иммуноглобулинов не обрабатывают в ходе процесса его получения химическим веществом, таким как β-пропиолактон, для стерилизации продукта. Подобным образом, препарат не обрабатывают добавленной протеазой, такой как пепсин, для стерилизации продукта. Поэтому иммуноглобулины находятся в основном в нативной форме.
Препарат антитела обладает более низкой протеолитической активностью, чем препараты антител, описанные в предшествующем уровне техники. В частности, невозможно детектировать протеолитическую активность в препарате при его хранении в пределах 2-8°C. Протеолитическую активность можно измерять стандартизованными способами тестирования, известными в данной области, такими как способ с применением хромогенного субстрата, описанный ниже в примере 6. В таких способах протеолитическую активность оценивают смешиванием хромогенного субстрата (в частности, субстрата, чувствительного, по меньшей мере, к одной сериновой протеазе) и образца препарата антитела (обычно разведенного в буфере для соответствия линейному диапазону анализа) при 37°C и мониторингом кинетики поглощения с использованием спектрофотометра. Протеолитическую активность образца рассчитывают из начальной разницы поглощения (∆Abs/мин) с применением уравнения C (Ед./л)=S×∆Abs/мин×F(C=протеолитическая активность; S=коэффициент перевода, относящийся к специфическому изменению поглощения хромогенного субстрата; и F=коэффициент разведения). Применение субстрата осуществляют согласно инструкциям производителя.
Протеолитическую активность можно, в частности, оценивать посредством следующих стадий:
(a) 25 мг субстрата S-2288 (Chromogenix) растворяют в 7,2 мл воды для инъекций;
(b) образец препарата антитела разводят в буфере (100 мМ Трис.HCl pH 8,4, 106 мМ NaCl) для соответствия линейному диапазону анализа, и температуру доводят до 37°C;
(c) смешивают равные количества (например, 200 мкл) разведенного препарата антитела и растворенного субстрата;
(d) измеряют кинетику поглощения при 405 нм в течение 1-3 минут при 37°C с использованием спектрофотометра;
(e) протеолитическую активность образца рассчитывают из начальной разницы поглощения (∆Abs/мин) с применением уравнения C (Ед./л)=313×∆Abs/мин×F (C=протеолитическая активность, F=коэффициент разведения).
Предел количественного определения по данному способу составляет 8 Ед./л, и с применением образца препарата антитела по настоящему изобретению протеолитическая активность не поддается детекции. Поэтому уровень протеолитической активности в конечном продукте по настоящему изобретению составляет ниже 8 Ед./л.
Как и препараты, известные в данной области, препарат антитела по настоящему изобретению можно хранить при 5±3°C. Однако благодаря эффективной очистке способом по настоящему изобретению, стабильность препарата антитела является необычайно хорошей. Конечный продукт является стабильным в жидкой форме в течение, по меньшей мере, 3 месяцев, предпочтительно, по меньшей мере, 6 месяцев и, наиболее предпочтительно, по меньшей мере, двух лет при 2-8°C, что означает, что отсутствует фрагментация или полимеризация IgM более 5%, измеренных в HPSEC, увеличение протеолитической активности, уменьшение активности антитела IgM против Escherichia coli и активности антитела IgM против Pneumococcus saccharide более 25% и увеличение антикомплементарной активности более 25%, остающейся ниже 1 CH50/мг белка. Кроме того, конечный продукт, полученный способом по настоящему изобретению, является стабильным в жидкой форме в течение, по меньшей мере, 3 месяцев, предпочтительно, по меньшей мере, 6 месяцев и, наиболее предпочтительно, по меньшей мере, одного года при комнатной температуре (от 23 до 27°C), как оценено по таким же критериям.
Способ по настоящему изобретению, кроме того, обеспечивает более высокий уровень удаления вирусов, чем способы предшествующего уровня техники, с получением препарата антитела, который является более безопасным, чем препараты антител из предшествующего уровня техники, особенно по отношению к активным безоболочечным вирусам, подобным, например, парвовирусам. Способом по настоящему изобретению можно удалять/инактивировать вирусы, и, в частности, безоболочечные вирусы, более чем на 3 log10, предпочтительно, более чем на 4 log10 и, наиболее предпочтительно, более чем на 5 log10. Это приводит в результате к препарату антитела, который является по существу свободным от вирусов и, в частности, по существу свободным от безоболочечных вирусов (т.е. обладает вирусной безопасностью). Кроме того, способом по настоящему изобретению можно достигать этого уровня удаления/инактивации вирусных частиц без существенного влияния на количество активного IgM или на антикомплементарную активность препарата антитела. Соответственно, можно получать препараты антител, обладающие вирусной безопасностью по отношению к оболочечным и безоболочечным вирусам, которые содержат, по меньшей мере, 15%, более предпочтительно, по меньшей мере, 20% уровень IgM, и которые обладают антикомплементарной активностью ≤1 CH50/мг белка.
Препарат антитела по настоящему изобретению является пригодным для применения в медицине, и его можно применять для лечения иммунологических нарушений и инфекций, в частности, нарушения с дефицитом IgM и бактериальных инфекций. Обогащенный IgM человека препарат поливалентных иммуноглобулинов для внутривенного введения, который можно получать способом по настоящему изобретению, содержит более высокие титры антител против клинически значимых грамотрицательных и грамположительных бактерий, а также более высокие титры антител против эндотоксинов грамотрицательных бактерий и экзотоксинов грамотрицательных и грамположительных бактерий по сравнению с препаратами поливалентного иммуноглобулина G.
В частности, препараты антител по настоящему изобретению являются пригодными для внутривенного введения пациентам и особенно пригодны для внутривенной инъекции человеку.
Изобретение относится также к способу лечения пациента, включающему стадию введения препарата антитела по настоящему изобретению пациенту. В частности, пациент может страдать иммунологическим нарушением или бактериальной инфекцией.
Настоящее изобретение в настоящее время описано дополнительно только путем примеров.
Описание способа тестирования для определения антикомплементарной активности
Анализ для определения антикомплементарной активности проводили согласно способу, описанному в Европейской Фармакопее (способ 2.6.17, Ph. Eur. 6. Edition, 2008).
Для предварительно обработанных гемолизином эритроцитов овцы проводили гемолиз посредством комплемента. Посредством комплемент-связывающих антител в образце гемолиз супрессируется. Определяют количество комплемента, которое связывается (инактивируется) 1 мг иммуноглобулина.
Определенное количество иммуноглобулина (10 мг) смешивают с комплементом морской свинки и титруют свободный комплемент. Антикомплементарная активность выражает применяемый комплемент относительно применяемого комплемента из эталонного раствора. Гемолитическая единица активности комплемента (CH50) представляет собой количество комплемента, приводящее к гемолизу 2,5×108 оптимально подготовленных эритроцитов из общего количества 5×108 эритроцитов в оптимальных буферных условиях.
Оптимально подготовленные эритроциты (8 мл стабилизированных эритроцитов овцы, промытых три раза желатиново-барбиталовым буфером, конечный 1 мл осадка эритроцитов суспендирован в 24 мл желатиново-барбиталового буфера) получают смешиванием 20 мл суспензии эритроцитов с 20 мл гемолизина (доведенного до 2 MHE/мл - минимальной гемолитической единицы) и инкубацией в течение 15 мин при 37°C.
Эквивалент 10 мг иммуноглобулина разводят в желатиново-барбиталовом буфере (1 г желатина в 1 л барбиталового буфера, pH 7,3, 5-кратный раствор барбиталового буфера: 83 г хлорид натрия, 10,192 г барбитала натрия в 2 литрах воды, pH 7,3). К конечному объему 1 мл добавляют 200 мкл комплемента 100 CH50/мл. Пробирки инкубируют при встряхивании в течение 1 час при 37°C. Образцы разводят и титруют против оптимально подготовленных эритроцитов. После инкубации в течение 1 час при 37°C образцы центрифугируют и определяют оптическую плотность с использованием спектрофотометра при длине волны 541 нм.
Пример 1 -Получение обогащенного IgM препарата из фракции I/III
180 кг фракции Коэна I/III, полученной фракционированием плазмы человека холодным этанолом, суспендируют в 720 л 0,1М буфера ацетата натрия pH 5,05 и перемешивают в течение 15-30 минут после достижения температуры суспензии (22±4°C).
Раствор обрабатывают добавлением 19,8 кг октановой кислоты (используют 0,110 кг на кг массы I/III) при комнатной температуре и раствор белка дополнительно перемешивают в течение 80 минут, с использованием вибросмесителя (Vibromixer®, размер 4, Graber+Pfenniger GmbH, Vibromixer, доведенный до уровня 2-3). Октановую кислоту добавляют медленно в течение 30 мин.
Добавляют приблизительно 3 кг трифосфата кальция (Ca3(PO4)2), и раствор белка дополнительно перемешивают в течение, по меньшей мере, 15 мин. Преципитат удаляют осветляющей фильтрацией с использованием фильтр-пресса. Проводят дополнительную фильтрацию через 0,2 мкм и раствор белка подвергают ультрафильтрации с помощью мембран 10 кДа. Раствор белка подвергают диафильтрации против раствора 0,04M NaCl и затем доводят до концентрации белка 40 г/л.
Раствор белка обрабатывают при pH 4,0±0,1 после разведения 1+1 водой для инъекций. Доведение pH проводят с использованием 1M HCl, и раствор белка инкубируют в течение 9 час при 37°C±2°C. После инкубации при pH 4 раствор белка доводят до pH 5,8, с использованием 1M NaOH. Полученный раствор белка дополнительно очищают добавлением DEAE Sephadex в периодическом режиме (75 г DEAE Sephadex на кг белка). Раствор белка инкубируют при перемешивании в течение ≥60 мин при комнатной температуре. DEAE Sephadex удаляют осветляющей фильтрацией. Раствор белка подвергают фильтрации через 0,2 мкм.
Раствор белка фильтруют через фильтр 0,1 мкм и фильтр Pall, Ultipor VF DV50, 20”. Фильтрат далее обрабатывают УФС-светом при 254 нм, с использованием устройства для проточного процесса UVivatec® (Bayer Technology Services/Sartorius Stedim) при дозе УФС 240 Дж/м2. Скорость потока через УФС-реактор рассчитывают с применением инструкций производителя. Облученный раствор белка концентрируют до концентрации белка 50-70 г/л посредством ультрафильтрации и подвергают диафильтрации (мембрана 10 кДа, с применением буфера 0,32M глицина pH 4,3). Конечный продукт фильтруют через фильтр 0,2 мкм и сохраняют при 2-8°C.
Пример 2 - Исследование условий на стадии обработки октановой кислотой
Для обработки октановой кислотой тестировали следующие экспериментальные диапазоны, также в сочетании друг с другом, с применением способа, описанного в примере 1 (результаты не показаны).
- Количество октановой кислоты: 0,09 кг/кг - 0,13 кг/кг (Количество октановой кислоты на кг применяемой фракции I/III) (120-180 мМ октановая кислота).
- pH при обработке октановой кислотой от pH 4,8 до 5,3.
- Диапазон температур реакции: 14°C-30°C.
- Время инкубации: 40-110 мин.
Все тестированные условия приводили к промежуточным соединениям, которые легко было осветлять для дальнейшей переработки, и со значительным снижением протеолитической активности от нескольких тысяч Ед./л в суспендированной фракции Коэна I/III. Эти промежуточные соединения приводили к конечному продукту с протеолитической активностью ниже 8 Ед./л (рассчитанной, как описано ниже в примере 6), что составляет предел количественного определения.
Пример 3 - Снижение количества вируса посредством использования вибросмесителя - Определение степеней удаления вируса для обработки октановой кислотой с и без использования вибросмесителя
250 мл суспендированной фракции I/III гомогенизировали в течение 30 мин при pH 5,05 и 22°C. В суспензию добавляли 2,6 мл исходного раствора вируса. Добавляли октановую кислоту (110 г/кг) и гомогенизировали в течение 60 мин с использованием вибросмесителя. В параллельном эксперименте такую же смесь гомогенизировали со стандартным перемешиванием. Через 60 мин добавляли трифосфат кальция (0,15 г/кг октановой кислоты) и суспензию перемешивали в течение 15 мин. Суспензию осветляли глубинной фильтрацией с использованием дискового фильтра. Дисковый фильтр предварительно промывали 70-80 мл буфера. После фильтрации фильтр промывали 80 мл буфера. Фильтрат и смыв объединяли и отбирали образец для титрования вирусов.
Титры вирусов из образцов, взятых до добавления октановой кислоты и после фильтрации, определяли на подходящих индикаторных клетках для SV40, Reo и PPV (CV-1, CCL.7.1 и PK13). Наконец, рассчитывали степень удаления в соответствии с современными руководствами для валидационных исследований вирусов.
В валидационных исследованиях вирусов безоболочечные вирусы, такие как SV40 и Reo, эффективно удаляли с порядком более 4 log10 и более 5 log10, соответственно. Более того, PPV удаляли более чем на 3 log10. Эти значения более чем в 10 раз и вплоть до 1000 раз выше, чем при такой же обработке октановой кислотой в условиях стандартного перемешивания без вибросмешивания.
Пример 4 - Оценка обработки УФС
Оценивали оптимальный диапазон для дозы облучения УФС. Существует равновесие между минимально необходимой дозой для достижения инактивации, по меньшей мере, 4 log10 для безоболочечных вирусов и максимально переносимой дозой для избегания денатурации молекул IgM, приводящей к нарушенной функции Fab для связывания антигенов и нарушенной функции Fc, влияющей на активацию комплемента. В диапазоне 200-400 Дж/м2 можно наблюдать только слабое увеличение количества агрегатов иммуноглобулинов и отсутствие существенного влияния на содержание фрагментов.
Для экспериментов оптическую плотность (OD) исходного раствора белка применяют для расчета скорости потока в системе UVivatec lab с помощью предоставленного поставщиком Excel-Sheet из BTS (Master Calculation Sheet UVivatec Lab II версии 3.0 покупателя). Скорость потока рассчитывают, принимая во внимание производительность лампы, заданное положение датчика УФ-сигнала лампы и желаемую дозу облучения УФС.
Содержащий IgM раствор с содержанием белка приблизительно 55 г/л (партия 86 GB005BE07) прокачивали насосом со скоростью потока 5,8 л/час через систему UVivatec для достижения дозы 200 Дж/м2 за однократный проток. Дозы 300 Дж/м2 достигали прокачиванием насосом раствора белка со скоростью потока 3,9 л/м2 через систему. 400 Дж/м2 достигали прокачиванием насосом раствора белка со скоростью потока 2,9 л/м2 через систему.
облучения УФС
Невозможно было наблюдать существенных различий для содержания иммуноглобулинов, протеолитической активности или ACA в диапазоне 200-400 Дж/м2. Предпочтительный диапазон для дозирования устанавливали от 200 до 300 Дж/м2, поскольку 200 Дж/м2 являются достаточно хорошими для инактивации безоболочечных вирусов, и при 300 Дж/м2 невозможно было наблюдать существенного влияния на образование агрегатов и титры антител. Предпочтительная доза составляет 225 Дж/м2.
Разведенный содержащий IgM раствор с содержанием белка 8-12 г/л (партия 86BB059BE07) прокачивали насосом со скоростью потока 5,8 л/час через систему UVivatech для достижения доз от 200 до 300 Дж/м2 за однократный проток.
Распределение между классами иммуноглобулинов остается без влияния облучения УФ при способе в пределах этого диапазона дозирования. Характер распределения молекулярной массы, анализированного посредством HPSEC, также не изменяется. Уровень чистоты, анализированный посредством CZE, остается неизменным. Протеолитическая активность (PA), активатор прекалликреина (PKA) и антикомплементарная активность (ACA) остаются неизменными. Антибактериальная активность, измеренная способом Elisa, также существенно не изменяется для всех классов иммуноглобулинов.
Аликвоты - облученные УФ с увеличивающимися значениями интенсивности - далее перерабатывали до конечного продукта и подвергали такой же панели аналитических тестов. В конечных продуктах также не существовало поддающихся наблюдению различий. Все тестированные титры антител всегда лежат в диапазоне 100±10% от контрольного препарата, не обработанного УФС.
Пример 5 - Общее снижение количества вирусов посредством использования вибросмесителя/обработки pH4 и обработки УФС - Определение степеней удаления вирусов
Подтверждение удаления/инактивации вируса для трех стадий обработки октановой кислотой с вибросмешиванием, обработки pH4 и обработки УФС (215 Дж/м2) проводили с применением следующих моделей вирусов: вирус бычьей вирусной диареи (BVDV) в качестве модели вируса для вируса гепатита C, вирус псевдобешенства (PRV) в качестве модели вируса для вирусов герпеса человека, вируса иммунодефицита человека (HIV-1), вируса конского артерита (EAV) в качестве модели вируса для коронавирусов, вируса Синдбис (SinV) в качестве модели вируса для флавивирусов, вируса энцефаломиелита мышей (MEV) в качестве модели вируса для вируса гепатита A, реовируса (Reo) в качестве модели вируса для других безоболочечных вирусов, парвовируса свиней (PPV) в качестве модели вируса для парвовируса B 19 человека.
Результаты этих исследований для трех стадий обработки октановой кислотой, обработки pH4 и обработки УФС перечислены в следующей таблице 4.
Необязательная нанофильтрация с фильтрами с номинальным размером пор приблизительно 50 нм добавляет дополнительную безопасность посредством увеличения общего снижения вплоть до более 17 log10 в зависимости от размера вируса. Например, >17,5 log10 достигают затем для HIV-1, в то время как PPV дополнительно не удалялся нанофильтрацией.
Таким образом, способ очистки по изобретению приводит к препарату IgM с выдающейся вирусной безопасностью с недостижимыми до настоящего времени для такого содержащего IgM препарата степенями инактивации/снижения количества вирусов более 8 log10. Это является особенно важным для безоболочечных вирусов, подобных MEV, Reo и PPV, которые, как правило, более устойчивы против способов инактивации и удаления вирусов из-за их малого размера и отсутствия липидной оболочки.
Пример 6: Определение остаточной протеолитической активности для обработки октановой кислотой с и без использования вибросмесителя
Обработку октановой кислотой проводили, как в примере 1, и в параллельном эксперименте без вибросмесителя, но с интенсивным стандартным перемешиванием с помощью лопастной мешалки. Протеолитическую активность в образцах после обработки октановой кислотой/трифосфатом кальция и ультра/диафильтрации определяли с применением хромогенного субстрата S-2288 (Chromogenix), следуя инструкциям производителя.
25 мг субстрата S-2288 (Chromogenix) растворяют в 7,2 мл воды для инъекций. Образцы разводят в буфере (100 мМ Трис/HCl pH 8,4, 106 мМ NaCl) для соответствия линейному диапазону анализа, например, 200 мкл буфера смешивают с 200 мкл образца (смешивание и доведение температуры до 37°C) и 200 мкл раствора хромогенного субстрата. Кинетику поглощения измеряют при 405 нм (1-3 мин) при 37°C, с использованием спектрофотометра. Протеолитическую активность образца рассчитывают из начальной разницы поглощения (∆Abs/мин) с применением уравнения C (Ед./л)=313×∆Abs/мин×F (C=протеолитическая активность. F=коэффициент разведения).
вибросмешивания
вибросмешиванием
Фильтрат после обработки октановой кислотой был прозрачным, когда применяли вибросмешивание. В сравнительном эксперименте фильтрат после обработки октановой кислотой с лопастной мешалкой был очень мутным и сложным для фильтрации.
Пример 7: Анти-бактериальные титры в препарате IgM по изобретению
Для сравнения с единственным коммерчески доступным переносимым при внутривенном введении содержащим IgM препарата пентаглобина, антибактериальную активность анализировали в трех партиях этого общепринятого лекарственного средства и сравнивали с препаратом по изобретению. Определение антител класса IgA или IgM против антибактериальных или противогрибковых антигенов в препарате IgM проводили посредством ELISA. Планшеты для микротитрования покрывали соответствующим антигеном и инкубировали со стандартом или препаратом IgM. Антитела, связанные с антигеном, детектировали с помощью конъюгата против IgA человека или против IgM человека. Детекцию проводили с применением субстрата фермента. Полученное изменение окраски соответствует количеству антител, присутствующих в препарате IgM.
препарате по изобретению и в коммерчески доступном пентаглобине
Опосредованная IgM и IgA активность в новом препарате, как правило, по меньшей мере, в 1,5 раза превышала активность в пентаглобине, что можно объяснить тем фактом, что IgM и IgA в пентаглобине являются химически модифицированными β-пропиолактоном. По настоящему изобретению эта стадия заменена более мягкими процедурами.
В целом эти данные показывают, что связывающая область молекул IgM в конечном препарате является функционально полностью активной.
Пример 8 Исследования стабильности при хранении для жидкого продукта IgM
Продукт согласно примеру 1 без обработки УФС сохраняли в стеклянных флаконах по 10 или 100 мл (объем заполнения 5 мл или 50 мл) при 2-8°C и анализировали по всем параметром согласно спецификации. Результаты показаны в таблице 8. Параметрами, важными, чтобы показать стабильность, являются содержание агрегатов и фрагментов, измеренные с помощью высокоэффективной эксклюзионной хроматографии (HPSEC), протеолитическая активность (PA) и антикомплементарная активность (ACA). Эти параметры являются критическими для переносимости при внутривенном введении и, по-видимому, изменяются в ходе долгосрочного хранения. При 2-8°C не присутствовало существенного изменения этих параметров. Даже при хранении при комнатной температуре (23-27°C) эти значения оставались в пределах спецификации, хотя присутствует небольшое увеличение количества фрагментов через 24 месяца при комнатной температуре. Определяли также другие параметры, подобно окрашиванию, опалесценции, значению pH, и они оставались неизменными в течение всего периода исследования. Титры IgM и IgA против различных бактерий оставались стабильными в течение 2 лет при 2-8°C.
Продукт согласно примеру 1 с обработкой УФС также сохраняли в стеклянных флаконах по 10 или 100 мл (объем заполнения 5 мл или 50 мл) при 2-8°C и комнатной температуре и анализировали по всем параметрам согласно спецификации. Результаты показаны в таблице 9. В этом текущем исследовании стабильности доступные в настоящее время данные за 12 месяцев показывают такой же профиль стабильности продукта, как без обработки УФС, что позволяет экстраполяцию на стабильность в течение 24 месяцев.
2-8°C
Пример 9 Эксперименты in vivo с продуктом IgM
Для подтверждения безопасности и переносимости исследовали эффекты препарата IgM на артериальное кровяное давление после повторяющихся внутривенных инфузий в течение 5 суток 8 бодрствующим яванским макакам. Вводили дозу 190 мг/IgM/кг/сутки препарата IgM, полученного способами, описанными в данном описании. Пентаглобин, коммерчески доступный, содержащий IgM препарат с переносимостью при внутривенном введении, вводили некоторым обезьянам в качестве сравнительного вещества. Пентаглобин вводили таким способом, как такую же дозу IgM. Контрольную дозу 0,9% NaCl вводили животным за некоторое время до введения препаратов иммуноглобулинов. Кровяное давление определяли после инъекции, чтобы определить, было ли введение ассоциировано с непереносимым уровнем неспецифической активации комплемента.
Введение препарата IgM (15 мл/кг/сутки) оказывало только незначительные эффекты на артериальное кровяное давление (среднее, систолическое и диастолическое). Различия вплоть до 4 часов после каждой инфузии по сравнению со значениями до тестирования не превышали 4 мм.рт.ст. (533,3 Па). Эти различия можно рассматривать как биологически не значимые.
Никаких значительных токсикологических обнаружений нельзя приписать препарату IgM, и не присутствовало значимых изменений, которых не наблюдали с пентаглобином. Поскольку безопасность пентаглобина хорошо установлена в многолетней клинической практике, на этом обосновании можно заключить, что эти изменения не имеют какой-либо клинической значимости.
Хорошую переносимость и безопасность препарата IgM также верифицировали в исследовании фазы I на людях для 24 здоровых мужчин и женщин - добровольцев. Систолическое кровяное давление в первые 4 часа после введения в среднем уменьшалось только приблизительно на 9% (11,9 мм рт.ст. (1,587 Па)) после инфузии 91-274 мг препарата IgM на кг BW/d при 0,5 мл/мин.
Это находилось в таком же диапазоне, как и плацебо - 0,9% NaCl-раствор (9,4%, 11,7 мм рт.ст. (1,56 Па)).
Не зарегистрировано тяжелых неблагоприятных событий, и все не тяжелые неблагоприятные события являлись самоограничивающимися. Кроме того, не существовало доказательств переноса инфекционного агента, как показано посредством определений PCT.
Отмечено, что полезность исследований эффективности на животных моделях соответствующих заболеваний является ограниченной из-за иммуногенности и преформированных Gal-антител в препаратах IgM, полученных из плазмы человека. Однако, принимая во внимание знания предшествующего уровня техники относительно применения пентаглобина в лечении заболеваний и титры антител против бактерий в препаратах IgM, полученных способом по настоящему изобретению (как показано в примере 7), можно заключить, что препарат IgM обладает клинической эффективностью.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ ИММУНОГЛОБУЛИНОВ | 2011 |
|
RU2765738C2 |
| ПРЕПАРАТЫ АНТИТЕЛ | 2011 |
|
RU2749732C2 |
| ПРЕПАРАТЫ АНТИТЕЛ | 2011 |
|
RU2617532C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНА ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ, ОБОГАЩЕННОГО ИММУНОГЛОБУЛИНОМ М, И ПРЕПАРАТ, ПОЛУЧЕННЫЙ ЭТИМ СПОСОБОМ | 2010 |
|
RU2470664C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА ИММУНОГЛОБУЛИНОВ IgG, IgM И IgA ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ | 2012 |
|
RU2492176C1 |
| ПРЕПАРАТ ИММУНОГЛОБУЛИНА ЧЕЛОВЕКА ПРОТИВ ЦИТОМЕГАЛОВИРУСА ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2009 |
|
RU2404250C1 |
| СПОСОБ ПОЛУЧЕНИЯ IGM-СОДЕРЖАЩЕГО КОНЦЕНТРАТА ИММУНОГЛОБУЛИНА | 1999 |
|
RU2158136C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНОВ ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ И ДРУГИЕ ИММУНОГЛОБУЛИНОВЫЕ ПРОДУКТЫ | 1999 |
|
RU2197500C2 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ВИРУСИНАКТИВИРОВАННЫХ РАСТВОРОВ ИММУНОГЛОБУЛИНОВ | 2007 |
|
RU2352358C1 |
| Способ производства иммуноглобулина для внутривенного введения | 2019 |
|
RU2742655C1 |
Изобретение относится к области биотехнологии. Предложен способ получения содержащей IgM композиции иммуноглобулинов из фракции плазмы. Способ предусматривает обеспечение фракции плазмы в виде раствора, содержащего иммуноглобулины, смешивание раствора с октановой кислотой, обработку смешанного раствора вибросмесителем для осаждения загрязняющих белков и отделение осажденных белков от раствора для получения содержащей IgM композиции иммуноглобулинов. Также описан препарат антитела, полученный таким способом, и применение такого препарата для лечения пациента или изготовления лекарственного средства для лечения иммунологических нарушений и бактериальных инфекций. 4 н. и 26 з.п. ф-лы, 1 ил., 11 табл., 9 пр.
1. Способ получения содержащей IgM композиции иммуноглобулинов из фракции плазмы, содержащей иммуноглобулины, включающий:
(a) обеспечение фракции плазмы в виде раствора, содержащего иммуноглобулины;
(b) смешивание октановой кислоты с раствором и обработку смешанного раствора вибросмесителем для осаждения загрязняющих белков, где октановую кислоту добавляют в количестве от 0,075 до 0,2 кг/кг фракции плазмы, рН смешанного раствора составляет 4,5-5,5 и температура составляет 10-35°С; и
(c) отделение осажденных белков от раствора для получения содержащей IgM композиции иммуноглобулинов.
2. Способ по п. 1, где на стадии (b) октановую кислоту инкубируют с раствором, содержащим иммуноглобулины, в течение по меньшей мере 30 минут.
3. Способ по п. 1 или 2, где иммуноглобулины фракции плазмы содержат по меньшей мере 5% IgM.
4. Способ по п. 1 или 2, где фракция плазмы представляет собой осажденную фракцию Коэна I/III или фракцию Кистлера/Нитшманна В или B+I.
5. Способ по п. 1 или 2, где стадия (с) включает ультрафильтрацию и композиция иммуноглобулинов содержит фильтрованный раствор.
6. Способ по п. 1, дополнительно включающий стадию инкубации содержащей IgM композиции иммуноглобулинов со стадии (с) от рН 3,5 до рН 4,5 для получения инкубированного раствора.
7. Способ по п. 6, где стадию инкубации содержащей IgM композиции иммуноглобулинов со стадии (с) проводят при температуре от 32 до 42°С.
8. Способ по п. 6, дополнительно включающий стадии подвергания инкубированного раствора адсорбции на DEAE-Sephadex и отделения DEAE Sephadex от раствора глубинной фильтрацией.
9. Способ по п. 8, дополнительно включающий стадию подвергания фильтрата после глубинной фильтрации нанофильтрации.
10. Способ по п. 9, где нанофильтрацию проводят с помощью фильтра с номинальным размером пор 35-75 нм и предпочтительно с номинальным размером пор 40-50 нм.
11. Способ по п. 10, дополнительно включающий стадию обработки фильтрата по п.10 облучением УФС для получения облученного УФС раствора.
12. Способ по п. 11, где фильтрат обрабатывают облучением УФС при 200-500 Дж/м2 и предпочтительно при 200-300 Дж/м2.
13. Способ по п. 11, дополнительно включающий стадию фильтрования облученного УФС раствора в стерильных условиях для получения препарата антитела, пригодного для внутривенного введения.
14. Способ по п. 13, включающий получение в виде состава препарата антитела в содержащем глицин буфере при рН от 4 до 5,5.
15. Способ по любому из пп. 11-14, дополнительно включающий стадию заполнения контейнера облученным УФС раствором по п. 11 или 12 или препаратом антитела по п. 13 или 14 в стерильных условиях.
16. Способ по любому из пп. 11-14, где облученный УФС раствор по п. 15 или 16 или препарат антитела по п. 17 или 18 обладает протеолитической активностью менее 8 Ед./л.
17. Способ по любому из пп. 11-14, обеспечивающий удаление более 3 log10 безоболочечных вирусов.
18. Препарат антитела для применения в медицине, содержащий иммуноглобулины, получаемые способом по любому из пп. 13-17, где фракцию плазмы получают из плазмы человека и где препарат антитела пригоден для внутривенного введения пациенту, являющемуся человеком, при этом препарат антитела содержит 5-30% IgM, 5-30% IgA и 40-70% IgG и является стабильным в жидкой форме в течение по меньшей мере 6 месяцев при хранении при 2-8°С.
19. Препарат антитела по п. 18, где по меньшей мере 15% от всех иммуноглобулинов представляют собой IgM.
20. Препарат антитела по п. 18, где препарат имеет вирусную безопасность по отношению к оболочечному и безоболочечному вирусу.
21. Препарат антитела по п. 18, где препарат имеет антикомплементарную активность ≤ 1 СН50/мг белка.
22. Препарат антитела по п. 18, дополнительно содержащий стабилизатор.
23. Препарат антитела по п. 22, где стабилизатор представляет собой глицин.
24. Препарат антитела по п. 18, где иммуноглобулины не являются химически модифицированными или где препарат не обработан в ходе процесса его получения β-пропиолактоном и/или добавленной протеазой.
25. Применение препарата антитела по любому из пп. 18-24 в лечении иммунологического нарушения.
26. Применение по п. 25, где иммунологическое нарушение представляет собой нарушение с дефицитом IgM.
27. Применение препарата антитела по любому из пп. 18-24 в лечении бактериальной инфекции.
28. Применение препарата антитела по любому из пп. 18-24 для изготовления лекарственного средства для лечения иммунологических нарушений и бактериальных инфекций.
29. Способ лечения пациента, включающий введение препарата антитела по любому из пп. 18-24 в эффективном количестве.
30. Способ лечения по п. 29, где пациент страдает иммунологическим нарушением или бактериальной инфекцией.
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНОВОГО ПРЕПАРАТА ДЛЯ ПРОФИЛАКТИКИ И ТЕРАПИИ БАКТЕРИАЛЬНЫХ И ВИРУСНЫХ ИНФЕКЦИЙ, ИММУНОГЛОБУЛИНОВЫЙ ПРЕПАРАТ ДЛЯ ПРОФИЛАКТИКИ И ТЕРАПИИ БАКТЕРИАЛЬНЫХ И ВИРУСНЫХ ИНФЕКЦИЙ (ВАРИАНТЫ) И СУППОЗИТОРИИ НА ОСНОВЕ ИММУНОГЛОБУЛИНОВОГО ПРЕПАРАТА | 2003 |
|
RU2255766C2 |
| КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОВИРУСНЫМ И АНТИМИКРОБНЫМ ДЕЙСТВИЕМ, СОДЕРЖАЩАЯ КОНСОРЦИУМ ИММУНОГЛОБУЛИНОВ | 2008 |
|
RU2457861C2 |
| АНТИТИМОЦИТАРНЫЙ ГЛОБУЛИН ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2000 |
|
RU2178309C2 |
| JARVIS J.N | |||
| et al., "Composition and biological behaviour of immune complexes isolated from synovial fluid of patients with juvenile rheumatoid arthritis (JRA)", Clin Exp Immunol | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| . | |||
Авторы
Даты
2017-03-13—Публикация
2011-04-21—Подача