Предлагаемое изобретение относится к медицине, а именно к кардиохирургии, и может быть использовано в отделениях интенсивной терапии и кардиологии.
Способы диагностики и прогнозирования постперикардиотомного синдрома условно можно разделить на 5 групп: клинико-инструментальные, цитологические, биохимические, иммунологические и генетические методы. Несомненной основой при любой патологии, в том числе и постперикардиотомном синдроме, среди перечисленных методов являются клинико-инструментальные исследования. В данной области наиболее перспективными считаются рентгенологическое исследование органов грудной клетки, электрокардиография, эхокардиография (ЭхоКГ) и магнитно-резонансная томография (MPT) (Maisch et al., 2004) /1/. Рентгенография позволяет диагностировать наличие плеврита/перикардита по увеличению сердечного силуэта (Драненко, 2013) /2/. Данный метод отличается наглядностью и простотой в исполнении, однако он не обладает превентивностью и может быть не эффективен на ранних сроках развития патологии.
Более чувствительным методом является эхокардиография. ЭхоКГ применима для (Mittal, 2003) /3/: 1) верификации диагноза экссудативный перикардит; 2) определения локализации экссудативного выпота; 3) оценки количества перикардиального выпота; 4) прогнозирования характера выпота; 5) диагностики тампонады сердца; 6) диагностики констриктивного перикардита.
ЭхоКГ позволяет обнаружить даже небольшие объемы перикардиального выпота, что значительно ускоряет постановку диагноза и выбор тактики ведения пациента (Mittal, 2003) /3/. Однако ЭхоКГ прежде всего направлена на обнаружение выпота плеврального или перикардиального характера, поэтому бессимптомные формы ПКТС при использовании данного способа часто остаются недиагностируемыми. Кроме того, эхокардиография не позволяет прогнозировать ПКТС.
Другой клинико-инструментальный метод, магнитно-резонансная томография, осуществляется для улучшения визуализации изменений в перикардиальной сумке (Драненко, 2013) /2/. Данный способ, как и перечисленные выше, обладает существенным недостатком - невозможностью отследить изменения, происходящие на клеточном и молекулярном уровнях.
Цитологические исследования основываются на отслеживании состояния иммунной системы, клеточного состава и степени эндотелиальной проницаемости. В работе Bocsi и сотрудников показана предикаторная способность подобных исследований. Они оценивали объем лейкоцитарных популяций, а параллельно - уровень факторов воспаления (компоненты системы комплимента С1-ингибитор, С3, С5, С5а, фактор некроза опухоли α, интерлейкин-10). Данное исследование направлено на прогнозирование возможных осложнений, связанных с воспалительной реакцией, в преоперационный и постоперационный период (Bocsi et al., 2002) /4/. Преимуществом такого подхода являются комплексность и многосторонность. Однако выбранные предикторы не специфичны для развития ПКТС. Поэтому, опираясь на результаты данных показателей, в преоперационный период невозможно дифференцировать вероятность развития ПКТС от наличия текущей патологии общего воспалительного профиля.
Стандартный набор биохимических тестов включает: определение уровня C-реактивного белка, фибриногена, активности лактатдегидрогеназы (ЛДГ) и аденозиндезаминазы. Вышеназванные методы отличаются высокой специфичностью, но низкой чувствительностью. Так, для теста на C-реактивный белок специфичность равна 84%, а чувствительность 64%. Особо стоит отметить способ прогнозирования сердечно-сосудистых осложнений, основывающийся на измерении активности ЛДГ, глюкозо-6-фосфатдегидрогеназы и глицерол-3-фосфатдегидрогеназы /5/ (см. RU 2466395, МПК: G01N 33/48; опубл. 10.11.2012).
Данный способ прост в исполнении и не требует много времени на реализацию, но поскольку в первую очередь направлен только на исследование состояния тромбоцитарного звена гемостаза, он охватывает широкий диапазон возможных изменений, которые не способен дифференцировать.
Наиболее интересным представляется способ прогнозирования послеоперационных осложнений, основывающийся на определении активности миелопероксидазы и лизосомальных катионных белков. МПО на протяжении многочисленных исследований зарекомендовала себя как потенциальный маркер сердечно-сосудистых заболеваний (в частности, острого коронарного синдрома и атеросклероза) (Nicholls, Hazen, 2005; Schindhelm et al., 2009; Wong et al., 2009; Olza et al., 2012) /6, 7, 8, 9/. Но без исследования других предикторов специфичность теста существенно снижается.
Иммунологические методы отличаются высокой специфичностью. Так, способ прогнозирования ПКТС, где предиктором выступает уровень интерлейкина-8, обладает специфичностью, равной 75%. Однако чувствительность данного способа составляет 62,5% (Jaworska-Wilczynska et al., 2014) /10/. Среди иммунологических методов существует и такие, которые имеют довольно высокий уровень специфичности и чувствительности. Примером может служить способ прогнозирования ПКТС, основывающийся на определении нистатина C /11/. Чувствительность и специфичность данного метода составляют 88,9% и 72,9% соответственно. И все же специфичность данного способа уступает аналогичному критерию предлагаемого изобретения (См. RU 2472152, МПК: G01N 33/48; опубл. 10.01.2013).
Наименее изученными остаются генетические факторы, влияющие на развитие ПКТС. А, следовательно, на данный момент диапазон генетических тестов довольно ограничен. В основном они направлены на выявление мутаций либо экспрессию генов провоспалительных маркеров. В работе Schwinn и Podgoreanu было показано, что предикторами возможных постоперационных осложнений на сердце могут быть полиморфизмы генов интерлейкина-6 и молекулы клеточной адгезии ICAM-1 (Schwinn, Podgoreanu, 2008) /12/. Однако для прогнозирования ПКТС эффективность данного теста не доказана.
Среди вышеперечисленных аналогов не удалось выбрать ближайшего в качестве прототипа. Предлагаемое нами техническое решение относится скорее к биохимическим прогностическим методам, предоставляющим возможность использования и разработки формы расчета активности ферментов.
В отличие от вышеназванных методов настоящий способ предполагает исследование предикативных показателей в двух биосубстратах - плазме и перикардиальной жидкости. Во-первых, доказанная эффективность изобретения в двух биосубстратах дает возможность выбора для клинической лаборатории. Во-вторых, появляется возможность верификации прогноза, сделанного в день операции. В-третьих, исследование в перикардиальной жидкости повышает значимость полученных результатов, поскольку именно экссудат представляет основную локализацию всех патогенетических процессов, а также содержит ключевые компоненты воспаления (кардиотропные медиаторы, простагландины, цитокины) (Мартынова и др., 2008; Накацева и др., 2010) /13, 14/. Кроме того, использование двух взаимосвязанных предикторов значительно повышает точность прогноза. Осуществление предлагаемого способа не требует специального оборудования и дорогостоящих реактивов. Выполнение теста не занимает много времени. К преимуществам также можно отнести высокие уровень чувствительности и специфичности изобретения.
ПКТС - это специфическая форма травматического перикардита, развивающаяся в рамках системной воспалительной реакции организма (Chien, Shen, 2006; Игольникова, Никулина, 2012) /15, 16/. Симптоматика ПКТС очень сходна с такими патологиями, как инфекционный эндокардит, застойная сердечная недостаточность, тромбоэмболия ветвей легочной артерии, миокардиты невирусной и вирусной этиологии, различные формы перикардитов. Используемые в лабораторной практике тесты, регистрирующие изменения маркеров острой фазы воспаления (повышение СОЭ, уровня C-реактивного белка, интерлейкина-6, фибриногена), не позволяют дифференцировать ПКТС от сходных патологий, а также малоинформативны (Игольникова, Никулина, 2012) /16/. В то же время частота возникновения осложнений при несвоевременной диагностике данного синдрома достаточно высока и варьирует от 10-68% (Накацева и др., 2010; Игольникова, Никулина, 2012) /14, 16/.
МПО - провоспалительный и прооксидантный фермент, секретируемый нейтрофилами крови (Razavi et al., 2013) /17/. Данный гемогликопротеин с молекулярной массой 140-155 кДа относится к факторам, уровень которых не зависит от стимуляции клетки, а целиком определяется количеством вещества, синтезированного в процессе гранулопоэза. Физиологическая функция МПО заключается в уничтожении микроорганизмов в нейтрофилах и моноцитах, формировании высокореактивных прооксидантов в пределах фагосомы. МПО-система оказывает защитную роль против инфекционных факторов, особенно грибковой флоры (Панасенко и др., 2010; Гавриленко и др., 2014) /18, 19/. Бактерицидная роль МПО опосредована цитотоксическим действием гипохлоритов, образующихся в результате пероксидазной реакции. Однако сверхпродукция гипохлоритов, которая отмечается при воспалительных процессах, приводит к окислению липопротеинов высокой плотности (ЛПВП). Окисленные липопротеины способны индуцировать многие проатерогенные процессы, включая модуляцию окислительного стресса. Они также индуцируют созревание дендритных клеток и регулируют изменения от активации макрофагов до ответа Т-хелперов 1 и 2, тем самым прокладывая мостик между врожденным и адаптивным иммунитетом, так как и тот, и другой вовлекаются в формирование бляшки (Гавриленко и др., 2014) /19/.
Вместе с тем в плазме крови и биологических жидкостях присутствует ЛПВП-ассоциированный фермент, обладающий антивоспалительным и антиатерогенным эффектами - параоксоназа (Huang et al., 2013) /20/. Семейство параоксоназ подразделяется на 3 изоформы PON1, 2 и 3. В плазме крови и перикардиальной жидкости представлены только первая и третья изоформы фермента (Reddy et al., 2001) /21/. Показано, что ферментативная активность и стабильность молекулы PON зависят от связи фермента с частицами ЛПВП. Обладая эстеразной и липолактоназной активностями, PON помогает ЛПВП предотвращать аккумуляцию липидных пероксидов из окисленных липопротеинов низкой плотности, стимулирует ЛПВП-опосредованную активацию синтазы оксида азота и повышает высвобождение холестерина из загруженных холестерином макрофагов. Однако активация МПО может опосредованно и напрямую ингибировать функционирование PON. Показано, что соотношение активностей МПО/PON можно использовать в качестве предиктора атеросклероза, а арилэстеразная активность PON1 имеет обратную корреляцию с развитием острого коронарного синдрома (Huang et al., 2013, Razavi et al., 2013) /20, 17/. Все вышеизложенное определило актуальность и цель работы.
Цель работы: оценить возможность использования соотношения активности миелопероксидазы и арилэстеразной активности параоксоназы в качестве биомаркера для прогнозирования развития ПКТС у пациентов с ИБС, перенесших аортокоронарное шунтирование.
Технический результат заявляемого изобретения заключается в повышении точности, специфичности и чувствительности прогностического метода, позволяющего выделить группу риска на раннем этапе и выбрать адекватную терапию для таких пациентов.
Поставленная задача решается следующим образом: способ прогнозирования постперикардиотомного синдрома (ПКТС) у больных ИБС после аортокоронарного шунтирования характеризуется тем, что у пациентов на момент операции и через сутки после нее определяют активность миелопероксидазы (МПО) и арилэстеразную активность параксоназы (PON) в перикардиальной жидкости и в плазме крови. Затем рассчитывают коэффициент К=МПО/PON, характеризующий соотношение активности МПО и арилэстеразной активности PON. При значении коэффициента К в перикардиальной жидкости, равном 4,27 и более, у пациента с вероятностью 71,4% прогнозируют развитие ПКТС, а при значении коэффициента К в плазме крови, равном 5,19 и более, вероятность развития ПКТС синдрома составит 70%.
Точность данного способа для определения в перикардиальной жидкости 71,4%, специфичность - 80% и чувствительность - 71,4%. Для определения в плазме соответствующие критерии равны 80%, 75% и 87,5%.
Материал и методы. Обследовано 76 больных ИБС в возрасте 41-75 лет (средний возраст 58±1,5), которые перенесли аортокоронарное шунтирование (АКШ) в отделении кардиохирургии РОСТГМУ, г. Ростов-на-Дону. Больные были разделены на 2 группы: 1 - больные ИБС (66 человек), у которых ПКТС не был обнаружен в результате клинических исследований; 2 - больные ИБС (10 человек, 15%), у которых в результате клинических исследований был установлен ПКТС. Биохимические показатели исследованы в динамике: на 1-е, 3-е, 5-е, 7-е и 10-е сутки послеоперационного периода. В качестве контроля использовали кровь 20 практически здоровых людей доноров обоего пола в возрасте от 35 до 52 лет (средний возраст 46,2±0,7).
Исследована динамика активностей МПО и PON в плазме крови в течение 10 суток со дня операции и в перикардиальной жидкости в момент операции. Статистическая обработка полученных результатов основывалась на U-критерии Манна-Уитни и t-критерии Стьюдента и осуществлялась при использовании пакета программ SPSS Statistics 17.0 и Statistica 10.0.
Полученные результаты свидетельствуют о повышении активности МПО в обеих группах на протяжении всего периода обследования. Наибольших значений активность МПО у больных с ПКТС достигает уже на первые сутки после оперативного вмешательства (0,0247±0,0009 у.е./мг*мин), что на 27% (р<0,01) выше, чем у доноров (0,0206±0,0013 у.е./мг*мин). Между группами в плазме и перикардиальной жидкости достоверных отличий обнаружено не было.
Арилэстеразная активность PON в плазме крови больных с ПКТС и без синдрома характеризуется противоположной динамикой. Так, активность PON во второй группе пациентов максимально снижается уже на первые сутки (0,0048±0,0008 МЕ/мг), что на 85% (р<0,001) ниже, чем у доноров (0,0326±0,0056 МЕ/мг). Между группами в плазме крови достоверных отличий не обнаружено. В перикардиальной жидкости в момент операции у больных с ПКТС активность PON (0,008±0,002 МЕ/мг) гораздо ниже (на 52%, р<0,05), чем у больных без ПКТС (0,016±0,003 МЕ/мг).
Была обнаружена высокая обратная корреляционная зависимость между активностями ферментов, коэффициент корреляции Спирмена составил -0,83 (р<0,05).
Исходя из полученных результатов, было решено для расчета соотношения активностей МПО и PON использовать данные по 1-м суткам послеоперационного периода в плазме и данные на момент операции в перикардиальной жидкости. Для исследуемого соотношения активностей у больных ИБС, перенесших АКШ, установлена высокая прямая корреляционная зависимость между плазмой (первые послеоперационные сутки) и перикардиальной жидкостью (момент операции), коэффициент корреляции Спирмена составил 0,71 (р<0,05). В плазме крови больных с ПКТС коэффициент МПО/PON равен 5,19, а в перикардиальной жидкости - 4,27. Для сравнения: коэффициент МПО/PON для плазмы доноров составил 0,63, для плазмы больных без ПКТС - 3,81, а для перикардиальной жидкости больных без ПКТС - 1,32.
Таким образом, если у пациента в первые сутки послеоперационного периода данный коэффициент в плазме крови превышает 5,19, тогда с вероятностью 70% возможно развитие ПКТС после перенесенной реваскуляризации миокарда. В то же время, если аналогичный коэффициент в перикардиальной жидкости у пациента в момент операции будет выше 4,27, вероятность развития ПКТС составит 71,4%. Чувствительность описанного способа для плазмы равна 87,5%, специфичность - 75%, общая точность - 80%. Для перикардиальной жидкости показатели теста равны 71,4%, 80% и 71,4% соответственно. Были построены графики с изображением ROC-кривой для плазмы и перикардиальной жидкости (фиг. 1 и 2).
Предлагаемое изобретение проиллюстрировано следующими чертежами:
На фиг. 1 изображена ROC-кривая теста, предназначенного для ранней диагностики ПКТС в плазме.
На фиг. 2 - ROC-кривая теста, предназначенного для ранней диагностики ПКТС в перикардиальной жидкости.
Судить о качестве теста можно по экспертной шкале для значений AUC (Area Under Curve, площадь под ROC-кривой) (таб. 1) (Simundic, 2012) /22/.
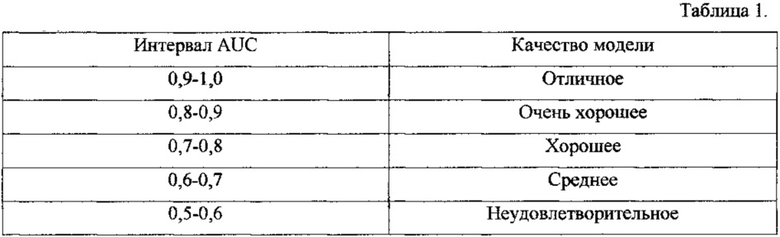
Величина AUC для теста, предназначенного для диагностики в плазме, составила 0,875 (95% ДИ 0,00-0,951), для диагностики в перикардиальной жидкости - 0,779 (95% ДИ 0,505-0,951). Установленные значения AUC свидетельствуют о высоком качестве описываемого способа.
Положительный эффект: прогнозирование развития ПКТС позволяет оценить вероятность развития синдрома уже на минимальных послеоперационных сроках и выделить группу риска пациентов для целенаправленной терапии. Известно, что ранняя противовоспалительная терапия заметно снижает частоту возникновения постперикардиотомного синдрома. На Конгрессе Европейского общества кардиологов 30 августа 2010 г. в Стокгольме были доложены результаты многоцентрового двойного слепого контролируемого рандомизированного исследования COPPS (Игольникова, Никулина, 2012) /16/. В ходе исследования больные, перенесшие операцию, получали колхицин уже на третьи сутки. Результаты COPPS показали, что по сравнению с плацебо превентивная терапия колхицином значительно снижает частоту возникновения ПКТС (соответственно 21,1 и 8,9%). Также ранее применение колхицина уменьшало вероятность перикардиального выпота на 43,9% и вероятность плеврального выпота на 52,3% (Imazio, 2010) /23/. Однако аналогичное исследование (COPPS-2), при котором колхицин применялся за 48 и 72 часа до операции, показало высокую частоту побочных эффектов (Imazio et al., 2014) /24/. Предложенный способ позволит избежать слепого применения лекарственных средств, которое угрожает появлением осложнений, у пациентов с низким риском развития ПКТС. Указание риска развития ПКТС при выписке пациента из кардиохирургического стационара полезно для настороженности амбулаторного звена в плане возможного позднего развития данного осложнения.
Осуществление изобретения
Использование предлагаемого способа осуществляют в перикардиальной жидкости, собранной в момент операции, и в плазме крови, собранной на первые сутки после АКШ. Подготовка перикардиальной жидкости к дальнейшему исследованию предполагает центрифугирование образца при 3000 об/мин 10 минут.
Исследование активности миелопероксидазы основано на спектрофотометрическом методе (Саидов, Пинегин, 1991) /25/ в модификации (Плотников, 2013) /26/. Для определения активности миелопероксидазы необходимо выполнить следующие этапы:
1. В опытные и контрольные пробирки вносят 100 мкл биосубстрата (плазмы или перикардиальной жидкости).
2. В контрольные пробирки добавляют 1 мл 1 н H2SO4.
3. Во все пробирки вносят по 1 мл 0,04% ортофенилендиамина.
4. Запускают реакцию добавлением 100 мкл 0,014% H2O2 в каждую пробирку.
5. Пробы инкубируют 5 минут при 37°C в термостате.
6. В опытных пробирках останавливают реакцию добавлением 1 мл 1 н H2SO4.
7. Оптическую плотность измеряют на спектрофотометре при длине волны 492 нм.
Активность миелопероксидазы рассчитывают по формуле:
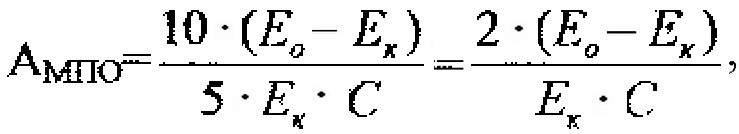
где Eо - оптическая плотность опытной пробы,
Ек - оптическая плотность контрольной пробы,
C - концентрация общего белка в плазме или перикардиальной жидкости (мг/мл).
Активность миелопероксидазы выражают в условных единицах на мг белка в минуту (у.е./мин⋅мг).
Исследование функционального состояния параоксоназы основано на определении ее арилэстеразной активности (Kilic S. et al, 2005) /27/. Принцип метода: параоксоназа катализирует гидролиз фенилацетата, расщепляющегося до фенола. Скорость образования фенола определяют, измеряя оптическую плотность исследуемого образца при λ=270 нм. Ход работы предполагает следующие этапы:
1. В опытные пробирки вносят 1,5 мл 1 мМ CaCl2, в контрольную пробирку - 1,75 мл 1 мМ CaCl2.
2. В опытные пробирки добавляют 250 мкл биосубстрата.
3. Запускают реакцию внесением 250 мкл 12 мМ фенилацетата.
4. Проводят измерение оптической плотности при λ=270, затем пробы инкубируют при 37°C 7 минут на водяной бане и снова измеряют оптическую плотность.
Арилэстеразную активность параоксоназы рассчитывают по формуле:
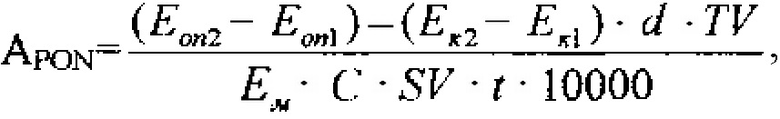
где Еоп1 - оптическая плотность опытной пробы до инкубации,
Еоп2 - оптическая плотность опытной пробы после инкубации,
Ек1 - оптическая плотность контрольной пробы до инкубации,
Ек2 - оптическая плотность контрольной пробы после инкубации,
t - время инкубации,
Ем - коэффициент молярной экстинкции, 1310 М-1 см-1,
C - концентрация общего белка в плазме или перикардиальной жидкости
d - толщины кюветы,
TV - общий объем пробы,
SV - объем образца.
Арилэстеразную активность параоксоназы выражают в международных единицах на мг белка (МЕ/мг белка).
Рассчитывают коэффициент, характеризующий соотношение активностей обоих ферментов (МПО/PON).
Изобретение проиллюстрировано клиническими примерами.
1. Пациенту, 65 лет, мужчине, страдающему ишемической болезнью сердца, выполнено аортокоронарное шунтирование в отделение кардиохирургии Ростовского государственного медицинского университета.
Коэффициент МПО/PON был определен в перикардиальной жидкости в день операции и составил 2,62. Согласно критерию прогнозирования по заявленному способу данное соотношение было меньше 4,27. В плазме крови коэффициент МПО/PON был определен на 1-е сутки после операции и составил 4,58. Согласно критерию прогнозирования по заявленному способу данное соотношение было меньше 5,19. Сделано заключение о минимальном риске развития ПКТС. Данный прогноз подтвердился. В течение всего периода наблюдения у пациента развития ПКТС не произошло.
2. Пациенту, 66 лет, мужчине, страдающему ишемической болезнью сердца, выполнено аортокоронарное шунтирование в отделение кардиохирургии Ростовского государственного медицинского университета.
Коэффициент МПО/PON был определен в перикардиальной жидкости в день операции и составил 8,08. Согласно критерию прогнозирования по заявленному способу данное соотношение было больше 4,27. В плазме крови коэффициент МПО/PON был определен на 1-е сутки после операции и составил 10,42. Согласно критерию прогнозирования по заявленному способу данное соотношение было больше 5,19. Сделано заключение о высоком риске развития ПКТС. Данный прогноз подтвердился. У пациента на 5-е сутки послеоперационного периода развился ПКТС.
3. Пациенту, 60 лет, мужчине, страдающему ишемической болезнью сердца, выполнено аортокоронарное шунтирование в отделение кардиохирургии Ростовского государственного медицинского университета.
Коэффициент МПО/PON был определен в перикардиальной жидкости в день операции и составил 1,39. Согласно критерию прогнозирования по заявленному способу данное соотношение было меньше 4,27. В плазме крови коэффициент МПО/PON был определен на 1-е сутки после операции и составил 7,95. Согласно критерию прогнозирования по заявленному способу данное соотношение было больше 5,19. Сделано заключение о высоком риске развития ПКТС. Данный прогноз подтвердился. У пациента на 5-е сутки послеоперационного периода развился ПКТС.
Источники информации
1. Maisch В, Seferovic РМ, Ristic AD, et al. Task Force on the Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology. Guidelines on the diagnosis and management of pericardial diseases. Executive summary. Eur. Heart. J. 2004; 25 (7): 587-610.
2. Драненко Н.Ю. Постперикардиотомный синдром: механизмы патогенеза и критерии диагноза//Таврический медико-биологический вестник. 2013; 16 (4): 42-48.
3. Mittal S.R. Echocardiography in Evaluation of Pericardial Disease // JAPI. 2003; 51:903-909.
4. Bocsi J., Hambsch J., Osmancik P., Schneider P., Valet G,  Preoperative prediction of pediatric patients with effusions and edema following cardiopulmonary bypass by serological and routine laboratory data // Crit Care. 2002; 6(3): 226-233.
Preoperative prediction of pediatric patients with effusions and edema following cardiopulmonary bypass by serological and routine laboratory data // Crit Care. 2002; 6(3): 226-233.
5. RU 2466395, МПК: G01N 33/48; опубл. 10.11.2012.
6. Nicholls S.J., Hazen S.L. Myeloperoxidase and Cardiovascular Disease // Arterioscler Thromb Vasc Biol. 2005; 25:1102-1111.
7. Schindhelm R.K., Zwan L.P., Teerlink Т., Scheffer P.G. Myeloperoxidase: A Useful Biomarker for Cardiovascular Disease Risk Stratification? // Clinical Chemistry. 2009; 55(8): 1462-1470.
8. Wong N.D., Gransar H., Narula J. et al. Myeloperoxidase, Subclinical Atherosclerosis and Cardiovascular Disease Events // JACC: Cardiovascular imaging. 2009; 2(9): 1093-1099.
9. Olza J., Aguilera С.M., Gil-Campos M. et al. Myeloperoxidase is of inflammation and cardiovasculars an early biomarker Risk in Prepubertal Obese Children // Diabetes care. 2012; 35: 2373-2376.
10. Jaworska-Wilczynska M., Magalska A., Piwocka K. et al. Low Interleukin-8 Level Predicts the Occurrence of the Postpericardiotomy Syndrome // PLoS ONE. 2014; 9(10): 1-8.
11. RU 2472152, МПК: G01N 33/48; опубл. 10.01.2013.
12. Schwinn D.A., Podgoreanu M. Pharmacogenomics and End-Organ Susceptibility to Injury in the Perioperative Period // Best Pract Res Clin Anaesthesiol. 2008; 22(1): 23-37.
13. Мартынова М.Г., Накацева E.B., Емельянова М.И., Ерохина И.Л., Моисеева О.М. Иммунолокализация предсердного натрийуретического пептида в тучных клетках перикарда крысы и человека. Цитология. 2008; 50 (3): 237-42.
14. Накацева Е.В., Мартынова М.Г., Титаренко О.Т., Вонский М.С., Толмачев Д.А., Моисеева О.М. Современные принципы диагностики лечения постперикардиотомного синдрома. Бюллетень федерального центра сердца, крови и эндокринологии им. В.А. Алмазова. 2010; 5: 95-102.
15. Chien N.-C., Shen Т.-С. Chronic Postpericardiotomy Syndrome and Cardiac Tamponade Lasting for Two Years after Open Heart Surgery // Acta Cardiol Sin. 2006; 22:170-174.
16. Игольникова Л.Н., Никулина Е.Г. Постперикардиотомный синдром: клинико-лабораторная диагностика, лечение (обзор литературы) // Кардиология и сердечно-сосудистая хирургия. 2012; 1: 42-46.
17. Razavi А.Е., Basati G., Varshosaz J., Abdi S. Association between HDL Particles Size and Myeloperoxidase / Paraoxonase-1 (MPO/PON1) Ratio in Patients with Acute Coronary Syndrome // Acta Medica Iranica. 2013; 51(6): 366-371.
18. Панасенко O.M., Горудко И.В., Ковалева A.M., Гусев С.А., Сергиенко В.И., Матишов Д.Г. Продукция и реакционные свойства активных форм галогенов в механизмах канцерогенеза // Вестник Южного научного центра РАН. 2010; 3(6): 73-90.
19. Гавриленко Т.И., Рыжкова Н.А., Пархоменко А.Н. Миелопероксидаза и ее роль в развитии ишемической болезни сердца // Украинский кардиологический журнал. 2014:119-126.
20. Huang Y, Wu Z., Riwanto M. et al. Myeloperoxidase, paraoxonase-1, and HDL form a functional ternary complex // The Journal of Clinical Investigation. 2013; 123(9): 3815-3828.
21. Reddy ST, Wadleigh DJ, Grijalva V et al.. "Human paraoxonase-3 is an HDL-associated enzyme with biological activity similar to paraoxonase-1 protein but is not regulated by oxidized lipids" // Arterioscler. Thromb. Vase. Biol. 2001; 21 (4): 542-547.
22.  Diagnostic Accuracy-Part 1: Basic Concepts: Sensitivity and Specificity, ROC Analysis, STARD Statement // The Journal of Near-Patient Testing & Technology. 2012; 11(1): 6-8.
Diagnostic Accuracy-Part 1: Basic Concepts: Sensitivity and Specificity, ROC Analysis, STARD Statement // The Journal of Near-Patient Testing & Technology. 2012; 11(1): 6-8.
23. Imazio M. The COPPS Trial: A multicenter, randomized, double-blind, placebo-controlled trial. Eur. Heart. J. 2010; 31: 22: 2749-2754.
24. M. Imazio; Brucato A., P. Ferrazzi et al. Colchicine for Prevention of Postpericardiotomy Syndrome and Postoperative Atrial Fibrillation The COPPS-2 Randomized Clinical Trial // JAMA. 2014: 1-8.
25. Саидов M.З., Пинегин Б.В. Спектрофотометрический метод определения миелопероксидазы в фагоцитирующих клетках // Лабораторное дело. 1991; 3: 56-59.
26. Плотников А.А. Роль прооксидантных процессов в нарушении редокс-баланса в крови и синовиальной жидкости при гонартрозе // Известия высших учебных заведений Северо-Кавказский регион. 2013; 6 (178): 68-72.
27. Kilic S.S., Aydin S., Kilic N. et al. Serum arylesterase and paraoxonase activity in patients with chronic hepatitis // World Journal of Gastroenterology. 2005; 11(46):7351-7354.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогноза развития постперикардиотомного синдрома у больных ИБС, перенесших аортокоронарное шунтирование | 2016 |
|
RU2630592C1 |
| СПОСОБ ПРОФИЛАКТИКИ РАЗВИТИЯ ПОСТПЕРИКАРДИОТОМНОГО СИНДРОМА У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА, ПОДВЕРГШИХСЯ КОРОНАРНОМУ ШУНТИРОВАНИЮ | 2014 |
|
RU2556198C1 |
| Способ профилактики развития постперикардиотомного синдрома и пароксизмов фибрилляции предсердий у кардиохирургических больных | 2020 |
|
RU2740530C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ПОСТПЕРИКАРДИОТОМНОГО СИНДРОМА ПОСЛЕ ПРОТЕЗИРОВАНИЯ КЛАПАНОВ СЕРДЦА В УСЛОВИЯХ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ | 2011 |
|
RU2472152C1 |
| Способ прогнозирования исходов операций коронарного шунтирования | 2019 |
|
RU2719914C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НЕБЛАГОПРИЯТНОГО ИСХОДА У ПАЦИЕНТОВ С ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА, ПЕРЕНЕСШИХ АОРТОКОРОНАРНОЕ ШУНТИРОВАНИЕ | 2018 |
|
RU2688241C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ СТАДИЙ ГОНАРТРОЗА | 2014 |
|
RU2588372C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ПОСЛЕОПЕРАЦИОННЫХ ОСЛОЖНЕНИЙ ПРИ АОРТОКОРОНАРНОМ ШУНТИРОВАНИИ | 2012 |
|
RU2480757C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РЕСТЕНОЗА СТЕНТА У ПАЦИЕНТОВ С ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА ЧЕРЕЗ 6 МЕСЯЦЕВ ПОСЛЕ КОРОНАРНОГО СТЕНТИРОВАНИЯ | 2019 |
|
RU2695782C1 |
| Способ прогнозирования синдрома малого сердечного выброса после операций коронарного шунтирования | 2023 |
|
RU2815149C1 |

Изобретение относится к медицине, а именно к кардиохирургии, и может быть использовано в отделениях интенсивной терапии и кардиологии. Способ прогнозирования постперикардиотомного синдрома (ПКТС) у больных ИБС после аортокоронарного шунтирования характеризуется тем, что у пациентов на момент операции и через сутки после нее определяют активность миелопероксидазы (МПО) и арилэстеразную активность параксоназы (PON) в перикардиальной жидкости и в плазме крови, затем рассчитывают коэффициент К=МПО/PON, характеризующий соотношение активности МПО и арилэстеразной активности PON, при значении коэффициента К в перикардиальной жидкости, равном 4,27 и более, у пациента с вероятностью 71,4% прогнозируют развитие ПКТС, а при значении коэффициента К в плазме крови, равном 5,19 и более, вероятность развития ПКТС синдрома составит 70%. Технический результат заявляемого изобретения заключается в повышении точности, специфичности и чувствительности прогностического метода, позволяющего выделить группу риска на раннем этапе и выбрать адекватную терапию для таких пациентов. 2 ил., 1 табл., 3 пр.
Способ прогнозирования постперикардиотомного синдрома (ПКТС) у больных ишемической болезнью сердца (ИБС) после аортокоронарного шунтирования, характеризующийся тем, что у пациентов на момент операции и через сутки после нее определяют активность миелопероксидазы (МПО) и арилэстеразную активность параксоназы (PON) в перикардиальной жидкости и в плазме крови, затем рассчитывают коэффициент К=МПО/PON, характеризующий соотношение активности МПО и арилэстеразной активности PON, при значении коэффициента К в перикардиальной жидкости, равном 4,27 и более, у пациента с вероятностью 71,4% прогнозируют развитие ПКТС, а при значении коэффициента К в плазме крови, равном 5,19 и более вероятность, развития ПКТС составит 70%.
| Е.В.Накацева | |||
| Предикторы развития постперикардиотомного синдрома после операции на открытом сердце / Санкт-Петербург, 2009, автореферат | |||
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ПОСТПЕРИКАРДИОТОМНОГО СИНДРОМА ПОСЛЕ ПРОТЕЗИРОВАНИЯ КЛАПАНОВ СЕРДЦА В УСЛОВИЯХ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ | 2011 |
|
RU2472152C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ПОСЛЕОПЕРАЦИОННЫХ ОСЛОЖНЕНИЙ ПРИ АОРТОКОРОНАРНОМ ШУНТИРОВАНИИ | 2012 |
|
RU2480757C1 |
Авторы
Даты
2017-05-12—Публикация
2016-04-11—Подача